Заміщені віолантрону
Номер патенту: 91480
Опубліковано: 26.07.2010
Автори: Жмурін Петро Миколайович, Гуркаленко Юрій Олександрович, Шершуков Віктор Михайлович
Формула / Реферат
Заміщені віолантрону загальної формули формули I
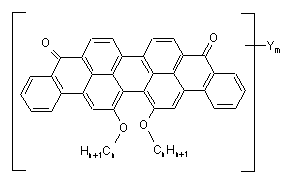 , I
, I
де X = Br, S-Alk, O-Ph-Alk, O-Alk, S-Ph-Alk, NH-Alk, N(Alk)2,
де Alk - алкіл,
n = 6-12,
m = 2-4.
Текст
Заміщені віолантрону загальної формули формули I 3 X 91480 Y O O R2 N N R1 II O O OR3 z де R1 і R2 - однаковий або різний аліфатичний, ароматичний або гетероциклічний гідрофобні радикали; X, Y і Z - хлор, бром або радикал OR3 і R3 незаміщений або заміщений феніл, нафтіл або антріл. Вказані сполуки II мають високу світлостійкість і, залежно від структури радикалів X, Y і Z, поглинають світло у області 560-585нм і випромінюють його у області 600-620нм. Синтез вказаних сполук здійснюється з перілен-3,4,9,10-тетракарбонової кислоти, яка шляхом хлорування газоподібним хлором в концентрованій сірчаній кислоті перетворюється на 1,6,7,12тетрахлорперилен-3,4,9,10-тетракарбонову кислоту з подальшим перетворенням її в діімід шляхом взаємодії з відповідним аміном і нуклеофільним заміщенням атомів хлора відповідним нуклеофілом. Одним з істотних недоліків відомих сполук є наявність значної реабсорбції в їх спектрах поглинання і люмінесценції (стоксов зсув складає 2030нм), що приводить до значного поглинання власного випромінювання при проходженні його по пластині ЛСК або світоводу. Іншим недоліком вказаних сполук є те, що вони здатні поглинати лише невелику ділянку падаючого сонячного світла (до 600нм), яке слабо трансформується фотодіодом із-за низкою його чутливості в цій області. Таким чином, перераховані недоліки роблять мало придатними люмінофори структури II для використання їх в ЛСК і світоводах. Найбільш близькими структурними аналогами до хімічних сполук, що заявляються, є заміщені віолантрона [пат. США №4.486.587, C07D39/00] загальної формули III: z Xn z III O O 4 алкокси і R3=алкіл, алкеніл, С2 або С3алкіленкарбоалкоксі, алкілзаміщенний бензіл або циклогексіл, або моноциклічний, біциклічний або поліциклічний насичений вуглеводневий радикал. Синтезують вказані сполуки з 16,17дигіроксівіолантрен-5,10-діону шляхом алкиліровання або ацилірування їх гідроксильних груп в середовищі органічного розчинника у присутності основних каталізаторів. Сполуки формули III є ефективними органічними люмінофорами, які залежно від структури введених в них радикалів X, Y і Z поглинають світло у області 600-700нм і випромінюють його у вигляді світла люмінесценції у області 580-700нм з високим квантовим виходом, а також мають високу термостійкість і фотостабільність. Крім того, вони мають добру розчинність у більшості органічних розчинників, поєднуються з широким спектром полімерних матеріалів і інтенсивно в них флуоресціюють. Проте, величина стоксова зсуву (30-40нм) у них також, як і у сполук II, невелика і тому в їх спектрах поглинання і люмінесценції спостерігається сильне перепоглинання, слідством якого є різке зниження інтенсивності їх свічення на шляху проходження до фотоприймача. Загальним недоліком відомих органічних люмінофорів є те, що їх область люмінесценції 580750нм далека від області максимальної чутливості кременевих фотодіодів (800-1000нм), найбільш часто вживаних як фотоприймачі в конструкціях ЛСК завдяки їх дешевизні. З цієї причини не вся світлова енергія, що випромінюється пластиною ЛСК, перетвориться в електричну, що приводить до зниження її ефективності. Як прототип нами вибрана сполука III. У основу справжнього винаходу поставлене завдання - розробка нових органічних люмінофорів у ряді заміщених віолантрона ближнього інфрачервоного свічення, область свічення яких була б максимально наближена до області максимальної чутливості кремнієвого фотодіода (8001000нм), з високою світлостійкістю і термостабільностью, достатньою розчинністю в органічних розчинниках і сумісністю з полімерними матеріалами, а також мінімальним перепоглинанням їх спектрів поглинання і люмінесценції для забезпечення високої прозорості виготовлених з їх використанням світоводов і пластин ЛСК. Рішення задачі забезпечується розробкою заміщених віолантрона загальної формули І: Ym де Z= -N= або -СН=; Y= -OSO2R1, -OPO(OR2)2, -OCOR ИЛИ -OR3, N R або обидва Y= O де R -алкіл; X=F, СІ; С1-С20 - алкіл; С3-С20 - алкен, арілалкіл; -COR1, -SO2R1 , OPO(OR2)2, NHCOR1 или NH-SO2-R1, m-2,3 або 4; n-0,1 або 2; незаміщений або заміщений алкіл, алкеніл або ароматичний або гетероциклічний радикал і, коли Y=OCOR1, може крім того бути алкокси або цикло O O Ym I O O Hn+1Cn CnHn+1 де X=Br, S-Alk, O-Ph-Alk, O-Alk, S-Ph-Alk, NHAlk, N(Alk)2. n=6-12 m=2-4 5 Модифікація хімічної структури сполук формули І шляхом варіювання X здійснюється в результаті нуклеофільного заміщення атома брому, дякуючи чому забезпечується отримання широкого набору нових перспективних сполук для використання їх в ЛСК і світоводах. Зсув люмінесценції в довгохвильову область (до 850нм) і наближення її до області максимальної чутливості фотодіода забезпечено введенням в молекулярну систему електроно-донорних заступників, таких як феноксі, тіофеноксі, алкілмеркапто, пірролідіно, алкіл- і діалкіламіногрупп. При цьому інтенсивність люмінесценції знаходиться на рівні зразка прототипу. Така властивість заявлених сполук є несподіваною для цієї структури і може бути пояснено, з нашої точки зору, як результат донорноакцепторної взаємодії акцепторних карбонільних (С=О) груп заявленої структури І і електронодонорних оксі-, тіофенольних і аміних груп, введених в їх молекулярну структуру. Унаслідок такої взаємодії різко зростає дипольний момент сполук І при їх переході в збуджений стан, що приводить до аномально великого довгохвильового зсуву спектрів люмінесценції. Це дає можливість не тільки максимально наблизитися до області максимальної чутливості фотодіода, але і значно зменшити можливість поглинання люмінофором світла власного випромінювання, оскільки область їх люмінесценції лежить на 105-140нм довше за область поглинання. Одержані сполуки характеризуються високою світлостійкістю і термостабільностью, достатньою розчинністю в органічних розчинниках і сумісністю з полімерними матеріалами, не поступаючись по цих характеристиках прототипу. Вказані властивості заявлених хімічних сполук дозволяють їх використовувати для виготовлення великогабаритних ЛСК, а також протяжних оптичних світоводів для дистанційного керування різними процесами, наприклад, управління ядерними реакціями. У таблиці приведені спектральнолюмінесцентні характеристики органічних люмінофорів, що заявляються, порівняно з аналогічними характеристиками люмінофора-прототипа. Органічні люмінофори, що заявляються, одержують відомим способом шляхом бромування діалкоксивіолантронів з подальшим заміщенням атома брому різними нуклеофільними агентами [Вейганд-Хильггетагг «Методи експерименту в органічній хімії», М: Хімія, 1968, С.427]. Аналіз структури отриманих люмінофорів проводився на приладі для елементного аналізу "Euro EA 3000", а вимірювання спектральних характеристик здійснювався на спектрофлуориметрі HORIBA JobinYvon "FluoroMax-4", і спектрофотометрі «SPECORD M40» при концентрації розчинів 10-6 моль/л. Нижче наведені приклади отримання заявлених органічних люмінофорів і їх характеристики. Приклад 1. Отримання трибром-16,17дідецилоксівіолантрен-5,10-діону (1). 4г (0.0052моль) 16,17-дідецилоксівіолантрен5,10-діона при перемішуванні розчиняють в 60мл 91480 6 тетрахлоретана при температурі біля 80°С, потім охолоджують до кімнатної температури і прикапують невеликими порціями розчин 4.65г брому (0.0029моль) в 30мл тетрахлоретана. Перемішують при кімнатній температурі протягом 1 години, потім поволі піднімають температуру до 80°С і витримують протягом 2 годин. Тетрахлоретан відганяють з водяною парою, смолянистий залишок розтирають в метанолі. Сформований осад темносинього кольору фільтрують і промивають метанолом. Очищення на хроматографічній колонці з силікагелем з четирихлористого вуглецю дає 3.8г трибром-16,17-дідецилоксівіолантрен-5,10-діона (1) з температурою плавлення 223-225°С. макс. . поглинання 654нм, макс. . люмінесценції 750нм (хлороформ). Знайдено (%): С, 65.47; Н, 6.59; О, 5.18; Br, 22.76. С54Н53О4Вr3 . Обчислено (%): С, 64.5; Н, 5.31; О, 6.36; Br, 23.8. Приклад 2. Отримання тріс(nтретбутілфеноксі)-16,17-дідецил-оксівіолантрен5,10-діона (2). 1.3г (0.0012моль) трибром-16,17дідецилоксівіолантрен-5,10-діона розчиняється при нагріванні до 40°С в 50мл діметілформаміда, додається 0.96г (0.0055моль) п-третбутілфенолята натрію, нагрівається до температури 90-95°С і витримується при перемішуванні протягом 1 години. Реакційна маса охолоджується до кімнатної температури і додається 60мл метанолу. Осад, що випав, фільтрується, промивається метанолом, віджимається і сушиться. Очищення на хроматографічній колонці з силікагелем з четирихлористого вуглецю дає 1.2г тріс(п-третбутілфеноксі)-16,17дідецилоксівіолантрен-5,10-діона (2) з температурою плавлення 181-185°С. макс. поглинання 652нм, макс. люмінесценції 755нм (хлороформ). Знайдено (%): С, 82.81; Н, 7.17; О, 9.07. С84Н92О7. Обчислено (%): С, 83.13; Н, 7.64; О, 9.23. Приклад 3. Отримання тріс(третбутілоксі)16,17-дідецилоксівіо-лантрен-5,10-діона (3). Аналогічно прикладу 2, але замість птретбутілфенолята натрію беруть третбутілат калію і одержують тріс(третбутілоксі)-16,17дідецилоксівіолантрен-5,10-діон (3) з температурою плавлення 250-255°С. макс. поглинання 645нм, макс. люмінесценції 748нм (хлороформ). Знайдено (%): С, 79.89; Н, 8.69; О, 11.72. С66Н80O7. Обчислено (%): С, 80.45; Н, 8.18; О, 11.37. Приклад 4. Отримання тріс(птретбутілтіофеніл)-16,17-дідецилоксі-віолантрен5,10-дюна (4). Аналогічно прикладу 2, але замість птретбутілфенолята натрію беруть птретбутілтіофенолят натрію і одержують тріс(птретбутілтіофеніл)-16,17-дідецилоксівіолантрен5,10-діон (4) з температурою плавлення 152157°С. макс. поглинання 670нм, макс. . люмінесценції 769нм (хлороформ). Знайдено (%): С,78.86; Н, 8.19; О, 5.72; S, 8.18. C84H92O4S3. Обчислено (%): С, 79.96; Н, 7.35; О, 5.07; S, 7.62. Приклад 5. Отримання тріс(децилмеркапто)16,17-дідецилоксівіо-лантрен-5,10-діона (5). 7 91480 Аналогічно прикладу 2, але замість птретбутілфенолята натрію беруть децилмеркаптід калію і одержують тріс(децилмеркапто)-16,17дідецил-оксівіолантрен-5,10-діон (5) з температурою плавлення 131-135°С. макс. . поглинання 660нм, макс. . люмінесценції 758нм (хлороформ). Знайдено (%):С, 78.86; Н, 8.19; О, 5.72; S, 8.18. C84H116N4O3. Обчислено (%):С, 78.45; Н, 9.09; О, 4.98; S, 7.48 Приклад 6. Отримання тріс(дібутіламіно)16,17-дідецилоксіеіо-лантрен-5,10-діона (6). 2г (0.0019моль) Трибром-16,17-дідецилоксівіолантрен-5,10-діона розчиняють при нагріванні до 80°С в 60мл N-метілпірролідона, додається 3г (0.042моль) дібутіламіна, 1.5г безводого поташу і нагрівається до температури 90-95°С і витримується при перемішуванні протягом 2 годин. Реакційна маса охолоджується до кімнатної температури і додається 60 мл метанолу. Осад фільтрується, промивається метанолом, віджимається і сушиться. Очищення на хроматографічній колонці з силікагелем з бензолу дає 1.2г тріс(дібутіламіно)-16,17-дідецилоксівіолантрен5,10-діона (6) з температурою плавлення 235240°С. макс. поглинання 644нм, макс. . люмінес 8 ценції 747нм (хлороформ). Знайдено (%): С, 80.57; Н, 9.87; N, 3.12; О, 5.68. С78Н107Н3О4. Обчислено (%): С, 81.41; Н, 9.37; N,3.65; О, 5.56. Приклад 7. Отримання тріс(пірролідіно)-16,17дидецилоксивио-лантрен-5,10-диона (7). Аналогічно прикладу 6, але замість дібутіламіна беруть пірролідін і одержують тріс(пірролідіно)16,17-дідецилоксі-віолантрен-5,10-діон (7) з температурою плавлення 250-253°С. макс. поглинання 646нм, макс. . люмінесценції 748нм (хлороформ). Знайдено (%): С, 80.52; Н, 7.18; N, 4.02; S, 7.18. C66H77N3O4. Обчислено (%):С, 81.19; Н, 7.95; N, 4.30; О, 6.55. Як випливає з прикладів, органічні люмінофори, що заявляються, не поступаються прототипу по інтенсивності люмінесценції, світлостійкості і сумісності з полімерними матеріалами, область їх люмінесценції максимально наближена до області чутливості фотодіода (800-1000нм), і при цьому мають незначний ступінь перекриття спектрів поглинання і люмінесценції, що забезпечує високу прозорість пластин ЛСК і світловодів до світла власного випромінювання. Таблиця Номер 1 Сполука n=10 Спектрально-люмінесцеїітні властивості в хлороформі* Відносний світСвітлостійОбласть люмакс, погловихід по відкість за 8мінесценції, линання, ношенню до бальною шканм нм прототипу лою, балл 654 101 750-800 96 8 2 z x Br O C6H4 C(CH3 )3 652 102 755-810 103 8 3 x O C(CH3 )3 645 100 748-780 102 8 4 x S C6H4 670 102 769-820 99 8 5 x S C10H21 660 101 758-810 98 8 6 x N(C 4H9 )2 644 103 747-780 103 8 646 105 748-780 102 8 670 100 725 55 8 C(CH3 )3 N 7 x Прототип n 8 * по аналогії з умовами вимірювання згідно прототипу. Комп’ютерна верстка Н. Лиcенко Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюViolantron substituted compounds
Автори англійськоюZhmurin Petro Mykolaiovych, Hurkalenko Yurii Oleksandrovych, Zhmurin Petro Mykolaiovych
Назва патенту російськоюЗамещенные виолантрона
Автори російськоюШершуков Виктор Михайлович, Гуркаленко Юрий Александрович, Жмурин Петр Николаевич
МПК / Мітки
МПК: C09B 3/00
Мітки: заміщені, віолантрону
Код посилання
<a href="https://ua.patents.su/4-91480-zamishheni-violantronu.html" target="_blank" rel="follow" title="База патентів України">Заміщені віолантрону</a>
Попередній патент: Спосіб дослідження структури і елементного складу речовини та пристрій для його здійснення
Наступний патент: Механізм передачі обертального руху силовий








