Спосіб одержання n-[3-[(2-метоксифеніл)сульфаніл]-2-метилпропіл]-3,4-дигідро-2н-1,5-бензоксатієпін-3-аміну
Формула / Реферат
1. Спосіб одержання N-[3-[(2-метоксифеніл)сульфаніл]-2-метилпропіл]-3,4-дигідро-2Н-1,5-бензоксатієпін-3-аміну загальної формули (1)
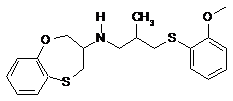 , (1)
, (1)
який відрізняється тим, що в ньому здійснюють конденсацію проміжних сполук формул (2) і (3)
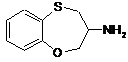 , (2)
, (2)  (3),
(3),
де R являє собою метил або переважно 4-метилфеніл.
2. Спосіб за п. 1, який відрізняється тим, що проміжні сполуки формули (3), де R являє собою метил або переважно 4-метилфеніл,
 , (3)
, (3)
одержують здійсненням реакції 3-[(2-метоксифеніл)сульфаніл]-2-метилпропанолу
 (4)
(4)
з сульфонілхлоридом, прийнятним для одержання сполуки формули (3).
3. Спосіб одержання N-[3-[(2-метоксифеніл)сульфаніл]-2-метилпропіл]-3,4-дигідро-2Н-1,5-бензоксатієпін-3-аміну формули (1) за п. 1 або 2, який відрізняється тим, що сполука (1) має абсолютну конфігурацію (R) відносно асиметричного атома вуглецю фрагмента 3,4-дигідро-2Н-1,5-бензоксатієпіну і абсолютну конфігурацію (S) відносно асиметричного атома вуглецю пропільного ланцюжка.
4. Спосіб одержання N-[3-[(2-метоксифеніл)сульфаніл]-2-метилпропіл]-3,4-дигідро-2Н-1,5-бензоксатієпін-3-аміну формули (1) за будь-яким з пп. 1-3, який відрізняється тим, що асиметричний атом вуглецю проміжної сполуки загальної формули (3), що використовується, має абсолютну конфігурацію (S).
5. Проміжні сполуки формули (3), в якій R являє собою метил або переважно 4-метилфеніл,
 (3).
(3).
6. Застосування проміжних сполук формули (3) для одержання сполук формули (1).
7. Проміжні сполуки загальної формули (3) за п. 5, в яких асиметричний атом вуглецю пропільного ланцюжка має абсолютну конфігурацію (S).
Текст
1. Спосіб одержання N-[3-[(2метоксифеніл)сульфаніл]-2-метилпропіл]-3,4дигідро-2Н-1,5-бензоксатієпін-3-аміну загальної формули (1) 3 94632 4 7. Проміжні сполуки загальної формули (3) за п. 5, в яких асиметричний атом вуглецю пропільного ланцюжка має абсолютну конфігурацію (S). Даний винахід стосується нового способу одержання похідного формули (1) товуються, а також деяких побічних продуктів, що утворюються, така послідовність є складною для реалізації в промисловому масштабі. У способі синтезу, описаному в заявці WO 05/103027, сполуку формули (1) одержують відповідно до схеми II відновленням хімічно і стереохімічно стабільного аміду формули (6). Перевага даного способу по суті полягає в тому, що він є надійним, реалізовуваним в промисловому масштабі і, таким чином, при необхідності прийнятним для використання для виробництва великих кількостей сполуки (1) в протилежність способу, описаному в WO 02/081464. його адитивних солей і гідратів таких адитивних солей з фармацевтично прийнятними неорганічними або органічними кислотами, а також їх таутомерних форм, енантіомерів, сумішей енантіомерів і стереоізомерів в чистому вигляді або в рацемічній або нерацемічній суміші. Новий спосіб переважно стосується сполуки (1), в якій асиметричний атом вуглецю фрагмента 3,4-дигідро-2Н1,5-бензоксатієпіну має абсолютну конфігурацію (R), а асиметричний атом вуглецю пропільного ланцюжка має абсолютну конфігурацію (S). Дескриптори (R) і (S), що використовуються для уточнення абсолютної конфігурації асиметричних атомів, що містяться в сполуці формули (1), визначені відповідно до правилу пріоритету CahnIngold-Prelog (E.L. Eliel and S.H. Wilen. Stereochemistry of Organic Compounds, John Wiley & Sons, Inc., chap. 5, 104-12, 1994). В особливо переважному варіанті здійснення даного винаходу стереоізомер сполуки (1) вибраний з: (3R)-N-{(2S)-3-[(2-метоксифеніл)сульфаніл]-2метилпропіл}-3,4-дигідро-2Н-1,5-бензоксатієпін-3аміну; її адитивних солей і гідратів таких адитивних солей з фармацевтично прийнятними неорганічними або органічними кислотами. У даному винаході стереоізомер вважається чистим, якщо він містить менше 1% іншого стереоізомера або суміші інших стереоізомерів (тобто, діастереоізомерна чистота (98%, L'actualité chimique, 2003, 11/12, 104). Сполука формули (1) описана в заявці на патент WO 02/081464, в якому вона заявлена як прийнятна при лікуванні стабільної стенокардії, нестабільної стенокардії, серцевої недостатності, природженого синдрому Романо-Уорда, інфаркту міокарда і розладів серцевого ритму. У згаданій заявці сполуку формули (1) одержують реакцією відновного амінування між сполукою формули (2) і альдегідом формули (5) згідно з наведеною далі схемою І. Однак така реакція відновного амінування створює проблеми внаслідок хімічної і стереохімічної нестабільності альдегіду формули (5). До того ж, відносно природи деяких реагентів, що викорис Однак, хоча даний спосіб є таким, що реалізовується в промисловому масштабі, він має два великих недоліки, які значно обмежують або ускладнюють експлуатацію. • На останній стадії способу WO 05/103027 застосовується відновлення амідогрупи до відповідної аміногрупи за допомогою комплексу борану (ВН3ТГФ) при нагріванні. В експериментальних умовах, що вимагаються для здійснення згаданої реакції відновлення, з гідриду бору (ВН3) може утворюватися диборан В2Н6, що є токсичним і надто вогне- і вибухонебезпечним (INRS, FT n°188, 1987). Внаслідок можливих ризиків отруєнь, пожеж і вибухів, що обумовлюються можливим утворенням В2Н6, під час маніпуляцій з комплексом ВН3ТГФ потрібно вживання особливих заходів обережності і захисту, що значно ускладнює експлуатацію. У той же час, виявляється, що відновлення аміду (6) до аміну (1) за допомогою інших відновлювальних агентів, відмінних від комплексу борану (тобто таких, які не можуть утворювати В2Н6), є незадовільним. • Інший обмежуючий фактор зумовлений тим, що в способі, описаному в WO 05/103027, як початкова сполука в синтезі проміжної сполуки (6) використовується метил-(R)-3-гідрокси-2метилпропаноат [72657-23-9], що є малодоступним в промисловому масштабі. Таким чином, розробка способу синтезу, здійсненного в промисловому масштабі без описаних раніше недоліків, є необхідною для одержання лікарських засобів, прийнятних при лікуванні стабільної стенокардії, нестабільної стенокардії, серцевої недостатності, природженого синдрому Романо-Уорда, інфаркту міокарда і розладів серцевого ритму. Таким чином, об'єктом даного винаходу є новий спосіб синтезу сполуки (1), що не володіє описаними раніше обмеженнями. 5 Так, наприклад, спосіб за даним винаходом, в протилежність способу, описаному в WO 05/103027, не включає в себе відновлення амідогрупи за рахунок застосування відновлювального агента типу комплексу борану. Внаслідок цього безпека нового способу підвищується значною мірою. Іншим важливим поліпшенням способу за даним винаходом є використання як початкової сполуки похідного типу (S)-3-галоген-2метилпропанолу, що є в більшій мірі доступним, ніж метил-(R)-3-гідрокси-2-метилпропаноат, який використовується в способі, описаному в WO 05/103027. Таким чином, в плані безпеки експлуатації і в економічному плані спосіб за даним винаходом володіє помітними перевагами в порівнянні зі способом, описаним в заявці на патент WO 05/103027. Таким чином, в першому аспекті даний винахід стосується поліпшення способу синтезу сполуки формули (1) . Дану сполуку одержують відповідно до схеми III конденсацією сполук формул (2) і (3) де R являє собою метил або переважно 4метилфеніл. Переважним стереоізомером сполук формул (1), (2) і (3) у всіх випадках є ізомер, в якому асиметричні атоми вуглецю фрагмента 3,4-дигідро2Н-1,5-бензоксатієпіну і ланцюжка мають абсолютну конфігурацію (R) і (S), відповідно. Згідно з новим способом за даним винаходом амін (2) при нагріванні переважно в інтервалі 100200°С взаємодіє з похідним формули (3), переважно тозилатом, в присутності основи, наприклад ненуклеофільної азотвмісної основи, такої як діізопропілетиламін або триетиламін, в інертному розчиннику, такому як толуол або ксилол. Заміщення тозилатної групи первинним аміном являє собою реакцію, добре відому в органічній хімії, див., наприклад, Organic Process Research & development, 2005, 9(3), 314. Однак несподіваним чином реакція аміну (2) з тозилатом (3) виявилася на диво ефективною. Насправді, в ході згаданої реакції не спостерігається утворення речовини, що одержується в результаті діалкілування аміну (2) тозилатом (3), і побічних продуктів, що одержуються внаслідок відщеплення п 94632 6 толуолсульфонової кислоти від сполуки (3). До того ж, в умовах реакції не відбувається істотна рацемізація як проміжних сполук (2) і (3), так і сполуки (1), що утворюється. Наслідком цього є те, що сполуку формули (1) одержують із задовільними виходом і стереохімічною чистотою. У технічному відношенні проведення реакції і обробка реакційної суміші є легкоздійснюваними. Таким чином, спосіб за даним винаходом є особливо прийнятним для виробництва великих кількостей сполуки формули (1). У другому аспекті даний винахід стосується способу синтезу нової проміжної сполуки формули (3) відповідно до схеми IV в якій сполуку формули (4), що являє собою 3(2-метоксифенілсульфоніл)-2-метилпропанол обробляють метансульфонілхлоридом або паратолуолсульфонілхлоридом в присутності органічної або неорганічної основи, такої як, наприклад, піридин, триетиламін, карбонат калію або крихта безводного гідроксиду калію, для одержання сполуки формули (3). Так, наприклад, функціональну спиртову групу 3(метоксифеніл)сульфаніл-2-метилпропанолу формули (4) для одержання нової сполуки формули (3) активують переважно переведенням в тозилат. Переважним енантіомером сполук формули (3) є енантіомер, в якому асиметричний атом вуглецю має абсолютну конфігурацію (S). Потім сполуку формули (3) конденсують з аміном (2) для одержання сполуки (1) (схема III). В іншому аспекті даний винахід стосується проміжної сполуки загальної формули (3) де R являє собою метил або переважно 4метилфеніл. Більш переважно даний винахід стосується проміжної сполуки загальної формули (3), такої, як описано раніше, в якій асиметричний атом вугле 7 94632 цю пропільного ланцюжка має абсолютну конфігурацію (S). Наведені далі приклади призначені для пояснення даного винаходу, однак без обмеження об'єму патентної охорони. Приклад 1 (S)-3-(2-метоксифеніл)сульфаніл-2метилпропанол-4-метилбензолсульфонат (3) У тригорлу колбу в інертній атмосфері вносять 10 мл метиленхлориду, 2 г (9,4 ммоль) (S)-3-(2метоксифенілсульфаніл)-2-метилпропанолу, 2 г (10,5 ммоль) паратолуолсульфонілхлориду, 115 мг (0,94 ммоль) 4-диметиламінопіридину і 1,2 г (12,1 ммоль) триетиламіну, що додаються по краплях. Після перемішування протягом 2 год. при кімнатній температурі додають 10 мл демінералізованої води. Значення рН доводять до 6,5 додаванням 2Н розчину соляної кислоти. Шари розділяють і потім органічний шар промивають 10 мл демінералізованої води. Органічний шар концентрують при зниженому тиску. Одержану маслоподібну речовину жовтого кольору (3,2 г) розчиняють в суміші 4,8 мл метиленхлориду і 19,2 мл ізопропілового ефіру. Одержаний осад відділяють фільтруванням, промивають ізопропіловим ефіром 2 рази по 10 мл і сушать при 40°С при зниженому тиску. Одержують згадану в заголовку сполуку (3) у вигляді порошку білого кольору в кількості 2,6 г (75%). Rf=0,56 (гептан/AcOEt: 60/40; діоксид кремнію Merck 254). tпл=86-87°C. 1 ЯМР Н (CDCІ3) δ: 1,03 (д, 3Η, J=7,0 Гц); 2,02 (м, 1Н); 2,43 (с, 3Н); 2,71 (дд, 1Н, J=6,8 Гц, J=13,0 Гц); 2,89 (дд, 1Н, J=6,7 Гц, J=13,0 Гц); 3,87 (с, 3Н); 4,01 (д, 2Н, J=5,6 Гц); 6,84 (д, 1Н, J=7,6 Гц); 6,88 (дд, 1Н, J=7,1 Гц, J=7,6 Гц); 7,10 (д, 1Н, J=7,6 Гц); 7,18 (дд, 1Н, J=7,1 Гц, J=7,6 Гц); 7,32 (д, 2Н, J=8,1 Гц); 7,77 (д, 2Н, J=8,1 Гц). 13 ЯМР С (CDCІ3) δ: 16,26; 21,62; 32,95; 35,14; 55,73; 73,37; 110,60; 121,02; 123,63; 127,62; 127,88 (2С); 129,81 (2С); 130,21; 132,88; 144,70; 157,64. ВЕРХ, колонка chiralcel OD (250x4,6 мм), елюент (гексан/етанол/діетиламін, 97/3/0,1), 1 мл/хв., tвид (S)=21,02 хв.; tвид (R)=19,77 хв. Хиральна чистота (ізомер S), визначена по площі під кривою: 99%. МС (АРСІ+) m/z: 367 (М+Н), 195 (M-TsO). Комп’ютерна верстка Л. Купенко 8 Приклад 2 (3R)-N-{(2S)-3-[(2-метоксифеніл)сульфаніл]-2метилпропіл}-3,4-дигідро-2Н-1,5-бензоксатієпін-3амін (1) У тригорлу колбу в інертній атмосфері вносять 6,5 г (35,9 ммоль) (R)-3,4-дигідро-2Н-1,5бензоксатієпін-3-аміну і 11 г (30 ммоль) (S)-3-(2метоксифенілсульфаніл)-2-метилпропіл-4метилбензолсульфонату в 33 мл толуолу. Додають 6 г (60 ммоль) триетиламіну і потім реакційну суміш нагрівають при 105°С при перемішуванні протягом 24 год. Після охолоджування до кімнатної температури додають 33 мл толуолу. Органічний шар промивають демінералізованою водою два рази по 66 мл, а потім знебарвлюють при перемішуванні протягом години в присутності 2 г Noir CXV. Після концентрування при зниженому тиску промивають 33 мл 100%-го етанолу. Одержують згадану в заголовку сполуку у вигляді маслоподібної речовини жовтого кольору (8,85 г; 79%). Rf=0,53 (гептан/AcOEt: 60/40; діоксид кремнію Merck 254). 8,85 г (23,5 ммоль) сполуки (1) вносять в 53 мл суміші 100%-й етанол/метил-трет-бутиловий ефір (2/4 об./об.). 62%-й розчин бромоводневої кислоти (3 г; 23,5 ммоль) повільно підливають при кімнатній температурі до розчину аміну, а потім після перемішування протягом двох годин при кімнатній температурі одержану тверду речовину відділяють фільтруванням і промивають метил-третбутиловим ефіром 3 рази по 15 мл. Після висушування протягом 12 год. при 50°С одержують 7,3 г (68%) гідроброміду сполуки (1). tпл = 129-131°С. 1 ЯМР Н (ДМСО-d6) δ: 1,12 (д, 3Н), 2,19 (м, 1H), 2,82 (дд, 1Н), 3,05 (уш.м, 1H), 3,12 (дд, 1H), 3,23 (уш.м, 1Н), 3,32 (м, 2Н), 3,82 (с, 3Н), 3,90 (уш.с, 1Н), 4,39 (дд, 1H), 4,52 (дд, 1Н), 6,98 (м, 2Н), 7,07 (м, 2Н), 7,23 (м, 3Н), 7,40 (дд, 1Н), 8,88 (уш.с, 2Н обмінні). ВЕРХ, колонка chiralcel OJ (250x4,6 мм), елюент (метанол/етанол/діетиламін: 50/50/0,1) 1 мл/хв., tвид (R, S)=24,37 хв.; tвид (R, R)=16,80 хв.; tвид (S, S)=19,79 хв.; tвид (S, R)=15,05 хв. Хиральна чистота (ізомер R, S), визначена по процентній частці площі під кривою: 98%. Підписне Тираж 24 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for preparing n-[3-[(2-methoxyphenyl)sulfanyl]-2-methylpropyl]-3,4-dihydro-2h-1,5-benzoxathiepin-3-amine
Автори англійськоюVacher, Bernard, Brunel, Yves, Maurel Jean-Louis
Назва патенту російськоюСпособ получения n-[3-[(2-метоксифенил)сульфанил]-2-метилпропил]-3,4-дигидро-2н-1,5-бензоксатиепин-3-амина
Автори російськоюВаше Бернар, Брюнель Ив, Морель Жан-Луи
МПК / Мітки
МПК: C07C 323/20, C07D 327/00
Мітки: n-[3-[(2-метоксифеніл)сульфаніл]-2-метилпропіл]-3,4-дигідро-2н-1,5-бензоксатієпін-3-аміну, спосіб, одержання
Код посилання
<a href="https://ua.patents.su/4-94632-sposib-oderzhannya-n-3-2-metoksifenilsulfanil-2-metilpropil-34-digidro-2n-15-benzoksatiehpin-3-aminu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання n-[3-[(2-метоксифеніл)сульфаніл]-2-метилпропіл]-3,4-дигідро-2н-1,5-бензоксатієпін-3-аміну</a>
Попередній патент: Спосіб одержання і регулювання додаткової сили притискання коліс локомотива до рейкового шляху та пристрій для його реалізації
Наступний патент: Система фритюрного апарата та протипожежна система (варіанти) для нього
Випадковий патент: Фотоннокристалічний оптично змінний елемент захисту та забезпечувальний документ, що його містить








