Похідні фенілаланіну
Номер патенту: 74385
Опубліковано: 15.12.2005
Автори: Йошімура Тосіхіко, Окудзумі Тацуя, Ідзава Хіроюкі, Мурата Масахіро, Сатаке Юко, Сагі Кадзуюкі, Цуджі Такасі, Макіно Сінго, Чіба Акіра, Судзукі Нобуясу, Наканісі Ейджі
Формула / Реферат
1. Похідні фенілаланіну поданої нижче загальної формули (1) та їхні фармацевтично прийнятні солі:
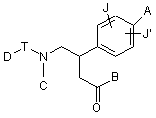 , 1
, 1
де А є одна з поданих нижче загальних формул (2), (3), (3-1) або (3-2):
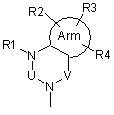 , (2)
, (2)
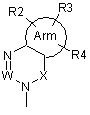 , (3)
, (3)
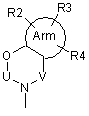 , (3-1)
, (3-1)
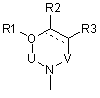 , (3-2)
, (3-2)
де Arm є циклоалкіл або ароматичний цикл, який містить 0, 1, 2, 3 або 4 гетероатоми, вибрані із групи, до якої входять атоми кисню, сірки та азоту,
подвійна суцільна лінія і штрихова лінія у формулі (3-2) означає одинарний або подвійний зв'язок,
U, V та Х означають С(=О), S(=O)2, C(-R5)(-R6), C(=C(-R5)(-R6)), C(=S), S(=O), P(=O)(OH) або Р(-Н)(=O),
W означає C(-R7) або атом азоту,
R1, R2, R3, R4, R5, R6 і R7 можуть бути однаковими або відрізнятися один від одного, і кожний з них є атом водню, атом галоїду, гідроксил, нижчий алкіл, заміщений нижчий алкіл, нижчий алкеніл, заміщений нижчий алкеніл, нижчий алкініл, заміщений нижчий алкініл, циклоалкіл, який може містити в циклі гетероатом (гетероатоми), арил, гетероарил, нижчий алкіл, заміщений циклоалкілом (циклоалкілами), який може (які можуть) містити в циклі гетероатом (гетероатоми), нижчий алкіл, заміщений арилом (арилами), нижчий алкіл, заміщений гетероарилом (гетероарилами), нижча алкоксигрупа, нижча алкілтіогрупа, нижча алкоксигрупа та нижча алкілтіогрупа, заміщені циклоалкілом (циклоалкілами), який може (які можуть) містити в циклі гетероатом (гетероатоми), нижча алкоксигрупа та нижча алкілтіогрупа, заміщені арилом (арилами), нижча алкоксигрупа та нижча алкілтіогрупа, заміщені гетероарилом (гетероарилами), циклоалкілоксигрупа, яка може містити в циклі гетероатом (гетероатоми), арилоксигрупа, гетероарилоксигрупа, нижчий гідроксіалкіл, нижчий гідроксіалкеніл, нижча гідроксіалкоксигрупа, нижчий галоїдний алкіл, нижча галоїдалкоксигрупа, нижча галоїдалкілтіогрупа, нижчий галоїдалкеніл, нітрогрупа, ціаногрупа, заміщена або незаміщена аміногрупа, карбоксил, нижчий алкілоксикарбоніл, заміщений або незаміщений карбамоїл, нижчий алканоїл, ароїл, нижчий алкілсульфоніл, заміщений чи незаміщений сульфамоїл або амонієва група, R5 та R6 можуть бути з'єднані між собою і утворювати цикл, який може містити один або два атоми кисню, азоту або сірки,
В є гідроксил, нижча алкоксигрупа або гідроксиламіногрупа,
С є атом водню, нижчий алкіл, нижчий алкеніл, нижчий алкініл, нижчий алкіл, заміщений циклоалкілом (циклоалкілами), який може (які можуть) містити в циклі гетероатом (гетероатоми), нижчий алкіл, заміщений арилом (арилами), або нижчий алкіл, заміщений гетероарилом (гетероарилами),
D є нижчий алкіл, нижчий алкеніл, нижчий алкініл, циклоалкіл, який може містити в циклі гетероатом (гетероатоми), арил, гетероарил, нижчий алкіл, заміщений циклоалкілом (циклоалкілами), який може (які можуть) містити в циклі гетероатом (гетероатоми), нижчий алкіл, заміщений арилом (арилами), нижчий алкіл, заміщений гетероарилом (гетероарилами), нижча алкоксигрупа, нижча алкоксигрупа, заміщена циклоалкілом (циклоалкілами), який може (які можуть) містити в циклі гетероатом (гетероатоми), нижча алкоксигрупа, заміщена арилом (арилами), нижча алкоксигрупа, заміщена гетероарилом (гетероарилами), циклоалкілоксигрупа, яка може містити в циклі гетероатом (гетероатоми), арилоксигрупа, гетероарилоксигрупа, нижчий гідроксіалкіл, нижчий гідроксіалкеніл, нижча гідроксіалкоксигрупа, нижчий галоїдний алкіл, нижча галоїдалкоксигрупа, нижчий галоїдалкеніл, нітрогрупа, ціаногрупа, заміщена або незаміщена аміногрупа, карбоксил, нижчий алкілоксикарбоніл, заміщений або незаміщений карбамоїл, нижчий алканоїл, ароїл, нижча алкілтіогрупа, нижчий алкілсульфоніл, або заміщений чи незаміщений сульфамоїл,
С та D можуть бути з'єднані між собою і утворювати цикл, який може містити один або два атоми кисню, азоту або сірки,
Т означає міжатомний зв'язок, С(=O), C(=S), S(=O), S(=O)2, N(H)-C(=O) або N(H)-C(=S),
J і J' можуть бути однаковими або відрізнятися один від одного, і кожний з них є атом водню, атом галоїду, нижчий алкіл, нижча алкілоксигрупа або нітрогрупа,
за умови, що згадані похідні фенілаланіну загальної формули (1) не включають сполуки, які мають подані нижче формули (А-1) або (А-2), коли А є формула (3-2)
 , (А-1)
, (А-1)
 . (А-2)
. (А-2)
2. Похідні фенілаланіну або їхні фармацевтично прийнятні солі за п. 1, де А є одна із груп, що мають загальні формули (2) або (3), a R1, R2, R3, R4, R5, R6 і R7 можуть бути однаковими або відрізнятися один від одного, і кожний із них є атом водню, атом галоїду, гідроксил, нижчий алкіл, заміщений нижчий алкіл, нижчий алкеніл, заміщений нижчий алкеніл, нижчий алкініл, заміщений нижчий алкініл, циклоалкіл, який може містити в циклі гетероатом (гетероатоми), арил, гетероарил, нижчий алкіл, заміщений циклоалкілом (циклоалкілами), який може (які можуть) містити в циклі гетероатом (гетероатоми), нижчий алкіл, заміщений арилом (арилами), нижчий алкіл, заміщений гетероарилом (гетероарилами), нижча алкоксигрупа, нижча алкілтіогрупа, нижча алкоксигрупа та нижча алкілтіогрупа, заміщені циклоалкілом (циклоалкілами), який може (які можуть) містити в циклі гетероатом (гетероатоми), нижча алкоксигрупа та нижча алкілтіогрупа, заміщені арилом (арилами), нижча алкоксигрупа та нижча алкілтіогрупа, заміщені гетероарилом (гетероарилами), циклоалкілоксигрупа, яка може містити в циклі гетероатом (гетероатоми), арилоксигрупа, гетероарилоксигрупа, нижчий гідроксіалкіл, нижчий гідроксіалкеніл, нижча гідроксіалкоксигрупа, нижчий галоїдний алкіл, нижча галоїдалкоксигрупа, нижча галоїдалкілтіогрупа, нижчий галоїдалкеніл, нітрогрупа, ціаногрупа, заміщена або незаміщена аміногрупа, карбоксил, нижчий алкілоксикарбоніл, заміщений або незаміщений карбамоїл, нижчий алканоїл, ароїл, нижчий алкілсульфоніл або заміщений чи незаміщений сульфамоїл, R5 та R6 можуть бути з'єднані між собою і утворювати цикл, який може містити один або два атоми кисню, азоту або сірки.
3. Похідні фенілаланіну або їхні фармацевтично прийнятні солі за п. 2, де в загальній формулі (1) В є гідроксил або нижча алкоксигрупа,
С є атом водню або нижчий алкіл,
J і J' є атоми водню, і
в загальних формулах (2) та (3)
V та Х означають будь-яку із груп С(=O), S(=O)2 або C(-R5)(-R6),
U означає будь-яку із груп С(=O), S(=O)2, C(-R5)(-R6), C(=C(-R5)(-R6)), C(=S), S(=О), P(=О)(OH) або Р(-Н)(=О).
4. Похідні фенілаланіну або їхні фармацевтично прийнятні солі за п. 2, де в загальній формулі (1) В є гідроксил або нижча алкоксигрупа,
С є атом водню або нижчий алкіл,
J і J' є атоми водню, і
в загальних формулах (2) та (3) Arm є бензольний цикл або ароматичний цикл, який містить 1, 2, 3 або 4 гетероатоми, вибрані із групи, до якої входять атоми кисню, сірки та азоту.
5. Похідні фенілаланіну або їхні фармацевтично прийнятні солі за п. 2, де в загальній формулі (1) В є гідроксил або нижча алкоксигрупа,
С є атом водню або нижчий алкіл,
J і J' є атоми водню, і
в загальних формулах (2) та (3) Arm є бензольний цикл або ароматичний цикл, який містить 1, 2, 3 або 4 гетероатоми, вибрані із групи, до якої входять атоми кисню, сірки та азоту,
V та Х означають будь-яку із груп С(=O), S(=O)2 або C(-R5)(-R6),
U означає будь-яку із груп С(=O), S(=O)2, C(-R5)(-R6), C(=C(-R5)(-R6)), C(-S), S(=O), P(=O)(OH) або Р(-Н)(=O).
6. Похідні фенілаланіну або їхні фармацевтично прийнятні солі за п. 1, де А означає подану нижче формулу (3-3):
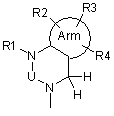 , (3-3)
, (3-3)
де Arm, U та R1-R4 відповідають визначенням за п. 1.
7. Похідні фенілаланіну або їхні фармацевтично прийнятні солі за п. 1, де А означає подані нижче формули (3-4) або (3-5):
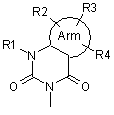 , (3-4)
, (3-4)
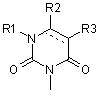 , (3-5)
, (3-5)
де Arm та R1-R4 відповідають визначенням за п. 1, і подвійна суцільна лінія і штрихова лінія у формулі (3-5) означає одинарний або подвійний зв'язок.
8. Похідні фенілаланіну або їхні фармацевтично прийнятні солі за п. 7, де А означає формулу (3-4), Arm є бензольний цикл, піридиновий цикл, піразоловий цикл або циклогексановий цикл, R1 є нижчий алкіл, R2, R3 та R4 можуть бути однаковими або відрізнятися один від одного, і кожний із них є атом водню, атом галоїду, гідроксил, нижчий алкіл, циклоалкіл, який може містити в циклі гетероатом (гетероатоми), нижчий алкіл, заміщений циклоалкілом (циклоалкілами), який може (які можуть) містити в циклі гетероатом (гетероатоми), нижча алкоксигрупа, нижча алкілтіогрупа, нижчий галоїдний алкіл, нижча галоїдалкоксигрупа, нижча галоїдалкілтіогрупа, нітрогрупа, ціаногрупа, аміногрупа, аміногрупа, заміщена нижчим алкілом (алкілами), або триалкіламонієва група.
9. Похідні фенілаланіну або їхні фармацевтично прийнятні солі за п. 1, де в загальній формулі (1) D означає подані нижче формули (4-1), (4-2), (4-3) або (4-4)
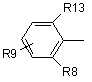 , (4-1)
, (4-1)
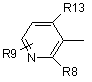 , (4-2)
, (4-2)
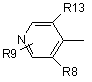 , (4-3)
, (4-3)
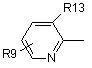 , (4-4)
, (4-4)
де R13 є атом галоїду або метил, R8 є атом галоїду, метил, трифторметил, метоксигрупа або атом водню, R9 є атом водню, атом галоїду, гідроксил, нижчий алкіл, циклоалкіл, який може містити в циклі гетероатом (гетероатоми), нижчий алкіл, заміщений циклоалкілом (циклоалкілами), який може (які можуть) містити в циклі гетероатом (гетероатоми), нижча алкоксигрупа, нижча алкілтіогрупа, нижчий галоїдний алкіл, нижча галоїдалкоксигрупа, нижча галоїдалкілтіогрупа, нітрогрупа, ціаногрупа, аміногрупа, аміногрупа, заміщена нижчим алкілом (алкілами), триалкіламонієва група, метансульфоніламіногрупа та тетразоліл.
10. Похідні фенілаланіну або їхні фармацевтично прийнятні солі за п. 9, де в загальній формулі (1) D означає формулу (4-1), і
в згаданій формулі (4-1) R13 та R8 є атоми хлору, а R9 є атом водню, атом галоїду, гідроксил, нижчий алкіл, циклоалкіл, який може містити в циклі гетероатом (гетероатоми), нижча алкоксигрупа, нижча алкілтіогрупа, нижчий галоїдний алкіл, нижча галоїдалкоксигрупа, нижча галоїдалкілтіогрупа, нітрогрупа, ціаногрупа, аміногрупа, аміногрупа, заміщена нижчим алкілом (алкілами), або триалкіламонієва група.
11. Похідні фенілаланіну або їхні фармацевтично прийнятні солі за п. 1, де в загальній формулі (1) С є атом водню і Т є С(=O).
12. Похідні фенілаланіну або їхні фармацевтично прийнятні солі за п. 1, де в загальній формулі (1) А означає подані нижче формули (3-4) або (3-5):
 , (3-4)
, (3-4)
 , (3-5)
, (3-5)
де Arm та R1-R4 відповідають визначенням за п. 1, і подвійна суцільна лінія та штрихова лінія в формулі (3-5) означає одинарний або подвійний зв'язок, D означає подані нижче формули (4-1), (4-2), (4-3) або (4-4):
 , (4-1)
, (4-1)  , (4-2)
, (4-2)
 , (4-3)
, (4-3)  , (4-4)
, (4-4)
де R13 є атом галоїду або метил, R8 є атом галоїду, метил, трифторметил, метоксигрупа або атом водню, R9 є атом водню, атом галоїду, гідроксил, нижчий алкіл, циклоалкіл, який може містити в циклі гетероатом (гетероатоми), нижчий алкіл, заміщений циклоалкілом (циклоалкілами), який може (які можуть) містити в циклі гетероатом (гетероатоми), нижча алкоксигрупа, нижча алкілтіогрупа, нижчий галоїдний алкіл, нижча галоїдалкоксигрупа, нижча галоїдалкілтіогрупа, нітрогрупа, ціаногрупа, аміногрупа, аміногрупа, заміщена нижчим алкілом (алкілами), триалкіламонієва група, метансульфоніламіногрупа та тетразоліл, В є гідроксил або нижча алкоксигрупа, С є атом водню, кожний з J і J' є атом водню і Т є С(=O).
13. Похідні фенілаланіну або їхні фармацевтично прийнятні солі за п. 12, де в загальній формулі (1) А означає формулу (3-4), Arm є бензольний цикл, піридиновий цикл, піразоловий цикл або циклогексановий цикл, R1 є нижчий алкіл, R2, R3 та R4 можуть бути однаковими або відрізнятися один від одного, і кожний із них є атом водню, атом галоїду, гідроксил, нижчий алкіл, циклоалкіл, який може містити в циклі гетероатом (гетероатоми), нижчий алкіл, заміщений циклоалкілом (циклоалкілами), який може (які можуть) містити в циклі гетероатом (гетероатоми), нижча алкоксигрупа, нижча алкілтіогрупа, нижчий галоїдний алкіл, нижча галоїдалкоксигрупа, нижча галоїдалкілтіогрупа, нітрогрупа, ціаногрупа, аміногрупа, аміногрупа, заміщена нижчим алкілом (алкілами), або триалкіламонієва група, D означає подану нижче формулу (4-1)
 , (4-1)
, (4-1)
в формулі (4-1) R13 та R8 є атоми хлору, a R9 є атом водню, атом галоїду, гідроксил, нижчий алкіл, циклоалкіл, який може містити в циклі гетероатом (гетероатоми), нижча алкоксигрупа, нижча алкілтіогрупа, нижчий галоїдний алкіл, нижча галоїдалкоксигрупа, нижча галоїдалкілтіогрупа, нітрогрупа, ціаногрупа, аміногрупа, аміногрупа, заміщена нижчим алкілом (алкілами) або триалкіламонієва група,
В є гідроксил або нижча алкоксигрупа, С є атом водню, кожний з J і J' є атом водню і Т є С(=О).
14. Похідні фенілаланіну або їхні фармацевтично прийнятні солі за п. 6, де в загальній формулі (1) А означає формулу (3-3), а в формулі (3-3) U є С(=O) або C(=S), R1 є нижчий алкіл, R2, R3 та R4 можуть бути однаковими або відрізнятися один від одного, і кожний з них є атом водню, атом галоїду, гідроксил, нижчий алкіл, циклоалкіл, який може містити в циклі гетероатом (гетероатоми), нижчий алкіл, заміщений циклоалкілом (циклоалкілами), який може (які можуть) містити в циклі гетероатом (гетероатоми), нижча алкоксигрупа, нижча алкілтіогрупа, нижчий галоїдний алкіл, нижча галоїдалкоксигрупа, нижча галоїдалкілтіогрупа, нітрогрупа, ціаногрупа, аміногрупа, аміногрупа, заміщена нижчим алкілом (алкілами), або триалкіламонієва група, С є атом водню, D означає формулу (4-1), (4-2), (4-3) або (4-4)
 , (4-1)
, (4-1)  , (4-2)
, (4-2)
 , (4-3)
, (4-3)  , (4-4)
, (4-4)
де R13 є атом галоїду або метил, R8 є атом галоїду, метил, трифторметил, метоксигрупа або атом водню, R9 є атом водню, атом галоїду, гідроксил, нижчий алкіл, циклоалкіл, який може містити в циклі гетероатом (гетероатоми), нижчий алкіл, заміщений циклоалкілом (циклоалкілами), який може (які можуть) містити в циклі гетероатом (гетероатоми), нижча алкоксигрупа, нижча алкілтіогрупа, нижчий галоїдний алкіл, нижча галоїдалкоксигрупа, нижча галоїдалкілтіогрупа, нітрогрупа, ціаногрупа, аміногрупа, аміногрупа, заміщена нижчим алкілом (алкілами), триалкіламонієва група, метансульфоніламіногрупа та тетразоліл, і Т є С(=O).
15. Похідні фенілаланіну або їхні фармацевтично прийнятні солі за п. 14, де в загальній формулі (1) А означає формулу (3-3), а в формулі (3-3) U є С(=O) або C(=S), R1 є метил або етил, R2, R3 та R4 можуть бути однаковими або відрізнятися один від одного, і кожний із них є атом водню, атом галоїду, гідроксил, нижчий алкіл, циклоалкіл, який може містити в циклі гетероатом (гетероатоми), нижча алкоксигрупа, нижча алкілтіогрупа, нижчий галоїдний алкіл, нижча галоїдалкоксигрупа, нижча галоїдалкілтіогрупа, нітрогрупа, ціаногрупа, аміногрупа, аміногрупа, заміщена нижчим алкілом (алкілами), або триалкіламонієва група, В є гідроксил або нижча алкоксигрупа, С є атом водню, D означає формулу (4-1), де R13 та R8 є атоми хлору, а R9 є атом водню, атом галоїду, гідроксил, нижчий алкіл, циклоалкіл, який може містити в циклі гетероатом (гетероатоми), нижча алкоксигрупа, нижча алкілтіогрупа, нижчий галоїдний алкіл, нижча галоїдалкоксигрупа, нижча галоїдалкілтіогрупа, нітрогрупа, ціаногрупа, аміногрупа, аміногрупа, заміщена нижчим алкілом (алкілами), або триалкіламонієва група, Т є С(=O) і кожний з J і J' є атом водню.
16. Похідні фенілаланіну поданої нижче формули або їхні фармацевтично прийнятні солі за п. 1:
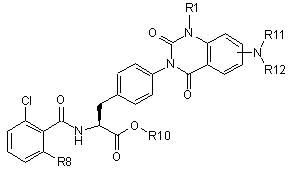 ,
,
де R1 є метил або етил, R8 є атом галоїду або метил, R10 є атом водню або нижчий алкіл, R11 і R12 можуть бути однаковими або відрізнятися один від одного, і кожний з них є атом водню, метил, етил або пропіл, R11 і R12 можуть бути з'єднані між собою і утворювати цикл, і в цьому разі R11-R12 є триметилен, тетраметилен або пентаметилен.
17. Похідні фенілаланіну поданих нижче формул або їхні фармацевтично прийнятні солі за п. 1:
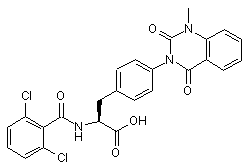 ,
,
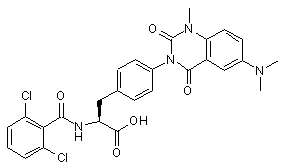 ,
,
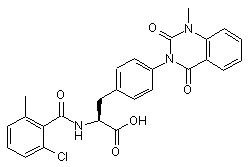 ,
,
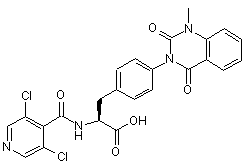 ,
,
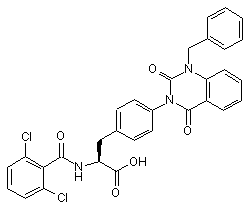 ,
,
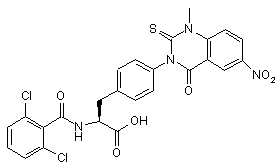 ,
,
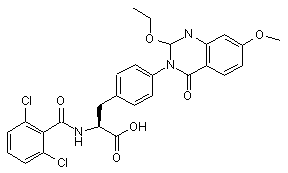 ,
,
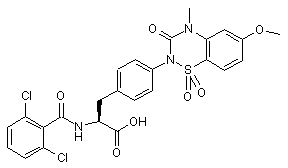 ,
,
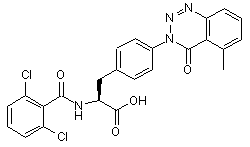 ,
,
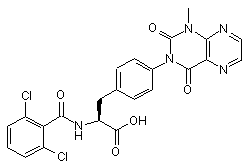 ,
,
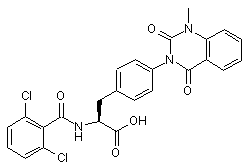 ,
,
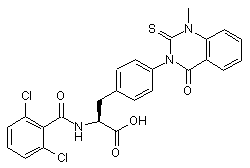 ,
,
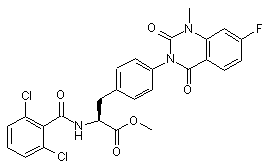 ,
,
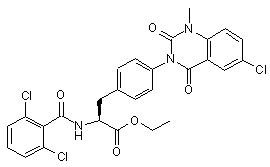 ,
,
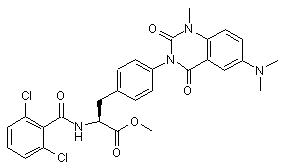 ,
,
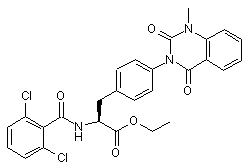 ,
,
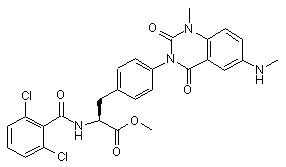 ,
,
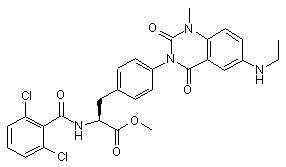 .
.
18. Антагоніст ![]() -4-інтегрину, який містить похідну фенілаланіну або її фармацевтично прийнятну сіль за будь-яким із пп. 1-17 як активний інгредієнт.
-4-інтегрину, який містить похідну фенілаланіну або її фармацевтично прийнятну сіль за будь-яким із пп. 1-17 як активний інгредієнт.
19. Засіб для лікування або профілактики запальних захворювань, патологія яких пов'язана із процесом адгезії, залежним від ![]() -4-інтегрину, який містить похідну фенілаланіну або її фармацевтично прийнятну сіль за будь-яким із пп. 1-17 як активний інгредієнт.
-4-інтегрину, який містить похідну фенілаланіну або її фармацевтично прийнятну сіль за будь-яким із пп. 1-17 як активний інгредієнт.
20. Фармацевтична композиція, яка містить похідну фенілаланіну або її фармацевтично прийнятну сіль за будь-яким із пп. 1-17 як активний інгредієнт.
21. Засіб для лікування або профілактики ревматоїдного артриту, запальних захворювань кишечнику, системного червоного вовчака, розсіяного склерозу, синдрому Шегрена, астми, псоріазу, алергії, діабету, захворювань серцево-судинної системи, артеріосклерозу, рестенозу, проліферації пухлин, розвитку метастазів пухлин і відторгнення трансплантатів, який містить похідну фенілаланіну або її фармацевтично прийнятну сіль за будь-яким із пп. 1-17 як активний інгредієнт.
Текст
шляхом реакції аміду (56) із заміщеним аміном у розчиннику, наприклад, в NMP або диметилсульфоксиді (ДМСО), а потім сполуку (58) шляхом відновлення нітрогрупи SnCl2, його гідратами тощо. Після одержання сполуки (60) шляхом циклізації (58) із застосуванням таких реагентів, як CDI, трифосген або n-нітрофенілхлорформіат, можна одержати сполуку (61) шляхом виконання реакції Міцунобу з використанням спирту, діізопропілазодикарбонової кислоти тощо. Як приклад методів синтезу складного ефіру (62), де в загальній формулі (1) А означає загальну формулу (2), обидві групи U та V є С(=О), a R2, R3 або R4 є амонієва група, згаданий складний ефір можна одержати шляхом реакції сполуки (61) з галоїдним алкілом у присутності основи, наприклад, діізопропілетиламіну, в органічному розчиннику, наприклад, в ДМФ або NMP. Як приклад методів синтезу складного ефіру (68), де в загальній формулі (1) А означає загальну формулу (3-2), згаданий складний ефір можна одержати, як описано нижче. Спочатку можна одержати амід (63) шляхом реакції аміну (6) із карбоновою кислотою, що має в b-положенні аміногрупу, захищену групою Fmoc, активованою з застосуванням агента конденсації, наприклад, DIC, і, в разі необхідності, відповідної домішки, наприклад, HOAt або HOBt, в органічному розчиннику, наприклад, в ДМФ, NMP або в хлористому метилені. Потім можна одержати амін (64) шляхом відщеплення групи Fmoc, з подальшим одержанням сульфаміду (65) шляхом реакції аміну (64) з сульфонілхлоридом, заміщеним нітрогрупою, в присутності основи, наприклад, 2,6-лутидину, в розчиннику, наприклад, в NMP або в хлористому метилені. Потім можна одержати сполуку (66) шляхом реакції (65) з галоїдним алкілом у присутності основи, наприклад, діізопропілетиламіну, а потім амін (67) шляхом реакції (66) з меркаптоетанолом, діазабіциклоундеценом тощо. Одержану сполуку піддають циклізації з застосуванням таких реагентів, як CDI, трифосген або nнітрофенілхлорформіат, і одержують складний ефір (68). Якщо А в похідній фенілаланіну формули (1) цього винаходу означає загальну формулу (3-3) і Arm є бензольний цикл, то такий складний ефір можна синтезувати, як описано нижче. Той же спосіб можна застосувати, якщо Arm не є бензольним циклом. Спочатку проводять реакцію аміну (6) з галоїдзаміщеним метилбензолом, який має в орто-положенні нітрогрупу, і одержують бензиламін (69). Після відновлення цього бензиламіну хлоридом олова тощо з одержанням аміну (70) можна одержати амін (71) шляхом перетворення аміногрупи при бензольному циклі введеного бензилового фрагменту в монозаміщену групу R1 різними способами. Нарешті, після циклізації з застосуванням таких реагентів, як CDI, трифосген або n-нітрофенілхлорформіат, можна одержати складний ефір (72). Фрагмент D-T в загальній формулі (1) можна утворити, як описано нижче. Наприклад, коли в формулі (1) Τ є С(=О), а В - гідроксил, якщо в складному ефірі (19) замісник G має структуру С, або є замісником, який можна перетворити в групу С на певній стадії процесу синтезу, або замісником, який має структуру з відповідною групою захисту, то замісник Ζ має структуру (2), (3), (3-1), (3-2) або є замісником, який можна перетворити в групу А на певній стадії процесу синтезу, або замісником, який має структуру з відповідною групою захисту, тоді складний ефір (19) можна перетворити в амін (20) шляхом відщеплення захисної групи у відповідних умовах, які залежать від природи групи захисту Е. Наприклад, якщо як Ε застосовано групу Fmoc (9-флуоренілметоксикарбоніл), то групу захисту можна видалити дією основи, наприклад, піперидину, в розчиннику, наприклад, в ДМФ. Амін (20) можна перетворити в амід (21) шляхом конденсації з карбоновою кислотою з застосуванням агента конденсації, наприклад, DIC, і, в разі необхідності, відповідної домішки, наприклад, HOAt або HOBt, в органічному розчиннику, наприклад, в ДМФ, NMP або в хлористому метилені. Крім того, амін (20) вводять в реакцію з галоїдним алкілом, ангідридом карбонової кислоти, галоїдсульфонілом або ангідридом сульфокислоти у присутності органічної основи, наприклад, триетиламіну, діізопропілетиламіну, піридину або Ν,Ν-диметиламінопіридину, або неорганічної основи, наприклад, карбонату калію або карбонату натрію, в органічному розчиннику, наприклад, в ДМФ, NMP або в хлористому метилені, після чого утворити відповідний амід або сульфамід. Крім того, амін (20) вводять в реакцію з різноманітними ізоціанатами та ізотіоціанатами в присутності, в разі необхідності, органічної основи, наприклад, триетиламіну, діізопропілетиламіну, піридину або Ν,Νдиметиламінопіридину, в органічному розчиннику, наприклад, ДМФ, толуолі або хлористому метилені, а потім одержують відповідну сечовину або тіосечовину. Складні ефіри, синтезовані за описаними вище способами, наприклад, (9), (12), (13), (14), (18), (21), (44), (45), (46), (50), (54), (55), (61), (62), (68) і (72), відщеплюють від смоли у відповідних умовах і одержують карбонову кислоту (87). Наприклад, при застосуванні смоли "Уонг", якщо в ефірі (22) групи А1, СІ і D1 є відповідно групами А, С і D або групами, які в умовах згаданого відщеплення перетворюються відповідно у групи А, С і D, то складний ефір (22) обробляють розчином кислоти, наприклад, TFA (трифтороцтової кислоти), і одержують розчин карбонової кислоти (87). Потім можна одержати чисту карбонову кислоту (87), застосовуючи добре відомі способи виділення та очищення, наприклад, концентрування, екстракцію, кристалізацію, хроматографію на колонці, РХВТ (рідинну хроматографію під високим тиском) та перекристалізацію одержаної таким чином карбонової кислоти (87). Сполуку, де В у загальній формулі (1) є нижча алкоксигрупа, можна одержати шляхом конденсації карбонової кислоти (87) з відповідним нижчим спиртом у присутності відповідного агента конденсації або кислотного каталізатора. Сполуку, де В у загальній формулі (1) є гідроксиламіногрупа, можна одержати шляхом конденсації карбонової кислоти (87) з гідроксиламіном у присутності відповідного агента конденсації. Похідні фенілаланіну формули (1) можна синтезувати з застосуванням представлених твердофазних методів до методів синтезу в розчинах, за умови добору відповідних груп захисту і з використанням добре відомих способів виділення та очищення. Якщо сполуки загальної формули (1) можуть утворювати солі, то достатньою умовою є фармацевтична прийнятність згаданих солей. Якщо ці сполуки містять кислотну групу, наприклад, карбоксил, то згадані солі можуть являти собою солі амонію або солі лужних металів, наприклад, натрію та калію, солі лужноземельних металів, наприклад, кальцію та магнію, солі алюмінію та цинку, солі згаданих сполук з органічними амінами, наприклад, із триетиламіном, етаноламіном, морфоліном, піперидином та дициклогексиламіном, та солі згаданих сполук з основними амінокислотами, наприклад, з аргініном та лізином. Якщо згадані сполуки містять основну групу, то згадані солі можуть являти собою солі неорганічних кислот, наприклад, хлористоводневої кислоти, сірчаної кислоти та фосфорної кислоти; солі з органічними кислотами, наприклад, солі оцтової кислоти, лимонної кислоти, бензойної кислоти, малеїнової кислоти, фумарової кислоти, винної кислоти та бурштинової кислоти; а також солі з органічними сульфокислотами, наприклад, солі метансульфокислоти і n-толуолсульфокислоти. Згадані солі можна одержувати шляхом змішування сполуки загальної формули (1) з необхідною кислотою або основою у відповідному співвідношенні в розчиннику або дисперсійному середовищі, або шляхом катіонного обміну або аніонного обміну з іншою сіллю. Сполуки загальної формули (1) цього винаходу охоплюють також їхні сольвати, наприклад, гідрати та спиртові адукти. Сполуки загальної формули (1) та їхні солі можна застосовувати у чистому вигляді або у формі різноманітних фармацевтичних композицій. Дозованими формами таких фармацевтичних композицій є, наприклад, таблетки, порошки, пілюлі, гранули, капсули, супозиторії, розчини, таблетки, вкриті цукровою оболонкою, депо та сиропи. їх можуть виготовляти працівники звичайної кваліфікації, застосовуючи звичайні способи. Наприклад, таблетки виготовляють шляхом змішування похідної фенілаланіну, що є активним інгредієнтом за цим винаходом, із будь-якими відомими домішками, наприклад, інертними розріджувачами, наприклад, із лактозою, карбонатом кальцію та фосфатом кальцію; зв'язуючими речовинами, наприклад, з акацієвою камеддю, кукурудзяним крохмалем та желатином; наповнювачами, наприклад, з альгіновою кислотою, кукурудзяним крохмалем та попередньо желатинизованим крохмалем; підсолоджувачами, наприклад, сахарозою, лактозою та сахарином; смаковими домішками, наприклад, м'ятою, гаультерієвою олією (Gaultheria aderothrix) та вишневим сиропом; змащувальними речовинами, наприклад, стеаратом магнію, тальком та карбоксиметилцелюлозою; наповнювачами для м'яких желатинових капсул та супозиторіїв, наприклад, жирами, восками, напівтвердими або рідкими поліолами, природними оліями та затвердлими оліями; і розріджувачами для розчинів, наприклад, водою, гліцерином, поліолами, сахарозою, інвертованими цукрами, глюкозою та рослинними оліями. Антагоніст, що містить сполуку (сполуки) вищезгаданої загальної формули (1) або її сіль (їхні солі) як активний інгредієнт, є корисним як засіб для лікування або профілактики захворювань, патологія яких пов'язана із процесом адгезії, залежним від a-4-інтегрину, наприклад, запальних захворювань, ревматоїдного артриту, запальних захворювань кишечнику, системного червоного вовчака, розсіяного склерозу, синдрому Шегрена, астми, псоріазу, алергії, діабету, захворювань серцево-судинної системи, артеріосклерозу, рестенозу, проліферації пухлин, розвитку метастазів пухлин, відторгнення трансплантатів тощо. Доза сполуки загальної формули (1) або її солі, яка застосовується для вищезгаданих цілей, варіює залежно від очікуваного терапевтичного ефекту, способу застосування, тривалості лікування, віку та маси тіла пацієнта. Така доза становить звичайно від 1мкг до 5г на день для дорослих при пероральному застосуванні і від 0,01мкг до 1г на день для дорослих при парентеральному застосуванні. (Приклади) Подані нижче Приклади додатково ілюструють цей винахід. Вони відображають лише варіанти здійснення винаходу, яким віддається перевага, і жодним чином не обмежують обсяг винаходу. Приклад 1. Синтез сполуки поданої нижче загальної формули (23). яка має замісник за Прикладом 1. Таблиця 1 Стадія 1. Приготування смоли Fmoc-Phe(4-NO2)OH (2,5г), 2,6-дихлорбензоїлхлорид (0,745мл) і піридин (1,5мл) в розчині в NMP (25мл) додавали до смоли "Уонг" (0,76ммоль/г, 2,3г) і перемішували при кімнатній температурі протягом 16год. Після видалення надлишку розчинника смолу тричі промивали ДМФ, тричі хлористим метиленом і двічі NMP. Із метою пасивації на смолі гідроксильних груп, які не вступили в реакцію, смолу обробляли оцтовим ангідридом (20мл), піридином (20мл) і NMP (20мл) протягом 2год. Після видалення надлишку розчинника смолу тричі промивали ДМФ, тричі хлористим метиленом, і сушили під зниженим тиском. Стадія 2. Відщеплення групи Fmoc До смоли, одержаної на Стадії 1, додавали 20%-ний розчин піперидину в ДМФ (25мл) і проводили реакцію протягом 15хв. Після видалення розчинника смолу тричі промивали ДМФ, тричі хлористим метиленом, і сушили під зниженим тиском. Стадія 3. Реакція ацилювання До 0,2г смоли, одержаної на Стадії 2, додавали 2,6-дихлорбензоїлхлорид (1,1мл), 2,6-лутидин (1,6мл) і NMP (26мл) і проводили реакцію протягом 6год. Після видалення надлишку розчинника смолу тричі промивали ДМФ, тричі хлористим метиленом, і сушили під зниженим тиском. Стадія 4. Відновлення нітрогрупи До 1,5г смоли, одержаної на Стадії 3, додавали розчин SnCl2·2H2O (15,0г) в NMP (30мл) і етанолі (1,5мл) і проводили реакцію протягом 16год. Після видалення реакційного розчинника смолу тричі промивали ДМФ і тричі хлористим метиленом. Стадія 5. Утворення циклу хіназолін-2,4-діону Проводили реакцію 2г смоли, одержаної на Стадії 4, з метил-2-ізоціанат-бензоатом (1,92г) в розчині в NMP (32мл) протягом 16год. Після видалення реакційного розчинника смолу тричі промивали ДМФ і тричі хлористим метиленом. Додавали до смоли 20%-ний розчин піперидину в ДМФ і проводили реакцію протягом 1год. Після видалення реакційного розчинника смолу тричі промивали ДМФ, тричі хлористим метиленом, і сушили під зниженим тиском. Стадія 6. Алкілування До 20мг смоли, одержаної на Стадії 5, додавали метилйодид (0,75ммоль), 18-краун-6 (30мг), NMP (1мл) і К2СО3 (35мг) і проводили реакцію протягом 3 діб. Після видалення реакційного розчинника смолу промивали ДМФ, водою, тричі ДМФ, тричі хлористим метиленом, і сушили під зниженим тиском. Стадія 7. Відщеплення від смоли Смолу, одержану на Стадії 6, обробляли трифтороцтовою кислотою із вмістом води 5% протягом 1год. Після фільтрування фільтрат концентрували під зниженим тиском. Залишок очищали рідинною хроматографією під високим тиском (елюент - суміш вода/ацетонітрил). Одержано 8мг цільової сполуки. MS (ESI MH+) - мас-спектр (іонізація електронним ударом): 512. Елементний аналіз: C25H19CІ 2N3O5. Приклади 2-7 Сполуки, подані нижче, були синтезовані за методикою, описаною в Прикладі 1, за тим винятком, що для алкілування на Стадії 6 Прикладу 1 були застосовані відповідні реагенти. В Таблиці 1 R означає замісник у поданій нижче загальній формулі (23); в Прикладі 2 застосовано ту ж методику, що в Прикладі 1, за тим винятком, що Стадію 6 Прикладу 1 не виконували. Таблиця 1 Приклад 1 2 3 4 5 6 7 R МеНEt2,6-дифторбензил 4-(1-піролідино)бензолкарбонілметил NCCH2НОС(=О)СН2 Мас-спектр, знайдено (МН+) 512 498 526 624 685 537 556 Приклад 8. Синтез сполуки поданої нижче загальної формули (24), яка має замісник за Прикладом 8, Таблиця 2 Стадія 1. Утворення циклу хіназолін-2,4-діону та відщеплення групи Fmoc Нітрогрупу смоли, одержаної на Стадії 1 Прикладу 1, відновлювали згідно зі Стадією 4 Прикладу 1 і утворювали цикл хіназолін-2,4-діону та відщепляли групу Fmoc згідно зі Стадією 5 Прикладу 1. Стадія 2. Ацилювання, алкілування та відщеплення від смоли Ацилювання виконували з використанням смоли, одержаної на Стадії 1 Прикладу 8 (25мг), 2,6диметилбензойної кислоти (0,4ммоль), DIC (0,4ммоль), HOAt (0,4ммоль) та NMP (2мл). Потім виконували алкілування згідно зі Стадією 6 Прикладу 1 і відщеплення від смоли та очищення, як описано в Стадії 7 Прикладу 1. Одержано цільову сполуку (9мг). Мас-спектр (іонізація електронним ударом): 472. Елементний аналіз: C27H25N3O5. Приклади 9-13 Сполуки, подані нижче, були синтезовані за методикою, описаною в Прикладі 8, за тим винятком, що на Стадії 2 Прикладу 8 були застосовані відповідні карбонові кислоти. В Таблиці 2 R означає замісник у поданій нижче загальній формулі (24). Крім того, у Прикладі 13 були використані подвійні кількості DIC та HOAt у порівнянні зі Стадією 2 Прикладу 8 для одержання цільової сполуки (7мг). Таблиця 2 Приклад 8 9 10 11 12 13 R 2,6-диметилбензоїл 2,6-диметоксибензоїл 2-етоксибензоїл 3,4-диметоксицинаміл циклогексилкарбоніл транс-4-карбоксициклогексанкарбоніл Мас-спектр, знайдено (МН+) 472 504 488 530 450 494 Приклад 14. Синтез сполуки поданої нижче загальної формули (25), яка має замісник за Прикладом 14, Таблиця 3. Стадія 1. Утворення циклу хіназолін-2-тіоксо-4-ону Проводили реакцію смоли, одержаної на Стадії 4 Прикладу 1 (2,00г), із розчином метил-2-ізотіоціанатбензоату (1,40г) в NMP (25мл) протягом 16год. Після видалення реакційного розчинника смолу тричі промивали ДМФ, тричі хлористим метиленом, і сушили під зниженим тиском. Стадія 2. Відщеплення від смоли Смолу, одержану на Стадії 1 (25мг), обробляли згідно зі Стадією 7 Прикладу 1. Одержано цільову сполуку (10мг). Мас-спектр (іонізація електронним ударом): 513. Елементний аналіз: C24H17Cl2N3O4S. Приклад 15. Синтез сполуки поданої нижче загальної формули (25). яка має замісник за Прикладом 15. Таблиця 3 Стадія 1. Ацилювання Ацилювання виконували з використанням смоли, одержаної на Стадії 2 Прикладу 1 (25мг), 2,6 диметилбензойної кислоти (0,4ммоль), DIC (0,4ммоль), HOAt (0,4ммоль) та NMP (2мл). Стадія 2. Утворення циклу хіназолін-2-тіоксо-4-ону Проводили реакцію смоли, одержаної на Стадії 1 (2,00г), із розчином метил-2-ізотіоціанат-бензоату (1,40г) в NMP (25мл) протягом 16год. Після видалення реакційного розчинника смолу тричі промивали ДМФ, тричі хлористим метиленом, і сушили під зниженим тиском. Стадія 3. Відщеплення від смоли Смолу, одержану на Стадії 1 (25мг), обробляли згідно зі Стадією 7 Прикладу 1. Одержано цільову сполуку (8мг). Мас-спектр (іонізація електронним ударом): 474. Елементний аналіз: C26H23N3O4S. Таблиця 3 Приклад 14 15 R 2,6-дихлорбензоїл 2,6-диметилбензоїл Мас-спектр, знайдено (МН+) 513 474 Приклад 16. Синтез сполуки поданої нижче загальної формули (26). яка має замісники згідно із Прикладом 16. Таблиця 4. Стадія 1. Алкілування До смоли, одержаної на Стадії 1 Прикладу 14 (25мг), додавали алілбромід (0,5ммоль), діізопропілетиламін (1,0ммоль) та NMP (2мл) і проводили реакцію протягом 16год. Після видалення реакційного розчинника смолу тричі промивали ДМФ, тричі хлористим метиленом, і сушили під зниженим тиском. Стадія 2. Відщеплення від смоли Смолу, одержану на Стадії 1, обробляли згідно зі Стадією 7 Прикладу 1. Одержано цільову сполуку (6мг). Мас-спектр (іонізація електронним ударом): 554. Елементний аналіз: C27H21CI 2N3O4S. Приклади 17-30 Сполуки, представлені в Таблиці 4, були синтезовані за методикою, описаною в Прикладі 16, за тим винятком, що на Стадії 1 Прикладу 16 було застосовано смолу, одержану на Стадії 1 Прикладу 14 або на Стадії 2 Прикладу 15 і відповідні галоїдні сполуки. В Таблиці 4 R1 та R2 означають замісники у поданій нижче загальній формулі (26). Таблиця 4 Приклад 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 R1 2,6-дихлорбензоїл 2,6-дихлорбензоїл 2,6-дихлорбензоїл 2,6-дихлорбензоїл 2,6-дихлорбензоїл 2,6-дихлорбензоїл 2,6-дихлорбензоїл 2,6-дихлорбензоїл 2,6-диметилбензоїл 2,6-диметилбензоїл 2,6-диметилбензоїл 2,6-диметилбензоїл 2,6-диметилбензоїл 2,6-диметилбензоїл 2,6-диметилбензоїл R2 аліл етил метил ізоаміл 2,6-дифторбензил 2-метилбензил 1-фенілетил 4-метоксифенацил метил етил аліл ізоаміл 2,6-дифторбензил 2-метилбензил 1-фенілетил Мас-спектр, знайдено (МН+) 554 542 528 584 640 618 618 662 488 502 514 544 600 578 578 Дані ЯМР для сполуки за Прикладом 18: 1Н-ЯМР (CDCІ 3) d =2,53 (3Н, s), 3,40 (2Н, t, J=5,3Гц), 5,20 (1Н, t, J=5,3Гц), 7,21-7,35 (6Н, m), 7,41 (1Н, t, J=7,5Гц), 7,50 (2H, d, J=8,7Гц), 7,65 (1H, d, J=8,4Гц), 7,76 (1H, t, J=6,9Гц), 8,19 (1H, d, J=7,5Гц). Приклад 31. Синтез сполуки поданої нижче загальної формули (27). яка має замісники за Прикладом 31. Таблиця 5 Стадія 1. Ацилювання До смоли, одержаної на Стадії 4 Прикладу 1 (1,00г), додавали 2-нітробензоїлхлорид (4ммоль), 2,6лутидин (8ммоль) і NMP і перемішували протягом 16год. Потім смолу тричі промивали ДМФ, тричі хлористим метиленом, і сушили під зниженим тиском. Стадія 2. Відновлення нітрогрупи Смолу, одержану на Стадії 1 (25мг), обробляли згідно зі Стадією 4 Прикладу 1, і одержували цільову смолу. Стадія 3. Циклізація складним ортоефіром і відщеплення від смоли До смоли, одержаної на Стадії 2 (25мг), додавали триметилортоацетат (1мл), АсОН (50мкл) та NMP (1мл) і перемішували при 50°С протягом 16год. Після промивання тричі ДМФ, тричі хлористим метиленом і висушування під зниженим тиском смолу обробляли згідно зі Стадією 7 Прикладу 1. Одержано цільову сполуку (8мг). Мас-спектр (іонізація електронним ударом): 496. Елементний аналіз: С25Н19СI 2N3О. Приклади 32-44 Сполуки, представлені в Таблиці 5, були синтезовані за методикою, описаною в Прикладі 31, за тим винятком, що на Стадії 1 Прикладу 31 було застосовано смолу, одержану на Стадії 4 Прикладу 1 або на Стадії 1 Прикладу 15, а на Стадії 3 Прикладу 31 - відповідні складні ортоефіри. В Таблиці 5 R1 та R2 означають замісники у поданій нижче загальній формулі (27). Таблиця 5 Приклад 31 32 33 34 35 36 37 38 39 40 41 42 43 44 R1 2,6-дихлорбензоїл 2,6-дихлорбензоїл 2,6-дихлорбензоїл 2,6-дихлорбензоїл 2,6-дихлорбензоїл 2,6-дихлорбензоїл 2,6-дихлорбензоїл 2,6-дихлорбензоїл 2,6-диметилбензоїл 2,6-диметилбензоїл 2,6-диметилбензоїл 2,6-диметилбензоїл 2,6-диметилбензоїл 2,6-диметилбензоїл R2 метил етил н-пропіл н-бутил феніл метокси етокси хлорметил метил н-пропіл н-бутил феніл етокси хлорметил Мас-спектр, знайдено (МН+) 496 510 524 538 558 521 526 530 456 484 498 518 486 490 Дані ЯМР для сполуки за Прикладом 32: 1Н-ЯМР (CDCІ 3) d 1,21 (3Н, t, J=7,4Гц), 2,47 (2Н, q, J=7,4Гц), 3,32-3,42 (2Н, m), 5,19 (1Н, t, J=5,4Гц), 7,10-7,20 (2H, m), 7,22-7,35 (4H, m), 7,43-7,54 (3H, m), 7,70-7,83 (2H, m), 8,21 (1H, d, J=7,8Гц). Приклад 45. Синтез сполуки поданої нижче загальної формули (28), яка має замісники за Прикладом 45. Таблиця 6 Стадія 1. Ацилювання До смоли, одержаної на Стадії 4 Прикладу 1 (200мг), додавали 3-хлор-2-нітробензойну кислоту (210мг, 1,04ммоль), HOAt (141мг, 1,04ммоль), DIC (161мкл, 1,04ммоль) та NMP (2мл) і перемішували протягом 64год. Потім смолу тричі промивали ДМФ, тричі хлористим метиленом, і сушили під зниженим тиском. Стадія 2. Відновлення нітрогрупи Смолу, одержану на Стадії 1, обробляли згідно зі Стадією 4 Прикладу 1. Стадія 3. Утворення циклу хіназолін-2,4-діону До смоли, одержаної на Стадії 2, додавали карбонілдіімідазол (844мг, 5,21ммоль) та NMP (2мл) і перемішували при 80°С протягом 16год. Після промивання тричі ДМФ, тричі хлористим метиленом, і висушування під зниженим тиском смолу обробляли згідно зі Стадією 7 Прикладу 1. Одержано цільову сполуку. Мас-спектр (іонізація електронним ударом): 532. Елементний аналіз: C24H16CI 3N3O5. Приклади 46-54 Сполуки, представлені в Таблиці 6, були синтезовані за методикою, описаною в Прикладі 45, за тим винятком, що на Стадії 1 Прикладу 45 було застосовано відповідні заміщені 2-нітробензойні кислоти. R1, R2, R3 та R4 в Таблиці 6 означають замісники у поданій нижче загальній формулі (28). Таблиця 6 Приклад 45 46 47 48 49 50 51 52 53 54 R1 хлор метокси НННметил НННН R2 ННННтрифтор-метил Нметокси ННН R3 ННхлор метокси нНметокси фтор НН R4 ННННННННметил хлор Мас-спектр знайдено (МН+) 532 528 532 528 566 512 558 516 512 532 Приклад 57. Синтез сполуки поданої нижче загальної формули (29), яка має замісник за Прикладом 57. Таблиця 7 Стадія 1. Ацилювання До смоли, одержаної на Стадії 4 Прикладу 1 (1г), додавали 2-фтор-5-нітробензойну кислоту (1,63г, 8,81ммоль), HOAt (1,2г, 8,81ммоль), DIC (675мкл, 4,36ммоль) та NMP (25мл) і перемішували протягом 14год. Потім смолу тричі промивали ДМФ, тричі хлористим метиленом, і сушили під зниженим тиском. Стадія 2. Заміна фтору на аміногрупу До смоли, одержаної на Стадії 1 (200мг), додавали ізопропіламін (400мкл) і NMP (2мл) і перемішували протягом 21год. Потім смолу тричі промивали ДМФ, тричі хлористим метиленом, і сушили під зниженим тиском. Стадія 3. Утворення циклу хіназолін-2,4-діону До смоли, одержаної на Стадії 2, додавали карбонілдіімідазол (200мг) та транс-декагідронафталін (2мл) і перемішували при 95°С протягом 15год. Після промивання тричі ДМФ, тричі метанолом і тричі хлористим метиленом, і висушування під зниженим тиском смолу обробляли згідно зі Стадією 7 Прикладу 1. Одержано цільову сполуку. Мас-спектр (іонізація електронним ударом): 585. Елементний аналіз: C27H22CI 2N4O7. Приклади 58-65 Сполуки, представлені в Таблиці 7, були синтезовані за методикою, описаною в Прикладі 57, за тим винятком, що на Стадії 2 Прикладу 57 було застосовано відповідні аміни. В Таблиці 7 R означає замісник у поданій нижче загальній формулі (29). Таблиця 7 Приклад 57 58 59 60 61 62 63 64 65 R ізопропіл втор-бутил циклобутан циклопентил ізобутил циклогексилметил метил циклопропіл бензил Мас-спектр знайдено (МН+) 585 599 597 611 599 639 557 583 633 Приклад 66. Синтез сполуки поданої нижче загальної формули (30), яка має замісники за Прикладом 66. Таблиця 8 Стадія 1. Заміна фтору на аміногрупу До смоли, одержаної на Стадії 1 Прикладу 57 (150мг), додавали 2,0Μ розчин метиламіну в ТГФ (3мл) і ΝΜΡ (2мл) і перемішували протягом 14год. Потім смолу тричі промивали ДМФ, тричі хлористим метиленом, і сушили під зниженим тиском. Стадія 2. Утворення циклу хіназолін-2-тіоксо-4-ону До смоли, одержаної на Стадії 1, додавали тіокарбонілдіімідазол (200мг) та транс-декагідронафталін (2мл) і перемішували при 95°С протягом 15год. Після промивання тричі ДМФ, тричі метанолом і тричі хлористим метиленом і висушування під зниженим тиском смолу обробляли згідно зі Стадією 7 Прикладу 1. Одержано цільову сполуку. Мас-спектр (іонізація електронним ударом): 573. Елементний аналіз: C25H18CІ 2N4O6S. Приклади 67-69 Сполуки, представлені в Таблиці 8, були синтезовані за методикою, описаною в Прикладі 66, за тим винятком, що на Стадії 1 Прикладу 66 було застосовано відповідні аміни. В Таблиці 8 R означає замісник у поданій нижче загальній формулі (30). Таблиця 8 Приклад 66 67 68 69 R Мас-спектр знайдено (МН+) 573 587 599 649 метил етил циклопропіл бензил Приклад 70. Синтез сполуки поданої нижче загальної формули (31). яка має замісники за Прикладом 70. Таблиця 9 Стадія 1. Ацилювання До смоли, одержаної на Стадії 4 Прикладу 1 (500мг), додавали 2-аміно-3,6-дихлорбензойну кислоту (845мг, 4,10ммоль), HOAt (558мг, 4,10ммоль), DIC (317мкл, 2,05ммоль) та NMP (11,5мл) і перемішували протягом 24год. Потім смолу тричі промивали ДМФ, тричі метанолом, тричі хлористим метиленом, і сушили під зниженим тиском. Стадія 2. Утворення циклу хіназолін-2,4-діону До смоли, одержаної на Стадії 1 (200мг), додавали карбонілдіімідазол (200мг) та трансдекагідронафталін (2мл) і перемішували при 95°С протягом 15год. Після цього смолу промивали тричі ДМФ, тричі метанолом, і тричі хлористим метиленом, і висушували під зниженим тиском. Стадія 3. Алкілування Смолу, одержану на Стадії 2, алкілували згідно зі Стадією 6 Прикладу 1. Стадія 4. Відщеплення від смоли Цільову сполуку одержано шляхом оброблення згідно зі Стадією 7 Прикладу 1. Мас-спектр (іонізація електронним ударом): 580. Елементний аналіз: C25H17CІ 4N3O5. Приклади 71-80 Сполуки за Прикладами 71-75 були синтезовані за методикою, описаною в Прикладі 70, за тим винятком, що на Стадії 1 Прикладу 70 було застосовано відповідні похідні бензойної кислоти. У Прикладах 76-80 була застосована та ж методика, що в Прикладі 70, за тим винятком, що алкілування за Стадією 3 Прикладу 70 не виконували. В Таблиці 9 R означають замісники в поданій нижче загальній формулі (31). Таблиця 9 Приклад 70 71 72 73 74 75 76 R1 метил метил метил метил метил метил Η R2 хлор хлор Η Η хлор R3 Η Η фтор Η Η Η Η R4 Η хлор Η бром Η Η Η R5 хлор Η Η Η Η хлор X1 С С С С Ν Ν С Х2 С С С С С N С Мас-спектр знайдено (МН+) 580 580 530 591 513 514 566 77 78 79 80 Η Η Η Η хлор Η Η фтор Η Η хлор Η Η Η Η Η Η С С N N С С С N 566 516 499 500 Приклад 81. Синтез сполуки поданої нижче загальної формули (32), яка має замісники за Прикладом 81, Таблиця 10 Стадія 1. Ацилювання Смолу, одержану на Стадії 4 Прикладу 1, ацилювали згідно зі Стадією 1 Прикладу 70. Стадія 2. Утворення триазенового циклу До смоли, одержаної на Стадії 1 (90мг), додавали нітрит натрію (150мг) та оцтову кислоту (4,5мл) і перемішували протягом 24год. Після промивання тричі ДМФ, тричі метанолом і тричі хлористим метиленом і висушування під зниженим тиском цільову сполуку було одержано шляхом оброблення згідно зі Стадією 7 Прикладу 1. Мас-спектр (іонізація електронним ударом): 551. Елементний аналіз: C23H14CI 4N4O4. Приклади 82 та 83 Сполуки за Прикладами 82 та 83, представлені в Таблиці 10, були синтезовані за методикою, описаною в Прикладі 81, за тим винятком, що на Стадії 1 Прикладу 81 було застосовано відповідні 2-амінобензойні кислоти. В Таблиці 10 R1, R2, R3 та R4 означають замісники в поданій нижче загальній формулі (32). Приклад 84. Синтез сполуки поданої нижче загальної формули (32), яка має замісники за Прикладом 84. Таблиця 10 Стадія 1. Ацилювання та відновлення нітрогрупи Ацилювання виконували з використанням смоли, одержаної на Стадії 4 Прикладу 1 (1г), 5-метокси-2нітробензойної кислоти (1,62г, 8,21ммоль), DIC (635мкл, 4,11ммоль), HOAt (1,12г, 8,21ммоль) та NMP (23мл). Потім відновлювали нітрогрупу згідно зі Стадією 2 Прикладу 31. Стадія 2. Утворення триазенового циклу, відщеплення від смоли Смолу, одержану на Стадії 1, обробляли згідно зі Стадією 2 Прикладу 81, а потім обробляли згідно зі Стадією 7 Прикладу 1. Одержано цільову сполуку. Мас-спектр (іонізація електронним ударом): 513. Елементний аналіз: C24H18CI 2N4O5. Приклади 85-89 Сполуки за Прикладами 85-89, представлені в Таблиці 10, були синтезовані за методикою, описаною в Прикладі 84, за тим винятком, що на Стадії 1 Прикладу 70 було застосовано відповідні 2-нітробензойні кислоти. В Таблиці 10 R1, R2, R3 та R4 означають замісники в поданій нижче загальній формулі (32). Приклад 90. Синтез сполуки поданої нижче загальної формули (32), яка має замісники за Прикладом 90, Таблиця 10 Стадія 1. Утворення триазенового циклу, відщеплення від смоли Смолу, одержану на Стадії 2 Прикладу 31, обробляли згідно зі Стадією 2 Прикладу 81, а потім обробляли згідно зі Стадією 7 Прикладу 1. Одержано цільову сполуку. Мас-спектр (іонізація електронним ударом): 483. Елементний аналіз: C23H16CI 2N4O4. Таблиця 10 Приклад 81 82 83 84 85 86 87 88 89 90 R1 хлор хлор НННметил Нхлор НН R2 ННфтор ННННННН R3 Нхлор Нметокси фтор Нхлор ННН R4 хлор НННННННметил Н Мас-спектр знайдено (МН+) 551 551 501 513 501 497 517 517 497 483 Приклад 91. Синтез сполуки поданої нижче загальної формули (33), яка має замісники за Прикладом 91, Таблиця 11 Стадія 1. Ацилювання та відновлення нітрогрупи Ацилювання та відновлення нітрогрупи виконували згідно зі Стадією 1 Прикладу 84 з використанням смоли, одержаної на Стадії 4 Прикладу 1. Стадія 2. Циклізація складним ортоефіром і відщеплення від смоли До смоли, одержаної на Стадії 1 (150мг), додавали тетраетоксиметан (800мкл), оцтову кислоту (200мкл) та NMP (2мл) і перемішували при 55°С протягом 15год. Після промивання тричі ДМФ, тричі метанолом і тричі хлористим метиленом і висушування під зниженим тиском цільову сполуку було одержано шляхом оброблення згідно зі Стадією 7 Прикладу 1. Мас-спектр (іонізація електронним ударом): 556. Елементний аналіз: C27H23CI 2N3O6. Приклади 92-94 Сполуки за Прикладами 92-94, представлені в Таблиці 11, були синтезовані за методикою, описаною в Прикладі 91, за тим винятком, що на Стадії 1 Прикладу 91 було застосовано відповідні 2-нітробензойні кислоти. В Таблиці 11 R1, R2, R3 та R4 означають замісники в поданій нижче загальній формулі (33). Приклад 95. Синтез сполуки поданої нижче загальної формули (33). яка має замісники за Прикладом 95. Таблиця 11 Стадія 1. Ацилювання До смоли, одержаної на Стадії 4 Прикладу 1 (500мг), додавали 2-аміно-4-фторбензойну кислоту (636мг, 4,10ммоль), HOAt (558мг, 4,10ммоль), DIC (317мкл, 2,05ммоль), та NMP (11,5мл) і перемішували протягом 24год. Потім смолу промивали тричі ДМФ, тричі метанолом і тричі хлористим метиленом і висушували під зниженим тиском. Стадія 2. Циклізація складним ортоефіром і відщеплення від смоли Смолу, одержану на Стадії 1, піддавали циклізації згідно зі Стадією 2 Прикладу 91, після чого одержували цільову сполуку шляхом обробки згідно зі Стадією 7 Прикладу 1. Мас-спектр (іонізація електронним ударом): 544. Елементний аналіз: C26H20CI 2FN3O5. Таблиця 11 Приклад 91 92 93 94 95 R1 ННННН R2 ННННфтор R3 метокси фтор хлор НН R4 НННметил Н Мас-спектр знайдено (МН+) 556 544 560 540 544 Приклад 96. Синтез сполуки поданої нижче загальної формули (34), яка має замісник за Прикладом 96. Таблиця 12 Стадія 1. Ацилювання та відновлення нітрогрупи Ацилювання виконували шляхом проведення реакції смоли, одержаної на Стадії 4 Прикладу 1 (1г), із 6метил-2-нітробензойною кислотою (1,49г, 8,21ммоль), DIC (635мкл, 4,11ммоль), HOAt (1,12г, 8,21ммоль) та NMP (23мл) протягом 18год. Потім відновлювали нітрогрупу згідно зі Стадією 2 Прикладу 31. Стадія 2. Циклізація До смоли, одержаної на Стадії 1 (200мг), додавали карбонілдіімідазол (400мг) та NMP (2мл) і перемішували при 95°С протягом 15год. Після цього смолу промивали тричі ДМФ, тричі метанолом і тричі хлористим метиленом і висушували під зниженим тиском. Стадія 3. Алкілування До смоли, одержаної на Стадії 2 (200мг), додавали етилйодид (200мкл) і тетраметилгуанідин (200мкл) і перемішували протягом 24год. Після промивання тричі водою, тричі ДМФ, тричі метанолом і тричі хлористим метиленом і висушування під зниженим тиском смолу обробляли згідно зі Стадією 7 Прикладу 1. Одержано цільову сполуку. Мас-спектр (іонізація електронним ударом): 540. Елементний аналіз: C27H23CI 2N3O5. Приклад 97 Сполука за Прикладом 97, представлена в Таблиці 12, була синтезована за методикою, описаною в Прикладі 96, за тим винятком, що на Стадії 3 Прикладу 96 була застосована відповідна галоїдна сполука. В Таблиці 12 R означає замісник у поданій нижче загальній формулі (34). Таблиця 12 Приклад 96 97 R Мас-спектр знайдено (МН+) 540 602 етил бензил Приклад 98. Синтез сполуки поданої нижче загальної Формули (35). яка має замісники за Прикладом 98. Таблиця 13 Стадія 1. Сульфамідування, відновлення нітрогрупи До смоли, одержаної на Стадії 4 Прикладу 1 (400мг), додавали 2-нітробензолсульфонілхлорид (450мг), 2,6-лутидин (450мкл) і хлористий метилен (10мл) і перемішували протягом 14год. Після промивання тричі ДМФ, тричі метанолом, тричі хлористим метиленом і висушування під зниженим тиском відновлювали нітрогрупу згідно зі Стадією 2 Прикладу 31. Стадія 2. Циклізація До смоли, одержаної на Стадії 1 (200мг), додавали карбонілдіімідазол (400мг) та NMP (2мл) і перемішували при 95°С протягом 15год. Після цього смолу промивали тричі ДМФ, тричі метанолом і тричі хлористим метиленом, і висушували під зниженим тиском. Стадія 3. Алкілування, відщеплення від смоли До смоли, одержаної на Стадії 2 (200мг), додавали метилйодид (400мкл), діізопропілетиламін (400мкл) і NMP (2мл) і перемішували протягом 17год. Після промивання тричі водою, тричі ДМФ, тричі метанолом і тричі хлористим метиленом і висушування під зниженим тиском смолу обробляли згідно зі Стадією 7 Прикладу 1. Одержано цільову сполуку. Мас-спектр (іонізація електронним ударом): 548. Елементний аналіз: C24H19CI 2N3O6S. Приклади 99-103 Сполуки, представлені в Таблиці 13, були синтезовані за методикою, описаною в Прикладі 98, за тим винятком, що на Стадії 1 Прикладу 98 було застосовано відповідні сульфонілхлориди. В Таблиці 13 R1, R2, R3, R4 та R5 означають замісники в поданій нижче загальній формулі (35). В Прикладах 101-103 була застосована та ж методика, що в Прикладі 98, за тим винятком, що алкілування за Стадією 3 Прикладу 98 не виконували. Таблиця 13 Приклад 98 99 100 101 102 103 R1 НННННН R2 Нметокси трифтор-метил Нметокси трифтор-метил R3 НННННН R4 НННННН R5 метил метил метил ННН Мас-спектр знайдено (МН+) 548 578 616 534 564 602 Приклад 104. Синтез сполуки поданої нижче загальної формули (36), яка має замісник за Прикладом 104. Таблиця 14 Стадія 1. Ацилювання, утворення циклу хіназолін-2,4-діону, алкілування та відновлення нітрогрупи Ацилювання виконували з використанням смоли, одержаної на Стадії 4 Прикладу 1 (500мг), 2-аміно-5нітробензойної кислоти (746мг, 4,10ммоль), DIC (317мкл, 2,05ммоль), HOAt (558мг, 4,10ммоль) та NMP (11,5мл). Потім утворювали цикл хіназолін-2,4-діону згідно зі Стадією 2 Прикладу 96 і проводили алкілування згідно зі Стадією 6 Прикладу 1. Потім відновлювали нітрогрупу, як описано для Стадії 4 Прикладу 1. Стадія 2. Ацилювання До смоли, одержаної на Стадії 1, додавали оцтовий ангідрид (600мкл), піридин (600мкл) та NMP (3мл) і перемішували протягом 19год. Після промивання тричі водою, тричі ДМФ, тричі метанолом і тричі хлористим метиленом і висушування під зниженим тиском смолу обробляли згідно зі Стадією 7 Прикладу 1. Одержано цільову сполуку. Мас-спектр (іонізація електронним ударом): 569. Елементний аналіз: C27H22CI 2N4O6. Приклади 105-107 Сполуки, представлені в Таблиці 14, були синтезовані за методикою, описаною в Прикладі 104, за тим винятком, що на Стадії 2 Прикладу 104 було застосовано відповідні хлорангідриди кислот. В Таблиці 14 R означає замісник в поданій нижче загальній формулі (36). В Прикладі 107 була застосована та ж методика, що в Прикладі 104, за тим винятком, що ацилювання за Стадією 2 Прикладу 104 не виконували. Таблиця 14 Приклад 104 105 106 107 R ацетил метоксіацетил півалоїл Η Мас-спектр знайдено (МН+) 569 599 611 527 Приклад 108. Синтез сполуки поданої нижче загальної формули (37). яка має замісник за Прикладом 108. Таблиця 15 Стадія 1. Ацилювання Смолу, одержану на Стадії 4 Прикладу 1 (1г), ацилювали з використанням 5-фтор-2-нітробензойної кислоти (1,63г, 8,81ммоль), DIC (675мкл, 4,36ммоль), HOAt (1,2г, 8,81ммоль) та NMP (25мл). Стадія 2. Заміна фтору на аміногрупу, відновлення нітрогрупи До смоли, одержаної на Стадії 1 (200мг), додавали 2,0Μ розчин диметиламіну в ТГФ (3мл) та ΝΜΡ (2мл) і перемішували протягом 14год. Після промивання тричі водою, тричі ДМФ і тричі хлористим метиленом і висушування під зниженим тиском відновлювали нітрогрупу згідно зі Стадією 2 Прикладу 31. Стадія 3. Утворення циклу хіназолін-2,4-діону Смолу, одержану на Стадії 2, обробляли згідно зі Стадією 2 Прикладу 96 для утворення циклу хіназолін-2,4-діону. Стадія 4. Алкілування До смоли, одержаної на Стадії 3, додавали трифенілфосфін (520мг), метанол (80мкл), 40%-ний розчин діізопропілазодикарбонової кислоти в толуолі (1мл) і хлористий метилен (2мл) і перемішували протягом 7год. Після промивання тричі водою, тричі ДМФ, тричі метанолом і тричі хлористим метиленом і висушування під зниженим тиском смолу обробляли згідно зі Стадією 7 Прикладу 1. Одержано цільову сполуку. Мас-спектр (іонізація електронним ударом): 555. Елементний аналіз: C27H24CI 2N4O5. Приклади 109-111 Сполуки за Прикладами 109-111, представлені в Таблиці 15, були синтезовані за методикою, описаною в Прикладі 108, за тим винятком, що на Стадії 2 Прикладу 108 було застосовано відповідні аміни. В Таблиці 15 R означає замісник в поданій нижче загальній формулі (37). Приклад 112. Синтез сполуки поданої нижче загальної формули (37), яка має замісник за Прикладом 112. Таблиця 15 Стадія 1. Заміна фтору на аміногрупу, відновлення нітрогрупи До смоли (200мг), одержаної на Стадії 1 Прикладу 108, додавали 2,0Μ розчин диметиламіну в ТГФ (3мл) та ΝΜΡ (2мл) і перемішували протягом 14год. Після промивання тричі водою, тричі ДМФ і тричі хлористим метиленом і висушування під зниженим тиском відновлювали нітрогрупу згідно зі Стадією 2 Прикладу 31. Стадія 3. Утворення циклу хіназолін-2,4-діону Смолу, одержану на Стадії 2, обробляли згідно зі Стадією 2 Прикладу 96 для утворення циклу хіназолін-2,4-діону. Стадія 4. Алкілування До смоли, одержаної на Стадії 3 (200мг), додавали метилйодид (400мкл), діізопропілетиламін (400мкл) та ΝΜΡ (2мл) і перемішували протягом 17год. Після промивання тричі водою, тричі ДМФ, тричі метанолом і тричі хлористим метиленом і висушування під зниженим тиском смолу обробляли згідно зі Стадією 7 Прикладу 1. Одержано цільову сполуку. Мас-спектр (іонізація електронним ударом): 569. Елементний аналіз: C28H27CI 2N4O5. Приклад 113 Сполука за Прикладом 113, представлена в Таблиці 15, була синтезована за методикою, описаною в Прикладі 112, за тим винятком, що на Стадії 1 Прикладу 112 було застосовано відповідний амін. В Таблиці 15 R означає замісник в поданій нижче загальній формулі (37). Таблиця 15 Приклад 108 109 110 111 112 113 R диметиламіно етилметиламіно піролідил діетиламіно формула X1 формула Х2 Мас-спектр знайдено (МН+) 555 569 581 583 569 595 Формули XI та Х2 представлені нижче. Дані ЯМР для сполуки за Прикладом 108: 1Н-ЯМР (400МГц, DMSO-d6) d 2,94 (3Н, m), 3,02 (1Н, dd, J=10,2, 14,1Гц), 3,22 (1H, m, J=4,4, 14,1Гц), 3,49 (3H, s), 4,82 (1H, m), 7,17 (2H, d), 7,24 (1H, d), 7,30 (1H, m), 7,36-7,45 (5H, m), 9,15 (1H, d), 13С-ЯМР (100МГц, DMSO-d6) d 30,90, 36,64, 40,77, 53,68, 109,21, 116,00, 116,22, 121,37, 128,26, 128,93, 129,90, 131,23, 131,82, 132,10, 135,23, 136,56, 137,57, 146,72, 150,38, 161,88, 163,91, 172,72. Формула X1 Формула Х2 Приклад 114. Синтез сполуки поданої нижче загальної формули (38), яка має замісники за Прикладом 114. Таблиця 16 Стадія 1. Алкілування До смоли, одержаної на Стадії 5 Прикладу 1 (150мг), додавали 2,6-дихлорбензиловий спирт (531мг), трифенілфосфін (786мг), хлористий метилен (3мл) і 40%-ний розчин діізопропілазодикарбонової кислоти в толуолі (1,5мл) і перемішували протягом 14год. Після промивання тричі водою, тричі ДМФ, тричі метанолом і тричі хлористим метиленом і висушування під зниженим тиском смолу обробляли згідно зі Стадією 7 Прикладу 1. Одержано цільову сполуку. Мас-спектр (іонізація електронним ударом): 656. Елементний аналіз: C31H21CI 4N3O5. Приклади 115-123 Сполуки за Прикладами 115-123, представлені в Таблиці 16, були синтезовані за методикою, описаною в Прикладі 114, за тим винятком, що на Стадії 1 Прикладу 114 було застосовано відповідні спирти. В Таблиці 16 R1, R2, R3, R4, R5 та n означають замісники в поданій нижче загальній формулі (38). Приклад 124. Синтез сполуки поданої нижче загальної формули (38), яка має замісники за Прикладом 124, Таблиця 16 Стадія 1. Ацилювання Смолу, одержану на Стадії 4 Прикладу 1 (150мг), ацилювали з використанням N-фенілантранілової кислоти (437мг, 2,05ммоль), HOAt (279мг, 2,05ммоль), DIC (106мкл, 1,03ммоль) та NMP (6мл). Стадія 2. Утворення циклу хіназолін-2,4-діону Смолу, одержану на Стадії 1, обробляли згідно зі Стадією 2 Прикладу 96. Після утворення циклу хіназолін-2,4-діону смолу обробляли згідно зі Стадією 7 Прикладу 1. Одержано цільову сполуку. Мас-спектр (іонізація електронним ударом): 574. Елементний аналіз: C30H21CI 2N3O5. Таблиця 16 Приклад 114 115 116 117 118 119 120 121 122 123 124 R1 хлор Η хлор Η Η хлор метил хлор Η Η Η R2 Η хлор Η Η Η Η Η Η Η Η Η R3 Η хлор хлор хлор метил Η Η Η Η Η Η R4 Η Η Η Η Η Η Η Η Η Η Η R5 хлор Η Η Η Η Η Η фтор Η Η Η n 1 1 1 1 1 1 1 1 1 2 0 Мас-спектр знайдено (МН+) 656 656 656 622 602 622 602 640 588 602 574 Приклад 125. Синтез сполуки поданої нижче загальної формули (39), яка має замісник за Прикладом 125, Таблиця 17 Стадія 1. Синтез імінофосфіну До смоли, одержаної на Стадії 4 Прикладу 1 (1 г), додавали трифенілфосфін (7,86г), 40%-ний розчин діізопропілазодикарбонової кислоти в толуолі (30мл) і толуол (30мл) і перемішували протягом 16год. Після цього смолу промивали 10 разів хлористим метиленом і висушували під зниженим тиском. Стадія 2. Синтез карбодііміду, нуклеофільне приєднання аміну і замикання циклу До смоли, одержаної на Стадії 1 (100мг), додавали метил-2-ізоціанатбензоат (200мг) і хлористий метилен (1мл), перемішували протягом 1год і промивали тричі ДМФ і тричі хлористим метиленом. До одержаної смоли додавали циклобутиламін (600мкл) і ΝΜΡ (3мл) і перемішували протягом 13год. Після промивання ДМФ, метанолом і хлористим метиленом і висушування під зниженим тиском смолу обробляли згідно зі Стадією 7 Прикладу 1. Одержано цільову сполуку. Мас-спектр (іонізація електронним ударом): 551. Елементний аналіз: C28H24CI 2N4O4. Приклади 126-130 Сполуки, представлені в Таблиці 17, були синтезовані за методикою, описаною в Прикладі 125, за тим винятком, що на Стадії 2 Прикладу 125 було застосовано відповідні аміни. В Таблиці 17 R означає замісник в поданій нижче загальній формулі (39). Таблиця 17 Приклад 125 126 127 128 129 130 R циклобутиламіно ізобутиламіно ізопропіламіно диметиламіно етилметиламіно азетидино Мас-спектр знайдено (МН+) 551 553 539 525 539 537 Приклад 131. Синтез сполуки поданої нижче загальної формули (40), яка має замісник за Прикладом 131. Таблиця 17 Стадія 1. Заміна фтору на аміногрупу До смоли, одержаної на Стадії 1 Прикладу 57 (150мг), додавали 2,0Μ розчин метиламіну в ТГФ (3мл) та ΝΜΡ (2мл) і перемішували протягом 14год. Після цього смолу промивали тричі ДМФ і тричі хлористим метиленом, і висушували під зниженим тиском. Стадія 2. Замикання циклу тіонілхлоридом До смоли, одержаної на Стадії 1, додавали триазол (250мг), тіонілхлорид (80мкл), хлористий метилен (1мл) і діізопропілетиламін (400мкл) і перемішували протягом 15год. Після промивання тричі ДМФ, тричі метанолом і тричі хлористим метиленом і висушування під зниженим тиском смолу обробляли згідно зі Стадією 7 Прикладу 1. Одержано цільову сполуку. Мас-спектр (іонізація електронним ударом): 576. Елементний аналіз: C24H18CI 2N4O7S. Приклади 132 і 133 Сполуки, представлені в Таблиці 17, були синтезовані за методикою, описаною в Прикладі 131, за тим винятком, що на Стадії 1 Прикладу 131 було застосовано відповідні аміни. В Таблиці 17 R означає замісник в поданій нижче загальній формулі (40). Таблиця 17 Приклад 131 132 133 R метил етил бензил Мас-спектр знайдено (МН+) 576 590 652 Приклад 134. Синтез сполуки поданої нижче загальної формули (41), яка має замісник за Прикладом 134, Таблиця 18 Стадія 1. Ацилювання, відщеплення групи Fmoc Ацилювання виконували шляхом проведення реакції смоли, одержаної на Стадії 4 Прикладу 1 (500мг), із Fmoc-b-аланіном (810мг, 2,60ммоль), DIC (200мкл, 1,30ммоль), HOAt (351мг, 2,60ммоль) та NMP (10мл) протягом 18год, після чого відщеплювали групу Fmoc згідно зі Стадією 2 Прикладу 1. Стадія 2. Замикання циклу з карбонілдіімідазолом До смоли, одержаної на Стадії 1, додавали карбонілдіімідазол (400мг) та NMP (2мл) і перемішували протягом 3год. Після цього смолу промивали тричі ДМФ, тричі метанолом і тричі хлористим метиленом, і висушували під зниженим тиском. До одержаної смоли додавали NMP (2мл) і перемішували при 95°С протягом 15год. Після промивання тричі ДМФ, тричі метанолом і тричі хлористим метиленом і висушування під зниженим тиском смолу обробляли згідно зі Стадією 7 Прикладу 1. Одержано цільову сполуку. Мас-спектр (іонізація електронним ударом): 450. Елементний аналіз: C20H17CI 2N3O5. Приклад 135. Синтез сполуки поданої нижче загальної формули (41). яка має замісник за Прикладом 135. Таблиця 18 Стадія 1. 2-нітросульфонілування, алкілування До смоли, одержаної на Стадії 1 Прикладу 134 (250мг), додавали 2-нітросульфонілхлорид (176мг, 2,6лутидин (184мкл) та хлористий метилен (4мл) і перемішували при 4°С протягом 16год. Після промивання тричі ДМФ, тричі метанолом і тричі хлористим метиленом і висушування під зниженим тиском смолу алкілували згідно зі Стадією 4 Прикладу 108. Стадія 2. Відщеплення 2-нітросульфогрупи До смоли, одержаної на Стадії 1, додавали 2-меркаптоетанол (600мкл), діазабіциклоундецен (300мкл) та NMP (3мл) і перемішували протягом 1год. Після цього смолу промивали тричі ДМФ, тричі метанолом і тричі хлористим метиленом і висушували під зниженим тиском. Стадія 3. Замикання циклу з карбонілдіімідазолом До смоли, одержаної на Стадії 2, додавали карбонілдіімідазол (500мг) та хлористий метилен (2,5мл) і перемішували протягом 10год. Після цього смолу промивали тричі ДМФ, тричі метанолом і тричі хлористим метиленом, і висушували під зниженим тиском. До одержаної смоли додавали карбонат калію (200мг) і NMP (1мл) і перемішували при 95°С протягом 17год. Після промивання тричі водою, тричі ДМФ, тричі метанолом і тричі хлористим метиленом і висушування під зниженим тиском смолу обробляли згідно зі Стадією 7 Прикладу 1. Одержано цільову сполуку. Мас-спектр (іонізація електронним ударом): 464. Елементний аналіз: C21H19CI 2N3O5. Таблиця 18 Приклад 134 135 R Η метил Мас-спектр знайдено (МН+) 450 464 Приклад 136. Синтез сполуки поданої нижче загальної формули (73), яка має замісники за Прикладом 136. Таблиця 19 Стадія 1. Ацилювання, відщеплення О-ацилу До смоли, одержаної на Стадії 4 Прикладу 1, додавали саліцилову кислоту (74мг, 0,535ммоль), РуВОР (гексафторфосфат бензотриазол-1-іл-окситрис-піролідинфосфонію) (278мг, 0,535ммоль), HOBt (120мг, 0,89 ммоль), DIEA (0,186мл, 1,068ммоль) і ДМФ (3,6мл) і перемішували протягом 19год. Після цього смолу промивали ДМФ, метанолом і хлористим метиленом (по 8 разів кожним розчинником), додавали до одержаної смоли 30%-ний розчин етаноламіну в ДМФ (5мл) і перемішували протягом 4год. Знову промивали смолу ДМФ, метанолом і хлористим метиленом (по 8 разів кожним розчинником). Стадія 2. Замикання циклу з карбонілдіімідазолом, відщеплення від смоли До смоли, одержаної на Стадії 1 (50мг), додавали карбонілдіімідазол (98мг) та хлористий метилен (6мл), перемішували протягом 1год і промивали 5 разів хлористим метиленом. Потім додавали до одержаної смоли хлористий метилен (4мл), перемішували протягом 3год при кімнатній температурі і промивали 5 разів хлористим метиленом. Після цього одержували цільову сполуку (3мг) шляхом відщеплення від смоли і очищення методом РХВТ, як описано для Стадії 7 Прикладу 1. Мас-спектр (іонізація електронним ударом): 499. Елементний аналіз: С24H16СI 2N2О6· Приклади 137-144 Сполуки, представлені в Таблиці 19, були синтезовані за методикою, описаною в Прикладі 136, за тим винятком, що на Стадії 1 Прикладу 136 було застосовано відповідні саліцилові кислоти. В Таблиці 19 R1, R2 та R3 означають замісники в поданій нижче загальній формулі (73). Таблиця 19 Приклад 136 137 138 139 140 141 142 143 144 R1 R2 Η Η -СН=СН-СН=СНН Η Η ОМе ОН Η Η ОН Η ΝΗ2 Η Η Η Η R3 Η Η СНО Η Η Η Η СI F Мас-спектр знайдено (МН+) 499 549 527 529 515 515 514 533 517 Приклад 145. Синтез сполуки поданої нижче загальної формули (74) Стадія 1. Замикання циклу з тіокарбонілдіімідазолом До смоли, одержаної на Стадії 1 Прикладу 98, додавали тіокарбонілдіімідазол (500мг) та хлористий метилен (2,5мл) і перемішували при кімнатній температурі протягом 16год. Після цього смолу промивали тричі метанолом, тричі ДМФ і тричі хлористим метиленом і висушували під зниженим тиском. Стадія 2. Відщеплення від смоли Смолу, одержану на Стадії 1 (100мг), обробляли згідно зі Стадєю 7 Прикладу 1. Одержано 1,2мг цільової сполуки. Мас-спектр (іонізація електронним ударом): 550. Елементний аналіз: C23H17CI 2N3O5S2. Приклад 146. Синтез сполуки поданої нижче загальної формули (75) Метилування та відщеплення від смоли До 100мг смоли, одержаної на Стадії 1 Прикладу 145, додавали діізопропілетиламін (200мкл), метилйодид (100мкл) і NMP (3мл) і перемішували при кімнатній температурі протягом 16год. Після промивання тричі метанолом, тричі ДМФ і тричі хлористим метиленом і висушування під зниженим тиском смолу обробляли згідно зі Стадією 7 Прикладу 1. Одержано цільову сполуку (13мг). Мас-спектр (іонізація електронним ударом): 564. Елементний аналіз: C24H19Cl2N3O5S2. Приклад 147. Синтез сполуки поданої нижче загальної формули (76), яка має замісники за Прикладом 147. Таблиця 20 Смолу, одержану на Стадії 4 Прикладу 1, готували для використання її як вихідний матеріал. До 100мг згаданої смоли додавали 500мг 2-нітробензилброміду, 500мкл діізопропілетиламіну і 5мл NMP і перемішували при кімнатній температурі протягом 12год. Після видалення реакційного розчинника смолу промивали тричі хлористим метиленом, тричі NMP і тричі хлористим метиленом. Додавали до одержаної смоли розчин SnCl2·2H2O (1,5г) в NMP (0,5мл) і етанолі (3мл) і проводили реакцію протягом 16год. Видаляли реакційний розчинник і промивали смолу тричі NMP і тричі хлористим метиленом. Потім до одержаної смоли додавали 200мг 2-нітробензол-сульфонілхлориду, 400мкл 2,6-лутидину і 2мл хлористого
ДивитисяДодаткова інформація
Назва патенту англійськоюPhenylalanine derivatives
Назва патенту російськоюПроизводные фенилаланина
МПК / Мітки
МПК: C07D 253/00, A61P 9/10, C07D 239/96, A61P 11/06, C07D 239/95, A61P 37/08, A61P 3/10, A61P 37/06, A61P 17/06, C07D 265/26, C07D 239/78, A61P 43/00, A61P 19/02, C07D 487/04, A61P 35/00, C07D 285/24, C07D 401/12, C07D 471/04, C07D 475/00, A61P 35/04, A61P 29/00, A61P 9/00, A61P 17/00, C07D 239/80, C07D 239/91, C07D 285/16, C07D 239/22, A61P 1/04, C07D 239/54
Мітки: фенілаланіну, похідні
Код посилання
<a href="https://ua.patents.su/40-74385-pokhidni-fenilalaninu.html" target="_blank" rel="follow" title="База патентів України">Похідні фенілаланіну</a>
Попередній патент: Лічильник електричної енергї
Наступний патент: Спосіб лікування сухості піхви або статевої дисфункції у жінок під час або після менопаузи
Випадковий патент: Спосіб вилучення галію з лужних розчинів та пульп виробництва глинозему












