Похідні еритроміцину, спосіб їх одержання та фармацевтична композиція
Номер патенту: 48244
Опубліковано: 15.08.2002
Автори: Агурідас Константен, Дені Алексіс, Шанто Жан-Франсуа, Пежак Жан-Марі
Формула / Реферат
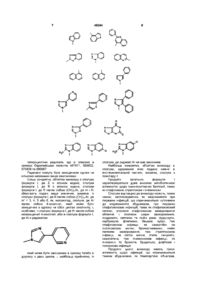
1. Похідні еритроміцину формули І;
,
де R являє собою атом водню; алкільний радикал, що містить аж до 12 атомів вуглецю, який може бути заміщеним галогеном чи радикалами (СН2)mАr або - (СН2)n-(СA=СB)-(СН2)mАr, де
m - ціле число від 1 до 8, n і p, однакові чи різні, позначають цілі числа від 0 до 6; А і В, однакові чи різні, являють собою атом водню або галогену чи алкіл, що містить аж до 8 атомів вуглецю; Аr - арильний або гетероарильний радикали, можливо заміщені, і Z - атом водню чи залишок карбонової кислоти, яка містить аж до 18 атомів вуглецю.
2. Сполуки формули І за п. 1, де Z є атомом водню.
3. Сполуки формули І за пп. 1 чи 2, де R є атомом водню.
4. Сполуки формули І за пп. 1, 2 або 3, де R являє собою групу (СН2)mАr, де m і Аr мають ті самі значення, що в пункті 1.
5. Сполуки формули І за п. 4, де R являє собою групу (СН2)m’Аr, де m’ є цілим числом: 3, 4, 5 або 6.
6. Сполуки формули І за п. 5, де Аr являє собою радикал 4-хінолініл, який може мати замісники в одному та/або в другому з двох циклів хіноліну.
7. Сполуки формули І за п. 6, де Аr являє собою незаміщений 4-хінолініл.
8. Сполуки формули І за п. 5, де Ar є радикалом формули:
,
який може мати замісники в одному та/або в другому з двох циклів.
9. Сполуки формули І за п. 8, де Ar не має замісників.
10. Сполука формули І за п. 1, що має таку назву: 11,12-дидезокси-3-де[(2,6-дидезокси-3-С-метил-3-О-метил-альфа-L-рибогексопіранозил)окси]-6-O-метил-3-оксо-12,11-{оксикарбоніл[3-(4-хінолініл)пропокси]іміно}еритроміцин.
11. Сполуки формули І, що їх описано в будь-якому з пунктів 1-10, як медикаменти.
12. Фармацевтична композиція, що містить як активну основу, принаймні, один медикамент згідно з пунктом 11.
13. Спосіб одержання сполук формули І згідно з будь-яким з пунктів 1-10, який відрізняється тим, що сполуку формули II:
,
де Z має значення, наведені в п. 1, піддають взаємодії з гідроксиламіном чи його галогенгідратом з одержанням сполуки формули ІA:
,
яку, при бажанні, піддають дії реагенту, що здійснює метаноліз гідроксилу в позиції 2', щоб одержати відповідну сполуку формули IB, де Z є атомом водню:
,
потім сполуку формули ІА або ІВ вводять у реакцію із сполукою формули III:
R'Hal (III),
де R' позначає те саме, що й R, за винятком водню, a Hal є атомом галогену, з метою одержання відповідної сполуки формули ІС, яку можна піддати дії агента гідрування можливого подвійного зв'язку в радикалі
та/або агента, що вивільнює гідроксильну групу в позиції 2' .
14. Сполуки формули III, що мають такі назви:
4-(3-йодпропіл)хінолін та
3-[1-(3-бромпропіл)-1Н-імідазол-4-іл]піридин, як нові хімічні продукти.
Текст
1 ПОХІДНІ еритроміцину формули І, арильний або гетероарильний радикали, можливо заміщені, і Z - атом водню чи залишок карбонової кислоти, яка містить аж до 18 атомів вуглецю 2 Сполуки формули І за п 1, де Z є атомом водню 3 Сполуки формули І за пп 1 чи 2, де R є атомом водню 4 Сполуки формули І за пп 1,2 або 3, де R являє собою групу (CbbJmAr, де т і Аг мають ті самі значення, що в пункті 1 5 Сполуки формули І за п 4, де R являє собою групу (СЬІ2)т Аг, де ггї є цілим числом 3, 4, 5 або 6 6 Сполуки формули І за п 5, де Аг являє собою радикал 4-хінолшіл, який може мати замісники в одному та/або в другому з двох циклів хіноліну 7 Сполуки формули І за п 6, де Аг являє собою незаміщений 4-ХІНОЛІНІЛ 8 Сполуки формули І за п 5, де Аг є радикалом формули о О який може мати замісники в одному та/або в другому з двох циклів 9 Сполуки формули І за п 8, де Аг не має замісників де R являє собою атом водню, алкільний радикал, що містить аж до 12 атомів вуглецю, який може бути заміщеним галогеном чи радикалами (CH2)mAr або - (СН 2 )п-(СА=СВ)-(СН 2 )гпАг, де m - ціле число від 1 до 8, п і р, однакові чи різні, позначають ЦІЛІ числа від 0 до 6, А і В, однакові чи різні, являють собою атом водню або галогену чи алкіл, що містить аж до 8 атомів вуглецю, Аг 10 Сполука формули І за п 1, що має таку назву 11,12-дидезокси-3-де[(2,6-дидезокси-3-С-метил-3О-метил-альфа-І_-рибогексопіранозил)окси]-6-Ометил-3-оксо-12,11-{оксикарбоніл[3-(4хшолшіл)пропокси]іміно}еритроміцин 11 Сполуки формули І, що їх описано в будьякому з пунктів 1-10, як медикаменти 12 Фармацевтична композиція, що містить як активну основу, принаймні, один медикамент згідно з пунктом 11 13 Спосіб одержання сполук формули І згідно з будь-яким з пунктів 1-10, який відрізняється тим, що сполуку формули II 0 0 48244 де Z має значення, наведені в п 1, піддають взаємодії з пдроксиламіном чи його галогенпдратом з одержанням сполуки формули потім сполуку формули U або їв вводять у реакцію із сполукою формули III R'Hal (III), де R' позначає те саме, що й R, за винятком водню, a Hal є атомом галогену, з метою одержання відповідної сполуки формули Іс, яку можна піддати дії агента гідрування можливого подвійного зв'язку в радикалі К' (СН 2 )п-СН-СН-(СН 2 )рАг А яку, при бажанні, піддають дії реагенту, що здійснює метаноліз гідроксилу в позиції 2', щоб одержати відповідну сполуку формули їв, де Z є атомом водню Цей винахід стосується нових похідних еритроміцину, способу їх одержання та їх застосування як антибіотиків Об'єктом винаходу є сполуки формули І В та/або агента, що вивільнює гідроксильну групу в позиції 2' 14 Сполуки формули III, що мають такі назви 4-(3-йодпропіл)хшолш та 3-[1-(3-бромпропіл)-1Н-імідазол-4-іл]піридин, як нові ХІМІЧНІ продукти де R являє собою атом водню, алкільнии радикал, що містить аж до 12 атомів вуглецю, який може бути заміщеним галогеном чи радикалами Аг або -(СН2)п-(С=С)-(СН2)р^ А В m - ціле число від 1 до 8, п і р, однакові чи різні, позначають ЦІЛІ числа від 0 до 6, А і В, однакові чи різні, являють собою атом водню або галогену чи алкіл, що містить аж до 8 атомів вуглецю, Аг арильний або гетероарильний радикали, можливо заміщені, і Z - атом водню чи залишок карбонової кислоти, яка містить аж до 18 атомів вуглецю У наведеному вище описі замісників алкільнии радикал може означати метил, етил, пропіл, ізопропіл, н-бутил, ізо- чи трет-бутил, циклобутил, циклопентил, циклогексил, децил або додецил 48244 Галоген, більш прийнятно, є атомом фтору, хлору чи брому Арильний радикал може бути фенілом або нафтилом Гетероарильнии радикал може являти собою ТІЄНІЛ, фурил, піроліл, тіазоліл, оксазоліл, імідазоліл, тіадіазоліл, піразоліл або ізопіразоліл, піридил, піримідил, піридазиніл чи піразиніл, а також індол іл, бензофураніл, бензотіазил або ХІНОЛІНІЛ Арильний чи гетероарильнии радикали можуть бути заміщеними кількома замісниками з групи, до якої входять гідроксил, атоми галогену, радикали NO2 та CN, алкіл, алкеніл або алкініл, О-алкал, Оалкеніл чи 0-алкшіл, S-алкіл, S-алкеніл або Sалкініл, N-алкіл, N-алкеніл і N-алкшіл, що містять аж до 12 атомів вуглецю, які можуть бути заміщеними одним чи кількома атомами вуглецю, радикал N де Ra та Rt,, однакові або різні - атом водню або алкіл, що містить аж до 12 атомів вуглецю, радикал 0 C-R 3 де R3 - це алкіл, що містить аж до 12 атомів вуглецю, або арил чи гетероарильнии радикал, який може бути заміщеним, причому карбоциклічні радикали арил, О-арил чи S-арил або п'яти- чи шестиланкові гетероциклічні арил, О-арил або Sарил з одним чи кількома гетероатомами, які можуть бути заміщеними одним чи кількома наведеними нижче замісниками Як більш прийнятні гетероциклічні радикали можна назвати такі радикали Rb -О -О CO ио 48244 o a н,с гетероциклічні радикали, що їх описано в заявках Європейських патентів 487411, 596802, 676409 та 680967 Радикали можуть бути заміщеними одним чи кількома названими вище замісниками Більш конкретно, об'єктом винаходу є сполуки формули І, де Z є атомом водню, сполуки формули І, де R є атомом водню, сполуки формули І, де R являє собою (CbbJmAr, де т і Аг зберігають подані вище значення, зокрема, ті сполуки формули І, де R являє собою (CbbJmAr, де т ' = 3, 4, 5 або 6, як, наприклад, сполуки, де Аг являє собою 4-хшолшіл, який може бути заміщеним в одному чи обох циклах хінолінілу, і, особливо, ті сполуки формули І, де Аг являє собою незаміщений 4-ХІНОЛІНІЛ, або ж сполуки формули І, де Аг є радикалом який може бути заміщеним в одному та/або в другому з двох циклів, і, найбільш прийнятно, ті сполуки, де радикал Аг не має замісників Найбільш конкретно, об'єктом винаходу є сполуки, одержання яких подано нижче в експериментальній частині, зокрема, сполука з прикладу 4 Продукти загальної формули І характеризуються дуже високою антибіотичною активністю щодо грам-позитивних бактерій, таких як стафілококи, стрептококи і пневмококи Сполуки ВІДПОВІДНО до винаходу можуть, таким чином, застосовуватись як медикаменти при лікуванні інфекцій, що спричинюються чутливими до медикаментів збудниками, при лікуванні стафілококових інфекцій, таких як стафілококовий сепсис, ЗЛОЯКІСНІ стафілококові захворювання обличчя і ЗЛОЯКІСНІ шкірні захворювання, піодерміти, септичні та ГНІЙНІ рани, фурункули, карбункули, флегмони, бешихи, вугри, такі стафілококові інфекції, як самостійні чи післягрипозні ангіни, бронхопневмонії, ГНІЙНІ легеневі захворювання, такі стрептококові інфекції, як гострі ангіни, отити, синусити, скарлатина, такі пневмококові інфекції, як пневмонії та бронхіти, бруцельоз, дифтерія і гонококова інфекція Продукти цього винаходу мають також активність щодо інфекцій, що спричинюються такими збудниками, як Haemophilus mfluenzae, 48244 Rickettsies, Mycoplasma pneumoniae, Chlamydia, Legionella, Ureaplasma, Toxoplasma та збудники роду Мусоbacterium Об'єктом цього винаходу є описані вище продукти формули І, що використовуються як медикаменти, зокрема, антибіотики, а також їх фармацевтично прийнятні солі з мінеральними та органічними кислотами Більш конкретно, об'єктом винаходу є продукти, що використовуються як медикаменти, зокрема, антибіотики, які описано в прикладах Об'єктом винаходу є також фармацевтичні композиції, що містять як активну основу, принаймні, визначені вище медикаменти Ці КОМПОЗИЦІЇ можуть вводитись перорально, ректально, парентерально або наноситись місцево на шкіру чи слизові тканини, але більш прийнятним методом нанесення є пероральний метод Композиції можуть бути твердими або рідкими і випускатись у вигляді дуже поширених у практичній медицині лікарських форм, таких, наприклад, як прості таблетки чи драже, желатинові капсули, гранули, СВІЧІ, ІН'ЄКЦІЙНІ препарати, мазі, креми та гелі Вони можуть готуватись у звичайні способи Активна основа чи активні основи можуть вводитись в них разом з ексципієнтами, що часто застосовуються у фармкомпозиціях, такими як тальк, гуміарабік, лактоза, крохмаль, стеарат магнію, какао масло, водні і неводні носи, жирові речовини тваринного і рослинного походження, парафінові ПОХІДНІ, ГЛІКОЛІ, різноманітні змочувальні агенти, диспергатори чи емульгатори і консерванти Композиції можуть також випускатись у вигляді порошку, призначеного для розчинення безпосередньо перед прийманням у підхожому розчиннику, наприклад, у стерильній апірогенній воді Доза, що вводиться, залежить від природи захворювання, особливостей хворого, метода введення, конкретного продукту Наприклад, для продукту, що його описано в прикладі 4, при пероральному застосуванні добова доза для дорослого коливається в межах від 50 до 500мг Сполуки формули II, які використовуються як ВИХІДНІ продукти, описано та заявлено у заявці Європейського патенту 0596802 Об'єктом винаходу є також спосіб, який полягає втому, що сполуку формули II 10 де Z має наведене вище значення, піддають дії пдроксиламшу чи його галогенпдрату, одержуючи сполуку U (Ід) яку, при бажанні, піддають реакції з агентом метанолізу по позиції 2' з одержанням відповідної сполуки формули їв ОН де Z являє собою атом водню, потім сполуку U або їв вводять у реакцію із сполукою формули III R'Hal (III), де R' позначає те саме, що й R, за винятком водню, a Hal є атомом галогену, з одержанням відповідної сполуки формули Іс, яку можна піддати дії агента гідрування можливого подвійного зв'язку в радикалі R' (СН 2 ) п -СН-СН-(СН2)рАг А til) OZ В та/або агента, що вивільнює гідроксильну функцію в позиції 2' Об'єктом винаходу є також сполуки формули III, спосіб одержання яких подано нижче в експериментальній частині У більш прийнятному варіанті втілення способу, що пропонується у винаході працюють у присутності надлишку пдроксиламіну чи його галогенпдрату в середовищі розчинника, яким може бути 12 11 48244 ацетонітрил, діоксан, диметилформамід, виливають на лід, екстрагують хлористим тетрапдрофуран, диметиловий ефір метиленом, промивають водою, сушать і етиленгліколю або диметилсульфоксид, упарюють до сухого Одержують 420мг продукту, вилучення гідроксилу в позиції 2' здійснюють який очищають на силікагелі, елююючи сумішшю за допомогою метанолізу, дмзопропіловий ефір-триетиламш-метанол (9/0, етерифікацію в позиції 2' здійснюють згідно з 4/0, 4) класичними методами, Hal у сполуці формули III є, Спектр ЯМР(300МГц, CDC13), м д і більш прийнятне, атомом брому, хлору чи йоду, 0,74 СН3СН2, 1,14 8-Ме та 10-Ме, 1,24 5 Ме, 1,31 4-Ме, 1,41 і 1,49 бта 12Ме, 1,39 2-Ме, реакцію між сполукою U та сполукою III 1,50 і 1,82 14-СН2, 1,25 та 1,68 4'-СН2, 2,29 проводять у присутності гідриду натрію, можливе 1 NMe2, 2,48 НЗ , 2,80 Н8, 2,83 6-ОМе, 3,03 Н10, відновлення ланцюга 1 3,19 Н2\ 3,54 Н5 , 3,84 Н2, 4,18 Н11,4,24 Н5, 4,29 НГ, 4,52та4,61 ОСН2СН3, 5,11 Н13, 6,40та -(СН 2 )п-С-С-(СН 2 )рАг 6,76 етиленові групи, 7,2 - 7,43 ароматичні групи Приклад 3 11,12-дидезокси-3-де[(2,6А В дидезокси-3-С-метил-3-О-метил-альфа-І_рибогексопіранозил)окси]-6-О-метил-3-оксо-12,11здійснюють за допомогою водню у [оксикарбоніл(3-фенілпро-покси)імшо]-еритроміцин присутності паладієвого чи платинового Суміш, що містить 57мг продукту з прикладу 2, каталізатора незалежно від наявності в 15мл етилацетату та 8мг паладію на вугіллі, реакційному середовищі хлористоводневої або перемішують протягом 2годин в атмосфері водню, оцтової кислоти Винахід ілюструється такими фільтрують, промивають етилацетатом і до сухого прикладами упарюють, одержуючи 56мг неочищеного Приклад І 11, 12-дидезокси-3-де[(2,6цільового продукту, який очищують на силікагелі, дидезокси-3-С-метил-3-О-метил-альфа-І_елююючи сумішшю дмзопропіловий ефіррибогексопіранозил)окси]-6-О-метил-3-оксо-12,11триетиламш-метанол (9/0, 45/0, 45), внаслідок чого [оксикарбоніл(пдроксиімшо)]-еритроміцин одержують 45мг чистого цільового продукту 200см3 ацетонітрилу та 20г 2'-ацетату 11Спектр ЯМР (CDC1 з), м д дезокси-10,11-дидепдро-3-де[(2, 6-дидезокси-З-С0,89 СН3СН2, 1,13 - 1,15 - 1,24 - 1,36, СН3-СН, метил-3-О-метил-альфа-І_1,37 - 1,50 6 та 12-Ме, 1,99 СН 2 в середині рибогексопіранозил)окси]-12-О-[(11 Н-імідазол-1 ланцюга, 2,27 NMe2 2,46 НЗ1, 2,69 6-ОМе, 2,74 іл)карбоніл]-6-О-метил-3-оксоеритроміцину СР2Рп та Н8, 2,97 Н10, 3,08 Н4, 3,17 Н21, 3,52 додають до розчину, що містить 5,9г Н51, 3,82 Н2, 3,90 і 3,98 CH2O-N, 4,2 Н5, 4,21 пдроксиламін-пдрохлориду та 20см3 води, Н11,4,26 НГ, 5,12 Н13, 7,1 та 7,3 феніл перемішують протягом Згодин, до сухого Приклад 4 11,12-дидезокси-3-де[(2,6упарюють, залишок поглинають метанолом і знову дидезокси-3-С-метил-3-О-метил-альфа-І_перемішують впродовж 20годин при кімнатній рибогексопіранозил)окси]-6-О-метил-3-оксо-12,11температурі Після ЦЬОГО розчин до сухого {оксикарбоніл[3-(4-хінолі-ніл)пропокси]імшо}упарюють, залишок поглинають хлористим еритроміцин метиленом, промивають водою, екстрагують Продукт одержують, виконуючи процедури, що етилацетатом, сушать і упарюють до сухого, їх описано в прикладі 2, виходячи з продукту, який одержуючи 17,4г продукту, який хроматографують одержано в прикладі 1, та продукту, одержаного в на силікагелі, елююючи сумішшю етилацетатПриготуванні 1 Т пл = 224°С триетиламш-метанол (98/0, 75/0, 75) При Спектр ЯМР(СОС1 з), м д хроматографуванні одержаного продукту з 0,88 СН3СН2 1,13 8-Ме, 1,18 10-Ме, 1,23 5івикористанням як елюенту системи Ме, 1,29 4-Ме, 1,35 2-Ме, 1,34 - 1,51 бта 12-Ме, дмзопропіловий ефір-триетиламш-метанол (90/5/5) 1,25 і 1,69 4'-СН2, 1,59 та 1,92 7-СН2, 2,13 СН 2 в одержують 2,06г кінцевого продукту середині ланцюга, 2,28 NMe2, 2,45 НЗ1, 2,68 6Спектр ЯМР(400МГц, CDC13), м д ОМе, 2,72 Н8, 3,05 Н10, 3,07 Н4, 3,17 Н21, 3,28 0,88 СН3СН2, 1,2 8-Ме, 1,25 5'-Ме, 1,31 4СН2С=, 3,52 Н51, 3,89 Н2, 4,01 та 4,08 Ме, 1,39 2-Ме, 1,33-1,49 6 та 12Ме , 1,55 та 1,94 CH2ONC=0, 4,16 Н11, 4,2 Н5, 4,27 НГ, 5,12 Н13, 13-СН2, 1,67 та 1,89 7-СН2, 1,67 3'-СН2, 2,27 1 NMe2, 2,46 НЗ , 2,68 6-ОМе, 2,72 Н8, 3,04 Н4, Приклад 5 11,12-дидезокси-3-де[(2,63,14 Н10, 3,18 Н2\ 3,57 Н51 3,82 Н11, 3,84 дидезокси-3-С-метил-3-О-метил-альфа-І_Н2, 4,26 Н5, 4,35 НГ, 5,14 Н13 рибогексопіранозил)окси]-6-О-метил-3-оксо-12,11Приклад 2 (Е) 11,12-дидезокси-3-де[2,6{оксикарбоніл[3-(4-(3-піриди-ніл)-1Н-імідазол-1дидезокси-3-С-метил-3-О-метил-альфа-І_іл)пропокси]імшо}еритроміцин рибогексопіранозил)окси]-6-О-метил-3-оксо-12,11Продукт одержують, виконуючи процедури, які {оксикарбоніл[(3-феніл-2описано в прикладі 2, виходячи з продукту, що пропеніл)окси]іміно}еритроміцин його одержано в прикладі 1, та продукту, Розчин, що містить 328мг продукту з прикладу одержаного у Приготуванні 2 3 1 та 4см диметилформаміду, охолоджують до Спектр ЯМР(СОС1 з), м д 0°С, додають 41 мг 60%-вого гідриду натрію в 0,88 СН3СН2, 1,15 10-Ме, 1,17 8-Ме, 1,24 5імаслі, перемішують 15хвилин при 0°С та додають Ме, 1,29 4-Ме, 1,35 2-Ме, 1,37 - 1,51 6 і 12 Me, 113мг броманпдриду коричної кислоти в 2мл 1,30-1,75 4'-СН2, 1,62-1,72 4'-СН2, 1,62 -1,72 7диметилформамід і на силіпориті Суміш СН2, 1,60 - 1,92 14-СН2, 2,17 СН 2 у середині 7 , 3 3 7 , 5 6 7 , 6 9 8 , 1 0 8 , 8 0 Х І Н О Л І Н 14 13 48244 1 ланцюга, 2,29 NMe2 2,48 НЗ , 2,68 6-ОМе та Н8, 1,042г йодиду натрію та ЗОмг 1 3,06 НЗ, 3,08 Н10, 3,19 Н2\ 3,53 Н5 , 2,83 Н2, тетрабутиламоніййодиду перемішують протягом 3,98 CH2-N, 4,05 Н11, 4,21 Н5, 4,27 Н1\ 4,15 4годин при 60°С, відганяють ацетон, залишок 4,40 NO-CH2, 5,09 Н13, 7,49 та 7,68 імідазол, поглинають хлористим метиленом промивають 10%-вим розчином сульфіту натрію, сушать та до 7.29 - 8,1 - 8,46 - 8,90 піридин сухого упарюють, одержуючи 3,91 мг потрібного Приготування І продукту 4-(3-йодпропіл)хінолш Стадія А етиловий ефір 4-(3-хлорпропіл)-2Приготування 2 3-[1-(3-бромпропіл)-1Н(діетоксифосфініл)-1(2Н)-хінолшкарбоновоі імідазол-4-іл]піридин кислоти Розчин, що містить 400мг 3-(1Н-імідазол-4іл)піридину, Змл диметилформамідута 132мг 60%Розчин 7,0г етилового ефіру 2вого гідриду натрію в маслі, перемішують 1 годину (діетоксифосфініл)-1(2Н)-хінолшкарбоновоі при 60°С, додають краплями розчин 3,22г кислоти у 70 мл тетрапдрофурану охолоджують до дибромпропану в 2мл диметилформаміду та -65°С, додають протягом 15хвилин 17,6мл перемішують ще 1 годину при кімнатній бутиллітію в 4мл бромхлорпропану, перемішують температурі Одержану суміш виливають на впродовж Згодин ЗОхвилин, виливають на 50смз крижану воду, екстрагують етилацетатом, сушать крижаної води, екстрагують етилацетатом, та упарюють до сухого Залишок хроматографують промивають водою, сушать і упарюють до сухого, на силікагелі, елююючи сумішшю хлористий одержуючи неочищений цільовий продукт, який метилен-метанол(9/1) Вихід чистого цільового очищують хроматографією на силікагелі, елююючи продукту становить 306мг сумішшю циклогексан-етилацетат(4/6) Вихід чистого цільового продукту становить 6,541 г Приклад фармацевтичної композиції Одержують композицію, що містить Спектр ЯМР(250МГц, CDC13), м д Продукт, одержаний в прикладі 4 150мг 0,98 - 1,19 - 1,33 групи СНз, 2,01, СН 2 у середині ланцюга, 2,55 - 2,85 =СН2, 3,59 СН2Ексципієнт до 1г СН2-Х, 3,71 - 4,14 СН 2 в POEt, 4,30 СН 2 в CO2Et, Як ексципієнт можна використовувати крохмаль, тальк, стеарат магнію 4.30 СН 2 в CO2Et, 5,57 Р-СН, 5,92 =СН-СН-Р, 7,11 -7,26-7,60 ароматичні групи Фармакологічне дослідження продуктів ВІДПОВІДНО до винаходу Стадія Б 4-(3-хлорпропіл)хшолш 6,5г продукту стадії А протягом 2годин Метод розбавлення рідким середовищем перемішують при 120°С з 65см3 етилового спирту Готують кілька пробірок, у які приміщують та 65см3 2 N розчину гідроксиду натрію, упарюють, однакову КІЛЬКІСТЬ стерильного живильного екстрагують ефіром, промивають водою, сушать і середовища Потім у пробірки приміщують упарюють до сухого, одержуючи 1,87г висходиві КІЛЬКОСТІ досліджуваного продукту, після неочищеного продукту, який очищають чого кожну з пробірок засівають штамом бактерій хроматографією на силікагелі, елююючи сумішшю Після інкубації впродовж 24годин в хлористий метилен-етилацетат(8/2) Вихід чистого термостатованій шафі при 37°С методом цільового продукту становить 0,617г Спектр просвічування оцінюють затримку росту, що дає ЯМР(СОС1з), м д змогу визначити мінімальні інгібуючі концентрації, що їх виражають у мікрограмах на 1см3 2,24 СНз в середині ланцюга, 3,27 СН2С=, 3,62 СН2-Х, 7,28 - 7,59 - 7,72 - 8,06 - 8,13 - 8,83 Для продукту, який було синтезовано у прикладі 4, отримали такі результати(замір через ХІНОЛІН 24години) Стадія В 4-(3-йодпропіл)хшолш Суміш 268мг продукту стадії Б, 5мл ацетону, Грам(+) бактеріальні штами Staphylococcus aureus 011UC4 0,04 Staphylococcus aureus 011GO251 0,15 Staphylococcus epidermidis 012GO111 0,15 Streptococcus pyogenes група А 02А1UC1
ДивитисяДодаткова інформація
Назва патенту англійськоюErythromycin derivatives, a process for their producing and a pharmaceutical composition
Автори англійськоюChanto Jean-Francois, Denis Alexis
Назва патенту російськоюПроизводные еритромицина, способ их получения и фармацевтическая композиция
Автори російськоюШАНТО Жан-Франсуа, Дени Алексис
МПК / Мітки
МПК: C07H 17/08, A61K 31/7048, A61P 31/04
Мітки: спосіб, еритроміцину, похідні, одержання, фармацевтична, композиція
Код посилання
<a href="https://ua.patents.su/8-48244-pokhidni-eritromicinu-sposib-kh-oderzhannya-ta-farmacevtichna-kompoziciya.html" target="_blank" rel="follow" title="База патентів України">Похідні еритроміцину, спосіб їх одержання та фармацевтична композиція</a>
Попередній патент: Спосіб вирощування лісових насаджень
Випадковий патент: Спосіб утворення поверхні штучного каменя