Трансгенна рослина, яка містить нуклеїнову кислоту, що має виділену нуклеотидну послідовність, яка кодує модифіковану інтеїном ксиланазу
Номер патенту: 115022
Опубліковано: 11.09.2017
Автори: Лессард Філліп, Епгар Джеймс, Лазар Габор, Рааб Р. Майкл, Шень Біньчжан, Де Ла Вега Умберто
Формула / Реферат
1. Трансгенна рослина, що містить виділену нуклеїнову кислоту, що має нуклеотидну послідовність, яка кодує модифіковану інтеїном ксиланазу, що містить амінокислотну послідовність, вибрану з групи, яка складається з SEQ ID NО: 2374, 2376-2378, 2383, 2385-2386, 2410, 2412-2413, 2420, 2422-2425, 2428, 2430-2431, 2436, 2442-2444, 2451, 2454-2458, 2460-2461, 2465-2468, 2471-2474, 2477-2480, 2482-2483, 2493-2494, 2500-2501, 2504, 2507-2513, 2517-2519, 2530-2531, 2533-2537, 2539-2543, 2545, 2548-2549, 2555-2557, 2559, 2565, 2569-2571, 2573-2575, 2579-2582, 2584-2597, 2600, 2602-2605, 2607-2621, 2624-2626, 2629-2634, 2636-2639, 2643, 2645-2648, 2650, 2652, 2656-2658, 2661, 2664, 2666-2672, 2674, 2677-2683, 2685 і 3315-3322, де виділена нуклеїнова кислота знаходиться у експресуючій конструкції.
2. Трансгенна рослина за п. 1, де експресуюча конструкція має послідовність SEQ ID NO: 1.
3. Трансгенна рослина, що містить виділену нуклеїнову кислоту, яка гібридизується в умовах високої жорсткості з послідовністю, вибраною з групи, що складається з SEQ ID NO: 2688, 2690-2692, 2697, 2699-2700, 2724, 2726-2727, 2734, 2736-2739, 2742, 2744-2745, 2750, 2756-2758, 2765, 2768-2772, 2774-2775, 2779-2782, 2785-2788, 2791-2794, 2796-2797, 2807-2808, 2814-2815, 2818, 2821-2827, 2831-2833, 2844-2845, 2847-2851, 2853-2857, 2859, 2862-2863, 2869-2871, 2873, 2879, 2883-2885, 2887-2889, 2893-2896, 2898-2911, 2914, 2916-2919, 2921-2935, 2938-2940, 2943-2948, 2950-2953, 2957, 2959-2962, 2964, 2966, 2970-2972, 2975, 2978, 2980-2986, 2988, 2991-2997, 2999 і 3323-3330, де виділена нуклеїнова кислота кодує модифіковану інтеїном ксиланазу та знаходиться у експресуючій конструкції.
Текст
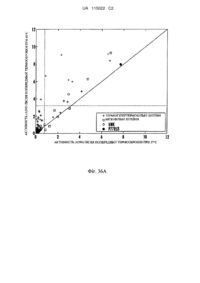
Реферат: Винахід стосується трансгенної рослини, що містить виділену нуклеїнову кислоту, що має нуклеотидну послідовність, яка кодує модифіковану інтерном ксиланазу з контрольованою активністю. UA 115022 C2 (12) UA 115022 C2 UA 115022 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід щонайменше частково здійснений за підтримкою уряду США по гранту United States Department of Energy Advanced Research Projects Agency-Energy (ARPA-e) № DEAR0000042. Уряд США володіє певними правами на цей винахід. Дана заявка являє собою заявку в часткове продовження патентної заявки США № 12/590444, поданої 6 листопада 2009 року і яка включена в цей документ як посилання так, як якби вона була наведена в повному об'ємі. Список послідовностей, поданий в електронному вигляді з даною заявкою, озаглавлений "Список послідовностей", створений 5 листопада 2010 року і маючий розмір 14792733 байт, включений в цей документ як посилання так, як якби він був наведений повністю. ГАЛУЗЬ ВИНАХОДУ Винахід стосується контролю активності білків. ПОПЕРЕДНІЙ РІВЕНЬ ТЕХНІКИ Багато які білки володіють придатними характеристиками, але в певних умовах використати білок може бути складним. Наприклад, у гідролітичних ферментів існують важливі промислові і сільськогосподарські застосування, але їх експресія і продукція у деяких хазяїв можуть асоціюватися з небажаними фенотипічними ефектами. Ферменти, що руйнують клітинну стінку, включаючи целюлази, ксиланази, лігнінази, естерази, пероксидази і інші гідролітичні ферменти, часто пов'язані з несприятливим впливом на ріст, фізіологічну продуктивність і агрономічну продуктивність при експресії в рослинах. Ксиланази являють собою ферменти, каталізуючі гідроліз бета-1,4-ксилану, лінійного полісахаридного компонента геміцелюлози, що міститься в клітинних стінках рослин. Целюлази являють собою ферменти, каталізуючі внутрішній або кінцевий гідроліз полімерів глюкози, пов'язаного бета-1,4-D-глікозидними зв'язками, присутніми в целюлозі, різновидах целюлози з різними мірами полімеризації і целлобіозі. Внаслідок цих видів активності експресія ксиланази або целюлази в рослинах може приводити до небажаного руйнування компонентів рослин. Багато які ферменти внаслідок їх гідролітичної активності, також можуть погано експресуватися в хазяях-мікроорганізмах. СУТЬ В одному з аспектів винахід стосується виділеного білка з амінокислотною послідовністю, яка щонайменше на 90 % ідентична послідовності, вибраній з групи, що складається з SEQ ID NO: 2373-2686 і 3315-3322. В одному з аспектів винахід стосується виділеної нуклеїнової кислоти з нуклеотидною послідовністю, що кодує амінокислотну послідовність, яка щонайменше на 90 % ідентична послідовності, вибраній з групи, що складається з SEQ ID NO: 2373-2686 і 3315-3322. В одному з аспектів винахід стосується трансгенної рослини, що містить виділену нуклеїнову кислоту з нуклеотидною послідовністю, що кодує амінокислотну послідовність, яка щонайменше на 90 % ідентична послідовності, вибраній з групи, що складається з SEQ ID NO: 2373-2686 і 3315-3322. В одному з аспектів винахід стосується виділеної нуклеїнової кислоти з нуклеотидною послідовністю, що гібридизується в умовах помірної жорсткості з послідовністю, вибраною з групи, що складається з SEQ ID NO: 2687-3000 і 3323-3330. В одному з аспектів винахід стосується трансгенної рослини, що містить виділену нуклеїнову кислоту з нуклеотидною послідовністю, що гібридизується в умовах помірної жорсткості з послідовністю, вибраною з групи, що складається з SEQ ID NO: 2687-3000 і 3323-3330. В одному з аспектів винахід стосується виділеної амінокислотної послідовності, що містить безперервну амінокислотну послідовність, яка щонайменше на 90 % ідентична 6, 10-50, 10-100, 10-150, 10-300, 10-400, 10-500 або 10-всім суміжним амінокислотним залишкам білка з будьякою послідовністю SEQ ID NO: 2373-2686 і 3315-3322. Білок містить послідовність інтеїну, послідовність ферменту, верхню ділянку з'єднання інтеїну-екстеїну і нижню ділянку з'єднання інтеїну-екстеїну. Білок з будь-якою послідовністю SEQ ID NO: 3315-3322 містить щонайменше одну амінокислотну заміну відносно SEQ ID NO: 2518. Виділена амінокислотна послідовність містить щонайменше одну з верхньої ділянки з'єднання інтеїну-екстеїну, нижньої ділянки з'єднання інтеїну-екстеїну або одного або декількох щонайменше з однієї амінокислотної заміни відносно SEQ ID NO: 2518. В одному з аспектів винахід стосується антитіла, що розпізнає епітоп на виділеній амінокислотній послідовності, що містить безперервну амінокислотну послідовність, яка щонайменше на 90 % ідентична 6, 10-50, 10-100, 10-150, 10-300, 10-400, 10-500 або від 10 до всіх суміжних амінокислотних залишків білка з будь-якою послідовністю SEQ ID NO: 2373-2686 і 3315-3322. Білок містить послідовність інтеїну, послідовність ферменту, верхню ділянку з'єднання інтеїну-екстеїну і нижню ділянку з'єднання інтеїну-екстеїну. Білок з будь-якою послідовністю SEQ ID NO:3315-3322 містить щонайменше одну амінокислотну заміну відносно 1 UA 115022 C2 5 10 15 20 25 30 35 40 45 50 55 60 SEQ ID NO:2518. Виділена амінокислотна послідовність містить щонайменше одну з верхньої ділянки з'єднання інтеїну-екстеїну, нижньої ділянки з'єднання інтеїну-екстеїну або одну або декілька щонайменше з однієї амінокислотної заміни відносно SEQ ID NO: 2518. В одному з аспектів винахід стосується виділеної нуклеїнової кислоти з послідовністю, що кодує безперервну амінокислотну послідовність, яка щонайменше на 90 % ідентична 6, 10-50, 10-100, 10-150, 10-300, 10-400, 10-500 або 10 - всіх суміжних амінокислотних залишків білка з будь-якою послідовністю SEQ ID NO: 2373-2686 і 3315-3322. Білок містить послідовність інтеїну, послідовність ферменту, верхню ділянку з'єднання інтеїну-екстеїну і нижню ділянку з'єднання інтеїну-екстеїну. Білок з будь-якою послідовністю SEQ ID NO:3315-3322 містить щонайменше одну амінокислотну заміну відносно SEQ ID NO:2518. Виділена амінокислотна послідовність містить щонайменше одну з верхньої ділянки з'єднання інтеїну-екстеїну, нижньої ділянки з'єднання інтеїну-екстеїну або одну або декілька щонайменше з однієї амінокислотної заміни відносно SEQ ID NO: 2518. КОРОТКИЙ ОПИС МАЛЮНКІВ Наведений далі докладний опис переважних варіантів здійснення буде більш зрозумілим при читанні в поєднанні з прикладеними малюнками. З метою ілюстрації винаходу в малюнках представлені варіанти здійснення, переважні в даному винаході. Однак потрібно розуміти, що винахід не обмежений конкретними представленими схемами і засобами. На малюнках: На фіг. 1 проілюстрована відстань ділянки вставки інтеїну від активного центра білка. Ромбами вказані ділянки вставок, а квадратами вказані інші ділянки С/S/Т, де інтеїн не вставлений. На фіг. 2A проілюстрований рослинний вектор експресії, позначений pAG2005 (SEQ ID NO: 1). На фіг. 2B проілюстрований pAG2005 (SEQ ID NO: 1) більш детально. На фіг. 3A-3L проілюстровані дані вестерн-блотинга для P77853, модифікованої інтеїном Tth, де інтеїн вставлений або по серину 158 (S158), або по треоніну 134 (T134) ферменту P77853. На деяких з фіг. 3A-3L, частини вестерн-блотинга закриті для фокусування уваги на конкретному наборі доріжок. Для кожного із зразків зверху доріжки позначені фенотипи на чашці з агаром. Фенотипи на чашках з агаром приведені у вигляді "SW" для фенотипу, що перемикається, TSP для фенотипу температурочутливого сплайсера, що перемикається і Р для пермісивного фенотипу. На кожній з фіг. 3A-3L NIC вказує на модифікований інтеїном білок, що містить N-екстеїн, інтеїн і С-екстеїн; а NC вказує на сплайсований білок, що містить N- і Секстеїни. На фіг. 3A проілюстрований вестерн-блотинг, що демонструє білок P77853-Tth-S158-2 (SEQ ID NO: 1672), який піддавали попередній термообробці при 37 °C (панель 2, ліва доріжка) або 55 °C (панель 2, права доріжка) протягом чотирьох годин. Також представлені доріжки, що містять білок з контрольного вектора без вставки (VCT) і білок P77853 дикого типу (P77), які піддавали попередній термообробці таким же способом. На фіг. 3B проілюстрований вестерн-блотинг, що демонструє білок P77853-Tth-S158-4 (SEQ ID NO: 1673), який піддавали попередній термообробці при 37 °C (панель 4, ліва доріжка) або 55 °C (панель 4, права доріжка) протягом чотирьох годин. Також представлені доріжки, що містять білок з контрольного вектора без вставки (VCT) і білок P77853 дикого типу (P77), які піддавали попередній термообробці таким же способом. На фіг. 3C проілюстрований вестерн-блотинг, що демонструє білок P77853-Tth-S158-7 (SEQ ID NO: 1674), який піддавали попередній термообробці при 37 °C (панель 7, ліва доріжка) і 55 °C (панель 7, середня доріжка) протягом чотирьох годин, і 70 °C протягом однієї години (панель 7, права доріжка). Також представлені доріжки, що містять білок з контрольного вектора без вставки (VCT) і білок P77853 дикого типу (P77). На фіг. 3D проілюстрований вестерн-блотинг, що демонструє білок P77853-Tth-S158-19 (SEQ ID NO: 1675), який піддавали попередній термообробці при 37 °C (панель 19, ліва доріжка) або 55 °C (панель 19, середня доріжка) протягом чотирьох годин, і 70 °C протягом однієї години (панель 19, ліва доріжка). Також представлені доріжки, що містять білок з контрольного вектора без вставки (VCT) і білок P77853 дикого типу (P77). На фіг. 3E проілюстрований вестерн-блотинг, що демонструє білок P77853-Tth-S158-20 (SEQ ID NO: 1676), який піддавали попередній термообробці при 37 °C (панель 20, ліва доріжка) або 55 °C (панель 20, середня доріжка) протягом чотирьох годин, і 70 °C протягом однієї години (панель 20, права доріжка). Також представлені доріжки, що містять білок з контрольного вектора без вставки (VCT) і білок P77853 дикого типу (P77). На фіг. 3F проілюстрований вестерн-блотинг, що демонструє білок P77853-Tth-S158-21 (SEQ ID NO: 1677), який піддавали попередній термообробці при 37 °C (панель 21, ліва доріжка) 2 UA 115022 C2 5 10 15 20 25 30 35 40 45 50 55 60 або 70 °C (панель 21, права доріжка) протягом однієї години. Також представлені доріжки, що містять білок з контрольного вектора без вставки (VCT) і білок P77853 дикого типу (P77), які піддавали попередній термообробці таким же способом. На фіг. 3G проілюстрований вестерн-блотинг, що демонструє білок P77853-Tth-S158-25 (SEQ ID NO: 1678), який піддавали попередній термообробці при 37 °C (панель 25, ліва доріжка) або 70 °C (панель 25, права доріжка) протягом однієї години. Також представлені доріжки, що містять білок з контрольного вектора без вставки (VCT) і білок P77853 дикого типу (P77), які піддавали попередній термообробці таким же способом. На фіг. 3H проілюстрований вестерн-блотинг, що демонструє білок P77853-Tth-S158-38 (SEQ ID NO: 1679), який піддавали попередній термообробці при 37 °C (панель 38, ліва доріжка) або 55 °C (панель 38, права доріжка) протягом чотирьох годин. Також представлені доріжки, що містять білок з контрольного вектора без вставки (VCT) і білок P77853 дикого типу (P77), які піддавали попередній термообробці таким же способом. На фіг. 3I проілюстрований вестерн-блотинг, що демонструє білок P77853-Tth-S158-39 (SEQ ID NO: 1680), який піддавали попередній термообробці при 37 °C (панель 39, ліва доріжка) або 55 °C (панель 39, середня доріжка) протягом чотирьох годин, і 70 °C протягом однієї години (панель 39, права доріжка). Також представлені доріжки, що містять білок з контрольного вектора без вставки (VCT) і білок P77853 дикого типу (P77). На фіг. 3J проілюстрований вестерн-блотинг, що демонструє білок P77853-Tth-S158-42 (SEQ ID NO: 1681), який піддавали попередній термообробці при 37 °C (панель 42, ліва доріжка) або 55 °C (панель 42, середня доріжка) протягом чотирьох годин, і 70 °C протягом однієї години (панель 42, права доріжка). Також представлені доріжки, що містять білок з контрольного вектора без вставки і білок P77853 дикого типу. На фіг. 3K проілюстрований вестерн-блотинг, що демонструє білок P77853-Tth-S158-138 (SEQ ID NO: 1691), який піддавали попередній термообробці при 37 °C (ліва доріжка) або 59 °C (друга від лівої доріжка) протягом чотирьох годин. Також представлені доріжки, що містять білок з контрольного вектора без вставки (VCT) і білок P77853 дикого типу (P77853). На фіг. 3L проілюстрований вестерн-блотинг, що демонструє білок P77853-Tth-T134-1 (SEQ ID NO: 1629) (панель 1), білок P77853-Tth-T134-2 (SEQ ID NO: 1630) (панель 2), білок P77853Tth-T134-3 (SEQ ID NO: 1631) (панель 3), білок P77853-Tth-T134-9 (SEQ ID NO: 1632) (панель 9), білок P77853-Tth-T134-91 (SEQ ID NO: 1644) (панель 91), білок P77853-Tth-T134-48 (SEQ ID NO: 1638) (панель 48), білок P77853-Tth-T134-80 (SEQ ID NO: 1640) (панель 80) і білок P77853-TthT134-95 (SEQ ID NO: 1645) (панель 95), які піддавали попередній термообробці при 37 °C (ліва доріжка в кожній з вказаних раніше панелей) і 70 °C (права доріжка в кожній з вказаних раніше панелей) протягом однієї години. Також представлені доріжки, що містять білок з контрольного вектора без вставки (VCT) і білок P77853 дикого типу (P77), які піддавали попередній термообробці таким же способом. Фенотип кожного білка приведений вгорі відповідної йому доріжки. На фіг. 4A-4C проілюстрований аналіз вестерн-блотинга для мутантів ксиланази P77853, модифікованої інтеїном Tth по S158. На фіг. 4A проілюстрований аналіз вестерн-блотинга для ксиланази P77853, модифікованої інтеїном Tth по S158-19 (SEQ ID NO: 1675). Зразки білка інкубували при 59 °C протягом різних періодів часу (0, 1, 2, 3, 4 і 6 годин). Праворуч представлені контрольні зразки вектора без вставки (V) і P77853 дикого типу разом з сходовим маркером молекулярної маси. Зафарбована сірим ділянка в середині призначена для ховання доріжок, що містять інші зразки. На фіг. 4B проілюстрований аналіз вестерн-блотинга для ксиланази P77853, модифікованої інтеїном Tth, S158-30-103 (SEQ ID NO: 1701). Зразки білка інкубували при будь-якій температурі з 37 °C, 50 °C, 59 °C і 65 °C протягом різних періодів часу (1, 2, 3, 4 і 6 годин), як указано. Праворуч представлені контрольні зразки вектора без вставки (Vect) і P77853 дикого типу разом з сходовим маркером молекулярної маси. На фіг. 4C проілюстрований аналіз вестерн-блотинга для ксиланази P77853, модифікованої інтеїном Tth, T134-100-101 (SEQ ID NO: 1711). Зразки білка інкубували при будь-якій температурі з 37 °C, 50 °C, 59 °C і 65 °C протягом різних періодів часу (1, 2, 4, 6 і 17 годин), як указано. Праворуч представлені контрольні зразки вектора без вставки (Vect) і P77853 дикого типу разом з сходовим маркером молекулярної маси. На фіг. 5 проілюстровані плазмідні вектори для експресії і секреції в дріжджових клітинах модифікованих інтеїном білків; наприклад, ендоглюканаз, що походять з Acidothermus cellulolyticus. На фіг. 6 проілюстровані аналізи активності штамів Pichia, експресуючих P07981 (ендоглюканаза EG-1 з Trichoderma reesei), P54583 або альбумін (як негативний контроль). 3 UA 115022 C2 5 10 15 20 25 30 35 40 45 50 55 60 На фіг. 7 проілюстрований аналіз на чашці для секреції P54583 з S. cerevisiae. На фіг. 8 проілюстрована активність P54583 при різних рівнях pH і при різних температурах. На фіг. 9 проілюстрований активність P54583 протягом періоду часу і при різних температурах. На фіг. 10 проілюстрований аналіз PNP-C для P54583. На фіг. 11 проілюстроване очищення P54583 з мікрокристалічною целюлозою. На фіг. 12 проілюстрована детекція P54583 дикого типу за допомогою вестерн-блотинга. На фіг. 13 проілюстрований ділянка-кандидат для вставки інтеїнів в P54583. На фіг. 14 проілюстрована стратегія збирання для генів, що кодують модифіковані інтеїном ендоглюканази. На фіг. 15 проілюстрована оцінка поведінки модифікованих інтеїном ендоглюканаз у відповідь на різну температурну обробку. На фіг. 16 проілюстрований аналізи активності модифікованих інтеїном ендоглюканаз. На фіг. 17 проілюстрований аналіз за допомогою вестерн-блотинга різних білків на основі модифікованого інтеїном P54583. На фіг. 18A-С проілюстрована ПЛР зниженої точності для отримання мутантних бібліотек. На фіг. 19 проілюстрована дія зміненого інтеїну на ферментативну активність P54583. На фіг. 20 проілюстроване відновлення ферментативної активності за допомогою попередньої інкубації при різних температурах. На фіг. 21 проілюстрована ферментативна активність, що відновлюється у P54583, несучого мініінтеїн в положенні S237, після попередньої інкубації при різних температурах. На фіг. 22 проілюстровані час попередньої інкубації і активація модифікованої інтеїном ендоглюканази. Кожна панель (1, 2, 3 і 4) містить стовпчики, що представляють 0, 2, 4, 6, 8 і 10 годин попередньої інкубації, представлені послідовно зліва направо. На фіг. 23 проілюстровані результати високопродуктивного аналізу ендоглюканази для бібліотеки модифікованих інтеїном ендоглюканаз. На фіг. 24 проілюстрований скринінг бібліотеки модифікованих мутантним інтеїном ендоглюканаз. На фіг. 25 проілюстровані повторні аналізи активності кандидатів з бібліотеки модифікованих мутантним інтеїном ендоглюканаз. На фіг. 26 проілюстрована індукована нагріванням ферментативна активність, модифікованих інтеїном ендоглюканаз, несучих мутації в положенні R51 інтеїну Tth. На фіг. 27 проілюстроване філогенетичне дерево ендоглюканаз. На фіг. 28 проілюстрований плазмідний вектор для експресії і секреції модифікованих інтеїном білків; наприклад, експресії і секреції ендоглюканази, що отримується у термітів, в дріжджах. На фіг. 29 проілюстровані дріжджі, експресуючі вектор експресії без вставки, вектор експресії, що кодує NtEG, і вектор експресії, що кодує мутантну NtEG з відсутністю нативного сигнального пептиду. На фіг. 30 проілюстрована ендоглюканазна активність NtEG і мутантної NtEG з відсутністю нативного сигнального пептиду в діапазоні температур. На фіг. 31 проілюстрована ендоглюканазна активність мутантної NtEG з відсутністю нативного сигнального пептиду і P54583 в діапазоні pH. На фіг. 32 проілюстрована ендоглюканазна активність мутантної NtEG з відсутністю нативного сигнального пептиду і з His-міткою або без неї. На фіг. 33 проілюстрована стратегія для збирання генів, що кодують модифіковані інтеїном ендоглюканази NtEG. На фіг. 34 проілюстрована часова динаміка активності ферментів дріжджових клітин, експресуючих модифіковані інтеїном ендоглюканази термітів. На фіг. 35 проілюстрована експресуюча касета у векторі λ ZAPоII. На фіг. 36A-D проілюстровані аналізи перемикання для модифікованої інтеїном P77853 при pH 6,5 в прикладі 15 для ділянок вставок T134 і S158. У положення S158 (фіг. 36A- В) і в положення T134 (фіг. 36C-D) P77853 вставляли групу інтеїнів. На графік наносять активність при високих і низьких температурах в порівнянні з P77853 дикого типу (фіг. 36A і С). Також на графік наносять активність при високих температурах в залежності від кратності індукції (активність при високих температурах/активність при низьких температурах) (фіг. 36B і D). Інтеїни руйнуються при термофільності їх хазяїна. Вертикальна пунктирна лінія являє собою 10 % активності дикого типу при низьких температурах. Горизонтальна пунктирна лінія являє собою 40 % активності дикого типу при високих температурах. На фіг. 37A-D проілюстровані аналізи перемикання для модифікованої інтеїном P77853 при 4 UA 115022 C2 5 10 15 20 25 30 35 40 45 50 55 60 pH 7,5 в прикладі 15 для ділянок вставок T134 і S158. В положення S158 (фіг. 37A- В) і в положення T134 (фіг. 37C-D) P77853 вставляли групу інтеїнів. На графік наносять активність при високих і низьких температурах в порівнянні з P77853 дикого типу (фіг. 37A і С). Також на графік наносять активність при високих температурах в залежності від кратності індукції (активність при високих температурах/активність при низьких температурах) (фіг. 37B і D). Інтеїни руйнуються при термофільности їх хазяїна. Вертикальна пунктирна лінія представляє 10 % активності дикого типу при низьких температурах. Горизонтальна пунктирна лінія являє собою 40 % активності дикого типу при високих температурах. На фіг. 38A-D проілюстровані кандидати з найкращою активністю в прикладі 15. В положення S158 (фіг. 38A і С) і в положення T134 (фіг. 39B і D) P77853 вставляли групу інтеїнів. На графік наносять активність найкращих 20 кандидатів з найбільшою активністю після термообробки при високій (правий стовпець для кожного зразка) і низькій (лівий стовпець для кожного зразка) температурах при pH 6,5 (фіг. 38A і В) і pH 7,5 (фіг. 38C і D) в порівнянні з диким типом і вектором без вставки. Пунктирна лінія між 2 і 4 на осі активності являє собою 40 % активності дикого типу при високих температурах. Пунктирна лінія нижче 2 являє собою 10 % активності дикого типу при низькій температурі. На фіг. 39A-D проілюстровані приклади різних класів, що перемикаються, з прикладу 15. На фіг. 39A і С проілюстровані дані для інтеїнових вставок в S158 P77853, а на фіг. 39B і D проілюстровані ДНК для інтеїнових вставок в T134 P77853. Фіг. 39A і В відповідають термообробці при pH 6,5. Фіг. 39C і D відповідають термообробці при pH 7,5. Пунктирна лінія між 2 і 4 на осі активності являє собою 40 % активності дикого типу при високих температурах. Пунктирна лінія нижче 2 являє собою 10 % активності дикого типу при низьких температурах. На фіг. 40 проілюстрована повторна оцінка найбільш добре функціонуючих в прикладі 15 кандидатів (AS-146, AS-2, AS-79, AS-83) і їх порівняння з найменш добре функціонуючим варіантом (AS-8), позитивним контролем (P77853) і контрольним вектором без вставки (pBS). Пунктирна лінія вище 1 на осі активності являє собою 40 % активності дикого типу при високих температурах. Пунктирна лінія нижче 0,5 являє собою 10 % активності дикого типу при низьких температурах. На фіг. 41 проілюстрований вестерн-блотинг найбільш добре функціонуючих кандидатів з ділянкою вставки S158 (AS-2, AS-79, AS-83 і AS-146) і з ділянкою вставки T134 (AT-2, AT-83, AT149, AT-154) P77853. pBS являє собою контрольний вектор без вставки, P77 являє собою позитивний контроль (P77853). Лівий і правий стовпці для кожного позначення зразка являють собою аліквоти при низькій температурі (37 °C/4 години) і при нагріванні (60 °C/4 години) з одного і того ж лізату, відповідно. Стрілки означають модифікованих інтеїном попередників P77853, NC означає положення зрілого білка. На фіг. 42A і В проілюстровані відмінності в активності і в перемиканні в залежності від стійкості до температури. Для інтеїнів з термофільних/гіпертермофільних організмів (правий стовпець для позначення кожного зразка) порівнюють частку кандидатів з високою активністю при високих температурах (фіг. 42A) і більш ніж 2х перемиканням (фіг. 42 B) в порівнянні з інтеїнами з мезофільних/UNK організмів (лівий стовпець для позначення кожного зразка). На фіг. 43A і В проілюстровані відмінності в активності і в перемиканні в залежності від довжини інтеїну. Для інтеїнів з довжиною 240 амінокислот (правий стовпець для кожного зразка). На фіг. 44A-D проілюстрована схожість послідовностей для найбільш вдалих варіантів. На фіг. 44A і С проілюстровано схожість послідовностей для інтеїнових вставок в S158 P77853, а на фіг. 44B і D проілюстрована схожість послідовностей для T134. На фіг. 44A і В проілюстровано схожість послідовностей для термообробки при pH 6,5. На фіг. 44C і D проілюстрована схожість послідовностей для термообробки при pH 7,5 для "найкращих вдалих варіантів" (що класифікуються як >40 % мас. активність або >30 % мас. активність і >2x перемикання) і "відсутність вдалих варіантів" (послідовності, що залишилися). На фіг. 44A-D проілюстрована частка схожих послідовностей (значення Е 1×10 фагових частинок) і 1 мкл 6 фага-помічника ExAssist® (Stratagene) (>1×10 БУО/мкл) поміщають у 15 мл поліпропіленову пробірку. Пробірку інкубують при 37 °C протягом 15 хвилин для забезпечення прикріплення фага до клітин. Після інкубації, додають 3 мл бульйону LB з добавками і суміш інкубують протягом 2,5-3 годин при 37 °C з перемішуванням. Потім суміш нагрівають при 65-70 °C протягом 20 хвилин для лізису частинок фага лямбда і клітин. Після лізису клітинний дебрис осаджують за допомогою центрифугування пробірки протягом 15 хвилин при 1000×g. Супернатант декантують у нову стерильну пробірку. Цей супернатант містить вирізану фагміду у вигляді частинок нитковидного фага. Для висівання вирізаних фагмід у 1,5-мл мікроцентрифужній пробірці 200 мкл свіжовиращених клітин SOLR™ (OD 600=1,0) змішують з 100 мкл супернатанту з фагом. Цю суміш інкубують при 37 °C протягом 15 хвилин, а потім 200 мкл клітинної суміші наносять на чашки з LB-ампіциліном з агаром (100 мкг/мл) і інкубують протягом ночі при 37 °C. Отримані колонії містять вирізану фагміду. Кожна фагміда містить маркер стійкості до ампіциліну для підтримки росту на середовищі, що містить ампіцилін. Після підтвердження за допомогою ПЛР і секвенування ДНК, клони фагміди протягом ночі культивували в аутоіндуктивних середовищах (позначаються також у дійсному документі як AIM, одержуваних як Overnight Express™ Instant TB Medium і доступних у Novagen). Клітини лізували з використанням буфера для лізису FastBreak™ (Promega) і оцінювали на сплайсинг за допомогою вестерн-блотинга. Модифіковані інтеїном ксиланази аналізували на фенотип бляшок на чашках з агаром NZY і на нагромадження попередника і нагромадження зрілої ксиланази з використанням модифікованого способу вестерн-блотинга (описаного нижче в прикладі 5). У P77853, по положеннях S112 (SEQ ID NO: 1696) і S124 (SEQ ID NO: 1697), спрогнозованих як ділянки вставок у прикладі 1 (вище), вставляли інтеїн Psp-pol (SEQ ID NO: 3). Фенотип бляшок для цих положень оцінювали як пермісивний для S112 і непермісивний для S124. На вестерн-блотингу для S112 накопичувалася визначена кількість модифікованого інтеїном попередника ксиланази і деяка кількість зрілої ксиланази. Для S124 накопичувався переважно модифікований інтеїном попередник ксиланази. На додаток до спрогнозованих ділянок, інтеїн Psp-pol також вставляли по декількох інших ділянках. Серед інших тестованих ділянок для S63 (SEQ ID NO: 1692), S86 (SEQ ID NO: 1694), S95 (SEQ ID NO: 1695) і S178 (SEQ ID NO: 1698) утворювалися бляшки, що оцінювали як такі, що володіють фенотипами, що переключаються, з інтеїном Psp-pol. На вестерн-блотингу для цих ділянок при відсутності нагрівання накопичувався модифікований інтеїном попередник ксиланази, а також зріла ксиланаза після термообробки фагового лізату при 70 °C. У P77853, по положеннях S112, T113, S124, T134, T145, S158 і T199, спрогнозованих як ділянки вставок у прикладі 1 (вище), вставляли інтеїн Tag (SEQ ID NO: 90). Бляшки, експресуючі модифіковану інтеїном ксиланазу P77853 з інтеїном Tag оцінювали по їх фенотипу в такий спосіб: S112 (непермісивний), T113 (непермісивний), S124 (непермісивний), T134 (пермісивний), T145 (що, переключається), S158 (непермісивний) і T199 (непермісивний). для вставок S112, T113, S124, T134, T145, S158 і T199 накопичувався модифікований інтеїном Tag попередник ксиланази; однак зріла ксиланаза накопичувалася тільки для T145 і T199. Для інших ділянок вставок на вестерн-блотингу спостерігали інші продукти розщеплення. У ксиланазу P77853, по положеннях S112, T113, S124, T134, T145, S158 і T199, спрогнозованих як ділянки вставок у прикладі 1 (вище), вставляли інтеїн Tth (SEQ ID NO: 91). Фенотип бляшок для цих положень оцінювали в такий спосіб: S112 (пермісивний), S124 (що, переключається), T113 (непермісивний), T134 (що, переключається), S158 (що, переключається), T145 (непермісивний) і T199 (непермісивний). На вестерн-блотингу для ділянок вставок S112, S124, T113, T134, S158, T145 і T199 детектували нагромадження 22 UA 115022 C2 5 10 15 20 25 30 35 40 45 50 55 60 визначеної кількості модифікованого інтеїном попередника ксиланази. Зрілу ксиланазу детектували на вестерн-блотингу для S112, S124, T113, S158 і T145. У ксиланазу P77853, по ділянці вставки S112, спрогнозованій як ділянка вставки в прикладі 1 (вище), вставляли інтеїни міні-Psp-Pol mPsp1L4 (SEQ ID NO:7) і mPsp5L5 (SEQ ID NO:36). Бляшки, експресуючі модифіковану інтеїном ксиланазу P77853, що містить mPsp1L4 або mPsp5L5, при вставці по S112 оцінювали як такі, що володіють непермісивними фенотипами, і не аналізували за допомогою вестерн-блотинга. Подібним чином при вставці в ксиланазу P77853 по S67 інтеїни міні-Psp-Pol mPsp1L4 (SEQ ID NO:7), mPsp1L7 (SEQ ID NO:10), mPsp2L5 (SEQ ID NO:15), mPsp4L3 (SEQ ID NO:27), mPsp5L2 (SEQ ID NO:33), mPsp5L5 (SEQ ID NO:36) і mPsp7L3 (SEQ ID NO:48) приводили до утворення бляшок з непермісивними фенотипами. На відміну від цього при вставці в ксиланазу P77853 по S95 і S178 ті ж інтеїни (mPsp1L4 (SEQ ID NO:7), mPsp1L7 (SEQ ID NO:10), mPsp2L5 (SEQ ID NO:15), mPsp4L3 (SEQ ID NO:27), mPsp5L2 (SEQ ID NO:33), mPsp5L5 (SEQ ID NO:36) і mPsp7L3 (SEQ ID NO:48)) приводили до утворення бляшок з пермісивними фенотипами. У ксиланазу O30700 по положеннях S215, S314 і S357, спрогнозованих у прикладі 1 (вище), вставляли інтеїн Psp-Pol (SEQ ID NO: 3). Фенотип бляшок для інтеїну Psp-pol, вставленого в цих положеннях, оцінювали як непермісивний для S215 і S314, але пермісивний для S357. На відміну від цього, коли в ці ж ділянки вставляли міні-інтеїни Psp-Pol mPsp1L4 (SEQ ID NO:7) і mPsp3L5 (SEQ ID NO:22), фенотип для S314 оцінювали як пермісивний, тоді як S215 і S357 оцінювали як непермісивний. У ксиланазу O30700 по положеннях S95, T137, S215, T250, S358, S314 і S357, спрогнозованих у прикладі 1 (вище), вставляли інтеїн Tth (SEQ ID NO: 91). Фенотип бляшок для фага, експресуючого ксиланазу O30700 із вставленим інтеїном Tth, оцінювали в такий спосіб: S95 (пермісивний), T137 (непермісивний), S215 (непермісивний), T250 (непермісивний), S314 (пермісивний), S357 (непермісивний) і S358 (пермісивний). Інтеїн Mth (SEQ ID NO: 2) і інтеїн Tag (SEQ ID NO: 90) в окремих експериментах роздільно зливали з C-кінцем ксиланази O30700 і отримані модифіковані інтеїнами білки були активними після інкубації протягом ночі при 37 °C, що означало, що злиття C-кінця з інтеїнами Mth і Tag для O30700 було пермісивним. У ксиланазу O43097 по положеннях S47, S50, S109, T111, T126, S130, T134, T151, T152, S158, T164, S170, T208, S213 і S214, спрогнозованих у прикладі 1 (вище), вставляли інтеїн Tth (SEQ ID NO: 91). Фагові бляшки, експресуючі ксиланазу O43097, модифіковану інтеїном Tth, оцінювали по фенотипу в такий спосіб: S47 (пермісивний), T134 (непермісивний), T151 (непермісивний), T152 (непермісивний), S158 (непермісивний), T164 (непермісивний), S170 (непермісивний), T208 (непермісивний), S213 (пермісивний), S214 (пермісивний). В аналізі за допомогою вестерн-блотинга для ділянок вставок S47, S50, S103, T111, S130, T164, S213 і S214 спостерігали модифікований інтеїном Tth попередник ксиланази O43097, а зрілу ксиланазу O43097 спостерігали для S47, S50, S103, S213 і S214. Фагові лізати фагів, експресуючих ксиланазу O43097, модифіковану інтеїном Tth по положеннях T126, T134, T152, S158, за допомогою вестерн-блотингу не аналізували. Як показано вище, вставка інтеїну в прогнозовану ділянку вставки на основі способу, описуваного в даному документі, може приводити до модифікованого інтеїном білку з фенотипом, що переключається. Але спосіб також приводить до пермісивних кандидатів або непермісивних кандидатів, що можуть відщеплюватися або піддаватися сплайсингу. Крім того, до фенотипу, що переключається, може приводити вставка інтеїну в ділянках, відмінних від ділянок, знайдених цим способом. Однак спосіб збагачує сукупність кандидатів ділянками вставок, що з більшою імовірністю приведуть до фенотипу, що переключається. Приклад 4 - Мутагенез модифікованих інтеїнами ферментів. У даній галузі існує множина різних способів мутагенезу білків, але як необмежуючий приклад, для одержання варіантів модифікованих інтеїнами ферментів використовували конкретні різні стратегії, як представлено нижче. У ксиланазу, модифіковану інтеїном ксиланазу або інтеїн із прикладів вище вносили випадкові мутації з використанням набору для мутагенезу Mutazyme® (Stratagene). Щоразу, коли матричну ДНК ампліфікують за допомогою Mutazyme®, існує визначена імовірність внесення мутації в знову синтезовану ДНК. На практиці, визначених пропорцій мутацій досягають, варіюючи кількість матричної ДНК і кількості циклів ПЛР. Спосіб мутагенної ПЛР у даному винаході оптимізували з внесенням 1-2 мутацій амінокислот на інтеїн при модифікації повної касети або частини, що кодує інтеїн. Для мутагенезу всієї касети за допомогою ПЛР ампліфікували п'ять мкг ДНК фагміди NIC протягом 10 циклів з використанням набору GeneMorph® II Random Mutagenesis Kit (Stratagene) 23 UA 115022 C2 5 10 15 20 25 30 35 40 45 50 55 60 із прямим і зворотним праймерами M13 по протоколу виробника. У короткому викладі, п'ять мкг ДНК фагміди NIC для мутагенезу змішують з 1X реакційним буфером для ПЛР, 200 мкМ кожного dNTP, 0,15 мкМ праймерів, комплементарних кінцям ДНК NIC і 2,5 одиницями ДНКполімерази Mutazyme® II у 50 мкл кінцевого об'єму і піддають одному циклу при 95 °C протягом двох хвилин з наступними 10 триетапними термальними циклами з 95 °C протягом 20 секунд, 58 °C протягом 30 секунд і 68 °C протягом трьох хвилин (одна хвилина на тисячу пар основ матриці) з наступним фінальним добудуванням ПЛР при 68 °C протягом 15 хвилин. За етапом ампліфікації для кожної ДНК мутантного NIC проводили 10 циклів ПЛР із клонуючими праймерами з використанням звичайної Taq-полімерази. Отриману, таким чином, бібліотеку ДНК мутантних NIC очищали на гелі з використанням набору QIAquick Gel Extraction (Qiagen), розщеплювали EcoRI і XhoІ (New England Biolabs), очищали на колонці з використанням набору для очищення продуктів ПЛР MinElute (Qiagen), лігували у вектор ZAP® II (Stratagene), упаковували у фаг лямбда, як описано вище, і висівали на агар NZY, як описано вище. Для мутагенезу інтеїну за допомогою ПЛР ампліфікували п'ять мкг плазмідної ДНК, що кодує інтерн, протягом 10 циклів зі специфічними до кінців інтеїну праймерами з використанням набору GeneMorph® II Mutagenesis (Stratagene) за протоколом виробника. У короткому викладі п'ять мкг ДНК інтеїну для мутагенезу змішують 1X реакційним буфером для ПЛР, 200 мкМ кожного dNTP, 0,15 мкМ специфічних до кінців інтеїну праймерів і 2,5 одиницями ДНКполімерази Mutazyme® II у 50 мкл кінцевого об'єму і з одним циклом при 95 °C протягом двох хвилин з наступними 10 триетапними термальними циклами з 95 °C протягом 20 секунд, 58 °C протягом 30 секунд і 68 °C протягом трьох хвилин з наступним фінальним добудуванням ПЛР при 68 °C протягом 15 хвилин. Потім бібліотеку мутантних інтеїнів очищали на гелі з використанням набору QIAquick Gel Extraction (Qiagen). За допомогою ПЛР із використанням звичайної Taq-полімерази одержували N-кінцевий і C-кінцевий фрагменти ксиланази (N і C). ДНК NIC з N і C дикого типу і бібліотеку мутантних інтеїнів, I, збирали способом ПЛР, описаним вище, і клонували у вектор ZAP® II для скринінга бібліотеки на чашках з агаром NZY, як описано вище. Для мутагенезу інтеїнів також одержували бібліотеку синтетичного мутагенезу інтеїну Tth (SEQ ID NO:91). Цю бібліотеку конструювали так, щоб у кожному положенні інтеїну Tth щонайменше один раз була присутня кожна одинична амінокислотна заміна. Після конструювання бібліотеку синтезували за допомогою Genscript. За допомогою ПЛР із використанням звичайної Taq-полімерази одержували N-кінцевий і C-кінцевий фрагменти ксиланази (N і C). ДНК NIC з N і C дикого типу і бібліотеку синтетично мутованого інтеїну Tth, I, збирали способом ПЛР, описаним вище, і клонували для скринінга бібліотеки. Цими способами одержували наступні мутантні бібліотеки: 1. Мутантну бібліотеку всієї касети, де мутагенезу піддавали касету, що містить інтеїн мініPsp-Pol mPsp1L4, вставлений у P77853 по ділянці S67; 2. Мутантну бібліотеку інтеїну, де в P77853 по ділянці S67 вставляли мутантний інтеїн мініPsp-Pol mPsp1L4; 3. Мутантну бібліотеку інтеїну, де в P77853 по ділянці S67 вставляли суміш мутантних інтеїнів міні-Psp-Pol mPsp1L4, mPsp2L5, mPsp3L5, mPsp4L3, mPsp5L5, mPsp5L2 і mPsp7L3; 4. Мутантну бібліотеку інтеїну, де в P77853 по ділянці S112 вставляли мутантний інтеїн мініPsp-Pol mPsp5L5; 5. Мутантну бібліотеку всієї касети, де мутагенезу піддавали касету, що містить інтеїн Tth, вставлений у P77853 по ділянці T134; 6. Мутантну бібліотеку інтеїну, де в P77853 по ділянці T134 вставляли мутантний Tth; 7. Мутантну бібліотеку інтеїну, де в P77853 по ділянці S158 вставляли мутантний Tth; і 8. Мутантну бібліотеку інтеїну, де в O30700 по ділянках S106, S215, S295, S314, S357 або S358 вставляли мутантний інтеїн міні-Psp-Pol mPsp3L5. Приклад 5 - Скринінг бібліотек модифікованих інтеїнами ферментів. Мутантні бібліотеки піддавали скринінгу і кандидати виділяли, очищали і підтверджували. Окремі бібліотеки титрували для вимірювання титру (бляшкоутворюючих одиниць або БУО на мкл) за допомогою серійного розведення в буфері SM (буфер SM можна одержувати, змішуючи 5,8 м NaCl, 2,0 м MgSO4*7H2O, 50,0 мл 1 M Tris-HCl (p 7,5), 5,0 мл 2 % (мас./об.) желатин у кінцевому об'ємі один літр і стерилізуючи в автоклаві) і висівали на чашки з NZY. При скринінгу для ділянок вставок, що оцінювали як відповідні непермісивному фенотипу, таких як інтеїн міні-Psp-Pol mPsp1L4 по ділянці S67 і по ділянці S112 у P77853 або по різних ділянках у O30700, використовували титри фагів з високою щільністю. На 15 см. чашку з 500 мкл клітин XL1-Blue MRF' (OD600=0,5) висівали до 10000 БУО. Для бібліотек, одержуваних з модифікованих інтеїнами ферментів (наприклад, бібліотеки, одержувані на основі вставки інтеїну Tth у P77853 по ділянках T134 і S158), що 24 UA 115022 C2 5 10 15 20 25 30 35 40 45 50 55 60 додають фенотип, що переключається, скринінгу піддавали 2000 БУО на чашку. Кожну бібліотеку висівали на чашки з агаром і інкубували при 37 °C протягом ночі. Бляшки із синіми ореолами маркірували наявність мутацій з пермісивним фенотипом. Потім чашки піддавали серії термообробки (50° протягом 2 годин, а потім 70 °C протягом 2 годин) з індукцією експресії фенотипу фагових бляшок кандидатів. Відбирали окремі бляшки і розчиняли в 500 мкл буферу SM. Проводили серійні розведенняв буфері SM і використовували їх для інфікування клітин XL1-Blue MRF', що потім висівали на чашки з NZY. Чашки інкубували протягом ночі при 37 °C, а потім при 70 °C протягом 2 годин. Фенотипи бляшок підтверджували після інкубації при обох температурах. Виділяли, очищали і підтверджували фенотип більш ніж для 500 кандидатів на основі ксиланази P77853, модифікованої інтеїнами. Серед них приблизно 100 містили вставку інтеїну міні-Psp-Pol по ділянці S67, 70 містили вставку інтеїну M5L5 по ділянці S112, 250 містили вставку інтеїну Tth по ділянці T134 і 75 містили вставку інтеїну Tth по ділянці S158. Для ксиланази O30700 для підтвердження фенотипу і підтвердження за допомогою ПЛР проводили приблизно 50 доборів. Кандидатів з підтвердженим фенотипом індивідуально вирізували у фагміду описаним вище способом. Більшість кандидатів аналізували за допомогою ферментного аналізу. Кандидати, що демонструють температурочутливу активність, що переключається, аналізували за допомогою аналізу за допомогою вестерн-блотинга (сплайсинг) і аналізу послідовності ДНК. Ферментні аналізи на ксиланазну активність проводили в такий спосіб: 1) Інокулювали культури з однієї колонії, що містить вирізану фагміду, і ростили протягом ночі в 1 мл бульйону Луріа (Luria Broth, LB, можна одержувати, змішуючи 10 м NaCl, 10 м бактотриптону і 5 м бактодріжджового екстракту в кінцевому об'ємі один літр, потім доводячи p до 7,0 з використанням 5 Н NaOH і стерилізуючи в автоклаві), доповненому 100 мг/л ампіциліну (AMP, одержуваного в Sigma), при 37 °C і 300 об./хв. 2) 50 мкл клітин переносили в 5 мл у середовище Overnight Express™ Instant TB (яка також називається в даному документі аутоіндуктивним середовищем або AIM і доступної в Novagen) і вирощували протягом ночі при 30 °C і 250 об./хв. 3) Культури центрифугували при 3000 об./хв. протягом 15 хв. 4) Супернатант видаляли і клітинні осади ресуспендували в 200 мкл буфера для лізису (буфер для лізису містить 1x буфера Fast Break Lysis Buffer™ (Promega), 200 мм фосфат натрію p 6,5 і 0,2 мкл ДНКази/мл). 5) Лізат ретельно перемішували і проводили розведення лізату 1:10 у 200 мм фосфаті натрію p 6,5. і 6) 100 мкл кожного розведення використовували для аналізів активності, що проводили на зразках, що піддавали умовам індукції сплайсинга, таким як попередня термообробка, або не піддавали умовам індукції. Для аналізів з попередньою обробкою (PT) зразки лізатів розподіляли на аліквоти рівного об'єму, що інкубували при 37 °C або 55 °C протягом 4 годин, а потім охолоджували на льоді. Потім додавали 20 мкл 0,2 % тонкоподрібненого субстрату AZCL і зразки добре перемішували. Реакціям дозволяли протікати при 37 °C протягом щонайменше однієї години, але іноді протягом ночі. У залежності від модифікованого інтеїном ферменту і його відповідного зрілого ферменту, час, температура, умови і субстрати реакції можуть варіювати. Для аналізів без попередньої обробки (NPT) зразки розподіляли на аліквоти рівного об'єму і змішували з 20 мкл 0,2 % тонкоподрібненого субстрату AZCL. Реакціям дозволяли протікати при 37 °C і при 70 °C протягом терміну до 6 годин. У залежності від модифікованого інтеїном ферменту і його відповідного зрілого ферменту, час, температура, умови і субстрати реакції можуть варіювати. В аналізах з попередньою обробкою (PT) або без попередньої обробки (NPT) після завершення періоду реакції зразки перемішували на центрифузі "вортекс", а потім центрифугували при 4000 об./хв. протягом 7 хвилин. Для кожного зразка використовували 50 мкл супернатанту для вимірювання коефіцієнта поглинання при 590 нм, що є показником того, як активно поводяться фермент або модифікований інтеїном фермент у зразку. Вимірювання коефіцієнта поглинання проводили на спектрофотометрі Thermo Scientific або на багаторежимному мікроспектрофотометрі для зчитування планшетів BioTek Synergy™ у 96- або 384-ямкових круглодонних планшетах для аналізу. Якщо необхідно зразки знову центрифугували для гарантії відсутності захоплення клітинного дебрису і при необхідності проводили 5x або 10x розведення в 200 мм фосфаті натрію з pН 6,5. Аналіз кандидатів з мутантних модифікованих інтеїном ферментів за допомогою вестернблотинга проводили в такий спосіб: 1) протягом ночі при 30 °C і 250 об./хв. вирощували 5 мл культури AIM, а потім центрифугували при 3000 об./хв. протягом 15 хв. 2) супернатант видаляли й осаджені клітини ресуспендували в 200 мкл буфера для лізису (див. вище). 3) лізат ретельно перемішували і проводили розведення 1:50 з використанням 1x фосфатного буфера (PBS 25 UA 115022 C2 5 10 15 20 25 30 35 40 45 50 55 60 можна одержувати, змішуючи 137 ммоль NaCl, 2,7 ммоль KCl, 4,3 ммоль Na 2HPO4 і 1,47 ммоль KH2PO4 у кінцевому об'ємі один літр, доводячи pН до 7,4 за допомогою 2 н NaOH,і стерилізуючи розчин за допомогою фільтрації через фільтр 0,22 мікрон), при цьому невикористаним розчин, що залишився, зберігали при -20 C (у залежності від рівнів експресії й активності може знадобитися більше розведення). 4) Для кожного розведення, 50 мкл кожного розведення переносили в стерильну центрифужну пробірку або пробірку для ПЛР, а потім обробляли при 37 °C або 59 °C протягом 4 годин (у залежності від необхідності об'єм може варіювати, але рекомендується мінімум 15-25 мкл). 5) Додавали рівний об'єм 2X буфера для нанесення (2X буфер для нанесення містить 62,5 мм Tris-Cl pН 6,8, 6 М сечовину, 10 % гліцерин, 2 % SDS, 0,0125 % бромфеноловий синій і 5 % BME); 6) У рівному об'ємі сечовини одержували біотинілований сходовий маркер (об'єм сходового маркера можна розрахувати, множачи кількість гелів для використання на 20 мкл для 18-ямкового гелю (Biorad), або множачи кількість гелів для використання на 15 мкл для 26-ямкового гелю (Biorad)). 7) Зразки добре перемішували на центрифузі "вортекс", а потім наносили на гель (для 18-ямкового гелю Biorad, наносили зразки по 30 мкл, а для 26-ямкового гелю Biorad наносили зразки по 20 мкл). 8) Форез гелю проводили при 150-175 В протягом 1 години, а потім проводили демонтаж. 10) Гель вимочували в 1x буфері для перенесення (Towbin) (25 мМ основи Tris, 192 мМ гліцин і 20 % метанол) протягом 15 хв. 11) Збирали багатошарову конструкцію ватман-PVDF (занурений у метанол)-гель-ватман і зразок переносили за допомогою електроблотингу при 15 В і менше ніж при 600 мА протягом 1 години. 12) Блот видаляли і вміщували в блокувальний розчин, що містить 2 % BSA у TBST (50 мм Tris-HCl, 150 мм NaCl, 0,1 % Tween-20). 13) Блот тримали в блокувальному розчині протягом ночі при 4 °C. 14) блокувальний розчин декантували і додавали розчин первинного антитіла (1 % BSA у TBST з 1:2000 первинного антитіла, що розпізнає детектовані фермент і модифікований інтеїном фермент). 15) Блот 5 разів відмивали TBST протягом 5 хвилин для кожного відмивання. 16) Додавали розчин вторинних антитіл (1 % бичачий сироватковий альбумін (BSA) у TBST з 1:20000 антитіл до біотину з пероксидазою хрону (HRP) і 1:5000 вторинних антитіл до антитіл кролика з HRP) і блот 5 разів відмивали TBST протягом 5 хвилин для кожного відмивання. 17) Блот вміщували в 20 мкл SuperSignal® West Pico Chemiluminescent Substrate (Pierce) на 5 хв, а потім одержували зображення в системі візуалізації гелів G:Box™ (Syngene) з використанням послідовних знімків, 20x з інтервалами 1 хв в умовах Chemi. Секвенування ДНК проводили загальноприйнятими в даній галузі способами. Одержували приблизно 40 кандидатів з бібліотеки (1) (інтеїн міні-Psp-Pol mPsp1L4 у P77853 по ділянці S67, мутагенез усієї касети) і аналізували за допомогою вестерн-блотинга і за допомогою секвенування ДНК. Більше п'ятдесяти відсотків секвенованих кандидатів у C-екстеїні прямо в лінкерній послідовності між з'єднуючим субстрат доменом і каталітичним доменом або після її містили стоп-кодон. Мутагенез усієї касети приводив до одержання великої кількості кандидатів з укороченим білком P77853 з відсутністю всього зв'язуючі вуглеці домену по ділянці вставки S67. Хоча для невеликої кількості кандидатів (m25, m30) спостерігали сплайсовану зрілу ксиланазу, у більшої кількості кандидатів був присутній тільки продукт відщіплення (такий як m3). Мутагенез інтеїнів був більш ефективним для одержання замін амінокислот. У тестованих умовах мутагенної ПЛР у кандидатах міні-Psp-Pol по обох ділянках P77853 S67 і S112 спостерігали в середньому 4 заміни амінокислот. Ці мутації для більшості кандидатів міні-PspPol приводили до розщеплення попередника, але не до сплайсингу інтеїну. Інтеїн Tth за результатами ферментного аналізу й аналізу нагромадження сплайсованого продукту на вестерн-блотинге приводив до одержання ксиланаз на основі модифікованої інтеїном P77853, чуттєвих до температури на чашках з агаром NZY. На основі цього результату кандидати на основі ксиланази, модифікованої інтеїном Tth, характеризували додатково. Для точного вимірювання температурочутливої активності переключення і сплайсинга великого в кількості кандидатів визначали оптимальні умови переключення (температуру і час) цих кандидатів. Спочатку тестували невелику кількість кандидатів на дію на ксиланазну активність умов індукції з попередньою термообробкою. Виявлено, що з ряду протестованих температур (30 °C, 37 °C, 45 °C, 55 °C, 70 °C) і протестованих періодів часу (0,5 години, 1 година, 2 години, 3 години, 4 години, 6 годин і 20 годин) кращими є 55 °C протягом 4 годин. Декілька кандидатів тестували протягом 4 годин при набагато меншому збільшенні температур близько 55 °C. Виявлено, що для всіх кандидатів Tth, тестованих у цих умовах, оптимальною є температура 59 °C. На фіг. 3A-3Lпроілюстровані дані вестерн-блотинга для P77853, модифікованої інтеїном Tth, де інтеїн або вставляють по серину 158 (S158), або по треоніну 134 (T134) ферменту 26 UA 115022 C2 5 10 15 20 25 30 35 40 45 50 P77853. Фенотип на чашці з агаром для кожного зразка позначений зверху кожної доріжки. Фенотипи на чашках з агаром наведені у виді "SW" для фенотипу, що переключається, TSP для фенотипу температура чутливого сплайсера, що переключається, і P для пермісивного фенотипу. На фіг. 3A проілюстрований вестерн-блотинг, що демонструє білок P77853-Tth-S158-2 (SEQ ID NO: 1672), що в аналізі на чашках з агаром демонстрував фенотип, що переключається. На фіг. 3B проілюстрований вестерн-блотинг, що демонструє білок P77853-Tth-S158-4 (SEQ ID NO: 1673), що в аналізі на чашках з агаром також демонстрував фенотип, що переключається. На фіг. 3C проілюстрований вестерн-блотинг, що демонструє білок P77853-Tth-S158-7 (SEQ ID NO: 1674), що в аналізі на чашках з агаром також демонстрував фенотип, що переключається. На фіг. 3D проілюстрований вестерн-блотинг, що демонструє білок P77853-Tth-S158-19 (SEQ ID NO:1675), що демонстрував фенотип температурочутливого сплайсера, що переключається. На фіг. 3E проілюстрований вестерн-блотинг, що демонструє білок P77853-Tth-S158-20 (SEQ ID NO:1676), що в аналізі на чашках з агаром демонстрував пермісивний фенотип. На фіг. 3F проілюстрований вестерн-блотинг, що демонструє білок P77853-Tth-S158-21 (SEQ ID NO:1677), що в аналізі на чашках з агаром демонстрував фенотип, що переключається. На фіг. 3G проілюстрований вестерн-блотинг, що демонструє білок P77853-Tth-S158-25 (SEQ ID NO:1678), який демонстрував фенотип температурочутливого сплайсера, що переключається. На фіг. 3H проілюстрований вестерн-блотинг, що демонструє білок P77853-Tth-S158-38 (SEQ ID NO:1679), який демонстрував фенотип температурочутливого сплайсера, що переключається. На фіг. 3I проілюстрований вестерн-блотинг, що демонструє білок P77853-Tth-S158-39 (SEQ ID NO:1680), який демонстрував фенотип температурочутливого сплайсера, що переключається. На фіг. 3J проілюстрований вестерн-блотинг, що демонструє білок P77853-Tth-S158-42 (SEQ ID NO:1681), який демонстрував фенотип температурочутливого сплайсера, що переключається. На фіг. 3K проілюстрований вестерн-блотинг, що демонструє білок P77853-Tth-S158-138 (SEQ ID NO:1691), який демонстрував фенотип температурочутливого сплайсера, що переключається. На фіг. 3L проілюстрований вестерн-блотинг, що демонструє білок P77853-Tth-T134-1 (SEQ ID NO:1629) (панель 1), білок P77853-Tth-T134-2 (SEQ ID NO:1630) (панель 2), білок P77853-TthT134-3 (SEQ ID NO:1631) (панель 3), білок P77853-Tth-T134-9 (SEQ ID NO:1632) (панель 9), білок P77853-Tth-T134-91 (SEQ ID NO:1644) (панель 91), білок P77853-Tth-T134-48 (SEQ ID NO:38) (панель 48), білок P77853-Tth-T134-80 (SEQ ID NO:1640) (панель 80) і білок P77853-TthT134-95 (SEQ ID NO:1645) (панель 95), що піддавали попередній термообробці при 37 °C (ліва доріжка в кожній із зазначених раніше панелей) і 70 °C (права доріжка в кожній з зазначених раніше панелей) протягом однієї години. Також представлені доріжки, що містять білок з контрольного вектора без вставки (VCT) і білок P77853 дикого типу (P77), що піддавали попередній термообробці таким же способом. Фенотип кожного білка приведений зверху відповідної йому доріжки. На основі ферментного аналізу і даних вестерн-блотинг на фіг. 3A-3L, інкубація при температурах від 55 °C до 70 °C протягом 4 годин збільшує сплайсинг інтеїну в багатьох кандидатів на основі ксиланази P77853, модифікованої інтеїном Tth. Кандидати T134 зі збільшеним сплайсингом інтеїну за результатами вестерн-блотинга тестували в аналізі в рідкій фазі з використанням попередньої обробки при 37 °C або попередньої обробки при 59 °C (PT) протягом чотирьох годин з наступною 12-годинною реакцією із субстратом при 37 °C. Альтернативно, для кожного з них не проводили попередньої обробки (NPT) і проводили реакцію при 37 °C або 70 °C протягом 5 годин. Результати приведені в таблиці 3, нижче. Активність кількісно визначають в аналізі, де вимірюють вивільнення барвника з міченого субстрату і виражають в умовних одиницях коефіцієнта поглинання, вимірюваних на спектрофотометрі або спектрофотометр для зчитування планшетів при довжині хвилі 590 нм. Відсоток у дужках у колонку для 59 °C означає кратність зміни активності для PT при 59 °C у порівнянні з PT при 37 °C, що розраховували як кратність зміни=([(активність після PT при 59 °C)/(активність після PT при 37 °C)]-1)×100. Н.о. означає не визначали. 27 UA 115022 C2 Таблиця 3 Модифікований інтеїном білок Т134-1 Т134 - 2 Т134 - 3 Т134 - 9 Т134-12 Т134-36 Т134 - 42 Послідовність SEQ ID N0: 1629 SEQ ID NO: 1630 SEQ ID NO: 1631 SEQ ID NO: 1632 SEQ ID NO: 1633 SEQ ID NO: 1634 SEQ ID NO: Активність з Активність з Активність при Активність при РТ при 37 °C РТ при 59 °C і NPT і реакція NPT і реакція і реакція при реакція при при 37 °C при 70 °C 37 °C 37 °C 1.275 3.140 (146%) 2.746 (72%) 0.983 (251%) 1.595 0.280 Н.О. Н.О. 2.090 (38%) 1.597 (144%) 1.264 1.515 0.653 0.537 28 0.203 3.75 0.209 3.771 0.368 1.711 Н.О. Н.О. 0.349 3.748 0.193 5.734 0.165 6.830
ДивитисяДодаткова інформація
Автори англійськоюShen, Binzhang, Lazar, Gabor, de la Vega, Humberto, Apgar, James, Lessard, Phillip, Raab, R., Michael
Автори російськоюШень Биньчжан, Лазар Габор, де ла Вега Умберто, Эпгар Джеймс, Лессард Филлип, Рааб Р. Майкл
МПК / Мітки
МПК: A01H 5/00, C12N 9/14, C12N 9/42, C12Q 1/34, C12N 15/63
Мітки: кислоту, має, яка, послідовність, містить, кодує, ксиланазу, нуклеотидну, модифіковану, інтеїном, трансгенна, виділену, нуклеїнову, рослина
Код посилання
<a href="https://ua.patents.su/4022-115022-transgenna-roslina-yaka-mistit-nuklenovu-kislotu-shho-maeh-vidilenu-nukleotidnu-poslidovnist-yaka-kodueh-modifikovanu-intenom-ksilanazu.html" target="_blank" rel="follow" title="База патентів України">Трансгенна рослина, яка містить нуклеїнову кислоту, що має виділену нуклеотидну послідовність, яка кодує модифіковану інтеїном ксиланазу</a>
Попередній патент: Хвильова електростанція
Випадковий патент: Спосіб панкреатоєюноанастомії при панкреатодуоденальній резекції