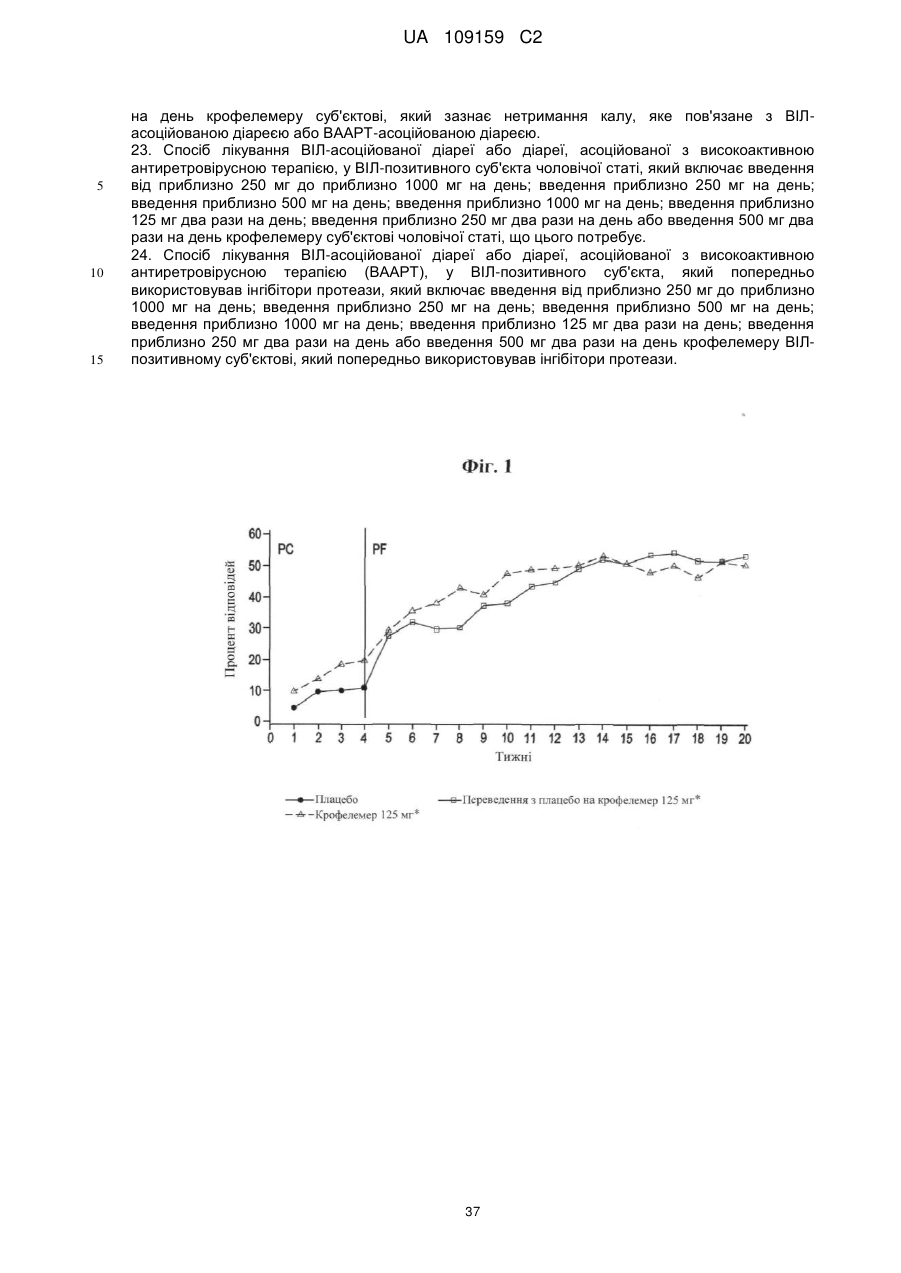
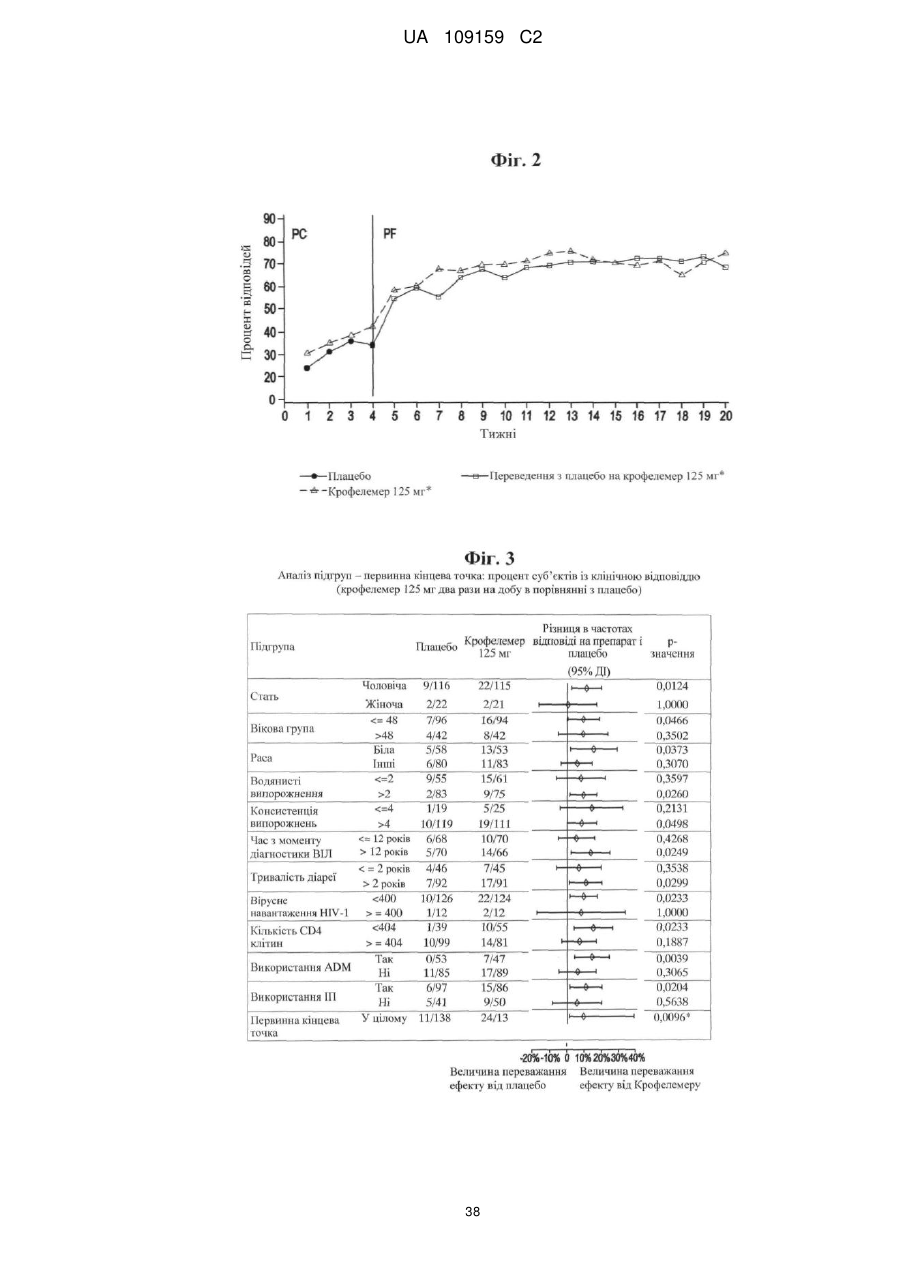
Способи і композиції для лікування віл-асоційованої діареї
Номер патенту: 109159
Опубліковано: 27.07.2015
Автори: Борті Еноч, Чатурведі Превін, Форбс Вільям, Кінг Стівен
Формула / Реферат
1. Спосіб лікування ВІЛ-асоційованої діареї або діареї, асоційованої з високоактивною антиретровірусною терапією (ВААРТ), у ВІЛ-позитивного суб'єкта, який включає: введення від приблизно 250 мг до приблизно 1000 мг на день; введення приблизно 250 мг на день; введення приблизно 500 мг на день; введення приблизно 1000 мг на день; введення приблизно 125 мг два рази на день; введення приблизно 250 мг два рази на день; або введення приблизно 500 мг два рази на день крофелемеру ВІЛ-позитивному суб'єктові.
2. Спосіб покращення консистенції випорожнень у ВІЛ-позитивного суб'єкта, який включає: введення від приблизно 250 мг до приблизно 1000 мг на день; введення приблизно 250 мг на день; введення приблизно 500 мг на день; введення приблизно 1000 мг на день; введення приблизно 125 мг два рази на день; введення приблизно 250 мг два рази на день; або введення приблизно 500 мг два рази на день крофелемеру ВІЛ-позитивному суб'єктові.
3. Спосіб полегшення водянистої діареї у ВІЛ-позитивного суб'єкта, який включає:
введення від приблизно 250 мг до приблизно 1000 мг на день; введення приблизно 250 мг на день; введення приблизно 500 мг на день; введення приблизно 1000 мг на день; введення приблизно 125 мг два рази на день; введення приблизно 250 мг два рази на день; або введення приблизно 500 мг два рази на день крофелемеру ВІЛ-позитивному суб'єктові.
4. Спосіб зменшення кількості випорожнень на день у ВІЛ-позитивного суб'єкта, який включає: введення від приблизно 250 мг до приблизно 1000 мг на день; введення приблизно 250 мг на день; введення приблизно 500 мг на день; введення приблизно 1000 мг на день; введення приблизно 125 мг два рази на день; введення приблизно 250 мг два рази на день; або введення приблизно 500 мг два рази на день крофелемеру ВІЛ-позитивному суб'єктові.
5. Спосіб за будь-яким із пп. 1-4, у якому введення здійснюється від приблизно 1 місяця до приблизно 6 місяців.
6. Спосіб за будь-яким із пп. 1-4, у якому введення здійснюється від приблизно 3 днів до 6 місяців.
7. Спосіб за будь-яким із пп. 1-4, у якому покращення симптомів починається на 3
день.
8. Спосіб за будь-яким із пп. 1-4, у якому покращення симптомів збільшується при більш довгій тривалості приймання після дня 3.
9. Спосіб за будь-яким із пп. 1-4, у якому суб'єкт є європеоїдом або має латиноамериканське походження.
10. Спосіб за будь-яким із пп. 1-4, у якому крофелемер вводять протягом 8 днів.
11. Спосіб за будь-яким із пп. 1-4, у якому крофелемер вводять у проміжку від 8 днів до 24 тижнів.
12. Спосіб за будь-яким із пп. 1-4, у якому введення відбувається протягом приблизно 6 місяців.
13. Спосіб за будь-яким із пп. 1-4, у якому введення відбувається приблизно 6 місяців або довше.
14. Спосіб за будь-яким із пп. 1-4, у якому введення відбувається протягом тривалості ВІЛ-інфекції.
15. Спосіб за будь-яким із пп. 1-4, 11 і 14, у якому відповідь на лікування збільшується після того, як крофелемер вводили протягом більше 4 місяців.
16. Спосіб за п. 1, у якому суб'єкт вважається вилікуваним, якщо суб'єкт демонструє зменшення кількості випорожнень на день на одне або більше, зменшення кількості водянистих випорожнень на день, покращення щоденної оцінки болю або дискомфорту в животі, покращення щоденної оцінки консистенції випорожнень, консистенцію випорожнень, що веде до сформованого випорожнення від водянистого випорожнення, зменшення числа днів на тиждень, у які суб'єкт зазнає невідкладних позивів до дефекації, зменшення числа днів на тиждень, у які суб'єкт зазнає нетримання калу, зменшення незапланованих візитів із приводу значного погіршення діареї.
17. Спосіб за п. 2, в якому суб'єкт вважається вилікуваним, якщо суб'єкт демонструє покращення щоденної оцінки консистенції випорожнень.
18. Спосіб за п. 2, в якому суб'єкт вважається вилікуваним, якщо суб'єкт демонструє консистенцію випорожнень, що веде до сформованого випорожнення від водянистого випорожнення.
19. Спосіб за п. 3, в якому суб'єкт вважається вилікуваним, якщо суб'єкт демонструє зменшення кількості водянистих випорожнень на день.
20. Спосіб за п. 4, у якому суб'єкт вважається вилікуваним, якщо суб'єкт демонструє зниження кількості випорожнень на день.
21. Спосіб за будь-яким із пп. 16-20, у якому збільшені або зменшені симптоми вимірювалися від початкового рівня.
22. Спосіб зменшення кількості днів на тиждень, у які суб'єкт зазнає нетримання калу, пов'язане з ВІЛ-асоційованою діареєю або ВААРТ-асоційованою діареєю, який включає введення від приблизно 250 мг до приблизно 1000 мг на день; введення приблизно 250 мг на день; введення приблизно 500 мг на день; введення приблизно 1000 мг на день; введення приблизно 125 мг два рази на день; введення приблизно 250 мг два рази на день або введення 500 мг два рази на день крофелемеру суб'єктові, який зазнає нетримання калу, яке пов'язане з ВІЛ-асоційованою діареєю або ВААРТ-асоційованою діареєю.
23. Спосіб лікування ВІЛ-асоційованої діареї або діареї, асоційованої з високоактивною антиретровірусною терапією, у ВІЛ-позитивного суб'єкта чоловічої статі, який включає введення від приблизно 250 мг до приблизно 1000 мг на день; введення приблизно 250 мг на день; введення приблизно 500 мг на день; введення приблизно 1000 мг на день; введення приблизно 125 мг два рази на день; введення приблизно 250 мг два рази на день або введення 500 мг два рази на день крофелемеру суб'єктові чоловічої статі, що цього потребує.
24. Спосіб лікування ВІЛ-асоційованої діареї або діареї, асоційованої з високоактивною антиретровірусною терапією (ВААРТ), у ВІЛ-позитивного суб'єкта, який попередньо використовував інгібітори протеази, який включає введення від приблизно 250 мг до приблизно 1000 мг на день; введення приблизно 250 мг на день; введення приблизно 500 мг на день; введення приблизно 1000 мг на день; введення приблизно 125 мг два рази на день; введення приблизно 250 мг два рази на день або введення 500 мг два рази на день крофелемеру ВІЛ-позитивному суб'єктові, який попередньо використовував інгібітори протеази.
Текст
Реферат: Винахід стосується способу лікування ВІЛ-асоційованої діареї або діареї, асоційованої з високоактивною антиретровірусною терапією (ВААРТ), у ВІЛ-позитивного суб'єкта, який включає: введення від приблизно 250 мг до приблизно 1000 мг на день крофелемеру. UA 109159 C2 (12) UA 109159 C2 UA 109159 C2 5 10 15 20 25 30 35 40 45 50 55 Родинні заявки За даною заявкою заявляється пріоритет згідно з попередньою заявкою 61/408,622, поданою 31 жовтня 2010; попередньою заявкою США 61/409,335, поданою 2 листопада 2010; попередньою заявкою США 61/416,249, поданою 22 листопада 2010; і попередньою заявкою США 61/434,379, поданою 19 січня 2011 року. Увесь зміст кожної з цих заявок включений до даного опису за допомогою посилання. Рівень техніки Діарея залишається важливою проблемою для ВІЛ-інфікованих суб'єктів у епоху високоактивної антиретровірусної терапії (ВААРТ), яка негативно позначається на якості життя, незважаючи на широке використання анти-діарейних препаратів. Причин тому безліч і вони включають ВІЛ-ентеропатію, надмірний розвиток нетипових мікробних агентів, злоякісність поширених кишкових патогенів і побічні ефекти власне ВААРТ терапії (Kartalija 1999). У той час як визначення і способи звітності змінюються, встановлено, що близько половини всіх ВІЛ-СНІД суб'єктів мають діарею в якийсь момент під час їхньої хвороби. Хоча захворюваність діареєю не змінювалася протягом впровадження ВААРТ, етіологія діареї значно змінилася з ростом неінфекційних причин і зниження опортуністичних інфекційних захворювань. Лікування діареї допоможе в підвищенні загальної ефективності противірусної лікарської терапії, а також якості життя і контролю втрати маси у ВІЛ-позитивних хворих. Діарея може призвести до зниження схильності до антиретровірусного лікування і/або призвести до необхідності переключати АРВ схеми. Діарея також супроводжується зниженням рівня антиретровірусних лікарських препаратів, що підтверджує, що адекватне лікування покращить абсорбцію АРВ препаратів. На популяційному рівні дотримання режиму лікування лікарськими препаратами і підтримання адекватного рівня АРВ є важливими для мінімізації розвитку стійких до ліків штамів вірусу. Таким чином, асоційована з лікарськими препаратами діарея у ВІЛпозитивних хворих являє собою важливу й незадоволену клінічну потребу, яка потребує більш ефективної тактики ведення. У даний час запропоноване лікування є ефективним тільки частково або ускладнюється небажаними побічними ефектами, такими як запор, і можливістю звикання. Розробка лікарського засобу для лікування ВІЛ-асоційованої діареї з низьким потенціалом для лікарської взаємодії, низьким впливом на метаболізм лікарських препаратів або низьким адиктивним потенціалом могла б призвести до значної користі для ВІЛ-інфікованих суб'єктів. Сутність винаходу У даному винаході описуються способи профілактики, полегшення і/або лікування діареї. У одному з варіантів представлені в даному винаході способи запобігають, полегшують або лікують ВІЛ-асоційовану діарею та діарею, асоційовану з високоактивною антиретровірусною терапією (ВААРТ). У одному аспекті, представленому в даному винаході, способи лікування ВІЛ-асоційованої діареї або діареї, асоційованої з високоактивною антиретровірусною терапією (ВААРТ), у ВІЛінфікованого суб'єкта включають введення від близько 250 мг до близько 1000 мг на день; введення близько 250 мг на день; введення близько 500 мг на день; введення близько 1000 мг на день; введення близько 125 мг два рази на день; введення близько 250 мг два рази на день або введення 500 мг два рази на день крофелемеру суб'єктові, що цього потребує. У одному аспекті в даному винаході представлені способи лікування консистенції випорожнень у ВІЛ-інфікованого суб'єкта, які включають введення від близько 250 мг до близько 1000 мг на день; введення близько 250 мг на день; введення близько 500 мг на день; введення близько 1000 мг на день; введення близько 125 мг два рази на день; введення близько 250 мг два рази на день або введення 500 мг два рази на день крофелемеру суб'єктові, що цього потребує. У одному аспекті в даному винаході представлені способи покращення консистенції випорожнень у ВІЛ-інфікованого суб'єкта, які включають введення від близько 250 мг до близько 1000 мг на день; введення близько 250 мг на день; введення близько 500 мг на день; введення близько 1000 мг на день; введення близько 125 мг два рази на день; введення близько 250 мг два рази на день або введення 500 мг два рази на день крофелемеру суб'єктові, що цього потребує. У одному аспекті в даному винаході представлені способи полегшення водянистої діареї у ВІЛ-інфікованого суб'єкта, які включають введення від близько 250 мг до близько 1000 мг на день; введення близько 250 мг на день; введення близько 500 мг на день; введення близько 1000 мг на день; введення близько 125 мг два рази на день; введення близько 250 мг два рази на день або введення 500 мг два рази на день крофелемеру суб'єктові, що цього потребує. 1 UA 109159 C2 5 10 15 20 25 30 35 40 45 50 55 У одному аспекті в даному винаході представлені способи зниження кількості випорожнень на день у ВІЛ-позитивного суб'єкта, які включають введення від близько 250 мг до близько 1000 мг на день; введення близько 250 мг на день; введення близько 500 мг на день; введення близько 1000 мг на день; введення близько 125 мг два рази на день; введення близько 250 мг два рази на день або введення 500 мг два рази на день крофелемеру суб'єктові, що цього потребує. У одному варіанті здійснення введення відбувається протягом від близько 1 місяця до близько 5 місяців. У одному варіанті здійснення введення відбувається протягом від близько 1 місяця до близько 6 місяців. У одному варіанті здійснення введення відбувається близько 6 місяців. У іншому варіанті здійснення введення відбувається 6 або більше місяців. У одному варіанті здійснення введення проходить від близько 3 днів до 5 місяців. У одному варіанті здійснення введення проходить від близько 3 днів до 6 місяців. У одному варіанті здійснення покращення симптомів починається на 3 день. У одному варіанті здійснення покращення симптомів збільшується з більш довгою тривалістю введення після 3 дня. У одному з варіантів здійснення суб'єкт є європеоїдом або має латиноамериканське походження. У одному варіанті здійснення крофелемер вводять протягом 8 днів. У одному варіанті здійснення крофелемер вводять від проміжку між 8 і 24 тижнями до проміжку від 8 днів до 26 тижнів. У одному варіанті здійснення суб'єкт вважається вилікуваним, якщо суб'єкт демонструє зменшення кількості випорожнень на день на одне або більше, зменшення кількості водянистих випорожнень на день, покращення щоденної оцінки болю або дискомфорту в животі, покращення щоденної оцінки консистенції випорожнень, покращення оцінки консистенції випорожнень (від водянистого до сформованого), зменшення числа днів на тиждень, у які суб'єкт зазнає невідкладних позивів до дефекації, зменшення числа днів на тиждень, у які суб'єкт зазнає нетримання калу, або зменшення незапланованих візитів з приводу значного погіршення діареї. У одному варіанті здійснення суб'єкт вважається вилікуваним, якщо суб'єкт демонструє покращення оцінки для щоденної консистенції випорожнень. У одному варіанті здійснення суб'єкт вважається вилікуваним, якщо суб'єкт демонструє зниження консистенції випорожнень. У одному варіанті здійснення суб'єкт вважається вилікуваним, якщо суб'єкт демонструє зменшення кількості водянистих випорожнень на день. У одному варіанті здійснення суб'єкт вважається вилікуваним, якщо суб'єкт демонструє зниження кількості випорожнень на день. У одному варіанті здійснення, збільшення або зменшення симптомів вимірюється від початкового рівня. У одному варіанті здійснення введення відбувається протягом близько 5 місяців. У іншому варіанті здійснення введення відбувається протягом близько 6 місяців. У одному варіанті здійснення введення відбувається близько 5 місяців або довше. У іншому варіанті здійснення введення відбувається близько 6 місяців або довше. У одному варіанті здійснення введення відбувається протягом тривалості ВІЛ-інфекції. У одному варіанті здійснення відповідь на лікування збільшується після того, як крофелемер вводили протягом більше 4 місяців. Інші варіанти здійснення розкриті нижче. Короткий опис креслень На Фіг. 1 показані суб'єкти з клінічною відповіддю в перехресному дослідженні фази без плацебо-контролю на вибірці для оцінки безпеки. На Фіг. 2 показані суб'єкти з відповіддю за консистенцією випорожнень у перехресному дослідженні фази без плацебо-контролю на вибірці для оцінки безпеки. На Фіг. 3 зображений аналіз підгрупи, який показує різницю в результатах лікування у відсотках суб'єктів, що відповіли на лікування (крофелемер 125 мг два рази на добу в порівнянні з плацебо), з відповідними довірчими інтервалами і р-величинами. Докладний опис винаходу Розкриті в даному винаході способи включали введення ефективних кількостей проантоціанідинових полімерів, наприклад, крофелемеру, суб'єктам, наприклад, із ВІЛасоційованою діареєю або з діареєю, асоційованою з високоактивною антиретровірусною терапією (ВААРТ). 2 UA 109159 C2 5 10 15 20 25 30 35 40 45 50 55 60 Проантоціанідини являють собою групу конденсованих танінів. Сирі екстракти з лікарських рослин, наприклад, Pycanthus angolenis і Baphia Nitida, як було показано, мають антидіарейні властивості у випробуваннях на тваринах (Onwukaeme and Anuforo, 1993, Discovery and Innovation, 5:317; Onwukaeme and Lot, 1991, Phytotherapy Res., 5:254). Сирі екстракти, які містять таніни, зокрема екстракти зі стручків ріжкового дерева й солодкого каштана, були запропоновані як профілактика або лікування (патент США № 5043160; Європейський патент № 481396). Проантоціанідини містять щонайменше дві або більше мономерних ланок, які можуть бути однаковими або різними мономерними структурами. Мономерні одиниці (загальна назва "лейкоантоціанідин"), як правило, є мономерними флавоноїдами, які включають катехіни, епікатехіни, галокатехіни, галоепікатехіни, флаваноли, флавоноли і флаван-3,4-діоли, лейкоціанідини і антоціанідини. Таким чином, полімерні ланцюги основані на різних структурних одиницях, які створюють значні варіації полімерних проантоціанідинів і велику кількість можливих ізомерів (Hemingway et al., 1982, J. C. S. Perkin, 1:1217). Більші полімери флавоноїд3-олових одиниць є переважаючими в більшості рослин і, як було виявлено, мають середню молекулярну масу більше 2000 дальтон та містять 6 або більше одиниць (Newman et al., 1987, Mag. Res. Chem., 25:118). Проантоціанідинові полімери були знайдені в найрізноманітніших рослинах, особливо рослинах із деревним характером росту (наприклад, Croton spp. і Calophyllum spp.). Велика кількість різних видів дерев Croton, у тому числі Croton sakutaris, Croton gossypifolius, Croton palanostima, Croton lechleri, Croton erythrochilus і Croton draconoides, знайдені в Південній Америці, продукують червоний в'язкий латексний сік, називаний Sangre de Drago або "Dragon's Blood". Патент США № 5211944 вперше описав виділення водорозчинних проантоціанідинових полімерних композицій із Croton spp. і застосування композиції як антивірусного агента (див. також Ubillas et al., 1994, Phytomedicine, 1:77). Було показано, що проантоціанідинова полімерна композиція має антивірусну активність проти різних вірусів, включаючи респіраторносинцитіальний, віруси грипу, парагрипу і герпесу. Патент США № 5211944 також розкриває виділення водорозчинної проантоціанідинової полімерної композиції з Calophyllum inophylum і застосування цієї композиції як противірусного агента. Типові проантоціанідинові полімерні композиції, використовувані в способах, представлених у даному винаході, переважно виділяють із Croton spp. або Calophyllum spp. будь-яким способом, відомим у даній області техніки. Наприклад, проантоціанідинова полімерна композиція може бути виділена з Croton spp. або Calophyllum spp. способом, розкритим у патенті США № 5211944 або в Ubillas et al., 1994, Phytomedicine 1: 77-106. Проантоціанідинові полімерні композиції, які використовуються в способах, представлених у даному винаході, також можуть бути отримані in vitro з використанням синтетичних методик. У одному конкретному варіанті здійснення проантоціанідинова полімерна композиція, яка використовується в способах, представлених у даному винаході, є крофелемером. Крофелемер являє собою олігомерний проантоціанідин, екстрагований і очищений із червоного в'язкого латексу рослини Croton lechleri сімейства Euphorbiace. Рослина широко розповсюджена по всій тропічній Центральній і Південній Америці й широко відома етноботанікам і місцевим цілителям своїми цілющими властивостями (Mcrae 1988), у тому числі для лікування діареї. Крофелемер, як вважають, виявляє свій антидіарейний ефект через люмінальну блокаду CFTR (муковісцидозного трансмембранного регулятора провідності) хлоридного (Cl ) каналу. Крофелемер продемонстрував активність in vitro проти холерного токсину, форсколіну, E. coli LT і STa токсин-опосередкованої секреції Cl- та для нормалізації акумуляції електроліту і рідини в мишах, що одержували CT-лікування (Gabriel 1999, Fischer 2004, Adam 2005), через його ефекти на CFTR-канал. Крофелемер також значно покращував секреторну діарею у людей внаслідок ентеротоксигенної E. coli (Dicesare 2002), яка також, як вважають, викликає секреторну діарею за допомогою активації CFTR (Kunzelmann 2002). Блокада CFTR-каналу, як можна очікувати, має негативні наслідки у людини, навіть нагадуючи муковісцидоз. Проте, крофелемер практично не має системної біодоступності у людини. Під час досліджень результати показали, що крофелемер мало або зовсім не абсорбується зі шлунково-кишкового тракту і що крофелемер добре переноситься здоровими чоловічими особинами. Таким чином, місцем прикладання дії крофелемеру є місцеве застосування в шлунково-кишковому тракті. Крофелемер (CAS 148465-45-6) є олігомерним проантоціанідином з різною довжиною ланцюга, одержуваним із Dragon's Blood Croton lecheri сімейства молочайних. Крофелемер має середню молекулярну масу від близько 1500 дальтон до близько 2900 дальтон. Мономери, що містять крофелемер, включають катехін, епікатехін, галокатехін і епігалокатехін. Довжина 3 UA 109159 C2 ланцюга крофелемеру перебуває в діапазоні від близько 3 до близько 30 одиниць із середньою довжиною ланцюга близько 8 одиниць. Структура крофелемеру показана нижче. 5 10 15 20 25 30 35 Де середній n=6. Інший спосіб виділення крофелемеру можна знайти в патентній публікації США № 2005/0019389, зміст якої явно включений до даного патенту. У інших варіантах здійснення початковий латекс, одержуваний із видів Croton або видів Calophyllum, або екстракту, отриманого з видів Croton або видів Calophyllum, є корисним у способах, представлених у даному винаході. Приклади екстрактів описані в Persinos et al., 1979, J. Pharma. Sci. 68:124 and Sethi, 1977, Canadian J. Pharm. Sci. 12:7. "Покращити", "покращення", "оздоровлення" або тому подібне відноситься, наприклад, до детектованих покращень або детектованих змін відповідно до оздоровлення, яке відбувається у суб'єкта або щонайменше у меншої частини суб'єктів, наприклад, щонайменше у близько 2 %, 5 %, 10 %, 15 %, 20 %, 25 %, 30 %, 40 %, 50 %, 60 %, 70 %, 75 %, 80 %, 85 %, 90 %, 95 %, 98 %, 100 % або в інтервалі приблизно між будь-якими двома з цих значень. Такі покращення або зміни можна спостерігати у суб'єктів, що одержували лікування (оброблених), в порівнянні з суб'єктами, що не одержували лікування крофелемером, де необроблені суб'єкти мають або можуть отримати таке ж або аналогічне захворювання, стан, симптом або подібне перерахованому вище. Покращення захворювання, стану, симптому або параметра аналізу може бути визначене суб'єктивно або об'єктивно, наприклад, за допомогою самооцінки суб'єкта(ів), за оцінкою лікаря або за допомогою проведення відповідного аналізу чи вимірювання. Покращення може бути тимчасовим, тривалим чи постійним, або воно може змінюватися у відповідний час у процесі або після того, як крофелемер введуть суб'єктові чи використовують у аналізі або іншим описаним у даному винаході або цитованому посиланні способом, наприклад, протягом термінів, описаних нижче, або від близько 1 години після введення чи використання крофелемеру до приблизно 7 днів, 2 тижнів, 28 днів або 1, 3, 6, 9 місяців чи більше після того, як суб'єкт(и) одержав(ли) подібну обробку. "Модуляція", наприклад, симптому, рівня чи біологічної активності молекули або т.п. означає, наприклад, що симптом чи активність або тому подібне детектовано збільшується або зменшується. Таке збільшення або зменшення може спостерігатися у суб'єктів, що одержували лікування, у порівнянні з суб'єктами, не обробленими крофелемером, де необроблені суб'єкти мають або можуть отримати таке ж або аналогічне захворювання, стан, симптом або подібне перерахованому. Такі збільшення або зменшення можуть бути щонайменше близько на 2 %, 5 %, 10 %, 15 %, 20 %, 25 %, 30 %, 40 %, 50 %, 60 %, 70 %, 75 %, 80 %, 85 %, 90 %, 95 %, 98 %, 100 %, 150 %, 200 %, 250 %, 300 %, 400 %, 500 %, 1000 % або більше, або в будь-якому діапазоні між будь-якими двома з цих значень. Модуляція може бути визначена суб'єктивно або 4 UA 109159 C2 5 10 15 20 25 30 35 40 45 50 55 60 об'єктивно. Модуляція може бути тимчасовою, тривалою або постійною, або вона може варіюватися у відповідний час у процесі або після того, як крофелемер введуть суб'єктові чи використають у аналізі або іншим описаним у даному винаході чи цитованому посиланні способом, наприклад, протягом термінів, описаних нижче, або від близько 1 години після введення чи використання крофелемеру до приблизно 2 тижнів, 28 днів, 3, 6, 9 місяців або більше після того, як суб'єкт(и) одержав(ли) крофелемер. Вираз "профілактично ефективна кількість" сполуки означає кількість крофелемеру, яка є ефективною після однієї або декількох доз введення суб'єктові для запобігання або лікування діареї, наприклад, ВІЛ-асоційованої діареї. Використовуваний у даному винаході термін "суб'єкт" включає організми, які здатні страждати ВІЛ-діареєю чи ВААРТ-асоційованою діареєю або які могли б мати користь із введення крофелемеру, як описано в даному винаході, такі як люди і тварини, що не належать до людського роду. Термін "тварини, що не належать до людського роду" включає всіх хребетних, наприклад, ссавців, таких як примати, крім людини, інших ссавців, наприклад, гризунів і овець, собак і корів, які піддаються ризику ВІЛ-асоційованої діареї або ВААРТасоційованої діареї. Суб'єкт із ризиком ВІЛ-асоційованої діареї або ВААРТ-асоційованої діареї означає включення суб'єкта з ризиком розвитку або зараження інфекцією ВІЛ. Вираз "профілактично ефективна кількість" сполуки означає кількість крофелемеру, яка є ефективною після однієї або декількох доз введення суб'єктові для запобігання або лікування діареї. Термін "введення" або "який вводиться" включає способи введення крофелемеру суб'єктові для здійснення призначеної йому функції. Приклади способів введення, які можуть бути використані, включають ін'єкції, пероральний, інгаляції, вагінальний, ректальний і трансдермальний. Фармацевтичні препарати можуть визначатися формою, підходящою для кожного способу введення. Наприклад, ці препарати вводяться в формі таблетки або капсули, ін'єкції, інгаляції, мазі або супозиторію. Введення також може здійснюватися за допомогою ін'єкції, інфузії або інгаляції; місцево за допомогою лосьйона або мазі, а також ректально за допомогою супозиторіїв. Переважним є пероральне введення. Залежно від способу введення, крофелемер може бути покритий або він може бути поміщений до обраного матеріалу для захисту від природних умов, які можуть негативно впливати на його здатність виконувати свої функції. Крофелемер можна вводити окремо або в комбінації з будь-яким іншим препаратом або препаратами, як описано вище, або з фармацевтично прийнятним носієм, або з обома. Типові форми з кишковорозчинними оболонками крофелемеру описані, наприклад, у патенті США 7556831. Введення "в комбінації з" одним або більше додатковими терапевтичними препаратами включає одночасне (сумісне) і послідовне введення в будь-якому порядку. Як повинно бути очевидним фахівцям у даній області техніки, корисне in vivo дозування для введення і конкретний спосіб введення можуть варіюватися в залежності від віку, маси і виду ссавця, якого лікують, конкретних використовуваних сполук і/або конкретного використання, для якого ці сполуки застосовуються. Визначення ефективного дозування, тобто рівнів дозування, необхідних для досягнення бажаного результату, може бути досягнуте фахівцями в цій області техніки за допомогою стандартних фармакологічних методів і відповідно до даних, представлених у даному патенті. Стосовно крофелемеру, крофелемер може бути вигідно вводити по 125 мг два рази на день для лікування водянистої діареї, якщо менш водянисте випорожнення є бажаним протягом тижня. Доцільно також піддавати лікуванню по 500 мг два рази на день, якщо є бажаним покращення консистенції випорожнень. Термін "одержання", як у "одержання крофелемеру", призначений для включення придбання, синтезу, виділення, екстракції або іншого здобування крофелемеру. Вираз "профілактично ефективна кількість" сполуки означає кількість крофелемеру, яка є ефективною після введення однієї або декількох доз суб'єктові для запобігання або лікування індикації. У одному варіанті здійснення призначенням є ВІЛ-асоційована діарея. Способи лікування У даному винаході наведені способи лікування, попередження або полегшення діареї або симптомів, викликаних ВІЛ-інфекцією або ВААРТ-терапією ВІЛ-інфекції, які включають введення суб'єктові, що цього потребує, ефективної кількості крофелемеру. Типова діарея, яка може бути вилікувана або попереджена з використання способів, описаних у даному винаході, включає ВІЛ-асоційовану діарею або діарею, асоційовану з високоактивною антиретровірусною терапією. У одному з варіантів здійснення, лікування ВІЛ-асоційованої діареї включає покращення наступних симптомів ВІЛ-асоційованої діареї або ВААРТ-асоційованої діареї, в тому числі, 5 UA 109159 C2 5 10 15 20 25 30 35 40 45 50 55 60 наприклад, зменшення кількості випорожнень на день (частота), зменшення кількості водянистих випорожнень на день, зменшення частоти симптомів (невідкладність позиву, нетримання калу), зниження тяжкості симптомів (болю в животі або дискомфорту), зниження щоденної оцінки консистенції випорожнень (від водянистого до сформованого) або зменшення консистенції випорожнень, що веде до сформованого випорожнення від водянистого випорожнення. У одному конкретному варіанті здійснення, лікування визначається як два або менше водянистих випорожнень на тиждень. Зокрема, лікування визначається як два або менше водянистих випорожнень на тиждень протягом щонайменше двох із чотирьох тижнів лікування крофелемером. У інших конкретних варіантах здійснення, лікування може також включати, наприклад, зниження на одне або більше випорожнень на день, зменшення кількості водянистих випорожнень на день, покращення щоденної оцінки болю в животі або дискомфорту, покращення щоденної оцінки для консистенції випорожнень, зменшення числа днів на тиждень, у які суб'єкти зазнавали невідкладність позиву, зменшення числа днів на тиждень, у які суб'єкти зазнавали нетримання калу, або зменшення незапланованих візитів із приводу значного погіршення діареї. У одному аспекті в даному винаході наведені способи лікування ВІЛ-асоційованої діареї або діареї, асоційованої з високоактивною антиретровірусною терапією (ВААРТ), у ВІЛ-позитивних суб'єктів. Лікування діареї може включати, наприклад, зниження кількості випорожнень на день на одне або більше випорожнень, зменшення кількості водянистих випорожнень на день, покращення щоденної оцінки болю в животі або дискомфорту, покращення щоденної оцінки для консистенції випорожнень, зменшення консистенції випорожнень, зменшення числа днів на тиждень, у які суб'єкти зазнавали невідкладності позиву, зменшення числа днів на тиждень, у які суб'єкти зазнавали нетримання калу, або зниження зменшення незапланованих візитів із приводу значного погіршення діареї. У одному аспекті в даному винаході наведені способи лікування консистенції випорожнень у ВІЛ-інфікованого суб'єкта, де суб'єкт вважається вилікуваним, якщо є покращення в щоденній оцінці для консистенції випорожнень і/або зменшення оцінки для консистенції випорожнень, які вимірюються протягом дня або днів, або тижнів. Це зниження може вимірюватися від початкового рівня. Початковий рівень може бути визначений у найближчі дні тижня до лікування крофелемером. Лікування включає введення від близько 250 мг до близько 1000 мг на день; введення близько 250 мг на день; введення 1000 мг на день; введення близько 125 мг два рази на день або введення 500 мг два рази на день крофелемеру суб'єктові, що цього потребує. У одному аспекті в даному винаході представлені способи покращення консистенції випорожнень у ВІЛ-інфікованого суб'єкта, в яких суб'єкт вважається вилікуваним, якщо є покращення в консистенції випорожнень і/або зменшення консистенції випорожнень протягом дня або декількох днів чи тижнів. Це збільшення може бути виміряне від початкового рівня. Початковий рівень може бути визначений у найближчі дні тижня до лікування крофелемером. Лікування включає введення від близько 250 мг потребує до близько 1000 мг на день; введення близько 250 мг на день; введення 1000 мг на день; введення близько 125 мг два рази на день або введення 500 мг два рази на день крофелемеру суб'єктові, що цього потребує. У одному аспекті в даному винаході представлені способи полегшення водянистої діареї у ВІЛ-інфікованого суб'єкта, де суб'єкт вважається вилікуваним, якщо суб'єкт відчуває зменшення кількості водянистих випорожнень на день і/або протягом декількох днів, тижня або тижнів введення крофелемеру. Це зниження може бути виміряне від початкового рівня. Початковий рівень може бути визначений у найближчі дні тижня до лікування крофелемером. Лікування включає введення від близько 250 мг до близько 1000 мг на день; введення близько 250 мг на день; введення 1000 мг на день; введення близько 125 мг два рази на день або введення 500 мг два рази на день крофелемеру суб'єктові, що цього потребує. У одному аспекті в даному винаході представлені способи зменшення кількості випорожнень на день, у яких суб'єкт вважається вилікуваним, якщо спостерігається зниження кількості випорожнень на день при вимірюванні від початкового рівня. Початковий рівень може бути визначений у найближчі дні тижня до лікування крофелемером. Лікування включає введення від близько 250 мг до близько 1000 мг на день; введення близько 250 мг на день; введення 1000 мг на день; введення близько 125 мг два рази на день або введення 500 мг два рази на день крофелемеру суб'єктові, що цього потребує. Крофелемер можна вводити, наприклад, один раз на день, два рази на день, три рази на день або чотири рази на день, або більш часто за необхідності. Крофелемер можна вводити в дозах, наприклад, від близько 25 мг два рази на день до близько 3000 мг тричі на день, 6 UA 109159 C2 5 10 15 20 25 30 35 40 45 50 55 60 переважно крофелемер вводять від близько 125 мг до близько 1000 мг на день. У іншому варіанті крофелемер вводять від 125 мг два рази на день до 500 мг два рази на день у залежності від симптомів. У іншому варіанті здійснення крофелемер вводять 125 мг два рази на день. У іншому варіанті здійснення крофелемер вводять 500 мг два рази на день. Крофелемер може бути введений перорально, наприклад, у формі таблеток, порошкоподібній формі, рідкій формі або в капсулах. У конкретних варіантах здійснення суб'єктові вводять 250, 500 або 1000 мг на день крофелемеру. У конкретних варіантах здійснення суб'єктові вводять 125, 250 або 500 мг р.о. b.i.d (перорально два рази на день). Інші підходящі дози для способів можуть бути визначені медичним працівником або суб'єктом. Кількість крофелемеру, що вводиться щодня, може бути збільшена або зменшена з розрахунку на масу, вік, стан здоров'я, стать і медичний стан суб'єкта. Фахівець у даній області техніки зможе визначити потрібну дозу для суб'єкта на основі даного опису і даних, представлених у прикладах, які наведені нижче. У інших варіантах здійснення суб'єктові вводять крофелемер протягом 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24 або більше тижнів, або 26 чи більше тижнів. У одному варіанті здійснення суб'єктові вводять крофелемер протягом захворювання. Тривалість лікування може варіюватися в залежності від типу та тривалості захворювання, і відповідна тривалість лікування може бути легко визначена фахівцем у даній області техніки, який має вигоду від цього розкриття. Лікування може бути до інфікування, під час інфекції або після підозри на інфекцію і протягом періоду часу, запропонованого лікарем, щоб зменшити або усунути діарею. Суб'єкти, що цього потребують, включають суб'єктів, які мають або є чутливими до ВІЛасоційованої діареї чи ВААРТ-асоційованої діареї. Використовуваний у даному винаході термін терапевтично ефективна кількість означає кількість, ефективну при введенні до організму людини або тварини, що не є людиною, щоб забезпечити терапевтичні переваги, такі як покращення симптомів, наприклад, у кількості, ефективній для зменшення симптомів ВІЛ-асоційованої діареї. Згідно з деякими варіантами здійснення крофелемер може бути введений у комбінації з іншими сполуками, включаючи, наприклад, антидіарейні препарати або анти-ВІЛ препарати, включаючи, наприклад, антиретровірусні препарати. Згідно з одним аспектом у даному винаході представлені способи лікування ВІЛасоційованої діареї або діареї, асоційованої з високоактивною антиретровірусною терапією (ВААРТ), у ВІЛ-позитивного суб'єкта, який попередньо використовував інгібітори протеази, які включають: введення від близько 250 мг до близько 1000 мг на день; введення близько 250 мг на день; введення близько 500 мг на день; введення близько 1000 мг на день; введення близько 125 мг два рази на день; введення близько 250 мг два рази на день або введення 500 мг два рази на день крофелемеру суб'єктові чоловічої статі, що цього потребує. Використовуваний у даному винаході термін "який попередньо використовує" включає, наприклад, суб'єктів, які використовували інгібітори протеази (ІП) до терапії крофелемером або перекриваючись із терапією крофелемером, але використання ІП почали до першої дози терапії крофелемером. Фармацевтичні препарати Крім того, наведені в даному винаході фармацевтичні композиції містять ефективну кількість крофелемеру, описаного в даному винаході, і фармацевтично прийнятний носій. У додатковому варіанті здійснення ефективна кількість є ефективною для лікування ВІЛ-асоційованої діареї і/або ВААРТ-асоційованої діареї. Приклади одержання і застосування крофелемеру були описані в патенті США 7556831, патенті США 20070254050 і патентній публікації США 20080031984, кожний із яких включений до даного опису за допомогою посилання в усій їхній повноті. Один варіант здійснення включає фармацевтичні композиції, що містять крофелемер і фармацевтично прийнятний носій. Фармацевтичні композиції, описані в даному винаході, можуть також містити допоміжні речовини, наприклад, один або більше розріджувач, зв'язуючу речовину, змащуючу речовину, дезінтегруючий агент, барвник, ароматизатор або підсолоджувач. Композиції можуть бути складені для обраних покритих і непокритих таблеток, твердих і м'яких желатинових капсул, драже, пастилок, вафельних листів, гранул і порошків у запечатаному пакеті. Наприклад, композиції можуть бути складені для місцевого застосування, наприклад, мазі, помади, креми, гелі та лосьйони. У деяких варіантах здійснення ці фармацевтичні композиції є придатними для місцевого або перорального введення суб'єктові. У інших варіантах здійснення, як докладно описано нижче, 7 UA 109159 C2 5 10 15 20 25 30 35 40 45 50 55 60 фармацевтичні композиції можуть бути спеціально приготовані для введення в твердій або рідкій формі, в тому числі адаптованій для наступних цілей: (1) пероральне введення, наприклад, великі дози (водні або неводні розчини чи суспензії), таблетки, болюси, порошки, гранули, пасти, (2) парентеральне введення, наприклад, за допомогою підшкірної, внутрішньом'язової або внутрішньовенної ін'єкції, як, наприклад, стерильний розчин або суспензія, (3) місцеве застосування, наприклад, як крем, мазь або спрей наноситься на шкіру, (4) інтравагінально або ректально, наприклад, у вигляді песарію, крему чи піни, або (5) аерозоль, наприклад, у вигляді водного аерозолю ліпосомного препарату або твердих часток, що містять сполуку. Вираз "фармацевтично прийнятний" відноситься до крофелемеру, як описано в даному винаході, до композицій, що містять крофелемер, і/або лікарських форм, які, в рамках ретельної медичної оцінки, є зручними для використання в контакті з тканинами людини і тварин без надмірної токсичності, подразнення, алергійної реакції або іншої проблеми або ускладнення, співрозмірних із розумним співвідношенням користь/ризик. Вираз "фармацевтично прийнятний носій" включає фармацевтично прийнятну речовину, композицію або носій, такі як рідкий або твердий наповнювач, розріджувач, допоміжна речовина, розчинник або інкапсулюючий матеріал, які беруть участь у переміщенні й транспортуванні хімічної речовини від одного органа або частини тіла до іншого органа або частини тіла. Кожний носій повинен бути "прийнятним" у сенсі сумісності з іншими інгредієнтами композиції та не шкідливим для пацієнта. Деякі приклади матеріалів, які можуть служити як фармацевтично прийнятні носії, включають: (1) цукри, такі як лактоза, глюкоза і сахароза; (2) крохмалі, такі як кукурудзяний крохмаль і картопляний крохмаль; (3) целюлозу та її похідні, такі як натрій-карбоксиметилцелюлоза, етилцелюлоза і ацетат целюлози; (4) порошкоподібний трагакант; (5) солод; (6) желатин; (7) тальк; (8) допоміжні речовини, такі як масло какао і воски для супозиторіїв; (9) олії, такі як арахісова олія, бавовняна олія, сафлорова олія, кунжутна олія, оливкова олія, кукурудзяна олія і соєва олія; (10) гліколі, такі як пропіленгліколь; (11) поліоли, такі як гліцерин, сорбіт, маніт і поліетиленгліколь; (12) складні ефіри, такі як етилолеат і етиллаурат; (13) агар; (14) буферні агенти, такі як гідроксид магнію і гідроксид алюмінію; (15) альгінову кислоту; (16) апірогенну воду; (17) ізотонічний сольовий розчин; (18) розчин Рінгера; (19) етиловий спирт; (20) фосфатні буферні розчини; а також (21) інші нетоксичні сумісні речовини, які використовуються в фармацевтичних препаратах. Змочувальні агенти, емульгатори і змащуючі речовини, такі як лаурилсульфат натрію і стеарат магнію, а також барвники, розділяючі засоби, покриваючі агенти, підсолоджувачі, смакові добавки і ароматизатори, консерванти і антиоксиданти також можуть бути присутніми в композиціях. Приклади фармацевтично прийнятних антиоксидантів включають: (1) водорозчинні антиоксиданти, такі як аскорбінова кислота, гідрохлорид цистеїну, бісульфат натрію, метабісульфіт натрію, сульфіт натрію і таке інше, (2) розчинні в олії антиоксиданти, такі як аскорбілпальмітат, бутилгідроксианізол (БОА), бутилгідрокситолуол (БОТ), лецитин, пропілгалат, альфа-токоферол і таке інше, і (3) метал-хелатуючі агенти, такі як лимонна кислота, етилендіамінтетраоцтова кислота (ЕДТА), сорбіт, винна кислота, фосфорна кислота і таке інше. Композиції, що містять крофелемер, включають композиції, придатні для перорального, назального, місцевого (включаючи букальне і сублінгвальне), ректального, вагінального, аерозольного і/або парентерального введення. Композиції можуть бути зручно представлені в формі одиничної дози і можуть бути приготовані будь-якими способами, відомими в області фармації. Кількість активного інгредієнта, яку можна комбінувати з речовиною носія для одержання одиничної дозованої форми, буде варіюватися в залежності від організму, що підлягає лікуванню, від конкретного способу введення. Кількість активного інгредієнта, яку можна комбінувати з речовиною носія для одержання одиничної дозованої форми, як правило, буде такою кількістю сполуки, яка дає терапевтичний ефект. Як правило, зі ста відсотків ця кількість буде варіюватися від близько 0,01 % до близько 99 % активного інгредієнта, наприклад, від близько 5 % до близько 70 % або від близько 10 % до близько 30 %. Рідкі лікарські форми для перорального або ректального введення крофелемеру можуть включати, наприклад, фармацевтично прийнятні емульсії, мікроемульсії, розчини, суспензії, сиропи і еліксири. На додаток до активного інгредієнта, рідкі лікарські форми можуть містити інертні розріджувачі, які зазвичай використовуються в даній області техніки, такі як, наприклад, вода або інші розчинники, солюбілізуючі агенти і емульгатори, такі як етиловий спирт, ізопропіловий спирт, етилкарбонат, етилацетат, бензиловий спирт, бензилбензоат, пропіленгліколь, 1,3-бутиленгліколь, олії (зокрема бавовняна, арахісова, кукурудзяна, 8 UA 109159 C2 5 10 15 20 25 30 35 40 45 50 55 60 зародкова, оливкова, касторова і кунжутна олії), гліцерин, тетрагідрофуриловий спирт, поліетиленгліколі та складні ефіри жирних кислот сорбітану і суміші перерахованого вище. Суспензії, крім крофелемеру, можуть містити суспендуючі агенти, такі як, наприклад, етоксильовані ізостеарилові спирти, поліоксиетиленсорбіт і складні ефіри сорбіту, мікрокристалічну целюлозу, метагідроксид алюмінію, бентоніт, агар-агар і трагакант, і суміші перерахованого вище. Лікарські форми для місцевого або трансдермального введення крофелемеру можуть включати, наприклад, порошки, спреї, мазі, пасти, креми, лосьйони, гелі, розчини, пластирі та інгаляції. Мазі, пасти, креми і гелі можуть містити на додаток до крофелемеру допоміжні речовини, такі як тваринні та рослинні жири, олії, воски, парафіни, крохмаль, трагакант, похідні целюлози, поліетиленгліколі, силікони, бентоніти, кремнієву кислоту, тальк і оксид цинку або суміші перерахованого вище. Порошки і спреї можуть містити, на додаток до крофелемеру, допоміжні речовини, такі як лактоза, тальк, кремнієва кислота, гідроксид алюмінію, силікати кальцію та поліамідний порошок або суміші перерахованих вище речовин. Спреї можуть додатково містити звичайні пропеленти, наприклад, хлорфторвуглеводні та леткі незаміщені вуглеводні, такі як бутан і пропан. Приклади підходящих водних і неводних носіїв, які можуть бути використані в фармацевтичних композиціях, можуть включати, наприклад, воду, етанол, поліоли (такі як гліцерин, пропіленгліколь, поліетиленгліколь і т.п.) і підходящі суміші перерахованого вище, рослинні олії, такі як оливкова олія, і органічні складні ефіри, що ін'єктуються, такі як етилолеат. Належну текучість можна підтримувати, наприклад, за допомогою використання інкапсулюючих речовин, таких як лецитин, за допомогою підтримання необхідного розміру часток у випадку дисперсій і за допомогою використання поверхнево-активних речовин. У одному варіанті здійснення крофелемер використовується з кишковорозчинною оболонкою, щоб захистити його від деградації в кислому середовищі шлунка і/або від взаємодії з білками, такими як пепсин, у шлунку, наприклад, кишковорозчинні захисні склади. У конкретному варіанті здійснення крофелемер застосовується у вигляді таблеток. У ще одному варіанті застосовуються таблетки з кишковорозчинною оболонкою, наприклад, Eudragit®. У одному варіанті здійснення крофелемер формується як гранула з кишковорозчинною оболонкою або гранула в кишковорозчинній капсульній оболонці. У іншому варіанті крофелемер формується як композиція з уповільненим вивільненням. У деяких варіантах здійснення композиція складена зі сполукою або сполуками, які нейтралізують шлункову кислоту. Альтернативно, фармацевтичну композицію, що містить композицію, вводять або одночасно, або послідовно з, або після введення фармацевтичної композиції, яка нейтралізує шлункову кислоту. Сполуки, такі як антациди, які можуть бути використані для нейтралізації шлункової кислоти, включають, але не обмежені ними, карбонат алюмінію, гідроксид алюмінію, основний азотнокислий вісмут, основний саліцилат вісмуту, карбонат кальцію, дигідроксиалюмінію натрію карбонат, магалдрат, карбонат магнію, гідроксид магнію, оксид магнію і суміші перерахованого вище. Сполуки, які здатні знижувати секрецію шлункової кислоти і/або здатні знижувати кислотність шлункової рідини, добре відомі в даній області техніки і включають, але не обмежуються ними, антациди (гідроксид алюмінію, карбонат гліцинат алюмінію, оксид магнію, гідроксид магнію, карбонат магнію, карбонат кальцію, бікарбонат натрію), блокатори шлункової кислоти і комбінації будь-якого з вищевказаних. Загалом, будь-який препарат, який був схвалений для продажу відповідним урядовим агентством і здатен зменшити продукування шлункової кислоти і/або зниження кислотності шлункової рідини, можна вводити в комбінації з інгібіторною молекулою, такою як крофелемер, відповідно до способів, представлених у даному патенті. У конкретному варіанті здійснення, де крофелемер не покритий кишковорозчинною оболонкою, крофелемер змішують із однією або більшою кількістю сполук, які здатні знижувати секрецію шлункової кислоти і/або здатні зменшувати кислотність шлункової рідини. У конкретному варіанті здійснення крофелемер формується в композиції контрольованого вивільнення (з уповільненим вивільненням), такій як Merck GEM, Alza OROS, восковий матрикс (вивільнення спочатку відкладається доти, доки композиція не пройде зі шлунка до кишечника). Крім того, даний винахід забезпечує фармацевтичні композиції крофелемеру, які містять композицію разом із фармацевтично прийнятним носієм, у дозі, яка є терапевтично ефективною при лікуванні ВІЛ-асоційованої діареї або ВААРТ-асоційованої діареї. У одному варіанті здійснення безпосередньо спресований крофелемер (наприклад, такий, що може бути безпосередньо спресованим без допоміжних речовин у таблетку з фармацевтично прийнятною твердістю і стиранністю), за необхідності спресований у таблетки з лубрикантом, таким як, але не обмежуючись ним, стеарат магнію, покривають кишковорозчинною оболонкою. Ці препарати можуть бути приготовані способами, відомими в даній області техніки, див., наприклад, способи, 9 UA 109159 C2 5 10 15 20 25 30 35 40 45 50 55 60 описані в Remington's Pharmaceutical Sciences, 18th Ed., ed. Alfonso R. Gennaro, Mack Publishing Co., Easton, Pa., 1990. У конкретному варіанті здійснення проантоціанідинова полімерна композиція містить крофелемер (CAS 148465-45-6). У ще одному варіанті здійснення композицію покривають кишковорозчинною оболонкою. Кишковорозчинні оболонки є покриттями, які залишаються недоторканими в шлунку, але розчиняються й вивільняють вміст лікарської форми як тільки досягають тонкого кишечника. Велику кількість кишковорозчинних оболонок одержують із інгредієнтів, які мають кислотні групи, такі, що при дуже низьких значеннях рН у шлунку, тобто при рН від 1,5 до 2,5, є нейонізованими і оболонка залишається в недисоційованій нерозчинній формі. При більш високих значеннях рН, наприклад, у середовищі кишечника, кишковорозчинна оболонка перетворюється в йонізовану форму, яка може розчинитися, звільняючи молекулу інгібітора. Інші кишковорозчинні оболонки залишаються незмінними, поки вони не деградують під дією ферментів у тонкому кишечнику, а інші розпадаються після певного впливу вологи, так що оболонка залишається незмінною, поки проходить через тонкий кишечник. Полімери, які можуть бути використані для одержання кишковорозчинних оболонок, включають, але не обмежуються ними, шелак, ацетат фталату крохмалю і амілози, співполімери стиролу і малеїнової кислоти, ацетат сукцинат целюлози, ацетат фталат целюлози (CAP), фталат полівінілацетату (PVAP), фталат гідроксипропілметилцелюлози (сорту HP-50 і HP-55), етилцелюлозу, жири, бутилстеарат і співполімери метакрилової кислоти та складних ефірів метакрилової кислоти з йонізованими кислотними групами. У одному варіанті здійснення фармацевтична композиція містить полімерну проантоціанідинову композицію і полімер для кишковорозчинної оболонки Eudragit® L 30D, аніонний співполімер метакрилової кислоти і метилакрилату з середньою молекулярною масою 250000 Дальтон. У іншому варіанті полімерною кишковорозчинною оболонкою є Eudragit® L 30D-55. Нанесення кишковорозчинної оболонки для композиції крофелемеру може бути виконане будь-яким способом, відомим у даній області техніки для нанесення кишковорозчинних оболонок. Наприклад, але не як обмеження, кишковорозчинні полімери можуть бути нанесені з використанням органічних розчинників на основі розчинів, що містять від 5 до 10 % маса/маса полімеру для нанесення обприскуванням і до 30 % маса/маса полімеру для дражирування. Розчинники, які зазвичай використовуються, включають, але не обмежуються цим, ацетон, суміші ацетон/етилацетат, суміші метиленхлорид/метанол і потрійні суміші, що містять ці розчинники. Деякі кишковорозчинні полімери, такі як співполімери метакрилової кислоти і складних ефірів метакрилової кислоти, можуть бути нанесені з використанням води як диспергатора. Леткість системи розчинників повинна бути пристосована для запобігання прилипанню внаслідок липкості та для запобігання високій пористості оболонки внаслідок передчасного висихання розпилених крапельок або осадження полімеру після випаровування розчинника. У іншому варіанті здійснення фармацевтична композиція, що містить крофелемер, формується як гранули чи порошок (мікросфери з діаметром 300-5001) із кишковорозчинною оболонкою, що або оснащені твердими желатиновими оболонками капсул, або суспендовані в пероральний розчин для педіатричного введення. Порошок або гранули з кишковорозчинною оболонкою можуть бути також змішані з їжею, особливо для педіатричного введення. Гранули і порошок можуть бути отримані з використанням будь-якого способу, відомого в даній області техніки, такого як, але не обмежуючись перерахованими, кристалізація, сушіння розпиленням, або будь-якого способу подрібнювання, наприклад, за допомогою високошвидкісного міксера/гранулятора. Типові склади можуть бути знайдені, наприклад, у наступних патентах США і заявках на патент США № 7341744; USSN 11/510,152 і USSN 12/175,131. Незалежно від обраного способу введення, крофелемер формується у фармацевтично прийнятних лікарських формах за допомогою способів, відомих фахівцям у даній області техніки. При лікуванні комбінованою терапією як сполуки, так і інший лікарський препарат(и) вводять ссавцям (наприклад, людям, чоловікам або жінкам) способами, відомими в даній області техніки. Агенти можуть бути введені у вигляді разової дозованої форми або у вигляді окремих лікарських форм. Ефективні кількості інших терапевтичних препаратів добре відомі фахівцям у даній області техніки. Проте, цілком укладається в компетенції фахівців у даній області техніки, щоб визначити діапазон оптимально ефективної кількості інших терапевтичних препаратів. У одному варіанті здійснення, у якому інший терапевтичний препарат вводять тварині, ефективна кількість сполуки є меншою, ніж її ефективна кількість у випадку, якщо інший терапевтичний препарат не вводять. У іншому варіанті здійснення ефективна кількість препарату є меншою, 10 UA 109159 C2 5 10 15 20 25 30 35 40 45 50 55 60 ніж його ефективна кількість у випадку, якщо сполука не вводиться. Таким чином, небажані побічні ефекти, пов'язані з високими дозами будь-якого препарату, можуть бути зведені до мінімуму. Інші потенційні переваги (включаючи без обмежень покращені режими дозування і/або зниження вартості препарату) будуть очевидними для фахівців у даній області техніки. У різних варіантах здійснення лікарські препарати (наприклад, профілактичні або терапевтичні препарати) вводять менше, ніж за 5 хвилин один від одного, менше, ніж за 30 хвилин один від одного, одну годину, з інтервалом приблизно 1 годину, з інтервалом від приблизно 1 до приблизно 2 годин, з інтервалом від приблизно 2 годин до приблизно 3 годин, з інтервалом від приблизно 3 годин до приблизно 4 годин, з інтервалом від приблизно 4 годин до приблизно 5 годин, з інтервалом від приблизно 5 годин до приблизно 6 годин, з інтервалом від приблизно 6 годин до приблизно 7 годин, з інтервалом від приблизно 7 годин до приблизно 8 годин, з інтервалом від приблизно 8 годин до приблизно 9 годин, з інтервалом від приблизно 9 годин до приблизно 10 годин, з інтервалом від приблизно 10 годин до приблизно 11 годин, з інтервалом від приблизно 11 годин до приблизно 12 годин, з інтервалом від приблизно 12 годин до приблизно 18 годин, з інтервалом від 18 годин до 24 годин, з інтервалом від 24 годин до 36 годин, з інтервалом від 36 годин до 48 годин, з інтервалом від 48 годин до 52 годин, з інтервалом від 52 годин до 60 годин, з інтервалом від 60 годин до 72 годин, з інтервалом від 72 годин до 84 годин, з інтервалом від 84 годин до 96 годин один від одного або від 96 годин до 120 годин. У одному або декількох варіантах здійснення дві або більше терапії вводять протягом одного відвідування пацієнта. Набори Даний винахід також забезпечує набори, наприклад, набори для лікування діареї, наприклад, ВІЛ-асоційованої діареї у суб'єкта. Набори можуть містити, наприклад, крофелемер або фармацевтичну композицію, що містить крофелемер, і вказівки з застосування препарату. Вказівки з застосування препарату можуть містити інформацію з призначення, інформацію про дозування, інформацію про зберігання і таке інше. Інструкція на етикетці містить, наприклад, інструкцію приймати крофелемер не менше 3 днів для лікування ВІЛ-асоційованої або ВААРТ-асоційованої діареї. У інструкції можна також прочитати, що, наприклад, слід застосовувати від 125 мг два рази на день до 500 мг два рази на день крофелемеру до регресії симптомів або протягом 24 тижнів для лікування ВІЛасоційованої діареї. У інструкції можна також прочитати, що, наприклад, слід застосовувати 125 мг два рази на день крофелемеру до регресії симптомів або протягом 24 тижнів для лікування ВІЛ-асоційованої діареї. У інструкції можна також прочитати, що, наприклад, слід застосовувати 500 мг крофелемеру два рази на день до регресії симптомів або протягом 24 тижнів для лікування ВІЛ-асоційованої діареї. Інструкція на етикетці може додатково або альтернативно включати, наприклад, інструкцію приймати крофелемер від 125 мг два рази на день до 500 мг два рази на день крофелемеру до регресії симптомів або протягом 26 тижнів для лікування ВІЛ-асоційованої діареї. У інструкції можна також прочитати, наприклад, приймати 125 мг крофелемеру два рази на день до регресії симптомів або протягом 26 тижнів для лікування ВІЛ-асоційованої діареї. У інструкції можна також прочитати, наприклад, приймати 250 мг крофелемеру два рази на день до регресії симптомів або протягом 26 тижнів для лікування ВІЛ-асоційованої діареї. У інструкції можна також прочитати, наприклад, приймати 500 мг крофелемеру два рази на день до регресії симптомів або протягом 26 тижнів для лікування ВІЛ-асоційованої діареї. ПРИКЛАДИ Слід мати на увазі, що даний винахід не повинен бути витлумачений як обмежений прикладами, які тут описуються, а скоріше даний винахід слід витлумачувати як такий, що включає будь-які та всі втілення, забезпечені даним винаходом, і всі еквівалентні варіанти в межах кваліфікації фахівця в даній області техніки. Приклад 1: Легеневі ефекти перорально введеного пацюкам крофелемеру Трьом групам із восьми самців пацюків вводили крофелемер у відповідних рівнях дози 60, 200 і 600 мг/кг. Додаткова група з восьми пацюків-самців служила як контрольні тварини, і їм вводили носій, очищену воду. Крофелемер і носій вводили в дозі 10 мл/кг. Ще одна група з восьми пацюків-самців одержувала препарат позитивного контролю баклофен у дозі 100 мг/кг, дозовий об'єм 15 мл/кг. Крофелемер, препарат позитивного контролю і носій вводили через шлунковий зонд всім групам. Спостереження за смертністю, захворюваністю, травмами, а також за наявністю їжі та води проводили щонайменше два рази на день для всіх тварин. Клінічні дослідження проводили перед введенням дози, приблизно через 1 годину після введення дози і після завершення періодів легеневого моніторингу (приблизно через 4 години після введення дози). Масу тіла 11 UA 109159 C2 5 10 15 20 25 30 35 40 45 50 55 60 вимірювали й записували до дозування (День 1). Функцію легенів (частота подиху, дихальний об'єм і хвилинний об'єм) контролювали протягом приблизно 1 години до введення дози для визначення початкового рівня і протягом приблизно 4 годин після введення дози. Після періодів легеневого моніторингу всіх тварин умертвлювали і тушки відкидали без додаткової оцінки. Крофелемер, введений перорально самцям пацюків у дозах 60, 200 і 600 мг/кг, не чинив яких-небудь ефектів на смертність або кількісні респіраторні кінцеві критерії оцінки протягом усього дослідження. Стосовно основних респіраторних кінцевих критеріїв оцінки, оцінюваних у даному дослідженні, пероральне введення крофелемеру не дало ніяких несприятливих ефектів у пацюків при дозах аж до 60 мг/кг. Приклад 2: 13-тижневе дослідження пероральної токсичності крофелемеру, введеного мишам Трьом групам із 15 самців і 15 самок мишей вводили крофелемер при відповідних дозових рівнях 40, 400 і 1200 мг/кг/день. Ще одна група з 15 тварин/стать служила як контроль і одержувала носій, очищену воду. Носій або крофелемер вводили всім групам у дозі 10 мл/кг. Крім того, чотири групи по вісім або 39 тварин/стать/група виступали як токсикокінетичні (TK) тварини і одержували контроль або крофелемер таким же способом, що й основні дослідницькі групи при відповідних дозових рівнях 0, 40, 400 або 1200 мг/кг/день. Внаслідок смертності тваринам основних досліджень і ТК-тваринам при 1200 мг/кг/день вводили крофелемер до 55 і 56 днів відповідно. Спостереження за захворюваністю, смертністю, травмами, а також доступністю їжі та води проводили два рази на день для всіх тварин. Докладні клінічні спостереження з клінічних ознак проводили щотижня за всіма основними досліджуваними тваринами. Масу тіла вимірювали й записували щотижня для всіх тварин. Споживання продуктів харчування вимірювали й записували щотижня за всіма основними досліджуваними тваринами. Офтальмоскопічні дослідження проводили попередньо і до аутопсії для всіх основних досліджуваних тварин. Зразки крові для оцінки клінічної патології відбирали з тварин основного дослідження в крайньому випадку і при термінації. Зразки крові для визначення концентрації в плазмі крофелемеру відбирали з призначених TK-тварин у призначених часових точках у дні 1, 56 і 91. Після відбору крові TK-тварин умертвлювали і тушки відкидали за винятком призначених тварин при 1200 мг/кг/день. Токсикокінетичні параметри визначали для крофелемеру з даних залежності концентрації від часу в досліджуваних зразках. При закінченні дослідження, після розтину проводили дослідження і масу органів записували для всіх тварин основного дослідження та призначених TK-тварин при 1200 мг/кг/день. Тканини досліджували мікроскопічно для тварин основного дослідження при 0, 400 і 1200 мг/кг/день. Починаючи з 7 дня, обмежені дослідження загального розтину в спробі визначити причину смерті здійснювали на будь-якій TK-тварині, яку піддавали евтаназії в термінальному стані або знайшли мертвою. Тканини збирали і зберігали для можливого майбутнього дослідження від тварин основного дослідження при 40 мг/кг/день і призначених TK-тварин при 1200 мг/кг/день. Пероральне введення через зонд крофелемеру два рази на день при 0, 40 або 400 мг/кг/день протягом 13 тижнів або 1200 мг/кг/день протягом 8 тижнів мишам переноситься тільки самками при дозі 40 мг/кг/день. Крофелемер-пов'язану смертність зафіксували у одного самця в дозі 40 мг/кг/день, а у обох статей при 400 і 1200 мг/кг/день. Крофелемер-пов'язані ефекти, що стосуються маси тіла, проявлялися при ≥ 400 мг/кг/день у обох статей і ефекти, що стосуються споживання їжі, проявлялися в дозі 40 мг/кг/день у самок і ≥ 400 мг/кг/день у обох статей. Клінічна патологія, маса органа і макроскопічні ефекти спостерігалися у обох статей при 1200 мг/кг/день. Внаслідок смертності в дозі 40 мг/кг/день неможливо було визначити рівень не спостережуваного шкідливого впливу (РНСШВ) у самців, однак РНСШВ визначений як 40 мг/кг/день у самок. Приклад 3: Нейробіхевіоральна оцінка перорально введеного пацюкам крофелемеру Трьом групам із шести самців пацюків вводили крофелемер у відповідних рівнях дози 60, 200 і 600 мг/кг. Ще одна група з шести самців пацюків служила як контроль і одержувала носій, очищену воду. Інша додаткова група з шести самців пацюків одержувала препарат позитивного контролю, хлорпромазин гідрохлорид у дозі 20 мг/кг. Крофелемер, препарат позитивного контролю або носій вводили всім групам один раз через шлунковий зонд у дозі 10 мл/кг. Спостереження за захворюваністю, смертністю, травмами, а також доступністю їжі та води проводили щонайменше два рази на день для всіх тварин. Клінічні спостереження проводилися після кожного дослідження з набору стандартних тестів (FOB). FOB-оцінки проводили перед введенням дози й приблизно через 1 і 24 години після введення дози. Масу тіла вимірювали й записували перед введенням дози в день 1. При вивченні дії, всіх тварин піддавали евтаназії й тушки відкидали без додаткової оцінки. 12 UA 109159 C2 5 10 15 20 25 30 35 40 45 50 55 60 Крофелемер, який вводили перорально самцям пацюків у дозах 60, 200 і 600 мг/кг, не чинив яких-небудь ефектів на смертність, клінічні спостереження, масу тіла або будь-які з проведених нейроповедінкових вимірювань. Таким чином, стосовно основних нейроповедінкових кінцевих точок, оцінюваних у даному дослідженні, пероральне введення крофелемеру не дало ніяких ефектів у пацюків при дозах аж до 600 мг/кг. Приклад 4: Вплив перорального введення крофелемеру на моторну функцію кишечника у пацюків Трьом групам із восьми самців пацюків вводили крофелемер у відповідних рівнях дози 60, 200 і 600 мг/кг. Ще одна група з восьми пацюків-самців одержувала препарат позитивного контролю, морфін, при рівні дози 20 мг/кг. Додаткова група з восьми пацюків-самців служила як контроль і одержувала носій, очищену воду. Носій, препарат позитивного контролю або крофелемер вводили в усіх групах через шлунковий зонд один раз у День 1 дослідження в дозі 10 мл/кг. Приблизно через 1 годину після введення пробного сніданку, 5 % вугільну суспензію в 10 % аравійській камеді в дейонізованій воді вводили всім тваринам через шлунковий зонд у дозі 10 мл/кг. Спостереження за захворюваністю, смертністю, травмою і доступністю їжі (за винятком періодів під час голодування) та води проводили щонайменше два рази на день для всіх тварин. Клінічні спостереження проводили до дозування і до термінації. Масу тіла вимірювали й записували перед введенням дози в день 1. Приблизно через 30 хвилин після введення пробного сніданку всіх тварин умертвлювали, тонкий кишечник видаляли хірургічним шляхом і вимірювали загальну довжину кишечника та відстань, яку пройшло вугілля. Трупи відкидали без додаткової оцінки. Крофелемер, введений перорально самцям пацюків у дозах 60, 200 або 600 мг/кг, не призвів до смертності або яких-небудь клінічних спостережень. Крофелемер-пов'язане дозозалежне зниження шлунково-кишкової перистальтики було відзначене в усіх групах, що одержували лікування крофелемером, але статистично значуще зниження було відмічене тільки після доз у 200 і 600 мг/кг. Внаслідок низьких значень вилучення, рівні доз, які фактично вводили тваринам у 60 і 200 мг/кг групах, становили 51 і 169 мг/кг відповідно. Приклад 5: Серцево-судинні ефекти перорального введеного крофелемеру у собак породи Бігль Подібним чином чотирьом самцям собак породи Бігль вводили контрольний препарат у вигляді таблеток плацебо в желатині номер 12 Torpac lock ring gelatin capsules (0 мг/кг) і крофелемер у дозах приблизно 60, 200 і 600 мг/кг відповідно до принципів побудови таблиці модифікованого латинського квадрата за трьома символами – тварина/стать/лікувальна доза для кожного тижня з наступним щонайменше 7-денним періодом вимивання препарату до завершення повного курсу лікування тварини з усіма вищезгаданими дозуваннями. Контрольний препарат і крофелемер вводили всім тваринам перорально в желатиновій капсулі. Тварини були раніше хірургічним чином обладнані радіопередавачами для вимірювання температури тіла, артеріального тиску, частоти серцевих скорочень і електрокардіограми (ЕКГ). Температуру тіла, систолічний, діастолічний і середній артеріальний тиск, частоту серцевих скорочень і ЕКГ (тривалість QRS і РР, PR і QT інтервалів) безперервно контролювали щонайменше за 2 години до дозування й щонайменше до 20 годин після використання препарату. За дев'ять днів до першого введення, тварин, що не отримували лікування, безперервно контролювали за серцево-судинними кінцевими точками щонайменше 22 години. Ці дані використовували при розрахунках коригованого QT інтервалу протягом усього дослідження. Спостереження за захворюваністю, смертністю, травмою, а також доступністю їжі та води проводили щонайменше два рази на день для всіх тварин. Клінічні спостереження проводили до дозування й після завершення періоду моніторингу стану серцево-судинної системи. Масу тіла вимірювали й записували щодня перед кожним введенням. При закінченні дослідження тварин переводили до вольєрів для проживання. Крофелемер, введений перорально кобелям у дозах 60, 200 і 600 мг/кг, не призводив до смертності чи до яких-небудь змін у ЕКГ протягом усього дослідження. Після доз 200 і 600 мг/кг досліджуваний препарат призводив до клінічних проявів червоних, чорних або коричневих випорожнень; м'яких, водянистих і/або слизуватих калових мас і/або до наявності чорних або коричневих забруднень (фекального походження) на підлозі кліток, де утримувалися тварини. Зате при цьому стосовно всіх фізіологічних параметрів, що характеризують стан серцевосудинної системи, рівень не спостережуваного шкідливого впливу (РНСШВ) відповідав дозі 600 мг/кг. + Приклад 6: Вплив крофелемеру на струм калієвих каналів hERG K у клітинах НЕК-293 13 UA 109159 C2 5 10 15 20 25 30 35 40 45 50 55 60 Канал hERG стабільно експресувався в субклоні (HEK-293/hERG) НЕК-293 клітинної лінії. Ефект крофелемеру вимірювали на максимальній амплітуді слідового струму. Цей параметр визначали за струмовими кривими, отриманими з фіксованого потенціалу клітин HEK293/hERG, використовуючи методику патч-затискання в конфігурації цілої клітини. Крофелемер досліджували при 5 концентраціях для першої серії експериментів: 0,001 мкМ, 0,01 мкМ, 0,1 мкМ, 1,0 мкМ і 10,0 мкМ, і при 6 концентраціях для другої серії експериментів: 0,1 мкМ, 0,3 мкМ, 1 мкМ, 3 мкМ, 10 мкМ і 30 мкМ. Препарат позитивного контролю досліджували при 10 мкМ. Препаратом негативного контролю була дейонізована вода. Крофелемер інгібував слідовий струм hERG дозозалежним чином. Установлені величини IC50 становили 1,79 мкМ для першої серії експериментів і 1,75 мкМ для другої серії експериментів. Цизаприд (позитивний контроль, 10 мкМ) інгібує слідовой струм hERG у середньому на 99,67 % та 100,47 % для першої та другої серії експериментів відповідно, що узгоджується з його відомою фармакологічною дією. Приклад 7: Вплив їжі на фармакокінетику крофелемеру 500 мг У цілому, 28 суб'єктів були зареєстровані в цьому дослідженні. Суб'єктів рандомізували на 1 день у співвідношенні 1:1 до групи 1 (голодували, потім харчувалися) або групи 2 (харчувалися, потім голодували). Рандомізацію стратифікували за статтю. Кожний суб'єкт одержував разову дозу крофелемеру 500 мг (перорально у вигляді таблеток 2 × 250 мг) з їжею з високим вмістом жиру (крофелемер, годовані) і після голодування (крофелемер, голодні). Періоди досліджень голодування/годування були розділено 7 днями. Послідовність голодування/годування або годування/голодування дозування на дні 1 і 8 визначали за допомогою рандомізації на день 1. Зразки крові для фармакокінетичного аналізу крофелемеру забирали перед використанням препарату і аж до 48 год. після використання однієї дози препарату як у голодного, так і у нагодованого. Протягом періоду дослідження впливу харчування, суб'єктів годували протягом ночі (без їжі протягом приблизно 9,5 годин) до введення сніданку високої жирності (крофелемер, годовані) або не годували протягом ночі протягом 10 годин до введення однієї дози досліджуваного препарату (крофелемер, голодні). Оцінки схеми лікування на відносну біодоступність крофелемеру були основані на порівнянні плазмових концентрації крофелемеру за кожною фазою дослідження. Зразки цільної крові забирали в наступні моменти часу (фактичний час відбору крові записували до первинної документації/електронної історії хвороби): дні 1 і 8: перед використанням препарату (приблизно 1 година перед дозуванням) і через 0,5; 1; 2; 4; 6; 8; 10; 12; 16; 24; 30; 36; 42 і 48 год. після використання препарату. Фармакокінетичний/фармакодинамічний (PK/PD) аналіз був призначений для здійснення з використанням усіх суб'єктів, які мали парні ЕКГ і концентрації в плазмі для крофелемеру. PK/PD фармакокінетичний/фармакодинамічний аналіз не був пророблений внаслідок недостатньої кількості фармакокінетичних PK даних. Цей аналіз був також розроблений для оцінки взаємозв'язку між концентрацією крофелемеру і QTcF (інтервал QT з коректуванням Фрідериція). Однак було виявлено, що тільки три зразки мають концентрації вище LLOQ (нижня межа кількісного виявлення), яка дорівнює 50 нг/мл, таким чином, відношення концентрації крофелемеру до QTcF не могло бути оціненим. Середній початковий рівень коректував зміну частоти серцевих скорочень, що показує зниження частоти серцевих скорочень, яке дорівнює -1,1 кількість ударів за хвилину і -1,0 кількість ударів за хвилину для крофелемер голодних і годованих відповідно, через 4 години. Середній початковий рівень коректував зміну частоти серцевих скорочень, що показує збільшення частоти серцевих скорочень, яке дорівнює 3,5 кількість ударів за хвилину і 1,6 кількість ударів за хвилину для крофелемер голодних і годованих відповідно, через 12 годин. Зміни частоти серцевих скорочень не мали клінічного значення. Не існувало ніяких викидів тахікардії або брадикардії у крофелемер голодних і годованих. Приклад 8: Ефективність і безпека крофелемеру для лікування ВІЛ-асоційованої діареї Дане дослідження проводили, щоб визначити, чи буде лікування крофелемером 125 мг, 250 мг і 500 мг усередину (перорально) два рази на день покращувати частоту, консистенцію та невідкладність позиву дефекації у суб'єктів із ВІЛ-асоційованою діареєю в порівнянні з плацебо. Суб'єкти чоловічого та жіночого роду у віці ≥ 18 років з ВІЛ-1 інфекцією, підтвердженою стандартними серологічними тестами і/або вірусним навантаженням та історією діареї тривалістю не менше 1 місяця. Дослідження було рандомізованим, подвійним сліпим, у паралельних групах, плацебоконтрольованим і багатоцентровим. Дослідження проводилося у дві стадії. Обидві стадії 14 UA 109159 C2 5 10 15 20 25 30 35 40 45 50 55 60 складалися з 10+4 денної, односторонньо сліпої, плацебо скринінгової фази; з наступною рандомізацією та 31-денною, подвійною сліпою, плацебо-контрольованою фазою лікування і завершилися 20-тижневою фазою додаткового лікування без плацебо-контролю. На стадії I (стадія підбору дози) подвійна сліпа фаза мала чотири відгалуження: три дози крофелемеру (125 мг два рази на день, 250 мг два рази на день, до 500 мг два рази на день) і плацебо два рази на день. Шанси одержати крофелемер або плацебо становили 3:1 (1:1:1:1). Суб'єкти на продовженні введення крофелемеру у фазі додаткового лікування одержували ту ж дозу препарату, або для групи, що одержувала плацебо, проводилася повторна рандомізація до однієї з трьох вищезгаданих доз препарату. Після того, як стадія I завершувалася, проводили проміжний аналіз, і доза крофелемеру, яка, очевидно, працює краще, безпечніше і/або краще переноситься, ніж інші, була обрана для використання винятково на стадії II. Стадія II буде мати тільки два відгалуження в подвійній сліпій, плацебо-контрольованій фазі лікування: обрана доза крофелемеру (крофелемер 125 мг) і плацебо. Шанс на одержання крофелемеру або плацебо дорівнюватиме 1:1. Усім суб'єктам пролонгації в 20-тижневій фазі додаткового лікування без плацебо-контролю на стадії II була призначена раніше обрана доза крофелемеру. Протягом як стадії I, так і стадії II суб'єкти спочатку будуть входити до односторонньо сліпої плацебоскринінгової фази тривалістю 10+4 дні, протягом якої вимірювали частоту дефекації, консистенцію та невідкладність позиву. Антиретровірусна терапія і лікування пов'язаних із нею станів (у тому числі профілактичне призначення антибіотиків для пневмоцистної пневмонії (PCP)) або інфекції повинна залишатися на незмінному рівні від чотирьох тижнів до скринінгу через плацебо-контрольовані фази лікування. Про будь-які зміни в антиретровірусній терапії в будь-якій точці дослідження слід повідомляти на сайт і документувати до індивідуальної реєстраційної карти. Основні аналізи ефективності були основані на даних з 4-тижневого періоду оцінки ефективності плацебо-контрольованої фази лікування. Аналіз первинної кінцевої точки був оснований на вибірці "усі пацієнти, що почали одержувати лікування" (ITT), і буде порівнюватися частка суб'єктів, що відповіли на лікування в групі плацебо, з часткою суб'єктів, що відповіли на лікування в групі крофелемер 125 мг. Первинним критерієм ефективності була клінічна відповідь, яка визначається як два або менше водянистих випорожнень на тиждень протягом щонайменше двох із чотирьох тижнів після 4-тижневого періоду оцінки ефективності в популяції ITT. Вторинними змінними ефективності протягом 4-тижневого періоду оцінки ефективності в популяції ITT були: Кількість випорожнень на день Кількість водянистих випорожнень на день; Оцінка для щоденного болю в животі або дискомфорту; Оцінка для щоденної консистенції випорожнень; Кількість днів на тиждень, у які суб'єкти зазнавали невідкладного позиву; Кількість днів на тиждень, у які суб'єкти зазнавали нетримання калу; і Частка суб'єктів, що здійснювали незапланований візит із приводу значного погіршення діареї або клінічно значущого загострення діареї протягом 4-тижневого періоду оцінки ефективності. Це дослідження складалося зі стадії вибору дози, періоду проміжного аналізу і стадії оцінки дози. Стадія I: Стадія вибору дози Суб'єктів рандомізували 1:1:1:1, приблизно по 50 суб'єктів на групу лікування: крофелемер 125 мг перорально два рази на день; крофелемер 250 мг перорально два рази на день; крофелемер 500 мг перорально два рази на день і плацебо перорально два рази на день. Крофелемер 125 мг, 250 мг і 500 мг або плацебо вводили у вигляді таблеткової комбінації перорально два рази на день із рідинами щонайменше за півгодини до сніданку й вечері. Фаза подвійного сліпого, плацебо-контрольованого лікування складалася з початкового 3денного вступного періоду (дні від -3 до -1), а потім 4-тижневого періоду оцінки ефективності (дні з 1 по 28). Вступний період гарантував, що ефект досліджуваного препарату був установлений перед тим, як почався 4-тижневий період оцінки ефективності. Суб'єкти, які завершили плацебо-контрольовану фазу лікування, вступили до 20-тижневої фази без плацебо-контролю додаткового лікування. Суб'єкти в групах: крофелемер 125 мг перорально два рази на день, крофелемер 250 мг перорально два рази на день, крофелемер або 500 мг два рази на день – продовжували одержувати ці лікарські препарати протягом фази лікування без плацебо-контролю; суб'єктів, які одержували плацебо повторно, рандомізували для одержання або крофелемеру 125 мг перорально два рази на день, або крофелемеру 250 мг перорально два рази на день, або 500 мг крофелемеру перорально два рази на день (1:1:1). 15 UA 109159 C2 5 10 15 20 25 30 35 40 45 50 55 Протягом 20-тижневої фази додаткового лікування не існувало ніякого ризику ускладнень від плацебо, і суб'єктам було дозволено без обмежень (за необхідності) використання ADM (антидіарейні лікарські засоби). Стадія I закінчувалася, коли близько 50 суб'єктів рандомізували до кожної з чотирьох груп лікування. Реєстрацію зупиняли при приблизно 50 суб'єктах на групу лікування доти, доки не були завершені проміжний аналіз і ухвалення рішення для стадії II. Проміжний аналіз Проміжний аналіз виконували, коли приблизно 50 суб'єктів (фактична кількість у таблицях, які представлені нижче) рандомізували до кожної з чотирьох груп лікування й завершували плацебо-контрольований період лікування або термінували дослідження (не в будь-якому випадку, щоб включити 14-денний період після використання препарату для телефонного дзвінка для оцінки побічних ефектів). На основі оцінки ефективності й безпеки суб'єкти відбиралися для продовження однієї з доз крофелемеру поряд із плацебо в стадії II. Стадія II: Стадія оцінки дози Як тільки проміжний аналіз був завершений, реєстрація відновилася. Суб'єктів обстежили на придатність для рандомізації на основі критеріїв на стадії I. Суб'єктів, які входять до фази подвійного сліпого, плацебо-контрольованого лікування на стадії II, рандомізували до однієї з двох груп лікування: крофелемер 125 мг перорально два рази на день або плацебо перорально два рази на день. Крофелемер 125 мг, 250 мг і 500 мг або підібране плацебо вводили у вигляді таблеткової комбінації перорально два рази на день із рідинами щонайменше за півгодини до сніданку й вечері. Метою стадії оцінки дози було визначення частки ВІЛ-позитивних хворих, що відчувають полегшення діареї з крофелемером 125 мг перорально два рази на день у порівнянні з плацебо перорально два рази на день під час плацебо-контрольованої фази лікування. Іншими цілями були оцінка ефектів крофелемеру 125 мг перорально два рази на день у порівнянні з плацебо на: i. Кількість випорожнень на день (частота) ii. Кількість водянистих випорожнень на день iii. Симптом частоти (невідкладний позив, нетримання калу) iv. Тяжкість симптомів (болі або дискомфорт у животі), а також v. Щоденна оцінка консистенції випорожнень. Співвідношення рандомізації до крофелемеру 125 мг перорально два рази на день або плацебо перорально два рази на день становить 1:1. Суб'єкти, які завершили фазу подвійного сліпого лікування, брали участь у 20- тижневій фазі додаткового лікування без плацебоконтролю й одержували крофелемер 125 мг перорально два рази на день. Суб'єкти, яких зарахували до стадії I і які одержували крофелемер або 125 мг перорально два рази на день, або 250 мг перорально два рази на день, або 500 мг перорально два рази на день, залишалися на раніше призначеній дозі. Проте, суб'єктам знову призначали крофелемер 125 мг перорально два рази на день, якщо на думку дослідника, відповідь на або толерантність до їхньої поточної дози були неадекватними. Лікування залишалося сліпим під час цього періоду лікування, у тому числі залишалася можливість того, що суб'єкти переводилися на ту ж дозу, яку вони приймали спочатку. Усі дослідницькі процедури, виконані на стадії I, не співпадали з процедурами стадії II. Суб'єктів, рандомізованих протягом стадій I і II, об'єднували та включали до розрахунків об'єму вибірки і аналізу ефективності та безпеки. Наступні критерії використовували для збирання даних для оцінки ефективності крофелемеру на ВІЛ-асоційовану діарею. Визначення щоденника дослідження (IVRS, система інтерактивної голосової відповіді) Діарея включає часті рідкі або водянисті випорожнення. Дефекація визначається як похід до туалету з видаленням випорожнень; число дефекацій означає число походів до туалету з видаленням випорожнень. - водянисті випорожнення визначаються як випорожнення, які можуть литися; - рідке випорожнення визначається як м'яке, без форми або обрисів; - сформоване випорожнення визначається як випорожнення, подібне до м'якої ковбаси; - тверде випорожнення визначається як випорожнення, подібне до твердої або грудкуватої ковбаси; і - дуже тверде випорожнення визначається як тверді грудки або горішки, які важко виходять. Невідкладний позив визначається як необхідність поспішати до туалету для дефекації. 16 UA 109159 C2 5 10 15 20 25 30 35 40 45 50 Нетримання калу визначається як витікання або проходження випорожнення в небажаний час (дві чайні ложки або більші кількості випорожнень). Біль або дискомфорт у животі визначається як біль, спазми або здуття живота, які є незручними і/або такими, що перешкоджають нормальній діяльності. Зразки випорожнень Кожний зразок збирають і аналізують за наступними параметрами: Візит 0 - Токсин Clostridium difficile; - Кишкові патогени, аналіз O&P (Ova and Parasites); - Лямблії-специфічний антиген методом ІФА; і - Модифікована фарба для офарблення стійких до кислот бактерій для Cryptosporidium, Cyclospora і Isospora; - Лактоферрин (якісний) і - Прихована кров. Візит 3 - Токсин Clostridium difficile; - Кишкові патогени, аналіз O&P (Ova and Parasites); - Лямблії-специфічний антиген методом ІФА; і - Модифікована фарба для офарблення стійких до кислот бактерій для Cryptosporidium, Cyclospora і Isospora; Візити 4, 5, 6, 7 і 8 - Токсин Clostridium difficile; - Кишкові патогени, аналіз O&P (Ova and Parasites); - Лямблії-специфічний антиген методом ІФА; - Модифікована фарба для офарблення стійких до кислот бактерій для Cryptosporidium, Cyclospora і Isospora; Аналіз показника первинної ефективності Первинна кінцева точка ефективності клінічної відповіді; суб'єкти класифікуються як такі, що відповідають, якщо вони повідомили про два або менше водянистих випорожнень на тиждень протягом щонайменше двох із чотирьох тижнів періоду оцінки ефективності фази плацебоконтрольованого лікування. Аналіз вторинних параметрів, що характеризують ефективність За кожним суб'єктом середній початковий рівень, середній за тижні від 1 до 4 і зміну від початкового рівня розраховують для наступних змінних: • Кількість випорожнень на день; • Кількість водянистих випорожнень на день; • Щоденна оцінка болю або дискомфорту в животі; • Щоденна оцінка консистенції випорожнень; • Кількість днів на тиждень, у які суб'єкти зазнавали невідкладного позиву; і • Кількість днів на тиждень, у які суб'єкти зазнавали нетримання калу. Кожна з вторинних безперервних змінних буде проаналізована як відсоток зміни в порівнянні з початковим рівнем. Щоденній оцінці болю або дискомфорту в животі присвоювали оцінку наступним чином: немає = 0, слабкі = 1, помірні = 2, тяжкі = 3, чим більша оцінка, тим гіршими є болі або дискомфорт. Оцінку консистенції випорожнень для кожної дефекації присвоювали наступним чином: 1 = дуже тверде, 2 = тверде, 3 = сформоване, 4 = рідке, 5 = водянисте. Оцінку консистенції випорожнень обчислювали за середнім значенням цих оцінок щодня. Наведена нижче таблиця 1 показує початкові характеристики для плацебо-контрольованої фази лікування, в тому числі діагностовані причини діареї, кількість лімфоцитів CD4 і категорія клітин CD4. Ця таблиця показує, що суб'єкти в кожній групі були схожими. 17 UA 109159 C2 Таблиця 1: Початкові характеристики у фазі плацебо-контрольованого лікування Початкові характеристики хвороби Причина діареї Антиретровірусна терапія ВІЛ-інфекції кишечника Інше Кількість CD4 клітин n Середнє SD Медіана Мінімальне Maксимальне Категорія лімфоцитів CD4 =404 5 10 15 Плацебо (N=138) Крофелемер Крофелемер Крофелемер Усі дози Крофелемер 125 мг * 250 мг 500 мг (N=239) (N=138) (N=54) (N=47) 104 (75,4 %) 104 (75,4 %) 37 (68,5 %) 30 (63,8 %) 33 (23,9 %) 32 (23,2 %) 15 (27,8 %) 15 (31,9 %) 1 (0,7 %) 2 (1,4 %) 2 (3,7 %) 2 (4,3 %) 138 530,5 244,79 518,5 76 1298 137 497,8 230,88 479,0 111 1183 54 425,2 226,13 374,0 100 1095 171 (71,5 %) 62 (25,9 %) 6 (2,5 %) 46 481,7 275,18 421,5 149 1734 237 478,1 239,81 429,0 100 1734 39 (28,3 %) 55 (39,9 %) 29 (53,7 %) 21 (44,7 %) 99 (71,7 %) 32 (59,4 %) 25 (46,3 %) 25 (53,2 %) 105 (3,9 %) 132 (55,2 %) [1] Як початкові дані була взята середня оцінка щоденних даних із 7 днів до дня першої дози препарату рандомізованого дослідження. [2] Як початкові дані була взята середня щоденна оцінка консистенції випорожнень за 7 днів до дня першої дози препарату рандомізованого дослідження. Щоденна оцінка = (1 × кількість дуже твердих випорожнень + 2 × кількість твердих випорожнень + 3 × кількість сформованих випорожнень + 4 × кількість рідких випорожнень + 5 × кількість водянистих випорожнень)/ (кількість загальних випорожнень). [3] Як початкові дані була взята середня щоденна оцінка за 7 днів до дня першої дози препарату рандомізованого дослідження, немає = 0, слабка = 1, помірна = 2, тверда = 3. [4] Початкові = 7 * A/B, A = кількість днів із подією протягом 7 днів до дня першої дози препарату рандомізованого дослідження, B = кількість днів із непропущеними оцінками. У таблиці 2, наведеній нижче, наводяться додаткові початкові характеристики плацебоконтрольованої фази лікування, у тому числі застосування антибіотиків у ході дослідження. Таблиця 2: Початкові характеристики в фазі плацебо-контрольованого лікування Початкові характеристики хвороби Плацебо (N=138) Крофелемер Крофелемер Крофелемер Усі дози Крофелемер 125 мг* 250 мг 500 мг (N=239) (N=138) (N=54) (N=47) Використання нової схеми приймання антибіотика під час плацебо-контрольованої фази лікування Так Ні 20 25 14 (10,1 %) 9 (6,5 %) 124 (89,9 %) 129 (92,5 %) 2 (3,7 %) 52 (96,3 %) 1 (2,1 %) 46 (97,9 %) 12 (5,0 %) 227 (95,0 %) Таблиці 3 і 3а, наведені нижче, показують відсоток суб'єктів із клінічною відповіддю, наприклад, покращення водянистої діареї в плацебо-контрольованій фазі лікування, і зміну у відповіді в порівнянні з початковим значенням як функцію часу відповідно. Як видно з таблиці 3, всі три групи лікування зі стадії I були статистично значущими для лікування водянистої діареї, а також у об'єднаній групі суб'єктів із дозою 125 мг на обох стадіях. Таблиця 3а представляє дані, які показують, що незалежно від групи лікування первинна кінцева точка (клінічна відповідь) демонструвала чутливість, що послідовно корелює з іншими щоденними оцінками, отриманими в дослідженні змін при оцінці симптомів. Суб'єкти, що відповіли на лікування, тобто суб'єкти з ≤ 2 водянистих випорожнень на тиждень, мали достовірно більше покращення в щоденній оцінці тяжкості симптомів, ніж ті, що не реагують на лікування, щотижня протягом усього дослідження. 18 UA 109159 C2 Таблиця 3: Первинна кінцева точка ефективності: відсоток суб'єктів із клінічною відповіддю в плацебо-контрольованій фазі лікування Плацебо (N=138) Стадія I Суб'єкт, що відповів на лікування - n/Ni (%) Різниця в лікуванні (у порівнянні з плацебо) 1/50 (2,0 %) Крофелемер Крофелемер Крофелемер 125 мг* 250 мг 500 мг (N=136) (N=54) (N=46) 9/44 (20,5 %) 18,5 % 00 1-стороння 97,5 % ДІ (довірчий інтервал) (1) 1-стороння P-значення (у порівнянні з плацебо) [1] Зведені дані Суб'єкт, що відповів на лікування - n/Ni (%) Різниця в лікуванні (у порівнянні з плацебо) (6,0 %, ) 0,0019 5/54 (9,3 %) 9/46 (19,6 %) 7,3 % 17,6 % 00 (-1,7 %, ) 0,0563 00 (5,3 %, ) 0,0024 11/138 (8,0 %) 24/136 (17,6 %) 9,6 % 00 1-стороння 97,5 % ДІ (1) 1-стороння P-значення (у порівнянні з плацебо) [1] (1,2 %, ) 0,0096 Таблиця 3а Сприйнятливість первинної кінцевої точки (клінічної відповіді) – a Клінічна відповідь : Щотижневий суб'єкт, що відповів на лікування Середня зміна в порівнянні з початковим (± SD) Тиждень Щоденне опитування Щоденні водянисті випорожнення Щоденна консистенція b випорожнень Щоденний біль у c животі Невідкладний позив d e Нетримання калу Щоденна частота випорожнень a Клінічна відповідь : Щотижневий суб'єкт, що Різниця не відповів на лікування PСередня зміна в Суб'єкт, що відповів на значення порівнянні з початковим лікування - суб'єкт, що (± SD) не відповів на лікування Тиждень 1 -1,75 (0,901) -0,51 (1,296) -1,24 < 0,0001 -1,08 (0,589) -0,19 (0,381) -0,90 < 0,0001 -0,41 (0,651) -0,11 (0,493) -0,30 0,0217 -2,97 (2,299) -0,75 (1,908) -2,22 < 0,0001 -1,48 (2,007) -0,43 (1,867) -1,06 0,0144 -1,13 (1,299) -0,31 (1,810) -0,83 < 0,0001 Тиждень 2 Щоденні водянисті випорожнення Щоденна консистенція b випорожнень Щоденний біль у c животі Невідкладний позив d e Нетримання калу Щоденна частота випорожнень -2,03 (1,184) -0,53 (1,392) -1,50 < 0,0001 -1,14 (0,672) -0,17 (0,379) -0,97 < 0,0001 -0,61 (0,701) -0,12 (0,494) -0,49 < 0,0001 -2,79 (2,418) -0,79 (2,014) -2,00 < 0,0001 -1,71 (2,071) -0,44 (1,982) -1,27 < 0,0001 -1,18 (1,331) -0,34 (1,851) -0,83 < 0,0001 Тиждень 3 Щоденні водянисті випорожнення Щоденна консистенція b випорожнень -2,00 (1,280) -0,65 (1,408) -1,35 < 0,0001 -1,20 (0,734) -0,22 (0,382) -0,98 < 0,0001 19 UA 109159 C2 Продовження таблиці 3а c Щоденний біль у животі d Невідкладний позив e Нетримання калу Щоденна частота випорожнень Щоденні водянисті випорожнення b Щоденна консистенція випорожнень c Щоденний біль у животі d Невідкладний позив e Нетримання калу Щоденна частота випорожнень -0,51 (0,668) -3,41 (2,215) -1,65 (2,228) -1,20 (1,314) Тиждень 4 -1,89 (1,058) -1,07 (0,645) -0,48 (0,658) -3,11 (2,411) -1,75 (2,140) -1,07 (1,086) -0,17 (0,517) -0,98 (2,253) -0,64 (2,121) -0,41 (1,992) -0,34 -2,43 -1,01 -0,79 0,0016 < 0,0001 0,0015 < 0,0001 -0,68 (1,430) -0,24 (0,410) -0,19 (0,533) -0,99 (2,166) -0,57 (2,085) -0,43 (2,039) -1,21 -0,83 -0,28 -2,12 -1,18 -0,64 < 0,0001 < 0,0001 0,0058 < 0,0001 < 0,0001 < 0,0001 a Клінічну відповідь через тиждень визначали як ≤ 2 водянистих випорожнень протягом даного тижня. Відповідь за консистенцією випорожнень визначали як щоденну оцінку консистенції випорожнень < 4 протягом даного тижня c Біль і дискомфорт у животі, оцінка: 0 = немає, 1 = слабкі, 2 = помірні й 3 = серйозні. d Кількість днів на тиждень із невідкладним позивом = 7 × A/В, де А = кількість днів із невідкладним позивом протягом тижня, а B = кількість днів із оцінками за тиждень. e Кількість днів на тиждень із нетримання калу = 7 × A/B, де А = кількість днів із нетримання калу на тиждень, а B = кількість днів із оцінками за тиждень. f P-значення одержували з критерію суми рангів Уілкоксона для порівняння груп суб'єктів, що відповіли на лікування, в порівнянні з групами суб'єктів, що не відповіли на лікування. b 5 У таблиці 4, наведеній нижче, показано кілька тижнів із клінічною відповіддю суб'єктів у дослідженні. Як буде показано нижче, суб'єкти, що приймали 500 мг два рази на день, мали більше тижнів відповіді на лікування. Таблиця 4: Кількість тижнів із клінічною відповіддю в плацебо-контрольованій фазі лікування Кількість тижнів з відповіддю Стадія I Кількість суб'єктів Тиждень 0 Тиждень 1 Тиждень 2 Тиждень 3 Тиждень 4 N=50 43 (86,0 %) 6 (12,0 %) 1 (2,0 %) Крофелемер у порівнянні з плацебо [1] Відношення шансів 95 % ДІ р-значення 10 Крофелемер 125 мг* (N=136) Крофелемер 250 мг (N=54) Крофелемер 500 мг (N=46) N=44 32 (72,7 %) 2 (4,5 %) 2 (4,5 %) 4 (9,1 %) 3 (6,8 %) N=54 41 (75,9 %) 8 (14,8 %) 2 (3,7 %) 2 (3,7 %) 1 (1,9 %) N=46 25 (60,9 %) 9 (19,6 %) 4 (8,7 %) 4 (8,7 %) 1 (2,2 %) 2,41 (0,84, 6,87) 0,1011 Плацебо (N=138) 2,02 (0,74, 5,56) 0,1727 4,21 (1,56, 11,33) 0,0045 Таблиця 5, наведена нижче, показує суб'єктів із клінічною відповіддю за місяцями. Як видно з таблиці, суб'єкти, що відповідають, і рівень відповідей зростає в міру збільшення часу введення крофелемеру суб'єктові. 20 UA 109159 C2 Таблиця 5: Суб'єкти зі щомісячною клінічною відповіддю за місяцями в фазі додаткового лікування без плацебо-контролю Суб'єкти, що відповіли на лікування, у фазі додаткового лікування без плацебо-контролю Крофелемер Крофелемер Крофелемер 125 мг* 250 мг 500 мг (N=219) (N=68) (N=50) n (%) n (%) n (%) Місяць 1 87/218 (39,9 %) 99/208 (47,6 %) 111/198 (56,1 %) 99/178 (55,6 %) 90/155 (58,1 %) Місяць 2 Місяць 3 Місяць 4 Місяць 5 5 19/68 (27,9 %) 31/60 (51,7 %) 30/58 (51,7 %) 27/54 (50,0 %) 30/53 (56,6 %) 14/50 (28,0 %) 19/48 (39,6 %) 17/47 (36,2 %) 20/44 (45,5 %) 17/42 (40,5 %) Усі дози крофелемер (N=337) n (%) 120/336 (35,7 %) 149/316 (47,2 %) 158/303 (52,1 %) 146/276 (52,9 %) 137/250 (54,8 %) У таблиці 6, представленій нижче, показаний відсоток суб'єктів із відповіддю на крофелемер за консистенцією випорожнень. Як видно з таблиці 6, суб'єкти, яким вводили 500 мг і 250 мг два рази день, відповідали краще, ніж ті, яким вводили 125 мг два рази день або 250 мг два рази день. Таблиця 6: Відсоток суб'єктів із відповіддю за консистенцією випорожнень у плацебо-контрольованій фазі лікування Плацебо (N=138) Крофелемер Крофелемер Крофелемер 125 мг* 250 мг 500 мг (N=136) (N=54) (N=46) Стадія I Суб'єкт, що відповів на лікування, - n/Ni (%) 11/50 (22,0 %) 14/44 (31,8 %) Різниця в лікуванні в порівнянні з плацебо 9,8 % 1-стороння 97,5 % ДІ [1] 1-стороння P-значення (у порівнянні з плацебо) [1] (-8,1 %, 00 ) 0,1412 20/54 (37,0 %) 15,0 % (-2,6 %, 00 0,0470 23/46 (50,0 %) 28,0 % ) (-8,8 %, 00 ) 0,0021 Зведені дані Суб'єкт, що відповів на лікування, - nNi (%) 49/186 (35,5 %) Різниця в лікуванні в порівнянні з плацебо 1-стороння 97,5 % ДІ [1] 1-стороння P-значення (у порівнянні з плацебо) [1] 10 53/136 (39,0 %) 3,5 % [-5,0 %, 00 ) 0,1428 Таблиця 7, наведена нижче, показує кількість місяців клінічної відповіді у суб'єктів на крофелемер у дослідженні. Таблиця 7 знову демонструє, що чим довше лікування, тим краща відповідь на лікування. 21 UA 109159 C2 Таблиця 7: Кількість місяців із клінічною відповіддю в групі у фазі додаткового лікування без плацебо-контролю Кількість тижнів з відповіддю Крофелемер 250 мг (N=66) Крофелемер 500 мг (N=50) 0 місяців 1 місяць 2 місяці 3 місяці 4 місяці 5 місяців 5 Крофелемер 125 мг* (N=219) 69 (31,5 %) 31 (14,2 %) 19 (8,7 %) 29 (13,2 %) 25 (11,4 %) 46 (21,0 %) 25 (36,8 %) 6 (8,8 %) 10 (14,7 %) 7 (10,3 %) 10 (14,7 %) 10 (14,7 %) 25 (50,0 %) 4 (8,0 %) 4 (8,0 %) 3 (6,0 %) 4 (8,0 %) 10 (20,0 %) У таблиці 8, наведеній нижче, показаний відсоток суб'єктів європеоїдів і латиноамериканського походження та всіх інших рас із клінічною відповіддю. Ця таблиця показує, що європеоїдна й латиноамериканська популяції, що одержали крофелемер, добре реагували на лікування. Таблиця 8: Відсоток суб'єктів із клінічною відповіддю за расами у плацебо-контрольованій фазі лікування Раса: білі/латиноамериканці Плацебо (N=83) Крофелемер 125 мг* (N=84) Крофелемер 250 мг (N=44) Крофелемер 500 мг (N=38) Стадія I Суб'єкт, що відповів на лікування, - n/Ni (%) 0/36 (0,0 %) 7/31 (22,6 %) 3/44 (6,8 %) 8/38 (21,1 %) Різниця в лікуванні в порівнянні з плацебо 22,6 % 6,5 % 21,1 % [95 % ДІ] [7,9 %, 37,3 %] [-0,6 %, 14,3 %] [8,14 %, 34,0 %] P-значення в порівнянні з плацебо [1] 0,0030 0,2481 0,0053 Зведені дані Суб'єкт, що відповів на лікування, - n/Ni (%) 6/83 (7,2 %) 19/84 (22,6 %) Різниця в лікуванні в порівнянні з плацебо 15,4 % [95 % ДІ] [4,9 %, 25,9 %] P-значення (у порівнянні з плацебо) [1] 0,0083 Крофелемер Крофелемер Крофелемер Плацебо Раса: Інші 125 мг* 250 мг 500 мг (N=55) (N=52) (N=10) (N=8) Стадія I Суб'єкт, що відповів на лікування, - n/Ni (%) 1/14 (7,1 %) 2/13 (15,4 %) 2/10 (20,0 %) 1/8 (12,5 %) Різниця в лікуванні в порівнянні з плацебо 8,2 % 12,9 % 5,4 % [95 % ДІ] 8,2 % [-15,6 %, 32,0 %] [-15,4 %, 41,1 %] [-21,2 %, 32,0 %] P-значення в порівнянні з плацебо [1] 0,5956 0,5504 1,0000 Зведені дані Суб'єкт, що відповів на лікування, - n/Ni (%) 5/55 (9,1 %) 5/52 (9,6 %) Різниця в лікуванні в порівнянні з плацебо 0,5 % [95 % ДІ] [-10,5 %, 11,6 %] P-значення (у порівнянні з плацебо) [1] 1,0000 10 Примітка: клінічну відповідь визначали як
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for manufacturing paper and board
Автори англійськоюForbes, William, Bortey, Enoch, King, Steven, Chaturvedi, Pravin
Автори російськоюФорбс Вильям, Борти Эноч, Кинг Стивен, Чатурведи Превин
МПК / Мітки
МПК: A61K 36/47, A61K 31/352, A61P 1/12
Мітки: діареї, способи, лікування, композиції, віл-асоційованої
Код посилання
<a href="https://ua.patents.su/41-109159-sposobi-i-kompozici-dlya-likuvannya-vil-asocijjovano-diare.html" target="_blank" rel="follow" title="База патентів України">Способи і композиції для лікування віл-асоційованої діареї</a>