Спосіб лікування остеопорозу
Формула / Реферат
1. Застосування сполуки 1, яка представлена формулою
 ,
,
або її фармацевтично прийнятної солі для лікування остеопорозу у пацієнта в кількості від 0,01 до 25 мг один раз на добу.
2. Застосування сполуки 1, яка представлена формулою
 ,
,
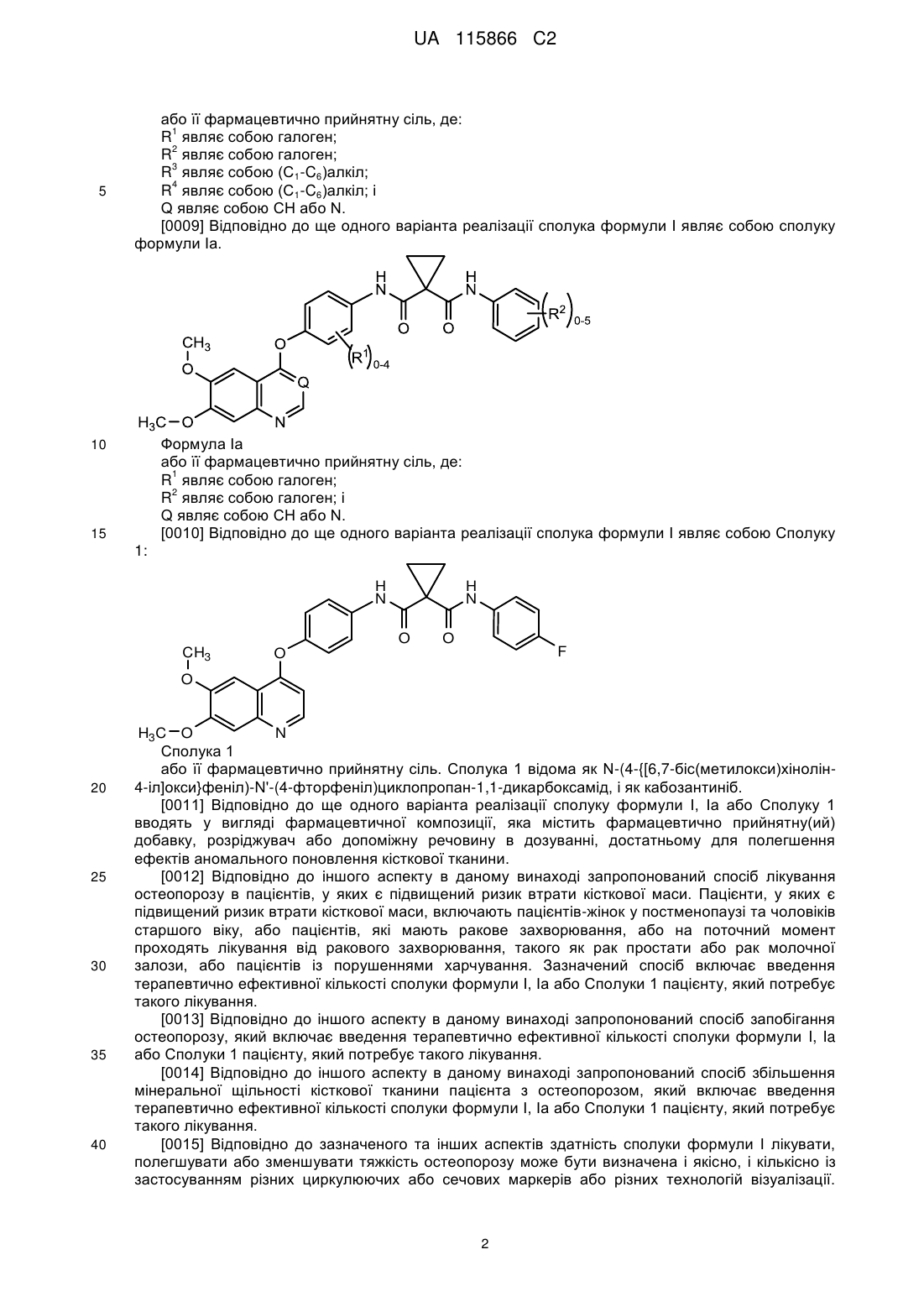
або її фармацевтично прийнятної солі для лікування остеопорозу у пацієнтів, які мають ракове захворювання або на поточний момент проходять лікування від ракового захворювання, в кількості від 0,01 до 25 мг один раз на добу.
3. Застосування сполуки 1, яка представлена формулою
 ,
,
або її фармацевтично прийнятної солі для зменшення аномального відкладення безструктурної кісткової тканини, що супроводжується підвищенням числа переломів скелетних кісток, компресією спинного мозку та сильним кістковим болем при остеопорозі, в кількості від 0,01 до 25 мг один раз на добу.
4. Застосування за будь-яким з пп. 1-3, де сполука 1 являє собою малатну сіль.
5. Застосування за п. 4, де сполука 1 являє собою (L)- або (D)-малатну сіль.
6. Застосування за п. 5, де сполука 1 являє собою (L)-малатну сіль.
7. Застосування за п. 5, де сполука 1 являє собою (D)-малатну сіль.
8. Застосування за п. 5, де сполука 1 знаходиться в кристалічній формі N-1 (L)-малатної солі і/або (D)-малатної солі.
9. Застосування за п. 5, де сполука 1 знаходиться в кристалічній формі N-2 (L)-малатної солі і/або (D)-малатної солі.
10. Застосування за будь-яким з пп. 1-9, де сполуку 1 або її фармацевтично прийнятну сіль вводять як фармацевтичну композицію, що додатково містить фармацевтично прийнятний носій, наповнювач або розчинник.
Текст
Реферат: Даний винахід стосується лікування остеопорозу із застосуванням N-(4-{[6,7біс(метилокси)хінолін-4-іл]окси}феніл)-N'-(4-фторфеніл)циклопропан-1,1-дикарбоксаміду. UA 115866 C2 (12) UA 115866 C2 UA 115866 C2 5 10 15 20 25 30 35 40 45 50 Перехресні посилання на споріднені заявки [0001] Дана заявка претендує на пріоритет на підставі попередньої заявки на патент США № 61/538039, поданої 22 вересня 2011 р., зміст якої повністю включений у дану заявку за допомогою посилання. Область техніки [0002] Даний винахід відноситься до лікування остеопорозу із застосуванням N-(4-{[6,7біс(метилокси)хінолін-4-іл]окси}феніл)-N'-(4-фторфеніл)циклопропан-1,1-дикарбоксаміду. Рівень техніки [0003] Остеопороз являє собою захворювання, яке характеризується низькою кістковою масою та руйнуванням мікроархітектури кісткової тканини, що призводять до підвищеної крихкості кісток і наступного збільшення ризику переломів. Зазначене захворювання призводить до того, що кістки стають крихкими і ламкими, і вражає як чоловіків, так і жінок. При остеопорозі кісток збільшується ризик перелому після мінімальної травми. У світі налічується близько 35 мільйонів жінок і 14 мільйонів чоловіків із остеопорозом або низькою кістковою масою. У Сполучених Штатах від остеопоротичного перелому страждає приблизно один із чотирьох дорослих у віці старше 50 років. Остеопороз і виникаючі у результаті переломи представляють значний тягар для охорони здоров'я, частково через те, що захворювання розвивається безсимптомно – на той час, коли у пацієнта діагностують остеопоротичний перелом, ушкодження кісток уже відбулося. [0004] Кістка постійно піддається процесу так званого ремоделювання. Втрата кісткової маси при остеопорозі відбувається тоді, коли при нормальному процесі ремоделювання, або відновлення кісткової тканини, втрачається більше кісткової тканини, ніж відшкодовується. Ремоделювання кістки включає два чітко виражених етапи: резорбція кістки (розпад) і кісткоутворення. Кальцій запасається у кістковій тканині. Коли він необхідний організму, клітини кісткової тканини, які називаються остеокластами, прикріплюються до поверхні кістки і руйнують її, залишаючи порожнини у кістковій тканині. Потім клітини, що формують кісткову тканину, які називаються остеобластами, заповнюють ці порожнини органічним матриксом, який називається остеоїдом. Потім остеоїд мимовільно мінералізується за рахунок фосфату кальцію з відновленням твердої кістки. Остеобласти, які залишаються укладеними у матрикс, називають остеоцитами. [0005] З віком, а також у результаті інших обставин, які можуть призводити до підвищення ризику втрати кісткової маси, наприклад, при лікуванні раку передміхурової або молочної залози, або у результаті порушень харчування, швидкість відновлення кісткової тканини у людей обох статей підвищується, а на тканинному рівні кісткоутворення за рахунок остеобластів відбувається повільніше, ніж резорбція кістки остеокластами, оскільки знижується кількість й активність індивідуальних клітин-остеобластів (Marie and Kassem, 2011). Резорбція кістки займає менше часу, ніж кісткоутворення. Резорбція кістки на конкретній ділянці кістки займає приблизно два тижні; формування займає три місяці або більше. У результаті утворюється нестача кісткової тканини у так званих порожнинах ремоделювання. У нормі це не призводить до значних наслідків, але при дисбалансі циклу ремоделювання відновлення кісткової тканини може призводити до значної втрати кісткової маси. Вважається, що інтенсивне поновлення кісткової тканини підвищує ризик переломів. [0006] У результаті продовжує існувати потреба у способах лікування остеопорозу. Короткий опис винаходу [0007] Зазначеним та іншим потребам відповідає даний винахід, який відноситься до способу лікування остеопорозу. Зазначений спосіб включає введення терапевтично ефективної кількості сполуки пацієнту, який потребує такого лікування. [0008] Відповідно до одного із варіантів реалізації зазначеного аспекту й інших аспектів сполука являє собою сполуку формули I: Формула I 1 UA 115866 C2 5 або її фармацевтично прийнятну сіль, де: 1 R являє собою галоген; 2 R являє собою галоген; 3 R являє собою (C1-C6)алкіл; 4 R являє собою (C1-C6)алкіл; і Q являє собою CH або N. [0009] Відповідно до ще одного варіанта реалізації сполука формули I являє собою сполуку формули Ia. Формула Ia або її фармацевтично прийнятну сіль, де: 1 R являє собою галоген; 2 R являє собою галоген; і Q являє собою CH або N. [0010] Відповідно до ще одного варіанта реалізації сполука формули I являє собою Сполуку 10 15 1: H N H N O CH3 O F O O H3 C 20 25 30 35 40 O N Сполука 1 або її фармацевтично прийнятну сіль. Сполука 1 відома як N-(4-{[6,7-біс(метилокси)хінолін4-іл]окси}феніл)-N'-(4-фторфеніл)циклопропан-1,1-дикарбоксамід, і як кабозантиніб. [0011] Відповідно до ще одного варіанта реалізації сполуку формули I, Ia або Сполуку 1 вводять у вигляді фармацевтичної композиції, яка містить фармацевтично прийнятну(ий) добавку, розріджувач або допоміжну речовину в дозуванні, достатньому для полегшення ефектів аномального поновлення кісткової тканини. [0012] Відповідно до іншого аспекту в даному винаході запропонований спосіб лікування остеопорозу в пацієнтів, у яких є підвищений ризик втрати кісткової маси. Пацієнти, у яких є підвищений ризик втрати кісткової маси, включають пацієнтів-жінок у постменопаузі та чоловіків старшого віку, або пацієнтів, які мають ракове захворювання, або на поточний момент проходять лікування від ракового захворювання, такого як рак простати або рак молочної залози, або пацієнтів із порушеннями харчування. Зазначений спосіб включає введення терапевтично ефективної кількості сполуки формули I, Ia або Сполуки 1 пацієнту, який потребує такого лікування. [0013] Відповідно до іншого аспекту в даному винаході запропонований спосіб запобігання остеопорозу, який включає введення терапевтично ефективної кількості сполуки формули I, Ia або Сполуки 1 пацієнту, який потребує такого лікування. [0014] Відповідно до іншого аспекту в даному винаході запропонований спосіб збільшення мінеральної щільності кісткової тканини пацієнта з остеопорозом, який включає введення терапевтично ефективної кількості сполуки формули I, Ia або Сполуки 1 пацієнту, який потребує такого лікування. [0015] Відповідно до зазначеного та інших аспектів здатність сполуки формули I лікувати, полегшувати або зменшувати тяжкість остеопорозу може бути визначена і якісно, і кількісно із застосуванням різних циркулюючих або сечових маркерів або різних технологій візуалізації. 2 UA 115866 C2 5 10 15 20 25 30 35 40 45 50 55 60 Маркери, які можуть підходити для індивідуального моніторингу пацієнтів із остеопорозом, що одержують лікування антирезорбтивними агентами, включають загальну лужну фосфатазу сироватки, кістково-специфічну лужну фосфатазу сироватки, остеокальцин сироватки, Стермінальний пропептид проколагену типу 1 C1NP сироватки або N-термінальний пропептид проколагену типу 1 сироватки (P1NP) [для моніторингу кісткоутворення], гідроксипролін у сечі, загальний піридинолін у сечі (ПІД), вільний дезоксипіридинолін у сечі (ДПІД), перехреснозв'язані N-термінальні тілопептиди колагену 1 типу (NTx) у сечі, перехресно-зв'язані Cтермінальні тілопептиди колагену 1 типу (CTx) у сечі або у сироватці, кістковий сіалопротеїн (КС) і стійку до тартрату кислу фосфатазу 5b (ТрКФ-5b) [для моніторингу резорбції кістки]. [0016] Технології візуалізації, які можуть підходити для оцінки здатності сполуки формули I, Ia або Сполуки 1 лікувати, полегшувати або зменшувати тяжкість остеопорозу, включають магніторезонансну візуалізацію, позитронно-емісійну томографію, комп'ютерну томографію (КТ) і рентгенівську абсорбціометрію. [0017] Відповідно до іншого аспекту в даному винаході запропонований спосіб прогнозування остеопорозу в суб'єкта, який включає: (a) вимірювання рівня P1NP, CTx або ТрКФ-5b у зразку, отриманому від суб'єкта; (b) порівняння рівня P1NP, CTx або ТрКФ-5b, виміряного на етапі (a), зі стандартним рівнем P1NP, CTx або ТрКФ-5b для визначення того, чи містить отриманий від суб'єкта зразок рівні P1NP, CTx або ТрКФ-5b, які не відповідають нормі; (c) вибір схеми лікування Сполукою формули I, Ia або 1 на підставі рівнів P1NP, CTx або ТрКФ-5b, які не відповідають нормі, або введення Сполуки формули I, Ia або 1 у відповідності зі схемою лікування, яка забезпечує придушення остеопорозу в зазначеного суб'єкта. [0018] Відповідно до іншого аспекту в даному винаході запропонований спосіб стимуляції диференціювання й/або активності остеобластів у пацієнта, який потребує такого лікування, що включає введення зазначеному пацієнту ефективної кількості Сполуки формули I, Ia або Сполуки 1. [0019] Відповідно до іншого аспекту в даному винаході запропонований спосіб стимуляції кісткоутворення у пацієнта, який потребує такого лікування, що включає введення зазначеному пацієнту ефективної кількості Сполуки формули I, Ia або Сполуки 1. [0020] Відповідно до іншого аспекту в даному винаході запропонований Спосіб придушення диференціювання остеокластів у пацієнта, який потребує такого лікування, що включає введення зазначеному пацієнту ефективної кількості Сполуки формули I, Ia або Сполуки 1. [0021] Відповідно до іншого аспекту в даному винаході запропонований спосіб модулювання поновлення кісткової тканини у напрямку кісткоутворення у пацієнта, який потребує такого лікування, що включає введення зазначеному пацієнту ефективної кількості Сполуки формули I, Ia або Сполуки 1. [0022] Відповідно до іншого аспекту в даному винаході запропонований спосіб лікування остеопорозу в пацієнтів після оваріектомії, що включає введення зазначеному пацієнту ефективної кількості Сполуки формули I, Ia або Сполуки 1. [0023] Відповідно до іншого аспекту в даному винаході запропонований спосіб модулювання поновлення кісткової тканини у напрямку кісткоутворення у пацієнтів після оваріектомії, що включає введення зазначеному пацієнту ефективної кількості Сполуки формули I, Ia або Сполуки 1. Короткий опис креслень [0024] На Фіг. 1 представлений вплив Сполуки 1 на диференціювання остеокластів, який вимірюється на 7 день, у вигляді активності ТрКФ-5b (од/л), секретованого в культуральне середовище. [0025] На Фіг. 2 представлений вплив Сполуки 1 на резорбційну активність остеокластів людини на 7 день у вигляді значень CTX/ТрКФ-5b. [0026] На Фіг. 3 представлений вплив Сполуки 1 на диференціювання остеобластів на 8 день у вигляді клітинної активності лужної фосфатази (ЛФ)/мг білка. [0027] На Фіг. 4 представлений вплив Сполуки 1 на кісткоутворюючу активність остеобластів миші на 11 день у вигляді секретованого в культуральне середовище PINP. [0028] На Фіг. 5 представлений вплив Сполуки 1 на кісткоутворюючу активність остеобластів миші на 13 день у вигляді відкладення кальцію на 13 день. [0029] На Фіг. 6 представлений дизайн дослідження короткострокового впливу Сполуки 1 на маркери поновлення кісткової тканини при оваріектомії у пацюків (модель ОВЕ). Докладний опис винаходу Скорочені позначення та визначення [0030] Наведені нижче скорочені позначення скрізь в даній заявці мають наступні значення: 3 UA 115866 C2 Скорочення Ac Br °C цКБЗ d dd dt ДХМ ДМЕ ДМФА ДМСО Dppf (ДФФФ) ЕІ г год РХВТ л M m мг мГц хв мл мкл мкмоль ммоль моль МС н нмоль ЯМР q к. т. S t або tr ТФК ТГФ ТШХ 5 10 Значення Ацетил Уширений Градуси Цельсію ЦиклоКарбобензокси = бензилоксикарбоніл Дублет Подвійний дублет Подвійний триплет Дихлорметан 1,2-диметоксіетан N,N-Диметилформамід диметилсульфоксид 1,1’-біс(дифенілфосфан)фероцен Іонізація електронним ударом Грам(и) Година(и) Рідинна хроматографія при високому тиску Літр(и) Молярний або молярність Мультиплет Міліграм(и) Мегагерц (частота) Хвилина(и) Мілілітр(и) Мікролітр(и) Мікромоль(і) або мікромолярний Мілімоль(і) Моль(і) Мас-спектральний аналіз Нормальний або нормальність Наномолярний Ядерна магнітно-резонансна спектроскопія Квадруплет Кімнатна температура Синглет Триплет Трифтороцтова кислота Тетрагідрофуран Тонкошарова хроматографія [0031] Символ «-» означає одинарний зв'язок, «=» означає подвійний зв'язок. [0032] При зображенні або описі хімічних структур, якщо явно не зазначено інше, передбачається, що на всіх атомах вуглецю є заміщення атомом водню для забезпечення чотиривалентності. Наприклад, мається на увазі, що в структурі наведеної нижче структурної формули, з лівої сторони, міститься дев'ять атомів водню. Ці дев'ять атомів водню показані в структурній формулі праворуч. Іноді в текстовій формулі вказується, що конкретний атом у структурі містить атом(и) водню як замісник(и) (явно позначений атом водню); наприклад, CH2CH2-. Фахівцю в даній області техніки буде зрозуміло, що вищевикладені способи опису є загальновживаними в області хімії, забезпечуючи стислість і простоту опису складних у цілому структур. H H H H Br Br H H H H H [0033] Якщо група «R» у кільцевій системі показана як «рухома», як, наприклад, у формулі: 4 UA 115866 C2 R 5 тоді, якщо не зазначено інше, замісник «R» може розташовуватися на будь-якому атомі зазначеної кільцевої системи, допускаючи заміну зображеного, такого, що мається на увазі, або явно позначеного атома водню на одному із атомів кільця, за умови утворення стабільної структури. [0034] Якщо група «R» у конденсованій кільцевій системі показана як рухома, наприклад, як у формулах: H R N R N H 10 15 20 25 Z HN R , або , або тоді, якщо не зазначено інше, замісник «R» може розташовуватися на будь-якому атомі конденсованої кільцевої системи, допускаючи заміну позначеного атома водню (наприклад, NH- у наведеній вище формулі), атома водню, який мається на увазі (наприклад, як у наведеній вище формулі, де атоми водню не показані, але їхня наявність мається на увазі), або явно позначеного атома водню (наприклад, як у наведеній вище формулі, де «Z» відповідає =CH-) на одному ізатомів кільця, за умови утворення стабільної структури. У показаному прикладі група «R» може розташовуватися або на 5-членному, або на 6-членному кільці конденсованої кільцевої системи. Якщо зображена група «R» розташовується на кільцевій системі, яка містить насичені атоми вуглецю, наприклад, як у формулі: (R)y де, у зазначеному прикладі, «y» може бути більше, ніж 1, за умови, що кожна група заміщає існуючий зображений, такий, який мається на увазі, або явно позначений атом водню на кільці; тоді, якщо не зазначено інше, за умови, що кінцева структура стабільна, дві «R»-групи можуть розташовуватися на одному атомі вуглецю. Простим прикладом є випадок, коли R являє собою метильну групу; на атомі вуглецю зображеного кільця може бути наявним гемінальний диметил («кільцевий» вуглець). В іншому прикладі дві R-групи на одному атомі вуглецю, включаючи зазначений атом вуглецю, можуть формувати кільце, утворюючи таким чином спіроциклічну кільцеву структуру («спіроциклільну» групу) із зображеним кільцем, наприклад, як у формулі: HN 30 35 40 45 50 [0035] «Галоген» або «гало-» відноситься до фтору, хлору, брому або йоду. [0036] «Вихід» для кожної з описаних у даній заявці реакцій виражений у відсотках від теоретичного виходу. [0037] Термін «пацієнт» для цілей даного винаходу включає людину й інших тварин, зокрема, ссавців, і інші організми. Відповідно, зазначені способи підходять як для лікування людини, так і для застосування у ветеринарії. Відповідно до іншого варіанта реалізації пацієнт являє собою ссавця; відповідно до ще одного варіанта реалізації пацієнт являє собою людину. [0038] «Фармацевтично прийнятна сіль» сполуки означає фармацевтично прийнятну сіль, яка має необхідну фармакологічну активність вихідної сполуки. Очевидно, що фармацевтично прийнятні солі повинні бути нетоксичні. Додаткову інформацію стосовно придатних фармацевтично прийнятних солей можна знайти у посібнику Remington's Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton, PA, 1985, включеному в дану заявку за допомогою посилання, або у S. M. Berge et al., «Pharmaceutical Salts», J. Pharm. Sci., 1977;66:119; обидва джерела включені в дану заявку за допомогою посилання. [0039] Приклади фармацевтично прийнятних солей приєднання кислоти включають утворені неорганічними кислотами, такими як соляна кислота, бромистоводнева кислота, сірчана кислота, азотна кислота, фосфорна кислота і т.п.; а також органічними кислотами, такими як оцтова кислота, трифтороцтова кислота, пропіонова кислота, гексанова кислота, циклопентанпропіонова кислота, гліколева кислота, піровиноградна кислота, молочна кислота, щавлева кислота, малеїнова кислота, малонова кислота, бурштинова кислота, фумарова кислота, винна кислота, яблучна кислота, лимонна кислота, бензойна кислота, корична кислота, 3-(4-гідроксибензоїл)бензойна кислота, мигдальна кислота, метансульфонова кислота, етансульфонова кислота, 1,2-етандисульфонова кислота, 2- гідроксіетансульфонова кислота, 5 UA 115866 C2 5 10 15 20 25 30 35 40 45 50 бензолсульфонова кислота, 4-хлорбензолсульфонова кислота, 2-нафталінсульфонова кислота, 4-толуолсульфонова кислота, камфорсульфонова кислота, глюкогептонова кислота, 4,4’метиленбіс-(3-гідроксі-2-ен-1-карбонова кислота), 3-фенілпропіонова кислота, триметилоцтова кислота, трет-бутилоцтова кислота, лаурилсірчана кислота, глюконова кислота, глутамінова кислота, гідроксинафтойна кислота, саліцилова кислота, стеаринова кислота, муконова кислота, п-толуолсульфонова кислота, саліцилова кислота і т.п. [0040] Термін «проліки» відноситься до сполук, які перетерплюють in vivo трансформацію (як правило, швидку) з утворенням вихідної сполуки, яка має наведену вище формулу, наприклад, шляхом гідролізу в крові. Розповсюджені приклади включають, не обмежуючись перерахованими, складноефірні й амідні форми сполуки з активною формою, яка несе фрагмент карбонової кислоти. Приклади фармацевтично прийнятних складних ефірів сполук згідно з даним винаходом включають, не обмежуючись перерахованими, складні алкілефіри (наприклад, приблизно з 1–6 атомами вуглецю), де алкільна група являє собою нерозгалужений або розгалужений ланцюг. Прийнятні складні ефіри також включають складні циклоалкілефіри і складні арилалкілефіри, наприклад, але не обмежуючись зазначеним, бензил. Приклади фармацевтично прийнятних амідів сполук згідно з даним винаходом включають, не обмежуючись перерахованими, первинні аміди, і вторинні і третинні алкіламіди (наприклад, приблизно з 1–6 атомами вуглецю). Аміди і складні ефіри сполук згідно з даним винаходом можуть бути отримані відповідно до загальноприйнятих способів. Докладне обговорення проліків можна знайти у джерелах: T. Higuchi and V. Stella, “Pro-drugs as Novel Delivery Systems,” Vol 14 °F the A.C.S. Symposium Series; і Bioreversible Carriers in Drug Design («Біооборотні носії при розробці лікарських препаратів»), ed. Edward B. Roche, American Pharmaceutical Association and Pergamon Press, 1987; обидва джерела включені в дану заявку за допомогою посилання повністю та для будь-яких цілей. [0041] «Терапевтично ефективна кількість» являє собою кількість сполуки згідно з даним винаходом, яка при введенні пацієнту полегшує симптом захворювання. Мається на увазі, що терапевтично ефективна кількість включає кількість сполуки, яка сама по собі або у сполученні з іншими активними інгредієнтами ефективно лікує, полегшує або зменшує тяжкість остеопорозу. Кількість сполуки згідно з даним винаходом, яка є «терапевтично ефективною кількістю», варіює залежно від сполуки, перебігу захворювання та його тяжкості, віку пацієнта, який підлягає лікуванню, і т.п. Терапевтично ефективна кількість може бути визначена фахівцем у даній області техніки з урахуванням наявного в нього досвіду та беручи до уваги даний опис, однак зазвичай терапевтично ефективна кількість становить від приблизно 0,1 до 1000 мг на добу, і, зокрема, знаходиться в діапазоні від 1 до 100 мг на добу. [0042] «Лікувати» або «лікування» захворювання, розладу або синдрому відповідно до даної заявки включає (i) запобігання настання захворювання, розладу або синдрому в людини, тобто забезпечення відсутності розвитку клінічних симптомів зазначеного захворювання, розладу або синдрому у тварини, яка може бути піддана або схильна до зазначеного захворювання, розладу або синдрому, але в якої раніше були відсутні або не проявлялися симптоми зазначеного захворювання, розладу або синдрому; (ii) придушення захворювання, розладу або синдрому, тобто зупинка його розвитку; і (iii) полегшення захворювання, розладу або синдрому, тобто забезпечення регресії зазначеного захворювання, розладу або синдрому. Як відомо в даній області техніки, можуть вимагатися коректування з урахуванням системної/локалізованої доставки, віку, маси тіла, загального стану здоров'я, статі, харчування, часу введення, взаємодії лікарських засобів і тяжкості стану; такі коректування можуть бути визначені в ході рутинної практики. Варіанти реалізації [0043] Відповідно до одного із варіантів реалізації сполука формули I являє собою сполуку формули Ia: Формула Ia 6 UA 115866 C2 або її фармацевтично прийнятну сіль, де: 1 R являє собою галоген; 2 R являє собою галоген; і Q являє собою CH або N. [0044] Відповідно до ще одного варіанта реалізації сполука формули I являє собою Сполуку 5 1: H N H N O CH3 O F O O H3 C 10 15 20 25 30 35 40 45 50 O N Сполука 1 або її фармацевтично прийнятну сіль. [0045] Як відзначено вище, Сполука 1 у даній заявці називається N-(4-{[6,7біс(метилокси)хінолін-4-іл]окси}феніл)-N'-(4-фторфеніл)циклопропан-1,1-дикарбоксамід. У WO 2005/030140 описана Сполука 1 і спосіб її одержання (Приклади 12, 37, 38 і 48), а також описана терапевтична активність зазначеної сполуки, яка придушує, регулює та/або модулює кіназні шляхи передачі сигналу (розділ «Аналізи», Таблиця 4, пункт 289). Приклад 48 наведений у параграфі [0353] у WO 2005/030140. [0046] Відповідно до інших варіантів реалізації сполуку формули I, Ia, або Сполуку 1, або її фармацевтично прийнятну сіль, вводять у вигляді фармацевтичної композиції, причому зазначена фармацевтична композиція додатково містить фармацевтично прийнятний(у) носій, допоміжну речовину або розріджувач. [0047] Сполука формули I, формули Ia і Сполука I, відповідно до опису в даній заявці, включає як перераховані сполуки, так й індивідуальні ізомери і суміші ізомерів. У кожному випадку сполука формули I включає фармацевтично прийнятні солі, гідрати і/або сольвати наведених сполук і будь-які їхні індивідуальні ізомери або суміш ізомерів. [0048] Відповідно до інших варіантів реалізації сполука формули I, Ia або Сполука 1 може являти собою (L)-малатну сіль. Малатна сіль Сполуки формули I і Сполуки 1 описана у PCT/US2010/021194 і в 61/325095. [0049] Відповідно до інших варіантів реалізації сполука формули I може являти собою (D)малатну сіль. [0050] Відповідно до інших варіантів реалізації сполука формули Ia може являти собою малатну сіль. [0051] Відповідно до інших варіантів реалізації сполука формули Ia може являти собою (L)малатну сіль. [0052] Відповідно до інших варіантів реалізації Сполука 1 може являти собою (D)-малатну сіль. [0053] Відповідно до інших варіантів реалізації Сполука 1 може являти собою малатну сіль. [0054] Відповідно до інших варіантів реалізації Сполука 1 може являти собою (D)-малатну сіль. [0055] Відповідно до ще одного варіанта реалізації зазначена малатна сіль знаходиться у кристалічній формі N-1 (L)-малатної солі та/або (D)-малатної солі Сполуки 1 відповідно до опису в заявці на патент США № 61/325095. Див. також WO 2008/083319 для ознайомлення з властивостями кристалічних енантіомерів, включаючи N-1 і/або N-2 кристалічні форми малатної солі Сполуки 1. Способи одержання та дослідження властивостей таких форм докладно описані у PCT/US10/21194, повністю включеної в дану заявку за допомогою посилання. [0056] Відповідно до ще одного варіанта реалізації даний винахід відноситься до способу полегшення симптомів остеопорозу, який включає введення пацієнту, що потребує такого лікування, терапевтично ефективної кількості сполуки формули I відповідно до будь-якого із описаних у даній заявці варіантів реалізації. [0057] Відповідно до ще одного варіанта реалізації даний винахід відноситься до способу полегшення симптомів остеопорозу, який включає введення пацієнту, що потребує такого лікування, сполуки формули I відповідно до будь-якого із описаних у даній заявці варіантів реалізації в добовій дозі, яка менше або дорівнює 100 мг. Відповідно до конкретного варіанта 7 UA 115866 C2 5 10 15 20 25 30 35 40 45 50 55 60 реалізації сполука формули I являє собою Сполуку 1. У даному і в інших варіантах реалізації доза представлена кількістю, яка перевищує 0 мг. [0058] Відповідно до ще одного варіанта реалізації даний винахід відноситься до способу полегшення симптомів остеопорозу, який включає введення пацієнту, що потребує такого лікування, сполуки формули I відповідно до будь-якого із описаних у даній заявці варіантів реалізації в добовій дозі, яка менше або дорівнює 90 мг. Відповідно до конкретного варіанта реалізації сполука формули I являє собою Сполуку 1. [0059] Відповідно до ще одного варіанта реалізації даний винахід відноситься до способу полегшення симптомів остеопорозу, який включає введення пацієнту, що потребує такого лікування, сполуки формули I відповідно до будь-якого із описаних у даній заявці варіантів реалізації в добовій дозі, яка менше або дорівнює 80 мг. Відповідно до конкретного варіанта реалізації сполука формули I являє собою Сполуку 1. [0060] Відповідно до ще одного варіанта реалізації даний винахід відноситься до способу полегшення симптомів остеопорозу, який включає введення пацієнту, що потребує такого лікування, сполуки формули I відповідно до будь-якого із описаних у даній заявці варіантів реалізації в добовій дозі, яка менше або дорівнює 70 мг. Відповідно до конкретного варіанта реалізації сполука формули I являє собою Сполуку 1. [0061] Відповідно до ще одного варіанта реалізації даний винахід відноситься до способу полегшення симптомів остеопорозу, який включає введення пацієнту, що потребує такого лікування, сполуки формули I відповідно до будь-якого із описаних у даній заявці варіантів реалізації в добовій дозі, яка менше або дорівнює 60 мг. Відповідно до конкретного варіанта реалізації сполука формули I являє собою Сполуку 1. [0062] Відповідно до ще одного варіанта реалізації даний винахід відноситься до способу полегшення симптомів остеопорозу, який включає введення пацієнту, що потребує такого лікування, сполуки формули I відповідно до будь-якого із описаних у даній заявці варіантів реалізації в добовій дозі, яка менше або дорівнює 50 мг. Відповідно до конкретного варіанта реалізації сполука формули I являє собою Сполуку 1. [0063] Відповідно до ще одного варіанта реалізації даний винахід відноситься до способу полегшення симптомів остеопорозу, який включає введення пацієнту, що потребує такого лікування, сполуки формули I відповідно до будь-якого із описаних у даній заявці варіантів реалізації в добовій дозі, яка менше або дорівнює 40 мг. Відповідно до конкретного варіанта реалізації сполука формули I являє собою Сполуку 1. [0064] Відповідно до ще одного варіанта реалізації даний винахід відноситься до способу полегшення симптомів остеопорозу, який включає введення пацієнту, що потребує такого лікування, сполуки формули I відповідно до будь-якого із описаних у даній заявці варіантів реалізації в добовій дозі, яка менше або дорівнює 30 мг. Відповідно до конкретного варіанта реалізації сполука формули I являє собою Сполуку 1. [0065] Відповідно до ще одного варіанта реалізації даний винахід відноситься до способу полегшення симптомів остеопорозу, який включає введення пацієнту, що потребує такого лікування, сполуки формули I відповідно до будь-якого із описаних у даній заявці варіантів реалізації в добовій дозі, яка менше або дорівнює 20 мг. Відповідно до конкретного варіанта реалізації сполука формули I являє собою Сполуку 1. [0066] Відповідно до ще одного варіанта реалізації даний винахід відноситься до способу полегшення симптомів остеопорозу, який включає введення пацієнту, що потребує такого лікування, сполуки формули I відповідно до будь-якого із описаних у даній заявці варіантів реалізації в добовій дозі, яка менше або дорівнює 10 мг. Відповідно до конкретного варіанта реалізації сполука формули I являє собою Сполуку 1. [0067] Відповідно до ще одного варіанта реалізації даний винахід відноситься до способу полегшення симптомів остеопорозу, який включає введення пацієнту, що потребує такого лікування, сполуки формули I відповідно до будь-якого із описаних у даній заявці варіантів реалізації в добовій дозі, яка менше або дорівнює 5 мг. Відповідно до конкретного варіанта реалізації сполука формули I являє собою Сполуку 1. [0068] Відповідно до ще одного варіанта реалізації даний винахід відноситься до способу полегшення симптомів остеопорозу, який включає введення пацієнту, що потребує такого лікування, сполуки формули I відповідно до будь-якого із описаних у даній заявці варіантів реалізації в добовій дозі, що становить від 0,01 мг до 25 мг. Відповідно до конкретного варіанта реалізації сполука формули I являє собою Сполуку 1. [0069] Відповідно до ще одного варіанта реалізації даний винахід відноситься до способу полегшення симптомів остеопорозу, який включає введення пацієнту, що потребує такого лікування, сполуки формули I відповідно до будь-якого із описаних у даній заявці варіантів 8 UA 115866 C2 5 10 15 20 25 30 35 40 45 50 55 60 реалізації в добовій дозі, що становить від 0,1 мг до 15 мг. Відповідно до конкретного варіанта реалізації сполука формули I являє собою Сполуку 1. [0070] Відповідно до ще одного варіанта реалізації даний винахід відноситься до способу полегшення симптомів остеопорозу, який включає введення пацієнту, що потребує такого лікування, сполуки формули I відповідно до будь-якого із описаних у даній заявці варіантів реалізації в добовій дозі, що становить від 1 мг до 10 мг. Відповідно до конкретного варіанта реалізації сполука формули I являє собою Сполуку 1. [0071] Відповідно до ще одного варіанта реалізації даний винахід відноситься до способу зниження тяжкості остеопорозу в пацієнтів, які проходили або проходять лікування раку молочної або передміхурової залози, який включає введення пацієнту, що потребує такого лікування, сполуки формули I відповідно до будь-якого із описаних у даній заявці варіантів реалізації в добовій дозі, яка менше або дорівнює 100, 95, 90, 85, 80, 75, 70, 65, 60, 55, 50, 45, 40, 35, 30, 25, 20, 15, 10 або 5 мг. Відповідно до деяких варіантів реалізації зазначене ракове захворювання являє собою рак молочної залози, рак передміхурової залози, рак кістки і/або пухлини кістки. Відповідно до конкретного варіанта реалізації сполука формули I являє собою Сполуку 1. Відповідно до конкретного варіанта реалізації Сполука формули I являє собою Сполуку 1, а доза становить від 0,01 до 25 мг. [0072] Відповідно до ще одного варіанта реалізації даний винахід відноситься до способу зменшення аномального відкладення безструктурної кісткової тканини, яке супроводжується підвищенням числа переломів скелетних кісток, компресією спинного мозку і сильним кістковим болем при остеопорозі, який включає введення пацієнту, що потребує такого лікування, терапевтично ефективної кількості сполуки формули I відповідно до будь-якого із описаних у даній заявці варіантів реалізації в добовій дозі, яка менше або дорівнює 1100, 95, 90, 85, 80, 75, 70, 65, 60, 55, 50, 45, 40, 35, 30, 25, 20, 15, 10 або 5 мг. Відповідно до конкретного варіанта реалізації Сполука формули I являє собою Сполуку 1, а доза становить від 0,01 до 25 мг. [0073] Як було відзначено вище, здатність сполуки формули I лікувати, полегшувати або зменшувати тяжкість остеопорозу може бути визначена і якісно, і кількісно з використанням різних циркулюючих або сечових маркерів. Відповідно до деяких варіантів реалізації маркери, які підходять для індивідуального моніторингу пацієнтів із остеопорозом, що одержують лікування антирезорбтивними агентами, можуть бути вибрані із загальної лужної фосфатази сироватки, кістково-специфічної лужної фосфатази сироватки, остеокальцину сироватки, проколагену 1 типу в сироватці (C-термінального/N-термінального): C1NP або PINP [для моніторингу кісткоутворення], гідроксипроліну сечі, загального піридиноліну в сечі (ПІД), вільного дезоксипіридиноліну в сечі (ДПІД), перехресно-зв'язаних N-термінальних тілопептидів колагену 1 типу (NTx) у сечі, перехресно-зв'язаних C-термінальних тілопептидів колагену 1 типу (CTx) у сечі або у сироватці, кісткового сіалопротеїну (КС) і стійкої до тартрату кислої фосфатази 5b [для моніторингу резорбції кістки]. [0074] Відповідно до конкретного варіанта реалізації маркер являє собою CTx. CTx являє собою фрагмент колагену 1 типу, який розщеплюється остеокластами при резорбції кістки, тому вважається, що його рівні у сироватці пропорційні активності остеокластів у момент часу, коли був узятий зразок. Відповідно, CTx у сироватці широко використовується для відстеження впливу бісфосфонатів на кісткову тканину (Marx et al, 2007). У проміжне дослідження в рамках дослідження поновлення кісткової тканини – випробування для оцінки зниження переломів при остеопорозі при застосуванні деносумабу кожні 6 місяців (FREEDOM) – включали 160 жінок, які рандомізовано одержували підшкірні ін'єкції деносумабу (60 мг) або плацебо кожні 6 місяців протягом 3 років. Через місяць після ін'єкції рівні CTx у сироватці у всіх суб'єктів, які одержували деносумаб, опускалися нижче пременопаузального референтного інтервалу. Крім того, спостерігалася значна кореляція між зниженням CTx і підвищенням мінеральної щільності кісткової тканини у суб'єктів, які одержували лікування деносумабом (Eastell et al, 2011). Крім надання зазначених ефектів на CTx, у дослідженні Фази 1 одна підшкірна ін'єкція деносумабу дозозалежним чином знижувала у жінок у постменопаузі вміст NTx у сечі на величину до 81% протягом періоду тривалістю 6 місяців (Bekker et al, 2004). [0075] Відповідно до ще одного варіанта реалізації зазначений маркер являє собою ТрКФ5b. [0076] У пацієнтів із метастатичним кастраційно-резистентним раком передміхурової залози введення Сполуки 1 зв'язували зі зменшенням CTx у плазмі, незалежно від того, чи одержували суб'єкти раніше лікування бісфосфонатами (Hussain et al, 2011). Аналогічні ефекти Сполуки 1 спостерігалися у пацієнтів при відсутності виявлених метастаз у кісткову тканину (Gordon et al, 2011), коли попереднє застосування бісфосфонатів призначалося саме для лікування пацієнтів із остеопорозом. Здатність Сполуки 1 знижувати рівні CTx у плазмі в пацієнтів незалежно від 9 UA 115866 C2 5 10 15 20 25 30 35 40 45 50 55 60 попереднього лікування бісфосфонатами і незалежно від наявності метастатичних ушкоджень кісткової тканини свідчить про сильний вплив на блокування аномального поновлення кісткової тканини. [0077] Відповідно, відповідно до ще одного варіанта реалізації даний винахід відноситься до способу зниження CTx у плазмі в пацієнта, який страждає від остеопорозу, що включає введення пацієнту, який потребує такого лікування, сполуки формули I відповідно до будь-якого із описаних у даній заявці варіантів реалізації в добовій дозі, яка менше або дорівнює 100, 95, 90, 85, 80, 75, 70, 65, 60, 55, 50, 45, 40, 35, 30, 25, 20, 15, 10 або 5 мг один раз на добу. Відповідно до конкретного варіанта реалізації Сполука формули I являє собою Сполуку 1, а доза становить від 0,01 до 25 мг. [0078] Відповідно до іншого аспекту в даному винаході запропонований спосіб прогнозування остеопорозу в суб'єкта, який включає: (a) вимірювання рівня P1NP, CTx або ТрКФ-5b у зразку, отриманому від суб'єкта; (b) порівняння рівня P1NP, CTx або ТрКФ-5b, виміряного на етапі (a), зі стандартним рівнем P1NP, CTx або ТрКФ-5b b для визначення того, чи містить отриманий від суб'єкта зразок рівні P1NP, CTx або ТрКФ-5b, які не відповідають нормі; (c) вибір схеми лікування Сполукою формули I, Ia або 1 на підставі рівнів P1NP, CTx або ТрКФ-5b, які не відповідають нормі, або введення Сполуки формули I, Ia або 1 у відповідності зі схемою лікування, яка забезпечує придушення остеопорозу в зазначеного суб'єкта. [0079] Відповідно до ще одного варіанта реалізації в даному винаході запропонований спосіб стимуляції диференціювання й/або активності остеобластів у пацієнта, який потребує такого лікування, що включає введення зазначеному пацієнту ефективної кількості Сполуки формули I, Ia або Сполуки 1 відповідно до будь-якого із описаних у даній заявці варіантів реалізації в добовій дозі, яка менше або дорівнює 100, 95, 90, 85, 80, 75, 70, 65, 60, 55, 50, 45, 40, 35, 30, 25, 20, 15, 10 або 5 мг один раз на добу. Відповідно до конкретного варіанта реалізації Сполука формули I являє собою Сполуку 1, а доза становить від 0,01 до 25 мг один раз на добу. [0080] Відповідно до іншого аспекту в даному винаході запропонований спосіб стимуляції кісткоутворення у пацієнта, який потребує такого лікування, що включає введення зазначеному пацієнту ефективної кількості Сполуки формули I, Ia або Сполуки 1 відповідно до будь-якого із описаних у даній заявці варіантів реалізації в добовій дозі, яка менше або дорівнює 100, 95, 90, 85, 80, 75, 70, 65, 60, 55, 50, 45, 40, 35, 30, 25, 20, 15, 10 або 5 мг один раз на добу. Відповідно до конкретного варіанта реалізації Сполука формули I являє собою Сполуку 1, а доза становить від 0,01 до 25 мг один раз на добу. [0081] Відповідно до іншого аспекту в даному винаході запропонований спосіб придушення диференціювання остеокластів у пацієнта, який потребує такого лікування, що включає введення зазначеному пацієнту ефективної кількості Сполуки формули I, Ia або Сполуки 1 відповідно до будь-якого із описаних у даній заявці варіантів реалізації в добовій дозі, яка менше або дорівнює 100, 95, 90, 85, 80, 75, 70, 65, 60, 55, 50, 45, 40, 35, 30, 25, 20, 15, 10 або 5 мг один раз на добу. Відповідно до конкретного варіанта реалізації Сполука формули I являє собою Сполуку 1, а доза становить від 0,01 до 25 мг один раз на добу. [0082] Відповідно до іншого аспекту в даному винаході запропонований спосіб модулювання поновлення кісткової тканини у напрямку кісткоутворення у пацієнта, який потребує такого лікування, що включає введення зазначеному пацієнту ефективної кількості Сполуки формули I, Ia або Сполуки 1 відповідно до будь-якого із описаних у даній заявці варіантів реалізації в добовій дозі, яка менше або дорівнює 100, 95, 90, 85, 80, 75, 70, 65, 60, 55, 50, 45, 40, 35, 30, 25, 20, 15, 10 або 5 мг один раз на добу. Відповідно до конкретного варіанта реалізації Сполука формули I являє собою Сполуку 1, а доза становить від 0,01 до 25 мг один раз на добу. [0083] Відповідно до іншого аспекту в даному винаході запропонований спосіб лікування остеопорозу в пацієнтів після оваріектомії, що включає введення зазначеному пацієнту ефективної кількості Сполуки формули I, Ia або Сполуки 1 відповідно до будь-якого із описаних у даній заявці варіантів реалізації в добовій дозі, яка менше або дорівнює 100, 95, 90, 85, 80, 75, 70, 65, 60, 55, 50, 45, 40, 35, 30, 25, 20, 15, 10 або 5 мг один раз на добу. Відповідно до конкретного варіанта реалізації Сполука формули I являє собою Сполуку 1, а доза становить від 0,01 до 25 мг один раз на добу. [0084] Відповідно до іншого аспекту в даному винаході запропонований спосіб модулювання поновлення кісткової тканини у напрямку кісткоутворення у пацієнтів після оваріектомії, що включає введення зазначеному пацієнту ефективної кількості Сполуки формули I, Ia або Сполуки 1 відповідно до будь-якого із описаних у даній заявці варіантів реалізації в добовій дозі, яка менше або дорівнює 100, 95, 90, 85, 80, 75, 70, 65, 60, 55, 50, 45, 40, 35, 30, 25, 20, 15, 10 10 UA 115866 C2 5 10 15 20 25 30 35 40 45 50 55 60 або 5 мг один раз на добу. Відповідно до конкретного варіанта реалізації Сполука формули I являє собою Сполуку 1, а доза становить від 0,01 до 25 мг один раз на добу. [0085] Відповідно до ще одного варіанта реалізації в даному винаході запропонований спосіб лікування остеопорозу в пацієнта, що включає введення зазначеному пацієнту ефективної кількості Сполуки формули I, Ia або Сполуки 1 відповідно до будь-якого із описаних у даній заявці варіантів реалізації в добовій дозі, яка менше або дорівнює 100, 95, 90, 85, 80, 75, 70, 65, 60, 55, 50, 45, 40, 35, 30, 25, 20, 15, 10 або 5 мг один раз на добу. Відповідно до одного із варіантів реалізації зазначене лікування призводить до стимулювання диференціювання остеобластів. Відповідно до ще одного варіанта реалізації зазначене лікування призводить до стимулювання кісткоутворення. Відповідно до ще одного варіанта реалізації зазначене лікування призводить до придушення диференціювання й/або активності остеокластів. Відповідно до ще одного варіанта реалізації зазначене лікування призводить до модулювання поновлення у напрямку кісткоутворення. Відповідно до цього й інших варіантів реалізації Сполука формули I являє собою Сполуку 1, і доза становить від 0,01 до 25 мг один раз на добу. Введення [0086] Введення сполуки формули I, формули Ia або Сполуки 1 або її фармацевтично прийнятної солі, у чистому вигляді або у складі придатної фармацевтичної композиції, може здійснюватися із застосуванням будь-якого прийнятного способу введення або агентів, які підходять для аналогічного використання. Відповідно, введення може бути, наприклад, пероральним, назальним, парентеральним (внутрішньовенним, внутрішньом'язовим або підшкірним), місцевим, трансдермальним, інтравагінальним, інтравезикальним, інтрацистернальним або ректальним, можуть вводитися тверді, напівтверді, ліофілізовані порошкові або рідкі дозовані форми, такі як, наприклад, таблетки, супозиторії, пігулки, м'які еластичні та тверді желатинові дозовані форми (які можуть бути представлені капсулами або таблетками), порошки, розчини, суспензії або аерозолі, або т.п., зокрема, одиничні дозовані форми, які підходять для легкого введення точних доз. [0087] Зазначені композиції включають загальноприйнятий(у) фармацевтичний(у) носій або допоміжну речовину і сполуку формули I як активний агент, і можуть додатково включати носії, ад’юванти і т.п. [0088] Ад’юванти включають консерванти, змочувальні, суспензувальні, підсолоджуючі, смакоароматичні, запашникові, емульгуючі та диспергуючі агенти. Запобігання дії мікроорганізмів може бути забезпечено різними антибактеріальними і протигрибковими агентами, наприклад, парабенами, хлорбутанолом, фенолом, сорбіновою кислотою і т.п. Також може бути бажане включення ізотонічних агентів, наприклад, цукру, хлориду натрію і т.п. Пролонгована абсорбція придатної для ін'єктування лікарської форми може бути забезпечена за рахунок застосування агентів, які сповільнюють абсорбцію, наприклад, моностеарату алюмінію та желатину. [0089] При необхідності фармацевтична композиція зі сполукою, яка має формулу I, може також містити незначні кількості допоміжних речовин, таких як змочувальні або емульгуючі агенти, рН-буферних агентів, антиоксидантів і т.п., таких як, наприклад, лимонна кислота, сорбітанмонолаурат, триетаноламін олеат, бутильований гідрокситолуол і т.п. [0090] Вибір композиції залежить від різних факторів, таких як спосіб введення лікарського засобу (наприклад, для перорального введення, композицій у формі таблеток, пігулок або капсул) і біодоступність лікарської речовини. За останній час були розроблені фармацевтичні композиції, зокрема, з лікарськими речовинами, що демонструють низьку біодоступність, на основі принципу можливості підвищення біодоступності завдяки збільшенню площі поверхні, тобто зниження розміру часток. Наприклад, у патенті США № 4107288 описана фармацевтична композиція, яка містить частки з розмірами у діапазоні від 10 до 1000 нм, де активна речовина розташовується на підтримуючій перехресно-зшитій макромолекулярній підкладці. У патенті США № 5145684 описане одержання фармацевтичної композиції, яке відрізняється тим, що лікарську речовину розпорошують на наночастинки (середній розмір частинок – 400 нм) у присутності модифікатора поверхні, і потім диспергують у рідкому середовищі з одержанням фармацевтичної композиції, яка демонструє винятково високу біодоступність. [0091] Композиції, які підходять для парентеральних ін'єкцій, можуть містити фізіологічно прийнятні стерильні водні або неводні розчини, дисперсії, суспензії або емульсії, і стерильні порошки для відновлення стерильних придатних для ін'єктування розчинів або дисперсій. Приклади придатних водних і неводних носіїв, розріджувачів, розчинників або основ включають воду, етанол, поліоли (пропіленгліколь, поліетиленгліколь, гліцерин і т.п.), їхні придатні суміші, рослинні олії (наприклад, оливкова олія) і придатні для ін'єктування органічні складні ефіри, наприклад, етилолеат. Потрібна текучість може забезпечуватися, наприклад, за рахунок 11 UA 115866 C2 5 10 15 20 25 30 35 40 45 50 55 60 застосування покриття, такого як лецитин, підтримки необхідного розміру частинок у випадку дисперсій та застосування поверхнево-активних речовин. [0092] Одним із конкретних шляхів введення є пероральне введення з використанням зручної схеми щоденного дозування, яка може коректуватися у відповідності зі ступенем тяжкості хворобливого стану, що підлягає лікуванню. [0093] Тверді дозовані форми для перорального введення включають капсули, таблетки, пігулки, порошки і гранули. У таких твердих дозованих формах активну сполуку змішують щонайменше з однією звичайною інертною допоміжною речовиною (або носієм), таким як цитрат натрію або дикальційфосфат, або (a) наповнювачами або об'ємоутворювачами, такими як крохмалі, лактоза, сахароза, глюкоза, маніт і кремнієва кислота, (b) сполучними засобами, такими як похідні целюлози, крохмаль, альгінати, желатин, полівінілпіролідон, сахароза та гуміарабік, (c) зволожувачами, наприклад, гліцерином, (d) поліпшуючими розпадання агентами, такими як агар-агар, карбонат кальцію, картопляний або тапіоковий крохмаль, альгінова кислота, кроскармелоза натрію, комплексні силікати і карбонат натрію, (e) сповільнювачами розчинення, такими як, наприклад, парафін, (f) прискорювачами абсорбції, наприклад, четвертинними сполуками амонію, (g) змочувальними агентами, такими як цетиловий спирт і моностеарат гліцерину, стеарат магнію і т.п. (h) адсорбентами, наприклад, каоліном і бентонітом, і (i) змазуючими речовинами, такими як тальк, стеарат кальцію, стеарат магнію, тверді поліетиленгліколі, лаурилсульфат натрію або їх суміші. У випадкукапсул, таблеток і пігулок дозовані форми можуть також містити буферні агенти. [0094] Тверді дозовані форми відповідно до наведеного вище опису можуть бути отримані з покриттями й оболонками, такими як кишковорозчинні покриття та інші, добре відомі в даній області техніки. Вони можуть містити агенти, що замутнюють, а також можуть мати склад, який забезпечує відстрочене вивільнення активної сполуки або сполук у певній частині шлунковокишкового тракту. Прикладами придатних матриксних композицій є полімерні речовини і воски. Активні сполуки можуть також знаходитися в мікрокапсульованій формі, при необхідності, разом із однією або більше зі згаданих вище допоміжних речовин. [0095] Рідкі дозовані форми для перорального введення включають фармацевтично прийнятні емульсії, розчини, суспензії, сиропи і еліксири. Такі дозовані форми одержують, наприклад, шляхом розчинення, диспергування і т.п., сполуки формули I або її фармацевтично прийнятної солі та, необов'язково, фармацевтичних ад’ювантів у носії, такому як, наприклад, вода, сольовий розчин, водний розчин декстрози, гліцерин, етанол і т.п.; солюбілізуючих агентах і емульгаторах, наприклад, етиловому спирті, ізопропіловому спирті, етилкарбонаті, етилацетаті, бензиловому спирті, бензилбензоаті, пропіленгліколі, 1,3-бутиленгліколі, диметилформаміді; маслах, зокрема, бавовняному маслі, маслі земляного горіха, маслі зародків кукурудзи, оливковому маслі, касторовому маслі та кунжутному маслі, гліцерині, тетрагідрофурфуриловому спирті, поліетиленгліколях і складних ефірах жирних кислот і сорбіту; або сумішах зазначених речовин і т.п., з одержанням таким чином розчину або суспензії. [0096] Суспензії, крім активних сполук, можуть містити суспендуючі агенти, наприклад, етоксильовані ізостеарилові спирти, поліоксіетиленсорбіт і складні ефіри сорбіту, мікрокристалічну целюлозу, метагідроксид алюмінію, бентоніт, агар-агар, трагакантову камедь або суміші зазначених речовин, і т.п. [0097] Композиції для ректального введення являють собою, наприклад, супозиторії, які можуть бути отримані змішуванням сполуки формули I з, наприклад, придатними неподразнюючими допоміжними речовинами або носіями, такими як масло какао, поліетиленгліколь або віск для супозиторіїв, твердими при звичайних температурах, але рідкими при температурі тіла, і, відповідно такими, які плавляться при знаходженні у придатній порожнині тіла та вивільняють у зазначену порожнину тіла активний компонент. [0098] Дозовані форми сполуки формули I для місцевого введення включають мазі, порошки, спреї та форми для інгаляцій. Активний компонент змішують у стерильних умовах з фізіологічно прийнятним носієм і, за необхідності, будь-якими консервантами, буферами або речовинами, що розпорошують. Мається на увазі, що офтальмологічні композиції, очні мазі, порошки і розчини також входять в обсяг винаходу згідно з даним описом. [0099] Для диспергування сполуки формули I у формі аерозолю можуть застосовуватися стиснені гази. Інертними газами, які підходять для зазначеної мети, є азот, діоксид вуглецю і т.п. [00100] Як правило, залежно від передбачуваного способу введення, фармацевтично прийнятні композиції містять від приблизно 1% до приблизно 99% за масою сполуки(к) формули I або її фармацевтично прийнятної солі, і від 99% до 1% за масою придатної фармацевтичної допоміжної речовини. Відповідно до одного із прикладів композиція містить від приблизно 5% до 12 UA 115866 C2 5 10 15 20 25 30 35 40 приблизно 75% за масою сполуки(к) формули I, формули Ia або Сполуки 1, або її фармацевтично прийнятної солі, інша частина представлена придатними фармацевтичними допоміжними речовинами. [00101] Фактичні способи одержання таких дозованих форм відомі фахівцям у даній області техніки або будуть для них очевидні; див., наприклад, Remington's Pharmaceutical Sciences, 18th Ed., (Mack Publishing Company, Easton, Pa., 1990). У будь-якому випадку, композиція для введення містить терапевтично ефективну кількість сполуки формули I або її фармацевтично прийнятної солі, для лікування хворобливого стану відповідно до концепцій винаходу згідно з даним описом. [00102] Сполуки згідно з даним описом або їх фармацевтично прийнятні солі або сольвати вводять у терапевтично ефективній кількості, яка варіює залежно від різноманітних факторів, у тому числі – від активності конкретної сполуки, яку використовують, метаболічної стабільності та тривалості дії зазначеної сполуки, віку, маси тіла, загального стану здоров'я, статі, харчування, способу та часу введення, швидкості виведення, сполучення лікарських речовин, тяжкості конкретного хворобливого стану, і суб'єкта, якого піддають терапії. Пацієнту можуть вводитися дози сполуки формули I, формули Ia або Сполуки 1 у діапазоні від приблизно 0,1 до приблизно 1000 мг на добу, і від приблизно 1 до приблизно 150 мг на добу. Наприклад, для середньостатистичної дорослої людини, яка має масу тіла приблизно 70 кілограмів, доза може становити від приблизно 0,01 до приблизно 100 мг на кілограм маси тіла на добу. Конкретне дозування, яке використовується, проте, може бути різним. Наприклад, дозування може залежати від ряду факторів, включаючи потреби пацієнта, тяжкість стану, який підлягає лікуванню, і фармакологічну активність сполуки, яка використовується. Визначення оптимальних дозувань для конкретного пацієнта добре знайоме фахівцям у даній області техніки. [00103] Відповідно до інших варіантів реалізації сполука формули I, формули Ia або Сполука 1, може вводитися пацієнту одночасно з іншими способами лікування раку. Такі способи лікування включають, зокрема, інші хіміотерапевтичні засоби для лікування раку, замісну гормональну терапію, променеву терапію або імунотерапію. Вибір додаткової терапії залежить від ряду факторів, у тому числі метаболічної стабільності та тривалості дії зазначеної сполуки, віку, маси тіла, загального стану здоров'я, статі, харчування, способу і часу введення, швидкості виведення, сполучення лікарських речовин, тяжкості конкретного хворобливого стану і суб'єкта, який піддається терапії. [00104] Відповідно до одного із варіантів реалізації сполуку формули I, формули Ia або Сполуку 1 вводять перорально у вигляді капсули. Відповідно до ще одного варіанта реалізації Сполуку 1 вводять перорально у вигляді капсули. Зазначена капсула може містити 100, 95, 90, 85, 80, 75, 70, 65, 60, 55, 50, 45, 40, 35, 30, 25, 20, 15, 10 або 5 мг або менше Сполуки 1. Відповідно до одного із варіантів реалізації доза становить від 0,01 до 25 мг. [00105] Відповідно до ще одного варіанта реалізації сполуку формули I, формули Ia або Сполуку 1 вводять перорально у вигляді таблетки. [00106] Відповідно до ще одного варіанта реалізації Сполуку 1 або фармацевтично прийнятну сіль Сполуки 1 вводять перорально у вигляді таблетки відповідно до наведеної нижче таблиці. Інгредієнт СПОЛУКА 1 Мікрокристалічна целюлоза Лактоза безводна Гідроксипропілцелюлоза Кроскармелоза натрію Всього, всередині гранули Діоксид кремнію, Колоїдний Кроскармелоза натрію Стеарат магнію Всього 45 (% за масою) 31,68 38,85 19,42 3,00 3,00 95,95 0,30 3,00 0,75 100,00 [00107] Відповідно до ще одного варіанта реалізації Сполуку 1 або фармацевтично прийнятну сіль Сполуки 1 вводять перорально у вигляді таблетки відповідно до наведеної нижче таблиці. 13 UA 115866 C2 Інгредієнт Сполука 1 Мікрокристалічна целюлоза Гідроксипропілцелюлоза Полоксамер Кроскармелоза натрію Колоїдний діоксид кремнію Стеарат магнію Всього 5 (% за масою) 25,0–33,3 за необхідності 3 0–3 6,0 0,5 0,5–1,0 100 [00108] Відповідно до ще одного варіанта реалізації Сполуку 1 або фармацевтично прийнятну сіль Сполуки 1 вводять перорально у вигляді таблетки відповідно до наведеної нижче таблиці. Інгредієнт Сполука 1 Мікрокристалічна целюлоза PH-102 Лактоза безводна 60M Гідроксипропілцелюлоза, EXF Кроскармелоза натрію Колоїдний діоксид кремнію Стеарат магнію (Не бичачий) Опадрай жовтий Всього 10 15 Теоретична кількість (мг/од. дози) 100,0 155,4 77,7 12,0 24 1,2 3,0 16,0 416 [00109] Описані вище склади для таблеток можуть бути модифіковані таким чином, щоб забезпечувати пероральну дозу 95, 90, 85, 80, 75, 70, 65, 60, 55, 50, 45, 40, 35, 30, 25, 20, 15, 10 або 5 мг або менше Сполуки 1 або фармацевтично прийнятної солі Сполуки 1. Відповідно до одного із варіантів реалізації доза становить від 0,01 до 25 мг. Одержання Сполуки 1 [00110] Одержання N-(4-{[6,7-біс(метилокси)хінолін-4-іл]окси}феніл)-N'-(4фторфеніл)циклопропан-1,1-дикарбоксаміду та її (L)-малатної солі. [00111] Спосіб синтезу, який застосовують для одержання N-(4-[6,7-біс(метилокси)хінолін-4іл]окси}феніл)-N'-(4-фторфеніл)циклопропан-1,1-дикарбоксаміду та її (L)-малатної солі, представлений на Схемі 1: 14 UA 115866 C2 Схема 1 5 10 15 20 25 30 Одержання 4-Хлор-6,7-диметоксихіноліну [00112] У реактор завантажували послідовно 6,7-диметоксихінолін-4-ол (10,0 кг) і ацетонітрил (64,0 л). Отриману суміш нагрівали до приблизно 65 °C і додавали оксихлорид фосфору (POCl3, 50,0 кг). Після додавання POCl3 температуру реакційної суміші підвищували до приблизно 80 °C. Реакцію вважають завершеною (приблизно 9,0 годин), коли залишається менше ніж 2 відсотки вихідного матеріалу (проведений у ході реакції аналіз із застосуванням високоефективної рідинної хроматографії [ВЕРХ]). Реакційну суміш охолоджували приблизно до 10 °C і потім зупиняли реакцію, виливаючи суміш в охолоджений розчин дихлорметану (ДХМ, 238,0 кг), 30% NH4OH (135,0 кг) і льоду (440,0 кг). Отриману суміш нагрівали до приблизно 14 °C, і розділяли фази. Органічну фазу відмивають водою (40,0 кг) і концентрували шляхом вакуумної дистиляції для видалення розчинника (приблизно 190,0 кг). До складу додавали метил-трет-бутиловий ефір (МТБЕ, 50,0 кг), і суміш охолоджували приблизно до 10 °C; за цей час продукт кристалізувався. Тверді речовини витягали шляхом центрифугування, промивали н-гептаном (20,0 кг) і висушували приблизно при 40 °C з одержанням титульної сполуки (8,0 кг). Одержання 6,7-диметил-4-(4-нітрофенокси)-хіноліну [00113] У реактор послідовно завантажували 4-хлор-6,7-диметоксихінолін (8,0 кг), 4нітрофенол (7,0 кг), 4-диметиламінопіридин (0,9 кг), і 2,6-лутидин (40,0 кг). Вміст реактора нагрівали приблизно до 147 °C. Після завершення реакції (менше ніж 5% вихідного матеріалу, що залишився, відповідно до оцінки за допомогою проведеного в ході реакції ВЕРХ-аналізу; приблизно 20 годин), вміст реактора залишали охолоджуватися до приблизно 25 °C. Додавали метанол (26,0 кг), а потім карбонат калію (3,0 кг), розчинений у воді (50,0 кг). Вміст реактора перемішували протягом приблизно 2 годин. Отриманий твердий осад фільтрували, промивали водою (67,0 кг) і висушували при 25 °C протягом приблизно 12 годин з одержанням титульної сполуки (4,0 кг). Одержання 4-(6,7-диметоксихінолін-4-ілокси)-феніламіну [00114] Розчин, який містить форміат калію (5,0 кг), мурашину кислоту (3,0 кг) і воду (16,0 кг) додавали до суміші 6,7-диметокси-4-(4-нітро-фенокси)-хіноліну (4,0 кг), 10% паладію на вугіллі (водонасиченість 50%, 0,4 кг) у тетрагідрофурані (ТГФ, 40,0 кг), нагрітої до приблизно 60 °C. Додавання робили таким чином, щоб температура реакційної суміші зберігала значення приблизно 60 °C. Коли реакцію вважали завершеною відповідно до оцінки за допомогою 15 UA 115866 C2 5 10 15 20 25 30 35 40 45 50 проведеного в ході реакції ВЕРХ-аналізу (менше ніж 2% вихідного матеріалу, що залишився, як правило, 1 5 годин), вміст реактора фільтрували. Фільтрат концентрували шляхом вакуумної дистиляції при приблизно 35 °C до половини вихідного об’єму, що призводило до випадання в осад продукту. Зазначений продукт витягали фільтрацією, промивали водою (12,0 кг) і висушували під вакуумом при приблизно 50 °C з одержанням титульної сполуки (3,0 кг; 97% площа під кривою (AUC)). Одержання 1-(4-фтор-фенілкарбамоїл)-циклопропанкарбонової кислоти [00115] Триетиламін (8,0 кг) додавали до охолодженого (приблизно 4 °C) розчину комерційно доступної циклопропан-1,1-дикарбонової кислоти (2 1, 10,0 кг) у ТГФ (63,0 кг) з такою швидкістю, щоб температура вмісту реактора не перевищувала 10 °C. Розчин перемішували протягом приблизно 30 хвилин, потім додавали тіонілхлорид (9,0 кг) при підтримці температури вмісту реактора нижче 10 °C. Після того як додавання було завершено, додавали розчин 4-фтораніліну (9,0 кг) у ТГФ (25,0 кг) з такою швидкістю, щоб температура вмісту реактора не перевищувала 10 °C. Суміш перемішували протягом приблизно 4 годин і потім розбавляли ізопропілацетатом (87,0 кг). Зазначений розчин послідовно промивали водним розчином гідроксиду натрію (2,0 кг, розчинені в 50,0 л води), водою (40,0 л) і водним розчином хлориду натрію (10,0 кг, розчинені в 40,0 л води). Органічний розчин концентрували шляхом вакуумної дистиляції, після чого додавали гептан, що призводило до випадання в осад твердої речовини. Тверду речовину витягали шляхом центрифугування та потім висушували при приблизно 35 °C під вакуумом з одержанням титульної сполуки (10,0 кг). Одержання 1-(4-фтор-фенілкарбамоїл)-циклопропанкарбонілхлориду [00116] Оксалілхлорид (1,0 кг) додавали до розчину 1-(4-фтор-фенілкарбамоїл)циклопропанкарбонової кислоти (2,0 кг) у суміші ТГФ (11 кг) і N,N-диметилформаміду (ДМФА; 0,02 кг) з такою швидкістю, щоб температура вмісту реактора не перевищувала 30 °C. Зазначений розчин використовували на наступному етапі без подальшої обробки. Одержання N-(4-{[6,7-біс(метилокси)хінолін-4-іл]окси}феніл)-N'-(4-фторфеніл)циклопропан1,1-дикарбоксаміду [00117] Отриманий у ході попереднього етапу розчин, який містить 1-(4-фторфенілкарбамоїл)-циклопропанкарбонілхлорид, додавали до суміші 4-(6,7-диметоксихінолін-4ілокси)-феніламіну (3,0 кг) і карбонату калію (4,0 кг) у ТГФ (27,0 кг) і воді (13,0 кг) з такою швидкістю, щоб температура вмісту реактора не перевищувала 30 °C. Після завершення реакції (як правило, через 10 хвилин), додавали воду (74,0 кг). Суміш перемішували при 15–30 °C протягом приблизно 10 годин, що призводило до випадання в осад продукту. Зазначений продукт витягали фільтрацією, промивали попередньо приготовленим розчином ТГФ (11,0 кг) і води (24,0 кг), і висушували при приблизно 65 °C під вакуумом протягом приблизно 12 годин з одержанням титульної сполуки (вільна основа, 5,0 кг). 1H ЯМР (400 МГц, d6-ДМСО): δ 10,2 (s, 1H), 10,05 (s, 1H), 8,4 (s, 1H), 7,8 (m, 2H), 7,65 (m, 2H), 7,5 (s, 1H), 7,35 (s, 1H), 7,25 (m, 2H), 7,15 (m, 2H), 6,4 (s, 1H), 4,0 (d, 6H), 1,5 (s, 4H), РХ/МС: M+H= 502. Одержання N-(4-{[6,7-біс(метилокси)хінолін-4-іл]окси}феніл)-N'-(4-фторфеніл)циклопропан1,1-дикарбоксаміду, (L)-малатної солі [00118] Розчин L-яблучної кислоти (2,0 кг) у воді (2,0 кг) додавали до розчину циклопропан1,1-дикарбонової кислоти [4-(6,7-диметоксихінолін-4-ілокси)-феніл]-амід (4-фтор-феніл)-аміду у вигляді вільної основи (1 5, 5,0 кг) в етанолі, при підтримці температури вмісту реактора, що становить приблизно 25 °C. Потім додавали вуглець (0,5 кг) і тіол-кремнезем (0,1 кг), отриману суміш нагрівали приблизно до 78 °C, і в цей момент додавали воду (6,0 кг). Потім реакційну суміш фільтрували, після чого додавали ізопропанол (38,0 кг) і залишали для охолодження приблизно до 25 °C. Продукт витягали фільтрацією, промивали ізопропанолом (20,0 кг) і висушували приблизно при 65 °C з одержанням титульної сполуки (5,0 кг). Альтернативний спосіб одержання N-(4-{[6,7-біс(метилокси)хінолін-4-іл]окси}феніл)-N'-(4фторфеніл)циклопропан-1,1-дикарбоксаміду та її (L)-малатної солі. [00119] Альтернативний спосіб синтезу, який може застосовуватися для одержання N-(4{[6,7-біс(метилокси)хінолін-4-іл]окси}феніл)-N'-(4-фторфеніл)циклопропан-1,1-дикарбоксаміду та її (L)-малатної солі, представлений на Схемі 2. 16 UA 115866 C2 Схема 2 5 10 15 20 25 30 35 Одержання 4-хлор-6,7-диметоксихіноліну [00120] У реактор завантажували послідовно 6,7-диметоксихінолін-4-ол (47,0 кг) і ацетонітрил (318,8 кг). Отриману суміш нагрівали до приблизно 60 °C і додавали оксихлорид фосфору (POCl3, 130,6 кг). Після додавання POCl3 температуру реакційної суміші підвищували до приблизно 77 °C. Реакцію вважали завершеною (приблизно через 13 годин), коли залишалося менше 3% вихідного матеріалу (аналіз із застосуванням проведеної в ході реакції високоефективної рідинної хроматографії [ВЕРХ]). Реакційну суміш охолоджували приблизно до 2–7 °C, і потім зупиняли реакцію, виливаючи суміш в охолоджений розчин дихлорметану (ДХМ, 482,8 кг), 26% NH4OH (251,3 кг) і води (900 л). Отриману суміш нагрівали до приблизно 20– 25 °C, і розділяли фази. Органічну фазу фільтрували через шар AW Hyflo Super-Cel NF (целіт; 5,4 кг); фільтруючий шар промивали ДХМ (118,9 кг). Комбіновану органічну фазу відмивали насиченим сольовим розчином (282,9 кг) і змішували з водою (120 л). Розділені фази і органічну фазу концентрували шляхом вакуумної дистиляції з видаленням розчинника (залишковий об’єм – приблизно 95 л). ДХМ (686,5 кг) завантажували у реактор, який містить органічну фазу, і концентрували шляхом вакуумної дистиляції з видаленням розчинника (залишковий об’єм – приблизно 90 л). Потім завантажували метил-трет-бутиловий ефір (МТБЕ, 226,0 кг), температуру суміші доводили до -20 – -25 °C і витримували протягом 2,5 годин для одержання твердого осаду, який потім фільтрували, промивали н-гептаном (92,0 кг) і висушували на фільтрі при приблизно 25 °C під азотом з одержанням титульної сполуки (35,6 кг). Одержання 4-(6,7-диметоксихінолін-4-ілокси)-феніламіну [00121] 4-Амінофенол (24,4 кг), розчинений в N,N-диметилацетаміді (ДМА, 184,3 кг), завантажували у реактор, який містить 4-хлор-6,7-диметоксихінолін (35,3 кг), трет-бутоксид натрію (21,4 кг) і ДМА (167,2 кг), при 20–25 °C. Потім зазначену суміш нагрівали до 100–105 °C протягом приблизно 13 годин. Після того як реакція вважалася завершеною відповідно до оцінки за допомогою проведеного в ході реакції аналізу ВЕРХ (менше ніж 2% вихідного матеріалу, що залишився), вміст реактора охолоджували при 15-20 °C і завантажували воду (попередньо охолоджену, 2-7 °C, 587 л) з такою швидкістю, щоб підтримувати температуру 15– 30 °C. Отриманий твердий осад фільтрували, промивали сумішшю води (47 л) і ДМА (89,1 кг), і на закінчення – водою (214 л). Потім відфільтрований осад висушували при приблизно 25 °C на фільтрі з одержанням неочищеного 4-(6,7-диметоксихінолін-4-ілокси)-феніламіну (волога маса 59,4 кг, суха маса 41,6 кг, відповідно до розрахунку з урахуванням втрат при висушуванні). Неочищений 4-(6,7-диметоксихінолін-4-ілокси)-феніламін нагрівали до рефлюкса (приблизно 75 °C) у суміші тетрагідрофурану (ТГФ, 211,4 кг) і ДМА (108,8 кг) протягом приблизно 1 години, а потім остуджували до 0–5 °C і витримували протягом приблизно 1 години, після чого тверду 17 UA 115866 C2 5 10 15 20 25 30 35 40 45 50 55 60 речовину фільтрували, промивали ТГФ (147,6 кг) і висушували на фільтрі під вакуумом при приблизно 25 °C з утворенням 4-(6,7-диметоксихінолін-4-ілокси)-феніламіну (34,0 кг). Альтернативний варіант одержання 4-(6,7-диметоксихінолін-4-ілокси)-феніламіну [00122] У реактор завантажували 4-хлор-6,7-диметоксихінолін (34,8 кг), 4-амінофенол (30,8 кг) і трет-пентоксид натрію (1,8 еквівалента) 88,7 кг, 35% за масою в ТГФ), потім завантажували N,N-диметилацетамід (ДМА, 293,3 кг). Далі зазначену суміш нагрівали до 105–115 °C протягом приблизно 9 годин. Після того як реакцію вважали завершеною відповідно до оцінки на підставі проведеного в ході реакції ВЕРХ-аналізу (менше ніж 2% вихідного матеріалу, що залишився), вміст реактора охолоджували при 15-25 °C, і протягом 2-х годинного періоду додавали воду (315 кг), підтримуючи при цьому температуру 20–30 °C. Потім реакційну суміш перемішували додатково протягом години при 20–25 °C. Неочищений продукт збирали фільтрацією та промивали сумішшю 88 кг води і 82,1 кг ДМА, а потім – 175 кг води. Зазначений продукт сушили на сушарці з фільтруючим шаром протягом 53 годин. Спостережувані втрати при висушуванні склали менше ніж 1% за масою. [00123] Відповідно до альтернативного способу застосовували 1,6 еквівалента третпентоксиду натрію та температуру реакції підвищували від 110–120 °C. Крім того, температуру охолодження підвищували до 35–40 °C, а початкову температуру при додаванні води доводили до 35–40 °C, із допустимою екзотермою до 45 °C. Одержання 1-(4-фтор-фенілкарбамоїл)-циклопропанкарбонової кислоти [00124] Триетиламін (19,5 кг) додавали до охолодженого (приблизно 5 °C) розчину циклопропан-1,1-дикарбонової кислоти (24,7 кг) у ТГФ (89,6 кг) з такою швидкістю, щоб температура вмісту реактора не перевищувала 5 °C. Зазначений розчин перемішували протягом приблизно 1,3 години, а потім додавали тіонілхлорид (23,1 кг) при підтримці температури вмісту реактора нижче 10 °C. Після завершення додавання розчин перемішували протягом приблизно 4 годин, підтримуючи температуру нижче 10 °C. Потім додавали розчин 4фтораніліну (18,0 кг) у ТГФ (33,1 кг) з такою швидкістю, щоб температура в реакторі не перевищувала 10 °C. Суміш перемішували протягом приблизно 10 годин, після чого реакція вважалася завершеною. Потім реакційну суміш розбавляли ізопропілацетатом (218,1 кг). Зазначений розчин послідовно промивали додатково розведеним водою (415 л) водним гідроксидом натрію (10,4 кг, 50%, розчинені в 119 л води), потім водою (100 л) і, на закінчення, водним розчином хлориду натрію (20,0 кг, розчинені в 100 л води). Органічний розчин концентрували шляхом вакуумної дистиляції (залишковий об’єм – 100 л) при температурі нижче 40 °C, після чого додавали н-гептан (171,4 кг), що призводило до випадання в осад твердої речовини. Зазначену тверду речовину витягали фільтрацією та промивали н-гептаном (102,4 кг) з одержанням вологої неочищеної 1-(4-фтор-фенілкарбамоїл)-циклопропанкарбонової кислоти (29,0 кг). Зазначену неочищену 1-(4-фтор-фенілкарбамоїл)-циклопропанкарбонову кислоту розчиняли у метанолі (139,7 кг) при приблизно 25ºC, після чого додавали воду (320 л), що призводило до утворення суспензії, яку фільтрували, послідовно промивали водою (20 л) і нгептаном (103,1 кг), а потім висушували на фільтрі при приблизно 25 °C під азотом з одержанням титульної сполуки (25,4 кг). Одержання 1-(4-фтор-фенілкарбамоїл)-циклопропанкарбонілхлориду [00125] Оксалілхлорид (12,6 кг) додавали до розчину 1-(4-фтор-фенілкарбамоїл)циклопропанкарбонової кислоти (22,8 кг) у суміші ТГФ (96,1 кг) і N,N-диметилформаміду (ДМФА; 0,23 кг) з такою швидкістю, щоб температура вмісту реактора не перевищувала 25 °C. Зазначений розчин використовували на наступному етапі без подальшої обробки. Альтернативний варіант одержання 1-(4-фтор-фенілкарбамоїл)циклопропанкарбонілхлориду [00126] У реактор завантажували 1-(4-фтор-фенілкарбамоїл)-циклопропанкарбонову кислоту (35 кг), 344 г ДМФА і 175 кг ТГФ. Зазначену реакційну суміш доводили до 12–17 °C; потім у реакційну суміш протягом періоду, який становить 1 година, додавали 19,9 кг оксалілхлориду. Реакційну суміш витримували при перемішуванні при 12–17 °C протягом 3–8 годин. Зазначений розчин використовували на наступному етапі без подальшої обробки. Одержання [4-(6,7-диметоксихінолін-4-ілокси)-феніл]-амід (4-фтор-феніл)-аміду циклопропан-1,1-дикарбонової кислоти [00127] Отриманий у ході попереднього етапу розчин, який містить 1-(4-фторфенілкарбамоїл)-циклопропанкарбонілхлорид, додавали до суміші сполуки 4-(6,7диметоксихінолін-4-ілокси)-феніламіну (23,5 кг) і карбонату калію (31,9 кг) у ТГФ (245,7 кг) і воді (116 л) з такою швидкістю, щоб температура вмісту реактора не перевищувала 30 °C. Після завершення реакції (приблизно через 20 хвилин) додавали воду (653 л). Суміш перемішували при 20–25 °C протягом приблизно 10 годин, що призводило до випадання в осад продукту. 18 UA 115866 C2 5 10 15 20 25 30 35 40 45 50 55 60 Зазначений продукт витягали фільтрацією, промивали попередньо приготовленим розчином ТГФ (68,6 кг) і води (256 л), і висушували спочатку на фільтрі під азотом при приблизно 25 °C, а потім при приблизно 45 °C під вакуумом з одержанням титульної сполуки (41,0 кг; 38,1 кг, відповідно до розрахунку з урахуванням втрат при висушуванні). Альтернативний варіант одержання [4-(6,7-диметокси-хінолін-4-ілокси)-феніл]-амід (4-фторфеніл)-аміду циклопропан-1,1-дикарбонової кислоти [00128] У реактор завантажували 4-(6,7-диметоксихінолін-4-ілокси)-феніламін (35,7 кг, 1 еквівалент), а потім – 412,9 кг ТГФ. До реакційної суміші додавали розчин 48,3 K2CO3 в 169 кг води. Розчин хлорангідриду відповідно до наведеного вище опису Альтернативного варіанта одержання 1-(4-фтор-фенілкарбамоїл)-циклопропанкарбонілхлориду переносили у реактор, який містить 4-(6,7-диметоксихінолін-4-ілокси)-феніламін, при підтримці температури 20–30 °C протягом як мінімум 2-х годин. Реакційну суміш перемішували при 20–25 °C протягом як мінімум 3-х годин. Потім температуру реакції доводили до 30–25 °C і суміш перемішували. Перемішування припиняли і фазам суміші давали розділитися. Нижню водну фазу видаляли й утилізували. До верхньої органічної фази, яка залишилася, додавали 804 кг води. Реакцію підтримували при перемішуванні при 15–25 °C протягом як мінімум 16 годин. [00129] Продукт випадав в осад. Зазначений продукт фільтрували і промивали сумішшю 179 кг води і 157,9 кг ТГФ, розділеної на дві порції. Неочищений продукт висушували під вакуумом протягом щонайменше двох годин. Висушений продукт потім додавали у 285,1 кг ТГФ. Отриману суспензію переносили у реакційну посудину та перемішували до переходу суспензії у прозорий розчин (до розчинення), для чого було потрібне нагрівання до 30–35 °C протягом приблизно 30 хвилин. Потім до зазначеного розчину додавали 456 кг води, а також 20 кг спеціально денатурованого (SDAG-1) етанолу (етанолу, денатурованого метанолом) протягом 2-х годин. Зазначену суміш перемішували при 15–25 °C протягом щонайменше 16 годин. Продукт фільтрували і промивали сумішшю 143 кг води і 126,7 ТГФ, розділеної на дві порції. Продукт висушували при температурі, яка становить максимум 40 °C. [00130] Відповідно до альтернативного способу температуру реакції під час формування хлорангідриду доводили до 10–15 °C. Температуру рекристалізації змінювали від 15–25 °C до 45–50 °C протягом 1 години, а потім знижували до 15–25 °C протягом 2 годин. Одержання малатної солі [4-(6,7-диметоксихінолін-4-ілокси)-феніл]-амід (4-фтор-феніл)аміду циклопропан-1,1-дикарбонової кислоти [00131] У реактор завантажували [4-(6,7-диметоксихінолін-4-ілокси)-феніл]-амід (4-фторфеніл)-амід циклопропан-1,1-дикарбонової кислоти (1–5; 13,3 кг), L-яблучну кислоту (4,96 кг), метилетилкетон (МЕК; 188,6 кг) і воду (37,3 кг), і зазначену суміш нагрівали до рефлюкса (приблизно 74 °C) протягом приблизно 2 годин. Температуру реактора знижували до 50–55 °C і вміст реактора фільтрували. Описані вище послідовні етапи повторювали ще два рази, з такою самою кількістю вихідного матеріалу (13,3 кг), L-яблучної кислоти (4,96 кг), МЕК (198,6 кг) і води (37,2 кг). Комбінований фільтрат висушували азеотропною перегонкою при атмосферному тиску із застосуванням МЕК (1133,2 кг) (приблизний залишковий об’єм – 711 л; вологовміст за методом Карла Фішера (KF) < 0,5% за масою) при приблизно 74 °C. Температуру вмісту реактора знижували до 20–25 °C і підтримували протягом приблизно 4 годин з одержанням твердого осаду, який фільтрували, промивали МЕК (448 кг) і висушували під вакуумом при 50 °C з одержанням титульної сполуки (45,5 кг). Альтернативний варіант одержання (L)-малатної солі [4-(6,7-диметокси-хінолін-4-ілокси)феніл]-амід (4-фтор-феніл)-аміду циклопропан-1,1-дикарбонової кислоти [00132] У реактор завантажували [4-(6,7-диметоксихінолін-4-ілокси)-феніл]-амід (4-фторфеніл)-амід (47,9 кг) циклопропан-1,1-дикарбонової кислоти, L-яблучну кислоту (17,2), 658,2 кг метилетилкетону і 129,1 кг води (37,3 кг), і зазначену суміш нагрівали при 50–55 °C протягом приблизно 1–3 годин, а потім при 55–60 °C протягом додаткових 4–5 годин. Суміш освітлювали фільтрацією через патронний фільтр 1 мкмоль. Температуру реактора доводили до 20–25 °C і проводили вакуумну дистиляцію при зниженому тиску 150–200 мм рт. ст. при максимальній температурі в сорочці 55 °C до об’єму в діапазоні 558–731 л. [00133] Вакуумну дистиляцію повторювали ще два рази, завантажуючи 380 кг і 380,2 кг метилетилкетону, відповідно. Після третього циклу дистиляції об’єм серії доводили до 18% (об./мас.) [4-(6,7-диметоксихінолін-4-ілокси)-феніл]-амід (4-фтор-феніл)-аміду циклопропан-1,1дикарбонової кислоти, завантажуючи 159,9 кг метилетилкетону з одержанням загального об’єму 880 л. Додаткову вакуумну дистиляцію проводили, вносячи 245,7 метилетилкетону. Реакційну суміш витримували при помірному перемішуванні при 20–25 °C протягом щонайменше 24 годин. Продукт фільтрували і промивали 415,1 кг метилетилкетону, розділеного на три порції. Продукт висушували під вакуумом при заданій температурі в сорочці 45 °C. 19 UA 115866 C2 5 10 15 20 25 30 35 40 45 50 55 60 [00134] В альтернативному способі порядок додавання міняли таким чином, що розчин 17,7 кг L-яблучної кислоти, розчинений в 129,9 кг води, додавали до [4-(6,7-диметоксихінолін-4ілокси)-феніл]-амід (4-фтор-феніл)-аміду циклопропан-1,1-дикарбонової кислоти (48,7 кг) у метилетилкетоні (673,3 кг). Приклад 1 Тестування Сполуки 1 в аналізах диференціювання й активності остеокластів і остеобластів in vitro [00135] Метою даного дослідження було вивчення впливу 7-ми концентрацій Сполуки 1 на диференціювання й активність остеокластів людини і остеобластів миші in vitro. Тестували наступні концентрації: 0,004; 0,012; 0,037; 0,11; 0,33; 1,0 і 3,0 мкмоль. Дослідження проводили із застосуванням отриманих із кісткового мозку людини CD34+ клітин-попередників остеокластів, які культивували на зрізах бичачої кістки, і остеопрогеніторних клітин миші KS483, які індукували для диференціювання у кісткоутворюючі остеобласти. [00136] Дослідження складалося з 4-х частин. У ході першої частини отримані з кісткового мозку людини клітини-попередники остеокластів CD34+ культивували на зрізах бичачої кістки протягом 7 днів, після чого остеокласти, які утворилися, підраховували шляхом вимірювання активності стійкої до тартрату кислої фосфатази 5b (ТрКФ-5b) у культуральному середовищі. Зазначений аналіз демонструє вплив Сполуки 1 на диференціювання остеокластів. Як еталонний інгібітор диференціювання остеокластів включали остеопротегерин (ОПГ), щоб продемонструвати, що культуральна система працює належним чином. [00137] У другій частині культуральне середовище для остеокластів людини заміняли новим середовищем на 7 день, і зрілі остеокласти, які утворилися, культивували протягом 3-х додаткових днів, дозволяючи їм резорбувати кістку. Сполуку 1 додавали у культуральне середовище на 7 день. Зазначений аналіз демонструє вплив Сполуки 1 на резорбційну активність зрілих остеокластів. У культуральному середовищі, зібраному на 10 день, вимірювали рівень C-термінальних перехресно-зв'язаних тілопептидів колагену I типу (CTx) для кількісного визначення резорбції кістки протягом днів 7-10. ТрКФ-5b вимірювали на 7 день для кількісного визначення числа остеокластів до додавання Сполуки 1. Показники CTx ділили на показники ТрКФ-5b, одержуючи індекс резорбції, який відображає середнє активності остеокластів. Як еталонний інгібітор активності остеокластів включали інгібітор цистеїнпротеази E64, щоб продемонструвати, що культуральна система працює належним чином. [00138] У третій частині протягом 8 днів культивували остеопрогеніторні клітини миші KS483, після чого підраховували зрілі остеобласти, які утворилися, шляхом вимірювання кількості активності внутрішньоклітинної лужної фосфатази (ЛФ, або ALP). Зазначений аналіз демонструє вплив Сполуки 1 на диференціювання остеобластів. У дане дослідження включали 17ß-естрадіол як еталонну сполуку, яка стимулює диференціювання остеобластів, щоб продемонструвати, що культуральна система працює належним чином. [00139] У четвертій частині дослідження остеопрогеніторні клітини миші KS483 культивували протягом 13 днів, протягом яких на 11 день визначали N-термінальний пропептид проколагену типу I (PINP), секретований у культуральне середовище, для виявлення впливу на утворення органічного кісткового матрикса, і на 13 день визначали кількість кальцію, яка депонована у кістковий матрикс, що сформувався, для виявлення впливу на утворення неорганічного кісткового матрикса. Аналіз активності остеобластів виявляє вплив Сполуки 1 на кісткоутворюючу активність остеобластів. 17ß-естрадіол включали у дане дослідження як еталонну сполуку, яка стимулює диференціювання й активність остеобластів, щоб продемонструвати, що культуральна система працює належним чином. [00140] Сполука 1 демонструвала дозозалежне придушення диференціювання остеокластів, значиме при концентраціях 0,11; 0,33; 1,0 і 3,0 мкмоль. Мікроскопічний аналіз показав, що концентрації 0,11 і 0,33 мкмоль не впливають на число Hoechst- і ТрКФ-позитивних мононуклеарних клітин, що говорить про специфічне придушення диференціювання остеокластів. Проте, при концентраціях 1,0 і 3,0 мкмоль зменшувалося число як Hoechst-, так і ТрКФ-позитивних мононуклеарних клітин, що вказує на те, що інгібуючі ефекти, які спостерігалися при зазначених концентраціях, є щонайменше частково цитотоксичними. При аналізі активності остеокластів ніяких ефектів не спостерігалося. [00141] Сполука 1 демонструвала дозозалежне стимулювання диференціювання й активності остеобластів. Концентрації Сполуки 1 0,012; 0,037; 0,11; 0,33 і 1,0 мкмоль підвищували, а концентрація 3,0 мкмоль знижувала рівні ЛФ при аналізі диференціювання остеобластів. При аналізі активності остеобластів концентрації 0,012 і 0,037 мкмоль підвищували рівні P1NP, а концентрації 0,004; 0,012; 0,037 і 0,11 мкмоль підвищували рівні кальцію. Концентрації 0,33; 1,0 і 3,0 мкмоль знижували рівні як PINP, так і кальцію. Ці результати 20 UA 115866 C2 5 10 15 20 25 30 35 40 45 50 55 60 вказують на те, що концентрації 0,004; 0,012; 0,037 і 0,11 мкмоль Сполуки 1 роблять сприятливу дію на клітини кісткової тканини, активуючи кісткоутворення остеобластами і не роблячи впливу на утворення резорбуючих кістку остеокластів або не придушуючи його. Опис дослідження [00142] Метою даного дослідження було вивчення впливу вибраної Замовником Сполуки 1 на диференціювання й активність остеокластів людини і остеобластів миші in vitro. Зазначений вплив на остеокласти досліджували із застосуванням моделі, в якій отримані з кісткового мозку людини клітини-попередники остеокластів культивують на зрізах бичачої кістки протягом 7 днів в умовах, які сприяють диференціюванню остеокластів, і дозволяють диференціювати у резорбуючі кістку остеокласти. Після завершення диференціювання остеокластів на 7 день культуральне середовище видаляли і додавали в ямки нове культуральне середовище, яке сприяє активності остеокластів. Потім зрілі остеокласти культивували протягом 3-х додаткових днів, дозволяючи їм резорбувати кістку. При аналізі диференціювання остеокластів тестовані сполуки і еталонний інгібітор остеопротегерин (ОПГ) додавали у культури на день 0. При аналізі активності остеокластів тестовані сполуки і еталонний інгібітор E64 додавали у культури на 7 день. В обох аналізах тестували по сім концентрацій в 8 повтореннях. Активність стійкої до тартрату кислої фосфатази 5b (ТрКФ-5b) у культуральному середовищі, зібраному на 7 день, вимірювали як показник числа остеокластів, які утворилися в кожній ямці під час періоду диференціювання. Вміст C-термінальних перехресно-зв'язаних тілопептидів колагену I типу (CTx) у культуральному середовищі, зібраному на 10 день, вимірювали для кількісного визначення резорбції кістки протягом 7-10 дня. [00143] Вплив на остеобласти досліджували із застосуванням остеопрогеніторних клітин миші KS483, які можуть бути індуковані для диференціювання у кісткоутворюючі остеобласти. 17ß-естрадіол (E2) включали у дане дослідження як еталонну сполуку, яка стимулює диференціювання й активність остеобластів, щоб продемонструвати, що культуральні системи дозволяють виявляти стимулювання диференціювання й активності остеобластів. При аналізі диференціювання остеобластів клітини культивували протягом 8 днів, після чого зрілі остеобласти, які утворилися, підраховували шляхом вимірювання рівнів активності внутрішньоклітинної лужної фосфатази (ЛФ). При аналізі активності остеобластів остеопрогеніторні клітини культивували протягом 13 днів, протягом яких на 11 день визначали вміст секретованого в культуральне середовище N-термінального пропептиду проколагену типу I (PINP) для виявлення впливу на утворення органічного кісткового матрикса, а на 13 день визначали кількість кальцію, депонованого у кістковий матрикс, який сформувався, для виявлення впливу на утворення неорганічного кісткового матрикса. [00144] Тести проводили у 96-ямкових планшетах, що містять фонову групу, яка включає основу, контрольну групу, яка включає еталонну сполуку, і групи, які включають тестовану сполуку. Щоб продемонструвати, що тест-системи працюють належним чином, включали еталонні сполуки. У культурах остеокластів дослідження вважали успішно проведеним, якщо результати для контрольної групи були істотно нижче результатів для фонової групи. У культурах остеобластів дослідження вважали успішно проведеним, якщо результати для контрольної групи були істотно вище результатів для фонової групи. Сполука 1 [00145] Сполуку 1 одержували від Замовника у вигляді твердої сполуки. Зазначену сполуку суспендували у ДМСО в концентрації 10 ммоль для одержання базового розчину. Перед експериментами готували свіжий базовий розчин, який зберігали у сухих умовах у темряві при кімнатній температурі. Для тривалого використання (більше 5 днів) базовий розчин зберігали при -70 °C. З базового розчину готували пілходящі розведення для одержання потрібних концентрацій для тестування; 0,004 мкмоль, 0,012 мкмоль, 0,037 мкмоль, 0,11 мкмоль, 0,33 мкмоль, 1 мкмоль і 3 мкмоль. Еталонні сполуки [00146] Остеопротегерин (ОПГ, 5 нмоль, кат. № 450-14, отриманий від PeproTech EC Ltd, Лондон, Великобританія) використовували як еталонний інгібітор диференціювання остеокластів, а інгібітор цистеїн-протеази E64 (1 _M, кат. № E-3132, отриманий від SigmaAldrich, Сент-Луїс, Міссурі, США) – як еталонний інгібітор резорбційної активності остеокластів. [00147] 17ß-естрадіол (E2; 10 нмоль, кат. № E1024, отриманий від Sigma-Aldrich, Сент-Луїс, Міссурі, США) використовували як еталонний стимулятор диференціювання й активності остеобластів. Спосіб Культури остеокластів [00148] Спосіб культивування остеокластів на зрізах кістки спочатку був описаний Boyde та 21 UA 115866 C2 5 10 15 20 25 30 35 40 45 50 55 60 ін. (1984) і Chambers та ін. (1984). Спочатку число остеокластів визначали шляхом підрахунку числа позитивних за стійкою до тартрату кислої фосфатази (ТрКФ- позитивних) багатоядерних клітин під мікроскопом. Пізніше було показано, що активність секретованої ТрКФ-5b відображає число остеокластів у культурах остеокластів миші (Alatalo et al. 2000). Хоча активність секретованого ТрКФ-5b виражено корелювала з числом остеокластів, ТрКФ-5b не секретувався ТрКФ-позитивними мононуклеарними клітинами-попередниками остеокластів до їх диференціювання в зрілі багатоядерні остеокласти. Таким чином, секретований ТрКФ-5b являє собою надійний маркер числа зрілих багатоядерних остеокластів. [00149] Швидкість резорбції кістки у культурах первинно визначали шляхом підрахунку числа резорбційних поглиблень на кожному зрізі кістки або дентину із застосуванням фазовоконтрастної мікроскопії. Пізніше поглиблення візуалізували із застосуванням лектину – аглютиніну зародка пшениці, який, зокрема, зв'язується з резорбованою ділянкою зсередини кістки, дозволяючи кількісно визначати загальну площу резорбованої кістки із застосуванням мікроскопії та системи комп'ютерного аналізу зображень. Зазначені способи мають два недоліки: вони потребують великих витрат часу і не дозволяють виявити розходження в глибині резорбційних поглиблень, що може призводити до хибних результатів. Пізніше було показано, що C-термінальні перехресно-зв'язані тілопептиди колагену I типу (CTx) є кількісним показником продуктів розкладання колагену кісткової тканини, які вивільняються у культуральне середовище (Bagger et al. 1999). Цей спосіб є швидким і чутливим, і являє собою надійний показник загального резорбованого об’єму (у тому числі глибини поглиблень). [00150] Для застосування в даному дослідженні була розроблена система культивування остеокластів людини, в якій CD34+ клітини-попередники остеокластів, отримані з кісткового мозку людини (попередники остеокластів людини Poietics®, Lonza, Уолкерсвілль, США) культивують на зрізах бичачої кістки у присутності придатних факторів росту, включаючи М-КСФ (M-CSF) і RANK-ліганд (Rissanen et al. 2009). Зазначеним клітинам спочатку дозволяють диференціювати у зрілі резорбуючі кістку остеокласти, і потім остеокластам, які сформувалися, дозволяють резорбувати кістку. Тестовані й еталонні сполуки додають у клітинні культури на початку періоду диференціювання та/або резорбції, і визначають їхній вплив на диференціювання та/або резорбційну активність остеокластів. [00151] Секретований ТрКФ-5b визначають у культуральному середовищі після періоду диференціювання із застосуванням комерційно доступного способу (BoneTRAPÒ, IDS Ltd, Болдон, Великобританія). Секретований ТрКФ-5b точно відображає число остеокластів, які утворилися в кожній ямці під час періоду диференціювання. CTx визначають у культуральному середовищі після періоду резорбції із застосуванням комерційно доступного способу (CrossLapsÒ для культур, IDS Ltd, Болдон, Великобританія). CTx точно відображає кількість продуктів розкладання колагену кісткової тканини, які вивільняють у культуральне середовище в кожній ямці протягом періоду резорбції. Індекс резорбції, який характеризує середнє активності остеокластів (Rissanen et al. 2009) розраховується діленням отриманого об’єму резорбції (значення CrossLapsÒ) на число остеокластів (значення BoneTRAPÒ). Культури остеобластів [00152] Остеобласти являють собою клітини, які формують кісткову тканину, що утворюються із мезенхімальних стовбурних клітин. Визначені три окремих періоди у ході розвитку остеобластів: 1) проліферація клітин і секретування позаклітинного матрикса (ПКМ); 2) дозрівання ПКМ; 3) мінералізація ПКМ. Описана послідовна експресія маркерів фенотипу остеобластів протягом зазначених періодів. Лужна фосфатаза (ЛФ) пов'язана з фенотипом кісткових клітин і активно експресується під час дозрівання остеобласту. N-термінальний пропептид проколагену типу I (PINP) являє собою маркер синтезу колагену I типу і синтезу ПКМ, і релевантний параметр для оцінки нових кандидатних лікарських речовин для лікування остеопорозу в доклінічних дослідженнях (Rissanen et al. 2008). Після початку мінералізації в зрілому органічному матриксі накопичуються більші кількості кальцію та гідроксіапатиту з утворенням кісткоподібних вузликів. Відслідковуючи зазначені маркери, можна досліджувати всі стадії диференціювання й активності остеобластів у культуральній системі. [00153] Для дослідження остеобластів було створено декілька модельних систем. У ході найпершої спроби виділяли клітини з фенотипом остеобластів зведення черепа. Однак зазначеними клітинами представлена винятково зріла стадія розвитку остеобластів, тому що тільки невелика фракція клітин зведення черепа містить попередники остеобластів (Bellows et al. 1989). Як варіант, можна стимулювати мезенхімальні клітини кісткового мозку або лінії прогеніторних клітин для диференціювання у клітини-остеобласти. Клітини KS483, які клоновані зі зведення черепа миші, являють собою естроген-чутливі попередники остеобластів, які здатні диференціювати у кісткоутворюючі остеобласти і формувати мінералізовані кісткові вузлики in 22 UA 115866 C2 5 10 15 20 25 30 35 40 45 50 55 60 vitro (Dang et al. 2002). [00154] Була створена культуральна система, яка підходить для застосування як in vitro модель для вивчення впливу анаболічних і естрогеноподібних сполук на диференціювання й активність остеобластів. У даній культуральній системі клітини KS483 миші спочатку проліферують, а потім диференціюють в остеобласти, які здатні формувати мінералізовані кісткові вузлики у присутності аскорбінової кислоти і ß-гліцерофосфату (Fagerlund et al. 2009). Одночасно із заміною середовища у клітинні культури додають тестовані й еталонні сполуки, і визначають їхній вплив на диференціювання й активність остеобластів. Клітинну ЛФ, маркер диференціювання остеобластів, визначають у клітинних лізатах відповідно до існуючого опису (Lowry et al. 1954). Секретований PINP, маркер утворення органічного кісткового матрикса, визначають у культуральному середовищі із застосуванням комерційно доступного способу (ІФА на PINP миші/пацюка, IDS Ltd, Болдон, Великобританія). Відкладення кальцію, показник утворення неорганічного кісткового матрикса, вимірюють із застосуванням комерційно доступного кальцієвого тесту (Roche Diagnostics). Методики проведення аналізів Аналіз диференціювання остеокластів [00155] У даному дослідженні отримані з кісткового мозку людини CD34+ стовбурні клітини (10 000 клітин/ямка) суспендували у культуральному середовищі та дозволяли прикріпитися до зрізів бичачої кістки в 96-ямкових планшетах для тканинних культур. У культуральне середовище (яке містить 10% ФБС, набір із клітинами-попередниками остеокластів BulletKit® Lonza, Уолкерсвілль, США) додавали придатні кількості важливих факторів росту, які сприяють диференціюванню й активності остеокластів, у М-КСФ (33 нг/мл, набір із клітинамипопередниками остеокластів BulletKit® Lonza, Уолкерсвілль, США) і RANK-ліганд (66 нг/мл, набір із клітинами-попередниками остеокластів BulletKit® Lonza, Уолкерсвілль, США) в 200 мкл середовища. Клітини інкубували в CO2-інкубаторі у зволоженій атмосфері, яка містить 95% повітря та 5% вуглекислого газу, при 37ºC протягом 7 днів. Тестовані сполуки і еталонну сполуку ОПГ додавали на день 0. Супернатанти, зібрані на 7 день, зберігали при -70 °C до аналізу ТрКФ-5b. ТрКФ-5b вимірювали у культуральному середовищі (20 мкл/зразок) із застосуванням лічильника VICTOR2™ Multilabel Counter (PerkinElmer, Уолтем, Массачусетс, США). Клітини фіксували 3% параформальдегідом і забарвлювали на активність ТрКФ (набір для визначення кислої фосфатази лейкоцитів; Sigma Aldrich, Сент-Луїс, Міссурі, США) і Hoechst 33258 (Sigma Aldrich, Сент-Луїс, Міссурі, США). [00156] Були включені наступні групи (кожна група включає 8 повторень): Планшет 1: 1) Фонова група, яка одержувала основу (ДМСО) 2) Контрольна група, яка одержувала 5 нмоль ОПГ 3) 0,004 мкмоль Сполуки 1 4) 0,012 мкмоль Сполуки 1 5) 0,037 мкмоль Сполуки 1 6) 0,11 мкмоль Сполуки 1 7) 0,33 мкмоль Сполуки 1 8) 1,0 мкмоль Сполуки 1 9) 3,0 мкмоль Сполуки 1 Аналіз активності остеокластів [00157] У даному дослідженні отримані з кісткового мозку людини CD34+ стовбурні клітини (10 000 клітин/ямка) суспендували у культуральному середовищі та дозволяли прикріпитися до зрізів бичачої кістки в 96-ямкових планшетах для тканинних культур. У культуральне середовище (яке містить 10% ФБС, набір із клітинами-попередниками остеокластів BulletKit® Lonza, Уолкерсвілль, США) додавали придатні кількості важливих факторів росту, які сприяють диференціюванню й активності остеокластів, у тому числі М-КСФ (33 нг/мл, набір із клітинамипопередниками остеокластів BulletKit® Lonza, Уолкерсвілль, США) і RANK-ліганд (66 нг/мл, набір із клітинами-попередниками остеокластів BulletKit® Lonza, Уолкерсвілль, США) в 200 мкл середовища. Клітини інкубували в CO2-інкубаторі у зволоженій атмосфері, яка містить 95% повітря та 5% вуглекислого газу, при 37ºC. Після завершення диференціювання остеокластів на 7 день культуральне середовище повністю видаляли і додавали в ямки нові 200 мкл культурального середовища, яке сприяє активності остеокластів. [00158] Зрілі остеокласти культивували протягом 3-х додаткових днів, дозволяючи їм резорбувати кістку. Тестовані сполуки і еталонну сполуку E64 додавали на 7 день, після завершення періоду диференціювання остеокластів. Супернатанти, зібрані на 7 день та 10 день, зберігали при -70 °C до аналізу ТрКФ-5b і CTx. ТрКФ-5b вимірювали у культуральному 23 UA 115866 C2 5 10 15 20 25 30 35 40 45 50 55 60 середовищі (20 мкл/зразок), яке зібране на 7 день, а CTx – у культуральному середовищі (50 мкл/зразок), яке зібране на 10 день, із застосуванням лічильника VICTOR2™ Multilabel Counter (PerkinElmer, Уолтем, Массачусетс, США). [00159] Були включені наступні групи (кожна група включає 8 повторень): Планшет 1: 1) Фонова група, яка одержувала основу (ДМСО) 2) Контрольна група, яка одержувала 1 _M E64 3) 0,004 мкмоль Сполуки 1 4) 0,012 мкмоль Сполуки 1 5) 0,037 мкмоль Сполуки 1 6) 0,11 мкмоль Сполуки 1 7) 0,33 мкмоль Сполуки 1 8) 1,0 мкмоль Сполуки 1 9) 3,0 мкмоль Сполуки 1 Аналіз диференціювання остеобластів [00160] Клітини KS483 миші культивували у колбах T-75 для тканинних культур в aMEM з додаванням 10% очищеної на активованому вугіллі фетальної бичачої сироватки до 80-90% конфлюентності. Зазначені клітини інкубували в CO2-інкубаторі у зволоженій атмосфері, яка містить 95% повітря та 5% вуглекислого газу, при 37ºC. Після досягнення 80-90% конфлюентності одержували субкультури. Клітини витягали із колб за допомогою обробки трипсином і підраховували. Для індукції дозрівання остеобластів і кісткоутворення незрілі клітини-остеобласти висівали у покриті колагеном I типу 96-ямкові планшети. Клітини культивували протягом 8 днів з додаванням аскорбінової кислоти (50 г/мл), і кожні 3-4 дні заміняли половину середовища. Тестовану сполуку і контрольну речовину (E2) додавали на початку періоду культивування та при заміні середовища. Ріст культур зупиняли на 8 день, видаляючи із ямок культуральне середовище, і одержували клітинні лізати. Активність клітинної ЛФ і загальний вміст білка (набір для визначення білка, Bio-Rad Laboratories Inc, Каліфорнія, США) підраховували із застосуванням лічильника VICTOR2™ Multilabel Counter (PerkinElmer, Уолтем, Массачусетс, США). [00161] Були включені наступні групи (кожна група включає 8 повторень): Планшет 1: 1) Фонова група, яка одержувала основу (ДМСО) 2) Контрольна група, яка одержувала 10 нмоль E2 3) 0,004 мкмоль Сполуки 1 4) 0,012 мкмоль Сполуки 1 5) 0,037 мкмоль Сполуки 1 6) 0,11 мкмоль Сполуки 1 7) 0,33 мкмоль Сполуки 1 8) 1,0 мкмоль Сполуки 1 9) 3,0 мкмоль Сполуки 1 Аналіз активності остеобластів [00162] Клітини KS483 миші культивували у колбах T-75 для тканинних культур у середовищі αMEM з додаванням 10% очищеної на активованому вугіллі фетальної бичачої сироватки до 8090% конфлюентності. Зазначені клітини інкубували в CO2-інкубаторі у зволоженій атмосфері, яка містить 95% повітря та 5% вуглекислого газу, при 37ºC. Після досягнення 80-90% конфлюентності одержували субкультури. Клітини витягали із колб за допомогою обробки трипсином і підраховували. Для індукції дозрівання остеобластів і кісткоутворення незрілі клітини-остеобласти висівали у покриті колагеном I типу 96-ямкові планшети. Зазначені клітини культивували протягом 13 днів з додаванням аскорбінової кислоти (50 мкг/мл) і ßгліцерофосфату (5 ммоль), і кожні 3-4 дні заміняли половину середовища. Тестовану сполуку і контрольну речовину (E2) додавали на початку періоду культивування та при заміні середовища. На 11 день у культуральному середовищі вимірювали секретований PINP як маркер утворення органічного кісткового матрикса. Ріст культур зупиняли на 13 день, видаляючи із ямок культуральне середовище і додаючи соляну кислоту. Кальцій, який депонований у кістковому матриксі, що сформувався, кількісно визначали із застосуванням лічильника VICTOR2™ Multilabel Counter (PerkinElmer, Уолтем, Массачусетс, США). [00163] Були включені наступні групи (кожна група включає 8 повторень): Планшет 1: 1) Фонова група, яка одержувала основу (ДМСО) 2) Контрольна група, яка одержувала 10 нмоль E2 24 UA 115866 C25 10 15 20 25 30 3) 0,004 мкмоль Сполуки 1 4) 0,012 мкмоль Сполуки 1 5) 0,037 мкмоль Сполуки 1 6) 0,11 мкмоль Сполуки 1 7) 0,33 мкмоль Сполуки 1 8) 1,0 мкмоль Сполуки 1 9) 3,0 мкмоль Сполуки 1 Статистичний аналіз [00164] Всі релевантні дані представлені у вигляді фігур і/або таблиць [середнє, стандартне відхилення (SD) і статистична значимість] з одиницями вимірювання. Статистичний аналіз виконували із застосуванням програмного забезпечення для статистичної обробки Origin (OriginLab Corporation, Нортгемптон, Массачусетс, США). Однофакторний дисперсійний аналіз (ANOVA) застосовували для визначення того, чи відрізняються статистично (з p < 0,05) значення, отримані для різних груп (фонова відносно груп з еталонним інгібітором і тестованими сполуками). Якщо однофакторний аналіз ANOVA виявляв статистично значимі розходження, для статистичного порівняння між групами використовували t-критерій. Результати [00165] Вплив Сполуки 1 на диференціювання остеокластів вимірювали на 7 день відповідно до Фіг. 1. Результати представлені у вигляді активності ТрКФ-5b (од/л), секретованого у культуральне середовище. На зазначеній та інших фігурах БР означає базовий рівень (без додавання сполук); К означає Контроль (5,0 нмоль ОПГ). Результати порівнювали з БР із застосуванням однофакторного аналізу ANOVA (p < 0,001 між всіма групами). Три зірочки (***) вказують на статистично значимий інгібуючий ефект із p-значенням, яке становить менше ніж 0,001. Дві зірочки (**) вказують на статистично значимий ефект із p-значенням, яке становить менше ніж 0,01. Одна зірочка (*) вказує на p-значення, яке становить менше ніж 0,05. Укладені в круглі дужки зірочки на Фігурі ([***]) вказують на значиму відмінність від базового рівня. [00166] Результати узагальнені далі в Таблиці 1. Як і на Фігурах, три зірочки ([***]) вказують на статистично значимий інгібуючий ефект із p-значенням, яке становить менше ніж 0,001. Як і на Фігурах, а також у даній таблиці та в інших таблицях, три зірочки (***) вказують на статистично значимий інгібуючий ефект із p-значенням, яке становить менше ніж 0,001; дві зірочки (**) вказують на статистично значимий ефект із p-значенням, яке становить менше ніж 0,01; одна зірочка (*) вказує на p-значення, яке становить менше ніж 0,05. Укладені в круглі дужки зірочки на Фігурі ([***]) вказують на значиму відмінність від базового рівня. Таблиця 1 Аналіз диференціювання остеокластів. Активність ТрКФ-5b на 7 день. Концентрація Сполуки 1 (мкмоль) Відсоток активності (%) у порівнянні з БР 0,004 0,012 0,037 0,11 0,33 1,0 3,0 85 80 74 45(***) 15(***) 4(***) 0(***) 35 [00167] Вплив Сполуки 1 на резорбційну активність остеокластів людини представлена на Фіг. 2. Результати представлені у вигляді значень CTx/ТрКФ-5b. Значення CTx визначали наприкінці періоду резорбції, на 10 день, а значення ТрКФ – на початку періоду резорбції, на 7 день. Результати узагальнені далі в Таблиці 2. 40 Таблиця 2 Аналіз диференціювання остеокластів. Активність CTx на 10 день і ТрКФ-5b на 7 день. Концентрація Сполуки 1 (мкмоль) Відсоток активності (%) у порівнянні з БР 0,004 0,012 0,037 0,11 0,33 1,0 3,0 84 104 115 107 102(***) 111(***) 85(***) [00168] Вплив Сполуки 1 на диференціювання остеобластів на 8 день представлений на Фіг. 3. Результати представлені у вигляді клітинної активності ЛФ/мг білка. Зазначені результати узагальнені нижче в Таблиці 3. 25 UA 115866 C2 Таблиця 3 Аналіз диференціювання остеобластів. Активність ЛФ на 8 день. Концентрація Сполуки 1 (мкмоль) Відсоток активності (%) у порівнянні з БР 5 0,004 0,012 0,037 0,11 0,33 1,0 3,0 109 113 134(***) 181(***) 166(***) 117(*) 57([***]) [00169] Вплив Сполуки 1 на кісткоутворюючу активність остеобластів миші показаний на Фіг. 4. Результати представлені як вміст PINP, секретованого у культуральне середовище на 11 день. Зазначені результати узагальнені далі в Таблиці 4. Таблиця 4 Аналіз диференціювання остеобластів. Активність PINP на 11 день. Концентрація Сполуки 1 (мкмоль) Відсоток активності (%) у порівнянні з БР 10 0,004 0,012 0,037 0,11 0,33 1,0 3,0 117 122(**) 135(***) 101 73([**]) 42([***]) 21([***]) [00170] Вплив Сполуки 1 на кісткоутворюючу активність остеобластів миші показаний на Фіг. 5. Результати представлені як відкладення кальцію на 13 день. Результати представлені як вміст PINP, секретованого у культуральне середовище на 11 день. Зазначені результати узагальнені далі в Таблиці 4. [00171] Таблиця 5 [00172] Аналіз диференціювання остеобластів. Відкладення кальцію на 13 день Концентрація Сполуки 1 0,004 0,012 (мкмоль) Відсоток активності (%) 145(***) 167(***) у порівнянні з БР 15 20 25 30 35 0,037 0,11 0,33 1,0 3,0 180(***) 144(*) 59([**]) 12([***]) 4([***]) Висновок [00173] Еталонні інгібітори ОПГ і E64 істотно придушували диференціювання й активність остеокластів, відповідно, а еталонний стимулятор 17β-естрадіол істотно стимулював диференціювання й активність остеобластів, що підтверджує успішність проведення аналізів і достовірність отриманих результатів. Сполука 1 продемонструвала дозозалежне придушення диференціювання остеокластів, значиме при концентраціях 0,11; 0,33; 1,0 і 3,0 мкмоль. Мікроскопічний аналіз показав, що концентрації 0,11 і 0,33 мкмоль Сполуки 1 не впливали на кількість Hoechst- і ТрКФ- позитивних мононуклеарних клітин, що ймовірно свідчить про специфічне придушення диференціювання остеокластів. Проте, концентрації 1,0 і 3,0 мкмоль знижували число як Hoechst-, так і ТрКФ-позитивних мононуклеарних клітин, що ймовірно свідчить про те, що інгібуючі ефекти, які спостерігаються для зазначених концентрацій, є щонайменше частково цитотоксичними. [00174] Сполука 1 не робити впливу на резорбційну активність остеокластів у протестованих концентраціях. Сполука 1 продемонструвала дозозалежну стимуляцію диференціювання остеобластів у концентраціях 0,012; 0,037; 0,11; 0,33 і 1,0 мкмоль та інгібуючі ефекти у концентрації 3,0 мкмоль. Сполука 1 продемонструвала дозозалежну стимуляцію кісткоутворюючої активності остеобластів у концентраціях 0,004; 0,012; 0,037 і 0,11 мкмоль, та інгібуючі ефекти у концентраціях 0,33; 1,0 і 3,0 мкмоль. Нарешті, концентрації 0,004; 0,012; 0,037 і 0,11 мкмоль Сполуки 1 продемонстрували сприятливу дію на клітини кісткової тканини, активуючи кісткоутворення остеобластами і не роблячи впливу на утворення резорбуючих кістку остеокластів або не придушуючи його. 26 UA 115866 C2 5 10 15 20 25 30 35 40 45 50 55 60 Використані джерела Alatalo SL, Halleen JM, Hentunen TA, Mönkkönen J, Väänänen HK (2000) Rapid screening method for osteoclast differentiation in vitro that measures tartrate-resistant acid phosphatase 5b activity secreted into the culture medium. Clin Chem 46:1751-1754. Bagger YZ, Foged NT, Andersen L, Lou H, Qvist P (1999) CrossLaps for culture: An improved enzyme-linked immunosorbent assay (ELISA) for measuring bone resorption in vitro. J Bone Miner Res 14, Suppl. 1, S370. Bellows CG, Aubin JE (1989) Determination of the number of osteoprogenitors in isolated fetal rat calvarial cells in vitro. Develop Biol 113:8-13. Boyde A, Ali NN, Jones SJ (1984) Resorption of dentine by isolated osteoclasts in vitro. Br Dent J 156:216-220. Chambers TJ, Revell PA, Fuller K, Athanasou NA (1984) Resorption of bone by isolated rabbit osteoclasts. J Cell Sci 66:383-399. Dang ZC, Van Bezooijen RL, Karperien M, Papapoulos SE, Löwik CWGM (2002) Exposure of KS483 cells to estrogen enhances osteogenesis and inhibits adipogenesis. J Bone Miner Res 17:394405. Fagerlund KM, Rissanen JP, Suutari T, Chan A, Halleen JM (2009) Validation of an in vitro osteoblast culture model using estrogen responsive KS483 mouse osteoblast precursor cell line. J Bone Miner Res 24 (Suppl 1). Див.: http://www.asbmr.org/Meetings/AnnualMeeting/AbstractDetail.aspx?aid=9815c5a5-00eb4952-b1aa838899f5e151. Дата останнього звернення – 1 жовтня 2009 р. Lowry OH, Roberts NR, Wu ML, Hixon WS, Crawford EJ (1954) The quantitative histochemistry of brain. II. Enzyme measurements. J Biol Chem 207:19-37. Rissanen JP, Suominen MI, Peng Z, Morko J, Rasi S, Risteli J, Halleen JM (2008) Short-term changes in serum PINP predict long-term changes in trabecular bone in the rat ovariectomy model. Calcif Tissue Int 82:155-161. Rissanen JP, Ylipahkala H, Fagerlund KM, Long C, Väänänen HK, Halleen JM (2009) Improved methods for testing antiresorptive compounds in human osteoclast cultures. J Bone Miner Metab 27:105-109. Приклад 2 Короткостроковий вплив Сполуки 1 на маркери поновлення кісткової тканини у моделі оваріектомії у пацюків (ОВЕ) [00175] Мета даного дослідження полягала в дослідженні короткострокового впливу Сполуки 1 на біохімічні маркери у сироватці метаболізму кісткової тканини у дослідженні із запобігання постменопаузального остеопорозу на моделі оваріектомії у пацюків (ОВЕ). 17β-естрадіол (E2) використовували як еталонну сполуку. У дане дослідження були включені наступні п'ять експериментальних груп: 1) Хибнооперовані контрольні пацюки, які одержують основу (5 мл/кг/день перорально) 2) Контрольні пацюки після ОВЕ, які одержують основу (5 мл/кг/день перорально) 3) Контрольні пацюки після ОВЕ, які одержують 17β-естрадіол (4 мкг/кг/день п/ш) 4) Пацюки після ОВЕ, які одержують тестовану сполуку – Сполуку 1 (1 мг/кг/день перорально) 5) Пацюки після ОВЕ, які одержують тестовану сполуку – Сполуку 1 (3 мг/кг/день перорально) [00176] Кожна група включала вісім самок пацюків (Спрег-Доулі) віком 3 місяці на початку прижиттєвої фази дослідження. До початку прижиттєвої фази тварин зважували, брали у них зразки крові та рандомізували у групи дослідження шляхом стратифікації відповідно до маси тіла та рівнів N-термінального пропептиду проколагену I типу (PINP) у сироватці. На початку прижиттєвої фази тварин зважували і оперували. Лікування починали через день після операцій та продовжували проводити один раз на добу протягом двох тижнів. Як основу в групах 1 і 2 використовували стерильну воду. Після одного тижня лікування визначали масу тіла та відповідно коректували дози для лікування. Після двох тижнів лікування тварин зважували і брали у них зразки крові; тварин умертвляли і визначали питому масу матки. Для аналізу короткострокових ефектів лікування у зразках сироватки, зібраних до початку та наприкінці прижиттєвої фази, визначали рівні чотирьох біомаркерів метаболізму кісткової тканини. Зазначені біомаркери включали PINP як маркер кісткоутворення, N-термінальний MID-фрагмент остеокальцину (ОК) як загальний маркер поновлення кісткової тканини, C-термінальні перехресно-зв'язані тілопептиди колагену I типу (CTx) як маркер резорбції кістки, та ізоформу стійкої до тартрату кислої фосфатази 5b (ТрКФ-5b) як маркер кількості остеокластів. Рівні у сироватці на -7 день використовували як базові рівні, а рівні у сироватці на 14 день як рівні, що 27 UA 115866 C2 5 10 15 20 25 30 35 40 45 50 55 60 піддаються впливу операцій та лікування. [00177] Через два тижні після операції хірургічної оваріектомії у самок пацюків підвищувалася маса тіла, знижувалася питома маса матки, підвищувалися рівні CTx, ОК і PINP у сироватці та знижувалася активність ТрКФ-5b у сироватці. Результати аналізів на біомаркери метаболізму кісткової тканини вказують на те, що при оваріектомії підсилювалася резорбція кістки, прискорювалися поновлення кісткової тканини і кісткоутворення, і знижувалося загальне число остеокластів. Зазначені висновки означають, що хірургічна оваріектомія збільшувала швидкість поновлення кісткової тканини у самок пацюків. [00178] Короткостроковий вплив 17β-естрадіолу досліджували шляхом порівняння тварин після ОВЕ, які одержували лікування 17β-естрадіолом підшкірно в дозі 4 мкг/кг/день, з тваринами після ОВЕ, які одержували лікування основою. Лікування 17β-естрадіолом робило наступні ефекти на масу тіла, питому масу матки і біомаркери метаболізму кісткової тканини у пацюків після ОВЕ: - Лікування 17β-естрадіолом запобігало індуковане ОВЕ збільшення маси тіла та індуковане ОВЕ зниження питомої маси матки. - Лікування 17β-естрадіолом запобігало індуковане ОВЕ підвищення рівнів CTx, ОК і PINP у сироватці. - Лікування 17β-естрадіолом не впливало на індуковане ОВЕ зниження активності ТрКФ-5b у сироватці. [00179] Результати аналізів на біомаркери метаболізму кісткової тканини вказують на те, що лікування 17β-естрадіолом підшкірно в дозі 4 мкг/кг/день запобігало індуковане ОВЕ посилення резорбції кістки та індуковане ОВЕ прискорення поновлення кісткової тканини і кісткоутворення, але не впливало на індуковане ОВЕ зниження загального числа остеокластів у пацюків після ОВЕ після двох тижнів лікування. Зазначені висновки означають, що лікування 17β-естрадіолом підшкірно в дозі 4 мкг/кг/день запобігало індуковане ОВЕ підвищення швидкості поновлення кісткової тканини у самок пацюків. [00180] Короткостроковий вплив Сполуки 1 досліджували шляхом порівняння тварин після ОВЕ, які одержували лікування Сполукою 1 перорально в дозах 1 і 3 мг/кг/день, з тваринами після ОВЕ, які одержували лікування основою. Лікування Сполукою 1 робить наступні ефекти на масу тіла, питому масу матки і біомаркери метаболізму кісткової тканини у пацюків після ОВЕ: - Лікування Сполукою 1 перорально в дозі 1 мг/кг/день частково запобігало індуковане ОВЕ збільшення маси тіла. - Лікування Сполукою 1 перорально в дозах 1 і 3 мг/кг/день не впливало на індуковане ОВЕ зниження питомої маси матки. - Лікування Сполукою 1 перорально в дозі 3 мг/кг/день підсилювало індуковане ОВЕ підвищення рівнів PINP у сироватці та індуковане ОВЕ зниження активності ТрКФ-5b у сироватці. - Лікування Сполукою 1 перорально в дозах 1 і 3 мг/кг/день не впливало на індуковане ОВЕ підвищення рівнів CTx і ОК у сироватці. [00181] Результати аналізів на біомаркери метаболізму кісткової тканини вказують на те, що лікування Сполукою 1 перорально в дозі 3 мг/кг/день підсилювало індуковане ОВЕ збільшення кісткоутворення та індуковане ОВЕ зниження загального числа остеокластів, але не впливало на індуковане ОВЕ посилення резорбції кістки і поновлення кісткової тканини у пацюків після ОВЕ після двох тижнів лікування. Посилене кісткоутворення у сполученні зі зменшенням загального числа остеокластів і рівнями резорбції кістки, які не змінилися, означають, що лікування Сполукою 1 перорально в дозі 3 мг/кг/день зрушувало стимульоване ОВЕ поновлення кісткової тканини у напрямку кісткоутворення у самок пацюків. Опис [00182] Остеопороз у людини являє собою системне захворювання скелета, яке характеризується низькою кістковою масою й ушкодженням мікроархітектури кістки, що призводить до крихкості кісток і підвищення ризику переломів (Raisz et al. 2008). Хронічний характер остеопорозу робить його все більш дороговартісним для суспільства. Оскільки прогнозується збільшення очікуваної тривалості життя, також очікується і підвищення частоти остеопорозу, створюючи додаткове навантаження на систему охорони здоров'я. Хоча ефективні терапевтичні методи для лікування остеопорозу вже існують, є потреба в нових методах терапії з поліпшеним терапевтичним вікном, тобто з кращим коефіцієнтом ефективності / безпеки. Доклінічні дослідження ефективності на моделях остеопорозу у тварин забезпечують одержання із першо Джерела інформації: про ефекти нових потенційних терапевтичних методів до початку їхніх клінічних випробувань (Rissanen and Halleen 2010). Регулюючі застосування лікарських засобів 28
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for treating osteoporosis
Автори англійськоюAftab, Dana, T., Clary, Douglas
Автори російськоюАфтаб Дана Т., Клари Дуглас
МПК / Мітки
МПК: A61K 31/47
Мітки: остеопорозу, лікування, спосіб
Код посилання
<a href="https://ua.patents.su/41-115866-sposib-likuvannya-osteoporozu.html" target="_blank" rel="follow" title="База патентів України">Спосіб лікування остеопорозу</a>
Попередній патент: Виконана у вигляді пасового приводу система приводу самохідного комбайну
Наступний патент: Клапан для наповнення та спорожнювання повітряних мішків (варіанти)
Випадковий патент: Спосіб лікування чи профілактики діабету