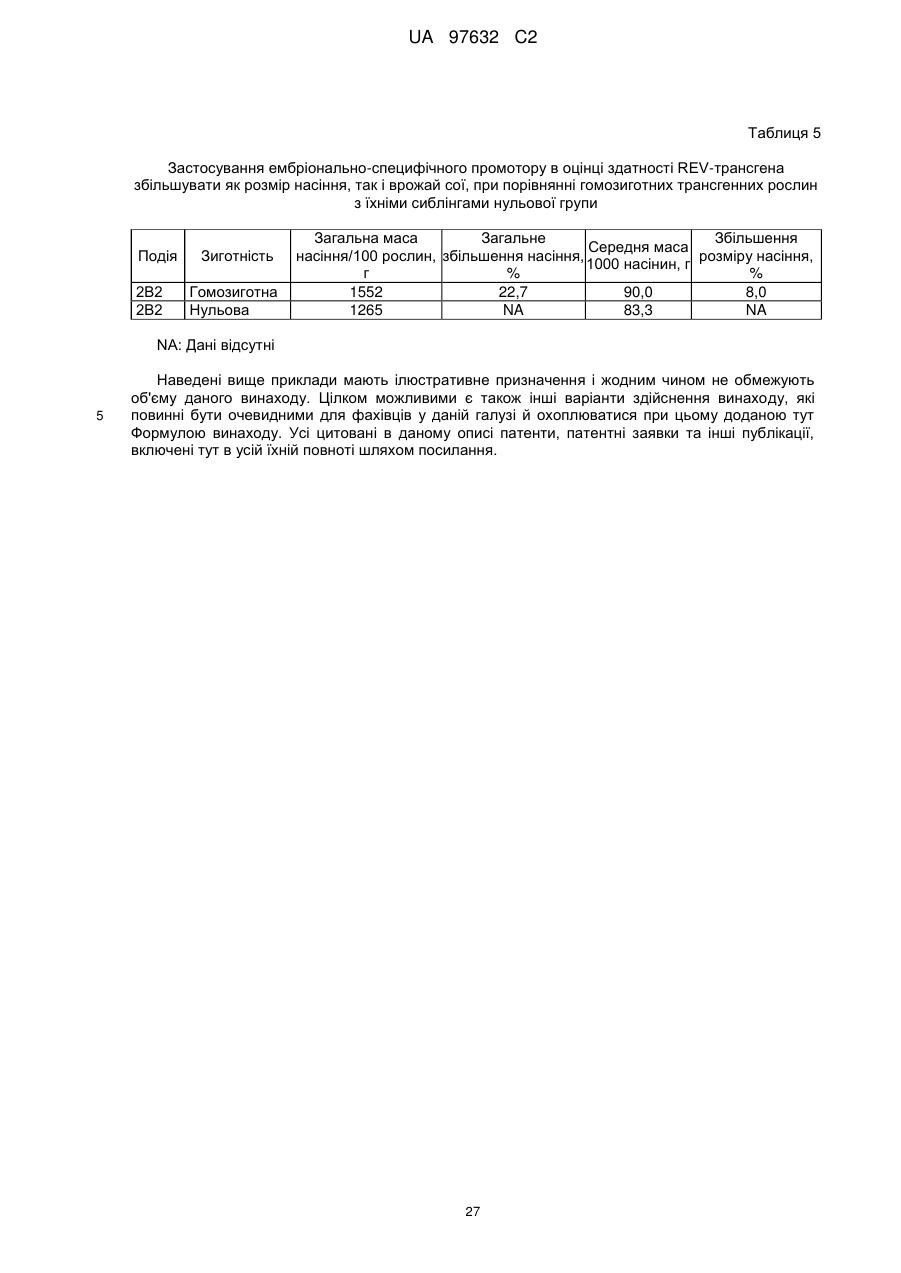
Спосіб збільшення розміру і кількості насіння внаслідок трансгенної надмірної експресії гена, асоційованого з ростом і/або розвитком, під час раннього ембріонального розвитку рослини
Формула / Реферат
1. Генетична конструкція, яка містить послідовність нуклеїнової кислоти, що кодує REV-ген, який оперативно зв'язаний з однією або більше контролюючими послідовностями, де контролюючі послідовності містять промотор, асоційований з геном листової сім'ядолі та/або геном олеату 12-гідроксилази:десатурази.
2. Генетична конструкція за п. 1, в якій геном листової сім'ядолі є ген LEC2 із виду Arabidopsis thaliana і геном олеату 12-гідроксилази:десатурази є ген олеату 12-гідроксилази:десатурази (LFAH12) із виду Lesquerella fendleri.
3. Генетична конструкція за п. 1 або п. 2, в якій REV-ген походить із виду Arabidopsis thaliana, Brassica napus, Glycine max або Zea mays.
4. Генетична конструкція за будь-яким із пп. 1-3, в якій конструкція додатково містить послідовність поліА.
5. Спосіб збільшення розміру насіння в рослині та/або збільшення кількості насіння, одержуваного з рослини, який включає введення в рослину або в рослинну клітину послідовності нуклеїнової кислоти, що кодує REV-ген, який оперативно зв'язаний з однією або більше контролюючими послідовностями, де контролюючі послідовності містять промотор, асоційований з геном листової сім'ядолі та/або геном олеату 12-гідроксилази:десатурази.
6. Спосіб за п. 5, в якому геном листової сім'ядолі є ген LEC2 із виду Arabidopsis thaliana, і геном олеату 12-гідроксилази:десатурази є ген олеату 12-гідроксилази:десатурази (LFAH12) із виду Lesquerella fendleri.
7. Спосіб за п. 5, в якому ген LEC або ген олеату 12-гідроксилази:десатурази є гетерологічним або гомологічним рослині.
8. Спосіб за будь-яким із пп. 5-7, в якому рослина є односім'ядольною або двосім'ядольною.
9. Спосіб за п. 8, в якому рослина є членом одного із таких сімейств: Brassicaceaе (Cruciferae), Gramineae, Malvaceae або Leguminosae-Papilionoideae.
10. Спосіб за п. 9, в якому рослиною є рапс, жито, камелія, бавовна, люцерна, соя, пшениця, рис або ячмінь.
11. Спосіб продукування трансгенної рослини, яка має збільшений розмір насіння та/або збільшену кількість насіння, спосіб включає: (a) введення в рослину або в рослинну клітину послідовності нуклеїнової кислоти, що кодує REV-ген, який оперативно зв'язаний з однією або більше контролюючими послідовностями, де контролюючі послідовності містять промотор, асоційований з геном листової сім'ядолі та/або геном олеату 12-гідроксилази:десатурази; і (b) культивування рослини або рослинної клітини, що містить послідовність нуклеїнової кислоти в умовах стимулювання регенерації рослини і росту зрілої рослини.
12. Спосіб за п. 11, в якому геном листової сім'ядолі є ген LEC2 із виду Arabidopsis thaliana, і геном олеату 12-гідроксилази:десатурази є ген олеату 12-гідроксилази:десатурази (LFAH12) із виду Lesquerella fendleri.
13. Спосіб за п. 11, в якому рослина або рослинна клітина виведена із рослини, яка є односім'ядольною або двосім'ядольною.
14. Спосіб за п. 13, в якому рослина є членом одного із таких сімейств: Brassicaceaе (Cruciferae), Gramineae, Malvaceae або Leguminosae-Papilionoideae.
15. Спосіб за п. 14, в якому рослиною є рапс, жито, камелія, бавовна, люцерна, соя, пшениця, рис або ячмінь.
16. Трансгенна рослина, яка містить послідовність нуклеїнової кислоти, що кодує REV-ген, який оперативно зв'язаний з однією або більше контролюючими послідовностями, де контролюючі послідовності містять промотор, асоційований з геном листової сім'ядолі та/або геном олеату 12-гідроксилази:десатурази, і має збільшений розмір насіння порівняно з відповідною рослиною дикого типу, має збільшену кількість насіння порівняно з відповідною рослиною дикого типу або має збільшені розмір насіння і кількість насіння порівняно з відповідною рослиною дикого типу.
17. Трансгенна рослина за п. 16, в якій геном листової сім'ядолі є ген LEC2 із виду Arabidopsis thaliana і геном олеату 12-гідроксилази:десатурази є ген олеату 12-гідроксилази:десатурази (LFAH12) із виду Lesquerella fendleri.
18. Трансгенна рослина за п. 16, в якій рослина або рослинна клітина виведена із рослини, яка є односім'ядольною або двосім'ядольною.
19. Трансгенна рослина за п. 18, в якій рослина є членом одного із таких сімейств: Brassicaceaе (Cruciferae), Gramineae, Malvaceae або Leguminosae-Papilionoideae.
20. Трансгенна рослина за п. 19, в якій рослиною є рапс, жито, камелія, бавовна, люцерна, соя, пшениця, рис або ячмінь.
21. Трансгенна рослина за будь-яким із пп. 16-20, в якій рослина є суцільною рослиною, рослинним органом, рослинним насінням, рослинною клітиною або їх нащадком.
22. Трансгенна рослина за п. 21, в якій рослинним органом є лист, стеблина, квітка або корінь, та рослинною клітиною є клітина тканинної культури.
Текст
Реферат: Винахід належить до генетичної конструкції, яка містить послідовність нуклеїнової кислоти, що кодує REV-ген, який оперативно зв'язаний з однією або більше контролюючими послідовностями, де контролюючі послідовності містять промотор, асоційований з геном листової сім'ядолі та/або геном олеату 12-гідроксилази:десатурази. Зазначена генетична конструкція збільшує розмір насіння в трансгенній рослині, яка її містить. Винахід також належить до трансгенних рослин, що містять зазначену конструкцію. UA 97632 C2 5 10 15 20 25 30 35 40 45 50 55 Перехресні посилання на споріднені заявки Дана заявка претендує на пріоритет заявки № 60/750,991 на патент США, поданої 15 грудня 2005 р. і включеної тут в усій її повноті і для всіх цілей шляхом посилання. Рівень техніки Найбільш важливою характеристикою, що стає предметом поліпшення будь-якої сільськогосподарської культури, є її врожайність. Зусилля, які спрямовуються на поліпшення врожайності сільськогосподарських культур шляхом розробки нових сортів рослин, можна поділити на два методологічні підходи. В одному з них знижують втрати врожайності культури методами селекційного або генного виведення сортів рослин з підвищеною стійкістю до абіотичних стресових умов, таких як посуха, холод або сіль, чи до біотичних стресових умов, спричинених комахами-шкідниками або хвороботворними патогенами. Хоча цей підхід і не позбавлений певної цікавості, проте він не дозволяє ґрунтовно поліпшувати врожайність за відсутності стресових умов. Інший підхід полягає в селекційному або генному виведенні сортів культур шляхом підвищення їхньої базової продуктивної спроможності. Застосовуючи цей підхід, класичні програми селекційного виведення дозволяли значно поліпшувати врожайність різноманітних сортів сільськогосподарських культур. Проте на практиці суттєве спочатку підвищення врожайності у подальшому, як правило, приймало форму все меншого його прирощування, котре, крім того, все важче було отримувати. Пізніше були знайдені більш сучасні підходи на основі методів молекулярної біології, які в принципі явили собою потужній інструмент, котрий дозволив досягати значного поліпшення врожайності сільськогосподарських культур шляхом змінювання часових схем, місць та рівнів експресії рослинних генів, що відіграють відому роль у рості та розвитку рослин. Значний прогрес був досягнутий упродовж останніх двадцяти років у справі ідентифікації рослинних генів, які беруть участь у рості та розвитку рослин. Але через складність процесів регуляції росту рослин і того, яким чином ці процеси, кінець кінцем, пов'язані з характеристиками врожайності, досі залишається нез'ясованим те, який із цих генів, якщо такий взагалі є, можна б було з упевненістю вважати кандидатом на перспективні засоби поліпшення врожайності. На рослинній моделі Arabidopsis thaliana було проведено багато роботи з ідентифікації рослинних генів, які виконують функцію росту і розвитку рослини. Один із таких генів під назвою REVOLUTA (REV) спочатку був ідентифікований як такий, що є мутацією втрати функції в Arabidopsis, та отримав назву revl (Talbert et al., Development 121:2723-2735, 1995). Ця мутація плейотропічним чином впливала на ріст і морфологію рослини. Один із цікавих фенотипів revlмутації характеризувався значно збільшеними розмірами насіння. Цей фенотип міг би бути потенційно корисним для сільського господарства, але він мав також небажані властивості зменшені кількості квітів і насіння, неплідність та змінену морфологію листа. Окрім грубішого насіння, мутант revl мав велике листя, а також великі стеблини і квіти. Ген REV був ідентифікований методом клонування на основі карти (описаним у заявці WO 01/33944, включеній тут в усій її повноті шляхом посилання) і показав, що є фактором транскрипції, який належить до сімейства факторів транскрипції типу домо-домен-лейцинових "застібок-блискавка" (HD-ZIP: home domain-leucine zipper). У рослинах гени HD-Zip залучаються до багатьох шляхів розвитку, включаючи розвиток судинних тканин, розвиток трихому і кореневого волоска, та регульованих світлом відповідей. Оскільки ген revl, з очевидністю, повинен бути мутацією втрати функції, були докладені зусилля для видалення функції REV у трансгенної рослини Arabidopsis шляхом експресії конструкцій REV з інвертованими повторами (REV-IR: inverted repeat) та шляхом спільної супресії, стимульованої надмірною експресією REV-гена (WO 01/33944). Конструкції REV-IR давали слабкий фенотип revl. Фенотип revl, включаючи більш грубе і важке насіння, спостерігався також в лініях надмірної експресії REV, де сильна конститутивна експресія REV-трансгена по всій рослині ініціювалася конститутивним 35S промотором. Слід зауважити, що цей ефект корелював з підвищеними рівнями мРНК REV, вказуючи на те, що він був зумовлений не спільною супресією ендогенного REV-гена. Виявлення того факту, що збільшений розмір насіння дає надмірна експресія, а не супресія REV, було дуже важливим, оскільки цього не очікувалося із результатів попередніх робіт з revlмутантом. Сильна конститутивна експресія REV трансгена по всій рослині імітувала грубонасіннєвий фенотип revl-мутанта, але при цьому вона також повторювала небажані фенотипи, що в ньому спостерігалися. Поряд з великими сподіваннями, що пов'язуються з можливістю отримувати фенотип грубішого насіння за допомогою технологічно простого процесу прямої конститутивної надмірної експресії REV-трансгена, існують також побоювання, що небажані фенотипи, які з цим 1 UA 97632 C2 5 10 15 20 25 30 35 40 45 50 55 60 процесом асоціюються, навряд чи дозволять йому вийти на рівень промислового сільськогосподарського застосування. Важливою для сільськогосподарського виробництва частиною рослини у багатьох культур є насіння. Якщо б здатність виробляти грубе насіння можна було культурі надавати без руйнівних побічних ефектів, зумовлених загальною конститутивною надмірною експресією REV, то це мало би для сільського господарства велике значення. Один із підходів до вирішення цієї проблеми полягає в обмеженні надмірної експресії REV лише насінням. Сьогодні вже є відомими й охарактеризовано багато насіння-специфічних промоторів, які б могли використовуватися для стимулювання експресії RЕ\/-трансгена, але немає свідчень того, що обмежена рамками насіння надмірна експресія REV у принципі може дати збільшення розмірів насіння. Природною функцією ендогенного REV-гена рослин у насінні, як відомо, є ініціація меристеми і визначення адаксіальної долі клітини (Otsuga et al., Plant J. 25:223-236, 2001; McConnell and Barton, Development 125:2935-2942 (1998); McConnell et al., Nature 411:709-713, 2001; Emery et al., Curr. Biol 13:1768-1774, 2003), а не ріст чи ділення клітини. Крім того, не відомо, чи є грубонасіннєвий фенотип у рослинах з надмірною експресією 35S/REV зумовлений надмірною експресією REV у насінні або в ембріоні, що розвивається, чи він зумовлений впливами на загальний ріст і розвиток рослини, викликаними надмірною експресією REV у всіх тканинах рослини. Окрім того, що не є відомою жодна біологічна функція REV у насінні, яка б могла впливати на визначення розміру насіння, немає також інформації стосовно того, в якій частині насінини або протягом якої стадії під час розвитку насінини було б найкраще спробувати здійснити надмірну експресію REV-трансгена для збільшення розміру насіння. У світлі вищевикладеного даний винахід спрямований на ембріонально-специфічну надмірну експресію гена, пов'язаного з ростом і/або розвитком, де зазначена надмірна експресія відбувається під час ранньої стадії ембріонального розвитку, в результаті чого збільшується розмір насіння порівняно з рослиною дикого типу, в котрій надмірної експресії цього гена не відбувається. В одному з варіантів практичного втілення даного винаходу здійснюють надмірну експресію REV-гена за допомогою специфічного промотору ранньої фази ембріонального розвитку. При цьому збільшений розмір насіння досягається без виникнення руйнівних побічних ефектів, які зазвичай спостерігаються при конститутивній надмірної експресії REV у всій рослині. Крім того, ембріонально-специфічна надмірна експресія REV дає непередбачене збільшення загальної кількості насіння на рослину порівняно з рослиною дикого типу. Збільшення загальної кількості насіння є результатом збільшення кількості насіння на плід, збільшення кількості грон на рослину, збільшення кількості плодів на гроно, зниження коефіцієнта припинення розвитку насіння або комбінації цих ефектів. Разом збільшений розмір насіння та збільшена його кількість внаслідок надмірної експресії REV в ембріоні, що розвивається, дають значне збільшення загального врожаю порівняно з рослиною дикого типу. Це свідчить про те, що ген, пов'язаний з ростом і/або розвитком рослини, може піддаватися надмірної експресії в асоціації зі специфічним промотором ранньої фази ембріонального розвитку і, таким чином, збільшувати врожай рослини. Суть винаходу Даним винаходом пропонуються способи, процеси і склади для збільшення розміру насіння і/або кількості насіння трансгенних рослин. Зокрема, винахід стосується використання специфічних промоторів ранньої фази ембріонального розвитку, оперативно зв'язаних з геном, асоційованим з ростом і/або розвитком рослини, для здійснення надмірної експресії цього гена і/або кодованого цим геном білка при розвитку насіння трансгенної рослини. Надмірна експресія зазначеного гена під час ранньої стадії розвитку насіння в трансгенній рослині дає збільшене продукування насіння і/або збільшений розмір насіння трансгенної рослини порівняно з рослиною дикого типу. В одному з варіантів здійснення даного винаходу REV-ген є оперативно зв'язаний зі специфічним промотором ранньої фази ембріонального розвитку для здійснення надмірної експресії REV-білка при розвитку насіння трансгенної рослини. Було виявлено, що в результаті надмірної експресії REV під час ранньої стадії розвитку насіння збільшується розмір і продукування насіння трансгенної рослини без виникнення руйнівних побічних ефектів, які спостерігалися, коли експресія REV відбувалася в усій рослині. Винаходом пропонується також спосіб збільшення розміру насіння в рослині, який включає у себе надмірну експресію гена, асоційованого з ростом і/або розвитком рослини, в насінні під час раннього ембріонального розвитку. Запропонований спосіб, зокрема, включає у себе експресію гена, асоційованого з ростом і/або розвитком у насінні під керуванням специфічного промотору ранньої фази ембріонального розвитку. Специфічний промотор ранньої фази ембріонального 2 UA 97632 C2 5 10 15 20 25 30 35 40 45 50 55 60 розвитку може бути гетерологічним або гомологічним по відношенню до рослини. У деяких варіантах здійснення даного винаходу зазначеним промотором є специфічний промотор ранньої фази, зв'язаний з геном амінокислотної пермеази, таким як ААР1, олеат 12гідроксилаза:десатуразним геном, 282-альбуміновим геном, геном елонгази жирних кислот, таким як FAE1, або геном листової сім'ядолі. Особливо підходящими для цілей даного винаходу промоторами є промотор ААР1 виду Arabidopsis thaliana, промотор олеат 12гідроксилаза:десатуразного гена із виду Lesquerellafendleri (LFAH12), промотор 2S2-гена і промотор LЕС2-гена листової сім'ядолі із виду Arabidopsis thaliana. В одному з варіантів здійснення даного винаходу REV-ген є оперативно зв'язаний зі специфічним промотором ранньої фази ембріонального розвитку. У цьому варіанті запропонованого способу надмірна експресія REV-гена відбувається на ранній стадії розвитку насіння і приводить до збільшення розмірів та кількості насінин порівняно з рослиною дикого типу. Способи згідно з даним винаходом можуть застосовуватися для збільшення розмірів і/або кількості насіння як однодольних, так і дводольних рослин. Зокрема, запропоновані способи можуть застосовуватися для збільшення розмірів і/або кількості насіння рослин, які є членами сімейств Brassicacea (Cruciferae), Gramineae, Malvaceae та Leguminosae-Papilionoideae. Особливо підходящими об'єктами застосування способів згідно з даним винаходом є рапс, жито, камелія, бавовна, люцерна, соя, пшениця, рис і ячмінь. Винаходом пропонуються також генетичні конструкції, які містять нуклеїнокислотну послідовність для того, щоб ген, асоційований з ростом і/або розвитком рослин, оперативно зв'язувався з однією чи більше керівними послідовностями, де зазначені керівні послідовності є здатними стимулювати експресію цього гена під час ембріонального розвитку. Генетична конструкція згідно з винаходом містить, зокрема, керівну послідовність зі специфічним промотором ранньої фази ембріонального розвитку. Специфічними промоторами ранньої фази ембріонального розвитку можуть бути, наприклад, промотор, асоційований з геном амінокислотної пермеази (ААР1), олеат 12-гідроксилаза:десатуразним геном, геном 2S2альбуміну (2S2), геном елонгази жирних кислот (FAE1), геном листової сім'ядолі (LEC2) тощо. Типові генетичні конструкції згідно з винаходом містять ААР1-промотор виду Arabidopsis thaliana, олеат 12-гідроксилаза:десатуразний промотор виду Lesquerella fendleri (LFAH12), промотор 2S2-гена виду Arabidopsis thaliana, промотор гена елонгази жирних кислот виду Arabidopsis thaliana, промотор гена 2 листової сім'ядолі промотор виду Arabidopsis thaliana та ін. Особливо підходящі генетичні конструкції згідно з винаходом містять специфічний промотор ранньої фази ембріонального розвитку, оперативно зв'язаний з REV-геном виду Arabidopsis. Запропонована генетична конструкція може також містити оперативно зв'язану послідовність поліА. Винаходом пропонуються також способи продукування трансгенної рослини, яка має збільшений розмір насіння і/або кількість насіння. Ці способи включають у себе: (а) введення в рослину або в рослинну клітину описаної вище генетичної конструкції і культивування рослини або рослинної клітини, що містить цю генетичну конструкцію, в умовах стимулювання регенерації рослини і росту зрілої рослини. Як правило, запропоновані способи дозволяють продукувати трансгенну рослину, яка має збільшений розмір насіння і/або кількість насіння порівняно з відповідною рослиною дикого типу. Трансгенні рослини, які містять згадані генетичні конструкції, можуть бути однодольними або дводольними, зокрема, коли однодольна рослина є членом сімейства Gramineae. До числа особливо підходящих для цілей даного винаходу рослин сімейства Gramineae належать рис, овес, жито і пшениця. Крім того, до числа підходящих трансгенних рослин згідно з винаходом належать рослини сімейств Brassicacea (Cruciferae), Malvaceae та Leguminosae-Papilionoideae і серед них, зокрема, соя, бавовна, камелія, люцерна і рапс. Винаходом пропонуються також процеси селекції для одержання гена, який збільшує врожайність рослини, коли він є функціонально зв'язаним зі специфічним промотором ранньої фази ембріонального розвитку. Запропоновані процеси включають у себе: конструювання вектора експресії, який містить ген, асоційований з ростом і/або розвитком рослин і функціонально зв'язаний зі специфічним промотором ранньої фази ембріонального розвитку; трансфекцію рослинної клітини вектором експресії для утворення трансгенної рослини; вирощування цієї трансгенної рослини і селекцію тих трансгенних рослин, які мають підвищену врожайність. Гени, які продукують трансгенну рослину з підвищеною врожайністю, відбирають для подальшої розробки трансгенних рослин. До числа генів, які можуть застосовуватися в цьому процесі, належать, наприклад, CAP (циклаза-асоційований протеїн)-ген, ген рисової гістон-деацетилази 1, E2Рс-ген, ВKI-ген, BRII-ген, ARL (аргозоподобний)-ген, bril (сприйняття 3 UA 97632 C2 5 10 15 20 25 30 35 40 45 50 55 60 brassino-стероїдного гормону)-ген, FATB-ген, ген пепіно, RGS (регулятор передачі сигналу Gпротеїну)-ген, ТІР1 ген, BB («старшого брата»)-ген, RHD2-ген, INCW2-ген, MN1-ген, WAK2-ген, WАK4-ген, AР2-ген і т. п. Скорочений опис фігур креслення На Фіг. 1 показані профілі експресії ембріонально-специфічних промоторів під час раннього ембріонального розвитку. Приблизні стадії ембріонального розвитку Arabidopsis: ранній глобулярний - 2 дні після запилення; ядро - 4 дні після запилення; торпеда - 6 днів після запилення; тростина - 7 днів після запилення; ембріон ранньої зрілості - 8 днів після запилення. На Фіг. 2 ілюстровано зіставляння амінокислотних послідовностей однієї із ділянок факторів транскрипції HD-ZIPIII класів REVOLUTA і не-REVOLUTA. Дана ділянка амінокислотної послідовності містить характерну відмінність в амінокислотній послідовності, котрою HD-ZIPIII протеїни визначаються як такі, що належать до класів протеїнів REVOLUTA або не-REVOLUTA. Окресленою частиною послідовностей позначений сайт інсерції амінокислотної послідовності, котрою визначаються HD-ZIPIII-протеїни не-REVOLUTA. Протеїни REVOLUTA визначаються відсутністю інсерції амінокислотної послідовності. Athb-9 (Arabidopsis; SEQ ID NO:2); Athb-14 (Arabidopsis; SEQ ID NO:3); REV (Arabidopsis; SEQ ID NO:4); BnLfREV (Bassica napis; SEQ ID NO:5); OsREVI (Oryza sativa; SEQ ID NO:6); ZmRLDI (Zea mayes; SEQ ID NO:7); OsREV2 (Oryza sativa; SEQ ID NO:8); Athb-15 (Arabidopsis; SEQ ID NO:9); і Athb-8 (Arabidopsis; SEQ ID NO:10). Докладний опис винаходу Даним винаходом пропонуються способи, процеси і склади, які можуть використовуватися для продукування рослин, що мають збільшений розмір насіння і/або збільшену кількість насіння порівняно з рослиною дикого типу. Зокрема, запропоновані способи включають у себе надмірну експресію гена, залученого до росту і/або розвитку рослини в ембріоні рослини, де в результаті надмірної експресії трансгена збільшується розмір насіння і/або збільшується кількість насіння в рослині. В одному з варіантів здійснення винаходу надмірної експресії піддають ген REVOLUTA (REV). RE\/-трансген у способах згідно з даним винаходом перебуває під керуванням промотору, який ініціює експресію під час ембріонального розвитку і, зокрема, під час специфічного ембріонального розвитку на ранній фазі. Було виявлено, що надмірна експресія REV-трансгена на ранній стадії ембріонального розвитку приводить до продукування насіння більших розмірів і в більших кількостях. Спочатку для визначення принципової можливості збільшувати розмір насіння шляхом застосування надмірної експресії гена, залученого до росту і/або розвитку рослини, були проведені дослідження з REV-геном націленим на насіння, в ході яких була випробувана REVтрансгенна конструкція, яка містила ембріонально-специфічний промотор для ініціації REVекспресії. Наявність у розпорядженні чималої кількості ембріонально-специфічних промоторів з добре охарактеризованими профілями експресії під час ембріонального розвитку рослини Arabidopsis уможливила створення трансгенних рослин, у котрих надмірна експресія REV спрямовувалася на декілька різних, але таких, що взаємно перекриваються, фаз ембріонального розвитку. Були проведені випробування, в котрих REV-трансгенні конструкції рослини Arabidopsis уводилися в рапс. Безпосереднє звертання авторів до рапсу було зумовлено по-перше тим, що геном Arabidopsis є дуже близьким до геному рапсу і, таким чином, відомі характеристики експресії промоторів, визначені в Arabidopsis, можна, цілком очевидно, переносити на рапс, а по-друге тим, що рапс є сільськогосподарською культурою. Отже, демонстрація впливу на розмір насіння рапсу буде мати пряме сільськогосподарське значення. Використовуване в даному описі поняття "гена, асоційованого з ростом і/або розвитком рослини”, слід розуміти таким чином, що ген такого роду відіграє певну роль у визначенні швидкості росту, габаритних розмірів, розмірів тканин і кількості тканин рослини або у програмі еволюційного розвитку рослини, що веде до визначення ідентичності та морфології її тканин. Такі асоційовані з ростом і розвитком рослин гени ідентифікуються, коли в результаті модифікації їхньої функції шляхом мутації, надмірної експресії або пригнічення експресії змінюються швидкість росту рослини, її габаритні розміри, розміри і кількість тканин або самий розвиток рослини. Дія генів, асоційованих з ростом і розвитком рослин, може проявлятися через різноманітні біологічні механізми, такі як регуляція клітинного циклу, шляхи синтезу і розпаду рослинних гормонів, чутливість до рослинних гормонів, біосинтез клітинних оболонок, визначення ідентичності клітин і т. п. Дослідження надмірної експресії та пригнічення експресії показують, що в рості та розвитку рослин бере участь велика кількість рослинних генів. Багато з них можуть застосовуватися також у випробуваннях і способах згідно з даним винаходом. Так наприклад, СAР-ген рослини Arabidopsis кодує асоційований з циклазою білок, залучений до передачі сигналів Ras-cAMP і регуляції актинового цитоскелету. Надмірна експресія CAP, активована промотором, що 4 UA 97632 C2 5 10 15 20 25 30 35 40 45 50 55 індукується глюкокортикоїдом, викликає втрату актинових волокон і зменшення розмірів листя внаслідок зменшення подовження епідермальних клітин і клітин мезофілу (Barrero et al., Annals of Botany 91:599-603, 2003). Пригнічення експресії гена синтезу сахарози у бавовні приводить до зменшення довжини клітинного волокна, розмірів і кількості клітин у волокні (Yong-Ling Ruan et al., Plant Cell 15:952-964, 2003). Внаслідок надмірної експресії гена гістон-деацетилази 1 рису промотором, що індукується ABA, у трансгенному рисі з'являлися рослини зі збільшеною швидкістю росту та аномальним розвитком тканини паростків і коріння порівняно з рослиною дикого типу (In-Cheol Jang et al., Plant J. 33:531-541, 2003). РНКі-супресія E2Fc в Arabidopsis підвищувала проліферативну активність у листі, меристемах, і клітинах перициклу. Клітини в органах мали менші розміри, але кількість їх була більшою, ніж у рослин дикого типу, і був зниженим рівень плоїдності в листі (del Pozo et al., Plant Cell 18:2224-2235, 2006). У результаті РНКі-супресії ВKІ-гена виходило насіння з гіпокотилями зменшеної довжини, а надмірна експресія ВKІ давала карликові рослини (Xuelu and Chory, Science 313:1118-1122, 2006). Трансгенні рослини, що експресували частково конститутивний стероїдний рецептор BRI1, мали довгіші гіпокотилі (Wang et al., Dev. Cell 8:855-865, 2005). Внаслідок супресії аргозоподібного (ARL) гена в Arabidopsis утворювалися менших розмірів сім'ядолі, листя та інші бічні органи, у той час як його надмірна експресія давала протилежний ефект. Ця зміна розмірів може бути зв'язана скоріше з розміром, ніж з кількістю клітин (Hu et al., Plant J. 47:1-9, 2006). Аналіз рослин з мутаціями, що дають фенотипи зі зміненими характеристиками росту і/або розвитку, дозволив ідентифікувати низку генів, які відіграють відповідні ролі в рості та розвитку рослин. Мутація, що зачіплює сприйняття brassino-стероїдного гормону, brіІ-5, приводить до продукування карликових рослин (Wang et al., Dev. Cell 8:855-865, 2005). Т-ДНК-вставка (вибивання) в FATB-гені Arabidopsis, який кодує ацил-ацил-несучий протеїн-тіоестеразу, призводить до зниження швидкості росту, зниження маси сирої тканини і низької життєздатності насіння (Bonaventure et al., Plant Cell 15:1020-1033, 2003). Мутація "втрати функції" в пепіно, уявна антифосфатаза, демонструвала пухлиноподібну проліферацію клітин у верхівковій меристемі паростків і продукувала надлишкове аномальне листя (Haberer et al., Dev. Genes Evol. 212:542-550, 2002). RGS-ген (регулятор передачі сигналу G-протеїну) в Arabidopsis має структуру G-протеїн-зв'язаного рецептора (GPCR) і містить блок RGS (регулятор передачи сигналу G-протеїну). RGS-протеїни прискорюють дезактивацію Ga-субблока і, таким чином, зменшують передачу сигналів GPCR. Нульовий rgs-мутант має зменшене подовження клітин у гіпокотилі, що виріс у темноті, і збільшене продукування клітин у корінні, що виросло у світлі (Chen et al., Science 301:1728-1731, 2003). ТІРІ-ген рослини Arabidopsis відіграє певну роль у розвитку кореневих волосків, а також у клітинному рості. Мутант tip 1-2 має менші розетки, зменшену висоту і коротші міжвузля (Ryan et al., New Phytol. 138:49-58, 1998 and Hemsley et al., Plant Cell 17:2554-2563, 2005). Мутанти (хромосомна перестановка або Т-ДНК-вставка) гена «старшого брата» (BB), які дають дуже малу або зовсім нульову mРНК «старшого брата», розвивають більш великі квіткові органи, більшу квіткову біомасу і товстіші стеблини. На противагу цьому, надмірна експресія «старшого брата» веде до зменшення розмірів квіткових органів, зниження квіткової біомаси, потоншення стеблин і зменшення розмірів листя. ВВмутанти можуть змінювати кількість клітин (Disch et al., Curr. Вiоl 16:272-279, 2006). RHD2-ген кодує NADPH-оксидазу, яка є важливою для акумулювання видів з хімічно активним киснем у волосках коріння і наступної активації кальцієвих каналів. Мутант під назвою rhd2 є дефективним у поширенні верхівкових клітин коріння (Foreman et al., Nature 422:442-446, 2003). Мініатюрна мутація в кукурудзі викликає втрату клітинно-оболонкової інвертази, експресованої із INCW2-гена. Клітини mn1-мутанта є менших розмірів, ніж клітини дикого типу, а mn1-мутанти насіння мають лише 20% маси ендосперму насіння дикого типу. Поширення може бути гіршим у клітин периферійних шарів mn1-ендосперму і призводити до зниження мітотичної активності цих клітин (Vilhar et al., Plant Physiol. 129: 23-30, 2002). Т-ДНК-інсерційний мутант WAK2, wak2-1, має зменшене подовження клітин у корінні. WAK2 може регулювати поширення клітин шляхом регуляції вакуолярної інвертазної активності. Експресія здатного індукуватися антисенсу WAK2 або WAK4 у рослинах запобігає подовженню клітин і продукує карликові рослини (Wagner and Kohorn, Plant Cell 13:303-318, 2001, Lally et al., Plant Cell 13:1317-1331, 2001, and Kohorn et al., Plant J, 46:307-316, 2006). Ген АР2 рослини Arabidopsis відіграє певну роль в ідентичності квіткового органу та у створенні ідентичності квіткової меристеми. Мутації «втрати функції» в АР2 дають збільшення насіннєвої маси порівняно з рослиною дикого типу (Masa- Onto et al., Proc. Nat'l Acad. Scl USA 102:3123-3128, 2005). Мутанти teb мають короткі корні, зубчасте листя і фасціацію. У них спостерігалися дефекти ділення клітин, які можуть бути зумовленими дефектом у розвитку G2/М-клітинного циклу (Inagaki et al., Plant Cell 18:879-892, 2006). 5 UA 97632 C2 5 10 15 20 25 30 35 40 45 50 55 60 Використовувані у даному описі терміни "ген росту і/або розвитку" і "трансген росту і/або розвитку" означають будь-яку полінуклеотидну послідовність, що кодує або полегшує експресію і/або продукування кодованого цим геном нуклеотиду або протеїну. Отже терміни "ген росту і/або розвитку" і "трансген росту і/або розвитку" в тому числі охоплюють своїми значеннями послідовності, які розташовуються по боках послідовностей, що кодують нуклеотид і/або протеїн. Наприклад, це можуть бути нуклеотидні послідовності, що кодують протеїни (екзони), проміжні послідовності (інтрони), фланкувальні 5' і 3' ДНК-ділянки, які містять послідовності, потрібні для нормальної експресії цього гена (тобто, відповідно, промоторна і поліАприєднувальна ділянки, а також будь-які енхансерні послідовності). Використовувані у даному описі терміни "протеїн росту і/або розвитку", "гомолог росту і/або розвитку" та "ортолог, асоційований з ростом і/або розвитком", означають протеїн, який володіє здатністю регулювати швидкість росту, габаритні розміри, розміри тканин і кількість тканин рослини або регулювати програму розвитку рослини, що веде до визначення ідентичності та морфології тканин (при практичному застосуванні способів згідно з даним винаходом), і який має амінокислотну послідовність, котра є принаймні на приблизно 70% ідентичною, у кращому варіанті - принаймні на приблизно 75% ідентичною, а в ще кращому варіанті - принаймні на приблизно 80% ідентичною амінокислотним послідовностям для даного гена. Використовуваний у даному описі термін "ембріонально-специфічний ген" означає ген, експресія котрого відбувається переважно під час ембріонального розвитку рослини. Відповідно до цілей даного винаходу ембріональний розвиток починається від перших ділень клітин у зиготі, триває до пізньої фази ембріонального розвитку (що характеризується визріванням, висушуванням, спокоєм) і закінчується продукуванням зрілого і висушеного насіння. Ембріонально-специфічні гени можуть поділятися далі на гени, "специфічні для ранньої фази", і гени, "специфічні для пізньої фази". Генами, специфічними для ранньої фази, є такі, що експресуються в ембріонах до кінця ембріо-морфогенезу. Генами, специфічними для пізньої фази, є такі, що експресуються від визрівання до продукування зрілого і висушеного насіння. Як приклад ембріонально-специфічні гени, що ініціюють експресію під час раннього ембріонального розвитку і є специфічними для ранньої фази, показані на Фіг. 1. "Гетерологічною послідовністю" є олігонуклеотидна послідовність, яка походить від відмінного виду або від того ж виду, і тоді є суттєво модифікованою відносно її початкової форми. Наприклад, гетерологічний промотор, оперативно зв'язаний зі структурним геном, може походити від виду, відмінного від того, із котрого був виведений структурний ген, або, якщо із того ж виду, може бути суттєво модифікований відносно його початкової форми. Термін "вектор" означає частину ДНК, зазвичай дволанцюгову, яка може мати вставлену в неї частину чужорідної ДНК. Вектор або реплікон може бути, наприклад, плазмідного або вірусного походження. Вектори містять "репліконові" полінуклеотидні послідовності, котрі полегшують автономну реплікацію вектора у клітині-хазяїні. Термін "реплікон" у контексті даного опису охоплює своїм значенням також ділянки полінуклеотидних послідовностей, які націлюють або іншим чином полегшують рекомбінацію векторних послідовностей у хромосому-хазяїна. Крім того, в той час як чужорідна ДНК може бути вставлена спочатку, наприклад, у ДНК вірусний вектор, трансформація ДНК вірусного вектора у клітину-хазяїна може давати перетворення вірусної ДНК на вірусну молекулу РНК-вектора. Чужорідною ДНК є гетерологічна ДНК, котрою є ДНК, у природному стані відсутня в клітині-хазяїні, яка, наприклад, реплікує молекулу вектора, кодує маркер або трансген, що може піддаватися селекції або скринінгу. Вектор використовують для транспортування чужорідної або гетерологічної ДНК у відповідну клітину-хазяїна. Потрапивши у клітину-хазяїна, вектор може реплікувати незалежно від хромосомної ДНК хазяїна або водночас з нею, і при цьому можуть бути створені декілька копій вектора та його вставленої ДНК. В альтернативному варіанті вектор може спрямовувати вставку чужорідної або гетерологічної ДНК у хромосому-хазяїна. Крім того, вектор може містити також необхідні елементи, які дозволяють здійснювати транскрипцію вставленої ДНК у молекулу mРНК або іншим чином здійснювати реплікацію вставленої ДНК у множину копій РНК. Деякі вектори експресії, крім того, містять елементи послідовностей, суміжні зі вставленою ДНК, які дозволяють здійснювати трансляцію mРНК у білкову молекулу. Таким чином може бути швидко синтезовано багато молекул mРНК і поліпептиду, кодованих вставленою ДНК. Використовуваний у даному описі термін "трансгений вектор" означає вектор, який містить вставлений сегмент ДНК, "трансген", транскрибований в mРНК або реплікований як РНК у клітині-хазяїні. Термін "трансген" означає не тільки частину вставленої ДНК, яка є перетвореною на РНК, але також ті частини вектора, котрі є необхідними для транскрипції або реплікації РНК. Крім того, трансгену не є потрібним обов'язково містити полінуклеотидну послідовність, що містить відкриту рамку зчитування, здатну виробляти протеїн. 6 UA 97632 C2 5 10 15 20 25 30 35 40 45 50 55 60 Терміни "трансформована клітина-хазяїн", "трансформований" і "трансформація" стосуються введення ДНК у клітину. Клітина при цьому зветься "клітиною-хазяїном" і може бути прокаріотичною або еукаріотичною. Типовими прокаріотичними клітинами-хазяїнами є, наприклад, різноманітні штами Е. соlі. Типовими еукаріотичними клітинами-хазяїнами є рослинні клітини (наприклад, рапсу, бавовни, камелії, люцерни, сої, рису, вівса, пшениці, ячменю, жита тощо), дріжджові клітини, клітини комах та тваринні клітини. Уведена ДНК зазвичай є у формі вектора, який містить вставлену частину ДНК. Послідовність вставленої ДНК може бути від того ж виду, що і клітина-хазяїн, або від виду, відмінного від клітини-хазяїна, або ж це може бути гібридна послідовність ДНК, що містить певну чужорідну ДНК і ДНК, виведену із виду хазяїна. Використовуваний у даному описі термін "рослина" охоплює своїм значенням суцільні рослини, органи рослин, (наприклад, листя, стеблини, квіти, корні і т. п), насіння і рослинні клітини (включаючи клітини тканинних культур) та їхні нащадки. Клас рослин, які можуть застосовуватися у способах згідно з даним винаходом,у загальному випадку є таким же широким, як і клас вищих рослин, до яких можуть застосовуватися методи трансформації, включаючи як однодольні, так і дводольні рослини, а також деякі нижчі рослини на зразок водоростей. До діапазону значення даного терміну входять, в тому числі, рослини різноманітних рівнів плоїдності, включаючи поліплоїдні, диплоїдні і гаплоїдні рослини. "Гетерологічною послідовністю" є така послідовність, яка походить із чужорідного виду або яка походить із того ж виду, але тоді є суттєво модифікованою із її початкової форми. Наприклад, гетерологічний промотор, оперативно зв'язаний зі структурним геном, може походити із виду, відмінного від того, із якого був виведений структурний ген, або ж він може походити із того ж виду, що і структурний ген, але тоді повинен бути суттєво модифікованим із його початкової форми. Використовувані в даному описі терміни "REVOLUTA-ген" і "REVOLUTA-трансген" означають будь-яку полінуклеотидну послідовність, що кодує або полегшує експресію і/або продукування REVOLUTA-протеїну. Таким чином, терміни "REVOLUTA-ген" і "REVOLUTA-трансген" можуть означати послідовності, що фланкують послідовності, які кодують REVOLUTA-протеїн. Цими послідовностями можуть бути, наприклад, екзони, тобто нуклеотидні послідовності, які кодують протеїни, інтрони, тобто проміжні послідовності, фланкувальні 5'- і 3'-ДНК ділянки, які містять послідовності, потрібні для нормальної експресії REVOLUTA-гена (тобто, відповідно, промоторна і поліА-приєднувальна ділянки, а також будь-які енхансерні послідовності). Використовувані в даному описі терміни "REVOLUTA-протеїн", "REVOLUTA-гомолог" і "REVOLUTA-ортолог" означають протеїн, який володіє здатністю регулювати ділення рослинних клітин (при практичному застосуванні способів згідно з даним винаходом) і має амінокислотну послідовність, котра є принаймні приблизно на приблизно 70% ідентичною, у кращому варіанті принаймні на приблизно 75% ідентичною, а в ще кращому варіанті - принаймні на приблизно 80% ідентичною амінокислотним послідовностям для REVOLUTA, описаним у заявці WO 01/33944 (включеній тут в усій її повноті шляхом посилання). З іншого боку терміни використовувані в даному описі терміни "REVOLUTA-протеїн", "REVOLUTA-гомолог" і "REVOLUTA-ортолог" означають REVOLTA-протеїни, котрі ідентифікуються як такі, що є відмінними від нe-REVOLUTA-членів HD-ZIPIII-класу рослинних факторів транскрипції. REVOLUTA-члени HD-ZIPIII-класу протеїнів характеризуються нестачею або відсутністю характеристичної вставки амінокислотної послідовності, яка є в не-REVOLUTA HD-ZIPIII протеїнах між амінокислотними залишками 146 і 147 амінокислотної послідовності REVOLUTA, описаної в заявці WO 01/33944 і показаної на Фіг. 2. На Фіг. 2 фактори транскрипції в гомеобоксі від Arabidopsis thaliana з позначеннями athb-8, athb-9, athb-14 та athb-15 є неREVOLUTA HD-ZIPIII протеїнами і всі мають вставку характеристичної амінокислотної послідовності між амінокислотами 146 і 147 амінокислотної послідовності REVOLUTA. Усі п'ять послідовностей REVOLUTA на Фіг. 2 не мають амінокислотної вставки у цьому місці амінокислотної послідовності REVOLUTA. Відсутність вставки амінокислотної послідовності є відмітною і визначальною характеристикою REVOLUTA-протеїнів. Термін "відносна ідентичність у відсотках" означає відсоток амінокислот або нуклеотидів, які займають однакові відносні положення при зіставлянні одна з одною двох амінокислотних або двох нуклеїнокислотних послідовностей за допомогою комп'ютерної програми, наприклад, такої як зазначено нижче. Термін "відносна подібність у відсотках" означає статистичний вимір ступеню спорідненості двох порівнюваних білкових послідовностей. Відносну подібність у відсотках обчислюють за допомогою комп'ютерної програми, яка надає кількісне значення цієї характеристики кожній порівнюваній парі амінокислот на основі їхньої хімічної спорідненості (наприклад, у тому, чи є порівнювані амінокислоти кислотними, основними, гідрофільними, ароматичними тощо) і/або еволюційної відстані, вимірюваної у величинах мінімальної кількості 7 UA 97632 C2 5 10 15 20 25 30 35 40 45 50 55 60 змін пар азотистих основ, потрібної для перетворення кодону, що кодує один член певної пари порівнюваних амінокислот, на кодон, що кодує інший член цієї пари. Ці обчислення проводять після виявлення найкращого емпіричного зіставляння двох даних послідовностей шляхом ітеративного порівняння всіх можливих варіантів зіставляння, як описано, наприклад, у роботі (Henikoff et al., Proc. Natl. Acad. Sci. USA 89:10915-10919, 1992). Термін "суттєва ідентичність" полінуклеотидної послідовності означає, що даний полінуклеотид має послідовність, ідентичність якої, визначена за допомогою описаних нижче програм за стандартними параметрами, складає принаймні 60%, у кращому варіанті - принаймні 70%, у ще кращому варіанті - принаймні 80%, а в найкращому варіанті - принаймні 90% порівняно з еталонною послідовністю. Цілком зрозуміло, що ці величини можуть бути відповідним чином пристосовані до визначення відповідної ідентичності протеїнів, кодованих двома нуклеотидними послідовностями, з урахуванням виродженості кодонів, амінокислотної подібності, розташування рамки зчитування тощо. Ідентичність амінокислотних послідовностей може визначатися, наприклад, таким чином. За допомогою програми BLASTP версія 2.0.9 (Atschul et al., Nucl Acids Res. 25:3389-3402, 1997) проводять пошук бази даних нуклеїнокислотних послідовностей, наприклад GenBank, користуючись як зразком частиною амінокислотної послідовності протеїну, кодованого асоційованим з ростом і/або розвитком геном, наприклад REVOLUTA. Порівняльний аналіз послідовностей двох (чи більше) полінуклеотидів або поліпептидів проводять, як правило, шляхом порівняння двох послідовностей у "вікні порівняння", ідентифікуючи і порівнюючи, таким чином, локальні ділянки подібності послідовностей. "Вікном порівняння" є сегмент, що складається принаймні із приблизно 20 суміжних положень, зазвичай від 50 до 200, а частіше приблизно від 100 до 150 суміжних положень, у котрих дана послідовність може порівнюватися з еталонною послідовністю такої самої кількості суміжних положень після того, як ці дві послідовності будуть оптимально зіставлені. Оптимальне зіставляння послідовності для порівняння може проводитися за допомогою, наприклад, алгоритмів локальної ідентичності або подібності, описаних у роботі (Smith et al., Adv. Appl Math. 2:482, 1981), алгоритму гомологічного зіставляння, описаного в роботи (Needleman et al., J. Mol. Biol. 48:443-453,1970), методу пошуку подібності, описаного в роботі (Pearson et al., Proc. Natl Acad. Sci. USA 85:2444-2448, 1988), комп'ютеризованих варіантів цих алгоритмів (GAP, BESTFIT, FASTA і TFASTA у програмному пакеті Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Drive, Madison, Wl) або шляхом візуального обстеження. Одним із особливо підходящих алгоритмів є, наприклад, PILEUP. PILEUP здійснює зіставляння множини послідовностей із групи споріднених послідовностей шляхом поступових, попарних зіставлянь і дає в результаті співвідношення та відносну ідентичність послідовностей у відсотках. Крім того, цей алгоритм будує графічне дерево або дендрограму, що ілюструють співвідношення кластероутворення, які використовуються у здійсненні зіставляння. Алгоритм PILEUP використовує спрощений метод Фенга поступового зіставляння, описаний в роботі (Feng et al., J. Mol. Evol 35:351-360, 1987). Цей метод є подібним методу, описаному Хігінсом (Higgins et al., CABIOS 5:151-153, 1989). Дана програма дозволяє проводити порівняльний аналіз до 300 послідовностей, кожна з яких може мати максимальну довжину 5000 нуклеотидів або амінокислот. Процедура множинного порівняльного аналізу починається попарним зіставлянням двох найбільш споріднених послідовностей. Далі цей кластер порівнюють з наступною найбільш спорідненою послідовністю або з кластером зіставлених послідовностей. Два кластери послідовностей порівнюють шляхом простого подовження попарного зіставляння двох індивідуальних послідовностей. Завершальне зіставляння здійснюють шляхом проведення низки послідовних, попарних зіставлянь. Програмою керують шляхом задавання специфічних послідовностей і координат їхніх нуклеотидів або амінокислот на ділянках порівняння послідовностей, а також задавання параметрів програми. Наприклад, еталонна послідовність може порівнюватися з іншою послідовністю, що аналізується, з метою визначення відносної ідентичності послідовності у відсотках при таких параметрах програми: вага проміжків за умовчанням (3,00), вага довжини проміжків за умовчанням (0,10) і зважені кінцеві проміжки. Іншим алгоритмом, підходящим для визначення відносної ідентичності послідовності у відсотках і подібності послідовності, є програма BLAST, докладно описана в роботі (Altschul et al., J. Mol. Biol. 215:403-410, 1990). Публічний доступ до програмного забезпечення для проведення BLAST аналізів відкритий через вебсайт Національного інформаційного центру з біотехнології (National Center for Biotechnology Information web site). Цей алгоритм спочатку ідентифікує пари послідовностей з високим рахунком (HSP) шляхом ідентифікації коротких слів з довжиною W в опитуваній послідовності, яка або відповідає або задовольняє певному 8 UA 97632 C2 5 10 15 20 25 30 35 40 45 50 55 60 позитивно оціненому граничному рахунку Τ при зіставлянні зі словом такої самої довжини в послідовності із бази даних. Рахунок Τ зветься порогом рахунку сусіднього слова (Altschul et al., supra). Ці початкові збіги сусідніх слів служать зародками для ініціації пошуку більш довгих HSPпар, що їх містять. Після цього збіги слів подовжуються в обох напрямках уздовж кожної послідовності, оскільки накопичуваний рахунок зіставляння може збільшуватися. Подовження збігів слів у кожному напрямку припиняється, коли: накопичуваний рахунок зіставляння зменшується на величину X від його максимальної досягнутої величини; накопичуваний рахунок доходить до нуля або нижче внаслідок акумулювання одного чи більше зіставлянь залишків з від'ємним рахунком; досягається кінець будь-якої із послідовностей. Параметри W, Τ і X алгоритму BLAST визначають чутливість і швидкість порівняльного аналізу. Програма BLAST використовує за умовчанням довжину слова (W) 11, зіставляння (В) 50 з матрицею підраховування BLOSUM62 (Henikoff et аі, Proc. Natl. Acad, Sci. USA 89:10915-10919, 1992), очікування (Ε) 10, Μ=5, Ν=-4 і порівняння обох ланцюгів. Окрім обчислення відносної ідентичності послідовності у відсотках, алгоритм BLAST проводить також статистичний аналіз подібності одна з одною двох послідовностей (Karlin et al., Proc. Natl. Acad. Sci. USA 90:5873-5877, 1993). Одним із вимірів подібності, які забезпечуються алгоритмом BLAST, є імовірність найменшої суми (P(N)), котра являє собою показник імовірності з яким може відбутися випадковий збіг між двома нуклеотидними або амінокислотними послідовностями. Наприклад, нуклеїнокислотна послідовність вважається подібною еталонній послідовності, якщо імовірність найменшої суми у порівняльному аналізі є меншою, ніж приблизно 0,1, у кращому варіанті - меншою, ніж приблизно 0,01, а в найкращому варіанті - меншою, ніж приблизно 0,001. Фахівцям у даній галузі, цілком очевидно, відомі також інші методи та алгоритми порівняльного аналізу послідовностей та аналізу подібності послідовностей. Для фахівця цілком зрозуміло також, що в тих випадках, коли вставлена полінуклеотидна послідовність транскрибується і транслюється для створення функціонального поліпептиду, деяка кількість полінуклеотидних послідовностей буде внаслідок виродженості кодону кодувати однаковий поліпептид. Ці варіанти специфічно передбачені термінами "ген росту і/або розвитку" і "трансген росту і/або розвитку", і зокрема термінами "REVOLUTA-ген" і "REVOLUTA-трансген". Крім того, значеннями цих термінів специфічно охоплюються ті послідовності повної довжини, які є суттєво ідентичними послідовності гена і які кодують протеїн, що зберігає функцію цього генного продукту, наприклад, REVOLUTA. Дві нуклеїнокислотні послідовності або полінуклеотиди вважаються "ідентичними", якщо послідовності, відповідно, нуклеотидів або амінокислотних залишків у цих двох послідовностях є однаковими за результатами порівняльного аналізу на максимальну відповідність, як описано вище. Використовуваний у даному описі термін "комплементарний" означає, що дана комплементарна послідовність є ідентичною всій або частині еталонної полінуклеотидної послідовності. Варіації та зміни в амінокислотній послідовності гена, асоційованого з ростом і/або розвитком, і протеїну, асоційованого з ростом і/або розвитком, наприклад, послідовностей REVOLUTA-гена і REVOLUTA-протеїну описані у заявці (WO 01/33944), включеній тут шляхом посилання. Потрібний ген, наприклад REVOLUTA-ген, полінуклеотид або полінуклеотидна послідовність можуть бути відокремлені або приготовані із рослинного виду. В одному з варіантів здійснення даного винаходу, що тут розглядається, використовується послідовність REVOLUTA-гена із виду Arabidopsis thaliana, але це не виключає можливість використання REVOLUTA-гена із іншого потрібного виду. Наприклад, у заявці (WO 2004/063379), включеній тут в усій її повноті шляхом посилання, описані нуклеотидна послідовність та амінокислотна послідовність для REVOLUTA із кукурудзи (Zea mays). Терміни "біологічна активність", "біологічно активний", "активність", "активний", "біологічна функція", "біологічна активність REV" і "функціонально активний" стосуються здатності даного протеїну, наприклад, REVOLUTA протеїну димеризувати (або іншим чином збирати у білкові олігомери), або здатності модулювати чи іншим чином впливати на димеризацію нативного (наприклад, ендогенного) REVOLUTA-протеїну дикого типу. Проте, значеннями цих термінів охоплюється також здатність даного протеїну, наприклад REVOLUTA-протеїну, зв'язуватися і/або взаємодіяти з іншими молекулами, включаючи, наприклад, ДНК, які містять специфічні нуклеотидні послідовності на промоторних ділянках, розпізнаних даним протеїном, наприклад REVOLUTA-протеїном, де подіїзв'язування і/або взаємодії опосередковують ділення рослинних клітин і кінець кінцем дають певний фенотип, або ж здатність модулювати чи іншим чином впливати на зв'язування і/або взаємодію інших молекул з нативним протеїном дикого типу, де події зв'язування і/або взаємодії опосередковують ділення рослинних клітин і кінець кінцем дають певний фенотип, асоційований з даним геном. 9 UA 97632 C2 5 10 15 20 25 30 35 40 45 50 55 Термін REV-фенотип у контексті даного опису означає фенотип, наданий нуклеїновою кислотою або протеїном REV, та охоплює своїм значенням, зокрема, характеристику, котрою виражається розмір або кількість насіння. REV-фенотип визначається, як правило, шляхом вивчення рослини, що надмірно експресує REV під час специфічного ембріонального розвитку на ранній фазі, де кількість і розмір насіння даної рослини можуть порівнюватися з кількістю і розміром насіння у відповідних тканинах батьківської рослини або рослини дикого типу. Рослини, які демонструють REV-фенотип, мають статистично значущу зміну в кількості і/або розмірі насіння в межах репрезентативної кількості популяції рослини. Промотор, підходящий для того, щоб оперативно зв'язуватися з геном, асоційованим з ростом і/або розвитком рослини, та експресований за допомогою описаних тут способів згідно з винаходом, як правило, характеризується більшою експресією в ембріоні і меншою або відсутньою експресією в інших тканинах рослини. Особливо підходящими для цілей даного винаходу є ті промоторні послідовності, які ініціюють експресію під час специфічного ембріонального розвитку на ранній фазі. Специфічним для ранньої фази є промотор, що ініціює експресію певного протеїну в період до 7 дня після запилення (тростина) в Arabidopsis або на еквівалентній стадії у рослини іншого виду. Особливо підходящими промоторними послідовностями є в тому числі: промотори гена амінокислотної пермеази (ААР1), наприклад, ААР1 промотор виду Arabidopsis thaliana (Hirner et al., Plant J. 14:535-544, 1998): промотор для олеат 12-гідроксилаза:десатуразного гена, наприклад, промотор під назвою LFAH12 із Lesquerella fendleri (Broun et al., Plant J. 13:201-210, 1998); промотор для 2S2-альбумінового гена, наприклад, 2S2-промотор виду Arabidopsis thaliana, (Guerche et al., Plant cell 2:469-478, 1990); промотор гена елонгази жирних кислот (FAE1), наприклад, FAE1 промотор виду Arabidopsis thaliana, (Rossak et al., Plant Mol. Biol. 46:717-715, 2001); і промотор гена листової сім'ядолі (LEC2), наприклад, LЕС2-промотор виду Arabidopsis thaliana, (Kroj et al., Development 130:6065-6073, 2003). Підходящими для цілей даного винаходу специфічними промоторами ранньої фази ембріонального розвитку є також сім'яніжка (Pinyopich et al., Nature 424:85-88, 2003), Fbp7 і Fbpll (сім'яніжка петунії) (Colombo et al., Plant cell 9:703-715, 1997), Banyuls (Devic et al., Plant J. 19:387-398, 1999), agl-15 та agl-18 (Lehti-Shiu et al., Plant Mol. Biol. 58:89-107, 2005), Phe1 (Kohler et al., Genes Develop. 17:1540-1553, 2003), Per1 (Haslekas et al., Plant Mol. Biol. 36:833-845, 1998; Haslekas et al., Plant Mol. Biol. 53:313-326, 2003), emb175 (Gushing et al., Planta 221:424-436, 2005), L1I (Kwong et al., Plant cell 15:5-18, 2003), Lec1 (Lotan et al., Cell 93:11951205, 1998), Fusca3 (Kroj et al., Development 130:6065-6073, 2003), tt12 (Debeaujon et al., Plant cell 13:853-871, 2001), tt16 (Nesi et al., Plant cell 14:2463-2479, 2002), A-RZf (Zou and Taylor, Gene 196:291-295, 1997), TtG1 (Walker et al., Plant cell 11:1337-1350, 1999; Tsuchiya et al., Plant J. 37:73-81, 2004), Tt1 (Sagasser et al., Genes Dev. 16:138-149, 2002), TT8 (Nesi et al., Plant cell 12:1863-1878, 2000), Gea-8 (морква) (Lin and Zimmerman, J. Exp. Botany 50:1139-1147, 1999), Knox (рис) (Postma-Haarsma et al., Plant Mol. Biol 39:257-271, 1999), Oleosin (Plant et al., Plant Mol. Biol. 25:193-205, 1994; Keddie et al., Plant Mol. Biol. 24:327-340, 1994), ABB (Ng et al., Plant Mol. Biol. 54:25-38, 2004; Parcy et al., Plant cell 6:15674582, 1994) тощо. При здійсненні даного винаходу можуть застосовуватися промотори як із того ж виду, що і призначена для трансформування рослина, так і з іншого виду, що їй не відповідає. Крім того, промотор може бути із того ж виду, що і використовуваний REV-трансген, або із гетерологічного йому виду. Промотори для застосування у способах згідно з даним винаходом можуть також містити химерний промотор, котрий може являти собою комбінацію промоторів з профілем експресії, подібним тим, що були описані вище. В одному з варіантів здійснення даного винаходу, промотор ААР1-гена виду Arabidopsis thaliana був об'єднаний з REV-геном виду Arabidopsis thaliana і використовувався для конструювання трансгенного рапсу (Brassica napus). Крім того, в іншому варіанті здійснення винаходу промотор олеат 12гідроксилаза:десатуразного гена LFAH12 із виду Lesquerella fendleri був оперативно зв'язаний з REV-геном Arabidopsis thaliana і використовувався для конструювання трансгенного рапсу (Brassica napus). Усі вищезгадані трансгенні рослини демонстрували REV-фенотип, характерний для способів згідно з даним винаходом, при здійсненні яких відбувається надмірна експресія REV при ранньому ембріонального розвитку, внаслідок чого збільшуються розмір насіння і/або кількість насіння. Слід зауважити, що описані вище специфічні промотори ранньої фази ембріонального розвитку служать лише типовими прикладами промоторів, які можуть застосовуватися у способах згідно з даним винаходом. Методи ідентифікації та характеризації промоторної ділянки в рослинній геномній ДНК є добре відомими фахівцям у даній галузі й описані, наприклад, у роботах (Jordano et al., Plant cell 1:855-866,1989; Bustos et al., Plant cell 1:839-854, 10 UA 97632 C2 5 10 15 20 25 30 35 40 45 50 55 60 1989; Green et al., EMBO J. 7:4035-4044, 1988; Meier et al., Plant cell 3:309-316, 1991; Zhang et al., Plant Physiol. 110:1069-1079, 1996). Трансгенні рослини, які надмірно експресують REV на ранній фазі ембріонального розвитку можуть отримуватися, наприклад, шляхом перенесення трансгенних векторів (наприклад, плазмід, вірусів і т. п), що кодують специфічний промотор ранньої фази ембріонального розвитку, оперативно зв'язаний з геном, що кодує REVOLUTA в рослину. Як правило, коли вектором є плазміда, вектор включає у себе також маркерний ген, який піддається селекції і яким може бути, наприклад, канаміциновий ген, що кодує стійкість до канаміцину. Найбільш загальний метод трансформації рослин здійснюється шляхом клонування цільового трансгена у вектор трансформації рослин, який далі трансформується в Agrobacterium tumifaciens, що містить допоміжну Ті-плазміду-хелпер, як описано в роботі (Hoeckeme et al., Nature 303:179-181, 1983). Інші підходящі для цього методи описані, наприклад, в публікації (Maloney et al., Plant cell Reports 8:238, 1989). Клітини Agrobacterium, які містять трансгенний вектор, можна інкубувати зі зрізами листя рослини, котра піддається трансформуванню, як описано в роботах (An et al., Plant Physiol. 81:301-305, 1986; Hooykaas, Plant Mol. Biol. 13:327-336, 1989). Трансформацію культивованих рослинних клітин-хазяїнів здійснюють зазвичай на Agrobacterium tumifaciens, як описано вище. Культури клітин-хазяїнів, які не мають жорстких мембранних бар'єрів, зазвичай трансформуються за допомогою методу фосфату кальцію, вперше описаного Грамом у роботі (Graham et al., Virology 52:546, 1978), і модифікують так, як описано в лабораторному підручнику Сембрука з молекулярного клонування (Sambrook et al., Molecular Cloning: A Laboratory Manual nd (2 Ed., 1989 Cold Spring Harbor Laboratory Press, New York, NY ). Проте, вводити ДНК в клітини можна також іншими методами, наприклад, полібрену (Kawai et al., Mol. Cell Biol. 4:1172, 1984), злиття протопластів (Schaffher, Proc. Natl. Acad. Sci. USA 77:2163, 1980), електропорації (Neumann et al., EMBOJ. 1:841, 1982) та прямої мікроін'єкції в ядра (Capecchi, Cell 22:479,1980). Калюси трансформованої рослини відбирають за допомогою маркера селекції шляхом вирощування клітин на середовищі, що містить, наприклад, канаміцин і відповідні кількості фітогормону, такого як нафталіноцтова кислота і бензальденін для калюсу і стимуляції проростання. Після цього рослинні клітини регенерують і створені в результаті рослини переносять у ґрунт, відповідно до процедур, добре відомих фахівцям у даній галузі. Окрім методів, описаних вище, відомо чимало інших методів перенесення клонованої ДНК у різноманітні види рослин і, в тому числі, в голонасінні, покритонасінні, однодольні і дводольні, див., наприклад, (Click and Thompson, eds., Methods in Plant Molecular Biology and Biotechnology, CRC Press, Boca Raton, Florida, 1993; Vasil, Plant Mol Biol. 25:925-937, 1994; and Komai et al., Current Opinions Plant Biol. 1:161-165, 1998 (загальний огляд); Loopstra et al., Plant Mol. Biol. 15:19, 1990; and Brasileiro et al., Plant Mol. Biol. 17:441-452, 1990 (трансформація дерев); Eimertef al., Plant Mol. Biol. 19:485-490, 1992 (трансформація капусти); Hiei et al., Plant J. 6:271-282, 1994; Hiei et al., Plant Mol. Biol. 35:205-218, 1997; Chan et al., Plant Mol. Biol. 22:491-506, 1993; U.S. Patent №№ 5,516,668 і 5,824,857 (трансформація рису); і U.S. Patent №№ 5,955,362 (трансформація пшениці); 5,969,213 (трансформація однодольних рослин); 5,780,798 (трансформація жита); 5,959,179 і 5,914,451 (трансформація сої). Типовими прикладами цих методів є полегшене електропорацією поглинання ДНК протопластами (Rhodes et al., Science 240:204-207, 1988; Bates, Meth. Mol. Biol. 111:359-366, 1999; D'Halluin et al., Meth. Mol. Biol. 111:367-373, 1999; U.S. Patent № 5,914,451); обробка протопластів поліетиленгліколем (Lyznik et al., Plant Mol. Biol. 13:151-161, 1989; Datta et al., Meth. Mol. Biol. 111:335-334, 1999); і бомбардування клітин мікрокулями, зарядженими ДНК (Klein et al., Plant Physiol. 91:440-444,1989; Boynton et al., Science 240:1534-1538, 1988; Register et al., Plant Mol. Biol. 25:951-961, 1994; Barcelo et al., Plant J. 5:583-592, 1994; Vasil et al., Meth. Mol. Biol. 111:349-358, 1999; Chhstou, Plant Mol. Biol. 35:197203, 1997; Finer et al., Curr. Top. Microbiol. Immunol. 240:59-80, 1999). Крім того, в роботах (Birch, Ann. Rev. Plant Phys. Plant Mol. Biol. 48:297, 1997; Forester et al., Exp. Agric. 33:15-33, 1997) можна ознайомитися з оглядами щодо стратегії і техніки трансформації рослин. Шляхом невеликих варіацій ці методи можна пристосовувати до широкого діапазону видів рослин. Для трансформації однодольних рослин зазвичай застосовують метод бомбардування частками. Але такі однодольні, як кукурудза, можна трансформувати також методами із застосуванням Agrobacterium, як описано в (Патент США № 5,591,616). В іншому відомому методі трансформації однодольних рослин, наприклад жита, змішують клітини із ембріогенних суспензійних культур із суспензією волокон (5% мас./об., силарових волокон Silar SC-9) і плазмідною ДНК (1 мкг/мкл), і суміш поміщають у вертикальному положенні у багатозразковий тримач вихрового змішувача Vortex GENIE II (фірми Scientific Industries, Inc., Bohemia, НьюЙорк, США) або в горизонтальному положенні у тримачу міксера МІХОМАТ зуболікарської амальгами (Degussa Canada Ltd., Burlington, Ontario, Canada). Далі трансформацію здійснюють 11 UA 97632 C2 5 10 15 20 25 30 35 40 45 50 55 60 шляхом змішування на повній швидкості впродовж приблизно 60 секунд (наприклад, у змішувачу Vortex GENIE II) або шляхом струшування на фіксованій швидкості впродовж 1 секунди (МІХОМАТ). У результаті цього процесу продукуються популяції клітин, із котрих вибирають стабільні трансформанти. Із отриманих таким чином стабільно трансформованих калюсів регенеруються рослини, які у своєму потомстві дають трансгени, наявність котрих може підтверджуватися шляхом аналізу методом саузерн-гібридизації. Головними перевагами цього підходу є його простота і низька вартість. На відміну від бомбардування частками, він не потребує застосування коштовного обладнання і матеріалів. Використання волокон у трансформації рослинних клітин і, зокрема, кукурудзи описано, наприклад, у (Патент США № 5,464,765). У (Патент США 5,968,830) описані методи трансформування і регенерування сої. У (Патент США 5,969,215) описані методи трансформації для продукування трансформованих рослин Beta vulgaris, таких як цукровий буряк. Усі вищезгадані методи трансформації мають кожний свої переваги і недоліки. В усіх них ДНК із плазміди генетично реконструюють таким чином, щоб вона містила не тільки потрібний ген, але також маркерні гени, що піддаються селекції та скринінгу. Селективний маркерний ген використовується для селективного відбору тільки тих клітин, які мають інтегровані копії даної плазміда (при цьому конструкція є такою, що потрібний ген і гени, що піддаються селекції та скринінгу, трансформуються єдиним блоком). Ген, що піддається скринінгу, дозволяє проводити інший контроль на успішність культивування тільки тих клітин, які несуть потрібні гени. Традиційна трансформація з використанням Agrobacterium і селективних маркерів стійкості до антибіотиків може бути небажаною через загальний публічний спротив щодо рослин, які асоціюються з надмірним ризиком поширення толерантності до антибіотиків на тварин і людей. Такі антибіотичні маркери можуть усуватися із рослин шляхом трансформування останніх за допомогою методів з використанням Agrobacterium, подібних описаним у (Патент США 5,731,179). Резистентності до антибіотиків можна ефективно уникати також шляхом застосування bar- або pat-кодуючих послідовностей на зразок описаних у (Патент США № 5,712,135). Такого типу маркерні ДНК кодують другі протеїни або поліпептиди, які інгібують або нейтралізують дію гербіцидів-інгібіторів глутамінсинтетази -фосфінотрицину (глуфозинату) і глуфозинатамонійної солі (Basta, Ignite). Плазміду, що містить принаймні один такий ген, за допомогою будь-якого із вищезгаданих методів уводять в рослинні протопласти або клітини калюсів. При цьому якщо маркерним геном є селективний ген, то в умовах селекції відповідним фітотоксичним агентом виживають лише ті клітини, які мають вбудований ДНК-пакет. Після того, як відповідні клітини ідентифіковані і розмножені, рослини регенерують. Потомство від цих трансформованих рослин повинно проходити тестування на підтвердження того, що ДНК-пакет був успішно інтегрований у геном рослини. На успішність трансформації можуть впливати численні фактори. Проектування і конструювання екзогенного гена та його регуляторні елементи впливають на інтеграцію екзогенної послідовності у хромосомну ДНК ядра рослини і на здатність трансгена експресуватися цією клітиною. Важливим є вибір підходящого методу введення конструкції екзогенного гена в клітинне ядро рослини, який би не призводив до летального кінця. Важливо також, щоб клітина, в котру вводиться дана конструкція, якщо відновлюватися повинна цілком уся рослина, належала до типу, придатного до регенерації за відповідною методикою. Для ініціації стадій клонування згідно з винаходом як клітини-хазяїни можуть використовуватися також прокаріоти. Методи, вектори, плазміди і клітини-хазяїни, підходящі для застосування на таких стадіях початкового клонування та експансії, є добре відомими фахівцям у даній галузі і тому не потребують їх детального розгляду. В іншому варіанті здійснення даного винаходу специфічний промотор ранньої фази ембріонального розвитку вставляють таким чином, щоб він був оперативно зв'язаним з геном, який кодує ген, асоційований з ростом і/або розвитком рослини, наприклад REV-ген, в рослині, котру трансформують за допомогою методів, добре відомих фахівцям у даній галузі. Така вставка промотору дозволить здійснювати ранню ембріональну експресію цього гена, наприклад REV, у розвитку насіння трансгенної рослини. Трансгенними рослинами, цікавими з погляду застосування способів згідно з даним винаходом, є однодольні і дводольні рослини, зокрема, сімейств Brassicacea (Cruciferae), Gramineae, Malvaceae i Leguminosae-Papilionoideae. Серед рослин-членів цих сімейств, особливо цікавих для цілей даного винаходу, є рапс, жито, камелія, бавовна, пшениця, рис, соя, ячмінь та інші насіннєві рослини, а також рослини іншого виробничого профілю, включаючи, наприклад, люцерну тощо, які в одному з варіантів здійснення даного винаходу містять RЕV 12 UA 97632 C2 5 10 15 20 25 30 35 40 45 50 55 60 трансген, що перебуває під керуванням специфічного промотору ранньої фази ембріонального розвитку. Цей трансген може бути із того ж виду, що і дана трансгенна рослина, або із гетерологічної йому рослини. Особливо цікавою в цьому зв'язку є трансгенна рослина, яка містить REV-трансген із виду Arabidopsis. Специфічний промотор ранньої фази ембріонального розвитку може також бути того ж виду, що і трансгенна рослина, або із гетерологічної рослини. Наприклад, специфічний промотор ранньої фази ембріонального розвитку може походити із того ж рослинного виду, що і REV-трансген, або навіть із іншого виду рослин. Особливу цікавість являють собою специфічні промотори ранньої фази ембріонального розвитку із видів Arabidopsis і Lesquerella fendleri, але специфічний для ранньої фази промотор може бути отриманий із іншого виду рослин. Серед специфічних комбінацій специфічного для ранньої фази промотору і REV-трансгена, які показали себе підходящими для застосування у способах згідно з даним винаходом, можна назвати, наприклад, такі: (a) LFAH12 промотор із Lesquerella fendleri/REV-ген із Arabidopsis; (b) AAP1 промотор із Arabidopsis/REV-ген із Arabidopsis; (c) LEC2 промотор із Arabidopsis/REV із Arabidopsis; (d) 2S2 промотор із Arabidopsis/REV із Arabidopsis. В одному з варіантів здійснення даного винаходу ці трансгенні конструкції використовувалися у трансформуванні рапсу і можуть застосовуватися для трансформування інших рослинних видів. Зокрема, вони можуть застосовуватися для одержання трансгенних рослин, які мають збільшений розмір насіння і/або збільшену кількість насіння сої, жита, бавовни, камелії, рису, пшениці, ячменю, люцерни та інших сільськогосподарських культур. Винаходом пропонуються також способи селекції асоційованого з ростом і/або розвитком гена, який збільшує врожайність рослини. Згідно з цими способами потрібний ген функціонально зв'язується зі специфічним промотором ранньої фази ембріонального розвитку у плазміді або векторі експресії. Плазміду або вектор експресії, що містить потрібний ген, трансфектують у рослинну клітину за допомогою відомого методу, в результаті чого утворюється трансгенна клітина. Клітину, яка містить даний трансген, вирощують і регенерують на трансгенну рослину за допомогою відомих методів, включаючи ті, що описані вище, доти, поки не будуть одержані трансгенні рослини. Отримані трансгенні рослини випробують на збільшену врожайність у порівнянні з рослиною дикого типу, і ті асоційовані з ростом і/або розвитком гени, які використовувалися для одержання трансгенних рослин з підвищеною врожайністю, відбирають для подальших розробок. Трансгенні рослини, які містять селектований ген, асоційований з ростом і/або розвитком рослини, можуть розроблятися далі з метою одержання рослин сільськогосподарської значущості, врожайність яких є вищою, ніж у рослин дикого типу. Нижче наведені приклади здійснення даного винаходу, які ілюструють його різноманітні аспекти і не повинні розглядатися як такі, що тим чи іншим чином даний винахід обмежують. Приклади У наведених нижче прикладах описане конструювання різноманітних векторів експресії, які містять специфічний промотор ранньої фази ембріонального розвитку і ген, що бере участь у рості і/або розвитку рослини. Зокрема, ембріонально-специфічні промотори (a) LFAH12 із Lesquerella fendleri; (b) AAP1 із Arabidopsis; (c) LEC2 із Arabidopsis; (d) 2S2 із Arabidopsis і (e) FAE1 із Arabidopsis оперативно зв'язувалися з геном REVOLUTA (REV) із виду Arabidopsis і використовувалися для виготовлення трансгенних рослин рапсу. Приклад 1. Трансгенні рослини рапсу, що експресують трансгенні конструкції, спроектровані для здійснення ембріонально-специфічної експресії гена REVOLUTA. Конститутивна надмірна експресія REV гена із виду Arabidopsis у трансгенних рослинах Arabidopsis має результатом збільшений розмір насіння відносно нетрансгенних рослин Arabidopsis дикого типу. Але надання цієї властивості супроводжується негативними плейотропними ефектами. Цими ефектами є, зокрема, зміна морфології листя і знижене утворення пазушних бруньок в Arabidopsis. Зміна морфології листя і загальний зменшений ріст рослин є тими негативними ефектами, що спостерігаються в трансгенному рапсі, який надмірно експресує REV-гени з високими конститутивними рівнями по всій рослині. Для одержання насіння збільшеного розміру й уникнення при цьому небажаних побічних ефектів у відмінних від насіннєвих тканинах, надмірна експресія RЕV-трансгена повинна бути специфічним чином спрямована на ембріональний розвиток у насіння. Така стратегія може здійснюватися за допомогою конструкції експресії трансгена, в котрій ембріонально-специфічний промотор ініціює експресію REV-гена. Конститутивна надмірна експресія інших рослинних генів, які подібно REVгену залучаються до процесів розвитку і росту рослини, може при цьому також мати місце і, очевидно, супроводжуватися негативними плейотропними ефектами у трансгенній рослині. Загальним методом оцінки ефективності таких генів у підвищенні врожайності рослини є використання ембріонально-специфічних промоторів, за допомогою яких гени, котрі беруть 13 UA 97632 C2 5 участь у розвитку і рості рослини можуть оцінюватися на їхню потенційну можливість служити генами підвищення її врожайності. Для використання в конструкціях експресії, призначених для здійснення трансгенної експресії REV-гена в ембріонах рапсу (Brassica napus) під час раннього ембріонального розвитку, було відібрано п'ять промоторів, які ініціюють ембріонально-специфічну експресію. Ними стали такі промотори: ААР1 (ген амінокислотної пермеази із Arabidopsis thaliana) (Hirner et al., Plant J. 14:535-544, 1998) 10 LFAH12 (олеат 12-гідроксилаза:десатуразний ген із Lesquerella fendlen) (Broun et al., Plant J. 13:201-210, 1998) 15 14 UA 97632 C2 5 2S2 (2S2 альбуміновий ген із Arabidopsis thaliana) (Guerche et al., Plant Cell 2:469-478, 1990), FAE1 (ген елонгази жирних кислот із Arabidopsis thaliana) (Rossak et al., Plant Mol. Biol. 46:717725, 2001) і LEC2 (ген листової сім'ядолі із Arabidopsis thaliana) (Kroj et al., Development 130:6065-6073, 2003) 15 UA 97632 C2 5 10 15 Усі п'ять промоторів дають ранню ембріональну експресію в Arabidopsis. Профілі експресії цих п'яти промоторів під час раннього ембріонального розвитку схематично представлені на Фіг. 1. Промотори ААР1, LFAH12, 2S2 і FAE1 на найбільш ранній стадії ембріонального розвитку є бездіяльними. Їхня транскрипційна активність з'являється на більш пізніх стадіях ембріонального розвитку спочатку у промотору ААР1 і далі послідовно у LFAH12, 2S2 і FAE1. Після цього усі чотири промотори залишаються активними на всіх подальших стадіях ембріонального розвитку. Промотор LEC2 має інверсний профіль експресії, є активним на дуже ранньому ембріональному розвитку, а потім з переходом до більш пізніх стадій свою активність поступово знижує. Досліджувалися комбінації промоторів ААР1, LFAH 12, 2S2, FAE1 і LEC2 з обома конфігураціями послідовностей кодувальної ділянки REV у конструкції REV-трансгенної експресії. Промотори ААР1, LFAH12, 2S2, FAE1 і LEC2 комбінувалися з кодувальною послідовністю REV-гена, включаючи всі наявні в REV-гені інтрони. Промотори ААР1 і LFAH12 комбінувалися також з послідовністю кодувальної ділянки REV-гена, виведеної із кДНК REVгена, яка не містила інтронів. кДНК REV-гена рослини Arabidopsis thaliana (AtRev) 16 UA 97632 C2 17 UA 97632 C2 5 10 15 20 25 30 35 40 45 REV-Трансгенні конструкції LFAH12-At REV-ген-rev 3' UTR Ділянку із 2170 пар нуклеотидів (п.н.) промотору LFAH12 ампліфікували із геномної ДНК Lesquerella fendleri праймерами EcoRI-LFAH12 (GAATTCTCAGGAAGATTAAGTCTTTGCTTG; SEQ ID NO: 14) і Sacl-LFAH12 (GAGCTCGCTGAAAATATCAAAAGAAGGAACA; SEQ ID NO: 15). Ці праймери починалися 24 нуклеотидами і 15 нуклеотидами, відповідно, від 5' і 3' кінців опублікованої послідовності LFAH12 ((позначення AF016103.1 або Gl:3452128 у Генбанку GenBank) (Broun et al., Plant J. 13:201 -210 (1998)). Було клоновано у pCR-Blunt (Invitrogen) і секвеновано кілька незалежних полімеразно-ланцюгових (PCR) реакцій. Послідовності всіх них були ідентичними одна одній (SEQ ID NO: 12) і на 97% ідентичними опублікованій послідовності LFAH12. Ці різниці могли бути зумовлені специфічним доступом L. fendleri, використовуваним для відновлення цього промотору. LFAH12 переносили у плазміду pBluescript II вектором EcoRI, а орієнтація цього промотору у pBluescript-плазміді була Kрnl на 5'-стороні промотору і Spel на 3'-стороні промотору (pTG143). Касету At REV-ген-rev 3' UTR відбирали у формі фрагмента Spel-Kрnl із pTG95 (35S-At REV-ген-rev 3'UTR у pCGN1547, патент WO 01/33944A1) і разом з промотором LFAH12 (фрагмент Kрnl-Spel із pTG143) лігували у бінарний вектор pCGN1547 (McBride et al., Plant Mol. Biol. 14:269-276, 1990), який зрізали з сайтом Kрnl у літуванні трьома шляхами, створюючи LFAH12-промотор-At REV-ген-rev 3' UTR з орієнтацією «хвіст у хвіст» з рослинною касетою експресії NPTII. ΑΑΡ1-At REV-ген-rev 3' UTR Ділянку із 809 пар нуклеотидів (п. н.) ΑΑΡ1-промотору ампліфікували із геномної ДНК Arabidopsis thaliana (екотип Колумбія) праймерами EcoRI-AAP1 (GAATTCGGTTGCATCTTTGAATACCTTTTT; SEQ ID NO: 16) і Sacl-AAP1 (GAGCTCTGAGAGAAAGAGAAAGAGAGAACAA; SEQ ID NO: 17). Прамер Sacl-AAP1 починався 6 нуклеотидами від 3'-кінця опублікованої послідовності ААР1 (позначення депозитів Х95622.1; GI: 1566687 у Генбанку GenBank) (Hirner et al., Plant J. 14:535-544, 1998). Послідовності всіх продуктів PCR-реакції були ідентичними одна одній, на 98% ідентичними опублікованій послідовності ААР1 екотип у С24, і на 100% ідентичними анотованій послідовності ААР1 екотипу Со1 (позначення АС008051.3; GI:7462019 у Генбанку GenBank) (SEQ ID NO: 11). AAP1 переносили у плазміду pBluescript вектором EcoRl, а орієнтація цього промотору у pBluescript була Kрnl на 5'-стороні промотору і Spel на 3'-стороні промотору (pTG145). Касету At REV-генrev 3' UTR відбирали у формі фрагмента Spel-Kрnl із pTG95 (35S-At REV-ген-rev 3' UTR у pCGN1547, див. WO 01/33944А1) і разом з промотором ААР1 (фрагмент Kpnl-Spel із pTG145) лігували у бінарний вектор pCGN1547 (McBride et al., Plant Mol. Biol. 14:269-276, 1990), який зрізали з сайтом Kрnl у лігуванні трьома шляхами, створюючи ААР1-промотор-At REV ген-rev 3' UTR з орієнтацією «голова у хвіст» з рослинною касетою експресії NPTII. LFAH12-кДНК At REV-гена-rev 3' UTR Проводилася ампліфікація кДНК At REV-гена із кДНК, синтезованої із повної РНК, виділеної із листя Arabidopsis екотипу Колумбія. Використовувані праймери вбудовували NсоІ-сайт на ATG і BamНІ-сайт після стоп-кодону: Ncol-ATG rev CCATGGAGATGGCGGTGGC TAAC (SEQ ID NO: 18) і BamHI-TGA rev GGATCCTCACACAAAAGACCAGTTTAC AAAGGA (SEQ ID NO: 19). Утворюваний у результаті PCR-продукт сДНК At REV-гена клонували у плазміду pCR-Blunt і піддавали секвенуванню (pTG230). Використовуючи pTG95 як матрицю, Rev 3' UTR ампліфікували праймерами, які вбудовували EcoRV-сайт на 5'-кінці і Notl/Kрnl на 3'-кінці: EcoRV revUTR GATATCTTCGATTGACAGAAAAAG (SEQ ID NO: 20) і Not/Kpn revUTR 18 UA 97632 C2 5 10 15 20 25 30 35 40 45 50 55 60 GCGGCCGCGGTACCCTCAACCAACCACATGGAACCA (SEQ ID NO: 21). Утворюваний у результаті At Rev 3' UTR клонували у плазміду pCR-Blunt і піддавали секвенуванню. Rev 3' UTR переносили у плазміду pBluescript сайтами EcoRV і Notl (pTG234). Після цього Rev 3' UTR відбирали із pTG234 і лігували у pTG230 з сайтами EcoRV і Notl (pTG239). Касету At REV сДНКrev 3'UTR відбирали у формі фрагмента Spel-Kрnl із pTG239 і разом з LFAH12-промотором (Kрnl-Spel фрагментом із pTG143) лігували у pCGN1547 бінарний вектор трьома шляхами, створюючи LFAH12-At REVcДHK-TQV 3'UTR з орієнтацією «голова у хвіст» з рослинною касетою експресії NPTII (pTG241). ААР1-кДНК At REV-генa-rev 3'UTR Касету кДНК At REV-генa-rev 3'UTR відбирали у формі Spel-Kpnl фрагмента із pTG239 і разом з ААР1-промотором (KpnI-SpeI фрагмент із pTG145) лігували у pCGN1547 бінарний вектор трьома шляхами, створюючи в результаті AAР1-кДНК At REV-генa-rev 3'UTR з орієнтацією «голова у хвіст» з рослинною касетою експресії NPTII (pTG242). FAE1-At REV ген-rev 3'UTR Промотор FAE1 завдовжки 933 п. н. ампліфікували із CD-вектора з сайтами Kрnl і Spel, клонували у плазміду pCR-Blunt, і піддавали секвенуванню (pTG238). Після цього FAE1промотор переносили у плазміду pBluescript вектором EcoRl (pTG243). Касету At REV-ген-rev 3' UTR відбирали у формі фрагмента SpeI-KpnI із плазміди pTG95 і разом з FAE1-промотором (Kpnl-Spel фрагмент із pTG243) лігували у бінарний вектор pCGN1547 (McBride et al., Plant Mol. Biol. 14:269-276, 1990), який зрізали з сайтом Kрnl у лігуванні трьома шляхами, створюючи в результаті FAE1 промотор-At REV ген-rev 3'UTR з орієнтацією «голова у хвіст» з рослинною касетою експресії NPTII (pTG248). 2S2-At REV-ген-rev3'UTR Із CD плазміди р4163 (фрагмент 2S2- At REV Swal) вирізали промотор 2S2 завдовжки 1379 п. н. і лігували його у плазміду pBluescript на сайті EcoRV. Даний промотор у плазміді pBluescript мав таку орієнтацію: Kрnl на його 5'-стороні і BamНІ на його 3'-стороні (pTG251). Касету At REVген-rev3'UTR відбирали у формі фрагмента BamНl-Kрnl із pTG138(35S-At REV-ген-rev3'UTR у ТОРО) і разом з 252-промотором (фрагмент Kрnl-BamНl із плазміди pTG251) лігували у бінарний вектор pCGN1547 (McBride et al., Plant Mol. Biol. 14:269-276, 1990), який зрізали з сайтом Kрnl у лігуванні трьома шляхами, створюючи в результаті 2S2 промотор-At REV-генrev3'UTR з орієнтацією «голова у хвіст» з рослинною касетою експресії NPTII. LEC2-At REV-ген-rev3'UTR Із CD-плазміди р5217 вирізали LЕС2-промотор завдовжки 1256 п. н. із сайтами Араl і Pstl і клонували у плазміду pBluescript на тих же сайтах (pTG252). Після цього промотор відбирали у формі фрагмента Kрnl-BamНl у плазміду pTG112 (At REV-ген у плазміді pCR-Blunt) і лінеаризували на тих же сайтах, отримуючи pTG280, тобто LEC2-At REV-ген у плазміді pCRBlunt. Використовуючи pTG234 як матрицю, Rev 3'UTR ампліфікували праймерами, які вбудовували Notl-сайт на 5' кінці і NotI/Kpnl на 3'-кінці: початок Not REV UTR GCGGCCGCTTCGATTGACAGAAAAAG (SEQ ID NO: 22) і NotKpn Rev UTR GCGGCCGCGGTACCCTCAACCAACCACATGGAACCA (SEQ ID NO: 23). Утворений At REV 3'UTR клонували у плазміду pCR-Blunt і піддавали секвенуванню (pTG281). Після цього Rev 3'UTR переносили у pTG280 за допомогою сайтів Notl і піддавали скринінгу за відповідною орієнтацією. У результаті утворювалася плазміда LEC2-At REV-ген-rev 3'UTR у плазміді pCRBlunt (pTG283). LEC2-At REV-ген-rev 3'UTR переносили як Kрnl у pCGN1547-плазміду, лінеаризовану сайтом Kрnl, і піддавали скринінгу за орієнтацією «голова у хвіст» з рослинною касетою експресії NPTII (pTG288). Трансформація рапсу (Brassica napus) Двогаплоїдний рапс сорту DH12075 трансформували конструкцією експресії REV-трансгена за допомогою методу Agrobacterium-опосередкованої трансформації, в основі якого лежав метод Мелоні, описаний у роботі (Maloney et al., Plant Cell Reports 8:238, 1989). Стерилізоване насіння пророщували на середовищах ½ MS (Murashige & Skoog) з 1% сахарози в 15 X 60 мм чашках Петрі протягом 5 днів з приблизно 40-60 насінин на чашку. Для кожної трансформаційної конструкції загальна кількість пророщуваного насіння складала приблизно 1500 насінин. Насіння не повністю занурювали у середовище для пророщування. Отримані паростки вирощували в камері для культивування тканин при температурі 25°С у циклі 16 годин світло/8 годин темрява. Сім'ядолі відрізали над самою верхівковою меристемою, не знімаючи зовсім меристемної тканини. Цю операцію виконували дуже обережно шляхом утримування двох черешків пінцетом над самою верхівковою ділянкою меристеми таким чином, щоби пінцетом не розчавити черешки. Використовуючи кінчики пінцета як напрямні, черешки зрізали скальпелем з гострим 19 UA 97632 C2 5 10 15 20 25 30 35 40 45 50 55 лезом № 12. Сім'ядолі викладали на чашку розмірами 15 мм X 100 мм з середовищем для спільної культивації. Правильно зрізані сім'ядолі легко відділялися. Якщо ж цього не відбувалося, то існувала висока імовірність того, що на них була меристематична тканина, і такі сім'ядолі у подальшому не використовувалися. До кожної чашки поміщали приблизно 20 сім'ядолей. Для уникнення в'янення, яке б негативно впливало на подальші стадії програми експерименту, сім'ядольні експланти партіями по декілька приготованих чашок інокулювали Agrobacterium. Трансформаційні REV-конструкції методом електропорації вводили в Agrobacterium tumefaciens. Agrobacterium, що ховали трансформаційну REV-конструкцію, вирощувалися в АВ середовищі з відповідними антибіотиками в умовах струшування протягом двох днів при температурі 28°С. Для інокулювання сім'ядольних експлантів до 10 мм x 35 мм чашки Петрі додавали невеликий об'єм культури Agrobacterium. У цю Agrobacterium-культуру занурювали черешок кожного експланта, а зрізаний кінець поміщали у середовище для спільного культивування у чашці Петрі. Чашки герметично закривали і поміщали в камеру для тканинних культур, де їх витримували при температурі 25°С у циклі 16 годин світло/8 годин темрява впродовж 3 днів. За 3 дні експланти партіями по десять штук переносили у свіжі 25 мм x 100 мм чашки Петрі із середовищем для стимуляції проростання. Це середовище містило агент селекції (20 мг/л канаміцину) і гормон (4,5 мг/л brassino-стероїду (ВА)). При цьому переносили лише здорові на вигляд експланти. На середовищі для стимуляції проростання експланти витримувалися протягом часу від 14 до 21 днів. У цей час можна було спостерігати зелені калюси і навіть певний розвиток паростків, а також деякі нетрансформовані паростки. Нетрансформовані легко розпізнавалися за їхнім біло-фіолетовим кольором. Паростки, чутливі до канаміцину, видалялися шляхом їх відрізання, а всі здорові на вигляд калюси переносили у свіжі чашки із середовищем для стимуляції проростання. У цих чашках експланти витримувалися ще протягом часу від 14 до 21 днів. За 2-3 тижні паростки, що мали темно-зелений колір, переносили у чашки, які містили середовище для подовження паростків. Це середовище містило агент селекції (20 мг/л канаміцину), але не містило гормонів. До кожної чашки перемістили по п'ять паростків. Чашки герметично закривали і повертали до камери для культивування тканин. Трансформовані паростки, що мали скловидний вигляд, переносили у середовище для подовження паростків, яке містило флороглюцин (150 мг/л). Паростки, які мали здоровий зовнішній вигляд і зелений колір, поверталися до чашок із середовищем для подовження паростків. У деяких випадках для одержання паростків з нормальним виглядом потребувалося повторне перенесення скловидних паростків до чашок з таким самим середовищем. Паростки з нормальною морфологією переносили до банок для дитячого харчування ємністю 4 унції із середовищем для проростання, яке містило 0,5 мг/л індолмасляної кислоти. При перенесенні паростків до цих банок усі надлишкові калюси зрізали. Паростки можна було витримувати в банках необмежено довго, переносячи їх приблизно кожні 6 тижнів до свіжих банок, що містили 0,2 мг/л індолмасляної кислоти. Як тільки утворювалася задовільна система паростків, паростки покоління Т 0 із банок видобували, з паростків видаляла агар, і отримані в результаті сіянці переносили у горщечковий ґрунт. Кожний сіянець Т0 являв собою незалежний епізод уведення трансгена в геном рапсу та іменувався "подією". Над кожним сіянцем установлювали прозорий ковпак, під яким його витримували кілька днів для акліматизації рослини в новому навколишньому середовищі. Коли рослина міцнішала, ковпак видаляли. Після цього трансгенні події Т 0 вирощували до стану зрілості в теплиці і збирали з них насіння T 1. Аналіз характеристик подій Т0 Шляхом аналізу методом саузерн-блоту в кожній події визначали кількість локусів сайтів трансгенних вставок. Експресію REV-трансгена в події Т0 перевіряли шляхом аналізу методом нозерн-блоту та методом RT-PCR-реакції в кінцевій точці. Дані стосовно REV-експресії отримувалися для однієї точки часу в період ембріонального розвитку - на 19 день після запилення (DAP: days after pollination). За отриманими даними був зроблений висновок, що в цій точці періоду ембріонального розвитку альбумінові промотори LFAH12 і 2S2 стимулювали вищі рівні продукування РНК REV, ніж ААР1-промотор. Конструкції 2S2/REV у багатьох подіях давали від помірних до високих рівні експресії. Отримані дані з експресії показали, що всі п'ять промоторів виконували свої функції стимулювання трансгенної експресії REV у трансгенних рослинах рапсу. 20 UA 97632 C2 5 10 15 20 25 30 35 40 45 50 55 60 Рослини Т0 успішно генерувалися всіма сімома REV-трансгенними конструкціями, які були піддані випробуванням, тобто: (а) AAP1/REV-ген; (b) ААР1/кДНК REV; (с) LFAH12/REV-ген; (d) LFAH12/кДНК REV; (e) 2S2/REV-ген; (f) FAE1/REV-ген; (g) LEC2/REV-ген. Приклад 2. Оцінка впливу трансгенної експресії REV під час ембріонального розвитку на врожайність рапсу у багатократних польових дослідах. У даному прикладі описані польові досліди, в котрих піддавалися випробуванням трансгенні рослини рапсу, які містили REV-трансген рослини Arabidopsis, що стимулювався різноманітними ембріонально-специфічними промоторами. Подальший розвиток трансгенних REV-подій у польових дослідах Для участі в польових дослідах події Т 0 добиралися за об'єднаним критерієм - трансгенною експресією і кількістю локусів трансгенних вставок. Подіям з перевіреною трансгенною експресією й одним локусом трансгенної вставки віддавався найвищий пріоритет у перенесенні піддослідного матеріалу для випробувань у польових умовах. У деяких випадках, коли наявність множини генів давала високий загальний рівень трансгенної експресії завдяки генній дозі, відбиралися події з множиною локусів трансгенних вставок. Насіння Т1 від вибраних подій Т0 вирощували на польових ділянках сегрегативними популяціями Т1. Кожну подію висаджували двома рядками в кількості двадцять чотири рослини на ділянку. У подій з одним локусом трансгенної вставки сегрегація трансгена поміж двадцяти чотирьох рослин Т1 приводить до розподілу на приблизно шість нульових рослин без трансгена, дванадцять гетерозиготних рослин і шість гомозиготних рослин. Перед цвітінням кожну Т1рослину укривали мішечком для запобігання ауткросингу. Насіння Т 2 від кожної із двадцяти чотирьох рослин Т1 збирали окремо. Насіннєві продукти Т2 використовували для встановлення того, які із двадцяти чотирьох батьківських рослин Т1 були нульовими, гетерозиготними і які гомозиготними. Близько тридцяти насінин Т2 від кожної рослини Т1 пророщувалися на фільтрувальному папері в чашках Петрі з розчином, що містив антибіотик G418, аналог канаміцину. Оскільки рослини трансформувалися разом з nptll-геном стійкості, що служив маркером селекції, проростало і росло далі лише те насіння, яке несло в собі цей трансген. Якщо все насіння на чашці виявлялося чутливим до G418, то його батьківська рослина Т1 визнавалася такою, що належала до нульової лінії. Якщо насіння на чашці було стійким до G418, то його батьківська рослина Т1 визнавалася такою, що належала до гомозиготної лінії. Якщо ж приблизно одна четверта частина насіння на чашці була чутливою, а решта - стійкою до цього антибіотика, то його батьківська рослина Т1 визнавалася такою, що належала до гетерозиготної лінії. Насіння Т 2 від гомозиготних рослин Т1 із однієї і тієї ж трансформаційної події зсипали разом для створення банку гомозиготного насіння для дослідів з апробації на полі. Насіння Т 2 від нульових рослин Т1 із однієї і тієї ж трансформаційної події зсипали разом для створення банку насіння нульових сиблінгів для дослідів з апробації на полі. Схема польових дослідів Випробування із застосуванням ембріонально-специфічних промоторів для оцінки потенційних можливостей REV-трансгена у збільшенні врожайності проводили на лініях трансгенного рапсу шляхом порівняння кожної трансгенної лінії безпосередньо з її нульовим сиблінгом у польових великомасштабних дослідах. Оскільки нульовий сиблінг виникає із сегрегації трансгена у поколінні Т 1, нульовий і гомозиготний сиблінги мають між собою близьку генетичну ідентичність. Єдиною суттєвою відмінністю між ними є наявність або відсутність у них REV-трансгена. Така висока ідентичність робить нульовий сиблінг оптимальним контрольним зразком в оцінці ефекту REV-трансгена. Оскільки головною метою даних дослідів було проведення порівняння трансгенної лінії від певної події з її нульовим представником, була вибрана схема дробної ділянки. Ця схема дає високий рівень оцінки взаємодії між трансгенними і нетрансгенними субпродуктами та різницям між трансгенними субділянками між подіями (взаємодії між субділянкою і головною ділянкою) і нижчий рівень оцінки різницям між загальними подіями головної ділянки. Польові досліди проводили в багатьох місцях прерій з метою оцінки промислових фенотипів у широкому діапазоні навколишніх умов, типових для вирощування рапсу. В усіх цих місцях кожна трансгенна подія фізично парувалася з її нульовим сиблінгом на сусідніх ділянках. Кожну ділянкову пару гомозиготного і нульового сиблінгів повторювали чотирикратно у кожному місці проведення дослідів. Місця розташування чотирьох повторюваних пар ділянок в кожному досліді розподіляли випадковим чином на кожному із місць дослідного поля. Ділянки мали розміри 1,6 м x 6 м і засаджувалися з густиною приблизно 142 насінини на квадратний метр. Рослини вирощували до стану зрілості відповідно до стандартної агрономічної практики, типової для промислового виробляння рапсу. 21 UA 97632 C2 5 10 15 20 25 30 35 Приклад 3. Експресія REV-трансгена із ембріонально-специфічного промотору для збільшення врожайності насіння трансгенного рапсу Врожаї кожної із ділянок в усіх місцях проведення дослідів на промисловому полі збирали окремо за допомогою комбайна. Дані загального врожаю насіння збирали в одиницях загальної маси насіння, скоригованої на вміст вологи від кожної ділянки. Для кожної трансгенної події в кожному досліді середню величину загального врожаю з чотирьох повторюваних ділянок кожної гомозиготної лінії порівнювали із середньою величиною загального врожаю з чотирьох повторюваних ділянок асоційованої лінії нульових сиблінгів. За результатами цього порівняння оцінювали ефект REV-трансгена на загальний врожай насіння. Результати від усіх численних місць проведення дослідів об'єднували для проведення перехресного аналізу впливу REVтрансгена на загальний врожай насіння. Статистичний аналіз відхилень результатів вимірювань у кожному місці проведення дослідів дозволив визначити межової величини значущості (Р=0,05) для різниць величин загального врожаю насіння між гомозиготними трансгенними лініями та їхнім нульовим сиблінгом. Характеристики ліній трансгенного REV-рапсy, які демонстрували статистично значуще збільшення загального врожаю насіння, підсумовані у Табл. 1. Трансгенні лінії, які демонстрували статистично значуще збільшення загального врожаю, були ідентифіковані для всіх семи конструкцій промотор/REV-трансген. Ці результати показують, що надмірна експресія REV-гена за допомогою ембріонально-специфічного промотору приводить до збільшення врожаю насіння. При цьому найбільший ефект збільшення врожаю був отриманий з LЕС2промотором. Це свідчить про те, що надмірна експресія REV-гена може бути найбільш ефективною на найбільш ранній стадії ембріонального розвитку, оскільки LЕС2-промотор є максимально активним на самому початку процесу ембріонального розвитку і поступово знижує транскрипційну активність на більш пізніх його стадіях. Промотори ААР1, LFAH12 і 2S2 ініціювали транскрипційну активність, послідовно вступаючи в процес ембріонального розвитку на більш пізніх його стадіях, але також були ефективними у збільшенні врожайності. Дія промотору LFAH12 була добре помітною на багатьох незалежних подіях, що відновлювалися і демонстрували значне збільшення врожайності, вказуючи цим на високий ступінь проникнення цього промотору у сферу даної властивості піддослідної культури. Лише одна подія з помірним збільшенням врожайності була відновлена у випадку FAE1-промотору, засвідчуючи, очевидно, що промотори, котрі ініціюють транскрипційну активність на більш ранніх стадіях ембріонального розвитку, є найкращими засобами підвищення врожайності і показують, що рання ембріональна надмірна експресія гена може застосовуватися для оцінки того, чи володіє ген, залучений до росту і/або розвитку рослини, потенціалом підвищення врожайності трансгенних рослин. Таблиця 1 Зміна загального врожаю насіння гомозиготних REV-рослин відносно їхнього нульового сиблінгу. Всі наведені величини ε статистично значущими (Р=0,05) Подія TG6-21 TG12-6 TG5-32 TG11-4 TG11-13 TG11-17 TG11-18 TG11-23 TG20-5 TG10-16 TG19-8 40 Промотор ААР1 ААР1 LFAH12 LFAH12 LFAH12 LFAH12 LFAH12 LFAH12 2S2 FAE1 LEC2 Трансген REV-ген кДНК REV-гена REV-ген кДНК REV-гена кДНК REV-гена кДНК REV-гена кДНК REV-гена кДНК REV-гена REV-ген REV-ген REV-ген Збільшення врожаю, % 7,8 7,9 15,5 18,9 8,9 16,7 5,8 9,4 25,6 5,6 59,8 Приклад 4. Збільшення розміру насіння у трансгенному рапсі, що експресує Rev-ген під час ембріонального розвитку при використанні ембріонально-специфічних промоторів Усе насіння, зібране окремо з кожної рослини в польових дослідах, просушували під невеликим припливом тепла у сушильній шафі для того, щоб зробити рівномірним розподіл вологи. У кожного зразка насіння від кожної із рослин з дослідного поля за допомогою 22 UA 97632 C2 5 10 15 20 25 30 лічильника насінин Agriculex (Guelph, Ontario, Canada) відраховували одну тисячу насінин. Після цього виміряли масу кожного із приготованих таким чином зразків, що складався із однієї тисячі насінин. Середню величину маси тисячі насінин (TSW: thousand seed weight) з чотирьох повторюваних ділянок кожної гомозиготної лінії порівнювали з середньою величиною TSW з чотирьох повторюваних ділянок відповідної лінії нульового сиблінгу. Різниці величин TSW між гомозиготними трансгенними REV-лініями та лініями їхніх нульових сиблінгів використовували як міру різниць розмірів насіння, які могли бути зумовлені ефектом REV-трансгена. Статистичний аналіз відхилень у кожному місці проведення дослідів дозволив визначити межову значущість (Р=0,05) для різниць величин TSW між гомозиготними трансгенними лініями та їхнім нульовим сиблінгом. Характеристики ліній трансгенного REV-рапсy, які демонстрували статистично значуще збільшення розміру насіння за величиною TSW, підсумовані у Табл. 2. Трансгенні лінії, які демонстрували статистично значуще збільшення за величиною TSW, були ідентифіковані для шести із семи трансгенних конструкцій промотор/REV. Вплив промоторів LEC2 і LFAH12, які стимулювали експресію REV, на розмір насіння відповідав ефектам, що спостерігалися у величинах загального врожаю при використанні цих промоторів. Велике збільшення розміру насіння, яке давала конструкція LEC2/REV, вказувало на те, що надмірна експресія REV у період дуже раннього ембріонального розвитку є високоефективною. Промотор LFAH12 демонстрував високу ефективність своєї дії на дану властивість у шести незалежних подій, у котрих спостерігалося статистично значуще збільшення розміру насіння. Промотори ААР1 і 2S2, що стимулювали надмірну експресію REV, також давали статистично значуще збільшення розміру насіння. Жодна з подій, що несли конструкцію FAE1/REV-трансген, не показала значного збільшення за величиною TSW. Оскільки FAE1-промоторна активність вступає в дію в період ембріонального розвитку найбільш останньою із п'яти досліджених промоторів, відсутність її ефекту свідчить про те, що промотори, які ініціюють транскрипційну активність на більш ранніх стадіях ембріонального розвитку, являють собою засоби збільшення врожаю, будучи асоційованими з геном, наприклад REV, який бере участь у рості та розвитку рослини. Крім того, ці промотори можуть застосовуватися для оцінки інших рослинних генів, пов'язаних з ростом і/або розвитком, на їхні потенційні можливості збільшувати врожаї, наприклад розмір і/або кількість, насіння трансгенних рослин. Таблиця 2 Зміна розміру насіння за масою 1000 насінин. Усі наведені величини є статистично значущими (Р=0,05). Величини, помічені знаком *, статистично значущими на одному місці проведення дослідів Подія TG6-21-15 TG12-6-6 TG5-32-23 TG5-61 TG11-4 TG11-13-9 TG11-17-19 TG11-18-19 TG20-15 TG19-8 TG19-23 35 40 Промотор ААР1 ААР1 LFAH12 LFAH12 LFAH12 LFAH12 LFAH12 LFAH12 2S2 LEC2 LEC2 Трансген REV-ген кДНК REV-гена REV-ген REV-ген кДНК REV-гена кДНК REV-гена кДНК REV-гена кДНК REV-гена REV-ген REV-ген REV-ген Збільшення маси 1000 насінин, % 3,9 3,6* 5,8 4,8 7,9 4,8 3,1 4,8 2,7 3,1 7,7 Приклад 5. Збільшення розміру насіння та врожайності трансгенного рапсу, що експресує Rev-ген під час ембріонального розвитку при використанні ембріонально-специфічних промоторів Одним із імовірних наслідків для фенотипу зі збільшеним розміром насіння може бути компенсаційна реакція рослини, виражена у зменшенні кількості насіння для збереження постійним загального розподілу ресурсів для продукування насіння. У Табл. 3 підсумовані характеристики шести незалежних трансгенних REV-подій, які демонструють як статистично значущий збільшений розмір насіння, так і збільшений загальний врожай у польових дослідах. Одночасне збільшення розміру насіння і загального врожаю спостерігалося у подій, що несли 23 UA 97632 C2 5 10 15 20 трансгенні конструкції ААР1/REV, LFAH12/REV, 2S2/REV і LEC2/REV. Таким чином, усі чотири промотори ефективно сприяли збільшенню розміру насіння, не виявляючи ефекту зменшення кількості насіння внаслідок компенсаційної реакції рослини. Порівняння величин TSW маси з величинами загального врожаю в Табл. 3 показує, що за загальне збільшення врожаю, що спостерігалося, відповідальним є не тільки збільшення розміру насіння. Збільшений розмір насіння був лише одним із компонентів загального збільшення врожаю, у той час як решту його зумовлювало збільшення кількості насіння. Збільшена кількість насіння, як правило, була головним компонентом загального збільшення врожаю. Збільшена кількість насіння могла зумовлюватися збільшенням кількості насіння у плоді, збільшенням кількості грон, збільшенням кількості плодів у гроні, зниженням відсотка насіння з припиненим розвитком або двома чи кількома цими факторами в різноманітних комбінаціях один з одним. Відсутність події, що несе FAE1/REV-трансгенну конструкцію із переліку подій, які демонструють збільшення як розміру насіння, так і загального врожаю, вказує на те, що промотори, котрі ініціюють транскрипційну активність на більш ранніх стадіях ембріонального розвитку, являють собою найкращі засоби для оцінки рослинних генів, залучених до розвитку і росту рослини, на їхню потенційну здатність збільшувати розмір насіння і врожаї трансгенних рослин. Очевидно також, що найбільшу ефективність у збільшенні врожайності можна отримувати з промоторами, котрі ініціюють транскрипційну активність на більш ранніх стадіях ембріонального розвитку. Таблиця 3 Незалежні трансгенні REV-події, котрі демонструють збільшені як розмір насіння, так і загальний врожай. Усі подані в таблиці величини є статистично значущими (Р=0,05) за винятком позначених подвійною зірочкою **, котрі не були статистично значущими, але давали позитивні результати в усіх чотирьох місцях проведення дослідів. Величини, позначені однією зірочкою *, були статистично значущими в одному місці проведення дослідів Подія TG6-21 TG12-6-6 TG5-32-14 TG11-4 TG20-15 TG19-8 25 30 35 40 Промотор ААР1 ААР1 LFAH12 LFAH12 2S2 LEC2 Трансген REV-ген кДНК REV-гена REV-ген кДНК REV-гена REV-ген REV-ген Збільшення маси 1000 насінин, Збільшення врожаю, % % 3,9 7,8 16,2* 103,9* 5,3 5,7 7,9 18,9 2,7 8,6** 3,1 59,8 Приклад 6. Трансгенна соя, що експресує трансгенні конструкції, спроектовані для надання ембріонально-специфічної експресії гена REVOLUTA. У світлі успішного використання ембріонально-специфічного LFAH12-промотору для ініціації експресії трансгена REVOLUTA в трансгенних рослинах рапсу (Табл. 1, 2 і 3) з метою збільшення врожайності і розмірів насіння була побудована конструкція LFAH12-AtREV-ген для трансформації рослин сої. Соя, подібно рапсу, є двосім'ядольною рослиною, і високе збереження REVOLUTA-генів у межах цього виду рослин робить вірогідним те, що REVOLUTAген рослин Arabidopsis буде виконувати свою функцію, будучи введеним у трансгенні соєві рослини. Конструювання REV-трансгена LFAH12-AtREV-ген-rev 3' UTR Ділянку промотору LFAH12 завдовжки 2170 п. н. ампліфікували із геномної ДНК Lesquerella fendleri праймерами EcoRI-LFAH12 (GAATTCTCAGGAAGATTAAGTCTTTGCTTG; SEQ ID NO: 14) і Sacl-LFAH12 (GAGCTCGCTGAAAATATCAAAAGAAGGAACA; SEQ ID NO: 15). Ці праймери починалися 24 нуклеотидами і 15 нуклеотидами, відповідно, від 5' і 3' кінців опублікованої послідовності LFAH12 ((позначення AF016103.1 або Gl:3452128 у Генбанку GenBank) (Broun et al., Plant J. 13:201-210(1998)). Було клоновано у pCR-Blunt (Invitrogen) і секвеновано кілька незалежних полімеразно-ланцюгових (PCR) реакцій. Послідовності всіх них були ідентичними одна одній і на 97% ідентичними опублікованій послідовності LFAH12. Ці різниці могли бути зумовлені специфічним доступом L. fendleri, використовуваним для відновлення цього промотору. LFAH12 переносили у плазміду pBluescript II вектором EcoRl, а орієнтація цього промотору у pBluescript-плазміді була Kрnl на 5'-стороні промотору і Spel на 3'-стороні 24 UA 97632 C2 5 10 15 20 25 30 35 40 45 50 55 промотору (pTG143). Касету At REV-ген-rev 3' UTR відбирали у формі фрагмента Spel-Kpnl із pTG95 (35S-At REV-ген-rev 3'UTR у pCGN1547, патент WO 01/33944A1) і разом з промотором LFAH12 (фрагмент Kpnl-Spel із pTG143) лігували у бінарний вектор pCGN1547 (McBride et al., Plant MoI. Biol. 14:269-276, 1990), який зрізали з сайтом Kрnl у лігуванні трьома шляхами, створюючи LFAH12-промотор-At REV-ген-rev 3' UTR з орієнтацією «голова у хвіст» з рослинною касетою експресії NPTII (pTG171). Касету LFAH12pr-At REV-ген-rev 3' UTR вирізали із pTG171 сайтом Kрnl, дефосфорилювали Т4-полімеразою і клонували у pBluescript II, який зрізали за допомогою Smal, отримуючи в результаті pTG464 (TG-GM6). Трансформація сої Сою сорту Х5 трансформували конструкцією експресії REV-трансгена за допомогою біолістичного методу для введення ДНК на частках золота в клітини сої, вирощені в суспензійній культурі. Лінійну ДНК, яка містила конструкцію експресії REV-трансгена, піддавали спільному трансформуванню з гігроміциновим маркерним геном, який піддається селекції, на окремому фрагменту лінійної ДНК. ДНК для інсерції в клітини сої виготовляли шляхом додавання 2,5 мкл ДНК REV-гена і 2,5 R мкл pHYG ДНК до часток золота. До цієї суміші додавали 50 мкл СаСІ 2. Все це перемішували у вихровій мішалці протягом 5 секунд, після цього добавляли 20 мкл спермідину і знову перемішували вихровим способом упродовж 5 сек. Далі суміш залишали відстоюватися до утворення осаду на дні пробірки. Супернатант видаляли, а дебрис двічі промивали 200 мкл 100% етанол. Супернатант знову видаляли, а дебрис повторно суспендували у 120 мкл 100% етанолу. Із суспензії відбирали 8 мкл аліквоти на диск для інсерції. Після біолістичної інсерції клітини вирощували в суспензійній культурі в колбах протягом 12 днів. Вирощені культури переносили в інші колби, які містили по 30 мкл суміші із 2,4% цукру, світлого Файнера (Finer's Light: F.L.) і 170 мкл 10 мкг/мкл гігроміцину. Упродовж наступних чотирьох тижнів живильні середовища щотижня замінювали шляхом перенесення культур в інші колби, котрі містили 2,4% цукру+F.L.+гігроміцин. Трансформовані зелені калюси розвивалися в колбах упродовж подальших п'ятого-десятого тижнів. Після цього вміст колб з зеленими калюсами виливали у стерильні 100x15 мм чашки або кришки. За допомогою стерильного пінцету зелені калюси зчісували з коричневих клітин і переносили на 26-лункові планшети, заповнені середовищем із 1-2 мл 2,4% цукру+F.L.+гігроміцин на лунку, по 1 зеленому калюсу (клону) на лунку. В кінцевому рахунку планувалося отримувати по 20-30 клонів на колбу. Середовища в планшетах замінювали кожні 2 тижні за допомогою стерильної 10 мл піпетки та автоматичного піпетора, відсмоктуючи таким чином всі середовища зі всіх лунок. Відібране середовище заміняли свіжим із 2,4% цукру+гігроміцин. Моніторинг планшетів проводили за розвитком підходящих проембріогенних культур. Вони мали зелений колір і декілька проембріогенних виростів, характеризувалися швидким діленням і ростом. Як тільки під мікроскопом спостерігалася наявність підходящої клітинної маси, її переносили на стерильну чашку або кришку, де видалялося якомога більше мертвого клітинного матеріалу. Решту тканини переносили до звичайної 30 мл колби з 2,4% цукру+гігроміцин. Клонам давали можливість рости протягом 3-5 тижнів між замінами середовища. Коли клони достатньо виростали, їх розділяли на частини. Зберігали лише 5 кращих частин на клон. Вони мали зелений колір і декілька проембріогенних виростів. Гладкі, зелені колонії були небажаними. Ці колонії субкультивували кожні 3-5 тижнів доти, поки вони не ставали достатньо великими. По досягненні достатніх розмірів колонії переносили в середовище для регенерації сої з активованим вугіллям, де проводилася перша стадія регенерації - видалення 2,4-D (OMSM6AC, Simmonds and Donaldson, Plant Cell Reports 19:485-490, 2000, включена тут в усій її повноті шляхом посилання). На середовищі OMSM6AC, що містило активоване вугілля (АС) для видалення 2,4-D із тканини, клони вирощувалися не більше шести днів. Після цього клони переносили в середовище для пророщування ембріонів сої (OMSM6G, Simmonds and Donaldson, supra), де їх витримували протягом трьох тижнів. Це середовище дозволяло розвивати ембріони. За три тижні були відібрані найкращі 20 ембріонів і перенесені у середовище для визрівання сої (OMSM6PH, Simmonds and Donaldson, supra). Цими найкращими ембріонами були одинарні (на противагу злитим) ембріони з 1 або 2 сім'ядолями і видимою меристемою. Ембріони переносили таким чином, щоб меристема була паралельною поверхні агару. Клони витримували на ОМSМ6РН-середовищі впродовж чотирьох тижнів. Протягом цього часу ембріони перетворювали свій колір на жовтий, і, таким чином, стали готовими для їх десикації і регенерації в рослини. 25 UA 97632 C2 5 10 15 20 25 Десикацію ембріонів здійснювали в ящиках Магента (Magenta), стерилізованих протягом 30 хв. трьома шарами Н2О-насичених фільтрів Ватмана (Whatman), укладеними на дні. Ембріони зневоднювалися протягом десяти днів, після чого їх переносили до середовища для укорінення сої (середовище В5/2 Симондса-Дональдсона (Simmonds and Donaldson), supra) на планшетах упродовж 10-12 днів. Коли коріння виростало до кришки або коли розкривалося листя, паростки ставали готовими до перенесення їх у ящики для розвитку розсади "Sunshine Mix". У цих ящиках трансгенні паростки вирощувалися доти, поки не з'являвся перший трилопатевий лист, а потім переносили до 6-дюймових горшків для вирощування на насіння. Приклад 7. Експресія REV-трансгена із ембріонально-специфічного промотору для визначення збільшеного розміру насіння трансгенної сої Для оцінки фенотипу за об'єднаним критерієм - трансгенною експресією і кількістю локусів трансгенних вставок - відбиралися події Т0, які утримували трансгенну конструкцію LFAH12AtREV-ген-rev 3' UTR (TG GM6). Подіям з перевіреною трансгенною експресією й одним локусом трансгенної вставки віддавався найвищий пріоритет у переході до стадії поширення насіння та польових випробувань. У деяких випадках, коли наявність множини генів давала високий загальний рівень трансгенної експресії завдяки генній дозі, відбиралися події з множиною локусів трансгенних вставок. Насіння Т1 від вибраних подій Т0 вирощували в теплиці сегрегативними популяціями Т1. Насіння з усіх рослин Т1 збирали індивідуально. Рослини покоління Т2 від кожної події вирощували і методом PCR типували, визначаючи те, які лінії Т 2 були гомозиготними, які гетерозиготними, а які - нульовими представниками сегрегацій для REV-трансгена. Насіння від кожної лінії збирали Т 2, підраховували і зважували. Шляхом ділення загальної маси насіння на кількість насінин для кожної лінії Т 2, визначали масу тисячі насінин (TSW) для кожної лінії. За цими даними обчислювали середні величини TSW для гомозиготної, гетерозиготної і нульової груп насіння по кожній події. Дві незалежні події трансформації з REV-експресією, стимульованою ембріональноспецифічним LFAH12-промотором, показували статистично значуще збільшення розмірів насіння як у гомозиготних, так і гетерозиготних лініях відносно ліній нульової групи. Підсумовані в Табл. 4 результати цього експерименту ілюструють надмірну експресію REV-трансгена під час раннього ембріонального розвитку рослин сої. 30 Таблиця 4 Застосування ембріонально-специфічного промотору в оцінці здатності REV-трансгена збільшувати розмір насіння сої за масою 1000 насінин у гомозиготних і гетерозиготних трансгенних рослин відносно їхніх сиблінгів нульової групи Подія 2А4 2А4 2А4 2В2 2В2 2В2 Зиготність Кількість ліній Середня маса 1000 насінин, г Стандартна похибка Гомозиготна Гетерозиготна Нульова Гомозиготна Гетерозиготна Нульова 32 79 38 3 19 14 69,8 70,6 66,0 83,6 79,5 73,2 1,03 0,58 0,97 5,90 2,33 2,29 Збільшення розміру насіння, % 5,8 7,0 NA 14,1 8,5 NA NA: Дані відсутні 35 40 Приклад 8. Експресія REV-трансгена із ембріонально-специфічного промотору для визначення збільшеного загального врожаю насіння трансгенної сої Для оцінки впливу стимульованої ембріонально-специфічним промотором трансгеної експресії REV-гена на загальний врожай насіння Т3 від гомозиготних ліній і ліній групи нульового сиблінгу об'єднували у загальні фонди і висівали в полі під час літнього вегетаційного періоду. Усе насіння, зібране на індивідуальних ділянках у полі, сушили під слабким припливом тепла у сушильній шафі для того, щоб зробити рівномірним розподіл вологи перед вимірюванням маси насіння. Одна із трансгенних подій з експресією REV, ініційованою ембріонально-специфічним LFAH12-промотором, демонструвала збільшення загального врожаю насіння на 22,7% і збільшення розміру насіння на 8,0% відносно її нульового сиблінгу (Табл. 5). 26 UA 97632 C2 Таблиця 5 Застосування ембріонально-специфічного промотору в оцінці здатності REV-трансгена збільшувати як розмір насіння, так і врожай сої, при порівнянні гомозиготних трансгенних рослин з їхніми сиблінгами нульової групи Подія 2В2 2В2 Зиготність Гомозиготна Нульова Загальна маса Загальне Збільшення Середня маса насіння/100 рослин, збільшення насіння, розміру насіння, 1000 насінин, г г % % 1552 22,7 90,0 8,0 1265 NA 83,3 NA NA: Дані відсутні 5 Наведені вище приклади мають ілюстративне призначення і жодним чином не обмежують об'єму даного винаходу. Цілком можливими є також інші варіанти здійснення винаходу, які повинні бути очевидними для фахівців у даній галузі й охоплюватися при цьому доданою тут Формулою винаходу. Усі цитовані в даному описі патенти, патентні заявки та інші публікації, включені тут в усій їхній повноті шляхом посилання. 27 UA 97632 C2 28
ДивитисяДодаткова інформація
Назва патенту англійськоюIncreased seed size and seed number through transgenic over expression of a growth and/or development related gene during early embryo development
Автори англійськоюDerocher, Jay, NGUYEN THU
Назва патенту російськоюСпособ увеличения размера и количества семян вследствие трансгенной чрезмерной экспрессии гена, ассоциированного с ростом и/или развитием, во время раннего эмбрионального развития растения
Автори російськоюДерочер Джей, Нгуйен Тху
МПК / Мітки
МПК: A01H 5/00, C12N 15/82
Мітки: насіння, внаслідок, асоційованого, надмірної, рослини, розвитку, спосіб, збільшення, раннього, гена, ембріонального, ростом, розміру, експресії, трансгенної, кількості, розвитком
Код посилання
<a href="https://ua.patents.su/41-97632-sposib-zbilshennya-rozmiru-i-kilkosti-nasinnya-vnaslidok-transgenno-nadmirno-ekspresi-gena-asocijjovanogo-z-rostom-i-abo-rozvitkom-pid-chas-rannogo-embrionalnogo-rozvitku-roslini.html" target="_blank" rel="follow" title="База патентів України">Спосіб збільшення розміру і кількості насіння внаслідок трансгенної надмірної експресії гена, асоційованого з ростом і/або розвитком, під час раннього ембріонального розвитку рослини</a>
Попередній патент: Терапевтична вакцина
Наступний патент: Циклічні антимікробні пептиди
Випадковий патент: П'єзоелектричний перетворювач механічних величин