Тверда дисперсія, спосіб її одержання, а також композиція і лікарська форма, що її містять
Номер патенту: 108842
Опубліковано: 25.06.2015
Автори: Лаупер Стефан, Гоу Зінаїда, Пудевель Йоганнес, Десай Діпен, Айєр Раман Махадеван, Вайзор Гарі Конард, Шах Навніт-Харговіндас, Ібрахім Прабха Н., Віершем Франк, Сандху Харпріт К., Діодоне Ральф, Маір Ханс-Йюрген, Віттенбах Ніколе
Формула / Реферат
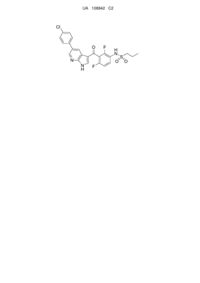
1. Тверда дисперсія, що містить Сполуку І
 , (I)
, (I)
молекулярно дисперговану в полімерній матриці, утвореній іонним полімером у твердому стані, де зазначений іонний полімер вибраний з групи, що складається з ацетатсукцинату гідроксипропілметилцелюлози, гідроксипропілметилцелюлози, фталату гідроксипропілметилцелюлози і співполімерів метакрилової кислоти.
2. Тверда дисперсія за п. 1, яка відрізняється тим, що зазначений іонний полімер вибраний з групи, що складається з ацетатсукцинату гідроксипропілметилцелюлози, гідроксипропілметилцелюлози і співполімерів метакрилової кислоти.
3. Тверда дисперсія за п. 1 або п. 2, яка відрізняється тим, що зазначений полімер являє собою ацетатсукцинат гідроксипропілметилцелюлози (HPMCAS).
4. Тверда дисперсія за п. 1 або п. 2, яка відрізняється тим, що зазначений полімер включає співполімер метакрилової кислоти.
5. Тверда дисперсія за п. 1, яка відрізняється тим, що зазначений полімер включає співполімер метакрилової кислоти (EUDRAGIT® L 100-55).
6. Тверда дисперсія за будь-яким з пп. 1-5, яка відрізняється тим, що співвідношення масового вмісту Сполуки І у твердій дисперсії до масового вмісту іонного полімеру в зазначеній твердій дисперсії становить від приблизно 1:9 до приблизно 1:1.
7. Тверда дисперсія за будь-яким з пп. 1-6, яка відрізняється тим, що співвідношення масового вмісту Сполуки І у твердій дисперсії до масового вмісту іонного полімеру в зазначеній твердій дисперсії становить від приблизно 2:8 до приблизно 4:6.
8. Тверда дисперсія за будь-яким з пп. 1-7, яка відрізняється тим, що співвідношення масового вмісту Сполуки І у твердій дисперсії до масового вмісту іонного полімеру в зазначеній твердій дисперсії становить приблизно 3:7.
9. Тверда дисперсія за будь-яким з пп. 1-8, яка відрізняється тим, що Сполука І переважно знаходиться в аморфній формі.
10. Тверда дисперсія за п. 3, яка відрізняється тим, що ацетатсукцинат гідроксипропілметилцелюлози (HPMCAS) присутній у кількості не менше ніж приблизно 20 % від маси твердої дисперсії.
11. Тверда дисперсія за п. 10, яка відрізняється тим, що ацетатсукцинат гідроксипропілметилцелюлози присутній у кількості, що становить від приблизно 20 % до приблизно 95 % від маси твердої дисперсії.
12. Тверда дисперсія за п. 10, яка відрізняється тим, що ацетатсукцинат гідроксипропілметилцелюлози присутній у кількості, що становить від приблизно 20 % до приблизно 70 % від маси твердої дисперсії.
13. Композиція, що містить тверду дисперсію за будь-яким з пп. 1-12 і фармацевтично прийнятний носій.
14. Композиція за п. 13, у якій тверда дисперсія містить аморфну форму Сполуки І.
15. Лікарська форма, що містить тверду дисперсію за будь-яким з пп. 1-12 або композицію за п. 13, суспендовану у водному середовищі.
16. Лікарська форма за п. 15, що додатково містить колоїдний діоксид кремнію.
17. Лікарська форма за п. 16, яка відрізняється тим, що зазначений колоїдний діоксид кремнію присутній у кількості, що становить щонайменше 0,5 % від маси композиції.
18. Лікарська форма за будь-яким з пп. 15-17, яка відрізняється тим, що зазначене водне середовище містить 2 % мас. гідроксипропілцелюлози.
19. Спосіб одержання твердої дисперсії за будь-яким з пп. 1-12, в якому здійснюють мікроосадження Сполуки І та іонного полімеру, де мікроосадження включає:
(a) розчинення Сполуки І та іонного полімеру у органічному розчиннику з одержанням єдиної органічної фази;
(b) додавання органічної фази, отриманої на етапі (а), у водну фазу;
(c) осадження суміші, що складається з аморфної форми Сполуки І та іонного полімеру, з водної фази, зазначеної на етапі (b), з утворенням водної суспензії осаду;
(d) виділення твердої фази з суспензії;
(e) промивання виділеної твердої фази водою; і
(f) деагломерацію та сушіння твердої фази.
20. Спосіб за п. 19, який відрізняється тим, що Сполуку І і зазначений іонний полімер одночасно осаджують з утворенням молекулярної дисперсії Сполуки І у зазначеному іонному полімері.
21. Спосіб за п. 19 або п. 20, який відрізняється тим, що зазначений полімер являє собою ацетатсукцинат гідроксипропілметилцелюлози (HPMCAS).
22. Спосіб за п. 21, який відрізняється тим, що Сполуку І і ацетатсукцинат гідроксипропілметилцелюлози розчиняють в органічному розчиннику.
23. Спосіб за п. 22, який відрізняється тим, що зазначений розчинник вибирають з групи, що складається з диметилформаміду, диметилацетаміду, диметилсульфоксиду і N-метилпіролідону.
24. Спосіб за п. 22 або п. 23, який відрізняється тим, що одночасним осадженням Сполуки І і ацетатсукцинату гідроксипропілметилцелюлози в водній фазі, якою є вода, отримують твердий молекулярний комплекс, що містить Сполуку І, поміщену в матрицю, утворену зазначеним полімером.
25. Спосіб за п. 22 або п. 23, який відрізняється тим, що одночасним осадженням Сполуки І і ацетатсукцинату гідроксипропілметилцелюлози в водній фазі, якою є водна соляна кислота (НСl), отримують твердий молекулярний комплекс, що містить Сполуку І, поміщену в матрицю, утворену зазначеним полімером.
26. Спосіб за п. 22, який відрізняється тим, що використовують на етапі (а) органічну фазу, яка являє собою 35 % розчин Сполуки І і HPMCAS у диметилацетаміді, при цьому співвідношення Сполуки І до HPMCAS становить від 30 % до 70 % (мас./мас.).
Текст
Реферат: Запропоновані тверді дисперсії, тверді молекулярні комплекси, солі та кристалічні поліморфні форми, що включають {3-[5-(4-хлорфеніл)-1Н-піроло[2,3-b]піридин-3-карбоніл]-2,4дифторфеніл}амідпропан-1-сульфонову кислоту. UA 108842 C2 (12) UA 108842 C2 UA 108842 C2 5 10 15 ГАЛУЗЬ ТЕХНІКИ [0001] У даному винаході запропоновані композиції, які містять сполуки, такі як біологічно активні сполуки, і способи одержання таких композицій. РІВЕНЬ ТЕХНІКИ [0002] У публікації заявки PCT WO 2007/002325 запропонований {3-[5-(4-хлорфеніл)-1Hпіролo[2,3-b]піридин-3-карбоніл]-2,4-дифторфеніл}амід пропан-1-сульфонової кислоти (див., наприклад, сторінку 80 і відповідну формулу на сторінці 82). КОРОТКИЙ ОПИС ВИНАХОДУ [0003] Згідно з цим винаходом запропоновані композиції, які містять Сполуку I або відносяться до Сполуки I. "Сполука I" у даному описі означає {3-[5-(4-хлорфеніл)-1H-піролo[2,3b]піридин-3-карбоніл]-2,4-дифторфеніл}амід пропан-1-сульфонової кислоти (зазначену сполуку також називають, відповідно до номенклатури, "{3-[5-(4-хлорфеніл)-1H-піролo[2,3-b]піридин-3карбоніл-2,4-дифторфеніл]-амідом} пропан-1-сульфонової кислоти"), солі зазначеної сполуки (включаючи фармацевтично прийнятні солі), кон'югати зазначеної сполуки, похідні зазначеної сполуки, форми зазначеної сполуки та проліки зазначеної сполуки. Структура {3-[5-(4хлорфеніл)-1H-піролo[2,3-b]піридин-3-карбоніл]-2,4-дифторфеніл}аміду пропан-1-сульфонової кислоти представлена нижче. 20 25 30 35 40 45 50 {3-[5-(4-хлорфеніл)-1H-піролo[2,3-b]піридин-3-карбоніл]-2,4-дифторфеніл}амід пропан-1сульфонової кислоти [0004] У даному описі термін "тверда дисперсія" означає будь-яку тверду композицію, що містить щонайменше два компоненти. У деяких варіантах реалізації, тверда дисперсія, описана в даній заявці, містить активний інгредієнт (наприклад, Сполуку 1), краще диспергований щонайменше в одному іншому компоненті, наприклад, полімері. У деяких варіантах реалізації, тверда дисперсія, описана в даній заявці, являє собою фармацевтичну дисперсію, яка включає щонайменше один фармацевтично або біологічно активний інгредієнт (наприклад, Сполуку 1). У деяких варіантах реалізації, тверда дисперсія включає Сполуку I, молекулярно дисперговану (тобто, що утворює дисперсію на молекулярному рівні) у полімері. Краще тверда дисперсія являє собою однофазну систему. Особливо краще тверда дисперсія згідно з цим винаходом являє собою мікроосаджений пухкий порошок (MBP), що містить Сполуку I. [0005] Термін "молекулярно диспергований" у даному описі відноситься до неупорядкованого розподілу сполуки (наприклад, Сполуки I) у полімері. У деяких варіантах реалізації зазначена сполука присутня в полімері в кінцевому роздробленому стані. Див., наприклад, M.G. Vachon і ін., J. Microencapsulation, 14:281-301 (1997) і Vandelli і ін., J. Microencapsulation, 10: 55-65 (1993). У деяких варіантах реалізації сполука (наприклад, Сполука I) може бути диспергирована в матриці, утвореній полімером у твердому стані, таким чином, що зазначена сполука імобілізована в аморфній формі. Чи утворюється молекулярна дисперсія даної сполуки в полімері, можна перевірити безліччю способів, наприклад, по тому, чи характеризується отриманий твердий молекулярний комплекс єдиною температурою переходу в склоподібний стан. [0006] Термін "твердий молекулярний комплекс" у даному описі означає тверду дисперсію, яка містить Сполуку I, молекулярно дисперговану в полімерній матриці. [0007] Термін "імобілізувати", що використовується у даному описі відносно імобілізації активної сполуки в полімерній матриці, означає, що молекули сполуки взаємодіють з молекулами полімеру таким чином, що молекули зазначеної сполуки втримуються згаданою вище матрицею, і запобігається зародження в них центрів кристалізації внаслідок відсутності рухливості. У деяких варіантах реалізації, зазначений полімер може запобігати утворенню міжмолекулярних водневих зв'язків або слабких дисперсійних сил між двома або декількома лікарськими молекулами Сполуки I. Див., наприклад, Matsumoro і Zografi, Pharmaceutical Research, тому 16, номер 11, стор. 1722-1728, 1999. 1 UA 108842 C2 5 10 15 20 25 30 35 40 45 50 55 60 [0008] Відповідно, у першому аспекті запропонована тверда дисперсія, яка містить Сполуку I і полімер. Також запропонований твердий молекулярний комплекс, який містить Сполуку I і полімер. Полімер може являти собою неіонний полімер або іонний полімер. У деяких варіантах реалізації, полімер вибирають з групи, що складається з ацетату сукцинату гідроксипропілметилцелюлози, гідроксипропілметилцелюлози, співполімерів метакрилової кислоти і тому подібних, а також з сумішей двох або декількох з перерахованих полімерів. У деяких варіантах реалізації, відношення кількості за масою Сполуки I у твердій дисперсії або твердому молекулярному комплексі до кількості за масою іонного полімеру в зазначеному комплексі становить від приблизно 1:9 до приблизно 5:5. У кращому варіанті реалізації цього винаходу, відношення кількості за масою Сполуки I у твердій дисперсії або твердому молекулярному комплексі до кількості за масою іонного полімеру в зазначеному комплексі становить від приблизно 2:8 до приблизно 4:6. У різних варіантах реалізації відношення Сполуки I до полімеру у твердій дисперсії не рівне 1:1; наприклад, відношення може становити приблизно 2:8; або приблизно 3:7 або приблизно 4:6. У кращому варіанті реалізації, відношення кількості за масою Сполуки I у твердій дисперсії або твердому молекулярному комплексі до кількості за масою іонного полімеру в зазначеному комплексі становить приблизно 3:7. У деяких кращих варіантах реалізації, Сполука I може бути присутня у твердій дисперсії в кількості, що становить від приблизно 0,1 % до приблизно 80 % від маси твердої дисперсії; або в кількості, що становить від приблизно 10 % до приблизно 70 % від маси твердої дисперсії; або в кількості, що становить від приблизно 20 % до приблизно 60 % від маси твердої дисперсії; або в кількості, що становить від приблизно 20 % до приблизно 40 % від маси твердої дисперсії; або в кількості, що становить приблизно 30 % від маси твердої дисперсії. У деяких варіантах реалізації, зазначений полімер може бути присутній у твердій дисперсії в кількості, не меншій, ніж приблизно 20 % від маси твердої дисперсії; або в кількості, що становить від приблизно 20 % до приблизно 95 % від маси твердої дисперсії; або в кількості, що становить від приблизно 20 % до приблизно 70 % від маси твердої дисперсії. [0009] У деяких кращих варіантах реалізації, Сполука I стабільна у твердій дисперсії (або твердому молекулярному комплексі) протягом щонайменше 2 місяців при 25(C; або протягом щонайменше 6 місяців при 25(C; або протягом щонайменше 12 місяців при 25(C; або протягом щонайменше 15 місяців при 25(C; або протягом щонайменше 18 місяців при 25(C; або протягом щонайменше 24 місяців при 25(C; або протягом щонайменше 2 місяців при 40(C і відносній вологості 75 %; або протягом щонайменше 4 місяців при 40(C і відносній вологості 75 %; або протягом щонайменше 5 місяців при 40(C і відносній вологості 75 %; або протягом щонайменше 6 місяців при 40(C і відносній вологості 75 %. У деяких кращих варіантах реалізації, Сполука I імобілізована таким чином, що вона перебуває краще в аморфній формі у твердій дисперсії або твердому молекулярному комплексі протягом щонайменше трьох тижнів зберігання при 40 ºC і відносній вологості 75 %; або протягом щонайменше одного місяця зберігання при 40 ºC і відносній вологості 75 %; або протягом щонайменше двох місяців зберігання при 40 ºC і відносній вологості 75 %; або протягом щонайменше трьох місяців зберігання при 40 ºC і відносній вологості 75 %; або протягом щонайменше чотирьох місяців зберігання при 40 ºC і відносній вологості 75 %; або протягом щонайменше п'яти місяців зберігання при 40 ºC і відносній вологості 75 %; або протягом щонайменше шести місяців зберігання при 40 ºC і відносній вологості 75 %. [0010] У деяких варіантах реалізації, Сполука I присутня у комплексі у вигляді тозилатної солі; або мезилатної солі. Зазначений комплекс може додатково включати фармацевтично прийнятний носій. [0011] У даному описі термін "переважно в аморфній формі" означає, що більше, ніж 50 %; або більше, ніж 55 %; або більше, ніж 60 %; або більше, ніж 65 %; або більше, ніж 70 %; або більше, ніж 75 %; або більше, ніж 80 %; або більше, ніж 85 %; або більше, ніж 90 %; або більше, ніж 95 % сполуки присутнє в композиції в аморфній формі. [0012] У даному описі термін "приблизно", що використовується у контексті кількісних вимірювань, означає зазначену кількість ± 10 %. Наприклад, "приблизно 2:8" буде означати 1,82,2:7,2-8,8. [0013] У даному описі в контексті фармацевтично або біологічно активної сполуки (наприклад, Сполуки I) термін "стабільний" відноситься до здатності зазначеної сполуки зберігати свою активність або зберігати деякі фізичні або хімічні властивості при деяких заданих умовах. У деяких варіантах реалізації, активна сполука "стабільна", якщо активність по закінченню заданого періоду становить щонайменше 50 %; або щонайменше 60 %; або щонайменше 70 %; або щонайменше 75 %; або щонайменше 80 %; або щонайменше 85 %; або щонайменше 90 %; або щонайменше 95 %; або щонайменше 98 % від активності зазначеної 2 UA 108842 C2 5 10 15 20 25 30 35 40 45 50 55 60 сполуки на початку заданого періоду. У деяких варіантах реалізації, сполука в аморфній формі стабільна, якщо щонайменше 50 %; або щонайменше 60 %; або щонайменше 70 %; або щонайменше 75 %; або щонайменше 80 %; або щонайменше 85 %; або щонайменше 90 %; або щонайменше 95 %; або щонайменше 98 % зазначеної сполуки залишається в аморфній формі по закінченні заданого періоду. У додаткових варіантах реалізації, аморфна сполука стабільна, якщо воно не утворює яких-небудь кристалічних піків, що детектуються, у профілях порошкового рентгеноструктурного аналізу (XRD) протягом зазначеного періоду. [0014] Термін "співполімери метакрилової кислоти" у даному описі включає співполімери метакрилової кислоти, співполімери метакрилової кислоти та метакрилату, співполімери метакрилової кислоти та етилакрилату, співполімери амонійметакрилату, співполімери аміноалкілметакрилатів і тому подібні співполімери. У деяких варіантах реалізації, "співполімер метакрилової кислоти" може являти собою EUDRAGIT® L 100 і EUDRAGIT® L 12,5 (що також називається або відповідає термінам: "співполімер метакрилової кислоти типу A"; "співполімер метакрилової кислоти і метилметакрилату (1:1)”; "співполімер метакрилової кислоти L"; "DMF 1242" або "PR-MF 6918"); EUDRAGIT® S 100 і EUDRAGIT® S 12,5 (що також називається або відповідає термінам: "співполімер метакрилової кислоти типу B"; "співполімер метакрилової кислоти і метилметакрилату (1:2)”; "співполімер метакрилової кислоти S"; "DMF 1242" або "PRMF 6918"); EUDRAGIT® L 100-55 (що також називається або відповідає термінам: "співполімер метакрилової кислоти типу C"; "співполімер метакрилової кислоти і етилакрилату (1:1) типу A"; "обезводнений співполімер метакрилової кислоти LD" або "DMF 2584"); EUDRAGIT® L 30 D-55 (що також називається або відповідає термінам: "дисперсія співполімеру метакрилової кислоти"; "30-процентна дисперсія співполімеру метакрилової кислоти і етилакрилату (1:1)"; "співполімер метакрилової кислоти LD"; JPE DMF 2584; PR-MF 8216); EUDRAGIT® FS 30 D (що також називається DMF 13941 або DMF 2006-176); EUDRAGIT® RL 100 (що також називається або відповідає термінам: "співполімер амонійметакрилату типу A"; "співполімер амонійметакрилату (типу A)"; "співполімер аміноалкілметакрилату RS"; "DMF 1242" або "PR-MF 6918"); EUDRAGIT® RL PO (що також називається або відповідає термінам: "співполімер амонійметакрилату типу A"; "співполімер амонійметакрилату (типу A)"; "співполімер аміноалкілметакрилату RS"; "DMF 1242"); EUDRAGIT® RL 12,5 (що також називається або відповідає термінам "співполімер амонійметакрилату типу A"; "співполімер амонійметакрилату (типу A)”; "DMF 1242" або "PR-MF 6918"); EUDRAGIT® L 100-55 (що також називається або відповідає термінам: "співполімер метакрилової кислоти типу C"; "співполімер метакрилової кислоти і етилакрилату (1:1) типу A"; "збезводнений співполімер метакрилової кислоти LD"; "DMF 2584"); EUDRAGIT® L 30 D-55 (що також називається або відповідає термінам: "дисперсія співполімеру метакрилової кислоти", NF “ 30-процентна дисперсія співполімеру метакрилової кислоти та етилакрилату (1:1)”; "співполімер метакрилової кислоти LD"; "DMF 2584" або "PR-MF 8216"); EUDRAGIT® FS 30 D (що також називається або відповідає термінам: "DMF 13941" або "DMF 2006-176"); EUDRAGIT® RL 100 (що також називається або відповідає термінам: "співполімер амонійметакрилату типу A"; "співполімер амонійметакрилату (типу A)”; "співполімер аміноалкілметакрилату RS"; "DMF 1242" або "PR-MF 6918"); EUDRAGIT® RL PO (що також називається або відповідає термінам: "співполімер амонійметакрилату типу A"; "співполімер амонійметакрилату (типу A)"; "співполімер аміноалкілметакрилату RS" або "DMF 1242"); EUDRAGIT® RL 12,5 (що також називається або відповідає термінам: "співполімер амонійметакрилату типу A"; "співполімер амонійметакрилату (типу A)"; "DMF 1242" або "PR-MF 6918"); EUDRAGIT® RL 30 D (що також називається або відповідає термінам: "дисперсія співполімеру амонійметакрилату типу A"; "співполімер амонійметакрилату (типу A)" або "DMF 1242"); EUDRAGIT® RS 100 (що також називається або відповідає термінам: "співполімер амонійметакрилату типу B"; NF "співполімер амонійметакрилату (типу B)"; "співполімер аміноалкілметакрилату RS"; "DMF 1242" або "PR-MF 6918"); EUDRAGIT® RS PO (що також називається або відповідає термінам: "співполімер амонійметакрилату типу B"; "співполімер амонійметакрилату (типу B)"; "співполімер аміноалкілметакрилату RS" або "DMF 1242"); EUDRAGIT® RS 12,5 (що також називається або відповідає термінам: "співполімер амонійметакрилату типу B"; NF полімер, що відповідає термінам: "співполімер амонійметакрилату (типу B)"; "DMF 1242" або "PR-MF 6918"); EUDRAGIT® RS 30 D (що також називається або відповідає термінам: "дисперсія співполімеру амонійметакрилату типу B"; NF полімер, що відповідає термінам "співполімер амонійметакрилату (типу B)" або "DMF 1242"); EUDRAGIT® E 100 (що також називається або відповідає термінам: "співполімер амінометакрилату"; NF "основный співполімер бутильованого метакрилату"; "співполімер аміноалкілметакрилату E"; "DMF 1242" або "PR-MF 6918"); EUDRAGIT® E PO (що також називається або відповідає термінам: "основный співполімер бутильованого метакрилату"; 3 UA 108842 C2 5 10 15 20 25 30 35 40 45 50 55 60 "співполімер аміноалкілметакрилату E"; "співполімер амінометакрилату"; "DMF 1242"); EUDRAGIT® E 12,5 (що також називається або відповідає термінам: "сополімер амінометакрилату"; "основный співполімер бутильованого метакрилату"; "DMF 1242" або "PRMF 6918"); EUDRAGIT® NE 30 D (що також називається або відповідає термінам: "дисперсія співполімеру етилакрилату і метилметакрилату"; “ 30-процентна дисперсія поліакрилату"; ("30 % дисперсія полі(етилакрилат-метилметакрилату)”); "дисперсія співполімеру етилакрилату і метилметакрилату"; "DMF 2822" або "PR-MF 6918"); EUDRAGIT® NE 40 D (що також називається або відповідає термінам: DMF 2822); EUDRAGIT® NM 30 D (що також називається" 30-процентна дисперсія поліакрилату"; "30 % дисперсія (полі(етилакрилатуметилметакрилату))" або "DMF 2822"; PLASTOID® B (що також називається або відповідає терміну: "DMF 12102"), або тому подібні. [0015] У другому аспекті, запропоновані способи одержання твердих дисперсій або твердих молекулярних комплексів, описаних у даній заявці. Зазначений спосіб може включати застосування Сполуки I у формі тозилатної або мезилатної солі. [0016] У третьому аспекті, запропонована кристалічна поліморфна Форма 1 Сполуки I. У деяких варіантах реалізації, на порошковій рентгенограмі зазначеної кристалічної поліморфної Форми 1 Сполуки I положення характеристичних піків приблизно становлять 4,7, 9,4, 11,0, 12,5 і 15,4 градуса 2θ; або положення характеристичних піків приблизно становлять 4,7, 9,4, 10,0, 11,0, 12,5, 14,2, 15,4, 18,6 і 22,2 градуса 2θ; або положення характеристичних піків приблизно становлять 4,7, 9,4, 10,0, 11,0, 12,5, 14,2, 15,4, 16,1, 18,6, 19,0, 22,2 і 26,8 градусів 2θ. У деяких варіантах реалізації, кристалічна поліморфна Форма 1 Сполуки I має по суті таку ж порошкову рентгенограму, як і порошкова рентгенограма на Фіг. 1. Також наведені способи одержання твердих дисперсій і твердих молекулярних комплексів, описаних у даній заявці, у яких тверду дисперсію або твердий молекулярний комплекс одержують зі Сполуки I у вигляді кристалічної поліморфної Форми 1. [0017] У четвертому аспекті, запропонована кристалічна поліморфна Форма 2 Сполуки I. У деяких варіантах реалізації, на порошковій рентгенограмі зазначеної кристалічної поліморфної Форми 2 Сполуки I положення характеристичних піків приблизно становлять 8,8, 9,2, 13,5, 19,1 і 24,4 градуса 2θ; або положення характеристичних піків приблизно становлять 6,7, 8,8, 9,2, 13,5, 15,0, 17,7, 19,1, 19,7, 21,4 і 24,4 градуса 2θ; або положення характеристичних піків приблизно становлять 6,7, 8,8, 9,2, 13,5, 14,1, 14,5, 15,0, 16,2, 17,0, 17,7, 19,1, 19,7, 21,4, 22,2, 24,1, 24,4 і 28,1 градуса 2θ. У деяких варіантах реалізації, кристалічна поліморфна Форма 2 Сполуки I має по суті таку ж порошкову рентгенограму, як і порошкова рентгенограма на Фіг. 2. Також наведені способи одержання твердих дисперсій і твердих молекулярних комплексів, описаних у даній заявці, у яких тверда дисперсія або твердий молекулярний комплекс одержують зі Сполуки I у вигляді кристалічної поліморфної Форми 2. [0018] Передбачається, що всі атоми в сполуці, описаній в даній заявці, включають будьякий їх ізотоп, якщо явно не зазначено інакше. Повинно бути очевидно, що для будь-якого даного атома ізотопи можуть бути присутня по суті в співвідношеннях згідно з їх поширеністю в природі, або кількість одного або декількох певних атомів можна збільшити стосовно одного або декількох ізотопів, застосовуючи синтетичні способи, відомі фахівцеві в цій галузі. Таким чином, водень включає, наприклад, 1H, 2H, 3H; вуглець включає, наприклад, 11C, 12C, 13C, 14C; кисень включає, наприклад, 16O, 17O, 18O; азот включає, наприклад, 13N, 14N, 15N; сірка включає, наприклад, 32S, 33S, 34S, 35S, 36S, 37S, 38S; фтор включає, наприклад, 17F, 18F, 19F; хлор включає, наприклад, 35Cl, 36Cl, 37Cl, 38Cl, 39Cl; і тому подібні. [0019] У даному описі термін "тверда форма" відноситься до твердого препарату (тобто препарату, який не є ані газом, ані рідиною) фармацевтично активної сполуки, яка придатна для введення передбачуваній тварині для терапевтичних цілей. Зазначена тверда форма включає будь-який комплекс, такий як сіль, співкристал або аморфний комплекс, а також будь-яку поліморфну форму зазначеної сполуки. Тверда форма може бути по суті кристалічною, напівкристалічною або по суті аморфною. Тверду форму можна вводити безпосередньо або використовувати для одержання придатної композиції, що має поліпшені фармацевтичні властивості. Наприклад, тверду форму можна застосовувати у вигляді лікарської форми, що містить щонайменше один фармацевтично прийнятний носій або допоміжну речовину. [0020] У даному описі в об'єм терміна "по суті кристалічний" матеріал входить матеріал, у якого ступінь кристалличности більше, ніж приблизно 90 %; і в об'єм терміна "кристалічний" матеріал входить матеріал, у якого ступінь кристалличности більше чому приблизно 98 %. [0021] У даному описі в обсяг терміна "по суті аморфний" матеріал входить матеріал, у якого ступінь кристалізації не більше, ніж приблизно 10 %; і в обсяг терміна "аморфний" матеріал входить матеріал, у якого ступінь кристалічності не більше ніж приблизно 2 %. 4 UA 108842 C2 5 10 15 20 25 30 35 40 45 50 55 60 [0022] У даному описі в обсяг терміну "напівкристалічний" матеріал входить матеріал, у якого ступінь кристалічності більше ніж 10 %, але не більше ніж 90 %; краще в обсяг терміну "напівкристалічний" матеріал входить матеріал, у якого ступінь кристалічності більше ніж 20 %, але не більше ніж 80 %. В одному аспекті цього винаходу, можна одержати суміш твердих форм зазначеної сполуки, наприклад, суміш аморфної і кристалічної твердих форм, наприклад, щоб одержати "напівкристалічну" тверду форму. Таку "напівкристалічну" тверду форму можна одержати за допомогою способів, відомих у цій галузі, наприклад, шляхом змішування аморфної твердої форми з кристалічною твердою формою в бажаному співвідношенні. У деяких випадках, сполука, змішана з кислотою або основою, утворює аморфний комплекс; напівкристалічну тверду речовину можна одержати, використовуючи деяку кількість сполуки в стехіометричному надлишку зазначеної сполуки і кислоту або основу в аморфному комплексі, одержуючи, тим самим, деяку кількість аморфного комплексу на підставі його стехіометрії, у якому надлишок сполуки перебуває в кристалічній формі. Величину надлишку сполуки, що використовується для одержання зазначеного комплексу, можна змінювати для одержання бажаного співвідношення аморфного комплексу і кристалічної сполуки в отриманій суміші твердих форм. Наприклад, якщо стехіометрія аморфного комплексу кислоти або основи і сполуки становить 1:1, одержання зазначеного комплексу з молярним співвідношенням сполуки до кислоти або основи 2:1 дозволить одержати тверду форму з 50 % аморфного комплексу і 50 % кристалічної сполуки. Така суміш твердих форм може бути корисна як лікарський продукт, наприклад, завдяки наявності аморфного компонента, що має поліпшені біофармацевтичні властивості, поряд із зазначеним кристалічним компонентом. Аморфний компонент буде мати більш високу біодоступність, тоді як кристалічний компонент буде мати більш низьку біодоступність. Така суміш може забезпечити одночасно швидкий і тривалий вплив активної сполуки. [0023] У даному описі термін "комплекс" відноситься до комбінації фармацевтично активної сполуки і додаткових молекул, які утворюють або дозволяють одержати нові хімічні сполуки у твердій формі. У деяких випадках, зазначений комплекс може являти собою сіль, тобто коли додаткова молекула несе протиіон кислоти/основи для кислотної/основної групи зазначеної сполуки, у результаті чого виникає взаємодія кислота:основа, яка приводить до утворення звичайної солі. Крім того, що такі сольові форми звичайно по суті кристалічні, вони також можуть являти собою частково кристалічні, по суті аморфні або аморфні форми. У деяких випадках, додаткова молекула в комбінації з фармацевтично активною сполукою утворює несольовий співкристал, тобто сполука і молекула не взаємодіють звичайним способом взаємодії кислота:основа, але все-таки утворюють по суті кристалічну структуру. Співкристали також можна одержати з солі зазначеної сполуки та додаткової молекули. У деяких випадках, комплекс являє собою по суті аморфний комплекс, який може включати солеутворення взаємодії кислота:основа, які не приводять до утворення звичайних сольових кристалів, але замість цього утворюють по суті аморфну тверду речовину, тобто тверду речовину, на порошковій рентгенограмі якого відсутні гострі піки (наприклад, проявляється аморфне гало). [0024] У даному описі термін "стехіометрія" відноситься до молярного співвідношення двох або більше взаємодіючих речовин, які поєднуються з утворенням комплексу, наприклад, до молярного співвідношення кислоти або основи і сполуки, які утворюють аморфний комплекс. Наприклад, суміш 1:1 кислоти або основи зі сполукою (тобто 1 моль кислоти або основи на моль сполуки) дозволяє одержати аморфну тверду форму зі стехіометрією 1:1. [0025] У даному описі термін "композиція" відноситься до фармацевтичного засобу, що придатний для введення передбачуваній тварині для терапевтичних цілей, яка містить щонайменше одну фармацевтично активну сполуку, включаючи будь-яку її тверду форму. Зазначена композиція може містити щонайменше один додатковий фармацевтично прийнятний компонент для одержання поліпшеної лікарської форми зазначеної сполуки, такий як придатний носій або допоміжну речовину. [0026] Термін "фармацевтично прийнятний" вказує на те, що зазначений матеріал не проявляє властивостей, які могли послужити причиною запобігання обережним лікаремтерапевтом введення зазначеного матеріалу пацієнтові, беручи до уваги конкретне захворювання або патологічні стани, які необхідно лікувати, і відповідний шлях введення. Наприклад, головним чином необхідно, щоб такий матеріал був по суті стерильним, наприклад, для лікарських засобів, що ін'єціюються. [0027] У контексті цього винаходу, термін "терапевтично ефективний" або "ефективна кількість" вказує на те, що матеріали або кількість матеріалу ефективна для попередження, часткового зняття або зниження виразності одного або декількох симптомів захворювання або патологічного стану і/або для продовження виживаності суб'єкта, якого лікують. У деяких 5 UA 108842 C2 5 10 15 20 25 30 35 40 45 варіантах реалізації, "терапевтично ефективна кількість" Сполуки I відноситься до таких дозувань і/або введенню протягом таких періодів часу, які необхідні для інгібування b-Raf людини, що містить мутацію V600E. Більше того, терапевтично ефективна кількість може являти собою таку кількість, при якій загальна терапевтично корисна дія перевершує токсичні або небажані побічні дії. Терапевтично ефективна кількість Сполуки I може змінюватися залежно від стадії захворювання, віку і ваги суб'єкта, якого лікують. Таким чином, схеми приймання лікарського засобу звичайно змінюють залежно від потреб суб'єкта в кожному конкретному випадку, що перебуває в рамках компетенції в цій галузі. У деяких варіантах реалізації, придатна щоденна доза для введення Сполуки I дорослій людині може становити від приблизно 100 мг до приблизно 3200 мг; або від приблизно 250 мг до приблизно 2000 мг, хоча верхню межу можна перевищувати, коли це необхідно. Щоденну дозу Сполуки I можна вводити у вигляді разової дози, у вигляді дробових доз або, для парентерального введення, її можна вводити у вигляді підшкірних ін'єкцій. [0028] У контексті цього винаходу, терміни "синергічно ефективний" або "синергічна дія" вказують на те, що дві або більше сполук, які є терапевтично ефективними, забезпечують поліпшену терапевтичну дію, коли застосовуються в комбінації, у порівнянні з їх сукупною дією, яка буде очікуватися на підставі дії кожної сполуки окремо. [0029] У даному описі термін "модулювання" або "модулювати" відноситься до ефекту зміни біологічної активності, особливо біологічної активності, пов'язаної з конкретною біомолекулою, такою як протеїнкіназа. Наприклад, агоніст або антагоніст конкретної біомолекули модулює активність цієї біомолекули, наприклад, ферменту, шляхом підвищення (наприклад, агоніст, активатор) або зниження (наприклад, антагоніст, інгібітор) активності зазначеної біомолекули, такої як фермент. Таку активність звичайно виражають у термінах інгібіторної концентрації (IC50) або середньоефективної концентрації (EC50) сполуки для інгібітора або активатора, відповідно, по відношенню, наприклад, до ферменту. [0030] Додаткові аспекти і варіанти реалізації повинні бути очевидні з наступного докладного опису та з формули винаходу. КОРОТКИЙ ОПИС КРЕСЛЕНЬ [0031] Фігура 1 являє собою порошкову рентгенограму для кристалічною поліморфної Форми 1 Сполуки I. [0032] Фігура 2 являє собою порошкову рентгенограму для кристалічною поліморфної Форми 2 Сполуки I. [0033] Фігура 3 являє собою порівняння порошкової рентгенограми для кристалічною поліморфної Форми 2 і мезилатної солі Сполуки I. [0034] Фігура 4 являє собою порівняння порошкової рентгенограми для кристалічною поліморфної Форми 2 і тозилатної солі Сполуки I. [0035] Фігура 5 являє собою схематичне зображення типової схеми одержання твердої дисперсії (MBP) згідно з етапами з a) по d), зокрема згідно з Прикладом 22 цього винаходу. [0036] Фігура 6 являє собою докладне схематичне зображення змішувача з великим зусиллям зсуву ((6) на Фіг. 5). [0037] На Фігурах 7A і 7B наведене порівняння рентгенограм, отриманих для двох партій твердих дисперсій (MBP), що містять HPMCAS і Сполуку I, отриманих шляхом осадження в змішувачі з великим зусиллям зсуву згідно зі способом, описаним у Прикладі 22 (див. Фігуру 7A), і шляхом звичайного розпилювального осадження (див. Фігуру 7B). ДОКЛАДНИЙ ОПИС ВИНАХОДУ [0038] {3-[5-(4-хлорфеніл)-1H-піролo[2,3-b]піридин-3-карбоніл]-2,4-дифторфеніл}амід пропан1-сульфонової кислоти, являє собою сполуку наступної структури: 50 {3-[5-(4-хлорфеніл)-1H-піролo[2,3-b]піридин-3-карбоніл]-2,4-дифторфеніл}амід сульфонової кислоти (Сполука I) 6 пропан-1 UA 108842 C2 5 10 15 20 25 30 35 40 45 50 55 [0039] У деяких варіантах реалізації Сполука I являє собою інгібітор кінази b-Raf. Нормально функціонуюча b-Raf являє собою кіназу, яка бере участь у передачі сигналів від мембрани в ядро клітини і активна тільки коли необхідно передавати такі сигнали. Мутантна b-Raf, проте, постійно активна і, таким чином, відіграє роль у розвитку пухлини. Мутантна b-Raf, що містить мутацію V600E, приводить до різних пухлин, наприклад, колоректального раку, меланомі і раку щитовидної залози. {3-[5-(4-хлорфеніл)-1H-піролo[2,3-b]піридин-3-карбоніл]-2,4дифторфеніл}амід пропан-1-сульфонової кислоти специфічно націлений на мутантну b-Raf мутацію, що містить, V600E. Відповідно, такий інгібітор застосовують для інгібування пухлин, особливо солідних пухлин, таких як меланома. Як зазначено раніше, формулювання "Сполука I" у даному описі відноситься до {3-[5-(4-хлорфеніл)-1H-піролo[2,3-b]піридин-3-карбоніл-2,4дифторфеніл]-аміду пропан-1-сульфонової кислоти, а також до будь-якої солі, кон'югату, похідної або проліків зазначеної сполуки. [0040] Сполуки, які мають низьку розчинність у воді (наприклад, деякі сполуки в кристалічній формі), мають низьку швидкість розчинення і, у результаті, можуть мати низку біодоступність. Низька біодоступність сполук може виявитися проблемою для терапевтичного введення пацієнтові, часто внаслідок неможливості прогнозувати дози/терапевтичні ефекти, що обумовлено нерівномірним усмоктуванням сполуки у пацієнта. Наприклад, приймання їжі може впливати на здатність організму пацієнта всмоктувати такі сполуки, що мають низьку біодоступність, таким чином, потенційно потрібні схеми приймання, що враховують вплив приймання їжі. Крім того, при введенні дози може знадобитися велика межа безпеки для зазначеної дози, внаслідок непередбаченої дії дози. Також внаслідок низької біодоступності, для досягнення бажаного терапевтичного ефекту може знадобитися більша доза сполуки, що потенційно може привести до небажаних побічних дій. [0041] Аморфні форми Сполуки I мають поліпшену розчинність у воді в порівнянні з кристалічною формою, але вони нестабільні, тому що проявляють схильність до кристалізації. Таким чином, необхідно одержати такий склад Сполуки I, щоб вона змогла стабільно існувати, краще в аморфній формі. [0042] Таким чином, у деяких аспектах і варіантах реалізації, розкритих і описаних у даній заявці, запропоновані методики, способи та композиції для поліпшення розчинності і/або біодоступності Сполуки I. У деяких варіантах реалізації, запропоновані композиції та способи, що включають Сполуку I у композиції, формі або лікарській формі, у якій вона має поліпшену розчинність у воді і/або біодоступність у порівнянні зі Сполукою I у кристалічній формі або Сполукою I у переважно кристалічній формі. [0043] У деяких варіантах реалізації запропоновані композиції, що містять Сполуку I в аморфній формі зазначеної сполуки. Зазначена аморфна форма Сполуки I може мати поліпшену розчинність у воді в порівнянні зі Сполукою I у кристалічній формі. У деяких варіантах реалізації, можна одержати лікарські форми Сполуки I, у яких Сполука I стабільно існує в аморфній формі, наприклад, шляхом імобілізації сполуки в матриці, утвореній полімером. Див., наприклад, патент США номер 6350786. Тверді дисперсії і тверді молекулярні комплекси Сполуки I та полімеру [0044] У деяких аспектах і варіантах реалізації запропоновані тверді дисперсії і тверді молекулярні комплекси, які містять Сполуку I. Наприклад, Сполуку I можна диспергувати у матриці, утвореній полімером, у твердому стані, таким чином, що воно імобілізується в аморфній формі. У деяких варіантах реалізації, зазначений полімер може запобігати утворенню внутрішньомолекулярних водневих зв'язків або слабких дисперсійних сил між двома або більше молекулами лікарської Сполуки I. Див., наприклад, Matsumoro і Zografi, Pharmaceutical Research, том 16, номер 11, стор. 1722-1728, 1999 р. У деяких варіантах реалізації, тверда дисперсія забезпечує більшу площу поверхні, таким чином, додатково забезпечуючи поліпшене розчинення та біодоступність Сполуки I. У деяких варіантах реалізації, тверда дисперсія або твердий молекулярний комплекс містить терапевтично ефективну кількість Сполуки I. [0045] У деяких варіантах реалізації цього винаходу, Сполука I присутня у твердій дисперсії в кількості від приблизно 1 % до приблизно 50 % за масою; або від приблизно 10 % до приблизно 40 % за масою; або від приблизно 20 % до приблизно 35 % за масою; або від приблизно 25 % до приблизно 30 % за масою. У подібних варіантах реалізації, полімер присутній у твердій дисперсії в кількості від приблизно 0 % до приблизно 50 % за масою; або від приблизно 5 % до приблизно 60 % за масою; або від 10 % до приблизно 70 % за масою. У деяких варіантах реалізації, полімер присутній у твердій дисперсії в кількості більшій, ніж приблизно 10 % за масою; або більшій, ніж приблизно 20 % за масою; або більшій, ніж приблизно 30 % за масою; або більшій, ніж приблизно 40 % за масою; або більшій, ніж 7 UA 108842 C2 5 10 15 20 25 30 35 40 45 50 55 приблизно 50 % за масою. В одному кращому варіанті реалізації, зазначена тверда дисперсія складається із приблизно 30 % за масою Сполуки I і приблизно 70 % за масою полімеру. [0046] Тверда дисперсія може містити Сполуку I, дисперговану в неіонному полімері. Цього можна добитися за допомогою різних засобів, включаючи: (A) плавлення полімеру і розчинення сполуки в полімері, а потім охолодження отриманої суміші; і (B) розчинення як сполуки, що цікавить, так і полімеру в органічному розчиннику і випарювання розчинника, наприклад, у роторному випарнику. Отримана в результаті цього тверда дисперсія може містити сполуку, дисперговану в полімері в аморфній формі. [0047] Тверду дисперсію можна одержати шляхом диспергування Сполуки I в іонному полімері. Одержання такої твердої дисперсії може привести до підвищеної стабільнасті Сполуки I. Цього можна добитися за допомогою різних засобів, включаючи способи, описані вище для одержання дисперсії в неіонному полімері. Оскільки іонні полімери мають залежну від pH розчинність у водних системах, отримана з ними тверда дисперсія Сполуки I і полімеру може виявитися стабільною при низькому pH у шлунку і може вивільняти Сполуку I при більш високому pH у кишечнику, який є місцем усмоктування. У кращих варіантах реалізації, Сполука I у таких твердих дисперсіях з іонним полімером, таким чином, може бути менше піддана відділенню від полімеру і може бути імобілізована полімером в аморфній формі. При реалізації цього винаходу можна застосовувати будь-який іонний полімер. Приклади таких іонних полімерів включають ацетатсукцинат гідроксипропілметилцелюлози (HPMC-AS), фталат гідроксипропілметилцелюлози (HPMCP) і співполімери метакрилової кислоти. Оскільки одна ціль складання формули Сполуки I у комплексі з іонним полімером полягала в імобілізації Сполуки I таким чином, щоб вона перебувало краще в аморфній формі, полімер, який здатен імобілізувати Сполуку I таким чином, що вона перебуває переважно в аморфній формі протягом тривалого періоду часу, є кращим. Виявили, що полімери, такі як HPMC-AS і Eudragit® L 100-55 (співполімер метакрилової кислоти), здатні імобілізувати Сполуку I таким чином, що вона перебуває краще в аморфній формі протягом щонайменше чотирьох тижнів зберігання при 40 ºC і відносній вологості 75 %. З цієї причини, HPMC-AS і Eudragit® L 100-55 являють собою кращі полімери для застосування в деяких варіантах реалізації цього винаходу. [0048] HPMC-AS (HPMCAS або AQOAT™, який доступний, наприклад, в Shin-Etsu) являє собою особливо кращий полімер для застосування при реалізації деяких варіантів реалізації цього винаходу. Він доступний при наступних ступенях чистоти: AS-LF, AS-MF, AS-HF, AS-LG, AS-MG і AS-HG. HPMC-AS являє собою аніонний, відносно нерозчинний у воді, високомолекулярний полімер з pH-залежною розчинністю у воді, при цьому розчинення відбувається при pH 5,2 і вище. Розчинення можна регулювати в діапазоні pH від 5,2 до 6,5, залежно від використовуваних ступенів чистоти HPMC-AS. HPMC-AS може бути відносно стійким до розпаду в кислому середовищі шлунку і при нормальних температурах зберігання. У той же час, оскільки HPMC-AS розчиняється при pH 5,2 і вище, він розчиняється в основному середовищі кишечнику, таким чином, забезпечуючи поліпшення усмоктування Сполуки I і додатково забезпечуючи підвищення біодоступності Сполуки I. Відповідно, у деяких варіантах реалізації цього винаходу, Сполука I перебуває у твердій дисперсії зі щонайменше одним полімером, обраним з HPMC-AS з різними ступенями чистоти, описаного вище. Проте, передбачається, що суміш двох або більше HPMC-AS з різними ступенями чистоти також можна застосовувати відповідно до цього винаходу. [0049] В одному варіанті реалізації цього винаходу, відношення кількості за масою Сполуки I у твердому комплексі до кількості за масою іонного полімеру в зазначеному комплексі становить від приблизно 1:9 до приблизно 1:1. У кращому варіанті реалізації цього винаходу, відношення кількості за масою Сполуки I у твердому комплексі до кількості за масою іонного полімеру в зазначеному комплексі становить від приблизно 2:8 до приблизно 4:6. У кращому варіанті реалізації цього винаходу, відношення кількості за масою Сполуки I у твердому комплексі до кількості за масою іонного полімеру в зазначеному комплексі становить приблизно 3:7. [0050] В одному варіанті реалізації цього винаходу, Сполука I імобілізована таким чином, що вона перебуває краще в аморфній формі в комплексі протягом до трьох тижнів зберігання при 40 ºC і відносній вологості 75 %. У кращому варіанті реалізації, Сполука I імобілізована таким чином, що вона перебуває краще в аморфній формі в комплексі протягом до одного місяця зберігання при 40 ºC і відносній вологості 75 %. В іншому кращому варіанті реалізації, Сполука I імобілізована таким чином, що вона перебуває краще в аморфній формі в комплексі протягом до двох місяців зберігання при 40 ºC і відносній вологості 75 %. В іншому кращому варіанті реалізації, Сполука I імобілізована таким чином, що вона перебуває краще в аморфній формі в комплексі протягом до трьох місяців зберігання при 40 ºC і відносній вологості 75 %. 8 UA 108842 C2 5 10 15 20 25 30 35 40 45 50 55 60 [0051] У деяких варіантах реалізації, HPMC-AS присутня у твердій дисперсії в кількості від приблизно 1 % до приблизно 50 % за масою; або від приблизно 5 % до приблизно 60 % за масою; або від 10 % до приблизно 70 % за масою. У деяких варіантах реалізації, HPMC-AS присутня у твердій дисперсії в кількості більшій, ніж приблизно 10 % за масою; або більшій, ніж приблизно 20 % за масою; або більшій, ніж приблизно 30 % за масою; або більшій, ніж приблизно 40 % за масою; або більшій, ніж приблизно 50 % за масою. [0052] Даний винахід також відноситься до композицій, що містять тверду дисперсію або твердий молекулярний комплекс, описаний у даній заявці. Зазначена композиція, крім твердої дисперсії або твердого молекулярного комплексу, також може включати терапевтично інертні неорганічні або органічні носії (наприклад, фармацевтично прийнятні носії або допоміжні речовини). Фармацевтична композиція також може містити додаткові агенти, такі як консервуючи агенти, солюбілізуючі агенти, стабілізуючі агенти, змочувальні агенти, емульгуючі агенти, підсолоджуючі агенти, підфарбовуючі агенти, ароматизуючі агенти, солі для зміни осмотичного тиску, буфери, агенти для покриття і антиоксиданти. Композиція також може містити додаткові терапевтично активні сполуки або більш ніж один комплекс терапевтично активної сполуки/полімеру (наприклад, тверду дисперсію або твердий молекулярний комплекс). [0053] У деяких варіантах реалізації, зазначена композиція містить тверду дисперсію або твердий молекулярний комплекс, суспендований у водному середовищі, що включає гідроксипропілцелюлозу (HPC). В особливо кращому варіанті реалізації, зазначене середовище містить приблизно 2 % за масою HPC. У кращому варіанті реалізації, композиція містить колоїдний діоксид кремнію. [0054] У деяких варіантах реалізації, додавання колоїдного діоксиду кремнію може додатково поліпшити стабільність твердої дисперсії або твердого молекулярного комплексу. В особливо кращому варіанті реалізації, зазначена композиція містить щонайменше приблизно 0,5 % за масою колоїдного діоксиду кремнію. [0055] У деяких варіантах реалізації, запропоновані композиції містять Сполуку I (наприклад, у твердій дисперсії або твердому молекулярному комплексі) і кросповідон (або Поліпласдон XL; розпушуючий агент для лікарської форми), стеарат магнію (змащувальний агент, який можна застосовувати в процесах таблетування і капсулювання) і/або кроскармелозу натрію (AcDiSol; розпушуючий агент). [0056] В особливо кращому варіанті реалізації, зазначена композиція включає тверду дисперсію або твердий молекулярний комплекс, суспендований у водному носії, що містить до 2 % за масою HPC і щонайменше приблизно 0,5 % за масою колоїдного діоксиду кремнію. Спосіб одержання твердого молекулярного комплексу Сполуки I та іонного полімеру [0057] Також запропоновані способи одержання твердих молекулярних комплексів, описаних у даній заявці, і композицій, що включають тверді молекулярні комплекси. У зазначеному способі, для Сполуки I можна провести мікроосадження з полімером, описаним у даній заявці (наприклад, HPMC-AS). Мікроосадження можна добитися за допомогою будь-яких засобів, відомих у цій галузі, наприклад: за допомогою розпилювального сушіння або ліофілізації; контрольованого розчинником осадження; контрольованого рівнем pH осадження; екструзії гарячого розплаву і технології із застосуванням надкритичних рідин. Кожний з даних способів докладно описаний нижче. [0058] Як тільки тверду дисперсію осадили з розчину за допомогою різних способів, її можна витягти з розчину за допомогою методик, відомих фахівцям у цій галузі, наприклад, шляхом фільтрування, центрифугування, промивання і т.д. Витягнутий твердий молекулярний комплекс потім можна висушити (наприклад, на повітрі, у печі або під вакуумом), і отриману в результаті цього тверду речовину можна перемолоти, розтерти або тонко подрібнити у дрібнодисперсний порошок за допомогою засобів, відомих у цій галузі. Порошковану форму твердої дисперсії потім можна диспергувати у носії з одержанням фармацевтичної композиції. У кращому варіанті реалізації, до зазначеної композиції додають щонайменше приблизно 0,5 % мас./мас. колоїдного діоксиду кремнію. a) Процес розпилювального сушіння або ліофілізації [0059] Сполуку I і полімер (наприклад, HPMC-AS) можна розчинити у звичайному розчиннику, що має низьку точку кипіння, наприклад, в етанолі, метанолі, ацетоні і т.д. За допомогою розпилювального сушіння або ліофілізації, розчинник випарюють шляхом миттєвого випаровування при температурі, близькій до точки кипіння розчинника, або під глибоким вакуумом (низький тиск насиченої пари), залишаючи Сполуку I осаджену у матриці, утвореній полімером. У деяких варіантах реалізації, Сполука I являє собою мезилатну або тозилатну сольову форму і, отже, краще має поліпшену розчинність. b) Контрольоване розчинником осадження 9 UA 108842 C2 5 10 15 20 25 30 35 40 45 50 55 [0060] Сполуку I і полімер (наприклад, HPMC-AS) можна розчинити у звичайному розчиннику, наприклад, диметилацетаміді, диметилформаміді, диметилсульфоксиді (ДМСО), Nметилпіролідоні (NMP), і т.д. Розчин Сполуки I/полімеру додають у холодну воду (від 0 ºC до 7 ºC, краще від 2 ºC до 5 ºC), доводять pH до придатного рівня (наприклад, у багатьох варіантах реалізації, придатний pH являє собою pH, рівний 3 або менше). Це викликає осадження Сполуки I у матриці, утвореній полімером (наприклад, HPMC-AS). Мікропреципітат можна промити кілька разів у водному середовищі доти, доки залишковий рівень розчинника не впаде нижче прийнятного межі для даного розчинника. "Прийнятну межу" для кожного розчинника визначають відповідно до рекомендацій Міжнародної конференції по гармонізації технічних вимог (ICH). [0061] У кращому варіанті реалізації, одержують розчин, що містить Сполуку I, органічний розчинник (такий як диметилформамід, диметилацетамід (ДМА), диметилсульфоксид (ДМСО), N-метилпіролідон (NMP) і тому подібні) та іонний полімер. Органічний розчинник краще являє собою ДМА при температурі від 20 до 25 ºC. Зазначений розчин можна одержати шляхом попереднього розчинення Сполуки I в органічному розчиннику. Потім додають полімер при перемішуванні. Отриману суміш потім нагрівають до температури між приблизно 50 і приблизно 110 ºC, краще до приблизно 70 ºC. [0062] Також одержують другий розчин, який являє собою 0,01 N HCl. У даному описі його називають "водною фазою". Водна фаза має температуру між приблизно 0 ºC і приблизно 60 ºC, краще між 5 ºC і 15 ºC. [0063] Водну фазу потім піддають циркуляції через змішувальну камеру змішувача з великим зусиллям зсуву, при цьому органічну фазу вводять дозами в камеру в процесі роботи камери. Дозування можна здійснити, наприклад, за допомогою шестеренчастого насосу, шлангового насосу або шприцевого насосу. У кращому варіанті реалізації, дозування здійснюють, застосовуючи шестеренчастий насос, при цьому розпилювач форсунки спрямований у змішувальну камеру. Змішувальна камера краще містить ротор і статор. У кожного ротора і статора може бути, наприклад, або один, або два ряди зубців. У кращому варіанті реалізації, у кожного ротора і статора є один ряд зубців. Окружну швидкість ротора краще встановлюють між приблизно 15 і приблизно 25 м/сек. [0064] У процесі змішування, Сполуку I і полімер осаджують, одержуючи суспензію частинок комплексу Сполуки I і полімеру у водному органічнім середовищі. Отриману суспензію потім можна багато разів пропустити через диспергуючий блок, щоб відрегулювати розмір частинок зазначеної сполуки. Суспензію потім можна центрифугувати і кілька разів промити у водній фазі, щоб видалити органічний розчинник, а потім промити ще раз чистою водою. Отриманий продукт потім можна просіяти і висушити з одержанням твердого комплексу згідно з цим винаходом. У процесі сушіння, температура отриманого комплексу повинна бути краще нижче 40 ºC, щоб уникнути перекристалізації Сполуки I. [0065] У деяких конкретних варіантах реалізації, описаний вище спосіб включає наступні етапи: (a) розчинення Сполуки I і HPMCAS у тому самому органічному розчиннику з одержанням єдиної органічної фази; (b) безперервне додавання органічної фази, отриманої в на етапі (a), у водну фазу, яка присутня в змішувальній камері, обладнаній змішувачем з великим зусиллям зсуву і двома додатковими отворами, які з'єднують зазначену змішувальну камеру із замкненим контуром, при цьому зазначену водну фазу піддають циркуляції з пропущенням через змішувальну камеру; (c) осадження суміші, що складається з аморфної форми Сполуки I і HPMCAS, з водної фази, зазначеної на етапі (b), у процесі роботи змішувача з великим зусиллям зсуву, і пропущення зазначеної водної фази через змішувальну камеру в замкненому контурі з утворенням водної суспензії осаду; (d) забезпечення безперервної циркуляції водної суспензії через змішувальну камеру в процесі роботи змішувача з великим зусиллям зсуву і після того, як органічний розчин, отриманий на етапі (a), повністю доданий у водну фазу, доти, доки не буде досягнутий певний розмір частинок і/або розподіл частинок за розміром; (e) виділення твердої фази з суспензії; (f) промивання виділеної твердої фази водою; і (g) деагломерація і сушіння твердої фази. [0066] У більш конкретних варіантах реалізації, способи згідно з цим винаходом включають етапи, на яких: 10 UA 108842 C2 5 10 15 20 25 30 35 40 45 50 55 60 - органічна фаза на етапі (a) вище являє собою 35 % розчин Сполуки I і HPMCAS у диметилацетаміді (ДМА), при цьому відношення Сполуки I до HPMCAS становить від 30 % до 70 % (мас./мас.); і - безперервне додавання на етапі (b) забезпечують за допомогою інжекторної форсунки, розташованої під кутом між 40° і 50° до поздовжньої осі змішувача з великим зусиллям зсуву і перебуває на відстані від приблизно 1 до приблизно 10 мм від ротора зазначеного змішувача з великим зусиллям зсуву, яке працює з окружною швидкістю від приблизно 15 до приблизно 25 м/сек. [0067] У ще більш конкретних варіантах реалізації, ці способи включають етап, на якому: - безперервне додавання на етапі (b) вище досягається за допомогою розпилювальної форсунки, розташованої під кутом приблизно 45° до поздовжньої осі змішувача з великим зусиллям зсуву і перебуває на відстані від приблизно 2 мм до приблизно 4 мм від ротора зазначеного змішувача з великим зусиллям зсуву, яке працює з окружною швидкістю, що становить приблизно 25 м/сек. [0068] В інших конкретних варіантах реалізації, способи згідно з цим винаходом включають етап, на якому - сушіння на етапі (g) вище досягається за допомогою сушіння в киплячому шарі. [0069] У додатковому варіанті реалізації, запропоновані тверді дисперсії, отримані за допомогою наведеного вище способу. [0070] Висушений осад, отриманий за допомогою наведеного вище способу, можна додатково переробити в будь-який тип твердих фармацевтичних препаратів або лікарських форм, які відомі фахівцеві в цій галузі. Особливо кращі пероральні лікарські форми, такі як таблетки, капсули, пігулки, порошки, суспензії і тому подібні форми. [0071] Отже, отримані в такий спосіб фармацевтичні препарати утворюють додаткові варіанти реалізації, наведені в даній заявці. [0072] Термін "органічний розчинник", згаданий на етапі (a) вище, означає будь-який органічний розчинник, у якому змішуються і Сполука I, і HPMCAS. Кращі органічні розчинники являють собою N-метилпіролідон (NMP), диметилформамід (DMF), диметилсульфоксид (ДМСО), диметилацетамід (ДМА) і тому подібні розчинники, при цьому ДМА є найкращим. Загальна кількість Сполуки I і HPMCAS в органічній фазі може лежати в діапазоні приблизно від 15 до 40 % за масою, краще приблизно від 25 до 40 %, найкраще може становити приблизно 35 % за масою. Масове співвідношення Сполуки I/HPMCAS в органічному розчиннику становить приблизно 30/70 % за масою, відповідно. Краще, температуру органічного розчинника доводять до 50 – 110 °C, краще до 60 – 90 °C, найкраще до приблизно до 70 °C перед його додаванням у змішувальну камеру, що згадано на етапі (b). Суміш Сполуки I і HPMCAS в органічному розчиннику також позначають у даній заявці як "органічна фаза" або "фаза ДМА". [0073] "Водна фаза", згадана на етапі (b), краще складається з кислої води (pH
ДивитисяДодаткова інформація
Назва патенту англійськоюPropane-i-sulfonic acid{3-[5-(4-chloro-phenyl)-1h-pyrrolo[2,3-b]pyridine-3-carbonyl]-2,4-difluoro-pheny l}-amide compositions and uses thereof
Автори англійськоюDesai, Dipen, Diodone, Ralph, Go, Zenaida, Ibrahim, Prabha, N., Iyer, Raman, Mahadevan, Mair, Hans-Juergen, Sandhu, Harpreet, K., Shah, Navnit, Hargovindas, Visor, Gary, Conard, Wyttenbach, Nicole, Lauper, Stephan, Pudewell, Johannes, Wierschem, Frank
Автори російськоюИбрахим Прабха Н., Шах Навнит Харговиндас
МПК / Мітки
МПК: A61K 31/437, A61P 35/00, C07D 471/04
Мітки: також, дисперсія, композиція, містять, спосіб, тверда, лікарська, форма, одержання
Код посилання
<a href="https://ua.patents.su/42-108842-tverda-dispersiya-sposib-oderzhannya-a-takozh-kompoziciya-i-likarska-forma-shho-mistyat.html" target="_blank" rel="follow" title="База патентів України">Тверда дисперсія, спосіб її одержання, а також композиція і лікарська форма, що її містять</a>
Попередній патент: Похідні циклопропіламіду, націлені на рецептор гістаміну н3
Наступний патент: Багатохвильовий лазерний доплерівський анемометр
Випадковий патент: Установка для сушіння твердої ізоляції високовольтних вводів трансформатора