Фармацевтична форма для перорального введення в ободову кишку лікарського засобу, спосіб її введення, спосіб отримання модифікованого хондроїтинсульфату, спосіб отримання модифікованого пектину
Формула / Реферат
1. Фармацевтическая форма для перорального введения в ободочную кишку лекарственного средства, нерастворяющегося в ферментах желудка и тонкой кишки, включающая лекарственное средство в матрице из полимерного вещества, отличающаяся тем, что в качестве полимерного вещества она содержит сахаридсодержащий полимер.
2. Фармацевтическая форма по п.1, отличающаяся тем, что сахаридсодержащий полимер является синтетическим полимером.
3. Фармацевтическая форма по пп.1 и 2, отличающаяся тем, что синтетический сахаридсодержащий полимер является метакриловым полимером.
4. Фармацевтическая форма по пп.1 и 3, отличающаяся тем, что синтетический сахаридсодержащий полимер дополнительно содержит олигосахарид, который переваривается ферментами ободочной кишки и устойчив в ферментах желудка и тонкой кишки.
5. Фармацевтическая форма по п.4, отличающаяся тем, что в качестве олигосахарида она содержит целлюлозу, лактулозу, рафинозу и стахиозу.
6. Фармацевтическая форма по п.1, отличающаяся тем, что указанная матрица содержит модифицированный полимер сахаридсодержащего природного полимера.
7. Фармацевтическая форма по пп.1 и 6, отличающаяся тем, что в качестве природного сахаридсодержащего полимера она содержит мукополисахарид.
8. Фармацевтическая форма по пп.1 и 6, отличающаяся тем, что в качестве природного сахаридсодержащего полимера она содержит модифицированный природный полимер, которым является поперечно-связанный хондроитинсульфат.
9. Фармацевтическая форма по п.1, отличающаяся тем, что в качестве лекарственного средства она содержит индометацин.
10. Фармацевтическая форма по п.7, отличающаяся тем, что в качестве природного сахарида она содержит металлическую соль пектина.
11. Фармацевтическая форма по п.10, отличающаяся тем, что в качестве металлической соли пектина она содержит кальциевую соль.
12. Фармацевтическая форма па п.1 или 6, отличающаяся тем, что указанное лекарственное средство содержит противовоспалительное вещество.
13. Фармацевтическая форма по п.12, отличающаяся тем, что в качестве противовоспалительного вещества используют нестероидное противовоспалительное вещество.
14. Фармацевтическая форма по п.12, отличающаяся тем, что указанное противовоспалительное вещество является стероидным противовоспалительным веществом.
15. Фармацевтическая форма по п.1 или 6, отличающаяся тем, что указанное лекарственное средство выбрано из группы, состоящей из дексаметазона, будезонида, беклометазона, флуктиказона, тиоксокортала и гидрокортизона.
16. Фармацевтическая форма по п.1 или 6, отличающаяся тем, что указанное лекарственное средство является циклоспорином.
17. Фармацевтическая форма по п.1 или 6, отличающаяся тем, что указанное лекарственное средство выбрано из группы, состоящей из теофилина, нифедипина, изосорбиддинитрата и оксипренолола.
18. Фармацевтическая форма по п.1 или 6, отличающаяся тем, что указанное лекарственное средство является спазмолитическим веществом для лечения синдрома раздраженной толстой кишки.
19. Фармацевтическая форма по п.18, отличающаяся тем, что указанное лекарственное средство является циметропбромидом.
20. Фармацевтическая форма по п.1 или 6, отличающаяся тем, что указанное лекарственное средство является противоопухолевым препаратом.
21. Фармацевтическая форма по п.20, отличающаяся тем, что указанный противоопухолевый препарат выбран из группы, состоящей из метотрексата, тамоксифена, циклофосфамида, меркаптоцурина и этопозида.
22. Способ получения модифицированного хондроитинсульфата путем модификации хондроитинсульфата с реакционной средой, содержащей алифатическую соль диамина в органическом растворителе в течение времени, достаточном для модифицирования хондроитинсульфата с последующим отделением его путем диализа, отличающийся тем, что модификацию хондроитинсульфата в реакционной среде ведут в присутствии катализатора и дополнительно после отделения его проводят лиофилизацию, а в качестве алифатической соли диамина используют 1,4-бутандиамин или 1,6-гександиамин или 1,7-гептандиамин или 1,12-додекандиамин.
23. Способ по п.22, отличающийся тем, что в качестве органического растворителя используют диметилсульфоксид или диметилформамид.
24. Способ по п.22, отличающийся тем, что в качестве катализатора в нем используют дициклогексил-карбодиимид.
25. Способ получения модифицированного пектина, включающий введение в водный раствор пектина едкого натра до pH 8,0 - 9,5, отличающийся тем, что в водный раствор пектина дополнительно перед введением едкого натра добавляют хлорид металла с последующим осаждением металлической соли пектина в виде осадка, просеиванием его до получения порошка.
26. Способ по п.25, отличающийся тем, что указанный металл выбран из группы, состоящей из кальция, стронция и магния.
27. Способ перорального введения лекарственного средства в матрице из полимерного вещества ферментационно расщепляющегося в ободочной кишке, отличающийся тем, что в качестве полимерного вещества используют сахаридсодержащий полимер.
28. Способ по п.27, отличающийся тем, что сахаридсодержащий полимер является синтетическим полимером.
29. Способ по пп.27 и 28, отличающийся тем, что синтетический сахаридсодержащий полимер является метакриловым полимером.
30. Способ по пп.27 и 29, отличающийся тем, что синтетический сахаридсодержащий полимер дополнительно содержит олигосахарид, который переваривается ферментами ободочной кишки и устойчив в ферментах желудка и тонкой кишки.
31. Способ по п.30, отличающийся тем, что в качестве олигосахарида сахаридсодержащий полимер содержит целлобиозу, лактулозу, рафинозу и стахиозу.
32. Способ по п.22, отличающийся тем, что в сахаридсодержащей матрице используют модифицированный полимер сахаридсодержащего природного полимера.
33. Способ по пп.27 и 32, отличающийся тем, что в качестве природного сахаридсодержащего полимера используют мукополисахарид.
34. Способ по пп.27 и 32, отличающийся тем, что в качестве природного сахаридсодержащего полимера используют модифицированный природный полимер, которым является поперечносвязанный хондроитинсульфат.
35. Способ по п.27, отличающийся тем, что в качестве лекарственного средства в нем используют индометацин.
36. Способ по п.35, отличающийся тем, что в качестве природного сахарида в нем используют металлическую соль пектина.
37. Способ по п.36, отличающийся тем, что в качестве металлической соли пектина в нем используют кальциевую соль.
38. Способ по п.27 и 32, отличающийся тем, что лекарственное средство содержит противовоспалительное вещество.
39. Способ по п.38, отличающийся тем, что в качестве противовоспалительного вещества используют нестероидное противовоспалительное вещество.
40. Способ по п.38, отличающийся тем, что противовоспалительное вещество является стероидным противовоспалительным веществом.
41. Способ по пп.37 и 32, отличающийся тем, что используемое лекарственное средство выбрано из группы, состоящей из дексаметазона, будезонида, беклометазона, флуктиказона, тиоксокортала и гидрокортизона.
42. Способ по пп.27 и 32, отличающийся тем, что используемое лекарственное средство является циклоспорином.
43. Способ по пп.27 и 32, отличающийся тем, что используемое лекарственное средство выбрано из группы, состоящей из тиофилина, нифедипина, изосорбиддинитрата и оксипренолона.
44. Способ по пп.27 и 32, отличающийся тем, что используемое лекарственное средство является спазмолитическим веществом для лечения синдрома раздраженной толстой кишки.
45. Способ по п.44, отличающийся тем, что используемое в нем лекарственное средство является циметропбромидом.
46. Способ по пп.27 и 32, отличающийся тем, что используемое в нем лекарственное средство является противоопухолевым препаратом.
47. Способ по п.46, отличающийся тем, что противоопухолевый препарат выбран из группы, состоящей из метотрексата, тамоксифена, циклофосфамида, меркаптопурина и этопозида.
Текст
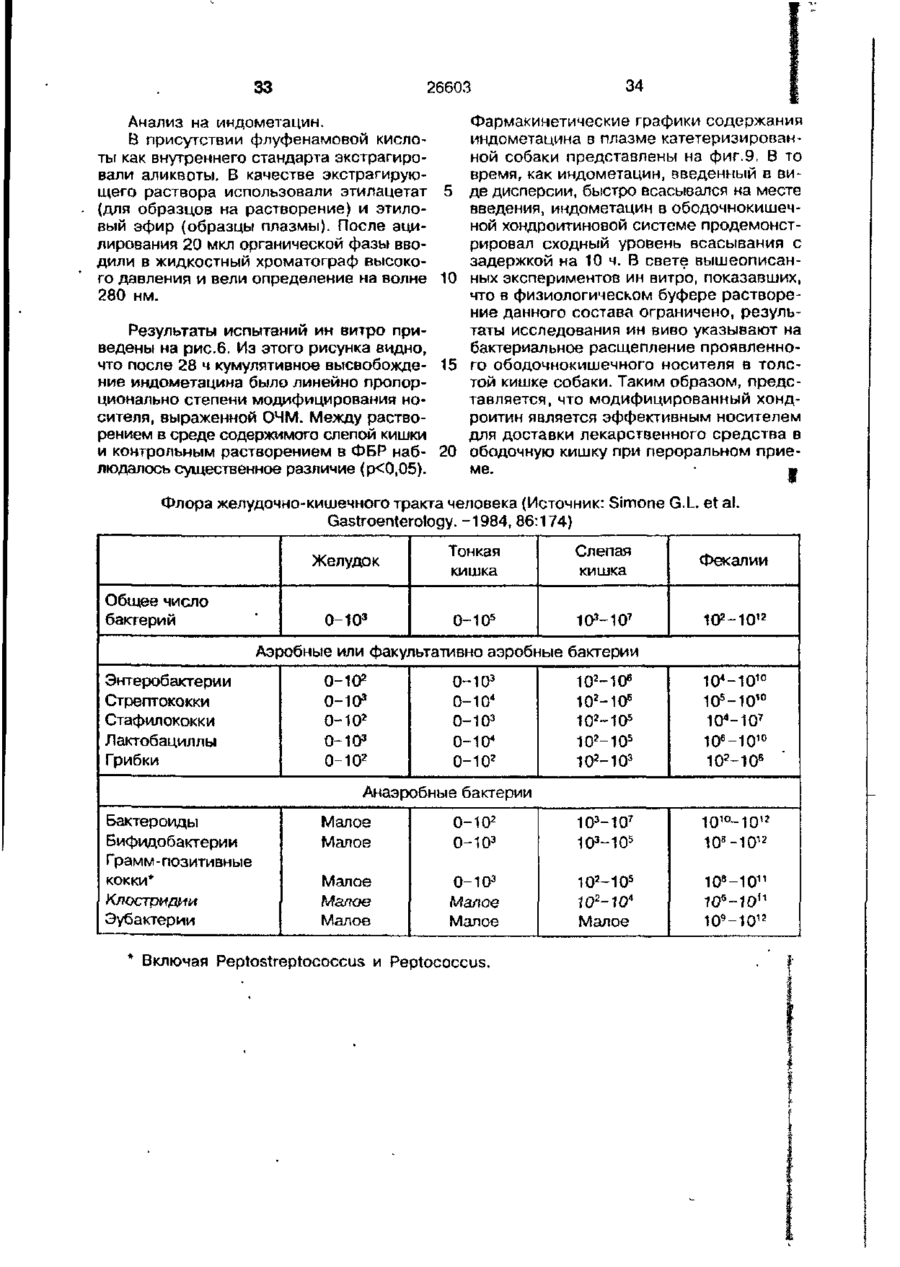
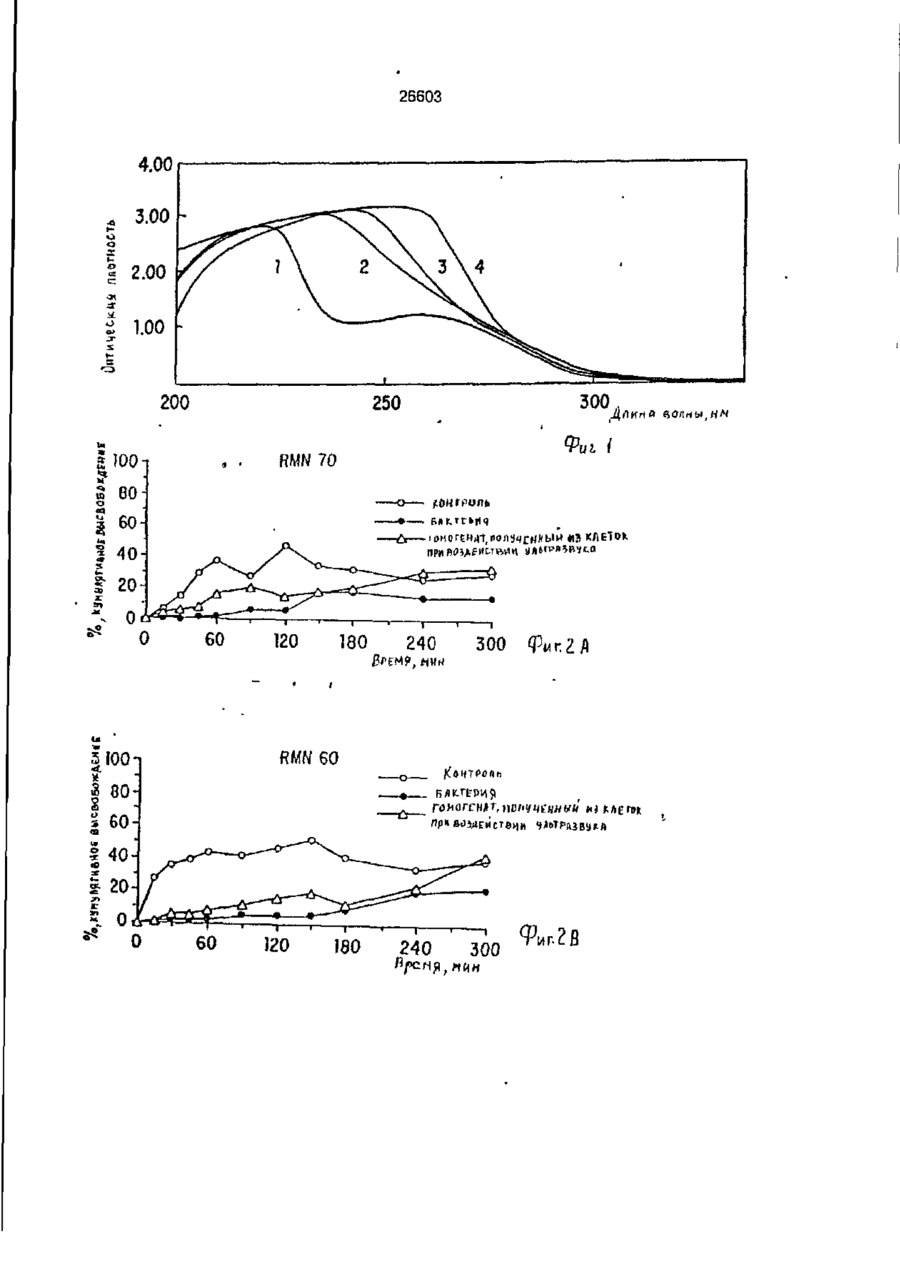
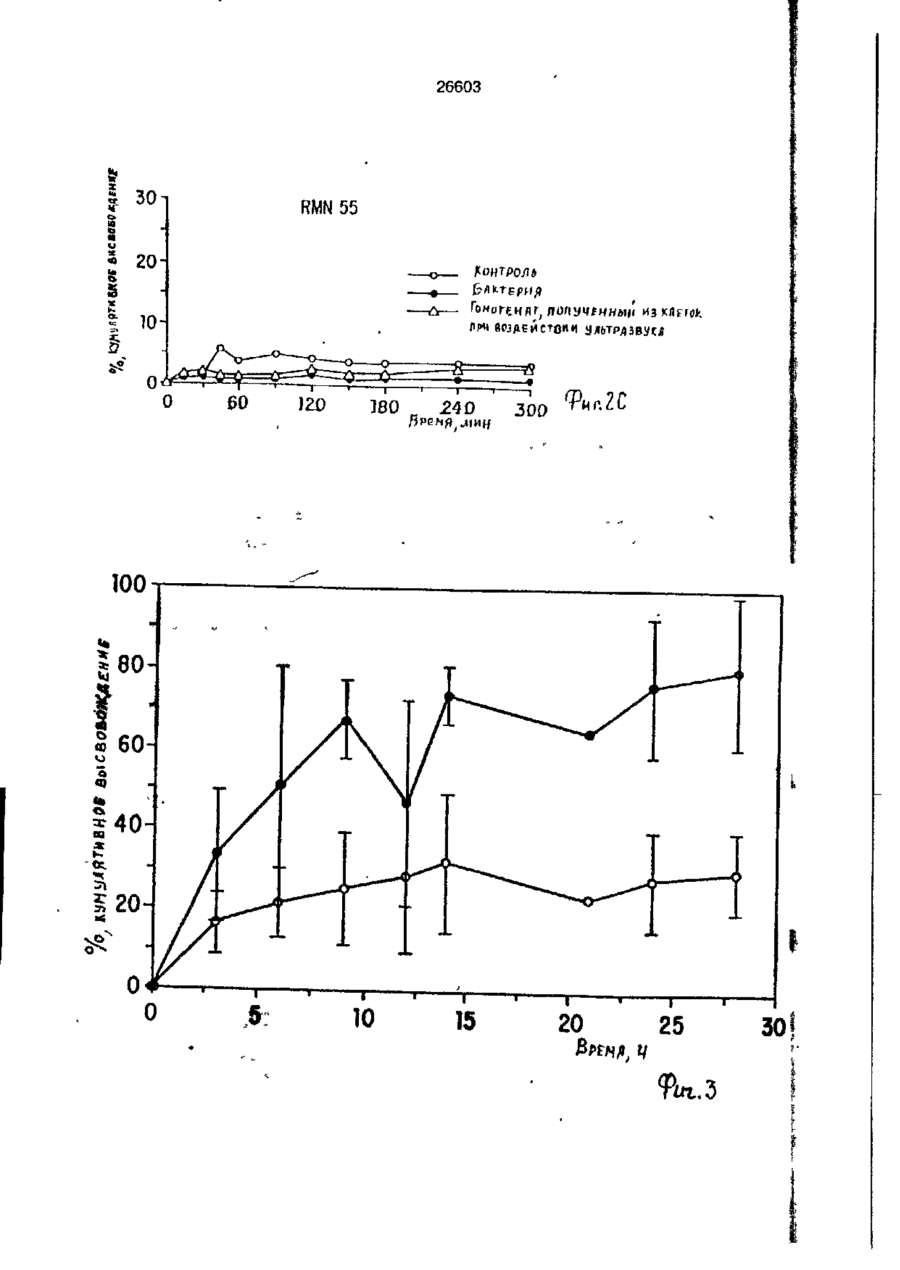
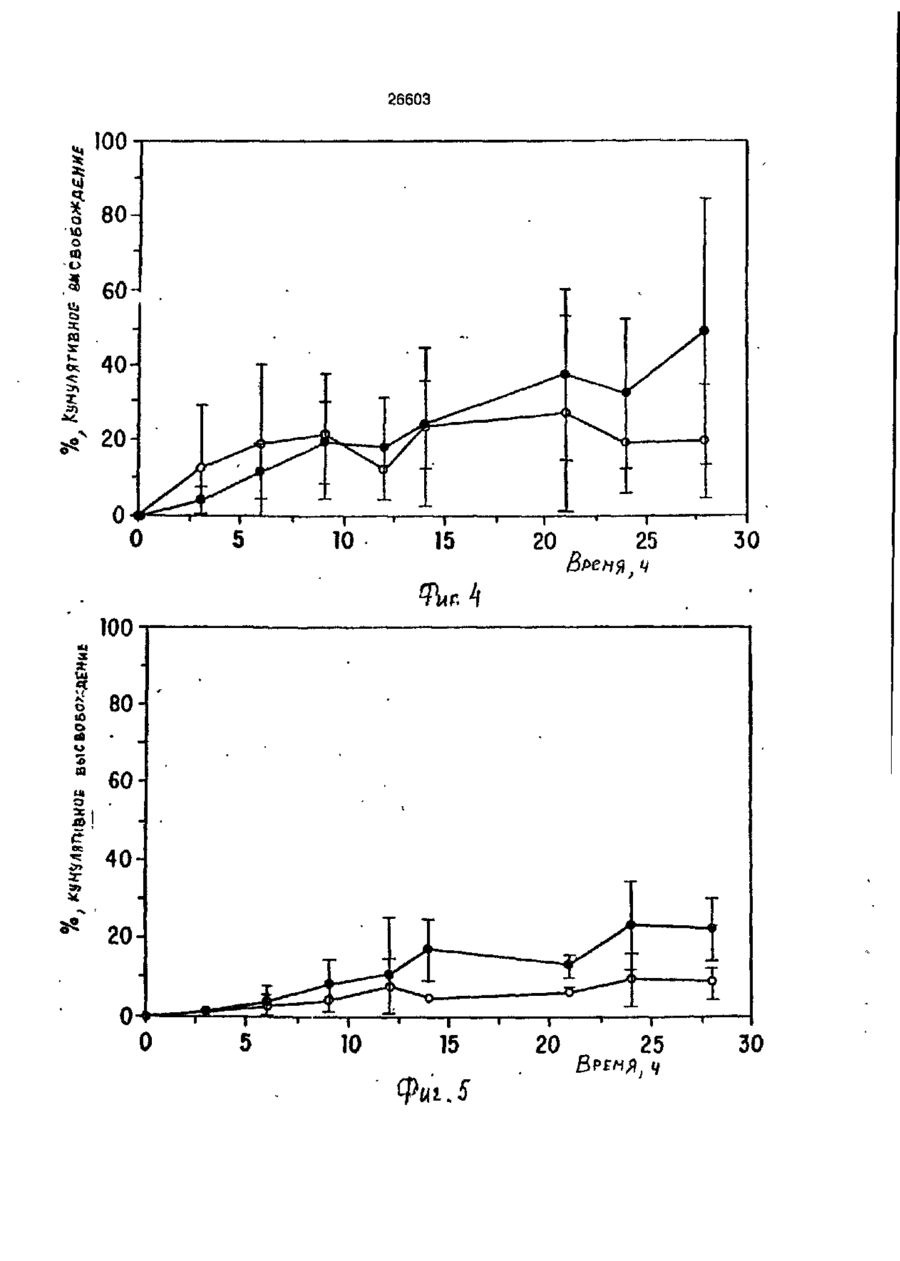
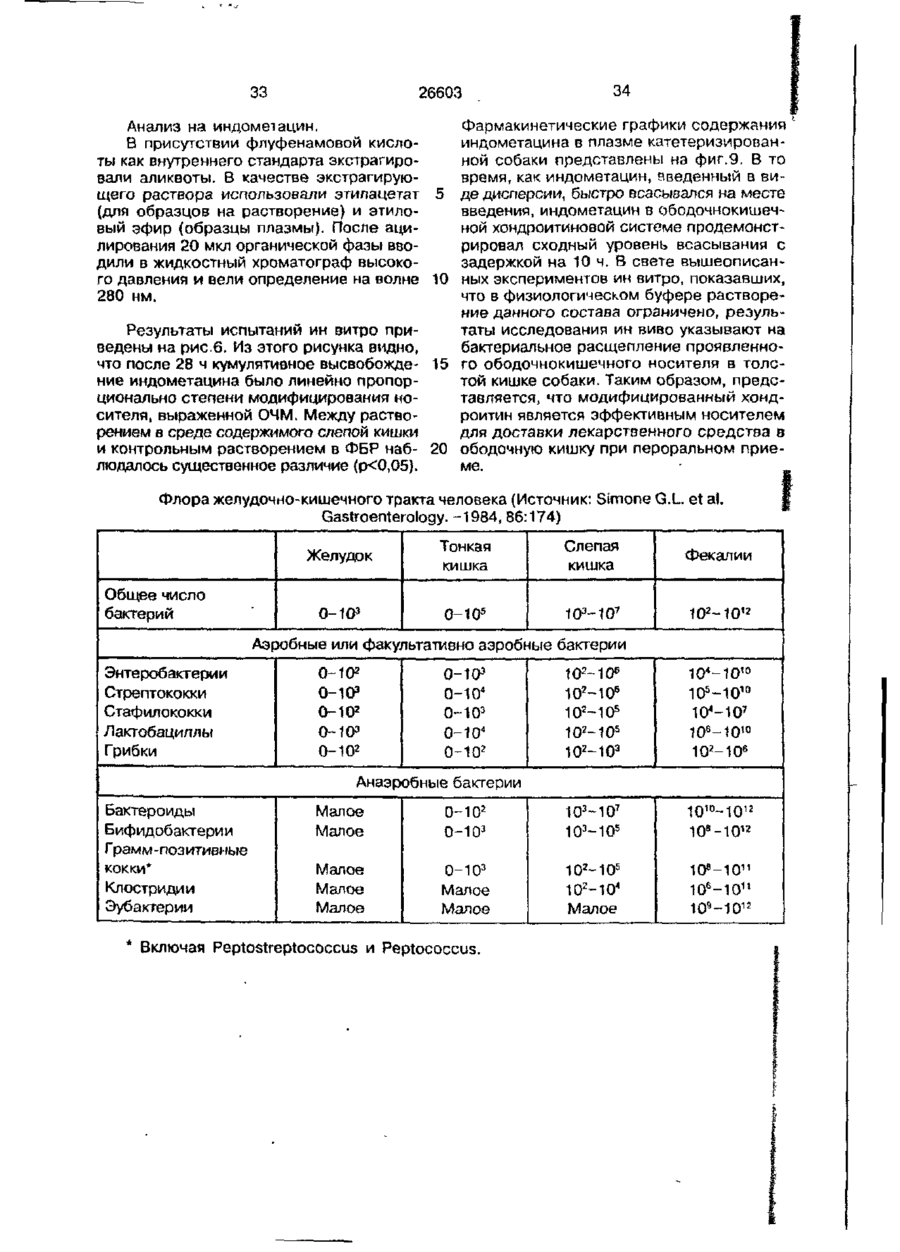
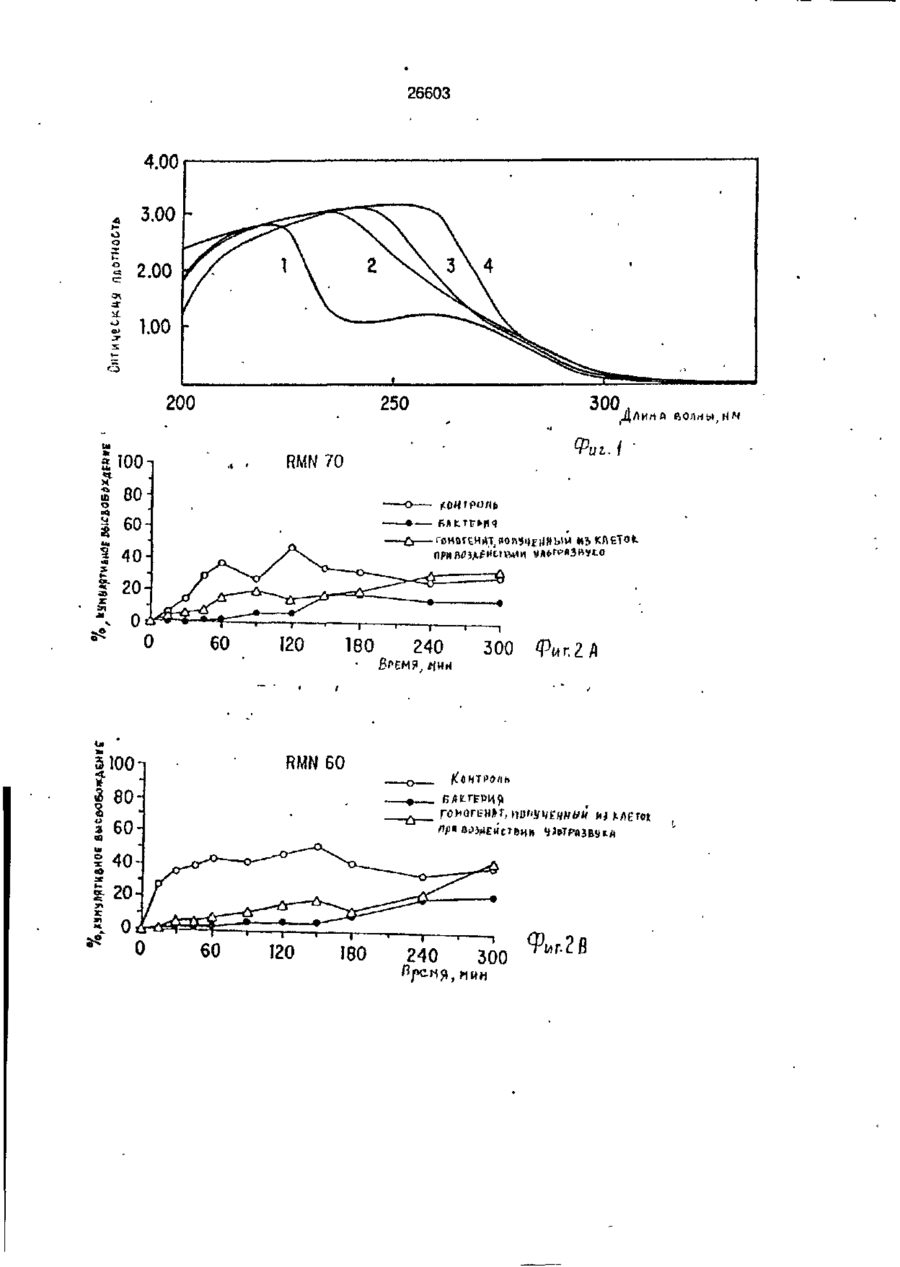
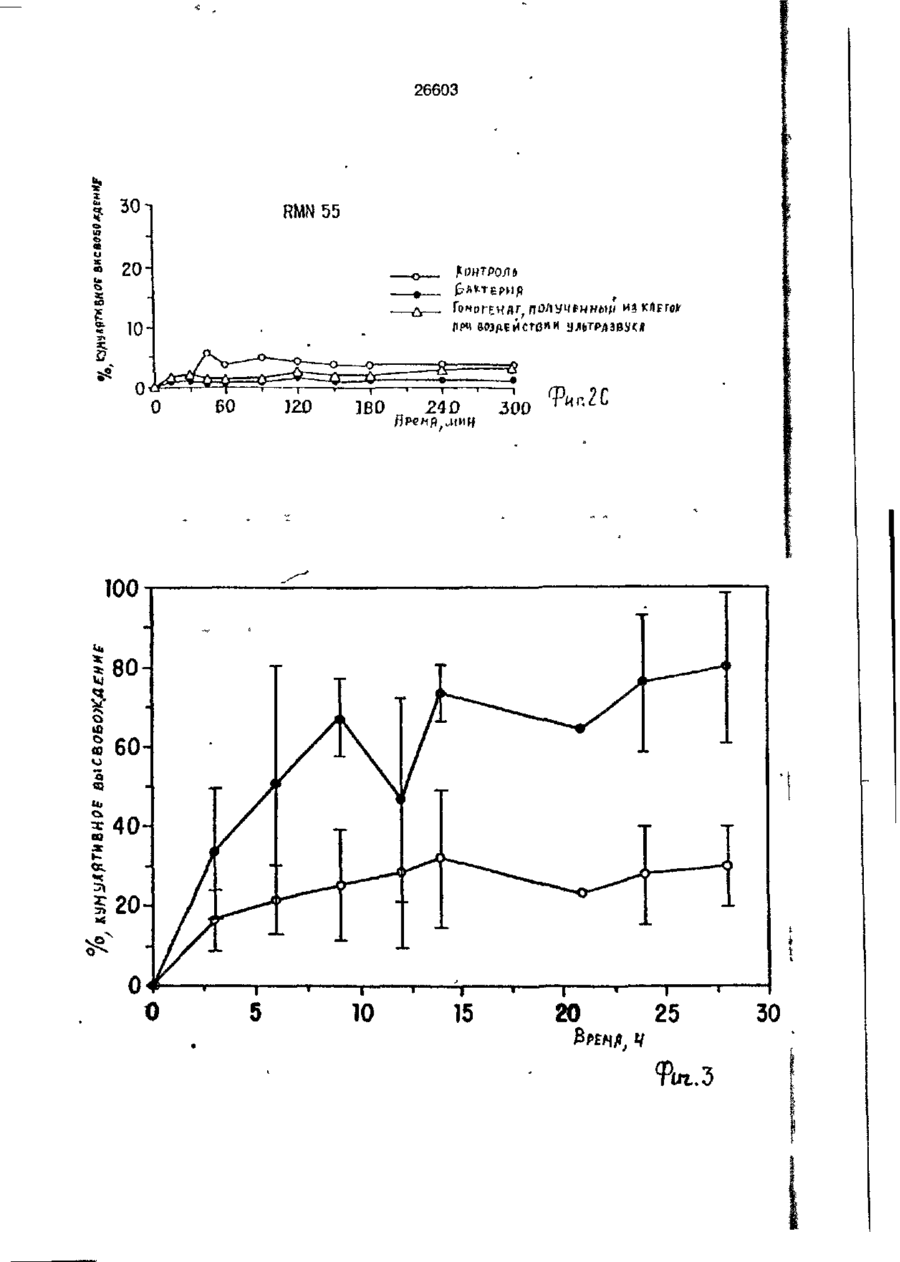
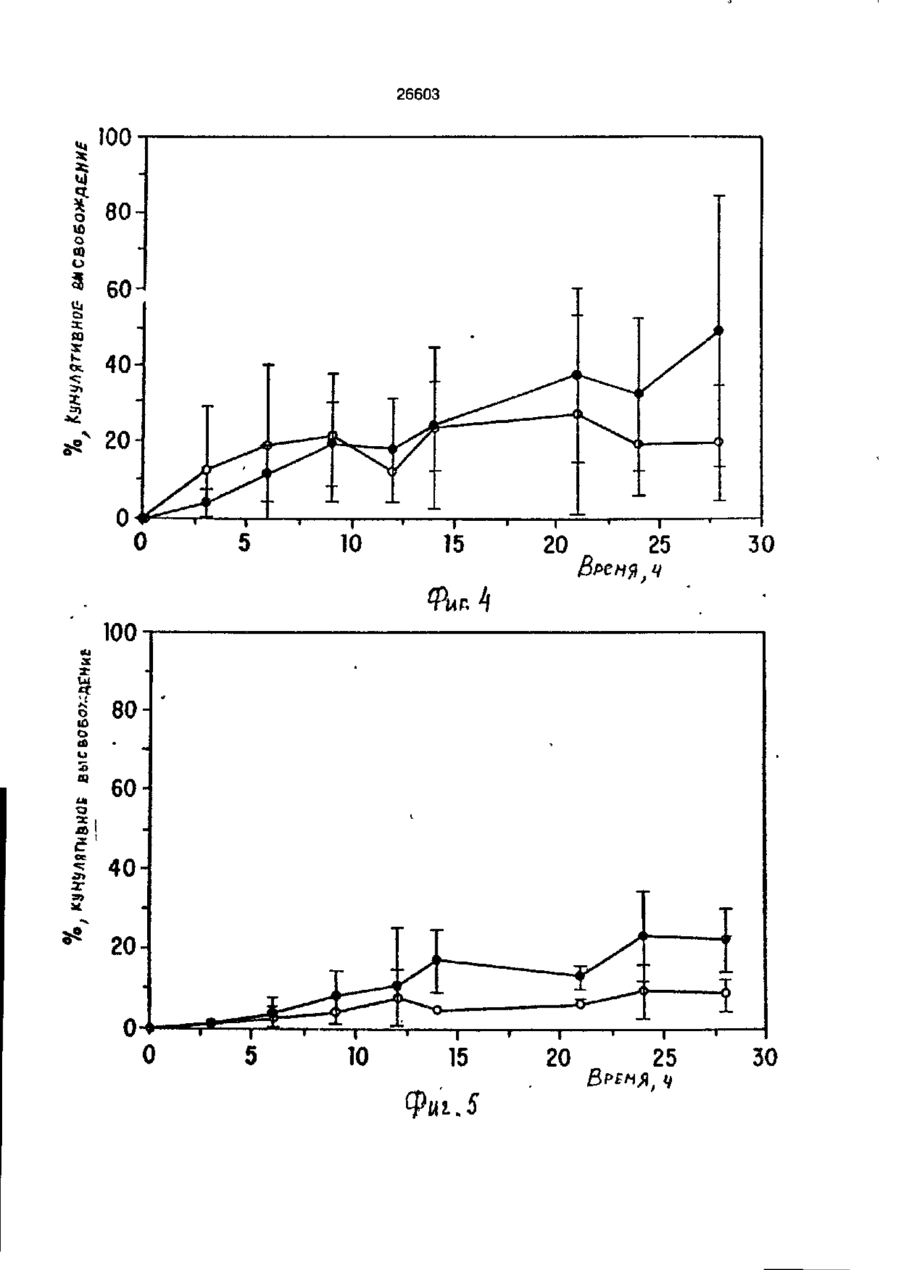
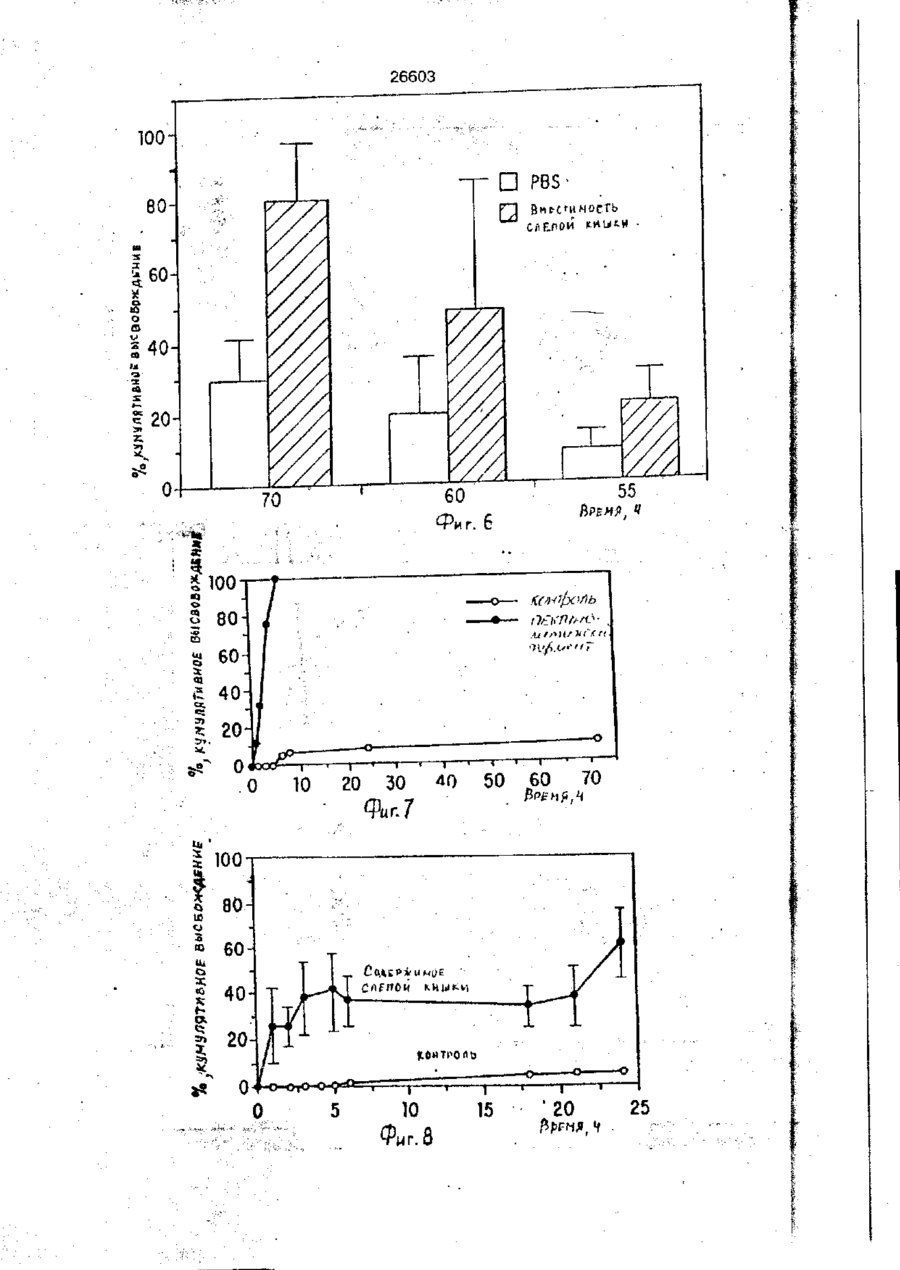
УКРАЇНА (19) UA S (II) 26603 „„ С1 (5І>6 А 61 К 9/50 ДЕРЖАВНЕ ПАТЕНТНЕ ВІДОМСТВО ОПИС ДО ПАТЕНТУ НА ВИНАХІД (54) ФАРМАЦЕВТИЧНА ФОРМА ДЛЯ ПЄРОРАЛЬНОГО ВВЕДЕННЯ В ОБОДОВУ КИШКУ ЛІКАРСЬКОГО ЗАСОБУ, СПОСІБ її ВВЕДЕННЯ, СПОСІБ ОТРИМАННЯ МОДИФІКОВАНОГО ХОНДРОІТИНСУЛЬФАТУ, СПОСІБ ОТРИМАННЯ МОДИФІКОВАНОГО ПЕКТИНУ 1 (21) 93002243 (22) 02.05.91 (24) 11.10.99 (31) 07/518.714 (32) 04.05.90 (33) US (85) 28.10.93 (86) PCT/US91/03014 (02.05.91) * ' (46) 11.10.99. Бюл. № 6 (56) 1. US № 4851231А2 (ALZA Corporation), кл. А 61 К 9/50, 1989. 2. SU № 1535369А1 (Эдьт Дьёдьсерведьесети Дьяр), кл. А 61 К 9/50, 1990. (72) Сінтов Амнон (II), Рубінштєйн Абрахам (IL) (73) ИССУМ РІСЕРЧ ДІВЕЛОПМЕНТ КОМПАНІ ОФ ДЗЕ ХЕБРЮ ЮНІВЕРСІТІ ОФ ІЄРУСАЛІМ (US), ПЕРЮ ПРОДАКТС ЛТД (U-) (57) Фармацевтическая форма для перорального введения в ободочную кишку лекарственного средства, нерастворяющегося в ферментах желудка и тонкой кишки, включающая лекарственное средство в матрице из полимерного вещества, о тличающаяся тем, что в качестве полимерного вещества она содержит сахари дсодержащий полимер. 2. Фармацевтическая форма по п.1, о т л и ч а ю щ а я с я тем, что сахаридсодержащий полимер является синтетическим полимером. 3. Фармацевтическая форма по пп.1 и 2, о т л и ч а ю щ а я с я тем, что синтетический сахаридсодержащий полимер является метакриловым полимером. 4. Фармацевтическая форма по пп.1 и 3, о т л и ч а ю щ а я с я тем, что синтетический сахаридсодержащий полимер дополнительно содержит олигосахарид, который переваривается фермента ми ободочной кишки и устойчив в ферментах желудка и тонкой кишки. 5. Фармацевтическая форма по п.4, о т л и ч а ю щ а я с я тем, что в качестве олигосахарида она содержит целлюлозу, лактулозу, рафинозу и стахиозу. 6. Фармацевтическая форма по п.1, о т л и ч а ю щ а я с я тем, что указанная матрица содержит модифицированный полимер сахаридсодержащего природного полимера. 7. Фармацевтическая форма по пп.1 и 6, о т л и ч а ю щ а я с я тем, что в качестве природного сахаридсодержащего полимера она содержит мукополисахарид. 8. Фармацевтическая форма по пп.1 и 6, о т л и ч а ю щ а я с я тем, что в качестве природного сахаридсодержащего полимера она содержит модифицированный природный полимер, которым является поперечно-связанный хондроитинсульфат. 9. Фармацевтическая форма по п.1, о т л и ч а ю щ а я с я тем, что в качестве лекарственного средства она содержит индометацин. 10. Фармацевтическая форма по п.7, о т л и ч а ю щ а я с я тем, что в качестве природного сахарида она содержит металлическую соль пектина. 11. Фармацевтическая форма по п. 10, о т л и ч а ю щ а я с я тем, что в качестве металлической соли пектина она содержит кальциевую соль. 12. Фармацевтическая форма по п.1 или 6, о т л и ч а ю щ а я с я тем, что указанное лекарственное средство содержит противовоспалительное вещество. с > KJ о о 26603 13. Фармацевтическая форма по п.12, о т л и ч а ю щ а я с я тем, что в качестве противовоспалительного вещества используют нестероидное противовоспалительное вещество. 14. Фармацевтическая форма по п. 12, о т л и ч а ю щ а я с я тем, что указанное противовоспапительное вещество является стероидным противовоспалительным веществом. 15. Фармацевтическая форма по п.1 или 6, о т л и ч'а ю щ а я с я тем, что указанное лекарственное средство выбрано из группы, состоящей из дексаметазона, будезонида, беклометазона, флуктиказона, тиоксокортала и гидрокортизона. 16. Фармацевтическая форма по п.1 или б, о т л и ч а ю щ а я с я тем, что указанное лекарственное средство является циклоспорином. 17. Фармацевтическая форма по п.1 или 6, о т л и ч а ю щ а я с я тем, что указанное лекарственное средство выбрано из группы, состоящей из теофилина, нифедипина, изосорбиддинитрата и оксипренолола. 18. Фармацевтическая форма по п.1 или 6, о т л и ч а ю щ а я с я тем, что указанное лекарственное средство является спазмолитическим веществом для лечения синдрома раздраженной толстой кишки. 19. Фармацевтическая форма по п.18, о т л и ч а ю щ а я с я тем, что указанное лекарственное средство является циметропбромидом. 20. Фармацевтическая форма по п.1 или 6, о т л и ч а ю щ а я с я тем, что указанное лекарственное средство является противоопухолевым препаратом. 21. Фармацевтическая форма по п.20, о т л и ч а ю щ а я с я тем, что указанный противоопухолевый препарат выбран из группы, состоящей из метотрексата, тамоксифена, циклофосфамида, меркаптоцурина и этопозида. 22. Способ получения модифицированного хондроитинсульфата путем модификации хондроитинсульфата с реакционной средой, содержащей алифатическую соль диамина в органическом растворителе в течение времени, достаточном для модифицирования хондроитинсульфата с последующим отделением его путем диализа, о т л и ч а ю щ и й с я тем, что модификацию хондроитинсульфата в реакционной среде ведут в присутствии катализатора и дополнительно после отделения его проводят лиофилизацию, а в ка честве алі%-Ьтической соли диамина используют 1,4-бутандиамин или 1,6-гександиамин или 1,7-гептандиамин или 1,12додекандиамин. 23. Способ по п.22, о т л и ч а ю щ и й с я тем, что в качестве органического растворителя используют диметилсульфоксид или диметилформамид. 24. Способ по п.22, о т л и ч а ю щ и й с я тем, что в качестве катализатора в нем используют дициклогексилкарбодиимид. * 25. Способ получения модифицированного пектина, включающий введение в водный раствор пектина едкого натра до рН 8,0-9,5, о т л и ч а ю щ и й с я тем, что в водный раствор пектина дополнительно перед введением едкого натра добавляют хлорид металла с последующим осаждением металлической соли пектина в виде осадка, просеиванием его до получения порошка. 26. Способ по п.25, о т л и ч а ю щ и й с я тем, что указанный металл выбран из группы, состоящей из кальция, стронция и магния. 27. Способ перорального введения лекарственного средства в матрице из полимерного вещества ферментационно расщепляющегося в ободочной кишке, о т личающийся тем, что в качестве полимерного вещества используют сахаридсодержащий полимер. 28. Способ по п.27, о т л и ч а ю щ и й с я тем, что сахаридсодержащий полимер является синтетическим полимером. 29. Способ по пп.27 и 28, о т л и чающийся тем, что синтетический сахаридсодержащий полимер является метакриловым полимером. 30. Способ по пп.27 и 29, о т л и ч а ю щ и й с я тем, что синтетический сахаридсодержащий полимер дополнительно содержит олигосахарид, который переваривается ферментами ободочной кишки и устойчив в ферментах желудка и тонкой кишки. 31. Способ по п.30, о т л и ч а ю щийся тем, что в качестве олигосахарида сахаридсодержащий полимер содержит целлобиозу, лактулозу, рафинозу и стахиозу. 32. Способ по п.22, о т л и ч а ю щ и й с я тем, что в сахариде о держа щей матрице используют модифицированный полимер сахаридсодержащего природного полимера. 33. Способ по пп.27 и 32, о т л и ч а ю щ и й с я тем, что в качестве 26603 природного сахаридсодержащего полимера используют мукополисахарид. 34. Способ по пп.27 и 32, о т л и ч а ю щ и й с я тем, что в качестве природного сахаридсодержащего полимера используют модифицированный природный полимер, которым является поперечносвязанный хондроитинсульфат. 35. Способ по п.27, о т л и ч а ю щийся тем, что в качестве лекарственного средства в нем используют индометацин. 36. Способ по п.35, о т л и ч а ю щийся тем, что в качестве природного сахарида в нем используют металлическую соль пектина. 37. Способ по п 36, о т л и ч а ю щ и й с я тем, что в качестве металлической соли пектина в нем используют кальциевую соль. 38. Способ по п.27 и 32, о т л и чающийся тем, что лекарственное средство содержит противовоспалительное вещество. 39. Способ по п.38, о т л и ч а ю щ и й с я тем, что в качестве противовоспалительного вещества используют нестероидное противовоспалительное вещество. 40. Способ по п.38, о т л и ч а ю щ и й с я тем, что противовоспалительное вещество является стероидным противовоспалительным веществом. 41. Способ по пп.37 и 32, о т л и чающийся тем, что используемое лекарственное средство выбрано из группы, состоящей из дексамьтазона, будезонида, беклометазона, флуктиказона, тиоксокортала и гидрокортизона. 42. Способ по пп.27 и 32, о т л и ч а ю щ и й с я тем, что используемое лекарственное средство является циклоспорином. 43. Способ по пп.27 и 32, о т л и ч а ю щ и й с я тем, что используемое лекарственное средство выбрано из группы, состоящей из тиофилина, нифедипина, изосорбиддинитрата и оксипренолона. 44. Способ по пп.27 и 32, о т л и чающийся тем, что используемое лекарственное средство является спазмолитическим веществом для лечения синдрома раздраженной толстой кишки, 45. Способ по п 44, о т л и ч а ю щ и й с я тем, что используемое в нем лекарственное средство является циметропбромидом. 46. Способ по пп 27 и 32, о т л и чающийся тем, что используемое в нем лекарственное средство является противоопухолевым препаратом, 47. Способ по п.46, о т л и ч а ю щ и й с я тем, что противоопухолевый препарат выбран из группы, состоящей из метотрексата, тамоксифена, циклофосфамида, меркаптопурина и этопозида. ІГ Изобретение относится к фармацевтической форме для энтерального введения в толстую кишку лекарственного препарата, способу введения лекарственного средства, способу получения матриц для 5 такой формы. Известно, что специальная доставка лекарственных средств и фармацевтических препаратов в ободочную кишку важна для лечения широкого спектра заболева- 10 ний толстой кишки. Целенаправленная доставка лекарственных средств в ободочную кишку дает возможность лечить заболевания локально, избегая тем самым системного действия лекарственных 15 средств или неприятного и болезненного введения лекарственных средств через ободочную кишку. Более того, необходимость в доставке в ободочную кишку лекарственных средств, таких как стероиды, которые всасываются в ободочной кишке, растет, поскольку это повышает их эффективность и дает возможность снизить величину эффективных доз (Godbillon Ir. et al// Br. J.CIm. Pharmacol. - 1985, 19; 113S; Antonin K.H. et al// Br.J.Clin. Pharmacol. 1985, 19: 137S; Fara. J.W. 3-rd International Conference on Drug Absorbtton. Ediburgh, 1988; Rubinstein A., Biopharm. Drug Dispos. - 1990, 11: 465-475). Целенаправленная доставка лекарственных средств в нужные места пищеварительного тракта может быть затруднена. Особенно трудно достигнуть ободочной кишки из-за ее дистального расположения в пищеварительном тракте. При разработке перорально вводимых систем доставки в ободочную кишку необходимо принимать во внимание такие факторы, как рН пищеварительного тракта и 26603 8 "спускового механизма". Патент США № присутствие ферментов в желудке и тон4627850 (Deters et al.) раскрывает осмокой кишке. тическую капсулу для доставки с контроПри современных способах целенаплируемой скоростью лекарственного равленной доставки лекарственных средств а ободочную кишку твердые сос- 5 -средства, состоящую из наружной и внутренней стенок, отформованных из разтавы из молекул желаемого лекарственного средства покрываются полимерной личных полимерных материалов; внутреноболочкой, стойкой к рН среды. Такие няя стенка образует пространство, в косоставы похожи на энтеральные покрытором находится лекарственное средство, тые составы, которые могут использоваться 10 причем через стенки проходит отверстие, для доставки лекарственных средств є диссоединяющее внешнее по отношению к тальную подвздошную кишку. В число энтенаружной стенке пространство с простральных покрытий входят био де градируюранством, внутренним по отношению к щие полимеры, такие как шеллак и фтавнутренней стенке. Патент США № лат ацетатцеллюлозы (Levine et al, 15 4904474 (Theeuwes et al) раскрывает устGastroenterology, - 1987, 92. 1 037 - 1044), ройство доставки лекарственного средства в ободочную кишку, включающее В отличие от энтеральных покрытых средства задержки доставки в лекарстсоставов, составы для доставки в ободочвенное средство и в тонкую кишку [видиную кишку разработаны так, чтобы выдер- 20 мо, в оригинале опечатка и должно быть: живать как низкие, так и слабощелочные средства задержки доставки лекарствен{около семи) величины рН в течение несного средства в желудок и тонкую кишку кольких часов. Считается, что за это вре- прим.переводчика] и средства доставки мя они должны лройти желудок, тонкую лекарственного средства в ободочную кишкишку и достигнуть толстой кишки, где 25 ку. Указанное устройство включает осмопокрытие разрушается и начинается протические средства, принуждающие лецесс высвобождения лекарственного карственное средство покинуть полость, в средства. Подобным образом в ободочкотором оно содержится, через имеющий-ную кишку доставлялись такие лекарстся в этой полости проход в ободочную венные средства, как 5-амино-салицило- 30 кишку. Фактически средствами задержки вая кислота (5-АСК) и некоторые стероидоставки в желудок или в тонкую кишку ды. являются покрытия, устойчивые к рН среОбычно используемые для этих целей ды. Задержка доставки лекарственного полимеры являются производными акрисредства осуществляется на основе факловой кислоты либо производными цел- 35 тора времени: конструкция рассчитана так, люлозы, такими как фталат ацетатцеллючтобы содержимое внутренней полости, лозы или этилцеллюлоза (Rasmussens S.N. заполненное лекарственным средством, не et at. Gastroenterology: - 1982, 83: 1 062; покидало устройство до того момента, когLevine D S. et al. Gastroenterology. - 1987, да оно достигнет заранее выбранного 92: 1 037; Mardmi H. et a! , Gut. 1987, 28: 40 участка желудочно-кишечного тракта. Один 1 084 - 1 089). Однако существенным из недостатков этих устройств заключаетограничением такого способа является ся в том, что если передвижение устнеопределенность места и среды, в которойства по желудочно-кишечному тракту рых покрытие начинает разрушаться. В будет задержано в какой-то части тракта, зависимости от особенностей желудочно- 45 например, по механическим причинам, лекишечной перистальтики, которая может карственное средство все равно будет высменяться в широких пределах от пациента вобождено после того, как пройдет устак пациенту, и различных стадий болезни, новленное время и вне зависимости от разрушение покрытия может начаться глутого, что нужный участок так и не был боко в ободочной кишке либо в тонкой 50 достигнут. кишке. Присутствие жирных кислот с коВ качестве альтернативного способа роткой цепью, диоксида углерода и друдоставки лекарственных средств в обогих продуктов ферментации, а также радочную кишку исследовалась способность дикалов желчной кислоты часто понижает флоры ободочной кишки разрушать субстрН ободочной кишки примерно до шести 55 раты, устойчивые к пищеварению в тон(Stevens C.E., Amer. J.Chn. Nutr. - 1978, кой кишке. Такой принцип использовался 31: S161; McNeil N.I. et al. Gut. - 1987, 28: для доставки слабительных средств, в ос707). Это изменение рН ставит под вопновном сеннозида и связанных с ним соерос использование более высокого знадинений Концентрированный экстракт сенчения рН ободочной кишки в качестве ны (александрийского листа) содержит 26603 производные антрацена, которые существуют в форме гликозидов и могут гидролизоваться до антрахинонов, антранолов и оксантронов. По сравнению с не содержащими сахар аглюконами, сеннозиды гораздо более эффективны в качестве слабительных средств тогда, когда они вводятся в интактном виде, возможно, потому, что сахарная часть молекулы обеспечивает защиту от разрушения в тонкой кишке (Fairbairn, T.W., J. Pharm. Pharmacol. - 1949, 1: 683). Хардкастл и Уилкинс (Hardcastle and Wilkins) показали, что при введении сеннозидов непосредственно в ободочную кишку никакого слабительного эффекта не наблюдалось в отличие от случая введение тех же соединений, предварительно инкубированных с фекалиями или E.coti. Утверждалось, что бактерии высвобождают свободные антрахиноны, которые стимулируют перистальтику ободочной кишки за счет локального воздействия на мышечные сплетения кишечника (Hardcastle J.D. et al. Gut - 1970, 11: 1038). Бактерии могут действовать и на фенольное слабительное сулисатин, в котором два фенола этерифицированы серой, Отсутствие активности арилсульфатаэы в слизистой оболочке тонкой кишки дает возможность лекарственному средству в интактном виде достигнуть ободочной кишки, где бактерии превращают его в активные окси- и диокси-производные. Этим он отличается от эфира уксусной кислоты в бисакодиле (производном дифенилметана), который легко расщепляется эстеразой в тонкой кишке до активного метаболита, который, в свою очередь, стимулирует секрецию воды и электролита из слизистой оболочки ободочной кишки и вызывает перистальтику кишечника (Cummings J.H. Gut - 1974, 15: 758; Moreto М. et al. Arzneim Forsch./Drug Res. - 1979, 29: 1 561; Gullikson G.W. et al. Pharmacology of Intestinal Permeation If, Csacy T.Z. (ed), Springer - Verlag. Heidelberg. - 1984, p. 419). Симпкинс с соавторами сделал сравнение способности антинаркотических средств налоксона и налмефена и их сопряженных глюкуронидов вызывать диарею у морфинзависимых крыс (у этих животных мозг чувствителен к антинаркотическим средствам, поэтому эти животные полезны при биологических испытаниях антинаркотических средств, предназначенных для локального высвобождения в ободочной кишке) Пероральное введение указанных двух лекарственных средств выз 5 10 15 20 25 30 35 40 45 50 55 10 вало диарею, реакцию абстиненции и изменение температуры кожи хвоста в первые 15 мин, а при введении сопряженных глюкуронидов обоих этих знтинаркотических средств диарея наступала позже на 1-3 ч, что отражает время, необходимое для достижения дистальной подвздошной кишки. Прямое введение в ободочную кишку глюкуронидов налоксона и налмефана вызывало диарею через 5-8 мин. Было предположено, что фармакологическая реакция на сопряженные глюкурониды налоксона и налмефена инициировалась бактериальными р-глюкуронидазами в ободочной кишке крыс. Было установлено, что гидролиз глюкуронидов лекарственных средств специфичен к бактериальной активности в ободочной кишке, поскольку глюкурониды были неактивными при подкожном введении (Simpkins J.W. et al. J. Pharmacol, Exp. Ther. - 1988, 244: 195). Лекарственным средством, традиционно применяемым для лечения воспалительной болезни кишечника, является сульфасалазин. Сульфасалазин состоит из антибактериального сульфапиридина, подсоединенного к противовоспалительной 5АСК через азосвязь. Когда в 1941 г. впервые появилось это лекарственное средство, считалось, что терапевтическое действие сульфасалазина определялось главным образом сульфагруппой. Позднее было установлено, что клинический эффект определяется 5-АСК, а сульфапиридин вызывает большую часть побочных эффектов этого лекарственного средства (Khan A.K. et al. Lancet, - 1977, 2: 892)- Фактически сульфасалазин является пролекарством, которое переносит в ободочную кишку активную 5-АСК, где бактериальное азовосстановление высвобождает молекулы с желаемыми терапевтическими свойствами (Kiotz U , Clin. Pharmacokin. 1985, 10: 285). Основываясь на понимании способа действия сульфасалазина, было разработано второе поколение сульфасалазина: азодисалицилат и салицилазобензойная кислота. Азодисалицилат состоит из двух 5-АСК молекул, причем аминогруппы этих двух молекул соединены через азогруппу. При восстановлении бактериями, ободочной кишки азодисалицилат выделяет двойное количество 5-АСК, причем при этом избегается нежелательное побочное действие сульфапиридина (Willoughby СР. et al. Gut. - 1982, 23: 1 081; Bartalsky A. Lancet. - 1982, 1: 960). Пролекарства на основе 5-АСК, включая сульфасалазин, азодисалицилат и салицилазобензойную кислоту, используют 11 26603 несколько иную, чем классическая, концепцию доставки пролекарством в той части, что высвобождение исходного лекарственного вещества способствуют скорее бактеризльные ферменты, сосредоточенные в целевом органе, чем бактериальные ферменты целевых тканей. Понимание того, что ферменты, характерные для микроорганизмов, населяющих ободочную кишку, могут превращать пролекарства и другие молекулы в активные терапевтические средства, привело к усилению исследовательской активности в области микробиологически контролируемой доставки лекарственных средств в ободочную кишку. О модифицированном способе доставки 5-АСК в ободочную кишку сообщили Браун, Паркинсон и их соавторы, которые с целью исключить эффекты от сульфапиридиновой фракции подсоединили сульфасалазин через азогруппу к основной цепи высокомолекулярного полимера. Было показано, что полученный в результате этого воднорастворимый полимер высвобождал 5-АСК в присутствии анаэробных слепокишечных бактерий 5 10 15 20 25 крыс. Фармакинетический анализ уровней 5АСК после перорального введения этого полимерного пролекарства крысам показал схожую доставку 5-АСК и метаболитов в нижние отделы кишечника, кровь и мочу. Фармодинамический анализ, основанный на количественных гистопатологических данных, показал, что этот полимер также уменьшает неспецифическую язвенную колитоподобную воспалительную реакцию в морских свинках, которая вызывается каррагеном. Было установлено, что эта фармакодинамическая реакция равна той, которая достигается при прямом введении 5-АСК, и превосходит реакцию на сульфасалазин (Brown J.P. et at. J.Med.Chem. - 1983, 26: 1 300). Френд и Чанг гликозилировали избранные стероидные лекарственные средства, которые повсеместно применяются для лечения воспалительной болезни кишечника (гидрокортизон, преднизолон, дексаметазон и фторкортизон). Гликозилирование осуществляют с использованием галактозы, глюкозы и целлобиозы, о которых известно, что они служат субстратами для бактерий ободочной кишки (Cummings J.H. et al. Amer. J.Ciin. Nutr. 1987, 45: 1 243). Пролекарства на основе гликозида инкубируют вместе с гомогенатами содержимого различных отделов пищеварительного тракта крыс. Было обна 30 35 40 45 50 55 12 ружено, что в желудке, проксимальной и дистальнои подвздошной кишках скорость гидролиза всех пролекарств относительно небольшая. В гомогенатах содержимого слепой кишки скорость гидролиза была выше. Авторы пришли к выводу, что доставка пролекарств на основе гликозида в ободочную кишку зависит от различных скоростей гидролиза в разных отделах п^цеварительного тракта, различного времени прохождения через эти отделы, а также коэффициента распределения октанола и воды в этих пролекарствах. Так, более быстрое время прохождения верхних отделов желудочно-кишечного тракта в сочетании с меньшей наблюдаемой скоростью деградации и медленное прохождение через слепую кишку, в которой деградация идет относительно быстрее, говорит о потенциальной возможности использования пролекарств на основе гликозида для лечения болезни толстой кишки (Friend D.R. et al. J. Med.Chem. - 1985, 28: 51). Наличие в азоароматических соединениях ковалентных функциональных групп, подверженных расщеплению бактериями ободочной кишки, недавно было использовано Саффраном с коллегами (Satfran, М. et al. Science. - 1986, 233: 1 081; Saffran M. et al., J.Pharm. Sci. - 1988, 77: 33). Исходя из предположения, что дистальная часть тонкой кишки и ободочная кишка являются предпочтительными местами кишечного всасывания протеиновых лекарственных средств, твердые лекарственные формы инсулина и лизинвазопрессина (таблетки и желатиновые миникапсулы) были покрыты сополимерами стирола и оксиэтилметакрилата, поперечносвязанными с дивинилазобензолом. Предполагалось, что этот полимер способен защитить заключенные в него лекарственные средства от пищеварительных ферментов желудка и верхнего отдела тонкой кишки, а в ободочной кишке полимер будет расщеплен. Действительно, при инкубации в фекальном содержи мом крысы или человека в течение восьми дней микроскопическим исследованием была обнаружена перфорация полимерной оболочки. Кроме того, наблюдалась устойчивая фармакологическая реакция на протеиновые лекарственные средства ( антидиурез на лизин-вазопрессин и" гипогликемия на инсулин) при пероральном введении покрытых систем доставки крысам, а затем к собакам {Saffran M., et al., Diabets. - 1989, 385; 81А). 13 26603 Известно о системе доставки противоамебного лекарственно! о средства, основанного на специфическом фагоцитозе носителя со стороны Entamoeba hystolytica, которая локализуется в полости толстой кишки (Mirelman, D.t et a!., S.Infect. Dis. 159(2): 303 (1989)}. Для уничтожения паразитов, обитающих в полости больного человека, было решено ковалентно присоединить маленькие частицы двуокиси кремния к лекарственному средству на основе нитроимидазола. Было обнаружено, что трофозоиты Entamoeba hystolytica активно фагоцитируют эти крошечные частицы и высвобождают связанное лекарственное средство, что приводит к быстрой гибели клеток трофозоитов как ин витро, так и ин виво в хомяках. Несмотря на то, что количество переваренных частиц не превышало 5% их общего числа, утверждалось, что этого оказалось достаточно для того, чтобы большинство трофозоитов погибло в течение 24 ч. В отсутствии амебных трофозоитов высвобождения сколь-нибудь заметного количества ковалентного связанного лекарственного средства не наблюдалось. Несмотря на то, что имеются свидетельства в пользу того, что на основе определенных протеинов и пептидов, таких как интерлейкин-11, интерферон, фактор стимулирования колоний, фактор некроза опухоли и гормон, стимулирующий меланоциты, могут быть созданы новые эффективные средства для лечения болезней, в настоящее время с трудом поддающихся лечению, использование их в качестве лекарственных средств сдерживается способами доставки. Доставка в ободочную кишку может стать предпочтительным путем введения этих и других новых протеиновых и пептидных лекарственных средств. Таким образом, доставка в ободочную кишку важна для целенаправленного введения лекарственных средств в ободочную кишку, особенно для лечения воспалительной болезни кишечника (ВБК) и неспецифического язвенного колита. Однако существующие в настоящее время лекарственные средства для энтерального введения, предназначенные для доставки в ободочную кишку не пригодны дли длительного применения для человека, частично из-за потенциальной токсичности азосоединений. Таким образом, существует потребность в улучшенной системе доставки в ободочную кишку, которая может использоваться совместно с широким диапазоном лекарственных средств и биологически активных соединений. 5 10 15 20 25 30 35 40 45 50 55 14 Настоящее изобретение касается фармацевтической формы для онтсрального введения лекарственного препарата в ободочную кишку; система состоит из лекарственного средства в комбинации с матрицей; указанная матрица состоит из сахаридсодержащего полимера. Фармацевтическая форма лекарственного средства для введения в ободочную кишку по настоящему изобретению основана на способности бактерий ободочной кишки переваривать вещества, которые не были расщеплены в желудке и тонкой кишке, либо были расщеплены лишь в незначительной степени. Фармацевтическая форма для введения лекарственного средства в ободочную кишку по настоящему изобретению служит средством целенаправленного введения энтеральных лекарственных средств в толстую кишку. Когда состав из лекарственного средства и матрицы находится в толстой кишке или в желудке, его лекарственное содержимое защищено матрицей и не подвергается действию ферментов или рН среды этих органов. После того, как состав из лекарственного средства и матрицы достигнет ободочной кишки, бактериальные ферменты расщепляют матрицу, высвобождая тем самым лекарственное средство. Соответственно, субъект, нуждающийся в лечении желаемым лекарственным средством (особенно когда желательно направить это желаемое лекарственное средство в район ободочной кишки указанного субъекта), может с удобством пройти курс лечения путем перорального приема состава по настоящему изобретению. Альтернативно состав по настоящему изобретению может быть выполнен в форме суппозитория. Примерами лекарственных средств, которые могут быть использованы в составе, лекформе и способах по настоящему изобретению, являются пептидные и протеиновые лекарственные средства, такие как анальгетики; пероральные вакцины; пептиды, активирующие ллазминоген; контрацептивные пептиды; пептиды, стимулирующие рост; стероидные лекарственные средства, такие как дексаметазон, будезонид, беклометазон, флуктиткаэон, тиоксокортол и гидрокортизон; протеиновые лекарственные средства, которые могут дольше находиться и лучше всасываться в ободочной кишке, чем в тонкой кишке, такие как LH1RH и инсулин; лекарственные средства, возможность всасывания которых в ободочной кишке доказана, такие как тео 15 26603 филлин, изосорбитдимитрат, инфедипин, оксипренолол; спазмолитические вещества для лечения синдрома раздраженной толстой кишки, такие как циметропбромид; противоопухолевые препараты, такие как метотрексат, тамоксифен, циклофосфамидл, меркаптопурин и этопозид; другие лекарственные средства, такие как циклоспорин; а также моноклональные препараты, содержащие антитела. Кроме того, могут быть предоставлены химиотерапевтические вещества, пригодные для лечения опухолей ободочной кишки, либо применяемые в качестве болеуспокаивающего средства при опухолях ободочной кишки. Терапевтические преимущества такой фармформы для введения в ободочную кишку зависят от ее способности непосредственно доставлять в ободочную кишку эффективные дозы лекарственных средств. Это позволяет осуществлять местное лечение болезней ободочной кишки, таких как неспецифический язвенный колит или карцинома ободочной кишки. Непосредственная доставка лекарственных средств в ободочную кишку увеличивает количество лекарственного средства, всасывающегося в ободочной кишке, а также количество лекарственного средства, воздействию которого непосредственно подвергаются клетки ободочной кишки-. Непосредственная доставка, или целенаправление, лекарственных средств уменьшает общее распределение лекарственных средств в организме, снижая тем самым нежелательные и потенциально вредные побочные эффекты. Кроме того, известно, что некоторые лекарственные средства лучше всасываются в толстой кишке, чем в других отделах желудочнокишечного тракта. Это справедливо, в частности, в отношении стероидов, ксантипов и других веществ. Прямая доставка таких лекарственных средств в толстую кишку существенно снизила бы потребную эффективную дозу. 5 10 15 20 25 30 35 40 45 В известных системах с контролируемым высвобождением лекарственные средства высвобождаются диффузионны- 50 ми механизмами во время прохождения желудочно-кишечного тракта составом, содержащим лекарственное средство. Как только лекарственное средство достигнет нижнего отдела кишки, процесс высво- 55 бождения становится ограниченным из-за малого содержания жидкости и высокой вязкости в этой части желудочно-кишечного тракта. Указанное уменьшение скорости высвобождения приводит к сниже 16 нию всасывания лекарственного средства. Однако в соответствии с настоящим изобретением, эти и другие проблемы современных способов доставки лекарственных средств преодолены путем введения лекарственного средства в подходящую матрицу (например, в ядро таблетки), которая подвергается бактериальному расщепленню в среде ободочной кишки и высвобождает содержащееся в ней лекарственное средство по крайней мере в эффективных количествах, что ведет к улучшению биологический доступности лекарственного средства. Флора, типичная для желудочно-кишечного тракта, в обобщенном виде представлена в таблице. Эта флора может меняться в зависимости от физиологического состояния подвергаемого лечению человека или животного. Система доставки может быть специально приспособлена к той флоре, которая особенно развита в пациенте. В одном из предпочтительных вариантов изобретения использованы метакриловые полимеры, поскольку они химически стойки в биологической среде. В частности, эти полимеры не катаболизируются и не всасываются в желудочно-кишечном тракте. Эти полимеры не содержат раздражающих веществ и, как было показано, могут применяться, например, в хирургии, офтальмологии и дерматологии. Предпочтительно использовать такие ковалентно присоединенные к акриловым полимерам олигосахариды, которые могут перевариваться бактериями ободочной кишки, но не ферментами желудка и томкой кишки. Примерами таких олигосахаридов являются целлобиоза, (-4-0-р-О-глюкопиранозил-О-глюкопираноза), лактулоза (4-0-р-0-галактопиранозил-О-фруктоураноза), трисахаридрафиноза (a-D-Gal-[1->6]tx-D-Glc-p-D-Fru) и стахиоза (a-D-Gai-a-2D-Gat-a-D-Glc-J3-D-Fru). Могут быть использованы несколько способов присоединения олигосахаридов к акриловым мономерам - часть из них являются прямыми, а другие требуют по меньшей мере двух стадий. Например, прямым методом (трансэтерификацией метилметакрилата или ацилированием с метакрилоилхлоридом) могут быть получены эфиры метакриловой кислоты и сахаристых спиртов. Теоретически в олигосахаридах в реакцию могут вступать разные гидроксильные группы. Однако один заместитель вводят в первую очередь в шестую позицию 17 26603 (первичный спирт). Используя избыток метакрилоилхлорида или метилметакрилате по отношению к олигосахариду, получают эфир двухосновной кислоты, который находит применение в качестве поперечносвязующего звена в процессе полимеризации. Полимеризация осуществляется для производства гомополимеров синтезированных ранее мономер-олигосахаридов или, предпочтительнее, сополимеров с такими мономерами как акрилатметакрилат, оксипропилметакрилат, оксиэтилметакрилат. Такие природные полимеры, как мукополисахариды, тоже могут расщепляться бактериями ободочной кишки. Ферменты, ответственные за бактериальный катаболизм, варьируют от полимера к полимеру, и могут быть ассоциированы с клеткой или быть внеклеточными ферментами. Однако большинство из этих природных полимеров в своей немодицифированной форме растворимы в воде и желудочном соке и поэтому без модифицирования непригодны в качестве носителей ободочнокишечных лекарственных средств. Например, мукой олисахарид хондроитинсульфат является весьма растворимым полимером, и в твердой лекарственной форме быстро распадается в воде. Сообщалось о том, что хондроитинсульфат служит субстратом для бактероидных обитателей толстой кишки, главным образом для B.thetaiotamicron B.ovatus (Salyers, А.А., Amer. J.CIi. Nutr. -1979, 13: 158-163; Saiyers A.A. and O'Brien M,Bacteriol.-i980, 143: 772-780). Было высказано предположение, что за распад хондроитина ответственны периплазменные ферменты, возможно посредством внешнего мембранного рецептора, которые связывают хондроитинсульфат и обеспечивает его контакт с такими ферментами как хондроитинсульфатлиаза. Для уменьшения гидрофильности этих полимеров и, следовательно, обеспечения возможности их применения в составах и способах по настоящему изобретению в качестве носителей ободочнокишечных лекарственных средств, которые проходят тонкую кишку и расщепляются в ободочной кишке, могут быть использованы способы поперечного связывания лолимєров. Примером предпочтительного способа поперечного связывания является защита амида посредством реакции диамина с указанным полимером. Ряд диаминов, которые можно использовать, вк 5 10 15 20 25 30 35 40 45 50 55 18 лючает 1,4-бутандиамин; 1,6-гександиамин; 1,7-гептандиамин и 1,12-додекандиамин. Таким образом, настоящее изобретение предоставляет способ модифицирования хондроитинсульфата, согласно которому хондроитинсульфат в подходящей среде, в присутствии подходящего катализатора и в течение подходящего промежутка времени вводится в контакт с диаминовым соединением, выбранным из группы, состоящей из 1,4-бутандиамина; 1,6-гександиамина; 1,7-гептандиамина и 1,12-додекандиамина; продукт диализируется в воде, а затем лиофилизируется. Предпочтительным амином является 1,12додекандиамин. Указанной средой предпочтительно являются диметилсульфоксид или диметилформамид. Предпочтительным катализатором является дициклогексилкарбодиимид. Настоящее изобретение предоставляет также способ модифицирования пектина, по которому водный раствор пектина смешивается с раствором хлорида металла, в котором способами, известными из современного уровня развития техники, концентрация соли подобрана в соответствии с желаемой степенью растворимости конечного продукта; для образования геля доводят гидроокисью натрия рН смеси до 8-8,5, затем следует осаждение, центрифугирование и промывка водой. Полученную твердую пектиновую соль металла для перевода в порошок просеивают. Подходящие пектиновые соли металла включают, например, соли кальция, стронция и магния; предпочтительной является соль кальция. После приготовления олигосахаридполимерной матрицы она объединяется с лекарственным средством. Способы подбора состава, который дает возможность управлять высвобождением избранного фармацевтического соединения, известны. Используя эти и другие известные методы, можно подобрать состав желаемого фармацевтического соединения, включающий полимеры по настоящему изобретению. Ряд таких способов описан Саффраном и Левиным (Saffran et ai., Science 233: 1 081 - 1 084 (1986) and Levine et al., Gastroenterology 92: 1 037 - 1 044 (1987)). Конкретные варианты приготовленных составов соединений по настоящему изобретению включают, например, таблетки из матрицы и лекарственного средства как в свободном виде, так и помещенные в желатиновые капсулы или любые другие средства, позволяющие осуществлять пе 19 26603 роральный прием; микрочастицы из матрицы и лекарственного средства как в свободном виде, так и помещенные в желатиновые капсулы или любые другие средства, позволяющие осуществлять пероральный прием; многослойные таблетки, состоящие из ядра, выполненного из лекарственного средства, и оболочки из биоразлагаемого полимера; полимерный слой может, например, изготавливаться напылением, формованием или двойным прессованием. Все эти способы приготовления подобных составов хорошо известны из современного уровня развития техники. Для обеспечения эффективной доставки желаемого лекарственного средства и учета возраста, пола, физического состояния пациента, характера болезни и других медицинских факторов количество лекарственного средства по желанию может варьироваться. Кроме того, количество лекарственного средства, доставляемого системой по настоящему изобретению, зависит от относительной эффективности этого лекарственного средства. Количество конкретного лекарственного средства, необходимого для достижения эффективных результатов в применении системы доставки и способов по настоящему изобретению, может быть определено в соответствии со способами-, известными из современного уровня развития техники. Например, дозировки, известные из современного уровня (см., например, the Physician' Desk Reference 1991 (E.R.Barnhart, hubhsher), The Merck Index, 10th Ed., Merck & Co., NJ, The Pharmacological Basis of Therapeutics, 8th ed., A.G.Goodman et al., eds., Pergamon Press, NY), дают основу для определения количества лекарственного средства, которое требовалось раньше для обеспечения эффективного уровня активности. Особенно в этом отношении полезны количества желаемого лекарственного средства, ранее вводимого в форме суппозиторных составов, а также характеристики этого лекарственного средства при вводе в форму суппозитория. Поскольку система доставки по настоящему изобретению не зависит от системной (кровью) доставки лекарственного средства в ободочную кишку, можно ожидать, что эффективные дозы ободочнокишечных лекарственных средств, которые вводятся пациенту системно, будут выше, чем эффективные дозы этих не лекарственных средств при доставке непосредственно в ободочную кишку. 5 10 15 20 25 30 35 40 45 50 55 20 Лекарственные средства, чьи эффективные количества для применения в предложенной фармформе по настоящему изобретению могут быть определены подобным образом, включают противовоспалительные средства, в г.ч. нестероидные и стероидные противовоспалительные средства, дексаметазон, будезонид, беклометазон, флуктиказон, тиоксокартал и гидрокортизон, циклоспорин, теофиллин, нефедипин, изосорбитдинитрат, оксипренолол, циметропбромид, противоопухолевые препараты, такие как метотрексат, тамоксифен, циклофосфамидл, меркаптопурин, этопозид и индометацин. Таблетки и капсулы могут быть получены по технологиям, хорошо известным из современного уровня развития техники, описанным, например, в Remington's Pharmaceutical Sciences, Mack Publishing Co., 16th ed., 1980, особенно в главе 89 - фармацевтические препараты и производство "таблеток, капсул и пилюль". Во всех вариантах настоящего изобретения при желании пациенту в одной матрице может даваться более, чем одно лекарственное средство. В "таблеточных" вариантах количества лекарственных средств в составах по настоящему изобретению могут варьироваться в широком диапазоне, например, количество лекарственного средства может составлять от примерно 5% до примерно 30% по массе. В другом варианте изобретения предложена прессованная таблетка, которая содержит такие же эффективные дозы желаемого лекарственного средства (лекарственных средств), как и в "таблеточном" варианте, и такое количество полимера по настоящему изобретению, которое обеспечивает распад таблетки и высвобождение лекарственного средства (лекарственных средств) после того, как таблетка подвергнется действию одного или нескольких микроорганизмов, присутствующих в ободочной кишке. Специалистам в данной области должны быть известны и другие приемлемые варианты. Состав, пригодный для энтерального введение, должен содержать лекарственное средство, предназначенное для высвобождения в ободочной кишке, и представлять собой олигосахаридполимерную матрицу по настоящему изобретению. Состав подбирается так, чтобы обеспечивать защиту лекарственного средства от желудочных и кишечных ферментов, но не препятствовать расщеплению олигосахаридсодержащей матрицы и высвобож 21 26603 дению лекарственного средства после того, как состав подвергнется действию ободочнокишечных бактерий. Система доставки и способы по настоящему изобретению не ограничиваются 5 введением лекарственных средств человеку: они особенно пригодны для ветеринарного введение лекарственных средств любым животным, включая домашних, таких как собаки, кошки, лошади, рыбы и 10 птицы, зоопарковых животных, а также для контроля и лечения диких животных и животных, важных для сельского хозяйства, таких как крупный рогатый скот, дойные коровы, свиньи и домашняя птица. 15 Нижеследующие примеры продолжают описание материалов и способов, использованных для воплощения изобретения. Эти примеры не ограничивают настоящее изобретение. -20 П р и м е р 1. Получение акриловых олигосахаридных мономеров одностадийным способом. А. Трансэтерификация. В присутствии 20 мг 4-этоксифенола 25 и 10 ммоль карбоната натрия смешивают с 2 ммоль рафинозы с 6 ммоль метилакрилата в 15 мл диметилформамида. Реакционную смесь нагревали до 70-75°С под вакуумом в 100 мм рт.ст. Для отгонки из 30 системы метанола была установлена 7тарелочная фракционная колонна. Через 12 ч смесь охлаждалась. Продукт идентифицировали при помощи пластинки для тонкослойной хроматографии, после чего 35 элюировали этилацетатом из колонны с силикагелем 60. Б. Ацилирование. Два ммоля рафинозы смешивали с 6 ммоль метакрилоилхлорида, 10 ммоль су- 40 хого карбоната натрия и 20 мг 4-этоксифенола в 15 мл диметилформамида или диметилэтилсульфоксида. Смесь нагревали под вакуумом (100 мм рт.ст.) в течение 7 ч до 80°С. Идентификация и очистка 45 выполнялась так же, как и в примере 1А. П р и м е р 2. Получение акриловых олигосахаридных мономеров двухстадийным способом. А. Три ммоль целлобиозы и 3 ммоль 50 цианборгидрида натрия смешивали с 5 мл этилендиамина (75 ммоль) в 25-миллилитровой колбе при температуре 510°С (ледяная ванна). По завершении реакционного процесса применяли плас- 55 тинки для тонкослойной хроматографии и бутанол-этанол-водную (5:3:2) систему проявления. Продукты идентифицировали при помощи распыления йода или гидрина. 22 Б. 0,3 ммоль целлобиозы растворяли в 8 мл воды, затем добавляли 11 ммоль цианборгидрида натрия и 7,2 ммоль ацетата аммония и перемешивали в лодяной ванне. Затем выполнялись те же действия, что и в примере 1. С. 3 ммоль целлобиозы растворяли в 11 мл воды, затем добавляли 9 ммоль цианборгидрида натрия; смесь охлаждали до 10°С в ледяной ванне. Затем добавляли 60 ммоль бикарбоната аммония и продолжали реакцию в течение 8 ч при 10°С и 64 ч при комнатной температуре. Далее, как и в примере 3, следовала тонкослойная хроматография, только для идентификации применялся фенолсернокислотный т ест. После 8 ч выпаривания смесь осушали, к ней добавляли 10 мл воды и снова высушивали. Разделение и выделение продукта осуществляли в хроматографической колонке со смолой Амберлит IR-120 (Н) высотой 23 см и внутренним диаметром 2 см. Смесь (15 мл) ацилированной уксусной кислоты до рй 5,5, затем добавляют 85 мл воды и про-, пускали через колонну (1,5 мл/мин). Колонна промывалась 250 мл воды, затем 250 мл аммиака (0,7 М) и снова 250 мл воды. После этого водная и аммиачная фракция собирались и выпаривались до осушения. П р и м е р З . Присоединение к акриловому мономеру. А. Реакция Шоттен-Баумана. * Три моля продукта по примеру 2С растворяли в 2 мл воды; раствор охлаждали в ледяной ванне до 2-4°С. В раствор добавляли 3 моль NaOH. По охлаждении в раствор по каплям и одновременно добавляли 3 ммоль метакрилоилхлорида и дополнительные 3 ммоль NaOH в 2 мл воды. Реакционная смесь еще час перемешивалась при комнатной температуре. После завершения реакции выполнялась тонкослойная хроматография (силикагелевые пластинки, BuOH/EtOH/H2O в соотношении 5:3:2). Б. Три моля продукта по примеру 2С перемешивали с 3 ммоль метакриловой кислоты в 5 мл диметилсульфоксида. К реакционной смеси добавляли 3,3 ммоль дициклогексилкарбодиимида, и смесь перемешивали в течение 24 ч при комнатной температуре. П р и м е р 4. Полимеризация. Поперечносвязанный метакриловый со* полимер рафинозы. 10 моль продукта по примеру 1 соединяли с 20 ммоль метакриловой кислоты в ацетоне или тетрагидрофуране (3 мл). К 23 26603 смеси в качестве инициатора добавляли 45 мг (азо-бис-нитрила изомасляной кислоты и проводили полимеризацию в азотной среде при температуре 55°С. Через 24 ч в смесь добавляли 5 мл воды, и выпаривали раствор при пониженном давлении в течение 1 ч. После этого помещали смесь в резервуар для диализа и диализировали ее в 10 л дистиллированной воды в течение 24 ч. Конечный продукт извлекали и лиофилизировали. П р и м е р 5. Модификация природных полимеров. А. Модификация хондроитина. 1. 1 г хондрои тин сульфата соединяли с 11 ммоль 1,12-дпдекандиамина и 24,2 ммоль дициклогексилкарбодиимида в 10 мл ди метил сул ьфоксида или диметилформамида. Реакция осуществлялась в течение 12 ч при комнатной температуре. Реакционную смесь затем помещали в резервуар для диализа и диализировали в 3 л дистиллированной воды в течение 48 ч. Очищенный материал лиофилизировали. 2. Хондроитинсульфат типа А (фирмы "Сигма", Сент-Луис, штат Миссури) обрабатывали 1,12-додекандиамином (фирмы ("Сигма", Сент-Луис, штат Миссури) в эквимолярных соотношениях 30, 50 и 60%. Процесс очистки полимера включал- промывку ацетоном и диализ в очищенной воде. Полученный продукт высушивали при температуре ниже 0°С в течение ночи; полученный сухой порошок собирали и герметически закрывали до момента последующей обработки. Постоянство состава продуктов от партии к партии определяли путем анализа из спектра поглощения в 1% (по весу) водно-спиртовом растворе {1 часть воды, 2 части спирта) - см. рис.1. Степень обработки определяли, исходя из количества метиленовой сини, абсорбированной на различных продуктах. Хондроитинсульфат и обработанные хондроитиновые продукты помещали в резервуар для диализа (марки (Spectra/por 6 х 30 мм, порог по молекулярной массе 12 000 - 14 000 дальтои, фирмы "Спектрум", Лос-Анджелес) и погружали в 0,1% (по весу) буферный раствор метиленовой сини я веронале. Метиленовая синь, в свою очередь, диффудировала в резервуар и абсорбировалась на диспергированном порошкеносителе. Спектрофотометром (Spectronic 1 001) в течение 6 ч регистрировали исчезновение хромофора на волне 665 нм. Определяли равновесную абсорбцию и де 5 10 15 20 25 30 35 40 24 лили ее на величину, определенную в момент помещения хондроитинсульфата а резервуар для диализа. Полученная величина, умноженная на 100, определяла относительное абсорбционное число метиленовой сини (04М). Было установлено, что эта величина для хондроитина со степенью обработки 30% составила 68,6, для хондроитина со степенью обработки 50% - 60,6, для хондроитина со степенью обработки 60% - 54,4. Округленно ОЧМ для этих веществ составило 70, 60 и 55 соответственно. Б. Модификация пептина. 5% по весу водный раствор пептина смешивали с 70% (пэ весу) раствором СаСІг в соотношении 1:1. Величина рН полученного опалесцирующего раствора составляла 2-2,5. Постепенным добавлением IN раствора NaOH величину рН доводили до 8-8,5. В результате образовывался гель, а за ним осадок, который подвергали центрифугированию при 5 000 об/мин и промывке очищенной водой. Указанная процедура повторялась три раза. Полученный шлам высушивали в полочной печи в течение 48 ч до конечного содержания воды в 5%. Твердый пектат кальция для получения порошка измельчали и пропускали через сито 40 меш. Можно использовать 50, 60, 80 и 90% (по весу) растворы хлорида кальция для получения более растворимых (50, 60%) или менее растворимых (80 и 90%) продуктов. Для получения пектиновых солей, пригодных в качестве матриц системы доставки в ободочную кишку, могут быть использованы и другие двухвалентные катионы, например магния (Мд++) или стронция (Sr f + ). П р и м е р 6. А. Модифицированный хондроитин: последования ин витро. 1. Хондроитинсульфат является растворимым мукополисахаридом, и бактерии толстой кишки могут использовать его в 50 качестве субстрата. Из поперечно-связанного хондроинтинсульфата, полученного так, как зто было описано в примере 5А (1), в форме прессованной таблетки с индометацином готовили твердую систе55 му доставки, пригодную для использования способами по настоящему изобретению. Высвобождение лекарственного средства исследовали при температуре 37°С и при использовании гомогената слепой кишки крысы. 45 25 26603 Скорость высвобождения индометацина из поперечно-связанного хондроитина была меньше, чем из контрольного образца обычного хондроитина. При исследовании в присутствии гомогената слепой кишки в течение 60 мин из необработанного носителя высвобождалось 54% лекарственного средства, а из обработанного носителя - только 17,6%.' Сравнительные исследования с использованием среды, не содержащей гомогенат, показали другую зависимость для скорости высвобождения. В течение 60 мин из обработанного хондроитина, помещенного в буфер, высвобождалось 32,5% индометацина (по сравнению с 17,6% в присутствии гомогената слепой кишки). В параллельном эксперименте из необработанного хондроитина в том же буфере было высвобождено 67,8% индометацина (по сравнению с 54% в присутствии гомогената слепой кишки). 2. Сухой порошок модифицированного хондроитина, полученного в примере 5А (2), пропускался через сито и смешивался с индометацином (фирмы "Сигма*) в соотношении 9:1 по весу. На ручном прессе фирмы "Перкин Элмер" прессовали матрицы весом по 200 мг каждая. Среда содержимого слепой кишки. Крысам сабра (I.Lutsky, F.Atzer, and N.Mar. Is. J.Med. Sci. 20: 603-612, 1984) массой 200-300 г за 24 ч до начала экспериментов по растворимости скармливали хондроитинсульфат (20% водный раствор). За 30 мин до начала экспериментов по растворимости крыс забивали, под атмосферой СО2 собирали содержимое их слепых кишок и помещали его в фосфатно-буферный солевой раствор (ФБР, рН 7) до получения окончательной степени разведения содержимого слепой кишки в 1,25% по весу. Эксперименты по высвобождению лекарственных средств. Для каждого состава эксперименты по растворению повторяли по три раза. Каждый эксперимент относится к разным партиям модифицированного хондроитина и выполнялся по два раза в 100 мл запаянных стеклянных ампулах, которые трясли в водной ванне при 80 об/мин и 37°С в атмосфере СО2. Эксперименты по высвобождению проводили в ФБР с добавлением и без добавления (контрольные эксперименты) содержимого слепой кишки. В заранее определенные интервалы времени для выполнения анализа по индометацину отбирали по три пробы (по 1 мл). Затем в систему добавляли равное 5 10 15 20 25 30 35 40 45 50 55 26 количество ФБР. В другой серии экспериментов перед добавлением ФБР суспензию содержимого слепой кишки в течение 3 мин подвергали воздействию ультразвука. Это делали с целью разрушения стенок клеток ободочнокишечных бактерий для того, чтобы эксперимент по растворению мог вестись в присутствии свободных эндоэнзимов (A.Salyers. Amer. J.CIin. Nutr. 32: 158-163 (1979)).' Целью этого последнего предварительного эксперимента было сравнение поведения ободочнокишечных носителей в двух различных ферментационных средах. Выполняли два типа исследований растворимости: "короткосрочные исследования" и "долгосрочные исследования". Продолжительность первых составляла 5 ч, а пробы отбирались в моменты времени 0, 15, 30, 45, 60, 90, 120, 150, 180 и 300 мин. Краткосрочные эксперименты включали исследования растворимости в трех средах: содержимом слепой кишки крысы; содержимом слепой кишки крысы, которое в течение 3 мин подвергали воздействию ультразвука ("ультраозвученные"); и контрольном (ФБР без добавки бактерий). Долгосрочные исследования продолжались в течение 24-28 ч, а пробы отбирали в моменты времени 0, 3, 6, 9, 12V 14, 21, 24 и 28 ч. В этих исследованиях использовали только бактерии, т.е. содержимое слепой кишки без параллельных экспериментов с ультраозвученными. f Анализ индометацина. Образцы (1 мл) ацилировали (200 мкл 0,4 N НС!) и экстрагировали 1 мл этилацетата, содержащего 0,2 мг % флуфенаминной кислоты {внутренний стандарт). Смесь завихряли и центрифугировали (3 мин при 3 400 об/мин). 500 мкл органической фазы подвергали выпариванию, остаток повторно растворяли с смеси (50:50) фосфатного буфера и ацетонитрила с рН 7,5, 20 мкл раствора вводили в жидкостный хроматограф высокого давления (насосная система "Hewlett Packard 1050", детектор "Jasco Intelligent UV/V", Hewlett Packard 3365 Chem Station Data" и двухканальный аналого-цифровой интерфейсный конвертер "Hewlett Packard 35900 С". Длина волны составляла 280 нм, применяемая колонна - 5-микронная, 250 х 4,6 мм марки RP-18 (LichroCART 250-4, E.Merck, Германия). Статистический анализ. і Значимость различий количеств лекарственного средства в разные моменты времени подвергалась статистическому анализу с использованием одновремен 27. 26603 ного парного t-критерия. Статистически значимым различие считалось в том случае, если величина р была менее 0,05. На фиг. 2 представлены данные тех исследований растворимости, которые продолжались 6 ч (краткосрочные эксперименты). Во всех случаях количество лекарственного средства, высвобожденного в контрольных системах (т.е. без содержимого слепой кишки крысы) было больше, чем количество, высвобожденное в присутствии содержимого слепой кишки или в присутствии содержимого слепой кишки, которое подвергали воздействию ультразвука {в присутствии "ультраозвученного"). Во всех случаях количество лекарственного средства, высвобожденного в присутствии ультраозвученного, было больше, чем в присутствии неразрушенного содержимого слепой кишки. Однако в то время, как график высвобождения индометацина а среде ФБР примерно через два часа достигал участка насыщения, график высвобождения лекарственного средства в среде ультраозвученного медленно шел вверх до тех пор, пока не достигал уровня лекарственного средства, высвобожденного в контрольных экспериментах (между 4 и 5 ч). Кумулятивный процент высвобождения индометацина к концу экспериментов составил в растворяющей среде ФБР 29,04; 39,68 и 3,80 для ОЧМ 70 и ОЧМ 60 и ОЧМ 55 соответственно, а в растворительной среде ультраозвученного 32,30; 43,00 и 3,30 для ОЧМ 70, ОЧМ 60 и ОЧМ 55 соответственно. Количество индометацина, высвобожденного в растворяющей среде неразрушенного содержимого слепой кишки, во всех случаях не достигало этих уровней и составило (в кумулятивных процентах) 13,80; 21,43 и 1,25 для ОЧМ 70, ОЧМ 60 и ОЧМ 55 соответственно. 5 10 15 20 25 30 35 40 Сходные эксперименты для матриц из 45 необработанного хондроитинсульфата, которые содержали такое же количество индометацина, завершились в течение 1 ч; к этому моменту наблюдалось полное растворение носителя, что означает пол- 50 ное высвобождение лекарственного средства. В тех экспериментах, в которых носителем был необработанный хондроитин, не наблюдалось существенного различия между графиками высвобождения 55 лекарственного средства в различных растворительных средах. В экспериментах по растворению, продолжительность которых планировалась в 28 ч, были получены другие результаты 28 (фиг. 3-5). Для состава ОЧМ 70 график высвобождения индометацина в среде содержимого слепой кишки в течение всего эксперимента шел выше, чем в среде ФБР, причем, начиная с 12-го часа - существенно выше (р
ДивитисяДодаткова інформація
МПК / Мітки
МПК: A61K 9/50
Мітки: перорального, введення, фармацевтична, форма, лікарського, спосіб, пектину, хондроїтинсульфату, отримання, модифікованого, кишку, засобу, ободову
Код посилання
<a href="https://ua.patents.su/42-26603-farmacevtichna-forma-dlya-peroralnogo-vvedennya-v-obodovu-kishku-likarskogo-zasobu-sposib-vvedennya-sposib-otrimannya-modifikovanogo-khondrotinsulfatu-sposib-otrimannya-modifikovan.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична форма для перорального введення в ободову кишку лікарського засобу, спосіб її введення, спосіб отримання модифікованого хондроїтинсульфату, спосіб отримання модифікованого пектину</a>
Попередній патент: Спосіб резекції печінки при виключенні її з кровообігу
Наступний патент: Комбінований літальний апарат
Випадковий патент: Спосіб зміцнення колінчатих валів