Спосіб боротьби з членистоногими
Номер патенту: 27215
Опубліковано: 15.08.2000
Автори: Робертс Девід Алан, Парнелл Едгард Вільям, Хеттон Леслі Рой, Хокінс Девід Віл'ям, Пьорсон Крістофер Джон
Формула / Реферат
(57) 1. Способ борьбы с членистоногими в очаге путем обработки последнего производным пиразола, отличающийся тем, что в качестве производ ного пиразола используют соединение общей формулы (I)
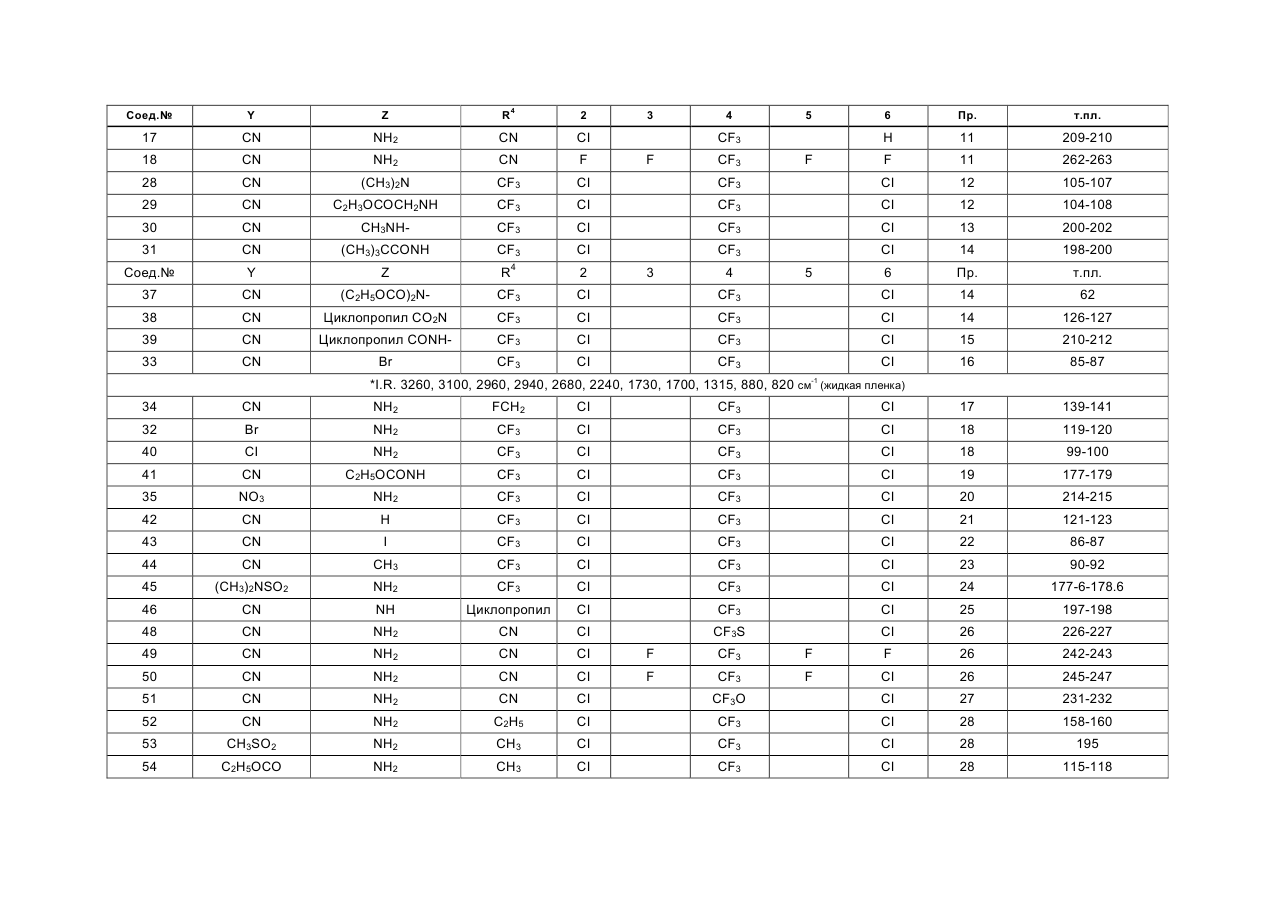
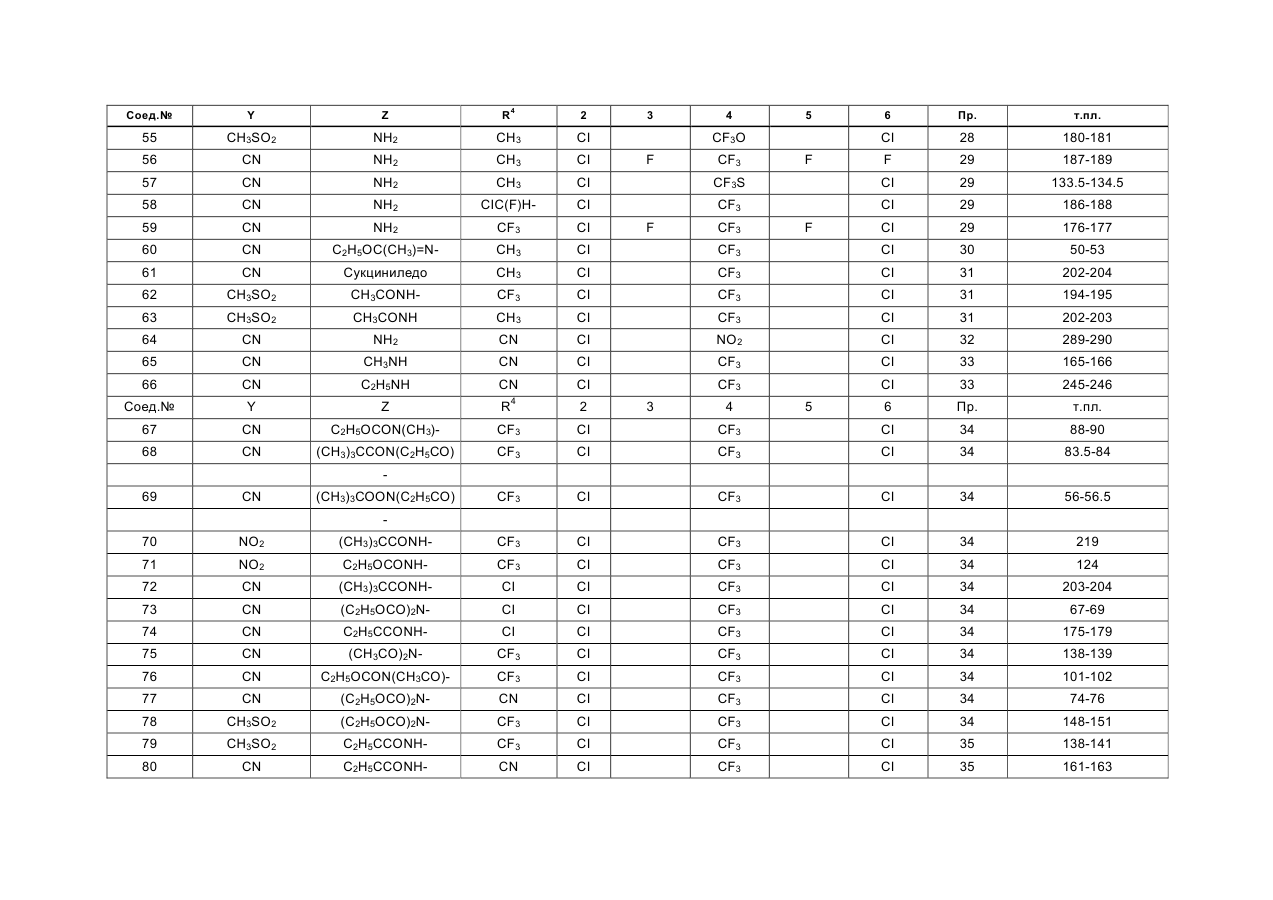
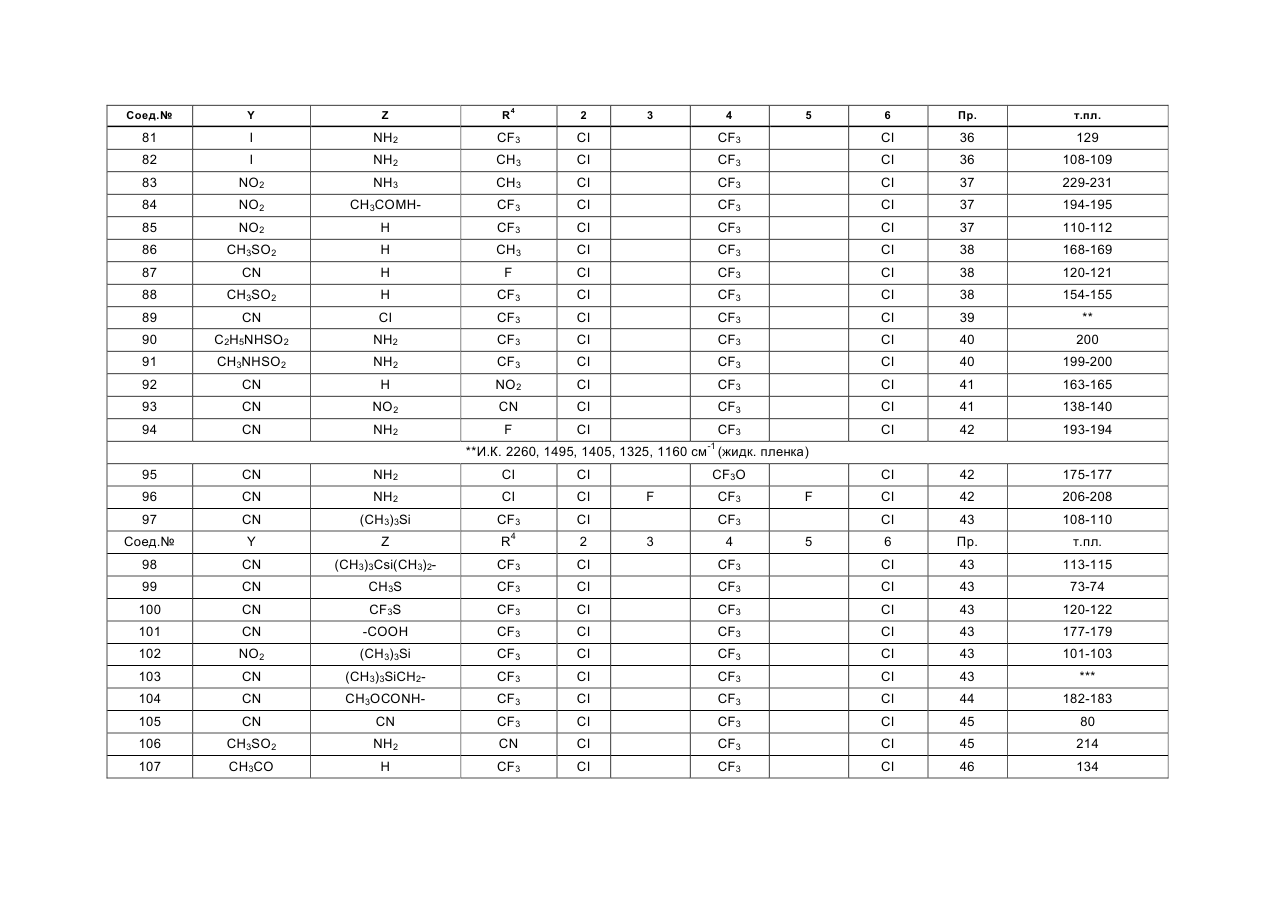
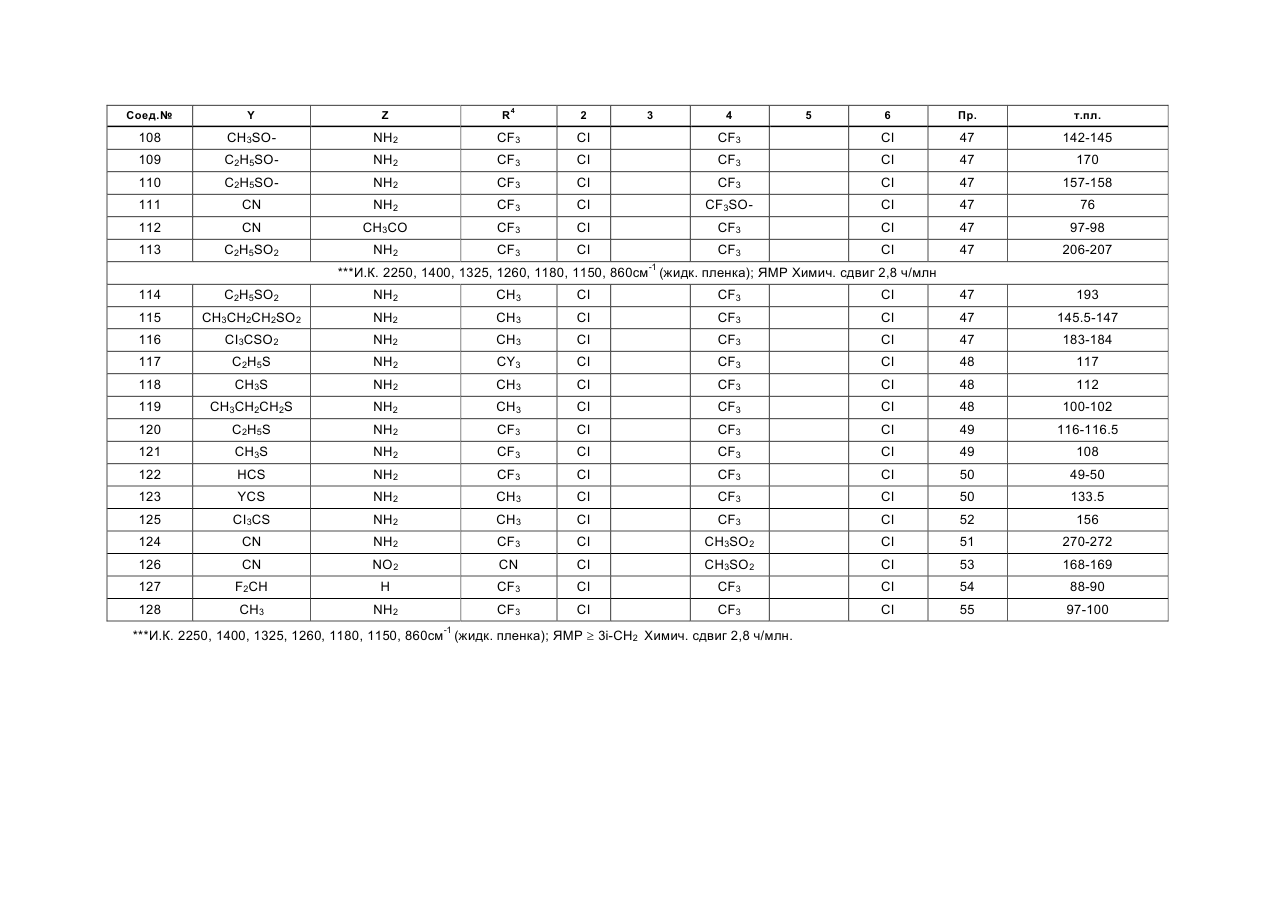
в которой Y представляет собой атом хлора, брома или йода, циано- или нитрогруппу или группу формулы RSO2, RSO или RS, в которой R означает алкильную группу с прямой или разветвленной цепью, содержащей от 1 до 4 углеродных атомов, или тригалогенметильную группу, су-льфамоильную группу, которая не замещена или замещена одной или двумя алкильными группами с прямой или разветвленной цепью, которые могут быть одинаковыми или различными и содержать от 1 до 4 углеродных атомов, карбамоильную группу, алкоксикарбонильную группу с прямой или разветвленной цепью, содержащей от 2 до 5 углеродных атомов, алканоильную группу с прямой или разветвленной цепью, содержащей от 2 до 5 углеродных атомов, или алкильную группу с прямой или разветвленной цепью, содержащей от 1 до 4 углеродных атомов, или фторозамещенную метальную группу, Z представляет собой атом водорода или аминогруппу NR1R2, где Ri и R2, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или алкильную группу с прямой или разветвленной цепью, содержащей от 1 до 6 углеродных атомов, и которая не замещена или замещена алкоксикар-бонилом с прямой или разветвленной цепью с 2 -5 углеродными атомами, прямую или разветвленную алканоильную группу, которая содержит от 2 до 5 углеродных атомов, хлорзамещенную ацета-мидогруппу или представляет собой циклопропил-карбонильную группу или алкоксикарбонильную группу с прямой или разветвленной цепью, которая содержит от 2 до 5 углеродных атомов, либо Z представляет алкоксиметиленаминогруппу с прямой или разветвленной цепью, содержащей от 2 до 5 углеродных атомов, которая не замещена или замещена на метилене алкильной группой с прямой или разветвленной цепью, содержащей от 1 до 4 углеродных атомов, или представляет собой атом хлора, брома или йода, алкильную группу с прямой или разветвленной цепью, содержащей от 1 до 4 углеродных атомов, алкилтиогруппу или алкилсульфинильную группу с прямой или разветвленной цепью, содержащую от 1 до 4 углеродных атомов, или представляет собой триалкилси-лилметильную группу с прямой или разветвленной цепью, содержащей от 1 до 4 углеродных атомов в каждой алкильной группе, которые могут быть одинаковыми или различными, триалкилсилиль-ную группу, содержащую от 1 до 4 атомов углерода в каждой алкильной группе, которые могут быть одинаковыми или различными, или цианогруппу, или нитрогруппу, (R3)n представляет собой 2,3,5,6-тетрафтор-4-трифторметил, 2,6-дихлор-4-трифто-рметилтио, 2,6-дихлор-4-нитро, 2,6-дихлор-4-три-фторметилсульфинил, 2,6-дихлор-4-метилсульфо-нил, 2,6-дихлор-4-трифторметилсульфонил, 2,6-дихлор-4-трифторметил или 2,6-дихлор-4-трифто-рметокси-замещение, и R4 представляет собой атом фтора, хлора, брома или йода, циано- или алкильную группу с прямой или разветвленной цепью, содержащей от 1 до 4 атомов углерода, которая не замещена или замещена одним или более атомом хлора или фтора, или циклопропильную группу и при условии, что R4, Y и Z одновременно не представляют собой три группы одного и того же вида, выбранные из (I) циано, (II) галогена и (III) незамещенного алкила, в агрохимически эффективном количестве.
2. Способ по п 1, отличающийся тем, что в соединении общей формулы (I) Y отличен от группы RSO или RS (в которой R представляет собой тригалогенметильную группу), Z не является триалкилсилилметильной группой, триалкилсилильной группой или нитрогруппой, a R3 и R4 имеют значения, определенные в п.1.
3. Способ по п 1, отличающийся тем, что включает применение к очагу эффективного количества соединения общей формулы (I).
4. Способ по любому из п-п 1,2 или 3, отличающийся тем, что в соединении общей формулы (I)
а) Y и R4 каждый представляет собой цианогруппу и Z представляет собой атом водорода, аминогруппу -NRiR2 или алкоксиметиленаминогруппу, которая не замещена или замещена на метилене алкильной группой, атом хлора, брома или йода, алкильйую группу, алкилтиофуппу или алкилсульфинильную группу, или триалкилсилилметильную фуппу, риалкилсилильную группу, или нитрогруппу,
б) Y представляет собой алкилсульфонильную или тригалогенметилсульфонильную группу, Z представляет собой атом водорода, аминогруппу-NR1R2 или алкоксиметиленаминогруппу, которая не замещена или замещена на метилене алкильной группой, атом хлора, брома или йода, алкильную группу, алкилтиогруппу или алкилсульфинильную группу, триалкилсилилметильную группу, триалкилсилильную группу или циано-или нитрогруппу и R4 представляет собой атом фтора, хлора, брома или цианогруппу,
в) R4 представляет собой атом фтора, хлора, брома или йода, Y представляет собой циано- или нитрогруппу, карбамоильную группу или алкоксикарбонильную группу и Z представляет собой атомводорода, аминогруппу -NR1R2 или алкоксиметиленаминогруппу, которая не замещена или замещена на метилене алкильной группой, атом хлора, брома или йода, алкильную группу, алкилтиогруппу или алкилфинильную группу, триалкилсилилметильную группу, триалкилсилильную группу или нитрогруппу, или
г) R4 представляет собой алкильную группу, которая не замещена или замещена одним или более атомами фтора или хлора, или циклопропильнуюгруппу, Y представляет собой атом хлора, брома или йода, циано- или нитрогруппу, группу RSO2, RSO или RS, сульфамоильную группу, карбамоильную группу, алкоксикарбонильную группу, алка-ноильную группу или алкильную группу или фтор-замещенный метил,
д) Z представляет собой атом водорода, аминогруппу -NR1R2 или алкоксиметиленаминогруппу, которая не замещена или замещена на метилене алкильной группой, атом хлора, брома или йода, алкильную группу, алкилтиогруппу, алкилсульфи-нильную группу, триалкилсилилметильную группу, триалкилсилильную группу или циано-, или нитрогруппу
5. Способ по любому из пп 1-3 или 4, отличающийся тем, что в общей формуле (I) R4 представляет собой трифторметильную или метальную группу.
6. Способ по любому из пп 1-3 или 4, отличающийся тем, что соединением общей формулы (I) является 5-амино-1 -(2,6-дихлор-4-трифторметил-фенил)-3,4-дицианопиразол.
7. Способ по любому из пп 1-3 или 4, отличающийся тем, что соединением общей формулы (I) является 5-амино-1 -(2,6-дихлор-4-трифторметилфенил)-4-метилсульфонил-3-трифторметилпиразол.
8. Способ по любому из пп 1-3 или 4, отличающийся тем, что соединением общей формулы (I) является 4-циано-1 -(2,6-дихлор-4-трифторметил-фенил)-5-бис- (этоксикарбонил)амино-З-трифтор-метилпиразол.
9. Способ по любому из пп 1-3 или 4, отличающийся тем, что соединением общей формулы (I)является 5-амино-1-(2,6-дихлор-4-трифторметил- фенил)-4-метилсульфонил-3-метилпиразол.
10. Способ по любому из пп 1-3 или 4, отличающийся тем, что соединением общей формулы (I)является 1 -(2,6-дихлор-4-трифторметилфенил)- 5-этоксикарбониламино-4-нитро-3-трифтормети-лпиразол.
11. Способ по любому из пп 1-3 или 4, отличающийся тем, что соединением общей формулы (I)является 5-амино-3-циано-1-(2,6-дихлор-4-трифто- рметилфенил)-4-метилсульфонилпиразол.
12. Способ по любому из пп 1-3 или 4, отличающийся тем, что соединением общей формулы (I) является 5-амино-1 -(2,6-дихлор-4-трифторметил-фенил)-3-метил-4-метилтиопиразол.
13. Способ по любому из пп 1-12, отличающийся тем, что соединение формулы (I) используют при уровне внесения 5-500 г/га
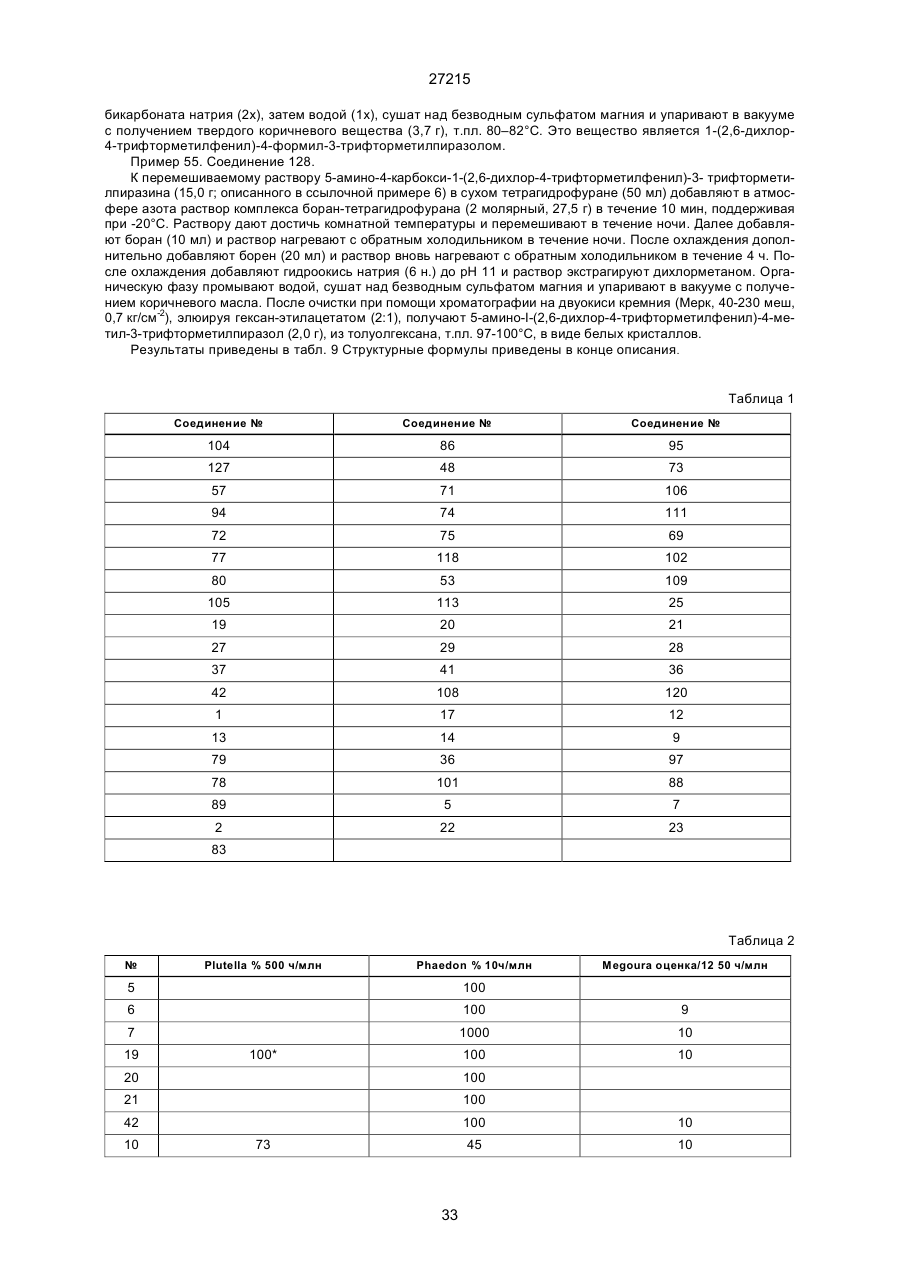
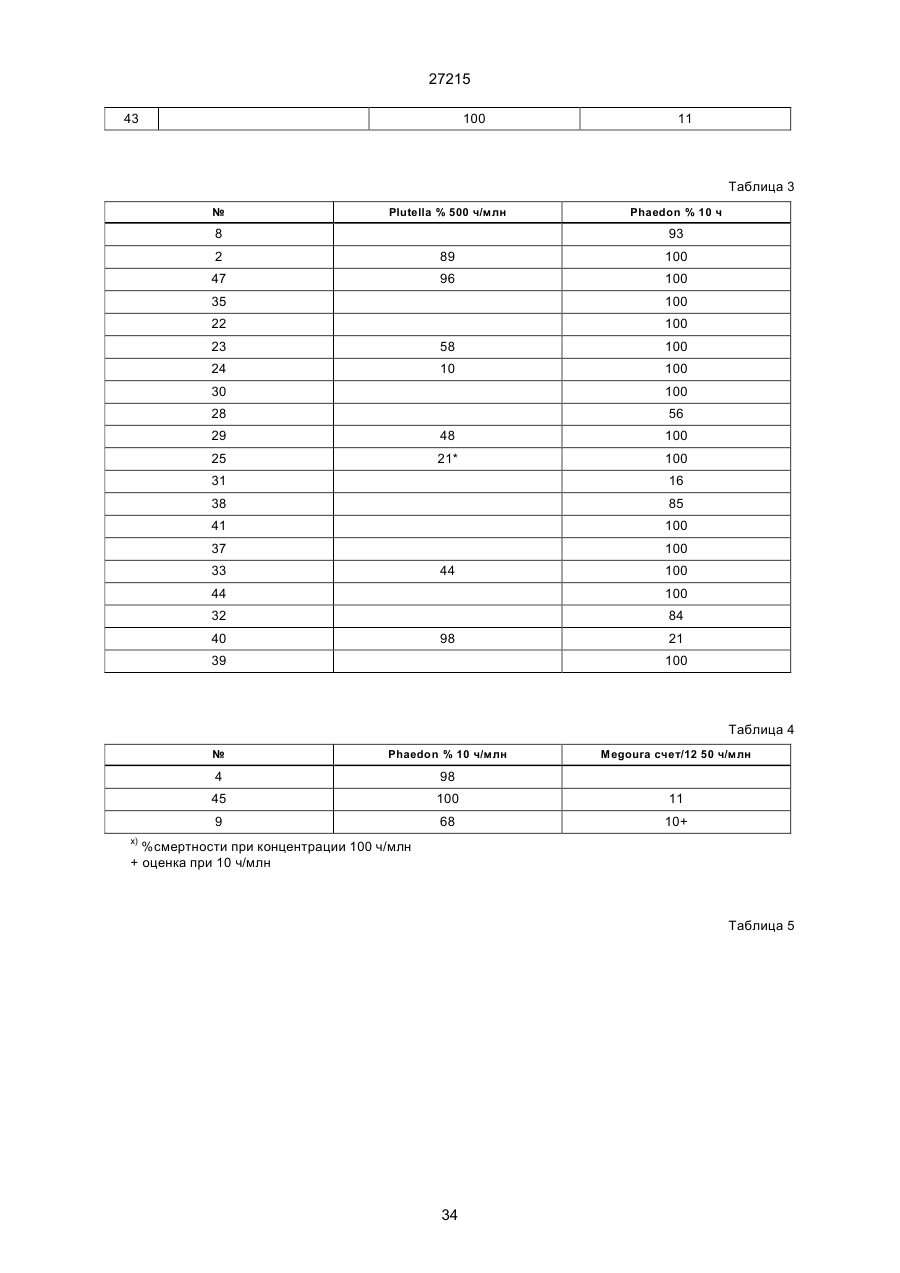
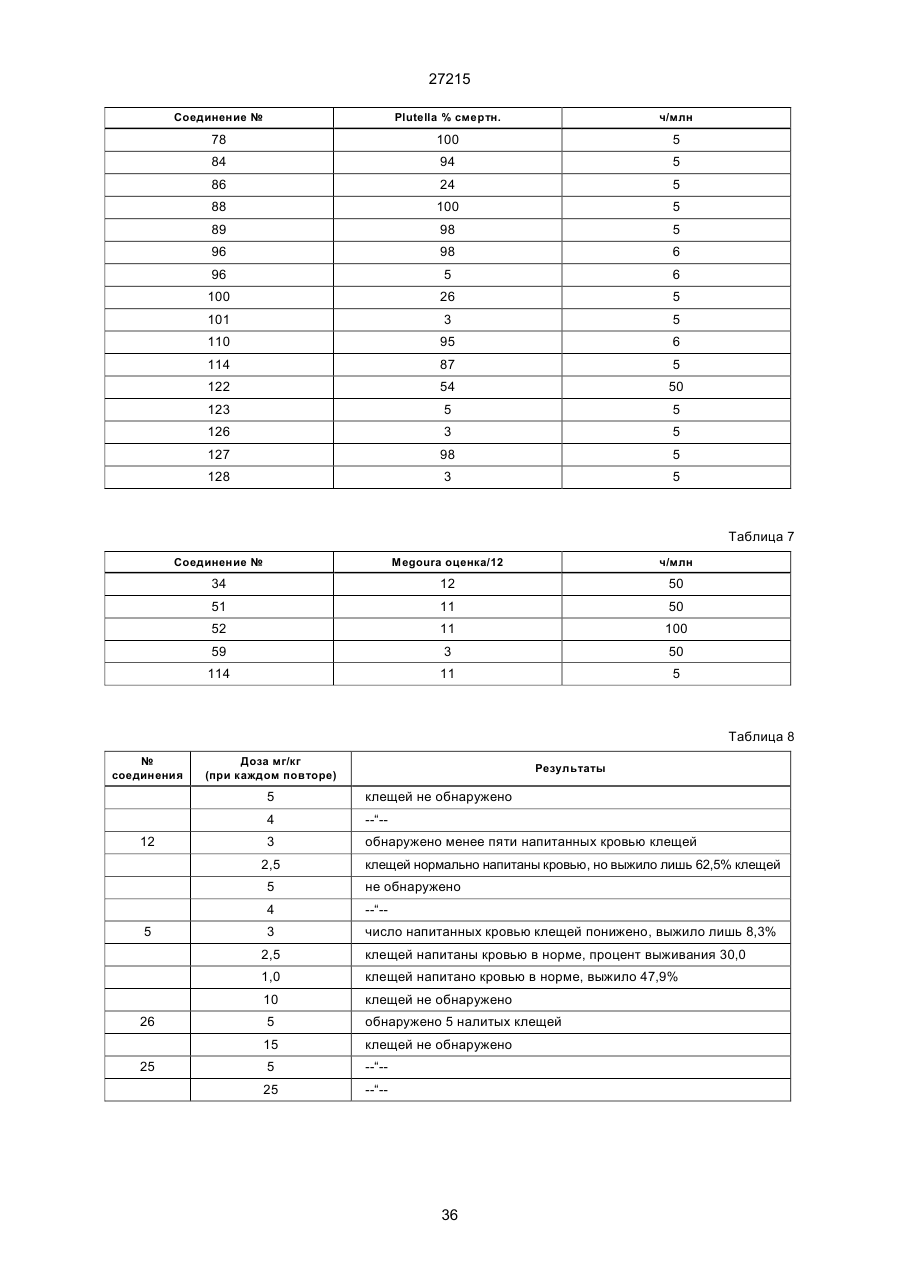
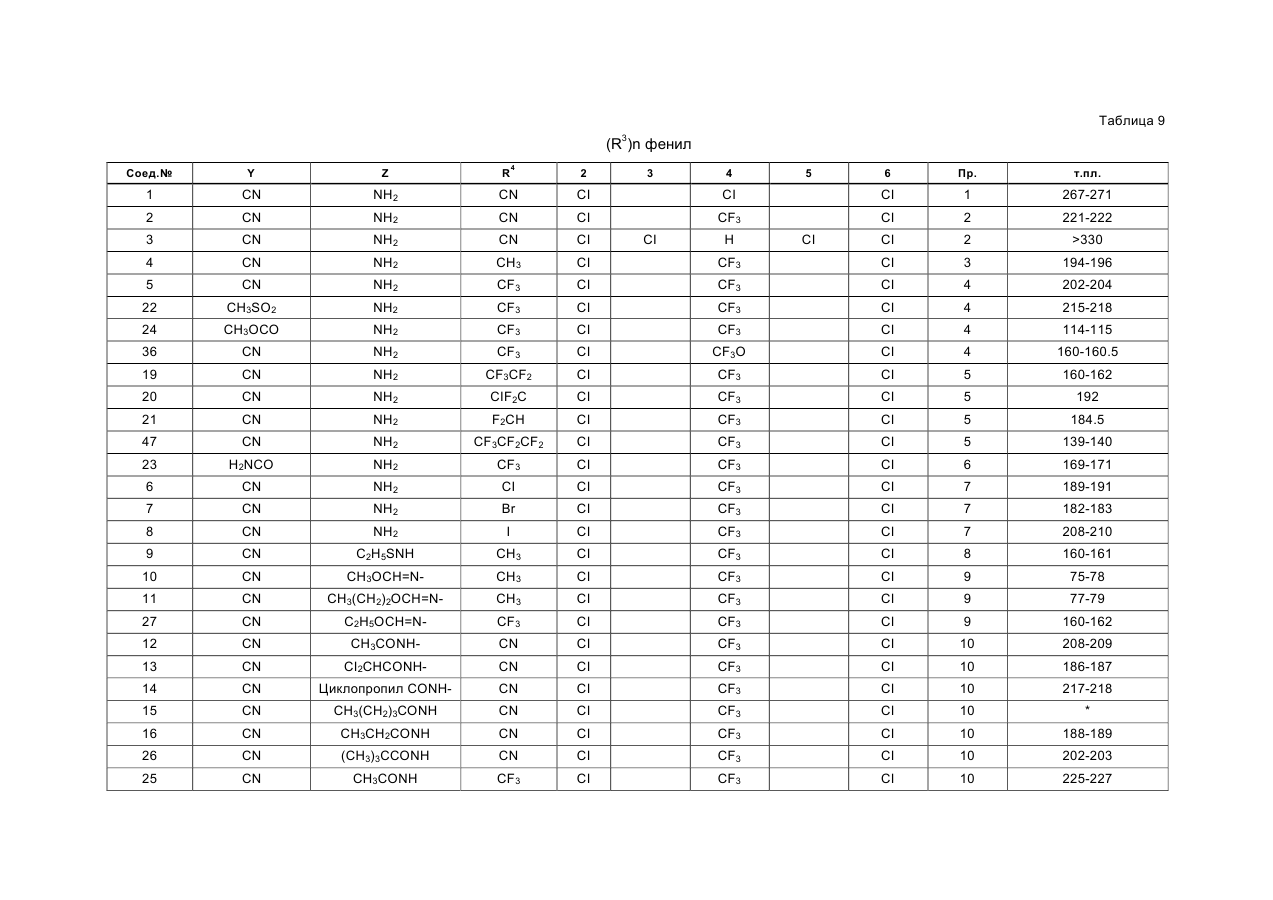
Текст
27215 Изобретение относится к способу борьбы с членистоногими, использующему в качестве активного вещества производные N-фенилпиразолов. П.Л. Саусвик и Б. Даван в 7.Heter chem 12, (1975), 1199-1205 описали эксперименты по получению 4,6диаминопиразоло [3,4-1]пиримидинов, которые согласно их предположениям должны были обладать полезными фармакологическими свойствами. В качестве исходных соединений они использовали 5-амино-4-цианопиразолы, содержащие в положении 1 атом водорода, метильную группу, гидроксиэтильную группу или фенильную группу, замещенную одним или более атомами хлора и/или метильными группами, а в положении 3 – атом водорода, метильную группу, фенильную или бензильную группу. В этой публикации не содержится никаких предложений относительно того, что такие соединения обшей формулы обладают или могут обладать активностью в отношении членистоногих. По-видимому, такие пиразольные соединения не обеспечивают получения (согласно мнению авторов статьи) полезных терапевтических (антималярийных), 4,6-диаминопиразоло [3,4-с1]пиримидинов. В патенте США № 3760084 описываются некоторые 5-амино-1-фенилпиразола, которые являются ценными веществами в отношении улучшения воспалительных состояний у теплокровных животных, такие соединения содержат в положении 3 атом водорода или низшую алкильную группу, а в положении 4-карбамоильную или цианогруппу. В патенте США № 3869274 описываются некоторые 4-нитропиразолы, которые оказались полезными веществами в отношении индукции сбрасывания фруктов с фруктовых растений. В патенте США № 4066776 описывается широкая группа 1,4-дизамещенных-3-нитропиразолов, как веществ, обладающих атимикробиальным паразицидным и гербицидными свойствами, указывается, что высокая биологическая активность соединений ограничена раскрытыми в патенте 3-нитропиразолами, причем отличительным признаком таких соединений является 3-нитропиразольные ядра. Известен способ получения 4-тиоцианотопиразоловых соединений, которые, как указывается, являются ценными бактерицидными препаратами (Патент № 49-117502). В опубликованном Японском патенте № 12644/64 описываются некоторые пиразолсульфонамиды, обладающие антитромбогенными свойствами. Ни в одной из предыдущих публикаций не описывалось и не предполагалось, что соединения общей формулы 1 обладают или могут обладать активностью в отношении членистоногих, которая была обнаружена заявителями. В настоящее время неожиданно было обнаружено, после широкой исследовательской и экспериментальной проработки, что N-фенилпиразоловые производные общей формулы 1, приведенной ниже, в которой у представляет собой галоген, например атом фтора, хлора, брома или йода, циано- или нитрогруппу, или группу RSО2, RSO или RS, в которых R представляет собой алкильную группу нормального или разветвленного строения, содержащую 1-4 атомов углерода, или тригалогенметильную группу; сульфамоильную группу, которая может быть незамещенной или замещенной одной или двумя алкильными группами с прямой или разветвленной цепочкой, которые могут быть одинаковыми или различными и содержат 1-4 атомов углерода; карбамоильную группу; алкоксикарбонильную группу с прямой или разветвленной цепью, содержащую 2-5 атомов углерода, алканоильную группу с прямой или разветвленной цепью, содержащую 2-5 атомов углерода, или алкильную группу нормальной или разветвленной структуры, содержащую 1-4 атомов углерода, или фторзамещенную метильную группу, Z представляет собой атом водорода, или аминогруппу – NR1R2, в которой R1 и R2, которые могут быть одинаковыми или различными, представляют собой каждый атом водорода или алкильную группу с нормальной или разветвленной структурой (содержащую 1-6 атомов углерода и которая может быть не замещенной или замещенной алкоксикарбонилом с прямой или разветвленной цепью, содержащим 2-5 атомов углерода), алканоильную группу с прямой или разветвленной структурой (которая содержит 2-5 атомов углерода), хлорзамещенную ацетамидную группу или циклопропилкарбонильную группу или алкоксикарбонильные группы нормального или разветвленного строения), которые содержат 2-5 атомов углерода или Z представляет алкоксиметиленаминогруппу нормального или разветвленного строения, содержащую 2-5 атомов углерода, которая может быть не замещена или замещена на метиленовом фрагменте алкильной группой нормального или разветвленного строения, содержащей 1-4 атома углерода, или представляет собой атом хлора, брома или йода, алкильную группу с нормальной или разветвленной цепочкой, содержащую 1-4 атомов углерода, прямоцепочечную или разветвленную алкилтио-, алкилсульфинил- или алкилсульфонилгруппу, содержащую 1-4 атомов углерода, или представляет собой триалкилсилилметильную группу с нормальной или разветвленной структурой, содержащую 1-4 атомов углерода в каждой алкильной группе, которые могут быть одинаковыми или различными, триалкилсилильную группу, содержащую 1-4 атомов углерода в каждой алкильной группе, которая может быть одинаковой или различной, либо циано- или нитрогрулпу, (R3)n представляет собой 2,3,5,6-тетрафтор-4-трифторметил, 2,6-дихлор-4-трифторметилтио, 2,6-дихлор-4-нитро, 2,6-дихдор-4-грифторметилсульфонил, 2,6-дихлор-4-метилсульфонил, 2,6-дихлор-4-трифторметилсульфонил, 2,6-дихлор-4трифторметил или 2,6-дихлор-4-трифторметокси, a R4 представляет собой атом фтора, хлора, брома или йода, циано- или алкильную группу нормальной или разветвленной структуры, сожержащую 1-4 атомов углерода, которая может быть не замещенной или замещенной одним или более атомами хлора или фтора, или циклотропильную группу, при условии, что R4, Y и Z одновременно не являются тремя группами одного класса, выбранными из (I) циано, (ІІ) галогена и (ІІІ) незамещенного алкила, обладают очевидной активностью против членистоногих. Предпочтительными соединениями обшей формулы 1 являются такие, в которых фенил замещен группами 2,3,5,6-тетрафтор-4-трифторметил, 2,6-дихлор-4-трифторметилтио, 2,6-дихлор-4-цитро, 2,6-дихлор-4трифторметилсульфинил, 2,6-дихлор-4-метилсульфонил и 2,6-диxлop-4-тpифтopмeтилcyльфoнил. Особенно предпочтительными являются соединения общей формулы 1, в которой фенильная группа в 1 27215 (R3)n замещена 2,6-дихлор-4-трифторметилом или 2,6-дихлор-4-трифторметоксизаместителем. Предпочтительными соедиинениями являются такие, в которых a) Y и R4 представляют собой цианогруппу а Z представляет собой атом водорода, аминогруппу – NR1R2 или алкоксиметиленаминогруппу, которая может быть не замещенной или замещенной в метиленовом фрагменте алкильиой группой, атом хлора, брома или йода, алкильную группу, алкилтио, алкилсульфинил, тиалкилсилилметильную группу, триалкилсилильную группу или нитрогруппу; b) Y представляет собой алкилсульфонильную группу или тригалогенметилсульфонильную группу, Z представляет собой атом водорода; аминогруппу – NR1R2 или алкоксиметиленаминогрупну, которая не замещена или замещена на метиленовом фрагменте алкильной группой, атом хлора, брома или йода, алкильную группу, алкилтио, алкилсульфинилгруплу, триалкилсилилметильную группу, триалкилсилильную группу или циано- либо нитрогруппу, а R4 представляет собой атом фтора, хлора, брома или циано. c) R4 представляет собой атом фтора, хлора, брома, Y представляет собой пиано- или нитрогруппу, карбамоильную группу или алкоксикарбонильную группу, а Z представляет собой атом водорода, аминогруппу – NR1R2 или алкоксиметиленамино группу, которая может быть не замещенной или замещенной на метиленовом фрагменте алкильной группой, атом хлора, брома или йода, алкильную группу, алкилтио, алкилсульфиннл группу, триалкилсилилметильную группу, триалкилсилильную группу или нитрогруппу; и d) R представляет собой алкильную группу, которая может быть не замещенной или замещенной одним или более атомами фтора или хлора, или циклопропильную группу, Y представляет собой атом хлора, брома или йода, циано- или нитрогруппу, группу RSО2, RSO или RS, сульфамоильную группу, карбамоильную группу, алкоксикарбонильную группу, алканоильную группу или алкильную группу, или фторзамещенный метил, Z представляет собой атом водорода, аминогруппу – NR1R2 или алкоксиметиленаминогруппу, которая может быть не замещенной или замещенной на метиленовом фрагменте алкильной группой, атом хлора, брома или йода, алкильную группу, триалкилсилилметильную группу, триалкилсилильную группу или циано- либо нитрогруппу. Следует принять во внимание, что перечисленные выше группы были ранее указаны в описании. Предпочтительными также являются соединения общей формулы 1, в которой R4 представляет собой трифторметильную или метильную группу. Ниже приведены примеры соединений общей формулы 1, которые представляют собой особый интерес в отношении борьбы с членистоногими: 1. 5-амино-3,4-дициано-1 - (2,4,6-трихлорфения)пиразол; 2. 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3,4-дицианопиразол; 3. 5-амино-3,4-дициано-1-(2,3,5,6-тетрахлорфенил)пиразол; 4. 5-амино-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-метилпиразол; 5. 5-амино-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол; 6. 5-амино-3-хлор-4-циазо-1-(2,6-дихлор-4-трифторметилфенил)пиразол; 7. 5-амино-3-бром-4-циано-1-(2,6-дихлор-4-трифторметилфенил)пиразол; 8. 5-амино-3-йод-4-циано-1-(2,6-дихлор-4-трифторметилфенил)пиразол; 9. 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-метил-5-этансульфениламинопиразол; 10. 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-метил-5- метоксиметиленаминопиразол; 11. 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-метил-5- пропоксиметиленаминопиразол; 12. 5-ацетамидо-1-(2,6-дихлор-4-трифторметилфенил)-3,4-дицианопиразол; 13. 5-дихлорацетамидо-1-(2,6-дихлор-4-трифторметилфенил)-3,4- дицианопиразол; 14. 5-циклопропилкарбонамило-1-(2,6-дихлор-4-трифторметилфенил)-3,4- дицианопиразол; 15. 5-пентанамило-1-(2,6-дихлор-4-трифторметилфенил)-3,4-дицианопиразол; 16. 5-пропионамидо-1-(2,6-дихлор-4-трифторметилфенил)-3,4-дицианопиразол; 17. 5-амино-1-(2-хлор-4-трифторметилфенил)-3,4-дицианопиразол; 18. 5-амино-3,4-дициано-1-(2,3,5,6-тетрафтор-4-трифторметилфенил) пиразол; 19. 5-амино-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3- пентафторэтилпиразол; 20. 5-амино-3-хлордифторметил-1-(2,6-дихлор-4-трифторметилфенил)-4- цианопиразол; 21. 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-циано-3- дифторметилпиразол; 22. 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-метансульфонил-3- трифторметилпиразол; 23. 5-амино-4-карбамоил-1-(2,6-дихлор-4-трифторметилфенил)-3-4-трифторметилпиразол; 24. 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-метоксикарбонил-3-4-трифторметилпиразол; 25. 5-ацетамидо-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-4-трифторметилпиразол; 26. 1-(2,6-дихлор-4-трифторметилфенил)-3,4-дициано-5-(2,2- диметилпропионамидо)пиразол; 27. 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-этоксиметилен-амино-3-трифторметилпиразол; 28. 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-диметиламино-3- трифторметилпиразол; 29. 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-этоксикарбонилметиламино-3-трифторметилпиразол; 30. 4-циано-5-метиламино-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол; 31. 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-(2,2- диметилпропионоамидо)-3-трифторметилпиразол; 32. 5-амино-4-бром-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметтилпиразол; 33. 5-бром-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-рифторметлпиразол; 34. 5-амино-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-фторметилпиразол; 35. 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-нитро-3-трифторметилпиразол; 36. 5-амино-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3- трифторметилпиразол; 2 27215 37. 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-бис(этоксикарбонил)амино-3-трифторметилпиразол; 38. 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-бис(циклопропанкарбонил)амино-3-трифторметилпиразол; 39. 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-циклопропанкарбонамидо-3-трифторметилпиразол; 40. 5-амино-4-хлор-1-(2,6-дихлор-4-триформетилфенил)-3-трифторметилпиразол; 41. 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-этоксикарбониламино-3-трифторметилпиразол; 42. 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол; 43. 4-амино-1-(2,6-дихлор-4-трифторметилфенил)-5-йод-З- трифторметилпиразол; 44. 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-метил-3- трифторметилпиразол; 45. 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-(N,N- диметилсульфамоил)-3-трифторметилпиразол; 46. 5-амино-4-циано-3-циклопропил-1-(2,6-дихлор-4-трифторметилфенил) пиразол; 47. 5-амино-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3- гептафторпиразол; 48. 5-амино-3,4-дициано-1-(2,6-дихлор-4-трифторметилтиофенил)пиразол; 49. 5-амино-1-(2-хлор-3,5,6-трифтор-4-трифторметилфенил)-3,4- дицианопиразол; 50. 5-амнно-1-(2,6-дихлор-3,5-дифтор-4-трифторметилфенил)-3,4- дицианопиразол; 51. 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3,4-дицианопиразол; 52. 5-амино-4-циано-3-этил-1-(2,6-дихлор-4-трифторметалфенил) пиразол; 53. 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-метансульфонил-3- метилпиразол; 54. 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3-метил-4-этоксикарбонилпиразол; 55. 5-амино-1-(2,6-дифтор-4-трифторметилфенил)-4-метансульфонил-3- метилпиразол; 56. 5-амино-1-(2,6-дихлор-3,5,6-трифтор-4-трифторметилфенил)-4-циано-3-трифторметилпиразол; 57. 5-амино-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол; 58. 5-амино-3-хлорфторметил-4-циано-1-(2,6-дихлор-4-трифторметилфенил)пиразол; 59. 5-амино-4-циано-1-(2,6-дихлор-3,5-дифтор-4-трифторметилфенил)-3- трифторметилпиразол; 60. 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-(1-этокси) этиленденамино-3-метилпиразол; 61. 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-метил-5- сукцинимидопиразол; 62. 5-ацетамидо-1-(2,6-дихлор-4-трифторметилфенил)-4-метансульфонил-3-трифторметилпиразол; 63. 5-ацетамидо-1-(2,6-дихлор-4-трифторметилфенил)-3-метил-4- метансульфонилпиразол; 64. 5-амино-1-(2,6-дифтор-4-титрофенил)-3,4-дицианопиразол; 65. 1-(2,6-дихлор-4-трифторметилфенил)-3,4-дициано-5-мстиламинопиразол; 66. 1-(2,6-дихлор-4-трифторметилфенил)-3,4-дициано-5-этиламинопиразол; 67. 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-(N-метил-N-этоксикарбониламино)-3-трифторметилпиразол; 68. 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-(N-ацетил-N-триметилацетиламино)-3-тгрифторматилпиразол; 69. 4-циано-1-(2,6-дихлор-4-трифторметилфeнил)-5-(N-пpoпиoнил-N- триметилацетиламино)-3-трифторметилпиразол; 70. 1-(2,6-дихлор-4-трифторметилфенил)-4-нитро-3-трифторметил-5- триметилацетиламинопиразол; 71. 1-(2,6-дихлор-4-трифторметилфенил)-5-этоксикарбониламино-4- нитро-3-трифторметилпиразол; 72. 3-хлор-1-(2,6-дихлор-4-трифторметилфенил)-4-циано-5-триметилацетиламинопиразол; 73. 3-хлор-1-(2,6-дихлор-4-трифторметилфенил)-4-циано-5- бис(этоксикарбонил)аминопиразол; 74. 3-хлор-1-(2,6-дихлор-4-трифторметилфенил)-4-циано-5- этоксикарбониламинопиразол; 75. 4-циано-5-диацетиламино-1-(2,6-дихлор-4-трифторметилфенил)-3- трифторметилпиразол; 76. 5-(N-ацетил-N-этоксикарбониламино)-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол; 77. 1-(2,6-дихлор-4-трифторметилфенил)-5-бис(этоксикарбонил) амино-3,4-диацианопиразол; 78. 1-(2,6-дихлор-4-трифторметилфенил)-5-бис(этоксикарбонил)амино-4- метилсульфонил-3-трифторметилпиразол; 79. 1-(2,6-дихлор-4-трифторметилфенил)-5-этоксикарбониламино-4-метансульфонил-3-трифторметилпиразол; 80. 1-(2,6-дихлор-4-трифторметилфенил)-3,4-дициано-5-этоксикарбониламинопиразол; 81. 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-йод-3-трифторметилпиразол; 52. 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-йод-3-трифторметилпиразол; 53. 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3-метил-4-нитропиразол; 84. 5-ацетамидо-1-(2,6-дихлор-4-трифторметилфенид)-4-нитро-3-трифторметилпиразол; 85. 1-(2,6-дихлор-4-трифторметилфенил)-4-нитро-3-трифторметилпиразол; 86. 1-(2,6-дихлор-4-трифторметилфенил)-3-метил-4-метансульфонилпиразол; 87. 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-фторпиразол; 88. 1-(2,6-дихлор-4-трифторметилфенил)-4-метансульфенил-3-трифторметилпиразол; 89. 5-хлор-1-(2,6-дихлор-4-трифторметилфенил)-4-циано-3-трифторметилпиразол; 90. 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-(N-этилсульфамоил-3-трифторметилпиразол; 91. 5-амин-1-(2,6-дихлор-4-трифторметилфeнил)-4-(N-метилcyльфaмoил)-3-трифторметиллиразол; 92. 1-(2,6-дихлор-4-трифторметилфенил)-4-циано-3-нитропиразол; 93. 1-(2,6-дихлор-4-трифторметилфенил)-3,4-дициано-5-нитропиразол; 3 27215 94. 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-циано-3-фторпиразол; 95. 6-амино-3-хлор-1-(2,6-дихлор-4-трифторметоксифенил)-4-цианопиразол; 96. 5-амино-3-хлор-4-циано-1-(2,6-дихлор-3,5-дифтор-4-трифторметилфенил)пиразол; 97. 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметил-5-триметилсилилпиразол; 98. 5-третбутилдиметилсилил-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол; 99. 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-метилтио-3-трифторметилпиразол; 100. 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметил-5-трифторметилтиопиразол; 101. 5-карбокси-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол; 102. 1-(2,6-дихлор-4-трифторметилфенил)-4-нитро-3-трифторметил-5-триметилсилилпиразол; 103. 4-пиано-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметил-5-триметилсилилметилпиразол; 104. 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-метоксикарбониламино-3-трифторметилпиразол; 105. 1-(2,6-дихлор-4-трифторметилфенил)-4,5-дициано-3-трифторметилпиразол; 106. 5-амино-3-циано-1-(2,6-дихлор-4-трифторметилфенил)-4-метансульфонилпиразол; 107. 4-ацетил-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол; 108. 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-метилсульфинил-3-трифторметилпиразол; 109. 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-этилсульфинил-3-трифторметилпиразол; 110. 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-этилсульфинил-3-метилпиразол; 111. 5-амино-4-циано-1-(2,6-дихлор-4-трифторметилсульфинилфенил)-3-трифторметилпиразол; 112. 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-метилсульфинил-3-трифторметилпиразол; 113. 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-этилсульфонил-3-трифторметилпиразол; 114. 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-этилсульфонил-3-метилпиразол; 115. 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3-метил-4-пропансульфонилпиразол; 116. 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-трихлорметансульфонил-3-метилпиразол; 117. 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-этилтио-3-метилпиразол; 118. 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3-метил-4-етилпиразол; 119. 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-н-пропилтио-3-метилпиразол; 120. 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-этилтио-3-трифторметилпиразол; 121. 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-метилтио-3-трифторметилпиразол; 122. 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-тиоцианато-3-трифторметилпиразол; 123. 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3-метил-4-тиоцианотопиразол; 124. 5-амино-4-циано-1-(2,6-дихлор-4-метансульфонилфенил)-3-трифторметилпиразол; 125. 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3-метил-4-трихлорметилтиопиразол; 126. 4-циано-1- (2,6-дихлор-4-трифторметансульфонилфенил)-5-нитро-3-трифторметилпиразол; 127. 1-(2,6-дихлор-4-трифторметилфенил)-4-дифторметил-3-трифторметилпиразол; 128. 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-метил-3-трифторметилпиразол. Приведенным выше соединением присвоены номера 1-128 в целях их идентификации и для ссылок на них далее в тексте. Особенно предпочтительными соединениями являются соединения 2, 22, 37, 53, 71, 106 и 118. Согласно отличительному признаку настоящего изобретения обеспечивается способ борьбы с членистоногими в месте их обитания, который заключается в обработке очага (например, путем применения в очаге или на особях) эффективного количества соединения общей формулы 1, различные цифровые обозначения которых приведены выше. Соединения общей формулы 1 могут, в особенности, использоваться в области ветеринарной медицины и в животноводческой практике, а также в профилактических мероприятиях против членистоногих или червеобразных, которые могут внутренним или внешним образом паразитировать на позвоночных, особенно на теплокровных позвоночных животных, например на людях и домашних животный, таких как крупный рогатый скот, овцы, козы, лошади, свиньи, домашняя птица, собаки, кошки и рыба, причем такие паразиты включают иксодовых клещей (например, Ixodes вида Boophilus, например, Boophilus microplus Amblyonima вида Hyaloms, вида Rhipicephalus. например, Rhipicephalus appondiculatus, вида Haemaphysalis, вида Dernmacentor, вида Ornithodorus, например, Ornithodorus moubata), а также клещей (например, вида Damalinia, Dermahyssus gаllinае, вида Sarcoptes, например, Sarcoptes scabiei, вида Psoroptes, виза Chorioptes, вида Demodex, вида Eutrombicula, Diptera, например, вида Aedes, вида Anopheles, вида Musca, айда Hypodemia, вида Gasterophilus, вида Similium; Нemірtеrа), разновидности Тriаtоmа; Phthiraptera (например, вида Damalinia, вида Linognathus); Sphonaptera (например, вида Ctenocephalides); Dictyoptera (например, вида Реrірlаnetа, вида Blatella); Hymsnoptera например, Monorium pharaonis, такие соединения могут также использоваться против инфицирования желудочно-кишечного тракта паразитическими круглыми червями, например, членами семейства Trichostrongylidae, Nippostrongylus brasiliensis, Тriсhіnllа spiralis Haemonchus contorius, Trichostrongylus colubriformis; Nematodirus battus, Osteragia cireumcincta, Trichostrongulus axei, Ccoperia u Hymenolepis nаnа; для защиты продуктов при их хранении, например, таких как хлебные злаки, включающие зерно и муку, земляной орех, корм для животных, товары для древесины и предметы домашнего обихода, например ковры и текстильные изделия, для борьбы с членистоногими, особенно с жуками, такими как долгоносик, моль и клещи, относящимися к разновидностям (Epheslia) садовая моль, (Anthrenus) ковровые жучки, (Trifolium) хрущак мучной, (Sitophilus) каландрины и (Acarus) клещи, для борьбы с тараканами, муравьями и родственными членистоногими насекомыми в зараженных бытовых и промышленных помещениях и для борьбы с личинками москитов в водоемах, водных путях, резервуарах и других емкостях для проточной и стоячей воды; в сельском хозяйстве против взрослых особой личинок и яиц Lepidoptera (бабочки и моль), например, вида Heliothis, такого как Heliothis oirescens (табачный червь), Heliothis amigera и He 4 27215 liothis zea вида Shodoptera, например S.exempta, S.littoralis (Египетский хлопковый червь), S.eridania (важный походный червь), вида Earias, например, E.insulana (Египетский круглый червь), вида Pectinophora, например, Pectinophora gossypiella (розовый коробочный червь), вида Ostrinia например O.nubilalis (мотылек кукурузный), Trichoplusiani вида laphygma (походные черви), виды Agrotis и itmates (совки), вида Wiseana (porinamoth) вида Chilo (огневка), вида Тrуроrуzа и diatraea (огневка сахарного тростника и рисовая огневка), Sparganothis pilleriana (виноградная гусеница), Cydia роmonellа (плодожорка яблонная) Archips (фруктовая плодожорка), Plutella xylostella (моль капустная); против взрослых особей и личинок жучков вида Coleoptera, например, Hypothenemus hampei (кофейный точильщик), вида Hylesinus (короеды), Anthonomus granfis (хлопковый долгоносики), вида Acalymma (огуречный жук), вида Lema, вида Psyllodes, Leptinotarsa decemlineata колорадский жук), Diabrotica (хлопковая гусеница), вида Gonocephalum (личинка чернотелки), вида Agriotes (наматода гемонхус), видов Dermolepida и Heteronychus (личинка хруща), Phaedon cochleariae (горчичный жук), Lissorhoptrus oryzophilus (долгоносик рисовый водяной), MeIigethes (жучки пыльцы), вида Ceutorhyn Ceutorhynclus, видов Ahynchophorus и Cosmopolites (корневые долгоносики); против Hemiptera например, вида Psylla, вида Веmesіа, вида Aphis, вида Myzus, Magouraviciae, вида Phyluxera, вида Adelges, Phorodon humuli (тля хмелевая), вида Аmoalamia, вида wephotetrix (рисовая толстоголовка), вида Empeasca, вида wilaparvata, вида Perkinsiella, вида Руrіllа, вида Aonidiella (щитовка красная померанцевая), вида Coccus, вида Psuedococcus вида Helopeltis (москитные клопы), вида Lygus вида Dysdircus, вида Oxycareuus вида wezara; Hymenoptera, например, вида Athalia и Cephus (песчанки), вида Aila (мурааейлисторез); Diptira, например, вида Нуlеmуіа (root flies), Atherigona и Chlorops (shool flies), вида Phytomyza (моли минеры), вида Сеrаtіtis (фруктовые мухи); семейства Ehysanoptira, например, Ehrips tabaci, Orthoptera например Locusia и вида Schistocrca (саранча) и сверчки, например, Gryllus и вида Achita; Collembola например, вида Sminthurus и вида Onychiurus Isoptera, например Odontotemu (термиты), Aermaptera нанример, вида Forficula (уховертка), а также против других членистоногих, имеющих сельскохозяйственное значение, например, Асаrі (клещи), например, вида Eetranychus вида Panonychus и вида Bryobia клещи пятнистые), вида Eriophyes (галлообразующие клещи), вида Polyphagotarsonenus вида Blanilus (двупарноногие), вида Seutigerella (симфилиды), Onisues (woodlice), вида Eriops (ракообразные); против нематод, воздействующих на растения и деревья, важные для сельского хозяйства, лесного хозяйства, садоводчества либо непосредственно, либо путем распостранения бактериальных, вирусных, микоплазменных или грибковых заболеваний растений, например, таких нематод корневого нароста, как Heloidogine, например, Mincognita цист-нематод, таких как Globodira (например, C.rostochiensis), вида Hetirodera (например, H.avenae); вида Radopholus (например, Psimilis); повреждающих нематод, например, вида Pratylenchus (например, P.pratensis вида Bilonolaimus например, B.gracilis), вида Eylenchulus (например, T.semipenetraus); вида Rotyluchulus (например, R.reniformis) вида; Rotyludus (например, R.robustus); вида Helicotyleuchus (например, H.multicinctus); вида Hemicycliophora (например, H.gracilus); вида Criconemoides (например, C.siniilis); вида Erichodorus (например, Eprimitivus); таких совковых нематод, как Xiphinema (например, X.diversicaudatum вида Liongidorus например, L.elongatus); вида Hoplolaineus (например, H.coronatus); вида Apheleuchoides (например, Aritzema-bsi, A.besseyi таких эхеловых гусениц, как Ditylenchus, например, D.dipsau. Настоящее изобретение обеспечивает также способ борьбы с членистоногими насекомыми растений, который заключается в применении на растениях или среде их произрастания эффективного количества соединения общей формулы 1. Соединения общей формулы 1 могут применяться в виде твердых или жидких композиций на почве с целью решительной борьбы с нематодами, обитающими в данном месте, а также на листве с целью борьбы с нематодами, воздействующими на аэрируемые участки таких растений (например, виды Aphelenchoides и Ditylenchus перечисленные выше). Соединения настоящего изобретения общей формулы 1 ценны в том, что могут уничтожать насекомых, которые обитают на частях растения, удаленных от места применения, например питающиеся листвой насекомые могут уничтожаться с помощью соединения изобретения, которое применяют на корневой системе. Кроме этого, соединения настоящего изобретения могут воздействовать на растение путем противопитательного и репелентного действия. Соединения общей формулы 1 особенно ценны для защиты полевых, фуражных, тепличных, фруктовых и лесных культур, декоративных и лесных растений, например хлебных злаков (таких как маис, пшеница, рис, сорго), хлопок, табак, овощи и салаты), например, бобы, капуста, curcurbits, латтук, лук, помидоры и перец), полевых культур (таких как картофель, свекла, земляные орехи, соя, капуста), сахарный тростник, кормовых культур (таких как маис, сорго, люцерна) плантационных культур (таких как чай, кофе, какао, бананы, пальмовое масло, кокосовый орех, каучук, специи), фруктовых культур (таких как однокосточковые и бескосточковые фрукты, лимоны, авокадо, манго, оливки и орехи), вьющихся, декоративных растений, цветов и кустарников в теплицах, садах и парках, лесных деревьев (как декадных, так и вечнозеленых) в лесах, на плантациях и питомниках. Такие соединения также обладают ценностью в отношении защиты древесины (стоячей, сваленной, превращенной, хранимой или структурированной) от вредного воздействия на них пилильщиков (например, urucerus) или жучков (например, сколитидов, платиподидов, ликтидов, бострихидов, керамбицидов, анобидов). Соединения изобретения находят применение при защите, при хранении таких продуктов, как пшеница, фрукты, орехи, табак, независимо от того, хранятся ли они как таковые или в размолотом либо компаундированном состоянии, от действия моли, жучков и клещей. Могут также защищаться при хранении и животные продукты, такие как шкуры, шерсть, волос и кожи, как в естественном, так и в превращенном виде, например в форме ковров или текстильных изделий, от вредного воздействия моли и жучков; от воздействия клещей и мух при хранении могут также предохраняться мясо и рыба. 5 27215 Соединения с общей формулы 1 обладают особой ценностью в отношении борьбы с членистоногими или с червями, которые оказывают вредное воздействие, распространяются или действуют как векторы заболеваний в отношении людей и домашних животных, например, тех, что были перечислены выше и особенно в отношении борьбы с клещами, вшами, блохами, мелкими двухкрылыми насекомыми, а также с мухами. Соединения общей формулы R1 оказываются особенно полезными при борьбе с членистоногими или червеобразными паразитами, которые присутствуют внутри домашних животных или которые питаются на их шкуре или сосут кровь животного и для такого назначения эти соединения могут применяться орально, парентерально, подкожно или локально. Описанные ниже композиции, предназначенные для локального применения на человеке и животных и для зашиты хранимых продуктов домашних товаров, собственности и площадей общего пользования могут, как правило, также использоваться для применения на растущих растениях, также на месте произрастания растения и во время посева семян. Подходящие методы применения соединений общей формулы 1 включают: на людях или животных, зараженных или подверженных воздействию инфицирования членистоногими или червеобразными паразитами, парентерально, орально или локально применяют композиции, в которых активный ингредиент обладает немедленным и/или пролонгированным действуем в течение некоторого периода времени в отношении членистоногих или червеобразных, например путем введения в пищу или с помощью подходящих орально усвояемых фармацевтических рецептур, съедобных приманок, солевых лизалок, добавок в питательный рацион, различных рецептур, спрэев, ванн, окунаний, опрыскиваний, дустов, смазок, шампуней, кремов, парафиновых мазков и систем для самообработки скота; в окружающей среде или в конкретных местах, где могут скрываться насекомые, включая хранимые продукты, древесину, домашнюю утварь, бытовые и промышленные помещения, такие соединения применяют в виде спрэев, капельных рецептур, дустов, дымов, мазков, лаков, гранул и приманок, а в видных путях, водоемах, резервуарах и других состояниях проточной или стоячей воды такие соединения вводят в виде добавок; для домашних животных, такие соединения вводят в пищу с целью борьбы с личинками мух, питающихся их фекалиями. Соединении общей формулы 1 могут применяться для борьбы с членистоногими или червями в композициях любого типа, известного из литературы для внутреннего или внешнего применения на позвоночных или применения для борьбы с членистоногими в любых помещениях, или на внешней или внутренний площадях, причем такие композиции содержат в качестве активного ингредиента, по крайней мере, одно соединение общей формулы 1 в смеси с одним или более совместимыми разбавителями или присадками, подходящими для данного назначения. Все такие композиции могут быть приготовлены любым из известных способов. Твердые или жидкие приманки, пригодные для борьбы с членистоногими включают одно или более соединений обшей формулы 1 и носитель или разбавитель, которые могут включать пищевое вещество или другие вещества, предназначенные для того, чтобы вызвать потребление членистоногим паразитом, Жидкие рецептуры включают смешивающиеся с водой концентрат-эмульгируемые концентраты, способные к истечению суспензии, смачиваемые или растворимые порошки, содержащие одно или более соединений общей формулы 1, которые могут применяться для обработки субстратов или участков, инфицированных или подверженных инфицированию членистоногими, и они включают помещения, площади внешнего или внутреннего хранения или обработки, резервуары или оборудование для проточной или стоячей воды. Твердые гомогенные или гетерогенные композиции, содержащие одно или более соединений общей формулы 1, например гранулы, таблетки, брикеты или капсулы, могут использоваться для обработки стоячей или проточной воды в течение некоторого периода времени. Аналогичный эффект может достигаться с использованием струи или периодической подачи водорастворимых концентратов, описанных в настоящем изобретения. Композиции в форме аэрозолей, а также водные или неводные растворы или дисперсии, подходящие для использования в целях опрыскивания, туманообразования или распрыскивания в малых или улътрамалых объемах также могут использоваться для данного назначения. Подходящие твердые разбавители, которые могут использоваться для приготовлений композиций, подходящих для применения соединений общей формулы 1, включают силикат алюминия, кизельгур, пшеничную шелуху, средний фосфат кальция, порошкообразную пробку, адсорбционную сажу, силикат магния, такие глины, как каолин, бентонит или аттапульгит, а также водорастворимые полимеры, и такие твердые композиции, если желательно, могут содержать один или более совместимых смачивающих, диспергирующих, эмульгирующих или придающих цвет агентов, которые в твердом состоянии могут служить также разбавителем. Такие твердые композиции, которые способны принимать форму дуста, гранул или смачиваемых порошков, обычно получают путем импрегнирования твердых разбавителей растворами соединения общей формулы 1 в среде летучих испарителей, выпариванием растворителей и, если это необходимо, путем размалывания продуктов с тем, чтобы получить порошки, и, если желательно, проводят грануляцию или компремирование продуктов с тем, чтобы получить гранулы, таблетки или брикеты или проводят капсулирование тонкоразмолотого активного ингредиента в природные или синтетические полимеры, например желатин, синтетические смолы и полиамиды. Смачивающие, диспергирующие и эмульгирующие агенты, которые могут присутствовать особенно в смачиваемых порошках, могут представлять собой вещество ионного или неионного типов, например сульфорициноляты, четвертичные аммониевые производные продуктов конденсации окиси этилена с нонил- и октилфенолом, или сложные эфиры карбоновой кислоты и ангидросорбитов, которые остаются раствори 6 27215 мыми в результате этерификации свободных гиароксильных групп путем конденсации окисью этилена, или смеси агентов таких типов. Смачиваемые порошки можно обрабатывать водой сразу перед использованием с тем, чтобы получить готовые к использованию суспензии. Жидкие композиции для применения соединений общей формулы 1 могут иметь форму растворов, суспензий и эмульсий, в которых соединение общей формулы 1 может быть закапсулировано природными синтетическими полимерами, и могут, если это желательно, включать смачивающие, диспергирующие или эмульгирующие агенты. Такие эмульсия, суспензии и растворы могут быть получены с использованием водных, органических или водно-органических разбавителей, например ацетофенона, изофорона толуола, ксилола, минеральных, растительных или животных жиров, а также водорастворимых полимеров (и смесей таких разбавителей), которые могут содержать смачивающие, диспергирующие или эмульгирующие агенты ионного или иеионного типов, или смеси таких веществ, например, те, что описаны выше. Если желательно, то эмульсии, содержащие соединения общей формулы 1, могут использоваться в форме самоэмульгирующих концентратов, содержащих активное соединение, растворенное в эмульгирующих агентах или в растворителях, содержащих эмульгирующие агенты, совместимые с активным веществом, причем простое присоединение воды к таким концентратам даст готовые к использованию композиции. Композиции, содержащие соединения общей формулы 1, могут использоваться для борьбы с членистоногими, растительными нематодами или червеобразными паразитами и они могут также содержать синергетики (например, пиперонилбуталат или сезамекс), стабилизирующие вещества, другие инсектициды, акаридиды, растительные нематоциды или антилметики, фунгициды (общепринятые в сельскохозяйственной практике или в ветеринарии, например беаомил, ипродин), бактерициды, аттрактанты, репелленты или феромоны членистоногих или позвоночных, реодоранты, вкусовые агенты, красители и вспомогательные терапевтические агенты, например следовые элементы. Эти вещества могут быть предназначены для улучшения мощности действия, длительного сохранения эффекта, безопасности, расширения, если это желательно, спектра насекомых, подлежащих уничтожений, или обеспечения других полезных функций на животном или обрабатываемой площади. Результаты испытаний пестицидных свойств. Испытательный пример 1. Методика испытаний. Были приготовлены одно или более разбавлений испытываемых соединений в 50% водном ацетоне. a) Испытываемые виды; Plutella xylostella (моль капустная) и Phaedon cochleariae (горчичный жух). Кружки листьев репы (турнепса) помещали в агар в чашках Петри и заражали 10 личинками (PIutella во второй стадии развития или Phaedon в третьей стадии). Для каждой обработки предназначали четыре одинаковых чашки и опрыскивали под колонной Поттера при соответствующем экспериментальном разбавлении. Через четыре или пять дней после обработки чашки удаляли из помещения с постоянной температурой (25°С), в котором они выдерживались, и определяли средний процент гибели личинок. Эти данные сравнивались и корректировались со смертностью в чашках, обработанных только 50% водным ацетоном, служившим в качестве контроля. b) Megoura viciae (гороховая тля). Выращенные в горшках растения бобов заражали Megoura в различных стадиях развития и опрыскивали сверху вниз с использованием вращающегося распылителя. Обработанные растения выдерживали в теплице два дня и оценивали смертность тлен с использованием системы оценок. О реакции судили из сравнения с растениями, обработанными только 50% водным ацетоном в качестве контрольного соединения. Оценка Все три погибли .....................................................3 Несколько экземпляров осталось в живых ............2 Большая часть осталась Б живых..........................1 Существенной смертности не наблюдается..........0 В соответствии с описанным выше способом (а) применение следующих ниже соединения в концентрации 500 ч/млн оказалось полностью эффективным против личинок Plutella xylostella, обеспечивая 100% смертность. Соединения N: 5, б, 7, 8, 20, 21, 22, 28, 30, 31, 32, 35, 36, 637, 38, 39, 41, 42, 43, 44, 68, 69, 70, 71, 72, 73, 76, 79, 80, 81, 85, 87, 94, 99, 102, 103, 104, 105, 106, 108, 111, 120, 121. Согласно описанному выше способу (а) применения следующих ниже соединений в количестве 5 ч/млн оказалось полностью эффективным против личинок Phaedon cochleariae, обеспечивая 100% смертность. Соединения N: 36, 53, 57, 58, 70, 71, 74, 79, 80, 90, 91, 97, 98, 99, 102, 104, 106, 108, 109, 111, 112, 113, 116, 118, 120, 121. Применение 50 ч/млн следующих ниже соединений согласно способу (а) оказалось полностью эффективным против Megonra vicial, обеспечивая 1000 смертность, т.е. была получена оценка 12 для 4 повторных экспериментов. Соединения N: 4, 5, 20, 21, 36, 48, 53, 57, 58, 82, 83, 92, 98, 102, 106. 109, 111, 116, 117, 118, 120 с) Испытываемые виды; Spodoptera lilloralis Кружки листьев фасоли обыкновенной помещали в агар в чашки Петри и заражали пятью личинками во второй стадии развития. Для каждой обработки предназначали 4 одинаковых чашки и опрыскивали под колонной Поттера при соответствующем разбавлении. Через два дня живые личинки были перенесены на аналогичные чашки, содержащие необработанные листья, помещенные в агар. Через два-три дня чашки 7 27215 удаляли из комнаты с постоянной температурой (25°С), в которой они содержались, и определяли средний процент гибели личинок. Эти данные сравнивали со смертностью личинок в чашках, обработанных только 50% водным ацетоном, служившим в качестве контроля. Данные, представленные в табл. 1-7, суммируют результаты нескольких различных экспериментов, проведенных в соответствии с а), о) и с), описанными выше. По описанной выше методике с) применение 500 частей на миллион следующих ниже соединений против личинок Spodoplera litooralis обеспечивает % гибели, приведенной ниже. N соединения % гибели 50 ......................................................................5 56 ......................................................................7 59 ......................................................................5 62 ....................................................................18 84 ....................................................................98 Дальнейшие испытания проводили на Sitophilus granarius и Blatella germanica, как описано ниже. Sitophilus granarius. Соединения растворяли в ацетоне для получения раствора требуемой концентрации 1,5 мл этого раствора пипеткой отбирали и наносили на 15 г зерна, которое затем высушивали. Зерно переносили в стеклянные пробирки и заражали 20 взрослыми особями. Смертность оценивали через одну или две недели. Представленные концентрации относятся к конечному уровню соединения на зерне (в массовом отношений). В соответствии с этой методикой применение следующих соединений было эффективным против взрослых Sitophilas granarius, вызывавшее, по меньшей мере, 70% гибель при 200 частях на миллион. Blatella germanica. Соединения растворяли в целлозольве или в бутаноне для получения раствора требуемой концентрации. Чувствительных самцов тараканов затем обрабатывали 0,5 мл этого раствора, нанося его между третьей парой сохае со стороны брюшка. Затем тараканов содержали шесть дней с получением пищи и воды и затем оценивали смертность. В соответствии с описанной методикой применения соединения 16, 26 и 92 оказались эффективным против Blatella germanica, вызывая 100% гибель при 250 частях на миллион. Ближайшими структурными аналогами заявленных соединений, обладающими инсектицидной активностью, являются соединения раскрытые в Заявке на Европейский патент ЕР-А-0201852. Ниже показано, что соединения настоящего изобретения, которые отличаются от соединений, раскрытых в ЕР-А-0201852, только природой заместителя в третьем положении пиразольного кольца, но обладают в сравнении с ними улучшенной пестицидной активностью. Такое выраженное усиление действия, наблюдаемое в случае заявленных соединений, т.е. при сравнении их с близкими соединениями, представляет собой явное доказательство наличия "положительного эффекта". В приведенном ниже обсуждении соединения настоящего изобретения обозначаются буквой "I" (т.е. Invention - Изобретение) с соответствующим номером соединения. Соединения из Патента ЕР-А-0201852 обозначаются буквой "С" (т.е. Comparsion - Сравнение) с соответствующим номером соединения. Результаты примера испытаний 1 настоящей заявки, относящиеся к использованию соединений настоящего изобретения против Plutella .и Phaedon, сравниваются с соответствующими данными по использованию также Plutella и Phaedon соединений из патента ЕР-А-0201852. С1 и 1121. СІ представляет собой 3-Н-1-(2,6-дихлор-4-трифторметилфенил) - 5-амино-4-метилтио-пиразол. 1121 представляет собой 3-СF3-1-(2,б-дихлор-4-трифторметилфенил)-5-амино-4-метилтиопиразол. Соединение настоящего изобретения 1121 отличается от сравниваемого с ним соединения С1 только наличием в третьем положении пиразольного кольца трифторметильного заместителя. Оба соединения эффективны против Phaedon. В отношении Plutella заявленное соединение также эффективно, тогда как сравниваемое соединение не эффективно против Plutekka. С86 и 1108. С86 представляет собой 3-Н-1-(2,6-дихлор-4-трифтоиметилфенил) -5-амино-4-метилсульфинилпиразол. 1108 представляет собой 3-СFз-1-(2,6-дихлор-4-трифторметилфенил) -5-амино-4-метилсульфонилпиразол. Соединение настоящего изобретения 1108 отличается от сравниваемого соединения С86 только наличием трифторметильного заместителя в третьем положении пиразольного кольца. 1108 эффективен как против Phaedon, так и против Plutella, тогда как С86 не эффективен ни против одного из этих видов. С61, 122 и 1106. С61 представляет собой 3-Н-1-(2,6-дихлор-4-трифторметилфенил) -5-амино-4-метилсульфонилпиразол. 122 представляет собой 3-СFз-1-(2,6-дихлор-4-трифторметилфенил) -5-амино-4-метилсульфонилпиразол. 1106 представляет собой 3-СN-1-(2,6-дихлор-4-трифторметилфенил) -5-амино-4-метилсульфонилпиразол. Все три соединения эффективны как против Phaedon, так и против Plutella. С6З и 1120. 8 27215 С63 представляет собой 3-Н-1-(2,6-дихлор-4-трифторметилфенил) -5- амино-4-этилтиопиразол. 1120 представляет собой 3-СFз-1-(2,6-дихлор-4-трифторметилфенил) -5-амино-4-этилтиопиразол. Оба соединения эффективны против Phaedon. Однако в отношении Plutella соединение настоящего изобретения 1120 также эффективно, тогда как сравниваемое соединение С63 не эффективно. С279 и 1109. С 279 представляет собой 3-Н-1-(2,6-дихлор-4-трифторметилфенил) - 5-амино-4-этилсульфинилпиразол. 1109 представляет собой 3-СFз-1-(2,б-дихлор-4-трифторметилфенил) -5-амино-4-этилсульфинилпиразол. Соединение настоящего изобретения 1109 эффективно против Phaedon, тогда как сравниваемое соединение С279 не эффективно против Phaedon. C280 и 1113. С280 представляет собой 3-Н-1-(2,6-дих-лор-4-трифторметилфенил) -5- амино-4-этил-сульфонилпиразол. 1113 представляет собой 3-СFз-1-(2,6-дихлор-4-трифторметилфенил)-5-амино-4-этилсульфонилпиразол. Соединение настоящего изобретения 1113 эффективно против Phaedon. А сравниваемое соединение C280 не эффективно против Phaedon. Резюмируя вышесказанное, можно отметить, что полученные результаты наглядно демонстрируют возможность применения соединения настоящего изобретения в борьбе с теми видами насекомых, против которых близкие по формуле соединения патента ЕР-А-0201852 неактивны. Испытательный пример 2. Двадцать личинок Rhipicephalus appendienlatus помещали в пластмассовые капсулы, которые присоединяли к обритому боку морских свинок. Через 3 часа, а затем через 23-часовые интервалы морским свинкам производили 4 подкожные инъекции испытуемого соединения. Примерно через 100 часов после инфицирования морских свинок умертвляли, отделяли напитанные кровью личинки клеща, подсчитывали их число и выдерживали при 23°С во влажной камере в течение 14-11 дней. После окончания этого периода оценивали процент выживаемости в результате линьки. Полученные результаты приведены в табл. 8. Испытательный пример 3. Высокая активность соединений общей формулы 1 против тараканов вида Periplanera аmегісаnа демонстрируется результатами следующего эксперимента. Ацетоновый раствор испытуемого соединения в количестве 0,2 мкл инъектировали через мягкую кожицу между лапой и грудной клеткой десятки насекомым, в результате чего обеспечивалась доза порядка 5 мкг на 1 г веса тела насекомого. Для контроля десятки тараканам производили аналогичную инъекцию 0,2 мкл одного ацетона. После обработки насекомых помещали в пластмассовые боксы. Через пять дней после обработки подсчитывали число погибших и выживших насекомых и рассчитывали процент смертности, В соответствии с указанным выше способом доза в 5 мет на 1 г вeca тела насекомого следующих ниже соединений оказалась полностью эффективной против тараканов вида Periplaneia аmегісаnа, обеспечивая 100% смертность. Соединение №: 2, 5, 14, 17, 22, 53. Следующие ниже примеры иллюстрируют композиции для использования против членистоногих, которые включают в качестве активного ингредиента соединения общей формулы 1. Пример А. Порошок для напыления может быть получен однородным смешением, мас.%: 5-Амино-4-циано-1-(2,6-дихлор4-трифторметилфенил)3-трифторметил-пиразол..................................1-10 Тонкоразмолотый тальк ................................ до 100 Этот порошок может быть применен к очагу заражения членистоногими, например к мусорным свалкам или кучам, местам хранения продуктов или хозяйственных товаров, или к зараженным животным, или при риске заразиться членистоногими для контроля членистоногих при глотании. Подходящими устройствами для распределения порошка для напыления к очагу заражения членистоногими являются механическая воздуходувка, приспособленная для обработки ручного инвентаря и домашних животных. 5-Амино-4-циан-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол может быть, при необходимости, заменен в вышеуказанном порошке на любое другое соединение формулы 1. Пример В. Съедобная приманка может быть приготовлена однородным смешение, мас.%: 5-Амино-4-циан-1-(2,6-дихлор4-трифторметил-фенил)3-трифторметилпиразола ............................. 0,1-1,0 Пшеничная мука...................................................80 Меласса ........................................................ до 100 Съедобная приманка может быть применена к очагу заражения, например к домашним или промышленным помещениям, то есть на кухнях, в госпиталях, складах или открытых площадках, зараженных членистоногими, например муравьями, саранчей, тараканами и мухами, для контроля членистоногих при оральном попадании. 5-Амино-4-циан-1-(2,6-дихлор-4-трифторметилфенил)-З-трифторметипиразол может быть, при необходимости, заменен в вышеуказанной съедобной приманки, на любое другое соединение общей формулы I. Пример С. Может быть приготовлен раствор, содержащий, мас.% /об.: 5-Амино-4-циан-1-(2,6-дихлор4-трифторметилфенил) 9 27215 3-трифторметипиразол ........................................15 Диметилсульфоксид ..................................... до 100 путем растворения производной пиразола в части диметилсульфоксида и затим добавления диметилсульфоксида до необходимого объема. Раствор может быть применен к домашним животным, зараженным членистоногими, путем непосредственного распределения на кожу или после стерилизации фильтрованием через политетрафтроэтиленовую мембрану (0,22 микрона размер пор) парентеральной инъекцией при дозах от 1,2 до 12 мл раствора на 100 кг жидкого веса животного. 5-Амино-4-циан-1 -/ 2,6-дихлор-4-трифто рметилфенил/-З -трифторметилпиразол может быть, при необходимости, заменен в вышеуказанном растворе таким же количеством любого другого соединения общей формулы I. Пример D. Смачиваемый порошок может быть получен, мас.%: 5-Амино-4-циан-1-/2,6-диклор4-трифторметилфенид/3-трифторметилпиразол ......................................50 Ethylon BCP (конденсат нонилфенол/этиленоксид, содержащий 9 моль зтиленоксида на 1 моль фенола) .................................................5 Аэросил (тонкодисперсная двуокись кремния)......5 Цетил PF (носитель в виде синтетического силиката магния) ........................40 путем адсорбции Ethylon BCP на Аэросил, смешивания с другими ингредиентами и измельчения смеси в молотковой дробилке с получением смачиваемого порошка, который может быть разбавлен водой до концентрации 0,001-2 мас. %/объем соединения пиразола и применен к очагу заражения членистоногими, например к личинкам двукрылых или нематодам растений, путем разбрызгивания, или к домашним животным, зараженным или при риске заражения членистоногими, путем разбрызгивания или смачивания, или при оральном применении в виде питьевой воды, для контроля за членистоногими или гельминтами. 5-Амино-4-циан-1-(2,6-дихлор-4-трифто рметилфенил)-3-трифторметилпиразол может быть при необходимости заменен в вышеуказанном порошке любым другим соединением общей формулы I. Пример Е. Пилюля с медленным выделением может быть получена из гранул, содержащих уплотняющий агент, связующее, агент медленного выделения и 5-амино-4-циан-1-(2,6-дихлор-4-трифторметил-фенил)- 3-трифторметилпиразолное соединение при варьируемом проценте содержании композиций. Пилюли могут быть получены путем сжатия смеси с получением пилюли удельного веса 2 или более и пилюли могут быть применены орально для жвачных домашних животных для задержки в желудке с обеспечением непрерывного медленного выделения пиразольного соединения жвачных домашних животных членистоногими или гельминтами. 5-Амино-4-циан-1-(2,6-дихлор-4-трифто рметилфенил)-3 -трифторметилпиразол может быть, при необходимости, заменен в вышеуказанных пилюлях на любое другое соединение обшей формулы I. Пример F. Композиция с медленным выделением может быть получена из мас.%: 5-Амино-4-циан-1 - (2,6-дихлор4-трифторметилфенил)3 -трифторметилпиразол ............................... 0,5-25 Поливинилхлоридная основа........................ до 100 путем смешивания поливинилхлоридной основы с пиразольным соединением и подходящим пластификатором, например диоктил-фталатом, и экструдированием из расплава или горячей отливкой гомогенных композиций в подходящие формы, например гранулы, шарики, брикеты или ленты, подходящие для добавления к стоячей воде или, в случае лент, изготовления колец или повязок для применения к домашним животным для контроля паразитов путем медленного выделения пиразольного соединения. Соединения общей формулы I могут быть получены с помощью применения или адаптации известных методов (то есть методов, ранее использованных или описанных в химической литературе) образования гетероциклов, обеспечивая, где необходимо, замену заместителей при защите/ снятии защиты с других заместителей как это, например, описано выше. В последующем описании, если символы, появляющиеся в формулах специально не определены, следует понимать, что они "принимают определенные выше значения" в соответствии с первым определением каждого символа в этой спецификации. Соединения общей формулы I, соответствующие общей формуле 1а, где Y' представляет собой цианогруппу или нитрогруппу RS02, RSO или RS, алкоксикарбонильную группу с нормальной или разветвленной цепью, содержащую 2-7 атомов углерода, или алкильную группу с нормальной или разветвленной цепью, содержащей 1-6 атомов углерода, которая может быть незамещенной или может быть заменена одним или более атомами галогена, Z' представляет собой незащищенную аминогруппу или алкильную группу с нормальной или разветвленной цепью, содержащую 1-4 атомов углерода, и R5 представляет собой атом фтора, или разветвленной цепью, содержащую 1-4 атомов углерода, которая может быть незамещенной или может быть замещена одним или более атомами галогена, или циклоалкильную группу, содержащую 3-6 атомов углерода, могут быть получены по способу, который включает: (і) реакцию соединения общей формулы II или кислотной составной соли этого соединения, например гидрохлоридной, с (1), когда R5 в соединении общей формулы ІА представляет собой атом фтора, хлора или 10 27215 брома, необязательно галогенированную алкильную группу с нормальной или разветвленной цепью, содержащую 1-4 атомов группу, содержащую 3-6 атомов углерода, соединением общей формулы III, где R6 представляет собой цианогруппу или алканоильную группу с нормальной или разветвленной цепью, содержащую 2-5 атомов углерода, и R8 представляет собой алкоксигруппу с нормальной или разветвленной цепью, содержащую 1-4 атомов углерода, предпочтительно отокси, оксигруппу или атом фтора, фтора или брома, или (2), когда R9 в соединении .рощйй формулы 1A представляет собой цианогруппу (и Y' представляет цианогруппу, и Z' представляет собой незамещенную аминогрупп) тетрациа-ноэтиленом. Реакцию соединения общей формулы II с соединением обшей формулы ІII (не обязательно приготовленным на месте) или тетрацианоэтиленом можно проводить в присутствии инертного органического растворителя, например алканола, содержащего 1-4 атома углерода, например этанола, уксусной кислоты, этоксиотанола или эфира, и при температуре от комнатной до температуры кипения с обратным холодильником реакционной смеси и не обязательно в присутствии ацетата, карбоната или бикарбоната щелочного металла, например натрия или калия, или органического основания, например триэтиламина. Когда используют кислую составную соль соединения общей формулы II, то реакцию с соединением общей формулы III осуществляют в присутствии ацетата, карбоната или бикарбоната щелочного металла, например натрия или калия. (ii) Соединения общей формулы 1A, где Z1 представляет собой незамещенную аминогруппу, могут быть получены альтернативной: непосредственно по реакций соединения общей формулы Y'CH2CN с соединением обшей формулы II в присутствии соединения общей формулы R7C(R°)3, где R7 представляет собой алкильную группу с нормальной или разветвленной цепью, содержащей 1-4 атома углерода, которая может быть незамещенной или может быть замещена одним или более атомами галогенов, или циклоалкильную группу, содержащую 3-6 атомов углерода, и R° представляет собой алкоксигруппу, которая может быть группой с нормальной или разветвленной цепью и предпочтительно содержит 1-4 атома углерода, в инертном органическом растворителе, предпочтительно этаноле, при температуры от комнатной до температуры кипения с обратным холодильником. (ііі) Соединения общей формулы IA, где Z1 представляет собой незамещенную аминогруппу и R5 представляет собой цианогруппу, могут быть получены по реакции соединения общей формулы IV с молярным эквивалентом соединения общей формулы V'CH2CN, то есть малононитрилом, когда Y' представляет собой цианогруппу, обычно в присутствии безводного инертного органического растворителя, например этанола, и молярного эквивалента основания, например гидрида натрия, и при температура от 0 до 50°С. Соединения общей формулы IA могут быть получены по реакции соединения обшей формулы II с соединением общей формулы III или тетрацианоэтиленом с выделением интермедиатного соединения обшей формулы V из реакционной смеси. Когда реакцию соединения общей формулы II с соединением общей формулы III проводят в уксусной кислоте, в отсутствии или присутствии ацетата щелочного металла, например натрия или калия, интермедиатное соединение общей формулы V может быть выделено из реакционной смеси в зависимости от его растворимости в реакционной среде и может быть, при необходимости, выделено перед циклизацией, как выше описано для соединения общей формулы IA. Циклизацию соединения общей формулы V, которая составляет существенный признак изобретения, можно проводить В присутствии инертного органического растворителя, например алканола, содержащего 1-4 атома углерода, например этанола, уксусной кислоты или этоксиэтанола, при температуре от комнатной до температуры кипения реакционной смси с обратным холодильником, и не обязательно в присутствии этоксида натрия, когда растворителем является этанол. Следует учитывать, что В препаративном получении соединений общей формулы I следующие вспомогательные способы или адаптации их могут быть осуществлены в подходящем сочетаний для достижения соединения хорошего качества. Соединений общей формулы 1, которые относятся к общей формуле IB, где R1 представляет собой R9C/=O/-группу, где R9 представляет собой алкильную или алкокси группу с нормальной или разветвленной цепью, содержащую 1-6 атомов углерода, или циклоалкильную группу, содержащую 3- 6 атомов углерода, и R2 представляет собой атом водорода или R9 С (=0)-группу, которая идентична группе R9C/=О/ для R1 или -NR1 R2 представляет собой циклический имид, как это определено выше, могут быть приготовлены по реакции соединения общей формулы 1, где представляет собой незамещенную аминогруппу или его соли щелочного металла, с соединением общей формулы R9 СОХ, где Х представляет собой атом хлора или брома, или с соединением общий формулы (R9 СО)2О, или с производной дикарбоновой кислоты. Реакция может быть проведена в отсутствии или присутствии инертного органического растворителя, например ацетонитрила, тетрагидрофурана, кетона, например ацетона, ароматического углеводорода, например бензола или толуола, хлороформа, дихлорметана или диметилфор-мамида, и не обязательно в присутствии кислотосвязующего агента, например пиридина, триэтиламина или карбоната, или бикарбонта щелочного металла, например натрия или калия, при температуре от 0°С до температуры кипения реакционной среды с обратным холодильником, с получением соединения общей формулы IB, где R1 представляет собой R9-С/=0/-группу, где R9 принимает определенные выше значения и R2 представляет собой атом водорода или R9 С/=0) -группу, в зависимости от выбранных условий реакции и/или использования избытка соединения обшей формулы VI или VII. Соединения общей формулы 1B, где R1 представляет собой формильную группу и R2 представляет собой атом водорода, могут быть приготовлены по реакции соединения обшей формулы 1, где Z представляет собой незамещенную аминогруппу, с муравьиной кислотой. Реакция может быть проведена в инертном органическом растворителе, например кетоне, например метилизобтилкетоне, или ароматическом углеводороде, например бензоле или толуоле, при температуре кипения реакционной смеси с обратным холодильником. 11 27215 Соединения общей формулы 1B, где R1 представляет формильную группу и R2 представляет собой атом водорода или формильную группу, могут быть приготовлены по реакции соединения обшей формулы 1, где Z представляет собой незамещенную аминогруппу, с формилуксусным ангидридом. Формилуксусный ангидрид может быть получен из муравьиной кислоты и уксусного ангидрида и реакция соединения общей формулы 1 может быть проведена в отсутствии или присутствии инертного органического растворителя, например ацетона, или ароматического углеводорода, например бензола или толуола, и не обязательно в присутствии кислотосвязывающего агента, например пиридина, триэтиламина или карбоната или бикарбоната щелочного металла, например натрия или калия, при температуре от 0°С до температуры кипения реакционной смеси с обратным холодильником, с получением соединения общей формулы 1B, где R1 представляет собой формильную группу и R2 представляет собой атом водорода или формильную группу, в зависимости от выбранных условий реакции и/или использовании избытка формилуксусного ангидрида. Соединения общей формулы 1B, где R1 представляет собой формильную группу или группу R9С/=0/- и R2 представляет собой атом водорода, могут быть приготовлены путем селективного удаления за счет гидролиза группы R9С/=0/- или формальной группы из соединения общей формулы 1B, где R1 и R2 оба представляют собой R9С/=0/ группу или формильную группу. Гидролиз осуществляют в мягких условиях, например обработкой водно-этанольным раствором или суспензией бикарбоната щелочного металла, например натрия или калия, или водным раствором аммиака. Соединения общей формулы 1B, где R1 представляет собой алкоксикарбонильную группу с нормальной или разветвленной цепью, содержащей 2-7 атомов углерода, которая является незамещенной или замещена одним или более атомами галогена, и R2 представляет собой атом водорода, могут быть получены по реакции соединения формулы VIII, где R10 представляет собой алкоксикарбонильную группу R11С/=0/, где R11 представляет собой алкоксигруппу с нормальной или разветвленной цепью, содержащей 1-6 атомов углерода (которая является незамещенной или замещена одним или более атомами галогена) или феноксигруппу, с соединением общей формулы R11Н, с заменой первой группы, представляемой символом R10 атомом водорода, и с заменой второй группы, представляемой символом R10 алкоксикарбонильной группой, когда R10 представляет собой феноксикарбонильную группу, или, при необходимости, с заменой второй группы, представляемой символом R10 дополнительной алкоксикарбонильной группой, когда R10 в формуле VIII представляет собой алкоксикарбонильную группу. Как хорошо известно специалистам в этой области науки, целевое соединение общей формулы IB получают за счет выбора соответствующих соединений общих формул VIII и IX. Реакцию можно проводить в воде или инертном водно-органическом или органическом растворителе, например алканоле, содержащем 1-4 атома углерода, например этаноле, или ароматическом углеводороде, например бензоле или толуоле, или реакция предпочтительна в избытке соединения общей формулы IX, при температуре от комнатной до температуры кипения реакционной смеси с обратным холодильником и, при необходимости, при повышенном давлении и, не обязательно, в присутствии основания, например алкоксида щелочного металла, например соединения общей формулы IХ. Соединения общей формулы IB, где R1 и R2 которые могут быть одинаковыми или различными, каждый представляет собой формильную группу или группу R9С/=О/-; могут быть получены по реакции производной щелочного металла, например натрия или калия, соединения общей формулы IB, где R1 представляет собой группу R9C/=O=, как определено выше, или формильную группу, и R2 представляет собой атом водорода, с муравьиной кислотой, формилуксусным ангидридом или соединением общей формулы VI. Реакцию можно проводить в инертном апротонном растворителе, например диметилформамиде, при температуре от комнатной до температури кипения реакционной смеси с обратным холодильником. Производные щелочного металла соединений общей формулы 1 (где Z представляет собой незамещенную амино группу) или 1B, где R1 представляет собой группу R9С/=0/ и R2 представляет собой атом водорода, могут быть получены на месте по реакция гидрида щелочного металла, например натрия или калия, в инертном апротонном растворителе, например диметилформамиде, при температуре от комнатной до температуры кйпеиия реакционной смеси с обратным холодильником. Соединения общей формулы VIII, где R10 представляет собой группу R11/=O/-, могут быть получены как описано выше. Соединения обшей формулы VIII, где R10 представляет собой феноксикарбонильнуто группу, могут быть получены по реакции соединения общей формулы I (где Z представляет собой незамещенную амино группу) с соединением общей формулы R12СОХ, где R12 представляет собой фенокси группу, или с соединением общей формулы (R12CO)2O с использованием условий реакции, описанных выше для реакции соединений общей формулы I с соединением формулы VI или VII. Соединении общей формулы IB, где R1 представляет собой группу R13 , которая представляет собой алкильнуто группу с нормальной или разветвленной целью, содержащей 1-6 атомов углерода (которая может быть незамещенной или замещена алкоксикарбонильными группами, содержащими 2-5 атомов углерода) или циклоалкильную группу, содержащую 3-6 атомов углерода, и R2 представляет собой атом водорода, могут быть получены путем удаления группы R9С/=0/- из соединения общей формулы IB, где R1 представляет собой группу R 3 и R2 представляет собой группу R9C/=O. Удаление группы R9С/=О/- может быть проведено селективным гидролизом в мягких условиях, например обработкой гидроокисью щелочного металла, например натрия или калия, в воде или инертном органическим или водно-органическом растворителе, например низшем алканоле, например метаноле, или смеси воды и низшего алканола, при температуре от комнатной до температуре кипения реакционной смеси с обратным холодильником. Соединения общей формулы ЇВ, где R1 представляет собой группу R13, и R2 представляет собой группу 9 R C/=O/, могут быть получены по реакции соединения общей формулы IB, где R1 представляет собой атом водорода, или его производной щелочного металла, например натрия ила калия, с соединением общей формулы R13X1, где X1 представляет собой атом хлора, брома или кода. Реакцию можна проводить в инер 12 27215 тном органическим растворителе, например дихлорметанв, тетрагидрофуране или диметилформамиде, при температуре от комнатной до температуры кипения реакционной смеси с обратным холодильником, когда используют соединение общей формулы 1B, в присутствии основания, например Тритон В; или no реакции соединения общей формулы 1B, где R1 представляет собой атом водорода и R2 представляет собой группу R13 , с соединением обшей формулы VI или VII. Соединения общей формулы 1, где Z представляет собой N-(алкил- или циклоалкил)-N-формиламино группу как описано выше, могут быть получены вышеописанным способом с использованием, где это необходимо, формилуксусного ангидрида вместо соединения общей формулы VI или VII. Соединения общей формулы 1B, где один из R1 и R2 или оба R1 и R2 представляют собой алкильную группу с нормальной или разветвленной цепью, содержащие 1-6 атомов углерода, или циклоалкильную группу, содержащую 3-6 атомов углерода, причем группа, представляемые R1 и R2, являются идентичными, могут быть получены по реакции соединения общей формулы 1, где Z представляет собой незамещенную аминогруппу, или его производное щелочного металла, например натрия иди калия, с соединением общей формулы X, в отсутствии или присутствии инертного органического растворителя, например ароматического углеводорода, например бензола или толуола, хлороформа, дихлорметана, тетрагидрофурана или диметилформамида, и не обязательно в присутствии кислотосвязывающего агента, например пиридина, триэтиламина или бикарбоната щелочного металла, например натрия или калия, при температуре от 0°С до температуры кипения реакционной смеси с обратным холодильником. Производные щелочного металла соединений формул IB (где R1 представляет собой атом водорода) и 1 (где Z представляет собой незамещенную аминогруппу) могут быть получены на месте по реакции соединений с гидридом щелочного металла, например натрия или калия, при температуре от комнатной до температуры кипения реакционной смеси с обратным холодильником. Соединения общей формулы 1, где Z представляет собой алкоксиметиленаминогруппу с нормальной или разветвленной цепью, содержащей 2-5 атомов углерода, которая может быть не замещенной или замещенной у метилена алкильной группой с нормальной или разветвленной цепью, содержащей от 1 до 4 атомов углерода, могут быть получены по реакции соединения общей формулы 1 (где Z представляет собой незамещенную аминогруппу) с трисалкоксиалканом в присутствии кислотного катализатора, например паратолуолсульфокислоты, при температуре от комнатной до температуры кипения реакционной смеси с обратным холодильником. Соединения обшей формулы 1, где Z представляет собой алкилсульфонилеминогруппу с нормальной или разветвленной цепью, содержащей 1-4 атомов углерода, могут быть получены по реакции соединения общей формулы 1 (где Z представляет собой незамещенную аминогруппу) с алкансульфенилхлоридом в присутствии основания, например гидрида натрия, и не обязательно в присутствии краун-эфирного катализатора, например 15-краун-5. Реакция может быть осуществлена в растворителе, например тетрагидрофуране, при температуре от 0°С до температуры кипения реакционной смеси с обратным холодильником. Соединения общей формулы 1, где Z представляет собой –NHCH2R14, где R14 представляет собой атом водорода или алкильную группу с нормальной или разветвленной цепью, содержащей 1-4 атомов углерода, могут быть получены по реакции соединения общей формулы 1; где Z представляет собой – N=(OR15) R14, где R15 означает алкильную группу с нормальной или разветвленной цепью, содержащую 1-4 атома углерода, с восстанавливающим агентом, предпочтительно боргидридом натрия. Реакция может быть проведена в инертном органическом растворителе, причем предпочтительным является этанол или метанол, при температуре от 0°С до температуры кипения реакционной смеси с обратным холодильником. Соединения общей формулы 1, где Y означает -C/=O/NH2, могут быть получены путем частичного гидролиза соединения общей формулы 1, где Y представляет собой -CN, предпочтительно, серной кислотой при температуре от комнатной до 100°С. Соединения общей формулы I, гае Y означает атом хлора, брома и иода, могут быть получены по реакции соединения общей формулы XI с галогенирующим агентом, предпочтительно N-галосукцинимидом, в инертном растворителе, предпочтительно четыреххлористом углероде, при температуре от комнатной до температуры кипения реакционной смеси с обратным холодильником. Соединения общей формулы 1, где Z представляет собой атом хлора, брома и иода, могут быть получены диазотированием соединения общей формулы 1, где Z представляет собой -NH2, с алкилнитритом, предпочтительно, трет-бутилнитритом, в присутствии гало-генирующего агента, предпочтительно бромоформа, иода или безводного хлорида меди, при температуре от 0 до 100°С. Соединения общей формулы 1, где Y означает нитрогруппу, могут быть получены по реакции соединения общей формулы XI с нитрирующим агентом, предпочтительно азотной кислотой не обязательно в присутствии серной кислоты, или азотной кислотой в растворителе, таком как уксусная кислота или уксусный ангидрид при температуре от 0°С до '100°С. Соединения общей формулы 1, где Y означает –SО 2NR16R17, где R16 и R17 могут быть одинаковыми или различными, и каждый представляет собой атом водорода или алкильную группу с нормальной или разветвленной цепью, содержащую 1-6 атомов углерода, могут быть получены по реакции соединения формулы XIV с амином общей формулы R16R17NH в растворителе, таком как толуол или вода при температуре от 0°С до температуры кипения реакционной смеси с обратным холодильником. Соединения общей формулы 1, где Y представляет собой –CONR16R17 , могут быть получены по реакции соединения общей формулы XV, где X2 означает атом хлор или бром, или активный сложноэфирный фрагмент, например 4-нитрофеноксигруппу, особенно атом хлора, с амином общей формулы R16R17NH, в 13 27215 растворителе, таком как толуол или вода, при температуре от 0°С до температуры кипения реакционной смеси с обратным холодильником. Промежуточные соединения общей формулы ХI могут быть получены путем декарбоксилирования соединения общей формулы XVI, осуществляя нагревание ври температуре 100-250°С не обязательно в присутствии инертного органического растворителя, особенно N,N-диметиланилина. Промежуточное соединения общей формулы XI, где означает незамещенную амино группу и R4 представляет собой алкильную группу с нормальной или разветвленной цепью, содержащей 1-4 атом углерода, которые могут быть незамещенными или могут быть замешены одним или более атомами галогена, могут быть также получены по реакции соответствующего b -кето-нитрила или его производной, например имина с арилгидразином, в инертном органическом растворителе, таком как этанол, необязательно в присутствии кислотного или основного катализатора при температуре от комнатной до 100°С, Альтернативно, промежуточные соединения общей формулы XI могут быть получены непосредственно из сложных эфиров соединений общей формулы XVI путем нагревания в инертном органическом растворителе, предпочтительно уксусной КИСЛОТЫ, при температуре от 50°С до кипения реакционной смеси с обратным холодильником в присутствии сильной кислоты, предпочтительно бромистоводородной кислоты. Промежуточные соединения общей формулы XVI могут быть получены гидролизом сложных эфиров общей формулы 1, где Y представляет собой -COOR18, где R18 означает алкильную группу с нормальной или разветвленной цепью, содержащую 1-6 атомов углерода, предпочтительно гидроокисью щелочного металла, в растворителе, таком как водный спирт при температуре от 0°С до температуры кипения реакционной смеси с обратным холодильником. Промежуточное соединения общей формулы XVI могут быть получены по реакции соединения общей формулы XI с хлорсульфоновой кислотой при температуре от 0°С до 150°С. Промежуточное соединения общей формулы XV получают по реакции соединения общей формулы XVI с хлорирующим или бромирующим агентом, или, например, 4-нитрофенолом (предпочтительно тионилхлоридом) при температуре от комнатной до температуры кипения реакционной смеси с обратной холодильником. Соединения обшей формулы I, где Y представляет собой группы -C/=O/R18, где R означает алкильную группу с нормальной или разветвленной цепью, содержащую 1-6 атомов углерода, могут быть получены по реакции соединения формулы XI с ацилирующим агентом, таким как R18COCI в присутствии катализатора, такого как хлорид алюминия, и В инертной органической растворителе, таком как 1,1,2,2-тетрахлорэтан, и при температуре от 0°С до температуры кипения реакционной смеси с обратным холодильником. Когда Z означает аминогруппу, она также может быть ацилирована и может стать необходимым последующий гидролиз с использованием кислоты, такой как соляная или бромистоводородная кислота. Соединения обшей формулы 1, где Y означает -C/=O/R18, также могут быть получены по реакции нитрилов общей формулы 1, где Y представляет собой -CN, с органометаллическим реагентом, таким как соединение общий формулы R18MgX1, в инертной органическом растворителе, таким как диэтиловый эфир или тетратгидрофуран при температуре от 0°С до температуры кипения реакционной смеси с обратным холодильником. Соединения обшей формулы 1C могут быть получены по реакции соединения общей формулы I, где Y означает тиоцианатную группу, с метаолоорганическим реагентом, таким как соединение общей формулы RMgX1, в инертном органическом растворителе, таком как диэтиловый эфир или тетрагидрофуран, и при температуре от комнатной до температуры кипения реакционной смеси с обратным холодильником. Соединения общей формулы 1С, где RS означает иную, чем 1-алкенилтиогруппу, могут быть получены также по реакции соединения общей формулы 1, где Y означает тиоцианатную группу, с основанием, предпочтительно гидроокисью натрия, или восстанавливающим агентом, предпочтительно боргидридом натрия, в присутствии реагента общей формулы R1X', где R1 принимает значения, определенные выше для R, за исключением 1-алкенильная группа, например, метилиодид в инертном органическом растворителе или водноорганическом растворителе, таком как спирт, например этанол или смесь спирта и воды, причем реакцию осуществляют при температуре от комнатной до температуры кипения реакционной смеси с обратным холодильником. Альтернативно, соединения общей формулы 1C, где RS принимает значения, иные чем 1-алкенилтиогруппа, могут быть получены путем восстановительного алкилирования дисульфидов общей формулы XVII, применяющим восстановительный агент, предпочтительно дитионит натрия или боргидрид натрия, в присутствии основания, предпочтительно гидроокси натрия или карбоната натрия, и реагента общей формулы R1Х1, такое как метилиодид, в инертном органическом растворителе или водноорганическом растворителе, таком как спирт, например этанол или смесь спирта с водой^ при температуре от комнатной до температуры кипения реакционной смеси с обратным холодильником. Альтернативно соединения общей формулы 1C могут быть получены из галоида обшей формулы 1, где Y представляет собой атом брома или иода, путем обмена на металл с использованием сильного основания, предварительно бутиллитий и последующего добавления соответствующего дисульфида обшей формулы R-S-S-R в инертном органическом растворителе, таком как тетрагидрофуран, и реакцию осуществляют при температуре от -78°С до комнатной температуры. Альтернативно, соединения обшей формулы 1C, где RS представляет алкилтиогруппу с нормальной или разветвленной цепью, содержащую 1-6 атомов углерода, которая может быть незамещенной или замещена одним или более атомами галогена, могут быть получены по реакции соединений общей формулы XI с алкансульфенил галоидом (который может быть не обязательно замещен одним или более атомами галогена) в инертном органическом растворителе, предпочтительно хлороформе, в присутствии основа 14 27215 ния, такого как пиридин, при температурах от 0°С до температуры кипения реакционной смеси с обратным холодильником. Соединения общей формулы 1C, где RS представляет собой метилтиогруппу, которая является замещенной тремя атомами галогена, которые могут быть одинаковыми или различными, могут быть также получены по реакции соединения общей формулы 1, где Y означает тиоцианатную группу, с источником галогенкарбена, таким как хлороформ и гидроокись натрия, предпочтительно с катализом фазы переноса с использованием бензилтриэтиламмоний хлорида или тетрабутиламмоний хлорида. Соединения обшей формулы 1C, где RS представляют собой алкилтиогруппу с нормальной или разветвленной цепью, содержащей 1-6 атомов углерода, которая является замещенной одним или более атомами фтора, могут быть также получены по реакции галогенного обмена соединения общей формулы IC, где RS представляет собой алкилтиогруппу с нормальной или разветвленной цепью, содержащей 1-6 атомов углерода, которая является замещенной одним или более атомами хлора, с фторирующим агентом, таким как смесь трехфтористой сурьмы и пентахлорида - сурьмы, фтористого калия или фтористого цезия, в апротонном растворителе, таком как сульфолан, при температуре от 50°С до температуры кипения реакционной смеси с обратным холодильником. Соединения общей формулы 1, где Y представляет собой тиоцианатную группу, могут быть получены по реакции соединения общей формулы XI с тиоцианирующим агентом, таким как соли щелочных, металлов или аммония тиоциановой кислоты (например NaSCN) и бромом в инертном органическом растворителе, таком как метанол, и при температуре от 0°С до 100°С. Промежуточные соединения формулы XVII могут быть получены гидролизом тиоцианатов общей формулы 1, где Y представляет собой тиоцианатную группу, предпочтительно с использованием соляной кислоты в присутствии этанола при температуре от комнатной до температуры кипения реакционной смеси с обратным холодильником; они могут быть также приготовлены за счет восстановления тиоцианатов боргидридом натрия в спирте, предпочтительно этаноле, при температуре от комнатной до температуры кипения реакционной смеси с обратным холодильником. Соединения общей формулы 1, где Y означает группу RSO, могут быть получены путем окисления соединений формулы 1C окисляющим агентом, предпочтительно 3-хлорпербензойной кислотой, в инертном органическом растворителе, таком как дихлорметан или перекисью водорода в уксусной кислоте при температуре от 0°С до температуры кипения реакционной среды с обратным холодильником. Соединения общей формулы 1, где Y означает группу RSО2, могут быть также получены по вышеуказанному способу с применением избытка окисляющего агента. Соединения общей формулы 1, где Y означает группу RSО2, где R представляет собой алкильную группу с нормальной или разветвленной цепью, содержащей 1-6 атомов углерода, которая замещена одним или более атомами фтора, могут быть также получены по реакции галогенного обмена соединения общей формулы 1, где Y представляет собой группу RSO2 где R означает алкильную группу с нормальной или разветвленной цепью, содержащей 1-6 атомов углерода, которая замешана одним или болей атомами хлора, с фторирующим агентом, таким как смесь трифторида сурьмы и пентахлорила сурьмы; фтористого калия или фтористого цезия, при температуре от 50 до 200°С. Соединения общий формулы 1, где Y представляет собой группу RSО2, могут быть также получены по реакции соединений обшей формулы XI с соответствующим сульфоновым ангидридом общей формулы (RSО2)2О, например трифторматансульфоновым или метансульфоновым ангидридом, и в присутствии хлористого алюминия в качестве катализатора, и применении инертного органического растворителя, такого как 1,1,2,2-тетрахлорэтана, при температуре от комнатной до 150°С. Ссединения общей формулы 1, где Z представляет гобой алкильную группу с нормальной или разветвленной цепью, содержащей 1 - 4 атомов углерода, карбоксигруппу, групп R19S, где R19 означает алкильную группу с нормальной или разветвленной цепью, содержащей 1-6 атомов углерода, которая может быть незамещенной или замешена одним или более атомами галогена или представляет собой триалкилсилильную группу, содержащую 1-6 атомов углерода в каждой алкильной группе, которые могут быть одинаковыми или различными, могут быть получены по реакции соединения обшей формулы 1, где представляет собой атом водорода, брома вели йода, слитирующим агентам, предпочтительно литийдиизопропиламидом или н-бутиллитием, и реакции с соответствующим субстратом из галоидалкила, двуокиси углерода, диалкилсульфидов или триалкилсилильных галоидов соответственно при температуре от -78°С до комнатной температуры, и в инертном растворителе, предпочтительно тетрагидрофуран. Соединения общей формулы 1, где Z представляет собой атом водорода, могут быть получены диазотированием амина общей формулы 1, где Z представляет собой незамещенную аминогруппу, с исполъзованием алкилнитрита, предпочтительно трет-бутилнитрита, в инертном растворителе, предпочтительно тетрагидрофуране, при температуре от комнатной до температуры кипения реакционной смеси с обратным холодильником. Соединения общей формулы 1, где Z представляет собой группу R19SO, могут быть получены по реакции соединения общей формулы 1, где Z означает группу R19S с окисляющим агентом, предпочтительно 3хлорпербензойной кислотой, в растворителе, таком как дихлорметан, или перекисью водорода в уксусной кислоте при температуре от 0°С до температуры кипения реакционной смеси с обратным холодильником. Соединения общей формулы 1, где Z представляет собой группу R19SО2, могут быть также получены по вышеуказанному способу, используя избыток окисляющего агента. Соединения общей формулы 1, где Z представляет собой атом фтора или цианогруппу, могут быть получены по реакции галоида обшей формулы 1, где Z означает атом хлора или брома, с фторидом щелочного металла, предпочтительно фторидом цезия, или с цианидом щелочного металла, предпочтительно 15 27215 фторидом цезия, или с цианидом щелочного металла, предпочтительно цианистым калием, в безводных условиях в инертном растворителе предпочтительно сульфолане, и при температуре от комнатной до 150°С. Соединения общей формулы 1, где Z представляет собой нитрогруппу, могут быть получены окислением аминов общей формулы 1, где представляет собой незамещенную аминогруппу, с окислителем, предпочтительно трифторуксусной кислотой или метахлорпербензойной кислотой, и в инертном органическом растворителе, предпочтительно дихлорметане, при температуре от 0°С до температуры кипения реакционной смеси с обратным холодильником. Соединения общей формулы 1, где Z представляет собой цианогруппу, могут быть получены дегидратацией соответствующих амидов, предпочтительно путем нагревания с пятиокисью фосфора, при температуре от 50 до 250°С. Амиды могут быть получены (і) по реакции карбоновий кислоты обшей формулы 1, где представляет собой карбоксигруппу, с хлорирующим агентом, предпочтительно тионилхлоридом, и (іі) по реакции полученного хлорида кислоты общей формулы XVIII, с аммиаком: (і) реакцию с хлорирующим агентом, предпочтительно тионилхлоридом, обычно проводят при температуре от комнатной до температуры кипения реакционной смеси с обратным холодильникам; (іі) реакцию с аммиаком обычно проводят в растворителе, который может быть инертнным, предпочтительно толуолом, или в присутствии воды и при температуре от 0°С до 100°С. Соединения обшей формулы 1, где Y представляет собой группу RSO2, которая является иной, чем 1алкенилсульфонильная группа, могут быть получены альтернативно по реакции соли металла сульфокислота, например натрия, с реагентом обшей формулы R1X1 или предпочтительно сульфатом общей формулы (R1)2SО4, в растворителе, таком как вода, и в присутствии бикарбоната натрия, при температуре от 0°С до 100°С. Промежуточная натриевая соль сульфокислоты может быть получена по реакции сульфонилхлоридов общей формулы XIV с сульфитом натрия в присутствии бикарбоната натрия и воды в качестве растворителя, при температуре от 50°С до температуры кипения реакционной смеси с обратным холодильником. Промежуточные соединения общей формулы XIV могут быть также получены из тиоцианатов обшей формулы 1, где Y представляет собой тиоцианатную группу, путем хлорирования с использованием хлора в растворителе, предпочтительно воде, при температуре от комнатной до температуры кипения реакционной смеси с обратным холодильником. Соединения общей формулы 1, где R3 представляет собой галоалкилсульфинильную группу, могут быть получены окислением галоалкилтиопроизводной общей формулы 1, предпочтительно с метахлорпербензойной кислотой и в инертном органическом растворителе, предпочтительно дихлорметане, при температуре от 0°С до температуры кипения реакционной смеси с обратным холодильником. Соединения общей формулы 1, где R° представляет собой галоалкилсульфонильную группу, могут быть получены таким же способом с использованием двух мольных эквивалента окислителя. Соединения обще формулы 1, где Y означает атом фтора, могут быть получены диазотированием соответствующих атомов с использованием нитрита натрия в тетрафторборной кислоте и серной кислоте при температуре от -10°С до +10°С, после чего следует фотолиз в присутствии избытка натриевой соли тетрафторборной кислоты при температуре от -30°С до комнатной температуры. Промежуточные амины, указанные выше, могут быть получены восстановлением нитросоединений общей формулы 1, где Y означает нитрогруппу, предпочтительно с цинком в этаноле при температуре от комнатной до температуры кипения реакционной смеси с обратным холодильником. Соединения общей формулы 1, где Y представляет собой метильную группу, могут быть получены восстановлением кислоты общей формулы XVI с использованием восстановителя, предпочтительно борантетрагидрофуранового комплекса, в растворителе, предпочтительно тетрагидрофуране, при температуре от -30°С до температуры кипения реакционной смеси с обратным холодильником. Соединения общей формулы 1, где Z представляет собой триалкилсилилметильную группу как определено выше, могут быть получены по реакции соединения общей формулы 1, где представляет собой метильную группу, с литирующим агентом, предпочтительно литийдиизопропиламидом или н-бутиллитием, и реакции с триалкилсилилгалоидом при температуре от –78°С до комнатной температуры, и в инертном органическом растворителе, предпочтительно тетрагидрофуране, не обязательно в инертной атмосфере. Следующие способы не обязательно применяют после проведения вспомогательных приемов, описанных выше, что позволяет получать остальные соединения общей формулы 1, не описанные выше, а также некоторые соединения, которые выше описаны. Соединения общей формулы 1, где R4 представляет собой атом хлора, брома или иода и Z представляет собой незамещенную аминогруппу, могут быть получены диазотированием (диамино) соединений обшей формулы 1, в которой Z представляет собой и R4 заменяют на аминогруппу, с использованием мольного эквивалента нитрита натрия в минеральной кислоте, например смеси серной кислоты и уксусной кислоты, при температуре от 0°С до 60°С, и последующей реакции с соответствующей солью меди и соответствующей минеральной кислотой или водным раствором иодида калия (когда R4 представляет собой атом иода) при температуре от 0 до 100°С. Вышеуказанные диаминосоединения, где Y представляет собой цианогруппу, могут быть приготовлены по реакции цианоформа калия KC/CN/з с фенилгидразином общей формулы II в присутствии соляной кислоты при температуре от 50°С до температуры кипения реакционной смеси с обратным холодильником. Соединения общей формулы 1, где R4 представляет собой фторметильнуго группу могут быть получены по реакции соединения общей формулы XII с фторирующим агентом. предпочтительно диэтиламиносератри 16 27215 фторидом в инертном органическом растворителе, предпочтительно дихлорметане, при температуре от 78°С до температуры кипения реакционной смеси с обратным холодильником. Промежуточные соединения общей формулы XII могут быть получены восстановлением соединений общей формулы XIX, предпочтительно, литийборгидридом в инертном органическом растворителе, например тетрагидрофуране, при температуре от 0°C до температуры кипения реакционной смеси с обратным холодильником. Промежуточные соединения общих формул XIX, где R20 представляет собой алкильную группу, и XX, ще Z представляет собой незамещенную аминогруппу, могут быть получены по реакции соединения общей формулы ХIII (где R° представляет собой алкоксигруппу) с -мольлым эквивалентом соединения общей формулы Y'CH2CN, малонитрилом, когда Y представляет собой цианогруппу в присутствии безводного растворителя, зтанола и мольным эквивалентом основания, например гидрид натрия, и при температуре от 0 до 50°С, после чего при необходимости гидролизуют сложные эфиры общей формула XIX водным основанием, например гидроокисью натрия, с сорастворителем, например этанолом, при температуре от 0°С до температуры кипения реакционной смеси с обратным холодильником. Промежуточные соединения формул IV и ХІІІ могут быть получены хлорированием соответствующего незамещенного соединения с использованием хлора или другого хлорирующего агента. Промежуточные соединения общих формул IV и XIII могут быть получены диазотированием соответствующего анилина раствором мольного эквивалента нитрита натрия в минеральной кислоте, например, смеси концетрированной серной кислоты и уксусной кислоты при температуре от 0 до 60°С, и затем реакцией с соединением формулы СНзСОСНз (CI) CN или соединением общей формулы СНзСОСН/Cl/COR0, где R0 представляет собой алкоксигруппу в присутствии инертного растворителя, например смеси воды и этанола, содержащей буфер, например, с избытком ацетата натрия, и при температуре от 0 до 50°С. Соединения общей формулы 1, где R4 означает нитрогруппу, могут быть получены окислением соответствующего амина окислитилем, предпочтительно трифторуксусной кислотой или метахлорпербонзойной кислотой в инертном органическом растворителе, предпочтительно дихлорметане, при температуре от 0°С до температуре кипения реакционной смеси с обратным холодильником, Этим способом могут получены соединения общей формулы 1, где Z представляет собой аминогруппу, с помощью применения известных защищающих агентов. Соединения общей формулы I, где R4 представляет собой атом фтора, могут быть получены диазотированием соответствующего амина общей формулы 1, в которой R4 заманен – NH2 с использованием, например, раствора нитрита натрия в минеральной кислоте, например серной кислоте, в присутствии фторборной кислоты или ее натриевой соли и последующего термолиза или фотолиза диазолиевой фторборатной производной известными методами. Вышеуказанные аминопромежуточные соединения, где Z представляет собой атом водорода, могут быть получены за счет осуществления перегруппировки Куртиса соответствующего азида кислоты путем нагревания в инертном органическом растворителе, таком как толуол, при температуре от 50 до 150°С получением изоцианата, который затем реагирует, например, с трет-бутанолом с получением карбоната, который, в свою очередь, гадролизует с использованием разбавленной кислоты, предпочтительно соляной кислоты, в эталоне при температуре от комнатной до температуры кипения реакционной смеси с обратным холодильником. Промежуточные азиды кислоты могут быть получены по реакции карбоновой кислоты общей формулы XX, где Z представляет собой атом водорода, с хлорирующим агентом, предпочтительно тионилхлоридом, при температурах от комнатной до температуры кипения реакционной смеси с обратным холодильником, после чего следует реакция промежуточного хлорида кислоты с азидом натрия в полярном растворителе, предпочтительно ацетоне и воде при температуре от 0°С до комнатной температуры. Соединения общей формулы 1, где R4 представляет собой цианогруппу, могут быть также получены по реакции карбоновой кислоты общей формулы XX с хлорирующим агентом, предпочтительно тионилхлоридом при температуре от комнатной до температуры кипения реакционной смеси с обратным холодильником, после чего проводят реакцию промежуточного хлорида кислоты с аммиаком с получением промежуточного амида, который затем дегидратируют путем нагревания с дегидратирующим агентом, прсдпочтительно пятиокисью фосфора, при температуре 50 - 250°С. Промежуточные соединения общей формулы XIX предпочтительно с использованием основания, такого как гидроокись натрия, и растворителя, такого как водный спирт, и при температуре от 0°С до температуры кипения реакционной смеси с обратным холодильником. Соединения общей формулы 1, где Y представляет собой 1,1-дифторалкильную группу, которая может быть замещена одним или более дополнительным атомом -галогена, могут быть получены по реакции соединения общей формулы 1, где Y представляет собой алканоильную группу с нормальной или разветвленной цепью, содержащей 2-6 атомов углерода, или соответствующего соединения, в котором Y заменен форминальной группой или алканоильной группой с нормальной или разветвленной цепью, содержащей 2-6 атомов углерода, которая замещена одним или более атомами галогена, с фторирующим агентом, предпочтительно трифторидом диэтиламиносеры или тетрафторидом серы в инертном органическом растворителе, предпочтительно дихлорметаном, при температуре от -78°С до температуры окружающей среды. Соединения общей формулы 1, где Y означает трифторметильную группу или трифторметилалкильную группу, содержащую от 2 до 6 атомов углерода, которая может быть замещена одним или более дополнительными атомами галогена, могут быть получены по реакции фторирующего агента, например тетрафторида серы, с кислотой общей формулы XVI или соответствующим карбоксиалкильным соединением (следует понимать, что карбоксигруппа может быть присоединена к любому положению алкильного фрагмента) при температуре от комнатной до 150°С. 17 27215 Соли с пестицидно-приемлемыми основаниями соединений общей формулы 1, где Z представлен собой карбоксильную группу, могут быть получены из соответствующих соединений общей формулы 1, известными методами, например по реакции стехиомет-рических количеств соединения общей формулы 1 и соответствующего основания, например гидроокиси, карбоната или бикарбоната гидроокиси или карбоната щелочного металла, щелочноземельного металла, аммиака или амина (например, диэтаноламина, триэтаноламина, октиламина, морфолина или диоктиламина) в подходящем растворителе. При необходимости соли могут быть очищены перекристаллизацией из одного, двух или более подходящих растворителей. Соединения общей формулы 1, не описанные до сих пор в химической литературе, вместе со способами из получения формируют дальнейшие существенные признаки настоящего изобретения. Согласно этому настоящее изобретение обеспечивает соединение общей формулы I, где различные символы принимают определенные выше значения, и их соли, за исключением соединений, где R4 и Z оба представляют собой метильную группу, Y означает тиоцианатную группу и (R3)N означает 2-, 3- или 4-нитрогруппу, 4-метильную группу, 4-хлор- или 2,4-динитрогруппу; R4 представляет метильную группу, Y представляет собой цианогруппу, Z представляет собой незамещенную аминогруппу и (R3)n представляет собой незамещенную аминогруппу и представляет собой 4-хлоро-2,4-дихлоро, 3,4-дихлоро, З-хлоро-4-метильную группу, или 2-метил-4-хлорогруппу; R4 означает метильную группу, Y означает цианогруппу или CONH2, Z означает незамещенную аминогруппу и (R3)N означает 3- или 4-фторозамещение; R4 означает этильную группу, Y означает цианогруппу или CONH2, Z представляет собой незамещенную аминогруппу и (R3)n означает 3-или 4-хлоро; 2-, 3- или 4-фторо- или метильную группу, 3-бромо- или 3-нитрозамещение; R4 означает пропильную группу, Y означает цианогруппу или CONH2, Z представляет собой незамещенную аминогруппу и (R3)n означает 3-фторозамещение; R4 представляет собой метильную группу Y означает сульфамиоильную группу, Z представляет собой хлор и (R3)n представляет собой 4-хлорозамещение; R4 представляет собой метильную группу, Y означает нитрогруппу, и Z означает хлор или R4 означает хлор, Y представляет собой нитрогруппу, и Z представляет собой метильную группу и (R3)n означает 4-нитрогруппу; R4 означает нитрогруппу, Y означает цианогруппу или CONH2, Z означает водород или Y означает водород или (R3)n представляет собой 4-нитрозамещение. Согласно следующей цепи настоящего изобретения, предлагаются промежуточные соединения для получения некоторых соединений общей формулы 1, то есть соединении, для которых в их альтернативных значениях Y означает атом водорода, формильную группу или карбоксигруппу, алканоильную группу с нормальной или разветвленной цепью, содержащей 2-6 атомов углерода, которая замещена одним или более атомами галогенов, дигиогруппу (которая соединяет два пиразольных кольца), аминогруппу, SO2Cl группу, карбоксиалкильную группу с нормальной или разветвленной цепью, содержащей от 2 до 6 атомов углерода, Z означает карбамоильную группу или алкоксикарбонильную группу с нормальной или разветвленной цепью, содержащей от 2 до 7 атомов углерода или дифеноксикарбониламино группу, (R3)0 замещение является предпочтительной комбинацией, данной ранее а спецификации или R4 представляет собой аминогруппу, оксиметильную группу, карбоксигруппу или карбамоильную группу или алкоксикарбонильную группу с нормальной или разветвленной цепью или алкоксикабониламиногруплу, содержащую от 2 до 7 атомов углерода. Следующие примеры и ссылочные примеры иллюстрируют получение соединений общей формулы 1 согласно изобретению, Пример 1. Соединение 1. Смесь 2,4,6-трихлорфенилгидразина (21,1 г) и тетраци-аноэтилена (1-5,3 г) в этаноле (100 мл) нагревалась с обратным холодильником в течение 15 минут. Реакционная смесь охлаждалась, а твердый осадок отфильтровывался и промывался ДИЭТИЛОВЫМ эфиром, давая 5-амино-3,4дициано-1-(2,4,б-трихлорфенил) пиразол (13 г) в виде окрашенного в цвет бычьей кожи твердого вещества, т.пл. 267 - 271°С. Пример 2. Соединения 2 и 3. Тетрацианоэтилен (1,9 г) и 2,6-дихлор-4-трифторметилпропилгидразин (3,7 г) добавлялись к перемешиваемому магнитному раствору ацетата натрия (0,6 г) в ледяной уксусной кислоте (15 мл) при температуре лаборатории. После перемешивания в течение 15 минут из раствора выпадало в осадок бесцветное твердое вещество, и перемешиваний продолжалось в течение ночи. Смесь затем фильтровали. Полученной твердое вещество промывалось последовательно уксусной кислотен, водой, видным раствором бикарбоната натрия и водой, давая 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3,4-дицианопиразол (2,5 г) в виде бежевых кристаллов, т.пл, 221 – 222°С. При проведении процесса аналогичным образом, но при замене 2,6-хлор-4-трифтор-метилфенилгидразина 2,3,5,6-тетрахлорфе-нилгидразином получался 5-амино-3,4-дициано-І-(2,3,5,6-тетрахлорфенил) пиразол, т.пл. выше З30°С, в виде окрашенного в бычий цвет порошка. Ссылочный пример 1, Фенилгидразины, используемые в качестве исходных материалов в примерах 1, 2 и 11, не описанные до сих пор В химической литературе, приготавливались следующим образом: 2,6-дихлор-4-трифторметилфениланилин (4,3 г) растворялся при перемешивании в ледяной уксусной кислоте (23 мл). Затем добавлялся раствор нитрата натрия (1,5г) в концентрированной серной кислота (II мл) при 55 - 60°С, Раствор, полученный таким образом, охлаждался до 0 - 5°С, и при энергичном перемешивании добавлялся раствор хлористого олова (2) (16,4 г) в концентрированной соляной кислоте (14 мл). Выпадало в осадок твердое вещество, окрашенной в кремовый цвет. Смесь фильтровалась, и полученное твердое вещество добавлялось к смеси водного раствора аммиака и льда. Полученная таким образом смесь экстрагировалась диэтиловым эфиром (6 х 500 мл), и объединенные эфирный экстракты сушились над сульфатом натрия, фильтровались и упаривались досуха, давая 2,6-дихлор-4-трифторметилфенилгидразин (3,7 г), т.пл. 54 56°С, в форме бесцветного кристаллического твердого вещества. При проведении процесса аналогичным образом, но при замене 2,6-дихлор-4-трифторметиланилина ука 18 27215 занным здесь ниже анилином получали: 2-хлор-4-трифторметфенилгидразин, т.пл. 38-39°С в виде бесцветного твердого вещества из 2-хлор-4трифторметиланилина. Пример 3. Соединение 4. Этоксиэтиленмалононитрил (44,5 г) и 2,6-дихлор-4-трифторметилфенилгидразин (80,0 г) добавлялись к перемешиваемому раствору ацетата натрия (13,4 г) в ледяной уксусной кислоте (110 мл) при комнатной температуре. Получалась пустая суспензия, которая перемешивалась в течение ночи, после чего образовывался темный раствор. Растворитель упаривался в вакууме, и остаток разбавлялся водным раствором бикарбоната натрия (100 мл) и экстрагировался дихлорметаном (3 х 100 мл), и объединенные экстракты промывались раствором бикарбоната натрия (50 мл), затем водой (100 мл), сушились над безводным сульфатом магния и упаривались в вакууме, давая темный сироп. Данное вещество нагревалось с обратным холодильником с 2-этоксиэтавдлом (200 мл) а течение 1 часа, а затем упаривалось в вакууме, давая темное масло. Масло растворялось в дихлорметане, промывалось раствором бикарбоната натрия (50 мл), затем водой (100 мл), сушилось над безводным сульфатом магния, обрабатывалось активированным углем и упаривалось в вакууме, давая черное твердое вещество, Твердое вещество перекристаллизовывались два раза из смеси толуола и петролейного эфира (т. кип. 60 - 80°С), давая 5-амино-4-циано-1 - (2, 6-дихлор-4трифторметилфенил)-3-метлпиразол (49,3 г), т.пл. 194 - 196°С в виде бледно-коричневых кристаллов. Пример 4. Соединения 5, 22, 24 и 36. К перемешиваемому механическим путем раствору 2,6-дихлор-4-трифторметилфенилгидразина (180,3 г) в сухом диэтиловом эфире (700 мл) добавлялся безводный карбонат калия (112 г), и смесь охлаждалась до 0°С. К данной смеси добавлялся по каплям в течение получаса раствор 2-хлор-1,1-дициано-2-трифторметиоэтилена (132,1 г) в сухом диэтиловом эфире (350 мл). В конце реакции ледяная баня удалялась и смесь оставлялась на ночь, а водный раствор экстрагировался диэтиловым эфиром (2 х 300 мл). Объединенные экстракты сушились над безводным сульфатом магния, фильтровались и упаривались в вакууме, давая твердое вещество темно-желтого цвета (350 г). Перекристаллизация из смеси толуола и гексана дала белые кристаллы (169,5 г), т.пл. 202-204°С, 5амино-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпира зола. Поступая аналогичным образом, но заменяя 2-хлор-1,1- дициано-2-трифторметилэтилен 2-хлор-1-циано-1метансульфонил-2-трифторметилэтиленом, получали: 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-метансульфонил-З-трифторметилпиразол в виде кристаллов темно-желтого цвета, т.пл. 215-218°С, из смеси толуолгексан. При проведении процесса аналогичным образом, но при замене 2-хлор-1,1-дициано-2-трифторметилэтилена 2-хлор-1-циано-1-метоксикарбонил-2-трифторметилэтиленом, получался: 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-метоксикарбонил-3-триформетилпиразол в виде желтовато-коричневых кристаллов т.пл. 114-115°С, из гексана. При проведении процесса аналогичным образом, но при замене 2,6-дихлор-4-трифторметилфенилгидразина 2,6-дихлор-4-трифторметоксифенилгидразином получался: 5-амино-4-циано-1-(2,6-дихлор-4-трифторметоксифенил)-3-трифторметилпиразол в виде белых кристаллов, т.пл. 160-160,5°С, из смеси толуола и гексана. Пример 5. Соединения 19, 20, 21 и 47. Безводный ацетат натрия (0,246 г) добавлялся к перемешиваемому раствору 2-хлор-1,1-дициано-2-пентафторэтилэтилена (1,38 г) в уксусной кислоте (5 мл). К данной смеси добавлялся 2,6-дихлор-4-трифторметилфенилгидразин (1,47 г) в течение 5 минут. После перемешивания в течение ночи смесь нейтрализовалась раствором бикарбоната натрия и экстрагировалась дихлорметаном ( 2 х 50 мл). Объединенные экстракты промывались водой, сушились над безводным сульфатом магния, фильтровались и упаривались в вакууме, давая твердое вещество цвета бычьей кожи (2,1 г). Данное вещество нагревалось с обратным холодильником с 2-этоксиэтанолом (10 мл) в течение 1 часа, и упаривалось в вакууме, давая коричневое масло (2,2 г). Данное масло хроматографировалось на кремнеземе (Мерк, 230-400 меш, 0,7 кг/ см-2) с использованием смеси дихлорметана и этилацетата (98,2), давая желтое твердое вещество. Перекристаллизация из смеси дихлорметана и петролейного эфира дала 5-амино-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-пентафторэтилпир азол в виде белых кристаллов, т.пл. 160-162°С. При проведении реакции аналогичным образом, но при замене 2-хлор-1,1-дициано-2-пентафторэтилэтидена 2-хлор-1,1- дициано-2-хлордифторметилэтиленом получался: 5-амино-З-хлордифторметил-1-(2,6-дихлор-4-трифторметил-фенил)-4-цианопиразол в виде белых призм, т.пл. 192°С, из смеси толуола и гексана. При работе аналогичным образом, но при замене 2-хлор-1,1 -дициано-2-пентефторэтилэтилена 2-хлор1,1 -дициано-2-дифтор-мети-лэтиленом получался: 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-циано-3-дифторметилпиразол в виде бесцветного твердого вещества, т.пл. 184,5°С (из смеси толуол - петролейный эфир). При работе аналогичным образом, но при замене 2-хлор-1,1-дициано-2-пентафторэтилэтилена 2-хлор1,1-дициано-2- гептафторпропилэтиленом получался: 5-амино-1-1 (2,6-дихлор-4-трифторметилфенил)4-циано-3-гептафторпропилпиразол в виде бесцветных призм, т.пл. 139-140°С (из толуолпетролейного эфира). Ссылочный пример 2. Хлордицианоэтилены, используемые в качестве исходных веществ в вышеприведенных примерах, до сих пор не описанные в химической литературе, приготавливались следующим образом: суспензия натриевой соли 2-циано-3-окси-4-хлор-4,4-дифторобут-2-еннитрила (18,56 г) в дихлорметане (60 мл) перемешивалась при комнатной температуре и обрабатывалась пентахлоридом фосфора 19 27215 (19,27 г). Смесь нагревалась с обратным холодильником в течение 6 часов, охлаждалась и фильтровались, и фильтрат отгонялся. Применение фракционирующей колонки Widnier'a давало 2-хлор-1,1-дициацо2-хлордифторметилен в виде жидкости, т.пл. 88°С (44 мм рт, ст.) (71 г). При проведении процесса аналогичным образом, но при замене натриевой соли 2-циано-3-гидрокси-4-хлор4,4-дифторбут-2-еннитрила натриевой солью 2-циано-З-гидрокси-4,4- дифторбут-2-еннитрила получали 2-хлор1,1-дициано-2-дифторметилэтилен в виде жидкости, т.пл. 94°С (46 мм рт. ст.). Заменяя нитриевую соль 2-циано-З-гидрокси-4-хлор-4,4-дифторбут-2-еннитрила натриевой солью З-гидрокси-2-метансульфонил- 4,4,4-трифторбут-3-еннитрила и проводя процесс аналогичным образом, получали 2-хлор-1-циано-1-метансульфонил-2-трифторметилэтилен в виде светло-коричневой жидкости. Заменяя натриевую соль 2-циано-З-гидрокси-4-хлор-4,4-дифторбут-2-еннатрила натриевой солью 3-гидрокси-2-метоксикарбонил-4,4,4-трифторбут-2-еннитрила и проводя процесс аналогичным образом, приготавливали 2-хлор-1-циано-1-метоксикарбонил-2-трифторметилэтилен в виде бесцветного масла, т.пл. 8692°C при 23-25 мм рт.ст. Заменяя натриевую соль 2-диано-3-гидрокси-4-хлор-4,4-дифторбут-2-енитрила натриевой солью 2-циано-3-гидрокси-4,4,5,5,6,6,6-гептафторг екс-2-еннитрила и при раоте аналогичным образом, получали 2хлор-1,1,-дициано-2-гептафторпропилэтилен в виде светло-желтой жидкости, т.пл. 110°C при 60 мм рт.ст. Ссылочный пример 3. Натриевые соли, используемые и вышеприведенных ссылочных примерах в качестве исходных материалов, до сих пор не были описаны в химической литературе, они приготавливались следующим образом. К раствору метилата натрия (5,61 г) в безводном метаноле (70 мл) добавлялся мелононитрил (6,85 г) и желтый раствор обрабатывался хлордифторацетатом (15 г.). Смесь нагревалась с обратным холодильником в течение 4 часов, растворитель упаривался в вакууме и вторичное упаривание после добавления толуола давало натриевую соль 2-циано-3-гидрокси-4-хлор-4,4-дифторбут-2-еннитрила в виде коричневого твердого вещества (18,9 г). Оно высушивалось в вакуумном оксикаторе. При проведении процесса аналогичным образом, но заменяя метил хлордифторацетат этил дифторацегатом, получали натриевую соль 2-циано-3-гидрокси-4,4-дифторбут-2-еннитрила, в виде светло-коричневого твердого вещества. При работе аналогичным образом, но, заменяя метилхлордифторацетат метилтрифторацетатом и малононитрил метансульфонилацетонитрилом, получали натриевую соль 3-гидрокси-2-метансульфонил-4,4трифторбут-2-енниитрила в виде коричневого твердого вещества. Осуществляя процесс аналогичным образом, но, заменяя метилхлордифторацетат метилтрафторацетатом и малононитрил металцианоадетатом, получали натриевую соль З-гидрокси-3-метоксикарбонил4,4,4- трифторбут-2-еннитрила в виде твердого вещества цвета бычьей кожи. При проведении процесса аналогичным образом, но при замене метилхлордифтора-цетата метилгептафторбутиратом, получали натриевую соль 2-циано-3-гидрокси-4,4,5,5,6,6,6 -гептафторгес-2-еннитрила в виде светло-коричневого гигроскопического твердого вещества. Пример 6. Соединение 23. К перемешиваемой 80% серной кислоте (22 мл) добавлялся 5-амино-4-циано-1-(2,6- дихлор-4-трифтарметилфенил)-3- трифторметилпиразол (3,98 г) при 80°С. Через 1 час охлажденный раствор выливался на лед и экстрагировался дихлорметаном, (Зх). Объединенные экстракты промывались водой, сушились над безводным сульфатом магния, фильтровались и упаривались в вакууме, давая белое твердое вещество. Данное твердое вещество перекристаллизовывалось из смеси этилацетата и петролейного эфира, давая 5-амино-4-карбамоил-1-(2,6-дихлор-4-трифторметилфенио)-3-трифторметалпиразол (3,5 г), т.пл. 169171°С, в виде белых кристаллов. Пример 7. Соединения 6, 7 и 8. 3,5-Диамино-4-циано-1-(2,6-дихлор-4-трифторметилфенил) пиразол (3,9 г; полученный, как описано ниже) растворялся при перемешивании в ледяной уксусной кислоте (60 мл) при 15°С. Затем на протяжении 5 минут добавлялся раствор нитрита натрия (0,88 г) в концентрированной серной кислоте (5,85 мл) при поддержании 15°С. После дополнительного 15- минутного нахождения при данной температуре раствор темно-красного масла выливался в течение 1 минуты В перемешиваемый раствор хлористой меди (I) (2,32 г) в концентрированной соляной кислоте (36 мл). После 15-минутного нахождения при комнатной температуре, в течение которого выделение азота полностью прекращалось, реакционная смесь выливалась на избыток льда и воды и экстрагировалась дихлорметаном (3 х 50 мл). Объединенные экстракты промывались водой (2 х 50 мл), затем раствором бикарбоната натрия (50 мл), сушились над безводным сульфатом магния и упаривались в вакууме, давая коричневое полутвердое вещество (4,1 г). Хроматография на кремнеземе (Меру, 230-400 меш, 0,7 кг/см с использованием смеси дихлорметана и этилацетата (98:2) в качестве элюента дала после упаривания элюата и перекристаллизации остатка из смеси дихлорметана и петролейного эфира (т. кип. 60-80°С) 5-амино-3-хлор-4-циано-1-(2,6-дихлор-4-трифторметилфенил) пиразол (0,95 г), т.пл. 189-191°С, в виде белых кристаллов. При проведении процесса аналогичным образом, но при замене хлористой меди и концентрированной соляной кислоты бромистой медью и 48 мас.%/ объем бромистоводородной кислотой соответственно получали: 5-амино-3-бром-4-циано-1-(2,6-дихлор-4 -трифторметилфенил) пиразол, т.пл. 182-183°С, в виде белых кристаллов. При замене хлористой меди и концентрированной соляной кислоты раствором йодистого калия в воде получали: 5-амино-3-иод-4-циано-(2,6-дихлор-4-трифторметилфенил) пиразол, т.пл. 208-210°С, в форме белых кристаллов. 20 27215 Ссылочный пример 4. Суспензии 2,6-дихлор-4-трифторметилфенилгидразина (14,7) в воде (40 мл) перемешивалась с коцентрированной соляной кислотой (5.2 мл) и добавлялся цианоформ калия (8,52 г). Суспензия перемешивалась и нагревалась с обратным холодильником в течение 16 часов, и оставлялась на ночь охлаждаться. Смесь промывалась в делительной воронке с помощью этилацетата и воды, и органическая фаза собиралась. Водная фаза повторно экстрагировалась этилацетатом (2 х 80 мл), и объединенные органические растворы промывались водой (2х50 мл), сушились над безводным сульфатом магния и упаривались в вакууме, давая оранжевое твердое вещество (20,9 г). Две перекристаллизации из смеси этилацетата и петролейного эфира (т.кип. 60-80°С) давали 3,5-диамино-2-циано-1-(2,6-дихлор-4-трифторметилфенил) пиразол (7,75 г), т.пл. 208-210°С, в виде белых кристаллов. Пример 8. Соединение 9. Раствор этантиола (2,1 г) в толуоле (10 мл) добавлялся по каплям при 5-10°С к перемешиваемой суспензии N-хлорсукцинимида (4,7 г) в толуоле (40 мл). Реакционная смесь фильтровалась через 20 минут, давая раствор этансульфонилхлорида. Данный фильтрат добавлялся по каплям при перемешивании к раствору натриевой соли 5-мино-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-метилпиразола, полученной на месте по реакции 5-амино-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-метилпиразола (5г) с гидридом натрия (0,4 г) в тетрагидрофуране (50 мл), содержащем 15-крон-5 (3 капли), при температуре 5-10°С. Через 2 часа добавлялся водный раствор бикарбоната натрия (50 мл) и органическая фаза отделялась и промывалась водой (2 х 50 мл), и сушилась над безводным сульфатом магния. Упаривание растворителя в вакууме дало темно-коричневую смолу, которая хроматографировалась на двуокиси кремния (Мерк 230400 меш, 0,7 кг/ см-2) с использованием дихлорметана в качестве элюента. Упаривание элюатов дало оранжевое камедеобразное вещество, которое затем перекристаллизовывалось из смеси этилацетата и гексана, давая 4-фиано-1-(-2,6-дихлор-4-трифторметилфенил)-3-метил-5-этансуль фениламинопиразол (2,3 г), т.пл. 160-161°С, в форме бледно-желтого твердого вещества. Пример 9. Соединения 10, 11 и 27. Смесь 5-амино-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-метилпиразола (5 г) и гидрата п-толуолсульфокислоты (0,1 г) в триметилортоформате (20 мл) нагревалась с обратным холодильником в течение 4,5 часов. После охлаждения реакционная смесь упаривалась досуха в вакууме. Остаток растворялся в диэтиловом эфире и оставлялся кристаллизоваться при 0°С. Темно-окрашенное твердое вещество перекристаллизовывалось из смеси этанола и воды, давая 4-циано-І-(2,6-дихлор-4-трифторметилфенил)-3-метил-5метоксиметиленаминопиразол (4,67 г), т.пл. 75-78°С, в виде кристаллов темно-желтого цвета. При проведении процесса аналогичным образом, но заменяя триметилортоформат трипропилортоформатом получали: 4-циано-1-(2,6-дихлор-4-трифторметилфенил)3-метил-5-пропоксиметиленаминопиразол, т.пл. 77-79°С, в виде темно-желтых кристаллов. При проведении процесса аналогичным образом, но при замене 5-амино-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-метилпиразола 5-амино-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразолом и триметилортоформата триэтилортофор-матом, получили: 4-циано-1-(2,6-дихлор-4-тримторметилфенил)-5-этоксиметиленамино-З-трифторме-тилпиразол, т.пл. 160162°С, из гексана, в виде белых кристаллов. Пример 10. Соединение 12, 13, 14, 15, 16, 26 и 25. Суспензия 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3,4-дицианопиразола (15,0 г) в хлороформе (250 мл) обрабатывалась ацетилхлоридом (42,8 мл) при механическим перемешивании при 0°С. При поддержании температуры 0°С на протяжении 30 минут по каплям добавлялся раствор сухого пиридина (7,0 мл) в хлороформе (30 мл). Смесь перемешивалась в течение ночи при комнатной температуре, а затем нагревалась с обратным холодильником для завершения реакции. После охлаждения раствор выливался в смесь льда и разбавленной соляной кислоты, и хлороформный слой отделялся. Водный раствор повторно экстрагировался хлороформом (2 х 100 мл), и объединенные органические экстракты промывались водой (100 мл), сушились над безводным сульфатом магния и упаривались в вакууме, давая окрашенное в тeмнo-жeлтый цвет твердое вещество (23,0 г). Перекристаллизация из смеси этилацетата и петролейного эфира (т. кип. 60-80'С) дала 5-ацетамидо-1-(2,6-лихлор-4-трифторметилфенил)-3,4-диацианопиразол, т.дл. 208-209°С, в виде белых кристаллов. При проведении процесса аналогичным образом при ацилировании 5-амино-1-(2,6-дихлор-4-трифтометилфенил)-3,4-дицианопиразола соответствующим хлорангидридом кислоты получили следующие фенилпиразолы; 5-дихлорацетамидо-1- (2,6-дихлор-4-трифторметилфенил)-3,4-дидианопиразол, т.пл. 186-187°С, после очистки при растирании с четыреххлористым углеродом и последующей перекристаллизации из смеси этанола и воды в виде не совсем белого твердого вещества. Реакция проводилась при комнатной температуре; 5-циклопропилкербонамидо-1-(2,6-дихлор-4-трифторметилфенил)-3,4-дицианопиразол, т.пл, 217-218°С после перекристаллизации из смеси этанола и воды в виде не совсем белого твердого вещества. Реакция проводилась при комнатной температуре; 5-пентанамидо-1-(2,6-дихлор-4-трифторметилфенил)-3,4-дицианопиразол в виде бледно-желтого стекла. Полосы инфракрасного поглощения: 3260, 3100, 2960, 2940, 2880, 2240, 1730, 1700, 1315, 880, 820 см (жидкая пленка). Реакция проводилась при 0°С во время добавления и после этого при комнатной температуре; 5-пропионамидо-1-(2,6-дихлор-4-трифторметилфенил)-3,4-диацианопиразол, т,пл. 188-I189°C, после очистки с помощью хроматографии на двуокиси кремния (Мекр, 230-400 меш, 0,7 кг/ см-2) с использованием смеси ацетона и гексана (2:3) а качества элюента н последующего растирания с толуолом, в виде бело 21 27215 го порошка. Реакция проводилась при комнатной температуре. При проведении процесса аналогичным образом, но заменяя растворитель ацетонит-рилом, при ацилировании 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3,4-дицианопиразола триметилацетилхлоридом получали следующий фенилпиразол; 1-(2,6-дихлор-4-трифторметилфенил)-3,4-дициано-5-(2,2-диметилпропионамидо) пиразол в виде белых кристаллов, т.лл. 202-203°С, из смеси толуола и гексана, и после очистки с помощью хроматографии на двуокиси кремния (Мекр, 230-400 меш, 0,7 кг/см-2) с использованием смеси дихлорметана и этилацетата (9:1) в качестве элюента. При проведении процесса аналогичным образом, но при замене 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3,4-дицианопира зола 5-амино-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилтагразолом и с помощью нагреванияс обратным холодильником в течение 18 ч получали: 5-ацетамидо-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол, т.пл. 225-227 °С, из смеси этилацетата и гексана, в виде белых кристаллов. Пример 11. Соединения 17 и 18. Безводный ацетат натрия (1,0 г) растворялся в перемешиваемой уксусной кислоте (40 мл), и при комнатной температуре добавлялся тетрацианоэтилен (3,5 г). Добавлялся 2-хлор-4-трифторметилфенилгидразин (5,25 г) в виде одной порции, и смесь перемешивалась в течение ночи. После разбавления водой выпавшее в осадок твердое вещество отфильтровывалось, давая посли сушки 5-амино-1-(2-хлор-4-трифторметилфенил)-2,4-дицианопиразол, т.пл. 209-210°С, в виде белого порошка. При проведении процесса аналогичным образом, но заменяя 2-хлор-4-трифторметилфенилгадразин 2,3,5,6тетрафтор-4-трифторметилфенилгидразином и при охлаждении в течение добавления фенилгидразина к раствору тетрацианоэтилена, получали: 5-амино-3,4-диацино-1-(2,3,5,6-тетрафтор-4-трифторметилфенил) пиразол, т.пл, 262-26З°С, в виде темно-желтого порошка, Пример 12. Соединения 28 и 29. Гидрид натрия (80%, 0,25 г) добавляется к перемешиваемому раствору 5-амино-4-циано-1(2,6-дихлор4-трифторметилфенил)-3-трифторметилпиразола (2,9 г) и сухом тетрагидрофуране (50 мл). После 3 часов нахождения при комнатной температуре при 0°С добавлялись 15-крон-5 (1 капля) и метилиодид (2 г), и смесь оставлялась на ночь при комнатной температуре. Раствор упаривался в вакууме, и остаток растворялся в дихлорметане (50 мл), промывался водой, разбавленной соляной кислотой и водой. После сушки над безводным сульфатом магния, фильтрования и упаривания в вакууме получалось желтое масло. Очистка с помощью хроматографии с использованием двуокиси кремния (Мерк, 230-400 меш, 0,7 кг/см2 ) с дихлорметаном в качестве элюента давала 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-диметиламино-3-триметилпиразол в виде белого твердого вещества, т.пл. 105-107°С. При проведении процесса аналогичным образом, но, заменяя метилиодид этилброма-цетатом и применяя диоксан в качестве растворителя вместо тетрагидрофурана, получался 4-циано-1-(2,6) дихлор-4трифторметилфенил)-5-этоксикарбонилметиламино-3-трифторметилпиразол в виде белых кристаллов, т.пл. 104-106°С, из смеси этилацетата и петролейного эфира. Пример 13. Соединение 30. К суспензии 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-этаксиметиленамино-3-трифторметилпиразола (1,0 г) в метаноле (10 мл), перемешиваемой при комнатной температуре, добавлялся боргидрид натрия (0,17 г). Через 2 ч добавлялось еще 0,17 г боргидрида натрия, а через 1 ч - еще 0,34 г. Спустя один час смесь выливалась в воду (80 мл) и экстрагировалась дихлорметаном (3 • 25 мл). Объединенные экстракты сушились над безводным сульфатом магния, фильтровались и упаривались в вакууме. Полученное таким образом белое твердое вещество очищалось с помощью хроматографии на двуокиси кремния (Мерк, 230-400 меш, 0,7 кг/см-2) с использованием дихлорметана в качестве элюента, давая 4-циано-5-метиламино-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол, в виде белого твердого вещества (0,6 г), т.пл. 200-202°С. Пример 14. Соединения 31, 37 и 38. Гидрид натрия (80%, 0,3 г) добавлялся к перемешиваемому раствору 5-амино-4-циан-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразола (2,9 г) в сухом тетрагидрофуране (50 мл). Спустя 3 часа добавлялся 15-кроун-5 (1 капля) и триметилацетилхлорид (1,8 г) и смесь перемешивалась в течение ночи. Упаривание в вакууме давало темно-желтое полутвердое вещество, которое растворялось в дихлорметане. Данный раствор промывался водой, разбавленной соляной кислотой и снова водой и, наконец, сушился над безводным сульфатом магния. Фильтрование с последующим упариванием в вакууме давали желтое масло, которое очищалось с помощью хроматографии на двуокиси кремния (Мерк, 40-230 меш, 0,7 кг/см-2). Элюирование дихлорметаном дало после упаривания 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-(2,2-диметилпропионамидо)-3-трифторметилпиразол в виде белого твердого вещества, т.пл. 198-200°С. При проведении процесса аналогичным образом, но при замене триметилацетилхлориде этилхлорформатом получался после перекристаллизации из толуола 4-циано-1-(2,6-дихлор-4- трифторметилфенил)-5бис-(этоксикарбонил)амино-З-трифторметилпира зол в виде белых кристаллов, т.пл. 62°С. При проведении процесса аналогичным образом, но при замене триметилацетилхлоридом циклопропан карбоновой кислоты получался 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-бис-(циклопропанкарбонил)амино-3-трифторметилпиразол в виде бледно-желтого вещества, т.пл. 126-127°С. Пример 15. Соединение 39. Раствор 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-бис- (циклопропанкарбонил) амино-3-трифторметилпиразола (1,0 г) в этаноле (50 мл) нагревался с обратным холодильником с насыщенным раствором бикарбоната натрия (25 мл) в течение 45 минут. После охлаждения и упари 22 27215 вания растворителя в вакууме остаток разбавлялся водой и экстрагировался дихлорметаном. Экстракт сушился над безводным сульфатом магния, фильтровался и упаривался в вакууме, давая 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-циклопропанкарбонамидо-З-трифторметилпиразол в виде белого твердого вещества, т.пл. 210-212°С. Пример 16. Соединение 33. Перемешивая смесь 5-амино-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-триф-торметилпиразола (3,89 г) и бромоформа (13 мл) образовалась третбутилнитритом (2,26 мл) при комнатной температуре. Через 15 мин смесь нагревалась до 50°С в течение 1 ч и упаривалась в вакууме, давая красное масло. Оно очищалось с помощью хроматографии на двуокиси кремния (Мерк, 40-230 меш, 0,7 кг/см-2) при элюировании смесью дихлорметана и петролейного эфира (1:2), давая 5-бром-4-циано-1-(2,6-дихлор-4-трифторметнлфенил)3-трифторметилпиразол в виде желтовато-коричневого твердого вещества с т.пл. 85-87°С (3,7 г). Пример 17. Соединение 34. Раствор 5-амино-4-циано-1-(2,6-лихлор-4-трифторметилфенил)-3-гидроксиметилпиразола (1,2.5 г) в дихлорметане (10 мл) добавлялся медленно к перемешиваемому раствору трехфазной диэтиламиносеры (0,66 г) в дихлорметане (6 мл), охлажденному до -78 °С, Через ЗО мин нахождения при данной температуре раствор подогревался до комнатной температуры и перемешивался в течение 2 часов. Смесь затем выливалась B воду (20 мл), дихлорметановый слой отделялся, сушился над безводным сульфатом магния, фильтровался и упаривался в вакууме. Продукт очищался с помошью хроматографии на двуокиси кремния (Мерк, 40-230 мещ, 0,7 кг/см-2) при элюировании смесью дихлорметана и этилацетата (98:2), и последующей перекристаллизации из смеси дихлорметан-пегролейный эфир, давая 5-амино-4-циано-1-(2,6-дихлор4-трифтормет илфенил)- 3-фторметилпиразол в виде белого твердого вещества с т.пл. 139-141°С. Ссылочный пример 5. 5-Амино-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-гидроксиметилпиразол приготавливался следующим образом. Раствор 5-амино-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-З-этоксикарбонилпиразола (1,0 г) в сухом тетрагидрофуране (15 мл) обрабатывался в атмосфере азота боргидритом лития (0,06 г) при перемешивании при комнатной температуре в течение 18 часов. Добавляся этилацетат (5 мл) с последующим добавлением насыщенного раствора хлористого натрия (5 мл), и смесь подкислялась разбавленной соляной кислотой и экстрагировалась дихлорметаном. Экстракт сушился над безводным сульфатом магния, фильтровался и упаривался в вакууме, Остаточное масло очищалось с помощью хроматографии на двуокиси кремния (Мерк, 40-230 мет, 0,7 кг/см-2) при элюировании смесью дихлорметана и этиладетата (1:1), и чистая фракция упаривались в вакууме и перекристаллизовывались из смеси этилацетата и петролейного эфира, давая целевое соединение в виде белого твердого вещества ст.пл. 159-161°С. 5-Аминно-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-этоксикарбонилпиразол приготавливался следующим образом. К гидрату натрия (80%, 0,9 г) в сухом этаноле (30 мл) добавлялся при перемешивании малононитрил (1,98 г). Затем при перемешивании и охлаждении добавлялся зтилхлор-(2,6-дихлор-4-трифторметилфенил гидразино)-ацетат (11,0 г). Внутренняя температура быстро повышалась до 20°С и поддерживалась на зтом уровне в течение часа перед фильтрацией бледно-желтого твердого вещества. Фильтрат упаривался в вакууме, давая оранжевое твердое вещество. Объединенные твердые вещества растворялись в этилацетате, дважды промывались водой, сушились над безводным сульфатам магния, фильтровались и упаривались в вакуума, давая оранжевое твердое вещество (11,0 г). Перекристаллизация из смеси этилацетатпетролейный эфир давала указанное в заголовке соединение в виде желтовато-коричневых кристаллов (8,3 г), т.пл, 208-209°С. Этилхлор-(2,6-дихлор-4-трифторметилфенил) гидразоноацетат приготавливался следующим образом. Нитрит натрия (3,04 г) добавляляся в течение 15 минут к перемешиваемой концентрированной серной кислоте (24 мл) при 30-50°С. Раствор охлаждался до 20°С и по каплям добавлялся в течение 15 минут к раствору 2,6-дихлор-4-трифторметиланилина (9,2 г) в уксусной кислоте (90 мл), температура которого поддерживалась в интервале 35-40°С. Этот раствор затем охлаждался до 10°С и добавлялся по каплям к перемешиваемому раствору безводного ацетата натрия (54 г) и зтилхлорацетоацетата (7,0 г) в смеси воды (72 мл) и этанола (48 мл) в течение 45 минут при таком охлаждении, чтобы поддерживалась температура 10°С. По истечении I часа при комнатной температуре смесь разбавлялась водой, фильтровалась в твердое вещество растворялось В дихлорметане. Данный раствор сушился над безводным сульфатом магния, фильтровался и упаривался в вакууме, давая указанное в заголовке соединение в виде белого твердого вещества (11,9 г), т.дл. 96-98°С. Пример 18. Соединения 32-40. Смесь 5-амино-1-(2-дихлор-4-трифторметилфенил)-3-трифторметилпиразола (3,64 г) и N-бромсукцинимида (1,78 г) в четыреххлористом углероде (30 мл) перемешивалась и нагревалась с обратным холодильником в течение 1 часа. Затем добавлялся N-бромсукцинимид (0,89 г) и нагревание с обратным холодильником продолжалось еще в течение 1 часа. Смесь охлаждалась, фильтровалась и фильтрат упаривался в вакууме, давая оранжевое твердое вещество. Перекристаллизация из петролейного эфира давала 5-амино-4-бром-1-(2,6-дихлор-4трифторметилфенил)-3-трифторметилпиразол в виде белых кристаллов (2,6 г), т.пл. 119-120°С. Проводя процесс аналогичным образом, но заменяя N-бромсукцинимид N-хлорсукцинимидом, получали 5-амино-4-хлор-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол в виде белых кристаллов с т.пл. 99-100°С. В этом случае не требовалось избытка хлорирующего агента. Ссылочный пример 6. 5-Амино-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметил-пиразол приготавливался следующим образом. Раствор 5-амино-4-карбокси-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметил-пиразол (10,5 г) в N, N 23 27215 диметиланилине (13 мл) нагревался с обратным холодильником в течение 3 ч. Охлажденная смесь выливалась в концентрированную соляную кислоту (15 мл) и экстрагировалась эфиром (4 х 30 мл). Объединенный экстракт промывался 6 н. соляной кислотой (3 х 30 мл), водой (2 х 30 мл), сушился над безводным сульфатом магния, фильтровался и упаривался в вакууме. Продукт перекристаллизовывался из циклогексана, давая указанное в заголовке соединение (5,7 г) в виде белых игл, т.пл. 126-128°С. 5-Амино-4-карбокси-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол приготавливался следующим образом. Смесь 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-метоксикарбонил-З-трифторметилпиразола (101,2 г; описанного выше в примере 4) и гидрокси натрия (48 г) в воде (170 мл) и метаноле (550 мл) перемешивалась при комнатной температуре в течение 2 дней, упаривалась в вакууме, и остаток растирался с разбавленной соляной кислотой. Твердое вещество фильтровалось, растворялось в этилацетате и полученный в результате раствор промывался раствором хлористого натрия. После сушки над безводным сульфатом натрия, фильтрации и упаривания в вакууме получали полутвердый остаток. Этот остаток растворялся с гексаном, и твердое вещество перекристаллизовывалось из смеси толуолгексан, давая целевое соединение в виде твердого вещества кремового цвета с т.пл. 212-215°С. Пример 19. Соединение 41. Этилхлорформат (1,6 г) добавлялся к перемешиваемому раствору 5-амино-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразола (3,9 г) в пиридине (15 мл). После перемешивания в течение ночи производилось еще одно добавление этилхлорформата (1,0 мл), и смесь оставлялась стоять в течение 12 ч. Растворитель упаривался в вакууме и остаток подкислялся разбавленной соляной кислотой и экстрагировался дихлорметаном. Данный экстракт промывался водой (Зх), сушился над безводным сульфатом магния, фильтровался и упаривался в вакууме. Очистка с помощью хроматографии на двуокиси кремния (Мерк, 40-230 меш, 0,7 кг/см-2) с элюированием смесью этилацетата и петролейного эфира (1:1) давала белое твердое вещество, которое перекристаллизовывалось из смеси дихлорметана и гексана, давая белые кристаллы 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-этоксикарбониламино-З- трифторметилпиразола, т.пл. 177-179°С. Пример 20. Соединение 35. Раствор 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразола (3,0 г) в концентрированной серной кислоте (10 мл) при 0°С обрабатывался дымящейся азотной кислотой (9 мл) в течение 15 мин при поддержании температуры при 5-15°С. Через 30 мин смесь выливалась в избыток льда, и осажденное твердое вещество отфильтровывалось и растворялось в этилацетате. После сушки над безводным сульфатом магния, фильтрования и упаривания в вакууме получалось коричневое масло. Данное масло растворялось в минимальном количестве этилацетате и разбавлялось гексаном. Выкристаллизовывалось бледно-желтое твердое вещество, которое отбрасывалось. Фильтрат упаривался в вакууме, давая твердое вещество, которое перекристаллизовывалось из смеси толуола и гексана, давая желтое твердое вещество. Одна дополнительная перекристаллизация из той же пары растворителей давала 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-нитро-3-трифторметилпиразол в виде белых кристаллов, т.пл. 214-215°С. Пример 21. Соединение 42. К раствору 5-амино-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразола (2,33 г) в сухом тетрагидрофуране (30 мл) добавлялся при перемешивании при комнатной температуре раствор трет-бутил-нитрита (1,36 мл) в сухом тетрагидрофуране (5 мл) в течение 2 мин. Раствор затем нагревался с обратным холодильником в течение 1 часа и охлаждался, добавлялось дополнительное количество третбутилнитрата (2,72 мл). Раствор нагревался с обратным холодильником в течение 30 минут и оставлялся охлаждаться на ночь. Упаривание в вакууме давало оранжевое масло, которое очищалось с помощью хроматографии на двуокиси кремния (Мерк, 40-230 меш, 0,7 кг/см-2) с элюированием смесью дихлорметана и гексана (1:1). Продукт перекристаллизовывался из гексана, давая 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол, т.пл. 121-123°С, в виде белых кристаллов. Пример 22. Соединение 43. К раствору 5-амино-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметтилпиразола (2,33 г) в хлороформе (30 мл), перемешиваемому при комнатной температуре, добавлялся йод (3,0 г) с последующим добавлением трет-бутилнитрита (1,1 г). Через 2 часа смесь нагревалась при кипячении с обратным холодильником В течение 1,5 ч, охлаждалась и фильтровалась, фильтрат промывался раствором тиосульфата натрия для удаления избытка йода. После промывки водой, сушки над безводным сульфатом магния и упаривания в вакууме получалось желтое твердое вещество. Данное вещество хроматографировалось на двуокиси кремния (Мерк, 40-230 меш, 0,7 кг/см-2) при элюировании смесью дихлорметана и гексана (1:1), давая желтое масло. Растворение в горячем гексане дало после охлаждения 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-5иод-З- трифторметилпиразол в виде белых кристаллов, т,пл.86-87°С. Пример 23. Соединение 44. К сухому циизопропиламину (0,135 г) в сухом тетрагидрофуране (4 мл), перемешиваемому при –78°С, в атмосфере азота добавлялся с помощью шприца раствор н-бутиллития (0,52 мл, 2,6 М раствора в гексане), После подогревания до комнатной температуры в течение 1 мин раствор повторно охлаждался до 78°С и добавлялся с помощью шприца к перемешиваемому раствору 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-З-трифторметилпиразола (0,5 г) в сухом тетрагидрофуране (4 мл) в атмосфере азота при -78°С. Добавление в течение 2 мин было экзотермическим, и внутренняя температура поддерживалась при –60°С в течение дальнейших 15 мин. Добавлялся метилиодид (0,1 мл). После 1,5 часов нахождения при данной температуре раствор выливался в избыток воды и экстрагировался дихлорметаном (Зх), Объединенная органическая фаза промывалась водой, сушилась над безводным сульфатом магния и упаривалась в вакууме, давая твердое вещество. Хроматография на двуокиси кремния (Мерк, 40-230 меш, 0,7 кг/см2) при элю 24 27215 ировании смесью дихлорметангексан (1;3) давала белое твердое вещество (0,2 г). Перекристаллизация из гексана давала 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-метил-З-трифторметилпиразол в виде белах кристаллов с т.пл.90-92°С. Пример 24. Соединение 45. Смесь 5-амино-4-хлорсульфонил-1-(2,6-дихлор-4-трифторметилфенил) -3трифторметилпиразола (1,2 г) и диметиламина (17,6 мл 40%-ного водного раствора) нагревалась на паровой бане в течение часа, охлаждалась и выливалась в толченый лед (50 г), что давало коричневое твердое вещество. Это твердое вещество фильтровалось, сушилось и перекристаллизовывалось из толуола, давая 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-(N,N-диметилсудьфомоил)- 3-трифторметилпиразол (0,8 г) в виде светло-коричневьгх кристаллов, т.пл. 177,6-178,6°С. Ссылочный пример 7. 5-Амино-4-хлор-сульфенил-1-(2,6-дихлор-4-трифторметилфенил)-3- трифторметилпиразол, использовавшийся в вышеприведенном примере, приготавливался следующим образом, 5-Амино-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпираэол (9,1 г) добавлялся порциями к перемешиваемой охлажденной хлорсулсьфоновой кислоте (16,2 г), внутренняя температура поддерживалась ниже 10°С. Оранжевый раствор перемешивался при комнатной температуре в течение 30 мин, затем при 120°С в течение 5 ч и выливался в ледяную воду (300 мл), давая светло-коричневое твердое вещество. Это твердое вещество фильтровалось, сушилось и перекристаллизовывалось из циклогексана, давая указанное в заголовке соединение в виде желтых кристаллов. Пример 25. Соединение 46. Раствор 2,6-дихлор-4-трифторметилфенилгидразина (3,8 г) и 1,1-дициано-2-циклопропил-2-метоксиэтилена (2,23 г) в метаноле (30 мл) перемешивался и обрабатывался гидридом натрия (80%, 30 мг). Спустя 4 ч. раствор упаривался в вакууме иостаток растворялся в этилацета (40 мл), обрабатывался древесным углем и промывался водой. Органическая фаза упаривалась в вакууме, остаточное масло растворялось в петролейном эфире и получались кристаллы 5-амино-4-цианоциклопропил-1- (2,6-дихлор-4-трифторметилфенил) пиразола, т.пл. 197-199°С. Пример 26, Соединения 48, 49 и 50. При проведении процесса по способу, аналогичному способу, описанному в примере 1, но при замене 2,4,6-трихлорфенилгидразина 2,4,6-дихлор-4-трифторметилтиофенилгидразином, получали: 5-амино-3,4-дициано-1-(2,6-дихлор-4-трифторметилтиофенил) пиразол, т.пл.226-226°С, в виде не совсем белого твердого вещества после перекристаллизации из толуола. При применении 2-хлор-3,5-трифтор-4-трифторметилфенил-фенилгидразина получали: 5-амино-1-(2-хлор-3,5,6-трифтор-4-трифторметилфенил)-3,4-дицианопиразол, т.пл. 242-243°С, в виде оранжевого твердого вещества, после перекристаллизации из смеси этанола и воды. При применении 2,6-дихлор-3,5-дифтор-4-трифторметилфенилгидразина получали: 5-амино-1- (2,6-дихлор-3,5-дифтор-4-трифторметилфенил)-3,4- дицианопиразол, т.пл. 245-247°С, в виде не совсем белого твердого вещества. Ссылочный пример 8. 2,6-Дихлор-4-трифторметилтиофенилгидразин приготавливался в соответствии с процедурой ссылочного примера 1 при проведении процесса аналогичным образом, но заменяя 2,6-дихлор-4-трифторметиланилина 2,6-дихлор-4-трифторметилтиоанилином. Ссылочный пример 9. 2-Хлор-3,4.5,6-трифтор-4-трифторметилфенилгидразин приготавливался следующим образом: 3-хлор-2,4,5,6-тетрафторбензотрифторид (12,1 г) и гидразингидрат (3,4 г) нагревались с обратным холодильником с этанолом (50 мл) в течение 3,5 ч. Смесь выливалась в смесь льда и воды (500 мл), перемешивалась, а продукт фильтровался. После промывки водой и сушки в эксикаторе получалось указанное в заголовке соединение в форме белых кристаллов, т.пл. 91 - 92°С. Осуществляя процесс аналогичным образом, но заменяя 2-хлор-3,4.5,6-тетрафторбензотрифторид 3,5дихлор-2,4,6-трифторбензотрифторидом, приготавливали 2,6-дихлор-3,5-дифтор-4-трифторметилфенилгидразин в виде бледно-желтых кристаллов, т.пл. 78 - 80°С. Пример 27. Соединение 51. Проводя процесс аналогичным образом, как описано в примере 2, но используя 2,6-дихлор-4-трифторметоксифенилгидразина, получали: 5-амино-1-(2,6-дихлор-4-трифторметоксифенил)-3,4-дицианопиразол, т.пл. 231-232°С, в форме коричневого твердого вещества, после перекристаллизации из толуола. Ссылочный пример 10. 2,6-Дихлор-4-трифторметоксифенилгидразин, используемый в примере 27, приготавливался с помощью метода ссылочного примера 1, проводимого сходным образом, но с заменой 2,6дихлор-4-трифторметиланилина 2,6-дихлор-4-трифторметоксианилина. Целевое соединение получалось в виде желтовато-коричневых кристаллов с т.пл. 64 - 65°С. Пример 28. Соединения 52, 53, 54 и 55. Осуществляя процесс таким же образом, как и в примере 3, но заменяя этоксиэти-ленмалононитрил этоксипропиленмалононитрилом, получали: 5-амино-4-циано-3-1-(2,6-дихлор-4-трифторметилфенил) пиразол в виде белых кристаллов, т.пл. 158– 160°С, после перекристаллизации из смеси этилацетата и гексана. Проводя процесс аналогичным образом, но, заменяя этоксиэтиленмалононитрил эток-сиэтиленметансульфонилацетонитрилом и заменяя ацетат натрия и ледяную уксусную кислоту, этанолом, содержащим 10 ммол.% триэтиламина при нагревании с обратным холодильником, получали: 5-амино-1-(2,6-дихлор-4-трифторметилфенил)4-метансульфонил-3-метилпиразол в виде белого твердого вещества, т.пл. 195°С, после перекристаллизации из смеси этил ацетата и гексана. Проводят процесс аналогичным образом, но, заменяя этоксиэтиленмалононитрил этиловым эфиром этоксиэ 25 27215 тилендианоуксусной кислоты, получали: 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3-метил-4-этоксикарбонилпиразол в виде белых кристаллов, т.пл. 115-118°С, после перекристаллизации из смеси толуола и петролейного эфира. Осуществляя процесс сходным образом, но, заменяя этоксиэтиленмалононитрил эток-сиэтиленметансульфонилацетонитрилом и заменяя 2,6-дихлор-4-трифторметилфенилгидразин 2,6-дихлор-4-трифторметоксифенилгидразином, и выполняя реакцию в смеси 1 : 1 по объему этанола и триэтиламина при подходящей температуре, получали: 5-амино-1-(2,6-дихлор-4-трифторметоксифенил)4-метансульфонил-3-метилпиразол, в виде желтовато-коричневого твердого вещества, т.пл. 180 - 181°С. Ссылочный пример 11. 3-Этокси-2-метансульфонилбут-2-еннитрил, использовавшийся в примере 28, приготавливался следующим образом: Смесь метансульфонилацетонитрила (200 г), триэтилортоацетата (348 г) и хлористого цинка (21 г) перемешивалась в гексане (1200 мл) при нагревании с обратным холодильником. Дистиллят собирался через головку Mclntyre с дополнительным добавлением гексана к реакционной смеси по мере необходимости. Гексан (2800 мл) собирался в течение 5 часов. После охлаждения смесь упаривалась в вакууме и упаривалась вторично после добавления толуола (100 мл). Остаток растворялся в этилацетате и перекристаллизовывался из смеси этилацетата и гексана дважды, давая белые кристаллы, т.пл. 99°С, которые представляли собой целевое соединение. Пример 29. Соединения 56, 57, 58 и 59. Осуществляя процесс способом, аналогичным описанному в примере 4, но заменяя 2,6-дихлор-4-трифторметилфенилгидразин 2-хлор-3,5,6-трифтор-4-трифторметилфенилгидразином, получали: 5-амино-І-(2-хлор-З,5,6-трифторметилфенил)-4-циано-3-трифторметилпиразол в виде белых кристаллов, т.пл. 187 – 189°С, после перекристаллизации на толуола. При использовании 2,6-дихлор-4-трифторметилтиофенилгидразина получали: 5-амино-4-циано-1-(2,6-дихлор-4-трифторметилтиофенил)-3-трифторметилпиразол в виде бледно-желтых кристаллов, т.пл. 133,5 - 134,5°С, после кристаллизации из гексана, Заменяя 2-хлор-1,1-дициано-2-трифторметилэтилен 2,3-дихлор-1,1-дициано-3-фтор-метилэтиленом, получали: 5-амино-3-хлорфторметал-4-циано-1-(2,6-дихлор-4-трифторметилтиофенил) пиразол после перекристаллизации из смеси толуола и гексана, в виде твердого вещества, т.пл. 186 - 188°С, Применяя 2,6-дихлор-3,5-дифтор-4-трифторметилфенилгидразин, получали: 5-амино-4-циано-1-(2,6-дихлор-3,5-дифтор-4-трифторметилфенил)-3-трифторметилпиразол в виде светло-коричневого твердого вещества, т.пл. 176–177°С. Ссылочный пример 12. Хлордицианоэтилен, использовавшийся в качестве исходного вещества в примере 29, ранее не описаный в химической литературе, приготавливался следующим образом: Осуществляя процесс таким же способом, что и в ссылочном примере 2, но заменяя натриевую соль 2циано-3-гидрокси-4-хлор- 4,4-дифторбут-2-еннитрила соли натриевой солью 2-циано-3-гидрокси-4-хлор-4фторбут-2-еннитрила, получали 2-хлор-2-хлорфторметил-1,1-дицианоэтилен в виде жидкости, т.кип. 90°С (46 мм рт.ст.). Осуществляя процесс таким же образом, что и в ссылочном примэре 3, но заменяя метилхлордифторацетат этилхлорфторацетатом, получали натриевую соль 2-циано-3-гидрокси-4-хлор-4-фторбут-2-еннитрила, представляющую собой оранжево-красное твердое вещество. Пример 30. Соединение 60. При использовании той же методики, как описано выше в примере 9, но, заменяя триметилортоформат на триэтилортоацетат, получают: 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-(1-этоксиэтилиденамино)-3-метил-пиразол в виде белого твердого вещества, т.пл. 50-3°C, после очистки при помощи хроматографии на двуокиси кремния (Мерк, 230400 мет, 0,7 кг/см-2), с использованием дихлорметана в качестве элюанта. Пример 31. Соединения 61, 62 и 63. При использовании этой же методики, как описано в примере 10, но, заменяя 5-амино-1- (2,6-дихлор-4трифторметилфенил)-3,4-дицианопиразол на 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-циано-3-метилпиразол и ацилируя хлорангидридом янтарной кислоты, получают: 4-циано-1-(2,6-дихлор-4-трифторметилфенил)3-метил-5-сукцинимидопирахол в виде белого твердого вещества, и.пл. 202-204°С, после очистки хроматографией на двуокиси кремния (Мерк, 230-400 меш, 0,7 кг/см-2), используя дихлорметанэтилацетат 98:2) в качестве элюанта. При использовании той же методики, но, заменяя 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3,4-дицианопиразол на 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-метансульфонил-3-трифторметилпиразол и применяя ацетонитрил в качестве растворителя для ацилирования, получают: 5-ацетамило-1-(2,6-дихлор-4-трифторметилфенил)-4-метансульфонил-3-трифторметилпиразол в виде белого твердого вещества, т.пл. 194-195°С, после перекристаллизации из толуола. При использовании той же методики (как в примере 10), но, заменяя 5-амино-1-(2,6-дихлор-4-трифторметалфенил)-3,4-дицианопиразол на 5-амино-1-(2,6-дихлор-4-трифторметилфенил) -3-метил-4- метансульфонилпиразол получают 5-ацетомидо-1-(2,6-дихлор-4-трифторметил фенил)-3-метил-4 -метансульфонилпиразол в виде желтых кристаллов, т.пл. 202-203°C. Пример 32. Соединение 64. При использовании той же методики, как описано в примере 11, но, заменяя 2-хлор-4-трифторметилфенилгидразин на 2,6-дихлор-4-нитрофенилгидразин, получают: 26 27215 5-амино-1-(2,6-дихлор-4-нитрофенил)-3,4-дицианопиразол в виде бледно-коричневого твердого вещества, т.пл. 289-290°С. Пример 33. Соединения 65 и 66. При использовании той же методики, как описано в примере 12, но, заменяя 5-амино-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол на 5-амино-1-(2,6-дихлор-4-трифторметилфенил)3,4-дицианопиразол и используя нужное количество метилйодида, получают: 1-(2,6-дихлор-4-трифторметилфенил)-3,4-дициано-5-метиламинопиразол в виде бледно-желтого твердого вещества, т.пл. 165-166°С, после перекристаллизации из толуола. При использовании методики, как описано выше, но, применяя этилйодид, получают: 1-(2,6-дихлор-4-трифторметилфенил)-3,4-дициано-5-этиламинопиразол в виде беловатого твердого вещества, т.пл. 245-246°С, после очистки хроматографией на двуокиси кремния (Мерк 230-400 меш, 0,7 кг/см-2/, используя смесь этилацетата и петролейного эфира (15:85). Пример 34. Соединения 67–79. При использовании той же методики, как описано в примере 14, но, заменяя 5-амино-4-циано-1-(2,6-дихлор4-трифторметилфенил)-3-трифторметилпиразол и триметилацетилхлорид на нужные фенилпиразолы и ацелируюшие агенты, получают: 4-циано-1-(2,6-дихлор-4-трифторметилфенил)5-N-метил-N-этоксикарбониламино) 3-трифторметилпиразол в виде белого твердого вещества, т.пл. 88-90°С, после перекристаллизации из гексана, используя 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-метил-амино-З-трифторметилпиразол и этилхлорформат; 4-циано-1-(2,6-дихлор-4-трифторметилфенил)5-N-ацетил-N-триметилацетиламино)-3-трифторметилпиразол в виде беловатого твердого вещества, т.пл. 83,5-84°С, после перекристаллизация из гексана, используя 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-триметилацетиламино-З-трифторметилпиразол и ацетилхлорид; 4-циано-1-(2,6-дихлор-4-трифторметилфенил)5-N-пропионил-N-триметилацетиламино)-3-трифторметилпиразол в виде белого твердого вещества, т.пл. 56-56,5°С, после перекристаллизации из гексана. используя 4-циано-1-(2,6-дихлор-4- трифторметилфенил)-5-триметилацетиламино-3-трифторметилпиразол и пропионилхлорид; 1-(2,6-дихлор-4-трифторметилфенил)-4-нитро-З-трифторметил-5-триметилацетиламинопиразол в виде белого твердого вещества, т.пл. 219°С, используя 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-нитро3-трифторметилпиразол и триметилацетилхлорид; 1-(2,6-дихлор-4-трифторметилфенил)-5-этоксикарбониламино-4-нитро-3-трифторметилпиразол в виде бледно-желтых кристаллов, т.пл. 124°С, используя 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-нитроЗ-трифторметилпиразол и этилхлорформат; и 3-хлор-1-(2,6-дихлор-4-трифторметилфенил)4-циано-5- триметилацетиламинопиразол, в виде белого твердого вещества, т.пл. 203-204°С; 3-хлор-1-(2,6-дихлор-4-трифторметилфенил)-4-циано-5-бисэтоксикарбонил) амино-пиразол, в виде оранжевого кристаллического твердого вещества, и.пл. б7-69°С; и 3-хлор-1-(2,6-дихлор-4-трифторметилфенил)4-циано-5-этоксикарбониламинопиразол, в виде желтого твердого вещества, т.пл. 175–179°С; (Последние три соединения были получены путем взаимодействия 5-амино-З-хлор-1-(2,6-дихлор-4трифторметилфенил) -4-цианопиразола с соответствующими ацилхлоридами). 4-циано-5-диацетиламино-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол в виде белых кристаллов, т.пл. 138-139°С; и 5-(N-ацетил-N-этоксикарбониламино)-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол в виде белого твердого вещества, т.пл. 101-102°С; (Два указанных выше соединения были получены путем взаимодействия 5-ацетиламино-1-(2,6-дихлор4-трифторметил)-4-циано-3-трифторметилпиразола и соответствующих ацилхлоридов) и 1 - (2,6 -дихлор-4-трифторметилфенил)-5-бис-(этоксикарбонил) - амино-3,4-дицианопиразол и 1-(2,6дихлор-4-трифторметилфенил)-5-бис-(этоксикарбонил)амино-4-метансульфонил-3-трифторметилпиразол получают таким же образом, как описано в примере 14, но заменяя 5-амино-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол на 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3,4-дицианопиразол и на 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-метансульфонил-3-трифторметилпиразол соответственно. Триметилацетилхлорид заменяют на соответствующее количество этилхлорформата (два эквивалента) и также используют 2 эквивалента гидрида натрия. Продукты получают в виде белых кристаллов с т.пл. 74 - 76°С и 148 - 151°С соответственно. Пример 35. Соединения 79 и 80. При использовании той же методики, как описано в примере 15, но, заменяя 4-циано-1- (2,6-дихлор-4трифторметилфенил)-5-бис-(циклопропанкарбонил)амино-3-трифторметилпиразол на 1-(2,6-дихлор-4-трифторметилфенил)-5-бис-(этоксикарбонил) амино- 4-метансульфоннл-3-трифторметилпиразол, получают: 1.- (2,6-дихлор-4-трифторметилфенил) -5-этоксикарбониламино- 4-метансульфонил-3-трифторметилпиразол в виде белого твердого вещества, т.пл. 138 - 141°С. При использовании той же методики, но, заменяя 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-бис(циклопропанкарбонил) амино-3-трифторметилпиразол на 1-(2,6-дихлор-4-трифторметилфенил)-5-бис-(этоксикарбонил) амино-3,4-дицианопиразол, получают: 1 - (2,6-дихлор-4-трифторметилфенил) -3,4-дициано-5-этоксикарбониламинопиразол в виде белого твердого вещества, т.пд, 161 –163°С. 27 27215 Пример 36. Соединения 81 и 82. При использовании той же методики, как описано в примере 18, но, заменяя N-бром-сукцинимид на Nйодсукцинимид, получают 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-йод-3-трифторметилпиразол в виде белого твердого вещества, т.пл. 129°С. Путем замены N-бромсукцинимида на N-йодсукцинимид и, заменяя 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол на 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-З-метилпиразол (далей описанный в ссылочном примере 13), получают: 5-амино-1-(2,6-дихлор-4-трифторметилфенил)4-йод-З-метилпиразол в виде темно-желтого твердого вещества, т.пл. 108–109°С, ПОСЛе перекристаллизации из гексана. Ссылочный пример 13. 5-Амино-1-(2,6-дихлор-4-трифторметилфенил)-3-метилпиразол получают следующим образом: 5-амино-4-карбокси-1-(2,6-дихлор-4-трифторметилфенил)- 3-метилпирззол (28 г) нагревают до 190°С в атмосфере азота и поддерживают при этой температуре до того, как прекратится выделение газа. После охлаждения соединение, указанное в названии, получают в количестве 22 г в виде желтой воды 5-Амино-4-карбокси-1-(2,6-дихлор-4-трифторметилфенил-3-метилпираэол, используемый выше, получают тем же методом, как описано в ссылочном примере 6, но заменяя 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-метоксикарбонил-3-трифтормtтилпиразол на 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-этоксикарбонил-3-метилпиразол (описанный в примере 28), и путем приведения основного гидролиза при температуре дефлегментации в этаноле в течение 13 ч. Получают указанное в названии соединениев виде белого твердого вещества, т.пл. 183 – 184°С. Примеры 37, Соединения 83, 84 и 85. При использовании той же методики, как описано в примере 20, но, заменяя 5-амино-1- (2,6-дихлор-4трифторметилфенил)-3-трифторметилпираэол на 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3-металпиразол и заменяя смесь концентрированной серной и дымящей азотной кислот на концентрированную азотную кислоту, получают: 5-амино-1- (2,6-дихлор-4-трифторметилфенил)-3-метил-4-нитропиразол в виде оранжевых кристаллов, т,пл. 229 - 231°С, после перекристаллизации из смеси толуола и петролейного эфира. При использовании той же методики, но, заменяя 5-амимо-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол на 5-ацетамудо-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол и заменяя смесь концентрированных серной и дымящей азотной кислот на смесь уксусной кислоты и уксусного ангидрида, к которым прибавляют дымящую азотную кислоту, получают: 5-ацитамидо-1-(2,6-дихлор-4-трифторметилфенил)4-нитро-3-трифторметилпиразол в виде кремового твердого вещества, т.пл. 194-195°С. При использовании той же методики, по, заменяя 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол на 1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол и заменяя смесь концентрированной серной кислоты и дымящей азотной кислоты на уксусный ангидрид, к которому добавляют дымящую азотную кислоту, получают: 1-(2,6-дихлор-4-трифторметилфенил)-4-нитро-3-трифторметилпиразол в виде оранжевого твердого вещества, т.пл. 110 – 112°С, после перекристаллизации их смеси толуола и гексана. Ссылочный пример 14. 1-(2,6-Дихлор-4-трифторметилфенил)-3-трифторметилпиразол, используемый в примере 37, получают при помощи методики, описанной в примера 211 путем замены 5-амино-4-циано-1(2,6-дихлор-4-трифторметилфенил)-3-грифторметилпиразола на 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол. Указанное в названии соединение получают в виде бледно-желтого масла. 5-Ацетам до-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол, используемый в примере 37, получают при помощи методики, описанной а примере 15, но заменяя 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-бис-(циклопропанкарбонил)амино-3-трифторметилпиразол на 5-бис-(ацетил) амино-1-(2,6дихлор-4-трифторметилфенил) -3-трифторметилпиразол. Указанное в названии соединение получают в виде белых кристаллов, т.пл. 142-144°С, после перекристаллизации из этилацетата и гексана. 5-бис-(ацетил) амино-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол, используемый выше, получают при помощи методики, описанной в примере 19, но заменяя 5-амино-4-циано-1- (2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол на 5-амино-1 - (2,6-дихлор-4-трифторметилфенил)-3трифторметилпиразол и этилхлорформат на ацетилхлорид. Указанное в названии соединение получают в виде белого твердого вещества, т.пл. 130-131°С. Пример 38. Соединение 86, 87, и 88. При использовании методики, как описано в примере 21, но, заменяя 5-амино-4-циано-1 - (2,6-дихлор4-трифторинтилфенил)-3-трифторметилпиразол на 5-амино-1-(2,6-дихлор-4-трифторметил -фенил) -3-метил-4-метансульфонилпиразол, получают 1-(2,6-дихлор -4-трифторметилфенил)-3-метил-4-метансульфонилпиразол в виде желтых кристаллов, т.пл. 1б8-169°С. При использовании той же методики, но, заменяя 5-амино-4-циано-1-(2,6-дихлор-4-трифторметилфенил) -3-трифторметилпиразол на 5-амино-4-циано-1-(2,6-дихлор-4-трифторметилфенил) -3-фтор-пиразол, получают 4-циано-1-(2,6-дихлор-4-трифторметилфенил) -3-фторпиразол в виде белых кристаллов, т.пл. 120-121°С. 1-(2,6-Дихлор-4-трифторметилфенил) -4-метансульфонил-3-трифторметилпиразол получают таким же путем, заменяя 5-амино-4-циано-1-(2,6-Дихлор-4-трифторметилфенил)-3-трифторметилпиразол на 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-метансульфонил -3-трифторметилпиразол. Указанное в названии соединение получают в виде белых иголок, т.пл. 154-155°С. Пример 39. Соединение 89. 28 27215 При использовании той же методики, как описано в примере 22, но, заменяя йод на безводный хлорид меди и заменяя хлороформ на безводный ацетонитрил, получают: 5-хлор-1 - (2,6-дихлор-4-трифторметилфенид)-4-циано -3-трифторметилпиразол в виде желтого масла после очистки хроматографией на двуокиси кремния (Мерк, 40-230 меш, 0,7 кг/см-2), элюируя смесью днхлорметана и гексана (1:2). Полосы инфракрасной абсорбции: 2260, 1495, 1405, 1325, 1160 см-1 (жидкая пленка). Пример 40. Соединение 90 и 91. При использовании той же методики, как описано в примере 24, но, заменяя диметиламин соответствующим амином, получают следующие фенилпиразолы: 5-амино-1-( (2,6-дихлор-4-трифторметилфенил)-4- N -этилсульфамоил)-3-трифторметилпиразол в виде кремообразного твердого вещества, т.пл. 200°С, после перекристаллизации из смеси толуола и петролинейного эфира; 5-амино-1-(2,6-дихліор-4-трифторметилфенил)-4- (N-метилсульфамоил) -3-трифторметилпиразол в виде светло-коричневого твердого вещества, т.пл. 199-200°С, после перекристаллизации из толуола. Пример 41. Соединения 92 и 93. Трифторуксусный ангидрид (3,5 мл) добавляют по каплям к перемешиваемой смеси 85 мас.% /об. раствора перекиси водорода (0,56 мл) в дихлорметане (15 мл), поддерживая при 0-10°С. После нагревания до 20°С в течение 5 мин раствор 3-амино-1 - (2,6-дихлор-4-трифторметилфенил) -4-цианопиразола( (1,0 г; далее описан в ссылочном примере 15) в дихлорметане (10 мл) добавляют по каплям в течение 5 мин. Наблюдают подъем температуры на 10°С во время добавления, и смесь нагревают с обратным холодильником в течение 1,5 ч. После охлаждения раствор сливают на избыток воды и органический раствор промывают по очереди раствором бикарбоната натрия и бисульфита натрия. После сушки над безводным сульфатом магния с последующим упариванием в вакууме получают отшлифованное твердое вещество, которое очищают хроматографией на двуокиси кремния (Мерк, 40-230 меш. 0,7 кг/см-2 , элюируя дихлорметаном. Полученное белое твердое вещество перекристаллизовывают из смеси дихлорметана и гексана с получением 1-(2,6-дихлор-4-трифторметилфенил)-4-циано-3-нитропиразол в виде белых кристаллов (0,7 г), т.пл. 163165°С. При использовании той же методики, но, заменяя 3-амино-1- (2,6-дихлор-4-трифторметилфенил)-4-цианопиразол на 5-амино-І-(2,6-дихлор-4-трифторметилфенил) -3,4-дицианопиразол ранее описан в примере 2), получают 1 - (2,6-дихлор-4-трифторметилфенил)-3,4-дициано-5-гитропиразол в виде оранжевых кристаллов, т.пл. 139-140°С после перекристаллизации из циклогексана. Ссылочный пример 15. 3-Амино-1-(2,6-дихлор-4-трифторметилфенил)-4-цианопиразол получают следующим образом. Раствор 3-трет-бутоксикарбониламино-1-(2,6-дихлор-4-трифторметилфеннл)-4-цианопиразол (2,5 г) в этаноле (100 мл) обрабатывают 50% об./об. соляной кислотой (10 мл) и смесь нагревают с обратным холодильником в течение 1 ч. После стояния в течение ночи при комнатной температуре карбонат натрия добавляют до достижения рН 8, и смесь экстрагируют три раза дихлорметаном. Экстракт промывают водой, сушат над безводном сульфатом магния и упаривают в вакууме с получением темно- желтого твердого вещества. После перекристаллизации из смеси этилацетата и петролейного эфира получают указанное в названии соединение (1,4 г) в виде белых кристаллов. Т.пл. 159-160С. 3-трет-бутоксикарбониламино-1-(2,6-дихлор-4-трифторметилфенил)-4-цианопиразол получают следующим образом. Смесь 3-карбокси-4-циано-1-(2,6-дихлор-4-трифторметмлфенил) пиразола (11 г) и тионилхлорида (35 мл) и N,N -диметилформамида (3 капли) нагревают с обратным холодильником в течение 2 ч. Растворитель упаривают s вакууме и вновь упаривают в вакууме после добавления сухого толуола (20 мл). Полученную смолу растворяют в сухом ацетоне (50 м) и перемешивают в то время, как добавляют раствор азида натрия (2,9 г) в воде (15 мл) в течение 5 мин поддерживая температуру 10-15°С. Через 30 минут смесь сливают в волу (250 мл) и экстрагируют с дихлорметаном (3х80 мл), Объединенный экстракт промывают водой,сушат над безводным сульфатом магния и упаривают в вакууме при температуре, равной или ниже 40°С, с получением темно-желтого твердого вещества (13 г). Полученный азид растворяют в сухом толуоле (200 мл) и нагревают с обратным холодильником в течение получаса при мягком выделении азота. После охлаждения его обрабатывают трет-бутанолом (40 г) и смесь нагревают с обратным холодильником в течение ночи. После упаривания в вакууме полученное коричневатое масло (15 г) очищают хроматографией на двуокиси кремния (Мерк, 230 - 400 меш, 0,6 кг/см-2), элюируя дихлорметаном и этилацетатом (98:2) с получением указанного в названии соединения (0,8 г) в виде белого твердого вещества, т.пл. 154 – 155°С, 3-Карбокси-4-циано-1-(2,6-дихлор-4-трифторметилфанил) пиразол получают следующим образом. Суспензию 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-угоксикарбонилпиразол (5,0 г) в этаноле (100 мл) обрабатывают раствором гидроокись натрия (0,63 г) в воде (15 мл) и помешивают при комнатной температуре в течение 1,5 ч. После упаривания в вакууме при температуре, равной или ниже 40°С, остаток растворяют в воде (150 мл) и экстрагируют дихлорметаном (1х100 мл). Этот экстракт обратно промывают водой (2х50 мл), и объединенные водные растворы доводят до рН 1 при помощи разбавленной соляной кислоты и затем экстрагируют этилацетатом (3х50 мл). Этот экстракт сушат над безводным сульфатом магния и упаривают н вакууме с получением темно-желтого твердого вещества (4,6 г). Поели перекристаллизации из смеси толуола и гексана получают указанное в названии соединение в виде темно-желтых кристаллов (4,4 г), т.пл. 203 – 205°С. 29 27215 4-Циано-1-(2,6-дихлор-4-трифторметил фенил)-3-этоксикарбонилпиразол получают следующим способом, описанным в примере 21, заменяя 5-амино-4-циано-.1-(2,6-дихлор-4-трифторматилфенил)-3-трифторметилпиразол на 5-амино-4-циано-1-(2,6-дихлор-4-трифторметалфенил)-3- этоксикарбонилпиразол. Указанное в названии соединение получают в виде темно-желтых кристаллов, т.пл. 198-199°С. Пример 42. Соединение 94, 95 и 96. Фторид серебра (I) в количестве 5 г добавляют по частям в течение 40 минут В энергично перемешиваемый раствор 1,1-дихлор-2,2-дтцтаноэтилен в адетонитриле (15 мл), поддерживая при 0 - 10°С при помощи внешнего охлаждения. Перемешивание продолжают при комнатной температуре в течение 1 часа и твердое вещество отфильтровывают, Фильтрат, содержащий 1,1-дифтор-2,2-дицианоэтилен, перемешивают и охлаждают, в то время как раствор 2,6 -дихлор-4 -трифторметилфенилгиадразина (4,9 г) в ацетонитриле (15 мл) добавляют по каплям при 5°С. После перемешивания в течение ночи твердое вещество отфильтровывают и фильтрат упаривают в вакууме с получением темно-оранжевого масла (6 г). Его очищают при помощи хроматографии на двуокиси кремния (Мерк, 230–400 меш, 10 фунт/дюйм-2), элюируя дихлорметаном с получением белого твердого вещества. После перекристаллизации из смеси циклогексама и этилацетата получают 5-амино-1-(2,6-дихлор-4-трифторметилфенил)-4-циано-3-фторпиразол (5,9 г) в виде белого твердого вещества, т.пл. 193–194°C. При использовании той же методики, эаменяя 2,6-дихлор-4-трифторметилфенилгидразин на 2,6-дихлор-4-трифторметоксифенилгидразин и применяя 1,1-дихлор-2,2-дицианоэтилен вместо 1,1-дифтор-2,2дицианоэтилена и используя диэтиловый эфир в качестве растворителя получают 5-амино-3-хлор-1- (2,6-дихлор-4-трифторметоксифенил)-4-цианопиразол в виде желтого твердого вещества, т.пл. 175–177°С. При использовании методики, описанной выше, но, заменяя 2,6-дихлор-4-трифторметоксифенилпиразин на 2,6-дихлор-3,5-дифтор-4-трифторметилфенилгидразин, получают 5-амино-3-хлор-4-циано-1-(2,6-дпхлор-3,5-дифтор-4-трифторметилфенил) пиразол в виде желтых кристаллов, т.пл. 206-208°С. Пример 43. Соединения 97, 98, 100, 101, 102 и 103. Перемешиваемый раствор 4-циано-1-(2,6-дихлор-4-дифторметилфенил)-3-триформетилпиразол (1,5 г) в сухом тетрагидрофуране охлаждением до –78°С обрабатывают раствором н-бутиллития (2,6 М в гексане, 1,71 мл) по каплям в атмосфере азота. Температуру поддерживают ниже -65°С до время добавления и полученный раствор поддерживают при –78°С в течение I ч. Раствор триметилсилинхлорида (0,56 мл) в сухом тетрагидрофуране (2 мл) затем добавляют по каплям в течение 2 мин. Смеси дают достичь комнатной температуры в течение 2 часов, оставляют на ночь и упаривают в вакууме с получением бледно-желтого твердого вещества. Его растворяют в дихлорметане, промывают водой, сушат над безводным сульфатом магния к упаривают в вакууме. Продукт перекристаллизовывают из гексана с получением 4-циано-1-(2,6-дихлор-4-трифторметилфенил) -3-трифторметил-5- триметилсилилпиразола в виде белых кристаллов, т.пл. 108 – 110°С. При использовании тойже методики, но, заменяя хлорид триметилсилила на реагенты, перечисленные ниже, получают следующие фенилпиразолы: 5-трет-бутилдиметилсилил-4-циано-1-(2,6-дихлор-4-трифторметилфенил) -3-трифторметилпиразол в виде белых кристаллов, т.пл. 113–115°С; из третбутилдиметилсилилхлорида, 4-циано-1-(2,6-дихлор-4-трифторметилсилил)-5-метилтио-3-трифторметилпиразол, в виде белого порошка, т.пл. 73 - 74°С; из метилтиоцианата, 4-циано-1-(2,6-дихлор-4-трифторметилфенил)3-трифторметил-5- трифторметилтиопиразол, в виде кристаллов, т.пл. 120 - 122°С; из бис-(трифторметил)дисульфида, 5-карбокси-4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3- трифторметилпиразол в виде белого твердого вещества, т.пл. 177–179°С, путем сливания литиированного раствора пиразола на большой избыток порошкообразного твердого диоксида углерода. При использовании той же методики, но, заменяя 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол на 1-(2,6-дихлор-4-трифторметилфенил)-4-нитро-3-трифторметилпиразол получают: 1-(2,6-дихлор-4-трифторметилфенил)-4-нитро-3-трифторметил-5-триметилсилилпиразол, в виде бледно-зеленого твердого вещества, т.пл, 101–103°С. При использовании той же методики, но заменяя 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-3-трифторметилпиразол на 4-циано-1-(2,6-дихлор-4-трифторметилфенид)-5-метил-3-трифторметилпиразол) (ране описанный в примере 23), получают: 4-циано-1-(2,6-дихлор-4-трифторметилфенил)3-трифторметил-5-триметилсилилметилпиразол в виде бесцветного масла. Полосы инфракрасной абсорбции: 2250, 1400, 1325, 1260, 1180, 1150, 860 см-1 (жидкая пленка). Ядерно-магнитный резонанс: химические уровни (дельта) для Si-CH2-2,8 млд в диметилсульфоксиде D6 Пример 44. Соединение 104. Метоксид натрия (0,3г) добавляют к ледяной перемешиваемой смеси 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-5-бис-(феноксикарбонил) амино-3-трифторметил (3,1 г) в метаноле (30 мл) и нагревают с обратным холодильником в течение 2 часов. Это сливают на воду (200 мл) и экстрагируют дихлорметаном. Органический раствор промывают раствором карбоната натрия, затем водой, сушат над безводным сульфатом магния и упаривают в вакууме. Полученное белое твердое вещество оказалось 4-циано-1-(2,6-дихлор-4-трифторметилфенил)-5- митоксикарбониламино-3-трифторметилпиразол, т,пл. 182–183°C. Ссылочный пример 16. 4-Циано-1-(2,6-дихлор-4-трифторметилфенил-5-бис-(феноксикарбонил) амино3-трифторметилпиразол, используемый в примере 44, получают при помощи следующей методики, опи 30
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod to control arthropoda
Автори англійськоюHATTON Laslie Roy, Hokins David William, Parnell Edgard William, Pjorson Christopher John, ROBERTS David Alan
Назва патенту російськоюСпособ борьбы с членистоногими
Автори російськоюХЕТТОН Лесли Рой, Хокинс Дэвид Вильям, Парнелл Эдгард Вильям, Пьёрсон Кристофер Джон, Робертс Дэвид Алан
МПК / Мітки
МПК: C07D 231/14, C07F 7/08, A61P 33/10, C07D 231/16, C07D 231/38, C07D 403/04, A01N 55/00, C07D 231/18, C07D 231/44, A61K 31/695, C07D 231/40, A61K 31/415, C07D 231/12, A01N 43/56, A01N 55/10, A61P 33/00, C07F 7/10
Мітки: членистоногими, спосіб, боротьби
Код посилання
<a href="https://ua.patents.su/42-27215-sposib-borotbi-z-chlenistonogimi.html" target="_blank" rel="follow" title="База патентів України">Спосіб боротьби з членистоногими</a>
Попередній патент: Спосіб реклами товарів чи послуг
Наступний патент: Спосіб виготовлення термопари
Випадковий патент: Полімерний ковпак для захисту від пошкоджень торцевих частин труби