Похідні фенілоцтової кислоти і засіб боротьби проти комах і павукоподібних та шкідливих грибів
Номер патенту: 55367
Опубліковано: 15.04.2003
Автори: Заутер Губерт, Байєр Герберт, Мюллер Рут, Рьоль Франц, Грамменос Вассіліос, Лоренц Гізелла, Аммерманн Еберхард, Харреус Альбрехт, Кірстген Райнхард
Формула / Реферат
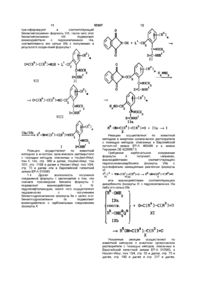
1. Производные фенилуксусной кислоты формулы І:
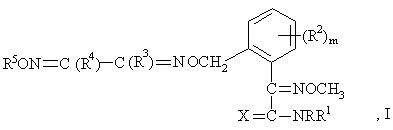
в которой Х - кислород или сера;
R - водород и С1-С4алкил;
R1 - водород и С1-С4алкил;
R2 - галоген, С1-С4алкил и С1-С4алкокси;
m=0 или 1;
R3 - амино, галоген, С1-С4алкил, С1-С4алкокси, С1-С4алкилтио, С1-С4алкиламино или ди-С1-С4алкиламино;
R4 - циано, амино, галоген, С1-С6алкил, С1-С6алкокси, С1-С6алкилтио, С1-С6алкиламино, ди-С1-С6алкиламино, С2-С6алкенил, С2-С6алкенилокси, С2-С6алкинилокси, причем углеводородные радикалы этих групп могут быть частично либо полностью галогенированы или могут нести от одного до трех радикалов из числа следующих: циано, С1-С6алкокси, С1-С6алкиламино, ди-С1-С6алкиламино, С3-С6циклоалкил, изоксазолил, фенил и галоген, причем циклические радикалы могут быть частично либо полностью галогенированы и/или могут нести от одной до трех групп из числа следующих: С1-С6алкил и С1-С6галогеналкил; С3-С6циклоалкил, С3-С6циклоалкилокси, фенил и гетарил, выбранный из группы, включающей изоксазолил, имидазолил, пиразолил, тиазолил, тиенил, оксазолил, фуранил, бензоксазолил, пирролидинил, пиридил, пиперидинил, пиперазинил и морфолинил, причем циклические радикалы могут быть частично либо полностью галогенированы или могут нести от одной до трех групп из числа следующих: С1-С6алкил, С1-С6галогеналкил, С1-С6алкокси, С1-С6алкиламино, ди-С1-С6алкиламино, фенил, галоген;
R5 - водород, С1-С10алкил, С2-С10алкенил, С2-С10алкинил, причем эти радикалы могут быть частично либо полностью галогенированы или могут нести от одной до трех групп из числа следующих: циано, гидрокси, амино, аминокарбонил, С1-С6алкил, С1-С6алкокси, С1-С6алкоксикарбонил, С1-С6алкиламино, ди-С1-С6алкиламино, С1-С6алкиламинокарбонил, ди-С1-С6алкиламинотиокарбонил, арил, фенетилокси, гетарил, выбранный из группы, включающей пиримидинил, фуранил, пирролил, оксазолил, тиенил, тиазолил, изоксазолил и 1,2,4-оксадиазолил, причем циклические группы могут быть частично либо полностью галогенированы или могут нести от одной до трех групп из числа следующих: гидрокси, С1-С6алкил, С1-С6галогеналкил, С3-С6циклоалкил, фенил, галоген; фенил или пиридил, которые могут быть частично либо полностью галогенированы или могут быть замещены группой С1-С6галогенилалкил;
причем если Х - кислород и m=0, то R3 и R4 одновременно не могут принимать следующие значения: R3 не может означать С1-С4алкил и метилтио и R4 не может означать незамещенный С1-С5алкил, незамещенный С3-С5циклоалкил, замещенный и незамещенный фенил и незамещенный тиенил;
а также их соли.
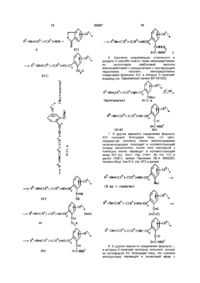
2. Соединения формулы I по п. 1, в которой
R3 - галоген, С1-С4алкил, С1-С4алкокси или С1-С4алкилтио;
R4 - галоген, циклопропил, циклогексил, С1-С4алкил, С1-С4алкокси, С1-С4алкилтио, фенил или гетарил, выбранный из группы, включающей изоксазолил, имидазолил, пиразолил, тиазолил, тиенил, оксазолил, фуранил, бензоксазолил, пирролидинил, пиридил, пиперидинил, пиперазинил и морфолинил, причем циклические радикалы частично или полностью могут быть галогенированы или могут нести от одной до трех групп из числа следующих: С1-С6алкил, С1-С6галогеналкил, С1-С6алкокси, С1-С6алкиламино, ди-С1-С6алкиламино и фенил;
R5 - водород, С1-С10алкил, С2-С10алкенил, С2-С10алкинил, причем эти группы частично или полностью могут быть галогенированы или могут нести от одной до трех групп из числа следующих: циано, гидрокси, аминокарбонил, С1-С6алкил, С1-С6алкокси, С1-С6алкоксикарбонил, С1-С6алкиламино, ди-С1-С6алкиламино, С1-С6алкиламинокарбонил, ди-С1-С6алкиламинокарбонил, арил, фенетилокси, гетарил, выбранный из группы, включающей пиримидинил, фуранил, пирролил, оксазолил, тиенил, тиазолил, изоксазолил и 1,2,4-оксадиазолил, причем ароматические и гетероароматические радикалы могут быть частично или полностью галогенированы и/или могут нести от одной до трех групп из числа следующих: гидрокси, С1-С6алкил, С1-С6галогеналкил, С3-С6циклоалкил и фенил; фенил или пиридил, которые частично или полностью могут быть галогенированы и/или могут быть замещены группой С1-С6галогеналкил;
причем если Х - кислород и m=0, то R3 и R4 одновременно не могут принимать следующие значения: R3 не может означать С1-С4алкил и метилтио и R4 не может означать незамещенный С1-С5алкил, незамещенный С3-С5циклоалкил, замещенный и незамещенный фенил и незамещенный тиенил;
а также их соли.
3. Соединения формулы I по п. 1, в которых m=0.
4. Соединения формулы I по п. 1, в которых R1 - метил.
5. Средство борьбы против насекомых и паукообразных и против вредоносных грибов, содержащее обычные добавки и эффективное количество соединения формулы I по п. 1.
Текст
1 Производные фенилуксусной КИСЛОТЫ формулы I R 5 ON=C ( R 4 ) - C ( R ) = N O C H C=NOCH, X=C-NRR 1 ,1 в которой Х - кислород или сера, R - водород и Сі-С4алкил, R1 - водород и Сі-С4алкил, R2 - галоген, Сі-С4алкил и СгС4алкокси, m=0 или 1, R3 - амино, галоген, Сі-С4алкил, Сі-С4алкокси, d С4алкилтио, Сі-С4алкиламино или ди-Cr Слалкиламино, R - циано, амино, галоген, Сі-Сєалкил, d Сєалкокси, Сі-Сєалкилтио, Сі-Сєалкиламино, ди Сі-Сєалкиламино, Сг-Сєалкенил, С-г Сбалкенилокси, Сг-Сбалкинилокси, причем углеводородные радикалы этих групп могут быть частично либо полностью галогенированы или могут нести от одного до трех радикалов из числа следующих циано, С-і-Сєалкокси, Сг Сєалкиламино, ди-Сі-Сєалкиламино, СзСбЦиклоалкил, изоксазолил, фенил и галоген, причем циклические радикалы могут быть частично либо полностью галогенированы и/или могут нести от одной до трех групп из числа следующих Ci-Сбэлкил и С-і-СбГалогеналкил, СзСбЦиклоалкил, Сз-СбЦиклоалкилокси, фенил и гетарил, выбранный из группы, включающей изоксазолил, имидазолил, пиразол ил, тиазолил, тиенил, оксазолил, фуранил, бензоксазолил, пирролидинил, пиридил, пиперидинил, пиперазинил и морфолинил, причем циклические радикалы могут быть частично либо полностью галогенированы или могут нести от одной до трех групп из числа следующих Сі-Сєалкил, d Сє гал о ге нал кил, Сі-Сєалкокси, Сі-Сєалкиламино, ди-С-і-Сєалкиламино, фенил, галоген, R5 - водород, С-і-С-іоалкил, Сг-Сюалкенил, СгСюалкинил, причем эти радикалы могут быть частично либо полностью галогенированы или могут нести от одной до трех групп из числа следующих циано, гидрокси, амино, аминокарбонил, Сі-Сєалкил, Сі-Сєалкокси, d Сєалкокси карбон ил, Сі-Сєалкиламино, ди-Сг Сєалкиламино, Сі-Сєалкиламинокарбонил, ди-Сг Сбалкиламинотиокарбонил, арил, фенетилокси, гетарил, выбранный из группы, включающей пиримидинил, фуранил, пиррол ил, оксазолил, тиенил, тиазолил, изоксазолил и 1,2,4оксадиазолил, причем циклические группы могут быть частично либо полностью галогенированы или могут нести от одной до трех групп из числа СЛеДуЮЩИХ ГИДРОКСИ, Ci-СбЭЛКИЛ, d Сб гал о ге нал кил, Сз-СбЦиклоалкил, фенил, галоген, фенил или пиридил, которые могут быть частично либо полностью галогенированы или могут быть замещены группой d-СбГалогенилалкил, причем если X - кислород и m=0, TO R3 и R4 одновременно не могут принимать следующие значения R3 не может означать СгС4алкил и метилтио и R4 не может означать незамещенный О 1 (О го Ю ю 55367 гетарил, выбранный из группы, включающей незамещенный Сз-СбЦиклоалкил, пиримидинил, фуранил, пиррол ил, оксазолил, замещенный и незамещенный фенил и тиенил, тиазолил, изоксазолил и 1,2,4незамещенный тиенил, оксадиазолил, причем ароматические и а также их соли гетероа ром этические радикалы могут быть 2 Соединения формулы І по п 1, в которой 3 частично или полностью галогенированы и/или R - галоген, Сі-С4алкил, Сі-С4алкокси или С г могут нести от одной до трех групп из числа С4ЭЛКИЛТИО, 4 СЛеДуЮЩИХ ГИДРОКСИ, Ci-СбЭЛКИЛ, Сг R - галоген, циклопропил, циклогексил, С г С4алкил, Сі-С4алкокси, Сі-С4алкилтио, фенил или Сб гал о ге нал кил, Сз-СбЦиклоалкил и фенил, фенил гетарил, выбранный из группы, включающей или пиридил, которые частично или полностью изоксазолил, имидазолил, пиразол ил, тиазолил, могут быть галогенированы и/или могут быть тиенил, оксазолил, фуранил, бензоксазолил, замещены группой Сі-Сєгалогеналкил, 3 4 пирролидинил, пиридил, пиперидинил, причем если X - кислород и m=0, TO R и R пиперазинил и морфолинил, причем циклические одновременно не могут принимать следующие 3 радикалы частично или полностью могут быть значения R не может означать СгС4алкил и 4 галогенированы или могут нести от одной до трех метилтио и R не может означать незамещенный групп из числа следующих Сі-Сєалкил, С г СгСбалкил, незамещенный Сз-СбЦиклоалкил, Сє гал о ге нал кил, Сі-Сєалкокси, Сі-Сєалкиламино, замещенный и незамещенный фенил и ди-Сі-Сєалкиламино и фенил, незамещенный тиенил, а также их соли R5 - водород, СгСюалкил, Сг-Сюалкенил, С-А3 Соединения формулы I по п 1, в которых т = 0 Сюалкинил, причем эти группы частично или полностью могут быть галогенированы или могут 4 Соединения формулы I по п 1, в которых R1 нести от одной до трех групп из числа следующих метил циано, гидрокси, аминокарбонил, Сі-Сєалкил, С г 5 Средство борьбы против насекомых и Сєалкокси, Сі-Сєалкоксикарбонил, Сг паукообразных и против вредоносных грибов, Сбалкиламино, ди-Сі-Сєалкиламино, Сг содержащее обычные добавки и эффективное Сєалкиламинокарбонил, ди-Сг количество соединения формулы I по п 1 Сєалкиламинокарбонил, арил, фенетилокси, Изобретение относится к производным фенилуксусной кислоты, а также к содержащим их средствам для борьбы с вредителями и вредоносными грибами Из публикаций известны производные фенилуксусной кислоты, применяемые для борьбы с вредителями (см Европейские патентные заявки ЕР-А 398692, ЕР-А 477631, ЕР-А 513580, ЕР-А 567828, ЕР-А 528682, ЕР-А 463488 и Международную заявку W0-A 92/13830) В основу настоящего изобретения была положена задача по получению новых соединений, обладающих более высокой эффективностью Поставленная задача достигается созданием производных фенилуксусной кислоты формулы I R5ON=C (R4)-C(R)=NOCH C=NOCH3 X=C-NRR1 в которой заместители и индекс имеют следующее значение X означает кислород или серу, R означает водород и СгС4алкил, R1 означает водород и СгС4алкил, R2 означает галоген, СгС4алкил и С г С4 ал ко кс и, m означает 0 или 1, R3 означает амино, галоген, СгС4алкил, С г С4алкокси, Сі-С4алкилтио, Сі-С4алкиламино или ди-Сі-С4алкиламино, R4 означает циано, амино, галоген, С г Сбалкил, СгСбалкокси, Сі-Сєалкилтио, Сг Сєалкиламино, ди-Сг-Сєалкиламино, C-zСєалкенил, Сг-Сєалкенилокси, Сг-Сєалкинилокси, причем углеводородные радикалы этих групп могут быть частично либо полностью галогенированы и/или могут нести от одного до трех радикалов из числа следующих циано, С г Сбалкокси, СгСбалкиламино, диСг Сбалкиламино, Сз-СбЦиклоалкил, изоксазолил, фенил и галоген, причем циклические радикалы в свою очередь могут быть частично либо полностью галогенированы и/ил и могут нести от одной до трех групп из числа следующих С г Сбалкил и СгСбГалогеналкил, Сз-СбЦиклоалкил, Сз-СбЦиклоалкилокси, фенил, и гетарил, выбранный из группы, включающей изоксазолил, имидазолил, пиразолил, тиазолил, тиенил, оксазолил, фуранил, бензоксазолил, пирролидинил, пиридил, пиперидинил, пиперазинил и морфолинил, причем циклические радикалы могут быть частично либо полностью галогенированы и/или могут нести от одной до трех групп из числа следующих С г Сбалкил, СгСбГалогеналкил, Сі-Сєалкокси, С г Сєалкиламино, ди- Сі-Сєалкиламино и фенил, галоген, R5 означает водород, СгСюалкил, С-АСюалкенил, Сг-Сюалкинил, причем эти радикалы могут быть частично либо полностью галогенированы или могут нести от одной до трех групп из числа следующих циано, гидрокси, 55367 амино, аминокарбонил, Сі-Сєалкил, Сі-Сєалкокси, Сі-Сєалкоксикарбонил, Сі-Сєалкиламино, ди-Cr Сєалкиламино, Сі-Сєалкиламинокарбонил, ди- СіСбалкиламинокарбонил, арил, фенетилокси, гетарил, выбранный из группы, включающей пиримидинил, фуранил, пиррол ил, оксазолил, тиенил, тиазолил, изоксазолил и 1,2,4оксадиазолил, причем циклические группы в свою очередь могут быть частично либо полностью галогенированы и/или могут нести от одной до трех групп из числа следующих гидрокси, d Сбалкил, Ci-Сбгалогеналкил, Сз-СбЦиклоалкил, фенил, галоген, фенил или пиридил, которые могут быть частично либо полностью галогенированы или могут быть замещены группой Ci-Сбгалогеналкил, причем 3 если X означает кислород и m равно 0, то R и R4 одновременно не могут принимать следующие значения R3 не может означать СгС4алкил и метилтио, значения 3 R не может означать СгС4алкил и метилтио, и 4 R не может означать незамещенный d Сбалкил, незамещенный Сз-СбЦиклоалкил, замещенный и незамещенный фенил и незамещенный тиенил, а также их соли Кроме того, предпочтительны соединения формулы І, в которых m означает 0, а также 1 соединения формулы І, в которых R представляет собой метил Настоящее изобретение относится также к средству борьбы против насекомых и паукообразных и против вредоносных грибов, содержащему обычные добавки и эффективное количество соединения вышеуказанной формулы I Описываются также производные фенилуксусной кислоты формулы I и R4 не может означать незамещенный d незамещенный Сз-СбЦиклоалкил, замещенный и незамещенный фенил и незамещенный тиенил, а также их солей Предпочтительны соединения формулы I, в которых R3, R4 и R5 имеют следующее значение R3 означает галоген, Сі-С4алкил, Сі-С4алкокси или Сі-С4алкилтио, R4 означает галоген, циклопропил, циклогексил, Сі-С4аалкил, Сі-С4алкокси, Сі-С4алкилтио, фенил или гетарил, выбранный из группы, включающей изоксазолил, имидазолил, пиразолил, тиазолил, тиенил, оксазолил, фуранил, бензоксазолил, пирролидинил, пиридил, пиперидинил, пиперазинил и мор-фолинил, причем циклические радикалы частично или полностью могут быть галогенированы или могут нести от одной до трех групп из числа следующих С-і-Сєалкил, С-і-СбГалогеналкил, Сі-Сєалкокси, СіСєалкиламино, ди-Сі-Сєалкиламино и фенил, R5 означает водород, С-і-С-іоалкил, Сг-Сюалкенил, Сг-Сюалкинил, причем эти группы частично или полностью могут быть галогенированы или могут нести от одной до трех групп из числа следующих циано, гидрокси, аминокарбонил, Сі-Сєалкил, Сі-Сєалкокси, СіСєалкокси карбон ил, Сі-Сєалкиламино, ди-Сг Сєалкиламино, Сі-Сєалкиламинокарбонил, ди-Cr Сєалкиламинокарбонил, арил, фенетилокси, гетарил, выбранный из группы, включающей пиримидинил, фуранил, пиррол ил, оксазолил, тиенил, тиазолил, изоксазолил и 1,2,4оксадиазолил, причем ароматические и гетероа ром этические радикалы в свою очередь могут быть частично или полностью галогенированы и/или могут нести от одной до трех групп из числа следующих гидрокси, d Сбалкил, Ci-Сбгалогеналкил, Сі-Сзциклоалкил и фенил, фенил или пиридил, которые частично или полностью могут быть галогенированы и/или могут быть замещены группой Сі-Сєгалоге-налкил, причем если X означает кислород и m равно 0, то R3 и R4 одновременно не могут принимать следующие R5ON=C (R4)-C(R)=NOCH C=NOCH3 X=C-NRR1 I в которой заместители и индекс имеют следующее значение X означает кислород или серу, R означает водород и СгС4алкил, R1 означает водород и СгС4алкил, R2 означает циано, нитро, трифторметил, галоген, Сі-С4алкил и СгС4алкокси, m означает О, 1 или 2, причем радикалы R2 могут быть разными, если m означает 2, R3 означает водород, циано, нитро, гидрокси, амино, галоген, Сі-С4алкил, Сі-С4галогеналкил, Сі-С4алкокси, Сі-С4галогеналкокси, СіС4алкилтио, Сі-С4алкиламино или ди-Сг С4алкиламино, R4 означает водород, циано, нитро, гидрокси, амино, галоген, Сі-Сєалкил, Сі-Сєалкокси, СіСєалкилтио, Сі-Сбалкиламино, ди-Сг Сєалкиламино, Сг-Сєалкенил, Сг-Сєалкенилокси, Сг-Сєалкенилтио, Сг-Сєалкениламино, N-C2Сбалкенил-ІЧ-Сі-Сбалкиламино, Сг-Сєалкинил, C-zСєалкинилокси, Сг-Сєалкинилтио, C-zСєалкиниламино, г\ІС2-Сбалкинил-І\І-СіСбалкиламино, причем углеводородные радикалы этих групп могут быть частично либо полностью галогенированы или могут нести от одного до трех радикалов из числа следующих циано, нитро, гидрокси, меркапто, амино, карбоксил, аминокарбонил, аминотиокарбонил, галоген, d Сбалкиламинокарбонил, ди-Сг Сбалкиламинокарбонил, dСбалкиламинотиокарбонил, ди-Сг Сбалкиламинотиокарбонил, d-Сбалкилсульфонил, Сі-Сбалкилсульфоксил, Сі-Сбалкокси, СіСєгалогеналкокси, Сі-Сєалкокси карбон нл, dСбалкилтио, Сі-Сбалкиламино, ди-Сг Сбалкиламино, Сг-Сбалкенилокси, СзСбЦиклоалкил, Сз-СбЦиклоалкилокси, гетероциклил, гетероциклилокси, арил, арилокси, арил-Сі-С4алкокси, арилтио, арил-Сі-С4алкилтио, 55367 гетарил, гетарилокси, гетарил-Сі^алкокси, гетарилтио, гетарил-Сі-С4алкилтио, причем циклические радикалы в свою очередь могут быть частично либо полностью галогенированы и/или могут нести от одной до трех групп из числа следующих циано, нитро, гидрокси, меркапто, амино, карбоксил, аминокарбонил, аминотиокарбонил, Сі-Сєалкил, dСє гал о ге нал кил, Сі-Сєалкилсульфонил, dСєалкилсульфоксил, Сз-СбЦиклоалкил, dСєалкокси, Сі-Сєгалогеналкокси, dСєалкоксикарбонил, Сі-Сєалкилтио, dСєалкиламино, ди-Сі-Сєалкиламино, dСєалкиламинокарбонил, ди-Сг Сєалкиламинокарбонил, dСєалкиламинотиокарбонил, ди-Сг Сєалкиламинотиокарбонил, Сг-Сєалкенил, С2Сєалкенилокси, бензил, бензилокси, арил, арилокси, арилтио, гетарил, гетарилокси, гетарилтио и C(=NOR6)-An-R , Сз-Сєциклоалкил, Сз-СбЦиклоалкилокси, Сз-СбЦиклоалкилтио, СзСбЦиклоалкиламино, г\І-Сз-СбЦиклоалкил-г\І-СіСєалкиламино, Сз-СбЦиклоалкенил, СзСбЦиклоалкенилокси, Сз-СбЦиклоалкенилтио, СзСбЦиклоалкениламино, М-Сз-СбЦиклоалкенил-NСз-Сєалкиламино, гетероциклил, гетероциклилокси, гетероциклилтио, гетероциклиламино, N-гетероциклил-М-СіСєалкиламино, арил, арилокси, арилтио, ариламино, ІЧ-арил-ІЧ-Сі-Сбалкиламино, гетарил, гетарилокси, гетарилтио, гетариламино, Nгетарил-Ы-СгСбалкиламино, причем циклические радикалы могут быть частично либо полностью галогенированы или могут нести от одной до трех групп из числа следующих циано, нитро, гидрокси, меркапто, амино, карбоксил, аминокарбонил, амияотиокарбонил, галоген, d Сбалкил, С-і-СбГалогеналкил, Сг Сєалкилсульфонил, Сі-Сєалкилсульфоксил, dСбЦиклоалкил, Сі-Сєалкокси, Сі-Сєгалогеналкокси, Сі-Сєалкоксикарбонил, Сі-Сєалкилтио, dСєалкиламино, ди-Сі-Сєалкиламино, dСєалкиламинокарбонил, ди-Cr Сєалкиламинокарбонил, dСєалкиламинотиокарбонил, ди-Cr Сєалкиламинотиокарбонил, С2-Сєалкенил, С2Сєалкенилокси, бензил, бензилоксн, арил, арилокси, гетарил и гетарилокси, R5 означает водород, С-і-С-юалкил, СзСбциклоалкил, С2-Сюалкенил, С2-Сюалкинил, С г Сюалкилкарбонил, Сг-Сюалкенилкарбонил, С2Сюалкинилкарбонил или С-і-С-юалкилсульфонил, причем эти радикалы могут быть частично либо полностью галогенированы или могут нести от одной до трех групп из числа следующих циано, нитро, гидрокси, меркапто, амино, карбоксил, аминокарбонил, аминотиокарбонил, галоген, d Сбалкил, С-і-СбГалогеналкил, Сг Сєалкилсульфонил, Сі-Сєалкилсульфоксил, dСбалкокси, С-і-СбГалогеналкокси, Сг Сєалкокси карбон ил, Сі-Сєаакилтио, dСєалкиламино, ди-Сі-Сєалкиламино, dСєалкиламинокарбонил, ди-Cr Сєалкиламинокарбонил, dСєалкиламинотиокарбонил, ди-Cr Сєалкиламинотиокарбонил, Сг-Сєалкенил, C-z 8 Сєалкенилокси, Сз-СбЦиклоалкил, СзСбЦиклоалкилокси, гетероциклил, гетероциклилокси, бензил, бензилокси, арил, арилокси, арилтио, гетарил, гетарилокси, гетарилтио, причем циклические группы в свою очередь могут быть частично либо полностью галогенированы или могут нести от одной до трех групп из числа следующих циано, нитро, гидрокси, меркапто, амино, карбоксил, аминокарбонил, аминотиокарбонил, галоген, d Сбалкил, С-і-СбГалогеналкил, Сг Сєалкилсульфонил, Сі-Сєалкилсульфоксил, dСбЦиклоалкил, Сі-Сєалкокси, Сі-Сєгалогеналкокси, Сі-Сєалкилоксикарбонил, Сі-Сєалкилтио, dСєалкиламино, ди-Сі-Сєалкиламино, dСєалкиламинокарбонил, ди-Cr Сєалкиламинокарбонил, dСєалкиламинотиокарбонил, ди-Cr Сєалкиламинотиокарбонил, Сг-Сєалкенил, C-zСєалкенилокси, бензил, бензилокси, арил, арилокси, арилтио, гетарил, гетарилокси, гетаридтио или C(=NOR6)-An-R7, арил, арилкарбонил, арилсульфонил, гетарил, гетарилкарбонил или гетарилсульфонил, причем эти радикалы могут быть частично либо полностью галогенированы или могут нести от одной до трех групп из числа следующих циано, нитро, гидрокси, меркапто, амино, карбоксил, аминокарбонил, аминотиокарбонил, галоген, d Сбалкил, С-і-СбГалогеналкил, Сі-Сєал кил карбон ил, Сі-Сєалкилсульфонил, Сі-Сбалкилсульфоксил, СзСбЦиклоалкил, Сі-Сєалкокси, Сі-Сєгалогеналкокси, Сі-Сєалкилоксикарбонил, Сі-Сєалкилтио, dСєалкиламино, ди-Сі-Сєалкиламино, dСєалкиламинокарбонил, диdСєалкиламинокарбонил, dСєалкиламинотиокарбонил, ди-Cr Сєалкиламинотиокарбонил, Сг-Сєалкенил, C-zСєалкенилокси, бензил, бензилокси, арил, арилокси, гетарил, гетарилокси или C(=NOR6)-AnR7, причем А представляет собой кислород, серу или азот и причем азот несет водород или Сі-Сєалкил, п означает 0 или 1, R6 означает водород или Сі-Сєалкил и R7 означает водород или Сі-Сєалкил, а также их соли Соединения формулы I могут быть получены различным путем с помощью методов, известных из существующих публикаций В принципе при синтезе соединений формулы I последовательность структурирования группировок существенной роли не играет, т е будет ли сначала структурирована группировка C(NOCH3)-CONRR1 или группировка CH2ON=C(R3)-C(R4)=NOR5 Структурирование группировки С(г\ІОСНз)CONRR известно, например, из указанных выше источников Тип синтеза боковой цепи CH2ON=C(R3)-C(R4)=NOR5 в определяется основном типом заместителей R и R , 1 В том случае, когда R3 и R4 не означают галоген, при структурировании группировки CH2ON=C(R3)-C(R4)=NORe работают преимущественно таким образом, что производное бензила формулы II подвергают 55367 10 взаимодействию с гидроксиимином формулы 4 S 3 l R -0N=aR*)-C(R )=N0H + L - C 3 1 HGN=C{R )-C(R )=N0H + . L - C H X=CNRR II III 4 S 3 R -ON=C(R* b C ( R )=NOCH 3 HON=C{R )-C[R )=N0-CH >NOCH 3 І і XONRR L1 в формуле II представляет собой нуклеофильно заменяемую уходящую группу, например, галоген или сульфонатную группу, предпочтительно хлор, бром, иод, мезилат, тозилат или трифлат Реакцию осуществляют по известной методике в инертном органическом растворителе в присутствии основания, такого, например, как гидрид натрия, гидроксид калия, карбонат калия и триэтиламин, с помощью методов, описанных в Houben-Weyl, том Е 14Ь, стр 370 и далее, и Houben-Weyl, том 10/1, стр 1189 и далее Требуемый для проведения реакции гидроксиимин формулы III получают, например, взаимодействием соответствующего дигидроксиимина формулы IV с нуклеофильно замещенным реагентом формулы VI R5~L 2 + VI —* H0N=C(H*)-C{R3)=N0H IV R B -ON=C(R4bC(R3)=NOH I I I L2 в формуле VI представляет собой нуклеофильно заменяемую уходящую группу, например, галоген или сульфонатную группу, предпочтительно хлор, бром, иод, мезилат, тозилат или трифлат Реакцию осуществляют по известной методике в инертном органическом растворителе в присутствии основания, такого, как, например, карбонат калия, гидроксид калия, гидрид натрия, пиридин и триэтиламин, с помощью методов, описанных в Houben-Weyl, том Е 14Ь, стр 307 и далее, стр 370 и далее и стр 385 и далее, Houben-Weyl, том 10/4, стр 55 и далее, стр 180 и далее и стр 217 и далее, Houben-Weyl, том Е 5, стр 780 и далее 1 1 Альтернативно описанным реакциям соединения формулы I могут быть получены также благодаря тому, что производное бензила формулы II взаимодействием с производным дигидроксиимина формулы IV сначала трансформируют в соответствующий бензилоксим формулы V, после чего этот бензилоксим V взаимодействием с нуклеофильно замещенным реагентом VI трансформируют в соединение формулы I R E -ON=C{R 4 )-C(R 3 )=NQC >HOCH I l 3 I X=CNRR Реакцию осуществляют по известной методике в инертном органическом растворителе в присутствии основания, такого, как, например, карбонат калия, гидроксид калия, гидрид натрия, пиридин и триэтиламин, с помощью методов, описанных в Houben-Weyl, том 10/1, стр 1189 и далее, Houben-Weyl, том Е 14Ь, стр 307 и далее, стр 370 и далее и стр 385 и далее, Houben-Weyl, том 10/4, стр 55 и далее, стр 180 и далее и стр 217 и далее, Houben-Weyl, том Е 5, стр 780 и далее 12 Аналогично этому возможно также получать требуемый гидроксиимин формулы III из карбонилгидроксиимина формулы VII взаимодействием с гидроксиламином IXa либо его солью IXb " -от IXa соотв. VII IXb RS~0N=C(R4J-C(R3)=NOH III Q e в формуле IXa представляет собой анион кислоты, прежде всего неорганической кислоты, например, галогенид, такой, как хлорид Реакцию осуществляют по известной методике в инертном органическом растворителе с помощью методов, описанных в Европейской патентной заявке ЕР-А 513580, в Houben-Weyl, том 10/4, стр 73 и далее, Houben-Weyl, том Е 14Ь, стр 369 и далее и стр 385 и далее 13 Альтернативно описанной реакции соединения формулы I могут быть получены также благодаря тому, что производное бензила формулы II взаимодействием с карбонилгидроксиимином формулы VII сначала 12 11 55367 трансформируют в соответствующий бензилкетоксиимин формулы VIII, после чего этот бензилкетоксиимин VIII подвергают взаимодействию с гидроксиламином IXa, соответственно его солью IXb с получением в результате соединений формулы -ОН + L -СН C=NOCH І і X=C-NRR II O = C ( R V C ( R 3 ] ™ N O H + I і 3 - с Н NNH а 2 X=CNRR II V I I ( R 2 ) ;=косн V I I I і і X=CNRR 3 Па S ІХа/ЇХЬ I X=CNRR* Реакцию осуществляют по известной методике в инертном органическом растворителе с помощью методов, описанных в Houben-Weyl, том Е 14Ь, стр 369 и далее, Houben-Weyl, том 10/1, стр 1189 и далее и Houben-Weyl, том 10/4, стр 73 и далее или в Европейской патентной заявке ЕР-А 513580 14 Другая возможность получения соединений формулы I заключается в том, что сначала производное бензила формулы II подвергают взаимодействию с Nгидроксифталимидом, после чего осуществляют гидразинолиз с получением бензилгидроксиламина формулы Па и затем этот бензил гид роксиламин Па подвергают взаимодействию с карбонильным соединением формулы X R - 0 H = C ( R 1 ) - C { R 3 ) - 0 + П а —* І X Реакцию осуществляют по известной методике в инертном органическом растворителе с помощью методов, описанных в Европейской патентной заявке ЕР-А 463488 и в заявке Германии DE 4228867 3 Требуемое карбонильное соединение формулы X получают, например, взаимодействием соответствующего гидроксииминокарбонила формулы Vila с нуклеофильно замещенным реагентом формулы VI VI X Vila или взаимодействием соответствующего дикарбонила формулы XI с гидроксиламином IXa либо его солью IXb IXa соотв. XI IXb S 3 R ON=C(R4-C(R )=O X Указанные реакции осуществляют по известной методике в инертном органическом растворителе с помощью методов, описанных в Европейской патентной заявке ЕР-А 513580, в Houben-Weyl, том 10/4, стр 55 и далее, стр 73 и далее, стр 180 и далее и стр 217 и далее, 13 55367 14 Houben-Weyl, том E 14b, стр 307 и далее и стр 369 и далее, Houben-Weyl, том Е 5, стр 780 и далее Г Х а Л Х Ь 5 3 > R -0N=CtR*)=-CER )N0-CH 1 5 Соединения формулы I могут быть получены, соответственно, также благодаря тому, >NOCH что сначала бензил гид роксиламин Па І і X=CNRR I взаимодействием с гидроксииминокарбонилом •.з 2 Соединения, в которых R° и/или формулы Vila трансформируют в представляют собой атом галогена, получают из соответствующий бензилоксиимин формулы V, соответствующих предварительных стадий, где после чего этот бензилоксиимин V подвергают соответствующий радикал представляет собой взаимодействию с нуклеофильно замещенным гидроксильную группу, по известным методам (ср реагентом VI, как это описано выше, получая Houben-Weyl, том Е 5, стр 631, Journ Org Chem соединения формулы I 36, 233 (1971), Journ Org Chem 57, 3245 (1992)) Предпочтительно соответствующие обменные реакции с получением производного галогена осуществляют на стадиях I и VIII 3 Соединения, в которых R3 и/или R4 связаны со скелетов молекулы через О-, S-либо N-атом, :=NOCH получают из соответствующих предварительных і і 3 стадий, где соответствующий радикал X-CNRR Vila представляет собой атом галогена, по известным Па методам (ср Houben-Weyl, том Е 5, стр 826 и далее и стр 1280 и далее, Journ Org Chem 36, 233 (1971), Journ Org Chern 46, 3623 (1981)) Предпочтительно соответствующие обменные 3 ) - C ( R )=NO-CH реакции с получением производного галогена осуществляют на стадиях I и VIII 4 Соединения, в которых R3 и/или R4 связаны X=CNRR со скелетом через атом кислорода, получают частично также из соответствующих предварительных стадий, где соответствующий радикал представляет собой гидроксильную группу, по известным методам (ср Houben-Weyl, том Е 5, стр 826 - 829, Aust Journ Chem 27, стр R 6 0N=C(R 4 J-C(R 3 )=N0-C 1341 1349 (1974)) Предпочтительно >M0CH соответствующие обменные реакции с получением алкоксипроизводных осуществляют X«CNRRl на стадиях I и VIII 16 Аналогично описанным реакциям 5 Соединения, в которых R5 не означает соединения формулы I могут быть получены также галоген, получают предпочтительно благодаря благодаря тому, что сначала тому, что соединение формулы X по методам, бензил гид роксиламин На взаимодействием с описанным в Европейской патентной заявке ЕР-А дикар-бонилом формулы XI переводят в 493711, с помощью лактона формулы XII, бензилоксиимин формулы VIII, после чего этот переводят сначала в соответствующую бензойную бензилоксиимин VIII подвергают взаимодействию кислоту формулы XIII, а затем бензойную кислоту с гидроксиламином IXa либо его солью IXb, как XIII через соответствующие галогениды переводят указано выше, получая соединения формулы I в цианкарбоновые кислоты формулы XIV, которые Э O=C(R 4 )-C{R 3 )=0 + H NQ-CH 2 2 "=NOCH I 13 X=CNRR VII! посредством реакции Пиннера (ср Angew Chem 94, 1 (1982)) переводят в а-кетоэфиры формулы XV Из производных XV путем амидирования получают соответствующие амиды карбоновой кислоты, которые затем переводят в соединения формулы I 15 16 55367 S 4 3 R ON=CIR )-C(R )=NOC X=C-ONRH (R*) 5 4 3 R -0№-C{ R ) -C (R ) =NQ-C XIII I 6 Согласно модификации описанного в разделе 5 способа можно также непосредственно из галогенидов карбоновой кислоты взаимодействием с изоцианатами и последующим гидролизом получать непосредственно соединения формулы XVI, в которых R означает водород (см Европейский патент ЕР 547825) ]-CCR ]= ЕНа1=галоген) OC-NRR CR=H) XVI 7 В другом варианте соединения формулы XVI получают благодаря тому, что ортосоединение галогена после металлирования оксалилхлоридом переводят в соответствующий хлорид кетокислоты, после чего последний с помощью амина переводят в соответствующий амид XVI (ср Journ Org Chem 46, стр 212 и далее (1981), заявка Германии DE-A 4042280, Houben-Weyl, том Е 5, стр 972 и далее) (Н al = галоген) RS-ON=C(R4)-C(R3)=NO-C XIV R5-0N=C(R4)-C(R3)=NO-CH RB-ON=CCR4)-C(R3]=N0-CH R5 -ON=C (H 4 ) -C (R3 ) =NO-CH XVI O^C-NRR O^C-NRR 8 В другом варианте соединения формулы I, в которых X означает кислород, получают, исходя из кетоэфиров XV, благодаря тому, что сначала кетофункцию переводят в оксимовый эфир и 17 S 3 R -ON=C(R*)-C(R )=NO-CH XV I RS-ON=C(R4-C(R3)=NO-C I RS ON=C(R 4 J-C{R 3 ]=NO-CH I OC-NRR' 9 Соединения формулы І, в которых X означает серу, получают из соответствующих амидов I взаимодействием с сульфитирующим средством (например, сульфидом фосфора или реагентом Цавессона, ср Houben-Weyl, том IX, стр 764 и далее) RS 4 ) -С (R 3 ) =NO-CH КХ=О) O=C-NRR [S] R 5 3 ON=C(R*)-C(R )=N0-C I(X*S) 18 Если при осуществлении синтеза получают смеси изомеров, то в принципе, однако, разделение проводить не обязательно, поскольку отдельные изомеры во время переработки для последующего применения или в процессе применения могут быть трансформированы друг в друга (например, под воздействием света, кислот или оснований) Соответствующие трансформации могут происходить и после применения указанных веществ, например, после проведенной обработки растений в обработанном растении или во вредоносных грибах, с которыми ведется борьба, или же в насекомом-вредителе Что касается двойной связи С=І\ІОСНз, то благодаря их эффективности предпочтительными являются цис-изомеры соединений формулы I (конфигурация в отношении группы -ОСНз по отношению к группе - CXNRR1) Что касается двойной связи C(R3)=NOCH2, то благодаря их эффективности предпочтительными являются Z-изомеры соединений формулы I (конфигурация в отношении радикала R3 по отношению к группе -ОСН2) При расшифровке соединений формулы I, приведенной выше, были использованы общие понятия, включающие общепринятые, обозначения следующих групп галоген фтор, хлор, бром и иод, ал кил линейные или разветвленные алкильные группы с 1-4, 6 или 10 атомами углерода, например, Сі-Сєалкил, такой, как метил, этил, пропил, 1-метилэтил, бутил, 1-метилпропил, 2-метил пропил, 1,1-диметилэтил, пентил, 1метилбутил, 2-метилбутил, 3-метилбутил, 2,2диметил пропил, 1-этил пропил, гексил, 1,1диметил пропил, 1,2-диметил пропил, 1метилпентил, 2-метилпентил, 3-метилпентил, 4метил пентил, 1,1 -диметил-бутил, 1,2диметилбутил, 1,3-д и метил бутил, 2,2диметилбутил, 2,3-д и метил бутил, 3,3диметилбутил, 1-этилбутил, 2-этилбутил, 1,1,2 55367 затем полученный таким путем оксимовый эфир с помощью соответствующего амина переводят в соединение формулы I (см Houben-Weyl, том Е 5, стр 941 и далее) C=NOCH I l3 Соединения формулы І, в которых R означает водород, получают по этому способу путем омыления сложных эфиров XV и последующей трансформацией в соединения формулы I Соединения формулы II известны (см Европейские патентные заявки ЕР-А 477631, ЕР-А 463488) или их можно получить с помощью описанных в указанных публикациях методов Соединения формулы I благодаря их двойным связям С=С и C=N могут быть получены в виде смесей E/Z-изомеров, которые по обычной методике, например, посредством кристаллизации или хроматографии, можно разделять на отдельные соединения ТрИМеТИЛПрОПИЛ, 1,2,2-ТрИМЄТИЛПрОПИЛ, 1-ЭТИЛ-1 метилпропил и 1-этил-2-метилпропил, алкиламино, аминогруппа, несущая линейную или разветвленную алкильную группу с 1 - 6 атомами углерода, как указано выше, диалкиламино, аминогруппа, несущая две независимые друг от друга линейные или разветвленные алкильные группы, соответственно с 1 - 6 атомами углерода, как указано выше, алкилкарбонил линейные или разветвленные алкильные группы с 1 - 10 атомами углерода, связанные со скелетом через карбонильную группу (-СО-), алкилсульфонил линейные или разветвленные алкильные группы с 1 - 6 либо 10 атомами углерода, связанные со скелетом через сульфонильную группу (-S(=O)2-), алкилсульфоксил линейные или разветвленные алкильные группы с 1 - 6 атомами углерода, связанные со скелетом через сульфоксильную группу (-S(=O)2), алкиламинокарбонил алкиламиногруппы с 1 6 атомами углерода, связанные со скелетом через карбонильную группу (-СО-), 20 19 55367 диалкиламинокарбонил диалкиламиног-руппы этилпропилтио, гексилтио, 1,1-диметилпропилтио, соответственно с 1 - 6 атомами углерода на 1,2-диметилпропилтио, 1-метилпентилтио, 2каждый алкильний остаток, как указано выше, метил пентилтио, 3-метил пентилтио, 4связанные со скелетом через карбонильную метил пентилтио, 1,1-диметилбутилтио, 1,2группу (-СО-), диметилбутилтио, 1,3-диметилбутилтио, 2,2диметилбутилтио, 2,3-диметилбутилтио, 3,3алкиламинотиокарбонил алкиламиногруппы с диметилбутилтио, 1 -этил бутилтио, 21 - 6 атомами углерода, как указано выше, связанные со скелетом через тиокарбонильную этилбутилтио, 1,1,2-триметилпропилтио, 1,2,2группу (-CS-), триметилпропилтио, 1-этил-1-метилпропилтио и 1этил-2-метил пропилтио, диалкиламинотиокарбонил диалкиламиногруппы соответственно с 1 - 6 атомами углерода циклоалкил моноциклические алкильные на каждый алкильный остаток, как указано выше, группы с 3 - 6 углеродными звеньями кольца, связанные со скелетом через тиокарбонильную например, циклопропил, циклобутил, циклопентил группу (-CS-), и циклогексил, галогеналкил линейные или разветвленные алкенил линейные или разветвленные алкильные группы с 1 - 6 атомами углерода, алкенильные группы с 2 - 6 или 10 атомами причем в этих группах частично либо полностью углерода и двойной связью в любом положении, атомы водорода могут быть заменены на атомы например, Сз-Сбалкенил, такой, как этенил, 1галогена, как указано выше, например, d пропенил, 2-пропенил, 1-метилетенил, 1-бутенил, С2 гал о ге нал кил, такой, как хлорметил, 2-бутенил, 3-бутенил, 1-метил-1-пропенил, 2дихлорметил, трихлорметил, фторметил, метил-1-пропенил, 1-метил-2-пропенил, 2-метилдифторметил, трифторметил, хлорфторметил, 2-пропенил, 1-пентенил, 2-пентенил, 3-пентенил, дихлорфторметил, хлордифторметил, 1-фторэтил, 4-пентенил, 1-метил-1-бутенил, 2-метил-1 2-фторэтил, 2,2-дифторэтил, 2,2,2-трифторэтил, бутенил, З-метил-1-бутенил, 1-метил-2-бутенил, 22-хлор-2-фторэтил, 2-хлор-2,2-дифторэтил, 2,2метил-2-бутенил, З-метил-2-бутенил, 1-метил-Здихлор-2-фторэтил, 2,2,2-трихлорэтил и бутенил, 2-метил-З-бутеннл, З-метил-3-бутенил, пентафторэтил, 1,1-диметил-2-пропенил, 1,2-диметил-1-пропенил, 1,2-диметил-2-пропенил, 1 -этил-1 -пропенил, 1 алкокси линейные или разветвленные этил-2-пропенил, 1-гексенил, 2-гексенил, 3алкильные группы с 1 - 4 или 6 атомами углерода, гексенил, 4-гексенил, 5-гексенил, 1-метил-1как указано выше, связанные со скелетом через пентенил, 2-метил-1-пентенил, З-метил-1атом кислорода (-О-), например, Сі-Сєалкокси, пентенил, 4-метил-1-пентенил, 1-метил-2такие, как метилокси, этилокси, пропилокси, 1пентенил, 2-метил-2-пентенил, З-метил-2метилэтилокси, бутилокси, 1-метилпропилокси, 2пентенил, 4-метил-2-пентенил, 1-метил-Зметил-пропилокси, 1,1-диметилэтилокси, пентенил, 2-метил-З-пентенил, З-метил-3пентилокси, 1-метилбутилокси, 2-метилбутилокси, пентенил, 4-метил-З-пентенил, 1 -метил-43-метилбутилокси, 2,2-диметилпропилокси, 1пентенил, 2-метил-4-пентенил, З-метил-4этил пропилокси, гексилокси, 1,1пентенил, 4-метил-4-пентенил, 1,1-диметил-2диметилпропилокси, 1,2-диметилпропилокси, 1бутенил, 1,1-диметил-З-бутенил, 1,2-диметил-1метил пентилокси, 2-метил пентилокси, 3бутенил, 1,2-диметил-2-бутенил, 1,2-диметил-Зметил пентилокси, 4-метил пентилокси, 1,1бутенил, 1,3-диметил-1-бутенил, 1,3-диметил-2диметилбутилокси, 1,2-диметилбутилокси, 1,3бутенил, 1,3-диметил-З-бутенил, 2,2-диметил-Здиметилбутилокси, 2,2-диметилбутилокси, 2,3бутенил, 2,3-диметил-1-бутенил, 2,3-диметил-2диметилбутилокси, 3,3-диметилбутилокси, 1бутенил, 2,3-диметил-З-бутенил, 3,3-диметил-1этилбутилокси, 2-этилбутилокси, 1,1,2бутенил, 3,3-диметил-2-бутенил, 1-этил-1-бутенил, триметил пропилокси, 1,2,2-триметил пропилокси, 1 -этил-2-бутенил, 1 -этил-3-бутенил, 2-этил-1 1 -этил-1 -метилп-ропилокси и 1 -этил-2бутенил, 2-этил-2-бутенил, 2-этил-З-буте-нил, метил пропилокси, 1,1,2-триметил-2-пропенил, 1-этил-1-метил-2алкокси карбон ил линейные или разветвленные алкильные группы с 1 - 6 атомами ПрОПеНИЛ, 1-ЗТИЛ-2-МЄТИЛ-1-ПрОПеНИЛ И 1-ЭТИЛ-2углерода, связанные со скелетом через метил-2-пропенил, оксикарбонильную группу (-ОС(=О)-), алкенилокси линейные или разветвленные галогеналкокси линейные или разветвленные алкенильные группы с 2 - 6 атомами углерода и алкильные группы с 1 - 6 атомами водорода, двойной связью в любом положении, связанные причем в этих группах частично либо полностью со скелетом через атом кислорода (-О-), атомы водорода могут быть заменены на атомы алкенилтио, соответственно алкениламино галогена, как указано выше, и причем эти группы линейные или разветвленные алкенильные связаны со скелетом через атом кислорода, группы с 2 - 6 атомами углерода и двойной связью в любом положении, связанные (алкенилтио) алкилтио линейные или разветвленные через атом серы, соответственно (алкениламино) алкильные группы с 1 - 4 или 6 атомами углерода, через атом азота со скелетом, как указано выше, связанные со скелетом через атом серы (-S-), например, Сі-Сєалкилтио, такая, алкенилкарбонил линейные или как метилтио, этилтио, пропилтио, 1разветвленные алкенильные группы с 2 - 10 метилэтилтио, бутилтио, 1-метил пропилтио, 2атомами углерода и двойной связью в любом метилпропилтио, 1,1-диметилэтилтио, пентилтио, положении, связанные со скелетом через 1 -метил бутилтио, 2-метил бутилтио, 3карбонильную группу (-СО-), м етил бутилтио, 2,2-диметил пропилтио, 1алкинил линейные или разветвленные 22 21 55367 алкинильные группы с 2 - 10 атомами углерода и 5-тиазолидинил, 2-имидазолидинил, 4тройной связью в любом положении, например, имидазолидинил, имидазолидинил 1,2,4-оксадиазолидин-З-ил, Сг-Сбалкинил, такой, как этинил, 2-пропинил, 21,2,4-оксадиазолидин-5-ил, 1,2,4-тиадиазолидинбутинил, 3-бутинил, 1-метил-2-пропинил, 23-ил, 1,2,4-тиадиазолидин-5-ил, 1,2,4пентинил, 3-пентинил, 4-пентинил, 1-метил-2триазолидин-3-ил, 1,3,4-оксадиазолидин-2-ил, бутинил, 1-метил-З-бутинил, 2-метил-З-бутинил, 1,3,4-тиадиазолидин-2-ил, 1,3,4-триазолидин-2-ил, 1,1-диметил-2-пропинил, 1-этил-2-пропинил, 22,3-дигидрофур-2-ил, 2,3-дигидрофур-З-ил, 2,3гексинил, 3-гексинил, 4-гексинил, 5-гексинил, 1дигидрофур-4-ил, 2,3-дигидрофур-5-ил, 2,5метил-2-пентинил, 1-метил-З-пентинил, 1-метил-4дигидрофур-2-ил, 2,5-дигидрофур-З-ил, 2,3пентинил, 2-метил-З-пентинил, 2-метил-4дигидротиен-2-ил, 2,3-дигвдротнен-З-ил, 2,3пентинил, З-метил-4-пентинил, 4-метил-2дигидротиен-4-ил, 2,3-дигидротиен-5-ил, 2,5пентинил, 1,1-диметил-2-бутинил, 1,1-диметил-Здигидротиен-2-ил, 2,5-дигидротиен-З-ил, 2,3бутинил, 1,2-диметил-З-бутинил, 2,2-диметил-Здигидропиррол-2-ил, 2,3-дигадропиррол-З-ил, 2,3бутинил, 1-этил-2-бутинил, 1-этил-З-бутинил, 2дигидропиррол-4-ил, 2,3-дигидропиррол-5-ил, 2,5этил-3-бутинил и 1-этил-1-метил-2-пропинил, дигвдропиррол-2-ил, 2,5-дигидропиррол-З-ил, 2,3дигидроизоксазол-3-ил, 2,3-дигидроизоксазол-4ал ки нил карбон ил линейные или ил, 2,3-дигидроизоксазол-5-ил, 4,5разветвленные алкинильные группы с 3 - 10 атомами углерода и тройной связью в любом дигидроизоксазол-3-ил, 4,5-дигидроизоксазол-4положении, связанные со скелетом через ил, 4,5-дигидроизоксазол-5-ил, 2,5карбонильную группу (-СО-), дигидроизотиазол-3-ил, 2,5-дигидроизотиазол-4ил, 2,5-дигидроизотиазол-5-ил, 2,3алкинилокси, соответственно алкинилтио и алкиниламино линейные или разветвленные дигидроизопиразол-3-ил, 2,3-дигвдроизопиразолалкинильные группы с 2 - 6 атомами углерода и 4-ил, 2,3-дигидроизопиразол-5-ил, 4,5тройной связью в любом положении, связанные дигидроизопиразол-3-ил, 4,5-дигидроизопиразол(алкинилокси) через атом кислорода, 4-ил, 4,5-дигидроизопиразол-5-ил, 2,5соответственно (алкинилтио) через атом серы или дигидроизопиразол-3-ил, 2,5-дигидроизопиразол(алкиниламино) через атом азота со скелетом, 4-ил, 2,5-дигидроизопиразол-5-ил, 2,3дигидрооксазол-3-ил, 2,3-дигидрооксазол-4-ил, циклоалкенил, соответственно циклоалке2,3-дигидрооксазол-5-ил, 4,5-дигидрооксазол-З-ил, нилокси, циклоалкенилтио и циклоалкениламино 4,5-дигидрооксазол-4-ил, 4,5-дигидрооксазол-5-ил, моноциклические алкенильные группы с 3 - 6 2,5-дигидрооксазол-З-ил, 2,5-дигидрооксазол-4-ил, углеродными звеньями кольца, непосредственно 2,5-дигидрооксазол-5-ил, 2,3-дигидротиазол-2-ил, связанные соответственно (циклоалкенилокси) 2,3-дигидротиазол-4-ил, 2,3-дигидротиазол-5-ил, через атом кислорода или (циклоалкенилтио) 4,5-дигидротиазол-2-ил, 4,5-дигвдротиазол-4-ил, через атом серы или (циклоалкениламино) через 4,5-дигидротиазол-5-ил, 2,5-дигидротиазол-2-ил, атом азота со скелетом, например, 2,5-дигидротиазол-4-ил, 2,5-дигадротиазол-5-ил, циклопропенил, циклобутенил, циклопентенил или 2,3-дигидроимидазол-2-ил, 2,3-дигидроимидазолциклогексенил, 4-ил, 2,3-дигидроимидазол-5-ил, 4,5циклоалкокси, соответственно циклоалкилтио и циклоалкиламино моноциклические алкенильные группы с 3 - 6 углеродными звеньями кольца, связанные (циклоалкилокси) через атом кислорода или (циклоалкилтио) через атом серы или (циклоалкиламино) через атом азота со скелетом, например, циклопропил, циклобутил, циклопентил или циклогексил, гетероциклил, соответственно гетероциклилокси, гетероциклилтио и гетероциклиламино трех-шестичленные, насыщенные либо частично ненасыщенные моноили полициклические гетероциклы, содержащие от одного до трех гетероатомов, выбранных из группы, включающей кислород, азот и серу, и непосредственно связанные соответственно (гетероциклилокси) через атом кислорода или (гетероциклилтио) через атом серы или (гетероциклиламино) через атом азота со скелетом, как, например, 2-тетрагидрофуранил, оксиранил, 3-тетрагидрофуранил, 2тетрагидротиенил, 3-тетрагидротиенил, 2пирролидинил, 3-пирролидинил, 3изоксазолидинил, 4-изоксазолидинил, 5-изоксазолидинил, 3-изотиазолидинил, 4-изотиазолидинил, 5-изотиазолидинил, 3-пиразолидинил, 4пиразолидинил, 5-пиразо-лидинил, 2оксазолидинил, 4-оксазолидинил, 5оксазолидинил, 2-тиазолидинил, 4-тиазо-лидинил, дигидроимидазол-2-ил, 4,5-дигидроимидазол-4-ил, 4,5-дигидроимидазол-5-ил, 2,5-дигидроимидазол2-ил, 2,5-дигидроимидазол-4-ил, 2,5дигадроимидазол-5-ил, 2-морфолинил, 3морфолинил, 2-пиперидинил, 3-пиперидинил, 4пиперидинил, 3-тетрагидропиридазинил, 4тетрагвдропиридазинил, 2тетрагидропиримидинил, 4тетрагидропиримидинил, 5тетрагидропиримидинил, 2-тетрагидропиразинил, 1,3,5-тетрагидротриазин-2-ил, 1,2,4тетрагидротриазин-3-ил, 1,3-дигидрооксазин-2-ил, 1,3-дитиан-2-ил, 2-тетрагидропиранил, 1,3диоксолан-2-ил, 3,4,5,6-тетрагадропиридин-2-ил, 4Н-1,3-тиазин-2-ил, 4Н-3,1-бензтиазин-2-ил, 1,1диоксо-2,3,4,5-тетрагидротиен-2-ил, 2Н-1.4бензтиазин-3-ил, 2Н-1,4-бензоксазин-З-ил, 1,3дигидрооксазин-2-ил, 1,3-дитиан-2-ил, арил, соответственно арилокси, арилтио, арилкарбонил и арилсульфонил ароматические моно- либо полициклические углеводородные остатки, непосредственно связанные соответственно (арилокси) через атом кислорода (-О-) или (арилтио) через атом серы (-S-), (арилкарбонил) через карбонильную группу (-СО-) или (арилсульфонил) через сульфонильную группу (-SO2-) со скелетом, например, фенил, нафтил и фенантренил, соответственно 24 23 55367 фенилокси, нафтилокси и фенантренилокси и связанный через азот 5-членный гетероарил, соответствующие карбонильные и сульфонильные содержащий от одного до четырех атомов азота, остатки, или связанный через азот бензконденсированныи 5-членный гетероарил, содержащий от одного до ариламино ароматические моноили трех атомов азота 5-циклические гетероарильные полициклические углеводородные остатки, группы, которые наряду с атомами углерода могут связанные со скелетом через атом азота, содержать в качестве членов цикла от одного до гетарил, соответственно гетарилокси, четырех атомов азота, соответственно от одного гетарилтио, гетарил карбонил и до трех атомов азота и в которых два соседних гетарилсульфонил ароматические моно- или углеродных члена или азотный член и соседний полициклические остатки, которые наряду с углеродный член могут соединяться мостиковой углеродными звеньями могут содержать связью бута-1,3-диен-1,4-дииловой группой, дополнительно от одного до четырех атомов причем эти циклы соединены со скелетом через азота либо от одного до трех атомов азота и один один из азотных членов цикла, атом кислорода либо один атом серы или один атом кислорода либо один атом серы и которые - 6-членный гетероарил, содержащий от непосредственно связаны соответственно одного до трех, соответственно от одного до (гетарилокси) через атом кислорода (-О-) или четырех атомов азота 6-циклические (гетарилтио) через атом серы (-S-), гетероарильные группы, которые наряду с (гетарилкарбонил) через карбонильную группу (атомами углерода могут содержать в качестве СО-) или (гетарилсульфонил) через членов цикла от одного до трех, соответственно сульфонильную группу (-SO2-) со скелетом, от одного до четырех атомов азота, например, 2например пиридинил, 3-пиридинил, 4-пиридинил, 3пиридазинил, 4-пиридазинил, 2-пиримидинил, 4- 5-членный гетероарил, содержащий от пиримидинил, 5-пирими-динил, 2-пиразинил, 1,3,5одного до трех атомов азота 5-циклические триазин-2-ил, 1,2,4-триазин-З-ил и 1,2,4,5гетероарил ьные группы, которые наряду с тетразинил, атомами углерода могут содержать в качестве звеньев цикла от одного до трех атомов азота, бензконденсированныи 6-членный например, 2-пирролил, 3-пирролил, 3-пиразолил, гетероарил, содержащий от одного до четырех 4-пиразолил, 5-пиразолил, 2-имвдазолил, 4атомов азота 6-циклические гетероарильные имидазолил, 1,2,4-триазол-З-ил и 1,3,4-триазол-2группы, в которых два соседних углеродных члена ил, могут соединяться мостиковой связью бута-1,3диен-1,4-дииловой группой, например, хинолин, - 5-членный гетероарил, содержащий от изохинолин, хиназолин и хиноксалин, одного до четырех атомов азота либо от одного до трех атомов азота и один атом серы либо один или соответствующие окси-, тио-, атом кислорода или один атом кислорода либо карбонильные или сульфонильные группы, один атом серы 5-циклические гетероарильные гетариламино, ароматические моно- или группы, которые наряду с атомами углерода могут полициклические остатки, которые наряду с содержать в качестве членов цикла от одного до углеродными членами могут содержать четырех атомов азота либо от одного до трех дополнительно от одного до четырех атомов атомов азота и один атом серы либо один атом азота либо от одного до трех атомов азота и один кислорода или один атом кислорода либо один атом кислорода либо один атом серы или один атом серы, например, 2-фурил, 3-фурил, 2-тиенил, атом кислорода либо один атом серы и которые 3-тиенил, 2-пирролил, 3-пнрролнл, 3-изоксазолил, связаны со скелетом через атом азота 4-изоксазолил, 5-изоксазолил, 3-изотиазолил, 4Понятие "частично либо полностью изотиазолил, 5-изотиазолил, 3-пиразолил, 4галогенированные" означает, что в пиразолил, 5-пиразолил, 2-оксазолил, 4характеризуемых таким образом группах атомы оксазолил, 5-оксазолил, 2-тиазолил, 4-тиазолил, водорода могут быть частично либо полностью 5-тиазолил, 2-имидазолил, 4-имидазолил, 1,2,4заменены на идентичные или разные атомы оксадиазол-3-ил, 1,2,4-оксадиазол-5-ил, 1,2,4галогена, как указано выше тиадиазол-3-ил, 1,2,4-тиадиазол-5-ил, 1,2,4С учетом их биологической эффективности триазол-3-ил, 1,3,4-оксадиазол-2-ил, 1,3,4предпочтительными соединениями формулы I тиадиазол-2-ил, 1,3,4-триазол-2-ил, являются те из них, в которых m означает О бензконденсированныи 5-членный По той же причине предпочтительны гетероарил, содержащий от одного до трех атомов соединения формулы І, в которых R представляет азота либо один атом азота и/или один атом собой водород или метил кислорода либо один атом серы 5-циклические По той же причине к предпочтительным гетероарильные группы, которые наряду с соединениям формулы I относятся те из них, в атомами углерода могут содержать от одного до которых R1 представляет собой водород или четырех атомов азота, либо от одного до трех метил атомов азота и один атом серы, либо один атом Особенно предпочтительны соединения кислорода или один атом кислорода, либо один формулы І, в которых R1 означает водород, a R1 атом серы в качестве членов цикла и в которых означает водород или метил два соседних углеродных члена или азотный член Также к предпочтительным соединениям и соседний углеродный член могут соединяться формулы I относятся те из них, в которых R и R1 мостиковой связью бута-1,3-диен-1,4-дииловой одновременно означают водород или метил группой, Кроме указанных, предпочтительны 26 25 55367 соединения формулы I, в которых R представляет С4галогеналкокси, Сі-С4алкиламино, ди-Cr собой водород, гидрокси, циклопропил, хлор, С4алкиламино, Сі-С4алкилсульфонил, dметил, метокси, метилтио или фенил С4алкокси карбон ил, Сі-С4алкиламинокарбонил или ди-Сі-С4алкиламинокарбонил Наряду с указанными предпочтительными 3 являются соединения формулы І, в которых R Кроме того, к предпочтительным относятся 5 представляет собой метил соединения формулы І, в которых R представляет собой водород, Сі-Сєалкил, арил далее К предпочтительным относятся ал кил, гетарилалкил, арилоксиалкил, соединения формулы в которых R" гетарилоксиалкил, арил или гетарил представляет собой метокси Кроме того, предпочтительными являются Предпочтительны далее соединения 3 соединения формулы І, в которых R формулы I, в которых R представляет собой d представляет собой гидрокси СбЭЛКИЛ К предпочтительным соединениям формулы I Наряду с указанными предпочтительными 3 5 следует далее причислить те из них, в которых R являются соединения формулы І, в которых R представляет собой хлор представляет собой метил или этил Предпочтительные соединения формулы I Предпочтительны далее соединения 4 включают далее те из них, в которых R формулы І, в которых R представляет собой представляет собой водород, гидрокси, арилалкил или гетарилалкил циклопропил, хлор, метил, этил, изопропил, К предпочтительным соединениям формулы I метокси или метилтио следует отнести также те из них, в которых R5 представляет собой арилоксиалкил или Кроме указанных, предпочтительны гетарилоксиалкил соединения формулы І, в которых R4 представляет собой метил Кроме того, предпочтительными являются К предпочтительным относятся далее соединения формулы І, в которых R5 соединения формулы І, в которых R4 представляет собой арил или гетарил представляет собой метокси Наряду с вышеуказанными к предпочтительным относятся соединения Наряду с указанными предпочтительными формулы І, в которых X представляет собой О являются соединения формулы І, в которых R4 представляет собой гидрокси Предпочтительны далее соединения формулы I, в которых X представляет собой S Предпочтительны далее соединения формулы І, в которых R4 представляет собой этил Ниже представлены соединения формулы I, Кроме того, к предпочтительным соединениям которые отнесены к предпочтительным прежде формулы I относятся те из них, в которых R4 всего с учетом их применения представляет собой изопропил 1 Предпочтительными, кроме того, являются Соединения общей формулы И , в которых соединения формулы І, в которых R4 представляет (R2) а комбинация означает во/ собой циклопропил заместителей R3, R4 и R° относится к соединению, К предпочтительным относятся далее указанному в каждой строке таблицы А соединения формулы І, в которых R4 соответственно представляет собой необязательно замещенный арил или гетарил Среди предпочтительных следует назвать 4 также соединения формулы І, в которых R представляет собой необязательно замещенный 1.1 пиридил, пиримидил, пиразинил, пиридазинил или триазинил Предпочтительными являются далее соединения формулы І, в которых R4 представляет собой необязательно замещенный фурил, тиенил или пирролил Соединения общей формулы И , в которых (R2)m означает хлор, а комбинация заместителей Предпочтительны далее соединения R3, R4 и R5 относится к соединению, указанному в формулы I, в которых R представляет собой каждой строке таблицы А соответственно необязательно замещенный оксазолил, тиазолил, изоксазолил, изотиазолил, пиразолил или 3 имидазолил Соединения общей формулы I 2, в которых К предпочтительным соединениям формулы I (R2) ъ означает водород, а комбинация относятся далее те из них, в которых R4 заместителей R°, R4 и R° относится к соединению, представляет собой необязательно замещенный указанному в каждой строке таблицы А оксдиазолил, тиадиазолил или триазолил соответственно Кроме указанных, предпочтительными являются соединения формулы І, в которых R4 представляет собой фенил, незамещенный или несущий от одной до двух групп из числа следующих нитро, циано, гидрокси, амино, аминокарбонил, аминотиокарбонил, галоген, С г Сі-С4галогеналкил, Сі-С4алкокси, C r 28 55367 1.2 1.5 NCCH ) Соединения общей формулы I 2, в которых 2 (R )m означает хлор, а комбинация заместителей 3 4 5 R , R и R относится к соединению, указанному в каждой строке таблицы А соответственно 5 Соединения общей формулы I 3, в которых 2 (R ) ъ означает водород, а комбинация заместителей R , R и R относится к соединению, указанному в каждой строке таблицы А соответственно 10 Соединения общей формулы I 5, в которых (R )m означает хлор, а комбинация заместителей 3 4 5 R , R и R относится к соединению, указанному в каждой строке таблицы А соответственно 11 Соединения общей формулы I 6, в которых (R2) ъ означает водород, а комбинация заместителей R , R и R" относится к соединению, указанному в каждой строке таблицы А соответственно 2 1.3 1.6 Соединения общей формулы I 3, в которых (R2)m означает хлор, а комбинация заместителей R3, R4 и R5 относится к соединению, указанному в каждой строке таблицы А соответственно 7 Соединения общей формулы I 4, в которых водород, а комбинация (R2) означает заместителей R3, R4 и R° относится к соединению, указанному в каждой строке таблицы А соответственно 1.4 Соединения общей формулы I 4, в которых (R2)m означает хлор, а комбинация заместителей 3 R , R4 и R5 относится к соединению, указанному в каждой строке таблицы А соответственно 9 Соединения общей формулы I 5, в которых водород, а комбинация (R2) означает заместителей R3, R4 и R° относится к соединению, указанному в каждой строке таблицы А соответственно Соединения общей формулы I 6, в которых (R2)m означает хлор, а комбинация заместителей R3, R4 и R5 относится к соединению, указанному в каждой строке таблицы А соответственно Соединения формулы I пригодны для применения в качестве фунгицидов Соединения формулы I отличаются исключительно высокой эффективностью против широкого спектра фитопатогенных грибов, прежде всего относящихся к классу Ascomyceten и Basidiomyceten Они обладают частично системным действием и могут применяться в качестве фунгицидов для обработки листьев и в качестве почвенных фунгицидов Особое значение они имеют для борьбы с многочисленными грибами, поражающими различные культурные растения, такие, как пшеница, рожь, ячмень, овес, рис, кукуруза, травы, хлопчатник, соя, кофе, сахарный тростник, виноград, плодовые и декоративные растения, овощные культуры, такие, как огурцы, бобовые и тыквенные, а также поражающими семена этих растений Особенно они пригодны для борьбы со следующими болезнями растении Erysiphe gramims (настоящая мучнистая роса) на зерновых, Erysiphe cichoracearum и Sphaerotheca fuhginea на тыквенных, Podosphaera leucotncha на яблоневых, Uncmula necator на виноградной лозе, виды Puctima на зерновых, виды Rhizoctoma на хлопчатнике и дернине, виды Ustilago на зерновых и сахарном тростнике, Ventuna maequahs (парша) на яблоневых, виды Helminthosponum на зерновых, Septona nodorum на пшенице, Botrytis cmerea (серая гниль) на землянике, виноградной 30 29 55367 лозе, Cercospora arachidicola на земляном орехе, гербицидами, инсектицидами, регуляторами Pseudocercosporella herpotnchoides на пшенице, роста, фунгицидами или же в том числе с ячмене, Pynculana oryzae на рисе, Phytophthora удобрениями mfestans на картофеле и томатах, виды Fusanum и При смешивании с другими фунгицидами во Verticil hum на различных культурах, Plasmopara многих случаях достигают при этом расширение viticola на виноградной лозе, виды Alternana на спектра фунгицидного действия овощных и плодовых культурах Ниже представлен перечень фунгицидов, в Принцип применения соединений формулы I сочетании с которыми могут применяться состоит в том, что грибы или растения, семена, соединения по изобретению, причем этот материалы или почву, требующие защиты от перечень служит для пояснения таких поражения грибами, обрабатывают фунгицид но комбинационных возможностей и никоим образом активным количеством действующих веществ не ограничивает объем изобретения Такую обработку проводят до либо после сера, дитиокарбаматы и их производные, заражения материалов, растений или семян такие, как диметилдитиокарбамат железа, грибами диметилдитиокарбамат цинка, Из соединений формулы I можно этиленбисдитиокарбамат цинка, приготавливать обычные композиции, такие, как этиленбисдитиокарбамат марганца, растворы, эмульсии, суспензии, препараты для этилендиаминбисдитиокарбамат марганец-цинка, опыливания, порошки, пасты и грануляты Форма тетраметилтиурамдисульфиды, аммиачный применения зависит соответственно от целей комплекс (N.N-этиленбисдитиокарбамат) цинка, применения, но в любом случае должно быть аммиачный комплекс (N.N'-пропил обеспечено тонкое и равномерное распределение енбисдитиокарбамат) цинка, (N.N1орто-замещенного бензилового эфира пропиленбисдитиокарбамат) цинка, N,N'циклопропанкарбоновой кислоты Композиции полипропиленбис(тио-карбамоил)дисульфид, приготавливают по обычной методике, например нитропроизводные, такие, как динитро-(1разбавлением действующего вещества метилгептил)фенилкротонат, 2-вторбутил-4,6растворителями и/или введением наполнителей, динитрофенил-3,3-диметилакрилат, 2-вторбутилпри необходимости с применением эмульгаторов 4,6-динитрофенилизопропил карбонат, и диспергаторов, причем в случае использования диизопропиловый эфир 5-нитроизофталевой воды в качестве разбавителя, могут применяться кислоты, также другие органические растворители в гетероциклические субстанции, как 2качестве вспомогательных средств, гептадецил-2-имидазолинацетат, 2,4-дихлор-6-(охлоранилино)-5-триазин, 0,0способствующих растворимости В качестве таких вспомогательных средств для указанных целей диэтилфталимидофосфонотиоат, 5-амино-1-[бисмогут использоваться в основном следующие (диметиламино)-фосфинил]-3-фенил-1,2,4растворители, такие, как ароматические триазол, 2,3-дициано-1,4-дитиоантрахинон, 2-тиоуглеводороды (например, ксилол), хлорированные 1,3-дитиоло [4,5-Ь]хиноксалин, метиловый эфир 1ароматические углеводороды (например, (бутилкарбамоил)-2-бензимидазол карбами новой хлорбензол ы), парафины (например, фракции кислоты, 2-метоксикарбониламинобен-зимидазол, нефти), спирты (например, метанол, бутанол), 2-(фурил-(2))-бензимидазол, 2-(тиазолил-(4))кетоны (например, циклогексанон), амины бензимидазол, 1\1-(1,1,2,2-тетрахлорэтилтио)(например, этаноламин, диметилформамид) и тетрагидрофталимид, Nвода, наполнители, такие, как природная мука трихлорметилтиотетрагидрофталимид, Nгорных пород (например, каолины, глиноземы, трихлорметилтиофталимид, тальк, мел) и синтетическая мука горных пород диамид г\І-дихлорфторметилтио-М',г\Г(например, тонкодисперсная кремниевая кислота, диметил-Ы-фенил-серной кислоты, 5-этокси-Зсиликаты), эмульгаторы, такие, как неионогенные трихлорметил-1,2,3-тиадиазол, 2и анионные эмульгаторы (например, роданметилтиобензтиазол, 1,4-дихлор-2,5полиоксиэтиленовый эфир жирного спирта, диметоксибензол, 4-(2-хлорфенилгидразоно)-3алкилсульфонаты и арилсульфонаты) и метил-5-изоксазолон, пириди-2-тио-1-оксид, 8диспергаторы, такие, как отработанный гидроксихинолин, соответственно его медная лигнинсульфитныи щелок и метилцеллюлоза соль, 2,3-дигидро-5-карбоксанилидо-6-метил-1,4оксатиин, 2,3-дигидро-5-карбоксанилидо-6-метилФунгицидные средства содержат, как правило, 1,4-оксатиин-4,4-диоксид, анилид 2-метил-5,6от 0,1 до 95, предпочтительно от 0,5 до 90 мае % дигидро-4Н-пиран-3-карбоновой кислоты, анилид действующего вещества 2-метилфуран-З-карбоновой кислоты, анилид 2,5Применяемые количества в зависимости от диметилфуран-3-карбоновой кислоты, анилид того, какой эффект хотят получить, составляют от 2,4,5-триметилфуран-З-карбоновой кислоты, 0,01 до 2,0кг действующего вещества на гектар циклогексиламид 2,5-диметилфуран-З-карбоновой При обработке семян действующие вещества кислоты, амид І\І-циклогексил-Мметокси-2,5необходимо применять, как правило, в диметилфуран-3-карбоновой кислоты, анилид 2количествах от 0,001 до 0,1 г, предпочтительно метилбензойной кислоты, анилид 2-иодбензойной 0,01 - 0,05г на килограмм семян кислоты, Ы-формил-Ы -морфолин-2,2,2Предлагаемые согласно изобретению трихлорэтилацеталь, пиперазин-1,4-диилбис-1средства при их применении в качестве (2,2,2-трихлорэтил)формамид, 1-(3,4фунгицидов могут использоваться также вместе с другими действующими веществами, например с дихлораншшно) -1 -формила-мино-2,2,2 32 31 55367 трихлорэтан, 2,6-диметил-І\І-тридецилморфолин, fiscellana, Laphygma exigua, Leucoptera coffeella, соответственно его соли, 2,6-диметил-ІЧLeucoptera scitella, Uthocolletis blancardella, Lobesia циклододецилморфолин, соответственно его botrana, Loxostege sticticahs, Lymantna dispar, соли, І\І-[3-(п-трет-бутилфенил)-2-метилпропил]Lymantna monacha, Lyonetia clerkella, Malacosoma цис-2,6-диметилморфолин, ІЧ-[3-(п-третneustna, Mamestra brassicae, Orgyia pseudotsugata, Ostrima nubilahs, Panohs flammea, Pectinophora бутилфенил)-2-метилпропил]пиперидин, 1-[2-(2,4gossypiella, Pendroma saucia, Phalera bucephala, дихлорфенил)-4-этил-1,3-диоксолан-2-илэтил ]Phthonmaea operculella, Phyllocnistis citrella, Piens 1Н-1,2,4-триазол, 1 -[2-(2,4-дихлорфенил)-4-нbrassicae, Plathypena scabra, Plutella xylostella, пропил-1,3-диоксолан-2-илэтил]-1 Н-1,2,4-триазол, Pseudoplusia mcludens, Rhyacionia frustrana, ІЧ-(н-пропил) -г\1-(2,4,6-трихлорфеноксиэтил)-г\ГScrobipalpula absoluta, Sitotroga cerealella, имидазол ил мочевина, 1-(4-хлорфенокси)-3,3Sparganothis pillenana, Spodoptera frugiperda, диметил-1 -(1 Н-1,2,4-триазол-1 -ил)-2-бутанон, 1 -(4Spodoptera httorahs, Spodoptera htura, хлорфенокси)-3,3-диметил-1 -(1 Н-1,2,4-триазол-1 Thaumatopoea pityocampa, Tortnx vindana, ил)-2-бутанол, а-(2-хлорфенил)-а-(4-хлорфенил)Tnchoplusia ni, Zeiraphera canadensis 5-пиримидинметанол, 5-бутил-2-диметиламино-4гидрокси-6-метилпиримидин, бис(п-хлорфенил)-3Из отряда жесткокрылых (Coleoptera), пи-ридинметанол, 1,2-бис(3-этоксикарбонил-2например Agnlus smuatus, Agnotes hneatus, тиоуреидо)бензол, 1,2-бис (З-метоксикарбонил-2Agnotes obscurus, Amphimallus solstitiahs, тиоуреидо) бензол, Amsandrus dispar, Anthonomus grandis, Anthonomus pomorum, Atomana Imeans, Blastophagus pmiperda, а также различные фунгициды, такие, как Bhtophaga undata, Bruchus rufimanus, Bruchus додецилгуанидинацетат, 3-[3-(3,5-диметил-2pisorum, Bruchus lentis, Byctiscus betulae, Cassida оксициклогексил)-2-гидроксиэтил]глутаримид, nebulosa, Cerotoma tnfurcata, Ceuthorrhynchus гексахлорбензол, ОІ_-метил-І\І-(2,6assimihs, Ceuthorrhynchus парі, Chaetocnema диметилфенил)-І\І-фуроил(2)-аланинат, DL-N-(2,6tibiahs, Conoderus vespertmus, Cnocens asparagi, диметилфенил)-І\І-(2'Diabrotica longicorais, Diabrotica 12-punctata, метоксиацетил)аланинметиловый эфир, N-(2,6Diabrotica vergifera, Epilachna vanvestis, Epitnx диметилфенил)-г\І-хлорацетил-ОІ_-2hirtipennis, Eutmobothrus brasihensis, Hylobius аминобутиролактон, О1_-г\1-(2,6-диметилфенил)-г\1abietis, Hypera brunneipennis, Hypera postica, Ips (фенилацетил)аланинметиловый эфир, 5-метил-5typographus, Lema bilmeata, Lema melanopus, винил-3-(3,5-дихлорфенил)-2,4-диоксо-1,3Leptmotarsa decemlmeata, Limomus cahfornicus, оксазолидин, 3-[3,5-дихлорфенил-(5-метил-5Lissorhoptrus oryzophilus, Melanotus commums, метоксиметил]-1,3-оксазолидин-2,4-дион, 3-(3,5Mehgethes aeneus, Melolontha hippocastani, дихлорфенил)-1-изопропилкарбамоилгидантоин, Melolontha melolontha, Oulema oryzae, имид |\|-(3,5-дихлорфенил)-1,2Ortiorrhynchus sulcatus, Otiorrhynchus ovatus, диметилциклопропан-1,2-дикарбоновой кислоты, Phaedon cochleanae, Phyllotreta chrysocephala, 2-циано-[1\1-(этиламинокарбонил)-2Phyllophaga sp , Phyllopertha horticola, Phyllotreta метоксимино]ацетамид, 1-[2-(2,4-дихлорфенил)nemorum, Phyllotreta stnolata, Popilha japomca, пентил]-1 Н-1,2,4-триазол, 2,4-дифтор-а-(1 Н-1,2,4Sitona hneatus, Sitophilus granana триазолил-1-метил)бензгидриловый спирт, N-(3хлор-2,6-динитро-4-трифторметилфенил)-5Из отряда двукрылых (Diptera), например трифторметил-З-хлор-2-аминопиридин, 1-((бис(4Aedes aegypti, Aedes vexans, Anastrepha ludens, фторфенил)метилсилил)метил)-1 Н-1,2,4-триазол Anopheles macuhpennis, Ceratitis capitata, Chrysomya bezziana, Chrysomya hommivorax, Соединения формулы I пригодны, кроме того, Chrysoraya macellana, Contarmia sorghicola, для эффективной борьбы против вредителей, Cordylobia anthropophaga, Culex pipiens, Dacus относящихся к классу насекомых, паукообразных cucurbitae, Dacus oleae, Dasmeura brassicae, и нематод В качестве средств борьбы с Fanma camculans, Gasterophilus intestmahs, вредителями они могут применяться для защиты Glossma morsitans, Haematobia irntans, растений, а также в области гигиены, для защиты Haplodiplosis equestns, Hylemyia platura, от амбарных вредителей, для защиты Hypoderma hneata, Linomyza sativae, Linomyza продовольственных запасов и в ветеринарии tnfohi, Luciha caprma, Luciha cuprma, Luciha sencata, К насекомым-вредителям из отряда Lycona pectorahs, Mayetiola destructor, Musca чешуекрылых (Lepidoptera) относятся, например, domestica, Muscma stabulans, Oestrus ovis, Agrotis ypsilon, Agrotis segetum, Alabama argillacea, Oscmella frit, Pegornya hysocyami, Phorbia antiqua, Anticarsia gemmatahs, Argyresthia conjugella, Phorbia brassicae, Phorbia coarctata, Rhagoletis Autographa gamma, Bupalus pimarius, Cacoecia cerasi, Rhagoletis pomonella, Tabanus bovmus, murmana, Capua reticulana, Cheimatobia brumata, Tipula oleracea, Tipula paludosa Chonstoneura f umif erana, Chonstoneura occidentals, Cirphis unipuncta, Cydia pomonella, Из отряда пузыреногих (Thysanoptera), Dendrohmus pim, Diaphania nitidahs, Diatraea например Frankhmella fusca, Frankhniella grandiosella, Eanas msulana, Elasmopalpus occidentals, Frankhmella tntici, Scirtothnps citn, hgnosellus, Eupoeciha ambiguella, Evetna bouhana, Thnps oryzae, Thnps palmi, Thnps tabaci Feltia subterranea, Gallena mellonella, Graphohtha Из отряда перепончатокрылых (Hymenoptera), funebrana, Graphohtha molesta, Hehothis armigera, например Athaha rosae, Atta cephalotes, Atta Hehothis virescens, Hehothis zea, Hellula undahs, sexdens, Atta texana, Hoplocampa mmuta, Hiberma defohana, Hyphantna cunea, Hyponomeuta Hoplocampa testudmea, Monomonum pharaoms, malmellus, Keifena lycopersicella, Lambdma Solenopsis gemmata, Solenolsis mvicta 34 33 55367 Из отрада настоящих полужесткокрылых goodeyi (Heteroptera), например Acrosternum hilare, Bhssus Действующие вещества могут применяться leucopterus, Cyrtopeltis notatus, Dysdercus как таковые, в виде их композиций или в cingulatus, Dysdercus mtermedius, Eurygaster приготовленных из них формах, например в виде mtegnceps, Euschistus impictiventns, Leptoglossus предназначенных для непосредственного phyllopus, Lygus Imeolans, Lygus pratensis, Nezara опрыскивания растворов, порошков, суспензий vindula, Piesma quadrata, Solubea insulans, Thyanta или дисперсий, эмульсий, масляных дисперсий, perditor паст, препаратов для опыливания, препаратов для опудривания, гранулятов, причем обработку Из отряда прямокрылых хоботных проводят различными методами, такими, как (Homoptera), например Acyrthosiphon onobrychis, опрыскивание, мелкокапельное опрыскивание, Adelges lancis, Aphidula nasturtii, Aphis fabae, Aphis опыливание, опудривание или полив Формы pomi, Aphis sambhci, Brachycaudus cardui, применения полностью зависят от целей Brevicoryne brassicae, Cerosipha gossypn, Dreyfusia применения, но во всех случаях должно быть nordmannianae, Dreyfusia piceae, Dysaphis radicola, обеспечено максимально тонкое и равномерное Dysaulacorthum pseudosolani, Empoasca fabae, распределение действующих веществ по Macrosiphum avenae, Macrosiphum euphorbiae, изобретению Macrosiphon rosae, Megoura viciae, Metopolophium dirhodum, Myzodes persicae, Myzus cerasi, Концентрация действующих веществ в Nilaparvata lugens, Pemphigus bursanus, Perkmsiella готовых для применения композициях может sacchancida, Phorodon humuh, Psylla mail, Psylla варьироваться в широких пределах pin, Rhopalomyzus ascalomcus, Rhopalosiphum Как правило, такая концентрация составляет maidis, Sappaphis mala, Sappaphis mail, Schizaphis от 0,0001 до 10%, предпочтительно от 0,01 до 1% graminum, Schizoneura lanugmosa, Tnaleurodes Действующие вещества могут успешно vaporanorum, Viteus vitifoln применяться также в так называемом способе сверхнизких объемов (ULV - Ultra-Low-Volume Из отряда термитов (Isoptera), например безводное опрыскивание средствами защиты Calotermes flavicolhs, Leucotermes flavipes, растений при норме расхода раствора Reticuhtermes lucifugus, Termes natalensis действующих веществ всего лишь 0,1 - 0,6л/га с Из отряда прямокрылых (Orthoptera), помощью сжатого воздуха в качестве например Acheta domestica, Blatta onentahs, диспергатора, обеспечивающем возможность Blattella germanica, Forficula aunculana, Gryllotalpa использования композиций с содержанием gryllotalpa, Locusta migratona, Melanoplus bivittatus, действующего вещества более 95мас % и даже Melanoplus femurrubrum, Melanoplus mexicanus, использования действующего вещества без Melanoplus sanguimpes, Melanoplus spretus, добавок Nomadacns septernfasciata, Penplaneta amencana, Schistocerca amencana, Schistocerca peregnna, Количество действующего вещества, Stauronotus maroccanus, Tachycmes asynamorus применяемое для борьбы с вредителями, составляет в условиях открытого грунта 0,1 Из класса паукообразных (Arachnoidea), таких, 2,0кг/га, предпочтительно 0,2 - 1,0кг/га как клещи (Асаппа), например Amblyomma amencanum, Amblyomma vanegatum, Argas Для приготовления предназначенных для persicus, Boophilus annulatus, Boophilus непосредственного опрыскивания растворов, decoloratus, Boophilus microplus, Brevipalpus эмульсий, паст или масляных дисперсии могут phoemcis, Bryobia praetiosa, Dermacentor silvarum, использоваться фракции нефтяного топлива со Eotetranychus carpmi, Enophyes sheldoni, средней до высокой температурой кипения, Hyalomma truncatum, Ixodes ncmus, Ixodes получаемые при перегонке нефти, такие, как rubicundus, Ormthodorus moubata, Otobius megmni, керосин или дизельное топливо, далее, масла на Paratetranychus pilosus, Dermanyssus galhnae, основе каменноугольной смолы, а также масла Phyllocoptruta oleivora, Polyphagotarsonemus latus, растительного или животного происхождения, Psoroptes ovis, Rhipicephalus appendiculatus, алифатические, циклические и ароматические Rhipicephalus evertsi, Sarcoptes scabiei, углеводороды, как, например, бензол, толуол, Tetranychus cinnabannus, Tetranychus kanzawai, ксилол, парафин, тетрагидронафталин, Tetranychus pacificus, Tetranychus telanus, алкилированные нафталины или их производные, Tetranychus urticae метанол, этанол, пропанол, бутанол, хлороформ, тетрахлорметан, циклогексанол, циклогексанон, Из класса нематод, например нематоды хлорбензол, изофорон, сильно полярные галловые, такие, как Meloidogyne hapla, растворители, такие, как диметилформамид, Meloidogyne incognita, Meloidogyne javamca, д и метил сульфоксид, N-метилпирролидон, вода цистообразующие нематоды, такие, как Globodera rostochiensis, Heterodera avenae, Heterodera Водные формы применения могут glycmes, Heterodera schachtii, Heterodera trifohi, приготавливаться из эмульсионных концентратов, луковый дитиленх и листовые угрицы, такие, как паст или смачивающихся порошков (порошки для Belonolaimus longicaudatus, Ditylenchus destructor, опрыскивания, масляные дисперсии) за счет Ditylenchus dipsaci, Hehocotylenchusmulticinctus, добавок воды Для приготовления эмульсий, паст Longidorus elongatus, Radopholus simihs, или масляных дисперсий действующие вещества Rotylenchus robustus, Tnchodorus pnmitivus, либо в их исходном виде, либо после их Tylenchorhynchus claytom, Tylenchorhynchus растворения в масле или растворителе можно dubius, Pratylenchus neglectus, Pratylenchus гомогенизировать в воде с помощью penetrans, Pratylenchus curvitatus, Pratylenchus смачивателей, прилипателей, диспергаторов или 36 35 55367 эмульгаторов Наряду с этим из действующих ксилола, бмас частей продукта присоединения 8 веществ, смачивателей, прилипателей, 10 молей этиленоксида к 1 молю Nдиспергаторов или эмульгаторов и при моноэтаноламида олеиновой кислоты, 2мас необходимости растворителей или масел могут частей кальциевой соли изготавливаться также соответствующие додецилбензолсульфоновой кислоты и 2мас концентраты, пригодные для разбавления водой частей продукта присоединения 40 молей этиленоксида к 1 молю касторового масла В качестве поверхностно-активных веществ (содержание действующего вещества 9мас %) могут использоваться соли щелочных и щелочноземельных металлов и аммониевые соли IV 20мас частей соединения по изобретению лигнинсульфоновой кислоты, растворяют в смеси, состоящей из бОмас частей циклогексанона, ЗОмас частей изобутанола, 5мас нафталинсульфоновой кислоты, частей продукта присоединения 7 молей фенолсульфоновой кислоты, этиленоксида к 1 молю изооктилфенол а и 5мас дибутил нафталинсульфоновой кислоты, частей продукта присоединения 40 молей алкиларилсульфонаты, алкилсульфаты, этиленоксида к 1 молю касторового масла алкилсульфонаты, сульфаты жирных спиртов и (содержание действующего вещества 16мас %) жирные кислоты, а также их соли щелочных и щелочноземельных металлов, соли V 80мас частей соединения по изобретению тщательно смешивают с Змас частями натриевой сульфатированного гликолевого эфира жирного соли диизобутилнафталин-а-сульфоновой спирта, продукты конденсации сульфированного кислоты, Юмас частями натриевой соли нафталина и производных нафталина с лигнинсульфоновой кислоты из отработанного формальдегидом, продукты конденсации сульфитного щелока и 7мас частями нафталина, соответственно порошкообразного геля кремниевой кислоты, нафталинсульфоновой кислоты с фенолом и после чего измельчают в молотковой мельнице формальдегидом, (содержание действующего вещества 80мас %) полиоксиэтиленоктилфеноловый эфир, этоксилированный изооктилфенол, октилфенол, VI 90мас частей соединения по изобретению нонилфенол, алкилфенолполигликолевый эфир, смешивают с Юмас частями N-метил-атрибутилфенилполигликолевый эфир, пирролидона и получают раствор, пригодный для применения в виде мельчайших капель ал киларил полиэфирные спирты, (содержание действующего вещества 90мас %) изотридециловый спирт, конденсаты жирного спирта и этиленоксида, этоксилированное VII 20мас частей соединения N 11 по касторовое масло, простой изобретению растворяют в смеси, состоящей из 40мас частей циклогексанона, ЗОмас частей полиоксиэтиленалкиловый эфир, изобутанола, 20мас частей продукта этоксилированный полиоксипропилен, ацеталь присоединения 7 молей этиленоксида к 1 молю полигликолевого эфира лаурилового спирта, изооктилфенола и Юмас частей продукта сложные сорбитовые эфиры, отработанный присоединения 40 молей этиленоксида к 1 молю лигнинсульфитныи щелок и метилцеллюлоза касторового масла После сливания и Порошковые препараты, препараты для равномерного распределения раствора в опыливания и распыл ивания могут ЮООООмас частях воды получают водную изготавливаться путем смешения или совместного дисперсию, содержащую 0,02мас % действующего измельчения действующих веществ с твердым вещества, наполнителем Композиции содержат, как правило, от 0,01 до VIII 20мас частей соединения по 95мас %, предпочтительно от 0,1 до 90мас % изобретению тщательно перемешивают с Змас действующего вещества Действующие вещества частями натриевой соли диизобутилнафталин-адолжны иметь при этом степень чистоты от 90 до сульфоновой кислоты, 17мас частями натриевой 100%, предпочтительно 95 - 100% (согласно соли лигнинсульфоновой кислоты из спектру ЯМР) отработанного сульфитного щелока и бОмас частями порошкообразного геля кремниевой Ниже представлены примеры следующих кислоты, после чего измельчают в молотковой композиций мельнице После равномерного распределения I 5мас частей соединения по изобретению смеси в 20000мас частях воды получают раствор тщательно смешивают с 95мас частями для опрыскивания, содержащий 0,1 мае % тонкодисперсного каолина Таким путем получают действующего вещества средство для опыливания, содержащее 5мас % действующего вещества Грануляты, например грануляты в оболочке, II ЗОмас частей соединения по изобретению импрегнированные грануляты и гомогенные тщательно смешивают со смесью, состоящей из грануляты могут быть получены связыванием 92мас частей порошкообразного геля кремниевой действующих веществ с твердыми кислоты и 8мас частей парафинового масла, наполнителями В качестве таких твердых которое напыляют на поверхность этого геля наполнителей могут использоваться, например, кремниевой кислоты Таким путем получают минеральные земли, такие, как силикагель, композицию действующего вещества с хорошей кремниевые кислоты, кизельгуры, силикаты, тальк, адгезионной способностью (содержание каолин, аттаклэй, известняк, известь, мел, болюс, действующего вещества 23мас %) лесс, глина, доломит, диатомовая земля, сульфат кальция, сульфат магния, оксид магния, III Юмас частей соединения по изобретению измельченные синтетические вещества, растворяют в смеси, состоящей из 90мас частей 38 37 55367 удобрения, как, например, сульфат аммония, органическую фазу промывают водой, сушат над фосфат аммония, нитрат аммония, мочевина, и Na2SO4 и концентрируют После растирания растительные продукты, такие, как мука зерновых, остатка с н-гексаном и отсасывания получают 1,8г мука из древесной коры, древесная мука и мука из (63%) указанного в заголовке соединения в виде ореховой скорлупы, целлюлозные порошки и светло-желтых кристаллов с температурой другие твердые наполнители плавления 69 - 72°С 1 К действующим веществам могут добавляться Н-ЯМР (CDCI3) 5 = 1,27 (t, ЗН), 1,96 (s, ЗН), масла различного типа, гербициды, фунгициды, 1,99 (s, ЗН), 3,84 (s, ЗН), 4,04 (s, ЗН), 4,17 (q, 2H), другие средства борьбы с вредителями, 5.06 (s, 2H), 7,17-7,49 (m, 4H) част/млн бактерициды, причем эти добавки при Пример 3 необходимости могут вводиться непосредственно Получение монометиламида (Е,Е,Е)-2перед практическим применением (в емкости для метоксиимино-2-[2'-(1 "-метил, 1 "-(1 '"смешивания) Указанные средства могут этоксииминоэтил))иминооксиметил]фенилуксусно смешиваться со средствами по изобретению в й кислоты массовом соотношении от 1 10 до 10 1 0,90г (2,60 ммоля) метилового эфира (Е,Е,Е)Примеры синтеза 2-метоксиимино-2-[2'-(1 "-метил, 1 "-(1 '"этоксииминоэтил))иминооксиметил]фенилуксусно Описанные в нижеследующих примерах й кислоты растворяют в 50мл тетрагидрофурана, синтеза рекомендации использовались при смешивают с 2,0г 40%-ного водного раствора соответствующей модификации исходных монометиламина и перемешивают в течение 16ч соединений для получения других соединений при комнатной температуре Затем смешивают с формулы I Полученные таким путем соединения водой, экстрагируют с помощью метил-третпредставлены в прилагаемых таблицах I и II с бутилового эфира, органическую фазу промывают указанием физических характеристик водой, сушат над Na2SO4 и центрифугируют В Пример 1 результате получают 0,80г (89%) указанного в Получение метилового эфира (Е,Е)-2заголовке соединения в виде светло-желтого метоксиимино-2-[2'-(1 "-метил, 1"масла ацетил)иминооксиметил]фенилуксусной кислоты 1 К 6,4г (0,21 моля) гидрида натрия (80%-ного) в Н-ЯМР (CDCI3) 5 = 1,28 (t, ЗН), 1,97 (s, ЗН), 150мл сухого диметилформамида в атмосфере 1,99 (s, ЗН), 2,90 (d, ЗН), 3,96 (s, ЗН), 4,18 (q, 2H), защитного газа и небольшого охлаждения при 5.07 (s, 2H), 6,74 (br, 1H), 7,17 - 7,48 (m, 4H) комнатной температуре добавляют 21 г (0,21 моля) част/млн диацетилмоноксима и смесь перемешивают в Пример 4 течение ЗОмин при комнатной температуре Затем Получение 4-гидроксиимино-2,2-диметилпо каплям добавляют раствор из 60г (0,21 моля) пентан-3-она метилового эфира 2-метоксии-мино-2-(2'К 96г (0,84 моля) 2,2-диметил-З-пентанона в бромметил)фенилуксусной кислоты в 360мл 960г толуола по каплям добавляют раствор из 40г диметилформамида и перемешивают в течение хлористого водорода в 156г простого диэтилового 16ч при комнатной температуре После добавки эфира при комнатной температуре После 10%-ной соляной кислоты экстрагируют с охлаждения до - 10°С по каплям добавляют помощью метилтретбутилового эфира раствор из 95г н-бутилнитрита в 470г простого Объединенные органические фазы промывают диэтилового эфира В течение 4ч при повышении водой, сушат над Na2SO4 и концентрируют температуры от -10°С до 0°С оставляют для Остаток суспендируют в слегка холодном перемешивания, после чего дают нагреться до метаноле После отсасывания получают 38г (59%) комнатной температуры В общей сложности указанного в заголовке соединения в виде светлочерез 16ч реакционную смесь трижды промывают коричневых кристаллов с температурой порциями ледяной воды по 1л соответственно, плавления 69 - 71 °С после чего дважды экстрагируют порциями 1М 1 едкого натра по 1л соответственно Щелочную Н-ЯМР (CDCI3) 6 = 1,87 (s, ЗН), 2,30 (s, ЗН), фазу отделяют и нейтрализуют 20%-ной серной 3,85 (s, ЗН), 4,05 (s, ЗН), 5,15 (s, 2H), 7,17 - 7,48 (m, кислотой Сырой продукт отсасывают и после 4Н) част/млн сушки перекристалл изовывают из н-гексана Пример 2 Таким путем получают 66г (55%) указанного в Получение метилового эфира (Е,Е,Е)-2заголовке соединения в виде светло-желтого метоксиимино-2-[2'-(1 "-метил, 1 '-(1 "порошка с температурой плавления 107 - 110°С этоксииминоэтил))иминооксиметил]фенилуксусно 1 й кислоты Н-ЯМР (CDCI3) 5 = 1,29 (s, 9H), 1,99 (s, ЗН), К раствору из 2,5г (8,2 ммолей) метилового 8,30 (s, 1H) част/млн эфира (Е,Е)-2-метоксиимино-2-[2'-(1 "-метил, 1"Пример 5 ацетил)иминооксиметил]фенилуксусной кислоты в Получение метилового эфира (Е)-260мл теплого метанола после охлаждения до метоксиимино-2-[2'-(1 "-метил, 1 "-(1'", 1 '"комнатной температуры добавляют 0,96г (9,8 диметилэтилкарбонил))иминооксиметил]фенилукс ммолей) гидрохлорида о-этилгидроксиламина и усной кислоты 0,6г сухих шариков молекулярного сита ЗА и К 6,4г (0,21 моля) гидрида натрия (80%-ного) в оставляют на 5 дней при комнатной температуре 150мл сухого диметилформамида в атмосфере После отфильтровывания молекулярного сита защитного газа порциями добавляют 25г (0,17 раствор концентрируют, остаток распределяют моля) 4-гидроксиимино-2,2-диметилпентан-3-она, между метил-трет-бутиловым эфиром и водой, при этом реакционная смесь нагревается до 50°С 40 39 55367 В течение ЗОмин дают перемешиваться, после водой, экстрагируют с помощью метил-третчего по каплям добавляют раствор из 50г (0,17 бутилового эфира, органическую фазу промывают моля) метилового эфира 2-метоксиимино-2-(2'водой, сушат над Na2SO4 и центрифугируют В бромметил)фенилуксусной кислоты в 300мл результате получают 2,3г (82%) указанного в диметилформамида и оставляют на 16ч для заголовке соединения в виде бесцветного масла 1 перемешивания при комнатной температуре Н-ЯМР (CDCI3) 5 = 1,08 (s, 9H), 1,26 - 1,41 (т, После добавки 10%-ной соляной кислоты 4Н), 1,53 - 1,67 (т, 4Н), 1,89 (s, ЗН), 2,56 (t, 2H), экстрагируют с помощью метил-трет-бутилового 2,87 (d, ЗН), 3,93 (s, ЗН), 3,99 (t, 2H), 5,02 (s, 2H), эфира Объединенные органические фазы 6,74 (s, шир , 1Н), 7,05 - 7,45 (т, 8Н) част /млн промывают водой, сушат над Na2SO4 и Пример 8 концентрируют Маслянистый остаток черного Получение монометилтиоамида (Е)-2цвета очищают посредством колоночной метоксиимино-2-[2'-(1 "-метил, 1 "-(1 '"хроматографии на силикагеле (метил-третметоксиимино,1'"-парабутиловый эфир/н-гексан) и полученный таким метоксифенил)метил)иминооксиметил]фенилуксу путем сырой продукт суспендируют в ледяном сной кислоты метаноле После отсасывания получают 24г (41%) 1,9г (4,5 ммолей) монометиламида (Е)-2указанного в заголовке соединения в виде почти метоксиимино-2-[2'-(1 "-метил, 1 "-(1 '"бесцветного порошка с температурой плавления метоксиимино,1'"-пара58 - 62°С метоксифенил)метил)иминооксиметил]фенилуксу 1 Н-ЯМР (CDCI3) 5 = 1,19 (s, 9Н), 1,90 (s, ЗН), сной кислоты растворяют в 80мл ксилола, смешивают с 1,8г (4,5 ммолей) реагента 3.83 (s, ЗН), 4,04 (s, ЗН), 5,11 (s, 2H), 7,18-7,45 (m, Лоуессона и перемешивают в течение 45мин при 4Н) част/млн 100°С Пример 6 Получение метилового эфира (Е)-2Затем реакционный раствор концентрируют и остаток очищают посредством хроматографии на метоксиимино-2-[2'-(1 "-метил, 1 "-(1 '"-(6""-(4 колонке хлорфенил)гексилоксиимино),2'",2'"диметилпропил))иминооксиметил ]фенилуксусной Выделением получают 1,5г (75%) указанного в кислоты заголовке соединения в виде смеси изомеров, представляющей собой масло желтоватого цвета К раствору из 3,0г (8,6 ммолей) метилового эфира (Е)-2-метоксиимино-2-[2'-(1 "-метил, 1 "ИК [см 1 ] (пленка) (V'\V"834, 977, 1027, 1065, 1175, 1251, 1358, диметилэтилкарбонил))иминооксиметил]фенилукс 1512, 1608, 2936,3330 усной кислоты в 60мл теплого метанола после Пример 9 охлаждения до комнатной температуры Изомеризация монометиламида (Е)-2добавляют 5,9г (26 ммолей) О-6-(4'метоксиимино-2-[2'-(1 "-метил, 1 "-(1 '"хлорфенил)гексилгидроксиламина, 3,6г сухих (2/Е)метоксиимино,1'"-фенил)метил)-(Е)шариков молекулярного сита (ЗА и 1,6г (8,6 иминооксиметил]фенилуксусной кислоты в ммолей) гидрата пара-толуолсульфоновой монометиламид (Е)-2-метоксиимино-2- [2'-(1"кислоты и нагревают в течение Зч с обратным метил,1"-(1'"-(Е)-метоксиимино,1'"-фенил)метил)холодильником После отфильтровывания (Е)-иминооксиметил]фенилуксусной кислоты молекулярного сита раствор концентрируют, 5г смеси изомеров E,E,E/E,Z,E (30 70) остаток распределяют между метил-третрастворяют в 50мл метанола, смешивают с 15мл бутиловым эфиром и водой, органическую фазу метанола, насыщенного HCI, и оставляют на 18ч промывают водой, сушат над Na2SO4 и при комнатной температуре Затем реакционный концентрируют После колоночной хроматографии раствор сливают на ледяную воду, экстрагируют на силикагеле (гексан/метил-трет-бутиловый дихлорметаном и сушат над Na2SO4 После эфир) получают 3,8г (79%) указанного в заголовке концентрирования в ротационном испарителе соединения в виде светло-желтого масла получают 5г масла (Е,Е,Е E,Z,E, приблизительно 1 65 35) При добавке метанола (2,1 г = 42%) Н-ЯМР (CDCI3) 5 = 1,09 (s, 9H), 1,26 - 1,42 (т, требуемый (Е,Е,Е)-изомер выпадает в виде 4Н), 1,52 - 1,67 (т, 4Н), 1,90 (s, ЗН), 2,57 (t, 2H), твердых бесцветных кристаллов 3.84 (s, ЗН), 3,99 (t, 2H), 4,03 (s, ЗН), 5,02 (s, 2H), 7,07-7,47 (т, 8Н) част/млн t m (Е,Е,Е-изомер) 134-136°С Пример 7 Примечание Фильтрат можно с помощью метанола, насыщенного HCI, повторно Получение монометиламида (Е)-2изомеризовать метоксиимино-2-[2'-(1 "-метил, 1 "-(1 '"(6""-(4 хлорфенил)гексилоксиимино),2'",2'"Примеры по исследованию действия против вредоносных грибов диметилпропил))иминооксиметил]фенилуксусной кислоты Фунгицидное действие соединений общей формулы I было подтверждено в ходе проведения 2,8г (5 ммолей) метилового эфира (Е)-2следующих опытов метоксиимино-2-[2'-(1 "-метил, 1 "-(1 '"-(6""-(4 хлорфенил)гексилоксиимино),2'",2'"Из действующих веществ приготавливали диметилпропил))иминооксиметил]фенилуксусной 20%-ную эмульсию в смеси из 70мас % кислоты растворяют в 10мл тетрагидрофурана, циклогексанона, 20мас % Nekanil® LN (Lutensol® смешивают с 3,9г 40%-ного водного раствора АР6, смачивающий агент с эмульгирующим и монометиламина и перемешивают в течение 16ч диспергирующим действием на основе при комнатной температуре Затем смешивают с этоксилированных алкилфенолов) и Юмас % 55367 42 41 11 111 Emulphor EL (Emulan EL, эмульгатор на основе 197, 1103, 1105, 1106, N12 и II 13 составляло этоксилированных жирных спиртов) и разбавляли 400част/млн и менее водой в соответствии с требуемой концентрацией Nephotettix cmcticeps (зеленая рисовая 1 Erysiphe gramims var tntici цикада), контактное действие Листья проростков пшеницы (сорт "Kanzler") Дисковые фильтры обрабатывали водной обрабатывали сначала водной композицией композицией действующих веществ, после чего в действующих веществ (содержание них помещали 5 взрослых цикад Через 24 часа определяли степень смертности насекомых 250част/млн), Приблизительно через 24ч растения опыляли спорами мучнистой росы В этом опыте пороговое действие соединений пшеницы (Erysiphe graminis var tntici) Затем по изобретению I 02, I 04, 110, 117, I 24, I 29, I 46, обработанные таким путем растения I 47, I 48, I 52, I 55, I 74, I 75, I 78, I 79 и I 92 инкубировали в течение 7 дней при температуре составляло 0,4мг и менее 20 - 22°С и относительной влажности воздуха 75 Prodema htura ("египетский хлопчатый червь"), 80% После этого определяли степень развития контактное действие грибов В фильтры, обработанные водной В этом эксперименте степень поражения композицией действующих веществ, помещали 5 растений, обработанных соединениями по гусениц Первую оценку проводили через 4 часа изобретению, составляла 5% и менее, тогда как Если в живых оставалась по крайней мере одна этот показатель у растений, обработанных гусеница, добавляли кормовую смесь Через 24 известным, действующим веществом (соединение часа выявляли степень смертности N 195, таблица III, Европейский патент ЕР-А В этом опыте пороговое действие соединений 463488), равнялся 25%, а у необработанных по изобретению I 04, 117, I 78, I 79, I 91, I 92, I 94, растений он составлял 70% I 101, I 102, I 103 и I 108 составляло 0,4мг и менее В другом аналогичном эксперименте (на Tetranychus telanus (обыкновенный паутинный проростках пшеницы сорта "Kanzler", клещ), контактное действие применяемое количество 250част/млн), в Горшечные растения фасоли обыкновенной котором растения сначала инфицировали и кустовой после появления второй пары листьев инкубировали, а затем обрабатывали обрабатывали водной композицией действующих действующими веществами, результаты были веществ Через 24 часа растения инфицировали таковы у растений, обработанных соединениями кусочками сильно пораженных листьев Через 12 по изобретению, степень поражения составляла дней в теплице определяли степень поражения 5% и менее, тогда как этот показатель у опытных растений необработанных растений составлял 60% В этом опыте пороговое действие соединений по изобретению 137, 191, 192, 193, 197, 1101, Примеры по исследованию действия против 1102, 1104, 1105, 1106, 1108, N13, II 14 и 1115 вредителей составляло 400част/млн и менее Инсектицидное действие соединений общей формулы I было подтверждено в ходе проведения Ниже приведены дополнительные примеры, следующих опытов подтверждающие действие против Из действующих веществ приготавливали фитопатогенных грибов а) 0,1%-ный раствор в ацетоне или Фунгицидное действие соединений формулы I было подтверждено в ходе проведения б) 10%-ную эмульсию в смеси из 70мас % следующих опытов циклогексанола, 20мас % Nekanil® LN (Lutensol® АР6, смачивающий агент с эмульгирующим и Из действующих веществ приготавливали диспергирующим действием на основе 20%-ную эмульсию в смеси из 70мас % этоксилированных алкилфенолов) и Юмас % циклогексанона, 20мас % Nekaml® (Lutensol® AP6, Cl R Cl R смачивающий агент с эмульгирующим и Emulphor EL (Emulan EL, эмульгатор на основе диспергирующим действием на основе этоксилированных жирных спиртов) и разбавляли этоксилированных алкилфенолов) и Юмас % в случае а) ацетоном, а в случае б) водой до Cl R Cl R требуемой концентрации Emulphor EL (Emulan EL, эмульгатор на основе После завершения опытов выявляли этоксилированных жирных спиртов) и разбавляли соответствующую наименьшую концентрацию, при водой до требуемой концентрации которой соединения по изобретению по Пример по применению 1 сравнению с необработанными контрольными Действие против Erysiphe gramims car tntici опытами все еще проявляли 80 - 100%-ный (мучнистая роса пшеницы) эффект по подавлению, соответственно полному Листья проростков пшеницы (сорт "Kanzler") уничтожению вредителей (пороговое действие, обрабатывали сначала водной композицией соответственно минимальная концентрация) действующих веществ По истечении Aphis fabae (тля свекловичная), контактное приблизительно 24ч растения опыливали спорами действие мучнистой росы пшеницы (Erysiphe gramims car Сильно пораженные растения фасоли tntici) Затем обработанные таким путем растения обыкновенной кустовой (Vicia faba) обрабатывали инкубировали в течение 7 дней при 20 - 22°С и водной композицией действующих веществ Через относительной влажности воздуха 75 - 80%, после 24 часа определяли степень смертности чего выявляли степень развития гриба Растения вредителей обрабатывали 250част/млн действующего В этом опыте пороговое действие соединений вещества по изобретению Результаты по изобретению I 68, I 69, I 70, I 71, I 81, I 86, I 94, представленье в таблице III Степень поражения 44 43 55367 растений, обработанных действующим веществом Действие против Pynculana oryzae по изобретению, составляла 25% и менее, тогда Листья выращенных в горшках проростков как этот показатель на необработанных риса сорта "Tai-Nong 67" обильно, до появления (контрольных) растениях достигал 70% капель, опрыскивали водной композицией действующего вещества, приготовленной из Пример по применению 2 исходного раствора, содержавшего в своем Действие против Puccmia recondita (бурая составе 10% действующего вещества, 63% ржавчина пшеницы) циклогексанона и 27% эмульгатора На Листья сеянцев пшеницы (сорт "Kanzler") следующий день растения инокулировали водной опыливали спорами бурой ржавчины (Puccmia суспензией спор гриба Pynculana oryzae Затем recondita) Обработанные таким путем растения опытные растения на б дней помещали в камеры инкубировали в течение 24ч при 20 - 22°С и с искусственным климатом при температуре 22 относительной влажности воздуха 90 - 95%, а 24°С и относительной влажности воздуха 95 затем их обрабатывали водной композицией 99% Затем визуально определяли степень действующего вещества По истечении развития болезни на листьях Растения последующих 8 дней, в течение которых растения обрабатывали 250част/млн действующего выдерживали при 20 - 22°С и относительной вещества по изобретению Результаты влажности воздуха 65 - 70% выявляли степень представлены в таблице III Степень поражения развития гриба Оценку результатов производили растений, обработанных действующим веществом визуально Растения обрабатывали 250част/млн по изобретению, составляла 25% и менее, тогда действующего вещества по изобретению как этот показатель на необработанных Результаты представлены в таблице III Степень (контрольных) растениях достигал 80% поражения растений, обработанных действующим веществом по изобретению, составляла 15% и Дополнительные примеры получения менее, тогда как этот показатель на соединений формулы I необработанных (контрольных) растениях Пример получения А1 достигал 60% Получение метилового эфира Е-2метоксиимино-2-[(2'Пример по применению 3 фталимидооксиметил)фенил]уксусной кислоты Действие против Plasmopara viticola (мильдью винограда) К раствору из 150г (0,52 моля) метилового эфира Е-2-метоксиимино-2-[(2'Горшечные растения виноградной лозы (сорт "Mueller-Thurgau") обильно, до появления капель, бромметил)фенил]уксусной кислоты и 85г (0,52 опрыскивали композицией действующего моля) N-гидроксифталимида в 250мл Nвещества (норма расхода 250част/млн) По метилпирролидона добавляют по каплям 59г (0,58 истечении 8 дней растения опрыскивали взвесью моля) триэтиламина и перемешивают в течение зооспор гриба Plasmopara viticola и в течение 5 2ч при 70°С Затем реакционную смесь сливают дней выдерживали при 20 - 30°С и при высокой на 2л ледяной воды, выпавшие кристаллы влажности воздуха Перед оценкой результатов отфильтровывают с помощью вакуум-фильтра и растения повторно выдерживали в течение 16ч растворяют их в метиленхлориде После при высокой влажности воздуха Оценку промывки органической фазы водой, сушки над результатов производили визуально Растения сульфатом натрия и удаления обрабатывали 250част/млн действующего центрифугированием растворителя получают 168г вещества по изобретению Результаты (выход 88%) метилового эфира Е-2представлены в таблице III Степень поражения метоксиимино-2-[(2'растений, обработанных действующим веществом фталимидооксиметил)фенил]уксусной кислоты в по изобретению, составляла 25% и менее, тогда виде светло-серого порошка с температурой как этот показатель на необработанных плавления 152 - 153°С (контрольных) растениях достигал 75% 1 Н-ЯМР (CDCI3) 5 = 3,81 (s, ЗН), 3,95 (s, ЗН), Пример по применению 4 5,05 (s, 2H), 7,12-7,81 (m, 8H) част/млн Работали аналогично примеру 1, с тем, Пример получения А2 однако, отличием, что действующее вещество Получение метилового эфира (Е,Е)-2применяли в количестве 16част/млн Степень метоксиимино-2-[2'-[(1 "-метил, 1"поражения растений, обработанных действующим гидроксикарбонил)иминооксиметил]фенил]уксусно веществом по изобретению, составляла 5% и й кислоты менее, тогда как этот показатель на К раствору из ЮОг (0,27 моля) соединения из необработанных (контрольных) растениях примера А1 в 1000мл метанола добавляют 14г достигал 90% (0,28 моля) гидрата гидразина и выдерживают в течение 1ч при комнатной температуре для Пример по применению 5 перемешивания Затем добавляют ЗОг Работали аналогично примеру 3, с тем, молекулярного сита (ЗА и 24г (0,27 моля) однако, отличием, что действующее вещество пировиноградной кислоты и повторно применяли в количестве 16част/млн Степень выдерживают в течение 1ч для перемешивания поражения растений, обработанных действующим Далее реакционную смесь фильтруют и фильтрат веществом по изобретению, составляла 25% и концентрируют Остаток растворяют с помощью менее, тогда как этот показатель на насыщенного раствора ІЧаНСОз и экстрагируют необработанных (контрольных) растениях метиленхлоридом После подкисления водной достигал 70% фазы 2М соляной кислотой повторно экстрагируют Пример по применению 6 46 45 55367 метиленхлоридом, органическую фазу промывают Таким путем получают 5,7г (выход 95%) водой, сушат над сульфатом натрия и соединения, указанного в заголовке 1 концентрируют Таким путем получают 71 г (выход Н-ЯМР (CDCI3) 5 = 1,21 (t, ЗН), 1,97 (s, ЗН), 86%) соединения, указанного в заголовке 2,90 (d, ЗН), 3,87 (s, ЗН), 3,94 (s, ЗН), 4,09 (q, 2H), { 5,10 (s, 2Н), 6,77 (s, шир , 1Н), 7,17 - 7,45 (m, 4H) Н-ЯМР (CDCL3) 5 = 2,20 (s, ЗН), 3,87 (s, ЗН), част/млн 4,04 (s, ЗН), 5,13 (s, 2H), 7,15 - 7,46 (m, 4H), 8,80 (s, шир , 1Н) част/млн Пример получения А6 Пример получения A3 Получение N-метоксиамида 2,2-диэтоксипропановой кислоты Получение метилового эфира (Е,Е)-2метоксиимино-2-[2'-[(1 "-метил, 1"К смеси из 250г (2,84 моля) пировиноградной метоксиаминокарбонил)иминооксиметил]фенил]ук кислоты и 1,15л триэтилортоформиата при сусной кислоты охлаждении льдом добавляли по каплям 1 мл концентрированной H2SO4 и перемешивали в К раствору из 71 г (0,23 моля) соединения из течение 1ч при 5 - 10°С Затем порциями примера А2 в 1000мл тетрагидрофурана добавляли в общей сложности 475г (2,84 моля) добавляют 37г (0,23 моля) карбонидциимидазола карбонилдиимидазола По завершении По завершении процесса газообразования газообразования смешивали с 365г (4,26 моля) смешивают порциями с 38г (0,46 моля) гидрохлорида метоксиамина и выдерживали в гидрохлорида метоксиамина и выдерживают в течение Зч при комнатной температуре для течение 16ч при комнатной температуре для перемешивания Осадок отделяли, фильтрат перемешивания Затем концентрируют, остаток концентрировали и избыточный растворяют с помощью метиленхлорида и органическую фазу сначала экстрагируют триэтилортоформиат удаляли под вакуумом, насыщенным раствором ЫаНСОз После создаваемым масляным насосом Остаток промывки органической фазы 2М соляной растворяли с помощью воды и экстрагировали кислотой и водой сушат над сульфатом натрия и метиленхлоридом, органическую фазу концентрируют Таким путем получают 72,5г промывали, сушили и концентрировали Таким (выход 94%) указанного в заголовке соединения в путем получили указанное в заголовке соединение виде белого порошка с температурой плавления в виде коричневого масла, которое без 105-108°С дальнейшей очистки использовали в 1 последующем процессе Н-ЯМР (CDCI3)5 = 2,00 (s, ЗН), 3,77 (s, ЗН), 1 3,88 (s, ЗН), 4,03 (s, ЗН), 5,00 (s, 2H), 7,13 - 7,42 (ш, Н-ЯМР (CDCI3) 5 = 1,22 (t, 6H), 1,52 (s, ЗН), 4Н), 9,19 (s, 1H) част/млн 3,43 - 3,59 (m, 4Н), 3,80 (s, ЗН), 9,28 (s, шир , 1Н), 7,17-7,45 (т, 4Н) част/млн Пример получения А4 Получение метилового эфира (Z,E,E)-2Пример получения А7 метоксиимино-2-[2'-[[1 "-метил, 1 "-(1 '"-этокси,1 '"Получение изопропилового эфира (Z)-Nметоксииминометил)]иминооксиметил]фени метокси-2,2-диэтоксипропаниминокислоты л]уксусной кислоты К смеси из 588г (4,26 моля) карбоната калия в 1л диметилформамида добавляли по каплям 700г К смеси из Юг (30 ммолей) соединения из (5,69 молей) 2-бромпропана и выдерживали в примера A3 и 8,2г (60 ммолей) карбоната калия в течение 12ч при 70°С для перемешивания После 500мл диметилформамида добавляют по каплям отделения осадка фильтрат сливали на воду, 6,6г (60 ммолей) этилбромида и выдерживают в экстрагировали метил-трет-бутиловым эфиром, течение 60ч при комнатной температуре для органическую фазу промывали, сушили и перемешивания Затем реакционную смесь концентрировали Таким путем получили 383г сливают на воду и экстрагируют метил-третуказанного в заголовке соединения в виде бутиловым эфиром Объединенные органические коричневого масла, которое согласно 1Н-ЯМР фазы промывают водой, сушат над сульфатом имеет чистоту порядка 80% натрия и концентрируют После колоночной 1 хроматографии на силикагеле (метил-третН-ЯМР (CDCI3) 5 = 1,20 (t, 6H), 1,27 (d, 6H), бутиловый эфир/гексан) получают 6,0г (выход 1,51 (s, ЗН), 3,47 - 3,64 (m, 4H), 3,80 (s, ЗН), 5,18 55%) соединения, указанного в заголовке (sep, 1H) част/млн { Н-ЯМР (CDCI3) 5 = 1,22 (t, ЗН), 1,99 (s, ЗН), Пример применения А8 3,86 (s, ЗН), 3,88 (s, ЗН), 4,04 (s, ЗН), 4,11 (q, 2H), Получение изопропилового эфира (Е)-25,10 (s, 2H), 7,16-7,48 (m, 4H) част/млн гидроксиимино, (Z)-NПример получения А5 метоксипропаниминокислоты Получение метиламида (Z,E,E)-2К раствору из 383г соединения из примера А7 метоксиимино-2-[2'-[[1 "-метил, 1 "-(1 '"-этокси,1 '"в смеси из 1л метанола, 300мл воды и 134г (1,70 метоксииминометил)]иминооксиметил]фенил]уксу моля) пиридина добавляли порциями 137г (1,97 сной кислоты моля) гидрохлорида метоксиамина и выдерживали для перемешивания сначала в 6,0г (16 ммолей) соединения из примера А4 течение 16ч при комнатной температуре, а затем растворяют в 100мл тетрагидрофурана, в течение 1ч при 60°С После этого реакционную смешивают с 20мл 40%-ного водного раствора смесь сливали на разбавленную соляную кислоту монометиламина и перемешивают в течение 16ч и экстрагировали метил-трет-бутиловым эфиром при комнатной температуре Затем смешивают с Затем органическую фазу экстрагировали 10%водой, экстрагируют метил-трет-бутиловым ным едким натром, а водную фазу подкисляли эфиром и органическую фазу промывают водой, разбавленной соляной кислотой и экстрагировали сушат над сульфатом натрия и центрифугируют 48 47 55367 метил-трет-бутиловым эфиром Эфирную фазу метоксииминометил)]иминооксиметил]фенил]уксу промывали водой, сушили и концентрировали сной кислоты После колоночной хроматографии на силикагеле Раствор из 8г (20 ммолей) соединения из (метил-трет-бутиловый эфир/н-гексан) получили примера А10 в 200мл тетрагидрофурана 96г указанного в заголовке соединения в виде смешивали с 50мл раствора метиламина (40%масла светло-желтого цвета ного в воде) По истечении 20мин при комнатной 1 температуре (приблизительно 25°С) реакционную Н-ЯМР (CDCI3) 6 = 1,27 (d, 6Н), 2,06 (s, ЗН), смесь сливали в охлажденную 2н соляную 3,88 (s, ЗН), 4,96 (sep, 1H), 10,36 (s, шир, 1Н) кислоту Продукт экстрагировали из полученной част/млн таким путем смеси трет-бутилметиловым эфиром Пример получения А9 Из эфирной фазы после обычной переработки Получение метилового эфира (Z,E,E)-3получили 7,7г (выход 96%) указанного в заголовке метокси-2-[2'-[[1 "-метил, 1"-изопропокси,1'"соединения в виде бесцветного порошка с метоксииминометил)]иминооксиметил]фенил]акри температурой, плавления 135 - 137°С ловой кислоты 1 К 0,45г (14,5 ммолей) гидрида натрия (80%Н-ЯМР (5 в част/млн, CDCI3) 2,09 (s, ЗН), ного) в 50мл диметилформамида добавляли 2,88 (d, ЗН), 3,94 (s, ЗН), 4,08 (s, ЗН), 5,15 (s, 2H), порциями 2,3г (13,2 ммолей) соединения из 6,74 (s, шир, 1Н), 7,15-7,51 (m, 4H) част/млн примера А8, растворенных в 50мл Пример получения А12 диметилформамида, и выдерживали в течение Получение N-метиламида (Z,E,E)-2ЗОмин для перемешивания Затем по каплям метоксиимино-2-[2'-[1 "-метил, 1"-(1 "-третдобавляли раствор из 3,75г (13,2 ммолей) бутилтио,1'"метилового эфира (Е)-3-метокси-2-[(2'метоксииминометил)]иминооксиметил]фенил]уксу бромметил)фенил]акриловой кислоты в 50мл сной кислоты диметилформамида и перемешивали в течение К раствору из 1,5г (3,8 ммоля) соединения из 16ч при комнатной температуре Реакционную примера А11 в 50мл диметилформамида смесь сливали на воду и экстрагировали метилдобавляли 0,47г (4,2 ммоля) 2-метил-2трет-бутиловым эфиром Органическую фазу пропантиолята натрия и выдерживали в течение промывали, сушили и концентрировали После 16ч при комнатной температуре для колоночной хроматографии на силикагеле (метилперемешивания После повторного добавления трет-бути-ловый эфир/н-гексан) получили 1,4г 0,47г (4,2 ммоля) 2-метил-2-пропантиолята натрия указанного в заголовке соединения в виде и 16-часового перемешивания реакционную смесь бесцветного масла сливали на воду, экстрагировали метил1 третбутиловым эфиром и по обычной технологии Н-ЯМР (CDCI3)5 = 1,22 (d, 6H), 2,01 (s, ЗН), перерабатывали Таким путем получили 1,4г 3,67 (s, ЗН), 3,81 (s, ЗН), 3,87 (s, ЗН), 4,63 (sep, указанного в заголовке соединения в виде желтого 1Н), 5,13 (s, 2H), 7,11 - 7,47 (m, 4H), 7,57 (s, 1H) масла част/млн 1 Пример получения А10 Н-ЯМР (CDCI3) 5 = 1,30 (s, 9H), 2,07 (s, ЗН), 2,88 (d, ЗН), 3,93 (s, ЗН), 4,02 (s, ЗН), 5,11 (s, 2H), Получение метилового эфира (Z,E,E)-26,74 (s, шир, 1Н), 7,13-7,47 (m, 4H) част/млн метоксиимино-2-[2'-[[1 "-метил, 1 "-(1 '"-бром,1 '"метоксиимннометил)]иминооксиметил]фенил]уксу Пример В1 сной кислоты Смесь из 50г (0,15 моля) соединения из примера A3 и 117г (0,45 моля) трифенилфосфина в 1000мл ацетонитрила смешивали порциями со 148г (0,45 моля) тетрабромметана Полученную таким путем смесь нагревали с обратным холодильником в течение 100ч, после чего Раствор из 50г (0,49 моля) 2-оксобутановой охлаждали до комнатной температуры (=25°С) кислоты в 300мл метанола смешивали порциями Затем из реакционной смеси удаляли твердые со 123г (1,47 моля) гидрохлорида метоксиамина вещества Из фильтрата отгоняли при После перемешивания в течение 16ч при пониженном давлении растворитель и комнатной температуре (приблизительно 25°С) из образовавшийся в результате остаток очищали реакционной смеси при пониженном давлении посредством хроматографии на колонке удаляли растворитель Образовавшийся в (силикагель, трет-бутилметиловый эфир/гексан) С результате остаток растворяли с помощью воды и целью трет-бутил-етилового эфира Эфирную фазу промывали насыщенным раствором ЫаНСОз и дальнейшей очистки продукт перекристалливодой, сушили над Na2SO4 и затем зовывали (метиленхлорид/гексан) Таким путем концентрировали при пониженном давлении получили 34г (выход 58%) указанного в заголовке Таким путем получили 47г указанного выше соединения в виде бесцветного порошка с соединения в виде бесцветной жидкости температурой плавления 103 - 105°С 1 1 Н-ЯМР (CDCI3, 5 в част/млн) 1,06 (t, ЗН), Н-ЯМР (5 в част/млн, CDCI3) 2,10 (s, ЗН), 2,57 (q, 2H), 3,85 (s, ЗН), 4,04 (s, ЗН) 3,86 (s, ЗН), 4,05 (s, ЗН), 4,10 (s, ЗН), 5,16 (s, 2H), Пример В2 7,16-7,51 (m, 4H) част/млн Пример получения А11 Получение N-метиламида (Z,E,E)-2метоксиимино-2-[2'-[[1 "-метил, 1 "-(1 '"-бром, 1 '" 49 55367 50 Н-ЯМР (CDCI3l 5 в част/млн) 1,03 (t, ЗН), 2,51 (q, 2H), 3,87 (s, 6H), 4,03 (s, ЗН), 4,86 (s, 2H), 7,14-7,45 (ш, 4Н), 8,92 (s, 1H) Пример В4 1 С1 Раствор из ЗЗг (0,48 моля) гидрохлорида гидроксиламина и 400мл метанола по каплям смешивали при 10°С с 46г (0,32 моля) соединения из примера 1, стадия 1 Затем к полученной таким путем смеси при охлаждении льдом добавляли в течение 15мин 171 г раствора метилата натрия (30%-ного в метаноле, 0,96 моля) Далее реакционную смесь перемешивали в течение 60ч при комнатной температуре (приблизительно 25°С) и при этом образовывалась суспензия Эту суспензию сливали в воду и полученную таким путем смесь при охлаждении льдом подкисляли концентрированной соляной кислотой до значения рН 6,5, после чего несколько раз экстрагировали метиленхлоридом Органические фазы объединяли, промывали водой, сушили над Na2SO4 и при пониженном давлении и 30°С удаляли из них растворитель Таким путем получили 34,1г указанного выше соединения в виде белого порошка с температурой плавления 56 - 59°С Следует иметь в виду, что гидроксамовые кислоты типа соединения согласно примеру 1, стадия 2, могут быть термически нестойкими и разлагаться при повышенных температурах взрывообразно 1 Н-ЯМР (CDCI3, 5 в част/млн) 1,03 (t, ЗН), 2,53 (q, 2Н), 3,93 (s, ЗН), 8,95 (s, шир , 2Н) Пример ВЗ Раствор из 28,5г (0,195 моля) соединения из примера 1, стадия 2, 55,8г (0,195 моля) метилового эфира Е-2-метоксиимино-2-[2'бромметилфенил]уксусной кислоты (согласно ЕРА 400417) и 600мл N.N-диметилформамида при охлаждении льдом смешивали по каплям с 38,6г раствора метилата натрия (30%-ного в метаноле, 0,215 моля) После перемешивания в течение 16ч при комнатной температуре (приблизительно 25°С) реакционную смесь смешивали с охлажденной разбавленной соляной кислотой и полученную таким путем смесь экстрагировали трет-бутил метиловым эфиром Органическую фазу промывали водой, сушили над Na2SO4 и при пониженном давлении и температуре порядка 35°С из нее удаляли растворитель Образовавшийся остаток очищали посредством хроматографии (силикагель, элюент третбутиловый эфир/циклогексан), После промывки выделенного твердого вещества пентаном получили 50г указанного выше соединения в виде светло-желтого порошка с температурой плавления 63 - 65°С Смесь из 6,0г (17,1 ммолей) соединения из примера 1, стадия 3, 22,4г (85,5 ммолей) трифенилфосфина и 250мл ацетонитрила смешивали порциями с 13,2г (85,5 ммолей) тетрахлорметана Полученную таким путем реакционную смесь кипятили в течение 60ч с обратным холодильником, после чего охлаждали до комнатной температуры (приблизительно 25°С) Затем при пониженном давлении отгоняли растворитель и образовавшийся остаток очищали посредством хроматографии (силикагель, третбутиловый эфир/циклогексан) Таким путем получили 2,3г указанного выше соединения в виде окрашенного в бежевый цвет порошка с температурой плавления 56 - 59°С 1 Н-ЯМР (CDCI3, 5 в част/млн) 0,97 (t, ЗН), 2,55 (q, 2H), 3,85 (s, ЗН), 3,99 (s, ЗН), 4,04 (s, ЗН), 5,13 (s, 2H), 7,15-7,50 (m, 4H) Пример В5 Раствор из 15,5г (42 ммоля) соединения из примера 1, стадия 4, и 100мл тетрагидрофурана смешивали с ЗЗг раствора метиламина (40%-ного в воде) По истечении 2ч при комнатной температуре (приблизительно 25°С) реакционную смесь сливали в охлажденную разбавленную соляную кислоту Этот кислый раствор экстрагировали трет-бутил метиловым эфиром Затем органическую фазу промывали водой, сушили над Na2SO4 и при пониженном давлении из нее удаляли растворитель После растирания остатка с гексаномл'рет-бутилметиловым эфиром получили 11,5г указанного выше соединения в виде окрашенного в бежевый цвет порошка с температурой плавления 66 - 69°С 1 Н-ЯМР (CDCI3, 5 в част/млн) 0,97 (t, ЗН), 2,54 (q, 2H), 2,85 (d, ЗН), 3,91 (s, ЗН), 3,97 (s, ЗН), 5,15 (s, 2H), 6,80 (s, шир, 1Н), 7,18 - 7,43 (m, 4H) Пример В6 55367 Раствор из 388г (4,65 моля) гидрохлорида метоксиамина и 1,5л метанола смешивали сначала с 60г молекулярного сита (ЗА), а затем при 60°С с 254г (1,55 моля) метилового эфира фенилглиоксиловой кислоты По истечении 6ч при 60°С и последующих 60ч при комнатной температуре (приблизительно 25°С) реакционную смесь смешивали с водой Этот водный раствор экстрагировали трет-бутил метиловым эфиром Эфирную фазу промывали водой, сушили над Na2SO4 и при пониженном давлении удаляли из нее растворитель Остаток очищали посредством хроматографии (силикагель, трет-бутилметиловый эфир/циклогексан) Таким путем получили 66г указанного выше соединения в виде светложелтого порошка 1 Н-ЯМР (CDCI3l 5 в част/млн) 3,88 (s, ЗН), 4,07 (s, 3H), 7,40 (s, 5H) Пример В7 Раствор из 20г (0,1 моля) соединения из примера 3, стадия 2, 27г (0,1 моля) метилового эфира Е-3-метил-2-[2'бромметилфенил]акриловой кислоты (согласно ЕР-А 513580) и 300мл N.N-диметилформамида при охлаждении льдом смешивали по каплям с 18г раствора метилата натрия (30%-ного в метаноле, 0,1 моля) После перемешивания в течение 12ч при комнатной температуре (приблизительно 25°С) реакционную смесь смешивали с ледяной водой и полученную таким путем смесь экстрагировали метиленхлоридом Органическую фазу промывали водой, сушили над Na2SO4 и при пониженном давлении и температуре приблизительно 35°С из нее удаляли растворитель Образовавшийся остаток кристаллизовали из трет-бутил метилового эфира/гексана/изопропанола Таким путем получили 23,8г указанного выше соединения в виде бесцветных кристаллов с температурой плавления 81 - 84°С 1 Н-ЯМР (CDCI3, 5 в част/млн) 1,63 (d, ЗН), 3,70 (s, ЗН), 3,92 (s, ЗН), 4,83 -4,92 (m, 2H), 7,08 7,53 ( т , ЮН), 9,07 (s, шир, 1Н) Пример В9 Раствор из 58,2г (1,04 моля) гидроксида калия в 750мл метанола смешивали по каплям с раствором из 36,1 г (0,52 моля) гидрохлорида гидроксиламина в 250мл метанола По истечении приблизительно Юмин образовавшийся осадок отфильтровывали и полученный раствор смешивали с другим раствором из 100г соединения из примера 3, стадия 1, в 500мл метанола, По истечении 24ч при комнатной температуре (приблизительно 25°С) реакционную смесь сливали на воду и экстрагировали третбутил метиловым эфиром Водную фазу при охлаждении льдом подкисляли разбавленной соляной кислотой до значения рН 6,5 и при этом образовывался осадок Таким путем получили 57г указанного выше соединения в виде окрашенного в бежевый цвет порошка с температурой плавления 142 - 144°С 1 Н-ЯМР (CDCI3l 5 в част/млн) 3,89 (s, ЗН), 7,33 - 7,55 (m, 5H), 9,20 (s, шир, 1Н), 11,14 (s, шир , 1Н) Пример В8 Смесь из 4,8г (12,6 ммолей) соединения из примера 3, стадия 3,1 Ог (38 ммолей) трифенилфосфина и 100мл ацетонитрила смешивали порциями с 12,6г (38 ммолей) тетрабромметана Полученную таким путем реакционную смесь кипятили в течение 100ч с обратным холодильником, после чего охлаждали до комнатной температуры (приблизительно 25°С) Растворитель отгоняли при пониженном давлении и образовавшийся остаток очищали посредством хроматографии (силикагель, третбутилметиловый эфир/циклогексан) Таким путем получили 2,4г указанного выше в заголовке соединения в виде бесцветного порошка с температурой плавления 60 - 61 °С 1 Н-ЯМР (CDCI3, 5 в част/млн) 1,54 (d, ЗН), 3,66 (s, ЗН), 3,99 (s, ЗН), 5,02 (s, 2H), 7,01-7,38 ( т , ЮН) Ниже приведены схемы реакций, иллюстрирующие вышеприведенные примеры Схемы синтеза соединений формулы I, где R4 представляет собой органический остаток аналогично вариантам синтеза 1 3 53 55367 Пример А2 Схема синтеза 1 4 Соединение па примеру А1 1) N -№ H г з Пример 2 С1 Соединение по примеру 1 + C2H5O-NH3 Пример 3 Соединение П примеру 2 + CH3NH2 О С Н Пример A3 Схема синтеза 1 4 Соединение по примеру А2 + CH2O-NH3 С1 Пример 5 - аналогично примеру 1 Пример АЮ Схема синтеза 2 о у? Соединение по примеру 4 Соединение по примеру A3 /\ Пример 6 - аналогично примеру 2 Пример 7 - аналогично примеру 3 Схема синтеза соединений формулы І, в которых R4 является либо галогеном либо группой, присоединенной через гетероатом Пример А1 Схема синтеза 1 4 Пример А11 - аналогично примеру 3 Пример А12 Схема синтеза 3 55 55367 56 С1 Соединение по примеру 10 Пример 5- аналогично примеру 3 Схемы синтеза соединений формулы которых R3 представляет собой атом галогена Пример В1 Схема синтеза 1 Пример В2 Схема синтеза 1 Соединение по примеру В1 Пример ВЗ Схема синтеза 2 Соединение по примеру В2 8г\ Пример В4 Схема синтеза 2 О Н Соединение по примеру 03 55367 55367
ДивитисяДодаткова інформація
Назва патенту англійськоюPhenylacetic acid derivatives and a remedy against insects and spidery and harmful fungi
Автори англійськоюMueller Ruth, Grammenos Vassilios, Harreus Albrecht, Roehl Franz, Ammermann Eberhard
Назва патенту російськоюПроизводные фенилуксусной кислоты и средство борьбы с насекомыми и паукообразными и вредоносными грибами
Автори російськоюМюллер Рут, Грамменос Вассилиос, Харреус Альбрехт, Рель Франц, Аммерманн Эберхард
МПК / Мітки
МПК: C07D 239/46, C07C 251/38, A01P 3/00, A01N 37/50, A01P 7/00, C07C 251/40, C07C 251/54, C07D 213/62, C07C 251/58
Мітки: комах, боротьби, фенілоцтової, павукоподібних, кислоти, грибів, засіб, шкідливих, похідні
Код посилання
<a href="https://ua.patents.su/43-55367-pokhidni-feniloctovo-kisloti-i-zasib-borotbi-proti-komakh-i-pavukopodibnikh-ta-shkidlivikh-gribiv.html" target="_blank" rel="follow" title="База патентів України">Похідні фенілоцтової кислоти і засіб боротьби проти комах і павукоподібних та шкідливих грибів</a>
Попередній патент: Затвор для закупорки скляних банок
Наступний патент: Боросилікатне скло з високою хімічною стійкістю та низькою в’язкістю, яке містить оксид цирконію та оксид літію
Випадковий патент: Полімеркомпозитне зносостійке покриття