Похідні 2-(2,6-дигалофеніламіно) фенілоцтової кислоти і спосіб їх одержання
Формула / Реферат
1. Производные 2-(2,6-дигалофениламино) фенилуксусной кислоты общей формулы I
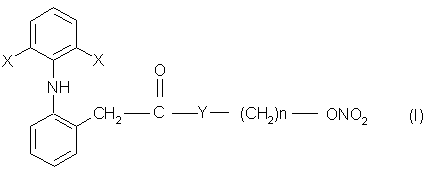
в которой Х представляет собой галоген, выбранный из хлора или брома, Y выбран из кислорода, NH, NR1, где R1 представляет собой линейную или разветвленную алкильную группу, а n представляет собой целое число от 1 до 10.
2. Производное 2-(2,6-дигалофениламино)фенилуксусной кислоты формулы I по п, 1, в которой Х представляет собой хлор, Y означает кислород, а n равно 4.
3. Производное 2-(2,6-дигалофениламино)фенилуксусной кислоты формулы I по п. 1, в которой Х представляет собой хлор, Y означает кислород, а n равно 2.
4. Производное 2-(2,6-дигалофениламино)фенилуксусной кислоты формулы I по п. 1, в которой Х представляет собой хлор, Y означает NH, а n равно 4.
5. Производные 2-(2,6-дигалофениламино)фенилуксусной кислоты формулы I по п. 1, обладающие противовоспалительным и анальгетическим действием.
6. Производные 2-(2,6-дигалофениламино)фенилуксусной кислоты формулы I по п. 1, обладающие иммунологическим и иммуногенным действием.
7. Производные 2-(2,6-дигалофениламино)фенилуксусной кислоты формулы I по п. 1, обладающие противоишемическим и антитромботическим действием.
8. Способ получения производных 2-(2,6-дигалофениламино)-фенилуксусной кислоты общей формулы I по п. 1, отличающийся тем, что функциональное производное 2-(2,6-дигалофениламино)фенилуксусной кислоты, выбранное из группы, включающей амид, ангидрид, сложный эфир или галоидангидрид, или натриевую соль 2-(2,6-дигалофениламино)-фенилуксусной кислоты, подвергают взаимодействию с соединением формулы
R4-(CH2)n-R3
где R4 означает хлор, бром, NHR, R означает водород или линейный, или разветвленный С6-С6алкил, R3 означает хлор, бром, йод или ОН, n = 1-10, и полученный продукт обрабатывают нитрующим агентом, таким как нитрат серебра, или, в случае, когда R3 означает ОН, его предварительно подвергают взаимодействию с галогенирующим соединением, таким как трехбромистый фосфор, с последующей обработкой нитратом серебра.
Текст
1. Производные 2-(2,6-дигалофениламино) фенилуксусной кислоты общей формулы I C2 (54) ПОХІДНІ 2-(2,6-ДИГАЛОФЕНІЛАМІНО) ФЕНІЛОЦТОВОЇ КИСЛОТИ І СПОСІБ ЇХ ОДЕРЖАННЯ 39172 Спектр фармакологического действия и эффективность натриевой соли 2-(2,6-дихлорофениламино)фенилуксусной кислоты описываются в Am.J.Med.80, Suppl. 4B, 1–87 (1986), в то время как другие данные, касающиеся фармакологического действия как противовоспалительного средства приводятся, например, в С.А.74, 86215 m (1971); Krupp et al. Experimentia 29, 450 (1973). Использование 2-(2,6-дихлорофениламино)фенилуксусной кислоты как противовоспалительного препарата, как известно, вызывает очень сильные обратные реакции, например, нежелательные эффекты в кишечно-желудочном тракте, а также повреждения печени и почек. Проведено множество экспериментов [S.Moncada, R.M.J.Palmer, E.A.Higgs, Pharmacological Reviews, 43(2), 109–142 (1991); Т.F.Lusher, C.M.Boulanger, Y.Dohi, Z.Yang, Hypertension, 19, 117–130 (1992)], на основании которых можно утверждать, что целостность сосудистого эндотелия действует как наиболее важный защитный барьер, позволяющий не допустить начала патологических реакций в различных органах и системах. Такой защитный барьер и, следовательно, целостность сосудистого эндотелия в физиологическом плане гарантируется присутствием азотной кислоты и простациклином. Лечение лекарствами, обладающими противовоспалительным действием, такими как, например, натриевая соль 2-(2,6-дихлорофениламино)фенилуксусной кислоты, вызывает ингибирование цикло-оксигеназы, фермента, который определяет синтез предшественника простациклина. Вследствие этого, при ингибировании таким путем простациклина клеточный резерв его значительно истощается, что вызывает опасность для сосудистого эндотелия. Как уже говорилось, ввиду указанного эндотелиального повреждения за счет истощения простациклина, диффузионные патологические реакции проявляются с большой силой, что оказывает воздействие на желудочно-кишечный тракт, печень и почки. Объектом данного изобретения является продукт, который, обеспечивая неизменность характеристик фармакологического действия известных противовоспалительных препаратов, может устранять также нежелательные реакции, вызванные лечением данными препаратами. Другим объектом данного изобретения является осуществление способа получения производных 2-(2,6-дигалофениламино)фенилуксусной кислоты, обладающих противовоспалительным действием и которые лишены тех нежелательных реакций, которые типичны для противовоспалительных лекарств. Эти и другие объекты и преимущества, которые даны в нижеследующем описании, достигаются благодаря производным 2-(2,6-дигалофениламино)фенилукусной кислоты, которые согласно настоящему изобретению имеют следующую общую формулу X X O NH CH2 C Y (CH2)n ONO2 (І) в которой: X представляет собой галоген, выбранный из числа хлора и брома, Y выбран из числа кислорода, NH, NR1, где R1 представляет собой линейную или разветвленную группу алкила, и n является числом от 1 до 10. Фактически установлено, что ввод такой группы, как концевая группа сложного эфира азотной кислоты в производные 2-(2,6-дигалофениламино)фенилуксусной кислоты как в (I) позволяет сохранить фармакологическое действие противовоспалительных лекарств, с одновременным устранением нежелательных реакций, вызванных лечением указанными лекарственными препаратами. Было отмечено, что соединения (I) могут найти полезное применение для лечения различных заболеваний, таких как ревматические заболевания, иммунологические нарушения, и могут также облегчить болевые ощущения низкой-средней силы любого типа. Кроме того, соединения (I), составляющие объект данного изобретения, находят полезное применение для лечения заболеваний сердечно-сосудистой системы и мозговой ишемии, а также для лечения артериального тромбоза. Согласно данному изобретению, особенно большую ценность имеет сложный эфир азотной кислоты производного 2-(2,6-дигалофениламино)фенилуксусной кислоты (I), в котором: X представляет собой хлор, Y представляет собой кислород и n равно 4, отвечающий следующей формуле: Cl Cl O NH CH2 C O (CH2)4 ONO2 (ІІ) Кроме того, особенно желательным соединением согласно настоящему изобретению является сложный эфир азотной кислоты производного 2-(2,6-дигалофениламино)фенилуксусной кислоты (I), в котором: X представляет собой хлор, Y представляет собой кислород, и n равно 2, который отвечает следующей формуле: 2 39172 Cl Cl чается мономерный сложный эфир или амид, отличающийся присутствием концевой галогеновой группы; – Реакцию указанного мономерного сложного эфира или амида, отличающегося присутствием концевой галогеновой группы, с нитратирующим агентом, таким как AgNO3 и другие аналогичные соединения, в результате чего получаются сложные эфиры азотной кислоты производных 2-(2,6-дигалофениламино)фенилуксусной кислоты (I). Растворители, используемые при осуществлении способа данного изобретения, выбраны предпочтительно из числа хлороформа, метиленхлорида, ацетонитрила, диметилформамида, тетрагидрофурана, диоксана и т.д. Такие способы получения производных 2(2,6-дигалофениламино)фенилуксусной кислоты (I), отвечающей данному изобретению, состоят из ограниченного числа фаз, позволяющих получить продукты при осуществлении такого процесса, с высокой скоростью, с удовлетворительными выходами и в больших количествах, даже в промышленных масштабах. Согласно способу данного изобретения особенно успешно осуществляется получение сложных эфиров азотной кислоты производных 2-(2,6дихлорофениламино)фенилуксусной кислоты, имеющих следующие формулы: O NH CH2 C O (CH2)2 ONO2 (ІІІ) Для получения производных (I) 2-(2,6-дигалофениламино)фенилуксусной кислоты, представляющей объект данного изобретения, наиболее предпочтителен первый способ, который, согласно настоящему изобретению, включает следующие фазы: – Реакцию между натриевой солью 2-(2,6дигалофениламино)фенилуксусной кислоты или 2(2,6-дигалофениламино)фенилуксусной кислоты с функциональной группой карбоновой кислоты, и соединением, имеющим следующую общую формулу: R4–(CH2)n–R3 (IV) в которой: R4 выбран из числа хлора, брома, NHR, где R представляет собой водород или линейную или разветвленную алкильную цепь, R3 выбран из числа хлора, брома и йода, и n составляет от 1 до 10, карбоксильная группа 2(2,6-дигалофениламино)фенилуксусной кислоты функционализирована как ациловый хлорид, ангидрид и т.д., в результате чего получается соответствующий мономерный сложный эфир или соответствующий амид; – Реакцию указанного мономерного сложного эфира или соответствующего амида с нитратирующим агентом, таким как AgNO3 или аналогичное соединение, в результате чего получаются сложные эфиры азотной кислоты производных 2-(2,6-дигалофениламино)фенилуксусной кислоты (I). Второй способ, также наиболее желательный, отвечающий данному изобретению, включает следующие фазы: – Реакцию между натриевой солью 2-(2,6дигалофениламино)фенилуксусной кислоты или 2(2,6-дигалофениламино)фенилуксусной кислоты, функционализированной карбоксильной группой, с соединением, имеющим следующую общую формулу: R4–(CH2)n–OH Cl Cl O NH C CH2 O (CH2)4 ONO2 (ІІ) и Cl Cl O NH CH2 C NH (CH2)4 ONO2 (ХІ) которые получаются как описано в нижеследующих примерах, которые даются для иллюстрации, но не для ограничения объема данного изобретения. Пример 1. а) 6 г 1-бром-4-хлор-бутана, разбавленного в 250 мл диметилформамида, вводили по каплям в раствор 10 г натриевой соли 2-(2,6дихлорофениламино)фенилуксусной кислоты в 100 мл диметилформамида. Реакционная смесь перемешивалась в течение 12 часов при комнатной температуре, затем разбавлялась водой и экстрагировалась метиленхлоридом. Экстрагированная таким образом органическая фаза обезвоживалась на сульфате натрия, и раство (V) в которой: R4 выбран из числа хлора, брома, NHR, где R представляет собой водород или линейную или разветвленную алкильную цепь, и n составляет от 1 до 10, карбоксильная группа 2-(2,6-дигалофениламино)фенилуксусной кислоты функционализирована как акриловый хлорид, ангидрид и другие, в результате чего получается соответствующий мономерный сложный эфир соответствующего амида; – Реакцию указанного мономерного сложного эфира или соответствующего амида с галогенирующим соединением, таким как PBr3 или другие аналогичные соединения, в результате чего полу 3 39172 ритель выпаривался при пониженном давлении до тех пор, пока не было получено 14 г остаточного продукта. Этот остаточный продукт очищался методом хроматографии на силикагеле с использованием хлороформа в качестве элюента. Затем головные фракции собирались, и выпаривание растворителя при пониженном давлении давало 11 г сухого остаточного продукта, который подвергался снова хроматографическому разделению на силикагеле с использованием в качестве элюента смеси, состоящей из гексана/простого эфира в соотношении 7/3 (объем/объем). Головные фракции собирались, растворитель выпаривался при пониженном давлении и получалось 3 г 2-(2,6-дихлорофениламино)фенилацетата 4-хлоробутила (VIII). ИК-спектр (см-1): C=0,1741; NH, 3340. Спектр 1Н–ЯМР (300 МГц) (CDCl3): 1,9 частей на миллион (м., 4Н); 3,6 частей на миллион (м., 2Н); 3,85 частей на миллион (с., 2Н); 4,2 частей на миллион(м., 2Н); 6,5–7,45 частей на миллион (м., ароматика). Масс-спектрометрия (i.e): М+ 385. б) 1,2 г AgNO3, разбавленного в 11 мл ацетонитрила, вводили по каплям в 2 г (VIII), полученного как описано в а), разбавленного в 7 мл ацетонитрила. Реакционная смесь перемешивалась в течение 12 часов при температуре 85оС и затем фильтровалась. Растворитель выпаривался при низком давлении из полученного раствора, и получался остаточный продукт, в который добавляли 30 мл метиленхлорида. Полученная таким путем смесь снова фильтровалась, органическая фаза промывалась водой и затем обезвоживалась над сульфатом натрия. Растворитель выпаривался при пониженном давлении и получалось 2,8 г сухого остаточного продукта, который затем очищался путем хроматографии на силикагеле с использованием в качестве элюента смеси, состоящей из гексана/простого эфира в соотношении 7/3 (об/об). Фракции, содержащие продукт, собирались, растворитель выпаривался при пониженном давлении и получалось 2,5 г сложного эфира азотной кислоты производных 2-(2,6-дихлорофениламино)фенилацетата 4-оксибутила (II). ИК-спектр (см-1): C=0,1729; NH, 3322; ONO 2, 1637. Спектр 1Н–ЯМР (80 МГц) (CDCl 3): 1,75 частей на миллион (м., 4Н); 3,8 частей на миллион (м., 2Н); 4,2 частей на миллион (м., 2Н); 4,4 частей на миллион (м., 2Н); 6,45–7,4 частей на миллион (м., ароматика). Масс-спектрометрия (i.e): М+ 412. Пример 2. а) 0,5 г сложного этилового эфира 2-(2,6дихлорофениламино)фенилуксусной кислоты вводили в 0,5 мл 4-аминобутанола и полученная смесь перемешивалась при температуре 100 оС в течение 12 часов. Затем эта смесь снова доводилась до комнатной температуры, разбавлялась 5 мл воды и экстрагировалась 5 мл метиленхлорида. Экстрагированная таким путем органическая фаза обезвоживалась над сульфатом натрия и растворитель выпаривался при по ниженном давлении до тех пор, пока не получалось 0,19 г 2-(2,6-дихлорофениламино)-4-оксибутилфенилацетамида (XII). ИК Спектр (см-1)(нуйол): С=0,1648; NH и ОН, 3413. Спектр 1Н–ЯМР (80 МГц) (CDCl 3): 1,65 частей на миллион (м., 4Н); 3,3 частей на миллион (м., 2Н); 3,6 частей на миллион (м., 2Н); 6,08 частей на миллион (м., 1Н); 6,5 частей на миллион (д.д., 1Н); 6,85–7,5 частей на миллион (м., 6Н). Масс-спектрометрия: РМ 366. б) 1,14 г PBr 3 вводили в раствор 0,19 г 2(2,6-дихлорофениламино)-4-оксибутил-фенилацетамида (XII) в 10 мл хлороформа; полученную таким путем смесь перемешивали в течение 30 минут и затем разбавляли 10 мл воды. Органическую фазу отделяли и обезвоживали над сульфатом натрия, и затем растворитель выпаривали при пониженном давлении, и в результате получался сырой остаточный продукт, который очищали методом хроматографии с использованием в качестве элюента смеси, состоящей из метиленхлорида/этилацетата в соотношении 10/0,1 (об/об). Промежуточные фракции извлекались, растворитель подвергался выпариванию при пониженном давлении и получалось 50 мг 2-(2,6дихлорофениламино)-4-бромбутилфенилацетамида (XIII). Спектр 1Н–ЯМР (80 МГц) (CDCl 3): 1,73 частей на миллион (м., 4Н); 3,3 частей на миллион (м., 8Н); 3,67 частей на миллион (с., 2Н); 5,91 частей на миллион (шир.с., 1Н); 6,5 частей на миллион (д.д., 1Н); 6,92–7,29 частей на миллион (м., 5Н); 7,4 частей на миллион (д., 1Н). с) 1,5 г AgNO 3, разбавленного в 10,7 мл ацетонитрила, вводили в раствор, состоящий из 2,8 г 2-(2,6-дихлорофениламино)-4-бромбутилфенилацетамида (XIII), разбавленного в 9 мл ацетонитрила. Реакционная смесь перемешивалась при температуре 25 оС в течение 3 дней и затем фильтровалась. Растворитель выпаривался при пониженном давлении из полученного раствора, и в результате получался остаточный продукт, который очищался методом хроматографии с использованием метиленхлорида в качестве элюента. Фракции, содержащие этот продукт, собирали, растворитель выпаривали при пониженном давлении, и получалось 0,5 г сложного эфира азотной кислоты производного 2(2,6-дихлорофениламино)-4-оксибутилфенилацетамида (XI). ИК Спектр (нуйол): С=0,1650; NH, 3290; ONO 2, 1630. Спектр 1Н–ЯМР (80 МГц) (CDCl 3): 1,62 частей на миллион (м., 4Н); 3,28 частей на миллион (м., 2Н); 4,4 частей на миллион (т., 2Н); 5,3 частей на миллион (шир.с., 1Н); 6,49 частей на миллион (д.д., 1Н); 6,85–7,36 частей на миллион (м., 5Н); 7,4 частей на миллион (д., 1Н). Масс-спектрометрия: РМ 411. Путем биологических испытаний определяли противовоспалительное и обезболивающее действие, например, производных 2-(2,6дигалофениламино)фенилуксусной кислоты (I), имеющей следующие формулы: 4 39172 Cl Cl Противовоспалительное действие указанных производных 2-(2,6-дихлорофениламино)фенилуксусной кислоты определяли на крысах Wistar методом испытания на эдему каррагинан, как сообщалось в работе C.A.Winter, E.Risley, G.W. Nuss, Proc. Soc. Exp. Biol. Med. 111, 544–547 (1962), в то время как обезболивающее действие указанных производных определяли на Швейцарских мышах, как сообщалось L.C.Hendershot, J.Forsaith, J. Pharmacol. Еxp. Ter. 125, 237–249 (1959). Противовоспалительное и обезболивающее действие указанных производных дается в таблице, и выражается как отношение силы их действия к силе действия 2-(2,6-дихлорофениламино)фенилуксусной кислоты, взятой для сравнения. Каждая величина представляет собой среднее значение величин, получаемых при обработке 10 животных. Соединения (II) и (XI), используемые для указанных биологических испытаний, суспендировались в 0,5% карбоксиметилцеллюлозе до их ввода. O NH C CH2 O (CH2)4 ONO2 (ІІ) и Cl Cl O NH CH2 C NH (CH2)4 ONO2 (ХІ) Соединение Противовоспалительное действие Обезболивающее действие XI II 2-(2,6-ди-хлорофениламино) фенил-уксусная кислота 1,25 1,30 1 1,40 1,50 1 1,5 или 3,0 мг/кг (внутриорально) соединения (III) обнаружили значительное снижение симптоматологии артрита. Толерантность желудочно-кишечного тракта крыс У всех животных, обработанных 15 мг/кг (внутриорально) 2-(2,6-дихлорофениламино)фенилуксусной кислоты были обнаружены сильно размытые язвы; небольшие язвы были обнаружены также у животных, обработанных данным соединением дозами 3,5 и 7,0 мг/кг (внутриорально). Средняя доза ульцерогенности 2-(2,6-дихлорофениламино)фенилуксусной кислоты согласно расчету равна 6,1 мг/кг при внутриоральном вводе. Соединение (II) показывает хорошую толерантность даже при значительно более высоких дозах по сравнению с указанными; меньшего размера язвочки были обнаружены лишь у двух животных из десяти, обработанных дозой 100 мг/кг. В связи с этим невозможно определить среднюю дозу ульцерогенности соединения (II). Общие аспекты фармакологии Проводили вторичные фармакологические оценки соединения (II) путем сопоставления его с 2-(2,6-дихлорофениламино)фенилуксусной кислотой; никаких дополнительных эффектов не обнаружено, кроме первичного фармакологического действия на центральную нервную систему, аутономную систему, сердечно-сосудистую систему, систему дыхательных путей и желудочно-кишечный тракт. Б. Токсикология Острая токсичность при испытаниях на грызунах Исследования проводили на двух видах животных с осуществлением двух различных способов ввода. Затем определяли острое токсическое действие указанных производных (II) и (XI) путем орального ввода единичной дозы каждого из соединений (II) и (XI), с использованием для каждой группы соединений по 10 Швейцарских мышей. Частота смертельных случаев и начало токсических симптомов определяли за период, составляющий 14 дней. Даже при вводе 250 мг/кг соединения (II) или соединения (XI) у исследуемых животных никаких симптомов токсичности обнаружено не было. Дальнейшие биологические эксперименты, пригодные для определения фармакотоксикологического действия производных (II) проводились с исследованием соединения (II) в сопоставлении с 2-(2,6-дихлорофениламино)фенилуксусной кислотой, взятой для сравнения. А. Фармакодинамическое действие Модели острого воздействия Эдэма лапок крыс каррагенан: Значения ED 30 (мг/кг, внутриоральный ввод), полученные при данном испытании, равны соответственно 4,88 для соединения (II) и 4,21 для 2-(2,6-дихлорофениламино)фенилуксусной кислоты, что говорит о сопоставимой эффективности этих двух соединений. Воздействие на мышей фенилхинона: при дозах в пределах от 3 до 10 мг/кг (при оральном вводе) производное (II) показало полную эффективность, и сила его действия была почти сопоставима с силой действия 2-(2,6-дихлорофениламино)фенилуксусной кислоты и индометацина. Модели подострого воздействия Адьювантный аpтpит у крыс: Животные, испытываемые в течение 19 последовательных дней (с 3-го по 21-й день после инъекции адьюванта) с использованием 3,0 мг/кг (внутриорально) 2-(2,6дихлорофениламино)фенилуксусной кислоты или 5 39172 Были получены указанные ниже значения LD50 (мг/кг) и пределы фунгицидного действия 95%: Крысы, оральный ввод: 511 (356–732); мыши, оральный ввод: 497 (323–762); крысы, внутрибрюшинный ввод: 237 (156–369); мыши, внутрибрюшинный ввод: 253 (171–374). Максимальная переносимая доза у негрызунов Соединение (II) было хорошо переносимым у данных видов животных, которые, как известно, особенно чувствительны к данному классу соединений. Животных обрабатывали дозами, увеличивающимися с 250 до 1000 мг/кг соединения (II): наименьшая доза не вызывала никаких симптомов, промежуточная доза вызывала лишь слабую обратимую диарею, в то время как наивысшая доза вызывала сильную, но обратимую диарею. В противоположность этому, ввод при тех же условиях 10 мг/кг 2-(2,6-дихлорофениламино)фенилуксусной кислоты вызывал смертельный исход. Подострая токсичность при испытании на грызунах. Животных обрабатывали дозами 5, 15 и 30 мг/кг соединения (II) в течение четырех недель. Общие состояния и клиническое поведение, привес, потребление воды и пищи, гематологический и химический клинический анализы показали, что две меньшие дозы хорошо переносимы. Подострая токсичность при испытании на собаках. Животных обрабатывали дозами 5, 15 и 30 мг/кг соединения (II) в течение 4 недель. Общие состояния и клиническое поведение, привес, потребление пищи и воды, гематологический и химический клинический анализы показали, что две меньшие дозы хорошо переносимы. Тираж 50 екз. Відкрите акціонерне товариство «Патент» Україна, 88000, м. Ужгород, вул. Гагаріна, 101 (03122) 3 – 72 – 89 (03122) 2 – 57 – 03 6
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of 2-(2,6-digalophenylamino) phenylacetic acid and method for the preparation thereof
Автори англійськоюMatJi Jose Antonio, Alkaide Antonio
Назва патенту російськоюПроизводные 2-(2,6-дигалофениламино) фенилуксусной кислоты и способ их получения
Автори російськоюМатхи Хозе Антонио, Алкаиде Антонио
МПК / Мітки
МПК: C07C 237/20, A61K 31/16, C07C 229/42, A61K 31/215
Мітки: спосіб, похідні, одержання, кислоти, фенілоцтової, 2-(2,6-дигалофеніламіно
Код посилання
<a href="https://ua.patents.su/6-39172-pokhidni-2-26-digalofenilamino-feniloctovo-kisloti-i-sposib-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Похідні 2-(2,6-дигалофеніламіно) фенілоцтової кислоти і спосіб їх одержання</a>
Попередній патент: Спосіб підтримання заданого рівня комунікаційних послуг для множини абонентів системи радіозв’язку , спосіб роботи радіостанції (варіанти)
Наступний патент: Кліщовий захват
Випадковий патент: Закупорювальний пристрій із висувним розливним блоком










