Застосуваня імуногену для профілактики або лікування хвороби альцгеймера або інших захворювань, пов’язаних з відкладенням амілоїду
Номер патенту: 85815
Опубліковано: 10.03.2009
Автори: Нільсен Клаус Грегоріус, Деган Флоранс Даль, Кофод Петер, Енсен Мартін Роланд, Расмуссен Петер Бірк
Формула / Реферат
1. Застосування імуногену, який
a) являє собою поліамінокислоту, яка містить в одній і тій же молекулі істотну частину В-клітинних епітопів АРР і/або Аβ, так, що поліамінокислота у тій же мірі, що і АРР або Аβ, реагує з поліклональною сироваткою, одержаною проти АРР або Аβ, і щонайменше один чужорідний Т-хелперний епітоп (ТН-епітоп), і яка містить щонайменше один чужорідний ТН-епітоп і розбиту на частини послідовність АРР або Аβ, так, що поліамінокислота не включає в себе жодної підпослідовності SEQ ID NО:2, яка продуктивно зв'язується з молекулами МНС класу II, викликаючи Т-клітинну відповідь; або
b) являє собоюкон’югат, що включає в себе полігідроксиполімерний кістяк, з яким роздільно зв'язана поліамінокислота, як визначено в (а); або
c) являє собою кон’югат, що включає в себе полігідроксиполімерний кістяк, з яким роздільно зв'язані (1) щонайменше один чужорідний ТН-епітоп і (2) розбита на частини послідовність АРР або Аβ, як визначено в (а); або
d) являє собою нуклеїнову кислоту, яка кодує поліамінокислоту, як визначено в (а); або
е) являє собою непатогенний мікроорганізм або вірус, який несе фрагмент нуклеїнової кислоти, який кодує і експресує поліамінокислоту, як визначено в (а), при виготовленні фармацевтичної композиції, що містить вказаний імуноген, для лікування, профілактики або поліпшення у тварини хвороби Альцгеймера або інших захворювань і станів, які характеризуються відкладеннями амілоїду.
2. Застосування за п. 1, при якому поліамінокислота або кон’югат містить у собі
- щонайменше одну першу групу, яка здійснює націлювання поліамінокислоти аналога на антигенпрезентуючу клітину (АРС) або В-лімфоцит, і/або
- щонайменше одну другу групу, яка стимулює імунну систему, і/або
- щонайменше одну третю групу, яка оптимізує презентацію поліамінокислоти імунній системі.
3. Застосування за п. 2, де перша і/або друга, і/або третя група приєднується(ються) як бічні групи за допомогою ковалентного або нековалентного зв'язування до відповідних хімічних груп у послідовності АРР або Аβ.
4. Застосування за будь-яким з попередніх пунктів, де поліамінокислота включає в себе гібридний білок.
5. Застосування за будь-яким з попередніх пунктів, де поліамінокислота або кон’югат включає в себе дуплікацію щонайменше одного В-клітинного епітопу АРР або Аβ і/або введення гаптену.
6. Застосування за будь-яким з попередніх пунктів, де чужорідний Т-клітинний епітоп є імунодомінантним у даної тварини.
7. Застосування за будь-яким з попередніх пунктів, де чужорідний Т-клітинний епітоп є змішаним, таким як чужорідний Т-клітинний епітоп, який вибраний з природного змішаного Т-клітинного епітопу і штучної пептидної послідовності, що зв'язує MHC-II.
8. Застосування за п.7, де природний Т-клітинний епітоп вибраний з епітопу анатоксину правця, такого як Р2 або Р30, епітопу дифтерійного анатоксину, епітопу гемаглютиніну вірусу грипу та епітопу CS P. falciparum.
9. Застосування за будь-яким з попередніх пунктів, де поліамінокислота або кон’югат включає в себе В-клітинні епітопи, що не експонуються в екстрацелюлярну фазу, коли представлені у зв'язаній з клітиною формі поліпептиду-попередника Аβ.
10. Застосування за будь-яким з попередніх пунктів, де в поліамінокислоті або кон’югаті відсутній щонайменше один В-клітинний епітоп, який експонований в екстрацелюлярну фазу, коли представлений у зв'язаній з клітиною формі поліпептиду-попередника Аβ.
11. Застосування за будь-яким з попередніх пунктів, де поліамінокислота або кон’югат включає в себе не більше 9 послідовних амінокислот послідовності SEQ ID NО:2, наприклад, не більше 8, не більше 7, не більше 6, не більше 5, не більше 4 і не більше 3 послідовних амінокислот.
12. Застосування за п. 11, де поліамінокислота або кон’югат включає в себе щонайменше одну підпослідовність SEQ ID NО:2, так, що кожна така щонайменше одна підпослідовність SEQ NО:2 незалежно складається з амінокислотних відрізків, вибраних з групи, що складається з 9 послідовних амінокислот SEQ ID NО:2, 8 послідовних амінокислот SEQ ID NО:2, 7 послідовних амінокислот SEQ ID NО:2, 6 послідовних амінокислот SEQ ID NО:2, 5 послідовних амінокислот SEQ ID NО:2, 4 послідовних амінокислот SEQ ID NО:2 і 3 послідовних амінокислот SEQ ID NО:2.
13. Застосування за пп.11 або 12, де послідовні амінокислоти починаються з амінокислотного залишку, вибраного з групи, що складається із залишків 672, 673, 674, 675, 676, 677, 678, 679, 680, 681, 682, 683, 684, 685, 686, 687, 688, 689, 690, 691, 692, 693, 694, 695, 696, 697, 698, 699, 700, 701, 702, 703, 704, 705, 706, 707, 708, 709, 710, 711, 712, 713 і 714.
14. Застосування за будь-яким з попередніх пунктів, де щонайменше дві копії поліамінокислоти або кон’югату ковалентно або нековалентно зв'язані з молекулою-носієм, здатною до ефективної презентації множинних копій антигенних детермінант.
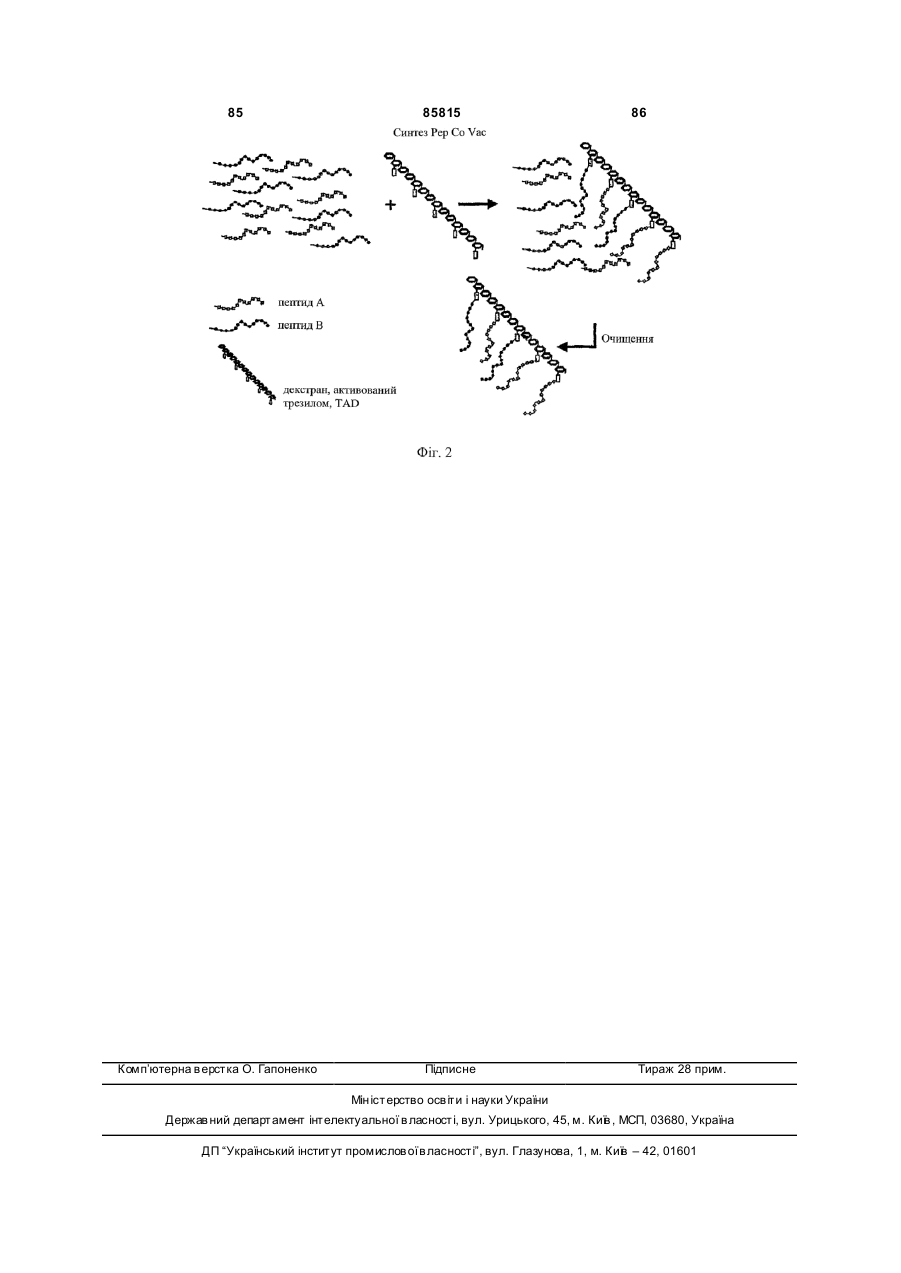
15. Застосування за будь-яким з попередніх пунктів варіантів b) або c), де поліамінокислота і ТН-епітоп зв'язані з полігідроксиполімером за допомогою амідного зв'язку.
16. Застосування за будь-яким з попередніх пунктів варіантів b) або c), де полігідроксиполімер являє собою полісахарид.
17. Застосування за будь-яким з попередніх пунктів, де поліамінокислота або кон’югат об'єднані з ад’ювантом, що полегшує порушення аутотолерантності до аутоантигенів.
18. Застосування за будь-яким з попередніх пунктів, де лікування, профілактика або покращення викликаються введенням тварині ефективної кількості поліамінокислоти або кон’югату за допомогою шляху, вибраного з парентерального шляху, такого як внутрішньовенний, підшкірний і внутрішньом'язовий шляхи; перитонеального шляху; перорального шляху; букального шляху; сублінгвального шляху; епідурального шляху; спінального шляху; анального шляху та інтракраніального шляху.
19. Застосування за п. 18, де ефективна кількість складає від 0,5 мкг до 2000 мкг поліамінокислоти або кон’югату.
20. Застосування за будь-яким з пп. 1-13, варіанта d), де лікування, профілактика або покращення викликаються введенням у клітини тварини поліамінокислоти або кон’югату, і таким чином одержують експресію in vivo клітинами введеної нуклеїнової кислоти (нуклеїнових кислот).
21. Застосування за п. 20, де введена(і) нуклеїнова(і) кислота(и) вибрана(і) з "оголеної" ДНК; ДНК, об'єднаної із зарядженими або незарядженими ліпідами, ДНК, поміщеної у ліпосоми; ДНК, включеної у вірусний вектор; ДНК, об'єднаної з білком або поліпептидом, що полегшує трансфекцію; ДНК, об'єднаної з націлюючим білком або поліпептидом; ДНК, об'єднаної із засобом, що осаджує кальцій; ДНК, зв'язаної з інертною молекулою-носієм; ДНК, інкапсульованої у хітин або хітозан, і ДНК, об'єднаної з ад’ювантом.
22. Застосування за будь-яким з пп. 18-21, де лікування, профілактика або покращення викликаються щонайменше одним призначенням/введенням на рік, наприклад щонайменше 2, щонайменше 3, щонайменше 4, щонайменше 6 і щонайменше 12 призначеннями/введеннями.
23. Застосування за будь-яким з попередніх пунктів, де лікування, профілактика або покращення викликаються тим, що АРР або Аβ піддаються понижуючій регуляції до такої міри, що загальна кількість амілоїду зменшується або що швидкість формування амілоїду зменшується з клінічною значимістю.
24. Поліамінокислота або кон’югат, одержаний з АРР або Аβ тварини, де введена модифікація, яка приводить до того, що імунізація тварини поліамінокислотою або кон’югатом викликає продукцію антитіл проти аутологічних АРР або Aβ тварини, і де поліамінокислота або кон’югат є такими, як визначено за будь-яким з пп. 1-16.
25. Імуногенна композиція, що включає в себе імуногенно ефективну кількість аналога за п. 24, де композиція додатково включає в себе фармацевтично та імунологічно допустимий носій і/або наповнювач і, необов'язково, ад’ювант.
26. Фрагмент нуклеїнової кислоти, що кодує поліамінокислоту або кон’югат за п. 24.
27. Вектор, що несе фрагмент нуклеїнової кислоти за п. 26, наприклад, вектор, який здатний до автономної реплікації.
28. Вектор за п. 27, вибраний з групи, що складається з плазміди, фагу, косміди, мініхромосоми та вірусу.
29. Вектор за пп. 27 або 28, що містить у напрямку 5'→3' та у функціональному з’єднанні промотор для керування експресією фрагмента нуклеїнової кислоти за п. 26, необов'язково послідовність нуклеїнової кислоти, яка кодує лідерний пептид, що робить можливою секрецію поліпептидного фрагмента або його інтеграцію у мембрану, фрагмент нуклеїнової кислоти за п. 26 і, необов'язково, термінатор.
30. Вектор за будь-яким з пп. 27-29, який при введенні у клітину-хазяїна здатний або нездатний до інтеграції у геном клітини-хазяїна.
31. Вектор за будь-яким з пп. 29 або 30, де промотор керує експресією в еукаріотичній клітині і/або у прокаріотичній клітині.
32. Трансформована клітина, що несе вектор за будь-яким з пп. 27-31, така як трансформована клітина, здатна до реплікації фрагмента нуклеїнової кислоти за п. 26.
33. Трансформована клітина за п. 32, що є мікроорганізмом, вибраним з групи бактерій, дріжджів, найпростіших або клітини, одержаної з багатоклітинного організму, вибраного з гриба, клітини комахи, такої як клітина S2 або SF, клітини рослини або клітини ссавця.
34. Трансформована клітина за пп. 32 або 33, що експресує фрагмент нуклеїнової кислоти за п. 27, така як трансформована клітина, яка секретує або несе на своїй поверхні поліамінокислоту або кон’югат за п. 24.
35. Застосування за будь-яким з пп. 1-13, варіанта е), де лікування, профілактика або покращення викликаються введенням непатогенного мікроорганізму або вірусу, що несе фрагмент нуклеїнової кислоти, який кодує і експресує поліамінокислоти або кон’югат .
36. Композиція для індукування продукції антитіл проти амілоїду, де композиція включає в себе
- фрагмент нуклеїнової кислоти за п. 26 або вектор за будь-яким з пп. 27-31 і
- фармацевтично та імунологічно прийнятний носій і/або наповнювач, і/або ад’ювант.
37. Стабільна клітинна лінія, що несе вектор за будь-яким з пп. 7-31, що при цьому експресує фрагмент нуклеїнової кислоти за п. 26 і необов'язково секретує або несе на своїй поверхні поліамінокислоту або кон’югат за п .24.
Текст
1. Застосування імуногену, який a) являє собою поліамінокислоту, яка містить в одній і тій же молекулі істотну частину В-клітинних епітопів АРР і/або Аβ, так, що поліамінокислота у тій же мірі, що і АРР або Аβ, реагує з поліклональною сироваткою, одержаною проти АРР або Аβ, і щонайменше один чужорідний Т-хелперний епітоп (ТН-епітоп), і яка містить щонайменше один чужорідний ТН-епітоп і розбиту на частини послідовність АРР або Аβ, так, що поліамінокислота не включає в себе жодної підпослідовності SEQ ID NО:2, яка продуктивно зв'язується з молекулами 2 (19) 1 3 85815 4 6. Застосування за будь-яким з попередніх пункад’ювантом, що полегшує порушення ауто толератів, де чужорідний Т-клітинний епітоп є імунодомінтності до а утоанти генів. нантним у даної тварини. 18. Застосування за будь-яким з попередніх пунк7. Застосування за будь-яким з попередніх пунктів, де лікування, профілактика або покращення тів, де чужорідний Т-клітинний епітоп є змішаним, викликаються введенням тварині ефективної кільтаким як чужорідний Т-клітинний епітоп, який вибкості поліамінокислоти або кон’югату за допомораний з природного змішаного Т-клітинного епітогою шляху, вибраного з парентерального шляху, пу і штучної пептидної послідовності, що зв'язує такого як внутрішньовенний, підшкірний і внутріMHC-II. шньом'язовий шляхи; перитонеального шляху; 8. Застосування за п.7, де природний Т-клітинний перорального шляху; букального шляху; сублінгепітоп вибраний з епітопу анатоксину правця, тавального шляху; епідурального шляху; спінальнокого як Р2 або Р30, епітопу дифтерійного анатокго шляху; анального шляху та інтракраніального сину, епітоп у гемаглютиніну вірусу грипу та епітошляху. пу CS P. falciparum. 19. Застосування за п. 18, де ефективна кількість 9. Застосування за будь-яким з попередніх пункскладає від 0,5 мкг до 2000 мкг поліамінокислоти тів, де поліамінокислота або кон’югат включає в або кон’югату. себе В-клітинні епітопи, що не експонуються в 20. Застосування за будь-яким з пп. 1-13, варіанта екстрацелюлярну фазу, коли представлені у зв'яd), де лікування, профілактика або покращення заній з клітиною формі поліпептиду-попередника викликаються введенням у клітини тварини поліАβ. амінокислоти або кон’югату, і таким чином одер10. Застосування за будь-яким з попередніх пункжують експресію in vivo клітинами введеної нуклетів, де в поліамінокислоті або кон’югаті відсутній їнової кислоти (нуклеїнових кислот). щонайменше один В-клітинний епітоп, який екс21. Застосування за п. 20, де введена(і) нуклеїнопонований в екстрацелюлярну фазу, коли предва(і) кислота(и) вибрана(і) з "оголеної" ДНК; ДНК, ставлений у зв'язаній з клітиною формі поліпептиоб'єднаної із зарядженими або незарядженими ду-попередника Аβ. ліпідами, ДНК, поміщеної у ліпосоми; ДНК, вклю11. Застосування за будь-яким з попередніх пункченої у вірусний вектор; ДНК, об'єднаної з білком тів, де поліамінокислота або кон’югат включає в або поліпептидом, що полегшує трансфекцію; себе не більше 9 послідовних амінокислот посліДНК, об'єднаної з націлюючим білком або поліпедовності SEQ ID NО:2, наприклад, не більше 8, не птидом; ДНК, об'єднаної із засобом, що осаджує більше 7, не більше 6, не більше 5, не більше 4 і кальцій; ДНК, зв'язаної з інертною молекулоюне більше 3 послідовних амінокислот. носієм; ДНК, інкапсульованої у хітин або хітозан, і 12. Застосування за п. 11, де поліамінокислота ДНК, об'єднаної з ад’ювантом. або кон’югат включає в себе щонайменше одну 22. Застосування за будь-яким з пп. 18-21, де ліпідпослідовність SEQ ID NО:2, так, що кожна така кування, профілактика або покращення викликащонайменше одна підпослідовність SEQ NО:2 ються щонайменше одним призначеннезалежно складається з амінокислотних відрізків, ням/введенням на рік, наприклад щонайменше 2, вибраних з групи, що складається з 9 послідовних щонайменше 3, щонайменше 4, щонайменше 6 і амінокислот SEQ ID NО:2, 8 послідовних амінокищонайменше 12 призначеннями/введеннями. слот SEQ ID NО:2, 7 послідовних амінокислот SEQ 23. Застосування за будь-яким з попередніх пункID NО:2, 6 послідовних амінокислот SEQ ID NО:2, тів, де лікування, профілактика або покращення 5 послідовних амінокислот SEQ ID NО:2, 4 послівикликаються тим, що АРР або Аβ піддаються довних амінокислот SEQ ID NО:2 і 3 послідовних понижуючій регуляції до такої міри, що загальна амінокислот SEQ ID NО:2. кількість амілоїду зменшується або що швидкість 13. Застосування за пп.11 або 12, де послідовні формування амілоїду зменшується з клінічною амінокислоти починаються з амінокислотного зазначимістю. лишку, вибраного з групи, що складається із за24. Поліамінокислота або кон’югат, одержаний з лишків 672, 673, 674, 675, 676, 677, 678, 679, 680, АРР або Аβ тварини, де введена модифікація, яка 681, 682, 683, 684, 685, 686, 687, 688, 689, 690, приводить до того, що імунізація тварини поліамі691, 692, 693, 694, 695, 696, 697, 698, 699, 700, нокислотою або кон’югатом викликає продукцію 701, 702, 703, 704, 705, 706, 707, 708, 709, 710, антитіл проти аутологі чних АРР або Aβ тварини, і 711, 712, 713 і 714. де поліамінокислота або кон’югат є такими, як ви14. Застосування за будь-яким з попередніх пункзначено за будь-яким з пп. 1-16. тів, де щонайменше дві копії поліамінокислоти або 25. Імуногенна композиція, що включає в себе кон’югату ковалентно або нековалентно зв'язані з імуногенно ефективну кількість аналога за п. 24, молекулою-носієм, здатною до ефективної презеде композиція додатково включає в себе фармантації множинних копій антигенних детермінант. цевтично та імунологічно допустимий носій і/або 15. Застосування за будь-яким з попередніх пункнаповнювач і, необов'язково, ад’ювант. тів варіантів b) або c), де поліамінокислота і ТН26. Фрагмент нуклеїнової кислоти, що кодує поліепітоп зв'язані з полігідроксиполімером за допоамінокислоту або кон’югат за п. 24. могою амідного зв'язку. 27. Вектор, що несе фрагмент нуклеїнової кислоти 16. Застосування за будь-яким з попередніх пункза п. 26, наприклад, вектор, який здатний до автотів варіантів b) або c), де полігідроксиполімер явномної реплікації. ляє собою полісахарид. 28. Вектор за п. 27, вибраний з групи, що склада17. Застосування за будь-яким з попередніх пункється з плазміди, фагу, косміди, мініхромосоми та тів, де поліамінокислота або кон’югат об'єднані з вірусу. 5 85815 6 29. Вектор за пп. 27 або 28, що містить у напрямку махи, такої як клітина S2 або SF, клітини рослини 5'→3' та у функціональному з’єднанні промотор або клітини ссавця. для керування експресією фрагмента нуклеїнової 34. Трансформована клітина за пп. 32 або 33, що кислоти за п. 26, необов'язково послідовність нукекспресує фрагмент нуклеїнової кислоти за п. 27, леїнової кислоти, яка кодує лідерний пептид, що така як трансформована клітина, яка секретує або робить можливою секрецію поліпептидного фрагнесе на своїй поверхні поліамінокислоту або мента або його інтеграцію у мембрану, фрагмент кон’югат за п. 24. нуклеїнової кислоти за п. 26 і, необов'язково, тер35. Застосування за будь-яким з пп. 1-13, варіанта мінатор. е), де лікування, профілактика або покращення 30. Вектор за будь-яким з пп. 27-29, який при ввевикликаються введенням непатогенного мікроорденні у клітину-хазяїна здатний або нездатний до ганізму або вірусу, що несе фрагмент нуклеїнової інтеграції у геном клітини-хазяїна. кислоти, який кодує і експресує поліамінокислоти 31. Вектор за будь-яким з пп. 29 або 30, де промоабо кон’югат . тор керує експресією в еукаріотичній клітині і/або у 36. Композиція для індукування продукції антитіл прокаріотичній клітині. проти амілоїду, де композиція включає в себе 32. Трансформована клітина, що несе вектор за - фрагмент нуклеїнової кислоти за п. 26 або вектор будь-яким з пп. 27-31, така як трансформована за будь-яким з пп. 27-31 і клітина, здатна до реплікації фрагмента нуклеїно- фармацевтично та імунологічно прийнятний нової кислоти за п. 26. сій і/або наповнювач, і/або ад’ювант. 33. Трансформована клітина за п. 32, що є мікро37. Стабільна клітинна лінія, що несе вектор за організмом, вибраним з групи бактерій, дріжджів, будь-яким з пп. 7-31, що при цьому експресує франайпростіших або клітини, одержаної з багатоклігмент нуклеїнової кислоти за п. 26 і необов'язково тинного організму, вибраного з гриба, клітини косекретує або несе на своїй поверхні поліамінокислоту або кон’югат за п .24. Даний винахід відноситься до вдосконалень у лікуванні і профілактиці хвороби Альцгеймера (AD) та інших захворювань, що характеризуються накопиченням амілоїду, наприклад, характеризуються накопиченням амілоїду у центральній нервовій системі (ЦНС). Більш конкретно, у даному винаході наданий спосіб для знижувальної регуляції (небажаного) накопичення амілоїду за допомогою включення продукції антитіл проти відповідного білка (АРР або Αb) або їх компонентів у суб'єктів, які страждають від захворювань з патологією, що включає в себе відкладення амілоїду, або ризикують постраждати від даних захворювань. Винахід також відноситься до способів одержання поліпептидів, які можна використати у вказаному способі, а також до модифікованих пептидів як таких. Також у даний винахід включені фрагменти нуклеїнових кислот, які кодують модифіковані поліпептиди, а також вектори, що включають в себе вказані фрагменти нуклеїнових кислот, і клітини-хазяїни і клітинні лінії, трансформовані ними. Нарешті, у даному винаході наданий новий тип імуногена на основі кон'югованих пептидів. Амілоїдоз являє собою позаклітинне накопичення нерозчинних пептидних фібрил, що приводить до пошкодження тканин і захворювання [Pepys, 1996; Tan et al., 1995; Kelly, 1996]. Фібрили формуються, коли розчинні у нормі білки і пептиди мимовільно асоціюються аномальним чином [Kelly, 1997]. Амілоїд асоційований з серйозними захворюваннями, включаючи системний амілоїдоз, AD, діабет дорослих, хворобу Паркінсона, хворобу Гентінгтона, фронтотемпоральну деменцію і пов'язані з пріонами губчасті енцефалопатії, що передаються (куру і хвороба Крейцфельда-Якоба у людини та скрейпі і BSE у овець і великої рогатої худоби, відповідно), і формування амілоїдних бляшок, наприклад, при хворобі Альцгеймера, очевидно, тісно пов'язане з прогресуванням захворювання у людини. На тваринних моделях показано, що надмірна експресія або експресія модифікованих форм білків, виявлених у відкладеннях, таких як білок b-амілоїд, викликають різні симптоми захворювання, наприклад, подібні до симптомів при хворобі Альцгеймера. Специфічного лікування накопичення амілоїду не існує, і такі захворювання, як правило, приводять до летального кінця. Субодиниці фібрил амілоїду можуть являти собою білки дикого типу, змінені або укорочені білки, і подібні фібрили можна формувати in vitro з олігопептидів і денатурованих білків [Bradbury et al., 1960; Filshie et al., 1964; Burke & Rougvie, 1972]. Характер амілоїдозу визначає природа поліпептидного компонента фібрил. Незважаючи на великі відмінності у розмірі, нативній структурі і функції амілоїдних білків, всі амілоїдні фібрили являють собою фібрили невизначеної довжини, нерозгалужені, мають у діаметрі від 70 до 120Å і характерно забарвлюються конго червоним [Pepys, 1996]. Вони являють собою характерну складчасту bструктур у, в якій поліпептидний ланцюг укладений у b-шари. Хоча амілоїдні білки володіють надзвичайно різноманітними структурами попередників, всі вони можуть зазнавати структурної конверсії, можливо, по схожому шляху, у неправильно укладену форму, яка являє собою будівельний блок протофіламенту спіралі b-шару. Дана характерна фібрилярна форма приводила до амілоїдоз, що називаються b-фібрильозами [Glenner, 1980a, b], а фібрилярний білок AD, до того як дізналися його вторинну структур у, нази 7 85815 8 то здатність суб'єкта виконувати прості і звичні вали b-білком [Glenner & Wong, 1984]. Характерна задачі починає знижуватися. AD також впливає на дифракційна картина перехресних b-структур, ракору головного мозку, особливо у ділянках, що зом з появою фібрил і властивостями при забарввідповідають за мову і мислення. Зрештою, залуленні у наш час являють собою загальноприйняті чаються й інші ділянки головного мозку, всі ці дідіагностичні ознаки амілоїду і означають, що фіблянки головного мозку атрофуються (скорочуютьрили, хоча і сформовані з абсолютно різних білкося), і пацієнти з AD стають прикутими до ліжка, вих попередників, володіють певною структурною нездатними до самоконтролю, повністю безпорадподібністю і складають структурне надсімейство, ними і несприйнятливими до навколишнього світу безвідносно до природи їх білків-попередників [джерело: National Institute on Aging Progress [Sunde Μ., Serpell L.C., Bartlam Μ., Fraser P.E., Report on Alzheimer's Disease, 1999]. Pepys M.B., Blake CCFJ Mol. Biol. 1997 Oct. 31; 273 Вплив AD (3): 729-739]. AD являє собою найбільш загальну причину Одне з найбільш широко поширених і добре деменції у людини у віці 65 років і старше. Вона відомих захворювань являє собою AD, де, як приявляє собою велику проблему для здоров'я внапускають, центральною роллю у розвитку захвослідок її величезного впливу на індивідів, сім'ї, рювання є відкладення амілоїду у центральній систему охорони здоров'я і суспільство загалом. нервовій системі. Вчені підрахували, що у наш час понад 4 мільйони AD людей страждають від даного захворювання, і Хвороба Альцгеймера (AD) являє собою безчастота захворювання у тих індивідів, кому більше поворотний, прогресуючий розлад головного моз65 років, подвоюється кожні 5 років. Також припуску, який відбувається поступово і приводить до кають, що кожного року виникне приблизно 360000 втрати пам'яті, змін у поведінці та особистості і нових випадків (інцидент), хоча ця цифра буде зниження розумових здібностей. Такі втрати пов'язбільшуватися в міру старіння населення зані із загибеллю клітин головного мозку і руйну[Brookmeyer et al., 1998]. ванням зв'язків між ними. Перебіг захворювання, AD накладає тяжкий економічний тягар на сусяк і ступінь деградації варіюють від людини до пільство. В останньому дослідженні у Сполучених людини. У середньому пацієнти з AD після встаноШтатах розрахували, що щорічна вартість лікуванвлення діагнозу живуть від 8 до 10 років, хоча хвоня одного пацієнта з AD складає $18408 для паціроба може тривати і до 20 років. єнта зі слабкою AD, $30096 - для пацієнта з помірAD прогресує по стадіях, від ранньої, помірної ною AD і $36132 - для пацієнта з тяжкою AD. безпам'ятності до тяжкої втрати розумової діяльПідраховано, що щорічні державні витрати у США ності. Така втрата відома як деменція. У більшості на лікування пацієнтів з AD складають трохи більлюдей з AD перші симптоми з'являються після 60 ше $50 мільярдів [Leon et al., 1998]. років, але не є рідкими більш ранні віки початку. Приблизно 4 мільйони американців знаходятьНайбільш ранні симптоми часто включають в себе ся у віці 85 років або більше і в найбільш індустрівтрату короткочасної пам'яті, помилкове судження алізованих країнах ця вікова група являє собою та особистісні зміни. Часто люди на початкових одну з найбільш швидко зростаючих частин насестадіях AD мислять менш ясно і забувають імена лення. Розраховано, що дана група до 2030 року у близьких родичів і назви звичайних речей. Пізніше, США складатиме приблизно 8,5 мільйонів; деякі при розвитку хвороби, вони можуть забувати як експерти, які вивчають зміни населення припускавиконувати навіть прості задачі. У результаті, люють, що дане число може навіть бути більшим. ди з AD повністю втрачають здатність до мисленОскільки все більше і більше людей живе довше, ня і стають залежними від інших людей через нечисло людей, уражених захворюваннями, пов'язаобхідність щоденного догляду за ними. Зрештою, ними з віком, включаючи AD, буде продовжувати хвороба так послаблює сили, що пацієнти стають збільшуватися. Наприклад, деякі дослідження поприкутими до ліжка, і зростає ймовірність розвитку казують, що приблизно половина з усіх людей у інших захворювань та інфекції. Як правило, люди, віці 85 років і старше має яку-небудь форму недоякі страждають AD, вмирають від пневмонії. умства [National Institute on Aging Progress Report Незважаючи на те, що ризик розвитку AD збіon Alzheimer's Disease, 1999]. льшується з віком, симптоми AD і деменції не є Основні характеристики AD частиною нормального старіння. AD та інші захвоОзнаками AD є дві аномальні структури у горювання, що приводять до недоумства, викликаловному мозку: амілоїдні бляшки і нейрофібриляються захворюваннями, які впливають на мозок. рні клубки (NFT). Бляшки являють собою щільні, При нормальному старінні нервові клітини голомайже абсолютно нерозчинні накопичення білка і вного мозку у великій кількості не руйнуються. На клітинної речовини поза і навколо нейронів головідміну від цього, при AD руйнується три ключових вного мозку. Клубки являють собою нерозчинні процеси: зв'язок, метаболізм і відновлення нервопереплетені волокна, що накопичуються всередині вих клітин. Таке руйнування, зрештою, викликає нейронів. зупинку функціонування багатьох нервових клітин, Існує дві форми AD: сімейна AD (FAD), яка втрату зв'язків з іншими нервовими клітинами і підпорядковується певному типу успадковування, і смерть. спорадична AD, для якої не спостерігається очеСпочатку AD р уйнує нейрони у частинах головидного типу успадковування. Внаслідок відмінновного мозку, які контролюють пам'ять, головним стей на початку захворювання AD додатково опичином у гіпокампі і пов'язаних структурах. В міру сують як захворювання з раннім початком (що того як клітини у гіпокампі по суті припиняють фунвиникає у людини молодше 65 років) і з пізнім покціонування, слабшає короткочасна пам'ять, і час 9 85815 10 чатком (що виникає у людини 65 років і старше). довжиною 42 амінокислоти, який швидко утворює AD з раннім початком трапляється рідко (приблизнерозчинні агрегати. Доки Αb формується, ще точно 10 процентів випадків) і, як правило, уражує но невідомо, як він рухається через нервові клітилюдей у віці від 30 до 60 років. Деякі форми AD з ни або навколо них. На фінальній стадії процесу раннім початком є спадковими і уражують членів "липкий" Αb агрегує у довгі філаменти ззовні клітисімей. AD з раннім початком також часто прогрени і разом з фрагментами відмерлих або відмирасує швидше, ніж більш часта форма з пізнім почаючих нейронів і мікроглією з астроцитами формує тком. бляшки, що характеризують AD у тканині головноВсі FAD, відомі до цього часу, характеризуго мозку. ються раннім початком, а у наш час відомо, що до Існують деякі докази, що мутації в АРР стають 50 процентів випадків FAD викликані дефектами у більш вірогідними, коли від попередника АРР відтрьох генах, розташованих на трьох різних хроморіжеться Αb, таким чином викликаючи утворення сомах. Вони являють собою мутації у гені АРР на або великих кількостей загального Αb, або відносхромосомі 21; мутації у гені, що називається прено великих кількостей «липкої» форми. Також висенілін-1, на хромосомі 14 і мутації у гені, що назиявили, що мутації у генах пресеніліну можуть здійвається пресенілін-2, на хромосомі 1. Однак досі снювати внесок у дегенерацію нейронів немає доказів того, що яка-небудь з цих мутацій щонайменше двома шляхами: за допомогою мограє основну роль у більш частій, спорадичній або дифікації продукції Αb або за допомогою запуску несімейній формі AD з пізнім початком [National клітинної смерті більш безпосередньо. Інші досліInstitute on Aging Progress Report on Alzheimer's дження наводять на думку, що мутовані пресеніліDisease, 1999]. ни 1 і 2 можуть бути залучені до зростаючої швидАмілоїдні бляшки кості апоптозу. При AD амілоїдні бляшки спочатку розвиваВважають, що Αb токсичний для нейронів. У ються у ділянках головного мозку, пов'язаних з дослідженнях на культурі тканини дослідники випам'яттю та іншими когнітивними функціями. Вони явили збільшення смерті нейрональних клітин гіскладаються з майже абсолютно нерозчинних напокампу, сконструйованих для підвищеної експрекопичень бета-амілоїду (який надалі позначається сії мутантних форм АРР людини у порівнянні з Αb), що являє собою білкові фрагменти більшого нейронами з підвищеною експресією нормальної білка, який називається білком-попередником аміАРР людини [Luo et al., 1999]. лоїду (АРР, амінокислотна послідовність якого Крім того, підвищена експресія або експресія приведена далі у SEQ ID NO:2), змішаного з часмодифікованих форм білка Αb, як показано на тинами нейронів і клітин, що не є нейронами, таких тваринних моделях, викликає симптоми, подібні до як мікроглія і астроцити. Невідомо, чи є амілоїдні симптомів при хворобі Альцгеймера [Hsiao К. et al., бляшки як такі основною причиною AD або вони 1998]. являють собою побічний продукт процесу AD. БезНа основі даних про те, що збільшене утвоумовно, як показано для успадковуваної форми рення Αb, його агрегація у бляшки і результуюча AD, що викликається мутаціями у гені АРР, зміни нейротоксичність можуть вести до AD, дослідженбілка АРР можуть викликати AD, a формування ня станів, в яких агрегацію Αb у бляшки можна бляшок Αb являється тісно асоційованим з прогрезнизити або навіть блокувати, представляє інтерес сією захворювання у людини [Lippa С. F. et al. для лікування. 1998]. Пресеніліни АРР Мутації у пресеніліні-1 (S-180) відповідають АРР являє собою один з багатьох білків, зв'ямайже за 50% всіх випадків сімейної AD з раннім заних з клітинними мембранами. Після його утвопочатком (FAD). Ідентифіковано близько 30 мутарення АРР вбудовується у мембрану нервової цій, що приводять до AD. Початок AD варіює, в клітини, розташовуючись частково всередині і часзалежності від мутацій. Мутації у пресеніліні-2 відтково ззовні клітини. Останні дослідження з викоповідають за набагато меншу частин у випадків ристанням трансгенних мишей показали, що, очеFAD, але проте являють собою значимий фактор. видно, АРР грає важливу роль у рості і виживанні Чи залучені пресеніліни до спорадичної несімейної нейронів. Наприклад, визначені форми і кількості AD, невідомо. Функція пресенілінів невідома, але АРР можуть захистити нейрони і від короткочасновони виявляються залученими до процесингу АРР го, і від тривалого пошкодження, а також можуть з одержанням Αb-42 (більш довга липка форма приводити пошкоджені нейрони у стан з кращою пептиду, SEQ ID NO:2, залишки 673-714), оскільки здатністю до самовідновлення і допомагають часпацієнти з AD з мутаціями у пресеніліні мають підтинам нейронів рости після травми головного мозвищені рівні даного пептиду. Чи виграють також ку. пресеніліни роль при індукції утворення NTF, неДоки АРР вбудований у клітинну мембрану, на зрозуміло. Деякі дані дозволяють припустити, що особливі ділянки АРР діють протеази, розщеплюпресеніліни також можуть мати більш безпосередючи його на білкові фрагменти. Одна протеаза ню роль у дегенерації і смерті нейронів. Пресенідопомагає розщепити АРР, з утворенням Αb, а лін-1 розташований на хромосомі 14, у той час як інша протеаза розщеплює АРР посередині амілоїпресенілін-2 зчеплений з хромосомою 1. Якщо дного фрагмента, так, що Αb не може сформувасуб'єкт несе мутовану версію хоча б одного з датися. Фрагмент Αb сформований з двох різних чаних генів, у нього або у неї майже достовірно розстин, більш короткого Αb довжиною 40 (або 41) винеться AD з раннім початком. амінокислот, який є відносно розчинним і повільно агрегує, і небагато більш довгого "липкого" Αb, 11 85815 12 Дещо незрозуміло, чи є пресенілін-1 ідентичпроцесі AD [National Institute on Aging Progress Report on Alzheimer's Disease, 1999]. ним гіпотетичній g-секретазі, залученій до процесингу АРР [Naruse et al., 1998]. Таупатії і клубки Тяжкі нейродегенеративні захворювання, відАполіпопротеїн Ε мінні від AD, характеризуються агрегацією тауАполіпопротеїн Ε звичайно асоційований з хобілків у нерозчинні філаменти у нейронах і глії, що лестерином, але його також знаходять у бляшках і приводять до дисфункції та смерті. Зовсім нещоклубках у головному мозку при AD. Незважаючи на те, що алелі 1-3 вважаються не залученими до AD, давно декілька груп дослідників, які вивчали сім'ї з різними видами успадковуваного недоумства, що існує значима кореляція між присутністю алеля відрізняється від AD, виявили першу м утацію у гені ΑΡOΕ-e4 і розвитком AD з пізнім початком тау-білка на хромосомі 17 [Clark et al., 1998; Hutton [Strittmatter et al., 1993]. Однак це являє собою et al., 1998; Poorkaj et al., 1998; Spillantini et al., фактор ризику, а не пряму причину як у випадку 1998]. У цих сім'ях мутації в гені та у-білка виклимутацій пресеніліну і АРР, і це не обмежено сімейкають смерть нейронів і недоумство. Такі розлади, ною AD. що розділяють деякі з характеристик з AD, але Шляхи, при яких у зв'язку з білком АРОЕ e4 відрізняються у деяких важливих аспектах, узазбільшується ймовірність розвитку AD, достовірно гальнено називають «фронто-темпоральне недоне відомі, але одна можлива теорія полягає у тоумство і паркінсонізм, зчеплені з хромосомою 17» му, що він полегшує накопичення Αb, і це сприяє (FTDP-17). Вони являють собою захворювання, зменшенню віку початку AD, або присутність або такі як хвороба Паркінсона, деякі форми аміотровідсутність конкретних алелів АРОЕ може впливафічного бічного склерозу (ALS), кортикобазальна ти на спосіб, яким нейрони відповідають на подегенерація, прогресуючі супрануклеарний парашкодження [Buttini et al., 1999]. ліч і хвороба Піка, всі з яких характеризуються Показано, что Аро Α1 також є амілоїдогенним. аномальним накопиченням тау-білка. Інтактний Аро A1 in vitro самостійно може формуІнші неврологічні захворювання, подібні до AD вати фібрили, подібні до амілоїду, які забарвлюІснують важливі паралелі між AD та іншими ються конго червоним [Am J. Pathol. 147 (2): 238неврологічними захворюваннями, включаючи прі244 (Aug. 1995), Wisniewski Т., Golabek A.A., Kida онні захворювання (такі як куру, хвороба КрейцΕ., Wisniewski K.E., Frangione В.]. фельдта-Якоба і бичачий губчатий енцефаліт), Очевидно, існують суперечливі результати, які хворобу Паркінсона, хворобу Гентінгтона і фронтовказують на те, що мають місце позитивні ефекти темпоральну деменцію. Всі вони пов'язані з накоалеля ΑΡΟΕ-e4 відносно зменшення симптомів пиченням у головному мозку аномальних білків. І ментальної втрати у порівнянні з іншими алелями AD, і пріонні захворювання викликають недоумст[Stern, Brandt, 1997, Annals of Neurology 41]. во і смерть, і асоційовані з формуванням нерозНейрофібрилярні клубки чинних фібрил амілоїду, але з мембранних білків, Дана друга ознака AD полягає в аномальному які відрізняються один від одного. накопиченні перекручених ниток, що виявляються Вчені, що вивчають хворобу Паркінсона, друвсередині нервових клітин. Головний компонент гий найбільш частий розлад після AD, виявили клубків являє собою одну з форм білка, що назиперший ген, зчеплений з даним захворюванням. вається тау (t). У центральній нервовій системі Даний ген кодує білок, що називається синуклеїн, тау-білки найбільш відомі своєю здатністю зв'язуякий, що цікаво, також виявлений в амілоїдних ватися з мікротрубочками, що являють собою одну бляшках головного мозку пацієнтів з AD [Lavedan зі складових внутрішньої підтримуючої структури C, 1998, Genome Res. 8 (9): 871-80]. Дослідники клітини, або цитоскелет, і допомагати їм стабілізутакож виявили, що генетичні дефекти при хворобі ватися. Однак при AD тау-білки змінені хімічно, і Гентінгтона, в іншому прогресуючому нейродегетакі змінені тау-білки більше не здатні стабілізуванеративному захворюванні, яке викликає недоумсти мікротрубочки, будучи причиною їх дезінтегратво, служать причиною того, що білок Гентінгтона ції. Таке руйнування транспортної системи може утворює нерозчинні фібрили, дуже подібні до фібспочатку привести до порушення зв'язків між неррил Αb при AD і білкових фібрил при прінному завовими клітинами, а пізніше може привести до хворюванні [Scherzinger Ε, et al, 1999, PNAS U.S.A. смерті нейронів. 96 (8): 4604-9]. При AD хімічно змінені тау-білки переплітаВчені також виявили новий ген, який у мутантються у парні спіральні філаменти, що являють ній формі відповідає за сімейне недоумство ангсобою дві нитки тау-білків, накручених одна налійців (FBD), рідке спадкове захворювання, що вколо іншої. Ці філаменти являють собою основну викликає тяжкі рухові порушення і прогресуюче речовину, що виявляється у нейрофібрилярних недоумство, подібне до того, що спостерігається клубках. В одному нещодавньому дослідженні бупри AD. При біохімічному аналізі фібрил амілоїду, ли виявлені нейрофібрилярні зміни менш ніж у 6 виявлених у бляшках при FBD, знайдений новий процентах нейронів у визначеній частині гіпокампу пептид, що називається Abri [Vidal et al., 1999]. у головному мозку здорових, більш ніж у 43 процеМутація в особливій точці у даному гені приводить нтах ци х нейронів у людей, які померли від помірдо продукції більш довгого, ніж звичайний, білка ної AD, і у 71 проценті цих нейронів у людей, які Вrі. Пептид Abri, який відрізається від мутантного померли від тяжкої AD. Коли вивчали загибель кінця білка Вrі, відкладається у вигляді фібрил нейронів, виявили подібну прогресію. Докази такоамілоїду. Вважають, що такі бляшки ведуть до го типу підтримують ідею про те, що формування нейрональної дисфункції та недоумства, що хараклубків і загибель нейронів прогресують разом у ктеризує FBD. 13 85815 14 у людини рівень антитіл проти її власних білків. Імунізація Αb Таким чином, перед тим як можна буде розглядати Імунна система звичайно бере участь в очищенні від чужорідних білків і білкових частинок в які-небудь випробування на людині, необхідно вирішити численні проблеми безпеки і ефективноорганізмі, але накопичення, асоційовані з вказанисті. ми вище захворюваннями, головним чином склаТаким чином, робота Schenk et al. показує, що даються з власних білків, отже, інтерпретація ролі якщо можна викликати сильну імунну відповідь до імунної системи у контролі даних захворювань менш очевидна. Крім того, накопичення розташовласних білків у білкових відкладеннях у центральній нервовій системі, таких як бляшки, що форвані у відділах (ЦНС), звичайно відділених від імумуються при AD, можна і запобігти формуванню нної системи, обидва цих факти дозволяють принакопичень, і можна також усун ути вже сформовапустити, що будь-яка вакцина або ні бляшки. імунотерапевтичний підхід виявляться безуспішними. Останнім часом клінічні спроби із застосуванПроте, вчені нещодавно спробували імунізуваням вакцин Αb, що обговорюються вище, обмежути мишей вакциною, що складається з гетерологівалися внаслідок несприятливих ефектів: у ряду вакцинованих суб'єктів розвивався хронічний енчного людського Αb і речовини, відомої як стимуцефаліт, який міг виникати внаслідок некерованого лятор імунної системи [Schenk et al., 1999 і WO 99/27944]. Вакцину тестували у конкретній моделі аутоімунітету проти Αb у ЦНС. AD у трансгенних мишей з мутантним геном АРР Метою даного винаходу є надання нових сполюдини, вставленим у ДНК миші. У мишей в міру собів лікування станів, таких як AD, що характериїх старіння продукувався модифікований білок зуються накопиченням амілоїду. Додаткова мета АРР і розвивалися амілоїдні бляшки. Дану мишачу являє собою розробку аутовакцини проти амілоїду модель використовували для тестування можлидля розробки нового способу лікування AD та інвого ефекту вакцинації проти модифікованого ших патологічних розладів, асоційованих з відклатрансгенного АРР людини на формування бляшок. денням амілоїду. У першому експерименті одній групі трансгенних Суть винаходу мишей щомісяця вводили ін'єкції вакцини, почиТут описане застосування способу аутовакцинаючи з віку у 6 тижнів і закінчуючи у віці 11 тижнів. нації для вироблення сильних імунних відповідей Друга гр упа мишей не одержувала ін'єкцій і служипроти інакше неімуногенних АРР і Αb. Також опила контрольною групою. До віку 13 місяців у мисане одержання таких вакцин для профілактики, шей в контрольній групі були наявні бляшки, що можливого лікування або ослаблення симптомів охоплюють від 2 до 6 процентів їх головного мозку. захворювань, асоційованих з відкладеннями аміНавпаки, у імунізованих мишей практично не було лоїду. бляшок. Таким чином, у своєму широкому і найбільш У другому експерименті вчені починали проповному обсязі, даний винахід відноситься до споводити ін'єкції на 11 місяці, коли деякі бляшки вже собу знижувальної регуляції білка-попередника розвинулися. Через 7 місяців контрольні трансгенамілоїду (АРР) або бета-амілоїду (Αb) in vivo у ні миші мали у 17 разів більшу кількість бляшок у тварин, включаючи людину, де спосіб включає в головному мозку, тоді як у мишей, що одержували себе ефективну презентаціюімунній системі твавакцину, відбувалося 99%-е зменшення кількості рини імуногенно ефективної кількості щонайменше бляшок у порівнянні з 18-місячними контрольними одного аналога АРР або Αb, який містить в одній трансгенними мишами. Було виявлено, що у демолекулі щонайменше один В-клітинний епітоп яких мишей деякі з попередніх відкладень бляшок АРР і/або Αb і щонайменше один чужорідний Твидалялися внаслідок лікування. Також виявили, хелперний епітоп (ТН-епітоп), так що імунізація що інші пошкодження, асоційовані з бляшками, тварини даним аналогом викликає продукцію антакі як запалення і аномальні процеси у нервових титіл проти аналогів АРР або Αb тварини, де анаклітинах, в результаті імунізації зменшувалися. лог Таким чином, вказане вище являє собою поa) являє собою поліамінокислоту, що складапереднє дослідження на мишах, і, наприклад, вчеється щонайменше з однієї копії підпослідовності ним необхідно з'ясувати, чи залишаються вакцизалишків 672-714 в SEQ ID NO:2, де чужорідний новані миші здоровими в інших аспектах і чи ТН-епітоп вводять за допомогою додавання і/або нормально зберігається пам'ять у вакцинованих вставки, і/або делеції, і/або заміни амінокислот, де мишей. Більш того оскільки мишача модель не підпослідовність вибрана з групи, що складається повністю відображає AD (у тварин не розвиваютьіз залишків 1-42, залишків 1-40, залишків 1-39, зася нейрофібрилярні клубки, і при цьому велика лишків 1-35, залишків 1-34, залишків 1-28, залишкількість з їх нейронів не гине), необхідні додаткові ків 1-12, залишків 1-5, залишків 13-28, залишків 13дослідження для визначення того, чи володіє лю35, залишків 17-28, залишків 25-35, залишків 35дина подібною до мишачої реакцією або реакцією, 40, залишків 36-42 і залишків 35-42 амінокислотної відмінною від мишачої. Інша проблема для розпослідовності, що складається з амінокислотних гляду полягає у тому, що спосіб, можливо, може залишків 673-714 SEQ ID NO:2; і/або «лікувати» накопичення амілоїду, але не зупиняти b) являє собою поліамінокислоту, що містить розвиток недоумства. чужорідний ТН-епітоп і розірвану послідовність Технічні проблеми також являють собою велиАРР або Αb, так, що аналог не містить жодної підкі складності. Наприклад, малоймовірно, якщо взапослідовності SEQ ID NO:2, яка продуктивно зв'ягалі можливо, застосування даного способу для створення вакцини, що дає можливість підвищити 15 85815 16 зується з молекулами МНС класу II, ініціюючи Ту контакт з відповідним активованим полігідроксиклітинну відповідь; і/або полімером, пептиди А і В приєднуються за допоc) являє собою поліамінокислоту, що включає могою активної групи у співвідношенні, що відповів себе чужорідний ТН-епітоп і одержані з АРР або дає вихідному співвідношенню між даними двома речовинами у суміші пептидів. Для подробиць див. Αb амінокислоти, і включає в себе 1 єдиний залиприклад 4. шок метіоніну, розташований на С-кінці аналога, Визначення причому інші залишки метіоніну в АРР або Αb і в Далі буде визначений і детально пояснений чужорідному ТН-епітопі заміщені або видалені і ряд термінів, що застосовуються у даному описі і переважно заміщені лейцином або ізолейцином; формулі винаходу, для пояснення меж винаходу. і/або Терміни "амілоїд" і "амілоїдний білок", що заd) являє собою кон'югат, що включає в себе стосовуються тут, є взаємозамінними і означають полігідроксиполімерний кістяк, до якого окремо клас білкових нерозгалужених фібрил невизначеприєднана поліамінокислота, як визначено в а), ної довжини. Фібрили амілоїду виявляють здаті/або поліамінокислота, як визначено у b), і/або ність до забарвлення конго червоним і мають поліамінокислота, як визначено у с); і/або складчасту b-структуру, в якій поліпептидні ланцюe) являє собою кон'югат, що включає в себе полігідроксиполімерний кістяк, до якого окремо ги організовані у b-шари. Амілоїд, як правило, поприєднані 1) чужорідний ТН-епітоп і 2) поліамінокиходить з амілоїдогенних білків, які володіють струслота, вибрана з групи, що складається з підпосктурами попередників, що сильно відрізняються, лідовностей, як визначено в а), розірваної посліале всі з яких можуть зазнавати структурної конверсії в аномально укладену форму, що являє довності АРР або Αb, як визначено в b), і одержану з АРР або Αb амінокислотну послідовність, що собою будівельний блок протофіламенту спіралі bшару. Звичайно діаметр фібрил амілоїду змінювключає в себе 1 єдиний залишок метіоніну, розється приблизно від 70 до 120Å. ташований на С-кінці, причому інші залишки метіТермін «амілоїдогенний білок» призначений оніну в АРР або Αb і в чужорідному ТН-епітопі задля позначення поліпептиду, який залучений до міщені або видалені і переважно заміщені утворення відкладень амілоїду, або, по суті, є часлейцином або ізолейцином. тиною відкладень або є частиною біосинтетичного Правонаступником даного винаходу раніше шляху, що приводить до утворення відкладень. була подана міжнародна патентна заявка, що відОтже, прикладами амілоїдогенних білків є АРР і носиться до безпечних стратегій вакцинації проти Αb, але амілоїдогенними білками також можуть амілоїдогенних пептидів, таких як АРР або Αb, пор. вважатися і білки, залучені до їх метаболізму. [WO 01/62284]. Дана заявка не була опублікована «Амілоїдний поліпептид» тут призначений для на момент дати подачі даної заявки і, крім того, не позначення поліпептидів, що включають в себе містить деталей, що відносяться до вказаних вище амінокислотну послідовність амілоїдогенних білків, придатних аналогів АРР і Αb. які обговорюються вище, що походять від людини Винахід також відноситься до аналогів АРР і або інших ссавців (або їх укорочені варіанти, що Αb, також як до фрагментів нуклеїнових кислот, що розділяють з інтактним амілоїдогенним білком іскодують їх підмножину. Також винахід відноситься тотну кількість В-клітинних епітопів), отже, амілоїдо імуногенних композицій, що включають в себе догенний поліпептид може, наприклад, включати в аналоги або фрагменти нуклеїнових кислот. себе істотну ділянку попередника амілоїдогенного Фігура 1: Схематичне зображення варіантів поліпептиду (у випадку Αb один з можливих амілоAuto vac, що дістали з білка-попередника амілоїду їдних поліпептидів може походити з АРР). Також з метою виклику відповідей за допомогою антитіл даний термін включає в себе неглікозильовані фопроти білка Αb Αb-43 (або С-100). АРР схематично рми амілоїдогенних поліпептидів, що одержують у показаний вгорі фігури, а схематичні конструкції, прокаріотичних системах, а також форми з різними що залишилися, показують, що модельні епітопи профілями глікозилювання через застосування, Р2 і Р30 заміщають різні укорочені продукти АРР наприклад, дріжджів або інших еукаріотичних сисабо вставлені в них. На Фігурі чорний блок означає тем, що експресують, які не належать до ссавців. сигнальну послідовність АРР, коса штриховка у Однак необхідно зазначити, що, коли застосовудвох напрямах означає екстрацелюлярну ділянку ють термін "амілоїдогенний поліпептид", це ознаАРР, темна вертикальна штриховка відповідає чає, що поліпептид, який розглядається, при претрансмембранному домену АРР, світла вертиказентації тваринам, що піддаються впливу, льна штриховка відповідає внутрішньоклітинному звичайно є неімуногенним. Іншими словами, амідомену АРР, жирна коса штриховка означає епітоп лоїдогенний поліпептид являє собою власний біР30 і тонка коса штриховка означає епітоп Р2. Ралок або аналог такого власного білка, який звимка з суцільних ліній означає Αb-42/43, а рамка з чайно не дає початку імунній відповіді проти суцільних ліній разом з рамкою з пунктирних ліній амілоїдогенного білка тварини, що розглядається. означають С-100. «Abeta» означає Αb. «Аналог» являє собою молекулу, одержану з Фігура 2: Схематичне зображення здійснення АРР або Αb, що містить одну або декілька змін у синтезу імуногенних кон'югатів, що застосовуютьсвоїй молекулярній структурі. Таку зміну, наприся у більшості випадків. Синтезують і змішують клад, можна здійснити при злитті поліамінокислот пептид А (будь-яка антигенна послідовність, наАРР або Αb з відповідним для злиття партнером приклад, послідовність Αb, описана тут) і пептид В (тобто зміна у первинній структурі, яка виключно (амінокислотна послідовність, що включає в себе включає в себе С -і/або N-кінцеві додавання аміТ-хелперний епітоп). Після того, як вони приходять нокислотних залишків) і/або можна здійснювати у 17 85815 18 вигляді вставок і/або делецій і/або замін амінокистипу. Знижувальну регуляцію можна одержати за лотної послідовності поліпептиду. Також у термін допомогою декількох механізмів, з яких проста включені дериватизовані молекули, одержані з взаємодія з амілоїдом за допомогою зв'язування антитіл, так, щоб запобігти аномальній агрегації, АРР або Αb, пор. обговорення модифікацій АРР являє собою найбільш простий. Однак в об'єм даабо Αb нижче. У деяких випадках аналог можна ного винаходу також входить те, що зв'язування сконструювати з тим, щоб зменшити або навіть антитіл приводить до видалення амілоїду погливиключити здатність спричиняти появу антитіл наючими клітинами (такими як макрофаги та інші проти нормального білка(ів)-попередника(ів) аміклітини, що фагоцитують), і що антитіла взаємоділоїду, таким чином уникаючи небажаної взаємодії ють з іншими амілоїдогенними поліпептидами, які з (фізіологічно нормальною) неагрегованою форприводять до утворення амілоїду. Додатковою мою поліпептиду, що є попередником амілоїдного можливістю є те, що антитіла зв'язують Αb поза білка. Необхідно зазначити, що, як припускається, ЦНС, таким чином видаляючи Αb з ЦНС за допозастосування як вакцини для людини чужорідного могою простого принципу дії мас. аналога (наприклад, собачого або свинячого анаВираз «ефективна презентація ... імунній сислога) АРР або Αβ людини створить бажаний імунітемі» призначений для позначення того, що імунна система тварин у контрольованому режимі зазнає тет проти АРР або Αb. Таке застосування чужорідімуногенної провокації імунної відповіді. Як стане ного аналога також розглядається як частина зрозуміло з опису нижче, таку провокацію відповіді винаходу. імунної системи можна провести рядом способів, Термін «поліпептид» у даному контексті принайбільш важливі з яких являють собою вакциназначений для позначення і коротких пептидів від 2 до 10 амінокислотних залишків, і олігопептидів від цію поліпептидом, що містить «фармацини» (тобто вакцину, яку вводять для лікування поточної хво11 до 100 амінокислотних залишків, і поліпептидів роби або поліпшення стану при цій хворобі) або з більш ніж 100 амінокислотних залишків. Більш вакцинацію нуклеїновою кислотою, що містить того, також припускається, що даний термін охоп«фармацини». Важливим результатом для досяглює білки, тобто функціональні біологічні молекули, які включають в себе щонайменше один полінення є те, щоб імунокомпетентні клітини тварини протистояли антигену імунологічно ефективним пептид; коли такі біологічні молекули містять способом, тоді як точний спосіб досягнення такого щонайменше два поліпептиди, останні можуть результату є менш важливим для ідеї відповідно формувати комплекси, бути ковалентно зв'язанидо винаходу, що лежить в основі даного винаходу. ми або можуть бути зв'язаними нековалентно. Поліпептид(и) у білку можуть бути глікозильованими Термін «імуногенно ефективна кількість» має значення, звичайно прийняте у даній області, тобі/або ліпоільованими, і/або включати в себе прото він означає кількість імуногена, якої досить для стетичні групи. Термін «поліамінокислота» також індукції імунної відповіді, що значимо охоплює паеквівалентний терміну «поліпептид». тогенні речовини, які розділяють загальні імунолоТерміни «Т-лімфоцит» і «Т-клітина» застосовують поперемінно для лімфоцитів, що походять з гічні властивості з імуногеном. тимуса, які відповідають за різні види імунної відКоли кажуть, що АРР або Αb «модифіковані», повіді, опосередкованої клітинами, а також за хелтут це означає, що проводили хімічну модифікацію перну активність у гуморальній імунній відповіді. поліпептиду АРР або Αb. Така модифікація може Подібним чином терміни "В-лімфоцит" і "В-клітина" являти собою одержання похідних (наприклад, застосовують поперемінно для лімфоцитів, які алкілування) визначених амінокислотних залишків продукують антитіла. у послідовності, але як можна буде зрозуміти з Термін «підпослідовність» означає будь-який опису нижче, переважні модифікації включають в безперервний відрізок щонайменше з 3 амінокиссебе зміни первинної структури амінокислотної лот або, коли доречно щонайменше з 3 нуклеотипослідовності. дів, безпосередньо одержаної з природних аміноКоли обговорюють "аутотолерантність до АРР кислотної послідовності або послідовності або Αb", зрозуміло, що оскільки поліпептид являє нуклеїнових кислот амілоїду, відповідно. собою власний білок популяції, що підлягає вакциТермін «тварина» у даному контексті, як пранації, у звичайних індивідів у популяції не виникає вило, призначений для позначення виду тварини імунної відповіді проти поліпептиду; однак це не (переважно ссавця), такої як Homo sapiens, Canis можна виключити, оскільки індивіди, що рідко зуdomesticus і т.п., а не тільки однієї-єдиної тварини. стрічаються у популяції тварин, можуть бути здатні Однак цей термін також означає популяцію такого продукувати антитіла до нативного поліпептиду, виду тварин, оскільки важливо, щоб всі індивіди, наприклад, як частина аутоімунного розладу. Приімунізовані способом відповідно до даного винанаймні, тварина звичайно аутотолерантна тільки ходу, володіли по суті однаковими АРР або Αb, до свого власного АРР або Αb, однак не можна якщо брати до уваги імунізацію тварин одним і тим виключати, що дана тварина також буде толеранже імуногенним(и) засобом(ами). Фахівцям зрозутною до аналогів, одержаних від іншого виду тваміло, що тварина у даному контексті являє собою рин або з популяції з іншим фенотипом. живу істоту з імунною системою. Переважно, щоб "Чужорідний Т-клітинний епітоп" (або: «Чужотварина була хребетною, такою як ссавець. рідний Т-лімфоцитарний епітоп») являє собою Під терміном «знижувальна регуляція АРР або пептид, що здатний зв'язуватися з молекулою Αb in vivo» тут мають на увазі зменшення у живому МНС і стимулює Т-клітини у виду тварин. Переваорганізмі загальної кількості накопиченого амілоїжні чужорідні Т-клітинні епітопи являють собою дного білка (або амілоїду як такого) відповідного "змішані" епітопи, тобто епітопи, що зв'язуються 19 85815 20 основною частиною молекул МНС конкретного або введення у молекулу гр уп, які полегшують класу у виду тварин або популяції. Відома тільки позиціонування. Дані проблеми детально обговодуже обмежена кількість таких змішаних Трюються нижче. клітинних епітопів, і вони детально обговорюються "Стимуляція імунної системи" означає, що ренижче. Змішані Т-клітинні епітопи також позначачовина або композиція речовин виявляє спільний, ють як "універсальні" Т-клітинні епітопи. Необхідно неспецифічний імуностимулювальний ефект. Ряд зазначити, що для імуногенів, які застосовуються ад'ювантів і передбачувані ад'юванти (такі як вивідповідно до даного винаходу, щоб бути ефектизначені цитокіни) володіють здатністю стимулювавними якомога в більшій частині популяції тварин, ти імунну систему. Результат застосування імуноможуть бути необхідні 1) вставка декількох чужорістимулювальних засобів являє собою підвищену дних Т-клітинних епітопів в один і той же аналог «готовність» імунної системи, що означає, що спіабо 2) одержання декількох аналогів, де кожний з льна або подальша імунізація імуногеном викликає аналогів володіє різним вставленим змішаним епізначно більш ефективну імунну відповідь у порівтопом. Необхідно також зазначити, що ідея про нянні з окремим застосуванням імуногена. чужорідні Т-клітинні епітопи також включає в себе «Продуктивне зв'язування» означає зв'язуванзастосування прихованих Т-клітинних епітопів, ня пептиду з молекулою МНС (класу І або II), щоб тобто епітопів, що одержані з власних білків і вибуло можливо стимулювати Т-клітини, які зв'язукликають імунологічну реакцію тільки тоді, коли ються з клітинами, які презентують пептид, зв'язавони існують в ізольованій формі, не будучи часний з молекулою МНС. Наприклад, пептид, зв'язатиною власного білка, що розглядається. ний з молекулою МНС класу II на поверхні АРС, є «Чужорідний Т-хелперний лімфоцитарний епіпродуктивно зв'язаним, якщо дана АРС стимулює топ» (чужорідний ТН-епітоп) являє собою чужорідТН-клітини, що зв'язуються з комплексом презенний Т-клітинний епітоп, який зв'язується з молекутований пептид-МНС класу II. лою МНС класу II і який може бути представлений Переважні здійснення знижувальної регуляції на поверхні клітини (АРС), що презентує епітоп, у амілоїду Переважно, щоб аналог, який застосовузв'язаному з молекулою МНС класу II виді. ється як імуноген у способі відповідно до винахо«Функціональна ділянка» (біологічної) молекуду, являв собою модифіковану молекулу АРР або ли у даному контексті означає ділянку молекули, Αb, де присутня щонайменше одна зміна в амінояка відповідає щонайменше за один з біохімічних кислотній послідовності АРР або Αb, оскільки у або фізіологічних ефектів, що викликаються молецьому випадку шанси одержання дуже значного кулою. У даній області добре відомо, що багато порушення аутотолерантності сильно полегшені, ферментів та інших ефекторних молекул володіщо очевидно, наприклад, з результатів, представють активною ділянкою, що відповідає за ефекти, лених тут у прикладі 2, де імунізацію диким типом які викликаються молекулою, що розглядається. Αb порівнюють з імунізацією варіантною молекуІнші ділянки молекули можуть служити для цілей лою Αb. Показано [у Dalum I et al., 1996, J. стабілізації або поліпшення розчинності, і тому їх Immunol. 157: 4796-4804], що потенційно аутоімунможна видалити, якщо дані цілі не мають значення ні В-лімфоцити, які розпізнають власні білки, фізіу контексті визначеного здійснення даного винахоологічно присутні у нормальних індивідів. Однак ду. Наприклад, в АРР або Αb можливим є застосудля індукції цих В-лімфоцитів для фактичної провання визначених цитокінів як груп, що модифікудукції антитіл, що реагують з відповідними власють (пор. докладну дискусію нижче), і в такому ними білками, необхідне сприяння Т-хелперних випадку проблема стабільності може бути несутлімфоцитів (ТН-клітини, або ТН-лімфоцити), що тєвою, оскільки зв'язування з АРР або Αb може продукують цитокіни. Звичайно така допомога не забезпечувати необхідну стабільність. забезпечується, оскільки Т-лімфоцити, як правило, Термін «ад'ювант» має те ж значення, яке є не розпізнають Т-клітинні епітопи, одержані з влазагальноприйнятим в області технології вакцин, сних білків, коли вони представлені клітинами тобто речовина або композиція речовин, яка 1) не (АРС), що презентують антиген. Однак якщо заздатна самостійно викликати специфічну імунну безпечити елемент "чужорідності" у власному білвідповідь проти імуногена вакцини, але яка, 2) ку (тобто ввести імунологічно значиму модифікапроте, здатна посилити імунну відповідь проти цію), Т-клітини, які розпізнають чужорідний імуногена. Або, іншими словами, вакцинація оделемент, активуються при розпізнаванні чужорідним ад'ювантом не забезпечує імунну відповідь ного епітопу на АРС (передусім, такий, як мононупроти імуногена, вакцинація імуногеном може або клеарна клітина). Поліклональні В-лімфоцити (що не може дати початок імунній відповіді проти імутакож є АРС), здатні до розпізнавання власних ногена, але комбінована вакцинація імуногеном і епітопів на модифікованих власних білках, також ад'ювантом викликає імунну відповідь на імуноген, інтерналізують антиген і згодом представляють яка є більш сильною, ніж викликана одним імуночужорідний(і) Т-епітоп(и) з нього, а активовані Тгеном. лімфоцити таким аутоімунним поліклональним В«Позиціонування або націлювання» молекули лімфоцитам згодом забезпечують допомогу цитоу даному контексті призначене для позначення кінами. Оскільки антитіла, що продукуються даниситуації, коли молекула при введенні тварині пеми поліклональними В-лімфоцитами, реагують з реважно з'являється у визначеній(их) тканині(ах) різними епітопами на модифікованому поліпептиабо переважно асоційована з визначеними клітиді, включаючи ті, які також представлені на нативнами або клітинними типами. Ефекту можна досяному поліпептиді, індукується антитіло, що перегти рядом способів, включаючи формування молехресно реагує з немодифікованим власним білком. кули у композицію, що полегшує позиціонування, На закінчення, Т-лімфоцити можуть бути приведе 21 85815 22 ні в дію так, як якби популяція поліклональних Вчужорідному ТН-епiтопі від природи, або тому, що лімфоцитів розпізнавала б повністю чужорідний його туди вставили або додали. Отже, також переантиген, тоді як фактично тільки вбудований(і) важно, щоб ділянка аналога, яка включає ТНепітоп(и) є чужорідним(и) для хазяїна. Таким чиепітоп, також не містила метіоніну, виключаючи ном, індукуються антитіла, здатні до перехресної можливе С-кінцеве розташування метіоніну. реакції з немодифікованими власними антигенами. Основна причина для видалення всіх метіоніУ даній області відомо декілька шляхів модинів, крім одного, полягає у тому, що стає можлифікації власного антигену пептиду для досягнення вим рекомбінантно одержувати полімерні аналоги, порушення аутотолерантності. Але все-таки переякі можна послідовно відщеплювати бромціаном з важно, щоб аналог відповідно до даного винаходу виходом окремого аналога. Перевага полягає у включав в себе тому, що рекомбінантна продукція полегшує даний - щонайменше одну першу введену гр упу, яка шлях. націлює модифіковану молекулу на клітину (АРС), Фактично, як правило, переважно, щоб всі що презентує антиген, і/або аналоги АРР або Αb, які застосовуються відповід- щонайменше одну другу введену гр упу, яка но до даного винаходу, володіли характерною ристимулює імунну систему, і/або сою простого включення в себе одного-єдиного - щонайменше одну третю введену груп у, яка метіоніну, розташованого в аналогу як С-кінцева оптимізує представлення аналога імунній системі. амінокислота, і щоб всі інші метіоніни або в амілоОднак всі ці модифікації потрібно проводити їдогенному поліпептиді, або у чужорідному ТНпоки в АРР або Αβ зберігається істотна частина епітопі були видалені або заміщені іншою амінокивихідних В-клітинних епітопів, оскільки розпізнаслотою. вання В-лімфоцитами нативної молекули таким Додаткова цікава мутація являє собою делечином посилюється. цію або заміщення фенілаланіну у положенні 19 В одному з переважних здійснень ковалентно Αb-43, а особливо переважно, щоб мутація являла або нековалентно введені бічні групи (у вигляді собою заміну фенілаланінового залишку на пролін. чужорідних Т-клітинних епітопів або вказаних ви ще Інші цікаві поліамінокислоти для застосування першої, другої і третьої груп). Це означає, що відв аналогах являють собою укорочені частини білка галуження з амінокислотних залишків, одержані з Αb-43. їх можна застосовувати в імуногенних анаАРР або Αb, дериватизовані без зміни первинної логах відповідно до даного винаходу. Особливо амінокислотної послідовності або щонайменше переважними є укорочені частини Αb (1-42), Αb (1без внесення змін у пептидних зв'язках між індиві40), Αb (1-39), Αb (1-35), Αb (1-34), Αb (1-28), Αb (1дуальними амінокислотами у ланцюгу. 12), Α (1-5), Αb (13-28), Αb (13-35), Αb (17-28), Αb В альтернативному і переважному здійсненні (25-35), Αb (35-40), Αb (36-42) і Αb (35-42) (де чисзастосовують амінокислотну заміну і/або делецію, ла у дужках означають відрізки амінокислот Αb і/або вставку, і/або додавання (які можна провести 43, які складають відповідний фрагмент: наприза допомогою рекомбінантних способів або за доклад, Αb (35-40) ідентичний амінокислотам 706помогою пептидного синтезу; модифікації, що 711 в SEQ ID NO:2). Всі ці варіанти з укороченими включають в себе більш довгі ділянки з амінокисчастинами Αb-43 можна одержати з описаними тут лот, можуть приводити до утворення гібридних фрагментами Αb, конкретно з варіантами 9, 10, 11, поліпептидів). Одну з особливо переважних версій 12, і 13, вказаними у прикладі 1. даного здійснення являє собою технологія, описаНаступна формула описує молекулярні консна у [WO 95/05849], де описаний спосіб знижуватрукції, що відносяться до винаходу: льної регуляції власних білків шляхом імунізації аналогами власних білків, де ділянка амінокислот(МOD1) S1(амілоїде1)n1(МOD2)S2(амілоїде2)n2 ... ної послідовності (ряд послідовностей) замінена (І) (МОВ х)s х(амілоїдех) nх відповідною ділянкою амінокислотної послідовності(ей), кожна з яких містить чужорідний імунодоміде амілоїде1 - амілоїдех являють собою x Внантний Т-клітинний епітоп, тоді як одночасно в клітинний епітоп, що містить підпослідовності АРР аналогу зберігається повна третинна структура або Αb, які незалежно є ідентичними або неідентивласного білка. Однак для цілей даного винаходу чними, і які можуть містити чужорідні бічні групи, x істотно, якщо модифікація (чи то вона є вставкою, являє собою число ³3, n1-nx являють собою x чидодаванням, делецією або заміною) приводить до сел ³0 (щонайменше, одне ³1), MOD 1-MOD x являутворення чужорідного Т-клітинного епітопу і одють собою x модифікацій, внесених між представночасно зберігає значну кількість В-клітинних епіленими В-клітинними епітопами, і s1-sx являють топів в АРР або Αb. Однак для одержання максисобою x чисел ³0 (щонайменше одне³1, якщо у мальної ефективності в індукції імунної відповіді послідовності амілоїдех не внесена жодна бічна переважно, щоб у модифікованій молекулі зберігрупа). Таким чином, враховуючи загальні функцігалася повна третинна структура АРР або Αb. ональні обмеження на імуногенність конструкції, У деяких випадках переважно, щоб АРР або винахід допускає всі види перестановок оригінаΑb, або їх фрагменти були мутантними. Особливо льної послідовності АРР або Αb і всі види модифіпереважними є варіанти замін, де метіонін у полокацій у ній. Таким чином, у винахід включені моженні 35 в Αb-43 заміщений, переважно лізином дифікований АРР або Αb, одержані за допомогою або ізолейцином або просто делетований. Особпропускання частин послідовності, які, наприклад, ливо переважні аналоги містять один-єдиний метівиявляють in vivo несприятливі ефекти, або проонін, розташований на С-кінці, або тому, що він пускання частин, які звичайно є внутрішньоклітинзустрічається в амілоїдогенному поліпептиді або 23 85815 24 ними і, таким чином, можуть дати початок небажалімфоцитарних епітопів АРР або Αb (наприклад, ним імунологічним реакціям. формула І, де щонайменше один В-клітинний епіОдна переважна версія конструкцій, окреслетоп представлений у двох положеннях). Даного них вище, коли застосовна, являє собою конструкефекту можна досягти різними шляхами, наприції, де підпослідовність, що містить В-клітинний клад, шляхом простого одержання гібридних поліепітоп амілоїдного білка, не експонована екстрапептидів, що містять структур у (одержаний з АРР целюлярно у попередньому поліпептиді, з якого або Αb поліпептид)m, де m являє собою число ³2, і одержаний амілоїд. Такий вибір епітопів служить потім ввести модифікації, які обговорюються тут, гарантією того, що не утворяться антитіла, які мощонайменше в одну з послідовностей АРР або Αb. гли б реагувати з клітинами, що продукують попеПереважно, щоб модифікації, які вводяться, вклюредник, і отже, імунна відповідь, що виробляється, чали в себе щонайменше одну дуплікацію епітопу стає обмежено направленою імунною відповіддю В-лімфоциту і/або введення гаптену. Дані здійспроти небажаних накопичень амілоїду. Наприклад, нення, включаючи множинні представлення вибу цьому випадку можна індукувати імунітет проти раних епітопів, особливо переважні у ситуаціях, де епітопів АРР або Αb, експонованих в екстрацелюяк компоненти засобів для вакцин придатні просто лярну фазу, тільки коли вони вільні від будь-якого невеликі частини АРР або Αb. зв'язку з клітинами, що їх продукують. Як вказано вище, введення чужорідного ТЗбереження істотної частини В-клітинних епіклітинного епітопу можна досягти щонайменше топів або навіть всієї третинної структури білка, що вставкою, додаванням, делецією або заміною одпіддається модифікації, як тут бажано, можна донієї амінокислоти. Зрозуміло, у звичайній ситуації сягти декількома шляхами. Один з них являє совідбувається введення більш ніж однієї зміни в бою просте одержання поліклональної антисироамінокислотну послідовність (наприклад, вставка ватки, направленої проти поліпептиду, що або заміна цілого Т-клітинного епітопу), але важрозглядається (наприклад, антисироватка, одерливою метою для досягнення є те, що аналог при жана від кролика), і застосування даної антисиропроцесуванні клітиною (АРС), яка представляє ватки згодом як тестового реагенту (наприклад, антиген, дасть початок такому чужорідному імуноконкурентної ELISA) проти одержаних модифікодомінантному Т-клітинному епітопу, представлеваних білків. Модифіковані версії (аналоги), які ному у зв'язку з молекулою МНС класу II на поверреагують з антисироваткою у тому ж об'ємі, що і хні АРС. Таким чином, якщо амінокислотна АРР або Αb необхідно розглядати як такі, що вопослідовність АРР або Αb у відповідних положенлодіють повністю однаковою третинною структунях містить ряд амінокислотних залишків, які можрою, що і АРР або Αb, тоді як аналоги, які виявляна виявити у чужорідному ТН-епітопі, тоді введенють обмежену (але все ще значну і специфічну) ня чужорідного ТН-епітопу може бути досягнуте реактивність з такою антисироваткою розглядають шляхом забезпечення амінокислот, що залишилияк такі, що зберегли істотну частину вихідних Вся, чужорідного епітопу за допомогою вставки, клітинних епітопів. додавання, делеції або заміни амінокислот. ІншиАльтернативно, можна провести відбір монокми словами, введення повного ТН-епітопу за долональних антитіл, що реагують з різними епітопомогою вставки або заміни для задоволення ціпами на АРР або Αb, і використати їх як тестову лей даного винаходу не є необхідним. панель. Даний підхід має перевагу, що дозволяє 1) Переважно, щоб число вставок, делецій, замін або додавань амінокислот являло собою щонайкартування епітопів АРР або Αb і 2) картування епітопів, збережених в одержаних аналогах. менше 2, наприклад, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, Звичайно, у третьому наближенні слід би ви13, 14, 15, 16, 17, 18, 19, 20, і 25 вставок, замін, додавань або делецій. Крім того, переважно, щоб значити 3-вимірну стр уктур у АРР або Αb, або їх число вставок, замін, додавань або делецій амінобіологічно активного укороченого продукту (пор. кислот не перевищувало 150, наприклад, не більвище) і порівняти їх з визначеною тривимірною ше 100, не більше 90, не більше 80 і не більше 70. структурою одержаних аналогів. Тривимірну струкОсобливо переважно, щоб число замін, вставок, туру можна розрізнити за допомогою вивчення делецій або додавань не перевищувало 60, і зокдифракції рентгенівських променів і ЯМРрема, дане число не повинно перевищувати 50 спектроскопії. Додаткову інформацію відносно або навіть 40. Найбільш переважно число не петретинної структури до деякої міри можна одержаревершує 30. По відношенню до додавань аміноти при вивченні циркулярного дихроїзму, який має кислот необхідно відмітити, що коли одержувана ту перевагу, що єдино необхідним для одержання конструкція знаходиться у формі гібридного полікорисної інформації про третинну стр уктур у даної пептиду, їх часто значно більше ніж 150. молекули є очищений поліпептид (тоді як при диПереважні здійснення даного винаходу вклюфракції рентгенівських променів необхідно забезчають в себе модифікацію за допомогою введення печити кристалізований поліпептид, а для ЯМР щонайменше одного чужорідного імунодомінантнеобхідно забезпечити ізотопні варіанти поліпепного Т-клітинного епітопу. Необхідно зрозуміти, що тиду). Однак зрештою дифракція рентгенівських питання про імунодомінантність Т-клітинного епіпроменів і ЯМР необхідні для одержання переконтопу залежить від виду тварини, що розглядаєтьливих даних, оскільки циркулярний дихроїзм може ся. Тут термін "імунодомінування" буквально віднадати тільки непрямі докази коректності 3носиться до епітопів, які у вакцинованих вимірної структури за допомогою інформації про індивідів/популяції дають початок значній імунній елементи вторинної структури. відповіді, але добре відомим фактом є те, що ТВ одному з переважних здійснень винаходу клітинний епітоп, який є імунодомінантним у однозастосовують множинні представлення В 25 85815 26 го індивіда/популяції, не обов'язково є імунодомінок відповіді популяції тільки на МНС-рестрикції Тнантним у іншого індивіда того ж виду, навіть неклітинних епітопів у вакцині, мінімальну частину зважаючи на те, що він здатний до зв'язування з популяції, що охоплюється конкретною композицімолекулами МНС-II у останнього індивіда. Звідси єю вакцини, можна визначити за допомогою надля цілей даного винаходу імунодомінантний Тступної формули: клітинний епітоп являє собою Т-клітинний епітоп, який, коли представлений в антигені, ефективно 3 забезпечить допомогу Т-клітин. Звичайно імуноfпопул. = 1- Õ 1- j j 2 (III) домінантні Т-клітинні епітопи володіють такою j=1 природною здатністю, що вони по суті завжди представлені зв'язаними з молекулами МНС класу де jj являє собою суму часто т алельних гапII, незалежно від поліпептиду, в якому вони знахолотипів, що кодуються молекулами МНС, які зв'ядяться. зують будь-який з Т-клітинних епітопів у вакцині і Іншим важливим питанням є проблема рестналежать j-ому з 3 відомих локусів HLA (DP, DR і рикції МНС Т-клітинних епітопів. Як правило, приDQ) у популяції; на практиці спочатку визначають, родні Т-клітинні епітопи рестриційовані по МНС, які молекули МНС розпізнають кожний Т-клітинний тобто визначені пептиди, що складають Тепітоп у вакцині, а потім їх сортують за типом (DP, клітинний епітоп, будуть ефективно зв'язуватися DR і DQ); далі для кожного типу підсумовують інтільки з підмножиною молекул МНС класу II. Це, у дивідуальні частоти різних відсортованих алельсвою чергу, має той е фект, що у більшості випадних гаплотипів, таким чином, одержуючи (j1, j2 і ків застосування одного специфічного Т-клітинного j3. епітопу приведе до компонента вакцини, ефективМоже трапитися, що значення pi у формулі II ного тільки для частини популяції, і, в залежності перевищить відповідне теоретичному значенню pi від розміру цієї частини, може виявитися необхідним включати більше Т-клітинних епітопів в одну і 3 ту ж молекулу або, альтернативно, готувати бага2 pi = 1 - Õ 1 - n j (IV) токомпонентну вакцину, де компоненти являють j=1 собою варіанти АРР або Αb, відмінні один від одного природою введеного Т-клітинного епітопу. де nj являє собою суму частот алельного гапЯкщо МНС-рестрикція Т-клітин, що застосовулотипу, що кодується молекулами МНС, які зв'яються, невідома (наприклад, у си туації, коли твазують і-ий Т-клітинний епітоп у вакцині і належать рина, що вакцинується, володіє погано визначеj-ому з 3 відомих локусів HLA (DP, DR і DQ) у поним складом МНС), частину популяції, що пуляції. Це означає, що в 1-pi популяції частота охоплюється конкретною композицією вакцини, відповідаючих складає fзалишкова_і=(рі-pі)/(1-pi). Таможна апроксимувати за допомогою наступної ким чином, формулу III можна перетворити так, формули: щоб одержати формулу V: ( ( n fпопул. = 1- Õ (1- pi ) i= 1 (II) де pi являє собою частоту реагуючи х у популяції на і-ий чужорідний Т-клітинний епітоп, представлений у композиції вакцини, а n являє собою загальне число чужорідних Т-клітинних епітетів. Таким чином, композиція вакцини, що містить 3 чужорідних Т-клітинних епітопи, які володіють частотами відповіді у популяції у розмірі 0,8, 0,7 і 0,6, відповідно, повинна дати 1-0,2´0,3´0,4=0,976, тобто у 97,6 процентів популяції статистично буде підвищуватися опосередкована МНС-ІІ відповідь на вакцину. Формулу вище не застосовують у ситуаціях, де більш або менш точно відомий профіль МНСрестрикції пептидів, що застосовуються. Якщо, наприклад, визначений пептид зв'язується тільки з молекулами МНС-ІІ людини, що кодуються алелями DR1, DR3, DR5 і DR7 HLA-DR, тоді застосування даного пептиду разом з іншим пептидом, що зв'язується з молекулами МНС-ІІ, що залишилися, які кодуються алелями HLA-DR, завершить 100% охоплення у популяції, що розглядається. Подібним чином, якщо другий пептид зв'язується тільки з DR3 і DR5, додавання даного пептиду абсолютно не збільшить охоплення. Якщо базувати розраху ) ) æ3 n ç fпопул. = 1- Õ 1 - j j 2 + ç 1 - Õ 1- fзалишкова _ і ç j =1 j=1 è ( ) ( ö )÷ (V) ÷ ÷ ø де член fзалишкова_і встановлюють в нуль, якщо він є негативним. Необхідно зазначити, що формула V вимагає, щоб все епітопи були картованими за ідентичними наборами гаплотипів. Отже, при виборі Т-клітинних епітопів для введення в аналог важливо враховувати всю доступну інформацію про епітопи: 1) частоту відповідаючих у популяції на кожний епітоп, 2) дані про МНСрестрикції і 3) частоту відповідних гаплотипів у популяції. Існує ряд природних "змішаних" Т-клітинних епітопів, активних у великої частини індивідів виду тварин або популяції тварин, і їх переважно вводити у вакцину, таким чином зменшуючи необхідність великого числа різних аналогів в одній вакцині. Змішаний епітоп відповідно до винаходу може являти собою природний Т-клітинний епітоп людини, такий як епітопи з анатоксину правця (наприклад, епітопи Р2 і Р30), анатоксину дифтерії, гемаглютиніну вірусу грипу (НА) і CS-антигену P. falciparam. 27 85815 28 Протягом декількох років ідентифікували ряд клад, манан або маноза). Альтернативно, друга інших змішаних Т-клітинних епітопів. Головним група може являти собою гаптен. Також як першу чином ідентифікували пептиди, здатні до зв'язугруп у можна застосовувати фрагмент антитіла, що вання з великою частиною молекул HLA-DR, що специфічно розпізнає поверхневу молекулу на кодуються різними алелями HLA-DR, і вони всі є ТАРС або лімфоцитах (наприклад, поверхнева моклітинними епітопами, допустимими для введення лекула може являти собою рецептор FCy макров аналоги, що застосовуються відповідно до данофагів або моноцитів, такий як FcgRI, або, альтерго винаходу. Пор. також епітопи, що розглядаютьнативно, будь-який інший поверхнево-специфічний ся у наступних посиланнях, які, таким чином, всі маркер, такий як CD40 або CTLA-4). Необхідно включені сюди за допомогою посилання: [WO зазначити, що всі ці приведені для прикладу моле98/23635 (Frazer I.H. et al., переданий The кули також можна застосовувати як частину ад'юUniversity of Queensland); Southwood S. et. al., ванта, порівняння нижче. 1998, J. Immunol. 160: 3363-3373; Sinigaglia F. et Як альтернативу або додатково для націлюal., 1988, Nature 336: 778-780; Chicz R.M. et al., вання аналога на визначений тип клітин для дося1993, J. Exp. Med. 178: 27-47; Hammer J. et al., гнення посиленої імунної відповіді можна збільши1993, Cell 74: 197-203; and Falk K. et al., 1994, ти рівень реактивності імунної системи за Immunogenetics 39: 230-242]. Останнє посилання допомогою включення вказаної вище другої гр упи, також стосується лігандів HLA-DQ і DP. Всі епітояка стимулює імунну систему. Типові приклади пи, перераховані у даних 5 посиланнях, є придаттаких други х груп являють собою цитокіни і білки ними як природні епітопи-кандидати для застосутеплового шоку або молекули шаперонів, а також вання відповідно до даного винаходу як епітопів, їх ефективні частини. що розділяють спільні з ними мотиви. Придатні для застосування відповідно до даАльтернативно, епітоп може являти собою ного винаходу цитокіни являють собою цитокіни, будь-який штучний Т-клітинний епітоп, здатний які будуть також нормально функціонувати у комзв'язуватися з великою частиною молекул МНС позиції вакцини як ад'юванти, тобто наприклад, класу II. У даному контексті пептиди, що являють інтерферон g (IFN-g), інтерлейкін 1 (IL-1), інтерлейсобою спільні епітопи для всіх DR ("PADRE"), опикін 2 (IL-2), інтерлейкін 4 (IL-4), інтерлейкін 6 (IL-6), сані у [WO 95/07707 та у відповідній статті інтерлейкін 12 (IL-12), інтерлейкін 13 (IL-13), інтерAlexander J. et al., 1994, Immunity 1: 751-761 (обидлейкін 15 (IL-15) і гранулоцитарнова описи включені сюди за допомогою посиланмакрофагальний колонієстимулуючий фактор ня)], являють собою цікаві кандидати для епітопів (GM-CSF); альтернативно, як другої групи може для застосування відповідно до даного винаходу. вистачити функціональної частини молекули цитоНеобхідно зазначити, що найбільш ефективні пепкіну. Що стосується застосування таких цитокінів тиди PADRE, описані у даних документах, несуть як засобів для ад'ювантів, порівняйте обговорення D-амінокислоти на С- і N-кінцях для збільшення нижче. стабільності при введенні. Однак у даному винаПридатні відповідно до даного винаходу білки ході головним чином прагнуть до введення відпотеплового шоку або молекулярні шаперони, що відних епітопів як частини аналога, який згодом застосовуються як друга група, можуть являти ферментативно руйнується всередині лізосомного собою HSP70, HSP90, HSC70, GRP94 [також відокомпартмента АРС, щоб дозволити подальшу премий як gp96, пор. Wearsch PA et al. 1998, зентацію у зв'язку з молекулою МНС-ІІ, і отже, Biochemistry 37: 5709-19] і CRT (калретикулін). введення D-амінокислот в епітопи, що застосовуАльтернативно, друга гр упа може являти соються відповідно до винаходу, є недоцільним. бою токсин, такий як лістеріолізин (LLO), ліпід А і Один з особливо переважних пептидів PADRE термолабільний ентеротоксин. Цікаві можливості являє собою пептид, що має амінокислотну послітакож пов'язані з мікобактеріальними похідними, довність AKFVAAWTLKAAA (SEQ ID NO:17) або її такими як МОР (м урамілдипептид), CFA (повний імунологічно ефективну підпослідовність Даний та ад'ювант Фрейнду) і складні ефіри трегалози TDM i інші епітопи, що володіють такою ж відсутністю TDE. МНС-рестрикції, являють собою переважні ТВажливе здійснення даного винаходу являє клітинні епітопи, які повинні бути присутніми в собою також можливість введення третьої групи, аналогах, що застосовуються у способі відповідно що посилює презентацію аналога імунній системі. до винаходу. Такий понадзмішаний епітоп є припуУ даній області показано декілька прикладів даностимим для більшості простих здійснень винаходу, го принципу. Наприклад, відомо, що якір ліпоілюде вакцинованій імунній системі тварини представання пальмітиновою кислотою у білку OspA у влений тільки один-єдиний аналог. Borrelia burgdorferi можна застосовувати так, що Як вказано вище, модифікація АРР або Αb надаються поліпептиди, які самі по собі є ад'юванможе також включати в себе введення першої грутами [пор., наприклад, WO 96/40718] - здається, пи, що націлює модифікований амілоїдогенний що ліпоільовані білки формують структури, подібні поліпептид на АРС або В-лімфоцит. Наприклад, міцелам, з ядром, що складається з частин якорів перша група може являти собою партнер, що спеліпоілювання поліпептидів, а частини молекули, цифічно зв'язується, для специфічного антигену що залишилися, які виступають звідти, приводять поверхні В-лімфоциту або для специфічного антидо множинної презентації антигенних детермінант. гену поверхні АРС. У даній області відомо багато Отже, застосування таких подібних підходів, пов'ятаких поверхнево-специфічних антигенів. Напризаних із застосуванням різних якорів ліпоілювання клад, група може являти собою вуглевод, для яко(наприклад, міристилової групи, фарнезилової го існує рецептор на В-лімфоциті або АРС (напригрупи, гераніл-геранілової групи, GPI-якоря і N 29 85815 30 ацилдигліцеридної групи), являє собою переважні меру трезильними (трифторетилсульфонільними) здійснення даного винаходу, оскільки, як правило, групами або іншими відповідними активуючими забезпечення таких якорів ліпоілювання в одержагрупами, такими як малеімід, параному рекомбінантним способом білку є досить нітрофенілхлороформ (для активації ОН-груп і простим і лише потребує у випадку аналога застоформування пептидного зв'язку між пептидом і сування, наприклад, природної сигнальної посліполігідроксиполімером) і тозил (парадовності як партнера злиття. Інша можливість явтолуолсульфоніл). Наприклад, можна одержати ляє собою застосування фрагмента C3d фактора активовані полісахариди, як описано у [WO С3 комплементу або самого фактора С3 [пор. 00/05316 і US 5874469 (обидва включені сюди за Dempsey et al., 1996, Science 271, 348-350 and Lou допомогою посилання)] і зв'язати їх з пептидами & Kohler, 1998, Nature Biotechnology 16, 458-462]. або поліамінокислотами, одержаними з АРР або Альтернативне здійснення винаходу, яке таΑb, а також з Т-клітинними епітопами, одержаними кож приводить до переважної презентації імунній за допомогою стандартних способів пептидного системі множинних (наприклад, щонайменше 2) синтезу у рідкій або твердій фазі. Одержаний прокопій важливих ділянок АРР або Αb з епітопами, дукт складається з полігідроксиполімерного кістяка являє собою ковалентне зв'язування аналога з (наприклад, декстранового кістяка), який своїми Nвизначеними молекулами, тобто варіанти d і є, кінцями або іншими азотними групами зв'язаний з вказані вище. Наприклад, можна застосовувати поліамінокислотами, одержаними з АРР або Αb і з полімери, наприклад, вуглеводи, такі як декстрин, чужорідних Т-клітинних епітопів. Якщо бажано, [пор., наприклад, Lees A et al., 1994, Vaccine 12: можна синтезувати пептиди АРР або Αb так, щоб 1160-1166; Lees A et al., 1990, J Immunol. 145: захистити всі доступні аміногрупи, крім однієї на N3594-3600], але маноза і манан також являють кінці, згодом зв'язуючи одержані захищені пептиди собою придатні альтернативи. Інтегральні мемз трезильованими групами декстрану і, на закінбранні білки, наприклад, з Е. coli та інших бактерій, чення, знімаючи захист з одержаного кон'югата. також є придатними для кон'югації партнерами. Конкретний приклад такого підходу описаний у Традиційні молекули-носії, такі як гемоціанін морприкладах нижче. ського блюдця (KLH), анатоксин правця, дифтеЗамість застосування водорозчинних молекул рійний анатоксин і бичачий сироватковий альбумін полісахариду, як викладено у [WO 00/05316 і US (BSA) також є переважними і придатними для 5874469], в рівній мірі можна застосовувати молекон'югації партнерів. кули перехреснозв'язаних полісахаридів, одержуПереважні здійснення ковалентного зв'язуванючи, таким чином, корпускулярні кон'югати між ня речовини, одержаної з АРР або Αb, з полігідрополіпептидами і полісахаридами, що, як вважають, ксиполімерами, такими як вуглеводи, включають в веде до поліпшеної презентації поліпептидів імунсебе застосування щонайменше одного пептиду, ній системі, оскільки досягаються дві мети, а саме: одержаного з АРР або Αb, і щонайменше одного одержання ефекту локального накопичення при чужорідного Т-хелперного епітопу, які роздільно ін'єкції кон'югата і одержання частинок, що є більш зв'язуються з полігідроксиполімером (тобто чужопривабливими мішенями для АРС. Даний підхід з рідний Т-хелперний епітоп і одержана з АРР або використанням таких систем також детально розглядається у прикладах. Αb амінокислотна послідовність не зливаються Міркування, що лежать в основі вибору діляодин з одним, але значною мірою зв'язуються з полігідроксиполімером, який служить як несучий нок для введення модифікацій в АРР або Αb, макаркас). З іншого боку, найбільш переважним є ють на увазі а) збереження відомих і передбачетаке здійснення, коли відповідні ділянки одержаних В-клітинних епітопів, b) збереження третинної структури, с) уникнення презентації В-клітинних них з АРР або Αb пептидів, що несуть В-клітинний епітопів на "клітинах-продуцентах" і т.п. Принаймепітоп, складені за допомогою коротких відрізків пептидів, тому що даний підхід являє собою дуже ні, як обговорювалося вище, скринінг набору аналогів, всі з яких були піддані внесенню Тзручний шлях для досягнення множинної презенклітинного епітопу у різні положення, є досить протації вибраних епітопів у кінцевому імуногені. Одстим. нак можна також просто зв'язувати аналоги, вже Оскільки найбільш переважні здійснення даноописані тут, з полігідроксиполімерним кістяком, го винаходу включають в себе знижувальну регутобто щоб речовина, одержана з АРР або Αb, не ляцію Αb людини, отже, переважно, щоб поліпепз'єднувалася з кістяком окремо від чужорідних ТНепітопів. тид АРР або Αb, що обговорюється вище, являв Особливо переважно, щоб зв'язування чужособою поліпептид Αb людини. У даному здійсненні рідного Т-хелперного епітопу і одержаного з АРР особливо переважно, щоб поліпептиди АРР або або Αb (полі)пептиду відбувалося за допомогою Αb були модифікованими шляхом заміни щонайамідного зв'язку, який можна розщепити пептидаменше однієї амінокислотної послідовності в SEQ зою. Дана стратегія має той ефект, що АРС змоID NO:2, однією амінокислотною послідовністю з жуть захоплювати кон'югат і згодом здійснювати еквівалентною або відмінною довжиною, що міспрезентацію чужорідного Т-клітинного епітопу у тить чужорідний ТН-епітоп. Переважні приклади зв'язку з МНС класу II. модифікованих амілоїдогенних АРР і Αb схематиОдним із шляхів досягнення зв'язування пепчно показані на Фігурі 1, із застосуванням як притидів (і одержаних з АРР або Αb пептидів, що кладів епітопів Р2 і Р30. Логічне обґрунтування представляють інтерес, також як і чужорідного таких конструкцій детально обговорюється у приепітопу) є активація відповідного полігідроксиполікладах. 31 85815 32 Більш конкретно, амінокислотну послідовність, служити ТН-епітопами, використання більш коротщо містить ТН, яку вносять в SEQ ID NO:2, можна ких фрагментів є одним з простих і прийнятних вносити з будь-якої амінокислоти в SEQ ID NO:2. підходів). Отже, дане здійснення винаходу також Тобто внесення можливе після будь-якої з амінослужить для того, щоб переконатися, що імуноген кислот у положеннях 1-770, але переважно після не включає в себе пептидні послідовності цільових будь-якої з амінокислот у положеннях 671, 672, АРР або Αb, які можуть служити як "самостимулю673, 674, 675, 676, 677, 678, 679, 680, 681, 682, вальні ТН-епітопи", включаючи послідовності, які 683, 684, 685, 686, 687, 688, 689, 690, 691, 692, просто містять консервативні заміни у послідовно693, 694, 695, 696, 697, 698, 699, 700, 701, 702, сті цільового білка, який інакше може функціонува703, 704, 705, 706, 707, 708, 709, 710, 711, 712, 713 ти як ТН-епітоп. і 714 в SEQ ID NO:2. Це можна комбінувати з деПереважні здійснення презентації імунній сислецією будь-якої або всіх з амінокислот у полотемі аналогів АРР або Αb включають в себе застоженнях 1-671 або будь-якою або всіх з амінокислот сування химерного пептиду, який містить щонайу положеннях 715-770. Крім того, при застосуванні менше один одержаний з АРР або Αb пептид, що способу заміни будь-яку з амінокислот у положенпродуктивно не зв'язується з молекулами МНС нях 671, 672, 673, 674, 675, 676, 677, 678, 679, 680, класу II, і щонайменше один чужорідний Т681, 682, 683, 684, 685, 686, 687, 688, 689, 690, хелперний епітоп. Більш того переважно, щоб 691, 692, 693, 694, 695, 696, 697, 698, 699, 700, одержаний з АРР або Αb пептид ніс В-клітинний 701, 702, 703, 704, 705, 706, 707, 708, 709, 710, епітоп. Особливо переважно, якщо імуногенний 711, 712, 713 і 714 у SEQ ID NO:2 можна видалити аналог являє собою аналог, де амінокислотні поразом з даним внесенням. слідовності включають в себе один або декілька ВІнше здійснення даного винаходу пов'язане з клітинних епітопів, представлених або як безперепредставленням аналогів, що не містять жодної з рвна послідовність, або як послідовність, що міспідпослідовностей SEQ ID NO:2, які продуктивно тить вставки, де вставки включають в себе чужозв'язуються з молекулами МНС класу II, ініціюючи рідні Т-хелперні епітопи. Т-клітинну відповідь. З іншого боку, найбільш переважним є таке Логічне обґрунтування такої стратегії для здійснення, коли відповідні ділянки, одержані з конструювання імуногена, що залучає імунну сиспептидів АРР або Αb, які несуть В-клітинний епітему до індукції, наприклад, імунної відповіді проти топ, складені за допомогою коротких пептидних Αb, полягає у наступному: зазначено, що при імувідрізків, які ніяк не здатні продуктивно зв'язатися нізації численними аутологічними білками, такими з молекулою МНС класу II. Вибраний В-клітинний як Αb, складеними з ад'ювантом, які досить сильні епітоп або епітопи амілоїдогенного поліпептиду для порушення толерантності організму до аутоповинні, отже, включати в себе не більше 9 послілогічних білків, існує небезпека, що у ти х же вакдовних амінокислот SEQ ID NO:2. Переважними є цинованих індивідів індукована імунна відповідь не більш короткі пептиди, такі як пептиди, що мають зможе припинитися просто внаслідок припинення не більше 8, 7, 6, 5, 4 або 3 послідовних амінокисімунізації. Це відбувається тому, що індукована лот амінокислотної послідовності амілоїдогенного імунна відповідь у таких індивідів найбільш ймовіполіпептиду. рно приводить у рух нативний ТН-епітоп аутологічПереважно, щоб аналог включав в себе щоного білка, а це має той несприятливий ефект, що найменше одну підпослідовність SEQ ID NO:2, так, власний білок вакцинованого індивіда буде здатщоб кожна з таких щонайменше однієї підпослідоний функціонувати як імуноген: таким чином, вставностей незалежно складалася з амінокислотних новиться аутоімунний стан. відрізків АРР або Αb, вибраних з групи, яка склаУ переважних способах, включаючи застосудається з 9 послідовних амінокислот, 8 послідоввання чужорідних ТН-епітопів, що є кращими за них амінокислот, 7 послідовних амінокислот, 6 відомостями авторів даного винаходу, ніколи не послідовних амінокислот, 5 послідовних амінокисспостерігали одержання даного ефекту, оскільки лот, 4 послідовних амінокислот і 3 послідовних імунна відповідь проти «свого» направляється амінокислот. чужорідним ТН-епітопом, а автори даного винаходу Особливо переважно, щоб послідовні амінокинеодноразово показували, що індукована імунна слоти починалися з амінокислотного залишку, вивідповідь, викликана шляхом застосування перебраного з групи, що складається із залишків 672, важної технології, дійсно зменшувалася після при673, 674, 675, 676, 677, 678, 679, 680, 681, 682, пинення імунізації. Однак в теорії у небагатьох 683, 684, 685, 686, 687, 688, 689, 690, 691, 692, індивідів може статися так, що імунна відповідь 693, 694, 695, 696, 697, 698, 699, 700, 701, 702, також буде направлятися аутологічним ТН703, 704, 705, 706, 707, 708, 709, 710,711, 712, 713 епітопом відповідного власного білка, проти якого і 714 SEQ ID NO:2. імунізували, що особливо значимо, коли розгляВакцинація білком/пептидом; препарати і введають власні білки, які є відносно численними, дення аналогів такими як Αb, тоді як інші терапевтично значимі Коли здійснюють презентацію аналога імунній власні білки присутні в організмі тільки локально системі тварини за допомогою його введення тваабо у таких малих кількостях, що "ефект самоімурині, препарати поліпептиду відповідають вимонізації" неможливий. Одним з дуже простих шляхів гам, загальноприйнятим у даній області. уникнути цього є, отже, цілковита відмова від Одержання вакцин, що містять як активні інгвключення в імуноген пептидних послідовностей, редієнти послідовності пептидів, у загальних рисах які можуть служити як ТН-епітопи (і оскільки пептидобре розробленіу даній області, як проілюстроди коротше приблизно 9 амінокислот не можуть вано [патентами США 4608251, 4601903, 4599231, 33 85815 34 4599230, 4596792 і 4578770, які всі включені сюди декількох сотень мікрограмів активного інгредієнта за допомогою посилання]. Звичайно такі вакцини на вакцинацію, з переважним діапазоном приблиодержують як препарати для ін'єкцій або як рідкі зно від 0,1мкг до 2000мкг (хоча розглядають і верозчини або суспензії; також можна одержати твеликі кількості у діапазоні 1-10мг), наприклад у діарді форми, придатні для розчинення або суспенпазоні приблизно від 0,5мкг до 1000мкг, переважно дування у рідині перед ін'єкцією. Препарати також у діапазоні від 1мкг до 500мкг і, особливо у діапаможна емульгувати. Активний імуногенний інгредізоні приблизно від 10мкг до 100мкг. Відповідні реєнт часто змішують з наповнювачами, що є фаржими для початкового введення і підтримуючих мацевтично допустимими і сумісними з активним доз також варіюють, але визначаються початковим інгредієнтом. Відповідні наповнювачі являють совведенням з подальшим щепленням або іншими бою, наприклад, воду, фізіологічний розчин, деквидами введення. строзу, гліцерин, етанол і т.п., та їх комбінації. Крім Спосіб застосування може широко варіювати. того, якщо бажано, вакцина може містити незначні Застосовним є будь-який з традиційних способів кількості допоміжних речовин, таких як зволожувавведення вакцини. Вони включають в себе оральчі або емульгатори, буферні засоби для стабілізане застосування на твердій фізіологічно прийнятції рН або ад'юванти, що збільшують ефективність ній основі або у фізіологічно прийнятній дисперсії, вакцин; пор. докладне обговорення ад'ювантів парентерально, за допомогою ін'єкції і т.п. Дозунижче. вання вакцини буде залежати від способу введенЗвичайно вакцини вводять парентерально, за ня і буде варіювати в залежності від віку суб'єкта, допомогою ін'єкції, наприклад, або підшкірно, або що піддається вакцинації, і складу антигену. внутрішньовенно, або внутрішньом'язово. ДодатДеякі з поліпептидів вакцини досить імуногенні кові препарати, які є придатними для інших спосоу вакцині, але для деяких інших імунна відповідь бів введення, включають в себе супозиторії і, в посилиться, якщо вакцина буде додатково містити деяких випадках, оральні, букальні, сублінгвальні, активуючу речовину. інтраперитонеальні, інтравагінальні, анальні, епіДля вакцин відомі різні способи досягнення акдуральні, спінальні та інтракраніальні препарати. тивуючого ефекту. Основні принципи і способи Для супозиторіїв стандартні в'яжучі засоби і носії добре розроблені в ["The Theory and Practical можуть включати в себе, наприклад, поліалкіленгApplication of Adjuvants", 1995, Duncan E.S. ліколі або тригліцериди; такі супозиторії можна Stewart-Tull (ed.), John Wiley & Sons Ltd, ISBN 0формувати з сумішей, що містять активний інгре471-95170-6, а також у "Vaccines: New Generationn дієнт у діапазоні від 0,5% до 10%, переважно - 1Immunological Adjuvants", 1995, Gregoriadis G et al. 2%. Оральні препарати включають в себе такі зви(eds.), Plenum Press, New York, ISBN 0-306-45283чайно застосовувані наповнювачі як, наприклад, 9, включених сюди за допомогою посилання]. маніт, лактозу, крохмаль, стеарат магнію, сахариОсобливо переважно застосовувати ад'ювант, нат натрію, целюлозу, карбонат магнію фармацевякий, як може бути показано, сприяє порушенню тичних ступенів очищення і т.п. Дані композиції аутотолерантності до аутоантигенів; фактично це приймають форми розчинів, суспензій, таблеток, істотно у випадках, коли як активний інгредієнт в пілюль, капсул, препаратів з уповільненим вивільаутовакцині застосовують немодифікований амілоненням або порошків і містять 10-95% активного їдогенний поліпептид. Як необмежувальні приклаінгредієнта, переважно - 20-70%. Для оральних ди відповідні ад'юванти вибирають з групи, яка препаратів відповідним компонентом для складанскладається з ад'юванта, що націлює імунітет; ня композиції (і також можливим компонентом для імуномодулюючого ад'юванта, такого як токсин, кон'югації) є холерний токсин. цитокін і похідні мікобактерій; масляного складу; Поліпептиди можна формувати у вакцини у виполімеру; ад'юванта, що формує міцели; сапоніну; гляді нейтральних форм або у вигляді солей. Фаімуностимулювального комплексного матриксу рмацевтично допустимі солі включають в себе (матрикс ISCOM); частинки; DDA; ад'ювантів на кислі адитивні солі (що утворюються з вільними основі алюмінію; ад'ювантів на основі ДНК; gаміногрупами пептиду) і ті солі, які утворюються з інуліну та інкапсулюючого ад'юванта. У загальних неорганічними кислотами, такими, наприклад, як рисах необхідно зазначити, що описи вище, які соляна або фосфорна кислоти, або з такими оргавідносилися до сполук і засобів, придатних як пенічними солями як оцтова, щавлева, винна, мигрша, друга і третя гр упи в аналогах, з відповідними далева і т.п. Солі, що утворюються з вільними казмінами також відносяться до їх використання в рбоксильними групами, також можна одержати за ад'юванті вакцини відповідно до винаходу. допомогою неорганічних основ, наприклад, таких Можливе використання ад'ювантів включає в як гідроксиди натрію, калію, амонію, кальцію або себе застосування таких засобів як гідроксид або заліза, і таких органічних основ як ізопропіламін, фосфа т алюмінію (галуни), що звичайно застосотриметиламін, 2-етиламіноетанол, гістидин, прокавується як 0,05-0,1-процентний розчин у забуфеїн і т.п. реному сольовому розчині, домішка з синтетичниВакцини вводять способом, сумісним з дозуми полімерами цукрів (наприклад, CarbopolÒ), що ванням препарату, і в такій кількості, яка терапевзастосовується як 0,25 процентний розчин, агрегатично ефективна та імуногенна. Кількість для ввецію білків у вакцині за допомогою впливу тепла з дення залежить від суб'єкта, який підлягає температурним діапазоном від 70 до 101°С протялікуванню, включаючи, наприклад, здатність імунгом періоду від 30 секунд до 2 хвилин, відповідно, ної системи індивіда встановлювати імунну відпоа також агрегацію за допомогою речовин, що струвідь і ступінь необхідного захисту. Відповідні діактурують. Також можна застосовувати агрегацію пазони дозування знаходяться у межах приблизно альбуміну за допомогою реактивації оброблених 35 85815 36 пепсином антитіл (Fab-фрагментів), суміш з бактеПридатні ад'юванти, що націлюють імунітет, ріальними клітинами, такими як С parvum, або енвибирають з групи, яка складається з ліганду CD40 дотоксинами, або компонентами ліпополісахаридів та антитіл до CD40 або їх фрагментів, шо специграмнегативних бактерій, емульсію у фізіологічно фічно зв'язуються, (пор. обговорення вище), манодопустимих масляних носіях, таких як манідмонози, Fab-фрагмента і CTLA-4. олеат (Аrасеl А) або емульсію з 20 процентним Придатні полімерні ад'юванти вибирають з розчином перфторвуглецю (Fluosol-DA), що застогрупи, що складається з вуглеводів, таких як дексовується як замісник, що блокує. Суміш з масластран, PEG, крохмаль, манан і маноза; пластичних ми, такими як сквален та IFA, також переважна. полімерів і латексу, такого як латексні гранули. Відповідно до даного винаходу, DD A (бромід Ще один цікавий шлях модуляції імунної віддиметилдіоктадециламонію) є цікавлячим кандиповіді являє собою включення імуногена (необов'язково разом з ад'ювантами і фармацевтично датом для ад'юванта, як і ДНК, і g-інулін, але повний і неповний ад'юванти Фрейнда, а також саподопустимими носіями) у "віртуальний лімфатичний вузол" (VLN) (патентований медичний пристрій ніни кілайї, такі як QuilA і QS21, також цікаві, як і розроблений в ImmunoTherapy, Inc., 360 Lexington RIBI. Додатковими можливостями є монофосфоліAvenue, New York, N Y 10017-6501). VLN (тонкий під A (MPL), вказані вище С3 і C3d, і мурамілдипетрубчастий пристрій) імітує структур у і функцію птид (MDP). Відомо, що препарати ліпосом дають ефекти лімфатичного вузла. Внесення VLN під шкіру створює ділянку стерильного запалення з підвищенням ад'ювантів, і отже, ад'юванти у вигляді ліпосом рівня цитокінів і хемокінів. Т- і В-клітини, також як і переважні відповідно до винаходу. АРС, швидко відповідають на сигнали про пошкоПереважними альтернативами відповідно до дження, направляються до ділянки запалення і винаходу також є ад'юванти у вигляді імуностимулювального комплексного матриксу (матрикс нагромаджуються всередині пористого матриксу VLN. Показано, що необхідна доза антигену, якої ISCOM®), особливо тому, що показано, що даний потрібно для встановлення імунної відповіді на тип ад'ювантів здатний до підвищувальної регуляантиген при застосуванні VLN, зменшена і, що ції експресії МНС класу II АРС. Матрикс ISCOM® імунопротекція, викликана імунізацією із застосускладається з (необов'язково фракціонованих) сапонінів (тритерпеноїди) з Quillaja saponaria, хованням VLN, перевищує стандартну імунізацію із застосуванням як ад'юванта RIBI. Технологія королестерину і фосфоліпіду. Коли це змішують з імутко описана у [Gelber С et al., 1998, "Elicitation of ногенним білком, одержуваний препарат з частиRobust Cellular and Humoral Immune Responses to нок являє собою те, що відомо як частинка ISCOM, Small Amounts of Immunogens Using a Novel де сапонін складає 60-70% мас./мас., холестерин і фосфоліпід складають 10-15% мас./мас., і білок Medical Device Designated the Virtual Lymph Node", in: "From the Laboratory to the Clinic, Book of складає 10-15% мас./мас. Подробиці, що відноAbstracts, October 12th-15th 1998, Seascape Resort, сяться до композиції і застосування імуностимуAptos, California"]. лювальних комплексів, можна знайти, наприклад, Показано, що препарати вакцин у вигляді міку вказаних ви ще підручниках, присвячених ад'ювантам, але у [Моrеіn В et al., 1995, Clin. рочастинок у багатьох випадках збільшують імуногенність білкових антигенів, а отже, являють собою Immunother. 3: 461-475, також як і у Barr IG and інше переважне здійснення винаходу. МікрочастиMitchell GF, 1996, Immunol, and Cell Biol. 74: 8-25 нки виготовляють або як композиції разом з полі(включених сюди за допомогою посилання)] також мером, ліпідом, вуглеводом або іншими молекунадані придатні інструкції для одержання повних імуностимулювальних комплексів. лами, придатними для виготовлення частинок, або мікрочастинки можуть являти собою гомогенні Інша дуже цікава (а значить, переважна) можчастинки, що складаються тільки з самого антигеливість досягнення ефекту ад'юванта пов'язана із ну. застосуванням способу, описаного у [Gosselin et Приклади мікрочастинок, що базуються на поal., 1992 (що, таким чином, включено сюди за допомогою посилання)]. Коротко, презентацію відполімерах, являють собою частинки, які базуються на PLGA і PVP [Gupta, R. К. et. al. 1998], де полівідного антигену, такого як антиген відповідно до мер і антиген конденсують у тверду частинку. Часданого винаходу можна посилити за допомогою тинки на основі ліпідів можна виготовити як міцели кон'югації антигену з антитілами (або антигензв'яз ліпіду (так звані ліпосоми), захоплюючи антиген у зувальними фрагментами антитіл) проти рецептоміцелу [Pietrobon, P. J. 1995]. Частинки на основі рів Fcg на моноцитах/макрофагах. Показано, що вуглеводу, звичайно виготовляють з відповідного імуногенність для цілей вакцинації особливо посивуглеводу, що розпадається, такого як крохмаль люють кон'югати між антигеном і анти-FcgRI. або хітозан. Вуглевод і антиген змішують і конденІнші можливості включають в себе застосусують у частинки у процесі, подібному до того, що вання речовин, що націлюють та імуномодулюють застосовують для полімерних частинок [Kas, Η. S. (наприклад, цитокінів), вказаних вище як кандидаet al. 1997]. ти для першої і другої груп у модифікованих версіЧастинки, що складаються тільки з антигену, ях амілоїдогенних поліпептидів. У зв'язку з цим можна виготовляти різними способами розпилення можливостями також є синтетичні індуктори цитоабо сушіння виморожуванням. Для цілей даного кінів, такі як полі І:С. винаходу особливо підходить спосіб надкритичної Придатні похідні мікобактерій вибрані з групи, рідини, який застосовують для виготовлення дуже що складається з мурамілдипептиду, повного однорідних частинок контрольованого розміру ад'юванта Фрейнда, RIBI і складних діефірів тре[York, P. 1999 & Shekunov, В. et al. 1999]. галози, таких як TDM або TDE. 37 85815 38 Очікується, що вакцину потрібно вводити 1-6 дом, що полегшує трансфекцію, ДНК, об'єднаної з разів на рік, тобто 1, 2, 3, 4, 5 або 6 разів на рік, білком або поліпептидом, що націлює, ДНК, об'єдіндивіду, який потребує цього. Раніше показано, наної з агентами, що осаджують кальцій, ДНК, що імунологічна пам'ять, індукована застосуванзв'язаної з інертною молекулою-носієм, ДНК, інканям переважних аутовакцин відповідно до даного псульованої у полімер, наприклад, у PLGA [поріввинаходу, не є постійною, і отже, імунна система няйте спосіб мікроінкапсуляції, описаний у WO потребує періодичної провокації імунної відповіді 98/31398], або хітин, або хітозан і ДНК, об'єднаної амілоїдогенним поліпептидом або модифікованиз ад'ювантом. У даному контексті потрібно зазнами амілоїдогенними поліпептидами. чити, що практично всі розглянуті варіанти, які Внаслідок генетичної різноманітності різні інстосуються застосування ад'ювантів у препаратах дивіди можуть реагувати на один і той же поліпептрадиційних вакцин, застосовуються і у препаратид імунною відповіддю різної сили. Отже, вакцина тах вакцин з ДНК. Отже, всі описи, які тут відновідповідно до винаходу може містити декілька різсяться до застосування ад'ювантів, у контексті них поліпептидів для збільшення імунної відповіді, вакцин на основі поліпептидів, з необхідними зміпор. також обговорення вище, що стосується винами застосовують для використання у способі бору введень чужорідного Т-клітинного епітопу. вакцинації нуклеїновими кислотами. Вакцина може включати в себе два або декілька Шляхи введення і схеми введення вакцин на поліпептидів, де всі поліпептиди являють собою основі поліпептидів, деталізовані вище, також затакі, як визначено вище. стосовні для вакцин на основі нуклеїнових кислот Отже, вакцина може включати в себе 3-20 різвідповідно до винаходу, і всі обговорення вище, них модифікованих або немодифікованих поліпепщо стосуються шляхів і схем введення поліпептитидів, наприклад, 3-10 різних пептидів. дів, з відповідними змінами застосовують до нукВакцинація нуклеїновою кислотою леїнових кислот. До цього необхідно додати, що Як альтернатива класичному введенню вакцивакцини на основі нуклеїнових кислот можна відни на основі білка технологія вакцинації нуклеїноповідним чином вводити внутрішньовенно і внутвою кислотою (також відома як "імунізація нуклеїрішньоартеріально. Більш того у даній області новою кислотою", "генетична імунізація" і "генна добре відомо, що вакцини на основі нуклеїнових імунізація") пропонує ряд привабливих особливоскислот можна вводити за допомогою застосування тей. так званої генної гармати, і отже, даний і еквівалеПередусім, на противагу традиційному підходу нтні способи введення розглядають як частина до вакцинації, вакцинація нуклеїновою кислотою даного винаходу. Нарешті, як повідомлялося, зане потребує ресурсів, що вимагають широкомасшстосування для введення нуклеїнових кислот VLN табного виробництва імуногена (наприклад, у також дає хороші результати, і отже, даний конкпромисловому масштабі ферментації мікроорганіретний спосіб введення є особливо переважним. змів, які продукують амілоїдогенні поліпептиди). Крім того, нуклеїнова(і) кислота(и), що застоБільш того немає необхідності у пристроях по совуються як засоби для імунізації, можуть містити очищенню і схемах рефолдингу імуногена. І, наділянки, що кодують 1-у, 2-у і/або 3-ю групи, нарешті, оскільки при вакцинації нуклеїновою кислоприклад, у вигляді імуномодулюючих речовин, тою для продукту експресії внесеної нуклеїнової описаних вище, таких як цитокіни, розглянуті як кислоти покладаються на біохімічний апарат індипридатні ад'юванти. Переважна версія даного віда, що вакцинується, очікується, що відбуде ться здійснення пов'язана з кодувальною ділянкою для оптимальний посттрансляційний процесинг продуаналога і кодувальною ділянкою для імуномодулякту, що експресується; це особливо важливо у тора у різних рамках зчитування або щонайменше випадку аутовакцинації, оскільки, як вказано вище, під контролем різних промоторів. Таким чином, у модифікованій молекулі необхідно зберегти знауникають того, щоб аналог або епітоп продукувачну частину ви хідних В-клітинних епітопів і оскіль лися як партнери злиття з імуномодулятором. ки В-клітинні епітопи в принципі можна скласти з Альтернативно, можна використати два окремих частин будь-якої (біологічної) молекули (напринуклеотидних фрагменти, але це є менш переважклад, вуглеводу, ліпіду, білка і т.п.). Отже, природні ним у зв'язку з перевагою, що забезпечується спіпрофілі глікозилювання і ліпоілювання імуногена льною експресією, коли обидві кодувальні ділянки можуть бути дуже важливими для загальної імуновключені в одну молекулу. генності, а це краще всього забезпечити, якщо як Таким чином, винахід також відноситься до продуцент імуногена використати хазяїна. композиції для індукування продукції антитіл проти Отже, переважне здійснення варіантів а-с відАРР або Αb, де композиція включає в себе повідно до винаходу включає в себе ефективну - фрагмент нуклеїнової кислоти або вектор презентацію аналога імунній системі за допомогою відповідно до винаходу (пор. обговорення векторів внесення нуклеїнових(ої) кислот(и), що кодують(є) нижче) і аналог, у клітини тварини і таким чином одержан- фармацевтично та імунологічно допустимий ня експресії введених(ої) нуклеїнових(ої) кислот(и) носій і/або ад'ювант, як обговорювалося вище. клітинами in vivo. У нормальних умовах нуклеїнову кислоту, що У даному здійсненні, введена нуклеїнова кискодує варіант, вносять у вигляді вектора, де екслота переважно являє собою ДНК, яка може знапресія знаходиться під контролем вірусного проходитися у формі чистої ДНК, ДНК, об'єднаної із мотору. Більш детальне обговорення векторів відзарядженими або незарядженими ліпідами, ДНК, повідно до винаходу див. обговорення нижче. поміщеної у ліпосоми, ДНК, включеної у вірусний Також докладні описи, що відносяться до формувектор, ДНК, об'єднаної з білком або поліпептивання і застосування вакцин на основі нуклеїнових 39 85815 40 кислот [див. Donnelly JJ. et al., 1997, Annu. Rev. Звичайно, наявність 1-ї і/або 2-ї, і/або 3-ї груп в Immunol. 15: 617-648 і Donnelly JJ. et al., 1997, Life одній і тій же рамці зчитування може забезпечити Sciences 60: 163-172. Обидва даних посилання аналог відповідно до винаходу як продукт експревключені сюди за допомогою посилання]. сії, і таке здійснення особливо переважне у даноЖиві вакцини му винаході. Третя альтернатива для ефективної презенЗастосування способу відповідно до винаходу тації аналогів імунній системі, як визначено у варідля лікування захворювання антах а-с, являє собою застосування способу жиЯк можна зрозуміти з обговорення вище, навих вакцин. У вакцинації живими вакцинами дання способу відповідно до винаходу дозволяє презентацію імунній системі здійснюють за допоконтролювати захворювання, що характеризуютьмогою введення тварині непатогенних мікроорганіся накопиченнями амілоїду. У даному контексті AD змів, які можна трансформувати фрагментом нукявляє собою ключову ціль способу відповідно до леїнової кислоти, що кодує аналог, або вектором, винаходу, але інші захворювання, які характерищо включає в себе такий фрагмент нуклеїнової зуються відкладеннями амілоїду, що містить Αb, кислоти. Непатогенний мікроорганізм може являти також є досяжними цілями. Отже, важливе здійссобою будь-який відповідний атенуйований бактенення способу відповідно до винаходу для знижуріальний штам (атенуйований за допомогою пасавальної регуляції амілоїдної активності включає в жів або шляхом видалення патогенних продуктів, себе лікування і/або профілактику і/або поліпшенщо експресуються, за допомогою технології реконя стану AD або інших захворювань, що характембінантних ДНК), наприклад, BCG. Mycobacterium ризуються накопиченням амілоїду, спосіб включає bovis, непатогенні Streptococcus spp., E. coli, в себе знижувальну регуляцію АРР або Αb спосоSalmonella spp., Vibrio cholerae, Shigella і т.п. Оглябом відповідно до винаходу, до такої міри, щоб ди, присвячені одержанню реальних живих вакцин, значно зменшувалася кількість амілоїду. можна, наприклад, знайти у [Saliou Ρ, 1995, Rev. Особливо переважно, щоб зменшення амілоїPrat. 45: 1492-1496 і Walker PD, 1992, Vaccine 10: ду приводило до зміни балансу між формуванням і 977-990, обидва з яких включені сюди за допомодеградацією/видаленням амілоїду, тобто швидгою посилання]. кість деградації/видалення амілоїду доведена до Для подробиць про фрагменти нуклеїнової киміри, коли вона перевищує швидкість формування слоти і вектори, що застосовуються в таких живих амілоїду. За допомогою ретельного контролю кільвакцинах, порівняйте обговорення нижче. кості та імунологічного впливу імунізацій індивіда, У вигляді альтернативи бактеріальним живим який потребує цього, можна згодом досягти балавакцинам, фрагмент нуклеїнової кислоти відповіднсу, що приводить до зменшення нетто накопино до винаходу, що обговорюється нижче, можна чень амілоїду без надмірних несприятливих ефекввести у невірулентний вектор вірусної вакцини, тів. такий як штам коров'ячої віспи або будь-який інАльтернативно, якщо спосіб відповідно до виший відповідний вірус віспи. находу не е фективний у видаленні або зменшенні Звичайно непатогенний мікроорганізм або вііснуючих відкладень амілоїду у індивіда, його морус тварині вводять тільки один раз, але у деяких жна застосовувати для одержання клінічно значивипадках може бути необхідним введення мікроормого зменшення формування нового амілоїду, ганізму більше одного разу протягом життя для таким чином значно подовжуючи період, до якого збереження захисного імунітету. Навіть припускастан хвороби не погіршиться. Потрібно мати можють, що деталізовані вище схеми імунізації для ливість контролювати швидкість накопичення амівакцинації поліпептидами будуть придатні для лоїду або шляхом вимірювання сироваткової конзастосування живих або вірусних вакцин. центрації амілоїду (яка, як вважають, знаходиться Альтернативно, вакцинацію живими вакцинау рівновазі з речовиною у накопиченнях), або за ми або вірусами комбінують з попередньою або допомогою позитронно-емісійного томографічного подальшою вакцинацією поліпептидами і/або нук(PET) сканування, [пор. Small G.W., et al., 1996, леїновими кислотами. Наприклад, можна здійсниAnn N.Y. Acad Sci 802: 70-78]. ти первинну імунізацію живою або вірусною вакциІнші захворювання і стани, де можна застосоною з подальшою підтримуючою імунізацією із вувати дані засоби і способи для лікування або застосуванням підходу на основі поліпептиду або полегшення стану аналогічним способом згадані нуклеїнової кислоти. вище у "передумовах винаходу" або перераховані Мікроорганізм або вірус можна трансформуванижче у розділі, який називається "інші амілоїдні ти нуклеїновою(ими) кислотою(ами), що містять захворювання і білки, асоційовані з ними". ділянки, які кодують 1-у, 2-у і/або 3-ю групи, наприПептиди, поліпептиди і композиції відповідно клад, у вигляді імуномодулюючих речовин, описадо винаходу них вище, таких як цитокіни, розглянуті як придатні Як видно з вказаного вище, даний винахід баад'юванти. Переважна версія даного здійснення зується на концепції імунізації індивідів проти анпов'язана з кодувальною ділянкою для аналога і тигену АРР або Αb для одержання зменшеної кількодувальною ділянкою для імуномодулятора у кості зв'язаних з патологією накопичень амілоїду. різних рамках зчитування або щонайменше під Переважний шлях досягнення такої імунізації явконтролем різних промоторів. Таким чином, униляє собою застосування описаних тут аналогів, з кають того, щоб аналог або епітоп продукувався як наданням, таким чином, молекул, раніше не опипартнер злиття з імуномодулятором. Альтернатисаних у даній області. вно, як засоби, що трансформують, можна викориВважають, що аналоги, які обговорюються тут, стовувати два окремих нуклеотидних фрагменти. є об'єктом винаходу самі по собі, і отже, важлива 41 85815 42 частина винаходу відноситься до описаних вище З попереднього опису зрозуміло, що аналоги аналогів. Отже, будь-який представлений тут опис, поліамінокислот можна одержати за допомогою технології рекомбінантних генів, а також за допощо відноситься до модифікованого АРР або Αb, є могою хімічного синтезу або напівсинтезу; останні релевантним для цілей опису амілоїдогенних анадві альтернативи особливо значимі, коли модифілогів відповідно до винаходу, також як і будь-які кація полягає у зв'язуванні з білковими носіями такі описи, навпаки, застосовні до опису вказаних (такими як KLH, дифтерійний анатоксин, анатоксин аналогів. Необхідно зазначити, що переважні модифікоправця і BSA) і небілковими молекулами, такими як вуглеводні полімери, а також, звичайно, коли вані молекули АРР або Αb включають в себе момодифікація включає в себе додавання бічних дифікації, які приводять до утворення поліпептиду, ланцюгів або бічних гр уп до пептидного ланцюга, що володіє ступенем ідентичності послідовності з одержаного з АРР або Αb. АРР або Αb, що складає щонайменше 70%, або з Для цілі технології рекомбінантних генів, а таїх підпослідовністю довжиною щонайменше у 10 кож, звичайно, для цілі імунізації нуклеїновою кисамінокислот. Більш високий ступінь ідентичності лотою фрагменти нуклеїнової кислоти, що кодують послідовності, наприклад, щонайменше 75% або аналоги, являють собою важливі хімічні продукти. навіть щонайменше 80, 85, 90 або 95% є переважОтже, важлива частина винаходу відноситься до ним. Ідентичність послідовності для білків і нуклеїфрагментів нуклеїнової кислоти, що кодують ананових кислот можна обчислити як (Nrefлог відповідно до винаходу, тобто поліпептид, Ndif)·100/Nref, де Ndif являє собою загальне число одержаний з АРР або Αb, що включає в себе або неідентичних залишків у двох послідовностях при природну послідовність, до якої додають або в яку вирівнюванні і де Nref являє собою число всіх залишків в одній з послідовностей. Так, послідоввставляють партнер злиття, або, переважно, оденість ДНК AGTC AGTC має ступінь ідентичності з ржаний з АРР або Αb поліпептид, в який за допопослідовністю ААТС ААТС, що складає 75% (N dif=2 могою вставки і/або додавання, переважно за доі Nref=8). помогою заміни і/або делеції, ввели чужорідний ТВинахід також відноситься до композицій, які клітинний епітоп. Фрагменти нуклеїнової кислоти можна використовувати при реалізації способу відповідно до винаходу являють собою фрагменти відповідно до винаходу. Отже, винахід також відДНК або РНК. носиться до імуногенної композиції, яка включає в Фрагменти нуклеїнової кислоти відповідно до себе імуногенно ефективну кількість описаного винаходу звичайно вставляють у відповідні вектовище аналога, причому вказана композиція додатри для утворення векторів, які клонують або ексково включає в себе фармацевтично та імунологіпресують, що несуть фрагменти нуклеїнової кисчно прийнятний розріджувач і/або носій, і/або налоти відповідно до винаходу; такі нові вектори повнювач і, необов'язково, ад'ювант. Ін шими також являють собою частину винаходу. Подробисловами, ця частина винаходу відноситься до ці, що відносяться до конструювання таких вектокомпозицій аналогів, в основному як описано вирів відповідно до винаходу, будуть обговорюватище. Таким чином, коли вибір ад'ювантів і носіїв ся нижче у зв'язку з трансформованими клітинами відноситься до композиції модифікованого або і мікроорганізмами. Вектори, в залежності від мети немодифікованого амілоїдогенного поліпептиду і типу застосування, можуть існувати у вигляді для застосування у способі відповідно до винахоплазмід, фагів, космід, мініхромосом або вірусу, але «оголена» ДНК, яка транзитно експресується ду для знижувальної регуляції АРР або Αb, він тільки у визначених клітинах, також є важливим знаходиться відповідно до того, що обговорювавектором. Переважні вектори, що клонують і екслося вище. пресують, відповідно до винаходу здатні до автоПоліпептиди одержують відповідно до спосономної реплікації, таким чином створюючи можлибів, добре відомих у даній області. Більш протяжні вість одержання великого числа копій для цілей поліпептиди звичайно одержують за допомогою високорівневої експресії або високорівневої реплітехнології рекомбінантних генів, яка включає в кації для подальшого клонування. себе введення послідовності амінокислот, що коОсновна схема вектора відповідно до винаходує аналог, у відповідний вектор, трансформацію ду включає в себе наступні елементи у напрямку даним вектором відповідної клітини-хазяїна, експресію даною клітиною-хазяїном послідовності 5'®3' та у функціональному з'єднанні: промотор нуклеїнових кислот, діставання продукту експресії для керування експресією фрагмента нуклеїнової з клітин-хазяїнів або їх супернатанту і подальше кислоти відповідно до винаходу, необов'язково очищення, і, необов'язково, додаткову модифікапослідовність нуклеїнової кислоти, яка кодує лідецію, наприклад, рефолдинг або дериватизацію. рний пептид, що робить можливою секрецію (в Більш короткі пептиди переважно одержують екстрацелюлярну фазу або, коли застосовно, у за допомогою добре відомих способів твердофапериплазму) поліпептидного фрагмента або його зового або рідкофазового пептидного синтезу. інтеграцію у мембрану, фрагмент нуклеїнової кисОднак нещодавні досягнення у даній технології лоти відповідно до винаходу і, необов'язково, постворили можливість одержання за допомогою слідовність нуклеїнової кислоти, що кодує терміданих способів повнорозмірних поліпептидів і білнатор. При оперуванні векторами, що ків, і отже, одержання довгих конструкцій за допоекспресують, у штамах-продуцентах або клітинних могою синтетичних способів також не виходить за лініях з метою генетичної стабільності трансформежі даного винаходу. мованої клітини переважно, щоб вектор при ввеФрагменти нуклеїнової кислоти і вектори відденні в клітину-хазяїна інтегрувався у геном клітиповідно до винаходу ни-хазяїна. Навпаки, при роботі з векторами, що 43 85815 44 застосовуються для здійснення експресії у тварисумісних з клітиною-хазяїном, застосовують у зв'яни in vivo (наприклад, при застосуванні вектора у зку з хазяїнами. Вектор звичайно несе сайт реплівакцинації ДНК), з міркувань безпеки переважно, кації, а також маркерні послідовності, здатні защоб вектор був нездатний до інтеграції у геном безпечити селекцію трансформованих клітин за клітини-хазяїна; звичайно застосовують «оголену» фенотипом. Наприклад, Е. coli звичайно трансфоДНК або вектори, що не інтегруються, вибір яких рмують із застосуванням pBR322, плазміди, одердобре відомий фахівцям у даній області. жаної з виду Е. coli [наприклад, див. Bolivar et al., Вектори відповідно до винаходу застосовують 1977]. Плазміда pBR.322 містить гени стійкості до для трансформації клітин-хазяїнів для одержання ампіциліну і тетрацикліну і таким чином забезпечує аналога відповідно до винаходу. Такі трансформопрості засоби для ідентифікації трансформованих вані клітини можуть являти собою клітини, що клітин. Плазміда pBR або інша плазміда мікрооркультивуються або клітинні лінії, які застосовуютьганізмів або фаг повинна також містити - або ж її ся для розмноження фрагментів нуклеїнової киснеобхідно модифікувати так, щоб вона містила лоти і векторів відповідно до винаходу або застопромотори, які прокаріотичний мікроорганізм може совуються для рекомбінантного одержання використати для експресії. аналогів відповідно до винаходу. Альтернативно, Такі промотори, що частіше за все застосовутрансформовані клітини можуть являти собою ються для конструювання рекомбінантної ДНК, штами живих вакцин, де фрагмент нуклеїнової включають в себе системи В-лактамазного і лактокислоти (одна єдина або декілька копій) вставлезного промоторів [Chang et al., 1978; Itakura et al., ний так, що здійснює секрецію або інтеграцію ана1977; Goeddel et al., 1979] і систему триптофанолога у бактеріальну мембрану або клітинну стінку. вого (trp) промотору [Goeddel et al., 1979; EP-AПереважні трансформовані клітини відповідно 0036116]. Хоча вони і є найчастіше застосовувадо винаходу являють собою мікроорганізми, такі як ними, виявлені та застосовуються також й інші бактерії (такі як види Escherichia [наприклад, Е. промотори мікроорганізмів, і опубліковані деталі, coli], Bacillus [наприклад, Bacillus subtilis], що відносяться до їх нуклеотидних послідовносSalmonella або Mycobacterium [переважно непатотей, дозволяючи фахівцям функціонально лігувати генні, наприклад, BCG М. bovis]), дріжджі (наприїх з плазмідними векторами [Siebwenlist et al., клад, Saccharomyces cerevisiae) і найпростіші тва1980]. Визначені гени прокаріот можуть ефективно рини. Альтернативно, трансформовані клітини експресуватися в Е. coli з її власної промоторної одержують з багатоклітинного організму, наприпослідовності, запобігаючи необхідності додаванклад, гриба, клітини комахи, клітини рослини або ня іншого промотору штучними способами. клітини ссавця. Найбільш переважними є клітини, Крім прокаріотичних, можна застосовувати і одержані від людини, порівняйте обговорення кліеукаріотичні мікроорганізми, такі як дріжджові тинних ліній і векторів нижче. Останні результати у культури, і тут промотор повинен бути здатний лабораторії авторів свідчать про перспективи занаправляти експресію. Saccharomyces cerevisiase, стосування для рекомбінантного одержання поліабо звичайні пекарські дріжджі, з еукаріотичних пептидів комерційно доступної лінії Drosophila мікроорганізмів застосовують найчастіше, хоча melanogaster (клітинна лінія і векторна система також доступний і ряд інших штамів. Для експресії Schneider 2 (S2), доступна в In vitrogen), і отже, дав Saccharomyces звичайно застосовують, наприна система, що експресує, особливо переважна. клад, плазміду YRp7 [Stinchcomb et al., 1979; Для цілей клонування і/або оптимізованої ексKingsman et al., 1979; Tschemper et al., 1980]. Дана пресії переважно, щоб трансформовані клітини плазміда вже містить ген trpl, що є селективним були здатні реплікувати фрагмент нуклеїнової кимаркером для мутантного штаму дріжджів, позбаслоти відповідно до винаходу. Клітини, що експревлених здатності рости на триптофані, наприклад, сують фрагмент нуклеїнової кислоти, є переважно АТСС №44076 або РЕР4-1 [Jones, 1977]. Наявкорисними здійсненнями даного винаходу; їх можність пошкодження trpl як характеристики геному на використовувати для обмеженого або широкодріжджової клітини-хазяїна, надає ефективну умомасштабного одержання аналога відповідно до ву для виявлення трансформації за допомогою винаходу або, у випадку непатогенних бактерій, як росту за відсутності триптофану. вакцинних складових у живій вакцині. Відповідні промоторні послідовності у дріжПри одержанні аналогів відповідно до винаходжових векторів включають в себе промотори для ду за допомогою трансформованих клітин, зручно, 3-фосфогліцераткінази [Hitzman et al., 1980] або хоча це і віддаляє від суті, щоб продукти експресії інших гліколітичних ферментів [Hess et al., 1968; або експортувалися назовні у середовище культиHolland et al., 1978)] таких як енолаза, гліцеральвування, або знаходилися на поверхні трансфордегід-3-фосфатдегідрогеназа, гексокіназа, пірувамованої клітини. тдекарбоксилаза, фосфофр уктокіназа, глюкозо-6Коли ефективні клітини-продуценти ідентифіфосфа тізомераза, 3-фосфогліцератмутаза, піруковані, на їх основі переважно створити стабільну ваткіназа, триозофосфатізомераза, фосфоглюкоклітинну лінію, яка несе вектор відповідно до виназоізомераза і глюкокіназа. Для забезпечення поліходу і експресує фрагмент нуклеїнової кислоти, що аденілювання мРНК і термінації бажано, щоб при кодує модифікований амілоїдогенний поліпептид. конструюванні відповідних плазмід, що експресуПереважно, щоб дана стабільна клітинна лінія ють, експресувалися послідовності, що термінусекретувала або несла аналог відповідно до винають, асоційовані з даними генами, також ліговані у ходу, таким чином полегшуючи його очищення. 3'-кінець послідовності вектора, що експресує. Як правило, плазмідні вектори, що містять реІнші промотори, що володіють додатковою пеплікон і контрольні послідовності, одержані з видів, ревагою транскрипції, контрольованої умовами 45 85815 46 росту, являють собою промоторні ділянки алкогоФахівцям зрозуміло, що не всі можливі варіанльдегідрогенази 2, ізоцитохрому С, кислої фосфати або модифікації природних АРР або Αb володітази, ферментів деградації, асоційованих з метають здатністю викликати у тварини утворення анболізмом азоту і вказаної вище гліцеральдегід-3титіл, які є перехресно-реагуючими з природною фосфа тдегідрогенази, і ферментів, що відповідаформою. Однак неважко зробити ефективний стають за утилізацію мальтози і галактози. Відповідндартний скринінг модифікованих амілоїдогенних ним є будь-який плазмідний вектор, що містить молекул, що задовольняють мінімальним вимогам промотор, придатний для дріжджів, ділянку початімунологічної реактивності, які обговорюються тут. ку реплікації і послідовності термінатора. Отже, можна застосовувати спосіб для ідентифіКрім мікроорганізмів, як хазяїни можна застокації модифікованих амілоїдогенних поліпептидів, совува ти культури клітин, одержаних з багатокліздатних індукува ти утворення антитіл проти немотинних організмів. В принципі будь-яка така клідифікованого амілоїдогенного поліпептиду у видів тинна культура є можливою, чи то є культура з тварин, де немодифікований амілоїдогенний поліхребетних або безхребетних. Однак найбільший пептид являє собою (неімуногенний) власний біінтерес представляють клітини хребетних, а розлок, причому цей спосіб включає в себе множення клітин хребетних у культурі (тканинна - одержання за допомогою пептидного синтезу культура) в останні роки стало звичайним спосоабо способів генної інженерії набору взаємно пробом [Tissue Culture, 1973]. Прикладами таких пристих аналогів відповідно до винаходу, де в амінодатних ліній клітин-хазяїнів є клітини VERO і HeLa, кислотну послідовність АРР або Αb виду тварин лінії клітин яєчника китайського хом'ячка (СНО) і додані, в неї вставлені, з неї видалені або в ній W138, ВНК, COS-7 293, клітини Spodoptera заміщені амінокислоти, таким чином приводячи до fragiperda (SF) (комерційно доступні як завершені амінокислотних послідовностей у наборі, які вклюсистеми, що експресують, крім іншого, у Protein чають в себе Т-клітинні епітопи, чужорідні для виSciences, 1000 Research Parkway, Meriden, CT ду тварин, або одержання набору фрагментів нук06450, U.S.A. та в In vitrogen) і клітинні лінії MDCK. леїнової кислоти, що кодують набір взаємно Найбільш переважна клітинна лінія відповідно до простих аналогів, даного винаходу являє собою лінію S2, доступну в - тестування елементів набору аналогів або Invitrogen, РО Box 2312, 9704 СН Groningen, The фрагментів нуклеїнової кислоти на їх здатність Netherlands. викликати продукцію антитіл у виду тварин проти Вектори, що експресують, для таких клітин немодифікованого АРР або Αb, звичайно включають в себе (якщо необхідно) ді- та ідентифікацію і, необов'язково, виділення лянку початку реплікації, промотор, розташований елемента(ів) набору аналогів, який(і) значимо інперед геном для експресії, разом з будь-якими дукує у виду продукцію антитіл проти немодифіконеобхідними ділянками зв'язування рибосом, діляваних АРР і Αb або ідентифікацію або, необов'язнками сплайсингу РНК, ділянкою поліаденілюванково, виділення продуктів, що експресують ня і послідовності термінатора транскрипції. поліпептид, які кодуються елементами набору Для застосування у клітинах ссавців, функції фрагментів нуклеїнової кислоти, що значимо індукерування на векторах, що експресують, часто кують у виду тварин продукцію антитіл проти незабезпечуються матеріалом вірусу. Наприклад, модифікованих АРР і Αb. звичайно застосовувані промотори одержують з У даному контексті, "набір взаємнопростих вірусу поліоми, аденовірусу 2 і, найчастіше, мавмодифікованих амілоїдогенних поліпептидів" явпячого вірусу 40 (SV40). Ранні та пізні промотори ляє собою колекцію неідентичних аналогів, вибравірусу SV40 особливо корисні у зв'язку з тим, що їх них на базі критеріїв, що обговорюються вище легко одержати з вірусу як фрагмент, що також (наприклад, у комбінації з дослідженням циркумістить ділянку початку реплікації вірусу SV40 лярного дихроїзму, спектрів ЯМР і/або профілів [Fiers et al., 1978]. Також можна використати мендифракції рентгенівських променів). Набір може ший і більший фрагменти SV40, за умови, що туди складатися тільки з малої кількості елементів, але включена послідовність довжиною приблизно вважають, що набір може містити і декілька сотень 250п.н., що продовжується від ділянки розпізнаелементів. вання Hindlll до ділянки розпізнавання Bgll, розтаТестування елементів набору, зрештою, можшована у вір усній ділянці початку реплікації. Крім на провести in vivo, але можна застосовувати ряд того, також можливо і часто бажано використовутестів in vitro, які зменшують кількість модифіковавати промотор або контрольні послідовності, звиних молекул, що служать метою даного винаходу. чайно асоційовані з бажаною генною послідовнісОскільки мета внесення чужорідних Ттю, за умови, що дані контрольні послідовності клітинних епітопів являє собою підтримку Всумісні з системами клітин-хазяїнів. клітинної відповіді за допомогою Т-клітин, необхідДілянку початку реплікації можна забезпечити на умова полягає утому, щоб аналог індукував або за допомогою конструювання такого вектора, проліферацію Т-клітин. Проліферацію Т-клітин щоб він включав в себе екзогенну ділянку початку можна тестува ти за допомогою стандартизованих реплікації, наприклад, яку можна одержати з SV40 аналізів проліферації in vitro. Коротко, від суб'єкта або інших вірусів (наприклад, вірусу поліоми, адеодержують зразок, збагачений Т-клітинами, і згоновірусів, VSV, BPV), або за допомогою механізму дом підтримують у культурі. Т-клітини, що культихромосомної реплікації клітини-хазяїна. Якщо веквуються, приводять у контакт з АРС суб'єкта, що тор інтегрований у хромосому клітини-хазяїна, її раніше захопили модифіковану молекулу і перечасто достатньо. творили її для презентації Т-клітинним епітопам. Ідентифікація придатних аналогів Спостерігають за проліферацією Т-клітин і порів 47 85815 48 нюють з відповідним контролем (наприклад, Тгтона); ІСАМ-І; IL-6; антиген CD68, асоційований з клітини у культурі, що контактували з АРС, які пелізосомами; Р21 ras; PLC-дельта 1 (ізофермент ретворювали інтактний нативний амілоїдогенний дельта 1 фосфоліпази С); компонент сироватковополіпептид). Альтернативно проліферацію можна го амілоїду Ρ (SAP); синаптофізин; синуклеїн виміряти за допомогою вимірювання концентрації (альфа-синуклеїн або NACP) і TGF-b1 (фактор вивільнення відповідних цитокінів Т-клітинами у росту b1, що трансформує). відповідь на розпізнавання ними чужорідних ТОписані у цьому документі засоби і способи клітин. знижувальної регуляції АРР або Αb можна комбіУявляється вельми вірогідним, що, оскільки нувати з лікуванням, наприклад, активною специщонайменше один аналог кожного типу набору фічною імунотерапією проти будь-якого з даних здатний викликати продукцію антитіл проти АРР інших амілоїдогенних поліпептидів. або Αb, можна одержати імуногенну композицію, Крім хвороби Альцгеймера, церебральна аміяка включає в себе щонайменше один аналог, лоїдна ангіопатія також являє собою хворобу, яка здатний індукувати утворення антитіл проти немоможе бути відповідною мішенню для наданого у дифікованих АРР або Αb у виду тварин, де немоданому документі способу. дифіковані АРР або Αb являють собою власні білПрипускають, що більшість способів імунізації ки, способом, що включає в себе змішування проти АРР або Αb потрібно обмежити імунізацією, елемента(ів) набору, який(і) значимо індукує прощо приводить до утворення антитіл, які перехресдукцію антитіл у виду тварин, що реагують з АРР но реагують з нативними АРР або Αb. Проте, у або Αb з фармацевтично та імунологічно прийнятдеяких випадках представляє інтерес індукувати ними носіями і/або розчинниками, і/або розріджуклітинний імунітет у формі CTL-відповіді проти вачами, і/або наповнювачами, необов'язково у клітин, які презентують епітопи МНС класу І з амікомбінації щонайменше з одним фармацевтично лоїдогенних поліпептидів - це може бути доцільта імунологічно прийнятним ад'ювантом. ним у тих випадках, коли зниження кількості клітин, Обговорювані вище тести наборів поліпептищо продукують АРР або Αb не приносить серйоздів легко виконати за допомогою початкового оденого несприятливого ефекту. У ти х випадках, коли ржання ряду взаємно простих послідовностей нукбажана CTL-відповідь, переважно використовувалеїнової кислоти або векторів відповідно до ти рекомендації авторів публікації [WO 00/20027]. винаходу, вставлянням їх у відповідні вектори, що Описи вказаних дво х документів, таким чином, експресують, трансформацією векторами відповівключені сюди за допомогою посилання. дних клітин-хазяїнів (або тварин-хазяїнів) і здійсІмуногенні носії ненням експресії послідовностей нуклеїнової кисМожна одержати молекули, які включають в лоти відповідно до винаходу. Після цих стадій себе Т-хелперний епітоп і пептиди АРР або Αb, що може йти виділення продуктів експресії. Переважявляють собою або включають В-клітинні епітопи, но, щоб послідовності нуклеїнової кислоти і/або ковалентно зв'язані з неімуногенною полімерною вектори одержували способами, які включають в молекулою, що діє як носій, наприклад, поліваленсебе застосування способів молекулярної амплітний активований полігідроксиполімер, які будуть, фікації, такими як ПЛР або за допомогою синтезу як вказано вище, функціонувати як молекули вакнуклеїнової кислоти. цини, що містять тільки імунологічно значимі часСпецифічні амілоїдогенні мішені тини, і вони являють собою здійснення, що цікавКрім найчастіше асоційованих з хворобою лять, у варіантах d і e, які обговорюються вище. Альцгеймера білків АРР, АроЕ4 і Таu, існує довгий Можна застосовувати змішані або так звані універсписок інших білків, так або інакше пов'язаних з AD сальні Т-хелперні епітопи, наприклад, якщо міабо внаслідок їх безпосередньої присутності у шень для вакцини являє собою власний білок АРР бляшках і клубках у головному мозку при AD або або Αb. Крім того, елементи, що посилюють імуновнаслідок їх вираженої генетичної асоціації із збілогічну відповідь, можна також зв'язати разом з льшеним ризиком розвитку AD. Більшість з даних носієм і таким чином вони будуть діяти як ад'юантигенів, якщо не всі, разом з обговорюваними вант. Такі елементи можуть являти собою манозу, вище Αβ, АРР, пресеніліном і АроЕ4, у визначених тафтсин, мурамілдипептид, мотиви CpG і т.п. В здійсненнях даного винаходу являють собою мож цьому випадку подальша ад'ювантна композиція ливі білки-мішені. Ці можливі мішені вже всебічно вакцинного продукту може не бути необхідною, і обговорювалися у [WO 01/62284]. Отже, ці можлипродукт можна вводити у чистій воді або фізіологіві мішені тут будуть тільки коротко згадані, тоді як чному розчині. більш докладне ґрунтовне обговорення можна Шляхом зв'язування епітопів цитотоксичних Тзнайти у [WO 01/62282], включеної сюди за допоклітин (CTL) з Т-хелперними епітопами можна гемогою посилання: нерувати CTL, специфічні у відношенні антигену, з альфа1-антихімотрипсин (ACT); альфа2якого одержаний CTL-епітоп. Елементи, що полемакроглобулін; ABAD (алкогольдегідрогеназа, що гшують захоплення продукту у цитозоль АРС, назв'язує Αb-пептид); APLP1 і -2 (білок, подібний до приклад, макрофагів, такі як маноза, також можна білка-попередника амілоїду 1 і 2); AMY117; Вах; зв'язувати з носієм, разом з CTL- і Т-хелперними Всl-2; гідролаза блеоміцину; BRI/ABRI; хромограепітопами, і посилити відповідь CTL. нін А; кластерин/apoJ; білок, що зв'язує CRF (факСпіввідношення В-клітинних і Т-хелперних епітор вивільнення кортикотропіну); EDTF (токсичний топів (Р2 і Р30) у кінцевому продукті можна варіюфактор, що походить з ендотелію); гепарансульвати шляхом зміни концентрації даних пептидів на фатпротеоглікани; білок-медіатор відповіді на костадії синтезу. Як вказано вище, імуногенну молелапсин людини 2; гентінгтин (білок хвороби Гентін 49 85815 50 кулу можна помітити, наприклад, манозою, тафтполі(силоксанів), полідиметил-силоксану, силікону, сином, CpG-мотивами або іншими імуностимулюполі(метилметакрилату) (РММА), полівінілового вальними речовинами (описаними тут) шля хом їх спирту), полі(вінілпіролідону), полі(2додавання, якщо необхідно, за допомогою, напригідроксіетилметакрилату), полі(N-вінілпіролідону), клад, амінованих похідних цих речовин, до карбополівінілового спирту), полі(акрилової кислоти), натного буфера на стадії синтезу. політетрафторетилену (PTFE), поліакриламіду, Якщо для комбінування пептидів, які містять Вполі(етиленковінілацетату), полі(етиленгліколю) і похідних, полі(метакрилової кислоти), полілактидів клітинні і Т-хелперні епітопи АРР або Αb, застосо(PLA), полігліколідів (PGA), повують нерозчинний активований полігідроксиполілі(лактидкогліколідів) (PLGA), поліангідридів і мер, то це можна, як вказано вище, провести у складних поліортоефірів. вигляді твердофазового синтезу, а кінцеві продукСередня молекулярна маса полігідроксиполіти можна зібрати і очистити шляхом промивання і фільтрації. Елементи для зв'язування з активовамеру, що розглядається (наприклад, перед активацією), звичайно складає щонайменше 1000, наним трезилом полігідроксиполімером (пептиди, приклад, щонайменше 2000, переважно - у мітки і т.п.) можна додавати до полігідроксиполідіапазоні 2500-2000000, більш переважно - у діамеру при низьких рН, наприклад, при рН 4-5, і допазоні 3000-1000000, особливо - 5000-500000. У зволяючи їм рівномірно перерозподілитися у "гелі" за допомогою пасивної дифузії. Далі, рН можна прикладах показано, що полігідроксиполімери із середньою масою у діапазоні 10000-200000 є осопідняти до рН 9-10 для запуску реакції основних бливо вигідними. аміногруп на пептидах і міток з трезильними груПолігідроксиполімер переважно є розчинним у пами на полігідроксиполімері. Після зв'язування воді у концентрації щонайменше 10мг/мл, перевапептидів і, наприклад, імуностимулювальних елементів гель подрібнюють з формуванням частинок жно, щонайменше 25мг/мл, наприклад, щонайменше 50мг/мл, особливо щонайменше 100мг/мл, відповідного для імунізації розміру. Такий імунонаприклад, щонайменше 150мг/мл при кімнатній ген, таким чином, включає в себе: температурі. Відомо, що декстран, навіть коли a) щонайменше одну першу амінокислотну поактивований, як тут описано, задовольняє вимогам слідовність, одержану з АРР або Αb, де щонаймерозчинності у воді. нше одна перша амінокислотна послідовність місДля деяких з найбільш цікавих полігідроксипотить у собі щонайменше один В-клітинний і/або лімерів співвідношення між групами С (атоми вугщонайменше один CTL-епітоп, і лецю) та ОН (гідроксильні групи) неактивованих b) щонайменше одну другу амінокислотну пополігідроксиполімерів (тобто нативні полігідроксислідовність, що включає в себе чужорідний епітоп полімери до активації) знаходиться у діапазоні від Т-хелперних клітин, 1,3 до 2,5, наприклад, 1,5-2,3, переважно - 1,6-2,1, де кожна з щонайменше першої і щонайменше особливо - 1,85-2,05. Поза зв'язком з якою-небудь другої амінокислотних послідовностей зв'язані з конкретною теорією вважають, що таке співвіднофармацевтично прийнятним активованим гідрошення С/ОН неактивованого полігідроксиполімеру ксиполімерним носієм. являє собою найбільш вигідний рівень гідрофільДля зв'язування амінокислотних послідовносності. Полівініловий спирт і полісахариди являють тей з полігідроксиполімером звичайно необхідно собою приклади полігідроксиполімерів, що задо"активувати" полігідроксиполімер, відповідною вольняють даній вимозі. Вважають, що вказане реакційною групою, яка може формувати необхідвище співвідношення повинно залишатися приний зв'язок з амінокислотними послідовностями. близно таким же для активованого полігідроксипоМається на увазі, що термін "полігідроксиполілімеру, тоді як співвідношення активації повинно мер" має те ж значення, що і у [WO 00/05316], тоббути істотно більш низьким. то полігідроксиполімер може мати точно такі ж Термін "полігідроксиполімерний носій" признахарактеристики, які конкретно вказані у даній зачений для позначення ділянки імуногена, яка несе явці. Отже, полігідроксиполімер може бути водоамінокислотні послідовності. Як загальне правило, розчинним або водонерозчинним (таким чином, полігідроксиполімерний носій має свої зовнішні потребуючи різних стадій синтезу у процесі одермежі, де амінокислотні послідовності можуть розжання імуногена). Полігідроксиполімер можна вищеплюватися пептидазами, наприклад, у клітині, брати з природних полігідроксисполук і синтетичщо представляє антиген, яка процесує імуноген. них полігідроксисполук. Отже, полігідроксиполімерний носій може являти Конкретні і переважні полігідроксиполімери собою полігідроксиполімер з активаційною групою, являють собою полісахариди, вибрані з ацетану, де зв'язок між активаційною групою і амінокислотамілопектину, камеді агар-агару, агарози, альгінаною послідовністю розщеплюється пептидазами в тів, гуміарабіку, карагенану, целюлози, циклодексАРС або гідроксиполімерний носій може являти тринів, декстрану, фурцеларану, галактоманану, собою гідроксиполімер з активаційною групою і, желатину, ghatti, глюкану, глікогену, гуар у, karaya, наприклад, містком, таким як одиночна Lkonjac/A, смоли плодів ріжкового дерева, манану, амінокислота або ряд D-амінокислот, де остання пектину, psyllium, pullulan, крохмалю, tamarine, частина містка може зв'язувати амінокислотні потрагаканту, ксантану, ксилану і ксилоглюкану. слідовності і розщеплюватися пептидазами в АРС. Особливо переважним є декстран. Як вказано вище, полігідроксиполімери несуть Однак полігідроксиполімер можна також вибфункціональні групи (активаційні групи), що полерати з сильнорозгалуженого полі(етиленіміну) гшують закріплення пептидів на носії. У даній об(РЕІ), тетратієніленвінілену, кевлару (довгі ланцюласті відома величезна кількість застосовних фунги поліпарафенілтерефталаміду), полі(уретанів), 51 85815 52 кціональних груп, наприклад, трезилова (трифтоспіввідношення між вільними гідроксильними груретилсульфонілова), малеімідна, парапами полігідроксиполімеру і активаційними групанітрофенілхлороформна, бромціанова, тозилова ми для одержання вигідного балансу між гідрофі(пара-толуолсульфонілова), трифлілова (трифтольністю і реактивністю полігідроксиполімеру рметан-сульфонілова), пентафторбензолсульфоповинно складати від 250:1 до 4:1. Переважно нілова і вінілсульфонова групи. Переважні приспіввідношення складає від 100:1 до 6:1, більш клади функціональних груп відповідно до даного переважно - від 60:1 до 8:1, особливо - від 40:1 до винаходу являють собою трезилові, малеімідні, 10:1. тозилові, трифлілові, пентафторбензолсульфоніОсобливо цікаві активовані полігідроксиполільні, пара-нітрофенілхлороформні та вінілсульфомери для застосування у способі для одержання нові групи, серед яких трезилові, малеімідні і тозизастосовного у більшості випадків імуногена відлові групи є особливо значимими. повідно до винаходу являють собою активовані Активовані трезилом полігідроксиполімери трезилом, тозилом і малеімідо полісахариди, осоможна одержувати із застосуванням трезилхлорибливо активований трезилом декстран (TAD), акду, як описано для активації декстрану у прикладі тивований тозилом декстран (TosAD) і активова1 і [WO 00/05316 або як описано у Gregorius et al., ний малеімідо декстран (MAD). J. Immunol. Meth. 181 (1995) 65-73]. Переважно, щоб зв'язок між полігідроксиполіАктивовані малеімідом полігідроксиполімери мерним носієм і зв'язаними з ним амінокислотними можна одержувати із застосуванням парапослідовностями розщеплювався пептидазами, малеімідофенілізоціанату, як описано для активанаприклад, такими як пептидази, активні при проції декстрану у [прикладі 3 в WO 00/05316]. Альтецесингу антигенів в АРС. Отже, переважно, щоб рнативно, малеімідні групи можна ввести у полігіщонайменше перша і щонайменше друга амінокидроксиполімер, наприклад, декстран, за слотні послідовності зв'язувалися з активованим допомогою дериватизації активованого трезилом полігідроксиполімерним носієм за допомогою аміполігідроксиполімеру (наприклад, активованого дного або пептидного зв'язку. Особливо переважтрезилом декстрану (TAD)) надлишком діамінової но, щоб кожна з щонайменше першої і щонайменсполуки (як правило, H2N-CnH2n-NH2, де n складає ше другої амінокислотних послідовностей 1-20, переважно 1-8), наприклад, 1,3надавала азотну груп у для амідного зв'язку, що діамінопропану, і, згодом, реакцією введених у відповідає їй. TAD аміногруп з реагентами, такими як сукциніміПолігідроксиполімерний носій може не містити дил-4-(N-малеімідометил)циклогексан-1амінокислотних залишків, якщо потрібно, щоб аккарбокислат (SMCC), суль фосукцинімідил-4-(Nтиваційна група надавала частину зв'язку, що малеімідометил)циклогексан-1-карбокислат (сурозщеплюється пептидазою, але, як вказано вище, льфоSМСС), сукцинімідил-4-(параносій може просто включати в себе спейсер, малеімідофеніл)бутират (SMPB), суль фосукцинівключаючи в себе щонайменше одну Lмідил-4-(пара-малеімідо-феніл)бутират (сульамінокислоту. Проте щонайменше перша і щонайменше друга амінокислотні послідовності звичайно фоSМРВ), Ν-g-малеімідобутирилоксисукцинімідні зв'язуються з активованим варіантом полігідроксискладні ефіри (GMBS) або Ν-gполімеру за допомогою азоту на N-кінці амінокисмалеімідобутирилоксисульфосукцинімідні складні лотної послідовності. ефіри. Незважаючи на те, що різні реагенти і шляОписаний вище імуноген, який застосовується хи активації формально приводять до продуктів, у більшості випадків, відповідно до даного винахоякі дещо відрізняються, активованих малеімідом ду можна застосовувати у способах імунізації, по відносно зв'язку між функціональністю малеіміду і суті, як тут описано, для поліпептидних вакцин. залишковою вихідною гідроксильною групою, на Тобто всі описи, які обговорюються тут, що відноякій проводили активацію, всі їх разом і окремо сяться до доз, способів введення і складу поліпепможна розглядати як "активовані малеімідом політидних вакцин для знижувальної регуляції амілоїгідроксиполімери". догенних поліпептидів з відповідними змінами Активовані тозилом полігідроксиполімери мовикористовують для звичайно застосовуваних імужна одержувати із застосуванням тозилхлориду, ногенів. як описано для активації декстрану у [прикладі 2 у Звичайно застосовуваний безпечний спосіб WO 00/05316]. Полігідроксиполімери, активовані вакцинації трифлілом і пентафторбензолсульфонілом, одерЯк обговорювалося вище, одне з переважних жують як аналоги, активовані тозилом або трезиздійснень даного винаходу спричиняє застосуванлом, наприклад, із застосуванням відповідних кисня варіантів амілоїдогенних пептидів, нездатних лих хлоридів. надати власні ТН-епітопи, здатні керувати імунною Активовані бромціаном полігідроксиполімери відповіддю проти амілоїдогенного поліпептиду. можна одержувати шляхом реакції полігідроксипоОднак автори даного винаходу вважають, що лімеру з бромціаном із застосуванням традиційних ця стратегія для розробки аутовакцин і для виклиспособів. Одержувані функціональні групи звичайку аутоімунітету являє собою застосовну у більшоно являють собою складні ефіри ціанової кислоти сті випадків технологію, яка є об'єктом винаходу з двома гідроксильними групами полігідроксиполісама по собі. Потрібно вважати особливо зручним меру. випадки, коли шуканий для знижувальної регуляції Ступінь активації можна виразити як співвідаутоантиген знаходиться в організмі в істотному ношення між вільними гідроксильними групами і надлишку, так що можливо, що може відбутися активаційними групами (тобто гідроксильними груаутостимуляція імунної відповіді. Отже, всі навепами, що стали функціональними). Вважають, що 53 85815 54 дені вище описи даного здійснення, оскільки це потенційну сильну перехресну реактивність по відноситься до забезпечення аутоімунної відповіді відношенню до зв'язаного з клітинною мембраною АРР, який присутній у великій кількості клітин ЦНС. проти АРР або Αb, з відповідними змінами, застоУ даному винаході надані способи ефективносовні до імунізації проти власних поліпептидів, го вироблення сильної імунної відповіді по відноособливо тих, які представлені в істотних кількосшенню до істинних власних білків, які потенційно тях, щоб підтримувати імунну відповідь у формі можуть формувати бляшки і викликати серйозне неконтрольованого аутоімунного стану внаслідок того, що ТН-епітопи відповідних власних білків назахворювання ЦНС або інших частин організму. Із застосуванням даної технології буде розроблена правляють імунну відповідь. безпечна і ефективна терапевтична вакцина на Приклад 1 Підхід аутовакцинації для імунізації проти АD основі білка Αb для лікування AD. Той факт, що миші, які характеризуються ноУ світлі цього, можна очікувати, що AD, за хворювання, яке за прогнозами могло завдати шкоди каутом гена білка Αb, не виявляють ніяких відхисистемі охорони здоров'я у наступному сторіччі, лень або несприятливих побічних ефектів, вказує можна вилікувати; або такі описані вакцини можуть на те, що усунення або зменшення кількостей Αb є щонайменше створювати ефективний терапевтичбезпечним, [Zheng H. (1996)]. ний підхід до лікування симптомів і прогресії даноОпубліковані експериментальні дані, де трансго захворювання. Даний спосіб являє собою абсогенних тварин імунізували проти трансгенного біллютно новий імунологічний підхід до блокування ка Αb людини, вказують на те, що якщо можливо накопичення амілоїду при AD, а також при інших порушити аутотолерантність, то знижувальну реневрологічних захворюваннях. гуляцію Αb можна одержати за допомогою аутореУ таблиці нижче вказано 35 конструкцій, що активних антитіл. Дані експерименти, крім того, розглядаються. Всі позиції подані у таблиці відновказують на те, що така знижувальна регуляція Αb сно стартового метіоніну АРР (перша амінокислопотенційно могла б як запобігати формуванню та у SEQ ID NO:2) і включають як стартову, так і бляшок, так і очищати головний мозок від Αbкінцеву амінокислоти, наприклад, фрагмент 672бляшок, що вже сформувалися, [пор. Schenk et al. 714 включає як амінокислоту 672, так і 714. Стар(1999]). Однак звичайно неможливо одержати антові і кінцеві положення для Р2 і Р30 показують, титіла проти власних білків. що епітоп заміщає частину фрагмента АРР у вкаТаким чином, опубліковані дані не надають заних положеннях (обидва положення включені у способів порушення істинної аутотолерантності по заміну), у більшості конструкцій введені епітопи відношенню до істинних власних білків. Дані не заміщають фрагмент, що дорівнює по довжині дають також інформації про те, як можна перекоепітопу. Зірочки у таблиці означають наступне: натися у випадку необхідності, що імунна реакція *) Тільки одне положення для Р2 і Р30 вказує направлена виключно або переважно проти відна те, що у даному положенні епітоп вставляли у кладень Αb, а не проти зв'язаного з клітинною похідне АРР (епітоп починається з амінокислоти, мембраною білка-попередника Αb (ΑΡΡ). Імунна що примикає до вказаного положення з боку Свідповідь, яку одержують за допомогою існуючої кінця). технології, буде переважно викликати імунну від**) Конструкція 34 містить три ідентичних фраповідь по відношенню до власних білків нерегугменти АРР, розділених за допомогою Р30 і Р2, льованим чином, так що можна одержати небажавідповідно. ну або надмірну аутореактивність по відношенню ***) Конструкція 35 містить дев'ять ідентичних до ділянок білка Αb. Отже, із застосуванням існуюфрагментів АРР, розділених за допомогою епітопів чих стратегій імунізації, швидше всього, неможлиР30 і Р2, що чергуються. во одержати сильні імунні відповіді по відношенню до власних білків; більш того це небезпечно через Конструкції АРР Auto Vac № варіа- Початок фрагмента АРР відносно 1 ак нта АРР 1 2 1 630 2 630 3 672 4 672 5 672 6 672 7 672 8 672 9 672 10 672 11 672 Кінець фрагмента АРР відносно 1 ак АРР 3 770 714 770 770 770 770 770 770 714 714 714 Положення епітопу Положення епітопу Довжина Р2 відносно 1 ак АРР Р30 відносно 1 ак молекули АРР 4 5 6 656-670 635-655 141 656-670 635-655 85 735-749 714-728 99 714-728 99 714-728 99 723* 723* 135 723* 120 723* 114 672* 64 714* 64 672* 58 55 1 12 13 14 14 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 2 672 672 672 672 672 672 672 672 672 672 672 672 672 672 672 672 672 672 672 672 672 672 672 672 85815 Конструкції АРР Auto Vac 3 714 714 714 714 714 714 714 714 714 714 714 714 714 714 714 714 714 714 714 714 714 714 714 714 Ділянка АРР, проти якої найбільш цікаво одержати відповідь, складає 43 амінокислоти корового пептиду Αb (Αb-43, що відповідає SEQ ID NO:2, залишки 672-714), який є основною складової амілоїдних бляшок у головному мозку при AD. Даний фрагмент АРР є частиною всіх перерахованих вище конструкцій. Варіанти 1 і 2 містять ділянку АРР проти ходу транскрипції від Αb-43, де помістили модельні епітопи Р2 і Р30. Всі варіанти 1 і 3-8 містять фрагмент С-100, що є, як показано, нейротоксичним фрагмент С-100 відповідає амінокислотним залишкам 714-770 з SEQ ID NO:2. У варіантах 3-5 епітопи заміщають частину фрагмента С-100, у той час як у варіантах 6-8 епітопи вставляли у С-100. Варіанти 9-35 містять тільки коровий білок Αb43. У варіантах 9-13 Р2 і Р30 злиті з тим або іншим кінцем Αb-43; у 14-21 Р2 і Р30 заміщають частину Αb-43; у 22-33 Р2 і Р30 вставляли в Αb-43; 34 містить три ідентичних фрагменти Αb-43, розділених Р30 і Р2, відповідно; 35 містить 9 повторів Αb-43, розділених епітопами Р2 і Р30, що чергуються. Відповідно до даного винаходу, в імуногенних аналогах можна також застосовувати укорочені частини білка Αb-43, що обговорюється вище. Особливо переважними є укорочені частини Αb(142), Αb(1-40), Αb(1-39), Αb(1-35), Αb(1-34), Αb(1-28), Αb(1-12), Αb(1-5), Αb(13-28), Αb(13-35), Αb(17-28), Αb(25-35), Αb(35-40), Αb(36-42), і Αb(35-42) (де номери у дужках вказують амінокислотні ділянки Αb-43, які складають відповідний фрагмент, наприклад, Αb(35-40) ідентичний амінокислотам 706711 у SEQ ID NO:2). Всі дані варіанти з укороченими частинами Αb-43 можна одержати з фрагме 4 714* 714* 680-694 685-799 690-704 695-709 680* 690* 700* 710* 680* 690* 700* 710* Після повтору 1** 34*´3* 56 5 672* 675-695 680-700 685-705 690-710 680* 690* 700* 710* 680* 690* 700* 710* Після повтору 2** 34´3*** 6 58 79 43 43 43 43 43 43 43 43 79 79 79 79 64 64 64 64 58 58 58 58 165 165 нтами Αb, описаними тут, особливо з варіантами 9, 10, 11, 12, і 13. У деяких випадках переважно, щоб Αb-43 або його фрагменти були мутантними. Особливо переважними є варіанти заміни, в яких метіонін у положенні 35 Αb-43 заміщений переважно на лейцин або ізолейцин або просто видалений. Особливо переважні аналоги містять одиночний метіонін, розташований на С-кінці, або у зв'язку з тим, що він є природним в амілоїдогенному поліпептиді або чужорідному епітопі ТН, або у зв'язку з тим, що його вставили або додали. Отже, також переважно, щоб та ділянка аналога, яка включає в себе чужорідний епітоп ТН, була вільною від метіоніну, за винятком можливого С-кінцевого розташування метіоніну. Фактично, як правило, переважно, щоб всі аналоги АРР або Αb, які застосовують відповідно до даного винаходу, володіли загальною характеристикою простого включення одного-єдиного метіоніну, розташованого в аналогу як С-кінцева амінокислота, а всі інші метіоніни як в амілоїдогенному поліпептиді, так і в чужорідному епітопі ТН, були видалені або заміщені іншою амінокислотою. Цікавою додатковою мутацією є делеція або заміщення фенілаланіну у положенні 19 в Αb-43, і особливо переважно, щоб дана мутація являла собою заміну цього залишку фенілаланіну на пролін. Наступна таблиця визначає групу особливо переважних конструкцій, що функціонують з укороченими формами або мутаціями Αb-43: 57 85815 58 Сегмент Αb, що застосову- Положення сегмента Положення епіт опу Положення епіт опу Загальна довР30 в ідносно 1 ак жина молекули № в аріанта ється у молекулі, в ідносно 1 Αb в ідносно 1 ак мо- Р2 в ідносно 1 ак лекули молекули молекули (ак) ак Αb (1-42/43) 36 1-28 22-49 50-64 1-21 64 37 1-12 (а)+13-28 (b) 1-12 (а)+49-64 (b) 34-48 13-33 64 38 1-12, 34-45, 61-72 46-60 13-33 72 1-12 (´3) 39 1-16, 38-53, 69-84 54-68 17-37 84 13-28 (´3) 1-12 (а)+34-56 (b)+7240 1-12 (а)+13-35 (b)+36-42 (с) 57-71 13-33 78 78 (с) 41 1-28, 50-77, 93-120 78-92 29-49 120 1-28 (´ 3) 42 1-43 (F19P/M35K) 1-43 65-79 44-64 79 У даній таблиці сегмент Αb, що використовується у молекулі, вказаний за допомогою номерів амінокислот відносно 1 ак молекули Αb (1-42/43), тобто 1-28 означає, що у молекулі використали фрагмент Αb (1-42/43) 1-28. Якщо використали два або більше різних фрагментів, у таблиці вказані обидва, тобто 1-12 (а)+13-28 (b) означає, що у молекулі використаний як фрагмент Αb (1-42/43) 112, так і фрагмент 13-28. Також якщо один і той же сегмент присутній у конструкції більш ніж в одній копії, це вказано у таблиці, тобто 1-12 (´3) вказує на те, що фрагмент Αb (1-42/43) 1-12 присутній у конструкції у трьох копіях. Далі, положення сегмента Αb у молекулі вказане за допомогою позицій амінокислот відносно першої амінокислоти у молекулі, тобто 22-49 вказує на те, що фрагмент Αb, який розглядається, розташований у молекулі від 22 амінокислоти до 49 амінокислоти, включаючи обидва положення. Положення епітопів Р2 і Р30 позначені таким же чином. Якщо у молекулі використали два або більше різних фрагментів Αb, всі їх положення вказані, тобто 1-12 (а)+49-64 (b) означає, що фрагмент (а) розташовується у молекулі від ак 1 до ак 12, і фрагмент (b) - від ак 49 до 64. Більш того якщо у молекулі присутня більш ніж одна копія одного і того ж фрагмента, вказані положення всіх копій, тобто 1-12, 34-45, 61-72 показує, що три копії фрагмента Αb розміщуються у молекулі у положеннях 1-12, 34-45 і 61-72, відповідно. Нарешті, зазначення сумарної довжини кожної молекули включає і фрагмент(и) Αb, і епітопи Р2 і Р30. Варіант 42 містить дві амінокислотні заміни у положеннях 19 (phe на pro) і 35 (met на lys), як це вказано у стовпці, що представляє фрагменти Αb. Див. Фігур у 1 і таблиці вище відносно деталей конкретних точок введення чужорідних Т-клітинних епітопів. Один з додаткових типів конструкцій є особливо переважним. Оскільки однією із задач даного винаходу є уникнення руйнування клітин, що продукують АРР, в той час як усунення Αb є бажаним, вважається придатним одержати конструкції аутовакцин, що включають в себе тільки ті частини Αb, які, коли присутні в АРР, не експонуються у позаклітинній фазі. Таким чином, подібні конструкції повинні містити щонайменше один В-клітинний епітоп, одержаний з амінокислотного фрагмента, що визначається амінокислотами 700-714 в SEQ ID NO:2. Оскільки передбачено, що такий короткий поліпептидний фрагмент буде тільки слабо імуногенним, переважно, щоб така конструкція аутовакцини складалася з декількох копій В-клітинного епітопу, наприклад, у вигляді конструкції, що має структур у, показану у формулі 1 в докладному описі даного винаходу, пор. вище. У даній версії формули 1 терміни амілоїде1-амілоїдех являють собою x В-клітинний епітоп, що містить послідовність амінокислот, одержану з амінокислот 700-714 SEQ ID NO:2. Переважна альтернатива являє собою детально описану вище можливість зв'язування амілоїдогенного (полі)пептиду з вибраним Тхелперним епітопом за допомогою амідного зв'язку з полісахаридною молекулою-носієм, таким способом стають можливими множинні презентації "слабкого" епітопу, сконструйованого амінокислотами 700-714 SEQ ID NO:2, а також стає можливим вибір оптимального співвідношення між Вклітинними і Т-клітинними епітопами. Приклад 2 Імунізація трансгенних мишей Αb і модифікованими білками відповідно до винаходу. Конструювання ДНК, що кодує hAB43+-34. Ген hAB43+-34 конструювали у декілька стадій. Спочатку одержували фрагмент ПЛР з праймерами МЕ№801 (SEQ ID NO:10) і МЕ№802 (SEQ ID NO:11), застосовуючи як матрицю праймер МЕ№800 (SEQ ID NO:9). МЕ№800 кодує фрагмент abeta-43 людини з оптимізованими для Е. coli ко донами. МЕ№801 і 802 додають до фрагмента відповідні ділянки рестрикції. Фрагмент ПЛР очищали, розщеплювали Ncol і Hindlll, знову очищали і клонували у розщепленому Ncol-Hindlll і очищеному векторі для експресії в Е. coli рЕТ28b+. Одержану плазміду, що кодує Αb-43 дикого типу людини, назвали рАВ1. На наступній стадії до С-кінця молекули додавали Т-хелперний епітоп Р2. Праймер МЕ№806 (SEQ ID NO:12) містить послідовність, що кодує епітоп Р2, таким чином, продукт злиття Р2 і abeta43 одержують за допомогою реакції ПЛР. Клонування проводили за допомогою одержання фрагмента ПЛР з праймерами МЕ№178 (SEQ ID NO:8) і МЕ№806, застосовуючи як матрицю рАВ1. Фрагмент очищали, розщеплювали Ncol і Hindlll, знову очищали і клонували у розщепленому Ncol-Hindlll і очищеному векторі рЕТ28b+. Одержану плазміду назвали рАВ2. Аналогічним способом одержували іншу плазміду, яка несе кодувальну послідовність Αb-43 з іншим Т-хелперним епітопом, Р30, доданим до Nкінця. Це виконували за допомогою одержання фрагмента ПЛР з праймерами МЕ№105 (SEQ ID 59 85815 60 NO:7) і МЕ№807 (SEQ ID NO:13), застосовуючи як Експресія і очищення hAB43+-34. Білок матрицю рАВ1. hAB43+-34, що кодується рАВ5, експресували у Фрагмент очищали, розщеплювали Ncol і клітинах Е. coli BL21-Gold (Novagen) як описано Hindlll, знову очищали і клонували у розщепленому виробниками системи pET28b+ (Novagen). Ncol-Hindlll і очищеному векторі рЕТ28b+. ОдержаЕкспресований білок bАВ43+-34 очищали до ну плазміду назвали рАВ3. більш ніж 85% чистоти за допомогою промивання тілець включення з подальшою катіонообмінною На третій стадії другий повтор Αb-43 з С-кінця додавали до епітопу Р2 плазміди рАВ2 за допомохроматографією у присутності 6Μ сечовини із застосуванням автоматизованого робочого місця гою праймера МЕ№809 (SEQ ID NO:14). У той же для очищення BioCad (PerSeptive Biosystems, час МЕ№809 створює сайт BamHI безпосередньо USA). Потім сечовину видаляли за допомогою ступісля повтору Αb-43. Фрагмент ПЛР одержували з пінчатого діалізу проти розчину, що містить кількопраймерами МЕ№178 і МЕ№809, застосовуючи як сті сечовини, які зменшуються. Кінцевий буфер матрицю рАВ2. Фрагмент розщеплювали Ncol і являв собою 10мМ Tris, рН 8,5. Hindlll, очищали і клонували у розщепленому NcolДослідження імунізації. Для дослідження викоHindlll і очищеному векторі рЕТ28b+. Дану плазміристовували мишей, трансгенних по АРР (білокду назвали рАВ4. попередник хвороби Алидгеймера) людини. Дані Нарешті, послідовність епітоп Р30 - повтор Αbмиші, які називаються TgRND8+, експресують му43 з рАВ3 клонували у плазміду рАВ4. Це виконутантну форму АРР, що приводить до високих конвали за допомогою одержання фрагмента ПЛР з центрацій Αb-40 і Αb-42 у головному мозку мишей праймерами МЕ№811 (SEQ ID NO:16) і МЕ№105, [Janus, С. et al.]. застосовуючи як матрицю рАВ3. Фрагмент очищаМишей (8-10 мишей у гр упі) імунізували або ли і використовували як праймер у подальшій ПЛР Abeta-42 (SEQ ID NO:2, залишки 673-714, синтезоз МЕ№810 (SEQ ID NO:15), застосовуючи як матваним за допомогою стандартного способу з рицю рАВ3. Одержаний фрагмент очищали, розFmoc), або варіантом hAB43+-34 (конструкція 34 у щеплювали BamHI і Hindlll і клонували у розщептаблиці в прикладі 1, одержана рекомбінантним лену BamHI-Hindlll і очищену плазміду рАВ4. способом) чотири рази з двотижневими інтерваОдержана плазміда, рАВ5, кодує молекулу лами. Дози складали 100мг для Αb або 50мг для bАВ43+-34. hAB43+-34. У мишей брали кров на 43 добу (після Всі способи ПЛР і клонування по суті виконутрьох ін'єкцій) і після 52 діб (після чотирьох ін'єквали, як описано в [Sambrook, J., Fritsch, E.F. & цій), і для визначення рівня специфічних титрів Maniatis, Т. 1989 "Molecular cloning: a laboratory manual". 2nd. Ed. Cold Spring Harbor Laboratory, антитіл проти Αb-42 із застосуванням прямого N.Y.]. ELISA Αb-42 використовували сироватку. Для всіх способів клонування застосовували Наступна таблиця показує середні відносні тиклітини Е. coli К-12, штам Тор-10 F' (Stratagene, три антитіл проти Abeta-42. USA). Вектор pET28b+ одержували в Novagen, USA. Всі праймери синтезували у DNA Technology, Denmark. Імуноген Αb-42 hАВ43+-34 43 доби (після 3 імунізацій) 4000 16000 Як стає зрозуміло, титри антитіл, одержані при імунізації варіантом Αb hAB43+-34, вище приблизно у 4 рази і в 7,5 разів після 3 і 4 імунізацій, відповідно, ніж титри, одержані із застосуванням як імуногена незміненого Αb-42 дикого типу. Даний факт у перспективі можна оцінити додатково, якщо брати до уваги той факт, що кількість варіанта, який застосовується для імунізації, складає тільки 50% від кількості послідовності дикого типу, що застосовується для імунізації. Приклад 3 Синтез Αb співполімерної пептидної вакцини із застосуванням активованого полігідроксиполімеру як агента, що структур ує. Вступ. Традиційна кон'югована вакцина складається з (полі)пептиду, ковалентно зв'язаного з білком-носієм. Пептид містить В-клітинний(і) епітоп(и), а білок-носій надає Т-хелперні епітопи. Однак більшість білків-носіїв у нормі є непридатними як джерела Т-хелперних епітопів, оскільки тільки незначна частина всієї послідовності містить придатні Т-хелперні епітопи. Такі епітопи можна ви 52 доби (після 4 імунізацій) 3000 23000 значити і синтезувати як пептиди, наприклад, по 12-15 амінокислот. Якщо дані пептиди ковалентно зв'язані з пептидами, які містять В-клітинні епітопи, наприклад, за допомогою полівалентного активованого полігідроксиполімеру, можна одержати молекулу вакцини, яка містить тільки значимі ділянки. Надалі можна одержати вакцинний кон'югат, який містить оптимізоване співвідношення між Вклітинними і Т-клітинними епітопами. Синтез активованого полігідроксиполімеру. Полігідроксиполімери, такі як декстран, крохмаль, агароза і т.д. можна активувати 2,2,2трифторетансульфоніл-хлоридом (трезилхлоридом) або за допомогою гомогенного синтезу (декстран), розчиненим у N-метилпіролідоні (NMP) або способом гетерогенного синтезу (крохмаль, агароза, структурований декстран), наприклад, в ацетоні. У сухи х умовах в 500мл круглодонну колбу, обладнану магнітом для перемішування, до висушеного виморожуванням, водорозчинного декстрану (4,5г, 83моль, очищений до ступеня, прида
ДивитисяДодаткова інформація
Назва патенту англійськоюUse of immunogene for prevention and treatment of alzheimer's disease or other diseases associated with deposition of amyloid
Автори англійськоюRasmussen Peter Birk, Jensen Martin Roland, Nielsen Klaus Gregorius, Koefoed Peter, Degan Florence Dal
Назва патенту російськоюПрименение иммуногена для профилактики или лечения болезни альцгеймера или других заболеваний, связанных с отложением амилоида
Автори російськоюРасмуссен Петер Бирк, Энсен Мартин Роланд, Нильсен Клаус Грегориус, Кофод Петер, Деган Флоранс Даль
МПК / Мітки
МПК: A61K 39/00, C07K 19/00, C07K 14/435, A61P 25/28, A61K 38/17
Мітки: хвороби, відкладенням, захворювань, амілоїду, лікування, профілактики, пов'язаних, застосуваня, імуногену, інших, альцгеймера
Код посилання
<a href="https://ua.patents.su/43-85815-zastosuvanya-imunogenu-dlya-profilaktiki-abo-likuvannya-khvorobi-alcgejjmera-abo-inshikh-zakhvoryuvan-povyazanikh-z-vidkladennyam-amilodu.html" target="_blank" rel="follow" title="База патентів України">Застосуваня імуногену для профілактики або лікування хвороби альцгеймера або інших захворювань, пов’язаних з відкладенням амілоїду</a>
Попередній патент: Рушій транспортних засобів з ручним приводом
Наступний патент: Спосіб визначення кута нахилу житлових будинків і будівельних споруд у процесі їхньої експлуатації
Випадковий патент: Система дренажу і контролю поливу для горщика для рослин