Вакцина
Формула / Реферат
1. Застосування імуногенної композиції, яка містить gЕ ВВВ чи його імуногенний фрагмент, причому gЕ ВВВ не є у формі гібридного білка, та ад'ювант, який містить QS21, 3D-МФЛ та ліпосоми, у виготовленні медикаменту для попередження або зменшення інтенсивності оперізувального герпесу та/або постгерпетичної невралгії.
2. Застосування за п. 1, де ліпосоми містять холестерин.
3. Застосування за п 1 або 2, де МФЛ знаходиться всередині ліпосом.
4. Застосування за будь-яким з попередніх пунктів, де gЕ ВВВ є скороченим.
5. Застосування за п. 4, де gЕ ВВВ є скороченим С-термінально.
6. Застосування за п. 5, де gЕ ВВВ складається з амінокислотної послідовності SEQ ID N0. 1.
7. Застосування за будь-яким з попередніх пунктів для застосування у популяції осіб віком 50 років або старіше.
8. Застосування за будь-яким з попередніх пунктів для застосування у популяції осіб з послабленим імунітетом.
9. Імуногенна композиція або вакцина, яка по суті складається з антигену gЕ ВВВ, скороченого з видаленням карбокситермінального закріплювального регіону, причому gЕ ВВВ не є у формі гібридного білка, у комбінації з ад'ювантом, який містить QS21, 3D-МФЛ та ліпосоми, що містять холестерин.
10. Застосування антигену gЕ ВВВ або його імуногенного похідного, як визначено в будь-якому з пп. 1-6, у виготовленні медикаменту для супутнього або послідовного застосування з живим послабленим або повністю інактивованим ВВВ, комбінацію застосовують для попередження або зменшення суворості оперізувального герпесу та/або постгерпетичної невралгії у осіб при ризику таких хвороб.
11. Застосування за п. 10, де антиген gЕ ВВВ уводять супутньо з живим послабленим ВВВ.
12. Застосування за п. 10 або 11, де антиген gЕ ВВВ є С-термінально скороченим антигеном gЕ ВВВ, а живий послаблений ВВВ є послабленим штамом ОКА ВВВ.
13. Комплект, що містить живий послаблений ВВВ або повністю інактивований ВВВ, а окремо, антиген gЕ ВВВ або його імуногенне похідне, як визначено в будь-якому з пп. 1-6, компоненти придатні для послідовного чи супутнього уведення, або для змішування як єдиної композиції перед уведенням.
14. Комплект, що містить як окремі компоненти Th1-ад'ювант, як визначено в будь-якому з пп. 1-3, та антиген gЕ ВВВ або його імуногенний фрагмент, як визначено в будь-якому з пп. 1-6, що є придатними для негайного отримання композиції вакцини для попередження або зменшення інтенсивності оперізувального герпесу та/або постгерпетичної невралгії.
Текст
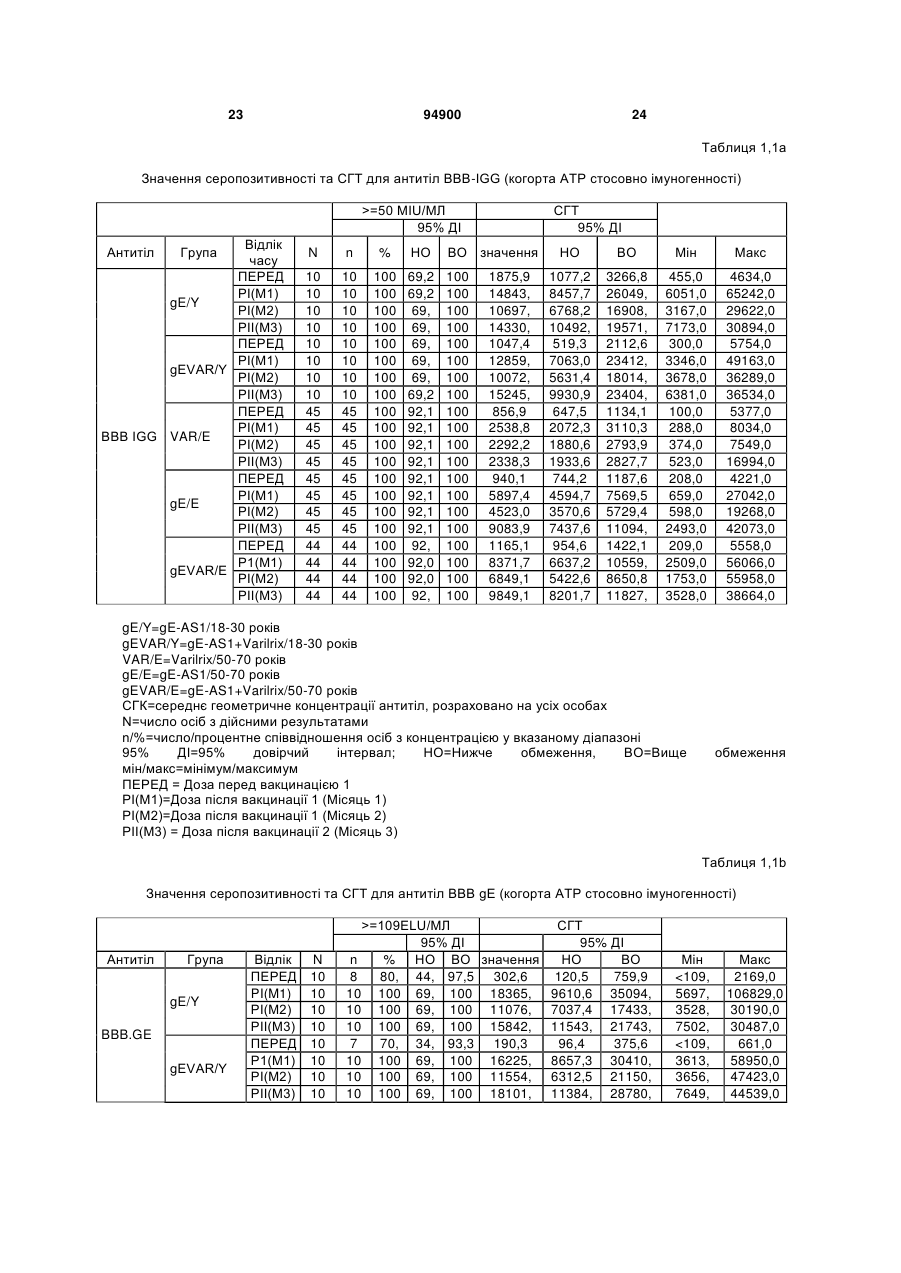
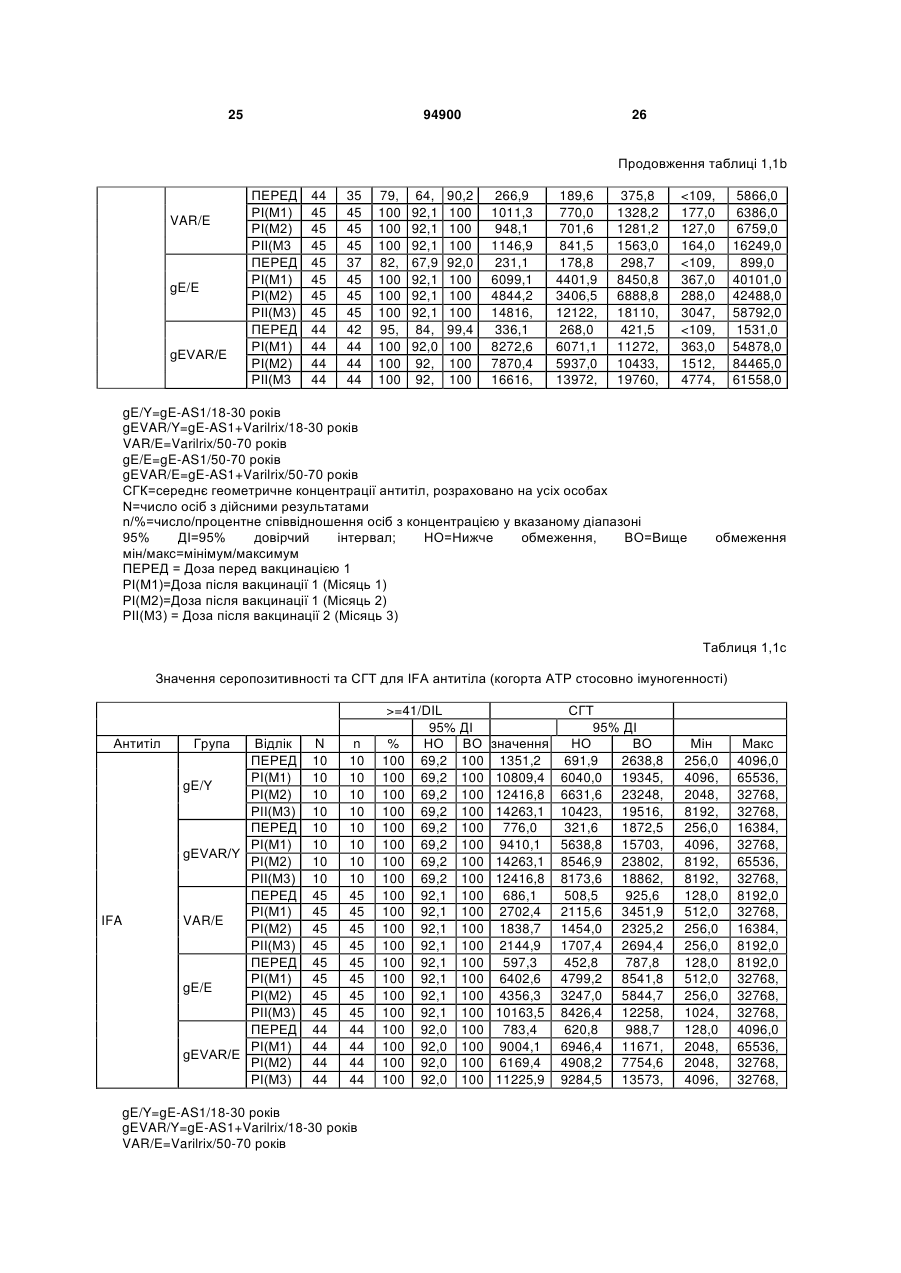
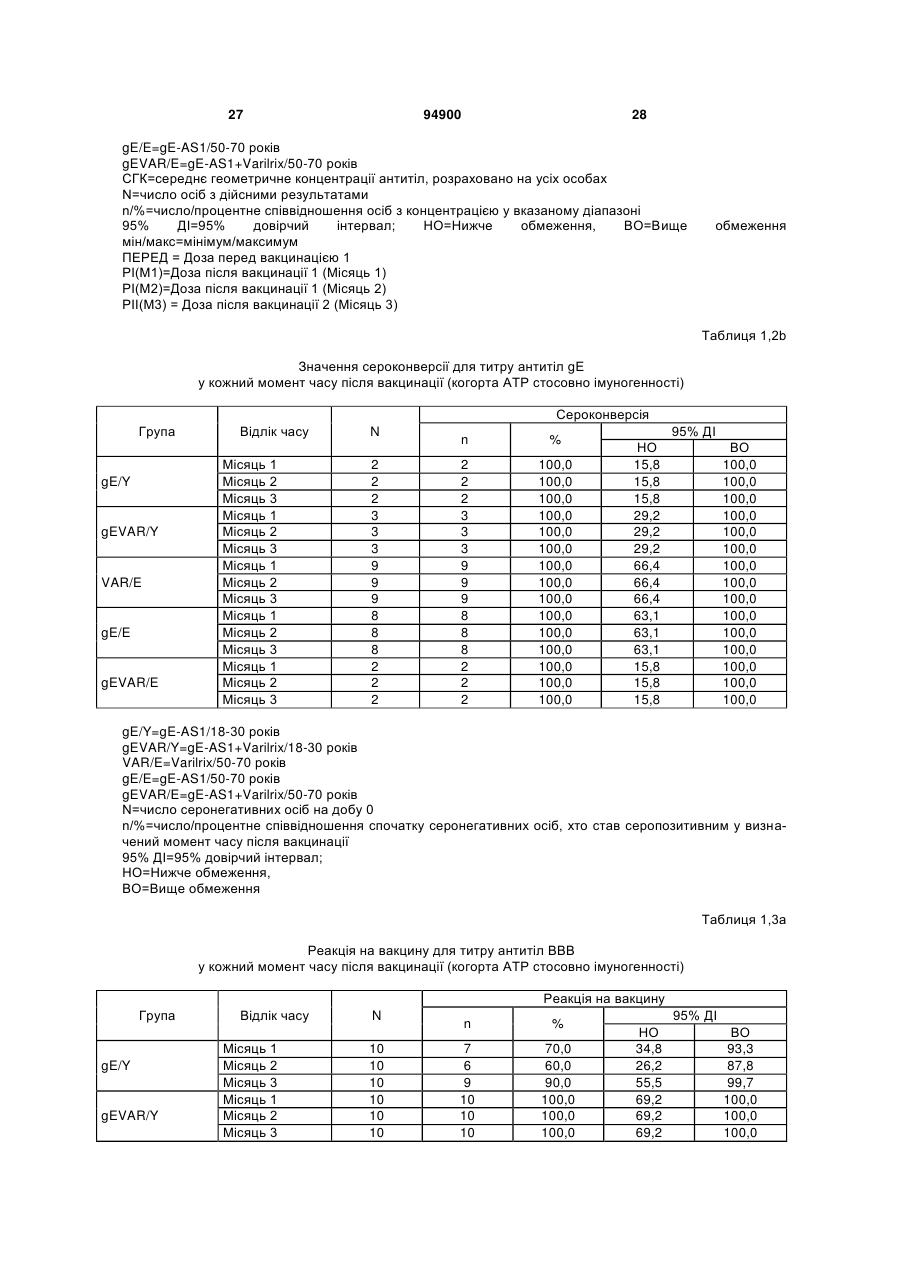
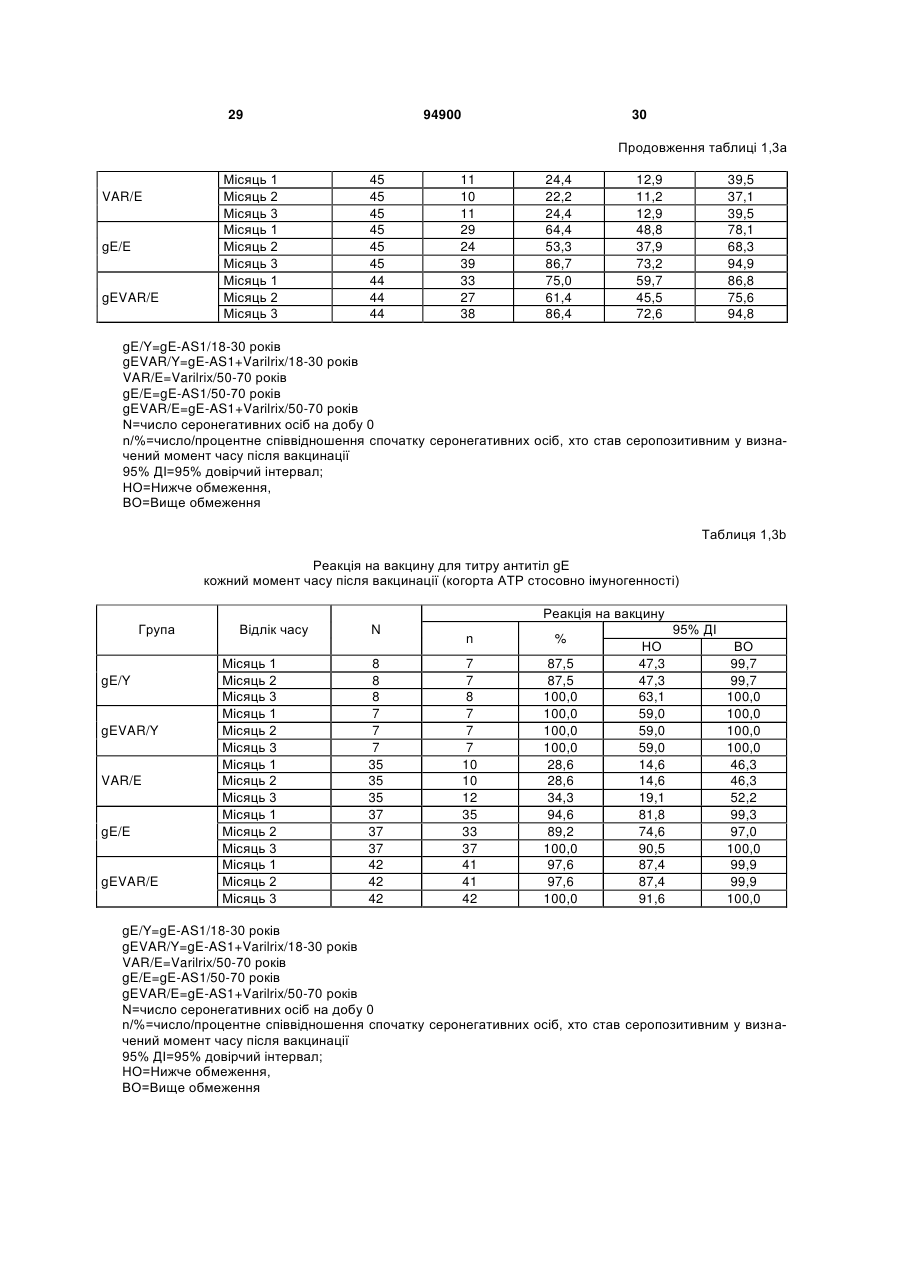
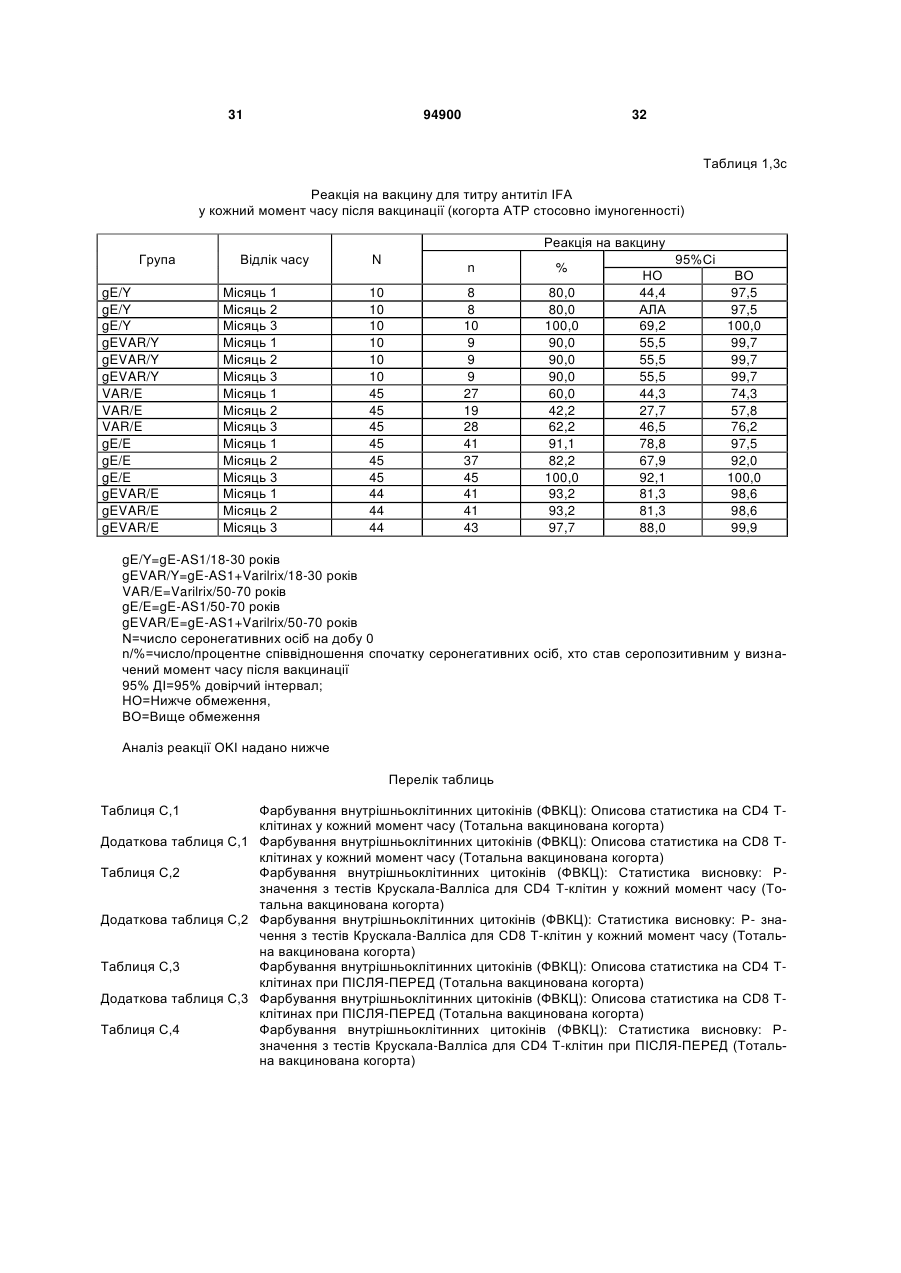
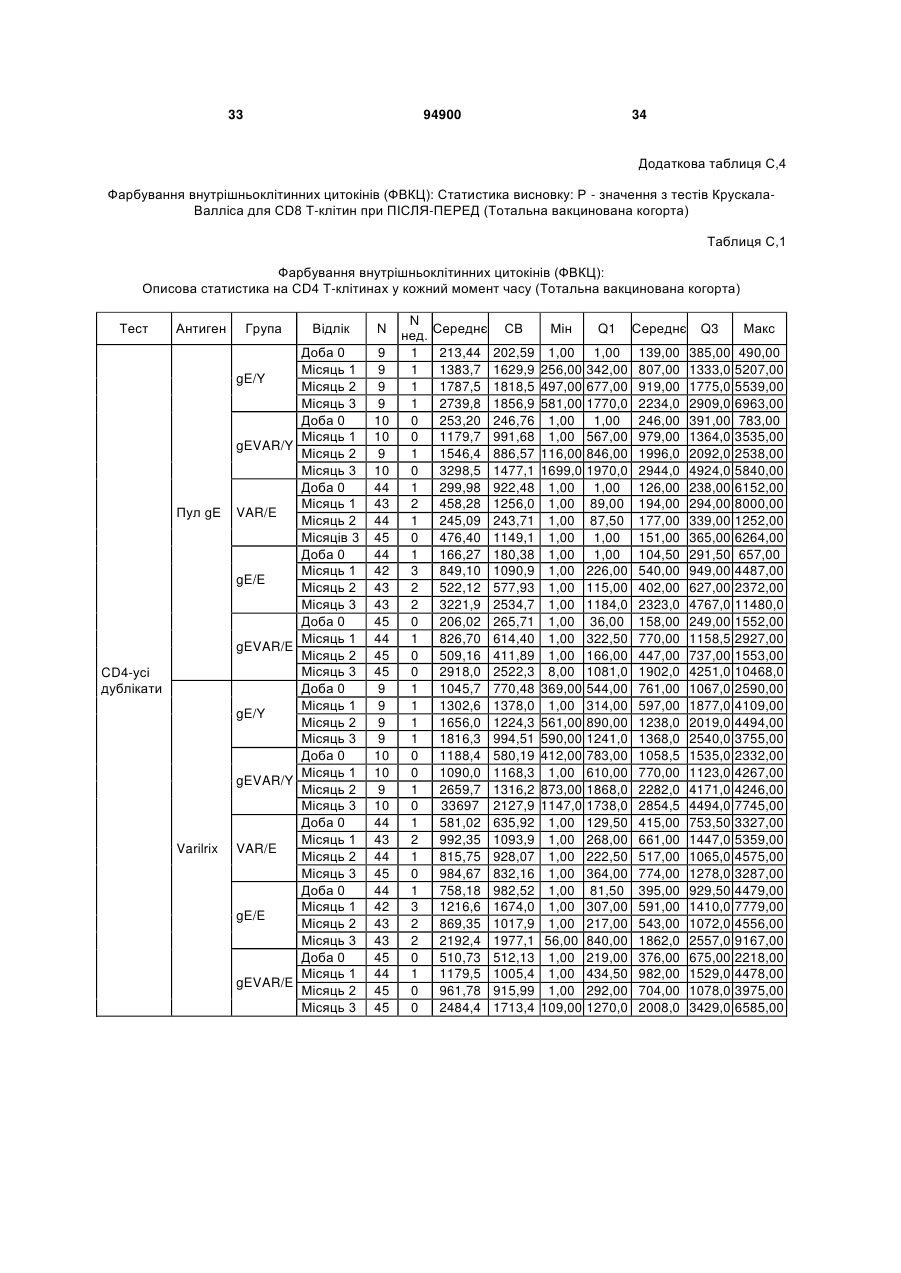
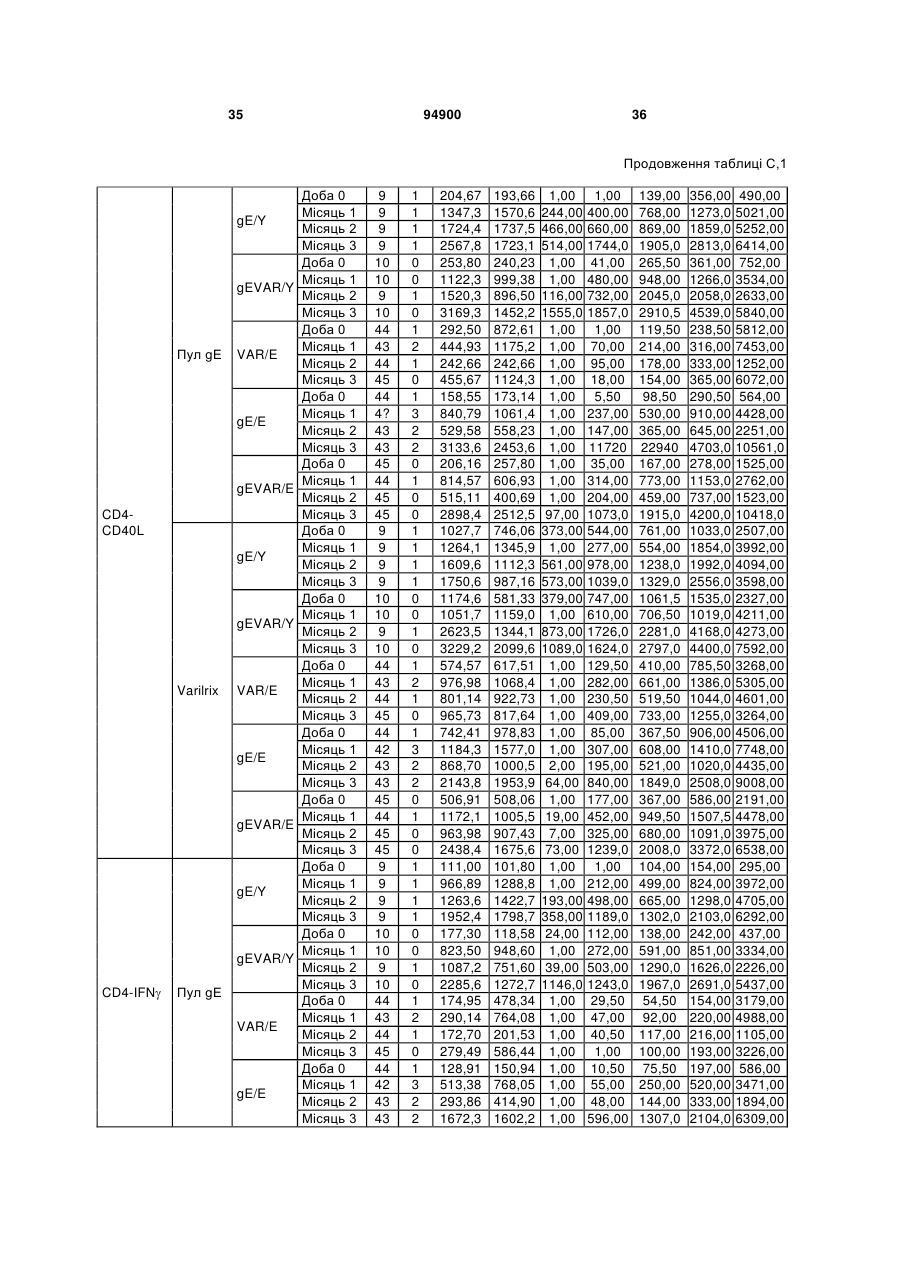
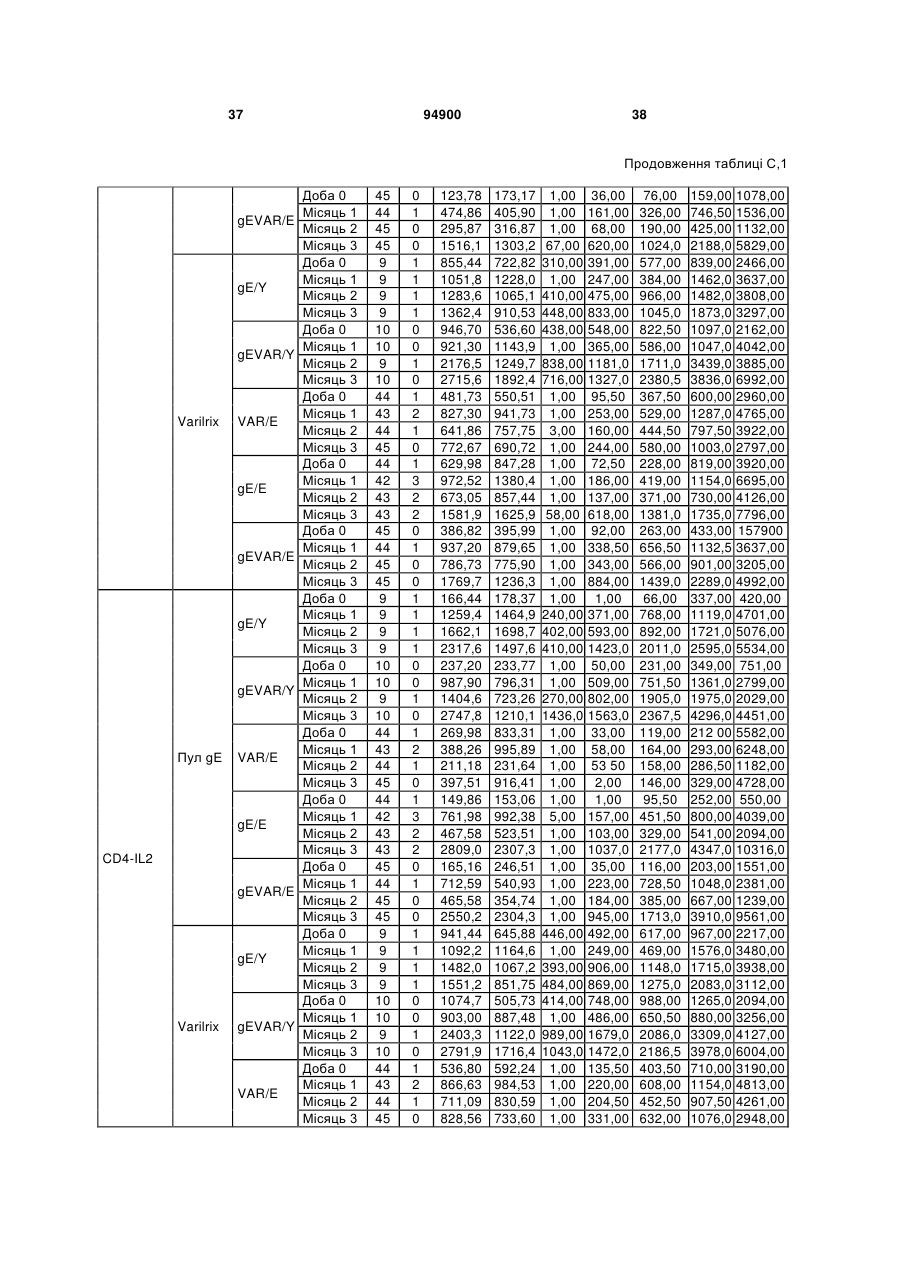
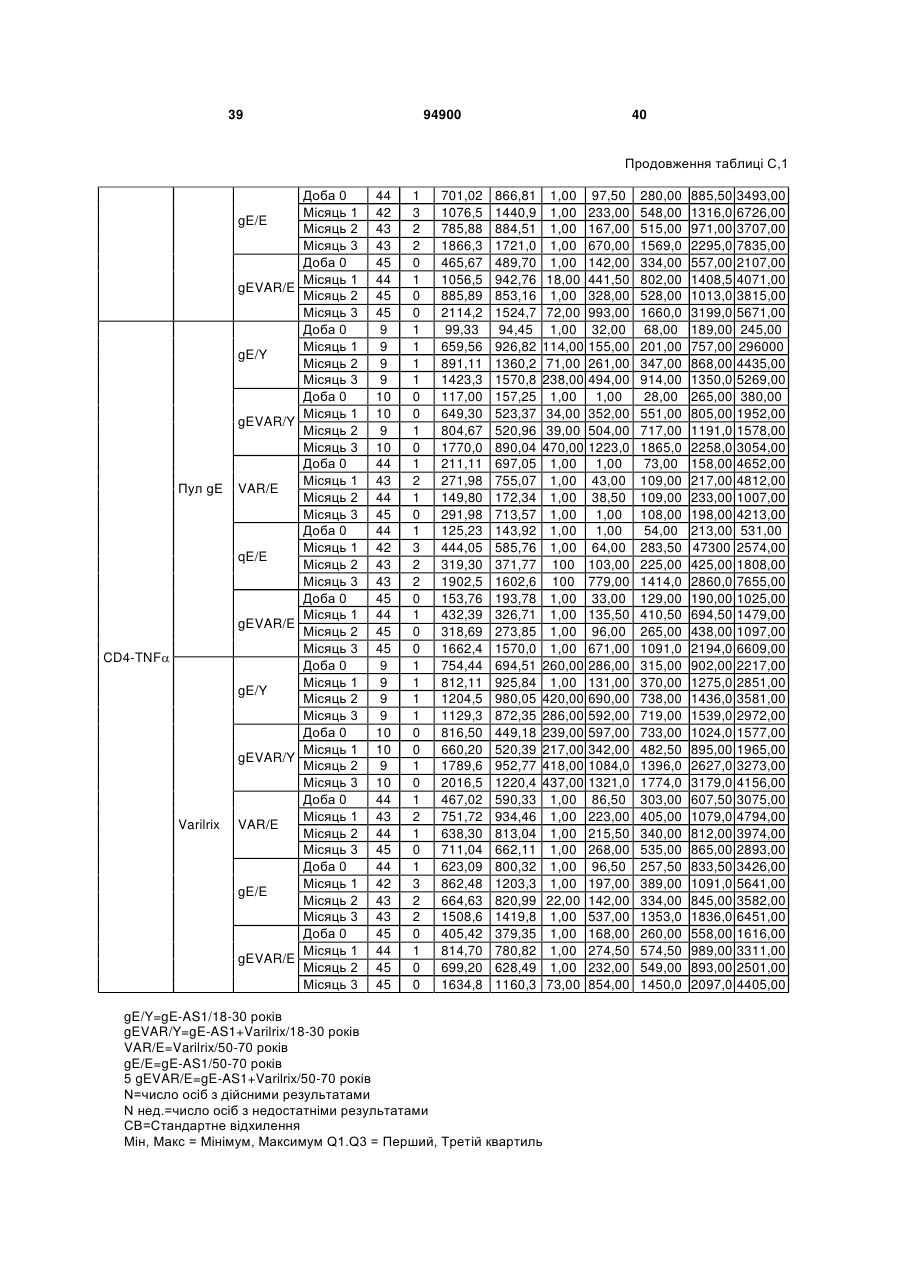
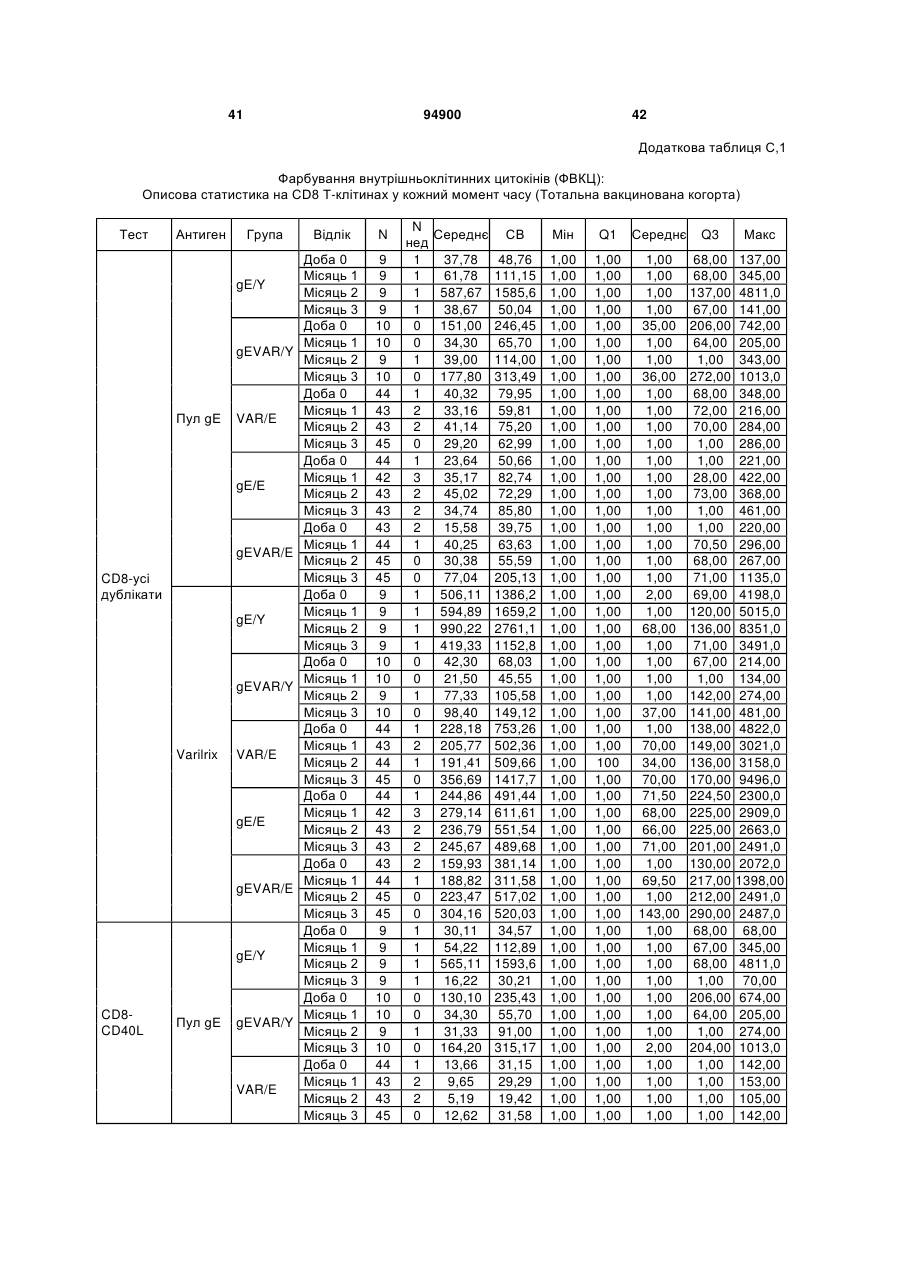
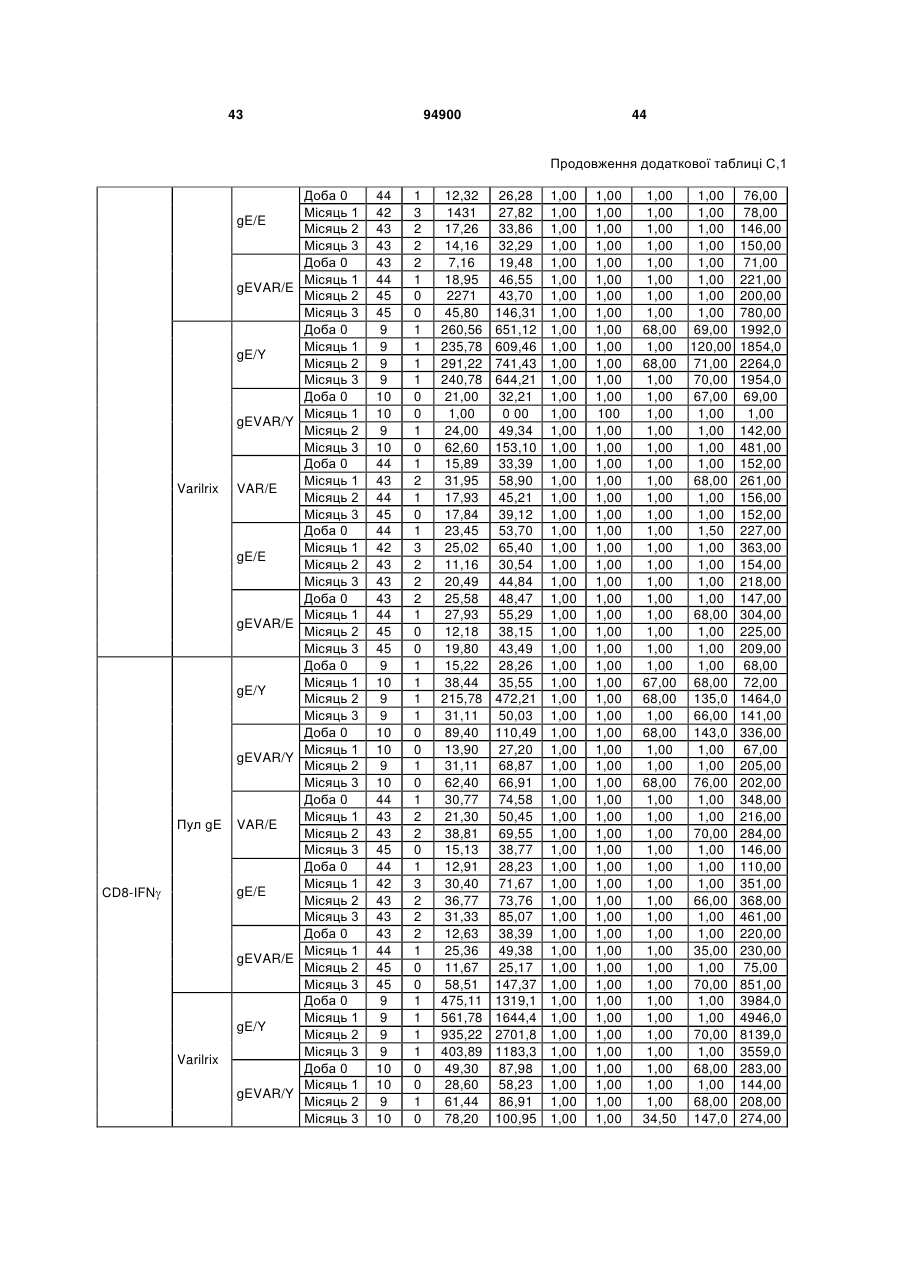
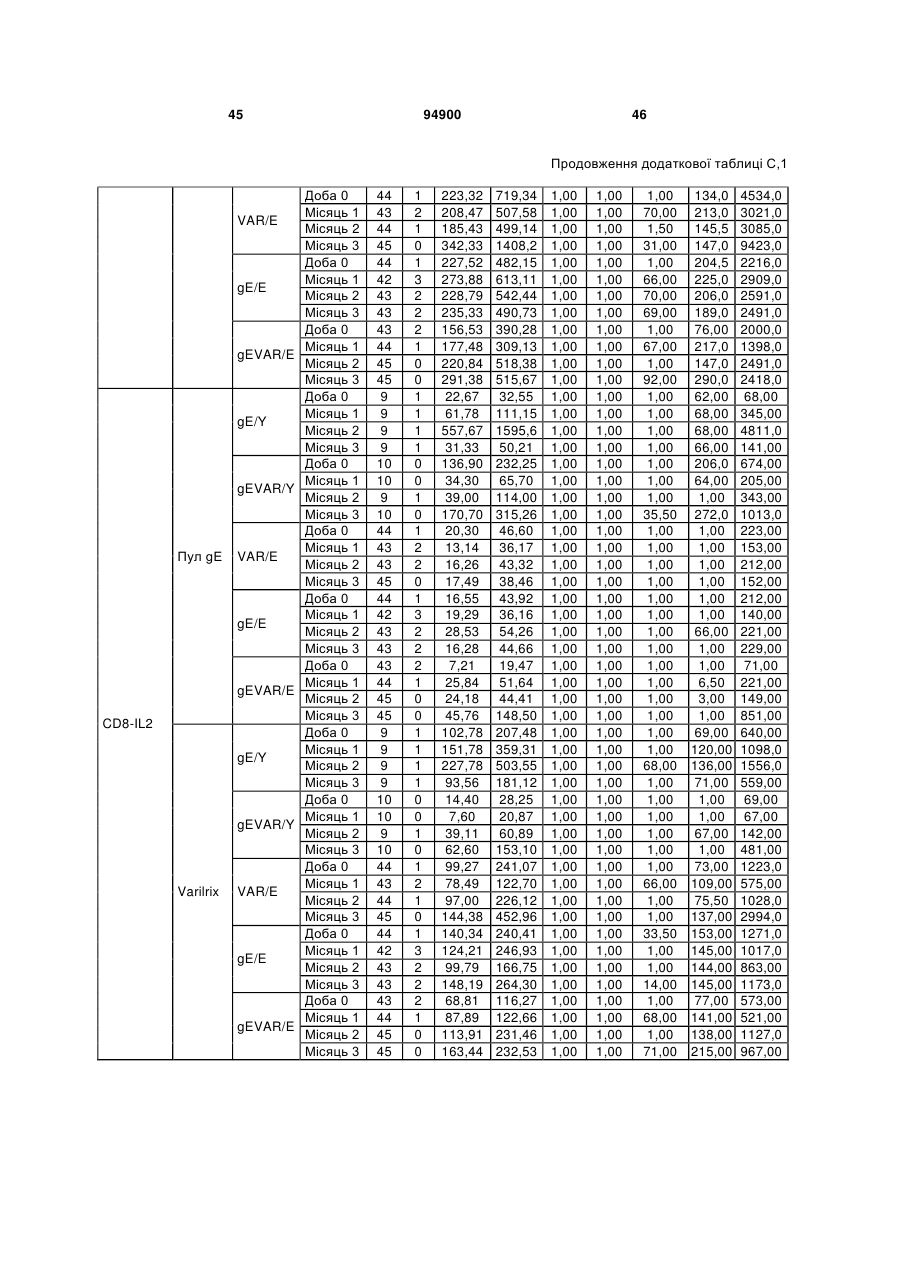
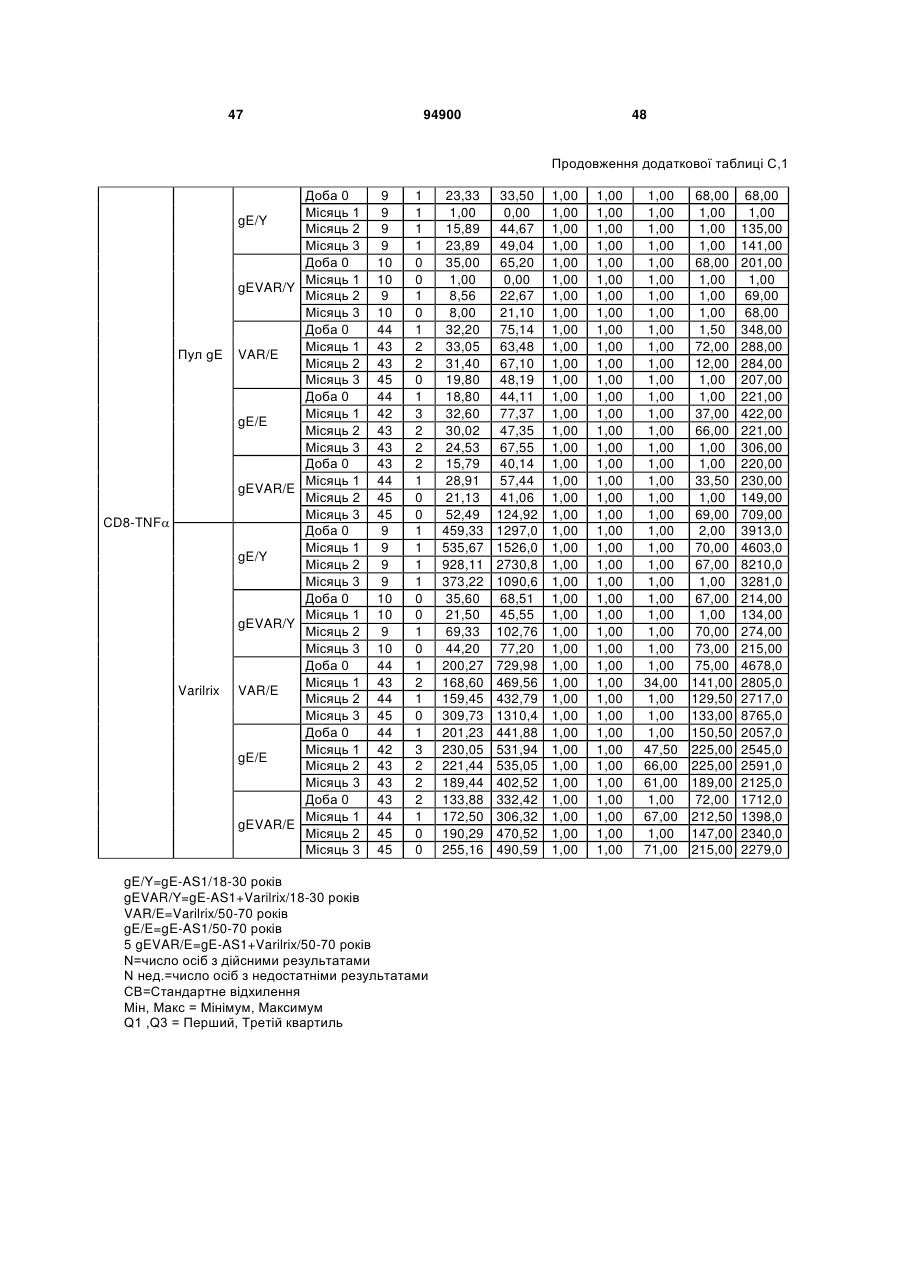
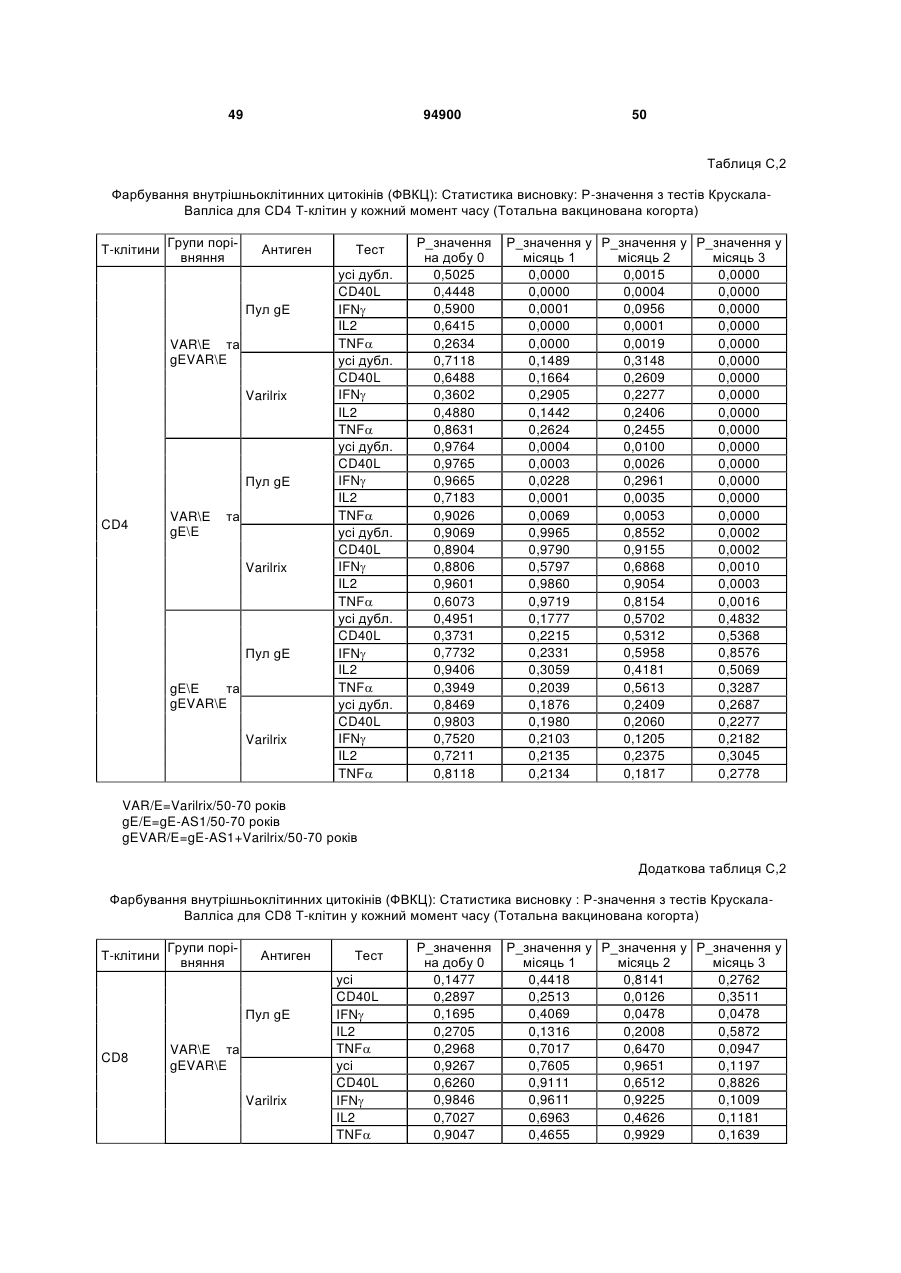
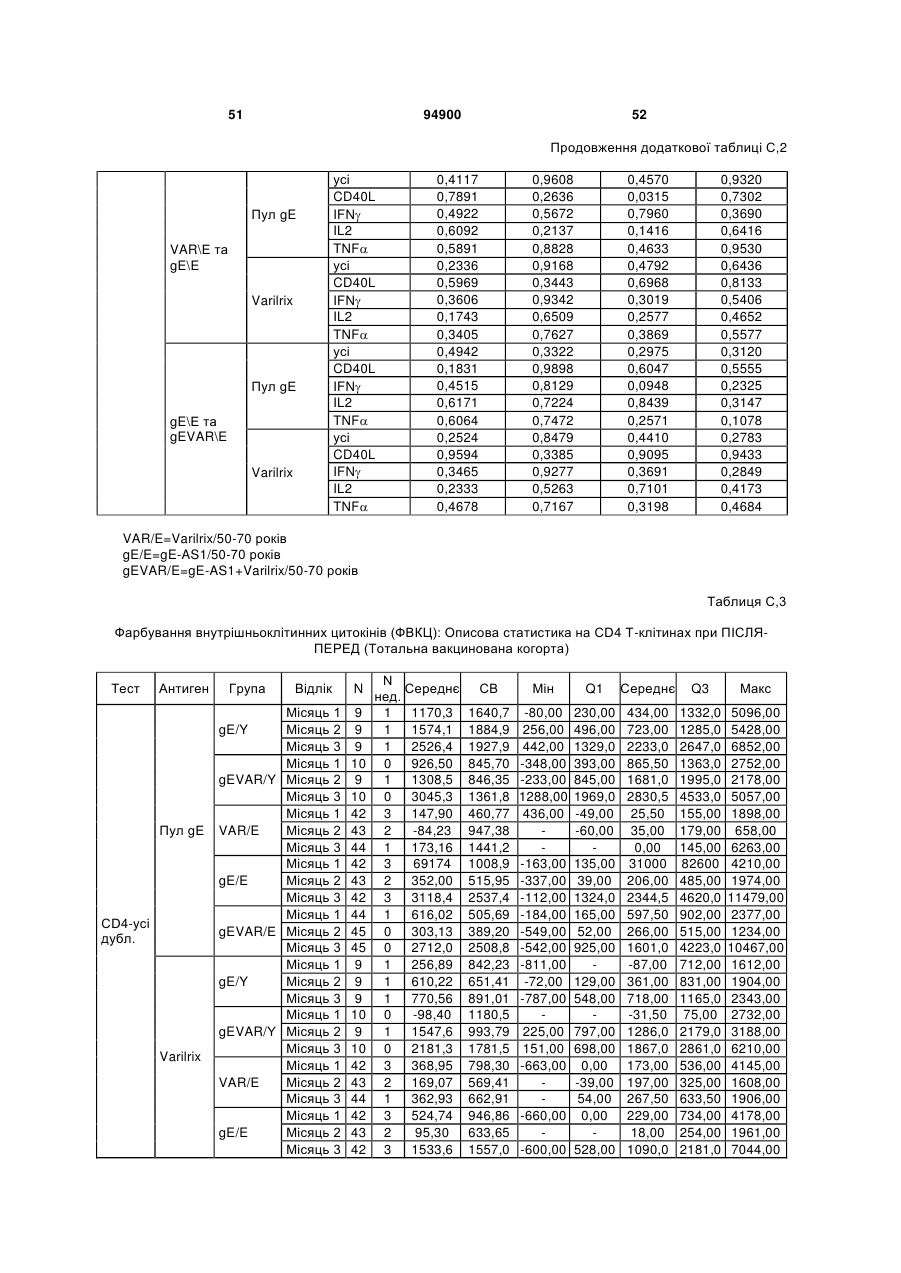
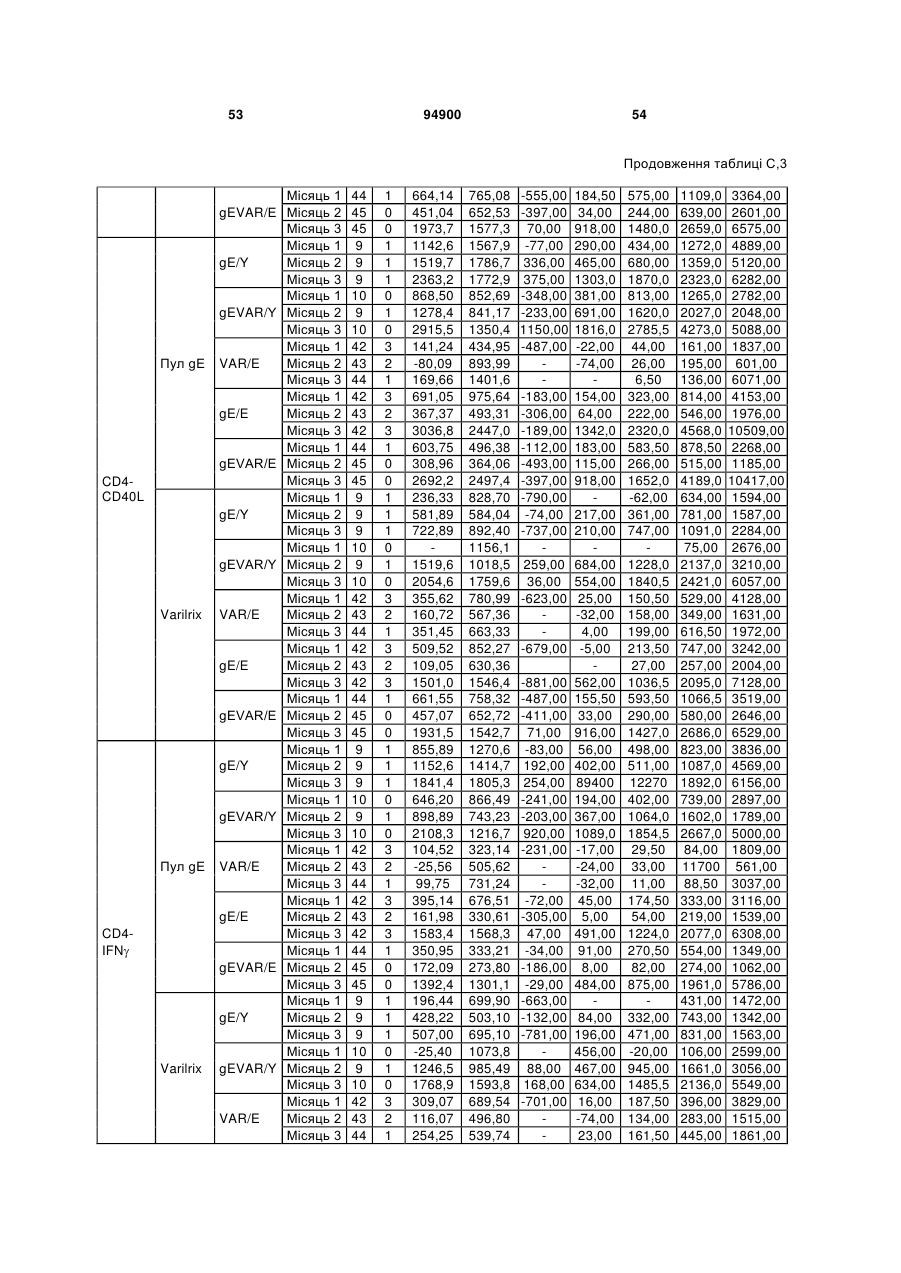
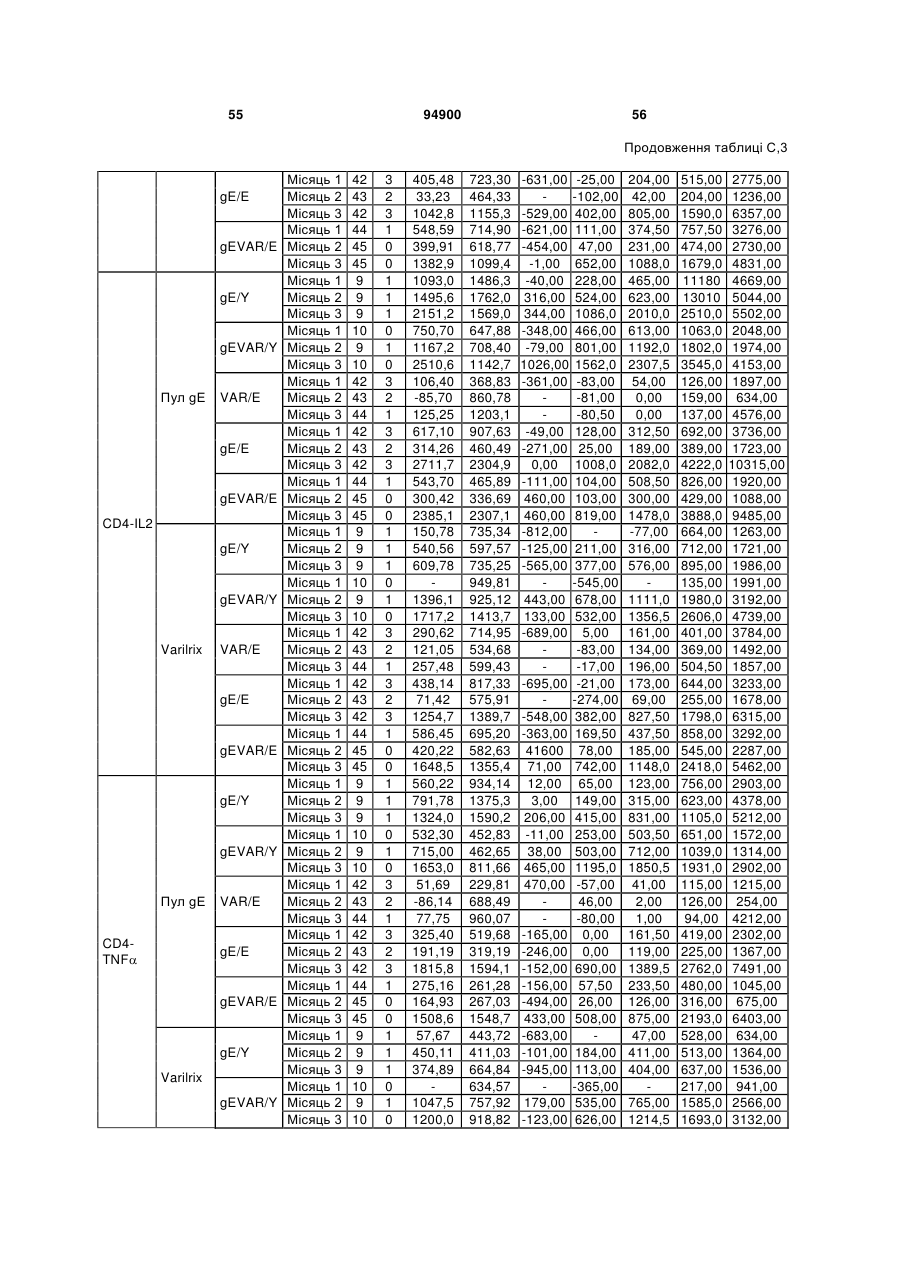
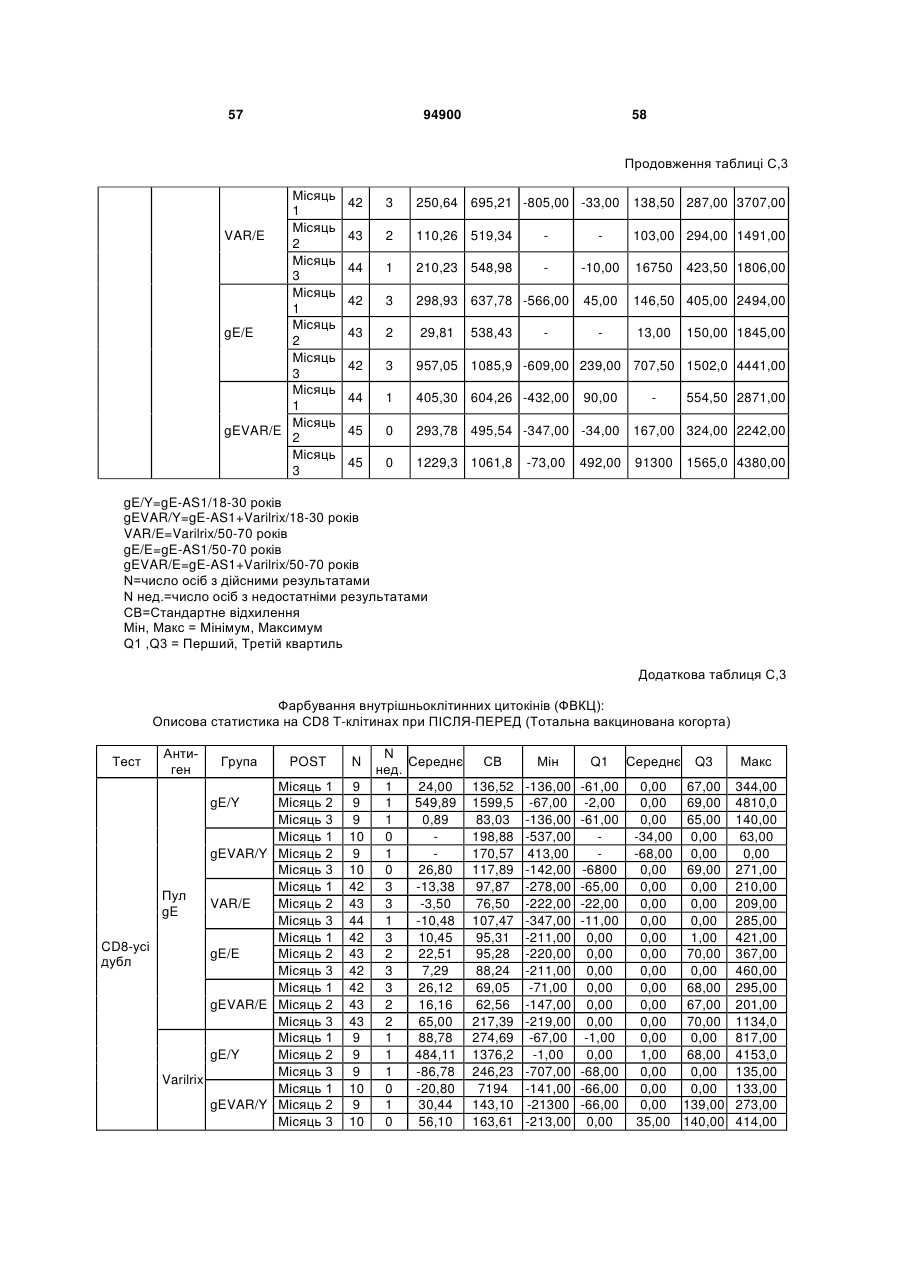
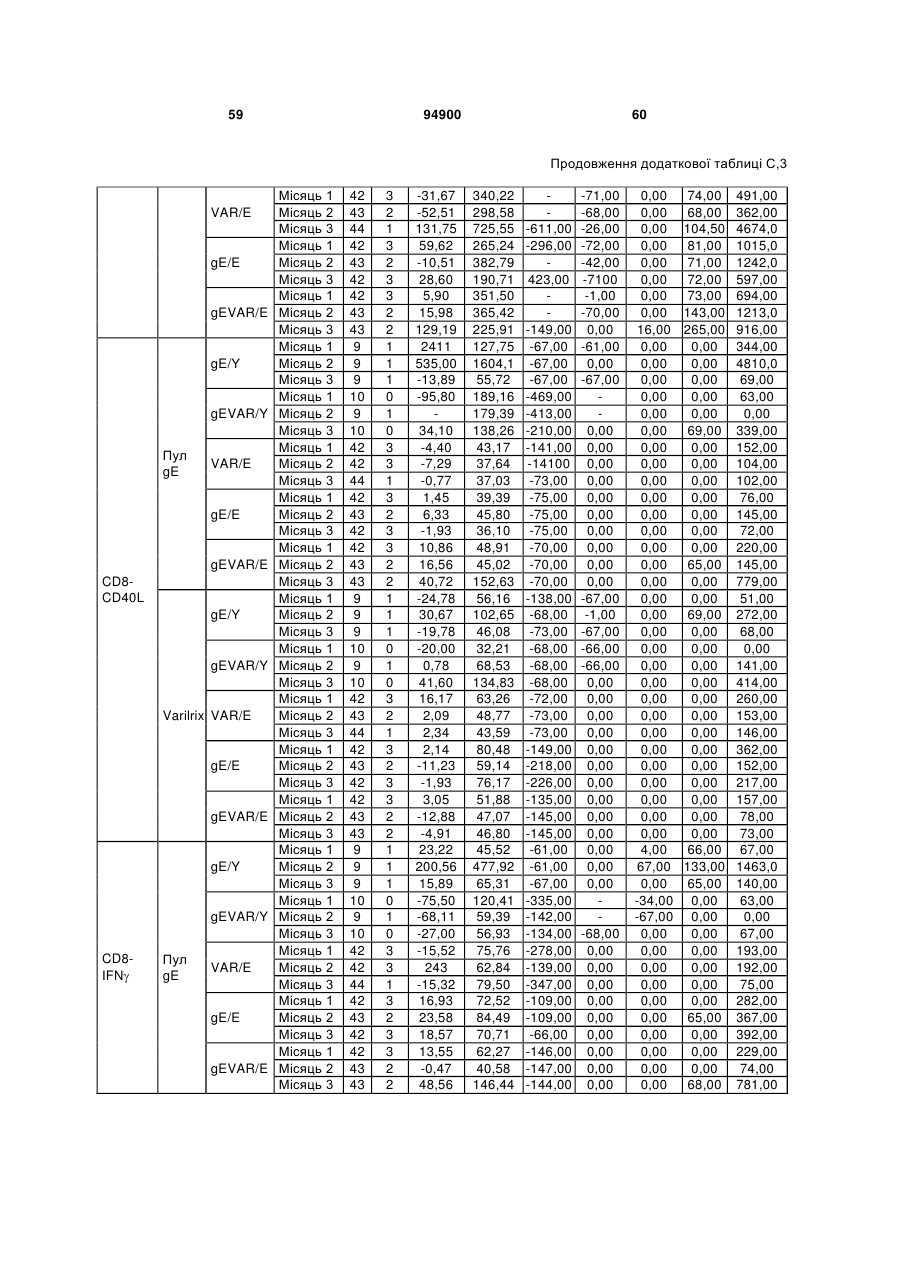
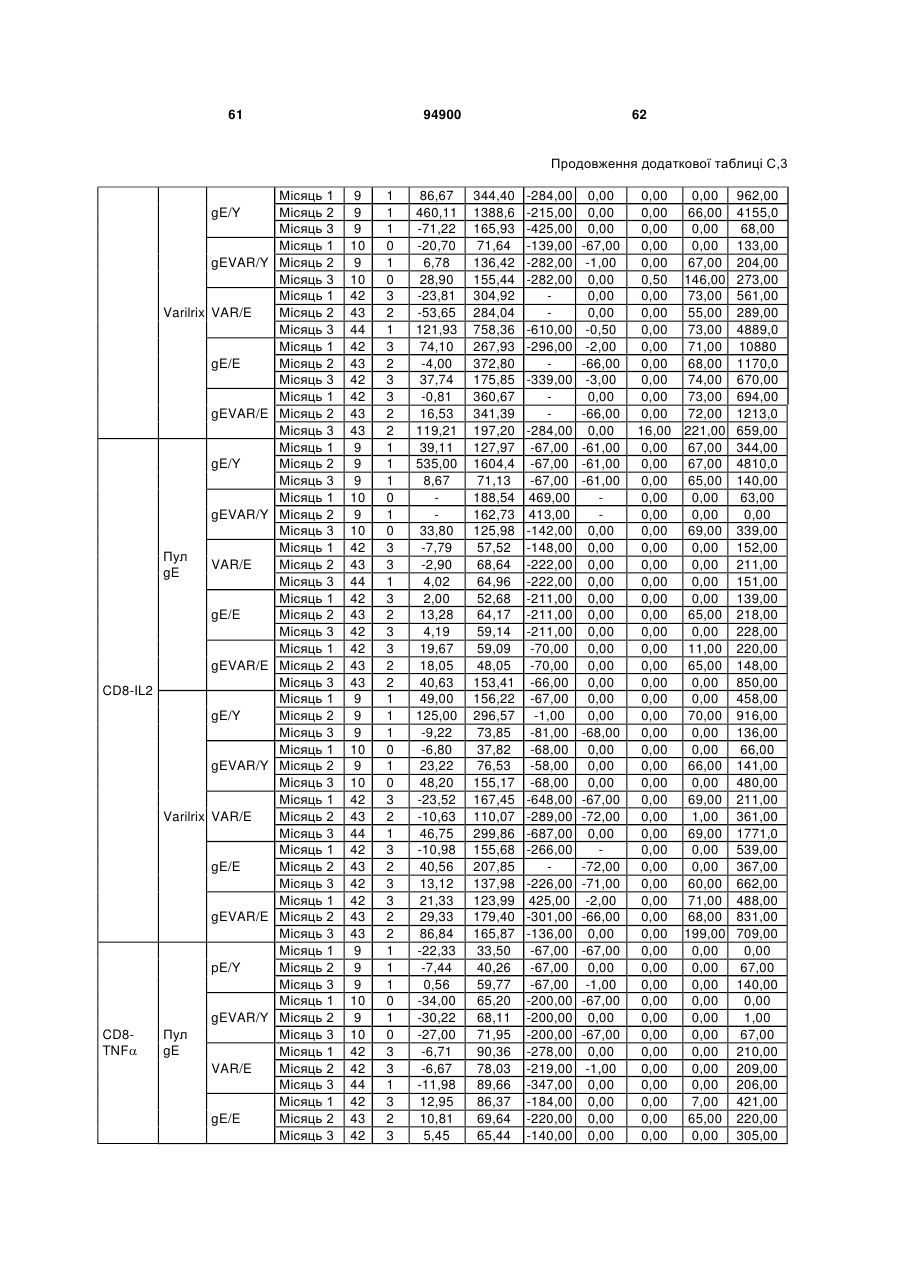
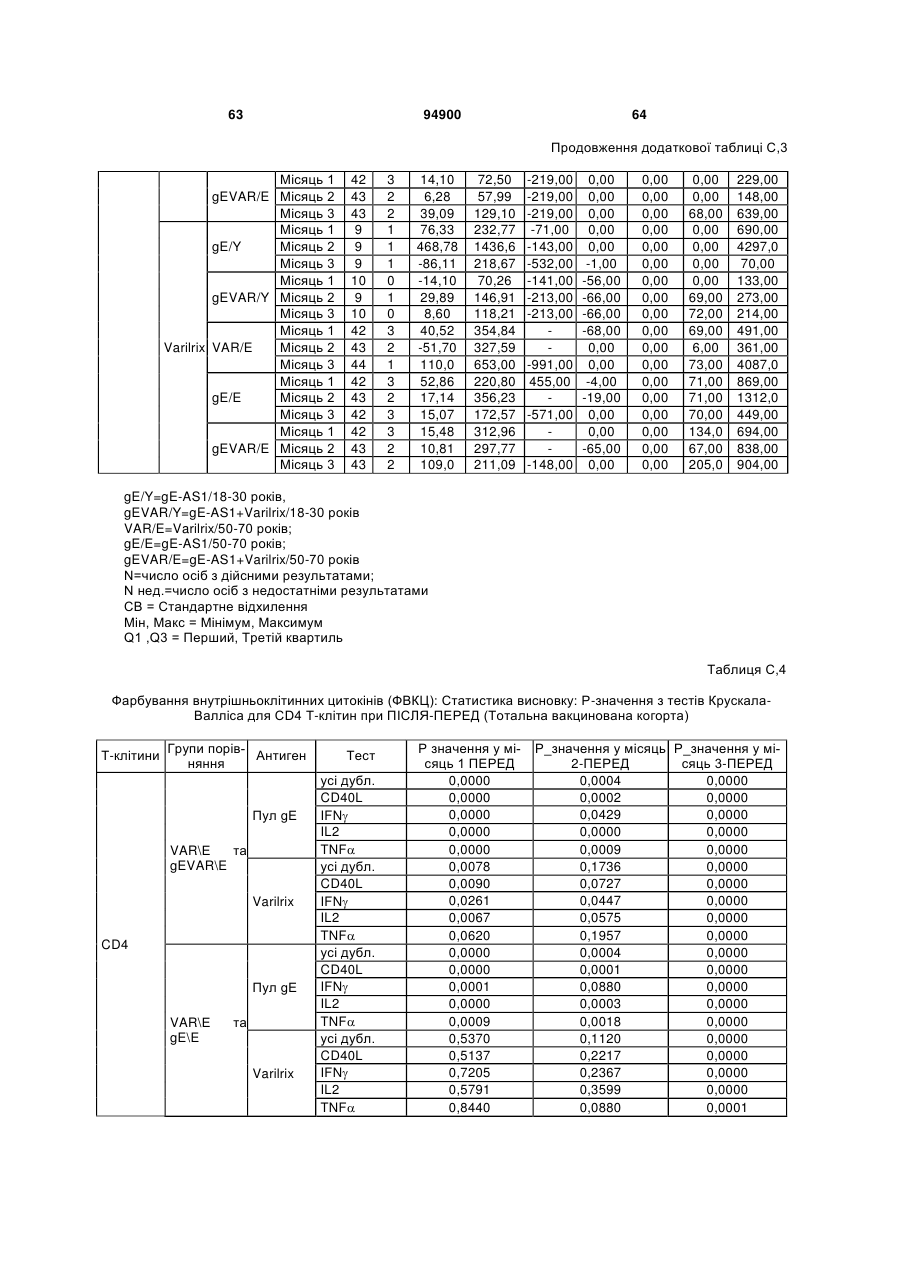
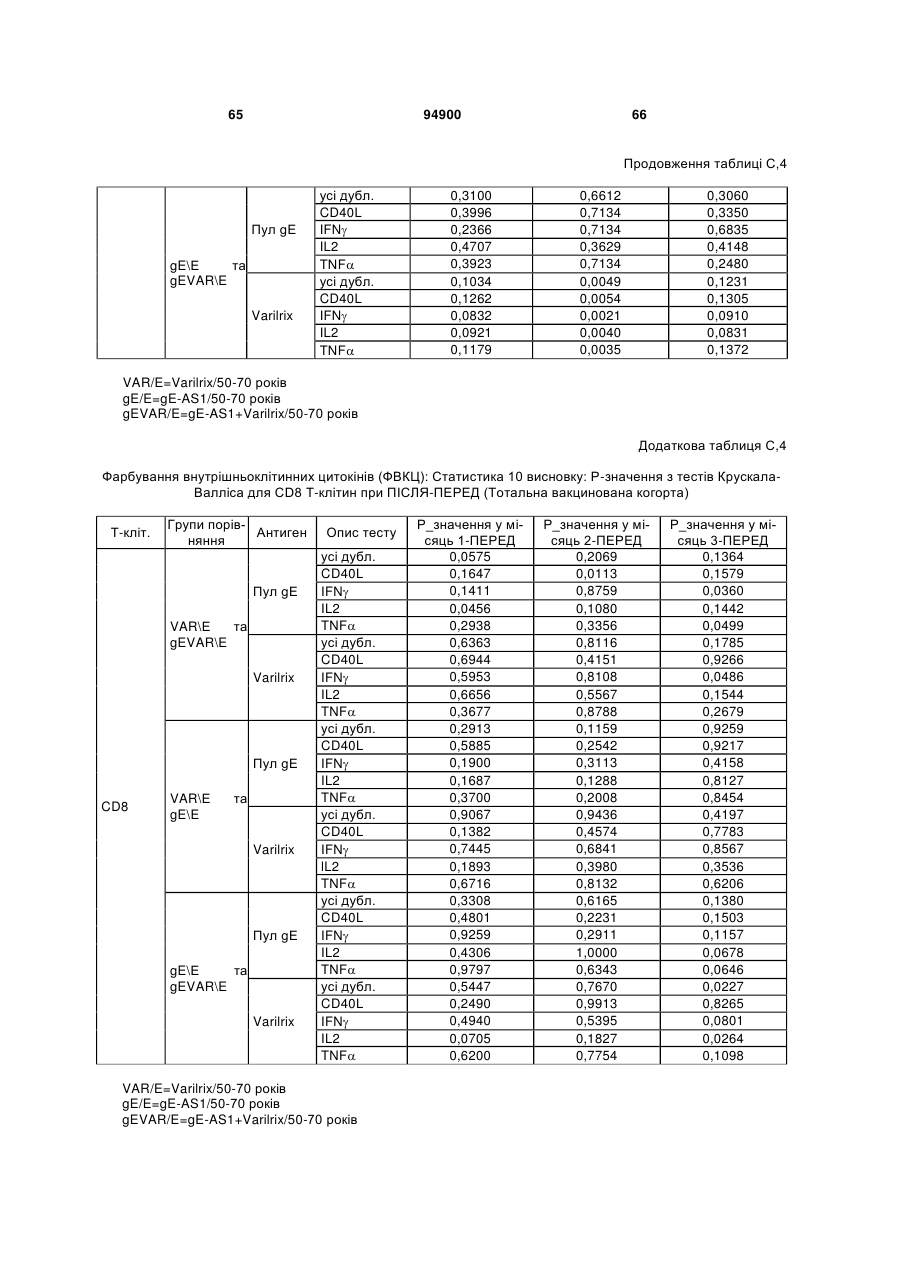
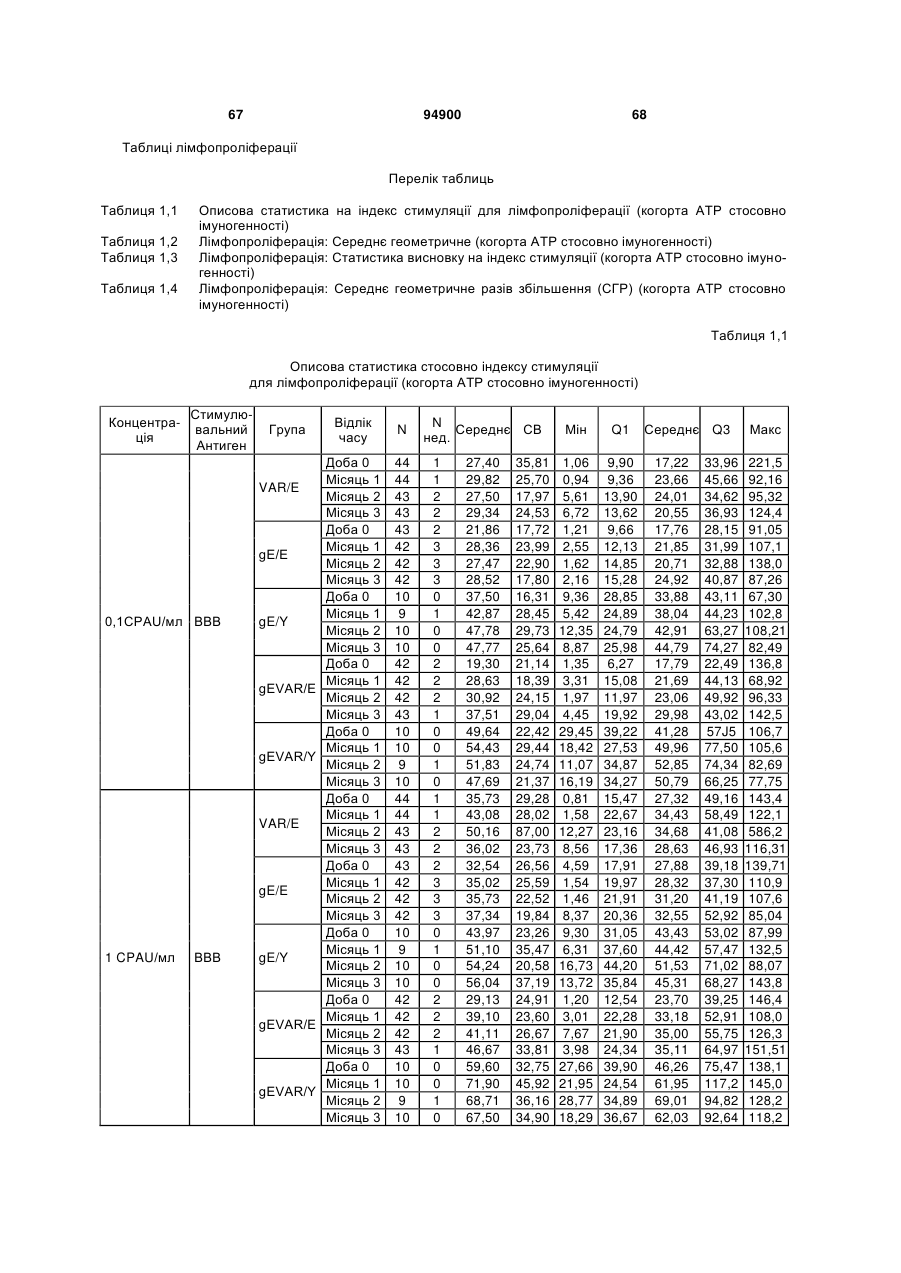
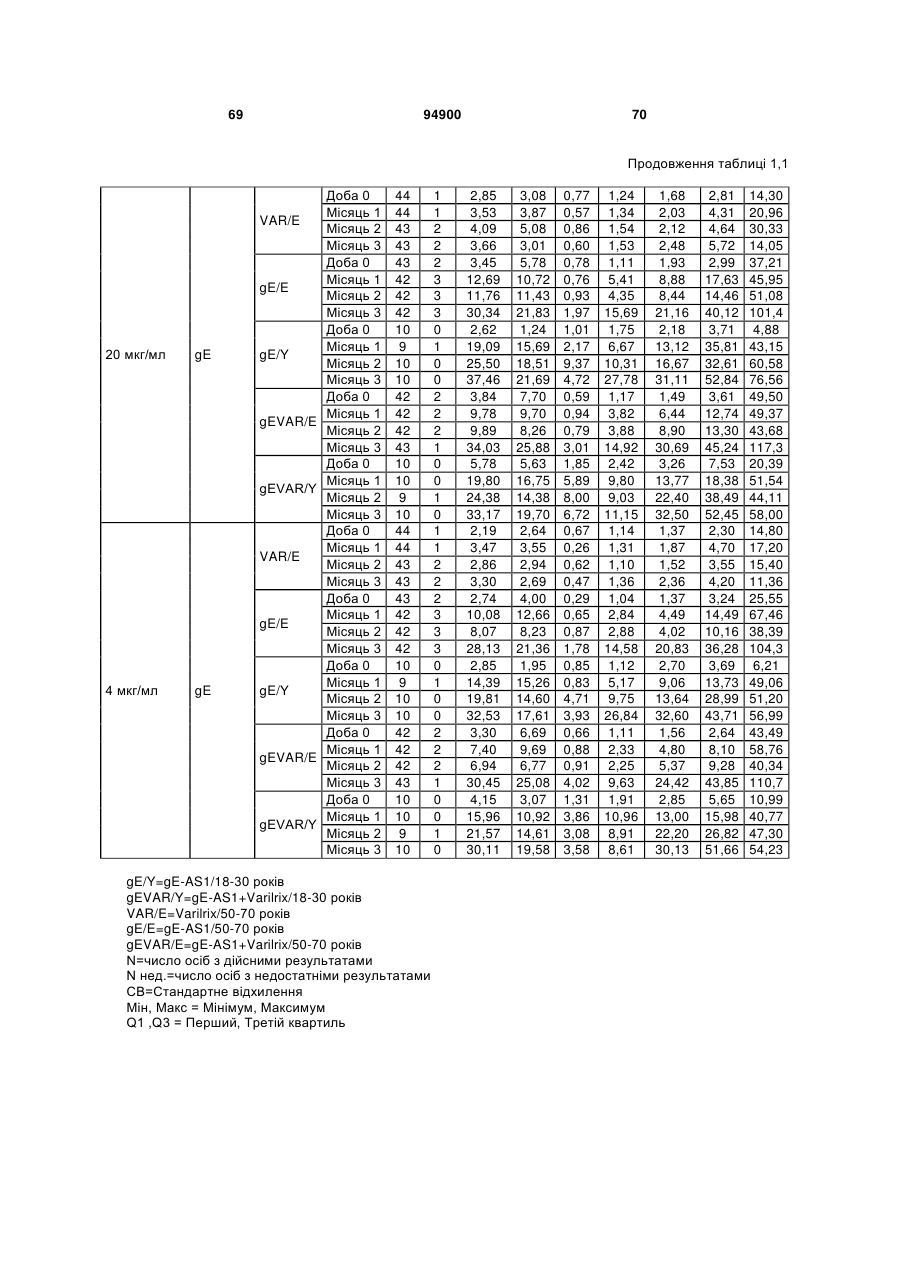
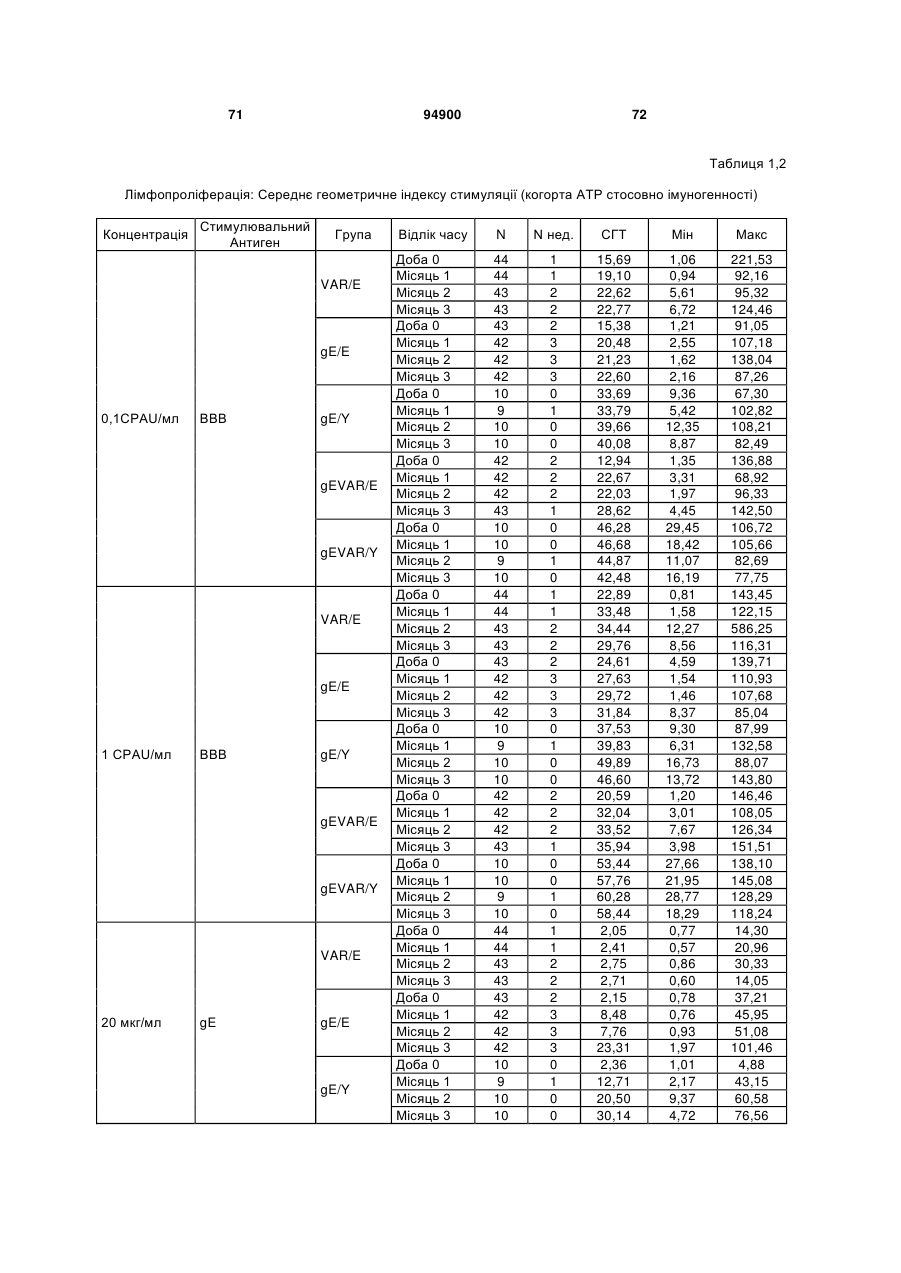
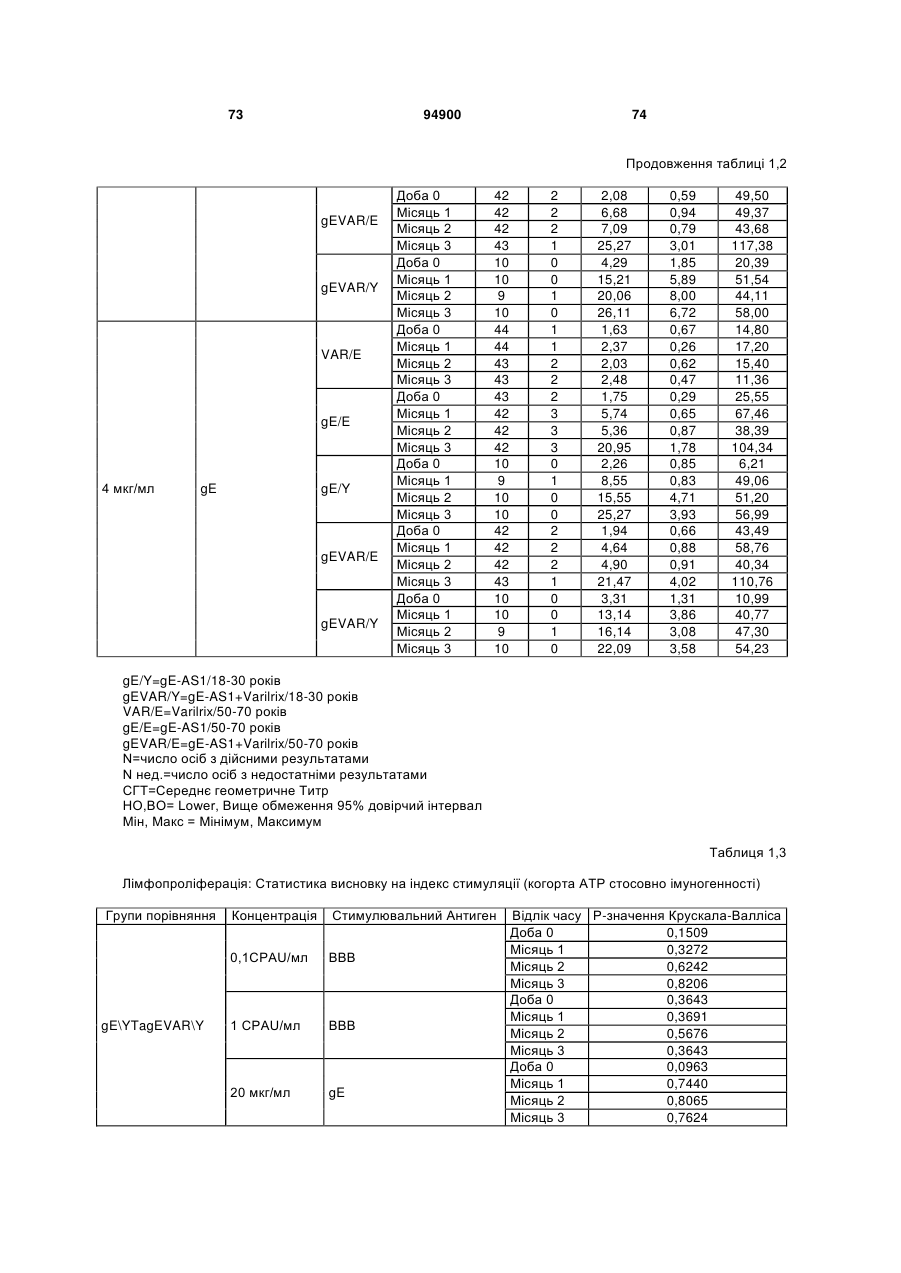
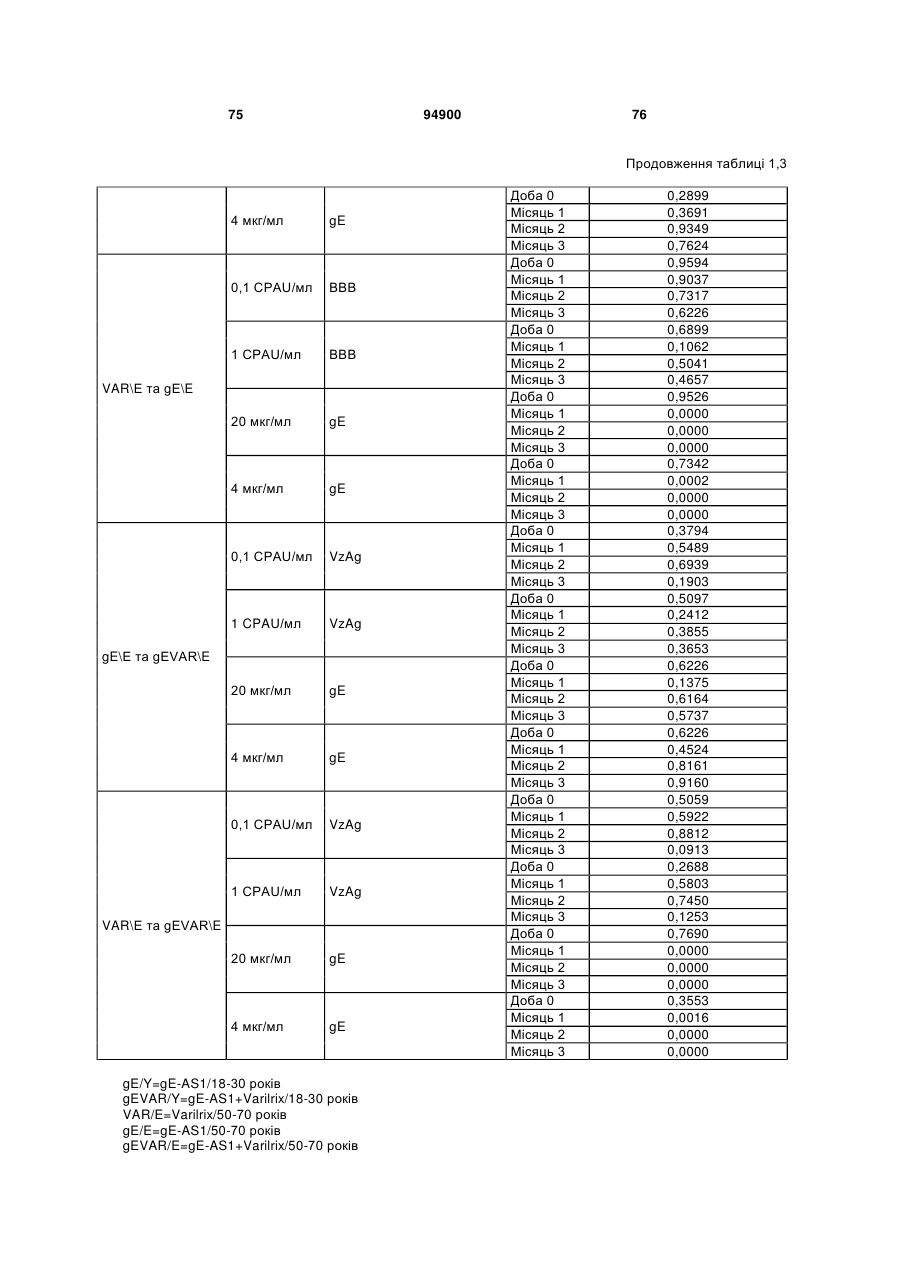
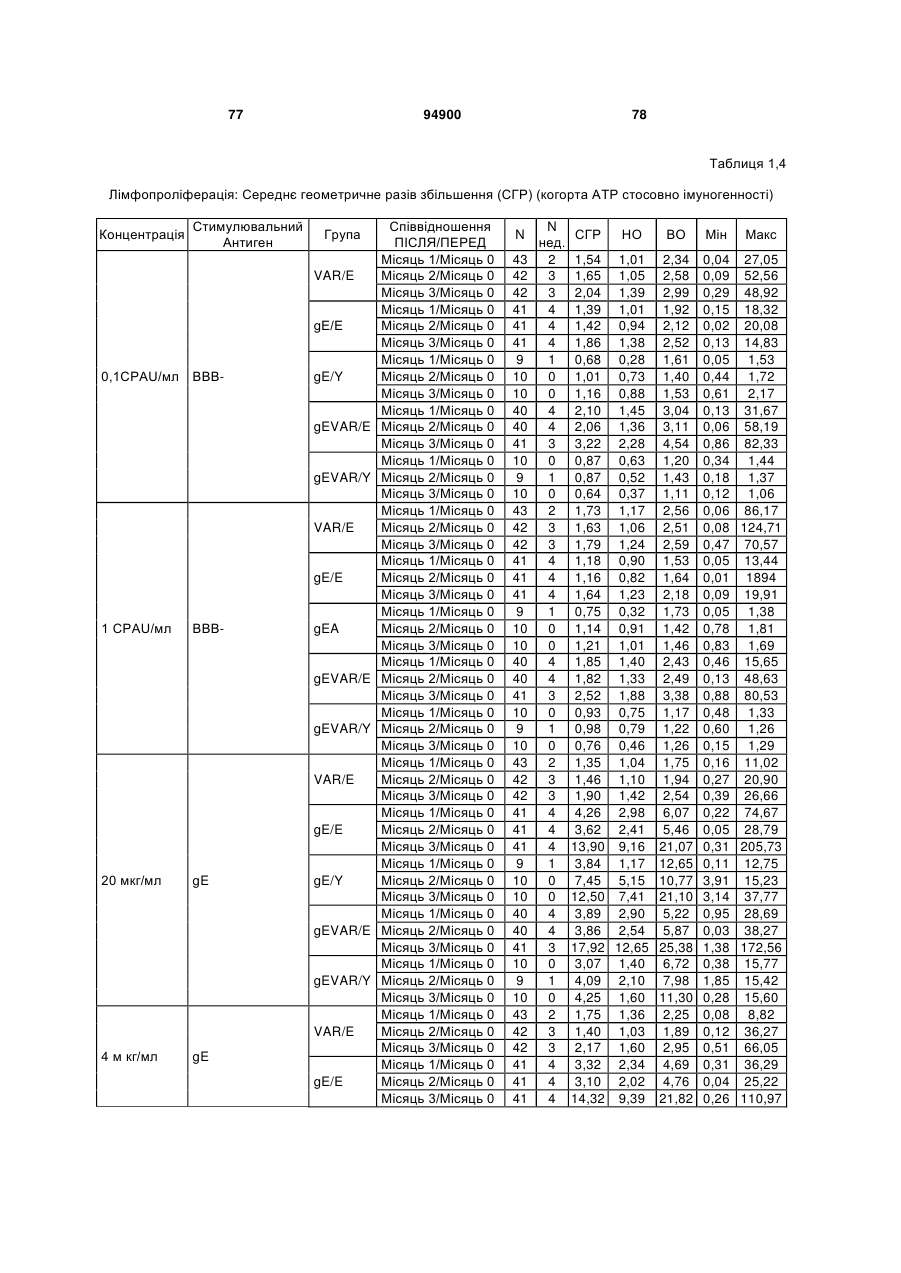
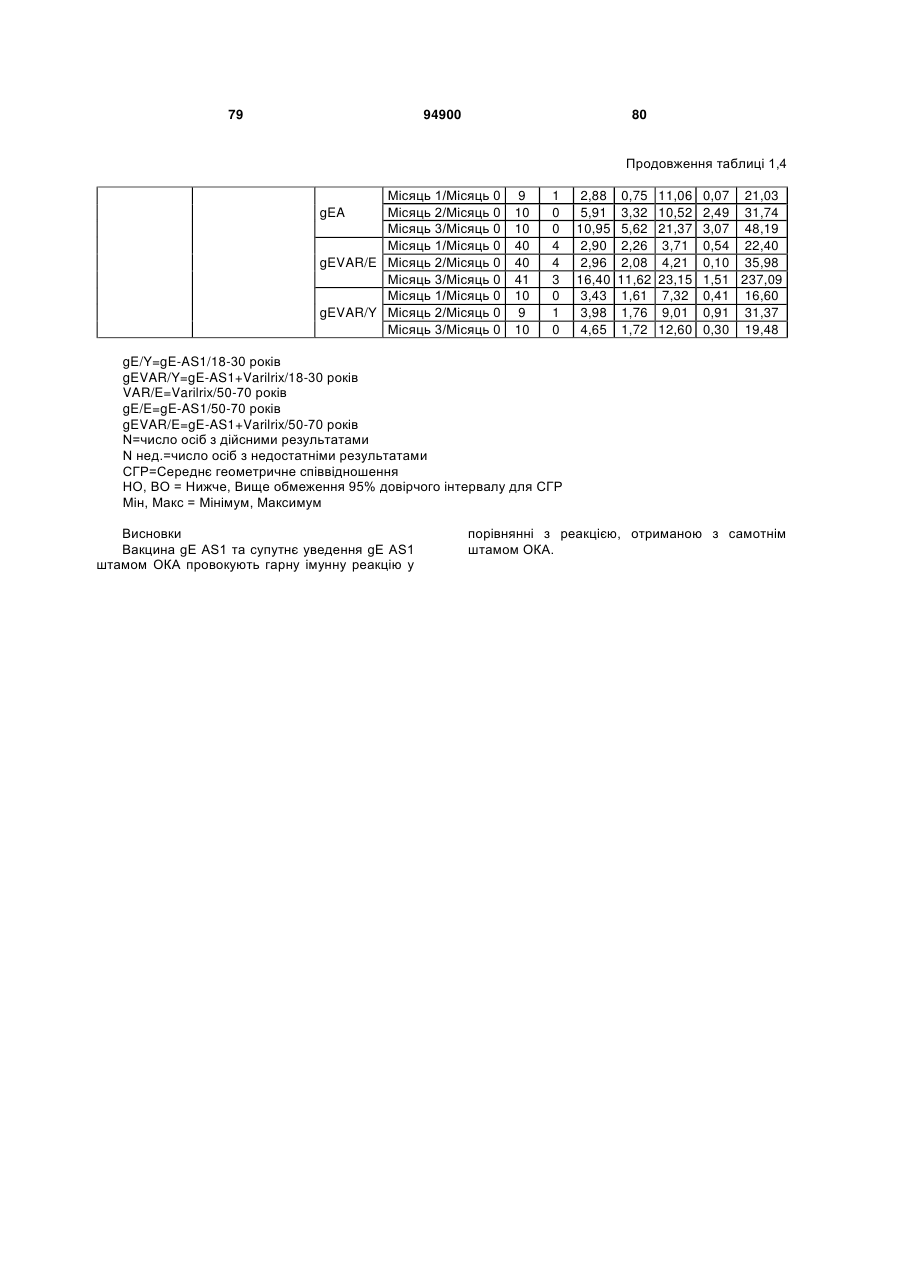
1. Застосування імуногенної композиції, яка містить gЕ ВВВ чи його імуногенний фрагмент, причому gЕ ВВВ не є у формі гібридного білка, та ад'ювант, який містить QS21, 3D-МФЛ та ліпосоми, у виготовленні медикаменту для попередження або зменшення інтенсивності оперізувального герпесу та/або постгерпетичної невралгії. 2. Застосування за п. 1, де ліпосоми містять холестерин. 3. Застосування за п 1 або 2, де МФЛ знаходиться всередині ліпосом. 4. Застосування за будь-яким з попередніх пунктів, де gЕ ВВВ є скороченим. 5. Застосування за п. 4, де gЕ ВВВ є скороченим С-термінально. 2 (19) 1 3 Цей винахід стосується композицій, здатних до індукування імунної реакції проти вірусу вітряної віспи. Вірус вітряної віспи (ВВВ) є вірусом герпесу людини, котрий є етіологічним агентом вітряної віспи та оперізувального лишаю. Вітряна віспа є результатом початкової або первинної інфекції, звичайно обмеженої дитинством, котра є відносно доброякісною. Однак, для дорослих, хто не хворіли вітряною віспою протягом дитинства, та іноді для осіб, хто є імунізованими, ВВВ може бути небезпечним для життя. Так само, інфекція ВВВ може бути небезпечною для життя новонароджених, вірус є здатним переходити плаценту. При безпосередньому контакті вітряна віспа, як відомо, є дуже заразною інфекційною хворобою. Як більшість вірусів герпесу, ВВВ має тенденцію інфікувати деякі клітини, у котрих його розвиток є затриманим. Після змінного латентного періоду, вірус вітряної віспи (ВВ) може вивільнятися для ініціації інфекції в інших клітинах. Ця реактивація вірусу ВВ викликає приблизно 5 мільйонів випадків оперізувального лишаю кожного року (Plotkin et al., Postgrad Med J 61: 155-63 (1985)). Оперізувальний лишай характеризується запаленням церебральних ганглій та периферійних нервів, та є асоційованим з гострим болем. Показано, що люди, вакциновані послабленими штамами ВВВ, мають загальновизнаний захисний імунітет від інфекції ВВВ (Arbeter et al, J. Pediatr 100 886-93 (1982) та Brunell et al, Lancet ii: 1069-72 (1982)). Зокрема, штам ОКА ВВВ застосовано у дослідженнях для по передження оперізувального герпесу та пост-герпетичної невралгії. Штам ОКА також застосовано у виготовленні вакцин для вітряної віспи протягом багатьох років та є добре характеризованим - наприклад, дивись ЕР651789 та посилання. Велике клінічне дослідження зі штамом ОКА для індикації оперізувального лишаю опубліковано у The New England Journal of Medicine 2005, number 22, Volume 352:2271-2284 (M.N. Oxmanetal). Існує необхідність у поліпшених вакцинах проти оперізувального герпесу та пов'язаних розладів, як-то пост-герпетична невралгія (ПГН). Перший аспект Заявлений винахід стосується згідно з першим аспектом імуногенної композиції, що містить антиген ВВВ або його імуногенне похідне у комбінації з живим послабленим ВВВ або повністю інактивованим ВВВ. Винахід крім того стосується композиції вакцини, що містить антиген ВВВ або його імуногенне похідне у комбінації з живим послабленим ВВВ або повністю інактивованим ВВВ. Винахід крім того стосується способу попередження та/або зменшення суворості оперізувального герпесу та/або пост-герпетичної невралгії (ПГН), що полягає в уведенні особі імуногенної композиції, що містить антиген ВВВ або 94900 4 його імуногенне похідне у комбінації з живим послабленим ВВВ або повністю інактивованим ВВВ. У наступному втіленні винахід стосується способу попередження та/або зменшення суворості оперізувального герпесу та/або пост-герпетичної невралгії, спосіб полягає у послідовному або супутньому уведенні особі антигену ВВВ або його імуногенного похідного та живого послабленого ВВВ або повністю інактивованого ВВВ. У ще одному втіленні винахід стосується комплекту, що містить живий послаблений ВВВ або повністю інактивований ВВВ, а окремо, антиген ВВВ або його імуногенне похідне, компоненти, придатні для послідовного або супутнього уведення, або для змішування для уведення як єдиної композиції. Винахід також стосується способу виробництва імуногенної композиції, спосіб полягає у комбінуванні живого послабленого ВВВ або повністю інактивованого ВВВ з антигеном ВВВ або його імуногенним похідним. Винахід крім того стосується застосування живого послабленого штаму ВВВ або повністю інактивованого ВВВ та антигену ВВВ або його імуногенного похідного у виготовленні імуногенної композиції для попередження та/або зменшення суворості оперізувального герпесу та/або постгерпетичної невралгії. Другий аспект Згідно з другим аспектом винахід стосується імуногенної композиції та/або вакцини, що містить gЕ або його імуногенне похідне чи імуногенний фрагмент у комбінації із Th1-ад'ювантом. Винахід також стосується застосування композиції, що містить gE або його імуногенне похідне чи імуногенний фрагмент у комбінації із Th1ад'ювантом, у виготовленні медикаменту для попередження або зменшення інтенсивності реактивації оперізувального герпесу та/або постгерпетичної невралгії. Винахід також стосується способу попередження або зменшення інтенсивності реактивації оперізувального герпесу та/або пост-герпетичної невралгії, спосіб полягає у призначенні особі при необхідності цього імуногенної композиції або вакцини, що містить gE або його імуногенне похідне чи імуногенний фрагмент у комбінації із Th1ад'ювантом. Фіг.1 розкриває послідовність скороченого gE ВВВ. Фіг.2-4 розкривають гуморальні реакції, отримані у клінічних дослідженнях людини з композиціями винаходу. Фіг.5 та 6 розкривають опосередкований клітинами імунітет, отриманий у клінічних дослідженнях людини з композиціями винаходу. Згідно з найширшим аспектом заявлений винахід стосується композицій та режимів, що описано тут, для провокування імунної реакції на ВВВ. Згідно з одним аспектом імунна реакція, створена піддаванням дії таких композицій, є належно відтворювано вищою та статистично вірогідною при 5 порівнянні з реакцією, отриманою у осіб, кого не піддавали дії композицій винаходу. Імунну реакцію можна оцінювати аналізом будь-якого одного або більше аспектів реакції OKI та/або реакції антитіл будь-яким зі способів, показаних нижче. Згідно з ще одним аспектом винахід стосується підходів для попередження та/або зменшення суворості оперізувального герпесу та/або постгерпетичної невралгії (ПГН). Для уникнення невизначеності винахід згідно з одним аспектом стосується застосування у попередженні інцидентності оперізувального лишаю. Якщо оперізувального лишаю нема, тоді суворість реактивації оперізувального лишаю є належно зменшеною порівняно з невакцинованим контролем (зменшення інтенсивності оперізувального лишаю). В іншому аспекті, якщо оперізувальний лишай є, винахід стосується застосування у попередженні інцидентності ПГН. Згідно з наступним аспектом, якщо ПГН є, тоді суворість ПГН є належно зменшеною порівняно з невакцинованим контролем (зменшення інтенсивності ПГН). Зменшення суворості можна належно оцінювати зменшенням болю, викликаного оперізувальним лишаєм або ПГН, наприклад, застосуванням відомих вимірів тяжкості болю (наприклад, Coplan et al J Pain 2004; 5 (6) 344-56). Зменшення суворості можна також оцінювати за іншими критеріями, як-то тривалість оперізувального лишаю або ПГН, пропорція площі тіла, враженої оперізувальним лишаєм або ПГН; або місця оперізувального лишаю/ПГН. Вищенаведені ствердження стосуються усіх аспектів винаходу. Якщо згідно з першим аспектом винаходу застосовують живий послаблений штам, тоді застосований згідно з цим аспектом живий послаблений штам ВВВ є штамом ОКА, штамом, добре відомим у рівні техніки, наприклад, як розкрито Arbeter et al. (Journal of Pediatrics, vol 100, No 6, p886 ft), WO9402596, та посиланні, як-то US 3985615, усі які уведені тут як довідки. Будь-який інший придатний застосований живий послаблений штам можна також застосовувати у винаході. Наприклад, штами Varilrix та Varivax є прийнятними та комерційно доступними та могли б бути застосовуваними у винаході. Повністю інактивовані штами ВВВ, як-то інактивований ВВВ ОКА, також придатні для застосування у заявленому винаході. Антигеном ВВВ для застосування у винаході може бути будь-як придатний антиген ВВВ або його імуногенне похідне, належно очищений антиген ВВВ. Згідно з одним аспектом антиген або похідне є тим, що здатне викликати при уведенні у комбінації, супутньо або послідовно з живим послабленим штамом ВВВ або повністю інактивованим ВВВ, імунну реакцію, котра є поліпшеною відносно викликаної самотнім живим послабленим штамом/повністю інактивованим штамом або самотнім антигеном ВВВ. Така реакція може бути, наприклад, поліпшеною у термінах одно або більше значень імунної реакції, тривалості імунної реакції, числа або % або респондерів, або широти реакції (наприклад, визначений діапазон реакцій антитіл 94900 6 або Т-клітин), або може поліпшувати на клінічному рівні у термінах інцидентності, зменшення болю або симптомів. Поліпшення в імунній реакції можна оцінювати, наприклад, рівнями антитіл або активності опосередкованого клітинами імунітету (OKI) стандартними способами у рівні техніки; поліпшення на клінічному рівні можна також оцінювати застосуванням відомих клінічних критеріїв. Зокрема, згідно з одним аспектом імунна реакція, викликана композицією або вакциною заявленого винаходу, показує одне або більше з групи: - статистично вірогідне збільшення реакції OKI та/або антитіл у порівнянні з рівнями перед вакцинацією, при порівнянні з самотнім антигеном ВВВ або живим послабленим штамом/повністю інактивованим штамом; - Поліпшена багатовалентна реакція OKI, у порівнянні з рівнями перед вакцинацією, при порівнянні з самотнім антигеном ВВВ або живим послабленим штамом/повністю інактивованим штамом. Багатовалентна реакція OKI розглядає діапазон маркерів для OKI, як-то (але без обмеження) IFN-гамма, IL2, TNF-альфа та CD40L, а поліпшена багатовалентна реакція індукує реакцію OKI по ширшому діапазону таких маркерів або вищої реакцією в одному або більше з маркерів при порівнянні з самотнім антигеном ВВВ або живим послабленим штамом/повністю інактивованим штамом; - Краща стабільна реакція OKI або антитіл, у порівнянні з рівнями перед вакцинацією, при порівнянні з самотнім антигеном ВВВ або живим послабленим штамом/повністю інактивованим штамом. Згідно з одним аспектом стабільність вимірюють після 1 місяця, 2 місяців, 3 місяців, 4 місяців, 5 місяців, 6 місяців, 12 місяців, 24 місяців, 36 місяців або 48 місяців. Згідно з одним аспектом поліпшення імунної реакції оцінюють у літній популяції, належно популяції зверх 50 років віку, для кого ризик оперізувального лишаю або ПГН є збільшеним стосовно популяції під 50 років віку. Поліпшену імунну реакцію можна також розглядати у популяціях з послабленим імунітетом. Згідно з одним аспектом такі популяції є цільовими популяціями для будь-якого втілення заявленого винаходу. Згідно з одним аспектом популяція має зверх 50 років, відповідно зверх 60 років, зверх 70 років, або навіть зверх 80 років та вище. Згідно з одним аспектом популяція має 50-70 років віку. Отже, згідно з одним аспектом винахід стосується застосування композицій та підходів винаходу у попередженні та/або зменшенні суворості оперізувального лишаю або ПГН у людей зверх 50 років віку. Згідно з одним аспектом винахід стосується застосування композицій та підходів винаходу у попередженні та/або зменшенні суворості оперізувального лишаю або ПГН у осіб з послабленим імунітетом, як-то пацієнти після трансплантації або пацієнти, хто є ВІЛ-позитивними. Термін "імуногенне похідне" охоплює будь-яку молекулу, котра залишає здатність індукувати імунну реакцію стосовно ВВВ після застосування до людини. Імуногенні сполуки тут відповідно можна 7 виявлювати імуноаналізом (як-то ELISA або аналізом стимуляції Т-клітин) з антисироватками та/або Т-клітинами від пацієнта із ВВВ. Скринінг на імуногенну активність можна проводити способами, добре відомими спеціалісту. Наприклад, такі скринінги можна проводити способами, описаними Harlow та Lane, антиbodies: A Laboratory Manual, Cold Spring Harbor Laboratory, 1988. Придатні способи створення похідних добре відомі у рівні техніки та охоплюють стандартні способи молекулярної біології, що розкрито, наприклад, у Sambrook et al [Molecular Cloning: A Laboratory Manual, third edition, 2000, Cold Spring Harbor Laboratory Press], як-то способи додавання, делеції, заміщення або перегрупування амінокислот або їх хімічні модифікації. Згідно з одним аспектом похідні охоплюють, наприклад, скорочення або інші фрагменти. Згідно з одним аспектом похідними у контексті цього винаходу є амінокислотні послідовності, що містять епітопи, тобто, антигенні детермінанти, по суті відповідальні за імуногенні властивості поліпептиду та здатні викликати імунну реакцію, згідно з одним аспектом є епітопами Т-клітин. Згідно з одним аспектом, рівень імуногенної активності імуногенного похідного є принаймні приблизно 50%, згідно з одним аспектом принаймні приблизно 70% та згідно з одним аспектом принаймні або більше приблизно 90% імуногенності поліпептиду, з котрого він походить, як відповідно оцінено способами імуноаналізу, описаними вище. У деяких аспектах винаходу можна ідентифікувати імуногенні частини, що мають рівень імуногенної активності більше відповідного поліпептиду повної довжини, наприклад, що мають більше приблизно 100% або 150% або більше імуногенної активності. Згідно з одним аспектом антигеном gE є глікопротеїн, згідно з одним аспектом антиген gE (також відомий як др1), або його імуногенне похідне. Антиген gE, його безопірні похідні (котрі є також імуногенними похідними) та їх отримання описано у ЕР0405867 та посиланнях [дивись також Vafai A. Antibody binding sites on truncated forms of varicalla-zoster virus gpl(gE) glycoprotein Vaccine 1994 12:1265-9]. EP192902 також розкриває gE та його продукування. Розкриття усіх цитованих документів уведено тут як довідки. Згідно з одним аспектом gE є скороченим gE, що має послідовність з Фіг.1, що розкрито у Virus research, vol 40,1996 рі99 ff, що уведено тут як довідка. Посилання на gE подалі охоплює посилання на скорочений gE, якщо інше не зрозуміло з контексту. Інші придатні антигени охоплюють, як приклад, gB, gH, gC, gl, IE63 (наприклад, дивись Huang et al. J. Virol. 1992, 66: 2664, Sharp et al. J. Inf. Dis. 1992,165:852, Debrus, J Virol. 1995 May; 69(5):32405 та посилання), ІЕ62 (наприклад, дивись Arvin et al. J. Immunol. 1991 146:257, Sabella J Virol. 1993 Dec; 67(12):7673-6 та посилання) ORF4 або ORF 10 ( Arvin et al. Viral Immunol. 2002 15: 507.) Заявлений винахід тут також пропонує застосування антигених комбінацій з живим послабленим або вбитим ВВВ, та згідно з одним аспектом 94900 8 gE може бути уведеним у будь-яку таку комбінацію. Згідно з одним аспектом винахід стосується комбінацій gE з ІЕ63 та gE з ІЕ62. Антигени ВВВ та похідні антигенів ВВВ можна тестувати на придатну імуногенну активність застосуванням у модельних системах, що описано у прикладах представленої заявки, або клінічними дослідженнями у людей. Один або більше з наступних індикаторів активності придатні для розглядання в оцінці імуногенної активності: - Збільшені реакції CD4 або CD8 Т-клітин на ВВВ або антигенні похідні. - Підвищення ВВВ або похідні від антигенів специфічні антитіла. - Посилене продукування цитокінів, як-то інтерферон у або IL-2 або TNF. - Посилена експресія CD40L на CD4 та CD8 Тклітинах. - Зменшення болю в інцидентності оперізувального лишаю нижче інцидентності, виявленої у загальній популяції таких осіб при ризику цього, та подібно зменшеної суворості хвороби та /або асоційованого з болем нижче інцидентності, виявленої у загальній популяції таких осіб при ризику цього. Збільшення або зменшення болю, що описано вище, є відповідно статистично вірогідним стосовно прийнятних контролів, як-то підібрана за віком невакцинована група. Згідно з одним аспектом живий послаблений ВВВ або вбитий ВВВ та антиген ВВВ або антигенні похідні вірогідно не взаємодіють один з одним, так що при застосуванні у комбінації 2 компоненти ще здані забезпечувати імуногенну реакцію на ВВВ. Згідно з одним аспектом реакцією є захисна імуногенна реакція, чи застосовують 2 компоненти як композицію, послідовно чи співзастосуванням. Слід розуміти, що деяка взаємодія є дозволеною, однак, за умови, що загальна захисна імунна реакція є поліпшеною деяким шляхом (посиленням , збільшенням % респондерів або розширенням антигенних реакцій, наприклад) зверх будь-якого з первинних застосовуваних окремо компонентів. Згідно з одним аспектом винахід стосується комбінації антигену gE та штаму ОКА, застосовуваного для супутнього або послідовного застосування у будь-якому порядку. При супутньому уведенні 2 компоненти уводять у відмінні місця ін'єкцій, але протягом тої ж доби, наприклад. Згідно з одним аспектом для 2 компонентів застосовують відмінні шляхи уведення, зокрема, підшкірне уведення для вірусного штаму, як-то ОКА та внутрішньом'язове уведення для антигену, як-то gE. Заявлений винахід також охоплює в усіх описаних втіленнях застосування комбінацій антигенів або похідних ВВВ з живим послабленим штамом ВВВ або вбитим ВВВ. Придатні комбінації антигенів охоплюють згідно з одним аспектом gE або його імуногенне похідне. Комбінована композиція або будь-який або обидва компоненти можуть додатково містити ад'ювант або імуностимулятор як-то, але без обмеження детоксифікований ліпід А з будь-якого джерела та нетоксичні похідні ліпіду А, сапоніни та 9 інші реагенти, належно здатні стимулювати реакції типу Th1. Згідно з одним аспектом композиція містить ад'ювант, здатний стимулювати реакції типу ТМ. Високі рівні цитокінів типу Th1 мають тенденцію сприяти індукції опосередкованих клітинами імунних реакцій на даний антиген, доки високі рівні цитокінів Типу Th2y мають тенденцію сприяти індукції гуморальних імунних реакцій на антиген. Відмінність імунної реакції типу Th1 та імунної реакції Th2 не є абсолютною. У реальності особа підтримуватиме імунну реакцію, котру описано переважно як Тh1 або Th2. Однак, часто зручно розглядати родини цитокінів у термінах клонів мишачих CD4 +ve Т-клітин, описаних Mosmann, T.R. та Coffman, R.L. (1989) Th1 and Th2 cells: different patterns of limphokine secretion lead to different functional properties. Annual Review of Immunology, 7, р145-173). Традиційно, реакції типу Th1 асоційовані з продукуванням цитокінів INF- та IL-2 Тлімфоцитами. Інші цитокіни, часто безпосередньо асоційовані з індукцією імунних реакцій типу Th1, не є продукованими Т-клітинами, як-то IL-12. На відміну, реакції типу Th2 асоційовані з секрецією ІI4, IL-5, IL-6, IL-10. Придатні системи ад'ювантів, котрі сприяють переважно реакції Th1, містять, монофосфорилліпід А або його похідне, особливо 3-де-Оацилований монофосфорилліпід А. Давно відомо, що ентеробактеріальний ліпополісахарид (ЛПС) є потужним стимулятором імунної системи, хоча його застосування в ад'ювантах обмежене його токсичною дією. Нетоксичне похідне ЛПС, монофосфорилліпід А (МФЛ), продукований видаленням серцевинної вуглеводної групи та фосфату зі зменшуваного кінця глюкозаміну, описано Ribi et al (1986, Immunology та immunopharmacology of bacterial endotoxins, Plenum Publ. Corp., NY, p407419) та має наступну структуру: Наступна детоксифікована версія МФЛ є результатом видалення ацильного ланцюга з 3позиції дисахаридної основи, та має назву 3-ОДеацилований монофосфорилліпід A (3D-МФЛ). Його можна очищати та отримувати способами, наведеними у GB 2122204В, це посилання також 94900 10 розкриває отримання дифосфорилліпіду А та його 3-О-деацилованих варіантів. Згідно з одним аспектом 3D-МФЛ має форму емульсії, що має частинки невеликого розміру менше 0,2 мкм діаметром, а його спосіб виробництва розкрито у WO 94/21292. Водні композиції, що містять монофосфорилліпід А та сурфактант, описані у WO9843670A2. Похідні від бактеріального ліпополісахариду ад'юванти для формування у композиції заявленого винаходу можна очищати та обробляти з бактеріальних джерел, або альтернативно вони можуть бути синтетичними. Наприклад, очищений монофосфорилліпід А описано у Ribi et al 1986 (вище), а 3-О-Деацилований монофосфорил або дифосфорилліпід А, похідний від Salmonella sp., описано у GB 2220211 та US 4912094. Інші очищені та синтетичні ліпополісахариди описані (Hilgers et al, 1986, Int. Arch. Allergy. lmmunol., 79(4):392-6; Hilgers et al, 1987, Immunology, 60(l):141-6; та ЕР 0549074 Bl). Згідно з одним аспектом бактеріальним ліпополісахаридним ад'ювантом є 3D-МФЛ. Відповідно, похідні ЛПС, що можна застосовувати у заявленому винаході, є імуностимуляторами, що подібні за структурою ЛПС, МФЛ або 3DМФЛ. У ще одному втіленні заявленого винаходу похідні ЛПС можуть бути ацилованим моносахаридом, котрий є субчастиною вищенаведеної структури МФЛ. Сапоніни описані у: Lacaille-Dubois, Μ та Wagner H. (1996. A review of the biological and pharmacological activities of saponins. Phytomedicine vol 2 pp 363-386). Сапоніни є стероїдними або тритерпеновими глікозидами, широко розповсюдженими у царстві рослин та морських тварин. Сапоніни, як відомо, утворюють колоїдні розчини у воді, котрі піняться при струшуванні, та осаджують холестерин. Коли сапоніни є поблизу мембран клітин вони створюють пороподібні структури у мембрані, котрі викликають розрив мембрани. Гемоліз еритроцитів є прикладом цього явища, котре є властивістю деяких, але не усіх сапонінів. Сапоніни відомі як ад'юванти у вакцинах для системного застосування. Ад'ювантна та гемолітична активність певних сапонінів добре досліджена у рівні техніки (Lacaille-Dubois та Wagner, вище). Наприклад, Quil А (похідне з кори південноамериканського дерева Quillaja Saponaria Molina), та його фракції, описані у патенті США 5,057,540 та "Saponins as vaccine adjuvants", Kensil, С. R., CritRev Ther Drug Carrier Syst, 1996, 12 (l-2):l-55; та ЕР 0362279 Bl. Particulate structures, termed Immune Stimulating Complexes (ISCOMS), comprising fractions of Quil A are haemolytic and have been used in the manufacture of vaccines (Morein, В., ЕР 0109942 Bl; WO 96/11711; WO 96/33739). Гемолітичні сапоніни QS21 та QS17 (очищені за допомогою ВЕРХ фракції Quil А) описані як потужні системні ад'юванти, а спосіб їх продукування розкрито у патенті США № 5,057,540 та ЕР 0362279 ВІ. Інші сапоніни, котрі застосовані у системних дослідженнях вакцинації, охоплюють похідні з інших видів рослин, як-то Gypsophila та Saponaria (Bomford et al, Vaccine, 10(9):572-577, 1992). 11 Посилена система містить комбінацію нетоксичного похідного ліпіду А та похідного сапоніну, особливо комбінацію QS21 та 3D-МФЛ, що розкрито у WO 94/00153, або менш реактогенну композицію де QS21 гасять холестерином, що розкрито у WO 96/33739. Згідно з одним аспектом комбінацію QS21 із 3D-МФЛ застосовують у заявленому винаході. Згідно з одним аспектом ад'ювант для застосування у винаході містить QS21 та ліпосомну композицію, що містить холестерин та 3D-МФЛ. Особливо потужну композицію ад'юванту, що містить QS21 та 3D-МФЛ в емульсії масло у воді, описано у WO 95/17210, вона є також придатною для застосування у заявленому винаході. Відповідно, в одному втіленні заявленого винаходу запропоновано композицію, що містить антиген ВВВ або похідне заявленого винаходу, доповнене детоксифікованим ліпідом А або нетоксичним похідним ліпіду А. Згідно з одним аспектом композицію доповнено монофосфорилліпідом А або його похідним. Згідно з одним аспектом композиція додатково містить сапонін, котрим згідно з одним аспектом є QS21, а згідно з ще одним аспектом QS21, гашений холестерином, що розкрито у WO 96/33739. Імуногенна композиція винаходу, як варіант, містить емульсію масло у воді, її можна застосовувати у комбінації з іншими ад'ювантами, як-то QS21 та/ або 3D-ΜΦΠ, що розкрито вище. Ад'ювантні композиції, що містять емульсію масло у воді, розкриті у WO9911241 та WO9912565, уведено тут як довідки. Альтернативним ад'ювантом за вибором є неметиловані динуклеотиди CpG ("CpG"). CpG є скороченням цитозин-гуанозин-динуклеотидних мотифів у нуклеїновій кислоті. CpG-олігонуклеотиди розкриті у WO 96/02555 та ЕР 468520. Згідно з одним аспектом комбінацію будьякого з ад'ювантів винаходу, описаних тут (QS21 або QS21, гашений холестерином + 3DМФЛ, як варіант, з емульсією масло у воді) застосовують з gE, або його імуногенним похідним, застосовуваним у супутньому або послідовному застосуванні з живим послабленим ВВВ або інактивованим суцільним ВВВ. Заявлений винахід також стосується способу отримання комплекту, придатного для індукування імунної реакції проти оперізувального лишаю, спосіб полягає у змішуванні препарату антигену ВВВ заявленого винаходу разом з ад'ювантом або комбінацією ад'ювантів, та комбінування у комплект з живим послабленим ВВВ. Кількість антигену ВВВ вибирають як кількість, котра індукує імунозахисну реакцію без вірогідної шкідливої побічної дії у типових вакцинах. Така кількість варіюватиме залежно від конкретного застосовуваного імуногену та того, як його представлено. Загалом, припускають, що кожна доза міститиме 1-1000 мкг білку, як-то 2-100 мкг, або 560 мкг. Коли застосовують gE, тоді згідно з одним аспектом можна застосовувати 25-100 мкг gE для людей, як-то 40-100 мкг gE для застосування людиною, згідно з одним аспектом приблизно 25 мкг, приблизно 50 мкг або приблизно 100 мкг gE, від 94900 12 повідно 25 мкг, 50 мкг або 100 мкг gE. Для штаму ОКА, наприклад, придатною дозою є 500-50000 pfu/0,5 мл, як-то 2000-6000 pfu/0,5 мл, із придатною дозою штаму ОКА GSK Varilrix наприклад, 6000-25000 на дозу, наприклад, 10000 pfu/дозу. Вищі дози, як-то 30000 pfu, 40000 pfu, 50000 pfu 60000 pfu, 70000 pfu, 80000 pfu, 90000 pfu або навіть 100000 pfu можуть бути застосовуваними. Оптимальну кількість для конкретної вакцини можна встановити стандартними дослідженнями, у тому числі спостереженням прийнятної імунної реакції у осіб. Після початкової вакцинації, особи можуть отримувати одну чи кілька адекватно рознесених у часі ревакцинацій. Композиції заявленого винаходу можна формувати для будь-якого прийнятного способу застосування, наприклад, місцевого, перорального, назального, крізь слизову, внутрішньовенного, iнтрадермального, інтраперитонеального, підшкірного та внутрішньом'язового. Уведення штаму ОКА є, згідно з одним аспектом, підшкірним. Імуногенну композицію заявленого винаходу можна застосовувати у складі вакцини, як варіант, у комбінації з ад'ювантом та/або (іншим) придатним носієм. Антиген ВВВ та послаблений ВВВ заявленого винаходу можна застосовувати разом у композиції для провокування імунної реакції на ВВВ, або окремо - супутньо або послідовно у режимі первинної ревакцинації. Для послідовного або супутнього уведення компоненти вакцини можна застосовувати у будь-якому порядку. В одному втіленні уведення живого послабленого ВВВ або повністю інактивованого ВВВ супроводжують антигеном ВВВ або його імуногенним похідним. У ще одному втіленні уведення антигену ВВВ або його імуногенного похідного супроводжують уведенням живого послабленого ВВВ або повністю інактивованого ВВВ. Винахід крім того стосується способу попередження та/або зменшення суворості оперізувального герпесу та/або пост-герпетичної невралгії, що полягає у призначенні особі при ризику оперізувального лишаю імуногенної композиції, що містить живий послаблений ВВВ та антиген ВВВ. У наступному втіленні винахід стосується способу попередження та/або зменшення суворості оперізувального герпесу та/або пост-герпетичної невралгії, що полягає у послідовному або супутньому уведенні особі при ризику оперізувального лишаю живого послабленого ВВВ та антигену ВВВ. Згідно з одним аспектом винахід стосується режиму первинної ревакцинації, де антиген ВВВ, згідно з одним аспектом активувальний антиген, уводять першим, після чого імунну систему ревакцинують уведенням послабленого ВВВ. Режим первинної ревакцинації у людей, згідно з одним аспектом, полягає у ініціюванні 25-100 мкг gE, згідно з одним аспектом 40-100 мкг gE, як-то 50 або приблизно 50 мкг gE, або його імуногенного похідного, активувального антигену QS21 (наприклад, QS21, гашеного холестерином, що описано вище) та 3D-MФЛ, та ревакцинувальним штамом ОКА ВВВ. 13 Коли застосовують режими первинної ревакцинації або багатократної вакцинації, тоді можуть бути застосовуваними 2, 3, 4 або більше імунізацій. Придатні режими первинної ревакцинації охоплюють 1, 2, 3, 4, 5 або 6 місяців між окремими імунізаціями. Режим первинної ревакцинації полягає, згідно з одним аспектом, в уведенні антигену ВВВ або його імуногенного похідного, належно активувального антигену ВВВ або похідне, при 0 місяців та ревакцинуваня живим послабленим ВВВ при 2М. В альтернативному режимі уведення є супутнім уведенням обох з двох окремих компонентів (антиген ВВВ або похідне та живий послаблений ВВВ) у 0 та 2 місяці. У ще одному втіленні винахід стосується комплекту, що містить живий послаблений ВВВ або інактивований суцільний ВВВ та антиген ВВВ. Винахід також стосується способу виробництва імуногенної композиції, спосіб полягає у комбінуванні живого послабленого/повністю інактивованого ВВВ та антигену ВВВ. Винахід крім того стосується застосування живого послабленого штаму ВВВ у виготовленні комбінації вакцини з антигеном ВВВ для попередження оперізувального герпесу, та для застосування антигену ВВВ у виготовленні комбінації вакцини з живим послабленим штамом ВВВ для попередження оперізувального герпесу. По-друге, аспект винаходу антиген gE або його імуногенне похідне чи імуногенний фрагмент можна застосовувати з ад'ювантом для отримання імуногенної композиції або вакцини. Антиген gE або його імуногенне похідне чи імуногенний фрагмент можна застосовувати у режимі вакцинації у відсутності живого послабленого штаму або повністю інактивованого штаму. Отже, другий аспект винаходу стосується імуногенної композиції або вакцини, що містить gE або його імуногенне похідне чи імуногенний фрагмент у комбінації із Th1-ад'ювантом. Винахід також стосується застосування композиції, що містить gE або його імуногенне похідне чи імуногенний фрагмент, у комбінації з Th1ад'ювантом у виготовленні медикаменту для попередження або зменшення інтенсивності реактивації оперізувального герпесу та/або постгерпетичної невралгії. Термін "імуногенне похідне" стосовно gE описано вище разом зі способами отримання таких похідних, як-то фрагменти gE. Імуногенні фрагменти, що описано тут, є імуногенними похідними, котрі залишають здатність індукувати імунну реакцію на ВВВ після застосування до людини. Згідно з одним аспектом винаходу застосовують скорочений gE, у котрому gE має Стермінальне скорочення. Згідно з одним аспектом скороченням видалено від 4 до 20% загального числа амінокислотних залишків на карбокситермінальному кінці. Згідно з одним аспектом у gE не вистачає карбокситермінального закріплювального регіону (відповідно приблизно амінокислоти 547-623 послідовності природного типу). 94900 14 Згідно з одним аспектом gE є скороченим gE, що має послідовність з Фіг.1, що розкрито у Virus research, (Haumont et al Vol 40,1996 p199-204), що уведено тут як довідку. Посилання на gE подалі охоплює посилання на скорочений gE, або інші фрагменти або похідне gE, якщо інше не зрозуміло з контексту. Згідно з ще одним аспектом винаходу композиція містить gE повної довжини. Згідно з ще одним аспектом gE або похідне чи його фрагмент є ліофілізованим. Згідно з ще одним аспектом gE або похідне чи його фрагмент відтворюють у розчин, що містить ад'ювант (як-то ад'ювант, що містить QS21, холестерин та 3DМФЛ) перед уведенням. В одному втіленні композиція або вакцина містить gE та Th1-ад'ювант та не містить антигену ЕВ63 або його частину. В одному втіленні композиція або вакцина містить gE та Th1-ад'ювант та не містить будь-якого іншого антигену ВВВ. В одному втіленні композиція або вакцина містить gE та Th1-ад'ювант та не містить будь-якого іншого вірусного антигену. Згідно з одним аспектом gE чи його імуногенний фрагмент не має форми конденсованого білку. Згідно з одним аспектом композиція або вакцина складається по суті з QS21, антигену скороченого gE ВВВ та ліпосом, що містять холестерин, та 3D-МФЛ. Згідно з одним аспектом композиція або вакцина складається з 3D-МФЛ, QS21, антигену скороченого gE ВВВ, ліпосом, що містять холестерин, та фармацевтично прийнятного носія. Композицію можна застосовувати у виготовленні медикаменту для попередження або зменшення інтенсивності реактивації оперізувального герпесу та/або пост-герпетичної невралгії. Композиція або вакцина є належно застосовуваною у популяції людей віком 50 або старше, ніж 50. Належно популяцією є популяція старше, ніж 55, 60, 65, 70, 75, 80, або старше, ніж 80. Належно популяцією є 50-70 років. Згідно з одним аспектом популяцією є ті, хто мали вітряну віспу або живу вакцину вітряної віспи. Отже, винахід стосується застосування композиції, що описано вище у виготовленні медикаменту для попередження або зменшення інтенсивності реактивації оперізувального герпесу та/або постгерпетичної невралгії у популяції людей віком 50 або вище. Винахід тому також стосується способу попередження або зменшення інтенсивності реактивації оперізувального герпесу та/або постгерпетичної невралгії, спосіб полягає у призначенні особі при необхідності цього композиції винаходу. Згідно з одним аспектом композицію за першим та другим аспектами винаходу застосовують для осіб, у кого вірус вітряної віспи не є реактивованим. Композицію можна застосовувати у дозах та шляхами уведення, як показано вище для першого аспекту винаходу. Конкретно кількість антигену gE 15 вибирають як кількість, котра індукує імунозахисну реакцію без вірогідної шкідливої побічної дії у типових вакцинах. Така кількість варіюватиме залежно від конкретного застосовуваного імуногену та того, як його представлено. Загалом, припускають, що кожна доза міститиме 1-1000 мкг білку, як-то 2100 мкг, або 5-60 мкг. Коли застосовують gE, тоді відповідно застосовують 25-100 мкг gE, згідно з одним аспектом 40-100 мкг gE, як-то приблизно 25 мкг, 50 мкг або приблизно 100 мкг gE, відповідно 25 мкг, 50 мкг або 100 мкг gE. Оптимальну кількість для конкретної вакцини можна встановити стандартними дослідженнями, у тому числі спостереженням прийнятної імунної реакції у осіб. Після початкової вакцинації, особи можуть отримувати одну чи кілька адекватно рознесених ревакцинацій. Згідно з одним аспектом gE та композицію ад'юванту або вакцину застосовують в однодозовому режимі уведення. Згідно з одним аспектом gE та композицію ад'юванту або вакцину застосовують у дво-дозовому режимі уведення. Згідно з одним аспектом композицію або вакцину винаходу застосовують у дво-дозовому режимі з проміжком 2 місяці між дозами. Згідно з одним аспектом Th1-ад'ювантом є будь-який ад'ювант, ідентифікований вище для першого аспекту винаходу. Зокрема, можна застосовувати комбінацію 3D-МФЛ та QS21, наприклад, розкриту у WO94/00153, або менш реактогенну композицію, де QS21 гасять холестерином, розкриту у WO 96/33739 та US6846489. Альтернативний ад'ювант містить QS21 та ЗОМФЛ в емульсії масло у воді, що описано у WO 95/17210. Згідно з одним аспектом композиція містить Стермінальне скорочення антигену gE ВВВ, наприклад, представлене у Фіг.1, у комбінації із 3D-МФЛ та QS21. Згідно з ще одним аспектом винахід стосується комплекту, що містить, як окремі компоненти, Th1-ад'ювант та антиген gE чи його імуногенний фрагмент, що описано вище, придатні для отримання композиції вакцини для негайного прийому. Згідно з одним аспектом обидва компоненти є рідинами. Згідно з одним аспектом одним компонентом є ліофілізований, він є придатним для відтворення з іншим компонентом. Згідно з одним аспектом комплект містить антиген gE, що мають послідовність з Фіг.1 та ад'ювант, що містить QS21 та ліпосом, що містить холестерин та 3D-МФЛ. Отримання вакцин загалом описано у New Trends and Developments in Vaccines, Voller et al. (eds), University Park Press, Baltimore, Maryland, 1978. Аспекти заявленого винаходу охоплюють: А Імуногенну композицію, що містить антиген ВВВ або його імуногенне похідне у комбінації з живим послабленим ВВВ або повністю інактивованим ВВВ. В Спосіб попередження та/або зменшення суворості оперізувального герпесу та/або постгерпетичної невралгії (ПГН), що полягає у призначенні особі імуногенної композиції, що містить антиген ВВВ або його імуногенне похідне у комбінації 94900 16 з живим послабленим ВВВ або повністю інактивованим ВВВ. С Спосіб попередження та/або зменшення суворості оперізувального герпесу та/або постгерпетичної невралгії, спосіб полягає у послідовному або супутньому уведенні особі антигену ВВВ або його імуногенного похідного та живого послабленого ВВВ або повністю інактивованого ВВВ. D Спосіб згідно з пунктом С, де антиген ВВВ уводять перед живим послабленим ВВВ. Ε Спосіб згідно з пунктом С, де антиген ВВВ уводять після живого послабленого ВВВ. F Спосіб згідно з пунктом С, де уводять антиген ВВВ супутньо з живим послабленим ВВВ, переважно з кожним компонентом у різні руки пацієнта. G Комплект, що містить живий послаблений ВВВ або повністю інактивований ВВВ, та окремо, антиген ВВВ або його імуногенне похідне, компоненти придатні для послідовного або супутнього уведення, або для змішування для уведення як єдиної композиції. Η Спосіб виробництва імуногенної композиції, спосіб полягає у комбінуванні живого послабленого ВВВ або повністю інактивованого ВВВ з антигеном ВВВ або його імуногенним похідним. І Застосування живого послабленого штаму ВВВ у виготовленні імуногенної композиції для попередження та/або зменшення суворості оперізувального герпесу та/або пост-герпетичної невралгії, коли живий послаблений штам ВВВ застосовують у комбінації з антигеном ВВВ або його імуногенним похідним. J Застосування повністю інактивованого штаму ВВВ у виготовленні імуногенної композиції для попередження та/або зменшення суворості оперізувального герпесу та/або пост-герпетичної невралгії, де повністю інактивований штамом ВВВ застосовують у комбінації з антигеном ВВВ або його імуногенним похідним. K Застосування антигену ВВВ або його імуногенного похідного у виготовленні імуногенної композиції для попередження та/або зменшення суворості оперізувального герпесу та/або постгерпетичної невралгії, де антиген ВВВ застосовують у комбінації з живим послабленим штамом ВВВ або повністю інактивованим штамом ВВВ. L Застосування згідно з будь-яким з пунктів ІK, де антиген або його похідне уводять у підході первинної ревакцинації перед штамом ВВВ. Μ Застосування згідно з будь-яким з пунктів ІK, де антиген або його похідне уводять у підході первинної ревакцинації після штаму ВВВ. N Застосування згідно з будь-яким з пунктів ІK, де антиген або його похідне уводять супутньо з штамом ВВВ. О Застосування згідно з будь-яким з пунктів ІK, де антиген або його похідне уводять у суміші зі штамом ВВВ. Ρ Застосування, спосіб, комплект або композиція згідно з будь-яким з попередніх пунктів, де живий послаблений штам ВВВ є штамом ОКА. Q Застосування спосіб, комплект, композиція згідно з будь-яким з попередніх пунктів, де антиген ВВВ антиген gE або його імуногенне похідне. 17 94900 R Застосування, спосіб, комплект, композиція або вакцина за будь-яким з попередніх пунктів, де антиген ВВВ уводять з ад'ювантом, здатні до стимуляції реакції типу Th1. Заявлений винахід далі ілюстровано необмежувальними прикладами. Приклад 1 Три експериментальні групи можна засновувати для дослідження обох аспектів винаходу: Режим 50 мкг gE+ад'юват AS1 1 0,2 місяців (МФЛ/QS21) Штам ОКА (Varilrix)-10000 2 0,2 місяців pfu/дозу Супутнє застосування 50 мкг 3 gЕ+група AS1 (як у 1) з Varilrix 0,2 місяців (як у 2) МФЛ=3D-МФЛ Застосовуваний gE може бути скороченим gE, що розкрито у Фіг.1. Varilrix є комерційно доступним штамом ОКА. Людей-добровольців (наприклад, 50 на групу здорових, віком 50-70 років) можна вибирати для вакцинації за вищенаведеним протоколом, та результати можна оцінювати вимірюванням опосередкованого клітинами імунітету та реакціями антитіл, наприклад, внутрішньоклітинним фарбуванням (ФВКЦ, Roederer et al. 2004 Clin. Immunol. 110: 199) або способами ELISA відповідно, що добре відомо у рівні техніки. Специфічний опосередкований клітинами імунітет можна оцінювати, наприклад, інкубацією in Група А В С D Ε Вік(Р) 18-30 18-30 50-70 50-70 50-70 N 10 10 45 45 45 vitro PBMC пацієнта екстрактами вірусу вітряної віспи, а також специфічними антигенами ВВВ або пептидами gE, IE63 та ІЕ62. Аналіз можна робити на рівні, наприклад,: а Лімфопроліферації (дані виражені як індекс стимуляції [IС]): GM, GM разів збільшення та % респондерів b Аналізу експресії IFN або IL2 або TNF, або CD 40L клітинами CD4 та CD8 ФВКЦ (фарбування внутрішньоклітинних цитокінів): GM, GM разів збільшення та % респондерів Ефективність можна оцінювати спостереженням вірогідного збільшення OКI та/або реакції антитіл у порівнянні з рівнями перед вакцинацією. Ефективність інших антигенів або підходів можна оцінювати цими або подібними способами, та порівнюючи рівні перед вакцинацією з рівнями після вакцинації. Приклад 2 Експеримент прикладу 1 проводили на людяхдобровольцях різного віку, таким чином: Група A gE AS1 у дорослих 18-30 років Група В gE, якій уводять супутньо з штамом ОКА Varilrix 18-30 років Група С самотній штам ОКА Varilrix дорослим 50-70 років Група D gE AS1 у дорослих 50-70 років Група Ε gE, якій уводять супутньо зі штамом ОКА Varilrix 50-70 років Режим вакцинації був таким: Вакц. 1 (Місяць 0) gE-AS1 gE-AS1 + Varilrix Varilrix gE-AS1 gE-AS1 + Varilrix Ад'ювант AS1 містить 3D-МФЛ та QS21 у гашеній формі з холестерином, робили те, що описано у WO9633739, що уведено тут як довідку. Зокрема, ад'ювант AS1 отримували по суті як у прикладі 1,1 WO9633739. Ад'ювант містить: ліпосоми, котрі у свою чергу містять діолеоїл фосфатидилхолін (DOPC), холестерин та 3D-МФЛ [у кількість. 1000 мкг DOPC, 250 мкг холестерину та 50 мкг 3D-МФЛ, кожне значення надане приблизно на дозу вакцини], QS21 [50 мкг/дозу], PBS та воду до об'єму 0,5 мл. Для отримання ліпосом, що містять МФЛ DOPC (Діолеоїл фосфатидилхолін), холестерин та МФЛ розчиняють в етанолі. Ліпідну плівку утворюють випарюванням розчиннику під вакуумом. Буферований фосфатом фізіологічний розчин або БФФР (9 мМ Na2HPO4, 41 мМ KН2РО4, 100 мМ NaCI) при рН 6,1 додають та суміш попередньо гомогенізують, а потім мікрофлюїдизують при 15000 фунт/кв.дюйм (20 циклів). Це призводить до продукування ліпосом, котрі стерильно фільтрують через мембрану 0,22 мкм в асептичній (клас 100) зоні. Стерильний продукт тоді розподіляють у стерильну скляну тару та зберігають у холодному приміщенні (+2 - +8°С). Такі продуковані ліпосоми 18 Вакц 2 (Місяць 2) gE-AS1 gEAS1+Varilrix Varilrix gE-AS1 gE-AS1+Varilrix містять МФЛ у мембрані ("МФЛ у" втіленні WO9633739). Скорочений gE з Фіг.1 експресували у клітинах СНО К1 стандартними способами та очищали застосуванням, у порядку, аніоно-обмінної хроматографії, гідрофобної хроматографії, іонообмінної хроматографії, діафільтрування та нанофільтрування, а потім стерилізації через 0 фільтр,22 мкм. Зокрема, наступні етапи були застосовані в очистці gE Перший етап: аніоно-обмінна хроматографія Супернатант культури, що містить gE (приблизн. 30 мг/л) очищають безпосередньо після очистки суспензії клітин або після розморожування при 4°С. Після переносу у бутель на 20 л, рН супернатанту доводять до 6. Етап захоплення має місце при зовнішній температурі на хроматографічній колонці, що містить смолу Q Sepharose XL. Після дезінфекції натрій гідроксидом, колонку кондиціонують у буфері для захоплення (піперазин 20 мМ рН 6). Супернатант тоді завантажують на колонку та колонку промивають урівноважувальним буфером та розчином піперазину 20 мМ + NaCl 150 мМ рН6. 19 Фракцію, що містить gE, тоді елюють розчином піперазину 20 мМ + NaCI 250 мМ при рН6. Другий етап: гідрофобна хроматографія Цей етап хроматографії має місце при зовнішній температурі на смолі ТоуореагІ бутил-650 Μ (Tosoh Biosep). Етап фракцій, що елювали 20 мМ піперазином + 250 мМ NaCI у Q Sepharose XL, роблять в 1 Μ амоній сульфаті та доводять до рН 7,5. Після дезінфекції натрій гідроксидом та перед завантаженням цієї фракції, колонку кондиціонують у буфері для захоплення (50 мМ KН2РО4 + 1М амоній сульфат з рН 7,5). Після завантаження, колонку промивають буфером 50 мМ KН2РО4 +100 мМ (NH4)2SO4 рН 7,5. gE елюють буфером 50 мМ KН2РО4 + 25 мМ (NH4)2SO4 рН 7,5. Третій етап: афінна хроматографія на іммобілізованому іоні металу Цей хроматографічний етап має місце при зовнішній температурі на смолі Chelating Sepharose Fast Flow. Цю смолу насипають іонами металу (Ni) застосуванням розчину нікель сульфату (1%) та надлишок незв'язаних іонів (Ni), видаляють промивкою. Фракцію gE, що елювали у 50 мМ KН2РО4 + 25 мМ (NH4)2SO4 рН 7,5 у гідрофобній фазі, роблять у 0,5 Μ NaCI та доводять до рН 7,5. Після дезінфекції, колонку урівноважують у буфері для захоплення (50 мМ KН2РО4 + 0,5 Μ NaCI рН 7,5). Розчин gE завантажують на колонку, котру тоді промивають розчином 50 мМ KН2РО4 + 0,5 Μ NaCI рН 5,6. gE тоді елюють буфером 50 мМ натрій ацетат + 0,5 Μ NaCI рН 5, та нейтралізують 1 Μ розчином Трис з рН 9,5. Четвертий етап: діафільтрування Заміну буферу та позбавлення від солей фракції gE, ельованої при рН 5 на попередньому етапі, проводять тангенційним ультрафільтрування. Цей етап проводять повністю при +4°С. Ультрафільтрування проводять на системі Millipore Proflux M12, з мембраною 10 кДа Pellicon2 Mini з регенерованої целюлози (cat: P2C010C01) обмеженої номінальної молекулярної маси та площею повер2 хні 0,1 м , розташованою у міні касеті Pellicon2 (cat.XX42PMINI). Після промивання водою та дезінфекції натрій гідроксидом, систему з 15 мембраною промивають 2 л модифікованого БФФРбуферу (=8,1 мМ Na2HPO4·2H2O, 1,47 мМ KН2РО4, 137 мМ NaCI, 2,68 мМ KCl рН 7,2), а тоді урівноважують з 2 л того ж буферу до рН значення 7,2 у розчиненій речовині. Вимір проникності мембрани контролюють. Тест цілісності на мембрані проводять піддаванням системи тиску до 1 бар перед етапом діафільтрування та у його кінці. Якщо цю мембрану застосовують двічі з інтервалом один тиждень, цілісність слід тестувати 3 рази (раз перед кожним ультрафільтруванням та раз після другого фільтрування). Мембрану вважають непошкодженою, якщо втрата тиску протягом 5 хвилин є менше 0,1 бар. Концентрацію фракції gE, ельованої при рН 5 у етапі афінності оцінюють вимірюванням оптичної густини при 280 нм. Кореляцію між поглинанням 94900 20 при 280 нм та концентрацією білку gE за допомогою microВСА фіксують при 1 ОГ280 = 1,75 мг/мл. Розчин, що містить gE, діафільтрують проти 10 об'ємів модифікованого БФФР-буферу (= 8,1 мМ Na2HPO42H2O,1,47 мМ KН2РО4,137 мМ NaCI, 2,68 мМ KCL рН 7,2). Тиск встановлюють так, щоб період діафільтрування був приблизно 1,5-2 години (потік проникнення приблизн. 60 мл/хвилин). Залишок від діафільтрування тоді отримують та на основі базового рівня ОГ20 мембрану промивають модифікованим БФФР для отримання приблизної кінцевої концентрації 0,4 мг/мл. П'ятий етап: нанофільтрування Цей наступний етап дає можливість позбавитися від вірусів з діаметром більше 15 нм стримуванням. Етап проводять повністю при +4°С. Нанофільтрування проводять на фільтрі PLANOVA 15N (середній розмір пор 15 нм; площа поверхні 2 фільтрування 0,12 м (ASAHI cat: 15NZ-120)). При постійному тиску 0,45 бар, розчин gE фільтрують на мембрані та збирають з іншого боку відносно видалених вірусів. Трубки та колонку ХК50 дезінфікують протягом 2 годин розчином NaOH 0,5M. Це тоді промивають та нейтралізують модифікованим БФФР-буфером (той же буфер, що для діафільтрування) до значення рН 7,2. Після фіксування нанофільтра PLANOVA 15N під кожухом, фільтр промивають та урівноважують з модифікованим БФФР розчином. Залишок від діафільтрування, що містить розчин gE є спершу попередньо фільтрують через 0,22 мкм (mini kleenpak OU Acropak20, залежно від об'єму, що фільтрують) перед нанофільтруванням при постійному тиску 0,45 бар на PLANOVA 15N. У кінці нанофільтрування, фільтр промивають достатнім об'ємом модифікованого БФФР для отримання кінцевої концентрації приблизно 0,3 мг/мл. До закінчення мембрану промивають 50 мл модифікованого БФФР. Розчин збирають через вихідний отвір для залишку. Тести цілісності на мембрані PLANOVA 15N тоді проводять таким чином: - перший тест полягає у піддаванні мембрани 2 тиску (1,0 кг/см ) та спостереженні утворення бульбашок повітря. Цей тест виявляє будь-які великі щілини. - другий тест: видалення частинок золота (PARTICORPLANOVA-QCVAL4) контролює структуру мембрани (гарне розподілення великих пор та капілярів). Склад вакцини gE-компонент вакцини містить 50 мкг gE та наповнювачі натрій хлорид, калій хлорид, монокалій фосфат, динатрій фосфат та воду для ін'єкцій, а також ад'ювант AS1. Функція неорганічних солей полягає у гарантуванні ізотонічності та фізіологічного рН. У стерильній скляній тарі, вода для ін'єкцій, концентрований буферований фосфатом фізіологічний розчин та антиген gE були змішані у порядку для досягнення концентрації інгредієнтів: 21 Інгредієнти gЕ Натрій хлорид (NaCI) Динатрій фосфат (Na2HPO4) Монокалій фосфат (KН2РО4) Калій хлорид (KCl) Вода для ін'єкцій 94900 Кількість (на дозу) 50 мкг 1603 мкг 288 мкг 40 мкг 40 мкг до 0,2 мл Розчин змішують протягом 30-40 хвилин. рН перевіряють та доводять до 7,2±0,1 НСІ або NaCI та перемішують ще 10 хвилин. Кінцеву порцію зберігали у поліпропіленових флаконах при -20°С та переносили у GSK Віо для наповнення. Вакциною заповнюють стерильні силіконізовані склянки 3 мл (0,25 мл/склянку), котрі закривають сірими хлорбутиловими пробками та алюмінієвими кришечками з центральним отвором. Перевірені склянки тоді зберігають при -20°С. Уведення вакцини Вакцину gE-AS1 для застосування отримували змішуванням препарату рідкого антигену з рідким ад'ювантом AS1 безпосередньо перед ін'єкцією (максимум одна година перед ін'єкцією). ОКА (Varilrix) комерційно доступний, партію отримували згідно з інструкціями виробника. Композиції вакцини були такими: Вакцина gE Композиція 50 мкг антигену ВВВ (gE) в об'ємі 0,2 мл AS1 в об'ємі 0,5 мл Презентація Склянка, що містить рідкий gЕ Загальний об'єм дози* 0,7 мл (після відтворення) Вакцина Varilrix з розріджувачем 4.0 Композиція Приблизно 10 pfu/дозу об'єм 0/5 мл Презентація Склянка, що містить ліофілізовану вакцину для відтворення Загальний об'єм дози* 0,5 мл Компонент gE AS1 застосовували внутрішньом'язовою ін'єкцією. Компонент Varilrix застосовували підшкірною ін'єкцією. Аналіз результатів Протокол клінічного дослідження, зареєстрований для клінічного дослідження, показані типи досліджень, що були проведені у дослідженні, а саме: 22 а Лімфопроліферація (дані виражені як індекс стимуляції [IС]): GM, разів збільшення GM та % респондерів після стимуляції лізатом ВВВ. b реакція IFN гамма та/або IL2, TNF альфа, CD40L, CD4 та CD8 за ФВКЦ (внутрішньоклітинне фарбування): GM, - разів збільшення GM та % респондерів після стимуляції лізатом ВВВ та пептиди gE, IE62 та ІЕ63. Лімфопроліферація Периферійної крові антиген-специфічні лімфоцити можна рестимулювати in vitro для проліферації, якщо інкубувати з їх відповідним антигеном. Далі, кількість антиген-специфічних лімфоцитів можна оцінити аналізом підрахунку приєднання тритійованого тимідину. У представленому дослідженні білки антигену ВВВ або похідного від ВВВ пептиду застосовуватимуть як антиген для рестимулювання ВВВ-специфічних лімфоцитів. Результати виражено як індекс стимуляції (IС), котрий відповідає співвідношенню між антиген-специфічною та фоновою лімфопроліферацією. Цитометрія цитокінів у потоці (CFC) Периферійної крові антиген-специфічні CD4 та CD8 Т-клітини можна рестимулювати in vitro для експресії CD40L, IL-2, TNF альфа та IFN гамма, якщо інкубувати їх відповідним антигеном. Далі, антиген-специфічні CD4 та CD8 Т-клітини можна перерахувати цитометрією у потоці після звичайного імунофлуоресцентного мічення клітинного фенотипу, а також внутрішньоклітинного продукування цитокінів. У представленому дослідженні білки антигену ВВВ або пептиду, похідного від ВВВ, застосовуватимуть як антиген для рестимулювання ВВВ-специфічних Т-кпітин. Результати виражено як частота цитокін-позитивних CD4 або CD8 Т-кпітин у субпопуляції CD4 або CD8 Т-клітин. Специфічне антитіло (анти-ВВВ та анти-gE) Рівні антитіл проти ВВВ та gE вимірюють застосуванням класичних аналізів ELISA. Результати експерименту показані у формі таблиць. Фіг.2-6 представляють результати у формі графіків для антитіл (Фіг.2-4, дивись таблиці 1,1 - с) та реакції OKI (Фіг.5 та 6 - дивись таблицю С1/тест "CD4 усі дублікати" з антигеном gE або Varilirix, середні значення). Гуморальні імунні реакції Таблиця 1,1а Значення серопозитивності та СГТ для антитіла ВВВ IGG (когорта АТР стосовно імуногенності) Таблиця 1,1 b Значення серопозитивності та СГТ для антитіла BBB.GE (когорта АТР стосовно імуногенності) Таблиця 1,1с Значення серопозитивності та СГТ для антитіла IFA (когорта АТР стосовно імуногенності) Таблиця 1,2b Значення сероконверсії для титру антитіл gE у кожний момент часу після вакцинації (когорта АТР стосовно імуногенності) Таблиця 1,3а Реакція на вакцину для титру антитіл ВВВ у кожний момент часу після вакцинації (когорта АТР стосовно імуногенності) Таблиця 1,3b Реакція на вакцину для титру антитіл gE у кожний момент часу після вакцинації (когорта АТР стосовно імуногенності) Таблиця 1,3с Реакція на вакцину для титру антитіл IFA у кожний момент часу після вакцинації (когорта АТР стосовно імуногенності) 23 94900 24 Таблиця 1,1а Значення серопозитивності та СГТ для антитіл BBB-IGG (когорта АТР стосовно імуногенності) >=50 MIU/МЛ 95% ДІ Відлік часу ПЕРЕД РІ(М1) gE/Y РІ(М2) РІI(М3) ПЕРЕД РІ(М1) gEVAR/Υ РІ(М2) РІІ(M3) ПЕРЕД РІ(М1) ВВВ IGG VAR/E РІ(М2) РІІ(M3) ПЕРЕД РІ(М1) gE/E РІ(М2) РІІ(M3) ПЕРЕД Р1(М1) gEVAR/Ε РІ(М2) РІІ(M3) Антитіл Група СГТ 95% ДІ N n % НО ВО значення 10 10 10 10 10 10 10 10 45 45 45 45 45 45 45 45 44 44 44 44 10 10 10 10 10 10 10 10 45 45 45 45 45 45 45 45 44 44 44 44 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 69,2 69,2 69, 69, 69, 69, 69, 69,2 92,1 92,1 92,1 92,1 92,1 92,1 92,1 92,1 92, 92,0 92,0 92, 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 100 1875,9 14843, 10697, 14330, 1047,4 12859, 10072, 15245, 856,9 2538,8 2292,2 2338,3 940,1 5897,4 4523,0 9083,9 1165,1 8371,7 6849,1 9849,1 НО ВО Мін Макс 1077,2 8457,7 6768,2 10492, 519,3 7063,0 5631,4 9930,9 647,5 2072,3 1880,6 1933,6 744,2 4594,7 3570,6 7437,6 954,6 6637,2 5422,6 8201,7 3266,8 26049, 16908, 19571, 2112,6 23412, 18014, 23404, 1134,1 3110,3 2793,9 2827,7 1187,6 7569,5 5729,4 11094, 1422,1 10559, 8650,8 11827, 455,0 6051,0 3167,0 7173,0 300,0 3346,0 3678,0 6381,0 100,0 288,0 374,0 523,0 208,0 659,0 598,0 2493,0 209,0 2509,0 1753,0 3528,0 4634,0 65242,0 29622,0 30894,0 5754,0 49163,0 36289,0 36534,0 5377,0 8034,0 7549,0 16994,0 4221,0 27042,0 19268,0 42073,0 5558,0 56066,0 55958,0 38664,0 gE/Y=gE-AS1/18-30 років gEVAR/Y=gE-AS1+Varilrix/18-30 років VAR/E=Varilrix/50-70 років gE/E=gE-AS1/50-70 років gEVAR/E=gE-AS1+Varilrix/50-70 років СГК=середнє геометричне концентрації антитіл, розраховано на усіх особах N=число осіб з дійсними результатами n/%=число/процентне співвідношення осіб з концентрацією у вказаному діапазоні 95% ДІ=95% довірчий інтервал; НО=Нижче обмеження, ВО=Вище мін/макс=мінімум/максимум ПЕРЕД = Доза перед вакцинацією 1 РІ(М1)=Доза після вакцинації 1 (Місяць 1) РІ(М2)=Доза після вакцинації 1 (Місяць 2) РІІ(M3) = Доза після вакцинації 2 (Місяць 3) обмеження Таблиця 1,1b Значення серопозитивності та СГТ для антитіл ВВВ gE (когорта АТР стосовно імуногенності) Антитіл Група gE/Y BBB.GE gEVAR/Υ Відлік ПЕРЕД PI(M1) РІ(М2) РІІ(M3) ПЕРЕД Р1(М1) РІ(М2) РІІ(M3) N 10 10 10 10 10 10 10 10 >=109ЕLU/МЛ СГТ 95% ДІ 95% ДІ n % НО ВО значення НО ВО 8 80, 44, 97,5 302,6 120,5 759,9 10 100 69, 100 18365, 9610,6 35094, 10 100 69, 100 11076, 7037,4 17433, 10 100 69, 100 15842, 11543, 21743, 7 70, 34, 93,3 190,3 96,4 375,6 10 100 69, 100 16225, 8657,3 30410, 10 100 69, 100 11554, 6312,5 21150, 10 100 69, 100 18101, 11384, 28780, Мін
ДивитисяДодаткова інформація
Назва патенту англійськоюVaccine
Автори англійськоюHanon Emmanuel Jules, Stephenne Jean
Назва патенту російськоюВакцина
Автори російськоюАнон Эммануэль Жюль, Стефенн Жан
МПК / Мітки
МПК: A61K 39/25, A61P 31/22, A61K 39/39, C12N 7/04, C07K 14/04
Мітки: вакцина
Код посилання
<a href="https://ua.patents.su/45-94900-vakcina.html" target="_blank" rel="follow" title="База патентів України">Вакцина</a>
Попередній патент: Фіксоване дозування антитіл до her
Наступний патент: Антибактеріальні похідні піперидину
Випадковий патент: Спосіб діагностики стану мозкового кровообігу