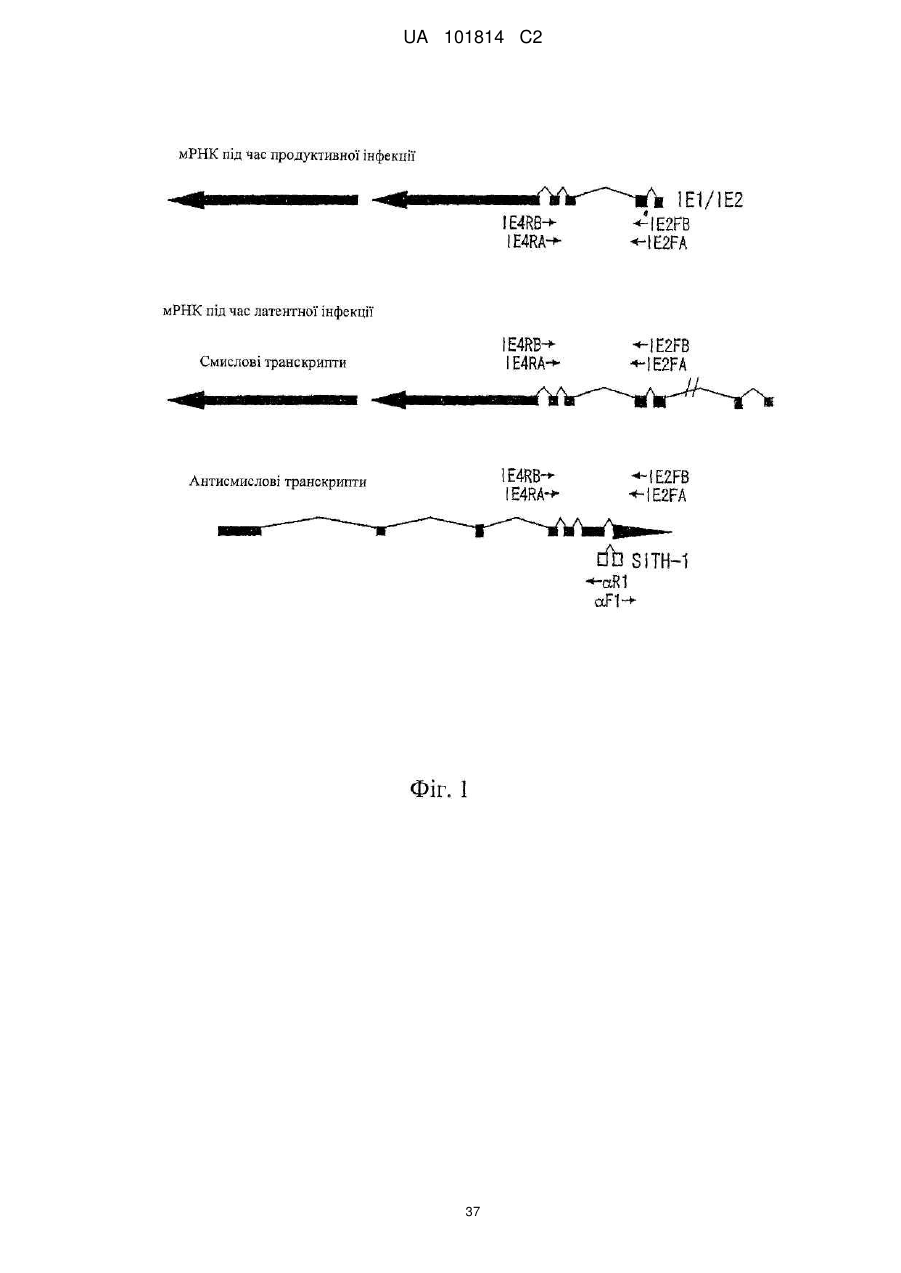
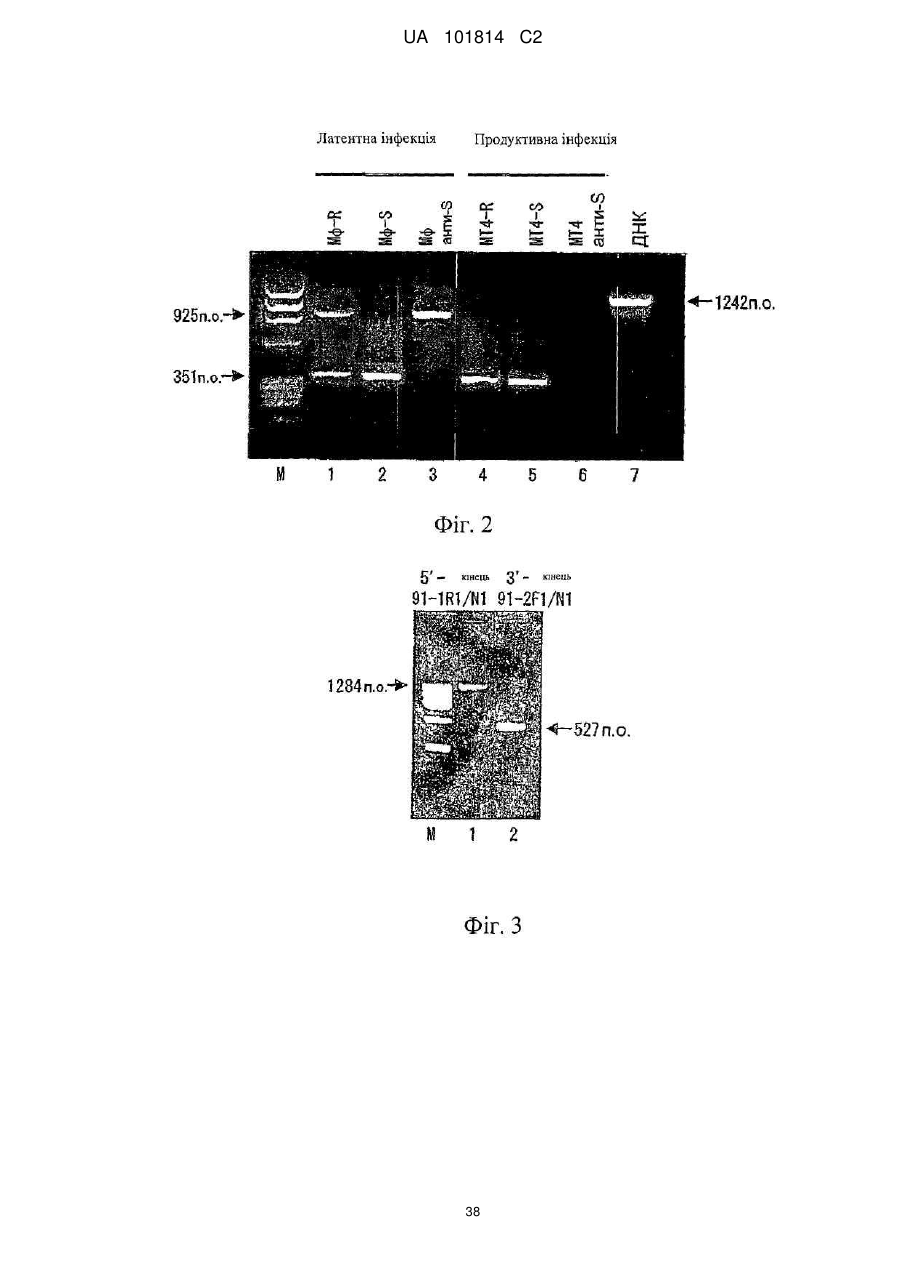
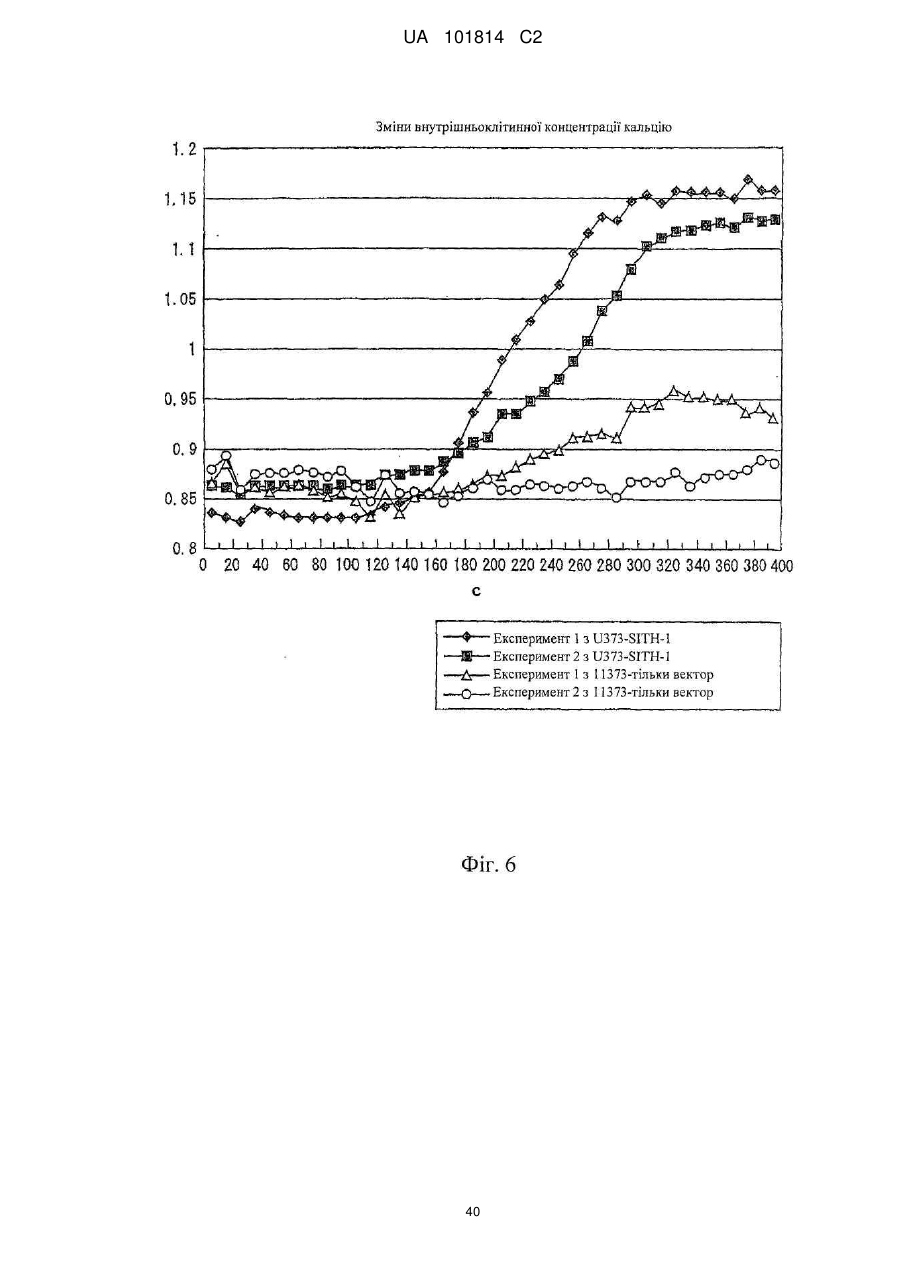
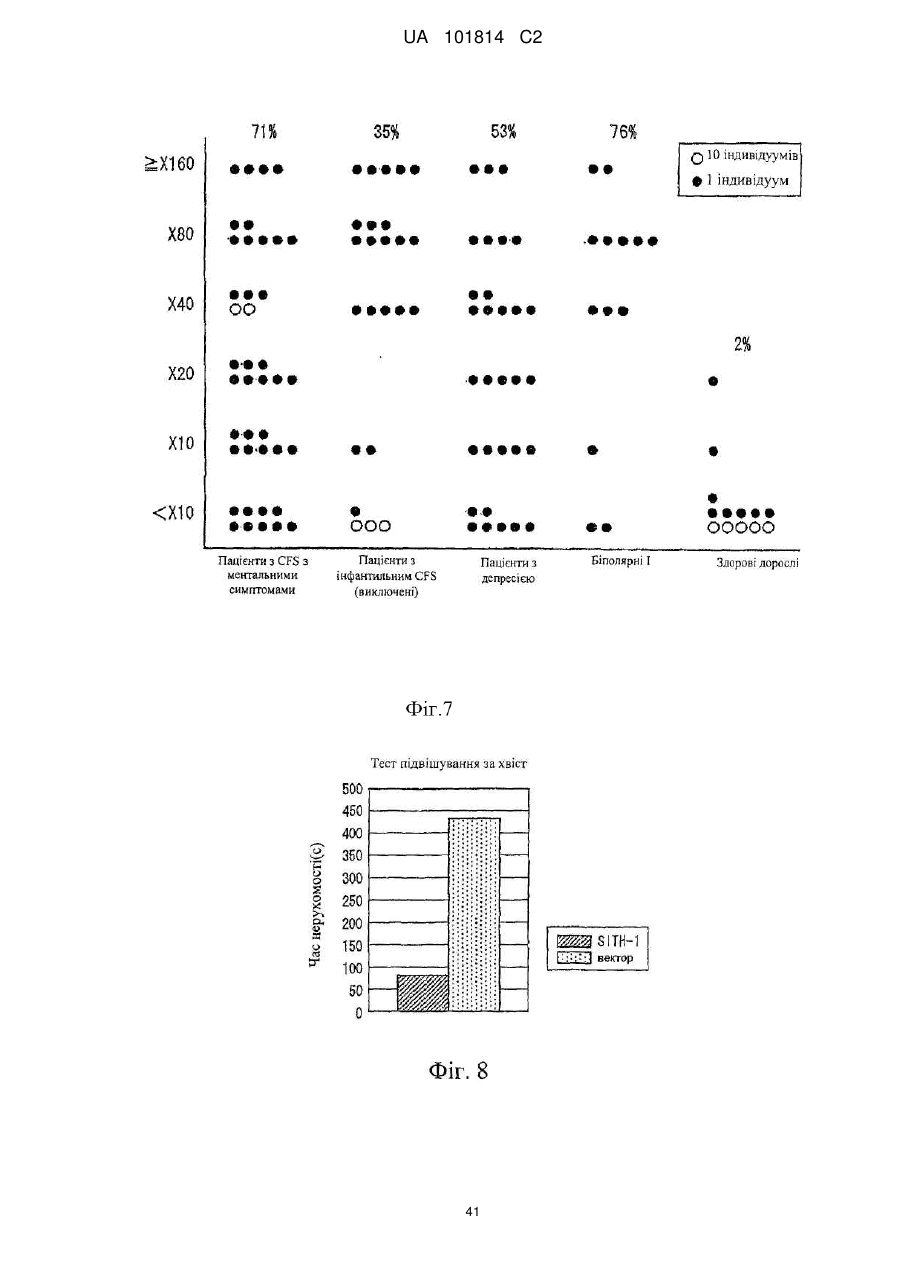
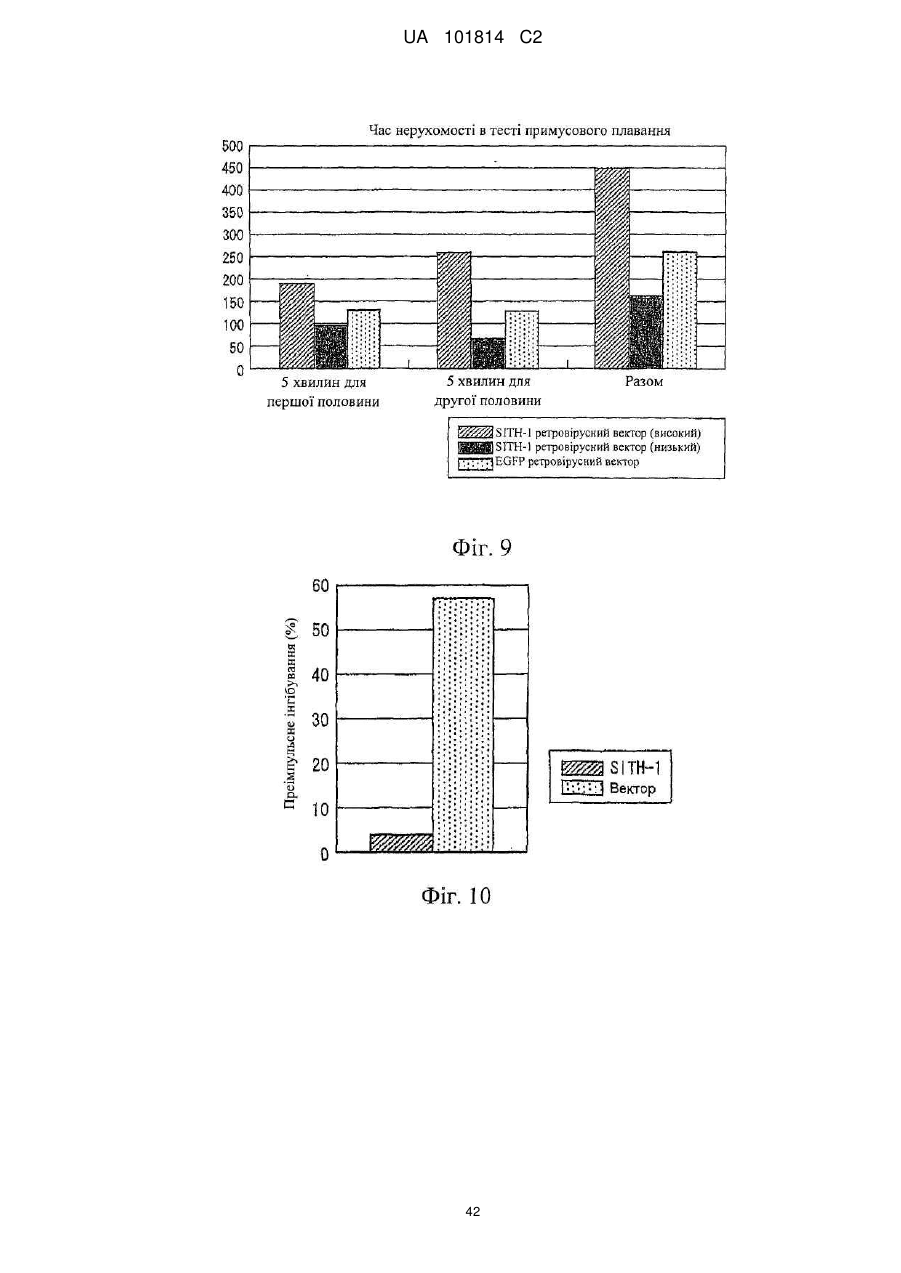
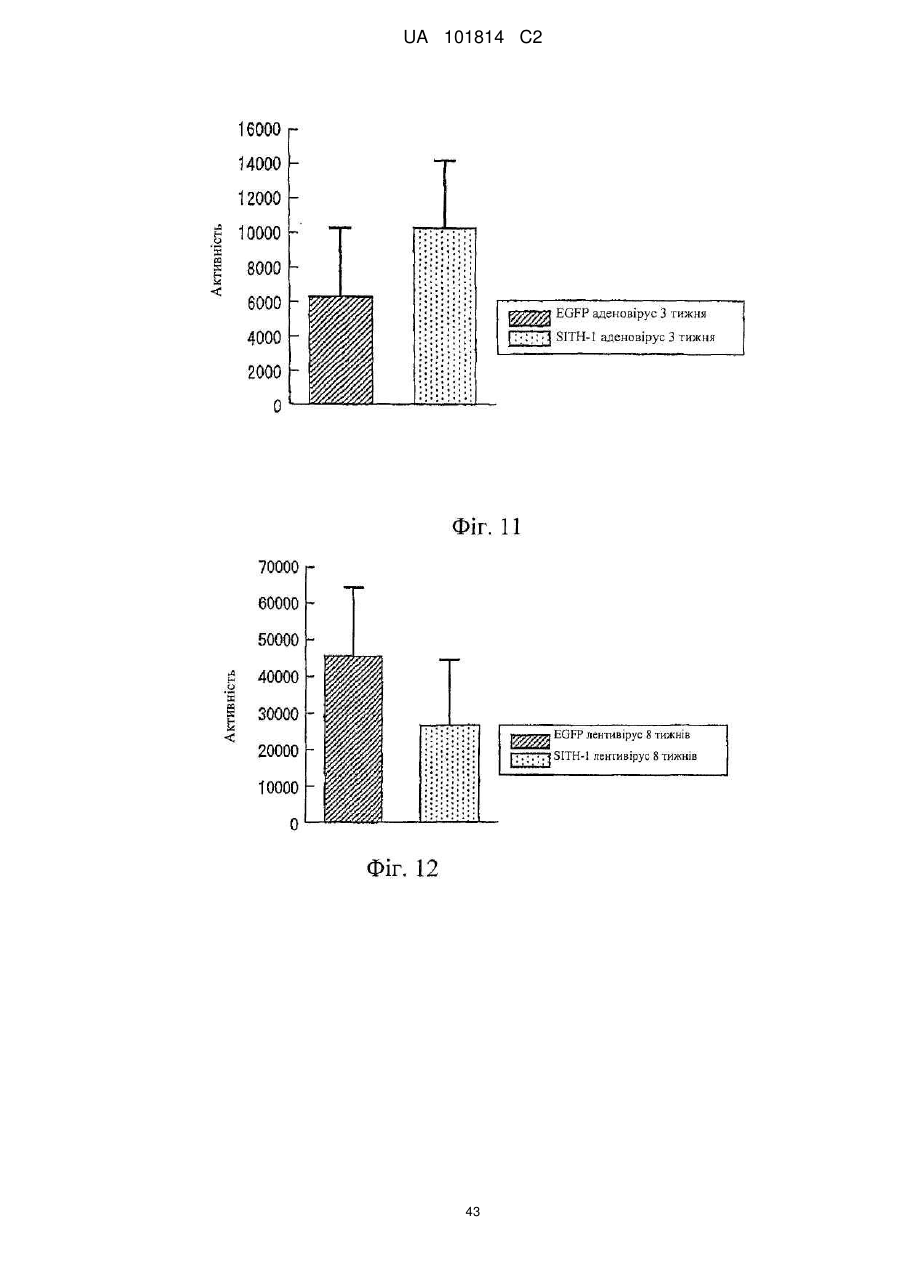
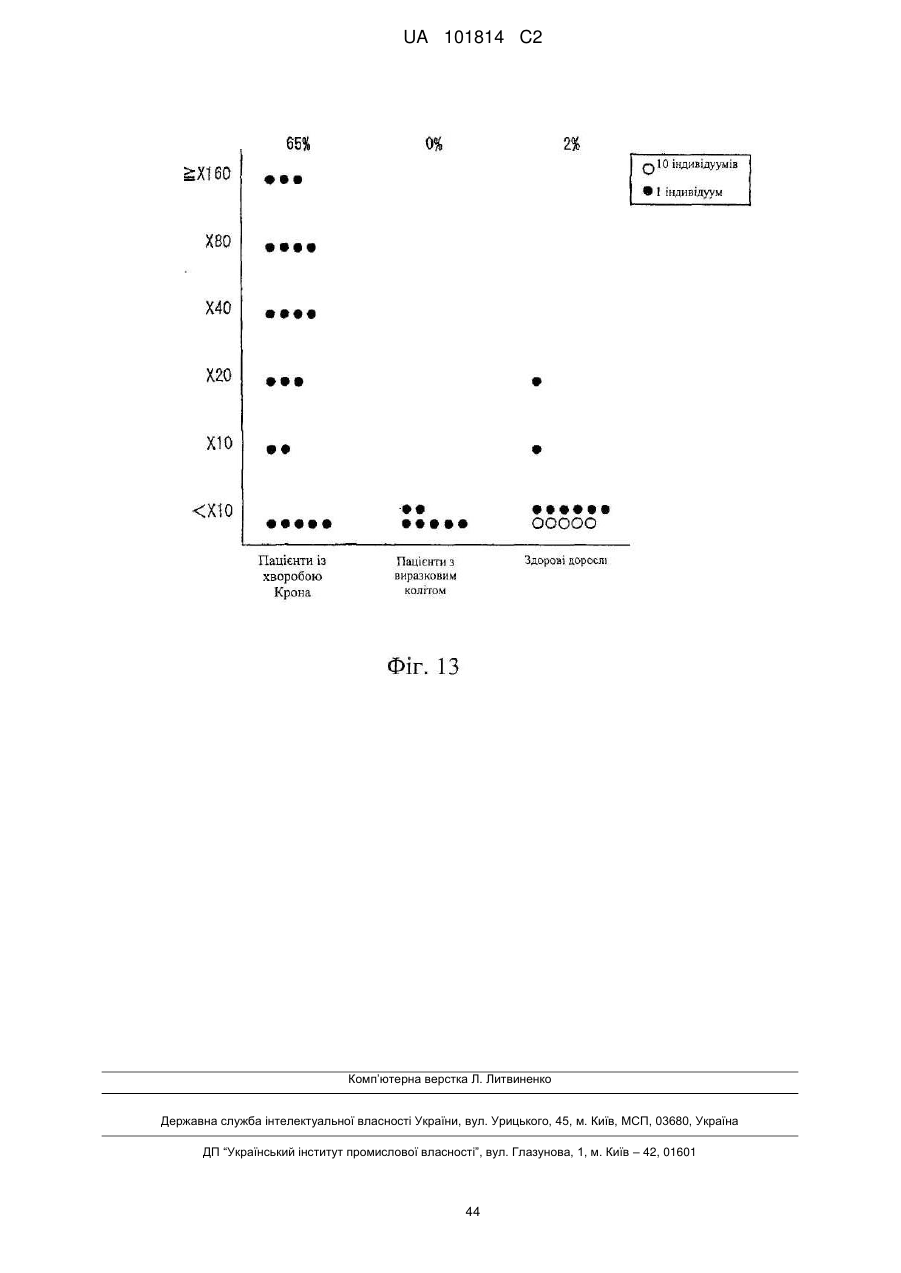
Фактор, залучений в латентну інфекцію герпесвірусом, і його застосування
Формула / Реферат
1. Ген, який являє собою:
(a) ген, що кодує білок, який має амінокислотну послідовність, показану на SEQ ID NO: 1;
(b) ген, що кодує білок, який має амінокислотну послідовність із заміною, делецією, вставленням і/або додаванням 10 або менше амінокислот в амінокислотній послідовності, показаній на SEQ ID NO: 1, де білок має активність збільшення внутрішньоклітинної концентрації кальцію або активність зв′язування з лігандом циклофіліну, який регулює рівень кальцію;
(c) ген, що містить зону відкритої рамки зчитування, що має нуклеотидну послідовність, показану на SEQ ID NO: 2; або
(d) ген, що кодує білок, де вказаний ген гібридизується в суворих умовах гібридизації із ДНК, що має нуклеотидну послідовність, комплементарну ДНК, що має нуклеотидну послідовність, показану на SEQ ID NO: 2, де білок має активність збільшення внутрішньоклітинної концентрації кальцію або активність зв′язування з лігандом циклофіліну, який регулює рівень кальцію,
при умові, що ген не є геном, що кодує білок, що має амінокислотну послідовність білка з номером доступу Q9QJ14 (AF157706.1).
2. Білок, який являє собою:
(a) білок, що має амінокислотну послідовність, показану на SEQ ID NO: 1;
(b) білок, що має амінокислотну послідовність із заміною, делецією, вставленням і/або додаванням 10 або менше амінокислот в амінокислотну послідовність, показану на SEQ ID NO: 1, де білок має активність збільшення внутрішньоклітинної концентрації кальцію або активність зв′язування з лігандом циклофіліну, який регулює рівень кальцію; або
(c) білок, який кодується геном за п. 1,
при умові, що ген не є геном, що кодує білок, що має амінокислотну послідовність білка з номером доступу Q9QJ14 (AF157706.1).
3. Антитіло, яке одержане із використанням як антигену білка за п. 2 або його часткового фрагмента, яке зв′язує білок за п. 2.
4. Рекомбінантний експресуючий вектор, який містить ген за п. 1.
5. Трансформант, що не є людиною, одержаний перенесенням гена за п. 1 або рекомбінантного експресуючого вектора за п. 4.
6. Засіб для детекції гена, який містить зонд, який має щонайменше від 12 до 50 основ нуклеотидної послідовності гена за п. 1 або комплементарну їй послідовність.
7. Засіб для детекції антитіла за п. 3, що містить зонд, який являє собою поліпептид, який має щонайменше частину амінокислотної послідовності білка за п. 2.
8. Спосіб діагностики ментального порушення з використанням виділеної біологічної проби, який включає стадію:
визначення кількості або рівня антитіл проти білка в біологічній пробі,
де вказаний білок вибраний з:
(a) білка, що має амінокислотну послідовність, показану на SEQ ID NO: 1;
(b) білка, що має амінокислотну послідовність із заміною, делецією, вставленням і/або додаванням 10 або менше амінокислот в амінокислотній послідовності, показаній на SEQ ID NO: 1, де білок має активність збільшення внутрішньоклітинної концентрації кальцію або активність зв'язування з регулюючим рівень кальцію лігандом циклофіліну;
(с) білка, що кодується геном, який включає ділянку відкритої рамки зчитування, що включає нуклеотидну послідовність, показану на SEQ ID NO: 2; та
(d) білка, що кодується геном, де вказаний ген гібридизується в суворих умовах гібридизації з ДНК, що має нуклеотидну послідовність, комплементарну ДНК, яка має нуклеотидну послідовність, показану на SEQ ID NO: 2, де білок має активність збільшення внутрішньоклітинної концентрації кальцію або активність зв'язування з регулюючим рівень кальцію лігандом циклофіліну.
9. Спосіб за п. 8, де визначення здійснюють за допомогою імунологічної детекції із застосуванням білка за п. 2 або часткового фрагмента білка.
10. Набір, використовуваний для здійснення способу діагностики ментального порушення, за п. 8, що містить щонайменше одне, вибране з:
(i) білка;
(ii) часткового фрагмента білка (i); та
(iii) засобу, на якому іммобілізований білок (i) або частковий фрагмент (ii),
де вказаний білок вибраний з:
(a) білка, що має амінокислотну послідовність, показану на SEQ ID NO: 1;
(b) білка, що має амінокислотну послідовність із заміною, делецією, вставленням і/або додаванням 10 або менше амінокислот в амінокислотній послідовності, показаній на SEQ ID NO: 1, де білок має активність збільшення внутрішньоклітинної концентрації кальцію або активність зв'язування з регулюючим рівень кальцію лігандом циклофіліну;
(с) білка, що кодується геном, який включає ділянку відкритої рамки зчитування, що включає нуклеотидну послідовність, показану на SEQ ID NO: 2; та
(d) білка, що кодується геном, де вказаний ген гібридизується в суворих умовах гібридизації з ДНК, що має нуклеотидну послідовність, комплементарну ДНК, яка має нуклеотидну послідовність, показану на SEQ ID NO: 2, де білок має активність збільшення внутрішньоклітинної концентрації кальцію або активність зв'язування з регулюючим рівень кальцію лігандом циклофіліну.
11. Спосіб діагностики, має чи ні суб′єкт-людина ментальне порушення, з використанням виділеної біологічної проби, який включає стадії:
(i) визначення кількості або рівня антитіл проти білка в біологічній пробі, виділеній з суб′єкта-людини; і
(ii) визначення, існує чи ні в суб′єкта-людини ментальне порушення, з використанням кількісного показника як індикатора, де кількісний показник являє собою кількість або рівень антитіл в біологічній пробі,
де вказаний білок вибраний з:
(a) білка, що має амінокислотну послідовність, показану на SEQ ID NO: 1;
(b) білка, що має амінокислотну послідовність із заміною, делецією, вставленням і/або додаванням 10 або менше амінокислот в амінокислотній послідовності, показаній на SEQ ID NO: 1, де білок має активність збільшення внутрішньоклітинної концентрації кальцію або активність зв'язування з регулюючим рівень кальцію лігандом циклофіліну;
(с) білка, що кодується геном, який включає ділянку відкритої рамки зчитування, що включає нуклеотидну послідовність, показану на SEQ ID NO: 2; та
(d) білка, що кодується геном, де вказаний ген гібридизується в суворих умовах гібридизації з ДНК, що має нуклеотидну послідовність, комплементарну ДНК, яка має нуклеотидну послідовність, показану на SEQ ID NO: 2, де білок має активність збільшення внутрішньоклітинної концентрації кальцію або активність зв'язування з регулюючим рівень кальцію лігандом циклофіліну.
12. Спосіб діагностики, має чи ні суб′єкт-тварина, що не є людиною, ментальне порушення, який включає стадії:
(i) визначення, існує чи ні в суб′єкта-тварини, що не є людиною, антитіло проти білка; і
(ii) визначення, що суб′єкт-тварина, що не є людиною, має ментальне порушення, у випадку, коли на стадії (i) визначають, що антитіло існує в суб′єкта-тварини, що не є людиною,
де вказаний білок вибраний з:
(a) білка, що має амінокислотну послідовність, показану на SEQ ID NO: 1;
(b) білка, що має амінокислотну послідовність із заміною, делецією, вставленням і/або додаванням 10 або менше амінокислот в амінокислотній послідовності, показаній на SEQ ID NO: 1, де білок має активність збільшення внутрішньоклітинної концентраціїкальцію або активність зв'язування з регулюючим рівень кальцію лігандом циклофіліну;
(с) білка, що кодується геном, який включає ділянку відкритої рамки зчитування, що включає нуклеотидну послідовність, показану на SEQ ID NO: 2; та
(d) білка, що кодується геном, де вказаний ген гібридизується в суворих умовах гібридизації з ДНК, що має нуклеотидну послідовність, комплементарну ДНК, яка має нуклеотидну послідовність, показану на SEQ ID NO: 2, де білок має активність збільшення внутрішньоклітинної концентрації кальцію або активність зв'язування з регулюючим рівень кальцію лігандом циклофіліну.
13. Набір для діагностики, використовуваний для здійснення діагностичного способу за п. 11 або 12,
що містить щонайменше одне, вибране з:
(i) білка;
(ii) часткового фрагмента білка (i); та
(iii) засобу для детекції, на якому іммобілізований білок (i) або частковий фрагмент (ii),
де вказаний білок вибраний з:
(a) білка, що має амінокислотну послідовність, показану на SEQ ID NO: 1;
(b) білка, що має амінокислотну послідовність із заміною, делецією, вставленням і/або додаванням 10 або менше амінокислот в амінокислотній послідовності, показаній на SEQ ID NO: 1, де білок має активність збільшення внутрішньоклітинної концентрації кальцію або активність зв'язування з регулюючим рівень кальцію лігандом циклофіліну;
(с) білка, що кодується геном, який включає ділянку відкритої рамки зчитування, що включає нуклеотидну послідовність, показану на SEQ ID NO: 2; та
(d) білка, що кодується геном, де вказаний ген гібридизується в суворих умовах гібридизації з ДНК, що має нуклеотидну послідовність, комплементарну ДНК, яка має нуклеотидну послідовність, показану на SEQ ID NO: 2, де білок має активність збільшення внутрішньоклітинної концентрації кальцію або активність зв'язування з регулюючим рівень кальцію лігандом циклофіліну.
14. Спосіб вибору експериментальної моделі на тварині, що не є людиною, для визначення, є чи ні суб′єкт-тварина, застосовним як тваринна модель ментального порушення або хвороби Крона, що включає стадії:
(i) діагностики, існує чи ні в суб′єкта-тварини, що не є людиною, антитіло проти білка; і
(ii) визначення, що суб′єкт-тварина, що не є людиною, є застосовним як тваринна модель ментального порушення або хвороби Крона, у випадку, коли на стадії (i) визначають, що у суб′єкта-тварини, що не є людиною, присутнє антитіло,
де вказаний білок вибраний з:
(a) білка, що має амінокислотну послідовність, показану на SEQ ID NO: 1;
(b) білка, що має амінокислотну послідовність із заміною, делецією, вставленням і/або додаванням 10 або менше амінокислот в амінокислотній послідовності, показаній на SEQ ID NO: 1, де білок має активність збільшення внутрішньоклітинної концентрації кальцію або активність зв'язування з регулюючим рівень кальцію лігандом циклофіліну;
(с) білка, що кодується геном, який включає ділянку відкритої рамки зчитування, що включає нуклеотидну послідовність, показану на SEQ ID NO: 2; та
(d) білка, що кодується геном, де вказаний ген гібридизується в суворих умовах гібридизації з ДНК, що має нуклеотидну послідовність, комплементарну ДНК, яка має нуклеотидну послідовність, показану на SEQ ID NO: 2, де білок має активність збільшення внутрішньоклітинної концентрації кальцію або активність зв'язування з регулюючим рівень кальцію лігандом циклофіліну.
15. Модельна тварина, що не є людиною, призначена для використання як тваринна модель ментального порушення або хвороби Крона, яка включає ген, продукт цього гена або рекомбінантного експресуючого вектора, який містить ген,
де вказаний ген вибраний з:
(a) гена, який кодує білок, що має амінокислотну послідовність, показану на SEQ ID NO: 1;
(b) гена, який кодує білок, що має амінокислотну послідовність із заміною, делецією, вставленням і/або додаванням 10 або менше амінокислот в амінокислотній послідовності, показаній на SEQ ID NO: 1, де білок має активність збільшення внутрішньоклітинної концентрації кальцію або активність зв'язування з регулюючим рівень кальцію лігандом циклофіліну;
(с) гена, який містить ділянку відкритої рамки зчитування, що включає нуклеотидну послідовність, показану на SEQ ID NO: 2; та
(d) гена, який гібридизується в суворих умовах гібридизації з ДНК, що має нуклеотидну послідовність, комплементарну ДНК, яка має нуклеотидну послідовність, показану на SEQ ID NO: 2, де білок має активність збільшення внутрішньоклітинної концентрації кальцію або активність зв'язування з регулюючим рівень кальцію лігандом циклофіліну.
16. Спосіб проведення скринінгу речовини-кандидата на психотропний засіб або на антипсихотичний засіб, який включає в себе стадії:
(i) введення речовини, що розглядається, у модельну тварину за п. 15 з ментальним порушенням або хворобою Крона;
(ii) визначення, є чи ні у модельної тварини, що не є людиною, антитіла проти білка; і
(iii) визначення, що розглянута речовина є речовиною-кандидатом на психотропний засіб або на антипсихотичний засіб, на основі кількості антитіл у модельної тварини.
17. Застосування гена, продукту цього гена або рекомбінантного експресуючого вектора, що містить ген, для одержання модельної тварини, де тварина не є людиною,
де вказаний ген вибраний з:
(a) гена, який кодує білок, що має амінокислотну послідовність, показану на SEQ ID NO: 1;
(b) гена, який кодує білок, що має амінокислотну послідовність із заміною, делецією, вставленням і/або додаванням 10 або менше амінокислот в амінокислотній послідовності, показаній на SEQ ID NO: 1, де білок має активність збільшення внутрішньоклітинної концентрації кальцію або активність зв'язування з регулюючим рівень кальцію лігандом циклофіліну;
(с) гена, який містить ділянку відкритої рамки зчитування, що включає нуклеотидну послідовність, показану на SEQ ID NO: 2; та
(d) гена, який гібридизується в суворих умовах гібридизації з ДНК, що має нуклеотидну послідовність, комплементарну ДНК, яка має нуклеотидну послідовність, показану на SEQ ID NO: 2, де білок має активність збільшення внутрішньоклітинної концентрації кальцію або активність зв'язування з регулюючим рівень кальцію лігандом циклофіліну.
18. Спосіб детекції антитіл для діагностики ментального порушення або хвороби Крона, що включає: детектування антитіла проти білка в біологічній пробі, що виділена з суб'єкта,
де вказаний білок вибраний з:
(a) білка, що має амінокислотну послідовність, показану на SEQ ID NO: 1;
(b) білка, що має амінокислотну послідовність із заміною, делецією, вставленням і/або додаванням 10 або менше амінокислот в амінокислотній послідовності, показаній на SEQ ID NO: 1, де білок має активність збільшення внутрішньоклітинної концентрації кальцію або активність зв'язування з регулюючим рівень кальцію лігандом циклофіліну;
(с) білка, що кодується геном, який включає ділянку відкритої рамки зчитування, що включає нуклеотидну послідовність, показану на SEQ ID NO: 2; та
(d) білка, що кодується геном, де вказаний ген гібридизується в суворих умовах гібридизації з ДНК, що має нуклеотидну послідовність, комплементарну ДНК, яка має нуклеотидну послідовність, показану на SEQ ID NO: 2, де білок має активність збільшення внутрішньоклітинної концентрації кальцію або активність зв'язування з регулюючим рівень кальцію лігандом циклофіліну.
19. Застосування білка або часткового фрагмента, що має щонайменше сім його амінокислот, для діагностики, має чи ні суб'єкт ментальне порушення або хворобу Крона, шляхом детектування антитіла проти білка в біологічній пробі, що виділена з суб'єкта,
де вказаний білок вибраний з:
(a) білка, що має амінокислотну послідовність, показану на SEQ ID NO: 1;
(b) білка, що має амінокислотну послідовність із заміною, делецією, вставленням і/або додаванням 10 або менше амінокислот в амінокислотній послідовності, показаній на SEQ ID NO: 1, де білок має активність збільшення внутрішньоклітинної концентрації кальцію або активність зв'язування з регулюючим рівень кальцію лігандом циклофіліну;
(с) білка, що кодується геном, який включає ділянку відкритої рамки зчитування, що включає нуклеотидну послідовність, показану на SEQ ID NO: 2; та
(d) білка, що кодується геном, де вказаний ген гібридизується в суворих умовах гібридизації з ДНК, що має нуклеотидну послідовність, комплементарну ДНК, яка має нуклеотидну послідовність, показану на SEQ ID NO: 2, де білок має активність збільшення внутрішньоклітинної концентрації кальцію або активність зв'язування з регулюючим рівень кальцію лігандом циклофіліну.
20. Застосування білка або часткового фрагмента, що має щонайменше сім його амінокислот, для діагностики, має чи ні суб'єкт ментальне порушення або хворобу Крона, де діагностика виконується шляхом використання біологічної проби, що виділена з суб'єкта,
де вказаний білок вибраний з:
(a) білка, що має амінокислотну послідовність, показану на SEQ ID NO: 1;
(b) білка, що має амінокислотну послідовність із заміною, делецією, вставленням і/або додаванням 10 або менше амінокислот в амінокислотній послідовності, показаній на SEQ ID NO: 1, де білок має активність збільшення внутрішньоклітинної концентрації кальцію або активність зв'язування з регулюючим рівень кальцію лігандом циклофіліну;
(с) білка, що кодується геном, який включає ділянку відкритої рамки зчитування, що включає нуклеотидну послідовність, показану на SEQ ID NO: 2; та
(d) білка, що кодується геном, де вказаний ген гібридизується в суворих умовах гібридизації з ДНК, що має нуклеотидну послідовність, комплементарну ДНК, яка має нуклеотидну послідовність, показану на SEQ ID NO: 2, де білок має активність збільшення внутрішньоклітинної концентрації кальцію або активність зв'язування з регулюючим рівень кальцію лігандом циклофіліну.
21. Спосіб діагностики, має чи ні суб'єкт ментальне порушення або хворобу Крона, який виконується шляхом використання біологічної проби, що виділена з суб'єкта, який включає стадії:
(i) визначення кількості або рівня білка або гена, що кодує цей білок в біологічній пробі, що виділена з суб′єкта; і
(ii) визначення, що суб′єкт має ментальне порушення або хворобу Крона, з використанням кількісного показника, де кільксний показник являє собою кількість або рівень білка або гена в біологічній пробі,
де вказаний білок вибраний з:
(a) білка, що має амінокислотну послідовність, показану на SEQ ID NO: 1;
(b) білка, що має амінокислотну послідовність із заміною, делецією, вставленням і/або додаванням 10 або менше амінокислот в амінокислотній послідовності, показаній на SEQ ID NO: 1, де білок має активність збільшення внутрішньоклітинної концентрації кальцію або активність зв'язування з регулюючим рівень кальцію лігандом циклофіліну;
(с) білка, що кодується геном, який включає ділянку відкритої рамки зчитування, що включає нуклеотидну послідовність, показану на SEQ ID NO: 2; та
(d) білка, що кодується геном, де вказаний ген гібридизується в суворих умовах гібридизації з ДНК, що має нуклеотидну послідовність, комплементарну ДНК, яка має нуклеотидну послідовність, показану на SEQ ID NO: 2, де білок має активність збільшення внутрішньоклітинної концентрації кальцію або активність зв'язування з регулюючим рівень кальцію лігандом циклофіліну.
22. Застосування антитіла проти білка для діагностики, має чи ні субєкт ментальне порушення або хворобу Крона, де діагностика виконується шляхом використання біологічної проби, що виділена у суб′єкта,
де вказаний білок вибраний з:
(a) білка, що має амінокислотну послідовність, показану на SEQ ID NO: 1;
(b) білка, що має амінокислотну послідовність із заміною, делецією, вставленням і/або додаванням 10 або менше амінокислот в амінокислотній послідовності, показаній на SEQ ID NO: 1, де білок має активність збільшення внутрішньоклітинної концентрації кальцію або активність зв'язування з регулюючим рівень кальцію лігандом циклофіліну;
(с) білка, що кодується геном, який включає ділянку відкритої рамки зчитування, що включає нуклеотидну послідовність, показану на SEQ ID NO: 2; та
(d) білка, що кодується геном, де вказаний ген гібридизується в суворих умовах гібридизації з ДНК, що має нуклеотидну послідовність, комплементарну ДНК, яка має нуклеотидну послідовність, показану на SEQ ID NO: 2, де білок має активність збільшення внутрішньоклітинної концентрації кальцію або активність зв'язування з регулюючим рівень кальцію лігандом циклофіліну.
23. Застосування гена, його комплементарної послідовності, щонайменше частини нуклеотидної послідовності гена або послідовності, що комплементарна їй, для діагностики, має чи ні суб'єкт ментальне порушення або хворобу Крона, де діагностика виконується шляхом використання біологічної проби, що виділена з суб'єкта,
де вказаний ген вибраний з:
(a) гена, який кодує білок, що має амінокислотну послідовність, показану на SEQ ID NO: 1;
(b) гена, який кодує білок, що має амінокислотну послідовність із заміною, делецією, вставленням і/або додаванням 10 або менше амінокислот в амінокислотній послідовності, показаній на SEQ ID NO: 1, де білок має активність збільшення внутрішньоклітинної концентрації кальцію або активність зв'язування з регулюючим рівень кальцію лігандом циклофіліну;
(с) гена, який містить ділянку відкритої рамки зчитування, що включає нуклеотидну послідовність, показану на SEQ ID NO: 2; та
(d) гена, який гібридизується в суворих умовах гібридизації з ДНК, що має нуклеотидну послідовність, комплементарну ДНК, яка має нуклеотидну послідовність, показану на SEQ ID NO: 2, де білок має активність збільшення внутрішньоклітинної концентрації кальцію або активність зв'язування з регулюючим рівень кальцію лігандом циклофіліну.
24. Застосування модельної тварини, що не є людиною, за п.15 для
(i) скринінгу речовини-кандидата на психотропний засіб або на антипсихотичний засіб, і/або
(ii) вивчення ефекту дії речовини-кандидата.
25. Застосування білка, гена, що кодує цей білок, або антитіла проти цього білка для одержання засобу для діагностики, має чи ні суб'єкт ментальне порушення або хворобу Крона,
де вказаний білок вибраний з:
(a) білка, що має амінокислотну послідовність, показану на SEQ ID NO: 1;
(b) білка, що має амінокислотну послідовність із заміною, делецією, вставленням і/або додаванням 10 або менше амінокислот в амінокислотній послідовності, показаній на SEQ ID NO: 1, де білок має активність збільшення внутрішньоклітинної концентрації кальцію або активність зв'язування з регулюючим рівень кальцію лігандом циклофіліну;
(с) білка, що кодується геном, який включає ділянку відкритої рамки зчитування, що включає нуклеотидну послідовність, показану на SEQ ID NO: 2; та
(d) білка, що кодується геном, де вказаний ген гібридизується в суворих умовах гібридизації з ДНК, що має нуклеотидну послідовність, комплементарну ДНК, яка має нуклеотидну послідовність, показану на SEQ ID NO: 2, де білок має активність збільшення внутрішньоклітинної концентрації кальцію або активність зв'язування з регулюючим рівень кальцію лігандом циклофіліну.
26. Спосіб діагностики, має чи ні суб'єкт хворобу Крона, який виконується шляхом використання біологічної проби, що виділена з суб'єкта, який включає стадії:
(i) визначення кількості або рівня антитіл проти білка в біологічній пробі, що виділена з суб'єкта; та
(ii) визначення, що суб'єкт має хворобу Крона, з використанням кількісного показника як індикатора, де кількісний показник являє собою кількість або рівень антитіл в біологічній пробі,
де вказаний білок вибраний з:
(a) білка, що має амінокислотну послідовність, показану на SEQ ID NO: 1;
(b) білка, що має амінокислотну послідовність із заміною, делецією, вставленням і/або додаванням 10 або менше амінокислот в амінокислотній послідовності, показаній на SEQ ID NO: 1, де білок має активність збільшення внутрішньоклітинної концентрації кальцію або активність зв'язування з регулюючим рівень кальцію лігандом циклофіліну;
(с) білка, що кодується геном, який включає ділянку відкритої рамки зчитування, що включає нуклеотидну послідовність, показану на SEQ ID NO: 2; та
(d) білка, що кодується геном, де вказаний ген гібридизується в суворих умовах гібридизації з ДНК, що має нуклеотидну послідовність, комплементарну ДНК, яка має нуклеотидну послідовність, показану на SEQ ID NO: 2, де білок має активність збільшення внутрішньоклітинної концентрації кальцію або активність зв'язування з регулюючим рівень кальцію лігандом циклофіліну.
27. Спосіб діагностики, має чи ні суб'єкт, що не є людиною, хворобу Крона, який виконується шляхом використання біологічної проби, що виділена з суб'єкта, який включає стадії:
(i) визначення, існує чи ні антитіло проти білка в біологічній пробі, виділеній з суб'єкта-тварини, що не є людиною; і
(ii) визначення, що суб′єкт-тварина, що не є людиною, має хворобу Крона, у випадку, коли на стадії (i) визначають, що антитіло присутнє в біологічній пробі,
де вказаний білок вибраний з:
(a) білка, що має амінокислотну послідовність, показану на SEQ ID NO: 1;
(b) білка, що має амінокислотну послідовність із заміною, делецією, вставленням і/або додаванням 10 або менше амінокислот в амінокислотній послідовності, показаній на SEQ ID NO: 1, де білок має активність збільшення внутрішньоклітинної концентрації кальцію або активність зв'язування з регулюючим рівень кальцію лігандом циклофіліну;
(с) білка, що кодується геном, який включає ділянку відкритої рамки зчитування, що включає нуклеотидну послідовність, показану на SEQ ID NO: 2; та
(d) білка, що кодується геном, де вказаний ген гібридизується в суворих умовах гібридизації з ДНК, що має нуклеотидну послідовність, комплементарну ДНК, яка має нуклеотидну послідовність, показану на SEQ ID NO: 2, де білок має активність збільшення внутрішньоклітинної концентрації кальцію або активність зв'язування з регулюючим рівень кальцію лігандом циклофіліну.
Текст
Реферат: Винахід належить до білка і гена, які є чинниками, залученими у латентну інфекцію герпесвірусом, до антитіла до зазначеного білка, до способу визначення ментального порушення й експериментальної моделі ментального порушення. UA 101814 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки Даний винахід стосується фактора, залученого в латентну інфекцію герпесвірусом, і його застосування. Зокрема, даний винахід стосується нового білка, який специфічно експресується під час латентної інфекції герпесвірусом, гена, що кодує зазначений білок, і їх застосування. Рівень техніки Віруси сімейства Herpesviridae, кожний з яких має загальний розмір приблизно 150-200 нм, є такими, що коров’ячий білок оточений багатоланцюговою ДНК із молекулярними масами 806 150×10 дальтон. Ця багатоланцюгова ДНК укладена в ікосаедричний капсид, що має діаметр приблизно 100 нм і складений з 162 капсомерів, з утворенням нуклеокапсиду, оточеного оболонкою. Герпесвіруси виявлені майже у всіх ссавців і земноводних. Зокрема віруси сімейства Herpesviridae, що мають специфічність до людині як до хазяїна, названі герпесвірусами людини (HHV). HHV класифіковані на підродини Alphaherpesvirinae (наприклад, вірус простого герпесу й вірус герпесу Варицела-Зостер), Betaherpesvirinae (наприклад, цитомегаловірус) і Gammaherpesvirinae (наприклад, вірус EB). Ці герпесвіруси характеризуються наявністю стадії латентної інфекції. «Латентна інфекція» належить до такої стадії інфекції, коли вірус, що інфікував клітину-хазяїна, не продукує інфекційні віріони всередині клітини-хазяїна, але продовжує виживати. Навіть у цій фазі латентної інфекції гени й продукти генів вірусу, що допомагають існувати генам вірусу, залишаються всередині клітини-хазяїна. Відомо, що герпесвіруси з латентною інфекцією відновляють продукцію віріонів і вірусну реплікацію у великих кількостях внаслідок певних причин з боку хазяїна (наприклад, старіння й соматичні ускладнення (включаючи стомлення)). Цей стан називають «реактивацією». Коротко, герпесвіруси мають наступну унікальну властивість: герпесвіруси продовжують інфікувати хазяїна латентно, поки у хазяїна немає нічого аномального; однак як тільки у хазяїна виникає соматичне порушення, і віруси детектирують, що хазяїн піддається небезпеці, віруси реактивуються для пошуку іншого, здоровішого хазяїна. Для вивчення біології таких вірусів сімейства Herpesviridae, розуміння їх латентної інфекції й реактивації є необхідним. Однак серед множини герпесвірусів тільки вірус EB, що належить до сімейства Gammaherpesvirinae, вивчали з одержанням множини результатів щодо латентної інфекції, і багато чого залишається незрозумілим щодо інших вірусів. Зокрема щодо факторів, які можуть бути залученими в латентну інфекцію Betaherpesvirinae, не одержано інформації, яка відрізняється від результатів, раніше одержаних авторами даного винаходу. Наприклад, у Непатентному документі 1 описана латентна інфекція HHV-6 у макрофагах у периферичній крові, де макрофаги були диференційованими до відносно високого ступеня, й ідентифіковані ділянки організму хазяїна, в яких хазяїн був латентно інфікованим HHV-6. У Непатентному документі 2 описана дуже часта інвазія HHV-6 у мозок при первинній інфекції, що викликає персистентну інфекцію й латентну інфекцію. У Непатентному документі 3 описані гени (гени латентної інфекції), які експресуються під час латентної інфекції HHV-6, і висунуто припущення, що ці гени відіграють роль в регуляції латентної інфекції й реактивації вірусу. У Непатентному документі 4 показано, що в стан латентної інфекції HHV-6 залучена проміжна стадія, яка є порівняно стабільною й дозволяє активну експресію генів, що приводить до того, що ген латентної інфекції й білок (білок гена латентної інфекції), кодований цим геном, експресуються надлишково. Більш того, у Непатентному документі 5 показано, що в пацієнтів із синдромом хронічної втоми в сироватці присутні антитіла проти білків генів латентної інфекції, які екпресовані на підвищеному рівні на проміжній стадії. Непатентний документ 1 Kondo. K et al. Latent human herpesvirus 6 infection of human monocytes/macrophages (J Gen Virol 72: 1401-1408, 1991) Непатентний документ 2 Kondo. K et al. Association of human herpesvirus 6 infection of the central nervous system with recurrence of febrile convulsions. (J Infect Dis 167: 1197-1200, 1993.) Непатентний документ 3 Kondo. K et al. Identification of human herpesvirus 6 latency-associated transcripts. (J Virol. 76: 4145-4151, 2002) Непатентний документ 4 Kondo K et al. Recognition of a novel Stage of Beta-Herpesvirus Latency in Human Herpesvirus 6. (J Virol. 77: 2258-2264, 2003) Непатентний документ 5 Kazuhiro Kondo, «Herpesvirus Kansen to Hiro (Herpesvirus latency and fatigue)», Virus, 2005, 1 UA 101814 C2 5 10 15 20 25 30 35 40 45 50 55 60 Vol. 55, No. 1, pages 9 to 18. Короткий виклад суті винаходу Однак не ідентифіковано будь-якого гена латентної інфекції або білка гена латентної інфекції, специфічно залученого в захворювання. Крім того, його функції й зв’язок з патогенетичним механізмом синдрому хронічної втоми залишаються невідомими. Крім того, існує можливість, що HHV-6 є залученим в інші захворювання на додаток до синдрому хронічної втоми. Таким чином, залишається сильна необхідність у проясненні зв’язку між інфекцією HHV-6 і захворюваннями, а також у розвитку способів, що сприяють розробці (i) об’єктивного діагностичного способу для захворювань і (ii) моделі на тваринах. Даний винахід зроблений, беручи до уваги вищезгадані проблеми, і метою даного винаходу є ідентифікація фактора, залученого в латентну інфекцію HHV-6, і забезпечення його застосування. Щоб подолати вищезгадані проблеми, автори даного винаходу провели ретельне дослідження. В результаті, у авторів даного винаходу виникла наступна унікальна ідея: у світлі характерної природи HHV-6, тобто латентної інфекції й реактивації, ідентифікація фактора, залученого в латентну інфекцію й реактивацію, приведе до відкриттів відносно зв’язку між інфекцією HHV-6 і ментальними порушеннями. На підставі цієї ідеї автори даного винаходу велику кількість разів проводили складні експерименти на сучасному рівні. В результаті автори даного винаходу ідентифікували: новий ген, що експресується на проміжній стадії, на якій ген, специфічний для латентної інфекції HHV-6, експресується активно; і новий білок (малий білок, кодований проміжним транскриптом HHV-6-1; SITH-1), кодований новим геном. Крім того, автори даного винаходу провели функціональний аналіз нового гена й білка SITH-1, кодованого новим геном, так що зроблені нові виявлення: (i) білок SITH-1 має здатність збільшувати внутрішньоклітинну концентрацію кальцію; і (ii) антитіло проти білка SITH-1 у значній кількості детектирують у пацієнтів з афективними розладами, але його майже неможливо детектирувати у здорових індивідуумів. Таким чином, даний винахід завершений. Даний винахід завершений на підставі вищезгаданих нових виявлень і містить у собі наступні винаходи: (1) Ген, який кодує: (a) білок, що має амінокислотну послідовність, показану на SEQ ID NO:1; або (b) білок, що має амінокислотну послідовність із заміною, делецією, вставленням і/або доданням однієї або декількох амінокислот в амінокислотній послідовності, показаній на SEQ ID NO:1, де білок має активність збільшення внутрішньоклітинної концентрації кальцію. (2) Ген, що містить зону відкритої рамки зчитування, який має нуклеотидну послідовність, показану на SEQ ID NO:2. (3) Ген, що кодує білок, який гібридизується у суворих умовах гібридизації із ДНК, яка має нуклеотидну послідовність, комплементарною ДНК, яка має нуклеотидну послідовність, показану на SEQ ID NO:2 або 3, де білок має активність збільшення внутрішньоклітинної концентрації кальцію. (4) Білок, кодований геном, як зазначено в будь-якому з (1)-(3). (5) Білок, що представляє собою: (a) білок, який має амінокислотну послідовність, показану на SEQ ID NO:1; або (b) білок, що має амінокислотну послідовність із заміною, делецією, вставленням і/або доданням однієї або декількох амінокислот в амінокислотну послідовність, показану на SEQ ID NO:1, де білок має активність збільшення внутрішньоклітинної концентрації кальцію. (6) Антитіло, що розпізнає білок, як зазначено в (4) або (5). (7) Рекомбінантний експресуючий вектор, що містить ген, як зазначено в будь-якому з (1)-(3). (8) Трансформант, одержаний перенесенням гена, як зазначено в будь-якому з (1)-(3), або рекомбінантного експресуючого вектора, як зазначено в (7). (9) Засіб для детекції гена, що містить зонд, який має щонайменше частину нуклеотидної послідовності гена, як зазначено в будь-якому з (1)-(3), або комплементарну їй послідовність. (10) Засіб для детекції, який містить зонд, що представляє собою поліпептид, який має щонайменше частину амінокислотної послідовності білка, як зазначено в (4) або (5). (11) Спосіб визначення, що включає в себе стадію: визначення, існує чи ні у суб’єкта антитіло, як зазначено в (6). (12) Спосіб визначення, як зазначено в (11), де: визначення здійснюють через імунологічну детекцію за допомогою застосування білка, як зазначено в (4) або (5), або часткового фрагмента білка. (13) Спосіб визначення, як зазначено в (11) або (12), де: визначення здійснюють з використанням біологічного зразка, виділеного із суб’єкта. 2 UA 101814 C2 5 10 15 20 25 30 35 40 45 50 55 60 (14) Набір для визначення, використовуваний для здійснення способу визначення, як зазначено в будь-якому з (11)-(13). (15) Набір для визначення, як зазначено в (14), що містить щонайменше одне, вибране з: (i) білка, як зазначено в (4) або (5); (ii) часткового фрагмента білка (i); і (iii) засобу, на якому іммобілізований білок (i) або частковий фрагмент (ii). (16) Діагностичний спосіб для діагностики, має або ні суб’єкт-людина ментальне порушення, що включає в себе стадії: (i) визначення, існує чи ні у суб’єкта-людини антитіло, як зазначено в (6), згідно зі способом визначення, як зазначено в будь-якому з (11)-(13); і (ii) визначення, що суб’єкт-людина уражена синдромом хронічної втоми, у випадку, де на стадії (i) визначають, що антитіло, як зазначено в (6), існує у суб’єкта-людини. (17) Діагностичний спосіб, як зазначено в (16), де: на стадії (i) визначення здійснюють з використанням біологічного зразка, виділеного із суб’єкта-людини. (18) Діагностичний спосіб для діагностики, має або ні суб’єкт-тварина ментальне порушення, що включає в себе стадії: (i) визначення, існує чи ні у суб’єкта-тварини антитіло, як зазначено в (6), згідно зі способом визначення, як зазначено в будь-якому з (11)-(13); і (ii) визначення, що суб’єкт-тварина має ментальне порушення, у випадку, де на стадії (i) визначають, що антитіло, як зазначено в (6), існує у суб’єкта-тварини. (19) Набір для діагностики, використовуваний для здійснення діагностичного способу, як зазначено в будь-якому з (16)-(18). (20) Набір для діагностики, як зазначено в (19), що містить щонайменше одне, вибране з: (i) білка, як зазначено в (4) або (5); (ii) часткового фрагмента білка (i); і (iii) засобу для детекції, на якому іммобілізований білок (i) або частковий фрагмент (ii). (21) Спосіб вибору тваринної моделі для визначення, є або ні суб’єкт-тварина застосовним як тваринна модель ментального порушення, що включає в себе стадії: (i) діагностики, має чи ні суб’єкт-тварина ментальне порушення, згідно зі способом діагностики, як зазначено в (18); і (ii) визначення, що суб’єкт-тварина є застосовним як модель ментального порушення, у випадку, коли на стадії (i) діагностують, що суб’єкт-тварина має ментальне порушення. (22) Модельна тварина, одержана перенесенням гена, як зазначено в будь-якому з (1)-(3), продукту цього гена або рекомбінантного експресуючого вектора, як зазначено в (7). (23) Спосіб скринінгу для проведення скринінгу речовини-кандидата на психотропний засіб, що включає в себе стадії: (i) введення розглянутої речовини в моделі ментального порушення на тварин; (ii) визначення, є або ні ментальне порушення у тваринній моделі вилікуваним або покращеним, згідно зі способом діагностики, як зазначено в (18); і (iii) визначення, що розглянута речовина є речовиною-кандидатом на психотропний засіб, у випадку, якщо визначають, що ментальне порушення у тваринній моделі є вилікуваним або покращеним. Є більш переважним, щоб спосіб скринінгу (23) проводили як (i) діагностичним способом (18), так і (ii) діагностичним способом з використанням, наприклад, (відомого раніше) порушення поведінки й/або реакції здригання у тварини. Ген або білок за даним винаходом специфічно експресується під час латентної інфекції герпесвірусом і має здатність регулювати латентну інфекцію й реактивацію герпесвірусу. Крім того, як описано пізніше, показано, що антитіло проти білка за даним винаходом в значній кількості виявляють у пацієнтів з ментальними порушеннями. Таким чином, визначення присутності або відсутності антитіла дозволяє об’єктивну діагностику ментальних порушень. Більш того, ген або білок за даним винаходом можна застосовувати для діагностики різних захворювань, так само як для діагностики захворювань, описаних у даному документі. Більш того, ген або білок за даним винаходом доступні також для застосування, наприклад, у способах скринінгу лікарських засобів, способах одержання моделей на тварин, і різних видах наборів. Для більш повного розуміння сутності й переваг винаходу слід зробити посилання на наступний докладний опис, у взаємозв’язку із супутніми кресленнями. Короткий опис креслень Фіг. 1 Фіг. 1 являє собою схему, що показує схематичну структуру специфічного для латентної інфекції гена й положення аналітичних праймерів. Фіг. 2 Фіг. 2 являє собою креслення, що показує результати ампліфікації, проведеної способом ПЛР стосовно продуктів гена HHV-6. Фіг. 3 Фіг. 3 являє собою креслення, що показує результати аналізу, проведеного способом RACE 3 UA 101814 C2 5 10 15 20 25 30 35 40 45 50 55 60 по відношенню до мРНК нового специфічного для латентної інфекції гена. Фіг. 4 Фіг. 4 являє собою схему, що показує результати експерименту, в якому білок хазяїна, що зв’язується з білком SITH-1, ідентифікували аналізом у дріжджовій двогібридній системі. Фіг. 5 Фіг. 5 являє собою креслення, яке показує, що білок SITH-1 збільшує кількість CAML в лінії астроцитоподібних гліальних клітин. Фіг. 6 Фіг. 6 являє собою графік, що показує, як SITH-1 збільшує концентрацію кальцію в гліальних клітинах. Фіг. 7 Фіг. 7 являє собою графік, що показує титри антитіл проти SITH-1 у пацієнтів з ментальними порушеннями. Фіг. 8 Фіг. 8 являє собою графік, що показує результат дослідження ефекту SITH-1 у тесті підвішування за хвіст. Фіг. 9 Фіг. 9 являє собою графік, що показує результат дослідження ефекту SITH-1 у тесті примусового плавання. Фіг. 10 Фіг. 10 являє собою графік, що показує результат дослідження ефекту SITH-1 відносно реакції здригання (преімпульсне інгібування). Фіг. 11 Фіг. 11 являє собою графік, що показує результат експерименту, в якому SITH-1 експресували в гліальних клітинах миші з використанням аденовірусного вектора й через три тижні у тварин вимірювали моторну активність за активністю на білячому колесі. Фіг. 12 Фіг. 12 являє собою графік, що показує результат експерименту, в якому SITH-1 експресували в гліальних клітинах миші з використанням лентивірусного вектора й через вісім тижнів у тварин вимірювали моторну активність за активністю на білячому колесі. Фіг. 13 Фіг. 13 являє собою графік, що показує результати діагностики різних захворювань, ускладнених депресією, з використанням SITH-1 як маркера. Опис варіантів здійснення Нижче описаний один варіант здійснення даного винаходу. Однак даний винахід не є обмеженим цим. Спочатку, щоб допомогти розумінню даного винаходу, коротко описано, як автори даного винаходу виконали даний винахід. Автори даного винаходу висунули припущення, що інфекція HHV-6 серед різних видів герпесвірусів людини, найбільш імовірно, є причиною ментальних порушень, зокрема, що супроводжуються афективними порушеннями. Причини містять у собі: (i) серед симптомів синдрому хронічної втоми (CFS), для яких дотепер HHV-6 визнавали однією із причин, розпізнавали симптоми депресії й інші, що часто виявляються при ментальних порушеннях; (ii) HHV-6 викликає латентну інфекцію в мозку; і (iii) антитіло, що пізнає ідентифікований до теперішнього часу білок гена, специфічного для латентної інфекції HHV-6, так само як антитіло, що пізнає невідомий білок, який експресується в клітинах, латентно інфікованих HHV-6, але для якого ще не ідентифікували гена або який ще не ідентифікували сам по собі, детектирували з високою частотою в сироватці пацієнтів з CFS. Крім того, у світлі того факту, що первинні ділянки в мозку при латентній інфекції HHV-6 включають в себе лобову частку й зону гіпокампу, кожна з яких керує думками й емоціями, так само як того факту, що вірусів, які викликають латентну інфекцію в мозку, зовсім небагато, включаючи HHV-6, автори даного винаходу висунули припущення про зв’язок між HHV-6 і ментальними порушеннями. Більш того, відомо, що HHV-6 викликає латентну інфекцію в гліальних клітинах (наприклад, астроцитах), що відіграє важливу роль у метаболізмі всередині мозку речовин (наприклад, серотоніну), пов’язаних з депресією. Також відносно цього автори даного винаходу прийшли до унікальної ідеї, що HHV-6 може бути пов’язаним з ментальними порушеннями, такими як афективні порушення. Таким чином, автори даного винаходу висунули припущення, що пацієнти з CFS можуть включати в себе чимало випадків із присутністю симптомів через латентну інфекцію мозку HHV6. Зокрема автори даного винаходу висунули припущення про зв’язок між HHV-6 і афективними порушеннями, такими як депресія й маніакально-депресивне захворювання. 4 UA 101814 C2 5 10 15 20 25 30 35 40 45 50 55 60 Афективні порушення являють собою симптоми, виявлені при ментальних порушеннях, такі як депресія й маніакально-депресивне захворювання, і два найбільш типові приклади являють собою депресію, при якій присутні тільки симптоми депресії, і маніакально-депресивне захворювання, при якому епізоди манії чергуються з епізодами депресії. У той час як припускали різні можливі причини, включаючи стрес, генетичні аберації й інфекції, ще не встановлено окремих факторів. У цей час частота виникнення афективних порушень збільшена, і це стає великою соціальною проблемою. Таким чином, є бажаним розпізнавати етіологію й патологію кожного афективного порушення й розвивати способи їх діагностики й лікування настільки швидко, наскільки можливо. Особливого згадування в даному документі заслуговує та проблема, що доступна тільки якісна діагностика афективних порушень, і вона пов’язана із труднощами в досягненні об’єктивності. Крім того, ще не розвинено адекватних моделей на тварин, що вносять внесок у вивчення афективних порушень і розвиток способів їх лікування. Це утруднює класифікацію етіології й розвиток способів лікування. Із цієї причини автори даного винаходу вважали, що є необхідним проясняти зв’язок між (i) інфекцією HHV-6 і (ii) афективними порушеннями й ментальними порушеннями, і розвивати спосіб, що вносить внесок у постановку об’єктивного діагнозу, і моделі на тваринах для афективних порушень і ментальних порушень. Немає необхідності згадувати, що ці припущення є унікальними, до яких автори даного винаходу прийшли в результаті ретельного дослідження, виконаного в даній галузі дослідження протягом тривалого часу, і до них не може легко прийти середній фахівець у даній галузі. Далі докладно описані білок, ген та інше за даним винаходом один за одним. (1) Білок і ген за даним винаходом (1-1) Структура Даний винахід стосується фактора, залученого в латентну інфекцію герпесвірусом. Більш докладно, даний винахід стосується (i) білка, що специфічно експресується під час латентної інфекції герпесвірусом, і (ii) гена, що кодує білок. Фраза, що говорить «що специфічно експресується під час латентної інфекції герпесвірусом», означає, що ген, одержаний з герпесвірусу, або продукт цього гена специфічно експресується в інфікованому вірусом хазяїні у той час, як хазяїн є латентно інфікованим (але не продуктивно інфікованим) герпесвірусом. Білок і ген можуть являти собою, наприклад, (a) білок, що має амінокислотну послідовність, показану на SEQ ID NO:1, і ген, що кодує білок. Як описано пізніше в прикладі, білок, що має амінокислотну послідовність, показану на SEQ ID NO:1, виділили й ідентифікували як білок, що специфічно експресується під час латентної інфекції герпесвірусом-6 людини (HHV-6). Цей білок надалі в цьому документі позначають «малий білок, кодований проміжним транскриптом HHV-6-1 (білок SITH-1)». Білок SITH-1 являє собою білок, що має молекулярну масу приблизно 17,5 кДа, амінокислотну послідовність, показану на SEQ ID NO:1, і 159 амінокислоти. Білок SITH-1 кодує ген SITH-1. Як показано на SEQ ID NO:3, кДНК гена SITH-1 має розмір 1795 пар основ (приблизно 1,79 т.п.о.). Крім того, послідовність нуклеотидів від 9544-го до 9566го являє собою стартовий кодон (Kozak ATG), у той час як послідовність нуклеотидів від 14313го до 14333-го являє собою стоп-кодон (TAA). Таким чином, ген SITH-1 має відкриту рамку зчитування (ORF), що має послідовність нуклеотидів від 9544-го до 14303-го з нуклеотидної послідовності, показаної на SEQ ID NO:3, з ORF, що має розмір 477 пар основ (приблизно 0,48 т.п.о.). Нуклеотидна послідовність, що представляє зону ORF із кДНК SITH-1, показана на SEQ ID NO:2. Слід зазначити, що нуклеотидна послідовність, показана на SEQ ID NO:2, містить три основи стоп-кодону. Білок за даним винаходом може являти собою, наприклад, (b) білок, що має амінокислотну послідовність із заміною, делецією, вставленням і/або доданням однієї або декількох амінокислот в амінокислотній послідовності, показану на SEQ ID NO:1, де білок специфічно експресується під час латентної інфекції герпесвірусом. Ген за даним винаходом може являти собою, наприклад, ген, що кодує цей білок. Фраза «із заміною, делецією, вставленням і/або доданням однієї або декількох амінокислот» означає заміну, делецію, вставлення й/або додання ряду амінокислот (наприклад, переважно, 10 або менше, більш переважно, 7 або менше, більш переважно, 5 або менше), які можна здійснювати відомим способом одержання мутантних пептидів, таким як сайт-спрямований мутагенез. Таким чином, білок (b) можна описати, як такий, що є мутантним білком з білка (a). Слід зазначити, що «мутант» у даному документі в першу чергу стосується мутанта, одержаного штучним введенням мутацій за допомогою відомого способу одержання мутантного білка, або може являти собою мутант, одержаний виділенням і очищенням існуючого в природі, подібного мутантного білка. 5 UA 101814 C2 5 10 15 20 25 30 35 40 45 50 55 60 Альтернативно, ген за даним винаходом може являти собою, наприклад, ген, що кодує (c) білок, який гібридизується в суворих умовах гібридизації із ДНК, що має нуклеотидну послідовність, комплементарною ДНК, що має нуклеотидну послідовність, показану на SEQ ID NO:2, де білок специфічно експресується під час латентної інфекції герпесвірусом. Фраза «гібридизується в суворих умовах гібридизації» означає, що гібридизація відбувається тільки у випадку, коли нуклеотидні послідовності, що представляють інтерес мають щонайменше 90% ідентичності, переважно, щонайменше 95% ідентичності, найбільш переважно, щонайменше 97% ідентичності. Як конкретний приклад «суворих умов гібридизації» можливі наступні умови: Фільтр для гібридизації інкубують протягом ночі при 42°C у розчині для гібридизації (включаючи 50% формамід, 5SSC (150 мМ NaСl, 15 мМ цитрат тринатрію), 50 мМ фосфат натрію (pН 7,6), 5Розчин Денхардта, 10% декстрансульфат і 20 мкг/мл денатурованої, фрагментованої ДНК сперми лосося) з наступним промиванням в 0,1SSC при приблизно 65°C. Крім того, гібридизацію можна проводити загальновідомим способом, наприклад, згідно зі способом, описаним в «J. Sambrook et al. Molecular Cloning, A Laboratory Manual, 2d Ed., Cold Spring Harbor Laboratory (1989)», і без обмеження будь-яким одним конкретним способом. Загалом, при підвищенні температури й зниженні концентрації солі рівень суворості збільшується (тобто більше труднощів для гібридизації). Слід зазначити, що термін «ген» у даному документі використовують взаємозамінно з «полінуклеотид», «нуклеїнова кислота» або «молекула нуклеїнової кислоти». «Полінуклеотид» належить до полімеру з нуклеотидів. Таким чином, термін «ген» у даному документі містить у собі не тільки дволанцюгові ДНК, але також одноланцюгові ДНК (наприклад, смисловий ланцюг і антисмисловий ланцюг, які складають дволанцюгову ДНК) і РНК (наприклад, мРНК). Антисмисловий ланцюг можна використовувати як зонд або антисмисловий лікарський засіб. Термін «ДНК» містить у собі, наприклад, (i) кДНК, одержану клонуванням, способом хімічного синтезу або їх комбінацією, і (ii) геномну ДНК. Тобто, «ДНК» може являти собою «геномну» ДНК що містить некодовану послідовність (наприклад, інтрон), де геномна ДНК являє собою форму, що міститься в геномах тварин. Альтернативно «ДНК» може являти собою кДНК, одержану з мРНК з використанням зворотної транскриптази або полімерази, тобто «транскрипційну» ДНК, що не містить некодуючу послідовність (наприклад, нітрону). Крім того, ген за даним винаходом може являти собою ген, який має не тільки послідовність, що кодує амінокислоти, описані стосовно вищезгаданих (a) або (b), але також послідовність нетрансльованої зони (UTR) і/або послідовність вектора (включаючи послідовність експресуючого вектора). Крім того, мРНК або кДНК може містити, на кінці й/або всередині її трансльованої зони, бажаний полінуклеотид, такий як регуляторна послідовність або послідовність поліаденілової кислоти. Більш того, у випадку, коли білок за даним винаходом може кодувати множину алелів, термін «нуклеїнова кислота» включає всі алелі, їх транскрипти й кДНК. Слід зазначити, що термін «нуклеїнова кислота» у даному документі включає в себе полінуклеотид, включаючи бажані звичайні нуклеотиди й/або модифіковані нуклеотиди, приклади яких включають в себе кДНК, мРНК, тотальну РНК і гяРНК. Термін «модифіковані нуклеотиди» включає в себе: складні фосфатні ефіри, наприклад, інозину, ацетилцитидину, метилцитидину, метиладенозину й метилгуанозину; і нуклеотиди, які можна одержати дією ультрафіолетових променів або хімічних речовин. Термін «нуклеотидна послідовність» використовують взаємозамінно з «послідовність нуклеїнової кислоти» і представляють як послідовність дезоксирибонуклеотидів (кожний скорочено позначений як A, G, C або T). Крім того, полінуклеотид або «нуклеотидна послідовність» полінуклеотиду призначена для позначення (i) послідовності дезоксирибонуклеотидів для молекули або полінуклеотиду ДНК і (ii) послідовності рибонуклеотидів (A, G, C і U) (кожний тимидин (T), який є дезоксинуклеотидом, у дезоксинуклеотидній послідовності, зазначеній в даному документі, замінений на уридин (U), який є рибонуклеотидом) для молекули або полінуклеотиду РНК. Наприклад, молекула РНК, що має послідовність, показану на SEQ ID NO:2 або 4, яка представлена скороченими найменуваннями дезоксирибонуклеотидів, призначена для позначення молекули РНК, що має послідовність, в якій дезоксинуклеотиди A, G і С, показані на SEQ ID NO:2 або 4, замінені відповідними їм рибонуклеотидами A, G і С, а дезоксинуклеотид T, показаний на SEQ ID NO:2 або 4, замінений рибонуклеотидом U. Крім того, полінуклеотид, що має нуклеотидну послідовність, показану на SEQ ID NO:2 або 4, або фрагмент полінуклеотиду призначений для позначення полінуклеотиду, що має послідовність, представлену дезоксинуклеотидами A, G, С і/або T, показаними в SEQ ID NO:2 або 4, або фрагмента полінуклеотиду. Фрагмент (часткову послідовність) гена за даним винаходом можна використовувати як праймер для полімеразної ланцюгової реакції (ПЛР) або як зонд для гібридизації. Фрагмент 6 UA 101814 C2 5 10 15 20 25 30 35 40 45 50 55 60 (полінуклеотид) є прийнятним для специфічної ПЛР ампліфікації гомолога або ортолога гена за даним винаходом, а також є прийнятним як зонд для гібридизації, який специфічно гібридизується з гомологом або ортологом гена за даним винаходом. Тобто, у переважному варіанті здійснення фрагмент гена за даним винаходом є застосовним для діагностики (i) як праймер для ампліфікації послідовності-мішені, що проводиться за допомогою полімеразної ланцюгової реакції (ПЛР), або (ii) як зонд згідно із загальноприйнятим способом гібридизації ДНК. Крім того, інші приклади застосування фрагмента гена за даним винаходом включають в себе: гібридизацію in situ (наприклад, FISH) по відношенню до препаратів мітотичних хромосом, за допомогою цієї гібридизації in situ показують точну ділянку на хромосомі (описано в Verma et al., Human Chromosomes: a Manual of Basic Techniques, Pergamon Press, New York (1988)); й аналіз нозерн-блотингом для детекції мРНК за даним винаходом, що експресується у конкретній тканині. Ген за даним винаходом включає в себе як необмежувальні приклади: власно полінуклеотид, який кодує амінокислотну послідовність зрілого білка; кодуючу послідовність зрілого білка й додаткову до неї послідовність (наприклад, послідовність, що кодує лідерну послідовність) (наприклад, послідовність пребілка, послідовність пробілка або послідовність препробілка); інтрон, некодуючу 5′-послідовність і некодуючу 3′-послідовність (наприклад, транскрипція нетрансльованої зони, діючої в транскрипції і процесингу мРНК (включаючи сигнал сплайсингу й поліаденілювання)); і додаткову кодуючу послідовність, що кодує інші амінокислоти, які забезпечують додаткову функціональність. Таким чином, для прикладу, послідовність, що кодує білок, можна зливати з маркерною послідовністю (наприклад, послідовністю, що кодує пептид, який полегшує очищення злитого білка). У переважному варіанті здійснення даного винаходу маркерна амінокислотна послідовність може являти собою гекса-гістидиновий пептид, такий як мітка, представлена у векторі pQE (Qiagen, Inc.). Як описано в «Gentz et al., Proc. Natl. Acad. Sci. USA 86: 821-824 (1989)», гекса-гістидиновий пептид є застосовним для очищення злитого білка простим способом. Альтернативно, можна використовувати публічно й/або комерційно доступну маркерну амінокислотну послідовність множини видів. Наприклад, як описано в «Wilson et al., Cell 37: 767 (1984)», мітка «HA» являє собою інший пептид, застосовний для очищення, де HA відповідає епітопу, одержаному з білка гемагглютиніну грипу (HA). Крім того, альтернативно, злитий білок, одержаний поєднанням Fc з N-кінцем або C-кінцем білка за даним винаходом, може бути застосовним для очищення. Крім того, даний винахід стосується мутанта гена за даним винаходом. Мутант може існувати в природі, як існує природний алельний мутант. «Алельний мутант» призначений для позначення однієї з деяких чергованих форм гена, що займають визначений генний локус на хромосомі організму. Крім того мутант, що не зустрічається в природі, можна одержати з використанням, наприклад, способу мутагенезу, відомого в даній галузі. Приклади такого мутанта включають в себе мутант, одержаний заміною, делецією або доданням одного або декількох нуклеотидів, як описано вище. Може відбуватися заміна, делеція або додання одного або декількох нуклеотидів. Мутант може місти мутацію, що виникла у кодуючій зоні, некодуючій зоні або і в тій, і в іншій. Мутація в кодуючій зоні може викликати консервативну або неконсервативну заміну, делецію або додання амінокислоти. На додаток до зрілого білка, приклади переважного білка за даним винаходом включають в себе: позаклітинний домен, трансмембранний домен, внутрішньоклітинний домен і білок, в якому відсутній весь або частина трансмембранного домену, але присутні позаклітинний і внутрішньоклітинний домени. Термін «білок» у даному документі використовують взаємозамінно з «поліпептид» або «пептид». Крім того, даний винахід стосується поліпептиду із заміною, доданням і/або делецією однієї або декількох амінокислот з білка, кодованого нуклеотидною послідовністю, показаною на SEQ ID NO:2. Консервативна або неконсервативна заміна, делеція й/або додання амінокислоти(амінокислот), що є переважною, і їх мовчазна заміна, додання й/або делеція, що є особливо переважною. Це не змінює характеристик і активності білка за даним винаходом або частини білка. Відносно цього питання особливо переважною є консервативна заміна. Крім того, білок за даним винаходом може являти собою не тільки білок, виділений із природних джерел, але також хімічно синтезований або одержаний рекомбінацією білок. Тобто, білок за даним винаходом можна виділити й очистити, наприклад, із клітин або тканин. Альтернативно, білок за даним винаходом можна експресувати всередині клітин за допомогою кодування його геном, перенесеним у клітину-хазяїна. Крім того, білок за даним винаходом може містити додатковий поліпептид. 7 UA 101814 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід стосується поліпептиду, що має амінокислотну послідовність яка несе епітоп частини білка, описаного в даному документі. Для поліпептиду, що має амінокислотну послідовність, яка несе епітоп частини білка за даним винаходом, необхідно тільки містити частину поліпептиду, де частина містить у собі щонайменше 6, 7, 8, 9 або 10 амінокислот. Крім того, такий поліпептид може також являти собою несучу епітоп частину поліпептиду, що має довжину (необов’язково, установлену), яка дорівнює або коротша, ніж довжина повної амінокислотної послідовності (i) білка, кодованого нуклеотидною послідовністю, показаною на SEQ ID NO:2 або 4 або (ii) білка, що має амінокислотну послідовність, показану на SEQ ID NO:1. Іншими словами, даний винахід стосується несучого епітоп пептиду з білка за даним винаходом. Як описано в описаному пізніше прикладі, білок за даним винаходом є імуногенним. Таким чином, є можливим ідентифікувати в білку за даним винаходом частину-епітоп, індукуючу відповідь антитіла, згідно зі способом, відомим у даній галузі. Наприклад, в Geysen, H. M. et al., Proc. Natl. Acad. Sci. USA 81: 3998-4002 (1984) описаний спосіб швидкого одночасного синтезу на твердих основах сотень пептидів, що мають достатню чистоту для реакції у твердофазному імуноферментному аналізі. Взаємодію синтезованих пептидів з антитілами потім легко детектирують без видалення їх з основ. За цим способом пептид, що несе імуногенний епітоп бажаного білка, фахівець у даній галузі може ідентифікувати загальноприйнятим чином. Наприклад, імунологічно важливий епітоп білка оболонки вірусу ящуру локалізований Geysen et al. з дозволом у сім амінокислот за допомогою синтезу, перекриваного набору всіх 208 можливих гексапептидів, що покривають повну 213 амінокислотну послідовність білка. Потім синтезували повний набір пептидів із замінами, в яких усі 20 амінокислот міняли по черзі в кожному положенні всередині епітопу й визначали конкретні амінокислоти, що придають специфічність для реакції з антитілом. Таким чином, пептидний аналог несучого епітоп пептиду за даним винаходом можна одержати загальноприйнятим чином за цим способом. У патенті США № 4708781, Geysen (1987), більш докладно описує цей спосіб, за допомогою якого ідентифікують пептид, що несе імуногенний епітоп бажаного білка. «Імуногенний епітоп» визначають як частину білка, індукуючу відповідь антитіла, у випадку, коли цілий білок є імуногеном. Вважають, що імуногенні епітопи обмежені двома або більше зонами молекули. З іншого боку, ділянку білкової молекули, з якою може зв’язуватися антитіло, визначають як «антигенний епітоп». Як правило, у білку кількість імуногенних епітопів менша, ніж кількість антигенних епітопів. Наприклад, див. Geysen, H. M. et al., Proc. Natl. Acad. Sci. USA 81: 3998-4002 (1984). Пептид, що несе антигенний епітоп за даним винаходом, є застосовним для індукції антитіл, включаючи моноклональне антитіло, що специфічно зв’язує білок за даним винаходом. Таким чином, більшість гібридів, одержаних поєднанням клітин селезінки, узятих від донора, імунізованого пептидом, що несе антигенний епітоп, секретують антитіла, як правило, пізнавальні природні білки. Антитіла, індуковані пептидом, що несе антигенний епітоп, є застосовними для детекції мімікруючих білків, і антитіла проти різних пептидів можна використовувати для простежування долі різних зон попередника білка, які зазнають посттрансляційний процесинг. Пептид і антитіло проти пептиду можна використовувати в множині кількісних або якісних аналізів для мімікруючих білків (наприклад, у конкурентних аналізах), оскільки показано, що в аналізах імунопреципітації навіть короткі пептиди (наприклад, приблизно 9 амінокислот) можуть зв’язуватися й заміщати більш довгі пептиди. Наприклад, див. Wilson, I. A. et al., Cell 37: 767-778 (1984) 777. Антитіло проти білка за даним винаходом є також застосовним для очищення мімікруючих білків (наприклад, адсорбційною хроматографією з використанням способу, відомого в даній галузі). Пептид, що несе антигенний епітоп за даним винаходом, сконструйований згідно з вищевказаним посібником, переважно, містить у собі послідовність із щонайменше семи, більш переважно, із щонайменше дев’яти, найбільш переважно, від приблизно 15 до приблизно 30 амінокислот, включених в амінокислотну послідовність білка за даним винаходом. Однак пептид або поліпептид, що містить більшу частину амінокислотної послідовності білка за даним винаходом, що містить від приблизно 30 до приблизно 50 амінокислот, або будь-яку довжину аж до повної амінокислотної послідовності білка за даним винаходом й включаючи її, також передбачений як пептид, що несе епітоп за даним винаходом й також є застосовним для індукції антитіл, що пізнають мімікруючий білок. Переважно, амінокислотну послідовність пептиду, що несе епітоп вибирають так, що вона може забезпечувати значну розчинність у водному розчиннику (тобто вибрана послідовність містить відносно гідрофільні залишки, і високо гідрофобної послідовності переважно уникають); і послідовність, що містить залишок проліну, є особливо переважною. Пептид, що несе епітоп за даним винаходом можна одержувати бажаними, 8 UA 101814 C2 5 10 15 20 25 30 35 40 45 50 55 60 загальноприйнятими способами одержання рекомбінантного білка з використанням гена за даним винаходом. Наприклад, коротку амінокислотну послідовність, що несе епітоп можна зливати з більшим поліпептидом, який діє як носій під час продукції й очищення рекомбінанту, й імунізації для одержання антитіла проти білка. Пептид, що несе епітоп можна також синтезувати з використанням відомого способу хімічного синтезу. Крім того, даний винахід може стосуватися білка, що підлягає експресії, де в білок включений прийнятний секреторний сигнал, для секреції трансльованого білка у внутрішню частину отвору ендоплазматичного ретикулума, у внутрішню частину периплазматичного просвіту або в позаклітинне середовище. Секреторний сигнал може бути ендогенним по відношенню до поліпептиду, або може являти собою гетерогенний сигнал. Таким чином, білок за даним винаходом можна експресувати у модифікованій формі, такій як злитий білок, і він може містити не тільки секреторний сигнал, але також додаткову гетерогенну функціональну зону. Наприклад, додаткову амінокислоту, зокрема зону електрично заряджених амінокислот, можна додавати до N-кінця білка для поліпшення стабільності й довговічності в клітинах-хазяїнах під час очищення або наступних маніпуляцій і зберігання. Крім того, частину пептиду можна додавати до білка для полегшення очищення. Таку зону можна видаляти перед остаточним виділенням білка. Зокрема додання частини пептиду до білка з метою викликати секрецію або екскрецію, поліпшити стабільність і полегшити очищення, добре відомі в даній галузі і являють собою загальноприйняті способи. Переважно, злитий білок містить гетерогенну зону, одержану з імуноглобуліну, де гетерогенна зона є застосовною, щоб зробити білок розчинним. Наприклад, в ЕР A 0 464 533 (еквівалентній канадській патентній заявці 2045869) описані злиті білки, що містять різні частини константних зон молекул імуноглобулінів разом з іншим білком людини або його частиною. У багатьох випадках застосування Fc-зони злитого білка є значно переважним для застосування в терапії й діагностиці, таким чином, приводячи, наприклад, до поліпшених фармакокінетичних властивостей (ЕР A 0232 262). З іншого боку, для деяких застосувань є бажаним делетувати Fcфрагмент після того, як злитий білок експресований, детектований і очищений описаним переважним способом. Це являє собою випадок, де доведено, що Fc-фрагмент є перешкодою для застосування в терапії й діагностиці (наприклад, у випадку, де злитий білок призначений для застосування як антиген для імунізацій). Наприклад, при скринінгу лікарських засобів білки людини, такі як hIL-5, зливали з Fc-фрагментами для застосування в аналізі високопродуктивного скринінгу для ідентифікації антагоніста hIL-5. Див. D. Bennett et al., Journal of Molecular Recognition Vol. 8: 52-58 (1995), і K. Johanson et al., The Journal of Biological Chemistry Vol. 270, No. 16, pages 9459-9471 (1995). (1-2) Функції Далі докладно описані функції білка за даним винаходом, беручи вищеописаний білок SITH1 як приклад. Як показано в описаному пізніше прикладі, ген SITH-1 експресований увесь час у цитоплазмі клітин, латентно інфікованих HHV-6, але не в продуктивно інфікованих клітинах. Ген, який кодує білок SITH-1, кодує ДНК, що формує комплементарний ланцюг для опублікованого раніше специфічного для латентної інфекції HHV-6 гена (H6LT) і експресія гена посилюється на проміжній стадії латентної інфекції HHV-6. За цими фактами вважають, що білок SITH-1 являє собою білок, який специфічно експресується під час латентної інфекції HHV-6. Крім того, виявили, що білок SITH-1 явно відрізняється від ідентифікованих дотепер білків, залучених у латентну інфекцію HHV-6. Крім того, автори даного винаходу провели функціональний аналіз білка SITH-1 і виявили наступний факт: білок SITH-1 зв’язується з CAML (регулюючим рівень кальцію лігандом циклофіліну, Інвентарний №; U18242), який являє собою білок хазяїна, так що збільшує концентрацію кальцію в гліальних клітинах, таких як астроцити. CAML являє собою білок, що у великій кількості зустрічається в мозку й лімфоцитах у живому організмі хазяїна, і відомо, що він збільшує концентрацію кальцію в клітинах. Крім того, вважають, що збільшення внутрішньоклітинної концентрації кальцію через експресію білка SITH-1 індукує активацію загальної передачі сигналів у латентно інфікованій клітині, таким чином, вносячи внесок в ефективну реактивацію HHV-6. Під терміном «гліальні клітини», як застосовують у даному документі, розуміють усі вигляди гліальних клітин, включаючи зрілі форми й форми попередників гліальних клітин у центральній нервовій системі, наприклад, астроцити, олігнодендроцити, мікроглію й епендимні клітини. Інші типи, які можна передбачати, являють собою сателітні клітини, швановскі клітини й термінальні гліоцити в периферичній нервовій системі. Відомо, що HHV-6 викликає латентну інфекцію гліальних клітин (наприклад, астроцитів) у 9 UA 101814 C2 5 10 15 20 25 30 35 40 45 50 55 60 мозку. Вважають, що концентрація кальцію в гліальних клітинах (наприклад, астроцитах) підвищується, якщо HHV-6, перебуваючи на стадії латентної інфекції або на проміжній стадії, яка являє собою стадію латентної інфекції, що характеризується високою активністю, викликає експресію SITH-1. В результаті виявлень, недавно зроблених в галузі психіатрії, вважають, що збільшення внутрішньоклітинної концентрації кальцію в клітинах мозку тісно пов’язані з афективними порушеннями й іншими ментальними порушеннями. Фактично, як показано в прикладі, виявилося, що експресія білка SITH-1 у гліальних клітинах миші (наприклад, астроцитах) індукує симптоми, подібні із симптомами афективних порушень, які являють собою ментальні порушення, і збільшує чутливість. Це переконливо дозволяє припускати можливість того, що HHV-6, який латентно інфікує гліальні клітини (наприклад, астроцити), може запускати ментальне порушення за допомогою білка SITH-1. Більше того, HHV-6 може інфікувати не тільки астроцити, але й інші типи гліальних клітин, такі як мікроглія. Таким чином, ментальні порушення, такі як депресія й маніакально-депресивне захворювання, можуть бути викликані іншими типами гліальних клітин на додаток до астроцитів. Вищезгадані виявлення дозволяють припускати, що білок за даним винаходом має здатність зберігати активність зв’язування CAML, який являє собою білок хазяїна, і збільшення внутрішньоклітинної концентрації кальцію. Виявлено також, що ментальне порушення можна індукувати, викликаючи експресію білка за даним винаходом в гліальних клітинах (наприклад, астроцитах), де, очевидно, відбувається найбільш сильна експресія цього білка. Таким чином, вважають, що білок за даним винаходом має здатність викликати ментальне порушення у хазяїна при експресії під час латентної інфекції герпесвірусом або на ранній стадії його реактивації. (1-3) Способи одержання гена й білка Способи одержання (або продукції) гена й білка за даним винаходом не є обмеженими конкретно. Нижче описані типові приклади способів. Спосіб одержання білка Як описано вище, спосіб одержання білка за даним винаходом (або спосіб продукції білка) не є обмеженим конкретно. Приклади способу включають в себе спосіб простого очищення з біологічних зразків (наприклад, клітин, тканин або окремого організму), що містять білок за даним винаходом. Спосіб очищення також не є обмеженим конкретно, і його можна здійснювати таким чином, що розчин екстракту екстрагують із клітин або тканин відомим способом, і потім розчин екстракту очищують відомим способом (наприклад, способом з використанням колонки). Наприклад, білок за даним винаходом можна очищувати й виділяти проведенням високоефективної рідинної хроматографії (HPLC) для фракції неочищеного білка, виділеної із клітин або тканин. Крім того, інші приклади способу одержання білка за даним винаходом включають в себе спосіб з використанням, наприклад, способу генної рекомбінації. У цьому випадку, наприклад, можна прийняти спосіб: ген за даним винаходом вставляють, наприклад, у вектор, вектор потім переносять у клітину-хазяїна відомим способом, так що він здатний експресуватися в їй, і білок, одержаний трансляцією всередині клітини, очищують. Конкретні способи перенесення гена (трансформації), експресії гена й т.п. описані нижче. Слід зазначити, що для перенесення чужорідного гена в хазяїна, як вище, вектора й хазяїна можна вибирати залежно від їх призначення, оскільки існують різні види хазяїнів і експресуючих векторів, що містять промотор, який функціонує в хазяїні для експресії чужорідного гена. Спосіб очищення продукованого білка відрізняється залежно від використовуваного хазяїна й/або характеристик білка. Однак, наприклад, використання мітки дозволяє виділяти цільовий білок відносно простим способом. Спосіб одержання мутантного білка також не є обмеженим будь-яким конкретним способом. Можна використовувати відомий спосіб одержання мутантного білка, наприклад, сайтспрямований мутагенез (Hashimoto-Gotoh, Gene 152, 271-275 (1995), й інші), спосіб одержання мутантного білка введенням точечної мутації в нуклеотидну послідовність способом ПЛР або способом одержання мутантної лінії вставленням транспозону. З використанням будь-якого із цих способів можна одержувати мутантний білок, здійснюючи в нуклеотидній послідовності кДНК, білок (a), що кодує, мутацію заміни, делеції, вставлення й/або додання одного або декількох нуклеотидів. Крім того, мутантний білок можна одержувати з використанням комерційно доступного набору. Спосіб одержання білка за даним винаходом не обмежений зазначеними вище способами. Альтернативно, можна використовувати, наприклад, хімічний синтез із використанням, наприклад, комерційно доступного синтезатора пептидів. Крім того, альтернативно, наприклад, безклітинний розчин для синтезу білка можна використовувати для синтезу пептиду за даним 10 UA 101814 C2 5 10 15 20 25 30 35 40 45 50 55 60 винаходом по гену за даним винаходом. Спосіб одержання гена Як описано вище, спосіб одержання гена за даним винаходом (або спосіб продукції гена) також не є обмеженим конкретно, і може являти собою, наприклад, спосіб з використанням диференціального скринінгу (віднімальне клонування). Цей спосіб можна здійснювати таким чином, щоб, згідно з відомим способом, проводити кілька повторів прямої гібридизації в пробірці, щоб сконцентрувати кДНК-мішень (ген за даним винаходом). Кожну стадію диференціального скринінгу можна проводити в загальноприйнятих умовах. Відносно клону, одержаного в результаті цього, можна одержувати карту за допомогою рестрикційного ферменту, і можна визначати нуклеотидну послідовність (секвенувати), для більш докладного аналізу клону. Цей аналіз дозволяє легко підтверджувати, одержаний або ні фрагмент ДНК, що містить послідовність гена за даним винаходом. Альтернативно, спосіб одержання гена за даним винаходом може являти собою спосіб виділення й клонування, згідно з відомим способом, фрагменту ДНК, що містить ген за даним винаходом. Наприклад, можна одержувати зонд, специфічно гібридизований із частиною послідовності кДНК, і проводити скринінг геномної бібліотеки ДНК або бібліотеки кДНК. Зонд може мати будь-яку послідовність і/або довжину, поки він специфічно гібридизується щонайменше із частиною послідовності кДНК або комплементарній їй послідовності. Крім того, альтернативно, спосіб одержання гена за даним винаходом може являти собою спосіб з використанням способів ампліфікації, таких як ПЛР. Наприклад, праймери одержують відповідно на основі 5′- і 3′-кінців послідовності кДНК (або комплементарній їй послідовності) гена за даним винаходом, і праймери використовують, наприклад, для проведення ПЛР із геномної ДНК (або кДНК) як матриці, так що ампліфікують зону ДНК між праймерами. Таким способом фрагменти ДНК, включаючи ген за даним винаходом, можна одержувати в масовій кількості. Крім того, альтернативно, полінуклеотид, що має цю послідовність, можна синтезувати відомим хімічним синтезом, на основі інформації про послідовність гена. (2) Антитіло за даним винаходом Антитіло за даним винаходом одержують у формі поліклонального або моноклонального антитіла відомим способом з використанням, як антигену, білка за даним винаходом (наприклад, білка (a) або (b)) або його часткового пептиду. Приклади відомого способу включають в себе способи, описані в документах, таких як: Harlow et al., «Antibodies: A laboratory manual (Cold Spring Harbor Laboratory, New York (1988); і Iwasaki et al., «Tankurohn koutai haiburidoma to ELISA (Monoclonal Antibody Hybridomas and ELISA)», Kodansha (1991)). Одержане таким чином антитіло можна використовувати для детекції й аналізу білка за даним винаходом. Наприклад, епітоп, що несе пептид за даним винаходом, описаний вище в (1-1), використовують для індукції антитіла способом, відомим у даній галузі. Наприклад, див.: Chow, M. et al., Proc. Natl. Acad. Sci. USA 82: 910-914; і Bittle, F. J. et al., J. Gen. Virol. 66: 2347-2354 (1985). Як правило, тварин можна імунізувати вільним пептидом; однак титр антитіла проти білка можна збільшувати бустер-імунізацією за допомогою сполуки пептиду з високомолекулярним носієм (наприклад, гемоціаніном морського блюдечка (KLH) або анатоксином правця). Наприклад, пептид, що містить цистеїн, можна з’єднувати з носієм з використанням лінкера, такого як м-малеімідобензоїл-N-гідроксисукцинімідний ефір (MBS), у той час як інші пептиди можна з’єднувати з носіями за допомогою більш розповсюджених лінкерів, таких як глутаральдегід. Тварин, таких як кролики, щури й миші, імунізують вільним або зв’язаним з носієм пептидом, наприклад за допомогою внутрішньочеревинної й/або внутрішньошкірної ін’єкції приблизно 100 мкг емульсії, що містить пептид або білок-носій і ад’ювант Фрейнда. Може знадобитися кілька ін’єкцій для бустер-імунізації, наприклад, з 2тижневими інтервалами, наприклад, для одержання антитіла проти білка із застосовним титром, який можна детектирувати в аналізі ELISA з використанням вільного пептиду, адсорбованого на твердій поверхні. Титр антитіла проти білка в сироватці від імунізованої тварини можна збільшувати відбиранням антитіла проти білка, наприклад, зв’язуванням з пептидом на твердій основі способом, відомим у даній галузі, і розчиненням відібраного антитіла. Термін «антитіло» у даному документі означає імуноглобуліни (IgA, IgD, IgE, IgG, IgM і їх Fab-фрагменти, F(ab')2-фрагменти й Fc-фрагменти), які містять у собі як необмежувальні приклади поліклональні антитіла, моноклональні антитіла, одноланцюгові антитіла, антиідіотипні антитіла й гуманізовані антитіла. Термін «антитіло, що пізнає білок за даним винаходом» у даному документі призначений, щоб включати в себе повні молекули й фрагменти антитіл (наприклад, Fab і F(ab')2-фрагменти), здатні специфічно зв’язувати описаний вище білок за даним винаходом. Fab- і F(ab')2 11 UA 101814 C2 5 10 15 20 25 30 35 40 45 50 55 60 фрагменти, у кожному з яких відсутній Fc-фрагмент, що входить в інтактне антитіло, зазнають більш швидкого кліренсу із кровотоку, і навряд чи можуть мати тканиноспецифічне зв’язування, як інтактне антитіло (Wahl et al., J. Nucl. Med. 24: 316-325 (1983)). Із цієї причини ці фрагменти є переважними. Крім того, інше антитіло, здатне пізнавати білок за даним винаходом, можна одержувати двоступінчастим способом за допомогою використання антиідіотипного антитіла. У цьому способі використовують перевагу того факту, що антитіло саме по собі є антигеном; таким чином, цим способом можна одержувати антитіло, що зв’язується із другим антитілом. За цим способом антитіло, специфічне для білка за даним винаходом, використовують для імунізації тварин (переважно, мишей). Потім клітини селезінки тварин використовують для одержання клітин гібридоми, які потім піддають скринінгу для ідентифікації клону, продукуючого антитіло, афінність якого для зв’язування з антитілом, специфічним для білка за даним винаходом, можна блокувати білковим антигеном за даним винаходом. Таке антитіло може являти собою антиідіотипне антитіло проти антитіла, специфічного для білка за даним винаходом, і його можна використовувати для імунізації тварин для індукції утворення додаткових антитіл, специфічних для білка за даним винаходом. Зрозуміло, що Fab-фрагмент, F(ab')2-фрагмент й інші фрагменти антитіла за даним винаходом можна використовувати в способах, описаних у даному документі. Ці фрагменти одержують розщепленням протеолізом з використанням ферменту, типові приклади якого включають в себе папаїн (що утворює Fab-фрагмент) або пепсин (що утворює F(ab')2фрагмент). Альтернативно фрагмент, що зв’язує білок, за даним винаходом можна одержувати застосуванням способу рекомбінантної ДНК або за допомогою синтетичної хімії. Для детекції збільшеного рівня білка за даним винаходом з використанням одержання зображення in vivo з метою діагностики в людей, може бути переважним використовувати «гуманізоване» химерне моноклональне антитіло. Таке антитіло можна одержувати з використанням генетичної конструкції, одержаної із клітин гібридоми, що утворює вищезгадане моноклональне антитіло. Способи одержання химерних антитіл відомі в даній галузі знань. Їх загальні описи див. в: Morrison, Science 229: 1202 (1985); Oi et al., Biotechniques 4: 214 (1986); Cabilly et al. Патент США № 4816567; Taniguchi et al., EP 171496; Morrison et al., EP 173494; Neuberger et al., WO 8601533; Robinson et al., WO 8702671; Boulianne et al., Nature 312: 643 (1984); і Neuberger et al., Nature 314: 268 (1985). (3) Рекомбінантний експресуючий вектор за даним винаходом Рекомбінантний експресуючий вектор за даним винаходом містить ген за даним винаходом, що кодує білок (a) або (b). Рекомбінантний експресуючий вектор може являти собою, наприклад, рекомбінантний експресуючий вектор, в який вставлена кДНК. Рекомбінантний експресуючий вектор можна одержувати з використанням, наприклад, плазміди, фагу або косміди (не обмежуючись ними). Крім того, у способі одержання рекомбінантного експресуючого вектора можна застосовувати відомий метод. Вектор не є обмежений будь-яким специфічним видом і може бути будь-яким, поки його можна експресувати у клітині-хазяїні (хазяїні). Тобто, експресуючий вектор можна одержувати таким чином: щоб ген надійно експресувався, послідовність промотору вибирають, як необхідно відповідно до типу клітини-хазяїна; і вибрану таким чином послідовність промотору й ген за даним винаходом вставляють, наприклад, у плазміду різних видів. Приклади експресуючого вектора включають в себе: фагові вектори; плазмідні вектори; вірусні вектори; ретровірусні вектори; хромосомні вектори; епісомні вектори; і одержані з вірусів вектори (наприклад, вектори, одержані з бактеріальних плазмід, бактеріофагів, епісоми дріжджів, хромосомні елементи дріжджів, віруси (наприклад, бакуловіруси, паповавіруси, віруси вісповакцини, аденовіруси, авіпоксвіруси, віруси інфекційного бульварного паралічу, герпесвіруси, лентивіруси й ретровіруси) і їх комбінації, наприклад, косміди й фагміди). Як правило, введення плазмідного вектора здійснюють в осадах, таких як осади фосфату кальцію, або в комплексі із зарядженими ліпідами. У випадку, коли вектор являє собою вірус, вектор можна впаковувати in vitro з використанням прийнятної лінії пакувальних клітин, і потім ними можна трансдукувати клітину-хазяїна. Ретровірусний вектор може бути реплікованим або дефектним по реплікації. В останньому випадку, розмноження вірусу, як правило, відбувається тільки в комплементарній клітині-хазяїні. Крім того, переважними є вектори, кожний з яких містить у собі цис-діючу регуляторну зону для гена-мішені. Прийнятний транс-діючий фактор може надавати хазяїн, комплементарний вектор, або сам вектор під час введення вектора хазяїну. У переважному щодо цього варіанті здійснення переважними є вектори, кожний з яких забезпечує специфічну експресію, яка може бути індуцибельною і/або специфічною для типу клітин. Особливо переважними серед цих 12 UA 101814 C2 5 10 15 20 25 30 35 40 45 50 55 60 векторів є вектори, індуцибельні за допомогою зовнішніх факторів, якими легко маніпулювати, такі як температура й харчові добавки. Приклади переважного вектора для бактерій для використання включають в себе: pQE70, pQE60 і pQE-9 (доступні з Qiagen); вектор pBS, вектор Phagescript, вектор Bluescript, pNH8A, pNH16a, pNH18A, pNH46A (доступні з Stratagene); і ptrc99a, pKK223-3, pKK233-3, pDR540, pRIT5 (доступні з Pharmacia). Крім того, приклади переважного вектора для еукаріотів містять включають в себе pWLNEO, pSV2CAT, pOG44, pXT1 і pSG (доступні з Stratagene); і pSVK3, pBPV, pMSG і pSVL (доступні з Pharmacia). Різні види маркерів можна використовувати для підтвердження, перенесений чи ні ген за даним винаходом в клітину-хазяїна, і для підтвердження, надійно чи ні ген експресується в клітині-хазяїні. Тобто, експресуючий вектор, переважно, містить щонайменше один селективний маркер. Приклади такого селективного маркера включають в себе: редуктазу дигідрофолієвої кислоти або стійкість до неоміцину для культури еукаріотичних клітин; і гени стійкості, такі як ген стійкості до тетрацикліну й ген стійкості до ампіциліну, для культури E. coli і інших бактерій. В іншому прикладі використовують, як маркер, ген, делетований у клітині-хазяїні, і в клітинухазяїна вводять, як експресуючий вектор, плазміду або т.п., що містить маркер і ген за даним винаходом. За експресією маркерного гена можна підтвердити, що ген за даним винаходом перенесений. Альтернативно, білок за даним винаходом можна експресувати як злитий білок. Наприклад, за допомогою зеленого флуоресцентного білка (GFP), одержаного з Aequorea victoria, застосовуваного як маркер, білок за даним винаходом можна експресувати у формі злитого з GFP білка. Крім того, ген за даним винаходом можна зв’язувати з вектором, що містить селективний маркер для розмноження клітини-хазяїна. Крім того, є переважним, щоб вставка ДНК була функціонально зв’язаною з прийнятним промотором (наприклад, промотором фага λPL, промотором lac E. coli, промотором trp, промотором tac, раннім промотором і пізнім промотором SV40, і промотором ретровірусу LTR). Як інший прийнятний промотор можна використовувати будь-який, відомий фахівцям у даній галузі. За даним винаходом відомі промотори бактерій, які переважно використовують, містять у собі промотори E. coli lacІ і lacZ, промотор T3 і промотор T7, промотор gpt, промотор λPR і промотор λPL, і промотор trp. Прийнятні промотори еукаріотів містять у собі негайний ранній промотор CMV, промотор тимидинкінази HSV, ранній промотор SV40 і пізній промотор SV40, промотор LTR ретровірусу (наприклад, промотор вірусу саркоми Рауса (RSV)), і промотор металотіонеїн (наприклад, промотор металотіонеїну I миші). Є переважним, щоб рекомбінантний експресуючий вектор додатково містив: ділянки старту транскрипції й термінації транскрипції; і зону транскрипції, що містить ділянку зв’язування рибосоми для трансляції. Зрілий транскрипт, експресований за допомогою векторної конструкції, містить кодуючу зону, що містить (i) старт транскрипції AUG на старті поліпептиду, що підлягає трансляції й (ii) стоп-кодон, належним чином розташований на кінці поліпептиду. Транскрипцію ДНК у вищих еукаріотів можна підсилювати вставленням послідовності енхансеру у вектор. Енхансер являє собою цис-діючий елемент ДНК (як правило, приблизно від 10 п.о. до 300 п.о.), який діє для посилення транскрипційної активності промотору визначеного типу клітини-хазяїна. Приклади енхансера включають в себе: енхансер SV40 (розташований від 100 п.о. до 270 п.о. на пізній стороні від точки початку реплікації); енхансер раннього промотору цитомегаловірусу; енхансер поліоми на пізній стороні від точки початку реплікації; і енхансер аденовірусу. Вищезгадані клітини-хазяїни не є обмеженими будь-якою однією конкретною, і можна прийнятним чином використовувати загальновідомі клітини різних видів. Типові приклади прийнятного хазяїна включають в себе: клітини бактерій (наприклад, клітини E. coli, клітини Streptomyces і клітини Salmonella typhimurium); клітини грибів (наприклад, клітини дріжджів); клітини комах (наприклад, клітини Drosophila S2 і клітини Spodoptera Sf9); клітини тварин (наприклад, клітини CHO, клітини COS і клітини меланоми Bowes); і клітини рослин. Більш конкретні приклади цього включають в себе не тільки клітини ссавців, такі як клітини людини й клітини миші, а також клітини, одержані з Bombys mori, комах, таких як Drosophila melanogaster, бактерій, таких як E. coli (Escherichia coli), дріжджів (Saccharomyces cerevisiae і Schizosaccharomyces pombe), і Caenorhabditis elegans, і клітини-ооцити Xenopus laevis. Однак даний винахід не є обмежений цим. Культуральне середовище й умови, прийнятні для кожної з вищезгаданих клітин-хазяїнів, можуть являти собою ті, які відомі в даній галузі. Спосіб введення експресуючого вектора в клітину-хазяїна, тобто спосіб трансформації, також не є обмеженим будь-яким конкретним, і можна прийнятним чином використовувати загальновідомий спосіб, наприклад, електропорацію, спосіб з фосфатом кальцію, спосіб з 13 UA 101814 C2 5 10 15 20 25 30 35 40 45 50 55 60 ліпосомами, спосіб з DЕАЕ-декстраном, мікроін’єкцію, опосередковану катіонними ліпідами трансфекцію, електропорацію, трансдукцію або інфекцію. Ці способи описані в багатьох загальноприйнятих лабораторних керівництвах, наприклад, Davis et al., Basic Methods In Molecular Biology (1986). Слід зазначити, що даний винахід може також стосуватися (i) рекомбінантного експресованого вектора, що містить полінуклеотид, що кодує частковий фрагмент білка за даним винаходом й (ii) трансформанту (клітини-хазяїна), генетично модифікованого за допомогою рекомбінантного експресуючого вектора, кожний з яких призначений для рекомбінантної продукції часткового фрагмента (фрагмента) білка за даним винаходом. Крім того, даний винахід може включати в себе також винахід, що стосується продукції білка за даним винаходом або його фрагмента за допомогою вищезгаданих рекомбінантних способів. Тобто, даний винахід може також стосуватися способу продукції білка за даним винаходом і його фрагмента за допомогою застосування рекомбінантного способу. Рекомбінантний білок, одержаний цим способом, можна збирати й очищати із продукту культивування рекомбінантних клітин за допомогою відомого способу, наприклад, преципітації сульфатом амонію або преципітації етанолом, кислої екстракції, аніоно- або катіонообмінної хроматографії, хроматографії на фосфоцелюлозі, хроматографії гідрофобної взаємодії, афінної хроматографії, хроматографії на гідроксіапатиті або лектинової хроматографії. Найбільш переважною, застосовуваною для очищення, є високоефективна рідинна хроматографія («HPLC»). (4) Трансформант за даним винаходом Трансформант за даним винаходом являє собою трансформант, в який перенесений ген за даним винаходом, тобто трансформант, в який перенесений рекомбінантний експресуючий вектор, описаний в (3) вище. Вираз «ген перенесений» у даному документі означає, що ген перенесений у клітину-мішень (клітину-хазяїна) прийнятним для експресії чином за допомогою відомого способу генної інженерії (способу генетичної маніпуляції). Крім того, «трансформант» означає не тільки клітину, тканину й орган, але також окремий організм. Спосіб одержання (продукції) трансформанту за даним винаходом може являти собою, наприклад, спосіб трансформації вищезгаданим рекомбінантним експресуючим вектором. Організм, що підлягає трансформації, також не є обмеженим будь-яким конкретним організмом, його приклади включають в себе різні види мікроорганізмів і тварин (наприклад, трансгенну мишу), проілюстрованих у вищезгаданих описах стосовно клітини-хазяїна. Крім того, рослина також може бути суб’єктом, що підлягає трансформації за допомогою вибраного промотору й/або a вектора. (5) Засіб для детекції генів за даним винаходом У засобі для детекції генів за даним винаходом застосовують, як зонд, щонайменше частину нуклеотидної послідовності гена за даним винаходом або комплементарній їй послідовності. Засіб для детекції генів можна використовувати, наприклад, для детекції й/або вимірювання характеру експресії гена за даним винаходом в різних умовах. Засіб для детекції генів за даним винаходом може, наприклад, являти собою чип ДНК, що містить субстрат (основу), на якій іммобілізований зонд, специфічно гібридизований з геном за даним винаходом. «Чип ДНК» у даному документі в першу чергу стосується синтетичного чипа ДНК, в якому використовують, як зонд, синтезований олігонуклеотид. Не тільки це, термін «чип ДНК» у даному документі включає в себе також мікромасив ДНК за типом приєднання, в якому використовують, як зонд, кДНК, таку як продукт ПЛР. Послідовність, застосовувану як зонд, можна визначати загальновідомим способом для визначення характерної послідовності за послідовністю кДНК. Конкретно, наприклад, спосіб може являти собою спосіб серійного аналізу експресії генів (SAGE) (Science 276:1268, 1997; Cell 88:243, 1997; Science 270:484, 1995; Nature 389:300, 1997; Патент США № 5695937). Слід зазначити, що чип ДНК можна виготовляти відомим способом. Наприклад, щоб використовувати синтезований олігонуклеотид як олігонуклеотид, спосіб фотолітографії й спосіб твердофазного синтезу ДНК можна використовувати в комбінації, так що олігонуклеотид одержують за допомогою синтезу на субстраті. З іншого боку, щоб використовувати кДНК як олігонуклеотид, кДНК можна приєднувати до субстрату за допомогою апарата для складання масиву. Крім того, так само як у загальноприйнятих чипах ДНК, точність детекції гена можна додатково поліпшити наданням повністю співпадаючого зонда (олігонуклеотиду) разом з незбіжним зондом, який відрізняється від повністю співпадаючого зонда заміною однієї основи. Крім того, для паралельної детекції різних генів чип ДНК можна сконфігурувати так, що множина видів олігонуклеотидів іммобілізують на одному субстраті. Далі більш докладно описаний засіб для детекції генів за даним винаходом. 14 UA 101814 C2 5 10 15 20 25 30 35 40 45 50 55 60 Субстрат Від матеріалу субстрату для застосування в засобі для детекції генів за даним винаходом потрібно тільки те, щоб він являв собою матеріал, на якому можна стабільно іммобілізувати олігонуклеотид. Матеріал містить у собі як необмежувальні приклади синтетичні смоли (наприклад, полікарбонат і пластмасу) і скло. Форма субстрату також не є обмеженою будьякою конкретною формою. Наприклад, переважно, можна використовувати субстрат у формі планшета або субстрат у формі плівки. Олігонуклеотид, що підлягає іммобілізації на поверхні субстрату Від олігонуклеотиду, що підлягає іммобілізації на поверхні субстрату із засобу для детекції генів за даним винаходом, потрібно тільки те, щоб він являв собою олігонуклеотид, оснований щонайменше на частині нуклеотидної послідовності гена за даним винаходом. За встановленням гібридизації між олігонуклеотидом і нуклеїновою кислотою, одержаною зі зразка, можна детектирувати ген, що міститься в зразку. Слід зазначити, що олігонуклеотид, оснований щонайменше на частині нуклеотидної послідовності гена за даним винаходом, далі в даному документі в деяких випадках позначають як «зв’язувальний олігонуклеотид». Зв’язувальний олігонуклеотид можна конструювати на основі нуклеотидної послідовності гена за даним винаходом. Таким чином, зв’язувальний олігонуклеотид може являти собою саму нуклеотидну послідовність або може містити в собі мутацію, поки це дозволяє встановлення специфічної гібридизації між зв’язувальним олігонуклеотидом і нуклеїновою кислотою, одержаної зі зразка, що підлягає детекції. Положення мутації не є конкретно обмеженим. Довжина (кількість основ) зв’язувального олігонуклеотиду не є конкретно обмеженою. Однак якщо довжина є занадто короткою, детекція гібридизації стає складною; якщо довжина є занадто довгою, можлива неспецифічна гібридизація. Автори даного винаходу продовжували досліджувати оптимізацію довжини зв’язувального олігонуклеотиду й визначили довжину 12-50 основ як стандартну довжину. Стандартна довжина становить переважно 12-40 основ, більш переважно, 12-30 основ, більш переважно, 13-22 основ. Однак даний винахід не є обмеженим цим. Довжина в основах у першу чергу залежить від характеристик послідовності (вмісту конкретної основи, повторення конкретної основи). Крім того, автори даного винаходу підтвердили, що навіть коротколанцюговий зв’язувальний олігонуклеотид здатний до специфічної гібридизації, за умови, що коротколанцюговий зв’язувальний олігонуклеотид має точне зв’язування. У випадку, коли зв’язувальний олігонуклеотид має одну зі структури шпильки, структури петлі й інших третинних структур, кожна з яких перешкоджає гібридизації з нуклеїновою кислотою, одержаної зі зразка, заміна одного або декількох нуклеотидів, що складають зв’язувальний олігонуклеотид, інозином або нуклеїновою кислотою(кислотами), що не спарюються з будь-яким нуклеотидом(нуклеотидами) може усувати третинну структуру. Спосіб синтезу зв’язувального олігонуклеотиду не є обмеженим будь-яким конкретним способом. Наприклад, можна використовувати відомий спосіб (наприклад, спосіб, описаний в Maniatis, T. et al., Molecular Cloning A Laboratory Manual, Second Edition, Cold Spring Harbor Laboratory Press (1989)). Загалом, зв’язувальний олігонуклеотид можна синтезувати хімічно з використанням комерційно доступного ДНК-синтезатора. У засобі для детекції генів за даним винаходом є переважним, щоб так званий контрольний зв’язувальний олігонуклеотид, так само як олігонуклеотид, оснований щонайменше на частині нуклеотидної послідовності гена за даним винаходом, були іммобілізованими на поверхні субстрату. Контрольний зв’язувальний олігонуклеотид містить у собі зв’язувальний олігонуклеотид для позитивного контролю і зв’язувальний олігонуклеотид для негативного контролю. Зв’язувальний олігонуклеотид для позитивного контролю використовують для перевірки, успішно чи ні пройшла реакція ампліфікації на описаній нижче стадії одержання зонда. Зв’язувальний олігонуклеотид для негативного контролю використовують для перевірки неспецифічної гібридизації, тобто хибнопозитивного сигналу гібридизації. Даний винахід стосується також засобу для детекції генів, в якому ці зв’язувальний олігонуклеотид для позитивного контролю і зв’язувальний олігонуклеотид для позитивного контролю іммобілізовані на поверхні субстрату. Зв’язувальний олігонуклеотид для позитивного контролю може являти собою будь-який олігонуклеотид, за умови, що він сконструйований на основі нуклеотидної послідовності, що входить у зонд, одержаний із зразка, що підлягає детекції. Крім того, щоб множина зразків, які підлягають детекції, детектирувати одночасно, з використанням одного засобу для детекції генів, зв’язувальні олігонуклеотиди для позитивного контролю можна сконструювати відповідно для зразків, що підлягають детекції, або зв’язувальний олігонуклеотид для позитивного контролю можна сконструювати на основі нуклеотидної послідовності, загальної для зондів, 15 UA 101814 C2 5 10 15 20 25 30 35 40 45 50 55 60 одержаних з множини зразків, що підлягають детекції. У випадку, якщо не існує нуклеотидної послідовності, загальної для зондів, одержаних із усіх зразків, які підлягають детекції, зв’язувальний олігонуклеотид для позитивного контролю можна сконструювати для кожної з деяких груп. Альтернативно, штучну послідовність можна сконструювати так, щоб вона мала послідовність, що відрізняється від послідовності розглянутої бактерії, але мала загальну послідовність праймеру, і частину штучної послідовності можна використовувати як зв’язувальний олігонуклеотид для позитивного контролю. За допомогою такої штучної послідовності, використовуваної як матриця, можна одержати зонд (такий зонд у даному документі називається «контрольний зонд»), і одержаний зонд додають до зонда, одержаного зі зразка. Таким чином, можна тестувати специфічність гібридизації. Більш докладно зонд обговорюють нижче. Є переважним зв’язувальний олігонуклеотид для негативного контролю конструювати так, щоб він мав нуклеотидну послідовність зв’язувального олігонуклеотиду для позитивного контролю зі штучною заміною однієї або декількох основ, але менш ніж 20% від усіх основ послідовності. Кількість замінених основ визначають, беручи до уваги умови гібридизації, так що зв’язувальний олігонуклеотид для негативного контролю не гібридизується із зондом, одержаним із зразка, який підлягає детекції. Зразок, що підлягає детекції, не є обмеженим будь-яким конкретним зразком. Крім того, необхідно тільки, щоб кількість видів зв’язувальних олігонуклеотидів, які підлягають іммобілізації на одному субстраті, становила один або більше, і не існує верхньої межі для цього. Також є найбільш переважним конструювати засіб для детекції генів за даним винаходом так званого типу мікромасиву, в якому множина часткових фрагментів (що мають різні нуклеотидні послідовності) гена за даним винаходом іммобілізують на одному субстраті як зв’язувальні олігонуклеотиди. Іммобілізація олігонуклеотиду (зв’язувального олігонуклеотиду) Спосіб іммобілізації олігонуклеотиду на поверхні субстрату не є обмеженим будь-яким конкретним способом, але його можна вибрати з відомих способів, за необхідністю. Наприклад, доступні засоби, застосовувані для загальних способів гібридизації, наприклад, фізична адсорбція, електричне зв’язування або молекулярне ковалентне зв’язування. Для засобу для детекції генів за даним винаходом є переважним використання субстрату, що має карбодіімідну групу або ізоціанатну групу на поверхні (Патент США № 5908746, Tokukaihei, № 8-23975) для іммобілізації. Якщо кількість олігонуклеотиду, що наноситься плямами на субстрат, занадто мала, детекція може бути складною, оскільки може відбуватися недостатньо сильна реакція між олігонуклеотидом і зондом. Крім того, нанесення плямами з високою щільністю приводить до технічних проблем і високої вартості, а також вимагає високоточного засобу для детекції, що дорого коштує (наприклад, сканера) для детекції сигналу гібридизації з використанням, наприклад, флуоресцентної мітки із зонда або хемілюмінесценції. Таким чином, є переважним іммобілізувати на поверхні субстрату олігонуклеотид у межах розміру від 10 мкм до 1000 мкм у діаметрі. Спосіб нанесення плям олігонуклеотиду на субстрат не є обмеженим будь-яким конкретним способом. Наприклад, нанесення плямами можна здійснювати нанесенням плям розчину олігонуклеотиду на субстрат з використанням апарату для нанесення плям. Таким чином, розчин олігонуклеотиду можна, як правило, наносити по суті колами. (6) Засіб для детекції з використанням білка за даним винаходом або його часткового фрагменту У засобі для детекції за даним винаходом використовують як зонд щонайменше частину амінокислотної послідовності білка за даним винаходом. Іншими словами, засіб для детекції за даним винаходом являє собою засіб для детекції з іммобілізованим на ньому білком за даним винаходом або його частковим фрагментом (фрагментом). Засіб для детекції можна використовувати для детекції й/або вимірювання, у різних умовах, речовини (наприклад, поліпептиду, нуклеїнової кислоти або антитіла), взаємодіючої з білком за даним винаходом. Засіб для детекції за даним винаходом може являти собою, наприклад, засіб, що містить субстрат (подложку) з іммобілізованим на ньому зондом, де зонд специфічно зв’язується з антитілом, що пізнає білок за даним винаходом. У випадку амінокислотної послідовності, використовуваної як зонд, є переважним використовувати ділянку білка за даним винаходом, де ділянка специфічно взаємодіє з антитілом за даним винаходом, тобто пептид білка, що несе епітоп за даним винаходом. Від матеріалу субстрату для застосування в засобі для детекції за даним винаходом потрібно тільки те, щоб він являв собою матеріал, на якому можна стабільно іммобілізувати олігопептид. Матеріал містить у собі як необмежувальні приклади синтетичні смоли (наприклад, 16 UA 101814 C2 5 10 15 20 25 30 35 40 45 50 55 60 полікарбонат і пластмасу) і скло. Форма субстрату також не є обмеженою будь-якою конкретною формою. Наприклад, переважно, можна використовувати субстрат у формі планшета або субстрат у формі плівки. Крім того, спосіб іммобілізації олігопептиду на субстраті може являти собою загальновідомий спосіб і не є обмеженим будь-яким конкретним способом. Наприклад, іммобілізацію можна здійснювати за допомогою: способу, в якому олігопептид зв’язаний з нерозчинним носієм за допомогою способу ковалентного зв’язування або способу адсорбції; спосіб іммобілізації захоплюванням, в якому олігопептид оточують високомолекулярними речовинами; або спосіб, в якому олігопептид іммобілізують на подложке з використанням зшивного засобу, або т.п. Слід зазначити, що прийнятний спосіб іммобілізації можна вибирати з врахуванням (i) сумісності між субстратом для іммобілізації олігопептидом (ii) мети використання іммобілізованої речовини. (7) Корисність гена, білка й іншого за даним винаходом Як описано вище, ген і білок за даним винаходом експресуються специфічно під час латентної інфекції герпесвірусом. Вважають, що цей білок має здатність індукувати ментальне порушення у хазяїна при експресії в гліальних клітинах (наприклад, астроцитах) у мозку. Крім того, цікаво, що виявлено, що ген і білок за даним винаходом стосуються пацієнтів з ментальними порушеннями. Більш докладно, як показано в описаному пізніше прикладі, антитіло проти SITH-1 детектирували приблизно в 50% пацієнтів, що страждають афективними порушеннями або іншими ментальними порушеннями, у той час як антитіло проти SITH-1 майже не піддавалося детекції у здорових індивідуумів (частота детекції антитіла проти SITH-1 у здорових індивідуумів становила менше приблизно 2%). Таким чином, автори даного винаходу самостійно відкрили, що антитіло, специфічне для білка за даним винаходом, виявлене в значній кількості тільки у пацієнтів з афективними порушеннями й іншими ментальними порушеннями, але ледь піддається детекції у здорових індивідуумів. Слід зазначити, що «ментальне порушення», як застосовують у даному документі, призначене для позначення стану, при якому виникають значні обмеження в повсякденному житті або соціальному житті через порушення ментальних функцій, таких як свідомість, інтелект, пам’ять, емоції, мислення й поведінка. «Афективне порушення» призначене, щоб позначати такий стан, коли через постійні зміни настрою або емоційних змін зазнають аномальних почуттів депресії або підйому з порушеннями у функціях повсякденного життя або у функціях соціального життя. Конкретні причини для вищезгаданого стану, коли «антитіло, специфічне для білка за даним винаходом виявляють у значній кількості тільки у пацієнтів з афективними порушеннями й іншими ментальними порушеннями, але воно ледь піддається детекції у здорових» у цей час інтенсивно вивчаються для їх розуміння. Білок за даним винаходом має таку властивість, що він активно продукується на проміжній стадії, коли латентна інфекція індукується в напрямку до реактивації. Вважають, що у відповідь на стрес індукується реактивація герпесвірусів (наприклад, HHV-6), в результаті чого продукується білок за даним винаходом. Вважають, що у індивідуумів, які мають антитіла проти білка за даним винаходом, що нараховують приблизно 50% з пацієнтів з ментальними порушеннями, експресія цього білка надлишкова через стрес або будь-який генетичний фактор протягом тривалого періоду в гліальних клітинах (наприклад, астроцитах) у мозку, коли гліальні клітини є латентно інфікованими HHV-6. В результаті, збільшення концентрації кальцію в гліальних клітинах (наприклад, астроцитах) триває протягом тривалого періоду, і метаболізм серотоніну й інші важливі функції гліальних клітин (наприклад, астроцитів) порушені, в результаті чого може проявлятися ментальне порушення. Пацієнти із синдромом хронічної втоми (CFS) із присутністю ментальних порушень є носіями антитіла проти білка за даним винаходом з високою частотою. Причиною для цього може бути те, що пацієнти з CFS часто є латентно інфікованими HHV-6 у більш високій кількості, ніж здорові індивідууми, таким чином, мають більшу ймовірність для продукції білка за даним винаходом (білок SITH-1). Той факт, що пацієнти з CFS є латентно інфікованими HHV-6 у більш високій кількості, ніж здорові, підтримують також результати реакції між опублікованим раніше продуктом специфічного для латентної інфекції гена й антитілом у пацієнтів з CFS (див. Непатентний документ 5). Таким чином, хоча детальний механізм того феномена, що антитіло проти білка за даним винаходом виявлене у пацієнтів з ментальними порушеннями, дотепер не ясний, використання цього феномена забезпечує спосіб визначення й діагностичний спосіб, які вносять внесок в об’єктивну діагностику ментальних порушень. Крім того, даний винахід також стосується набору для визначення, набору для діагностики, способу одержання моделі на тваринах і способу скринінгу лікарського засобу. Нижче докладно описаний кожний із цих способів. 17 UA 101814 C2 5 10 15 20 25 30 35 40 45 50 55 60 (7-1) Спосіб визначення за даним винаходом Від способу визначення за даним винаходом потрібно тільки те, щоб він являв собою спосіб визначення, існує або ні у суб’єкта антитіло, що пізнає білок за даним винаходом (тобто білок (a) або (b)). Слід зазначити, що термін «суб’єкт» означає людину або ссавця, що відрізняється від людини. Аналіз антитіла можливий за допомогою детекції, наприклад, за допомогою реакції зв’язування білка, пізнаваного антитілом, або часткового фрагмента білка. Таким чином, у цьому способі визначення білок, пізнаваний антитілом, або частковий фрагмент білка переважно використовують для визначення присутності антитіла імунологічним способом (тобто з використанням реакції антиген-антитіло). Слід зазначити, що «частковий фрагмент» переважно містить щонайменше пептид, що несе епітоп. Як приклад цього способу визначення нерозчинний носій, на якому іммобілізований білок відповідно до даного винаходу або його частковий фрагмент, приводять у контакт із біологічним зразком, узятим від суб’єкта, промивають і потім детектирують антитіла, специфічно зв’язані з білком або його частковим фрагментом на нерозчинному носії. Антитіла, специфічно зв’язані з білком або його частковим фрагментом на нерозчинному носії, являють собою, наприклад, антитіла, одержані від суб’єкта. Таким чином, такі антитіла можна легко детектирувати із використанням вторинного антитіла, тобто антитіла, специфічного для антитіл суб’єкта. У цьому випадку барвник, фермент або радіоактивну або флуоресцентну мітку можна включати у вторинне антитіло для посилення й, таким чином, додаткового полегшення передбаченої детекції. Таким чином, аналізи антитіл для застосування в розглянутому способі визначення містять у собі способи аналізу з використанням загальноприйнятих імуногістологічних способів, таких як спосіб із флуоресцентним антитілом, дот-блот-аналіз, спосіб Вестерн-Блотинга, способи твердофазного імуноферментного аналізу (включаючи спосіб ELISA і сендвіч-ELISA), спосіб радіоімунного аналізу (RIA) і спосіб аналізу імунодифузії. У цих аналізах використовують такі молекули як авідин і біотин, для цілей молекулярної іммобілізації й детекції, і способи одержання цих реагентів і способи їх використання можуть являти собою способи, відомі фахівцеві в даній галузі. Слід зазначити, що результатом розглянутого способу визначення є імуногістологічне фарбування зрізів тканин для патологічного тестування. Слід також зазначити, що розглянутий спосіб визначення переважно здійснюють із використанням біологічного зразка, виділеного із суб’єкта. Термін «біологічний зразок, виділений» може стосуватися будь-якого зразка, що містить клітини, тканини або їх дезорганізовані частини, як узято від суб’єкта. Наприклад, «виділений біологічний зразок» може являти собою кожний зі зразків периферичної крові, слини, сили, калу й клітин, і не є обмеженим будь-яким конкретним зразком. З них особливо переважним зразком є периферична кров, узята від суб’єкта, беручи до уваги той факт, що герпесвіруси латентно інфікують макрофаги в периферичній крові. У цьому випадку суб’єкт одержує переваги від низького ступеня інвазії. Кількість антитіл, що присутні у біологічному зразку (зразку), можна легко обчислити, проводячи порівняння з кількістю антитіл, що присутні у стандартному препараті (наприклад, у стандартному зразку, узятому від здорового індивідуума, або в зразку, узятому від типового пацієнта з ментальним порушенням), з використанням, наприклад, комп’ютерного алгоритму лінійної регресії. У той час як різні способи аналізу доступні для детекції антитіл, приклад ELISA описаний в Iacobelli et al., Breast Cancer Research and Treatment 11: 19-30 (1988). Прийнятні ферментні мітки можна проілюструвати мітками, одержаними із класу оксидаз, каталізуючих утворення пероксиду водню за допомогою реакції із субстратом. Оксидаза глюкози є особливо переважною, оскільки має задовільну стабільність, і її субстрат (глюкоза) є легкодоступною. Активність оксидазної мітки можна оцінювати вимірюванням концентрації пероксиду водню, утвореного за допомогою реакції міченого ферментом антитіла/субстрату. На додаток до ферментів інші прийнятні мітки містять у собі радіоактивні ізотопи (наприклад, йод 125 125 14 35 3 112 99m ( I і I), вуглець ( C), сірку ( S), тритій ( H), індій ( In) і технецій ( Тc), так само як флуоресцентні мітки (наприклад, флуоресцеїн і родамін) і біотин. Рівень антитіл (проти білка за даним винаходом), присутніх у біологічних зразках, одержаних від суб’єкта, можна також детектирувати in vivo способами, що відрізняються від вищеописаного способу імуноаналізу, наприклад, за допомогою аналізу одержання зображення. Коротко, беручи до уваги той факт, що антитіло проти білка відповідно до даного винаходу також являє собою білок, антитіло, що специфічно пізнає це антитіло, можна використовувати для детекції in vivo за допомогою аналізу зображення за рівнем антитіл (проти білка за даним винаходом), присутніх у біологічних зразках, одержаних від суб’єкта. 18 UA 101814 C2 5 10 15 20 25 30 35 40 45 50 55 60 Мітки або маркери антитіла для аналізу одержання зображення антитіл включають в себе ті, які можна детектирувати одержанням рентгенівських зображень, ЯМР або ЕПР. Для одержання рентгенівських зображень прийнятні мітки включають в себе радіоактивні ізотопи, такі як барій або цезій, які випромінюють радіоактивне випромінювання, що піддається детекції, але які явно безпечні для тестованого зразка. Прийнятні маркери для ЯМР і ЕПР включають в себе маркери, які можна використовувати для мічення поживних речовин для культивування зв’язаної гібридоми для одержання відповідного антитіла, таким чином, мітку включають у продуковане антитіло; прикладом такої мітки є дейтерій, що має характерний спин, який піддається детекції. Антитіло або його фрагмент, яке є специфічним для антитіла проти білка за даним винаходом і яке є міченим прийнятною частиною, що піддається детекції аналізом одержання 131 111 99m зображення, такою як радіоактивний ізотоп (наприклад, I, In або Тc), непроникний для радіоактивності субстрат або речовину, яку можна детектирувати ядерним магнітним резонансом, вводять (наприклад, парентерально, підшкірно або внутрішньовенно) ссавцеві, що підлягає тестуванню по порушенню. У даній галузі знань відомо, що кількість частини для аналізу одержання зображення, необхідна для одержання діагностичного зображення, визначають за розміром зразка, що підлягає тестуванню й за системою аналізу зображення, що підлягає використанню. У випадку, коли ця частина являє собою частину радіоактивного ізотопу, кількість радіоактивності, що підлягає ін’єкції в людський зразок, як правило, лежить у 99m діапазоні від приблизно 5 до приблизно 20 мКі Тc. Потім мічене антитіло або його фрагмент накопичується переважно в тій ділянці клітини, яка містить антитіло проти білка за даним винаходом. Слід зазначити, що аналіз одержання зображення пухлин in vivo описаний в S. W. Burchiel et al., «Immunopharmacokinetics of Radiolabeled Antibodies and Their Fragments» (Turner Imaging, Chapter 13: The Radiochemical Detection of Cancer, Burchiel, S. W. and Rhodes, B. A. eds., Masson Publishing Inc. (1982)). Нижче перелічені конкретні приклади мітки, доступної за даним винаходом. Приклади прийнятних ферментних міток включають в себе малатдегідрогеназу, нуклеазу Staphylococcus, алкогольдегідрогеназу дріжджів, α-гліцерин-фосфатдегідрогеназу, триозофосфатізомеразу, пероксидазу, лужну фосфатазу, аспарагіназу, оксидазу глюкози, β-галактозидазу, рибонуклеазу, уреазу, каталазу, глюкоза-6-фосфатдегідрогеназу, глюкоамілазу й ацетилхолінестеразу. 3 111 125 131 Приклади прийнятних міток з радіоактивними ізотопами містять у собі H, In, In, In, 32 35 14 51 57 58 59 75 152 90 67 217 211 212 47 109 Р, S, C, CR, To, Co, Fe, Se, Eu, Y, Cu, Ci, At, Pb, Sc і Pd. Індій 111 111 ( In) є переважним ізотопом у випадку, коли застосовують одержання зображення in vivo, 125 оскільки цим уникають проблеми дегалогенування моноклонального антитіла, міченого I або 131 I, де дегалогенування здійснюється в печінці. Крім того, цей радіоактивний ізотоп має сприятливу для одержання зображення енергією висвічування гама-квантів (Perkins et al., Eur. J. Nucl. Med. 10: 296-301 (1985); Carasquillo et al., J. Nucl. Med. 28: 281-287 (1987)). Наприклад, 111 показано, що індій 111 ( In), приєднаний до моноклонального антитіла з використанням 1-(Pбензилізотіоціанат)-DPTA, має невелике поглинання в непухлинних тканинах, зокрема печінці, і, таким чином, підсилює специфічність локалізації пухлини (Esteban et al., J. Nucl. Med. 28: 861870 (1987)). 157 55 Приклади прийнятних міток з нерадіоактивними ізотопами включають в себе Gd, Mn, 162 52 56 Dy, Tr і Fe. l52 Приклади прийнятних флуоресцентних міток включають в себе мітку Eu, флуоресцеїнову мітку, ізотіоціанатну мітку, родамінову мітку, фікоеритринову мітку, фікоціанінову мітку, алофікоціанінову мітку, о-фталальдегідну мітку й флуорескамінову мітку. Приклади прийнятних маркерних токсинів включають в себе дифтерійний токсин, рицин і холерний токсин. Приклади хемілюмінесцентних міток включають в себе люміналову мітку, ізолюміналову мітку, мітку ароматичного складного ефіру акридинію, імідазолову мітку, мітку солі акридинію, мітку оксалатного складного ефіру, люциферинову мітку, люциферазну мітку й екворинову мітку. Приклади контрастних засобів для ядерного магнітного резонансу включають в себе ядра атомів важких металів, таких як Gd, Mn і Fe. Репрезентативні способи для зв’язування вищезгаданих міток з антитілами представлені в Kennedy et al. (Clin. Chim. Acta 70: 1-31 (1976)) і Schurs et al. (Clin. Chim. Acta 81: 1-40 (1977)). Способи приєднання, описані в останньому, включають в себе спосіб із глутаральдегідом, спосіб з періодатом, спосіб з дималеїнімідом і спосіб з м-малеїнімідбензил-N-гідроксисукцинімідним складним ефіром. Усі ці способи наведені в даному документі як посилання. (7-2) Діагностичний спосіб Від діагностичного способу визначення за даним винаходом потрібно тільки те, щоб в ньому 19 UA 101814 C2 5 10 15 20 25 30 35 40 45 50 55 60 використовували вищезгаданий спосіб визначення. Конкретна конфігурація, умови та інше діагностичного способу не є конкретно обмеженими. Наприклад, з використанням як маркер антитіла за даним винаходом, що існує в суб’єкта-людини або суб’єкта-тварини, є можливим визначити, що суб’єкт-людина або суб’єкт-тварина уражена ментальним порушенням. Крім того, діагностику можна здійснювати з використанням як показник кількісне значення для антитіла за даним винаходом таким чином: Граничне значення встановлюють відповідним чином відповідно до кількісного значення (нормальним значенням), виміряним у здорового індивідуума, або з кількісним значенням (значенням для порушення), виміряного у типового пацієнта з ментальними порушеннями; якщо значення, виміряне у суб’єкта, вище або нижче граничного значення, визначають, що суб’єкт з великою ймовірністю уражений ментальним порушенням. При розвитку ментального порушення кількість антитіла збільшена. Через це, за даним винаходом, наприклад, кількісне значення (нормальне значення), виміряне у здорового індивідуума, встановлюють як граничне значення; якщо значення, виміряне у суб’єкта-людини, нижче граничного значення, можна визначити, що суб’єкт-людина з високою ймовірністю уражений ментальним порушенням. Слід зазначити, що термін «суб’єкт-людина» у даному документі означає людину, а термін «суб’єкт-тварина» означає тварину, що відрізняється від людини. Приклади суб’єкта-тварини включають в себе мишей, щурів і мавп. Не тільки ці, будь-яка тварина, що відрізняється від людини, може бути «суб’єктом-твариною». Таким чином, цей діагностичний спосіб надає можливість простого й точного визначення, (i) має чи ні суб’єкт ментальне порушення, або (ii) має чи ні суб’єкт імовірність ураження ментальним порушенням. Крім того, діагностичний спосіб для суб’єкта-тварини може бути досить корисним, наприклад, для скринінгу лікарського засобу для розроблення лікарських засобів проти ментальних порушень і суб’єктів-тварин для тестування ефективності лікарського засобу. (7-3) Набір для визначення, набір для діагностики Набір для визначення й набір для діагностики за даним винаходом потрібно тільки розробити так, щоб дозволяти здійснення способу визначення, описаного вище в (7-1), або діагностичного способу, описаного вище в (7-2). Конкретні конфігурації, матеріали, інструменти та інше із цього не є конкретно обмеженими. Для специфічності, для імунологічної детекції антитіла за даним винаходом, кожний з набору для визначення й набору для діагностики переважно містить будь-яке з: (i) білка за даним винаходом; (ii) часткового фрагмента (переважно, який містить пептид, що несе епітоп) білка (i); і (iii) засобу для детекції, на якому іммобілізований білок (i) або частковий фрагмент (ii). Набір, що має вищевказану конфігурацію, є досить корисним, оскільки такий набір забезпечує можливість легко й надійно здійснювати спосіб визначення або діагностичний спосіб за даним винаходом. Крім того, на додаток до вищевказаної конфігурації кожний з набору для визначення й набору для діагностики може містити елемент для здійснення кожної стадії способу визначення або діагностичного способу. Приклади такого елемента включають в себе: інструменти для забору зразка від суб’єкта (наприклад, шприц (ін’єктор) для збору периферичної крові); і елемент, необхідний для здійснення способу визначення й/або діагностичного способу, такий як лабораторні інструменти й різні реагенти (наприклад, реагенти, застосовувані для імунологічної реакції, такої як ELISA). Крім того, кожний з набору для визначення й набору для діагностики може містити обчислювальне обладнання (наприклад, комп’ютер) або програмне забезпечення, кожне з яких є необхідним для проведення визначення більш просто й точно. (7-4) Способи одержання, визначення, скринінгу й оцінки моделі на тваринах Діагностичний спосіб за даним винаходом є застосовним в: способі одержання моделі на тваринах (що відрізняються від людини) ментального порушення; в способі визначення корисності моделі на тваринах; і в способі визначення корисності лікарського засобу за допомогою скринінгу лікарського засобу з використанням моделі на тваринах. Конкретно, як описано в прикладі, модельні тварини для ментального порушення можна одержувати введенням білка SITH-1 у мозок тварини з використанням, наприклад, вектора. Крім того, корисність моделі ментального порушення на тваринах можна визначати таким чином: подібним чином, як у способі визначення й діагностичному способі, визначають, розвивається чи ні у суб’єкта-тварини ментальне порушення залежно від присутності або відсутності антитіла за даним винаходом; якщо в суб’єкта-тварини розвилося ментальне порушення, можна визначити, що суб’єкт-тварина є застосовним як модель ментального порушення на тваринах. Є більш переважним, щоб у кожному з вищевказаних різних способів, крім того, використовували, як засіб оцінки, діагностичний спосіб з використанням, наприклад, відомого 20 UA 101814 C2 5 10 15 20 25 30 35 40 45 50 55 60 дотепер порушення поведінки й/або реакції здригання тварини. Конкретно, для діагностики в тестах на тваринах можна використовувати кожне з наступного: (i) тест порушення поведінки, наприклад, тест підвішування за хвіст або тест примусового плавання; і (ii) відомий тест функціонування мозку, наприклад, реакцію здригання. «Суб’єкт-тварина» у даному документі може являти собою будь-яку тварину, що відрізняється від людини, особливо переважні приклади тварин включають в себе мишей, щурів, морських свинок, собак, кроликів, мавп і шимпанзе. Визначення (діагностика) ментальних порушень для тварин, що відрізняються від людини, було більш складним. У відношенні цього спосіб за даним винаходом є досить корисний. Крім того, речовина-кандидат на психотропний засіб або антипсихотичний засіб (засіб для лікування або поліпшення ментального порушення) можна вводити в такій моделі на тваринах, і після цього тест на порушення поведінки й детекцію антитіла за даним винаходом можна проводити таким способом, як описано вище. Потім, якщо ментальне порушення є вилікуваним або поліпшеним, можна визначити, що речовина-кандидат має ефект проти ментального порушення. Таким чином, застосування діагностичного способу за даним винаходом дозволяє легко й надійно проводити скринінг речовин-кандидатів на психотропний засіб. «Речовина-кандидат на психотропний засіб» у даному документі може являти собою будь-яку речовину, бажану для особи, що проводить тест. Слід зазначити, що головним у способі визначення, діагностичному способі або т.п. за даним винаходом є надання об’єктивного способу визначення для визначення, уражений чи ні суб’єкт ментальним порушенням, за допомогою детекції антитіла проти білка, який специфічно експресується під час латентної інфекції герпесвірусом, і головне не лежить у кожній маніпуляції, конкретно описаній в даному документі. Таким чином, слід зазначити, що способи визначення й діагностичні способи з використанням маніпуляцій, що відрізняються від описаних вище, також входять в обсяг даного винаходу. Крім того, вважають, що інфекція герпесвірусами пов’язана з: захворюваннями, що супроводжуються імунодефіцитом, такими як CFS, які описані також у прикладі, (наприклад, аутоімунні захворювання, такі як хвороба Крона); шкірні захворювання, які також вважають пов’язаними з HHV-6 (наприклад, індукований лікарським засобом синдром гіперчутливості); і енцефаліт, і енцефалопатія, індуковані HHV-6. Таким чином, можна вважати, що спосіб визначення й діагностичний спосіб за даним винаходом також дозволяють об’єктивні діагностику й оцінку цих захворювань. Тобто, білок, ген та інше за даним винаходом можна використовувати як маркер захворювання для різних захворювань, в які може бути залучений HHV-6. Крім того, даний винахід стосується також моделі на тваринах, одержаної перенесенням вищеописаного гена за даним винаходом, продукту цього гена (наприклад, білка, кодованого геном) або рекомбінантного експресуючого вектора, що несе ген. Оскільки ген за даним винаходом залучений у ментальне порушення як описано вище, у моделі на тваринах, одержаної перенесенням гена, продукту цього гена (наприклад, білка, кодованого геном) або рекомбінантного експресуючого вектора, що несе ген, проявляється симптом ментального порушення. Приклади симптому ментального порушення включають в себе подібні до маніакально-депресивних симптомів, подібні до маніакальних симптомів, подібні до депресивних симптомів і, залежно від способу тестування, подібні до симптомів шизофренії. Суб’єкт-тварина не є обмеженою будь-якою конкретною твариною, за умови, що вона є доступною як тестована тварина. Особливо переважна тварина являє собою ссавця, наприклад, мишу, щура або мавпу. Більше того, спосіб перенесення гена, продукту гена й рекомбінантного експресуючого вектора може являти собою загальновідомий спосіб і не є обмеженим будь-яким конкретним способом. Наприклад, спосіб викликання експресії білка за даним винаходом в мозку може являти собою спосіб з використанням аденовірусного вектора або спосіб з використанням ретровірусного вектора (див. описаний нижче приклад) і, зрозуміло, може являти собою кожний зі способів з використанням векторів, які не є аденовірусним вектором або ретровірусним вектором. Альтернативно, можна використовувати перенесення гена з використанням системного трансгену (наприклад, одержання трансгенної миші). Крім того, альтернативно, можна використовувати спосіб прямої інокуляції в мозок білка за даним винаходом. Тваринну модель ментального порушення можна прийнятним чином використовувати, наприклад, для дослідження в способах лікування ментальних порушень, вивчення ефектів лікарських засобів, визначення ефектів лікарських засобів і оцінки способів лікування (наприклад, термотерапії), які не є способами лікування з використанням лікарських засобів, і, таким чином, вона є досить корисною. Крім того, модельних тварин можна використовувати для дослідження фактора, пов’язаного 21 UA 101814 C2 5 10 15 20 25 30 35 40 45 50 55 60 з фактором розвитку ментального порушення. Модельних тварин можна також використовувати для дослідження для запобігання розвитку ментальних порушень, наприклад, за допомогою дослідження, наскільки сильне стомлення й стрес залучені в індукцію ментального порушення. Нижче показані приклади для більш докладного опису варіантів здійснення даного винаходу. Зрозуміло, даний винахід не є обмеженим прикладами нижче, і деталі можуть набирати різні форми. Крім того, даний винахід не є обмеженим описом вищевказаних варіантів здійснення, але фахівець у даній галузі може змінювати його в межах обсягу формули винаходу. Варіант здійснення, оснований на відповідній комбінації технічних засобів, описаних в інших варіантах здійснення, входить у технічний обсяг даного винаходу. Приклади 1. Ідентифікація продукту гена (мРНК), що кодує специфічний для латентної інфекції білок SITH-1 Матричну РНК (мРНК) виділяли з макрофагів, описаних у Непатентному документі 1, які були латентно інфікованими HHV-6, і реакцію зворотної транскрипції проводили з використанням випадково синтезованих праймерів, IE4RB як праймер для зворотної транскрипції смислових транскриптів, і IE2FB як праймер для зворотної транскрипції антисмислових транскриптів. Потім одержані зворотні транскрипти (кДНК) ампліфікували способом ПЛР із використанням праймерів IE4RB і IE2FB, і продукти далі ампліфікували способом подвійної гніздової ПЛР із використанням внутрішніх праймерів IE4RA і IE2FA. На фіг. 1 показана (i) відповідність між смисловим транскриптом (H6LT) відомої мРНК під час продуктивної інфекції й новим специфічним для латентної інфекції геном, і (ii) відкрита рамка зчитування специфічного для латентної інфекції білка SITH-1. Подробиці інформації про послідовність SITH-1 і нового специфічного для латентної інфекції гена див. у списку послідовностей. В результаті ампліфікації одержали продукт 925 п.о., який відрізнявся як від (i) продукту 351 п.о., ампліфікованого із мРНК, експресованою у клітинах MT-4, продуктивно інфікованих HHV-6, так і від (ii) продукту 351 п.о., ампліфікованого із продукту специфічного для латентної інфекції гена (асоційований з латентною інфекцією HHV-6 транскрипт: H6LT), описаного в Непатентному документі 3, який піддається детекції під час латентної інфекції макрофагів (МФ) HHV-6. Цей продукт відрізнявся також від продукту 1241 п.о., ампліфікованого із ДНК HHV-6, тим що він ампліфікувався винятково із продукту зворотної транскрипції антисмислових транскриптів у клітинах, латентно інфікованих HHV-6. Із цього показали, що продукт є невідомим дотепер продуктом нового специфічного для латентної інфекції гена (див. фіг. 2). На фіг. 2 «R» позначає випадково синтезований праймер, «S» позначає смисловий транскрипт і «анти-S» позначає антисмисловий транскрипт. Для визначення структури мРНК цього нового специфічного для латентної інфекції гена здійснювали спосіб швидкої ампліфікації 5′-кінців кДНК (RACE) і спосіб 3′-RACE, в результаті чого визначили не тільки 5′- і 3′-кінці, але також усю нуклеотидну послідовність (див. фіг. 3). IE4RB: 5′-GATGCTCCTTCTTCCACATTACTGG-3′ IE2FB: 5′-CATCCCATCAATTATTGGATTGCTGG-3′ IE2FA: 5′-GAAACCAC-CACCTGGAATCAATCTCC-3′ IE4RA: 5′-GACACATTCTTGGAAGCGATGTCG-3′ N1:5′-GCTGGGTAGTCCCCACCTTTCTAGA-3′ αF1:5′-CTGAAGCATGTAAGCACATCTCTTGC-3′ αR1:5′-GCTTCGAGATCAGTAGTGGTACG-3′ 2. Функціональний аналіз нового білка SITH-1 для специфічного для латентної інфекції гена Для дослідження функції білка SITH-1 ідентифікували білок хазяїна, з яким білок SITH-1 може зв’язуватися всередині клітин. Це здійснювали скринінгом бібліотеки кДНК ембріонального мозку людини за допомогою двогібридного аналізу в дріжджах з використанням білка SITH-1 як наживки. Результат показаний на фіг. 4. На фіг. 4 (A) показані клони дріжджів, в яких β-галактозидаза сильно експресувалася через зв’язування між SITH-1 і CAML; на (B) показана підтверджена Вестерн-блотингом і фарбуванням антитілами проти CAML схема того, що в аналізі осадження in vitro CAML, експресований в E. coli, можна копреципітувати зі злитим білком GST-SITH-1, який також експресують в E. coli, і на (C) показана підтверджена Вестернлотингом і фарбуванням антитілами проти FLAG схема, того, що після того, як SITH-1 з міткою FLAG і CAML перенесли в клітини 293T з використанням експресуючого вектора, SITH-1 можна копреципітувати із антитілами проти CAML. Як показано на фіг. 4, виявили, що білок SITH-1 сильно зв’язується з лігандом циклофіліну (CAML), що регулює рівень кальцію. CAML являє собою білок, для якого показали сильну експресію в лімфоцитах і в мозку, і відомо, що CAML має здатність збільшувати внутрішньоклітинну концентрацію кальцію. Таким 22 UA 101814 C2 5 10 15 20 25 30 35 40 45 50 55 60 чином, щоб побачити, чи може білок SITH-1 опосередковано через CAML збільшувати внутрішньоклітинну концентрацію кальцію, як лінію астроцитоподібних гліальних клітин (U373), в яких експресували SITH-1, так і необроблені клітини U373 офарблювали способом із флуоресцентним антитілом з використанням антитіл проти SITH-1 і антитіл проти CAML. Як з’ясувалося, коли білок SITH-1 експресований у лінії астроцитоподібних гліальних клітин (U373), виявлено більше CAML, ніж в необроблених клітинах U373 (фіг. 5). Рівень експресії CAML у клітинах U373 був не дуже високим, коли клітини U373 були необробленими, однак виявлено, що більше CAML виникає при експресії SITH-1 у клітинах U373. В іншому експерименті одержували два зразки: один зразок одержували перенесенням SITH-1 у лінію астроцитоподібних гліальних клітин (U373) за допомогою ретровірусного вектора, а інший зразок одержували введенням в U373 тільки вектора. Кожний зразок стимулювали за допомогою тапсигаргіну (TG), і внутрішньоклітинну концентрацію кальцію вимірювали з використанням Fura2. В результаті, дійсним вимірюванням внутрішньоклітинної концентрації кальцію показали, що внаслідок стимуляції за допомогою тапсигаргіну (TG), внутрішньоклітинна концентрація кальцію в експресуючій SITH-1 лінії астроцитоподібних гліальних клітин була значно більш високою, ніж в клітинах, в які переносили тільки вектор (фіг. 6). За цими результатами виявили, що білок SITH-1 має здатність збільшувати внутрішньоклітинну концентрацію кальцію в лінії астроцитоподібних гліальних клітин при його експресії під час латентної інфекції HHV-6 для збільшення внутрішньоклітинної кількості CAML. 3. Зв’язок між SITH-1 і афективними порушеннями На наступній стадії автори даного винаходу досліджували зв’язок між SITH-1 і ментальними порушеннями. Результати показані на фіг. 7. На відміну від білка специфічного для латентної інфекції гена, опублікованого, наприклад, у Непатентному документі 5, зв’язок між антитілом проти SITH-1 і пацієнтами із синдромом хронічної втоми був низький, однак частота носіїв антитіла була високою серед пацієнтів із синдромом хронічної втоми, що супроводжуються ментальними порушеннями. У багатьох випадках у пацієнтів із синдромом хронічної втоми (CFS), що супроводжуються психіатричними симптомами, в першу чергу проявляються депресивні симптоми, у той час як у пацієнтів з інфантильним CFS в основному проявляється аномальне збудження. На фіг. 7 «біполярні I» стосується пацієнтів з важкими симптомами маніакально-депресивного захворювання. Здорові дорослі майже не є носіями антитіла проти SITH-1. Для вимірювання титру антитіла експресуючі SITH-1 клітини 293T використовували як антигени, і застосовували спосіб із флуоресцентним антитілом. 4. Створення модельних мишей для ментального порушення за допомогою експресії SITH-1 SITH-1 із промотором гліального фібрилярного кислого білка (GFAP), приєднаного на 5′-кінці від його відкритої рамки зчитування, ін’єктували в мозок новонароджених мишей з використанням аденовірусного вектора або ретровірусного вектора. GFAP являє собою білок, який специфічно експресується в гліальних клітинах, таких як астроцити. Через приблизно чотири або п’ять тижнів після ін’єкції спостерігали поведінку кожної миші, щоб підтвердити, що модельні миші з ментальними порушеннями одержані перенесенням SITH-1. Тест підвішування за хвіст і тест примусового плавання проводили для оцінки ментальних порушень; ці тести є загальноприйнятими для спостереження пацієнтів з депресією або маніакально-депресивним захворюванням. Конкретно, мишей, яким переносили SITH-1 з використанням аденовірусного вектора, піддавали тесту підвішування за хвіст. Як з’ясувалося, миші, яким переносили SITH-1, мали помітно більш короткий час нерухомості, що вказує на те, що ці миші перебували в маніакальному стані (фіг. 8). Потім мишей, яким переносили SITH-1 з використанням ретровірусного вектора, піддавали тесту примусового плавання. Як з’ясувалося, миші, яким переносили SITH-1 з використанням ретровірусного вектора з високим титром, мали більш довгий час нерухомості, ніж контрольні миші, яким переносили ген зеленого флуоресцентного білка (EGFP), що вказує на те, що миші, яким переносили SITH-1 з високим титром, перебували в стані депресії. На відміну від цього миші, яким переносили SITH-1 з використанням ретровірусного вектора з низьким титром, мали більш короткий час нерухомості, що вказує на те, що миші, яким переносили SITH-1, з низьким титром, перебували в маніакальному стані (фіг. 9). Таким чином, маніакальний стан спостерігали в тесті підвішування за хвіст, у той час як і маніакальний стан, і депресивний стан спостерігали в тесті примусового плавання. Крім того, той факт, що або маніакальний стан, або депресивний стан спостерігали залежно від титру ретровірусного вектора, використовуваного для введення SITH-1, не тільки показує, що модель, яка представляє інтерес, може однаково служити моделями депресії й маніакально-депресивного захворювання, але також дозволяє припускати, що рівень експресії SITH-1 впливає на симптоми ментальних порушень. Автори даного винаходу виміряли також преімпульсне інгібування, щоб перевірити будь-яку 23 UA 101814 C2 5 10 15 20 25 30 35 40 45 50 55 60 аномалію в реакції здригання, де цю аномалію можна виявити в пацієнтів з маніакальнодепресивним захворюванням і шизофренією. Конкретно, у мишей, яким переносили SITH-1 з використанням аденовірусного вектора, оцінювали реакцію здригання вимірюванням преімпульсного інгібування. Результат показаний на фіг. 10; як з’ясувалося, миші з перенесеним SITH-1 мали помітно більш низьке преімпульсне інгібування, що вказує на те, що миші ставали надчутливими до стимулів. Таким чином, значну аномалію спостерігали також у реакції здригання, що вказує на те, що SITH-1 сильно впливає на функцію мозку, пов’язану з ментальними порушеннями. 5. Створення модельних мишей для ментального порушення 2 за допомогою експресії SITH1 Потім відкриту рамку зчитування SITH-1 приєднували на 3′-кінці від промотору GFAP і експресували в гліальних клітинах мишей з використанням аденовірусного вектора; через три тижні у мишей вимірювали моторну активність відносно активності на білячому колесі. Результат показаний на фіг. 11. Як показано на фіг. 11, в порівнянні з контрольними мишами, в яких експресували EGFP (посилений зелений флуоресцентний білок), експресуючі SITH-1 миші мали посилену моторну активність, і для експресуючих SITH-1 мишей показали тенденцію перебувати в маніакальному стані. 6. Створення модельних мишей для ментального порушення 3 за допомогою експресії SITH1 Потім відкриту рамку зчитування SITH-1 приєднували на 3′-кінці від промотору GFAP і експресували в гліальних клітинах мишей з використанням лентивірусного вектора; через вісім тижнів у мишей вимірювали моторну активність відносно активності на білячому колесі. Результат показаний на фіг. 12. Як показано на фіг. 12, в порівнянні з контрольними мишами, в яких експресували EGFP (посилений зелений флуоресцентний білок), експресуючі SITH-1 миші мали подавлену моторну активність, і для експресуючих SITH-1 мишей показали тенденцію перебувати в депресивному стані. Як можна бачити з фіг. 11 і 12, виявили, що той самий SITH-1 викликає два протилежні феномени, маніакальний стан і депресивний стан. Причини можуть бути наступними: 1) SITH-1, який несе аденовірусний вектор, експресується в більшій кількості, ніж коли SITH-1 несе лентивірусний вектор; 2) з іншого боку, лентивірусний вектор дозволяє експресію SITH-1 протягом більш тривалого періоду, так що спостерігали ефект тривалої експресії SITH-1. Цей факт, тобто те, що модельних мишей і для маніакального стану, і для депресивного стану можна сконструювати, експресуючи SITH-1, можна описати як одержання результату в хорошій відповідності із клінічними виявленнями, що антитіла проти SITH-1 детектирують як у пацієнтів з маніакально-депресивним захворюванням, так і у пацієнтів з депресією. 7. Діагностика з використанням SITH-1 як маркера Проводили дослідження, щоб побачити, чи може діагноз, оснований на SITH-1, бути також застосовним при діагностиці інших захворювань, ускладнених депресією. Результати показані на фіг. 13. Діагноз, оснований на антитілі проти SITH-1, є досить специфічним для афективних порушень, таких як депресія, маніакально-депресивне захворювання й синдром хронічної втоми. Однак, як показано на фіг. 13, для того ж самого діагнозу показали винятково високу позитивну частоту серед пацієнтів із хворобою Крона. Не одержали позитивних відповідей для пацієнтів з виразковим колітом, що є подібним до хвороби Крона. Однак відомо, що хвороба Крона найбільш часто ускладнюється «депресивними симптомами», і позитивні по антитілах проти SITH-1 індивідууми, показані на фіг. 13, являють собою випадки хвороби Крона, досить важкі для ускладнення депресивними симптомами. Розглянутий приклад показує, що навіть у таких серйозних випадках, коли у пацієнтів із хворобою Крона, яка являє собою хронічне захворювання, класифіковане як аутоімунне захворювання, також проявляються депресивні симптоми, депресію можна діагностувати з використанням SITH-1 як маркера. Іншими словами, тестування за допомогою антитіла проти SITH-1 можна розглядати, як таке, що є «також застосовним при діагностиці депресії, викликаної іншими, не психіатричними захворюваннями». ПРОМИСЛОВА ЗАСТОСОВНІСТЬ Як описано вище, кожний з гена й білка за даним винаходом є чинником, залученим у латентну інфекцію герпесвірусом. З використанням гена й/або білка як маркера є можливим об’єктивно визначити, чи є чи ні суб’єкт ураженим ментальним порушенням. Таким чином, даний винахід не тільки надає перевагу в галузі академічної науки й в галузі фундаментальних 24 UA 101814 C2 досліджень, але також має значення для клінічної медицини. 25 UA 101814 C2 26 UA 101814 C2 27 UA 101814 C2 28
ДивитисяДодаткова інформація
Назва патенту англійськоюFactor employed in latent herpesvirus infection and its using
Автори англійськоюKondo, Kazuhiro, Kobayashi, Nobuyuki
Назва патенту російськоюФактор, задействованный в латентной инфекции герпесвирусом, и его применение
Автори російськоюКондо Казухиро, Кобаяси Нобуюки
МПК / Мітки
МПК: C12N 1/19, C07K 14/47, C12N 1/15, C12N 15/12, G01N 33/68, C12Q 1/68, C12N 1/21
Мітки: герпесвірусом, латентну, фактор, залучений, інфекцію, застосування
Код посилання
<a href="https://ua.patents.su/46-101814-faktor-zaluchenijj-v-latentnu-infekciyu-gerpesvirusom-i-jjogo-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Фактор, залучений в латентну інфекцію герпесвірусом, і його застосування</a>
Попередній патент: Панель підлоги
Наступний патент: Способи і пристрої для керування режимом вимірювань ue у drx-режимі
Випадковий патент: Спосіб ведення виноградного куща