Пептид
Формула / Реферат
1. Пептид, або його фармацевтично прийнятна сіль, де пептид включає амінокислотну послідовність Cys Cys Glu Туr Cys Cys Asn Pro Ala Cys Thr Gly Cys Tyr, де
щонайменше одна карбоксильна група пептиду являє собою алкіловий ефір, що має формулу (-COOR), в якій R являє собою С1-6алкіл.
2. Пептид, або його фармацевтично прийнятна сіль за п. 1, де пептид включає амінокислотну структуру:

або її фармацевтично прийнятну сіль, де R' являє собою Н або С1-6алкіл і щонайменше один R' являє собою С1-6алкіл.
3. Пептид, або його фармацевтично прийнятна сіль, за п. 1, де пептид включає амінокислотну структуру:
 ,
,
де R вибраний з С1-6алкілу.
4. Пептид, або його фармацевтично прийнятна сіль, за будь-яким з пп. 1 або 3, де R являє собою С1-4алкіл, переважно метил, етил або пропіл.
5. Пептид, або його фармацевтично прийнятна сіль, за будь-яким з пп. 1, 3 або 4, де пептид включає амінокислотну структуру, вибрану з:
 ;
;
 або
або
 .
.
6. Пептид, або його фармацевтично прийнятна сіль, за п. 1, де пептид включає амінокислотну структуру:
 ,
,
де R являє собою С1-6алкіл.
7. Пептид, або його фармацевтично прийнятна сіль, за будь-яким з пп. 1 або 6, де R являє собою С1-4алкіл, переважно метил, етил або пропіл.
8. Пептид, або його фармацевтично прийнятна сіль, за будь-яким з пп. 1, 6 або 7, де пептид включає амінокислотну структуру, вибрану з:
 ;
;
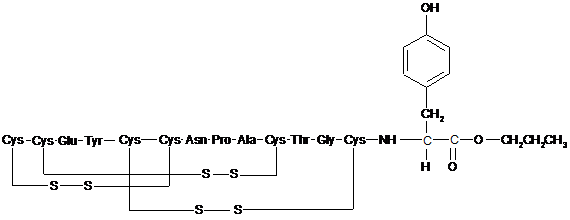
або
 .
.
9. Пептид, або його фармацевтично прийнятна сіль, де пептид включає амінокислотну структуру:
 .
.
10. Пептид, або його фармацевтично прийнятна сіль, де пептид включає амінокислотну послідовність Cys Cys Glu Tyr Cys Cys Asn Pro Ala Cys Thr Gly Cys Tyr, де щонайменше одна карбоксильна група пептиду являє собою алкіловий ефір, що має формулу (-COOR), в якій R являє собою С1-6алкіл.
11. Пептид, або його фармацевтично прийнятна сіль, за п. 10, де пептид включає амінокислотну структуру:

або її фармацевтично прийнятну сіль, де R' являє собою Н або С1-6алкіл і щонайменше один R' являє собою С1-6алкіл.
12. Пептид, або його фармацевтично прийнятна сіль, за п. 10, де пептид включає амінокислотну структуру:
 ,
,
де R являє собою С1-6алкіл.
13. Пептид, або його фармацевтично прийнятна сіль, за будь-яким з пп. 10 або 12, де R являє собою С1-4алкіл, переважно метил, етил або пропіл.
14. Пептид, або його фармацевтично прийнятна сіль, за будь-яким з пп. 10, 12 або 13, де пептид включає амінокислотну структуру, вибрану з:
 ;
;
 або
або
 .
.
15. Пептид, або його фармацевтично прийнятна сіль, за п. 10, де пептид включає амінокислотну структуру:
 ,
,
де R являє собою С1-6алкіл.
16. Пептид, або його фармацевтично прийнятна сіль, за будь-яким з пп. 10 або 15, де R являє собою С1-4алкіл, переважно метил, етил або пропіл.
17. Пептид, або його фармацевтично прийнятна сіль, за будь-яким з пп. 10, 15 або 16, де пептид включає амінокислотну структуру, вибрану з:
 ;
;
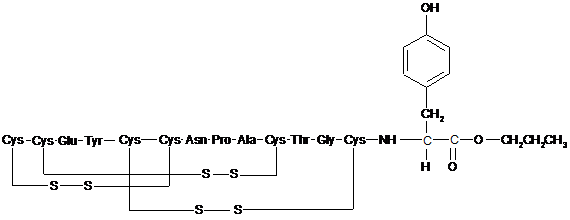
або
 .
.
18. Пептид, або його фармацевтично прийнятна сіль, де пептид включає амінокислотну структуру:
 .
.
19. Пептид, або його фармацевтично прийнятна сіль, за будь-яким з пп. 1-18, де пептид активує рецептор гуанілатциклази С.
20. Пептид, або його фармацевтично прийнятна сіль, за будь-яким з пп. 1-19, де пептид включає 30, 20 або менше амінокислот, де менше ніж п'ять амінокислот передують першому залишку Cys у амінокислотній послідовності.
21. Пептид, або його фармацевтично прийнятна сіль, за будь-яким з пп. 1-20, де вказаний пептид, або його фармацевтично прийнятна сіль, виділений або очищений.
22. Фармацевтична композиція, що містить щонайменше пептид або його фармацевтично прийнятну сіль за будь-яким з пп. 1-21.
23. Фармацевтична композиція, що містить два або декілька пептидів, вибраних з наступного:
і) пептид, або його фармацевтично прийнятна сіль, де пептид включає амінокислотну структуру:
 ;
;
іі) пептид, або його фармацевтично прийнятна сіль, де пептид включає амінокислотну структуру:
 ; і
; і
ііі) пептид, або його фармацевтично прийнятна сіль, де пептид включає амінокислотну послідовність Cys Cys Glu Tyr Cys Cys Asn Pro Ala Cys Thr Gly Cys Tyr, де щонайменше одна карбоксильна група пептиду являє собою алкіловий ефір, що має формулу (-COOR), в якій R являє собою С1-6алкіл.
24. Фармацевтична композиція, що містить лінаклотид і пептид, або його фармацевтично прийнятну сіль, де пептид включає амінокислотну структуру, вибрану з:
 ;
;

або
 ;
;
і пептид, або його фармацевтично прийнятна сіль, становить менше ніж 1 %, 2 %, 3 %, 4 %, 5 %, 6 %, 7 %, 8 %, 9 %, 10 %, 20 %, 30 %, 40 %, 50 %, 60 %, 70 %, 80 % або 90 % по масі, відносно маси лінаклотиду.
25. Фармацевтична композиція, що містить пептид або його фармацевтично прийнятну сіль, де пептид включає амінокислотну структуру:
 ,
,
і пептид складає щонайменше 90 % по масі по відношенню до маси лінаклотиду або іншого агоніста гуанілатциклази С.
26. Фармацевтична композиція, що складається, по суті, з пептиду або його фармацевтично прийнятної солі, де пептид включає амінокислотну структуру:
 .
.
27. Фармацевтична композиція за будь-яким з пп. 22-26, що додатково містить один або декілька агентів, вибраних з (і) катіона, вибраного з Mg2+, Ca2+, Zn2+, Mn2+, K+, Na+ або Аl3+, або (іі) просторово утрудненого первинного аміну.
28. Фармацевтична композиція за п. 27, де вказаний агент, який являє собою Mg2+, Ca2+, Zn2+, Mn2+, K+, Na+ або Аl3+, представлений у вигляді ацетату магнію, хлориду магнію, фосфату магнію, сульфату магнію, ацетату кальцію, хлориду кальцію, фосфату кальцію, сульфату кальцію, ацетату цинку, хлориду цинку, фосфату цинку, сульфату цинку, ацетату марганцю, хлориду марганцю, фосфату марганцю, сульфату марганцю, ацетату калію, хлориду калію, фосфату калію, сульфату калію, ацетату натрію, хлориду натрію, фосфату натрію, сульфату натрію, ацетату алюмінію, хлориду алюмінію, фосфату алюмінію або сульфату алюмінію.
29. Фармацевтична композиція за п. 28, де вказаний агент, який являє собою просторово утруднений первинний амін, який є амінокислотою, вибраною з амінокислоти, що зустрічається в природі, амінокислоти, що не зустрічається в природі, або амінокислотного похідного, і де амінокислота, що зустрічається в природі, являє собою гістидин, фенілаланін, аланін, глутамінову кислоту, аспарагінову кислоту, глутамін, лейцин, метіонін, аспарагін, тирозин, треонін, ізолейцин, триптофан або валін, або амінокислота, що не зустрічається в природі, являє собою 1-аміноциклогексанкарбонову кислоту, лантанін або теанін.
30. Фармацевтична композиція за п. 27, де просторово утруднений первинний амін має формулу:
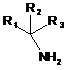 ,
,
в якій R1, R2 і R3 незалежно вибрані з: Н, С(О)ОН, С1-С6алкілу, С1-С6алкілефіру, С1-С6алкілтіоефіру, С1-С6алкілкарбонової кислоти, С1-С6алкілкарбоксиламіду і алкіларилу, де будь-яка група може бути однократно або багато разів замінена на: галоген або аміно, при умові, що не більше ніж один R1, R2 і R3 являє собою Н.
31. Фармацевтична композиція за п. 30, де просторово утруднений первинний амін являє собою циклогексиламін, 2-метилбутиламін, полімерний амін або хітозан.
32. Фармацевтична композиція за будь-яким з пп. 29-31, де вказана фармацевтична композиція додатково містить Mg2+, Ca2+, Zn2+, Mn2+, K+, Na+ або Аl3+.
33. Фармацевтична композиція за будь-яким з пп. 22-32, що додатково містить антиоксидант, де вказаним антиоксидантом є ВНА, вітамін Е або пропілгалат.
34. Фармацевтична композиція за будь-яким з пп. 22-32, що додатково містить фармацевтично прийнятну зв'язувальну речовину або допоміжну речовину, де фармацевтично прийнятна зв'язувальна речовина або допоміжна речовина вибрана з полівінілового спирту, полівінілпіролідону (повідону), крохмалю, мальтодекстрину або простого ефіру целюлози, де простий ефір целюлози вибраний з: метилцелюлози, етилцелюлози, карбоксиметилцелюлози, гідроксіетилцелюлози, гідроксіетилметилцелюлози, гідроксипропілцелюлози і гідроксипропілметилцелюлози.
35. Фармацевтична композиція за будь-яким з пп. 22-34, що додатково містить фармацевтично прийнятний наповнювач, де фармацевтично прийнятний наповнювач являє собою целюлозу, дрібноподрібнену целюлозу, мікрокристалічну целюлозу, ізомальт, манітол або двоосновний фосфат кальцію.
36. Фармацевтична композиція за будь-яким з пп. 22-35, що додатково містить додатковий терапевтичний агент, де вказаний додатковий терапевтичний агент вибраний з одного або декількох з наступного: аналгетичний засіб, антидепресант, засіб, стимулюючий моторику шлунково-кишкового тракту, або прокінетик, протиблювотний засіб, антибіотик, інгібітор протонної помпи, блокатор кислоти, інгібітор PDE5, антагоніст кислотної помпи, агоніст GABA-B, речовина, що посилює екскрецію жовчних кислот, або речовина, що захищає слизову оболонку.
37. Дозована одиниця, що містить фармацевтичну композицію за будь-яким з пп. 22-36, де вказана дозована одиниця являє собою капсулу або таблетку або містить від 5 мкг до 1 мг вказаного пептиду.
38. Фармацевтична композиція за будь-яким з пп. 22-36 для застосування при лікуванні шлунково-кишкового розладу.
39. Фармацевтична композиція за п. 38, де шлунково-кишковий розлад вибраний з групи, що складається з: синдрому подразненого кишечнику (СПК), де синдром подразненого кишечнику являє собою синдром подразненого кишечнику з переважаючими запорами (з-СПК), синдром подразненого кишечнику з переважаючою діареєю (д-СПК) або синдром подразненого кишечнику, що змінюється між двома цими типами (зм-СПК); запору, де запор є хронічним запором, ідіопатичним запором, запором в результаті післяопераційної кишкової непрохідності або обумовлений прийомом опіатів; функціонального шлунково-кишкового порушення, гастроезофагеальної рефлюксної хвороби; функціональної печії; диспепсії; вісцерального болю; парезу шлунка, де вказаний парез шлунка є ідіопатичним, діабетичним або післяопераційним парезом шлунка; хронічної псевдонепрохідності кишечнику; товстокишкової псевдонепрохідності; хвороби Крона; виразкового коліту і запального захворювання кишечнику.
40. Фармацевтична композиція за будь-яким з пп. 22-36 для застосування при посиленні перистальтики кишечнику у пацієнта.
Текст
Реферат: Винахід належить до пептиду і фармацевтичної композиції, що його містить, для лікування шлунково-кишкових розладів і станів, зокрема синдрому подразненого кишечнику (СПК). UA 108636 C2 (12) UA 108636 C2 UA 108636 C2 5 10 15 20 25 30 35 40 45 50 ГАЛУЗЬ ВИНАХОДУ Даний винахід належить до пептидів, композицій і способів лікування шлунково-кишкових розладів. ДОМАГАННЯ ПРІОРИТЕТУ У цій заявці заявляється пріоритет попередньої заявки США № 61/305465, зареєстрованої 17 лютого 2010 р. Повний зміст вищезазначеної заявки включений тут за допомогою посилання. СПИСОК ПОСЛІДОВНОСТЕЙ У цій заявці за допомогою посилання в повному його об'ємі включений список послідовностей. ПЕРЕДУМОВИ СТВОРЕННЯ ВИНАХОДУ Шлунково-кишкові розлади (GI) включають синдром подразненого кишечнику (СПК), який є поширеним хронічним захворюванням кишечнику, яке вражає від 20 до 60 мільйонів людей тільки в США (Lehman Brothers, Global Healthcare-Irritable bowel syndrome industry update, September 1999). СПК являє собою найбільш поширене захворювання, що діагностується гастроентерологами, і є причиною 12 % візитів до лікарів першої медичної допомоги (Camilleri 2001, Gastroenterology 120: 652-668). В США економічний ефект СПК оцінюється в 25 мільярдів доларів щорічно, внаслідок безпосередніх витрат застосування медичної допомоги і непрямих витрат внаслідок невиходу на робоче місце (Talley 1995, Gastroenterology 109: 1736-1741). Пацієнти з СПК в три рази частіше не виходять на робоче місце і відмічають знижену якість життя. Існує величезна незадоволена потреба в терапевтичній допомозі пацієнтам, які страждають на СПК, оскільки існує незначне число варіантів рецептурних ліків для лікування СПК. Пацієнти з СПК страждають на біль в ділянці живота і порушену активність кишечнику. Виходячи з переважаючої особливості кишечнику, були визначені три підгрупи пацієнтів з СПК: синдром подразненого кишечнику з переважаючими запорами (з-СПК), синдром подразненого кишечнику з переважаючою діареєю (д-СПК), або змінюваний синдром подразненого кишечнику між цими двома варіантами (зм-СПК). За оцінним даними, пацієнти, які страждають на з-СПК, становлять 20-50 % пацієнтів з СПК, часто згадуються 30 %. На відміну від двох інших підгруп, в яких спостерігається однаковий розподіл статей, з-СПК більш характерний для жінок (співвідношення 3:1) (Talley et al. 1995, Am J Epidemiol 142: 76-83). Визначення і діагностичні критерії СПК були приведені відповідно до формальних вимог "Римських Критеріїв" (Drossman et al. 1999, Gut 45:Suppl II: 1-81), які широко застосовні в клінічній практиці. Останнім часом спостерігається збільшення доказів ролі запалення в етіології СПК. Звіти показують, що підгрупи пацієнтів з СПК мають невелике, але значне збільшення запалення в товстому кишечнику і мастоцитах, підвищення оксиду азоту (NO) і індуцибельної синтази оксиду азоту (iNOS), і змінену експресію запальних цитокінів (огляд у Talley 2000, Medscape Coverage of DDW week). Шлунково-кишкові розлади можуть також включати запор, при якому 34 мільйони американців страждають на симптоми, пов'язані з хронічним запором (ХЗ), і 8,5 мільйонів пацієнтів звернулися за лікуванням. Пацієнти з ХЗ часто мають тверді і грудкуваті випорожнення, відчувають напруження під час дефекації, почуття неповного випорожнення і менше, ніж три акти дефекації на тиждень. Почуття дискомфорту і здуття живота при ХЗ впливають значним чином на якість життя пацієнтів внаслідок зменшення їх працездатності і можливості брати участь в типовій повсякденній активності. Половина пацієнтів з ХЗ не задоволена доступними в цей час способами лікування ХЗ. Таким чином, залишається потреба в нових сполуках і способах лікування ХЗ. У патентах США №№ 7304036 і 7371727 розкриті пептиди, які діють як агоністи рецептора гуанілат циклази С (GC-C) для лікування шлунково-кишкових розладів. Один конкретний розкритий пептид являє собою лінаклотид, який складається з наступної амінокислотної послідовності: Cys Cys Glu Tyr Cys Cys Asn Pro Ala Cys Thr Gly Cys Tyr. У цих патентах також розкриті способи отримання лінаклотиду і споріднених пептидів. Лінаклотид має наступну амінокислотну структуру: . 55 1 UA 108636 C2 5 10 15 20 25 30 35 Лінаклотид призначений для перорального застосування і в цей час застосовується в клінічних випробуваннях для лікування синдрому подразненого кишечнику із запорами (з-СПК) і хронічного запору (ХЗ), має численні ефекти на фізіологію шлунково-кишкових розладів, в тому числі: (1) ослаблення вісцерального болю, (2) зменшення здуття живота, і (3) підвищення шлунково-кишкової прохідності, що може привести до збільшення частоти випорожнень і поліпшення консистенції випорожнення. Лінаклотид, що вводиться перорально, діє місцево, активуючи GC-C на поверхні просвіту; не спостерігаються рівні лінаклотиду, що визначаються систематично, після перорального застосування терапевтичних доз. Таким чином, результати клінічних випробувань лінаклотиду, а також доклінічних випробувань, які були проведені з лінаклотидом і спорідненими пептидами, вказують на те, що пептидні агоністи GC-C можна використовувати в терапевтичних цілях. Змісти патентів США №№ 7304036 і 7371727 включені тут за допомогою посилання в повному їх об'ємі. Даний винахід описує пептиди, які можуть бути модифіковані по їх аміногрупах в похідні імідазолідинону і/або модифіковані по їх карбоксильних групах в алкілові ефіри, які здатні активувати і/або зв'язувати рецептори гуанілат циклази-С (GC-C) з різними афінностями. GC-C являє собою ключовий регулятор інтестинальної функції у ссавців, хоч низькі рівні GC-C були виявлені в інших тканинах. GC-C реагує на ендогенні гормони, гуанілін і урогуанілін, і на ентеральні бактеріальні пептиди сімейства термостійких ентеротоксинів (ST-пептид). Коли агоніст зв'язує GC-C, відбувається підвищення вторинного месенжера, циклічної GMP (c-GMP), і підвищення виділення хлориду і бікарбонату, що приводить в результаті до підвищення секреції інтестинальної рідини. У деяких прикладах даного винаходу, пептиди, описані тут, можуть продукувати підвищені рівні росту c-GMP, і забезпечувати терапевтичний вибір для лікування шлунково-кишкових розладів. КОРОТКИЙ ОПИС ВИНАХОДУ Даний винахід описує пептиди, композиції і супутні способи лікування шлунково-кишкових розладів і станів, в тому числі, але не обмежуючись ними, синдрому подразненого кишечнику (СПК), порушення моторики шлунково-кишкового тракту, запорів, функціональних порушень роботи шлунково-кишкового тракту, гастроезофагеальної рефлюксної хвороби (ГЕРХ), дуоденогастрального рефлюкса, хвороби Крона, виразкового коліту, запального захворювання кишечнику, функціональної печії, диспепсії, вісцерального болю, парезу шлунка, хронічної кишкової псевдонепрохідності (або товстокишкової псевдонепрохідності), і інших станів і захворювань, описаних тут, використовуючи пептиди і композиції, які активують рецептор гуанілатциклази С (GC-C). У одному аспекті даний винахід забезпечує пептид або його фармацевтично прийнятну сіль, де даний пептид містить амінокислотну послідовність Cys Cys Glu Tyr Cys Cys Asn Pro Ala Cys Thr Gly Cys Tyr, де щонайменше одна карбоксильна група даного пептиду є алкіловим ефіром, що має формулу (-COOR), в якій R являє собою C1-6 алкіл. У одному варіанті здійснення, даний пептид містить амінокислотну структуру: 40 , або його фармацевтично прийнятну сіль, де R' являє собою Н або C 1-6 алкіл, і щонайменше один R' являє собою C1-6 алкіл. 2 UA 108636 C2 У другому аспекті даного винаходу забезпечується пептид, який містить амінокислотну структуру: , 5 або його фармацевтично прийнятну сіль, де R являє собою C 1-6 алкіл; або пептид, який містить амінокислотну структуру: , 10 або його фармацевтично прийнятну сіль, де R являє собою C1-6 алкіл. У третьому аспекті даний винахід забезпечує пептид, або його фармацевтично прийнятну сіль, де даний пептид містить амінокислотну структуру: 3 UA 108636 C2 . 5 10 15 20 25 30 35 40 45 50 У четвертому аспекті даний винахід забезпечує фармацевтичну композицію, що містить пептид за даним винаходом. У п'ятому аспекті даний винахід забезпечує спосіб лікування шлунково-кишкового розладу, який включає застосування фармацевтичної композиції відповідно до даного винаходу. Докладні описи одного або декількох варіантів здійснення даного винаходу викладені в супровідному описі. КОРОТКИЙ ОПИС ФІГУР На Фігурі 1 представлений ефект дози ілюстративних пептидів за даним винаходом в аналізі c-GMP клітини T84. На Фігурі 2 представлений приклад аналізу ілюстративних пептидів за допомогою ОФ-ВЕРХ (RP-HPLC), де "Cys1-IMD" означає імідазолідинонове похідне лінаклотиду, модифіковане по його N-кінцевій аміногрупі. На Фігурі 3 представлене специфічне зв’язування лінаклотиду і Cys 1-IMD з рецепторами GCC клітинної поверхні на клітинах Т84 в аналізі конкурентного радіолігандного зв’язування. На Фігурі 4 зображений ефект дози ілюстративних пептидів за даним винаходом в аналізі cGMP клітини Т84. Дані фігури надані як приклад і не призначені для обмеження діапазону даного винаходу. ДОКЛАДНИЙ ОПИС ВИНАХОДУ Гуанілатциклаза С (GC-C) являє собою трансмембранний рецептор, який розташовується в апікальній поверхні епітеліальних клітин в шлунку і кишечнику. Даний рецептор має позаклітинний ліганд-зв'язувальний домен, єдину трансмембранну область і домен С-кінцевої гуанілілциклази. Коли ліганд зв'язується з позаклітинним доменом GC-C, даний внутрішньоклітинний каталітичний домен каталізує продукцію cGMP з GTP. In vivo, це підвищення внутрішньоклітинного cGMP ініціює каскад подій, що приводить до підвищеної секреції хлориду і бікарбонату в просвіт кишечнику, підвищення рН просвіту, зниженого всмоктування натрію в просвіті, підвищеної секреції рідини і прискорення кишкового транзиту. cGMP секретується двонаправлено з епітелію в слизову і просвіт. Пептиди і композиції за даним винаходом зв'язуються з інтестинальним рецептором GC-C, який являє собою регулятор балансу рідини і електролітів в кишечнику. При деяких обставинах може бути бажане лікування пацієнтів за допомогою варіанту, або модифікованого пептиду, який зв'язує і активує інтестинальні рецептори GC-C, але є менш активним, або більш активним, ніж неваріантна форма пептиду. Знижена активність може бути результатом зниженої афінності до даного рецептору, або зниженої здатності активувати даний рецептор після зв’язування, або зниженої стабільності даного пептиду. Підвищена активність може бути результатом підвищеної афінності до даного рецептору, або підвищеної здатності активувати даний рецептор після зв’язування, або підвищеної стабільності даного пептиду. ОПИС ІЛЮСТРАТИВНИХ ПЕПТИДІВ У різних варіантах здійснення пептид може бути модифікований таким чином, що щонайменше одна карбоксильна група амінокислотного залишку даного пептиду модифікована в алкіловий ефір. Ця модифікація може бути здійснена, наприклад, за допомогою обробки карбонової кислоти спиртом в присутності дегідратуючої речовини, де дана дегідратуюча речовина може включати, але не обмежуючись цим, сильну кислоту, таку як сірчана кислота. Інші способи отримання алкілових ефірів з карбоксильних груп відомі фахівцеві в даній галузі, і передбачені тут. Використовувана тут карбоксильна група має формулу: (-COOH). Використовуваний тут термін "алкіл" стосується насиченого лінійного або з розгалуженим ланцюгом моновалентного вуглеводневого радикала. Як використовується тут, група є кінцевою або конечною, коли дана група присутня на кінці даної амінокислотної послідовності. 4 UA 108636 C2 Як використовується тут, аміногрупа в пептиді має формулу: , 5 де R2 являє собою залишок даного пептиду. Як використовується тут, іміногрупа в пептиді має формулу: , 10 15 20 де R2 являє собою залишок даного пептиду. У деяких варіантах здійснення, карбонова кислота бічного ланцюга глутамінової амінокислоти в пептидній послідовності модифікована в алкіловий ефір. У наступних варіантах здійснення, дана карбонова кислота в бічному ланцюгу глутамінової амінокислоти пептидної послідовності модифікована в етиловий ефір. У інших варіантах здійснення, С-кінцева карбонова кислота амінокислоти тирозин в пептидній послідовності модифікована в алкіловий ефір. У наступних варіантах здійснення, С-кінцева карбонова кислота амінокислоти тирозин в пептидній послідовності модифікована в етиловий ефір. У декількох варіантах здійснення, даний винахід забезпечує пептид, або його фармацевтично прийнятну сіль, де даний пептид складається з амінокислотної послідовності Cys Cys Glu Tyr Cys Cys Asn Pro Ala Cys Thr Gly Cys Tyr, де щонайменше одна карбоксильна група даного пептиду являє собою алкіловий ефір, що має формулу (-COOR), в якій R являє собою C1-6 алкіл. У декількох варіантах здійснення даний пептид містить амінокислотну структуру: 25 30 або його фармацевтично прийнятну сіль, де R' являє собою Н або C 1-6 алкіл, і щонайменше один R' являє собою C1-6 алкіл. У деяких варіантах здійснення даний пептид, або його фармацевтично прийнятна сіль, містить пептид, що має амінокислотну структуру: 5 UA 108636 C2 , 5 де R являє собою С1-6 алкіл ("Glu3-алкіловий ефір"). У інших варіантах здійснення R являє собою C 1-4 алкіл. У наступних варіантах здійснення R являє собою метил, етил або пропіл. У деяких варіантах здійснення даний пептид, або його фармацевтично прийнятна сіль, містить амінокислотну структуру ("Glu3-етиловий ефір"): . 10 У деяких варіантах здійснення даний пептид, або його фармацевтично прийнятна сіль, містить амінокислотну структуру: 6 UA 108636 C2 . У деяких варіантах здійснення даний пептид, або його фармацевтично прийнятна сіль, містить амінокислотну структуру: 5 . 10 У деяких варіантах здійснення відсутній С-кінцевий тирозин Glu3-алкілового ефіру або фармацевтично прийнятної солі. У деяких варіантах здійснення даний пептид, або його фармацевтично прийнятна сіль, містить амінокислотну структуру: 7 UA 108636 C2 , 5 де R являє собою C1-6 алкіл. У деяких варіантах здійснення R являє собою C1-4 алкіл. У наступних варіантах здійснення R являє собою метил, етил або пропіл. У деяких варіантах здійснення даний пептид, або його фармацевтично прийнятна сіль, містить амінокислотну структуру ("Tyr14-етиловий ефір"): . 10 У деяких варіантах здійснення даний пептид, або його фармацевтично прийнятна сіль, містить амінокислотну структуру: 8 UA 108636 C2 . У деяких варіантах здійснення даний пептид, або його фармацевтично прийнятна сіль, містить амінокислотну структуру: 5 . 10 15 20 25 Без обмеження якою-небудь теорією, пептид може бути модифікований, при цьому щонайменше одна аміногрупа амінокислотних залишків даного пептиду модифікована до іміну. Ця модифікація може бути здійснена, наприклад, за допомогою обробки аміногрупи карбонілом, таким як альдегід або кетон, в присутності кислотного каталізатора. Інші способи отримання імінів з аміногруп добре відомі фахівцеві в даній галузі, і передбачені тут. У деяких варіантах здійснення дана імінна модифікація може бути здійснена в результаті опосередкованої формальдегідом реакції в присутності кислотного каталізатора. У наступних варіантах здійснення імінний вуглець може бути поперечно зв'язаний з іншою аміногрупою даного пептиду. У інших варіантах здійснення пептид може бути модифікований в імін в α-аміногрупі Nкінцевої амінокислоти, де вуглець іміну перехресно зв'язаний з аміногрупою другого амінокислотного залишку пептиду, формуючи п’ятичленне кільце. У інших варіантах здійснення пептид, що містить амінокислотну послідовність Cys Cys Glu Tyr Cys Cys Asn Pro Ala Cys Thr Gly Cys Tyr, може бути модифікований за допомогою додавання метилену до α-аміногрупи N-кінцевого Cys1, який перехресно зв'язаний з аміногрупою Cys2 для формування п’ятичленного кільця імідазолідинону на N-кінці даного пептиду ("Cys1-IMD"). У одному аспекті даний винахід забезпечує нові пептидні агоністи GC-C, придатні для лікування шлунково-кишкових розладів. У деяких варіантах здійснення даний винахід забезпечує пептид, або його фармацевтично прийнятну сіль, де даний пептид містить амінокислотну послідовність Cys Cys Glu Tyr Cys Cys 9 UA 108636 C2 Asn Pro Ala Cys Thr Gly Cys Tyr, де щонайменше одна аміногрупа даного пептиду являє собою імін, що має формулу , де R2 являє собою залишок даного пептиду. У деяких варіантах здійснення даний пептид або його фармацевтично прийнятна сіль, включає пептид, в якому N-кінцева аміногрупа даного пептиду являє собою імін, що має 5 формулу , де R2 являє собою залишок даного пептиду. У наступних варіантах здійснення даний пептид, або його фармацевтично прийнятна сіль, включає амінокислотну структуру: . 10 У декількох варіантах здійснення даний пептид або його фармацевтично прийнятна сіль, включає амінокислотну структуру: . 15 20 25 У деяких варіантах здійснення відсутній даний С-кінцевий тирозин пептиду Cys1-IMD або його фармацевтично прийнятної солі. У деяких варіантах здійснення даний пептид Cys 1-IMD, або його фармацевтично прийнятна сіль, додатково включає одну або декілька пептидних модифікацій, де щонайменше одна карбоксильна група даного пептиду являє собою алкіловий ефір, що має формулу (-COOR), в якій R являє собою C1-6 алкіл. У деяких варіантах здійснення даний винахід забезпечує пептид, або його фармацевтично прийнятну сіль, де даний пептид включає амінокислотну послідовність Cys Cys Glu Tyr Cys Cys Asn Pro Ala Cys Thr Gly Cys Tyr, в якій щонайменше одна карбоксильна група даного пептиду являє собою алкіловий ефір, що має формулу (-COOR), в якій R являє собою C1-6 алкіл. У декількох варіантах здійснення даний пептид включає амінокислотну структуру: 10 UA 108636 C2 або його фарамцевтично придатну сіль, де R' являє собою Н або C 1-6 алкіл, і щонайменше один R' являє собою C1-6 алкіл. У деяких варіантах здійснення даний пептид, або його фармацевтично прийнятна сіль, включає амінокислотну структуру: 5 , 10 в якій R являє собою C1-6 алкіл. У наступних варіантах здійснення С-кінцевий тирозин відсутній. У інших варіантах здійснення R являє собою C 1-4 алкіл. У інших варіантах здійснення R являє собою метил, етил або пропіл. У деяких варіантах здійснення даний пептид, або його фармацевтично прийнятна сіль, включає пептид, що має амінокислотну структуру: . 15 У деяких варіантах здійснення даний пептид, або його фармацевтично прийнятна сіль, включає пептид, що має амінокислотну структуру: 11 UA 108636 C2 . У деяких варіантах здійснення даний пептид, або його фармацевтично прийнятна сіль, включає пептид, що має амінокислотну структуру: 5 . У деяких варіантах здійснення даний пептид, або його фармацевтично прийнятна сіль, включає пептид, що має амінокислотну структуру: 10 12 UA 108636 C2 , 5 де R являє собою C1-6 алкіл. У інших варіантах здійснення R являє собою C 1-4 алкіл. У інших варіантах здійснення R являє собою метил, етил або пропіл. У деяких варіантах здійснення даний пептид, або його фармацевтично прийнятна сіль, включає амінокислотну структуру: . 10 У деяких варіантах здійснення даний пептид, або його фармацевтично прийнятна сіль, включає амінокислотну структуру: 13 UA 108636 C2 . У деяких варіантах здійснення даний пептид, або його фармацевтично прийнятна сіль, включає амінокислотну структуру: 5 . 10 У декількох варіантах здійснення даний винахід забезпечує пептид, або його фармацевтично прийнятну сіль, де даний пептид включає амінокислотну послідовність Cys Cys Glu Tyr Cys Cys Asn Pro Ala Cys Thr Gly Cys Tyr, де щонайменше одна аміногрупа даного пептиду являє собою імін, що має формулу: , 15 в якій R2 являє собою залишок даного пептиду. У деяких варіантах здійснення даний пептид, або його фармацевтично прийнятна сіль, включає пептид, в якому N-кінцева аміногрупа даного пептиду являє собою імін, що має формулу: , 20 14 UA 108636 C2 де R2 являє собою залишок даного пептиду. У наступних варіантах здійснення даний пептид, або його фармацевтично прийнятна сіль, включає амінокислотну структуру: . 5 У деяких варіантах здійснення даний пептид, або його фармацевтично прийнятна сіль, включає амінокислотну структуру: . 10 15 20 25 30 35 40 45 У деяких варіантах здійснення відсутній С-кінцевий тирозин даного пептиду Cys1-IMD або його фармацевтично прийнятної солі. У деяких варіантах здійснення даний пептид Cys 1-IMD, або його фармацевтично прийнятна сіль, додатково включає одну або декілька пептидних модифікацій, наприклад, де щонайменше одна карбоксильна група даного пептиду являє собою алкіловий ефір, що має формулу (-COOR), де R являє собою C1-6 алкіл. У деяких варіантах здійснення даний пептид, або його фармацевтично прийнятна сіль, активує рецептор гуанілатциклази С. У інших варіантах здійснення даний пептид, або його фармацевтично прийнятна сіль, містить 30 або менше амінокислот. У наступних варіантах здійснення даний пептид, або його фармацевтично прийнятна сіль, містить 20 або менше амінокислот. У інших варіантах здійснення даний пептид, або його фармацевтично прийнятна сіль, включає пептид, в якому менше п'яти амінокислот передують першому залишку Cys в даній амінокислотній послідовності. У деяких варіантах здійснення даний пептид, або його фармацевтично прийнятна сіль, ізольований. У інших варіантах здійснення даний пептид, або його фармацевтично прийнятна сіль, очищений. У деяких варіантах здійснення забезпечена фармацевтично прийнятна сіль даного пептиду. У деяких випадках дана фармацевтично прийнятна сіль являє собою хлористу сіль. ВАРІАНТНІ АБО МОДИФІКОВАНІ ПЕПТИДИ У різних варіантах здійснення даний пептид включає два Cys, що утворюють один сульфідний зв'язок, даний пептид включає чотири Cys, що утворюють два дисульфідні зв'язки або даний пептид включає шість Cys, що утворюють три дисульфідні зв'язки. У деяких пептидах один або обидва члени однієї або обох пар залишків Cys, які звичайно утворюють дисульфідний зв'язок, можуть бути заміщені на гомоцистеїн, пеніциламін, 3меркоптопролін (Kolodziej et al. 1996 IntJ Pept Protein Res 48: 274); β,β диметилцистеїн (Hunt et al. 1993 Int J Pept Protein Res 42: 249) або діамінопропіонову кислоту (Smith et al. 1978 JMed Chem 21: 117) для утворення альтернативних внутрішніх поперечних зв'язків в місцях звичайних дисульфідних зв'язків. У інших варіантах здійснення дані дисульфідні зв'язки можуть бути замінені на вуглеводневе поперечне зв’язування (Schafmeister et al. 2000 J Am Chem Soc 122: 5891, Patgiri et al. 2008 Асс Chem Res 41: 1289, Henchey et al. 2008 Curr Opin Chem Biol 12: 692). ОТРИМАННЯ ПЕПТИДІВ У одному варіанті здійснення пептиди, або попередні пептиди за даним винаходом, можуть бути отримані рекомбінантними способами за допомогою будь-якої відомої системи, яка експресує білок, в тому числі, без обмеження, бактеріальної (наприклад, Е. coli або Bacillus 15 UA 108636 C2 5 10 15 20 25 30 35 40 45 50 55 60 subtilis), систем клітин комах (наприклад, системи клітин Sf9 Drosophila), систем дріжджових клітин (наприклад, S. cerevisiae, S. saccharomyces) або експресуючих систем міцеліальних грибів, або експресуючих систем клітин тварин (наприклад, експресуючі системи клітин ссавців). Пептиди або попередні пептиди за даним винаходом також можуть бути хімічно синтезовані. Якщо даний пептид, або варіантний пептид, повинен бути отриманий рекомбінантно, наприклад, Е. coli, дана молекула нуклеїнової кислоти, що кодує даний пептид, також може кодувати лідерну послідовність, яка робить можливою секрецію даного зрілого пептиду даною клітиною. Таким чином, дана послідовність, що кодує даний пептид, може включати передпослідовність і пропослідовність, наприклад, бактеріального пептиду ST, що зустрічається в природі. Секретований зрілий пептид може бути очищений від культурального середовища. Послідовність, що кодує описаний тут пептид, може бути вбудована у вектор, здатний доставляти і підтримувати молекулу даної нуклеїнової кислоти в бактеріальній клітині. Дана молекула ДНК може бути вбудована у вектор, який автономно реплікується (відповідні вектори включають, наприклад, pGEM3Z і pcDNA3, і їх похідні). Дана векторна нуклеїнова кислота може бути бактеріальною або ДНК бактеріофага, такого як бактеріофаг лямда або М13, або їх похідні. За конструкцією вектора, що містить описану тут нуклеїнову кислоту, може піти трансформація клітини-хазяя, наприклад, бактеріальної. Прийнятні бактеріальні хазяї включають, але не обмежуються ними, Е. coli, В. subtilis, Pseudomonas і Salmonella. Дана генетична конструкція також включає, в доповнення до даної кодуючої молекули нуклеїнової кислоти, елементи, які роблять можливою експресію, такі як промотор і регуляторні послідовності. Експресуючі вектори можуть містити послідовності транскрипційного контролю, які контролюють ініціацію транскрипції, такі як послідовності промотору, енхансера, оператора і репресора. Множина послідовностей транскрипційного контролю добре відома фахівцеві в даній галузі. Даний експресуючий вектор також може включати послідовності, які регулюють трансляцію (наприклад, нетрансльована 5'-послідовність, нетрансльована 3'-послідовність, або ділянка внутрішньої посадки рибосоми). Даний вектор може бути здатний до автономної реплікації, або він може бути інтегрований в ДНК хазяя для забезпечення стабільності під час виробництва пептиду. Дана послідовність, що кодує білок, яка включає описаний тут пептид, може бути також злита з нуклеїновою кислотою, яка кодує афінну мітку пептиду, наприклад, глутатіон Sтрансферазу (GST), мальтоза Е-зв'язувальний білок, протеїн А, мітку FLAG, гекса-гістидин, мітку myc або мітку грипу НА, для полегшення очищення. Дана афінна мітка, або репортерне злиття, з'єднує рамку зчитування пептиду, який представляє інтерес, з рамкою зчитування гена, що кодує дану мітку афінності, таким чином, що утворюється трансляційне злиття. Експресія даного злитого гена в результаті приводить до трансляції єдиного пептиду, який включає і даний пептид, який представляє інтерес, і дану мітку афінності. У деяких випадках, коли використовуються мітки афінності, послідовність ДНК, що кодує ділянку розпізнавання протеази, буде злита між рамками зчитування для даної мітки афінності і даного пептиду, який представляє інтерес. Генетичні конструкція і способи, прийнятні для виробництва незрілих і зрілих форм пептидів і варіантів, описаних тут, в системах, які експресують білок, які не є бактеріальними, і добре відомих фахівцеві в даній галузі, також можна використовувати для виробництва пептидів в біологічній системі. У інших варіантах здійснення, пептиди, які містять амінокислоти звичайно не вбудовані за допомогою трансляційний апарату і описані вище (наприклад, β-карбоксилований Asp, γкарбоксилований Glu, Asu, Aad і Apm), можуть бути отримані рекомбінантно за допомогою методів модифікацій тРНК. Способи модифікації тРНК що включають, але що не обмежуються ними, модифікацію анти-кодона, ділянки прикріплення амінокислоти, і/або акцепторного стовбура, для забезпечення інкорпорування неприродних і/або випадкових амінокислот, відомі в даній галузі (Biochem. Biophys. Res. Comm. (2008) 372: 480-485; Chem. Biol. (2009) 16: 323-36; Nat. Methods (2007) 4: 239-44; Nat. Rev. Mol. Cell Biol. (2006) 7: 775-82; Methods (2005) 36: 227238; Methods (2005) 36: 270-278; Annu. Rev. Biochem. (2004) 73: 147-176; Nuc. Acids Res. (2004) 32: 6200-6211; Proc. Natl. Acad. Sci. USA (2003) 100: 6353-6357; Royal Soc. Chem. (2004) 33: 422430). У деяких варіантах здійснення пептиди можуть бути отримані хімічним способом. Пептиди можуть бути синтезовані за допомогою цілого ряду різних способів, що включають синтез на рідкій і твердій фазі, з використанням традиційного BOC або FMOC захисту. Наприклад, даний пептид може бути синтезований на 2-хлортритил або Wang смолі з використанням послідовного зв’язування амінокислот. Наступні захисні групи можуть бути використані: фторенілметилоксикарбонил або трет-бутилоксикарбоніл (альфа аміногрупи, N-кінець); тритил 16 UA 108636 C2 5 10 15 20 25 або трет-бутил (тіолові групи Cys); трет-бутил (γ-карбоксил глутамінової кислоти і гідроксильна група треоніну, якщо присутня); і тритил (β-амідна функціональна група бічного ланцюга аспарагіну і фенольна група тирозину, якщо присутня). Сполука може бути здійснена з DIC і HOBt в присутності третинного аміну, і даний пептид може бути позбавлений захисту і вирізаний з твердої підкладки з використанням коктейлю К (трифтороцтова кислота 81 %, фенол 5 %, тіоанізол 5 %, 1,2-етандитіол 2,5 %, вода 3 %, диметилсульфід 2 %, йодид амонію 1,5 % ваг/ваг). Після видалення трифтороцтової кислоти і інших летких компонентів, даний пептид може бути осаджений з використанням органічного розчинника. Дисульфідні зв'язки між залишками Cys можуть бути утворені з використанням диметилсульфоксиду (Tam et al. (1991) J. Am. Chem. Soc. 113: 6657-62), або використовуючи стратегію окислення киснем повітря. Отриманий пептид може бути очищений за допомогою хроматографії із оберненою фазою, і ліофілізований. Ці пептиди можуть бути вироблені, виділені або використані або у вигляді основи, або у вигляді їх фармацевтично прийнятних солей. Приклади солей включають, без обмеження, ацетатні, хлористі, сульфатні або фосфатні солі даного пептиду. КОМПОЗИЦІЇ ПЕПТИДІВ І АГОНІСТІВ РЕЦЕПТОРА GC-C У іншому аспекті забезпечені фармацевтичні композиції, в яких пептиди, самі по собі або в сполученні, можуть бути скомбіновані з фармацевтично прийнятним носієм або середовищем. У декількох варіантах здійснення фармацевтична композиція містить пептид, або його фармацевтично прийнятну сіль, як описано тут. Дана фармацевтична композиція може містити два або декілька пептидів, або їх фармацевтично прийнятних солей, описаних тут. У деяких варіантах здійснення дана фармацевтична композиція містить два або декілька пептидів, вибраних з: i. пептиду, або його фармацевтично прийнятної солі, де даний пептид містить амінокислотну структуру: ; 30 ii. пептиду, або його фармацевтично прийнятної солі, де даний пептид містить амінокислотну структуру: ;і 35 iii. пептиду, або його фармацевтично прийнятної солі, де даний пептид містить амінокислотну послідовність Cys Cys Glu Tyr Cys Cys Asn Pro Ala Cys Thr Gly Cys Tyr, в якій щонайменше одна карбоксильна група являє собою алкіловий ефір, що має формулу (-COOR), де R являє собою C1-6 алкіл. У інших варіантах здійснення дана фармацевтична композиція містить лінаклотид і пептид, або його фармацевтично прийнятну сіль, де даний пептид містить амінокислотну структуру: 40 17 UA 108636 C2 ; 5 і даний пептид, або його фармацевтично прийнятна сіль, складає менше ніж 10 %, 20 %, 30 %, 40 %, 50 %, 60 %, 70 %, 80 %, або 90 % по масі, в порівнянні з масою лінаклотиду. У наступних варіантах здійснення, дана фармацевтична композиція містить лінаклотид і пептид, або його фармацевтично прийнятну сіль, де даний пептид містить амінокислотну структуру: ; 10 15 20 і даний пептид, або його фармацевтично прийнятна сіль, складає менше ніж 9 %, 8 %, 7 %, 6 %, 5 %, 4 %, 3 %, 2 %, або 1 % по масі, в порівнянні з масою лінаклотиду. У деяких варіантах здійснення дане імідазолидинонове похідне лінаклотиду складає менше ніж приблизно 15 % по масі даної композиції, менше ніж приблизно 10 % по масі даної композиції, менше ніж приблизно 7 % по масі даної композиції, менше ніж приблизно 5 % по масі даної композиції. У інших ілюстративних варіантах здійснення, дане імідазолідинонове похідне лінаклотиду складає від приблизно 0,01 % до приблизно 15 % по масі даної композиції, від приблизно 0,05 % до приблизно 10 % по масі даної композиції, від приблизно 0,07 % до приблизно 7 % по масі даної композиції, від приблизно 0,05 % до приблизно 5 % по масі даної композиції. У інших варіантах здійснення дана фармацевтична композиція містить лінаклотид і пептид, або його фармацевтично прийнятну сіль, де даний пептид містить амінокислотну структуру: ; 25 18 UA 108636 C2 5 і даний пептид, або його фармацевтично прийнятна сіль, складає менше ніж 10 %, 20 %, 30 %, 40 %, 50 %, 60 %, 70 %, 80 %, або 90 % по масі, в порівнянні з масою лінаклотиду. У наступних варіантах здійснення, дана фармацевтична композиція містить лінаклотид і пептид, або його фармацевтично прийнятну сіль, де даний пептид містить амінокислотну структуру: ; 10 15 і даний пептид, або його фармацевтично прийнятна сіль, складає менше ніж 9 %, 8 %, 7 %, 6 %, 5 %, 4 %, 3 %, 2 %, або 1 % по масі, в порівнянні з масою лінаклотиду. У деяких варіантах здійснення, пептид Tyr14-етиловий ефір складає менше ніж приблизно 15 % по масі даної композиції, менше ніж приблизно 10 % по масі даної композиції, менше ніж приблизно 7 % по масі даної композиції, менше ніж приблизно 5 % по масі даної композиції. У інших ілюстративних варіантах здійснення, пептид Tyr 14-етиловий ефір складає від приблизно 0,01 % до приблизно 15 % по масі даної композиції, від приблизно 0,05 % до приблизно 10 % по масі даної композиції, від приблизно 0,07 % до приблизно 7 % по масі даної композиції, від приблизно 0,05 % до приблизно 5 % по масі даної композиції. У інших варіантах здійснення дана фармацевтична композиція містить лінаклотид і пептид, або його фармацевтично прийнятну сіль, де даний пептид містить амінокислотну структуру: 20 ; 19 UA 108636 C2 5 і даний пептид, або його фармацевтично прийнятна сіль, складає менше ніж 10 %, 20 %, 30 %, 40 %, 50 %, 60 %, 70 %, 80 %, або 90 % по масі, в порівнянні з масою лінаклотиду. У наступних варіантах здійснення, дана фармацевтична композиція містить лінаклотид і пептид, або його фармацевтично прийнятну сіль, де даний пептид містить амінокислотну структуру: ; 10 15 20 і даний пептид, або його фармацевтично прийнятна сіль, складає менше ніж 9 %, 8 %, 7 %, 6 %, 5 %, 4 %, 3 %, 2 %, або 1 % по масі, в порівнянні з масою лінаклотиду. У деяких варіантах здійснення пептид Glu3-етиловий ефір складає менше ніж приблизно 15 % по масі даної композиції, менше ніж приблизно 10 % по масі даної композиції, менше ніж приблизно 7 % по масі даної композиції, менше ніж приблизно 5 % по масі даної композиції. У інших ілюстративних варіантах здійснення, пептид Glu3-етиловий ефір складає від приблизно 0,01 % до приблизно 15 % по масі даної композиції, від приблизно 0,05 % до приблизно 10 % по масі даної композиції, від приблизно 0,07 % до приблизно 7 % по масі даної композиції, від приблизно 0,05 % до приблизно 5 % по масі даної композиції. У деяких варіантах здійснення, дана фармацевтична композиція містить лінаклотид і пептид, або його фармацевтично прийнятну сіль, де даний пептид містить амінокислотну структуру: . 25 У інших варіантах здійснення, дана фармацевтична композиція містить лінаклотид і пептид, або його фармацевтично прийнятну сіль, де даний пептид містить амінокислотну структуру: 20 UA 108636 C2 . 5 10 15 20 25 30 35 40 45 50 Використовуваний тут термін "яка складається переважно з", і його варіанти, коли використовується відносно композиції, означає, що дана композиція включає єдиний активний пептид і інші необхідні фармацевтично неактивні допоміжні речовини, наповнювачі і/або компоненти (наприклад, полімери, просторово утруднені первинні аміни, катіони, наповнювачі, зв'язувальні речовини, носії, ексципієнти, розріджувачі, речовини для поліпшення розпадання таблеток, мастильні речовини, розчинники, дисперсанти, що покривають добавки, добавки, які промотують абсорбцію, добавки з контрольованим вивільненням, антигрудкувачі, протимікробні добавки, консерванти, підлуговувальні добавки, забарвлювальні речовини, смакоароматичні добавки, осушувальні речовини, пластифікуючі добавки, барвники і тому подібне), і немає іншого активного фармацевтичного інгредієнта (інгредієнтів). Пептиди, описані тут, можуть бути скомбіновані з будь-яким фармацевтично допустимим носієм або середовищем, наприклад, розчинниками, дисперсантами, покривними речовинами, агентами, які промотують абсорбцію, агентами з контрольованим вивільненням, і одним або декількома ексципієнтами (які включають крохмаль, поліоли, гранулюючі агенти, мікрокристалічну целюлозу (наприклад, Celphere beads®), розріджувачі, мастильні речовини, зв'язувальні речовини, речовини для поліпшення розпадання таблеток, і тому подібне), і тому подібне. При необхідності, на таблетовану лікарську форму може бути нанесене покриття за допомогою стандартних водних або неводних технологій. Приклади ексципієнтів для використання як фармацевтично прийнятні інертні носії і вищезазначені додаткові інгредієнти, включають, але не обмежуються зв'язувальними речовинами, наповнювачами, речовинами для поліпшення розпадання таблеток, мастильними речовинами, протимікробними речовинами і покривними речовинами. Використовуваний тут термін "зв’язувальна речовина" стосується будь-якої фармацевтично прийнятної зв’язувальної речовини, яка може бути використана при здійсненні даного винаходу. Приклади фармацевтично прийнятних зв’язувальних речовин включають, без обмеження, крохмаль (наприклад, кукурудзяний крохмаль, картопляний крохмаль і прежелатинізований крохмаль (наприклад, STARCH 1500® і STARCH 1500 LM®, що реалізовується компанією Colorcon, Ltd.) і інший крохмаль), мальтодекстрин, желатин, природні і синтетичні камеді, такі як камедь з акації, подрібнена трагакантова камедь, гуарова камедь, целюлоза і її похідні (наприклад, метилцелюлоза, гідроксіетилцелюлоза, гідроксіетилметилцелюлоза, гідроксипропілцелюлоза і гідроксипропілметилцелюлоза (гіпромелоза), етилцелюлоза, ацетатцелюлоза, кальцієва карбоксиметилцелюлоза, натрієва карбоксиметилцелюлоза, карбоксиметилцелюлоза, мікрокристалічна целюлоза (наприклад, AVICEL™, така як, AVICELPH-101™, -103™ і -105™, що реалізовується компанією FMC Corporation, Marcus Hook, PA, USA)), полівініловий спирт, полівінілпіролідон (наприклад, полівінілпіролідон K30), і їх суміші. Використовуваний тут термін "наповнювач" означає будь-який фармацевтично прийнятний наповнювач, який може бути використаний при здійсненні даного винаходу. Приклади фармацевтично прийнятних наповнювачів включають, без обмеження, тальк, карбонат кальцію (наприклад, гранули або порошок), двоосновний фосфат кальцію, триосновний фосфат кальцію, сульфат кальцію (наприклад, гранули або порошок), мікрокристалічну целюлозу (наприклад, Avicel PH101 або Celphere CP-305), порошкоподібну целюлозу, декстрани, каолін, маніт, кременеву кислоту, сорбіт, крохмаль (наприклад, STARCH 1500), прежелатинізований крохмаль, лактозу, глюкозу, фруктозу, галактозу, трегалозу, сахарозу, мальтозу, ізомальт, рафінозу, мальтит, мелецитозу, стахіозу, лактит, палатиніт, ксиліт, міоінозит і їх суміші. Приклади фармацевтично прийнятних наповнювачів, які можуть бути зокрема використані для покриття даних пептидів, включають, без обмеження, тальк, мікрокристалічну целюлозу (наприклад, Avicel PH101 або Celphere CP-305), порошкоподібну целюлозу, декстрани, каолін, маніт, кременеву кислоту, сорбіт, крохмаль, прежелатинізований крохмаль, лактозу, глюкозу, фруктозу, галактозу, трегалозу, сахарозу, мальтозу, ізомальт, двоосновний фосфат кальцію, рафінозу, мальтит, мелецитозу, стахіозу, лактит, палатиніт, ксиліт, маніт, міоінозит, і їх суміші. 21 UA 108636 C2 5 10 15 20 25 30 35 40 45 50 55 60 Використовуваний тут термін "допоміжні речовини" стосується будь-якої фармацевтично прийнятної допоміжної речовини. Фармацевтично прийнятні допоміжні речовини включають, без обмеження, речовини для полегшення розпадання таблеток, диспергуючі речовини, мастильні речовини, гліданти, антиоксиданти, покривні речовини, розріджувачі, поверхнево-активні речовини, смакові добавки, зволожувальні речовини, добавки, які промотують абсорбцію, добавки з контрольованим вивільненням, антигрудкувачі, протимікробні речовини (наприклад, консерванти), забарвлювальні речовини, зневоднювальні речовини, пластифікатори і барвники. Використовуваний тут термін "наповнювач" являє собою будь-яку фармацевтично прийнятну допоміжну речовину, наповнювач, зв'язувальну речовину або агент. Композиції за даним винаходом також, при бажанні, можуть включати терапевтичні інгредієнти, антигрудкувачі, консерванти, підлуговувальні речовини, забарвлювальні речовини, смакові добавки, зневоднювальні речовини, пластифікатори, барвники, гліданти, антиадгезиви, засоби, що знижують статичний заряд, поверхнево-активні речовини (змочувальні речовини), антиоксиданти, плінкоутворювачі, і тому подібне. Будь-який такий необов'язковий інгредієнт повинен бути сумісним зі сполукою, описаною тут, для забезпечення стабільності даної композиції. Дана композиція може включати інші допоміжні речовини, якщо необхідно, в тому числі, наприклад, лактозу, глюкозу, фруктозу, галактозу, трегалозу, сахарозу, мальтозу, рафінозу, мальтит, мелецитозу, стахіозу, лактит, палатиніт, крохмаль, ксиліт, маніт, міоінозит, і тому подібне, і їх гідрооксиди, і амінокислоти, наприклад, аланін, гліцин і бетаїн, і пептиди і білки, наприклад, альбумін. Дані композиції можуть включати, наприклад, різні додаткові розчинники, дисперсанти, покривні речовини, добавки, які промотують абсорбцію, добавки з контрольованим вивільненням, і одну або декілька інертних допоміжних речовин (які включають, наприклад, крохмаль, поліоли, гранулюючі речовини, мікрокристалічну целюлозу, розріджувачі, мастильні речовини, зв’язувальні речовини, речовини для полегшення розпадання таблеток, і тому подібне), і інше. При бажанні, на таблетовані лікарські форми даних розкритих композицій можуть бути нанесені покриття, з використанням стандартних водних і неводних технологій. Композиції також можуть містити, наприклад, антигрудкувачі, консерванти, підлуговувальні речовини, забарвлювальні речовини, смакові добавки, зневоднювальні речовини, пластифікатори, барвники, і тому подібне. Прийнятні речовини для полегшення розпадання таблеток включають, наприклад, агарагар, карбонат кальцію, мікрокристалічну целюлозу, кроскармелозу натрію, кросповідон, повідон, полакрилін калію, натрієву сіль карбоксиметилкрохмалю, картопляний або маніоковий крохмаль, інший крохмаль, прежелатинізований крохмаль, глини, інші альгіни, інші целюлози, камеді, і їх суміші. Прийнятні мастильні речовини включають, наприклад, стеарат кальцію, стеарат магнію, мінеральне масло, очищене мінеральне масло, гліцерин, сорбіт, маніт, поліетиленгліколь, інші гліколі, стеаринову кислоту, лаурилсульфат натрію, тальк, гідрогенізовану рослинну олію (наприклад, арахісову олію, бавовняну олію, соняшникову олію, кунжутну олію, оливкову олію, кукурудзяну олію і олію з соєвих бобів), стеарат цинку, етилолеат, етиллаурат, агар, силоїдний силікагель (AEROSIL 200, W.R. Grace Co., Baltimore, MD USA), коагульований аерозоль синтетичного діоксиду кремнію (Evonik Degussa Co., Plano, TX USA), пірогенний діоксид кремнію (CAB-O-SIL, Cabot Co., Boston, MA USA), і їх суміші. Прийнятні гліданти включають, наприклад, лейцин, колоїдний діоксид кремнію, трисилікат магнію, порошкоподібну целюлозу, крохмаль, тальк, і триосновний фосфат кальцію. Прийнятні антигрудкувачі включають, наприклад, силікат кальцію, силікат магнію, діоксид кремнію, колоїдний діоксид кремнію, тальк, і їх суміші. Прийнятні протимікробні речовини, які можна використовувати, наприклад, як консерванти для даних пептидних композицій, включають, наприклад, бензалконій хлорид, бензетоній хлорид, бензойну кислоту, бензиловий спирт, бутилпарабен, цетилпіридиній хлорид, крезол, хлорбутанол, дегідроацетову кислоту, етилпарабен, метилпарабен, фенол, фенілетиловий спирт, феноксіетанол, фенілртутьацетат, нітрат фенілртуті, сорбат калію, пропілпарабен, бензойнокислий натрій, дегідроацетат натрію, пропіонат натрію, сорбінову кислоту, тимерсол, тимо і їх суміші. Прийнятні антиоксиданти включають, наприклад, антиоксиданти, BHA (бутильований гідроксіанізол), BHT (бутильований гідрокситуол), вітамін Е, пропілгалат, аскорбінову кислоту і її солі або складні ефіри, токоферол і його складні ефіри, альфа-липоєву кислоту і бета-каротин. Прийнятні покривні речовини включають, наприклад, карбоксиметилцелюлозу натрію, ацетатфталат целюлози, етилцелюлозу, желатин, фармацевтичну глазур, гідроксипропілцелюлозу, гідроксипропілметилцелюлозу, фталат гідроксипропілметилцелюлози, 22 UA 108636 C2 5 10 15 20 25 30 35 40 45 50 55 60 метилцелюлозу, поліетиленгліколь, полівінілацетат фталат, шелак, сахарозу, діоксид титану, карнаубський віск, мікрокристалічний віск, і їх суміші. Прийнятні захисні покриття включають Aquacoat (наприклад, водна дисперсія аквакоат етилцелюлози, 15 % ваг/ваг, FMC Biopolymer, ECD-30), еудрагіт (наприклад, Eudragit Е PO PE-EL, Roehm Pharma Polymers) і опадрай (наприклад, дисперсія Opadry AMB, 20 % ваг/ваг, Colorcon). У деяких варіантах здійснення прийнятні допоміжні речовини для даних пептидних композицій включають одне або декілька з сахарози, тальку, стеарату магнію, кросповідону або BHA. Композиції за даним винаходом також можуть включати інші ексципієнти, агенти і їх групи, що включають, але що не обмежуються цим, L-гістидин, Pluronic®, полоксамери (такі як Lutrol® і Полоксамер 188), аскорбінову кислоту, глутатіон, речовини, що посилюють проникність (наприклад, ліпіди, холат натрію, ацилкарнітин, саліцилати, змішані солі жовчних кислот, міцели жирних кислот, хелатори, жирні кислоти, поверхнево-активні речовини, середньоланцюжкові гліцериди), інгібітори протеаз (наприклад, інгібітор трипсину соєвих бобів, органічні кислоти), речовини, які знижують значення pH і підсилювачі абсорбції, ефективні для підвищення біодоступності (що включають, але що не обмежуються, ті, які описані в US6086918 і US5912014), речовини для жувальних таблеток (такі як декстроза, фруктоза, моногідрат лактози, лактоза і аспартам, лактоза і целюлоза, мальтодекстрин, мальтоза, маніт, мікрокристалічна целюлоза і гуарова камедь, кристалічний сорбіт); паренетальні речовини (такі як маніт і повідон); пластифікатори (такі як дибутилсебацинат, пластифікатори для покриттів, полівінілацетат фталат); порошкоподібні мастильні речовини (такі як гліцерин бегенат); м'які желатинові капсули (такі як спеціальний розчин сорбіту); сфери для покриття (такі як цукрові сфери); агенти, що викликають сферонізацію (такі як гліцерин бегенат і мікрокристалічна целюлоза); суспендуючі/желюючі речовини (такі як карагенан, геланова камедь, маніт, мікрокристалічна целюлоза, повідон, карбоксиметилкрохмаль натрію, ксантанова камедь); підсолоджувачі (такі як аспартам, аспартам і лактоза, декстроза, фруктоза, мед, мальтодекстрин, мальтоза, маніт, меляса, кристалічний сорбіт, спеціальний розчин сорбіту, сахароза); речовини вологого гранулювання (такі як карбонат кальцію, безводна лактоза, моногідрат лактози, мальтодекстрин, маніт, мікрокристалічна целюлоза, повідон, крохмаль), карамель, карбоксиметилцелюлоза натрію, вишневий вершковий ароматизатор і вишневий ароматизатор, безводналимонна кислота, лимонна кислота, цукрова пудра, D&С червоний № 33, алюмінієвий лак D&С жовтий № 10, динатрієва сіль етилендіамінтетраоцтової кислоти, етиловий спирт 15 %, алюмінієвий лак FD&С жовтий № 6, алюмінієвий лак FD&С блакитний № 1, FD&С блакитний № 1, алюмінієвий лак FD&С блакитний № 2, FD&С зелений № 3, FD&С червоний № 40, алюмінієвий лак FD&С жовтий № 6, FD&С жовтий № 6, FD&С жовтий № 10, гліцерин пальмитостеарат, гліцерил моностеарат, індигокармін, лецитин, маніт, метил- і пропілпарабени, моноамонію гліциризинат, натуральний і штучний апельсиновий ароматизатор, фармацевтична глазур, полоксамер 188, полідекстроза, полісорбат 20, полісорбат 80, полівідон, прежелатинізований кукурудзяний крохмаль, прежелатинізований крохмаль, червоний окисел заліза, сахарин натрію, карбоксиметиловий ефір натрію, хлорид натрію, цитрат натрію, фосфат натрію, полуничний ароматизатор, синтетичний чорний залізооксидний барвник, синтетичний червоний окисел заліза, діоксид титану, і білий віск. У деяких варіантах здійснення забезпечена фармацевтична композиція, що включає 2+ 2+ 2+ 2+ + + описаний тут пептид і один або декілька агентів, вибраних з Mg , Ca , Zn , Mn , K , Na або 3+ Al , їх комбінації, і/або просторово утрудненого первинного аміну. У наступних варіантах 2+ 2+ 2+ здійснення даний агент являє собою Mg , Ca або Zn , або їх комбінацію. У деяких варіантах здійснення даний катіон передбачений, без обмеження, у вигляді ацетату магнію, хлориду магнію, фосфату магнію, сульфату магнію, ацетату кальцію, хлориду кальцію, фосфату кальцію, сульфату кальцію, ацетату цинку, хлориду цинку, фосфату цинку, сульфату цинку, ацетату марганцю, хлориду марганцю, фосфату марганцю, сульфату марганцю, ацетату калію, хлориду калію, фосфату калію, сульфату калію, ацетату натрію, хлориду натрію, фосфату натрію, сульфату натрію, ацетату алюмінію, хлориду алюмінію, фосфату алюмінію або сульфату алюмінію. У наступних варіантах здійснення даний катіон передбачений у вигляді хлориду магнію, хлориду кальцію, фосфату кальцію, сульфату кальцію, ацетату цинку, хлориду марганцю, хлориду калію, хлориду натрію або хлориду алюмінію. У інших варіантах здійснення даний катіон передбачений у вигляді хлориду кальцію, хлориду магнію або ацетату цинку. У інших варіантах здійснення даний агент являє собою просторово утруднений первинний амін. У одному варіанті здійснення даний просторово утруднений первинний амін являє собою амінокислоту. У ще одному варіанті здійснення, дана амінокислота являє собою амінокислоту, що зустрічається в природі. У ще одному варіанті здійснення, дана амінокислота, що 23 UA 108636 C2 5 10 зустрічається в природі, вибрана з групи, що має в своєму складі: гістидин, фенілаланін, аланін, глутамінову кислоту, аспарагінову кислоту, глутамін, лейцин, метіонін, аспарагін, тирозин, треонін, ізолейцин, триптофан, гліцин і валін; крім того, дана амінокислота, що зустрічається в природі, являє собою лейцин, ізолейцин, аланін або метіонін. У ще одному варіанті здійснення дана амінокислота, що зустрічається в природі, являє собою лейцин. У іншому варіанті здійснення даний просторово утруднений первинний амін являє собою амінокислоту, що не зустрічається в природі (наприклад, 1-аміноциклогексан карбонова кислота). У наступному варіанті здійснення даний просторово утруднений первинний амін являє собою циклогексиламін, 2-метилбутиламін або хітозан. У іншому варіанті здійснення один або декілька просторово утруднених амінів можна використати в композиції. У деяких випадках даний просторово утруднений первинний амін має формулу: , 15 20 25 30 35 40 45 50 де R1, R2 і R3 незалежно вибрані з: Н, С(О)OH, C1-C6 алкілу, C1-C6 алкілового ефіру, C1-C6 алкілового тіоефіру, C1-C6 алкілкарбонової кислоти, C1-C6 алкілкарбоксиламіду і алкіларилу, де будь-яка група може бути однократно або багато разів заміщена на: галоген або аміно, при умові, що не більш ніж два з R1, R2 і R3 являють собою H. В іншому варіанті здійснення не більше одного з R1, R2 і R3 являє собою Н. У інших варіантах здійснення передбачена фармацевтична композиція, що включає 2+ 2+ 2+ 2+ + + фармацевтично прийнятний носій, пептид, катіон, вибраний з Mg , Ca , Zn , Mn , K , Na або 3+ Al , або їх суміш, і просторово утруднений первинний амін. У одному варіанті здійснення даний 2+ 2+ 2+ катіон являє собою Mg , Ca або Zn , або їх суміш. У наступному варіанті здійснення дана фармацевтична композиція додатково містить фармацевтично прийнятну зв’язувальну речовину і/або фармацевтично прийнятну глідант, пом'якшувальну речовину або допоміжну речовину, яка діє і як глідант, і як пом'якшувальна речовина і/або антиоксидант. У деяких варіантах здійснення дана фармацевтична композиція наноситься на носій. У деяких варіантах здійснення даний носій являє собою наповнювач. У деяких випадках мольне відношення катіон:просторово утруднений первинний амін:пептид у водному розчині, нанесеному на носій, становить 5-100:5-50:1. В деяких випадках мольне відношення катіон:просторово утруднений первинний амін може дорівнювати або перевершувати 2:1 (наприклад, між 5:1 і 2:1). Таким чином, в деяких випадках мольне відношення катіон:просторово утруднений первинний амін:пептид, нанесене на носій, становить 100:50:1, 100:30:1, 80:40:1, 80:30:1, 80:20:1, 60:30:1, 60:20:1, 50:30:1, 50:20:1, 40:20:1, 20:20:1, 10:10:1, 10:5:1, або 5:10:1. У випадку, коли зв’язувальна речовина, наприклад, метилцелюлоза, присутня в розчині пептидного агоніста GC-C, нанесеного на носій, вона може становити 0,5 %2,5 % по масі (наприклад, 0,7 %-1,7 % або 0,7 %-1 % або 1,5 % або 0,7 %). У наступному варіанті здійснення дана фармацевтична композиція додатково містить фармацевтично прийнятну зв’язувальну речовину або допоміжну речовину, і/або фармацевтично прийнятний глідант, пом'якшувальну речовину або допоміжну речовину, яка діє і як глідант, і як пом'якшувальна речовина і/або антиоксидант. Прийнятні фармацевтичні композиції за даним винаходом будуть в загальному значенні включати кількість активної сполуки (сполук) з прийнятним фармацевтичним розріджувачем або ексципієнтом, таким як стерильний водний розчин, для забезпечення діапазону кінцевих концентрацій, залежно від передбачуваного застосування. Технології отримання в загальному значенні добре відомі фахівцеві в даній галузі, приклади їх приведені в Remington's Pharmaceutical Sciences (18th Edition, Mack Publishing Company, 1995). Композиції, описані тут, можна застосовувати системно або місцево, наприклад: перорально (наприклад, використовуючи капсули, порошки, розчини, суспензії, таблетки, під’язикові таблетки і тому подібне), при вдиханні (наприклад, аерозоль, газ, інгалятор, небулайзер і тому подібне), вводити у вухо (наприклад, використовуючи вушні краплі), місцево (наприклад, використовуючи крем, гелі, лініменти, лосьйони, мазі, пасти, черезшкірні пластири, і тому подібне), офтальмічні (наприклад, використовуючи очні краплі, очні гелі, очні мазі), ректально (наприклад, використовуючи клізми або супозиторії), назально, трансбукально, вагінально 24 UA 108636 C2 5 10 15 20 25 30 35 40 45 50 55 60 (наприклад, використовуючи спринцівку, внутрішньоматкові пристрої, вагінальні супозиторії, вагінальні кільця або таблетки, і тому подібне), за допомогою імплантованого резервуара або чого-небудь подібного, або парентерально, залежно від тяжкості і типу захворювання. Використовуваний тут термін "парентеральний" включає, але не обмежується цим, підшкірну, внутрішньовенну, внутрішньом'язову, внутрішньосуглобову, внутрішньосиновіальну, надчеревну, підоболонкову, внутрішньопечінкову, всередину патологічного пошкодження і інтракраніальну ін'єкцію, або вливання. Переважно дані композиція вводяться перорально, внутрішньоочеревинно або внутрішньовенно. Для лікування шлунково-кишкових розладів, описані тут пептиди переважно застосовуються перорально, наприклад, в формі таблетки, капсули, порційного пакетика, що містить визначену кількість активного інгредієнта, кульки, гелю, пасти, сиропу, болюсу, електуарію, рідкої кашки, порошку, ліофілізованого порошку, гранул, у вигляді розчину або суспензії у водній рідині або неводній рідині; у вигляді рідкої емульсії типу масло-в-воді або рідкій емульсії типу вода-вмаслі, за допомогою ліпосомальної рецептури (див., наприклад, EP 736299) або в деяких інших формах. Композиції, що застосовуються перорально, можуть включати зв’язувальні речовини, мастильні речовини, інертні розріджувачі, змочувальні, поверхнево-активні або диспергуючі речовини, смакові добавки, і зволожувальні речовини. Препарати, що застосовуються перорально, такі як таблетована форма, можуть бути, необов'язково, покриті оболонкою або мати риску на одній стороні, і можуть бути сформульовані таким чином, щоб забезпечити безперервне, із затримкою або контрольоване вивільнення активного інгредієнта. Дані пептиди можна застосовувати спільно з іншими агентами, що використовуються для лікування шлунково-кишкових розладів, в тому числі, але не обмежуючись ними, агентами, описаними тут. У іншому аспекті, прийнятні фармацевтичні композиції можуть містити одне або декілька інших терапевтичних засобів. Такі терапевтичні засоби включають, без обмеження, болезаспокійливі засоби; протисекреторні засоби, в тому числі, інгібітори протонного насоса, антагоністи кислотного насоса, антагоністи рецептора Н2; інгібітори PDE5; інгібітори GABA-B; речовини, що посилюють секрецію жовчних кислот; прокінетики і засоби, стимулюючі моторику шлунково-кишкового тракту; антидепресанти; антибіотики; протиблювотні засоби; і засоби, що захищають слизову оболонку. СПОСОБИ ЛІКУВАННЯ У різних варіантах здійснення описані тут пептиди і композиції є ефективними при лікуванні пацієнта з шлунково-кишковим розладом. У деяких варіантах здійснення, даний шлунково-кишковий розлад вибраний з групи, яка має в своєму складі синдром подразненого кишечнику (СПК), запор, функціональне шлунковокишкове порушення, гастроезофагеальну рефлюксну хворобу, функціональну печію, диспепсію, вісцеральний біль, парез шлунка, хронічну псевдонепрохідність кишечнику, товстокишкову псевдонепрохідність, хворобу Крона, виразковий коліт, і запальне захворювання кишечнику. У наступному варіанті здійснення даний шлунково-кишковий розлад являє собою запор. Запор може являти собою хронічний запор, ідіопатичний запор, в результаті післяопераційної кишкової непрохідності, або в результаті застосування опіатів. Клінічно загальновизнані критерії, які визначають запор, включають частоту дефекації, консистенцію калу і легкість дефекації. Одне загальне визначення запору укладається в менше ніж три акти дефекації на тиждень. Інші визначення включають понадміру тверді випорожнення або дефекацію, для якої потрібне надмірне напруження (Schiller 2001, Aliment Pharmacol Ther 15: 749-763). Запор може бути ідіопатичним (функціональний запор або запор в результаті уповільненого транзиту) або вторинним для інших процесів, що включають неврологічні, метаболічні або ендокринні захворювання. Ці захворювання включають цукровий діабет, гіпотиреоз, гіпертиреоз, гіпокальцинемію, розсіяний склероз, хворобу Паркінсона, пошкодження спинного мозку, нейрофіброматоз, вегетативну невропатію, хворобу Чагаса, хворобу Хиршспрунга і муковісцидоз. Запор також може бути результатом хірургічного втручання (післяопераційна кишкова непрохідність) або в результаті застосування лікарських засобів, таких як анальгетики (наприклад, опіати), гіпотензивні засоби, антиконвульсанти, антидепресанти, протисудомні засоби і нейролептики. У інших варіантах здійснення даним шлунково-кишковим розладом є синдром подразненого кишечнику (СПК). Синдром подразненого кишечнику може являти собою синдром подразненого кишечнику з переважаючими запорами (з-СПК), синдром подразненого кишечнику з переважаючою діареєю (д-СПК), або синдром подразненого кишечнику, що змінюється між цими двома типами (зм-СПК). У інших варіантах здійснення даним шлунково-кишковим розладом є диспепсія. 25 UA 108636 C2 5 10 15 20 25 30 35 40 45 50 55 60 У інших варіантах здійснення даним шлунково-кишковим розладом є парез шлунка. Даний парез шлунка може бути вибраний з ідіопатичного, діабетичного або післяопераційного парезу шлунка. У інших варіантах здійснення даним шлунково-кишковим розладом є хронічна кишкова псевдонепрохідність. У інших варіантах здійснення даним шлунково-кишковим розладом є хвороба Крона. У деяких варіантах здійснення даним шлунково-кишковим розладом є виразковий коліт. У деяких варіантах здійснення даним шлунково-кишковим розладом є запальне захворювання кишечнику. У деяких варіантах здійснення даним шлунково-кишковим розладом є вісцеральний біль. У наступному варіанті здійснення даного винаходу описується спосіб зменшення шлунковокишкового болю або вісцерального болю у пацієнта, даний спосіб включає введення в організм пацієнта фармацевтичної композиції, що містить описаний тут пептид. Дані пептидні агоністи, описані тут, можна використовувати самі по собі, або в комбінаційній терапії для лікування, запобігання або зменшення вісцерального болю, пов'язаного з шлунково-кишковим розладом або болю, пов'язаного з іншим захворюванням. У іншому варіанті здійснення даного винаходу описується спосіб лікування запалення, в тому числі запалення шлунково-кишкового тракту, наприклад, запалення, пов'язаного з шлунково-кишковим розладом або інфекцією, або яким-небудь іншим захворюванням, даний спосіб включає введення в організм пацієнта фармацевтичної композиції, що містить очищений пептид, описаний тут. У іншому варіанті здійснення даного винаходу описується спосіб лікування шлунковокишкового розладу, що включає введення в організм пацієнта агоніста рецептора інтестинальної гуанілатциклази (GC-C) перорально, за допомогою ректальних супозиторіїв, або парентерально. У ще одному варіанті здійснення даного винаходу описується спосіб лікування шлунковокишкового розладу, що включає введення в організм пацієнта агоніста рецептора інтестинальної гуанілатциклази (GC-C). У іншому аспекті даного винаходу описується спосіб підвищення рівня циклічного гуанозин 3'-монофосфату (cGMP) в біологічному зразку, тканині (наприклад, слизова оболонка кишки), або клітині (наприклад, клітина, яка несе рецептор GC-A), або всьому організмі, за допомогою контакту даного зразка, тканини або організму з пептидами, описаними тут. Агоністи рецептора GC-C, описані тут, можна застосовувати в сполученні з іншими речовинами. Наприклад, дані пептиди можна застосовувати з аналгетичним пептидом або сполукою. Даний аналгетичний пептид, або сполука, може бути ковалентно зв'язаний з пептидом, описаним тут, або може являти собою окремий агент, що застосовується разом з або послідовно з пептидом, описаним тут, в комбінованому лікуванні. Пептиди, описані тут, також можна застосовувати в комбінації з іншими речовинами, що використовуються для лікування шлунково-кишкових розладів, які включають антидепресанти, засоби, стимулюючі моторику шлунково-кишкового тракту і прокінетики, протиблювотні засоби, антибіотики, інгібітори протонного насоса, блокатори кислоти (наприклад, антагоністи рецептора гістаміну Н2), антагоністи кислотного насоса, інгібітори PDE5, агоністи GABA-B, речовини, що посилюють екскрецію жовчних кислот, і речовини, що захищають слизову оболонку. У деяких варіантах здійснення ефективні аналгетичні речовини, які можна використовувати з даним пептидом, описаним тут, включають блокатори Ca каналів (наприклад, зиконотид), антагоністи рецептора 5HT (наприклад, антагоністи рецептора 5HT3, 5HT4 і 5HT1), антагоністи 5HT4 (наприклад, тегасерод [Zelnorm®], мосаприд, закоприд, цисаприд, рензаприд, прукалоприд [Resolor®], похідні бензімідазолону, такі як BIMU 1 і BIMU 8, і лірексаприд), агоністи 5HT1 (наприклад, суматриптан і буспірон), агоністи опіоїдних рецепторів (наприклад, лоперамід, федотозин, енкефалін пентапептид, морфін, дифенілоксилат, фракефамід, тримебутин і фентаніл), агоністи рецептора CCK (наприклад, локсиглумід і декслоксиглумід), антагоністи рецептора NK1 (наприклад, апрепітант, вофопітант, езлопітант, R-673 (Hoffmann-La Roche Ltd), SR-48968 і SR-14033, (Sanofi Synthelabo), CP-122,721 (Pfizer, Inc.), GW679769 (Glaxo Smith Kline) і TAK-637 (Takeda/Abbot)), антагоністи рецептора NK2 (наприклад, непадутант, саредутунт, GW597599 (Glaxo Smith Kline), SR-144190 (Sanofi-Synthelabo) і UK-290795 (Pfizer Inc)), антагоністи рецептора NK3 (наприклад, осанетант (SR-142801; Sanofi-Synthelabo), SR-241586 і талнетант), інгібітори зворотного захоплення норепінефрин-серотонін (NSRI) (наприклад, мілнаципран), змішані і селективні антагоністи допамінового рецептора (наприклад мотоклопрамід, ітоприд, домперидон), агоністи ванілоїдного і канабіноїдного рецепторів, сіалорфін і сіалорфінзв'язані пептиди. У літературі описані різні класи аналгетичних агентів. 26 UA 108636 C2 5 10 15 20 25 30 35 40 45 50 55 60 У деяких варіантах здійснення один або декілька інших терапевтичних засобів можуть бути використані в комбінації з пептидами, описаними тут. Такі засоби включають антидепресанти, засоби, стимулюючі моторику шлунково-кишкового тракту і прокінетики, протиблювотні засоби, антибіотики, інгібітори протонного насоса, блокатори кислоти (наприклад, антагоністи рецептора гістаміну Н2), антагоністи кислотного насоса, інгібітори PDE5, агоністи GABA-B, речовини, що посилюють екскрецію жовчних кислот, і речовини, що захищають слизову оболонку. Приклади антидепресантів включають, без обмеження, трициклічні антидепресанти, такі як амітриптилін (Elavil®), дезипрамін (Norpramin®), іміпрамін (Tofranil®), аміксапін (Asendin®), нортриптилін; селективні інгібітори зворотного захоплення серотоніну (SSRFs), такі як пароксетин (Paxil®), флуоксетин (Prozac®), сертралін (Zoloft®), і цитралопрам (Celexa®); і інші, такі як доксепін (Sinequan®) і тразодон (Desyrel®). Приклади засобів, які стимулюють моторику шлунково-кишкового тракту, і прокінетиків, включають, без обмеження, ітоприд, октреотид, бетанехол, метоклопрамід (Reglan®), домперидон (Motilium®), еритроміцин (і його похідні) і цисаприд (Propulsid®). Приклад протиблювотних засобів включає, без обмеження, прохлорперазин. Приклади антибіотиків, які можна використовувати, включають ті, які можна застосовувати для лікування інфекцій Heliobacter pylori, такі як амоксицилін, тетрациклін, метронідазол, або кларитроміцин. Інші антибіотики, такі як еритроміцин і його похідні, також можна використовувати в комбінації з пептидами, описаними тут. Приклади інгібіторів протонного насоса включають, без обмеження, омепразол (Prilosec®), езомепразол (Nexium®), лансопразол (Prevacid®), пантопразол (Protonix®) і рабепразол (Aciphex®). Приклади блокаторів рецептора H2 включають, без обмеження, циметидин, ранітидин, фамотидин і нізатидин. Приклади інгібіторів кислотної помпи включають, без обмеження, ревапразан, CS-526 (J. Pharmacol. Exp. Ther. (2007) 323: 308-317), PF-03716556 (J. Pharmacol. Exp. Ther. (2009) 328(2): 671-9), і YH1885 (Drug Metab. Dispos. (2001) 29(1):54-9). Приклади інгібіторів PDE5 включають, без обмеження, аванафіл, лоденафіл, міроденафіл, силденафіл цитрат, тадалафил, варденафіл і уденафіл. Агоністи GABA-B включають, без обмеження, баклофен і XP19986 (CAS Реєстраційний № 847353-30-4). Приклади засобів, що посилюють екскрецію жовчних кислот, включають, без обмеження, GT102-279, холестирамін, колесевелам, колесевелам гідрохлорид, урсодезоксихолеву кислоту, колестипол, колестилан, севеламер, полідіаліламін, перехресно зв'язаний з епихлоргідрином, діалкіламіноалкілові похідні перехресно-зшитого декстрану, і N-(циклоалкіл)алкіламіни. Приклади засобів, що захищають слизову оболонку, включають, без обмеження, сукральфат (Carafate), тепренон, полапрецинк, цетраксат і вісмуту субсалициклат. Комбіноване лікування може бути здійснене за допомогою застосування двох або декількох агентів, наприклад, пептиду, описаного тут, і іншого терапевтичного пептиду або сполуки, кожний з яких приготований і вводиться окремо, або за допомогою застосування двох або декількох агентів в одній композиції. Інші комбінації також здійснюються в комбінованій терапії. Наприклад, два агенти можуть бути приготовані разом і застосовуються в сполученні з окремою композицією, що містить третій агент. Незважаючи на те, що два або декілька агентів в комбінованій терапії можуть бути введені одночасно, вони не обов'язково повинні бути. Наприклад, введення першого агента (або комбінації агентів) може передувати введенню другого агента (або комбінації агентів) на хвилини, години, дні або тижні. Таким чином, дані два або декілька агентів можуть бути введені протягом хвилин один відносно одного, або протягом 1, 2, 3, 6, 9, 12, 15, 18, або 24 годин, один відносно одного, або протягом 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 14 днів один відносно одного, або протягом 2, 3, 4, 5, 6, 7, 8, 9, або 10 тижнів один відносно одного. У деяких випадках можливі навіть більш тривалі інтервали. Незважаючи на те, що в багатьох випадках бажано, щоб дані два або декілька агентів, що використовуються в комбінованій терапії, були присутнім в організмі даного пацієнта в один і той же час, це необов'язково повинно бути так. ДОЗА Діапазон доз для дорослих людей може, як правило, складати від 5 мкг до 100 мг/день описаного тут пептиду для перорально введення. Таблетки, капсули або інші форми випуску, забезпечені в окремих одиницях, можуть для зручності містити кількість описаної тут сполуки, яка є ефективною в такому дозуванні, або множину однакових, наприклад, одиниць, що містять від 25 мкг до 2 мг, або приблизно від 100 мкг до 1 мг. Лікуючий лікар буде відповідальний за точну кількість сполуки, прописану пацієнту. Однак застосовувана доза буде залежати від цілого ряду чинників, що включають вік і стать даного пацієнта, визначеного порушення, що піддається лікуванню, і його тяжкості. 27 UA 108636 C2 5 10 15 20 25 30 35 40 45 50 55 У різних варіантах здійснення одиниця дозування вводиться в організм з їжею в будь-який час дня, поза їдою в будь-який час дня, під час їди після нічної утримуваності від їжі (наприклад, під час сніданку), перед сном після маложирного перекусу. У одному конкретному варіанті здійснення, дана одиниця дозування застосовується перед, або після їди (наприклад, їжа). У наступному варіанті здійснення, дана одиниця дозування застосовується перед їдою приблизно від 15 хвилин до 1 години. У різних варіантах здійснення дана одиниця дозування застосовується один раз на день, два рази на день, три рази на день, чотири рази на день, п'ять разів на день або шість разів на день. У деяких варіантах здійснення дана одиниця дозування еквівалента денній дозі. Точна кількість кожного з двох або декількох активних інгредієнтів в одиниці дозування буде залежати від бажаного дозування кожного компонента. Таким чином, може бути ефективне створення одиниці дозування, яка буде, при застосуванні відповідно до певної схеми застосування (наприклад, схема застосування, що передбачає деяку кількість одиниць і певний час застосування), доставить таку ж дозу кожного компонента, як якби даний пацієнт отримував лікування тільки єдиним компонентом. При інших обставинах, може бути необхідне створення одиниці дозування, яка доставить дозу одного або декількох компонентів, яка менша, ніж доза, що вводиться, якщо пацієнт отримує лікування тільки одним компонентом. Нарешті, може бути доцільне створення одиниці дозування, яка доставить дозу одного або декількох компонентів, яка більша дози, що вводиться, у випадку, коли пацієнт отримує лікування тільки одним компонентом. Дана композиція може мати в своєму складі додаткові інгредієнти, що включають, але не обмежуючись ними, ексципієнти, описані тут. У деяких варіантах здійснення один або декілька терапевтичних агентів даної одиниці дозування може бути в композиції з тривалим або контрольованим вивільненням і додаткові терапевтичні агенти можуть не бути присутніми в композиції з тривалим вивільненням. Наприклад, пептид або агоніст, описаний тут, може знаходитися в композиції з контрольованим вивільненням або в композиції з тривалим вивільненням, в тій же одиниці дозування з іншим агентом, який може бути присутнім, а може і не бути присутнім, або в композиції з контрольованим вивільненням або в композиції з тривалим вивільненням. Таким чином, в деяких варіантах здійснення може бути доцільно забезпечення негайного вивільнення одного або декількох агентів, описаних тут, і контрольоване вивільнення одного або декількох інших агентів. Даний винахід описаний з посиланням на деякі його ілюстративні варіанти здійснення. Однак, фахівцеві в даній галузі буде очевидно, що здійснення даного винаходу можливе в інших видах, відмінних від ілюстративних варіантів здійснення, описаних тут. Це може бути здійснене без відхилення від суті даного винаходу. Зразкові варіанти здійснення призначені тільки для ілюстрації і не повинні розглядатися як яке-небудь обмеження. Діапазон даного винаходу визначається прикладеною формулою винаходу і її еквівалентами, а не попереднім описом. ПРИКЛАДИ Пептидні агоністи GC-C, або їх фармацевтично прийнятні солі, як описано тут, були отримані за допомогою хімічного твердофазного синтезу і природного укладання (окислення киснем повітря) в компанії American Peptide Company (Sunnyvale, CA).в деяких випадках дані пептиди були модифіковані після синтезу, як описано тут. Пептид Cys1-IMD був синтезований в результаті змішування 4,6 г (3,0 ммоль) лінаклотиду в 200 мл EtOH. До цієї суміші був доданий формальдегід в концентрації 37 % (1,12 мл/5 екв). Дану реакційну суміш інкубували на водяній бані (45 °C) протягом ночі. На наступний день сольвент був видалений за допомогою випарювання при обертанні. Даний пептид був далі очищений за допомогою хроматографії із оберненою фазою. Пептид Glu3-етиловий ефір був синтезований на смолі Fmoc-Tyr(tBu)-Wang 20 ммоль. Для амінокислот використовували наступні захисні групи: група t-Бутил для Tyr і Thr, група Trt для Asn і Cys. Пептидний ланцюг був зібраний на смолі за допомогою повторного видалення захисної групи Fmoc і зв’язування захищеної амінокислоти. DIC і HOBt використали як зв'язувальні реагенти, і NMM використовували як основу для цієї реакції. Як реагент de-Fmoc використовували 20 % піпередин в DMF. Після видалення останньої захисної групи Fmoc, смолу обробляли коктейлем К протягом 3 годин для відщеплення даного пептиду від смоли і видалення захисних груп бічних ланцюгів. Даний елюйований пептид осаджували холодним ефіром і висушували. Висушений пептид розчиняли в суміші TFA/TIS/вода (95:3:2 об./об.) в співвідношенні 1 до 10 (г/об). Цю суміш перемішували протягом 1 години при кімнатній температурі. Ізольований пептид також осаджували холодним ефіром, збирали за допомогою фільтрації і висушували в умовах високого вакууму. 28
ДивитисяДодаткова інформація
Автори англійськоюFretzen, Angelika, Zhao, Hong, Kessler, Marco
Автори російськоюФретцен Ангелико, Чжао Хун, Кесслер Марко
МПК / Мітки
МПК: C07K 7/08
Мітки: пептид
Код посилання
<a href="https://ua.patents.su/46-108636-peptid.html" target="_blank" rel="follow" title="База патентів України">Пептид</a>
Попередній патент: Взуття з водонепроникними та паропроникними верхом та підошвою
Наступний патент: Пінна композиція, що містить щонайменше один тритерпеноїд та одну мембраноутворюючу сполуку
Випадковий патент: Корпус апарата