Хітоолігосахариди та способи застосування при стимулюванні росту рослин
Формула / Реферат
1. Спосіб стимулювання росту рослин, який включає обробку насінини рослини та/або рослини, що проростає з насінини, ефективною кількістю щонайменше одного хітоолігосахариду (CO), представленого формулою:
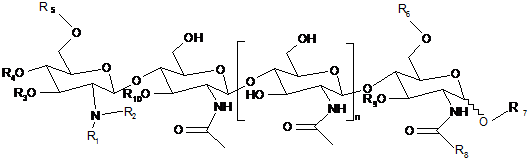 ,
,
де
R1 являє собою водень або метил;
R2 являє собою водень або метил;
R3 являє собою водень, ацетил або карбамоїл;
R4 являє собою водень, ацетил або карбамоїл;
R5 являє собою водень, ацетил або карбамоїл;
R6 являє собою водень, арабінозил, фукозил, ацетил, естер сірчаної кислоти, 3-0-S-2-0-MeFuc, 2-0-MeFuc або 4-0-AcFuc;
R7 являє собою водень, манозил або гліцерин;
R8 являє собою водень, метил або -СН2ОН;
R9 являє собою водень, арабінозил або фукозил;
R10 являє собою водень, ацетил або фукозил; та
n дорівнює 0, 1, 2 або 3.
2. Спосіб за п. 1, який відрізняється тим, що щонайменше один CO включає CO, представлений структурою:
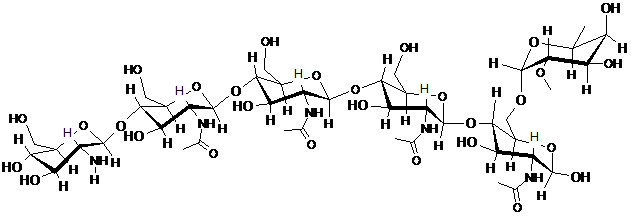 .
.
3. Спосіб за будь-яким із пп. 1-2, який відрізняється тим, що щонайменше один CO включає CO, представлений структурою:
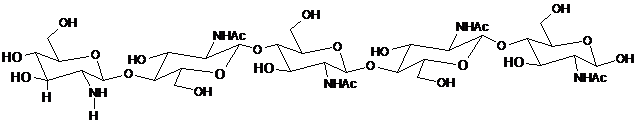 .
.
4. Спосіб за будь-яким із пп. 1-3, який відрізняється тим, що щонайменше один CO включає CO, представлений формулою:
 ,
,
де n=1 або 2; R1 являє собою водень або метил; та R2 являє собою водень або SO3H.
5. Спосіб за будь-яким із пп. 1-4, який відрізняється тим, що щонайменше один CO включає CO, представлений структурою:
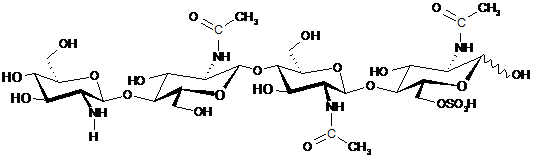 .
.
6. Спосіб за будь-яким із пп. 1-5, який відрізняється тим, що щонайменше один CO включає CO, представлений структурою:
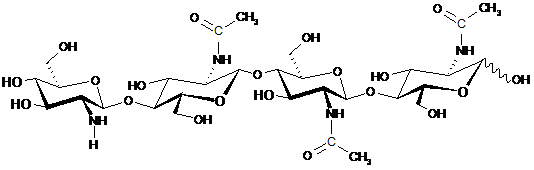 .
.
7. Спосіб за будь-яким із пп. 1-6, який відрізняється тим, що щонайменше один CO включає синтетичний CO.
8. Спосіб за будь-яким із пп. 1-7, який відрізняється тим, що щонайменше один CO включає рекомбінантний CO.
9. Спосіб за п. 8, який відрізняється тим, що рекомбінантний CO є щонайменше на 60 % чистим.
10. Спосіб за п. 8, який відрізняється тим, що рекомбінантний CO є щонайменше на 70 % чистим.
11. Спосіб за п. 8, який відрізняється тим, що рекомбінантний CO є щонайменше на 80 % чистим.
12. Спосіб за п. 8, який відрізняється тим, що рекомбінантний СО с щонайменше на 90 % чистим.
13. Спосіб за будь-яким із пп. 1-12, який відрізняється тим, що щонайменше один СО наносять на насінину до посіву та/або приблизно у час посіву.
14. Спосіб за будь-яким із пп. 1-13, який відрізняється тим, що щонайменше один СО наносять на насінину щонайменше за один місяць до посіву.
15. Спосіб за будь-яким із пп. 1-13, який відрізняється тим, що щонайменше один СО наносять на насінину щонайменше за два місяці до посіву.
16. Спосіб за будь-яким із пп. 1-13, який відрізняється тим, що щонайменше один CO наносять на насінину щонайменше за три місяці до посіву.
17. Спосіб за будь-яким із пп. 1-13, який відрізняється тим, що щонайменше один CO наносять на насінину щонайменше за шість місяців до посіву.
18. Спосіб за будь-яким із пп. 1-13, який відрізняється тим, що щонайменше один CO наносять на насінину щонайменше за один рік до посіву.
19. Спосіб за будь-яким із пп. 1-18, який відрізняється тим, що щонайменше один CO наносять на насінину у борозні.
20. Спосіб за будь-яким із пп. 1-19, який відрізняється тим, що щонайменше один CO наносять на рослину шляхом позакореневої обробки.
21. Спосіб за будь-яким із пп. 1-20, який відрізняється тим, що ефективна кількість щонайменше одного CO становить від приблизно 10-5 до приблизно 10-14 М.
22. Спосіб за будь-яким із пп. 1-20, який відрізняється тим, що ефективна кількість щонайменше одного CO становить від приблизно 10-5 до приблизно 10-11 М.
23. Спосіб за будь-яким із пп. 1-20, який відрізняється тим, що ефективна кількість щонайменше одного CO становить від приблизно 10-7 до приблизно 10-8 М.
24. Спосіб за будь-яким із пп. 1-23, який відрізняється тим, що ефективна кількість щонайменше одного CO становить від приблизно 1 мкг/акр до приблизно 70 мкг/акр.
25. Спосіб за будь-яким із пп. 1-23, який відрізняється тим, що ефективна кількість щонайменше одного CO становить від приблизно 1 мкг/акр до приблизно 30 мкг/акр.
26. Спосіб за будь-яким із пп. 1-23, який відрізняється тим, що ефективна кількість щонайменше одного CO становить від приблизно 11 мкг/акр до приблизно 20 мкг/акр.
27. Спосіб за будь-яким із пп. 1-23, який відрізняється тим, що ефективна кількість щонайменше одного CO становить від приблизно 50 мкг/акр до приблизно 60 мкг/акр.
28. Спосіб за будь-яким із пп. 1-27, який додатково включає нанесення на насінину та/або на рослину, що проростає з насінини, щонайменше одного поживного мікроелемента.
29. Спосіб за п. 28, який відрізняється тим, що щонайменше один поживний мікроелемент включає один або декілька вітамінів та/або слідових елементів.
30. Спосіб за будь-яким із пп. 1-29, який додатково включає нанесення на насінину та/або на рослину, що проростає з насінини, жирної кислоти або її похідної.
31. Спосіб за будь-яким із пп. 1-30, який додатково включає нанесення на насінину та/або на рослину, що проростає з насінини, щонайменше однієї сигнальної молекули для рослин.
32. Спосіб за п. 31, який відрізняється тим, що щонайменше одна сигнальна молекула для рослин включає щонайменше один ліпохітоолігосахарид (LCO).
33. Спосіб за п. 32, який відрізняється тим, що щонайменше один LCO включає LCO, представлений структурою:
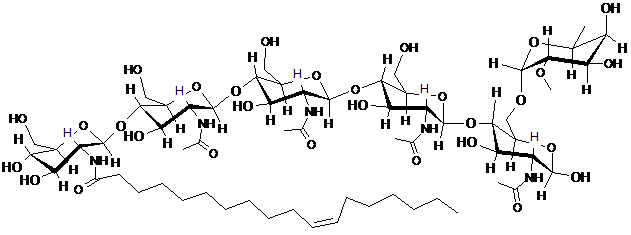 .
.
34. Спосіб за будь-яким із пп. 32-33, який відрізняється тим, що щонайменше один LCO включає LCO, представлений структурою:
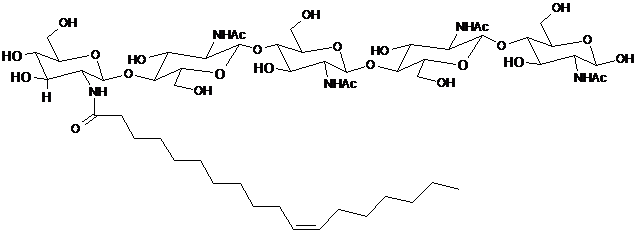 .
.
35. Спосіб за будь-яким із пп. 32-34, який відрізняється тим, що щонайменше один LCO включає LCO, представлений структурою:
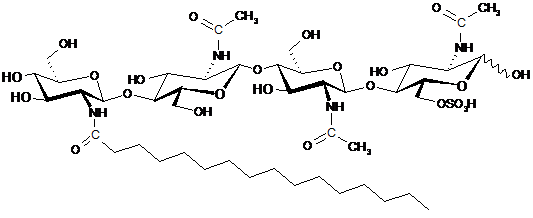 .
.
36. Спосіб за будь-яким із пп. 32-35, який відрізняється тим, що щонайменше один LCO включає LCO, представлений структурою:
 .
.
37. Спосіб за будь-яким із пп. 32-36, який відрізняється тим, що щонайменше один LCO включає щонайменше один LCO, одержаний зі штаму Rhizobium, Sinorhizobium, Azorrhizobium, Mesorhizobium або Bradyrhizobium.
38. Спосіб за будь-яким із пп. 32-37, який відрізняється тим, що щонайменше один LCO включає щонайменше один LCO, одержаний зі штаму Bradyrhizobium japonicum.
39. Спосіб за будь-яким із пп. 32-38, який відрізняється тим, що щонайменше один LCO включає щонайменше один LCO, одержаний зі штаму Sinorhizobium meliloti.
40. Спосіб за будь-яким із пп. 32-39, який відрізняється тим, що щонайменше один LCO включає щонайменше один LCO, одержаний зі штаму Rhizobium leguminosarum.
41. Спосіб за будь-яким із пп. 32-40, який відрізняється тим, що щонайменше один LCO включає щонайменше один LCO, одержаний із мікоризного гриба.
42. Спосіб за будь-яким із пп. 32-41, який відрізняється тим, що щонайменше один LCO включає щонайменше один LCO, одержаний зі штаму Glomeromycota.
43. Спосіб за будь-яким із пп. 32-42, який відрізняється тим, що щонайменше один LCO включає щонайменше один LCO, одержаний зі штаму Glomus intraradices.
44. Спосіб за будь-яким із пп. 31-43, який відрізняється тим, що щонайменше одна сигнальна молекула для рослин включає сигнальну молекулу для рослин, вибрану із групи, яка включає хітинові сполуки, флавоноїди, жасмонову кислоту та її похідні, лінолеву кислоту та її похідні, ліноленову кислоту та її похідні, а також карикіни та їх похідні.
45. Спосіб за будь-яким із пп. 31-44, який відрізняється тим, що щонайменше одна сигнальна молекула для рослин включає хітин та/або хітозан.
46. Спосіб за будь-яким із пп. 1-45, який додатково включає нанесення на насінину та/або рослину, що проростає з насінини, одного або декількох гербіцидів, інсектицидів та/або фунгіцидів.
47. Спосіб за будь-яким із пп. 1-46, який додатково включає нанесення на насінину та/або рослину, що проростає з насінини, щонайменше одного мікроорганізму, що солюбілізує фосфати.
48. Спосіб за п. 47, який відрізняється тим, що щонайменше один мікроорганізм, що солюбілізує фосфати, включає щонайменше один штам Рenicillium.
49. Спосіб за п. 47, який відрізняється тим, що щонайменше один мікроорганізм, що солюбілізує фосфати, включає щонайменше один штам P. bilaiae.
50. Спосіб за п. 49, який відрізняється тим, що щонайменше один штам P. bilaiae включає NRRL 50162, NRRL 50169, АТСС 20851, АТСС 22348 та/або АТСС 18309.
51. Спосіб за будь-яким із пп. 47-50, який відрізняється тим, що щонайменше один мікроорганізм, що солюбілізує фосфати, включає щонайменше один штам P. gaestrivorus.
52. Спосіб за п. 51, який відрізняється тим, що щонайменше один штам P. gaestrivorus включає NRRL 50170.
53. Спосіб за будь-яким із пп. 47-52, який відрізняється тим, що щонайменше один мікроорганізм, що солюбілізує фосфати, включає щонайменше один штам Streptomyces.
54. Спосіб за будь-яким із пп. 1-46, який додатково включає нанесення на насінину та/або рослину, що проростає з насінини, щонайменше одного діазотрофа.
55. Спосіб за п. 54, який відрізняється тим, що зазначений щонайменше один діазотроф включає один або декілька штамів Rhizobium, Sinorhizobium, Azorrhizobium, Mesorhizobium та/або Bradyrhizobium.
56. Спосіб за будь-яким із пп. 54-55, який відрізняється тим, що зазначений щонайменше один діазотроф включає щонайменше один штам Bradyrhizobium japonicum.
57. Спосіб за будь-яким із пп. 54-55, який відрізняється тим, що зазначений щонайменше один діазотроф включає щонайменше один штам Sinorhizobium meliloti.
58. Спосіб за будь-яким із пп. 54-55, який відрізняється тим, що зазначений щонайменше один діазотроф включає щонайменше один штам Rhizobium leguminosarum.
59. Спосіб за будь-яким із пп. 54-55, який відрізняється тим, що зазначений щонайменше один діазотроф включає щонайменше один штам Mesorhizobium ciceri.
60. Спосіб за будь-яким із пп. 1-46, який додатково включає нанесення на насінину та/або рослину, що проростає з насінини, щонайменше одного мікоризного гриба.
61. Спосіб за п. 60, який відрізняється тим, що зазначений щонайменше один мікоризний гриб включає щонайменше один штам Glomeromycota.
62. Спосіб за будь-яким із пп. 1-61, який відрізняється тим, що насінина являє собою насінину бобової рослини.
63. Спосіб за будь-яким із пп. 1-61, який відрізняється тим, що насінина являє собою насінину рослини, яка не належить до бобових.
64. Спосіб за будь-яким із пп. 1-61, який відрізняється тим, що насінина являє собою насінину Poaceae, Cucurbitaceae, Malvaceae, Asteraceae, Chenopodiaceae або Solanaceae.
65. Спосіб за будь-яким із пп. 1-61, який відрізняється тим, що насінина являє собою насінину пшениці.
66. Спосіб за будь-яким із пп. 1-61, який відрізняється тим, що насінина являє собою насінину ячменя.
67. Спосіб за будь-яким із пп. 1-61, який відрізняється тим, що насінина являє собою насінину вівса.
68. Спосіб за будь-яким із пп. 1-61, який відрізняється тим, що насінина являє собою насінину жита.
69. Спосіб за будь-яким із пп. 1-61, який відрізняється тим, що насінина являє собою насінину картоплі.
70. Спосіб за будь-яким із пп. 1-61, який відрізняється тим, що насінина являє собою насінину буряку.
71. Спосіб за будь-яким із пп. 1-61, який відрізняється тим, що насінина являє собою насінину сої.
72. Спосіб за будь-яким із пп. 1-61, який відрізняється тим, що насінина являє собою насінину томату.
73. Насінина, оброблена згідно зі способом за будь-яким із пп. 1-72, що містить щонайменше один хітоолігосахарид (CO), представлений формулою:
 ,
,
де
R1 являє собою водень або метил;
R2 являє собою водень або метил;
R3 являє собою водень, ацетил або карбамоїл;
R4 являє собою водень, ацетил або карбамоїл;
R5 являє собою водень, ацетил або карбамоїл;
R6 являє собою водень, арабінозил, фукозил, ацетил, естер сірчаної кислоти, 3-0-S-2-0-MeFuc, 2-0-MeFuc або 4-0-AcFuc;
R7 являє собою водень, манозил або гліцерин;
R8 являє собою водень, метил або -СН2ОН;
R9 являє собою водень, арабінозил або фукозил;
R10 являє собою водень, ацетил або фукозил; та
n дорівнює 0, 1, 2 або 3.
Текст
Реферат: Спосіб стимулювання росту рослин, який включає обробку насіння або рослини, що проростає з насіння, ефективною кількістю щонайменше одного хітоолігосахариду (CO), причому при одержанні рослина характеризується щонайменше одним зі збільшеної врожайності рослини, вимірюваної в бушелях/акр, збільшеної кількості коренів, збільшеної довжини коренів, UA 114299 C2 МІНІСТЕРСТВО ЕКОНОМІЧНОГО РОЗВИТКУ І ТОРГІВЛІ УКРАЇНИ UA 114299 C2 збільшеної маси коренів, збільшеного об'єму коренів і збільшеної листової поверхні порівняно з необробленими рослинами або рослинами, одержаними з необробленого насіння. UA 114299 C2 5 10 15 20 25 30 35 40 45 50 55 ПЕРЕДУМОВИ ВИНАХОДУ [0001] Симбіоз між грамнегативними ґрунтовими бактеріями, Rhizobiaceae і Bradyrhizobiaceae, та бобовими рослинами, такими як соя, є переконливо підтвердженим документальними доказами. Біохімічна основа цих взаємозв'язків включає обмін молекулярними сигналами, де сигнальні сполуки, що передаються від рослини до бактерій, включають флавони, ізофлавони та флаванони, а сигнальні сполуки, що передаються від бактерій до рослини та включають кінцеві продукти експресії генів nod брадиризобій та ризобій, відомі як ліпохітоолігосахариди (LCO). Симбіоз між цими бактеріями та бобовими рослинами дозволяє бобовим рослинам фіксувати атмосферний азот, необхідний для росту рослин, таким чином, усувається потреба в азотних добривах. Оскільки азотні добрива можуть зумовлювати значне збільшення вартості сільськогосподарських культур і пов'язані з рядом ефектів забруднення, у сільськогосподарській промисловості тривають спроби використання цих біологічних взаємозв'язків та розробки нових засобів та способів для поліпшення врожайності рослин без збільшення використання добрив на основі азоту. [0002] У патенті США № 6979664 описується спосіб стимулювання проростання насіння або появи паростків рослинної культури, що включає етапи забезпечення композиції, яка містить ефективну кількість щонайменше одного ліпохітоолігосахариду та придатний з погляду сільського господарства носій, і застосування композиції в безпосередній близькості від насіння або паростка в ефективній кількості для стимулювання проростання насіння або появи паростків порівняно з необробленим насінням або паростком. [0003] Подальший розвиток цієї ідеї описується у WO 2005/062899, спрямованому на комбінації щонайменше одного індуктора для рослин, а саме LCO, у комбінації з фунгіцидом, інсектицидом або їх комбінацією для поліпшення характеристики рослин, такої як густота стояння, ріст, потужність та/або врожайність рослин. Ці композиції та способи, як описано, є застосовними як до бобових рослин, так і до рослин, що не належать до бобових, та їх можна застосовувати для обробки насіння (безпосередньо перед посівом), паростка, кореня або рослини. [0004] Аналогічно, у WO 2008/085958 описуються композиції для стимулювання росту рослин і врожайності культур як бобових рослин, так і рослин, що не належать до бобових, і при цьому композиції містять LCO у комбінації з іншим активним засобом, таким як хітин або хітозан, флавоноїдна сполука або гербіцид, та їх можна наносити на насіння та/або рослини одночасно або послідовно. Як і у випадку публікації '899, у публікації '958 описується обробка насіння безпосередньо перед посівом. [0005] Останнім часом у Halford, "Smoke Signals", Chem. Eng. News (12 квітня 2010 р.), на сторінках 37-38, повідомлялося, що карикіни або бутеноліди, які містяться в димі, діють як стимулятори росту та сприяють проростанню насіння після лісової пожежі, і можуть активувати насіння, наприклад, кукурудзи, різновидів томату, латуку та різновидів цибулі, яке зберігали. Ці молекули є об'єктом патенту США № 7576213. [0006] Проте усе ще існує потреба в системах для поліпшення або стимулювання росту рослин. КОРОТКИЙ ОПИС ВИНАХОДУ [0007] Перший аспект даного винаходу спрямований на спосіб стимулювання росту рослин, що включає a) обробку (наприклад, нанесення на) насіння або рослини, що проростає з насіння, ефективною кількістю щонайменше одного хітоолігосахариду (CO), при цьому при одержанні рослина характеризується щонайменше одним зі збільшеної врожайності рослини, вимірюваної в бушелях/акр, збільшеної кількості коренів, збільшеної довжини коренів, збільшеної маси коренів, збільшеного об'єму коренів і збільшеної листової поверхні порівняно з необробленими рослинами або рослинами, одержаними з необробленого насіння. [0008] У деяких варіантах здійснення застосовують щонайменше два CO. У деяких варіантах здійснення обробка насіння передбачає безпосереднє нанесення щонайменше одного CO на насіння, яке потім можна висівати або зберігати протягом періоду часу до посіву. Обробка насіння також може передбачати опосередковану обробку, наприклад, шляхом введення щонайменше одного CO у ґрунт (відомого в даній галузі техніки як нанесення у борозну). В інших варіантах здійснення щонайменше один CO можна наносити на рослину, яка проростає з насіння, наприклад, за допомогою розпилення на листя. Дані способи додатково можуть передбачати застосування інших агрономічно корисних засобів, наприклад, поживних мікроелементів, жирних кислот і їх похідних, сигнальних молекул для рослин (відмінних від CO), наприклад, ліпохітоолігосахаридів, хітинових сполук (відмінних від CO), флавоноїдів, жасмонової кислоти, лінолевої кислоти та ліноленової кислоти та їх похідних, а також карикінів), 1 UA 114299 C2 5 10 15 20 25 30 35 40 45 50 55 60 гербіцидів, фунгіцидів та інсектицидів, мікроорганізмів, що солюбілізують фосфати, діазотрофів (ризобіальних інокулянтів) і/або мікоризних грибів. [0009] Спосіб за даним винаходом є застосовним до бобових рослин так само, як і до рослин, що не належать до бобових. У деяких варіантах здійснення насіння бобової рослини являє собою насіння сої. У деяких інших варіантах здійснення насіння, яке обробляють, являє собою насіння рослини, що не належить до бобових, наприклад, насіння польової культури, наприклад, зернової культури, такої як кукурудза, або насіння овочевої культури, такої як картопля. [0010] Як продемонстровано в робочих прикладах, у яких узагальнені експерименти, проведені як у теплиці, так і в польових умовах, результати, досягнуті за допомогою способів за даним винаходом, демонструють, що нанесення щонайменше одного CO на насіння або рослину, яка проростає з насіння, приводить у результаті до стимульованого росту рослин. Ці результати вважаються неочікуваними, зокрема, виходячи з тієї точки зору, що CO, як відомо, беруть участь у системній набутій стійкості (SAR), але не обов'язково залучені в безпосереднє стимулювання росту рослин. Результати, описані в даному документі, демонструють, що в деяких випадках способи за даним винаходом приводили до досягнення фактично однакового ефекту або в деяких інших випадках перевершували стимулювання росту рослин, досягнуте за допомогою LCO. Результати, одержані з експериментів у теплиці, є особливо важливими в тому відношенні, що їх проводили в умовах фактичної відсутності захворювань. КОРОТКИЙ ОПИС ГРАФІЧНИХ МАТЕРІАЛІВ [0011] На Фіг. 1а і 2а показані хімічні структури хітоолігосахаридних сполук (CO), придатних при здійсненні даного винаходу. [0012] На Фіг. 1b і 2b показані хімічні структури відповідних ліпохітоолігосахаридних сполук (LCO), які відповідають CO на Фіг. 1a і 2a, і які також є придатними при здійсненні даного винаходу. [0013] На Фіг. 3а і 4а показані хімічні структури інших CO, придатних при здійсненні даного винаходу. [0014] На Фіг. 3b і 4b показані хімічні структури Myc-факторів, які відповідають CO на Фіг. 3a і 3b і які також є придатними при здійсненні даного винаходу. [0015] Фіг. 5 являє собою стовпчасту діаграму, на якій проілюстрований вплив CO за даним -7 -8 -9 винаходом (проілюстрованого на Фіг. 2a) у трьох різних концентраціях (10 , 10 та 10 M) порівняно із двома різними джерелами LCO, проілюстрованого на Фіг. 1b, та контролем, якими обробляли насіння томату, виражений через показник середньої довжини коренів проростка. [0016] Фіг. 6 являє собою стовпчасту діаграму, на якій проілюстрований вплив CO за даним -7 -8 -9 винаходом (проілюстрованого на Фіг. 2a) у трьох різних концентраціях (10 , 10 та 10 M) порівняно із двома різними джерелами LCO, проілюстрованого на Фіг. 1b, та контролем, якими обробляли насіння томату, виражений через показник середньої сирої ваги коренів проростка. [0017] Фіг. 7 являє собою стовпчасту діаграму, на якій проілюстрований вплив CO за даним винаходом (проілюстрованого на Фіг. 2a) при середньому значенні концентрації (з трьох концентрацій) порівняно із двома різними джерелами LCO, проілюстрованого на Фіг. 1b, якими обробляли насіння томату, виражений через показник середньої довжини коренів проростка. [0018] Фіг. 8 являє собою стовпчасту діаграму, на якій проілюстрований вплив CO за даним винаходом (проілюстрованого на Фіг. 2a) при середньому значенні концентрації (з трьох концентрацій) порівняно із двома різними джерелами LCO, проілюстрованого на Фіг. 1b, якими обробляли насіння томату, виражений через показник середньої сирої ваги коренів проростка. [0019] Фіг. 9 являє собою стовпчасту діаграму, на якій проілюстрований вплив CO за даним винаходом (проілюстрованого на Фіг. 2a) порівняно із LCO, проілюстрованим на Фіг. 2b, та контролем, якими обробляли насіння бавовнику, виражений через показник середньої сухої ваги кожного проростка на обробку. [0020] Фіг. 10 (випробування 1) та 11 (випробування 2) являють собою стовпчасті діаграми, на яких показаний вплив CO, проілюстрованого на Фіг. 2a, порівняно із LCO, проілюстрованим на Фіг. 2b, та сумішшю (що не відносяться до даного винаходу) хітинових сполук, одержаних за допомогою хітинази, якими обробляли насіння кукурудзи, вираженний через показник середньої сухої ваги пагонів, коренів і загальної сухої ваги (об'єднаної сухої ваги пагонів і коренів). [0021] Фіг. 12 являє собою стовпчасту діаграму, на якій проілюстрований вплив CO, проілюстрованого на Фіг. 2a, порівняно із LCO, проілюстрованим на Фіг. 2b, сумішшю CO, одержаною за допомогою хітинази, ізофлавоноїдом і контролем, якими обробляли насіння сої, виражений через показник площі листової поверхні. [0022] Фіг. 13 являє собою стовпчасту діаграму, на якій проілюстрований вплив CO, проілюстрованого на Фіг. 2a, LCO, проілюстрованого на Фіг. 1b, ізофлавоноїду та суміші 2 UA 114299 C2 5 10 15 20 25 30 35 40 45 50 55 хітинових сполук, що не відносяться до даного винаходу (одержаних із хітозану за допомогою ферментативного процесу), якими обробляли насіння сої, виражений через показник середньої сухої ваги рослин сої. [0023] Фіг. 14 являє собою стовпчасту діаграму, на якій проілюстрований вплив CO, проілюстрованого на Фіг. 2a, окремо або в комбінації з однією або двома різними жирними кислотами порівняно із LCO, проілюстрованим на Фіг. 2b, та водою на деформацію кореневих волосків сиратро, виражену у відсотках. [0024] Фіг. 15 являє собою діаграму, на якій проілюстрований вплив CO, проілюстрованого на Фіг. 2a, окремо або в комбінації з однією або двома різними жирними кислотами порівняно із LCO, проілюстрованим на Фіг. 2b, та водою, якими обробляли насіння каноли, виражений через показник відсотка проростання насіння. [0025] Фіг. 16 являє собою діаграму, на якій проілюстрований вплив CO, проілюстрованого на Фіг. 2a, окремо або в комбінації з однією або двома різними жирними кислотами порівняно із LCO, проілюстрованим на Фіг. 2b, та водою, якими обробляли насіння пшениці, виражений через показник відсотка проростання насіння. [0026] Фіг. 17 являє собою діаграму, на якій проілюстрований вплив CO, проілюстрованого на Фіг. 2a, окремо або в комбінації з однією або двома різними жирними кислотами порівняно із LCO, проілюстрованим на Фіг. 2b, та водою, якими обробляли насіння люцерни, виражений через показник відсотка проростання насіння. [0027] Фіг. 18 являє собою кругову діаграму, на якій проілюстрований вплив CO, проілюстрованого на Фіг. 2a, окремо або в комбінації з однією із двох різних жирних кислот, порівняно із LCO, проілюстрованим на Фіг. 2b, та водою, якими обробляли насіння кукурудзи, виражений через показник відсотка проростання насіння. [0028] Фіг. 19 являє собою діаграму, на якій проілюстрований вплив CO, проілюстрованого на Фіг. 2a, окремо або в комбінації з однією із двох різних жирних кислот, порівняно із LCO, проілюстрованим на Фіг. 2b, кожною із жирних кислот окремо та контролем, якими обробляли насіння кукурудзи, виражений через показник відсотка проростання насіння. [0029] Фіг. 20 являє собою діаграму, на якій проілюстрований вплив CO, проілюстрованого на Фіг. 2a, окремо або в комбінації з однією із двох різних жирних кислот, CO разом із обома жирними кислотами порівняно із LCO, проілюстрованим на Фіг. 2b, та контролем, якими обробляли насіння пшениці, виражений через показник відсотка проростання насіння. [0030] Фіг. 21 являє собою стовпчасту діаграму, на якій проілюстрований вплив CO, проілюстрованого на Фіг. 2a, окремо або в комбінації з однією із чотирьох різних жирних кислот, порівняно із LCO, проілюстрованим на Фіг. 2b, та водою, якими обробляли насіння Vicia sativa, виражений через показник відсотка проростання насіння. [0031] Фіг. 22 являє собою стовпчасту діаграму, на якій проілюстрований вплив CO, проілюстрованого на Фіг. 2a, окремо або в комбінації з однією із двох жирних кислот порівняно із LCO, проілюстрованим на Фіг. 2b, та контролем, якими обробляли корені Vicia sativa, виражений через показник середньої довжини коренів. [0032] Фіг. 23 являє собою стовпчасту діаграму, на якій проілюстрований вплив CO, проілюстрованого на Фіг. 2a, окремо або в комбінації з однією із двох різних жирних кислот, порівняно із LCO, проілюстрованим на Фіг. 2b, та водою, якими обробляли насіння зеленого машу, лобії, червоної сочевиці та червоної конюшини, виражений через показник відсотка проростання насіння. [0033] Фіг. 24 являє собою стовпчасту діаграму, на якій проілюстрований вплив CO, проілюстрованого на Фіг. 2a, окремо або в комбінації з однією із двох різних жирних кислот, порівняно із LCO, проілюстрованим на Фіг. 2b, та водою на ріст проростків томату, виражений через показник середньої довжини коренів. [0034] Фіг. 25 являє собою стовпчасту діаграму, на якій проілюстрований вплив CO, проілюстрованого на Фіг. 2a, окремо або в комбінації з однією із двох різних жирних кислот, порівняно із LCO, проілюстрованим на Фіг. 1b, на насіння сої, виражений через показник середньої довжини зародкового кореня. [0035] Фіг. 26 являє собою стовпчасту діаграму, на якій проілюстрований вплив CO, проілюстрованого на Фіг. 2a, порівняно із LCO, проілюстрованим на Фіг. 2b, та водою, якими обробляли насіння бавовнику, виражений через показник середньої сухої ваги рослин. [0036] Фіг. 27 являє собою стовпчасту діаграму, на якій проілюстрований вплив CO, проілюстрованого на Фіг. 2a, порівняно із LCO, проілюстрованим на Фіг. 1b, і сумішшю CO, одержаних за допомогою хітинази, якими обробляли рослини сої, виражений через показник середньої сухої біомаси рослин. 3 UA 114299 C2 5 10 15 20 25 30 35 [0037] Фіг. 28 являє собою стовпчасту діаграму, на якій проілюстрований вплив CO, проілюстрованого на Фіг. 2a, окремо або в комбінації з LCO, проілюстрованим на Фіг. 2b, порівняно із LCO, проілюстрованим на Фіг. 2b, та водою, якими обробляли насіння кукурудзи, виражений через показник середньої сухої ваги рослин. [0038] Фіг. 29 являє собою стовпчасту діаграму, на якій проілюстрований вплив CO, проілюстрованого на Фіг. 2a, окремо або в комбінації з LCO, проілюстрованим на Фіг. 2b, порівняно із LCO, проілюстрованим на Фіг. 2b, та водою, якими обробляли насіння сорго, виражений через показник середньої довжини коренів проростків. [0039] Фіг. 30 являє собою стовпчасту діаграму, на якій проілюстрований вплив CO, проілюстрованого на Фіг. 2a, окремо або у комбінації з поживним мікроелементом порівняно із водою, якими обробляли рослини бавовнику, виражений через показник середнього вмісту хлорофілу. [0040] Фіг. 31 являє собою стовпчасту діаграму, на якій проілюстрований вплив CO, проілюстрованого на Фіг. 2a, окремо або у комбінації з поживним мікроелементом порівняно із водою, якими обробляли рослини бавовнику, виражений через показник середньої сухої ваги рослин. ДОКЛАДНИЙ ОПИС Хітоолігосахариди [0041] CO відомі в даній галузі техніки як структури на основі N-ацетилглюкозамінів, зв'язаних β-1-4-зв'язками, визначені як олігомери хітину, а також як N-ацетилхітоолігосахариди. CO мають унікальні та різні фрагменти бічного ланцюга, які відрізняють їх від молекул хітину [(C8H13NO5)n, № згідно із CAS 1398-61-4], і молекул хітозану [(C5H11NO4)n, № згідно із CAS 901276-4]. Див., наприклад, Hamel, et al., Planta 232:787-806 (2010) (наприклад, Фіг. 1, на якій показані структури хітину, хітозану, Nod-Факторів (LCO) і відповідних CO (які не будуть містити 18C, 16C або 20C ацильну групу)). CO за даним винаходом також є відносно розчинними у воді порівняно із хітином і хітозаном, і в деяких варіантах здійснення, описаних нижче в даному документі, вони є пентамерними. Типова література, у якій описана структура та одержання CO, які можуть бути підходящими для застосування згідно із даним винаходом, являє собою наступне: Muller, et al., Plant Physiol. 124:733-9 (2000) (наприклад, Фіг. 1 у цьому документі); Van der Holst, et al., Current Opinion in Structural Biology, 11:608-616 (2001) (наприклад, Фіг. 1 в цьому документі); Robina, et al., Tetrahedron 58:521-530 (2002); D'Haeze, et al., Glycobiol. 12(6):79R105R (2002); Rouge, et al. Глава 27, "Молекулярна імунологія складних вуглеводів" ("The Molecular Immunology of Complex Carbohydrates") в Advances in Experimental Medicine and Biology, Springer Science; Wan, et al., Plant Cell 21:1053-69 (2009); патентний документ PCT/F100/00803 (9/21/2000); і Demont-Caulet, et al., Plant Physiol. 120(1):83-92 (1999). [0042] У тому, що стосується структури, CO відрізняються від LCO, головним чином, тим, що вони не містять бічний ланцюг жирної кислоти. CO, одержані з ризобій, та їх синтетичні похідні, що не зустрічаються в природі, які можуть бути придатними при здійсненні даного винаходу, можуть бути представлені наступною формулою: 40 45 , [0043] де кожний з R1 та R2 незалежно являє собою водень або метил; R3 являє собою водень, ацетил або карбамоїл; R4 являє собою водень, ацетил або карбамоїл; R 5 являє собою водень, ацетил або карбамоїл; R6 являє собою водень, арабінозил, фукозил, ацетил, естер сірчаної кислоти, 3-0-S-2-0-MeFuc, 2-0-MeFuc і 4-0-AcFuc; R7 являє собою водень, манозил або гліцерин; R8 являє собою водень, метил або -CH2OH; R9 являє собою водень, арабінозил або фукозил; R10 являє собою водень, ацетил або фукозил; та n дорівнює 0, 1, 2 або 3. Структури відповідних ризобіальних LCO описані в D'Haeze, et al., вище. 4 UA 114299 C2 5 10 [0044] Два CO, придатних для застосування згідно із даним винаходом, проілюстровані на Фіг. 1a і 2a. Вони відповідають LCO, які продукуються Bradyrhizobium japonicum і Rhizobium leguminosarum біовар viciae, які вступають у симбіотичну взаємодію із соєю та горохом, відповідно, але не містять ланцюги жирної кислоти. Відповідні LCO, що продукуються цими ризобіями (і які також є придатними при здійсненні даного винаходу), проілюстровані на Фіг. 1b і 2b. [0045] Структури інших CO, які можуть бути придатними для застосування згідно із даним винаходом, можна легко одержувати з LCO, одержаних (тобто виділених і/або очищених) з мікоризних грибів, таких як гриби із групи Glomerocycota, наприклад, Glomus intraradices. Див., наприклад, патентний документ WO 2010/049751 та Maillet, et al., Nature 469:58-63 (2011) (LCO, описані у цих документах, також називаються "Myc-факторами"). Типові CO, одержані з мікоризних грибів, представлені наступною структурою: , 15 20 25 30 35 40 45 де n = 1 або 2; R1 являє собою водень або метил; та R2 являє собою водень або SO3H. Два інших CO, придатних для застосування згідно із даним винаходом, один з яких є сульфатованим, а інший не є сульфатованим, проілюстровані на Фіг. 3a і 4a, відповідно. Вони відповідають вищезгаданим двом різним LCO, що продукуються мікоризними грибами Glomus intraradices, які проілюстровані на Фіг. 3b і 4b (і вони також є придатними при здійсненні даного винаходу). [0046] CO можуть бути синтетичними або рекомбінантними. Способи одержання синтетичних CO описані, наприклад, у Robina, вище. Способи одержання рекомбінантних CO, наприклад, із використанням E. coli у якості хазяїна, відомі в даній галузі техніки. Див., наприклад, Dumon, et al., ChemBioChem 7:359-65 (2006), Samain, et al., Carbohydrate Res. 302:35-42 (1997); Cottaz, et al., Meth. Eng. 7(4):311-7 (2005); і Samain, et al., J. Biotechnol 72:33-47 (1999) (наприклад, Фіг. 1 у цьому документі, на якій показані структури CO, які можна одержувати за допомогою технології рекомбінантної ДНК з E. coli, що містять різні комбінації генів nodBCHL). Для цілей даного винаходу щонайменше один CO відрізняється за структурою від хітинів, хітозанів та інших хітоолігосахаридів, одержаних ферментативним шляхом із використанням хітину як вихідного матеріалу. [0047] Для цілей даного винаходу щонайменше один рекомбінантний CO є щонайменше на 60 % чистим, наприклад, щонайменше на 60 % чистим, щонайменше на 65 % чистим, щонайменше на 70 % чистим, щонайменше на 75 % чистим, щонайменше на 80 % чистим, щонайменше на 85 % чистим, щонайменше на 90 % чистим, щонайменше на 91 % чистим, щонайменше на 92 % чистим, щонайменше на 93 % чистим, щонайменше на 94 % чистим, щонайменше на 95 % чистим, щонайменше на 96 % чистим, щонайменше на 97 % чистим, щонайменше на 98 % чистим, щонайменше на 99 % чистим, аж до 100 % чистоти. [0048] Насіння можна обробляти щонайменше одним CO у декілька способів, наприклад, за допомогою розпилення або розбризкування. Обробку за допомогою розпилення та розбризкування можна проводити шляхом складання ефективної кількості щонайменше одного CO у прийнятному з позиції сільського господарства носії, звичайно, водному за своєю природою, та розпилення або розбризкування композиції на насіння за допомогою системи для безперервної обробки (відрегульованої для застосування обробки із заздалегідь заданою нормою пропорційно до постійного розходу насіння), наприклад, обладнання для обробки барабанного типу. У цих способах переважно використовують порівняно невеликі об'єми носія для того, щоб забезпечити порівняно швидке висушування обробленого насіння. У такий спосіб можна ефективно обробляти більші обсяги насіння. Також можна використовувати системи для роботи з партіями, у яких попередньо визначений розмір партії насіння і композицій на основі 5 UA 114299 C2 5 10 15 20 25 30 35 40 45 50 55 сигнальної молекули доставляють у мішалку. Системи та установки для здійснення цих способів є комерційно доступними від численних постачальників, наприклад, Bayer CropScience (Gustafson). [0049] В іншому варіанті здійснення обробка передбачає нанесення покриття на насіння із використанням щонайменше одного CO. Один такий спосіб включає покривання внутрішньої стінки сферичного контейнера композицією, додавання насіння, потім обертання контейнера для приведення насіння у контакт зі стінкою та композицією, при цьому спосіб відомий у даній галузі техніки як "нанесення покриття за допомогою контейнера". На насіння можна наносити покриття за допомогою комбінацій способів нанесення покриття. Просочування, звичайно, передбачає застосування водного розчину, що містить засіб, який стимулює ріст рослин. Наприклад, насіння можна просочувати протягом періоду від приблизно 1 хвилини до приблизно 24 годин (наприклад, протягом щонайменше 1 хв., 5 хв., 10 хв., 20 хв., 40 хв., 80 хв., 3 год., 6 год., 12 год., 24 год.). Деякі типи насіння (наприклад, насіння сої) виявляють чутливість до вологості. Таким чином, просочування такого насіння протягом тривалого періоду часу може бути небажаним, у цьому випадку просочування звичайно здійснюють протягом від приблизно 1 хвилини до приблизно 20 хвилин. [0050] У тих варіантах здійснення, які передбачають зберігання насіння після нанесення щонайменше одного CO, прилипання CO до насіння протягом будь-якого періоду часу, що перевищує період зберігання, не є вирішальним. Не бажаючи обмежуватися будь-якою конкретною теорією дій, заявники припускають, що навіть у тих випадках, коли обробка може не викликати те, що сигнальна молекула для рослин залишається в контакті з поверхнею насіння після обробки та під час будь-якого періоду зберігання, CO може забезпечувати досягнення передбачуваного ефекту внаслідок явища, відомого як пам'ять насіння або сприйняття насіння. Див., Macchiavelli, et al., J. Exp. Bot. 55(408):1635-40 (2004). Заявники також припускають, що після обробки CO дифундує в напрямку до молодого зародкового кореня, що розвивається, і активує гени, пов'язані із симбіозом і розвитком, що зумовлює зміну будови коренів рослини. Проте, у випадках, коли це бажано, композиції, що містять CO, можуть додатково містити клейкий або покривний засіб. З естетичною метою композиції можуть додатково містити покривний полімер та/або барвник. [0051] Кількість щонайменше одного CO є ефективною для стимулювання росту, так що при одержанні рослина характеризується щонайменше одним зі збільшеної врожайності рослини, вимірюваної в бушелях/акр, збільшеної кількості коренів, збільшеної довжини коренів, збільшеної маси коренів, збільшеного об'єму коренів і збільшеної листової поверхні порівняно з необробленими рослинами або рослинами, одержаними з необробленого насіння (не обробленого жодним з активних засобів). Ефективна кількість щонайменше одного CO, використовуваного для обробки насіння, яка виражена в одиницях концентрації, як правило, -5 -14 знаходиться в діапазоні від приблизно 10 до приблизно 10 M (молярна концентрація), і в -5 -11 деяких варіантах здійснення від приблизно 110 до приблизно 10 M, і в деяких інших -7 -8 варіантах здійснення від приблизно 10 до приблизно 10 M. Ефективна кількість, виражена в одиницях маси, як правило, знаходиться в діапазоні від приблизно 1 до приблизно 400 мкг/хандредвейт (cwt) насіння, і в деяких варіантах здійснення від приблизно 2 до приблизно 70 мкг/cwt, і в деяких інших варіантах здійснення від приблизно 2,5 до приблизно 3,0 мкг/cwt насіння. [0052] Для цілей опосередкованої обробки насіння, тобто обробки в борозні, ефективна кількість щонайменше одного CO, як правило, знаходиться в діапазоні від 1 мкг/акр до приблизно 70 мкг/акр і в деяких варіантах здійснення від приблизно 50 мкг/акр до приблизно 60 мкг/акр. Для цілей нанесення на рослини ефективна кількість LCO, як правило, знаходиться в діапазоні від 1 мкг/акр до приблизно 30 мкг/акр і в деяких варіантах здійснення від приблизно 11 мкг/акр до приблизно 20 мкг/акр. [0053] Насіння можна обробляти щонайменше одним CO безпосередньо перед або під час посіву. Обробка під час посіву може передбачати безпосереднє нанесення на насіння, як описано вище, або в деяких інших варіантах здійснення застосування шляхом введення активних засобів у ґрунт, відоме в даній галузі техніки як обробка в борозні. У тих варіантах здійснення, які передбачають обробку насіння з наступним зберіганням, насіння потім можна пакувати, наприклад, у мішки на 50 фунтів або 100 фунтів, або мішки для сипких матеріалів, або контейнери відповідно до стандартних методик. Насіння можна зберігати протягом щонайменше 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 або 12 місяців і навіть довше, наприклад, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36 місяців або навіть довше у відповідних умовах зберігання, відомих у даній галузі техніки. У той час як насіння сої 6 UA 114299 C2 5 10 15 20 25 30 35 40 45 50 55 60 може підлягати посіву в наступний сезон, насіння кукурудзи можна зберігати протягом набагато триваліших періодів часу, у тому числі понад 3 роки. Інші агрономічно корисні засоби [0054] Даний винахід додатково може передбачати обробку насіння або рослин, які проростають із насіння, корисним з погляду сільського господарства/агрономічно корисним засобом. Використовуваний у даному документі та у даній галузі техніки вираз "корисний з погляду сільського господарства або агрономічно корисний" стосується засобів, які у випадку застосування до насіння або рослин зумовлюють стимулювання (яке може бути статистично значущим) характеристик рослин, таких як густота стояння, ріст (наприклад, як визначено щодо CO) або потужність, порівняно з необробленим насінням або рослинами. Ці засоби можна складати разом із щонайменше одним CO або наносити на насіння або рослину у вигляді окремих складів. Типові приклади цих засобів, які можуть бути придатними при здійсненні даного винаходу, включають поживні мікроелементи (наприклад, вітаміни та слідові елементи), жирні кислоти та їх похідні, сигнальні молекули для рослин (відмінні від CO), гербіциди, фунгіциди й інсектициди, мікроорганізми, що солюбілізують фосфати, діазотрофи (ризобіальні інокулянти) і/або мікоризні гриби. Поживні мікроелементи [0055] Типові вітаміни, які можуть бути придатними при здійсненні даного винаходу, включають пантотенат кальцію, фолієву кислоту, біотин і вітамін C. Типові приклади слідових елементів, які можуть бути придатними при здійсненні даного винаходу, включають бор, хлор, марганець, залізо, цинк, мідь, молібден, нікель, селен і натрій. [0056] Кількість щонайменше одного поживного мікроелемента, використовуваного для обробки насіння, яка виражена в одиницях концентрації, як правило, знаходиться в діапазоні від 10 частин на мільйон до 100 частин на мільйон і в деяких варіантах здійснення від приблизно 2 частин на мільйон до приблизно 100 частин на мільйон. В одному варіанті здійснення ефективна кількість, виражена в одиницях маси, як правило, знаходиться в діапазоні від приблизно 180 мкг до приблизно 9 мг/хандредвейт (cwt) насіння і в деяких варіантах здійснення від приблизно 4 мкг до приблизно 200 мкг/рослина при нанесенні на листя. Інакше кажучи, для цілей обробки насіння ефективна кількість щонайменше одного поживного мікроелемента, як правило, перебуває в діапазоні від 30 мкг/акр до приблизно 1,5 мг/акр і в деяких варіантах здійснення від приблизно 120 мг/акр до приблизно 6 г/акр при позакореневому внесенні. Жирні кислоти [0057] Типові жирні кислоти, які можуть бути придатними при здійсненні даного винаходу, включають жирні кислоти, які є замісниками у LCO, що зустрічаються в природі, наприклад, стеаринову та пальмітинову кислоти. Інші жирні кислоти, які можуть бути придатними, включають насичені C12-18 жирні кислоти, які (окрім пальмітинової та стеаринової кислот) включають лауринову кислоту та міристинову кислоту, і ненасичені C12-18 жирні кислоти, такі як міристолеїнова кислота, пальмітолеїнова кислота, сапієнова кислота, олеїнова кислота, елаїдинова кислота, вакценова кислота, лінолева кислота, ліноленова кислота та ліноелаїдинова кислота. Лінолева кислота та ліноленова кислота утворюються к ході біосинтезу жасмонової кислоти (яка, як описано нижче, також є агрономічно корисним засобом для цілей даного винаходу). Як повідомляється, лінолева кислота та ліноленова кислота (та їх похідні) є індукторами експресії гена nod або утворення LCO ризобактеріями. Див., наприклад, Mabood, Fazli, "Linoleic and linolenic acid induce the expression of nod genes in Bradyrhizobium japonicum, " USDA 3, May 17, 2001. [0058] Придатні похідні жирних кислот, які можуть бути придатними для здійснення даного винаходу, включають естери, аміди, глікозиди та солі. Типові естери являють собою сполуки, у яких карбоксильна група жирної кислоти, наприклад, лінолевої кислоти та ліноленової кислоти 1 1 була замінена на групу --COR, де R являє собою групу --OR , у якій R являє собою алкільну групу, наприклад, нерозгалужену або розгалужену C1-C8алкільну групу, наприклад, метильну, етильну або пропільну групу; алкенільну групу, наприклад, нерозгалужену або розгалужену C 2C8алкенільну групу; алкінільну групу, наприклад, нерозгалужену або розгалужену C 2C8алкінільну групу; арильну групу, що має, наприклад, 6-10 атомів вуглецю; або гетероарильну групу, що має, наприклад, 4-9 атомів вуглецю, де гетероатоми у гетероарильній групі можуть являти собою, наприклад, N, O, P або S. Типові аміди являють собою сполуки, у яких карбоксильна група жирної кислоти, наприклад, лінолевої кислоти та ліноленової кислоти була 2 3, 2 3 замінена на групу --COR, де R являє собою групу NR R у якій R та R незалежно являють собою водень, алкільну групу, наприклад, нерозгалужену або розгалужену C 1-C8алкільну групу, наприклад, метильну, етильну або пропільну групу; алкенільну групу, наприклад, нерозгалужену або розгалужену C2-C8алкенільну групу; алкінільну групу, наприклад, нерозгалужену або 7 UA 114299 C2 5 10 15 20 25 30 35 40 розгалужену C2-C8алкінільну групу; арильну групу, що має, наприклад, 6-10 атомів вуглецю; або гетероарильну групу, що має, наприклад, 4-9 атомів вуглецю, де гетероатоми у гетероарильній групі можуть являти собою, наприклад, N, O, P або S. Естери можна одержувати за допомогою відомих способів, наприклад, каталізованого кислотою нуклеофільного приєднання, де здійснюють реакцію карбонової кислоти зі спиртом за присутності каталітичної кількості мінеральної кислоти. Аміди також можна одержувати за допомогою відомих способів, наприклад, шляхом реакції карбонової кислоти з відповідним аміном за присутності сполучної речовини, такої як дициклогексилкарбодіімід (DCC), у нейтральних умовах. Придатні солі жирних кислот, наприклад, солі лінолевої кислоти та ліноленової кислоти включають, наприклад, солі приєднання основи. Основи, які можна застосовувати як реактиви для одержання метаболічно прийнятних основних солей цих сполук, включають ті, які отримані з катіонами, наприклад, катіонами лужних металів (наприклад, калію і натрію) та катіонами лужноземельних металів (наприклад, кальцію і магнію). Ці солі можна легко одержувати за допомогою змішування розчину жирної кислоти з розчином основи. Цю сіль можна осаджувати з розчину та збирати за допомогою фільтрації або можна вилучати за допомогою інших засобів, наприклад, за допомогою випарювання розчинника. [0059] Кількості жирної кислоти або її похідної, як правило, становлять від приблизно 10 % до приблизно 30 % і в деяких варіантах здійснення приблизно 25 % від кількості щонайменше одного CO. Сигнальні молекули для рослин [0060] Даний винахід також може передбачати обробку насіння або рослини сигнальною молекулою для рослин, що відрізняється від LCO. Для цілей даного винаходу вираз "сигнальна молекула для рослин", який можна використовувати взаємозамінно із "засобом, що стимулює ріст рослин", в цілому, стосується будь-якого засобу, як того, що зустрічається в природі у рослин або мікробів, так і синтетичного (який може бути таким, що не зустрічається в природі), який безпосередньо або опосередковано активує біохімічний шлях рослин, що зумовлює збільшений ріст рослин, вимірюваний щонайменше в показниках щонайменше одного зі збільшеної врожайності, що вимірюється в бушелях/акр, збільшеної кількості коренів, збільшеної довжини коренів, збільшеної маси коренів, збільшеного об'єму коренів і збільшеної листової поверхні порівняно з необробленими рослинами або рослинами, отриманими з необробленого насіння. Типові приклади сигнальних молекул для рослин, які можуть бути придатними для здійснення даного винаходу, включають ліпохітоолігосахариди, хітинові сполуки (відмінні від CO), флавоноїди, жасмонову кислоту, лінолеву кислоту та ліноленову кислоту й їх похідні (вище), а також карикіни. [0061] Ліпохітоолігосахаридні сполуки (LCO), також відомі у даній галузі техніки як симбіотичні Nod-сигнали або Nod-фактори, складаються з олігосахаридного кістяка із залишків N-ацетил-D-глюкозаміну ("GIcNAc"), зв'язаних β-1,4-зв'язком, із N-зв'язаним ланцюгом жирного ацилу, конденсованим на невідновлювальному кінці. LCO відрізняються за числом залишків GIcNAc у кістяку, за довжиною та ступенем насиченості ланцюга жирного ацилу та за заміщенням відновлювальних та невідновлювальних цукрових залишків. Див., наприклад, Denarie, et al., Ann. Rev. Biochem. 65:503-35 (1996), Hamel, et al., вище., Prome, et al., Pure & Appl. Chem. 70(1):55-60 (1998). Приклад LCO представлений нижче як формула I, , 45 де G являє собою гексозамін, який може бути заміщений, наприклад, ацетильною групою за азотом, сульфатною групою, ацетильною групою та/або ефірною групою за киснем, 8 UA 114299 C2 5 10 15 20 25 30 R1, R2, R3, R5, R6 і R7, які можуть бути ідентичними або різними, являють собою H, CH3CO--, CxHyCO--, де x являє собою ціле число від 0 до 17, а y являє собою ціле число від 1 до 35, або будь-яку іншу ацильну групу, таку як, наприклад, карбамоїл, R4 являє собою аліфатичний ланцюг із одним, двома або трьома ненасиченими зв'язками, який містить щонайменше 12 атомів вуглецю, а n являє собою ціле число від 1 до 4. [0062] LCO можна одержувати (наприклад, виділяти та/або очищувати) з бактерій, таких як ризобії, наприклад, Rhizobium sp., Bradyrhizobium sp., Sinorhizobium sp. та Azorhizobium sp. Структура LCO є характерною для кожного такого виду бактерій, і кожний штам може продукувати декілька LCO з різними структурами. Наприклад, конкретні LCO з S. meliloti також були описані в патенті США № 5549718, причому вони мають формулу II, , де R являє собою H або CH3CO-, а n дорівнює 2 або 3. [0063] Ще більш конкретні LCO включають NodRM, NodRM-1, NodRM-3. Під час ацетилювання (R=CH3CO--) вони перетворюються на AcNodRM-1 і AcNodRM-3, відповідно (патент США № 5545718). [0064] LCO з Bradyrhizobium japonicum описані у патентах США №№ 5175149 і 5321011. Загалом, вони являють собою пентасахаридні фітогормони, що містять метилфукозу. Описана низка цих LCO, одержаних з B. japonicum: BjNod-V (C18:1); BjNod-V (Ac, C18:1), BjNod-V (C16:1) і BjNod-V (Ac, C16:0), при цьому "V" позначає наявність п'яти N-ацетилглюкозамінів; "Ac" ацетилювання; число після "C" позначає число атомів вуглецю у бічному ланцюзі жирної кислоти; і число після ":" - число подвійних зв'язків. [0065] LCO, що застосовуються у варіантах здійснення даного винаходу, можна одержувати (тобто виділяти та/або очищувати) зі штамів бактерій, які продукують LCO, таких як штами Azorhizobium, Bradyrhizobium (у тому числі B. japonicum), Mesorhizobium, Rhizobium (у тому числі R. leguminosarum), Sinorhizobium (у тому числі S. meliloti) і штамів бактерій, сконструйованих за допомогою генної інженерії так, що вони продукують LCO. [0066] LCO є головними визначними чинниками для специфічності щодо хазяїна у симбіозі з бобовими рослинами (Diaz, et al., Mol. Plant-Microbe Interactions 13:268-276 (2000)). Таким чином, у межах родини бобових у певних родів і видів ризобій виникають симбіотичні взаємозв'язки, пов'язані з фіксацією азоту, з певним хазяїном, що належить до бобових рослин. Ці комбінації рослина-хазяїн/бактерії описані в Hungria, et al., Soil Biol. Biochem. 29:819-830 (1997), при цьому приклади цих симбіотичних партнерських відносин бактерія/бобова рослина включають S. meliloti/люцерна та буркун білий; R. leguminosarum біовар viciae/різновиди гороху 9 UA 114299 C2 5 10 15 20 25 30 35 40 та різновиди сочевиці; R. leguminosarum біовар phaseoli/різновиди квасолі; Bradyrhizobium japonicum/різновиди сої та R. leguminosarum біовар trifolii/червона конюшина. Hungria також перераховує ефективні флавоноїдні індуктори генів Nod з видів ризобій і структури конкретних LCO, які продукуються різними видами ризобій. Проте, специфічність LCO необхідна тільки для забезпечення утворення бульбочок у бобових рослин. У здійсненні даного винаходу застосування даного LCO не обмежується обробкою насіння його симбіотичного партнера, що належить до бобових рослин, для досягнення збільшеної врожайності рослин, що вимірюється в бушелях/акр, збільшеної кількості коренів, збільшеної довжини коренів, збільшеної маси коренів, збільшеного об'єму коренів і збільшеної листової поверхні порівняно з рослинами, одержаними з необробленого насіння, або порівняно з рослинами, одержаними з насіння, обробленого сигнальною молекулою безпосередньо перед посівом або в межах тижня до посіву або менше. [0067] Таким чином, у якості додаткових прикладів, LCO і їх похідні, що не зустрічаються в природі, які можуть бути придатними при здійсненні даного винаходу, представлені наступною формулою: де R1 являє собою C14:0, 3OH-C14:0, ізо-C15:0, C16:0, 3-OH-C16:0, ізо-C15:0, C16:1, C16:2, C16:3, ізо-C17:0, ізо-C17:1, C18:0, 3OH-C18:0, C18:0/3-OH, C18:1, OH-C18:1, C18:2, C18:3, C18:4, C19:1, карбамоїл, C20:0, C20:1, 3-OH-C20:1, C20:1/3-OH, C20:2, C20:3, C22:1 і C18-26(ω1)-OH (що згідно із D'Haeze, et al., вище, охоплює C18, C20, C22, C24 і C26 гідроксильовані групи та C16:1Δ9, C16:2 (Δ2,9) і C16:3 (Δ2,4,9)); R2 являє собою водень або метил; R3 являє собою водень, ацетил або карбамоїл; R4 являє собою водень, ацетил або карбамоїл; R5 являє собою водень, ацетил або карбамоїл; R6 являє собою водень, арабінозил, фукозил, ацетил, естер сірчаної кислоти, 3-0-S-2-0-MeFuc, 2-0-MeFuc і 4-0-AcFuc; R7 являє собою водень, манозил або гліцерин; R8 являє собою водень, метил або -CH2OH; R9 являє собою водень, арабінозил або фукозил; R10 являє собою водень, ацетил або фукозил; і n дорівнює 0, 1, 2 або 3. Структури ризобіальних LCO, що зустрічаються в природі, які охоплені цією структурою, описані в D'Haeze, et al., вище. [0068] У якості додаткових прикладів, LCO, отриманий з B. japonicum, проілюстрований на Фіг. 1b, можна застосовувати для обробки насіння бобової рослини, що відрізняється від сої, та насіння рослини, що не належить до бобових, наприклад, кукурудзи. Як інший приклад, LCO, одержуваний з R. leguminosarum, проілюстрований на Фіг. 2b (позначений LCO-V (C18:1), SP104), можна застосовувати для обробки насіння бобової рослини, що відрізняється від гороху, а також рослин, що не належать до бобових. [0069] Даний винахід також охоплює застосування LCO, одержаних (тобто виділених та/або очищених) із мікоризних грибів, таких як гриби з групи Glomerocycota, наприклад, Glomus intraradicus. Структури типових LCO, отриманих з цих грибів, описані в WO 2010/049751 і WO 2010/049751 (LCO, описані в цих документах, також мають назву "Myc-факторів"). Типові LCO, одержані з мікоризних грибів, і їх похідні, що не зустрічаються в природі, представлені наступною структурою: 10 UA 114299 C2 5 10 15 20 25 30 35 40 45 50 де n = 1 або 2; R1 являє собою C16, C16:0, C16:1, C16:2, C18:0, C18:1Δ9Z або C18:1Δ11Z; і R2 являє собою водень або SO3H. У деяких варіантах здійснення мікоризні гриби продукують LCO, які проілюстровані на Фіг. 3b і 4b. [0070] Даний винахід додатково охоплює застосування синтетичних сполук LCO, таких як описані у WO 2005/063784, і рекомбінантних LCO, одержаних за допомогою генної інженерії. Базова структура LCO, які зустрічаються в природі, може містити модифікації або заміщення, що виявляються в LCO, які зустрічаються в природі, таких як описані в Spaink, Crit. Rev. Plant Sci. 54:257-288 (2000); і D'Haeze, et al., Glycobiology 12:79R-105R (2002). Олігосахаридні молекули-попередники (CO, які описані нижче, також є придатними як сигнальні молекули для рослин за даним винаходом), для конструювання LCO також можуть бути синтезовані організмами, сконструйованими за допомогою генної інженерії, наприклад, як описано в Samain, et al., Carbohydrate Res. 302:35-42 (1997); Cottaz, et al., Meth. Eng. 7(4):311-7 (2005); і Samain, et al., J. Biotechnol.& Biotechnol. 72:33-47 (1999) (наприклад, Фіг. 1 у цьому документі, на якій показані структури LCO, які можна одержувати за допомогою технології рекомбінантної ДНК з E. coli, що містять різні комбінації генів nodBCHL). [0071] LCO можна використовувати у різних формах чистоти та можна застосовувати окремо або у формі культури бактерій або грибів, що продукують LCO. Наприклад, OPTIMIZE® (комерційно доступний від Novozymes BioAg Limited) містить культуру B. japonicum, яка продукує LCO (LCO-V (C18:1, MeFuc), MOR116), проілюстрований на Фіг. 1b. Способи для забезпечення фактично чистих LCO включають лише видалення мікробних клітин із суміші LCO та мікроба або продовження виділення та очищення молекул LCO за допомогою розділення фаз LCOрозчинник із наступною ВЕРХ-хроматографією, як описано, наприклад, у патенті США № 5549718. Очищення можна поліпшити за допомогою повторної ВЕРХ, і очищені молекули LCO можна ліофілізувати для довготермінового зберігання. Хітоолігосахариди (CO), описані вище, можна використовувати як вихідні матеріали для одержання синтетичних LCO. Для цілей даного винаходу рекомбінантні LCO є щонайменше на 60 % чистими, наприклад, щонайменше на 60 % чистими, щонайменше на 65 % чистими, щонайменше на 70 % чистими, щонайменше на 75 % чистими, щонайменше на 80 % чистими, щонайменше на 85 % чистими, щонайменше на 90 % чистими, щонайменше на 91 % чистими, щонайменше на 92 % чистими, щонайменше на 93 % чистими, щонайменше на 94 % чистими, щонайменше на 95 % чистими, щонайменше на 96 % чистими, щонайменше на 97 % чистими, щонайменше на 98 % чистими, щонайменше на 99 % чистими, аж до 100 % чистоти. [0072] Хітини та хітозани, які є основними компонентами клітинних стінок грибів і екзоскелетів комах і ракоподібних, також складаються із залишків GIcNAc. Хітинові сполуки включають хітин (IUPAC: N-[5-[[3-ацетиламіно-4,5-дигідрокси-6-(гідроксиметил)оксан-2іл]метоксиметил]-2-[[5-ацетиламіно-4,6-дигідрокси-2-(гідроксиметил)оксан-3-іл]метоксиметил]-4гідрокси-6-(гідроксиметил)оксан-3-іс]етанамід) і хітозан (IUPAC: 5-аміно-6-[5-аміно-6-[5-аміно4,6-дигідрокси-2(гідроксиметил)оксан-3-іл]окси-4-гідрокси-2-(гідроксиметил)оксан-3-іл]окси2(гідроксиметил)оксан-3,4-діол). Ці сполуки можна одержувати комерційно, наприклад, від Sigma-Aldrich, або одержувати з комах, панцирів ракоподібних або клітинних стінок грибів. Способи отримання хітину та хітозану відомі в даній галузі техніки та були описані, наприклад, у патенті США № 4536207 (отримання з панцирів ракоподібних), Pochanavanich, et al., Lett. Appl. Microbiol. 35:17-21 (2002) (одержання з грибних клітинних стінок) і патенті США № 5965545 (одержання з панцирів крабів і гідроліз комерційного хітозану). Також див. Jung, et al., Carbohydrate Polymers 67:256-59 (2007); Khan, et al., Photosynthetica 40(4):621-4 (2002). Можна одержувати деацетильовані хітини та хітозани, ступінь деацетилювання яких варіює від менш ніж 35 % до більш ніж 90 %, і при цьому охоплюється широкий спектр молекулярних мас, наприклад, олігомери хітозану з низькою молекулярною масою менше 15 кДа та олігомери 11 UA 114299 C2 5 10 15 20 25 30 35 40 45 50 55 60 хітину 0,5-2 кДа; хітозан "практичного ступеня чистоти" з молекулярною масою приблизно 15 кДа та хітозан із високою молекулярною масою - до 70 кДа. Композиції на основі хітину та хітозану, складені для обробки насіння, також є комерційно доступними. Комерційні продукти включають, наприклад, ELEXA® (Plant Defense Boosters, Inc.) і BEYOND™ (Agrihouse, Inc.). [0073] Флавоноїди являють собою фенольні сполуки, що мають загальну структуру з двох ароматичних кілець, з'єднаних тривуглецевим містком. Флавоноїди продукуються рослинами та мають багато функцій, наприклад, як корисні сигнальні молекули і як засоби захисту від комах, тварин, грибів і бактерій. Класи флавоноїдів включають халкони, антоціанідини, кумарини, флавони, флаваноли, флавоноли, флаванони та ізофлавони. Див. Jain, et al., J. Plant Biochem. & Biotechnol. 11:1-10 (2002); Shaw, et al., Environmental Microbiol. 11:1867-80 (2006). [0074] Типові флавоноїди, які можуть бути придатними для здійснення даного винаходу, включають геністеїн, даїдзеїн, формононетин, нарингенін, гесперетин, лютеолін та апігенін. Флавоноїдні сполуки є комерційно доступними, наприклад, від Natland International Corp., Research Triangle Park, Північна Кароліна; MP Biomedicals, Ірвайн, Каліфорнія; LC Laboratories, Вобурн, Массачусетс. Флавоноїдні сполуки можна виділяти з рослин або насіння, наприклад, як описано в патентах США №№ 5702752; 5990291 і 6146668. Флавоноїдні сполуки також можуть продукувати організми, сконструйовані за допомогою генної інженерії, наприклад, дріжджі, як описано в Ralston, et al., Plant Physiology 137:1375-88 (2005). [0075] Жасмонову кислоту (JA, [1R-[1α,2β(Z)]]-3-оксо-2-(пентеніл)циклопентаноцтову кислоту) та її похідні (які включають лінолеву кислоту та ліноленову кислоту (які описані вище у зв'язку з жирними кислотами і їх похідними) можна використовувати при здійсненні даного винаходу. Жасмонова кислота та її метиловий естер, метилжасмонат (MeJA), разом відомі як жасмонати, являють собою октадеканоїдні сполуки, які зустрічаються в природі у рослин. Жасмонову кислоту продукують корені паростків пшениці та грибні мікроорганізми, наприклад, Botryodiplodia theobromae і Gibberella fujikuroi, дріжджі (Saccharomyces cerevisiae) та патогенні і непатогенні штами Escherichia coli. Лінолева кислота та ліноленова кислота утворюються в ході біосинтезу жасмонової кислоти. Як повідомляється, подібно до лінолевої кислоти та ліноленової кислота жасмонати (та їх похідні) є індукторами експресії гена nod або утворення LCO ризобактеріями. Див., наприклад, Mabood, Fazli, Jasmonates induce the expression of nod genes in Bradyrhizobium japonicum, May 17, 2001. [0076] Придатні похідні жасмонової кислоти, які можуть бути придатними для здійснення даного винаходу, включають естери, аміди, глікозиди та солі. Типові естери являють собою сполуки, у яких карбоксильна група жасмонової кислоти була замінена на групу --COR, де R 1 1 являє собою групу --OR , у якій R являє собою алкільну групу, наприклад, нерозгалужену або розгалужену C1-C8алкільну групу, наприклад, метильну, етильну або пропільну групу; алкенільну групу, наприклад, нерозгалужену або розгалужену C 2-C8алкенільну групу; алкінільну групу, наприклад, нерозгалужену або розгалужену C 2-C8алкінільну групу; арильну групу, що має, наприклад, 6-10 атомів вуглецю; або гетероарильну групу, що має, наприклад, 4-9 атомів вуглецю, де гетероатоми у гетероарильній групі можуть являти собою, наприклад, N, O, P або S. Типові аміди являють собою сполуки, у яких карбоксильна група жасмонової кислоти була 2 3 2 3 замінена на групу --COR, де R являє собою групу NR R , у якій R та R незалежно являють собою водень, алкільну групу, наприклад, нерозгалужену або розгалужену C 1-C8алкільну групу, наприклад, метильну, етильну або пропільну групу; алкенільну групу, наприклад, нерозгалужену або розгалужену C2-C8алкенільну групу; алкінільну групу, наприклад, нерозгалужену або розгалужену C2-C8алкінільну групу; арильну групу, що має, наприклад, 6-10 атомів вуглецю; або гетероарильну групу, що має, наприклад, 4-9 атомів вуглецю, де гетероатоми в гетероарильній групі можуть являти собою, наприклад, N, O, P або S. Естери можна одержувати за допомогою відомих способів, наприклад, каталізованого кислотою нуклеофільного приєднання, де здійснюють реакцію карбонової кислоти зі спиртом за присутності каталітичної кількості мінеральної кислоти. Аміди також можна одержувати за допомогою відомих способів, наприклад, шляхом реакції карбонової кислоти з відповідним аміном за присутності сполучної речовини, такої як дициклогексилкарбодіімід (DCC), у нейтральних умовах. Підходящі солі жасмонової кислоти включають, наприклад, солі приєднання основи. Основи, які можна застосовувати як реактиви для одержання метаболічно прийнятних основних солей цих сполук, включають ті, які отримані з катіонів, наприклад, катіонів лужних металів (наприклад, калію і натрію) та катіонів лужноземельних металів (наприклад, кальцію і магнію). Ці солі можна легко одержувати за допомогою змішування розчину лінолевої кислоти, ліноленової кислоти або жасмонової кислоти з розчином основи. Цю сіль можна осаджувати з розчину та збирати за допомогою фільтрації або можна вилучати за допомогою інших засобів, наприклад, за допомогою випарювання розчинника. 12 UA 114299 C2 [0077] Карикіни являють собою вінілогічні 4H-пірони, наприклад, 2H-фуро[2,3-c]піран-2-они, у тому числі їх похідні й аналоги. Приклади цих сполук представлені наступною структурою: 5 10 15 20 25 30 35 40 45 50 , де Z являє собою O, S або NR5; кожний з R1, R2, R3 і R4 незалежно являє собою H, алкіл, алкеніл, алкініл, феніл, бензил, гідроксі, гідроксіалкіл, алкоксі, фенілоксі, бензилоксі, CN, COR6, COOR=, галоген, NR6R7 або NO2; і кожний з R5, R6 і R7 незалежно являє собою H, алкіл або алкеніл, або їх біологічно прийнятну сіль. Приклади біологічно прийнятних солей цих сполук можуть включати солі приєднання кислоти, утворені біологічно прийнятними кислотами, приклади яких включають гідрохлорид, гідробромід, сульфат або бісульфат, фосфат або гідрофосфат, ацетат, бензоат, сукцинат, фумарат, малеат, лактат, цитрат, тартрат, глюконат; метансульфонат, бензенсульфонат і п-толуенсульфонову кислоту. Додаткові біологічно прийнятні солі металів можуть включати солі лужних металів, одержані з основами, приклади яких включають натрієві та калієві солі. Приклади сполук, які охоплюються структурою та можуть бути придатними для застосування за даним винаходом, включають наступні: 3-метил2H-фуро[2,3-c]піран-2-он (де R1=CH3, R2, R3, R4=H), 2H-фуро[2,3-c]піран-2-он (де R1, R2, R3, R4=H), 7-метил-2H-фуро[2,3-c]піран-2-он (де R1, R2, R4=H, R3=CH3), 5-метил-2H-фуро[2,3-c]піран2-он (де R1, R2, R3=H, R4=CH3), 3,7-диметил-2H-фуро[2,3-c]піран-2-он (де R1, R3=CH3, R2, R4=H), 3,5-диметил-2H-фуро[2,3-c]піран-2-он (де R1, R4=CH3, R2, R3=H), 3,5,7-триметил-2H-фуро[2,3c]піран-2-он (де R1, R3, R4=CH3, R2=H), 5-метоксиметил-3-метил-2H-фуро[2,3-c]піран-2-он (де R1=CH3, R2, R3=H, R4=CH2OCH3), 4-бром-3,7-диметил-2H-фуро[2,3-c]піран-2-он (де R1, R3=CH3, R2=Br, R4=H), 3-метилфуро[2,3-c]піридин-2(3H)-он (де Z=NH, R1=CH3, R2, R3, R4=H), 3,6диметилфуро[2,3-c]піридин-2(6H)-он (де Z=N-CH3, R1=CH3, R2, R3, R4=H). Див. патент США № 7576213. Ці молекули також відомі як карикіни. Див. Halford, вище. [0078] Кількість щонайменше однієї сигнальної молекули для рослин, використовуваної для обробки насіння, яка виражена в одиницях концентрації, як правило, знаходиться в діапазоні від -5 -14 приблизно 10 до приблизно 10 M (молярна концентрація), і в деяких варіантах здійснення від -5 -11 -7 приблизно 10 до приблизно 10 M, і в деяких інших варіантах здійснення від приблизно 10 -8 до приблизно 10 M. Ефективна кількість, виражена в одиницях маси, як правило, знаходиться в діапазоні від приблизно 1 до приблизно 400 мкг/хандредвейт (cwt) насіння, і в деяких варіантах здійснення від приблизно 2 до приблизно 70 мкг/cwt, і в деяких інших варіантах здійснення від приблизно 2,5 до приблизно 3,0 мкг/cwt насіння. [0079] Для цілей опосередкованої обробки насіння, тобто обробки в борозні, ефективна кількість щонайменше однієї сигнальної молекули для рослин, як правило, знаходиться в діапазоні від 1 мкг/акр до приблизно 70 мкг/акр і в деяких варіантах здійснення від приблизно 50 мкг/акр до приблизно 60 мкг/акр. Для цілей нанесення на рослини ефективна кількість щонайменше однієї сигнальної молекули для рослин, як правило, знаходиться в діапазоні від 1 мкг/акр до приблизно 30 мкг/акр і в деяких варіантах здійснення від приблизно 11 мкг/акр до приблизно 20 мкг/акр. Гербіциди, фунгіциди й інсектициди [0080] Придатні гербіциди включають бентазон, ацифлуорфен, хлоримурон, лактофен, кломазон, флуазифоп, глюфосинат, гліфосат, сетоксидим, імазетапір, імазамокс, фомесаф, флуміклорак, імазаквін і клетодим. Комерційні продукти, що містять кожну з цих сполук, є легкодоступними. Концентрація гербіциду в композиції, як правило, буде відповідати зазначеній нормі застосування для певного гербіциду. [0081] "Фунгіцид", як використовується в даному документі та у даній галузі техніки, являє собою засіб, який знищує гриби або пригнічує їх ріст. Як використовується в даному документі, фунгіцид "характеризується активністю щодо" певних видів грибів, якщо обробка фунгіцидом зумовлює знищення або пригнічення росту популяції грибів (наприклад, у ґрунті) порівняно з необробленою популяцією. Ефективні фунгіциди згідно з даним винаходом, відповідно, будуть характеризуватися активністю щодо широкого спектра патогенів, у тому числі, але без 13 UA 114299 C2 5 10 15 20 25 30 35 40 45 50 55 60 обмеження, Phytophthora, Rhizoctonia, Fusarium, Pythium, Phomopsis або Sclerotinia і Phakopsora та їх комбінації. [0082] Комерційні фунгіциди можуть бути придатними для застосування у даному винаході. Придатні комерційно доступні фунгіциди включають PROTÉGÉ, RIVAL або ALLEGIANCE FL або LS (Gustafson, Плейно, Техас), WARDEN RTA (Agrilance, Сент-Пол, Міннесота), APRON XL, APRON MAXX RTA або RFC, MAXIM 4FS або XL (Syngenta, Вілмінгтон, Делавер), CAPTAN (Arvesta, Гвелф, Онтаріо) і PROTREAT (Nitragin Argentina, Буенос-Айрес, Аргентина). Активні інгредієнти в цих та інших комерційних фунгіцидах включають, але без обмеження, флудіоксоніл, мефеноксам, азоксистробін і металаксил. Комерційні фунгіциди найдоцільніше застосовують згідно з інструкціями виробника в рекомендованих концентраціях. [0083] Як використовується в даному документі, інсектицид "характеризується активністю щодо" певних видів комах, якщо обробка інсектицидом зумовлює знищення або пригнічення популяції комах порівняно з необробленою популяцією. Ефективні інсектициди згідно з даним винаходом, відповідно, будуть характеризуватися активністю щодо широкого спектра комах, у тому числі, але без обмеження, дротяників, совок, червоподібних личинок, кукурудзяного жука, личинок мухи паросткової, земляних блішок, клопів-наземників, попелиць, листоїдів і щитників. [0084] Комерційні фунгіциди можуть бутипридатними для застосування у даному винаході. Придатні комерційно доступні інсектициди включають CRUISER (Syngenta, Вілмінгтон, Делавер), GAUCHO і PONCHO (Gustafson, Плейно, Техас). Активні інгредієнти в цих та інших комерційних інсектицидах включають тіаметоксам, клотіанідин та імідаклоприд. Комерційні інсектициди найдоцільніше застосовують згідно з інструкціями виробника в рекомендованих концентраціях. Мікроорганізми, що солюбілізують фосфати, діазотрофи (ризобіальні інокулянти) і/або мікоризні гриби [0085] Даний винахід додатково може передбачати обробку насіння мікроорганізмом, що солюбілізує фосфати. Як використовується в даному документі, "мікроорганізм, що солюбілізує фосфати" являє собою мікроорганізм, який здатний збільшувати кількість фосфору, доступного для рослини. Мікроорганізми, що солюбілізують фосфати, включають штами грибів і бактерій. У варіанті здійснення мікроорганізм, що солюбілізує фосфати, являє собою споротвірний мікроорганізм. [0086] Необмежувальні приклади мікроорганізмів, що солюбілізують фосфати, включають види з роду, вибраного з групи, яка включає Acinetobacter, Arthrobacter, Arthrobotrys, Aspergillus, Azospirillum, Bacillus, Burkholderia, Candida, Chryseomonas, Enterobacter, Eupenicillium, Exiguobacterium, Klebsiella, Kluyvera, Microbacterium, Mucor, Paecilomyces, Paenibacillus, Penicillium, Pseudomonas, Serratia, Stenotrophomonas, Streptomyces, Streptosporangium, Swaminathania, Thiobacillus, Torulospora, Vibrio, Xanthobacter і Xanthomonas. [0087] Необмежувальні приклади мікроорганізмів, що солюбілізують фосфати, вибрані з групи, яка включає Acinetobacter calcoaceticus, Acinetobacter sp., Arthrobacter sp., Arthrobotrys oligospora, Aspergillus niger, Aspergillus sp., Azospirillum halopraeferans, Bacillus amyloliquefaciens, Bacillus atrophaeus, Bacillus circulans, Bacillus licheniformis, Bacillus subtilis, Burkholderia cepacia, Burkholderia vietnamiensis, Candida krissii, Chryseomonas luteola, Enterobacter aerogenes, Enterobacter asburiae, Enterobacter sp., Enterobacter taylorae, Eupenicillium parvum, Exiguobacterium sp., Klebsiella sp., Kluyvera cryocrescens, Microbacterium sp., Mucor ramosissimus, Paecilomyces hepialid, Paecilomyces marquandii, Paenibacillus macerans, Paenibacillus mucilaginosus, Pantoea aglomerans, Penicillium expansum, Pseudomonas corrugate, Pseudomonas fluorescens, Pseudomonas lutea, Pseudomonas poae, Pseudomonas putida, Pseudomonas stutzeri, Pseudomonas trivialis, Serratia marcescens, Stenotrophomonas maltophilia, Streptomyces sp., Streptosporangium sp., Swaminathania salitolerans, Thiobacillus ferrooxidans, Torulospora globosa, Vibrio proteolyticus, Xanthobacter agilis і Xanthomonas campestris. [0088] У конкретному варіанті здійснення мікроорганізм, що солюбілізує фосфати, являє собою штам гриба Penicillium. Штами гриба Penicillium, які можуть бути придатними для здійснення даного винаходу, включають P. bilaiae (раніше відомий як P. bilaii), P. albidum, P. aurantiogriseum, P. chrysogenum, P. citreonigrum, P. citrinum, P. digitatum, P. frequentas, P. fuscum, P. gaestrivorus, P. glabrum, P. griseofulvum, P. implicatum, P. janthinellum, P. lilacinum, P. minioluteum, P. montanense, P. nigricans, P. oxalicum, P. pinetorum, P. pinophilum, P. purpurogenum, P. radicans, P. radicum, P. raistrickii, P. rugulosum, P. simplicissimum, P. solitum, P. variabile, P. velutinum, P. viridicatum, P. glaucum, P. fussiporus і P. expansum. [0089] В одному конкретному варіанті здійснення вид Penicillium являє собою P. bilaiae. В іншому конкретному варіанті здійснення штами P. bilaiae вибрані з групи, що включає ATCC 20851, NRRL 50169, ATCC 22348, ATCC 18309, NRRL 50162 (Wakelin, et al., 2004. Biol Fertil Soils 14 UA 114299 C2 5 10 15 20 25 30 35 40 45 50 55 60 40:36-43). В іншому конкретному варіанті здійснення вид Penicillium являє собою P. gaestrivorus, наприклад, NRRL 50170 (див., Wakelin, вище). [0090] У деяких варіантах здійснення використовують більше одного мікроорганізму, що солюбілізує фосфати, наприклад, щонайменше два, щонайменше три, щонайменше чотири, щонайменше п'ять, щонайменше 6, у тому числі будь-яку комбінацію Acinetobacter, Arthrobacter, Arthrobotrys, Aspergillus, Azospirillum, Bacillus, Burkholderia, Candida, Chryseomonas, Enterobacter, Eupenicillium, Exiguobacterium, Klebsiella, Kluyvera, Microbacterium, Mucor, Paecilomyces, Paenibacillus, Penicillium, Pseudomonas, Serratia, Stenotrophomonas, Streptomyces, Streptosporangium, Swaminathania, Thiobacillus, Torulospora, Vibrio, Xanthobacter і Xanthomonas, у тому числі один вид, вибраний з наступної групи: Acinetobacter calcoaceticus, Acinetobacter sp., Arthrobacter sp., Arthrobotrys oligospora, Aspergillus niger, Aspergillus sp., Azospirillum halopraeferans, Bacillus amyloliquefaciens, Bacillus atrophaeus, Bacillus circulans, Bacillus licheniformis, Bacillus subtilis, Burkholderia cepacia, Burkholderia vietnamiensis, Candida krissii, Chryseomonas luteola, Enterobacter aerogenes, Enterobacter asburiae, Enterobacter sp., Enterobacter taylorae, Eupenicillium parvum, Exiguobacterium sp., Klebsiella sp., Kluyvera cryocrescens, Microbacterium sp., Mucor ramosissimus, Paecilomyces hepialid, Paecilomyces marquandii, Paenibacillus macerans, Paenibacillus mucilaginosus, Pantoea aglomerans, Penicillium expansum, Pseudomonas corrugate, Pseudomonas fluorescens, Pseudomonas lutea, Pseudomonas poae, Pseudomonas putida, Pseudomonas stutzeri, Pseudomonas trivialis, Serratia marcescens, Stenotrophomonas maltophilia, Streptomyces sp., Streptosporangium sp., Swaminathania salitolerans, Thiobacillus ferrooxidans, Torulospora globosa, Vibrio proteolyticus, Xanthobacter agilis і Xanthomonas campestris. [0091] У деяких варіантах здійснення також можна комбінувати два різні штами того самого виду, наприклад, використовують щонайменше два різні штами Penicillium. Застосування комбінації із щонайменше двох різних штамів Penicillium має наступні переваги. У разі внесення в ґрунт, що вже містить нерозчинні (або помірно розчинні) фосфати, застосування комбінованих штамів грибів буде зумовлювати збільшення кількості фосфору, доступного для поглинання рослинами, порівняно із застосуванням тільки одного штаму Penicillium. Це, у свою чергою, може зумовлювати збільшення поглинання фосфатів та/або підвищення врожайності рослин, вирощених на ґрунті, порівняно з роздільним використанням окремих штамів. Комбінація штамів також дає можливість застосовувати нерозчинні фосфорити як ефективне добриво для ґрунтів, які характеризуються недостатніми кількостями доступного фосфору. Таким чином, у деяких варіантах здійснення використовують один штам P. bilaiae та один штам P. gaestrivorus. В інших варіантах здійснення ці два штами являють собою NRRL 50169 і NRRL 50162. В додаткових варіантах здійснення щонайменше два штами являють собою NRRL 50169 і NRRL 50170. В додаткових варіантах здійснення щонайменше два штами являють собою NRRL 50162 і NRRL 50170. [0092] Мікроорганізми, що солюбілізують фосфати, можна одержувати з використанням будь-якого придатного способу, відомого фахівцеві в даній галузі техніки, наприклад, твердофазного культивування або культивування на рідкому середовищі з використанням придатного джерела вуглецю. Мікроорганізм, що солюбілізує фосфати, переважно одержують у формі стабільних спор. [0093] У варіанті здійснення мікроорганізм, що солюбілізує фосфати, являє собою гриб Penicillium. Гриб Penicillium згідно з даним винаходом можна вирощувати з використанням твердофазного культивування або культивування на рідкому середовищі та придатного джерела вуглецю. Ізоляти Penicillium можна вирощувати за допомогою будь-якого придатного способу, відомого фахівцеві в даній галузі техніки. Наприклад, гриб можна культивувати на твердому поживному середовищі, такому як картопляно-декстрозний агар або солодовопептонний агар, або у колбах, що містять придатні рідкі середовища, наприклад, середовище Чапека-Докса або картопляно-декстрозний бульйон. Ці способи культивування можна використовувати при одержанні інокуляту Penicillium spp. для обробки насіння (наприклад, нанесення покриття) та/або застосування з агрономічно прийнятним носієм для внесення в ґрунт. Вираз "інокулят", використовуваний в даному описі, як передбачається, стосується будьякої форми мікроорганізму, що солюбілізує фосфати, а саме клітини гриба, міцелію або спор, клітини бактерій або спор бактерій, який здатний розмножуватися на ґрунті або в ґрунті, якщо умови температури, вологості тощо сприяють росту грибів. [0094] Одержання спор Penicillium під час твердофазного культивування, наприклад, можна досягти шляхом інокуляції твердого середовища, наприклад субстрату на основі торфу або вермікуліту, або зерна, у тому числі, але без обмеження, різновидів вівса, пшениці, ячменю або рису. Стерилізоване середовище (одержане за допомогою автоклавування або опромінення) 15 UA 114299 C2 2 5 10 15 20 25 30 35 40 45 50 55 60 7 інокулюють суспензією спор (1×10 -1×10 КУО/мл) відповідного Penicillium spp., і вологість доводять до 20-50 % залежно від субстрату. Цей матеріал інкубують протягом 2-8 тижнів за кімнатної температури. Спори також можна одержувати за допомогою культивування на рідкому середовищі (Cunningham et al., 1990. Can J Bot. 68:2270-2274). Одержання на рідкому середовищі можна досягти шляхом культивування гриба в будь-яких придатних середовищах, таких як картопляно-декстрозний бульйон або середовища із сахарозою та дріжджовим екстрактом, при відповідному значенні pH і температурних умовах, які можна визначити відповідно до стандартних методик в даній галузі техніки. [0095] Одержаний у результаті матеріал можна використовувати відразу або спори можна збирати, концентрувати за допомогою центрифугування, складати та потім сушити за допомогою методик сушіння на повітрі, ліофілізації або сушіння у псевдозрідженому шарі (Friesen, et al., 2005, Appl. Microbiol. Biotechnol. 68:397-404) з одержанням змочуваного порошку. Змочуваний порошок потім суспендують у воді, наносять на поверхню насіння і забезпечують його висушування до посіву. Змочуваний порошок можна використовувати в комбінації з іншими видами обробки насіння, наприклад, але без обмеження, видами хімічної обробки насіння, носіями (наприклад, тальк, глина, каолін, силікагель, каолініт) або полімерами (наприклад, метилцелюлоза, полівінілпіролідон). У альтернативному випадку, суспензію спор відповідного Penicillium spp. можна наносити на придатний сумісний із ґрунтом носій (наприклад, порошок або гранули на основі торфу) при відповідному кінцевому вмісті вологи. До використання матеріал можна інкубувати за кімнатної температури, як правило, протягом від приблизно 1 дня до приблизно 8 тижнів. [0096] Окрім інгредієнтів, використовуваних для культивування мікроорганізму, що солюбілізує фосфати, у тому числі, наприклад, інгредієнтів, згаданих вище стосовно до культивування Penicillium, мікроорганізм, що солюбілізує фосфати, можна складати з використанням інших агрономічно прийнятних носіїв. Використовуваний в даному документі разом із виразом "носій" вираз "агрономічно прийнятний" стосується будь-якого матеріалу, який можна використовувати для доставки активних засобів до насіння, ґрунту або рослини, і переважно цей носій можна додавати (до насіння, ґрунту або рослини) без небажаного впливу на ріст рослин, структуру ґрунту, дренованість ґрунту або подібне. Придатні носії включають, але без обмеження, пшеничну полову, висівки, подрібнену пшеничну солому, порошки або гранули на основі торфу, гіпсові гранули та глини (наприклад, каолін, бентоніт, монтморилоніт). У разі додавання спор у ґрунт гранульований склад буде переважним. Склади у формі рідини, торф'яного порошку або змочуваного порошку будуть придатними для нанесення покриття на насіння. У разі використання для нанесення покриття на насіння матеріал можна змішувати з водою, наносити на насіння і забезпечувати висушування. Приклад інших носіїв включає змочені висівки, висушені, просіяні та наносяться на насіння, попередньо покрите клейкою речовиною, наприклад, гуміарабіком. У варіантах здійснення, у яких передбачається склад з активних засобів в одній композиції, агрономічно прийнятний носій може бути водним. [0097] Кількість щонайменше одного мікроорганізму, що солюбілізує фосфати, варіює залежно від виду насіння або ґрунту, виду культурних рослин, кількості джерела фосфору та/або поживних мікроелементів, які присутні у ґрунті або додаються у нього тощо. Для кожного конкретного випадку придатну кількість можна визначити за допомогою простих експериментів із використанням емпіричних методик. Звичайно, для Penicillium, наприклад, кількість, що наноситься, знаходиться в діапазоні 0,001-1,0 кг спор та міцелію грибів (сира вага) на гектар або 2 6 10 -10 колонієутворювальних одиниць (КУО) на насінину (якщо використовується насіння з 6 11 нанесеним покриттям), або на гранульованому носії вносять від 1×10 до 1×10 колонієутворювальних одиниць на гектар. Клітини грибів у формі, наприклад, спор і носій можна додавати в борозну для насіння у ґрунті на рівні коренів або можна використовувати для нанесення покриття на насіння до посіву. [0098] У варіантах здійснення, наприклад, у яких передбачається застосування щонайменше двох штамів мікроорганізму, що солюбілізує фосфати, наприклад, двох штамів Penicillium, у ґрунт замість природного фосфориту (або навіть на додаток до нього) можна додавати комерційні добрива. Джерело фосфору може включати джерело фосфору, нативне щодо ґрунту. В інших варіантах здійснення джерело фосфору можна додавати в ґрунт. В одному варіанті здійснення джерело являє собою фосфорит. В іншому варіанті здійснення джерело являє собою штучне добриво. Комерційно доступні штучні фосфатні добрива поділяються на багато видів. Деякі типові добрива являють собою такі, які містять монофосфат амонію (MAP), потрійний суперфосфат (TSP), діамонійфосфат, простий суперфосфат і поліфосфат амонію. Усі з цих добрив одержують шляхом хімічної обробки нерозчинних природних фосфоритів на устаткуванні для виробництва добрив у великому масштабі, і цей продукт є дорогим. За 16 UA 114299 C2 5 10 15 20 25 30 35 40 45 50 55 60 допомогою даного винаходу можливо зменшити кількість цих добрив, які вносять в ґрунт, при цьому усе ще зберігається така ж кількість фосфору, що поглинається з ґрунту. [0099] У додатковому варіанті здійснення джерело фосфору є органічним. Органічне добриво стосується ґрунтополіпшувача, одержаного із природних джерел, що забезпечує щонайменше мінімальний відсотковий вміст азоту, фосфату та карбонату калію. Приклади включають рослинні відходи та відходи тваринництва, кам'яний пил, водорості, інокулянти та поліпшувачі. Конкретні типові приклади включають кісткове борошно, м'ясне борошно, тваринний гній, компост, осад стічних вод або гуано. [0100] Інші добрива, наприклад, джерела азоту або інші ґрунтополіпшувачі, звичайно, також можна додавати в ґрунт приблизно одночасно з мікроорганізмом, що солюбілізує фосфати, або в інший час за умови, що інші матеріали не є токсичними для гриба. [0101] Діазотрофи являють собою бактерії та археї, які фіксують атмосферний газоподібний азот з утворенням форми, придатнішої для використання, наприклад, амонію. Приклади діазотрофів включають бактерії з родів Rhizobium spp. (наприклад, R. cellulosilyticum, R. daejeonense, R. etli, R. galegae, R. gallicum, R. giardinii, R. hainanense, R. huautlense, R. indigoferae, R. leguminosarum, R. loessense, R. lupini, R. lusitanum, R. meliloti, R. mongolense, R. miluonense, R. sullae, R. tropici, R. undicola та/або R. yanglingense), Bradyrhizobium spp. (наприклад, B. bete, B. canariense, B. elkanii, B. iriomotense, B. japonicum, B. jicamae, B. liaoningense, B. pachyrhizi та/або B. yuanmingense), Azorhizobium spp. (наприклад, A. caulinodans та/або A. doebereinerae), Sinorhizobium spp. (наприклад, S. abri, S. adhaerens, S. americanum, S. aboris, S. fredii, S. indiaense, S. kostiense, S. kummerowiae, S. medicae, S. meliloti, S. mexicanus, S. morelense, S. saheli, S. terangae та/або S. xinjiangense), Mesorhizobium spp. (M. albiziae, M. amorphae, M. chacoense, M. ciceri, M. huakuii, M. loti, M. mediterraneum, M. pluifarium, M. septentrionale, M. temperatum та/або M. tianshanense) та їх комбінації. У конкретному варіанті здійснення діазотроф вибраний з групи, яка включає B. japonicum, R. leguminosarum, R. meliloti, S. meliloti та їх комбінації. В іншому варіанті здійснення діазотроф являє собою B. japonicum. В іншому варіанті здійснення діазотроф являє собою R leguminosarum. В іншому варіанті здійснення діазотроф являє собою R meliloti. В іншому варіанті здійснення діазотроф являє собою S. meliloti. [0102] Мікоризні гриби утворюють симбіотичні асоціації з коренями судинних рослин і забезпечують, наприклад, здатність до поглинання води та мінеральних поживних речовин завдяки порівняно великій площі поверхні міцелію. Мікоризні гриби охоплюють ендомікоризні гриби (що також мають назву везикулярно-арбускулярних мікоризних грибів, VAM, арбускулярних мікоризних грибів або AM), ектомікоризні гриби або їх комбінацію. В одному варіанті здійснення мікоризні гриби являють собою ендомікоризу з типу Glomeromycota і родів Glomus і Gigaspora. У додатковому варіанті здійснення ендомікориза являє собою штам Glomus aggregatum, Glomus brasilianum, Glomus clarum, Glomus deserticola, Glomus etunicatum, Glomus fasciculatum, Glomus intraradices, Glomus monosporum або Glomus mosseae, Gigaspora margarita або їх комбінацію. [0103] Приклади мікоризних грибів включають ектомікоризні гриби з типів Basidiomycota, Ascomycota і Zygomycota. Інші приклади включають штами Laccaria bicolor, Laccaria laccata, Pisolithus tinctorius, Rhizopogon amylopogon, Rhizopogon fulvigleba, Rhizopogon luteolus, Rhizopogon villosuli, Scleroderma cepa, Scleroderma citrinum або їх комбінацію. [0104] Мікоризні гриби включають ерикоїдні мікоризи, арбутоїдні мікоризи або монотропоїдні мікоризи. Арбускулярна мікориза та ектомікориза утворюють ерикоїдну мікоризу з багатьма рослинами, що належать до порядку Ericales, тоді як у деяких Ericales утворюється арбутоїдна та монотропоїдна мікориза. В одному варіанті здійснення мікориза може являти собою ерикоїдну мікоризу, переважно з типу Ascomycota, наприклад, Hymenoscyphous ericae або Oidiodendron sp. В іншому варіанті здійснення мікориза також може являти собою арбутоїдну мікоризу, переважно з типу Basidiomycota. У ще одному варіанті здійснення мікориза може являти собою монотропоїдну мікоризу, переважно з типу Basidiomycota. У ще одному варіанті здійснення мікориза може являти собою орхідну мікоризу, переважно з роду Rhizoctonia. [0105] Способи за даним винаходом є застосовними до насіння бобової рослини, типові приклади якої включають сою, люцерну, арахіс, горох, сочевицю, квасолю та конюшину. Способи за даним винаходом також є застосовними до насіння рослини, що не належить до бобових, наприклад, Poaceae, Cucurbitaceae, Malvaceae, Asteraceae, Chenopodiaceae і Solonaceae. Типові приклади насіння рослини, що не належить до бобових, включають польові культури, наприклад, кукурудзу, рис, овес, жито, ячмінь і пшеницю, бавовник та канолу, і овочеві культури, наприклад, різновиди картоплі, різновиди томату, різновиди огірка, різновиди буряка, латук і канталупу. 17 UA 114299 C2 5 10 15 20 25 30 35 40 45 50 55 60 [0106] Даний винахід тепер буде описано за допомогою наступних необмежувальних прикладів. Якщо не зазначено інше, воду використовували як контроль (позначено як "контроль" або "CHK"). Приклади 1-17: Експерименти в теплиці Приклад 1. In vitro біологічний аналіз росту коренів проростків томату [0107] Поверхню насіння томату гібридного сорту томату Royal Mounty стерилізували за допомогою 10 % дезінфекційного розчину протягом 10 хвилин з наступними 3 промиваннями стерилізованою дистильованою водою. Потім насіння висушували у витяжній шафі з ламінарним потоком повітря протягом 3 годин. Потім насіння поміщали у чашки Петрі на середовище із затверділим агаром, що містила різні концентрації LCO з різних джерел, проілюстрованого на Фіг. 1b (виробленого у Дармштадті, Німеччина, та Греноблі, Франція) (який також називається у прикладах "LCO для сої") та CO за даним винаходом, проілюстрованого на Фіг. 2a (який також називається у прикладах "CO для гороха" або "CO-V"). Корені проростків вимірювали за допомогою ручної лінійки та значення сирої ваги коренів одержували за допомогою мікроваг у день 7. Вивчення росту проводили у вегетаційній камері при 22 °C. [0108] Виходячи з порівняння CO для гороху (варіант здійснення даного винаходу) та LCO (не відноситься до даного винаходу та призначений для порівняння), при застосуванні CO для -7 -9 гороху спостерігали кращий результат (у концентрації 10 M та 10 M) або однаковий результат -8 (у концентрації 10 M) порівняно із LCO при вимірюванні довжини коренів проростків томату (Фіг. 5). Що стосується сирої ваги коренів проростків, CO для гороху переважали LCO при усіх трьох рівнях значень концентрації (Фіг. 6). Як LCO, так і CO характеризувалися значно кращим результатом у плані збільшення довжини коренів і сирої ваги порівняно із контрольними проростками. Коли побудували графік середнього росту коренів при всіх 3 значеннях концентрації, виявилось, що CO характеризувався значно кращим результатом у плані збільшення росту коренів томату порівняно із LCO (Фіг. 7 і 8). Приклад 2. Експеримент із використанням листя бавовнику [0109] Насіння бавовнику висівали та вирощували до стадії V4 (стадії 4 листків), а потім -8 обприскували 10 M LCO, проілюстрованого на Фіг. 2b (який також називається у прикладах "LCO для гороху"), та CO для гороху, а потім забезпечували можливість росту протягом періоду до 4 тижнів при періодичному поливі розчином Хогланда. Контрольні рослини обприскували водою. [0110] Результати, досягнуті у варіанті здійснення даного винаходу (CO), продемонстрували, що як CO, так і LCO (не відноситься до даного винаходу та призначений для порівняння) приводили до значного збільшення значень сирої ваги рослин порівняно із контролем, але CO продемонстрував на 1,14 % більше збільшення сирої ваги рослин порівняно із LCO (Фіг. 9). Приклад 3. Обробка насіння кукурудзи [0111] Два експерименти з обробкою насіння за допомогою лише LCO для гороху, CO для гороху та сумішей CO, одержаних із хітозану шляхом ферментативного процесу (відмінних за структурою від CO для гороху та також називаних у прикладах "китайський CO"), здійснювали у теплиці. Насіння гібриду кукурудзи (92L90, Peterson Farm, США) обробляли розчинами для -8 обробки (10 M) при нормі 3 рідкі унції/100 фунтів насіння. Насіння висівали у пластикові горщики, що містили суміш пісок:перліт 1:1. Забезпечували ріст насіння протягом приблизно 3-4 тижнів, а потім збирали та вимірювали суху вагу. [0112] Результати, одержані з обох експериментів, вказують на те, що (CO для гороху) за даним винаходом продемонстрував більше збільшення пагону, коренів і загальної біомаси порівняно із LCO, що не відносяться до даного винаходу та призначені для порівняння. Що стосується першого випробування, CO характеризувався збільшенням сухої ваги на 11,84 % порівняно із LCO (Фіг. 10). У другому випробуванні CO характеризувався збільшенням сухої ваги на 12,63 % порівняно із LCO (Фіг. 11). Китайський CO, який також може вважатися замінним джерелом CO для гороху, також продемонстрував збільшення сухої ваги рослин, збільшене порівняно із LCO, що не відноситься до даного винаходу. Приклад 4. Обробка сої різними активними засобами [0113] Насіння сої (Jung seed, сорт 8168NRR) обробляли різними активними молекулами. Насіння обробляли при рівні дози рідини 3 рідкі унції/100 фунтів насіння. Забезпечували висушування насіння протягом 2 годин і висівали в теплиці у пластикові горщики, що містили суміш пісок:перліт 1:1. Проростки вирощували протягом 4 тижнів із періодичним внесенням рідкого добрива, а потім збирали рослини. Центральний листок з 2-ого трилисника (знизу догори) відокремлювали та вимірювали площу поверхні за допомогою сканера WinRhizo. Решту рослин використовували для визначення сухої ваги (DW) рослин. 18 UA 114299 C2 5 10 15 20 25 30 35 40 45 50 55 60 [0114] Виходячи з результатів, одержаних у експерименті, встановили, що LCO для гороху, який не відноситься до даного винаходу, CO для гороху за даним винаходом та китайський CO демонстрували значне збільшення площі листової поверхні. Але із числа цих трьох активних засобів CO для гороху приводив до одержання найбільшої площі листової поверхні (значно більшої, ніж контроль (вода)) і порівняно більшою, ніж китайський CO (Фіг. 12). В іншому експерименті CO приводив до одержання найвищих значень сухої ваги рослин при вимірюванні або пагона, або кореня, або загальної біомаси рослин. Таким чином, було очевидно, що збільшення біомаси за допомогою CO було більшим, ніж за допомогою LCO для сої або будьяких інших видів обробки, у тому числі обробки водою в якості контролю та ізофлавоноїдами в якості окремої сигнальної молекули для рослин (Фіг. 13). Приклад 5. Біологічний аналіз деформації кореневих волосків [0115] Насіння сиратро (Macroptelium atropurpureum) пророщували на вологому фільтрувальному папері у чашках Петрі. Коли корені проростків достягали довжини 1 дюйм, їх -8 відділяли від проростків та обробляли 2 мл 10 M розчинів для обробки у пробірках протягом 4 годин у темряві. Після того як час обробки добігав кінця, розчини офарблювали Конго червоним протягом 10 хвилин. Після цього спостерігали сегменти коренів за допомогою біологічного мікроскопа для підрахунку кількості деформованих кореневих волосків у найбільш чутливій зоні сегмента кореня. Біологічний аналіз деформації кореневих волосків також проводили з використанням червоної конюшини аналогічно проведенню аналізу на сиратро, як описано вище, і при цьому здійснювали лише візуальне спостереження та результати записували у текстовій формі. [0116] Як розчин LCO, так і розчин CO викликали деформацію кореневих волосків у сегментах коренів (Фіг. 14). Комбінації CO та жирної кислоти (стеаринової кислоти або пальмітинової кислоти) також продемонстрували деформацію кореневих волосків, причому CO разом з пальмітиновою кислотою та CO разом як із пальмітиновою кислотою, так і зі стеариновою кислотою забезпечували кількісно більшу деформацію кореневих волосків порівняно із LCO або CO. Врешті, у тому, що стосується ефекту щодо деформації кореневих волосків, CO не відрізнявся від LCO. Додавання пальмітинової кислоти приводило до поліпшення ефекту щодо деформації. Контроль або CHK обробляли дистильованою водою. [0117] Для CO загальна картина деформації кореневих волосків у червоної конюшини була набагато кращою та більш вираженою порівняно із LCO. CO або з пальмітиновою кислотою, або зі стеариновою кислотою характеризувалися профілем деформації, подібним до такого для LCO. Врешті, для червоної конюшини CO був найкращим засобом, що приводив до деформації кореневих волосків. Приклад 6. Проростання насіння каноли та пшениці [0118] Для проростання насіння каноли та пшениці поміщали у чашки Петрі на вологий -9 фільтрувальний папір, змочений 10 M розчином для обробки. Через 18 год. після розміщення у чашки Петрі CO для гороху індукував більше проростання насіння каноли та пшениці порівняно із LCO для гороху. Протягом періоду 21-24 годин показник проростання насіння зростав з LCO та CO. У експерименті продемонстрували ранню індукцію проростання за допомогою CO порівняно із LCO (Фіг. 15 і 16). Приклад 7. Проростання насіння люцерни [0119] Насіння люцерни (Medicago sativa) пророщували у чашках Петрі на вологому фільтрувальному папері, що містив розчини для обробки на основі LCO для гороху та CO для -8 гороху (10 M), та чашки Петрі залишали у темряві при кімнатній температурі (22 °C). Через 20 та 27 год. за насінням спостерігали щодо проростання. Через 20 год. не спостерігали відмінностей за показником проростання між контролем, LCO та CO, але через 27 год. CO продемонстрував на 6 % більше проростання порівняно із контролем та LCO. Було продемонстровано, що LCO для гороху може не бути ефективним щодо насіння люцерни, але CO для гороху міг мати позитивний вплив на проростання насіння порівняно із контролем та LCO для гороху (Фіг. 17). Приклад 8. Проростання насіння кукурудзи та пшениці у чашках Петрі [0120] Насіння кукурудзи та пшениці поміщали на фільтрувальний папір у чашки Петрі, що містили 5 мл розчину для обробки. Насіння кукурудзи поміщали на вологий фільтрувальний папір для проростання. Аналогічно, насіння пшениці (ярової пшениці) поміщали у чашки Петрі. За насінням кукурудзи та пшениці спостерігали щодо появи проростків протягом 5 днів після поміщення у чашки Петрі. Корені збирали та їх довжину вимірювали за допомогою системи WinRhizo. [0121] Щодо кукурудзи LCO для гороху, CO для гороху та CO з пальмітиновою кислотою продемонстрували збільшене проростання (Фіг. 18) та вони також приводили до значного 19 UA 114299 C2 5 10 15 20 25 30 35 40 45 50 55 збільшення довжини коренів проростка порівняно із контролем. Їх вплив статистично значуще не відрізнявся, при цьому CO з пальмітиновою кислотою характеризувався найвищим значенням щодо проростання та довжини коренів. Додавання CO до пальмітинової кислоти приносило незначну користь (без статистичної значущості різниці) порівняно із LCO або CO (Фіг. 19). У пшениці CO переважав LCO, утворюючи довші корені. Збільшення довжини коренів за допомогою LCO та CO у пшениці не було статистично значущим, але постійно було більшим (Фіг. 20). Приклад 9. Проростання насіння горошку посівного (Vicia sativa) [0122] Насіння горошку посівного поміщали на фільтрувальний папір у чашки Петрі, що містили 5 мл розчину для обробки. Проростання насіння при 22 °C підраховували через 24 год. та довжину коренів проростків вимірювали у день 5 за допомогою системи WinRhizo. [0123] У експерименті з оцінки проростання застосовували LCO для гороху та CO для гороху в комбінації з 4 різними жирними кислотами. Виявили, що CO окремо, або з пальмітиновою кислотою, або зі стеариновою кислотою індукував раннє проростання насіння. Черездень після поміщення у чашки Петрі CO характеризувався на 25 % більшим проростанням порівняно із контролем та LCO (Фіг. 21). При вимірюванні довжини коренів лише LCO та CO з пальмітиновою кислотою приводили до значного збільшення довжини коренів проростків порівняно із контролем (Фіг. 22). Приклад 10. Проростання насіння декількох сільськогосподарських культур [0124] Аналогічно до експерименту з оцінки проростання насіння, який згаданий вище, насіння різних сільськогосподарських культур поміщали на вологий фільтрувальний папір у чашки Петрі, що містили 5 мл рідини у кожній. Потім чашки Петрі із насінням залишали у темряві при 22 °C. Через 24 год. (за винятком лобії, для якої час становив 30 год.) за насінням спостерігали щодо проростання. [0125] Загальне проростання насіння з CO для гороху характеризувалося більшим значенням порівняно із LCO для гороху. З чотирьох сільськогосподарських культур (зеленого машу, лобії, червоної сочевиці та червоної конюшини) при застосуванні CO краще проростання демонструвалося у трьох сільськогосподарських культур, за винятком червоної сочевиці (Фіг. 23). CO разом із пальмітиновою кислотою індукував найбільше проростання у зеленого машу та червоної конюшини. LCO був кращим порівняно із CO або CO разом із пальмітиновою кислотою тільки для червоної сочевиці. Приклад 11. Ріст коренів проростків томату [0126] У способі оцінки проростання насіння у чашці Петрі насіння томату сорту Royal Mounty поміщали на вологий фільтрувальний папір, просочений 5 мл розчину для обробки. При 22 °C та після 5 днів у темряві вимірювали ріст коренів проростків томату за допомогою системи WinRhizo. [0127] Усі з LCO для гороху, CO для гороху та CO з жирними кислотами продемонстрували збільшену довжину коренів порівняно із контролем з водою. Середня довжина коренів проростків була більшою при застосуванні CO порівняно із LCO, але вона не була значно більшою. CO або з пальмітиновою, або зі стеариновою кислотою приводив до значного збільшення довжини коренів проростків томату (Фіг. 24). Приклад 12. Обробка насіння сої [0128] Насіння сої (Pioneer 9oM80) поміщали в чашки Петрі на вологий папір для пророщування, просочений 5 мл розчину для обробки, що містив або воду, або LCO для сої, CO для гороху та CO разом із жирними кислотами. Зародкові корені проростків виділяли через 48 годин і вимірювали їх довжину. [0129] LCO продемонстрував краще стимулювання росту зародкового кореня насіння порівняно із контролем і CO, але при застосуванні CO разом зі стеариновою кислотою або пальмітиновою кислотою спостерігалося значне збільшення довжини зародкового кореня. CO сам по собі є менш ефективним щодо сої, ніж LCO, але додавання жирної кислоти, або пальмітинової, або стеаринової кислоти, до CO може додатково стимулювати ріст кореня проростка (Фіг. 25). Приклад 13. Обробка насіння бавовнику -8 [0130] Насіння бавовнику обробляли 10 M розчинами для обробки на основі LCO та CO при рівні дози 3 рідкі унції/100 фунтів насіння. Наступного дня насіння висівали у пластикові горщики, що містили суміш пісок:перліт 1:1. Насіння пророщували у теплиці протягом 4 тижнів, а потім збирали. [0131] Не спостерігали значних відмінностей сухої ваги рослин бавовнику для контролю, LCO та CO. Проте, CO приводив до одержання відносно більшої сухої ваги рослин порівняно із 20 UA 114299 C2 5 10 15 20 25 30 35 40 45 50 контролем та LCO. Збільшення загальної сухої ваги рослин при застосуванні CO порівняно із контролем становило 3,29 % (Фіг. 26). Приклад 14. Позакоренева обробка сої різними активними засобами [0132] Рослини сої (Jung seed, сорт 8168NRR) обробляли різними активними молекулами на стадії росту V4. Рослини вирощували з насіння у теплиці в пластикових горщиках, що містили суміш пісок:перліт 1:1. Проростки вирощували протягом 4 тижнів із періодичним внесенням рідкого добрива, а потім збирали рослини. [0133] Позакореневе внесення LCO для сої, CO для гороху або китайського CO не виявляло значного впливу на збільшення сухої біомаси рослин (Фіг. 27). Біомаса для кожного LCO, CO і китайського CO була відносно вищою, ніж для контрольних рослин, при цьому активні засоби були однаково ефективними. Приклад 15. Нанесення на насіння кукурудзи -8 [0134] Насіння кукурудзи обробляли різними комбінаціями CO для гороху (10 M) та LCO -8 -9 для гороху (10 , 10 M). Насіння висівали у теплиці у пластикові горщики, що містили суміш пісок:перліт 1:1. Проростки збирали через 10 днів після посіву, відмивали дочиста, а потім висушували у сушильній шафі при 60 C протягом 48 год. -8 -8 [0135] Як проілюстровано на Фіг. 28, як CO (10 M) (позначений CO8), так і LCO (10 M) (позначений SP8) сам по собі приводив до збільшення сухої ваги проростків кукурудзи. Тільки -9 -8 комбінація LCO при 10 /CO при 10 приводила до збільшення сухої ваги проростків кукурудзи більшою мірою, ніж будь-який з LCO для гороху (SP) або CO для гороху. Приклад 16. Проростання насіння сорго у чашках Петрі [0136] Насіння сорго пророщували в чашках Петрі, що містили рідкі розчини для обробки. Проростки збирали через 5 днів та їх корені вимірювали за допомогою сканера WinRHIZO. Як -8 -8 проілюстровано на Фіг. 29, як CO для гороху (10 M), так і LCO для гороху (10 M) приводили до -8 збільшення довжини коренів проростків, а комбінація CO у концентрації 10 та LCO у -9 концентрації 10 приводила до більшого збільшення довжини коренів проростків, ніж збільшення за допомогою лише CO або LCO. Приклад 17. Позакореневе нанесення на бавовник [0137] Рослини бавовнику вирощували з насіння у теплиці в пластикових горщиках, що містили суміш пісок:перліт 1:1. Коли проростки знаходились на V-стадії, їх листя обприскували -8 CO для гороху (10 M) та CO разом із поживними мікроелементами (Ca-пантотенатом та борною кислотою), при цьому кожний з них був присутній у незначних кількостях. [0138] Рослини збирали через 4 тижні після обробки. До збору вимірювали зеленість листя за допомогою вимірювача хлорофілу SPAD. Як проілюстровано на Фіг. 30 та 31, CO приводив до значного підвищення зеленості листя та давав кількісне збільшення середньої ваги сухої рослини порівняно із контролем, і при цьому комбінована обробка за допомогою CO та поживних мікроелементів приводила до досягнення ще більшого збільшення. 18-20: Випробування в польових умовах Приклад 18. Соя [0139] Дев'ятнадцать випробувань в польових умовах проводили для оцінки варіантів здійснення даного винаходу щодо врожайності зерна при нанесенні на листя сої. Випробування в польових умовах проводили у восьми штатах при різних характеристиках ґрунту й умовах навколишнього середовища. [0140] Засоби для обробки, використовувані у випробуваннях, являли собою контроль (вода), чистий CO (хітоолігосахарид) - CO-V (проілюстрований на Фіг. 2a) та чистий LCO (ліпохітоолігосахарид) – SP104 (проілюстрований на Фіг. 2b). Засоби для обробки з CO і LCO -8 застосовували при молярній концентрації 8 × 10 М, що давало у результаті внесення 12 мкг/акр. Використовували різні комерційні сорти сої. Засоби для обробки додавали до гербіциду гліфосату та розпилювали на листя на вегетативній стадії V4-V5. Чотири унції засобу для обробки на акр у комбінації з гербіцидом і водою вносили при нормі 5-10 галонів на акр. Рослини сої вирощували до дозрівання, збирали та визначали врожайність зерна. Результати наведено у Таблиці 1. 21 UA 114299 C2 Таблиця 1 Середнє (N=19) Ефект (бушелі/акр) Збільшення ефекту (% порівняно із контролем) Позитивний ефект на врожайність (%) 5 10 15 20 УРОЖАЙНІСТЬ (бушелі/акр) Контроль LCO (SP104) CO (CO-V) 56,5 58,3 58,2 1,8 1,7 3% 3% 68,4 68,4 [0141] Виходячи з порівняння контролю та CO, урожайність підвищувалася на 1,7 бушеля/акр при позакореневій обробці CO, що становило в результаті 3 % збільшення порівняно з контролем, і при цьому позитивне стимулювання врожайності спостерігали в 68,4 % випробувань. [0142] Порівняно з ефектом позакореневого нанесення LCO середня врожайність при використанні CO становила на 0,1 бушеля/акр менше, але спостерігали таке ж відсоткове збільшення врожайності порівняно з контролем і такий же відсоток позитивного стимулювання врожайності. Отже, як CO, так і LCO забезпечували фактично однакове стимулювання врожайності при використанні в якості позакореневої обробки. Приклад 19. Кукурудза [0143] Шістнадцять (16) випробувань у польових умовах проводили для оцінки варіантів здійснення даного винаходу щодо врожайності зерна при нанесенні на листя кукурудзи. Випробування в польових умовах проводили у восьми штатах при різних характеристиках ґрунту й умовах навколишнього середовища. [0144] Засоби для обробки, використовувані у випробуваннях, являли собою контроль (вода), чистий CO (хітоолігосахарид) - CO-V (проілюстрований на Фіг. 2a) та чистий LCO (ліпохітоолігосахарид) - SP104 (проілюстрований на Фіг. 2b). Використовували різні комерційні гібриди кукурудзи. Засоби для обробки додавали до гербіциду гліфосату та розпилювали на листя під час планового внесення гербіциду. Чотири унції засобу для обробки на акр поєднували з гербіцидом і водою та вносили при нормі 5-10 галонів на акр. Кукурудзу вирощували до дозрівання, збирали та визначали врожайність зерна. Таблиця 2 Середнє (N=16) Ефект (бушелі/акр) Збільшення ефекту (% порівняно із контролем) Позитивний ефект на врожайність (%) УРОЖАЙНІСТЬ (бушелі/акр) Контроль LCO (SP104) CO (CO-V) 192,6 196,8 201,8 4,2 9,2 2,2 4,8 75,0 93,8 25 30 35 40 [0145] Виходячи з порівняння контролю та CO, урожайність підвищувалася на 9,2 бушеля/акр при позакореневій обробці CO, що приводило у результаті до 4,8 % збільшення порівняно з контролем, і при цьому позитивне стимулювання врожайності спостерігали в 93,8 % випробувань. [0146] Порівняно із ефектом позакореневої обробки за допомогою LCO середня врожайність при використанні CO була на 5,0 бушеля/акр вищою, що забезпечувало збільшення врожайності на 2,6 %, і при цьому у випробуваннях із позитивним ефектом спостерігали на 18,8 % більше значення. [0147] Отже, як CO, так і LCO забезпечували збільшення врожайності при використанні у якості позакореневої обробки, але CO показав щонайменше у два рази кращий результат, ніж LCO. Приклад 20. Кукурудза [0148] Десять випробувань у польових умовах проводили для оцінки варіантів здійснення даного винаходу щодо врожайності зерна при нанесенні на насіння кукурудзи перед посівом. П'ять випробувань у польових умовах проводили у п'яти штатах і п'ять випробувань у польових умовах проводили у Аргентині. [0149] Засоби для обробки, використовувані у випробуваннях, являли собою контроль (вода), чистий CO (хітоолігосахарид) - CO-V (проілюстрований на Фіг. 2a) та чистий LCO (ліпохітоолігосахарид) - SP104 (проілюстрований на Фіг. 2b). Засоби для обробки з CO і LCO 22 UA 114299 C2 -8 5 застосовували при молярній концентрації 1×10 М, що давало у результаті внесення 1 мкг/акр. Використовували різні комерційні гібриди кукурудзи. Три рідкі унції засобу для обробки наносили на п'ятдесят (50) фунтів насіння перед посівом. Кукурудзу вирощували до дозрівання, збирали та визначали врожайність зерна. Результати наведено у Таблиці 3. Таблиця 3 УРОЖАЙНІСТЬ (бушелі/акр) Контроль LCO (SP104) CO (CO-V) 181,5 192,6 188,0 11,1 6,5 6,1 3,6 90,0 80,0 Середнє (N=10) Ефект (бушелі/акр) Збільшення ефекту (% порівняно із контролем) Позитивний ефект на врожайність (%) 10 15 20 25 [0150] Виходячи з порівняння контролю та CO, урожайність підвищувалася при нанесенні на насіння засобу для обробки з CO на 6,5 бушеля/акр, що приводило у результаті до збільшення на 3,6 % порівняно з контролем, і при цьому позитивне стимулювання врожайності спостерігали в 80,0 % випробувань. [0151] При порівнянні CO та LCO середня врожайність при використанні CO була на 4,6 бушеля/акр меншою, що давало у результаті на 2,5 % менше збільшення врожайності вище за значення для контролю та на 10,0 % менші позитивні ефекти на врожайність у десяти випробуваннях. [0152] При нанесенні на насіння кукурудзи засоби для обробки як із CO, так і з LCO забезпечували підвищення урожайності вище значення для контролю, при цьому LCO забезпечував найбільший ефект. [0153] Усі патентні та непатентні публікації, що цитуються в даному описі, свідчать про рівень компетентності фахівців у галузі, до якої належить даний винахід. Усі ці публікації включені в даний документ за допомогою посилання тією самою мірою, як якби кожна окрема публікація або патентна заявка була спеціально й окремо зазначена як включена за допомогою посилання. [0154] Хоча в даному документі даний винахід був описаний з посиланням на конкретні варіанти здійснення, слід розуміти, що дані варіанти здійснення є тільки ілюстраціями принципів і шляхів застосування даного винаходу. Отже, слід розуміти, що можна здійснювати численні модифікації ілюстративних варіантів здійснення і що можна розробити інші засоби без відступу від сутності й обсягу даного винаходу, як визначено в формулі винаходу, що додається. ФОРМУЛА ВИНАХОДУ 30 1. Спосіб стимулювання росту рослин, який включає обробку насінини рослини та/або рослини, що проростає з насінини, ефективною кількістю щонайменше одного хітоолігосахариду (CO), представленого формулою: R5 R6 O OH O R4O R3O N R1 OH O O R10O NH R2 O O O HO NH O O O R9O NH n O R8 35 40 O де R1 являє собою водень або метил; R2 являє собою водень або метил; R3 являє собою водень, ацетил або карбамоїл; R4 являє собою водень, ацетил або карбамоїл; R5 являє собою водень, ацетил або карбамоїл; 23 O R7 O , UA 114299 C2 5 R6 являє собою водень, арабінозил, фукозил, ацетил, естер сірчаної кислоти, 3-0-S-2-0-MeFuc, 2-0-MeFuc або 4-0-AcFuc; R7 являє собою водень, манозил або гліцерин; R8 являє собою водень, метил або -СН2ОН; R9 являє собою водень, арабінозил або фукозил; R10 являє собою водень, ацетил або фукозил; та n дорівнює 0, 1, 2 або 3. 2. Спосіб за п. 1, який відрізняється тим, що щонайменше один CO включає CO, представлений структурою: OH OH H HO HO H H HO HO 10 O HO O H H H O H O H H H O HO NH H H H H H HO H H H O H O H H NH H O O NH H H O NH O OH H H O H H H H O O HO O OH O OH NH H . 3. Спосіб за будь-яким із пп. 1-2, який відрізняється тим, що щонайменше один CO включає CO, представлений структурою: NHAc O HO HO NHAc O O HO O O O HO O HO O OH HO O NHAc OH NHAc OH NH H OH OH OH H 15 . 4. Спосіб за будь-яким ізпп. 1-3, який відрізняється тим, що щонайменше один CO включає CO, представлений формулою: O O OH OH NH O HO HO NH O O HO O NH HO O HO O NH n OR2 OH R1 OH O O , де n=1 або 2; R1 являє собою водень або метил; та R2 являє собою водень або SO3H. 5. Спосіб за будь-яким із пп. 1-4, який відрізняється тим, що щонайменше один CO включає CO, представлений структурою: O OH HO O NH H O HO HO O O O OH OSO3H NH OH CH3 NH O O HO O C OH NH HO 20 C O CH3 C CH3 . 6. Спосіб за будь-яким із пп. 1-5, який відрізняється тим, що щонайменше один CO включає CO, представлений структурою: 24 UA 114299 C2 O OH HO O NH H 10 15 20 25 30 35 40 45 C OH NH HO 5 C O CH3 O NH O O HO O HO HO O O OH OH NH OH CH3 C O CH3 . 7. Спосіб за будь-яким із пп. 1-6, який відрізняється тим, що щонайменше один CO включає синтетичний CO. 8. Спосіб за будь-яким із пп. 1-7, який відрізняється тим, що щонайменше один CO включає рекомбінантний CO. 9. Спосіб за п. 8, який відрізняється тим, що рекомбінантний CO є щонайменше на 60 % чистим. 10. Спосіб за п. 8, який відрізняється тим, що рекомбінантний CO є щонайменше на 70 % чистим. 11. Спосіб за п. 8, який відрізняється тим, що рекомбінантний CO є щонайменше на 80 % чистим. 12. Спосіб за п. 8, який відрізняється тим, що рекомбінантний СО с щонайменше на 90 % чистим. 13. Спосіб за будь-яким із пп. 1-12, який відрізняється тим, що щонайменше один СО наносять на насінину до посіву та/або приблизно у час посіву. 14. Спосіб за будь-яким із пп. 1-13, який відрізняється тим, що щонайменше один СО наносять на насінину щонайменше за один місяць до посіву. 15. Спосіб за будь-яким із пп. 1-13, який відрізняється тим, що щонайменше один СО наносять на насінину щонайменше за два місяці до посіву. 16. Спосіб за будь-яким із пп. 1-13, який відрізняється тим, що щонайменше один CO наносять на насінину щонайменше за три місяці до посіву. 17. Спосіб за будь-яким із пп. 1-13, який відрізняється тим, що щонайменше один CO наносять на насінину щонайменше за шість місяців до посіву. 18. Спосіб за будь-яким із пп. 1-13, який відрізняється тим, що щонайменше один CO наносять на насінину щонайменше за один рік до посіву. 19. Спосіб за будь-яким із пп. 1-18, який відрізняється тим, що щонайменше один CO наносять на насінину у борозні. 20. Спосіб за будь-яким із пп. 1-19, який відрізняється тим, що щонайменше один CO наносять на рослину шляхом позакореневої обробки. 21. Спосіб за будь-яким із пп. 1-20, який відрізняється тим, що ефективна кількість -5 -14 щонайменше одного CO становить від приблизно 10 до приблизно 10 М. 22. Спосіб за будь-яким із пп. 1-20, який відрізняється тим, що ефективна кількість -5 -11 щонайменше одного CO становить від приблизно 10 до приблизно 10 М. 23. Спосіб за будь-яким із пп. 1-20, який відрізняється тим, що ефективна кількість -7 -8 щонайменше одного CO становить від приблизно 10 до приблизно 10 М. 24. Спосіб за будь-яким із пп. 1-23, який відрізняється тим, що ефективна кількість щонайменше одного CO становить від приблизно 1 мкг/акр до приблизно 70 мкг/акр. 25. Спосіб за будь-яким із пп. 1-23, який відрізняється тим, що ефективна кількість щонайменше одного CO становить від приблизно 1 мкг/акр до приблизно 30 мкг/акр. 26. Спосіб за будь-яким із пп. 1-23, який відрізняється тим, що ефективна кількість щонайменше одного CO становить від приблизно 11 мкг/акр до приблизно 20 мкг/акр. 27. Спосіб за будь-яким із пп. 1-23, який відрізняється тим, що ефективна кількість щонайменше одного CO становить від приблизно 50 мкг/акр до приблизно 60 мкг/акр. 28. Спосіб за будь-яким із пп. 1-27, який додатково включає нанесення на насінину та/або на рослину, що проростає з насінини, щонайменше одного поживного мікроелемента. 29. Спосіб за п. 28, який відрізняється тим, що щонайменше один поживний мікроелемент включає один або декілька вітамінів та/або слідових елементів. 30. Спосіб за будь-яким із пп. 1-29, який додатково включає нанесення на насінину та/або на рослину, що проростає з насінини, жирної кислоти або її похідної. 25 UA 114299 C2 5 31. Спосіб за будь-яким із пп. 1-30, який додатково включає нанесення на насінину та/або на рослину, що проростає з насінини, щонайменше однієї сигнальної молекули для рослин. 32. Спосіб за п. 31, який відрізняється тим, що щонайменше одна сигнальна молекула для рослин включає щонайменше один ліпохітоолігосахарид (LCO). 33. Спосіб за п. 32, який відрізняється тим, що щонайменше один LCO включає LCO, представлений структурою: OH OH H HO HO H HO HO O HO O H H H H H O H O H O HO H NH H H H H H O HO H H H H H H HO O OH H O O HO O H O H O H H NH H O O NH H NH O OH O OH NH H . 34. Спосіб за будь-яким із пп. 32-33, який відрізняється тим, що щонайменше один LCO включає LCO, представлений структурою: OH OH OH NHAc O HO HO HO O O O HO O OH HO O NHAc OH NHAc OH NH H O O HO O NHAc O 10 . 35. Спосіб за будь-яким із пп. 32-34, який відрізняється тим, що щонайменше один LCO включає LCO, представлений структурою: O OH HO NH C O 15 O HO HO O O O OH OSO3H NH OH CH3 NH O O HO O C OH NH O HO C O CH3 C CH3 . 36. Спосіб за будь-яким із пп. 32-35, який відрізняється тим, що щонайменше один LCO включає LCO, представлений структурою: 26 UA 114299 C2 O OH HO NH C O 5 10 15 20 25 30 35 O HO HO O O O OH OH NH OH CH3 NH O O HO O C OH NH O HO C O CH3 C CH3 . 37. Спосіб за будь-яким із пп. 32-36, який відрізняється тим, що щонайменше один LCO включає щонайменше один LCO, одержаний зі штаму Rhizobium, Sinorhizobiwn, Azorrhizobium, Mesorhizobium або Bradyrhizobium. 38. Спосіб за будь-яким із пп. 32-37, який відрізняється тим, що щонайменше один LCO включає щонайменше один LCO, одержаний зі штаму Bradyrhizobium japonicum. 39. Спосіб за будь-яким із пп. 32-38, який відрізняється тим, що щонайменше один LCO включає щонайменше один LCO, одержаний зі штаму Sinorhizobium meliloti. 40. Спосіб за будь-яким із пп. 32-39, який відрізняється тим, що щонайменше один LCO включає щонайменше один LCO, одержаний зі штаму Rhizobium leguminosarum. 41. Спосіб за будь-яким із пп. 32-40, який відрізняється тим, що щонайменше один LCO включає щонайменше один LCO, одержаний із мікоризного гриба. 42. Спосіб за будь-яким із пп. 32-41, який відрізняється тим, що щонайменше один LCO включає щонайменше один LCO, одержаний зі штаму Glomeromycota. 43. Спосіб за будь-яким із пп. 32-42, який відрізняється тим, що щонайменше один LCO включає щонайменше один LCO, одержаний зі штаму Glomus intraradices. 44. Спосіб за будь-яким із пп. 31-43, який відрізняється тим, що щонайменше одна сигнальна молекула для рослин включає сигнальну молекулу для рослин, вибрану із групи, яка включає хітинові сполуки, флавоноїди, жасмонову кислоту та її похідні, лінолеву кислоту та її похідні, ліноленову кислоту та її похідні, а також карикіни та їх похідні. 45. Спосіб за будь-яким із пп. 31-44, який відрізняється тим, що щонайменше одна сигнальна молекула для рослин включає хітин та/або хітозан. 46. Спосіб за будь-яким із пп. 1-45, який додатково включає нанесення на насінину та/або рослину, що проростає з насінини, одного або декількох гербіцидів, інсектицидів та/або фунгіцидів. 47. Спосіб за будь-яким із пп. 1-46, який додатково включає нанесення на насінину та/або рослину, що проростає з насінини, щонайменше одного мікроорганізму, що солюбілізує фосфати. 48. Спосіб за п. 47, який відрізняється тим, що щонайменше один мікроорганізм, що солюбілізує фосфати, включає щонайменше один штам Рenicillium. 49. Спосіб за п. 47, який відрізняється тим, що щонайменше один мікроорганізм, що солюбілізує фосфати, включає щонайменше один штам P. bilaiae. 50. Спосіб за п. 49, який відрізняється тим, що щонайменше один штам P. bilaiae включає NRRL 50162, NRRL 50169, АТСС 20851, АТСС 22348 та/або АТСС 18309. 51. Спосіб за будь-яким із пп. 47-50, який відрізняється тим, що щонайменше один мікроорганізм, що солюбілізує фосфати, включає щонайменше один штам P. gaestrivorus. 52. Спосіб за п. 51, який відрізняється тим, що щонайменше один штам P. gaestrivorus включає NRRL 50170. 27 UA 114299 C2 5 10 15 20 25 30 35 40 53. Спосіб за будь-яким із пп. 47-52, який відрізняється тим, що щонайменше один мікроорганізм, що солюбілізує фосфати, включає щонайменше один штам Streptomyces. 54. Спосіб за будь-яким із пп. 1-46, який додатково включає нанесення на насінину та/або рослину, що проростає з насінини, щонайменше одного діазотрофа. 55. Спосіб за п. 54, який відрізняється тим, що зазначений щонайменше один діазотроф включає один або декілька штамів Rhizobium, Sinorhizobium, Azorrhizobium, Mesorhizobium та/або Bradyrhizobium. 56. Спосіб за будь-яким із пп. 54-55, який відрізняється тим, що зазначений щонайменше один діазотроф включає щонайменше один штам Bradyrhizobium japonicum. 57. Спосіб за будь-яким із пп. 54-55, який відрізняється тим, що зазначений щонайменше один діазотроф включає щонайменше один штам Sinorhizobium meliloti. 58. Спосіб за будь-яким із пп. 54-55, який відрізняється тим, що зазначений щонайменше один діазотроф включає щонайменше один штам Rhizobium leguminosarum. 59. Спосіб за будь-яким із пп. 54-55, який відрізняється тим, що зазначений щонайменше один діазотроф включає щонайменше один штам Mesorhizobium ciceri. 60. Спосіб за будь-яким із пп. 1-46, який додатково включає нанесення на насінину та/або рослину, що проростає з насінини, щонайменше одного мікоризного гриба. 61. Спосіб за п. 60, який відрізняється тим, що зазначений щонайменше один мікоризний гриб включає щонайменше один штам Glomeromycota. 62. Спосіб за будь-яким із пп. 1-61, який відрізняється тим, що насінина являє собою насінину бобової рослини. 63. Спосіб за будь-яким із пп. 1-61, який відрізняється тим, що насінина являє собою насінину рослини, яка не належить до бобових. 64. Спосіб за будь-яким із пп. 1-61, який відрізняється тим, що насінина являє собою насінину Poaceae, Cucurbitaceae, Malvaceae, Asteraceae, Chenopodiaceae або Solanaceae. 65. Спосіб за будь-яким із пп. 1-61, який відрізняється тим, що насінина являє собою насінину пшениці. 66. Спосіб за будь-яким із пп. 1-61, який відрізняється тим, що насінина являє собою насінину ячменя. 67. Спосіб за будь-яким із пп. 1-61, який відрізняється тим, що насінина являє собою насінину вівса. 68. Спосіб за будь-яким із пп. 1-61, який відрізняється тим, що насінина являє собою насінину жита. 69. Спосіб за будь-яким із пп. 1-61, який відрізняється тим, що насінина являє собою насінину картоплі. 70. Спосіб за будь-яким із пп. 1-61, який відрізняється тим, що насінина являє собою насінину буряку. 71. Спосіб за будь-яким із пп. 1-61, який відрізняється тим, що насінина являє собою насінину сої. 72. Спосіб за будь-яким із пп. 1-61, який відрізняється тим, що насінина являє собою насінину томату. 73. Насінина, оброблена згідно зі способом за будь-яким із пп. 1-72, що містить щонайменше один хітоолігосахарид (CO), представлений формулою: R5 R6 O OH O R4O R3O N R1 45 50 OH O O R10O NH R2 O O O O HO NH O O O R9O NH n O R8 де R1 являє собою водень або метил; R2 являє собою водень або метил; R3 являє собою водень, ацетил або карбамоїл; R4 являє собою водень, ацетил або карбамоїл; R5 являє собою водень, ацетил або карбамоїл; 28 O R7 O ,
ДивитисяДодаткова інформація
Назва патенту англійськоюChitooligosaccharides and methods for use in enhancing plant growth
Автори англійськоюSmith, R. Stewart, Habib, Ahsan
Автори російськоюСмит Р. Стюарт, Хабиб Ахсан
МПК / Мітки
МПК: A01N 35/10, A01C 1/00, A01N 43/54, A01N 31/06, A01N 43/40, A01N 37/40, C05G 3/02, A01N 43/80, A01N 43/38, A01N 57/20, A01N 43/88, A01N 43/50, C05F 11/00, C05F 11/08
Мітки: хітоолігосахариди, росту, стимулюванні, рослин, способи, застосування
Код посилання
<a href="https://ua.patents.su/46-114299-khitooligosakharidi-ta-sposobi-zastosuvannya-pri-stimulyuvanni-rostu-roslin.html" target="_blank" rel="follow" title="База патентів України">Хітоолігосахариди та способи застосування при стимулюванні росту рослин</a>
Попередній патент: Пептид торк та вакцина, що його містить
Наступний патент: Пристрій, системи та способи подачі насіння
Випадковий патент: Спосіб визначення втомних змін експлуатаційних характеристик покриттів












