Дельта-кодек
Номер патенту: 46822
Опубліковано: 17.06.2002
Автори: Попов Валентин Петрович, Молчанов Сергій Юрійович, Бондаренко Валентин Іванович, Тимошенко Микола Андрійович
Формула / Реферат
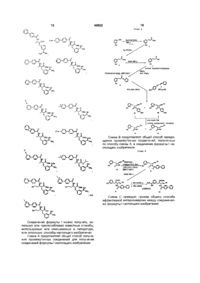
1. Дельта-кодек, що містить дельта-кодер і дельта-декодер, причому дельта-кодер містить компаратор, вихід якого з'єднано з інформаційним входом першої схеми керування зміною кроку квантування (ЗКК), вихід якої приєднано до першого входу компаратора, другий вхід якого з'єднано з першою вхідною інформаційною шиною дельта-кодека, перша вихідна інформаційна шина якого з'єднана з виходом послідовного коду першої схеми керування ЗКК, а в склад дельта-декодера входить друга схема керування ЗКК, вихід і перший вхід якої з'єднані відповідно з другою вихідною інформаційною шиною і другою вхідною інформаційною шиною дельта-кодека, а також формувач тактових імпульсів (ТІ), який відрізняється тим, що в нього введено генератор, керований напругою (ГКН), вихід якого через подільник частоти з'єднано з першим входом фазового компаратора, вихід якого через перший фільтр нижніх частот (ФНЧ) з'єднано з входом ГКН, вихід якого також з'єднано з входом формувача ТІ, виходи якого з'єднані з відповідними тактовими входами першої і другої схем керування ЗКК, вихід подільника частоти також з'єднано з відповідними входами синхроімпульсів першої та другої схем керування ЗКК, а другий вхід фазового компаратора і другий вхід подільника частоти з’єднані відповідно з шиною синхроімпульсів і першою шиною керування дельта-кодека.
2. Дельта-кодек за п. 1, який відрізняється тим, що в дельта-кодері перша вхідна інформаційна шина дельта-кодека з'єднана з другим входом компаратора через послідовно з'єднані диференціальний підсилювач, антиалайзинговий фільтр і другий ФНЧ, який виконано на комутованих конденсаторах, а тактовий вхід другого ФНЧ з'єднано з відповідним виходом формувача ТІ.
3. Дельта-кодек за п. 1 або 2, який відрізняється тим, що в дельта-декодері вихід другої схеми керування ЗКК з'єднано з другою вихідною інформаційною шиною дельта-кодека через послідовно з'єднані фільтр п'ятого порядку і третій ФНЧ, при цьому фільтр п'ятого порядку виконано на комутованих конденсаторах, а тактовий вхід фільтра п'ятого порядку приєднано до відповідного виходу формувача тактових імпульсів.
4. Дельта-кодек за будь-яким з пп. 1-3, який відрізняється тим, що містить вихідний пристрій з трьома станами роботи, відповідно вмикання, вимикання і перемикання, причому вихід послідовного коду першої схеми керування ЗКК з'єднано з першою вихідною інформаційною шиною дельта-кодека через згаданий вихідний пристрій, керуючий вхід якого є п'ятою шиною керування.
Текст
1 Дельта-кодек, що містить дельта-кодер і дельта-декодер, причому дельта-кодер містить компаратор, вихід якого з'єднано з інформаційним входом першої схеми керування зміною кроку квантування (ЗКК), вихід якої приєднано до першого входу компаратора, другий вхід якого з'єднано з першою вхідною інформаційною шиною дельтакодека, перша вихідна інформаційна шина якого з'єднана з виходом послідовного коду першої схеми керування ЗКК, а в склад дельта-декодера входить друга схема керування ЗКК, вихід і перший вхід якої з'єднані ВІДПОВІДНО З другою вихідною інформаційною шиною і другою вхідною інформаційною шиною дельта-кодека, а також формувач тактових імпульсів (ТІ), який відрізняється тим, що в нього введено генератор, керований напругою (ГКН), вихід якого через подільник частоти з'єднано з першим входом фазового компаратора, вихід якого через перший фільтр нижніх частот (ФНЧ) з'єднано з входом ГКН, вихід якого також з'єднано з входом формувача ТІ, виходи якого з'єднані з ВІДПОВІДНИМИ тактовими входами першої і другої схем керування ЗКК, вихід подільника частоти також з'єднано з ВІДПОВІДНИМИ входами синхроімпульсів першої та другої схем керування ЗКК, а другий вхід фазового компаратора і другий вхід подільника частоти з'єднані ВІДПОВІДНО з шиною синхроімпульсів і першою шиною керування дельта-кодека 2 Дельта-кодек за п 1, який відрізняється тим, що в дельта-кодері перша вхідна інформаційна шина дельта-кодека з'єднана з другим входом компаратора через послідовно з'єднані диференціальний підсилювач, антиалайзинговий фільтр і другий ФНЧ, який виконано на комутованих конденсаторах, а тактовий вхід другого ФНЧ з'єднано Соединения формулы 1 проявляют полезную фармакологическую активность и, соответственно, включены в фармацевтические композиции и используются для лечения пациентов, страдающих определенными медицинскими нарушениями Более конкретно, они являются ингибиторами Фактора Ха Настоящее изобретение относится к соединениям формулы I, композициям, содержащим соединения формулы I, и к их использованию для лечения пациентов, страдающих от или подверженных состояниям, которые можно облегчить путем введения ингибитора Фактора Ха Фактор Ха является предпоследним ферментом в каскаде реакций коагуляции Как свободный фактор Ха, так и фактор Ха, включенный в протромбиназный комплекс (Фактор Ха, Фактор Va, кальций и фосфолипид), оба ингибируются соединениями формулы I Ингибирование Фактора Ха 3 ВІДПОВІДНИМ виходом формувача ТІ 3 Дельта-кодек за п 1 або 2, який відрізняється тим, що в дельта-декодері вихід другої схеми керування ЗКК з'єднано з другою вихідною інформаційною шиною дельта-кодека через послідовно з'єднані фільтр п'ятого порядку і третій ФНЧ, при цьому фільтр п'ятого порядку виконано на комутованих конденсаторах, а тактовий вхід фільтра п'ятого порядку приєднано до ВІДПОВІДНОГО виходу формувача тактових імпульсів 4 Дельта-кодек за будь-яким з пп 1-3, який відрізняється тим, що містить вихідний пристрій з трьома станами роботи, ВІДПОВІДНО вмикання, вимикання і перемикання, причому вихід послідовного коду першої схеми керування ЗКК з'єднано з першою вихідною інформаційною шиною дельтакодека через згаданий вихідний пристрій, керуючий вхід якого є п'ятою шиною керування О 00 (О 46822 достигается непосредственным комплексообразованием между ингибитором и ферментом, и поэтому не зависит от конфактора плазмы антитромбина III Эффективного ингибирования Фактора Ха достигают либо вводя соединение перорально, либо с помощью непрерывного внутривенного вливания, либо болюсного внутривенного введения, либо любым другим парэнтеральным способом, с помощью которого достигается нужный эффект предотвращения вызываемого Фактором Ха образования тромбина из протромбина Антикоагуляционная терапия показана для лечения и профилактики различных состояний, связанных с тромбозом, как венозных, так и артериальных сосудов В артериальной системе ненормальное образование тромба, главным образом, связано с артериями коронарной, церебральной и периферической сосудистой системы Заболевания, связанные с закупоркой тромбом этих сосудов включают, главным образом, острый инфаркт миокарда (AMI), нестабильную стенокардию, тромбоэмболию, закупорку сосудов, связанную с тромболитической терапией и чрескожной транслюминальной коронарной ангиопластикой (РТСА), преходящие ишемические приступы, перемежающаяся хромота и коронарное шунтирование (CABG) или шунтирование периферических артерий Постоянная антикоагуляционная терапия также может быть благоприятной для предотвращения сужения просветов сосудов (рестеноз), который часто наблюдается после РТСА и CABG, а также для поддержания доступа к сосудам пациента в случае длительного гемодиализа В отношении венозных сосудов, патологическое образование тромбов часто происходит в венах нижних конечностей после абдоминальной хирургии и операций на коленях и бедрах (тромбоз глубоких вен, DVT) Кроме того, DVT подвергает пациента дополнительному риску легочной тромбоэмболии Системная диссеминированная внутрисосудистая коагулопатия (DIC) обычно наблюдается в обеих сосудистых системах во время септического шока, при некоторых вирусных инфекциях и при раковых заболеваниях Эти условия отличаются быстрым расходованием факторов коагуляции и их плазменных ингибиторов, что приводит к образованию закупорки микрососудов некоторых систем органов Обсуждавшиеся ранее показания включают некоторые (но не все) возможные клинические ситуации, в которых оправдана антикоагуляционная терапия Специалистам хорошо известны обстоятельства, требующие либо острой, антикоагуляци-онной терапии, либо терапии для хронической профилактики Настоящеее изобретение относится к фармацевтическому использованию соединения формулы I (представлена далее) для ингибирования выработки или физиологического влияния Фактора Ха при лечении пациентов, страдающих болезненными состояниями, связанными с физиологически вредным избытком Ха фактора, формула I имеет вид H,N NR e COR 5 Ri и F 2 представляют водород, или, взятые вме? сте представляют =NRg, R3 представляет -CO2R6, -C(O)R6l -CONR6R6, CH2OR7 или -CH2SR7, R4 представляет группу ФОРМУЛЫ А или R4 представляет водород, алкил, циклоалкил или циклоалкилалкил, Rs представляет алкил, алкенил, необязательно замещенный арил или необязательно замещенный гетероарил, R6 представляет водород или низший алкил, R7 представляет водород, низший алкил, низший ацил, ароил или гетероарил, Rs представляет водород или низший алкил, Rg представляет R10O2C-, RioO-, НО- циано, RioCO-, HCO-, низший алкил, нитро или у y2N-, где R-іо представляет необязательно замещенный алкил, необязательно замещенный аралкил или необязательно замещенный гетероаралкил, и где у1 и у2 независимо представляют водород или алкил, А и В представляют водород, или, взятые вместе, представляют связь, Аг представляет необязательно замещенный арил или необязательно замещенный гетероарил, и п = 0,1 или 2, или к его фармацевтически приемлемой соли, Nоксиду, гидрату или сольвату В том смысле, как здесь использованы (и ранее и в дальнейшем тексте описания) следующие термины означают Определения Термин «пациент» относится как к человеку, так и к другим млекопитающим «Алкил» означает алифатическую углеводородную группу, которая может быть разветвленной или неразветвленной, и может содержать от около 1 до 15 атомов углерода в цепи Предпочтительные алкильные группы содержат от 1 до 12 атомов углерода в цепи Термин «разветвленный» означает, что одна или более низших алкильных групп, таких как метил, этил или пропил, присоединена к линейной алкильной цепи «Низший алкил» относится к цепочке, содержащей от 1 до 6 атомов углерода, причем цепь может быть разветвленной или неразветвленной Алкильная группа может быть замещена одним или более галоидом, циклоал килом или циклоалкенилом Примеры алкильных групп включают метил, фторметил, дифторметил, трифторметил, циклопропилметил, циклопентилметил, этил, н-пропил, изо-пропил, н-бутил, трет -бутил, н-пентил, 3 46822 алкокси, арилокси, аралкокси, карбокси, ацил, пентил, гептил, октил, нонил, децил и додецил ароил, галоид, нитро, циано, карбокси, алкокси«Алкенил» означает алифатическую углевокарбонил, арилоксикарбонил, аралкоксикарбонил, дородную группу, содержащую двойную связь угациламино, ароиламино, алкилсульфонил, ариллерод-углерод, группа может быть разветвленной суль-фонил, алкилсульфинил, арилсульфинил, или неразветвленной и может содержать от 2 до 1 2 1 2 алкилтио, арилтио, аралкилтио У У 1\1-, У У 1Чоколо 15 атомов углерода в цепи Предпочтитель2 2 алкил-, СО- или yV NSO2-, где У и У независимо ные алкенильные группы содержат от 2 до 12, представляют водород, алкил, аралкил и арил наиболее предпочтительные от около 2 до около 6 Предпочтительные заместители арильной группы атомов углерода в цепи Термин разветвленный включают водород, алкил, необязательно замеозначает, что одна или более из низших алкильщенный арил, необязательно замещенный гетеных групп, таких как метил, этил или пропил, прироарил, гидрокси, ацил, ароил, галоид, нитро, соединена к линейной алкенильной цепи «Низциано, алкокси карбон ил, ациламино, алкилтио, ший алкенил» означает цепочку, содержащую от 2 1 2 2 1 2 У У Ы-, y V N C O - или yV NSO 2 -, где У и У незадо около 4 атомов углерода в цепи, причем она висимо представляют водород и алкил может быть разветвленной или неразветвленной Алкенильная группа может быть замещена одним «Гетероарил» обозначает 5 - 10 членную ароили более галогеном Примеры алкенильных матическую моноциклическую или полицикличегрупп включают этенил, пропенил, н-бутенил, изоскую углеводородную кольцевую систему, в котобутенил, З-метил-бут-2-енил, н-пентенил, гептерый один или более из атомов углерода в нил, октенил и деценил кольцевой системе является (являются)элементом (элементами) отличными от углеро«Циклоалкил» относится к неароматической да, например, азотом, кислородом или серой «Гемоно- или полициклической кольцевой системе, тероарил» также может быть замещен одним или содержащей от около 3 до около 10 атомов углеболее из заместителей арильной группы Примерода Примеры моноциклических циклоалкильных ры гетероарильных групп включают пиразинил, колец включают циклопентил, фторциклопентил, фуранил, тиенил, пиридил, пиримидинил, изоксациклогексил и цикло-гептил Циклоалкильная золил, изотиазолил, хинолинил, индолил и изохигруппа может быть замещена одним или более нолинил галогеном, метиленом (Н2С=) или алкилом Примеры полициклических циклоалкильных колец «Аралкил» означает арил-алкильную группу, в включают 1-декалин, адамант-(1-или 2-)ил и норкоторой арил и алкил имеют указанные ранее знаборнил чения Предпочтительные аралкилы содержат фрагмент низшего алкила Примеры аралкильных «Циклоалкенил» означает неароматическую групп включают бензил, 2-фенэтил и нафталинмемоноциклическую или полициклическую кольцетил вую систему, содержащую двойную связь углеродуглерод и от около 3 до около 10 атомов углерода «Гидроксиалкил» означает НО-алкил группу, в Примеры моноциклических циклоалкенильных которой алкил имеет указанные ранее значения колец включают циклопентенил, циклогексенил Предпочтительные гид роксиал килы содержат или циклогептенил Примером полициклических низший алкил Примеры гидроксиалкильных групп циклоалкенильных колец может служить норборвключают гидроксиметил и 2-гидроксиэтил ниленил Циклоалкенильная группа может быть «Ацил» означает Н-СО- или алкил-СО- группу, замещена одним или более галогеном, метиленом в которой алкильная группа имеет указанные ра(ЬІ2С=) или алкилом нее значения Предпочтительные ацилы содержат низший алкил Примеры ацильных групп включают «Гетероциклил» обозначает неароматическую формил, ацетил, пропаноил, 2-метилпропаноил, моноциклическую или полициклическую кольцебутаноил и пальмитоил вую систему, содержащую от около 3 до около 10 атомов в кольце Предпочтительные кольца вклю«Ароил» означает арил-СО- группу, в которой чают от 5 до около 6 атомов в кольце, где один из алкильная группа имеет указанные ранее значеатомов кольца представляет кислород, азот или ния Примеры групп включают бензоил и 1- и 2серу Гетероциклил может быть необязательно нафтоил замещен одним или более галогеном Предпочти«Алкокси» означает алкил-О- группу, в кототельные моноциклические гетероциклические рой алкильная группа имеет указанные ранее знакольца включают пиррол, тетрагидротиофенил и чения Примеры алкокси групп включают метокси, тетрагидротиопиранил Тио или азотный фрагмент этокси, н-пропокси, изо-пропокси, н-бутокси и гепгетероциклила может быть также необязательно токси окислен до соответствующего N-оксида, S-оксида «Арилокси» означает арил-О- группу, в котоили S.S-диоксида рой арильная группа имеет указанные ранее значения Примеры арилоксигрупп включают фенокси «Арил» обозначает ароматический карбоцики нафтокси лический радикал, содержащий от около 6 до около 10 атомов углерода Примеры ари-лов вклю«Аралкилокси» означает аралкил-О- группу, в чают фенил или нафтил, необязательно которой аралкильная группа имеет указанные разамещенный одним или более заместителями нее значения Примеры аралкилоксигрупп вклюарильных групп, которые могут быть одинаковы чают бензилокси и 1- или 2-нафталинметокси или различны, где «заместитель арильной груп«Алкилтио» означает алкил-S- группу, в котопы» включает водород, алкил, необязательно зарой алкильная группа имеет указанные ранее знамещенный арил, необязательно замещенный гечения Примеры алкилтиогрупп включают метилтероарил, аралкил, гидрокси, гидроксиалкил, тио, этилтио, изо-пропилтио и гептилтио 8 46822 «Арилтио» означает арил-S-rpynny, в которой NH арильная группа имеет указанные ранее значения Другим предпочтительным соединением наПримеры арилтиогрупп включают фенилтио и стоящего изобретения является соединение форнафтилтио мулы І, в котором R3 представляет -CO2R6, CH2OR7 или -CH2SP7 «Аралкилтио» означает аралкил-S- группу, в которой аралкильная группа имеет указанные раДругим предпочтительным соединением нанее значения Примером аралкилтиогрупп являетстоящего изобретения является соединение форся бензилтио мулы І, в котором п = 1 2 «yV N-» означает замещенную или незамеДругим предпочтительным соединением изо1 2 щенную аминогруппу, где У и У имеют указанные бретения является соединение формулы І, в которанее значения Примеры групп включают амиром R3 представляет -CO2R6 и R6 представляет Hofb^N-), метиламине, этилметиламино, диметинизший алкил ламино и диэтиламино Другим предпочтительным соединением настоящего изобретения является соединение фор«Алкоксикарбонил» представляет алкил-Омулы І, в котором R3 представляет -CH2OR7 или СО- группу Примеры алкоксикарбонильных групп CH2SR7, a R7 представляет водород или низший вкллючают метокси- и этоксикарбонил алкил «Арилоксикарбонил» представляет арил-ОСО- группу Примеры арилоксикарбонильных Другим предпочтительным аспектом настоягрупп включают фенокси- и нафтоксикарбонил щего изобретения является соединение формулы I, в котором Ri и R2, взятые вместе, представляют «Аралкоксикарбонил» представляет аралкил= NH, и образуют аминоиминометил на фенильО-СО- группу Примером аралкоксикарбонильной ном фрагменте, то есть, в мета-положении пригруппы является бензилоксикарбонил соединения фенильного фрагмента к пропильно«yV 2 NCO-» означает замещенную или незаму фрагменту мещенную карбамоильную группу, где У1 и У2 имеют указанные ранее значения Примерами Другим предпочтительным соединением нагрупп являются карбамоил (H2NCO-) и диметиластоящего изобретения является соединение форминокарбамоил (Me2NCO-) мулы І, в котором Аг представляет необязательно замещенный арил «yV2NSO2-» означает замещенную или незамещенную сульфа-моильную группу, где У1 и У2 Еще одним предпочтительным соединением имеют указанные ранее значения Примерами настоящего изобретения является соединение групп являются аминосульфамоил (H2NSO2-) и формулы І, в котором Аг представляет фенил диметиламиносульфамоил (Me2NSO2-) Другим предпочтительным соединением настоящего изобретения является соединение фор«Ациламино» представляет ацил-NH- группу, мулы І, в котором Rs представляет необязательно где ацил имеет указанные ранее значения замещенный фенил, необязательно замещенный «Ароиламино» представляет ароил-NH- групбифенил, необязательно замещенный нафтил, пу, где ароил имеет указанные ранее значения или необязательно замещенный гетеробифенил «Алкилсульфонил» означает алкил-БОг- группу Предпочтительными группами являются те, в Другим предпочтительным соединением накоторых алкильная группа является низшим алкистоящего изобретения является соединение форлом мулы І, в котором R-іо представляет низший алкил «Алкилсульфинил» означает алкил-SO- групВ объем соединения формулы I включены сопу Предпочтительными группами являются те, в единения, в которых Ri и R2, вместе взятые, предкоторых алкильная группа является низшим алкиставляют = NRg, где Rg представляет R10O2C-, лом RioO-, циано, R-ioCO-, необязательно замещенный низший алкил, нитро, или У1У21Ч- Такие производ«Арилсульфонил» означает арил-БОг группу ные могут сами по себе представлять биологиче«Арилсульфинил» означает арил-SO- группу ски активные соединения, пригодные для лечения «Галоид» означает фтор, хлор, бром или йод болезненных состояний, которые можно модулиПредпочтительными являются фтор, хлор или ровать, ингибируя продуцирование Фактора Ха у бром, и более предпочтительны фтор или хлор пациента, страдающего указанным болезненным Термин «пролекарство» означает соединение, состоянием, или могут' действовать как пролекоторое может (а может и не быть) само биологикарства таких биологически активных соединений, чески активным, но которое может в результате которые образуются из них в физиологических метаболических, сольволитических или других условиях физиологических процессов быть превращено в биологически активное химическое соединение Соединения настоящего изобретения выбиПредпочтительные варианты рают из следующих Предпочтительным вариантом изобретения является способ лечения болезненного состояния, которое можно изменить путем ингибирования продуцирования Фактора Ха у пациента, страдающего указанным болезненным состоянием, с помощью эффективного количества соединения формулы I Предпочтительным соединением настоящего изобретения является соединение формулы I, в котором Ri и R2, взятые вместе, представляют = 46822 HH 10 11 46822 12 CH 3 q CH3O CH3O. ' OH 46822 он NHAc AOHN. OH 14 15 46822 16 Схема A о CHO THF.rl - CN и KjN^NH % РФСаСОї / ^ 0 ~д NiOH,THF.M затем меркаптопирндин 0 NH у/ NH О О рг >-/ >-г атЗн разделяю? изомеры Схема В представляет общий способ превращения промежуточных соединений, полученных по способу схемы А, в соединения формулы I настоящего изобретения ;and NH О -~-AA 0 H Ph NH "NHE Соединения формулы I можно получить, используя или приспосабливая известные способы, используемые или описываемые в литературе, или используя, способы настоящего изобретения Схема А представляет общий способ получения промежуточных соединений для получения соединений формулы I настоящего изобретения Схема С приводит пример общего способа зффеїсгивной интерконверсии между соединениями формулы I настоящего изобретения 17 46822 18 На схеме Е представлен дополнительный общий способ осуществления взаимопревращения соединений формулы I настоящего изобретения Схеыа £ j 2 J»iiC ВОН HN 45PSI О 52 OMc На схеме F представлен общий способ получения соединений настоящего изобретения, в которых R4 формулы I представляет необязательно замещенный фенэтил Схема F Кроме того, соединения, в которых F 3 пред? ставляет гидроксиметил, можно превратить в соответствующие тиометильные соединения путем обработки спирта ал кил или арилсульфонил галоидом, и замещая алкил- или арилсульфонат NaSH Затем тиометильные соединения можно алкилировать или ацилировать до получения других соединений, входящих в объем настоящего изобретения Схема Д приводит пример общего способа превращения нит-рильного промежуточного соединения в соединение формулы I, и дополнительно общие способы осуществления взаимопревращений соединений настоящего изобретения формулы I вое. вое LHMDS Схема Д нсшш 1 2 HjS &3N пиридин З 4 Ph HN о На схеме G представлен общий способ получения соединений настоящего изобретения, в которых R4 формулы I представляет метил 46822 19 Схема t» NH о LHMOS NH О OMe NC о OMe AfylCCOEt3N or АгуЮООКЛ-ВТи Специалистам должно быть понятно, что некоторые соединения формул I могут существовать в виде изомеров, например, геометрических изомеров, т е Е или Z изомеров, и оптических изомеров, т е иметь R или S конфигурации Геометрические изомеры включают цис и транс формы соединений настоящего изобретения, содержащих алкенильные фрагменты Отдельные геометрические изомеры и стереоизомеры, соответствующие формуле I, и их смеси также попадают в объем настоящего изобретения Такие изомеры можно выделить из их смесей, используя или приспосабливая известные способы, например, методики хроматографического разделения и перекристаллизацию, или их отдельно получают из соответствующих изомеров соответствующих им промежуточных соединений, например, используя или приспосабливая описанные ранее способы Соединения настоящего изобретения можно использовать как в виде свободных оснований или кислот, так и форме их фармацевтически приемлемых солей Все эти формы входят в объем настоящего изобретения В тех случаях, когда соединение настоящего изобретения замещено основным фрагментом, образуются соли присоединения кислоты, и они просто представляют более удобную для использования форму, и на практике гораздо чаще используют соли, чем свободное основание Кислоты, которые можно использовать для получения солей присоединения кислот, включают, предпочтительно, те, которые при присоединении к свободному основанию образуют фармацевтически 20 приемлемые соли, то есть, соли, анионы которых нетоксичны для пациента в фармацевтических дозах этих солей, так, что благоприятный ингибирующий эффект на Фактор Ха, присущий свободному основанию, не нарушается из-за побочных воздействий, приписываемых анионам Хотя предпочтительны фармацевтически приемлемые соли указанных основных соединений, все соли присоединения кислот можно использовать для получения соединения в форме свободного основания, даже если сама по себе конкретная соль желательна только в качестве промежуточного продукта, как, например, если соль получают только для целей очистки и идентификации, или если ее используют в качестве промежуточного продукта для получения фармацевтически приемлемой соли при ионообмене Фармацевтически приемлемыми солями в объеме настоящего изобретения являются соли, полученные из следующих кислот таких минеральных кислот, как соляная кислота, серная кислота, фосфорная кислота и сульфаминовая кислота, таких органических кислот, как уксусная кислота, лимонная кислота, молочная кислота, винная кислота, малоновая кислота, метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, па ратолуол сул ьфо новая кислота, циклогексилсульфаминовая кислота, хинная кислота и т п Соответствующие соли присоединения кислот включают следующие галоидводороды, например, хлоргидрат, и бромгидрат, сульфат, фосфат, нитрат, сульфамат, ацетат, цитрат, лактат, тартрат, малонат, оксалат, салицилат, пропионат, сукцинат, фумарат, малеат, метилен-бис-В-гидроксинафтоаты, гентизаты, мезилаты, изэтионаты и дипаратолуолтартратметансульфонат, этансульфонат, бен зол сул ьфо нат, пара-толуол сул ьфо нат, циклогексилсульфат и соль хинной кислоты, соответственно В соответствии со следующим признаком настоящего изобретения, соли присоединения кислот соединений настоящего изобретения получают в результате реакции свободного основания с соответствующей кислотой, используя известные или адаптированные способы Так, например, соли присоединения кислот настоящего изобретения получают, либо растворяя свободное основание в водной среде или в растворе вода-спирт или других подходящих растворителях, содержащих соответствующую кислоту, и выделяя соль путем выпаривания раствора, либо осуществляя взаимодействие свободного основания и кислоты в органическом растворителе, и в этом случае соль выделяется непосредственно, или может быть получена при концентрировании раствора Соли присоединения кислот соединений настоящего изобретения можно регенерировать из солей, используя известные или адаптированные способы Так, например, исходное соединение изобретения можно регенерировать из солей присоединения кислот, обрабатывая их щелочью, например, водным раствором бикарбоната натрия или водным раствором аммиака Если соединение настоящего изобретения замещено кислотным фрагментом, можно получить 22 21 46822 соли присоединения оснований, и это более удобтителя аминогруппу Предпочтительными солями но на практике, и такие соли чаще используют на присоединения кислот соединений настоящего практике, нежели соединения в форме свободной изобретения являются те, которые не содержат кислоты Основания, которые можно использовать лабильной кислотной группы для получения солей присоединения оснований, Будучи сами полезны в качестве активных совключают, предпочтительно, те, которые при приединений, соли соединений настоящего изобретесоединении к свободной кислоте образуют фарния полезны для целей очистки соединений, исмацевтически приемлемые соли, то есть соли, пользуя различие в растворимости солей и катионы которых нетоксичны в организме животисходных соединений, побочных продуктов и/или ного в фармацевтических дозах солей, так что исходных материалов, способами, известных спеблагоприятные ингибирующие воздействия на циалистам Фактор Ха, присуще свободной кислоте, не наруИсходные материалы и промежуточные сошаются за счет побочных эффектов, приписываеединения получают, используя или адаптируя измых катионам Фармацевтически приемлемые вестные способы, например, способы приведенсоли, включая, например, соли щелочных и щеные в сравнительных примерах, или их очевидных лочноземельных металлов, в объеме настоящего химических эквивалентах, или способы настоящеизобретения включают соли, полученные из слего изобретения дующих оснований гидрида натрия, гидроксида Далее настоящее изобретение иллюстрируетнатрия, гидроксида калия, гидроксида кальция, ся примерами, получения соединений настоящего гидроксида алюминия, гидроксида лития, гидроизобретения, которые носят лишь иллюстративксида магния, гидроксида цинка, аммиака, этиленный характер и никоим образом не ограничивают диамина, N-метил-глюкамина, лизина, аргинина, изобретение орнитина, холина, N, N-дибензилэтилендиамина, В спектрах ядерного магнитного резонанса хлоропрокаина, диэтаноламина, прокаина, N(ЯМР) химические сдвиги выражены в частях на бензилфенэтиламина, диэтиламина, пиперазина, млн относительно тетраметилсилана Сокращетрис(гидроксиметил)-аминометана, гидроксида ния имеют следующие значения с-синглет, дтетраметиламмоний и т п дублет, т-триплет, м-мульти, дд-дублет дублетов, ддд-дублет дублетов дублетов, дт-дублет триплеСоли металлов соединений настоящего изотов, шир-широкий бретения можно получить путем взаимодействия гидрида, гидроксида, карбоната или аналогичных Пример 1 соединение 1 о реакционноспособных соединений выбранного металла в водном или органическом растворителе ОМе с соединением в форме свободной кислоты В качестве водного растворителя можно использовать воду, или это может быть смесь воды с оргаК перемешиваемому раствору 3ническим растворителем, предпочтительно, таким цианобензальдегида (20г, 153ммоля) в 100мл суспиртом, как метанол или этанол, таким кетоном, хого ТГФ в атмосфере азота при комнатной темкак ацетон, таким алифатическим эфиром кактетпературе добавляют мерагидрофуран, или таким сложным эфиром, как тил (трифенилфосфоранилиден)ацетат (61,2г, этилацетат Обычно такие реакции проводят при 183ммоля) Полученную смесь перемешивают в комнатной температуре, но при желании их можно течение ночи при комнатной температуре, а затем проводить при нагревании концентрируют в вакууме Остаток очищают хроматографически (40% EtAc гексан) до получения Соли аминов соединений настоящего изобре27,3г (96%) акрилата 1 тения можно получить путем взаимодействия 1Н NMR (CDCI3, d) 7 43 - 7 8 (m, 5H), 6 47 (d, J = амина в водном или органическом растворителе с 12 Hz, 1H), 3 8(s, ЗН) соединением в форме свободной кислоты Подходящие водные растворители включают воду и Пример 2 соединение 2 о смеси воды с такими спиртами, как метанол или этанол, такими эфирами, как тетрагидрофуран, ОМе такими нитрилами, как ацетонитрил, или такими кетонами, как ацетон Аналогичным образом можно получить соли аминокислот К перемешиваемому раствору соединения 1 (27,33г) в 150мл ЕЮН добавляют 2г 10% Соли присоединения оснований настоящего Pd/СаСОз Полученную смесь гидрируют при давизобретения можно получать из солей, используя лении 45 пси ьЬ (3,164кг/см2) в шейкере Парра в или адаптируя известные способы Так, например, течении 8 часов при комнатной температуре Заисходные соединения настоящего изобретения тем полученную смесь фильтруют через слой цеможно получать из их солей присоединения оснолита, а полученный фильтрат концентрируют в ваний, обрабатывая их кислотой, например, солявакууме до получения 26,93г (98%) соединения 2 в ной кислотой виде прозрачного масла Как должно быть ясно специалистам, некото1 Н NMR (CDCI3, d) 7 33 - 7 72 (m, 4H), 3 66 (s, ЗН), рые соединения настоящего изобретения не обра2 97 (t, J = 7 8 Hz, 2H), 2 62 (t, J = 7 8 Hz, 2H) зуют стабильные соли Однако, соли присоединеПример 3 соединение З ния кислот, по-видимому, лучше образуются соединениями настоящего изобретения, содержащими гетероарильную группу и/или теми соединениями, которые содержат в качестве замес 23 ОН К перемешиваемому раствору соединения 2 (16,8г, 89ммолей) в 200мл ТГФ МеОН (2 1) при комнатной температуре добавляют 9мл Юн раствора NaOH по каплям Через 2 часа большую часть растворителя удаляют в вакууме, и добавляют 30мл 5н HCI Полученную смесь несколько раз экстрагируют EtAc Объединенные экстракты сушат над сульфатом магния, фильтруют и концентрируют до получения 9,8г (63%) чистой кислоты 3 в виде белого твердого вещества 1 Н NMR (CDCI3l d) 7 35 - 7 55 (m, 4H), 2 98 (t, J = 7 9 Hz, 2H), 2 7 (t, J = 7 9 Hz, 2H) Пример 4 соединение 4 о К перемешиваемому раствору карбоновой кислоты 3 (8,2г, 47ммолей) и ДМФ (0,5мл) в сухом CH2CI2 в атмосфере азота при комнатной температуре добавляют оксалилхлорид (6,1мл, 70ммолей) по каплям Через 1 час выделение газа прекращается, и растворитель и избыток оксалилхлорида удаляют в вакууме Остаток снова растворяют в 100мл сухого CH2CI2 и охлаждают до 0°С Добавляют меркаптопиридин (5,6г, 50ммолей), а затем триэтиламин (7,9мл, 56ммолей) Полученной смеси дают нагреться до комнатной температуры, и перемешивают в течение 1 часа Полученную смесь разбавляют CH2CI2, и промывают 1н NaOH Органический слой сушат над сульфатом магния, фильтруют и концентрируют Остаток подвергают хроматографии (элюент 50% EtAc гексан) до получения 5,12г (84%) тиоэфира 4 в виде масла желтого цвета 1Н NMR (CDCI3l d) 8 63 (d, J = 9 Hz, 1H), 7 7 - 7 8 (m, 1H), 7 27 - 7 62 (m, 6H), 3 05 (s, 4H) Пример 5 соединение 5 M(O К перемешиваемому раствору циннамальдегида (10,2мл, 81ммоля) и пара-анизидина (Юг, 81ммоля) в 200мл CH2CI2 в атмосфере азота, при 0°С добавляют сульфат магния (19,55г, 162ммоля) Через 4 часа полученную смесь фильтруют, а полученный фильтрат концентрируют в вакууме до получения 18,87г (98%) иминасоединения 5 в виде золотисто-коричневого твердого вещества 1Н NMR (CDCI3l d) 8 28 (m, 1Н), 7 52 (m, 2H), 7 38 (m, ЗН), 7 2 (m, 2H), 712 (m, 2H), 6 93 (m, 2H), 3 82 (s, ЗН) Пример 6 соединение 6 yea/ *| Г ОМе 24 К перемешиваемому раствору сложного тиоэфира 5 (7г, 26ммолей) в сухом CH2CI2 (120мл) в атмосфере азота при температуре -78°С добавляют раствор ТіСЦ (26,1 мл 1 М раствора в СН2СІ2) Через 15 минут прикалывают триэтиламин (3,6мл, 26ммолей) Полученную смесь перемешивают в течение 1/2 часа при -78°С, а затем прикалывают раствор имина І (4,42г, Юммолей в 20мл СН2СІ2) Затем полученную смесь нагревают до 0°С Через 1,5 часа при этой температуре смесь гасят насыщенным раствором бикарбоната натрия и разделяют водой Органический слой промывают 1н NaOH, сушат над сульфатом магния и концентрируют в вакууме Полученный продукт обрабатывают хроматографически (элюент 40% EtAc гексан) до получения 2,42г (32%) смеси 5 1 транс/цис-р-лактама 6а и 6в в виде смолы Основной изомер 6а 46822 1 Н NMR (СОСІз, d) 7 2 - 7 6 (m, 11H), 6 8 (d, J = 11 Hz, 2H), 6 65 (d, J = 15 8 Hz, 1H), 6 2 (dd, J = 15 8, 7 9 Hz, 1H), 4 32 (m, 1H), 3 72 (s, 3H), 3 - 3 42 (m, 3H) Пример 7 соединение 7 РЬ К перемешиваемому раствору 6а, 6в (1,5г, 3,8ммоля) в 60мл Tra>/CH3CN (1/3) при -20°С добавляют раствор церийаммонийнитрата (CAN 3,13г, 5,7ммоля в 10мл воды) Через 15 минут добавляют другую порцию 1,5г CAN в 5мл воды Еще через 30 минут полученную смесь гасят насыщенным раствором бикарбоната натрия, и оставляют нагреваться до комнатной температуры Полученную суспензию фильтруют через слой целита, несколько раз промывают лепешку целита CH2CI2 (всего примерно 200мл) Слои фильтрата разделяют и органический слой сушат над сульфатом магния, фильтруют и концентрируют в вакууме Сырой продукт очищают хроматографически (элюент = 60% EtAc гексан) до получения 476мг(43%) чистого транс-изомера 7а вместе с 85мг смеси цис-7а и транс-7а изомеров Основной Транс-изомер 7а 'И NMR (CDCI3, d) 7 17 - 7 65 (m, 9H), 6 52 (d, J = 15 8 Hz, 1H), 6 25 (s, 1H), 6 14 (dd, J = 15 8, 7 9 Hz, 1H), 3 97(m, 1H), 3 - 3 3 3 (m, 3H) Меньший цис-изомер 7в 1H NMR (COCI3, d) 7 21 - 7 52 (m, 9H), 6 62 (d, J = 15 8 Hz 1H), 6 45 (s, 1H), 6 1 (dd, J = 15 8, 7 9 Hz, 1H), 4 46(m, 1H), 3 7(m, 1H), 3 0 2 - 3 1 7 ( m 1H)28 -2 93(m, 1H) Пример 8 соединение 8 К перемешиваемому раствору транс-рлактама 7а в сухом CH2CI2 в атмосфере азота при комнатной температуре добавляют триэтиламин (4,04мл, 29ммолей) по каплям Затем добавляют бифенилкарбонилхлорид (5,05г, 23,2ммоля), а затем DMAP (50мг) Через 30 минут полученную смесь разбавляют CH2CI2 и промывают 1н HCI Затем органический слой сушат над сульфатом 25 46822 26 натрия, фильтруют и концентрируют Сырой проилхлоридом заменяют 4-бифенилкарбонилхлсрид дукт обрабатывают хроматографически (элюент = на стадии ацилирования р-лактама Конечный 30% EtAc гексан) до получения 2,19г (81%) пропродукт 11 очищают с помощью ВЭЖХ с обрадукта 3 в виде твердого вещества щенной фазой (CH3CN Н2О, 0,1% ТФК) и лиофи1Н NMR (CDCI3, d) 8 06 (m, 2H), 7 2 - 7 75 (m, лизируют Ь 16Н), 6 67 (d, J = 15 8, Hz, 1H), 6 23 (dd, J = 15 8, И NMR (МеОН - d 4 , d) 8 6 1 (d, J = 11 3 Hz, 1H), 7 9 Hz, 1H), 4 63 (m, 1H), 3 46 (m, 1H), 3 1 - 3 3 (m, 7 83 (d, J = 7 5 Hz, 2H), 7 15 - 7 67 (m, 14H), 6 67 (d, 2H) J = 15 8 Hz, 1H), 6 3 (dd, J = 15 8, 7 9 Hz, 1H), 4 98 (m, 1H), 3 55 (s, 3H), 3 27 (m, 1H), 3 1 (m, 2H) Пример 9 соединение 9 соон Пример 12 соединение 12 f\ CQOMe NH К перемешиваемому раствору р-лактама 8 2,19г, 4,7ммслл) в 50мл ТГФ при комнатной температуре добавляют 1н NaOH раствор (13,6мл) по каплям Через 2 часа большую часть ТГФ удаляют в вакууме, и добавляют 20мл 1н HCI Полученную смесь экстрагируют EtAc Полученный экстракт сушат над сульфатом натрия, фильтруют и концентрируют в вакууме Сырой продукт очищают хроматографически с помощью ВЭЖХ с обращенной фазой (CH3CN вода, 0,1% TFA, градиент 40 100), и фракцию, содержащую продукт, лиофилизируют до получения 1,1 г (50%) карбоновой кислоты 9 в виде твердого вещества белого цвета 1Н NMR(CDCI 3 , d) 7 1 8 - 7 97 (m, 18H), 6 61 (d, J = 15 8 Hz, 1H), 6 2 (dd, J = 15 8, 7 9 Hz, 1H), 5 14 (m, 1H), 3 - 3 2 2 (m, 3H) Пример 10 соединение 10 ( ^ COOMe if NH 1 HN К перемешиваемому раствору карбоновой кислоты 9 (105м, 0,22ммоля) в Змл сухого МеОН при комнатной температуре добавляют молекулярные сита (примерно 50мг) Затем примерно в течение 2 минут барботируют газообразную HCI Полученную смесь перемешивают в течение ночи при комнатной температуре, а затем концентрируют в потоке азота Затем к остатку добавляют раствор ІЧНз в МеОН ( Змл 7н раствора), и полученную смесь кипятят с обратным холодильником в течение 1,5 часа, оставляют остыть, и растворитель удаляют в вакууме Остаток очищают хроматографиче-ски с помощью ВЭЖХ с обращенной фазой (CH3CN вода, 0,1% TFA, 40 - 100 градиент), и фракции, содержащие продукт, лиофилизируют до получения 73мг (53%) продукта 10 в виде твердого вещества белого цвета 1Н NMR (DMSO - de, d) 8 7 (d, J = 8 6 Hz, 1 H), 7 92 (d, J = 9 Hz, 2H), 7 78 (d, J = 9 Hz, 2H), 7 75 - 7 21 (m, 14H), 6 67(d, J = 16 1 Hz, 1H), 6 4 (dd, J = 16 1, 7 8 Hz, 1H), 4 98 (dd, J = 16 1, 7 8 Hz, 1H), 3 46 (s, 3H), 3 2 5 - 3 18(m, 1H), 3 05 - 2 88 (m, 2H) Пример 11 соединение 11 COOMe NH HN Это соединение получают способом, аналогичным способу получения соединения 10 ранее, исходя из имина 5 и сложного тиоэфира 4 Бензо Это соединение получают способом, аналогичным способу получения соединения 10, исходя из имина 5 и сложного тиоэфира 4 Ортотолуолхлоридом заменяют 4бифенилкарбонилхлорид на стадии ацилирования р-лактама Конечный продукт 12 очищают с помощью ВЭЖХ с обращенной фазой (CH3CN H2O, 0,1% ТФК) и лиофилизируют 1 Н NMR (DMSO-d 6 , d) 9 3 (s, 1H), 9 15 (s, 1H), 8 7 (d, J = 7 6 Hz, 1H), 7 7 (d, J = 8 Hz 2H), 7 6 (d, J = 9 Hz, 2H), 7 2 - 7 6 ( m , 12H), 6 9 (d, J = 8 Hz, 1H), 6 6 (d, J = 15 Hz, 1H), 6 35 (dd, J = 15, 6 Hz, 1H), 4 9 (dd, J = 15, 6 Hz, 1H), 3 55 (s, 3H), 3 2 - 3 3 (m, 1H), 2 8 - 3 (m, 1H), 2 3(s, 3H) Пример 13 соединение 13 [«^S COOMe H y V O y v 2 N NH H N i pb _/=\ Это соединение получают способом, аналогичным способу получения соединения 10, исходя из имина 5 и сложного тисэфира 4 Метатолуоилхлоридом заменяют 4бифенилкарбонилхлорид на стадии ацилирования р-лактама Конечный продукт 13 очищают с помощью ВЭЖХ с обращенной фазой (CH3CN H2O, 0,1% ТФК) и лиофилизируют 1 Н NMR (DMSO - d 6 , d) 9 3 (s, 1H), 9 2 (s, 1H), 8 7 (d, J = 7 6 Hz, 1H), 7 7 (d, J = 8 Hz, 2H), 7 6 (d, J = 9 Hz, 2H), 7 2 - 7 6 (m, 12H), 6 9 (d, J = 8 Hz, 1H), 6 6 (d, J = 15 Hz, 1H), 6 35 (dd, J = 15, 6 Hz, 1H), 4 9 (dd, J = 16, 6 Hz, 1H), 3 6 (s, 3H), 3 2 - 3 3 (m, 1H), 2 8 - 3 (m, 1H), 2 35(s, 3H) Пример 14 соединение 14 COOMe Это соединение получают способом, аналогичным способу получения соединения 10, исходя из имина 5 и сложного тиоэфира 4 4-этил-4бифенилкарбонилхлоридом заменяют 4-бифенилкарбонилхлорид на стадии ацилирования р лактама Конечный продукт 14 очищают с помощью ВЭЖХ с обращенной фазой (CH3CN H2O, 0,1% ТФК) и лиофилизируют 1 Н NMR (DMSO-d 6 , d) 9 3 (s, 1H), 9 15 (s, 1H), 8 9 (d, J = 7 6 Hz, 1 H), 8 2 (d, J = 8 Hz, 2H), 8 (d, J = 9 Hz, 2H), 7 4 - 7 9 (m, 12H), 7 2 (d, J = 8 Hz, 1H), 6 9 (d, J = 15 Hz, 1H), 6 6 (dd, J = 15, 6 Hz, 1H), 5 2 27 46822 (dd, J = 16, 6 Hz, 1H), 3 7 (s, 3H), 3 4 - 3 5 (m, 1H), 3 1 - 3 2 (m, 1H), 2 85 (q, 2H), 1 4 (t, 3H) Пример 15 соединение 15 ff\ COOMe Ph Это соединение получают по способу получения соединения 10, исходя из имина 5 и сложного тиоэфира 4 3', 4'-диметокси-4бифенилкарбонихлоридом заменяют 4бифенилкарбонилхлорид на стадии ацилирования р -лактама Конечный продукт 15 очищают с помощью ВЭЖХ с обращенной фазой (CH3CN НгО, 0,1% ТФК) и лиофилизируют 1 Н NMR (DMSO - d 6 , d) 9 5 (s, 1H), 9 3 (s, 1H), 8 9 (d, J = 7 6 Hz, 1H), 8 1 (d, J = 8 Hz, 2H), 7 9 (d, J = 9 Hz, 2H), 7 8 (s, 2H), 7 4 - 7 7 (m, 11H), 7 25 (d, J = 8 Hz, 1H), 6 6 (d, J = 15 Hz, 1H), 6 4 (dd, J = 15, 6 Hz, 1H), 4 (s, 3H), 3 9 (s, 3H), 3 7 (s, 3H), 3 4 - 3 5 (m, 1H), 3 2 - 3 4 (m, 1H) Пример 16 соединение 16 COOMc Ph HN ь О ^ NЭто соединение получают по способу получения соединения 10, используя а качестве исходного материала ими к 5 и сложный тиоэфир 4 4-(2'пиридил)бензоилхлоридом заменяют 4-бифенилкарбонилхлорид на стадии ацилирования рлактама Конечный продукт 16 очищают с помощью ВЭЖХ с обращенной фазой (CH3CN НгО, 0,1% ТФК) и лиофилизируют 1 Н NMR (DMSO - d 6 , d) 9 5 (s, 1H), 9 3 (s, 1H), 8 9 (d, J = 7 6 Hz 1H), 8 8 (s, 1H), 8 4 (d, J = 8 Hz, 2H), 8 3 (d, J = 9 Hz, 1H), 8 1 (d, J = 8 Hz, 2H), 7 9 (s, 2H), 7 4 - 7 8 (m, 10H), 7 4 (d, J = 8 Hz, 1H) 6 9 (d, J = 15 Hz, 1H), 6 6 (dd, J = 15, 6 Hz, 1H), 5 2 (dd, J = 16, 6 Hz, 1H), 3 7 (s, 3H), 3 4 - 3 5 (m, 1H), 3 2 - 3 4 (m, 1H) Пример 17 соединение 17 f\ COOMc Это соединение получают способом, аналогичным способу получения соединения 10, исходя из имина 5 и сложного тиоэфира 4 4-(3'-пиридил)бензоилхлоридом заменяют 4бифенилкарбонилхлорид на стадии ацилирования р-лактама Конечный продукт 17 очищают с помощью ВЭЖХ с обращенной фазой (CH3CN НгО, 0,1% ТФК) и лиофилизируют 1 Н NMR (DMSO-d 6 , d) 9 5 (s, 1H), 9 3 (s, 1H), 8 9 (d, J = 7 6 Hz, 1H), 8 5 (s, 1H), 8 2 (d, J = 8 Hz, 2H), 8 1 (d, J = 9 Hz, 2H), 8 (d, J = 8 Hz, 1H), 7 9 (s, 2H), 7 4 - 7 8 (m, 9H), 7 4 (d, J = 8 Hz, 1H), 6 9 (d, J = 15 Hz, 1H), 6 6 (dd, J = 15, 6 Hz, 1H), 5 2 (dd, J = 16, 6 Hz, 1H), 3 7 (s, 3H), 3 4 - 3 5 (m, 1H), 3 2 - 3 4 (m, 1H) Пример 18 соединение 18 28 COOMe Это соединение получают способом, аналогичным способу получения соединения 10, исходя из имика 5 и сложного тиоэфира 4 4-(4'пиридил)бензоилхлоридом заменяют 4бифенилкарбонилхлорид на стадии ацилирования р-лактама Конечный продукт 18 очищают с помощью ВЭЖХ с обращенной фазой (CH3CN НгО, 0,1% ТФК) и лиофилизируют 1 Н NMR(DMSO-d 6 , d) 9 5 (s, 1H), 9 3 (s, 1H), 9 (d J = 7 6 Hz, 1H), 8 2 (s, 4H), 7 8 (s, 2H), 7 5 - 7 8 (m, 11H), 7 4(d, J = 8Hz, 1H), 6 9(d, J = 15 Hz, 1H), 6 6 (dd J = 15, 6 Hz, 1H), 5 2 (dd, J = 16, 6 Hz, 1H), 3 7 (s, 3H), 3 4 - 3 5 (m 1H), 3 2-3 4 (m, 1H) Пример 19 соединение 19 H-.N NH Это соединение получают способом, аналогичным способу получения соединения 10, исходя из имина 5 и сложного тиоэфира 4 2'-метил-4бифенилкарбонилхлоридом заменяют 4бифенилкарбонилхлорид на стадии ацилирования р-лактама Конечный продукт 19 очищают с помощью ВЭЖХ с обращенной фазой (CH3CN НгО, 0,1% ТФК) и лиофилизируют 1 Н NMR (DMSO - d 6 , d) 9 25 (s, 1H), 9 03 (s, 1H), 8 71 (d, J = 8 7 Hz, 1H), 7 86 (d, J = 8 Hz, 2H), 7 61 (d, J = 8 Hz, 2H), 7 6 - 7 12 (m, 13H), 6 67 (d, J = 15 9 Hz, 1H), 6 42 (dd, J = 15 9, 7 8 Hz, 1H), 5 0 (dd, J = 16, 7 9 Hz, 1H), 3 32 (s, 3H), 3 3 -3 15(171, 1H),3 11 -29(m,2H), 2 21 (s, 3H) Пример 20 соединение 20 COOMe Pb Это соединение получают способом, аналогичным способу получения соединения 10, исходя из имина 5 и сложного тиоэфира 4 3'-метил-4бифенилкарбонилхлоридом заменяют 4бифенилкарбонилхлорид на стадии ацилирования р-лактама Конечный продукт 20 очищают с помощью ВЭЖХ с обращенной фазой CH3CN НгО, 0,1% ТФК) и лиофилизируют 1 Н NMR (DMSO - d 6 , d) 9 25 (s, 1H), 8 99 (s, 1H), 8 68 (d, J = 8 7 Hz, 1H), 7 9 (d, J = 9 Hz, 1H), 7 75 (d, J = 9 Hz, 1H), 7 6 8 - 7 1 5 (m, 13H), 668 (d, J = 159 Hz, 1H), 6 4 (dd, J = 15 9, 7 8 Hz, 1H), 5 0 (dd, J = 16, 7 9 Hz, 1H), 3 46 (s, 3H), 3 2 8 - 3 1 8 (m, 1H), 3 1 2 9 (m, 2H), 2 36 (s, 3H) Пример 21 соединение 21 COOMe HjN Это соединение получают способом, анало 29 46822 30 гичным способу получения соединения 10, исходя бифенилкарбонилхлорид на стадии ацилирования из имина 5 и сложного тиоэфира 4 2'-метокси-4р-лактама Конечный продую" 24 очищают с помобифенилкарбонилхлоридом заменяют 4щью ВЭЖХ с обращенной фазой (CH3CN НгО, 0,1% ТФК) и лиофилизируют бифенилкарбонилхлорид на стадии ацилирования 1 Н NMR (DMSO - d 6 l d) 9 27 (s, 1H), 9 11 (s, 1H), р-лактама Конечный продую" 21 очищают с помо8 88 (d, J = 8 67 Hz, 1H), 8 1 8 - 8 0 7 (m, 1H), 805 щью ВЭЖХ с обращенной фазой (CH3CN НгО, 7 9 (m, 2H), 7 7 - 7 2 (m, 13H), 6 73 (d, J = 15 9 Hz, 0,1% ТФК) и лиофилизируют 1 1H), 6 4 (dd, J = 15 9, 7 8 Hz, 1H), 5 07 (dd, J = 16, Н NMR (DMSO - d 6 , d) 9 25 (s, 1H), 9 03 (s, 1H), 7 9 Hz, 1H), 3 52 (s, 3H), 3 2 8 - 3 1 7 (m,1H), 3128 76 (d, J = 8 7 Hz, 1H), 7 83 (d, J = 9 5 Hz, 2H), 7 65 2 95 (m,2H) -6 95(m, 15H), 6 64(d, J = 15 9 Hz, 1H), 6 4 (dd, J = 15 9, 7 8 Hz, 1H), 4 99 (dd, J = 16, 7 9 Hz, 1H), 3 75 Пример 25 соединение 25 (s, 3H), 3 46 (s, 3H), 3 3 -3 17 (m 1H) 3 1 -2 9(m, I^S COOMe 2H) Пример 22 соединение 22 NH HN COOMe Это соединение получают способом, аналогичным способу получения соединения 10, исходя из имина 5 и сложного тиоэфира 4 3'-метокси-4бифекилкарбонилхлоридом заменяют 4бифенилкарбонилхлорид на стадии ацилирования р-лактама Конечный продую" 22 очищают с помощью ВЭЖХ с обращенной фазой (CH3CN НгО, 0,1% ТФК) и лиофилизируют 1 Н NMR (DMSO - de, d) 9 23 (s, 1 Н), 8 96 (s, 1 Н), 8 69 (d, J = 8 7 Hz, 1H), 7 9 (d, J = 9 6 Hz, 2H), 7 68 7 18 (m, 12H), 6 96 (dd, J = 9 6, 2 Hz, 1H), 6 64 (d, J = 15 9 Hz, 1H), 6 39 (dd, J = 15 9, 7 8 Hz, 1H), 4 98 (dd, J = 16, 7 9 Hz, 1H), 3 81 (s, 3H), 3 47 (s, 3H), 3 2 8 - 3 17(m, 1H), 3 08 - 2 86 (m, 2H) Пример 23 соединение 23 Это соединение получают способом, аналогичным способу получения соединения 10, исходя из имина 5 и сложного тиоэфира 4 3'-этил-4бифенилкарбонилхлоридом заменяют 4бифенилкарбонилхлорид на стадии ацилировакия р-лаїсгама Конечный продую" 25 очищают с помощью ВЭЖХ с обращенной фазой (CH3CN НгО, 0,1% ТФК) и лиофилизируют 1 Н NMR (DMSO - d 6 , d) 9 25 (s, 1H), 9 05 (s, 1H), 8 68 (d, J = 8 6 Hz, 1H), 7 88 (d, J = 9 Hz, 2H), 7 76 (d, J = 9 Hz, 2H), 7 62 (m, 2H), 7 5 5 - 7 1 5 (m, 11H), 6 66 (d, J = 16 Hz, 1H), 6 4 (dd, J = 16, 7 8 Hz, 1H), 4 96 (dd, J = 16, 7 8 Hz, 1H), 3 47 (s, 3H), 3 3 - 3 18 (m, 1H), 3 1 - 2 88 (m, 2H), 2 67 (q, J = 8 5 Hz, 2H), 1 22 (t, J = 8 5 Hz 3H) Пример 26 соединение 26 COOMe COOMe 0 M e Это соединение получают способом, аналогичным способу получения соединения 10, исходя из имина 5 и сложного тиоэфира 4 2нафтилкарбонилхлоридом заменяют 4бифенилк'арбокилхлорид на стадии ацилирования р-лаїсгама Конечный продую" 23 счищают с помощью ВЭЖХ с обращенной фазой (CH3CN НгО, 0,1% ТФК) и лиофилизируют 1 Н NMR (DMSO - d 6 , d) 9 24 (s, 1H), 9 02 (s, 1H), 8 83 (d, J = 8 6 Hz, 1H), 8 4 (s, 1H), 8 08-7 85 (m, 4H), 768 - 7 2 (m, 12H), 6 68 (d, J = 15 8 Hz, 1H), 6 43(dd, J = 15 8, 7 8 Hz, 1H) 5 03 (dd, J = 15 8 7 8 Hz, 1H), 3 46 (s, 3H), 328 - 3 2 (m, 1H), 3 13 -2 95 (m 2H) Пример 24 соединение 24 COOMe Это соединение получают способом, аналогичным способу получения соединения 10, исходя из имина 5 и сложного тиоэфира 4 4'-метокси-4бифенилкарбонилхлоридом заменяют 4бифенилкарбонилхлорид на стадии ацилирования р-лактама Конечный продую" 26 очищают с помощью ВЭЖХ с обращенной фазой (CH3CN НгО, 0,1% ТФК) и лиофилизируют 1 Н NMR (DMSO - d 6 , d) 9 23 (s, 1H), 8 96 (s, 1H), 8 66 (d, J = 8 7 Hz, 1H), 7 88 (d, J = 9 1 Hz, 2H), 7 72 - 7 22 (m, 11H), 7 03 (d, J = 8 7 Hz, 2H), 6 64 (d, J = 16 1 Hz, 1H), 6 4 (dd, J = 16 1, 7 9 Hz, 1H), 4 97 (dd, J = 16 1, 7 9 Hz, 1H), 3 77(s, 3H), 3 46 (s, 3H), 3 283 15(m, 1H), 3 0 8 - 2 88(m, 2H) Пример 27 соединение 27 COOMe HN РЬ Это соединение получают способом, аналогичным способу получения соединения 10, исходя из имина 5 и сложного тиоэфира 4 1нафтилкарбсниохлоридом заменяют 4 OMe MeO Это соединение получают способом, аналогичным способу получения соединения 10, исходя из имина 5 и сложного тиоэфира 4 2', 4'диметокси-4-бифенилкарбонилхлоридом заменяют 4-бифенилкарбонилхлорид на стадии ацилирования р-лактама Конечный продую" 27 очищают с помощью ВЭЖХ с обращенной фазой (CH3CN Н2О, 0,1% ТФК) и лиофилизируют 31 46822 1 H NMR (DMSO - d 6 l d) 9 23 (s, 1H), 9 07 (s, 1H), 8 63 (d J = 9 Hz, 1H) 7,81 (d, J = 8 9 Hz, 2H), 7 68 7 15 (m, 14H)6 7 2 - 6 52 (m, 1H) 6 4 5 - 6 3 (m, 1H), 5 04 - 4 9 (m, 1H), 3 78 (s, 3H), 3 75 (s, 3H), 3 51 (s, 3H), 3 21 - 3 15 (m, 1H), 3 08 - 2 85 (m, 2H), Пример 28 соединение 28 32 2H), 3 45 (s, 3H), 3 2 5 - 3 1 5 (m, 1H), 3 0 8 - 2 8 9 (m, 2H), 1 32(t, J = 7 5Hz, 2H) Пример 31 соединение 31 COOMe HiN COOMe Это соединение получают способом, аналогичным способу получения соединения 10, исходя из имина 5 и сложного тиоэфира 4 2'-этил-4бифенилкарбонилхлоридом заменяют 4бифенилкарбонилхлорид на стадии ацилирования р-лактама Конечный продую" 28 очищают с помощью ВЭЖХ с обращенной фазой (CH3CN НгО, 0,1% ТФК) и лиофилизируют 1 Н NMR (DMSO - d 6 , d) 9 25 (s, 1H), 8 92 (s, 1H), 8 69 (d, J = 8 7 Hz, 1H), 7 78 (d, J = 9 Hz, 2H), 7 68 7 08(m, 15H), 6 65(d, J = 15 9 Hz, 1H), 6 38 (dd, J = 15 9, 7 8 Hz, 1H), 5 0 (dd, J = 16, 7 9 Hz, 1H), 3 46 (s, 3H), 3 2 8 - 3 1 8 (m, 1H), 2 52 (q, J = 9 6 Hz, 2H), 0 98 (t, J = 9 6 Hz, 3H) Пример 29 соединение 29 Это соединение получают способом, аналогичным способу получения соединения 10, исходя из имина 5 и сложного тиоэфира 4 4'-этокси-4бифенилкарбонилхлоридом заменяют 4бифенилкарбонилхлорид на стадии ацилирования р-лактама Конечный продую" 31 очищают с помощью ВЭЖХ с обращенной фазой (CH3CN НгО, 0,1% ТФК) и лиофилизируют 1 Н NMR (DMSO - d 6 , d) 9 26 (s, 1H), 9 02 (s, 1H), 8 64 (d, J = 8 7 Hz, 1H), 7 86 (d, J = 9 Hz, 2H), 7 72 (d, J = 9 Hz 2H), 7 7 - 7 22 (m, 11H), 7 01 (d, J = 10 4 Hz, 2H), 6 64 (d, J = 15 9 Hz, 1H), 6 38 (dd, J = 15 9, 7 8 Hz, 1H), 4 98 (dd, J = 16, 7 8 Hz, 1H), 4 06 (q, J = 8 2 Hz, 2H), 3 45 (s, 3H), 3 3 - 3 18 (m, 1H), 3 08 - 2 85 (m,2H), 1 32(t, J = 8 2Hz, 3H) Пример 32 соединение 32 i«*S COOMe COOMe Это соединение получают способом, аналогичным способу получения соединения 10, исходя из имика 5 и сложного тиоэфира 4 4'-метил-4бифенилкарбонилхлоридом заменяют 4бифенилкарбонилхлорид на стадии ацилирования р-лаїсгама Конечный продую" 29 очищают с помощью ВЭЖХ с обращенной фазой (CH3CN НгО, 0,1% ТФК) и лиофилизируют 1 Н NMR(DMSO - de, d) 9 22 (s, 1H), 8 91 (s, 1H), 8 68 (d, J = 8 7 Hz, 1H), 7 85 (d, J = 9 Hz, 2H), 7 75 (d, J = 9 Hz, 2H), 7 65 - 7 2 (m, 13H), 6 65 (d, J = 15 9 Hz, 1H), 6 39 (dd, J = 15 9, 7 8 Hz, 1H), 4 99 (dd, J = 16, 7 9 Hz, 1H), 3 46 (s 3H), 3 2 8 - 3 1 8 (m, 1H), 3 08 - 2 88 (m, 2H), 2 35 (s, 3H) Пример 30 соединение ЗО Это соединение получают способом, аналогичным способу получения соединения 10, исходя из имина 5 и сложного тиоэфира 4 2'-этокси-4бифенилкарбонилхлоридом заменяют 4бифенилкарбонилхлорид на стадии ацилирования р-лаїсгама Конечный продую" 32 очищают с помощью ВЭЖХ с обращенной фазой (CH3CN НгО, 0,1% ТФК) и лиофилизируют 1 Н NMR (DMSO - d 6 , d) 9 24 (s, 1H), 9 11 (s, 1H), 8 68 (d, J = 8 7 Hz, 1H), 7 85 (d, J = 9 Hz, 2H), 7 6 (d, J = 9 Hz, 2H), 7 59 - 6 95 (m, 13H), 6 65 (d, J = 15 9 Hz, 1H), 6 39 (dd, J = 15 9, 7 8 Hz, 1H), 4 98 (dd, J = 16, 7 8 Hz, 1H), 4 03 (q, J = 8 1 Hz, 2H), 3 47 (s, 3H), 3 2 8 - 3 18(m, 1H), 3 1 - 2 88 (m, 2H), 1 24 (t, J = 8 1 Hz, 3H) Пример 33 соединение 33 COOMe OMe о Это соединение получают способом, аналогичным способу получения соединения 10, исходя из имина 5 и сложного тиоэфира-4 3'-этокси-4бифенилкарбонилхлоридом заменяют 4бифенилкарбонилхлорид на стадии ацилирования р-лактама Конечный продую" 30 очищают с помощью ВЭЖХ с обращенной фазой (CH3CN НгО, 0,1% ТФК) и лиофилизируют 1 Н NMR (DMSO - d 6 l d) 9 22 (s, 1H), 9 05 (s, 1H), 8 7 (d, J = 8 7 Hz, 1H), 7 88 (d, J = 9 Hz, 2H), 7 76 (d, J = 9 Hz, 2H), 7 68 - 7 12 (m, 12H), 6 98 - 6 85 (m, 1H), 6 67 (d, J = 16 Hz, 1H), 6 4 (dd, J = 16, 7 8 Hz, 1H), 5 01 (dd, J = 16, 7 8 Hz, 1H), 4 08 (q, J = 7 5Hz, К перемешиваемому раствору 2нафтальдегида (20г, 0,13ммоля) в 200мл CH2CI2 при комнатной температуре добавляют параанизидин (15,8г, 0,13ммоля), а затем безводный сульфат магния (16,9г, 0,14ммоля) Через 3,5 часа полученную смесь фильтруют, полученный фильтрат концентрируют в вакууме до получения 31,5г(92%) имина 33 1 Н NMR (CDCIs, d) 8 64 (s, 1H), 8 19 (m, 2H), 7 7 8 7 98 (m, ЗН), 7 43 - 7 56 (m, 2H), 7 32 (m, 2H), 6 96 (m, 2H), 3 83 (s, ЗН) Пример 34 соединение 34 34 33 46822 Получают, используя транс-3-(2'-нафтил) акСООМе ролеин, пара-анизидин и безводный сульфат магния по способу примера 33 ранее 1 Н NMR (CDCI3l d) 8 35 (d, J = 9 Hz, 1H), 7 7 8 7 9 (m, 4H), 7 72 (m, 1H), 7 5 (m, 2H), 7 25 (m, 4H), 6 93 (m, 2H), 3 82 (s, 3H) Это соединение получают способом, аналогиПример 35 соединение 35 чным способу получения соединения 10, исходя из имина 35 и сложного тиоэфира 4 Бензоилхлоридом заменяют 4-бифенилкарбонилхлорид на стадии ацилирования р-лактама Конечный проПолучают, используя транс-3-(4'дукт 39 очищают с помощью ВЭЖХ с обращенной бифенил)акролеин, пара-анизидин и безводный фазой CH3CN H2O, 0,1% ТФК) и лиофилизируют 1 сульфат магния, по способу для соединения 33 Н NMR (DMSO - d 6 , d) 9 25 (s, 2H), 9 11 (s, ранее 2Н), 8,74 {d, 1H), 7 30 - 8 (m, 22H), 6 23 (d, J = 18 ^Н NMR (CDCI3l d) 8 33 (d, J = 9 Hz, 1H), 7 2 - 7 6 8 Hz, 1H), 6 47 (dd, J = 18, 6 Hz, 1H), 5 04 (m, 1H), (m, 13H), 6 9 (m, 2H), 3 82, (s, 3H) 3 49 (s, 3H), 3 3 (m, 1H), 3 03 (m, 2H) Пример 36 соединение 36 Пример 40 соединение 40 r N. A OMe Получают, используя 4бифенилкарбоксальдегид, пара-анизидин и безводный сульфат магния по способу, использованному для соединения 33 1 Н NMR (CDCI3l d) 8 52 (s, 1H), 7 97 (m, 2H), 7 62 - 7 73 (m, 4Н), 7 35 - 7 52 (m, ЗН), 7 27 (m, 2H), 6 95 (m, 2H), 3 85 (s, ЗН) Пример 37 соединение 37 СООМе NH HN Это соединение получают способом, аналогичным способу получения соединения 10, исходя из имина 33 и сложного тиоэфира 4 Бензоилхлоридом заменяют 4-бифенилкарбонилхлорид на стадии ацилирования р-лактама Конечный продукт 37 очищают с помощью ВЭЖХ с обращенной фазой (CH3CN Н2О, 0,1% ТФК) и лиофилизируют 1 Н NMR (МеОН - d 4 , d) 9 01 (d, J = 9 4 Hz, 1H), 7 77 - 7 98 (m, 6H), 7 43 - 7 67 (m, 9H), 5 53 (m, 1H), 3 56 (m, 1H), 3 54 (s, 3H), 3 1 (m, 1H), 2 81 (m, 1H) Пример 38 соединение 38 СООМе Это соединение получают способом, аналогичным способу получения соединения 10, исходя из имина 34 и сложного тиоэфира 4 Бензоилхлоридом заменяют 4-бифенилкарбонилхлорид на стадии ацилирования р-лактама Конечный продукт 38 очищают с помощью ВЭЖХ с обращенной фазой (CH3CN H2O, 0,1% ТФК) и лиофилизируют 1 Н NMR (DMSO - d 6 , d) 9 27 (s, 2H), 9 1 (s, 2H), 8 72 (d, 1H), 7 4 - 795 (m, 16H), 6 86 (d, J = 18 Hz, 1H), 6 54(dd, J = 10, 6 Hz, 1H), 5 03 (m, 1H), 3 48 (s, 3H),3 32(m, 1H), 3 04(m, 2H) Пример 39 соединение 39 Это соединение получают способом, аналогичным, способу получения соединения 10, исходя из имина 36 и сложного тиоэфира 4 Бензоилхлоридом заменяют 4-бифенилкарбонилхлорид на стадии ацилирования р-лактама Конечный продукт 40 очищают с помощью ВЭЖХ с обращенной фазой (CH3CN H2O, 0,1% ТФК, и лиофилизируют 1 Н NMR (DMSO - de, d) 9 23 (s, 2H), 9 05 (s, 2H), 8 97 (s, 2H), 7 28 - 7 8 (m, 18Н), 5 35 (t, 1H), 3 42 (s, ЗН), 3 31 (m, 1Н), 2 89 (dd, 1Н), 2 6 (dd, 1Н) Пример 41 соединение 41 ІНЗОН К перемешиваемому раствору карбоновой кислоты 9 (980мг, 2ммоля) и триэтиламина (0,44мл, 3,2ммоля) в сухом ТГФ в атмосфере азота при 0°С добавляют изо-бутилхлорформат (0,39мл, Зммоля) по каплям Через 15 минут прикалывают раствор боргидрида натрия (153мг, 4ммоля в 5мл воды) Полученной смеси дают нагреться до комнатной температуры Через 1 час большую часть ТГФ удаляют в вакууме Затем добавляют воду, и полученную смесь экстрагируют этилацетатом Объединенные экстракты сушат над сульфатом магния, фильтруют и концентрируют Сырой продукт очищают хроматографически (элюент = 35% EtAc гексаны) до получения 720мг (76%) спирта 41 1 Н NMR (CDCI3l d) 7 92 (d, J = 9 Hz, 2H), 12-112 (m, 16H), 6 67 (d, J = 15 5 Hz, 1H), 6 27 (dd, J = 15 5, 7 8 Hz, 1H), 4 94 (m, 1H), 3 88 (m, 1H), 3 5 (m, 1H), 3 12(m, 1H), 2 82 - 3 03 (m, 2H), 1 95 (m, 1H) Пример 42 соединение 42 NH HN К перемешиваемому раствору спирта 41 (106мг, 0,22ммоля) в Змл сухого МеОН при ком 35 46822 36 натной температуре добавляют молекулярные (d, J = 8 Hz, 2H), 7 78 (d J = 8 Hz, 2H), 7 17 - 7 73 сита (примерно 50мг) Затем в течение примерно (m, 14Н), 6 55 (d, J = 15 8 Hz, 1H), 6 31 (dd, J = 2 минут барботируют газообразный HCI Получен15 8, 7 9 Hz, 1H), 4 77 (m, 1H), 3 7 (dd, J = 9 5, 3 1 ную смесь оставляют при перемешивании в течеHz, 1H), 3 47 (dd, J = 9 5, 3 1 Hz, 1H), 3(d,J = 7 9Hz, ние ночи при комнатной температуре, а затем 2H),2 35(m, 1H) концентрируют в атмосфере потока азота Затем Пример 45 соединение 45 добавляют к остатку раствор ІЧНз в МеОН (Змл 7н раствора) и полученную смесь кипятят с обратным холодильником в течение 1,5 часа, оставляют охлаждаться, и растворитель удаляют в вакууме Полученный остаток очищают с помощью ВЭЖХ с обращенной фазой (CH3CN Н2О, 0,1% ТФК, 40 100 градиент), и фракции, содержащие продукт, лиофилизируют до получения 29мг (22%) продукСмесь спирта 41 (480мг, 1ммоля), пиридина та 42 в виде трифторацетатной соли (0,40мл, 4,9ммолл) и уксусного ангидрида (0,12мл, Пример 43 соединение 43 1,2ммоля) перемешивают в течение ночи при комнатной температуре На следующий день добавляют 3 капли пиридина и уксусного ангидрида На следующий день оказывается, что реакция не завершена, и поэтому добавляют 4мг ДМАР Через 1 час реакция завершается (по данным ТСХ) ПолуК перемешиваемому раствору спиртового соченную смесь разбавляют CH3CI2 и промывают единения (88мг, 0,2мл) в 2мл смеси 2 1 ТГФ 0,1 н раствором HCI Органический слой сушат над ДМФ в атмосфере азота при 0°С добавляют NaH сульфатом магния, фильтруют и концентрируют (15мг 60% дисперсии, 0,4ммоля) Через 15 минут до получения 520мг соединения 45 1 добавляют метилиодид (0,02мл, О.Зммоля}, и поН NMR (CDCI3l d) 7 98 (d, J = 8 Hz, 2H), 7 73 (d, J лученной смеси дают нагреться до комнатной = 8 Hz, 2H), 7 67 (d, J = 8 Hz, 2H), 7 17 - 7 50 (m, температуры Через 2 часа полученную смесь га12H), 6 94(d, 1H) 6 55(d, J = 18 Hz, 1H), 6 21 (dd, J сят насыщенным раствором бикарбоната натрия = 18, 5 Hz, 1H), 5 1 (m, 1H), 4 38 (m, 1H), 4 08 (m, Большую часть ТГФ удаляют в вакууме, а остаток 1H), 2 68 - 2 97 (m, 2H), 2 51 (m, 1H) разбавляют водой и экстрагируют CH2CI2 ОбъеПример 46 соединение 46 диненные экстракты сушат над сульфатом натрия, CHjOAs фильтруют и концентрируют Сырой продукт обрабатывают хроматографически (элюент = 35% EtAc гексаны) до получения 21мг (23%) продукта 43 вместе с 34мг выделенного спирта 41 1 Н NMR (CDCI3l d) 7 93 (d, J = 9 3 Hz, 2H), 7 15 Соединение 45 превращают в соответствую7 83 (m, 16Н), 6 57 (d, J = 15 8 Hz, 1H), 6 22 (dd, J щий амидин 46, используя сероводо= 15 8, 6 8 Hz, 1H), 5 (m, 1H), 3 75 (m, 1H), 3 42 (s, род/метил иод ид аммонийацетат в последова3H), 3 27(m, 1H), 2 87 - 3 03 (m, 2H), 2 12(m, 1H) тельности, описанной для превращения 43 в 44 Пример 44 соединение 44 Продукт 46 очищают с помощью ВЭЖХ с обращенной фазой, и выделяют б виде трифторацетатной соли 1 Н NMR (DMSO - de, d) 9 31 (s, 2H), 8 97 (s, 2H), 8 7 (d, 1Н), 7 1 8 - 8 (m, 18Н), 6 6 (d, J = 18 Hz, 1H), 640 (dd, J = 18, 6 Hz, 1H), 483 (m, 1H), 4 02 (m, В перемешиваемый раствор соединения 43 1H), 3 84 (m, 2H), 2 95 (m, 1H), 2 57 (m, 1H), 1 93 (s (20мг, 0,04ммоля) в 1,5мл смеси 2 1 пиридин3H) EtsN барботируют H2S в течение примерно 1 миПример 47 соединение 47 нуты Полученную смесь перемешивают при комf**4 COOH натной температуре в течение ночи, а затем концентрируют в атмосфере потока азота, и затем NH помещают в 2мл CH2CI2 Добавляют метилиодид, и полученную смесь кипятят с обратным холодильником в течение 1 часа Растворитель удаКарбоновую кислоту 9 превращают в соответляют в вакууме, остаток помещают в 2мл МеОН и ствующий амидин 47, используя сероводородімедобавляют МН4ОАС (30мг) Полученную смесь тилиодид аммонийацетат в последовательности, кипятят с обратным холодильником в течение 1 описанной для превращения 43 в 44 Продукт 47 часа, а затем оставляют охлаждаться Затем расвыделяют с помощью ВЭЖХ с обращенной фазой творитель удаляют в вакууме, а остаток очищают в виде трифторацетатной соли 1 с помощью ВЭЖХ с обращенной фазой (CH3CN Н NMR (МеОН - d 4 , d) 8 (d, J = 9 Hz, 2H), 7 82 (d, J Н2О, 0,1% ТФК, 40- до 100% градиент CH3CN), и = 9 Hz, 2H), 7 22 - 7 77 (m, 14H), 6 73 (d, J = 15 8 фракции, содержащие продукт, лиофилизируют до Hz, 1H), 6 4 (dd, J = 15 8, 7 9 Hz, 1H), 4 95 (m, 1H) получения 13мг (51%) продукта 44 в виде триф3 08 - 3 45 (m, 3H) торацетатной соли Пример 49 соединение 49 1 Н NMR(MeOH - d 4 , d) 8 47 (d, J = 7 9 Hz, 1H), 7 95 37 38 46822 ток очищают с помощью ВЭЖХ с обращенной фазой Продукт 51 выделяют в виде его трифторацеСОО-Рг татной соли ин ( у—Ph 1 Н NMR(MeOH - d 4 , d) 8 63 (d, J = 7 9 Hz, 1H), 7 84 (d, J = 8 Hz 2H), 7 16 -7 68 (m, 12H), 6 68 (d, J = 15 8 Hz, 1H), 6 32 (dd, J = 15 8, 7 9 Hz, 1H), 5 (m, 1H), 4 02 (q, 2H), 3 25 (m, 1H), 3 07 (d, J = 7 9 Hz, о — 2H), 1 05 (t, 3H) К перемешиваемому раствору карбоновой кислоты 48 (120мг, 0,29ммоля) в 5мл сухого CH2CI2 в Пример 52 соединение 52 атмосфере азота при комнатной температуре до^ S COOM. бавляют триэтиламин (0,05мл, 0,38ммоля) Прикалывают изо-пропилхлорформат (0,38мл 1 М раствора в толуоле) Через 30 минут добавляют DMAP (18мг, 0,15ммоля), и полученную смесь перемешивают в течение 1,5 часов при комнатной Смесь соединения II и 10% Pd/C (25мг) в EtAc температуре Затем полученную смесь разбавля(2мл) ЕЮН (5мл) гидрируют при 45 при 2 ют CH2CI2 и промывают 1н HCI Затем органиче(3,164кг/см ) в течение 19 часов при комнатной ский слой сушат над сульфатом магния, фильтрутемпературе Полученную смесь фильтруют через ют и концентрируют Сырой продукт слой целита, а полученный фильтрат концентриобрабатывают хроматографически (элюент 40% руют Сырой продукт очищают с помощью ВЭЖХ с EtAc гексаны) до получения 44мг (33%) соответобращенной фазой (CH3CN Н20, 0,1% ТФК, 10 ствующего изопропилового эфира Затем это со100% СНзСІЧ градиент), и фракции, содержащие единение превращают в соответствующий амидин продукт, лиофилизируют до получения 21мг со49, используя сероводород мстилиодид аммоединения 52 1 нийацотат по схеме, представленной для превраН NMR (МеОН - d 4 , d) 8 27 (d, J = 9 3 Hz, 1H), щения 43 в 44 Продукт 49 очищают с помощью 7 83 (m, 2H), 7 43 - 7 65 (m, 7H), 7 09 - 7 27 (m, 5H), ВЭЖХ с обращенной фазой и выделяют в виде 4 35 (m, 1H), 3 58 (s, ЗН), 2 9 5 - 3 1 5 (m, ЗН), 2 5 4 трифторацетатной соли 2 75 (m, 2H), 1 93(m 2H) 1 Н NMR (MeOH - d 4 , d) 8 6 (d, J = 7 9 Hz, 1H), 7 85 Разделение соединения 0 (d, J = 8 Hz, 2H), 7 16 - 7 7 (m, 12H), 6 69 (d, J = Рацемическую смерь соединения 10 (пример15 8 Hz, 1H), 6 32(dd, J = 15 8, 7 9 Hz, 1H), 4 98 (m, но 650мг, отдельный диастереоизомер с предпо1H), 4 85 (m, 1H), 3 23 (m, 1H), 3 08 (m, 2H), 107 лагаемой син-стереохимией) разделяют на два (d, J = 6 Hz, 3H), 0 97 (d, J = 6 Hz, 3H) энантиомера 53 (позже выходящий изомер) и 54 Пример 50 соединение 50 (выходящий раньше изомер), используя препаративную ВЭЖХ (колонка Chi-ralpak AD, 50мм внутр H2N — Диаметр к 500мм, 15мк) Мобильная фаза гептан (А) с 0,1% ТФК и изопропанол (В) с 0,1% ТФК, изо, COOH BN \_/ — кратично 20% А, 80% В (поток = 200мл минуту) у Выходящий позже изомер выделяют концентрированием в вакууме Выход составляет 180мг % ее энантиомера 53, как обнаружено, составляет 100% по данным аналитической ВЭЖХ (Chiralpak d AD) 1Н ЯМР спектры для соединений 53 и 54 Это соединение получают путем превраидентичны щения 48 в соответствующий амидин, используя 1 сероводород метилиодид аммонийацетат в поН NMR (DMSO-d 6 , d) 8 7 (d, J = 8 6 Hz, 1H), 7 92 следовательности, описанной для превращения (d, J = 9 Hz, 2H), 7 78 (d, J = 9 Hz, 2H), 7 75 - 7 21 43 в 44 Продукт 50 очищают с помощью ВЭЖХ с (m, 14H), 6 67(d, J = 16 1 Hz, 1H), 6 4 (dd, J = 16 1, обращенной фазой, и выделяют в виде трифтора7 8 Hz, 1H), 4 98 (dd, J = 16 1, 7 8 Hz, 1H), 3 46 (s, цетатной соли 3H), 3 2 5 - 3 18(m, 1H), 3 05-2 88 (m, 2H) 1 Н NMR (MeOH-d 4 , d) 8 6 (d, J = 7 9 Hz, 1H), 7 85 Пример 55 соединение 55 (d, J = 8 Hz, 2H), 7 16 - 7 7 (m, 12H), 6 69 (d, J = COOMe 15 8 Hz, 1H), 6 32(dd, J = 15 8, 7 9 Hz, 1H), 4 98 (m, 1H), 4 85 (m, 1H), 3 23 (m, 1H), 3 08 (m, 2H), 1 07 (d, J = 6 Hz, 3H), 0 97 (d, J = 6 Hz, 3H) Пример 51 соединение 51 Гидрирование соединения 53 (выходящий COOEt позже энантиомер) осуществляют как и для соединения 52 ранее, за исключением того, что этилацетат опускают Полученный продукт очищают с помощью ВЭЖХ с обращенной фазой В перемешиваемый раствор карбоновой ки(CH3CN Н2О, 0,1% ТФК, 40 - 100% CH3CN), и слоты 50 (96мг, 0,18ммоля) в Змл ЕЮН при компродукт 55 выделяют в виде его трифторацетатнатной температуре барботируют HCI примерно в ной соли 1 течение 3 минут Полученную смесь перемешиН NMR (MeOH - d 4 , d) 8 3 (d, J = 9 3 Hz, 1H), 7 84 вают в течение 7 часов при комнатной температу(m, 2H), 707 - 7 8 (m, 16H), 4 37 (m, 1H), 3 6 (S, ре, а затем хранят в холодильнике (0°С) в течение 3H), 2 97 - 3 17 (m, 3H) 2 57 - 2,77 (m, 2H), 1 95 (m, уикэнда Растворитель удаляют в вакууме, а оста2H) V 39 Пример 56 соединение 56 NHBec 46822 К раствору N-a-Boc-D-фенилаланин (38ммоля) в 80мл сухого тетрагидрофурана добавляют Nметилморфолин (38ммолей) одной порцией, а затем изобутилхлорформат (38ммоля) таким же образом, при -20°С Реакционную смесь перемешивают в течение 10 минут при -20°С, а затем фильтруют в заранее подготовленный раствор диазометана (примерно 70ммолей) при 0°С, Полученный раствор оставляют выстаиваться при 0°С б течение 20 минут Избыток диазометана разлагают, прикалывая ледяную уксусную кислоту и растворители удаляют в вакууме Полученное масло растворяют в 150мл сухого метанола Раствор бензозта серебра (8 шлюлей) в 17мл тризтиламина медленно добавляют при перемешивании при комнатной температуре Полученную реакционную смесь черного цвета перемешивают в течение 45 минут при комнатной температуре, метанол удаляют в эакууме, а остаток помещают в 700мл этилацетата Полученную смесь фильтруют через целит, и промывают последовательно насыщенным раствором бикарбоната натрия (150мл х 3), водой (150мл х 1), 1н бисульфатом калия (150мл х 3) и рассолом (150мл х 1} Органический слой сушат над сульфатом магния, фильтруют, концентрируют в вакууме и очищают с помощью флеш-хроматографии (3 1 гексаны этилацетат) Пример 57 соединение 57 NHBoc Соединение 57 получают по пособу получения 56, используя N-a-Boc-D-аланин Пример 58 соединение 58 NHBoc k c o ос н3 Соединение 58 получают, используя способ получения соединения 56, используя N-a-Boc-Dгомофвнилаланин Пример 59 соединение 59 NHBoc 40 получения соединения 56, используя N-a-Boc-Dциклогексилаланин Пример 62 соединение 62 NHBoc ,СООСН 3 Раствор соединения 56 (Иммолей) в 70мл сухого тетрагидрофурана охлаждают до -78°С, и через шприц добавляют раствор литийгексаметилдисилазана в тетрагидрофуране (ЗЗммоля) с такой скоростью, чтобы температура не повышалась выше -60°С Реакционную смесь нагревают до -25°С в течение 40 минут, и снова охлаждают до -78°С Через шприц добавляют раствор 3цианобензилбромида (27ммолей) в 20мл тетрагидрофурана с такой скоростью, чтобы температура не повышалась выше примерно -60°С Реакционной смеси дают нагреться до комнатной температуры, и перемешивают при комнатной температуре в течение 1 часа Добавляют 125мл насыщенного раствора бикарбоната натрия, и тетрагидрофуран удаляют в вакууме Оставшийся материал разделяют между 500мл этилацетата и 150мл насыщенного бикарбоната натрия Затем органическую фазу промывают насыщенным раствором бикарбоната натрия (2 х 100мл) и рассолом Органический слой сушат над сульфатом магния, фильтруют и концентрируют в вакууме Остаток тщательно растирают с 40мл смеси 4 1 гексаны этилацетат Твердый материал отфильтровывают и сливают Полученный фильтрат, содержащий целевой продукт, концентрируют в вакууме Пример 63 соединение 63 NHBoc -СООСНэ Соединение 63 получают, используя способ получения соединения 62, используя продукт, полученный в примере 57 Пример 64 соединение 64 СООСНэ NHBoc ,соосн 3 Соединение 59 получают, используя способ получения соединения 56, используя N-a-Boc-D-3пиридилаланин Пример 60 соединение 60 NHBoc •СООСНз Соединение 60 получают, используя способ получения соединения 56, используя N-a-Boc-Dизолейцин Пример 61 соединение 61 i^*N NHBoc Соединение 61 получают, используя способ Соединение 64 получают, используя способ получения соединения 62, используя продукт, полученный в примере 58 Пример 65 соединение 65 NHBoc J СООСНэ 42 41 46822 Соединение 65 получают, используя способ получения соединения 62, используя продую", полученный в примере 59 Пример 66 соединение 66 СООСНэ NHBoc Соединение 66 получают, используя способ получения соединения 62, используя продукт, полученный в примере 60 Пример 67 соединение 67 СООСНэ Соединение 67 получают, используя способ получения соединения 62, используя продую", полученный в примере 61 Пример 68 соединение 68 СООСНз К раствору соединения 62 (5ммолей) в 60мл метиленхлорида добавляют 20мл трифторуксусной кислоты, по каплям при 0°С Полученный раствор перемешивают в течение 2 часов при 0°С Растворители удаляют в вакууме, а остаток очищают с помощью ВЭЖХ с обращенной фазой, используя градиент от 30% до 70% ацетонитрила в воде, содержащей 0,1% трифторуксусной кислоты Ацетонитрил удаляют в вакууме, а оставшийся материал разделяют между насыщенным раствором бикарбоната натрия и етилацетатом Водный слой экстрагируют дважды етилацетатом, и объединенные органические слои сушат над сульфатом магния, фильтруют и концентрируют в вакууме Пример 69 соединение 69 NH2 .СООСНз Соединение 69 получают по способу получения, описанному в примере 68, используя продукт, полученный в примере 63 Пример 70 соединение 70 Соединение 70 получают по способу, описанному в примере 68, используя продую", полученный в примере 64 Пример 71 соединение 71 CN Соединение 71 получают по способу, описанному в примере 68, используя продую", полученный в примере 65 Пример 72 соединение 72 NH2 Соединение 72 получают по способу, описанному в примере 68, используя продую", полученный в примере 66 Пример 73 соединение 73 NH, СООСНз Соединение 73 получают по способу, описанному в примере 68, используя продую", полученный в примере 67 Пример 74 соединение 74 СООСНз Раствор А К раствору 11,8мл н-бутиллития в гексанах (19ммоля)в 13мл тетрагидрофурана добавляют раствор 1 -бром-2-фторбензола (19ммолей) в 2мл тетрагидрофурана, прикалывая через шприц при -78°С Перемешивание при -78°С продолжается в течение 1 часа Раствор хлористого цинка (19ммолей) в 38мл тетрагидрофурана добавляют за 2 минуты при -78°С Полученному раствору дают нагреться до комнатной температуры за 40 минут Раствор В К раствору бис(трифенилфосфин)палладийдихлорида (1 ммоль) в 11 мл тетрагидрофурана добавляют диизобутилалюминийгидрид (1 ммоль) в виде раствора в гексанах, при комнатной температуре, а затем метилиодобензоат (16ммолей) одной порцией при комнатной температуре Раствор А добавляют к раствору В, и реакци 46822 44 43 онную смесь оставляют при перемешивании при отфильтровывают, и метанол удаляют в вакууме комнатной температуре на ночь Реакционную до получения масла, которое тщательно растирасмесь разбавляют 300мл диэтилового эфира и ют с эфиром и фильтруют промывают 1н соляной кислотой (3 х 75мл) и расПример 82 соединение 82 солом Органический слой сушат над сульфатом магния, фильтруют и концентрируют в вакууме СООСН3 Пример 75 соединение 75 BocN СООСНз Соединение 75 получают по способу, описанному для соединения 74, используя 1-бром-Зфторбензол при получении раствора А Пример 76 соединение 76 -СООСНз Соединение 76 получают по способу, описанному для получения соединения 74, используя 1бром-4-фторбензол при получении раствора А Пример 77 соединение 77 л >-СООСН 3 Соединение 77 получают по способу, описанному в примере 74, используя 3,4этилендиоксибромбензол при получении раствора А Пример 78 соединение 78 L >-соосн 3 Соединение 78 получают по способу, описанному в примере 74, используя 3,4метилендиоксибромбензол при получении раствора А Пример 79 соединение 79 Раствор соединения 81 (15,4ммоля), триэтиламина (17ммолей), ди-трет-бутилдикарбоната (15,4ммоля) и 4-диметиламинопиридина (1,5ммоля) в 60 диметилформамида перемешивают при комнатной температуре в течение ночи Этот раствор разбавляют 800мл этилацетата, и промывают 1н соляной кислотой (3 х 150мл) и рассолом Органический слой сушат над сульфатом магния, фильтруют, концентрируют в вакууме и очищают с помощью флеш-хроматографии (3 2 гексаны этилацетат) Пример 83 соединение 83 СООСНз AcNH СООСНз Соединение 80 получают по способу, описанному в примере 74, используя 3-цианобромбензол при получении раствора А Пример 81 соединение 81 СООСНз Газообразный аммиак барботируют в суспензию соединения 80 (24ммоля) в 200мл метанола в течение 5 минут К полученному раствору добавляют родий на окиси алюминия (5г), и полученную суспензию встряхивают при положительном давлении водорода в течение 36 часов Катализатор v v Раствор соединения 81 (2ммоля), уксусного ангидрида (8ммолей) и диметиламинопиридина (0,2ммоля) в 20мл пиридина перемешивают при комнатной температуре в течение ночи Реакционную смесь выливают в 200мл 5% соляной кислоты и экстрагируют этилацетатом (3 х 200мл) Объединенные органические экстракты сушат над безводным сульфатом магния, фильтруют, концентрируют в вакууме, и очищают с помощью флеш-хроматографии (3 1 гексаны этилацетат) Пример 84 соединение 84 •СООСНз Соединение 84 получают по способу, описанному для соединения 74, используя 4цианобромбензол при получении раствора А Пример 85 соединение 85 СНзО Соединение 79 получают по способу, описанному в примере 74, используя 3,4диметоксибромбензол при получении раствора А Пример 80 соединение 80 у ** -соосн3 Соединение 85 получают по способу, описанному для соединения 81, используя продукт, полученный в примере 84 Пример 86 соединение 86 BocHN Соединение 86 получают по способу, описанному для соединения 82, используя продукт, полученный в примере85 Пример 87 соединение 87 AcHf •СООСН3 Соединение 87 получают по способу, описанному для соединения 83, используя продукт, полученный в примере 85 Пример 88 соединение 88 45 COOCHa 46822 46 Твердую часть отфильтровывают и сушат в вакууме Пример 94 соединение 94 К раствору метилкумалата (6,5ммоля) и 3нитростирола (32,5ммоля} в 30мл мета-ксилола добавляют 10% палладий на угле (2,5г) в одной порции Реакционную смесь нагревают при 140°С в течение ночи После охлаждения реакционную смесь фильтруют через целит, и полученный фильтрат концентрируют в вакууме Полученную суспензию тщательно растирают со смесью 3 1 гексаны этилацетат Твердую часть, которая представляет целевой продукт, отфильтровывают Пример 89 соединение 89 a \ > ) \ tfz Соединение 89 получают, используя способ получения, соединения 88, используя 4нитростирол Пример 90 соединение 90 В колбу, содержащую 100мл дымящейся азотной кислоты, добавляют порциями 20ммолей 4-бифенилкарбоновой кислоты при 0°С Перемешивание продолжают 15 минут при 0°С Медленно добавляют 100мл воды и собирают фильтрат, и перекристаллизовывают его из этанола Пример 91 соединение 91 СООН Соединение 94 получают по способу, описанному для получения соединения 93, используя продукт, полученный в примере 75 Пример 95 соединение 95 •соон Соединение 95 получают по способу, описанному для соединения 93, используя продукт, полученный в примере 76 Пример 96 соединение 96 СООН Соединение 96 получают по способу, описанному для соединения 93, используя продукт, полученный в примере 77 Пример 97 соединение 97 СООН Соединение 97 получают по способу, описанному для соединения 93, используя продукт, полученный в примере 78 Пример 98 соединение 98 СООН %_J-\ >-сооснэ Соединение 91 получают по способу получения соединения 74, используя 3бензилоксибромбензол при получении раствора А Пример 92 соединение 92 •СООСНэ Соединение 92 получают по способу получения соединения 74, используя 4бензилоксибромбензол при получении раствора А Пример 93 соединение 93 соон К суспензии соединения 74 (1,6ммоля) в 10мл метанола и 20мл тетрагидрофурана добавляют 10мл 2н раствора гидроксида натрия по каплям при комнатной температуре Полученный раствор перемешивают при комнатной температуре в течение 2 часов Органические растворители удаляют в вакууме, а остаток разбавляют 20мл воды, и доводят до рН 2 с помощью 1 н соляной кислоты Соединение 98 получают по способу, описанному для соединения 93, используя продукт, полученный в примере 79 Пример 99 соединение 99 СООН BocHN Соединение 99 получают по способу, описанному для соединения 93, используя продукт, полученный в примере 82 Пример 100 соединение 100 СООН АсН Соединение 100 получают по способу, описанному для соединения 93, используя продукт, полученный в примере 83 Пример 101 соединение 101 BocHN Соединение 101 получают по способу, описанному для получения соединения 93, используя продукт, полученный в примере 86 Пример 102 соединение 102 47 AcHN /=m. 46822 /~~y -COOH Соединение 102 получают по способу, описанному для соединения 93, используя продукт, полученный в примере 87 Пример 103 соединение 103 48 чи при комнатной температуре Реакционную смесь разбавляют 300мл этилацетата и промывают последовательно 1н соляной кислотой (3 х 75мл), водой, насыщенным раствором бикарбоната натрия (3 х 75мл) и рассолом Органическую фазу сушат над сульфатом магния, фильтруют и концентрируют в вакууме Пример 108 соединение 108 COOH O2N Соединение 103 получают по способу, описанному для соединения 93, используя продукт, полученный в примере 88 Пример 104 соединение 104 СООСНз •соон Соединение 104 получают по способу, описанному для соединения 93, используя продукт, полученный в примере 89 Пример 105 соединение 105 Соединение 108 получают, используя способ, описанный для соединения 107, заменяя соединение 96 соединением 93 Пример 109 соединение 109 СООН Соединение 105 получают по способу, описанному для соединения 93, используя продукт, полученный в примере 91 Пример 106 соединение 106 СООН Соединение 106 получают по способу, описанному для соединения 93, используя продукт, полученный в примере 90 Пример 107 соединение 107 СООСНз Соединение 109 получают, используя процедуру, описанную для соединения 107, и заменяя соединение 96 соединением 94 ПримерИО соединение 110 СООСНд СООСНа К раствору соединения 96 (2ммоля) в 10мл ДМФ добавляют диизопропилэтиламин (2ммоля) одной порцией при комнатной температуре, а затем 2-(1Н-бензотриазол-1-ил)-1,1,3,3тетраметилуронийтетрафторбораг (2ммоля) аналогичным образом Реакционную смесь перемешивают в течение 2 минут при комнатной температуре и добавляют раствор Соединения 70 (2ммоля) в 15мл диметилформамида одной порцией Перемешивание продолжают в течение но Соединение 110 получают, используя процедуру, описанную для соединения 107, заменяя соединение 96 соединением 95 Пример 111 соединение 111 49 46822 50 Соединение 114 получают, используя способ получения соединения 107, и заменяя соединение 96 соединением 99, и заменяя соединение 70 соединением 68 Пример 115 соединение 115 .NHAc СООСИз CN Соединение 111 получают, используя способ получения соединения 107, заменяя соединение 96 4-бифинилкарбоновой кислотой, заменяя соединение 70 соединением 68 Пример 112 соединение 112 СООСНз Соединение 115 получают, используя способ получения соединения 107, заменяя соединение 96 соединением 100, и заменяя соединение 70 соединением 68 Пример 116 соединение 116 NHBoc СООСНз Соединение 112 получают по способу получения соединения 107, заменяя соединение 96 соединением 97 Пример 113 соединение 113 СООСНз снэо СН 3 О, Соединение 116 получают по способу получения соединения 107, заменяя соединение 96 соединение 101 и заменяя соединение 70 соединением 68 Пример 117 соединение 117 СООСНз NHAc Соединение 113 получают по способу получения соединения 107, заменяя соединение 96 соединением 98 Пример 114 соединение 114 .СООСНз NHBoc СООСНз Соединение ния соединения единением 102, нением 68 Пример 118 117 получают по способу получе107, заменяя соединение 96 сои заменяя соединение 70 соедисоединение 118 51 46822 52 СООСНз СООСНз Соединение 118 получают, используя способ получения соединения 107, заменяя соединение 96 соединением 103, и заменяя соединение 70 соединением 68 Пример 119 соединение 119 Соединение 121 получают по способу получения соединения 107, заменяя соединение 96 соединением 105, и заменяя соединение 70 соединением 68 Пример 122 соединение 122 .СООСНз СООСНз Соединение 119 получают, используя способ получения соединения 107, заменяя соединение 96 соединением 104, и заменяя соединение 70 соединением 68 Пример 120 соединение 120 Соединение 122 получают, используя способ получения соединения 107, заменяя соединение 96 соединением 106, и заменяя соединение 70 соединением 68 Пример 123 соединение 123 .NHBoc СООСНз СООСНз Соединение 120 получают, используя способ получения соединения 107, заменяя соединение 96 соединением 90, и заменяя соединение 70 соединением 68 Пример 121 соединение 121 Соединение 123 получают, используя способ получения соединения 107, заменяя соединение 96 соединением 99, и заменяя соединение 70 соединением 68 Пример 124 соединение 124 53 46822 54 NHBoc COOCHr Соединение 124 получают, используя способ, описанный для соединения 107, заменяя соединение 96 соединением 99, и заменяя соединение 70 соединением 73 Пример 125 соединение 125 Соединение 127 получают, используя способ получения соединения 107, заменяя соединение 96 индол-6-карбоновой кислотой, и заменяя соединение 70 соединением 69 Пример 128 соединение 128 СООСНз ,NH8oc .СООСНз Соединение 125 получают, используя способ получения соединения 107, заменяя соединение 96 соединением 99, и заменяя соединение 70 соединением 71 Пример 126 соединение 126 CN Соединение 128 получают, используя способ получения соединения 107, заменяя соединение 96 индол-5-карбоноиой кислотой, и заменяя соединение 70 соединением 69 Пример 129 соединение 129 ОН -NHSoc Соединение 126 получают, используя способ получения соединения 107, заменяя соединение 96 соединением 99, и заменяя соединение 70 соединением 72 Пример 127 соединение 127 К раствору соединения 107 (1,2ммоля) в 10мл метанола и 10мл тетрагидрофурана добавляют 10мл 1н раствора гидроксида натрия по каплям при 0°С Раствору дают нагреться до комнатной температуры и перемешивают при комнатной температуре в течение 2,5 часа Раствор охлаждают до 0°С и добавляют 1н соляную кислоту до достижения рН 7 Органический растворитель удаляют в вакууме, а остаток разбавляют 25мл воды Добавляют 1н соляную кислоту до достижения рН 2, и полученную смесь экстрагируют этилацетатом (3 х 75мл) Объединенные органические экстракты сушат над сульфатом магния, фильтруют и концентрируют, и сушат в вакууме Кислоту (1,1ммоля) растворяют в 15мл тетрагидрофурана и охлаждают до -20°С Добавляют М-метилморфолин (1,45ммоля) в одной пропорции, а затем добавляют по каплям через шприц 56 55 46822 изобу-тилхлорформат (1,45ммоля) Реакционную смесь перемешивают при -20°С в течение 20 минут Реакционную смесь фильтруют в раствор боргидрида натрия (Иммолей) в 20мл воды при 0°С Перемешивание продолжают 1,5 часа при 0°С Реакционную смесь разбавляют 300 мл этилацетата и промывают водой (3 х 100мл) и рассолом Органическую фазу сушат над сульфатом магния, фильтруют и концентрируют Полученный спирт очищают с помощью флеш-хроматографии (2 3 этилацетат гексаны) Пример 130 соединение 130 Соединение 133 получают по способу, описанному для соединения 129, заменяя соединение 107 соединением 112 Пример 134 соединение 134 ОН снэо СН 3 О. " Соединение 130 получают по способу получения соединения 129, заменяя соединение 107 соединением 108 Пример 131 соединение 131 ОН Соединение 134 получают по способу получения соединения 129, заменяя соединение 107 соединением 113 Пример 135 соединение 135 ОН Соединение 131 получают по способу получения соединения 129, заменяя соединение 107 соединением 109 Пример 132 соединение 132 ОН Соединение 132 получают по способу получения соединения 129, заменяя соединение 107 соединением 110 Пример 133 соединение 133 ОН Соединение 135 получают по способу получения соединения 129, заменяя соединение 107 соединением 114 Пример 136 соединение 136 .NHAc ОН 57 46822 58 Соединение 136 получают по способу получеСоединение 140 получают по способу получения соединения 129, заменяя соединение 107 сония соединения 129, заменяя соединение 107 соединением 115 единением 119 Пример 137 соединение 137 Пример 141 соединение 141 NHBOC O 2 N. ОН ОН Соединение 137 получают по способу получения соединения 129, заменяя соединение 107 соединением 116 Пример 138 соединение 138 NHAc Соединение 141 получают по способу получения соединения 129, заменяя соединение 107 соединением 120 Пример 142 соединение 142 ОМ ОН un noСоединение 138 получают по способу милучения соединения 129, заменяя соединение 107 соединением 117 Пример 139, соединение 139 Соединение 142 получают по способу получения соединения 129, заменяя соединение 107 соединением 121 Пример 143 соединение 143 ОН Соединение 139 получают по способу получения соединения 129, заменяя соединение 107 соединением 118 Пример 140 соединение 140 Соединение 143 получают по способу получения соединения 129, заменяя соединение 107 соединением 122 Пример 144 соединение 144 59 46822 .NHBoc ОН Соединение 144 получают по способу получения соединения 129, заменяя соединение 107 соединением 123 Пример 145 соединение 145 .NHBoc ОН Соединение 145 получают, используя способ получения соединения 129, заменяя соединение 107 соединением 124 60
ДивитисяДодаткова інформація
Автори англійськоюBondarenko Valentyn Ivanovych, Molchanov Serhii Yuriiovych
Автори російськоюБондаренко Валентин Иванович, Молчанов Сергей Юрьевич
МПК / Мітки
МПК: H03M 3/02
Мітки: дельта-кодек
Код посилання
<a href="https://ua.patents.su/49-46822-delta-kodek.html" target="_blank" rel="follow" title="База патентів України">Дельта-кодек</a>
Попередній патент: Заміщені n-[(аміноімінометил або амінометил)феніл]пропіламіди, фармацевтична композиція, способи лікування та проміжні сполуки
Наступний патент: Пристрій для обробки та запам’ятовування даних
Випадковий патент: Покрівельне покриття