Спосіб одержання регулятора росту рослин
Номер патенту: 17558
Опубліковано: 06.05.1997
Автори: Боровикова Галина Семенівна, Блізнюк Світлана Тимофіївна, Пономаренко Сергій Платонович, Ізжеурова Валентина Василівна
Формула / Реферат
Способ получения регулятора роста растений, включающий культивирование микроорганизма на жидкой питательной среде с последующим выделением продуктов метаболизма, отличающийся тем, что культивируют штамм микроскопического гриба Cylindrocarpon magnusianum ИМВ F-100004 на жидкой питательной среде в условиях ограниченной аэрации при 122 - 28°C в течение 30 суток с последующим адсорбированием продуктов метаболизма активированным углем в течение 6 - 8 часов и экстрагированием 70% этиловым спиртом при объемном соотношении компонентов культуральная жидкость : спирт 2,5 : 1, определяют активность препарата.
Текст
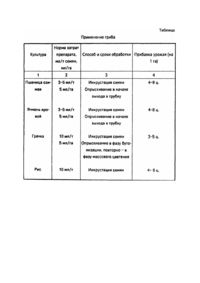
Изобретение относится к биотехнологии и сельскохозяйственной микробиологии, а именно к способу получения препарата, регулирующего развитие широкого круга растений. Неблагоприятная экологическая обстановка, сложившаяся в мире, способствует поиску новых экологически чистых и дешевых биотехнологий, в частности, разработке способов получения новых дешевых и удобных в применении биопрепаратов для культивирования растений как альтернативы химическим средствам. Получение регуляторов роста путем микробиологического синтеза имеет преимущество перед химическими способами, т.к. позволяет получать природные соединения мягкого действия. Продукты жизнедеятельности микроорганизмов-продуцентов имеют значительные преимущества перед синтетическими регуляторами и очищенными микробными веществами. Неочищенные и малоочищенные микробные препараты, содержащие кроме основного действующего начала - фитогормонов смесь биологически активных веществ, зачастую в оптимальных сочетаниях, хорошо сбалансированных для проявления желаемого биологического эффекта, более экономичны и полифункциональны. Однако известные методы их получения включают многоступенчатую систему фракционирования и очистки препаратов, что усложняет процесс, ведет к его удорожанию и снижает выход препарата из-за потерь. Применение регуляторов роста в сельскохозяйственной практике, особенно в повышении устойчивости растений к экстремальным условиям, регулировании процессов вегетативного роста, корнеобраэования, прорастания семян и клубней и т.д. не соответствует реальным потребностям, сфера их практического применения довольно ограничена, в частности, из-за недостаточного количества доступных дешевых отечественных препаратов, способов их получения, транспортировки, хранения. Известны способы, в которых получение биопрепаратов достигается культивированием различных микроорганизмов с последующим выделением и использованием определенных веществ в качестве препарата (Япония: з. №62 - 20163, з. №1 - 79101, PCT №87/06796). Однако этот путь сложен, многоступенчат и ведет к получению узконаправленных препаратов. Известны регуляторы роста растений, обладающие широким спектром действия (гиббрелин, гибберсиб) для широкого круга растений и повышающие урожай на 15 - 20%. Однако эти препараты нерастворимы в воде, а в 0,5% водном растворе аммиака плохо сохраняются. (Микробные фитогормоны в растениеводстве. - Рига: Зенитне, 1988). Известны способы получения биопрепаратов, в основе которых положено культивирование микроорганизмов с последующим суспендированием их биомассы в воде либо физиологическом растворе (А.с. СССР №1423550, №1555320, №1698242, №1699990, №1712348, ГДР э.п. №272986, ЧССР а.с. №256150. США п. №4818530, п. №4718935). Однако эти способы, использующие монокультуры, ведут к получению препаратов регулирующи х развитие одного вида растений и на определенном этапе. Известен способ получения регулятора роста растений из фильтрата культуральной жидкости микроорганизмов, однако, он характеризуется многоступенчатостью, использованием разнообразных экстрагентов и растворителей (Stowe B.B. Yamaki T. Ann & Reu & Plant Physiol., 8, 181 - 216, 1956). В основу изобретения поставлена задача создания способа получения регулятора роста растений, в котором за счет выращивания штамма микроскопического гриба в оптимальных для него условиях и последующего выделения продуктов метаболизма, обеспечивается простота получения биологически активного препарата широкого спектра действия, недорогого и удобного в применении. Поставленная задача решается тем, что в способе получения регулятора роста растений, включающем культивирование микроорганизма на жидкой питательной среде с последующим выделением продуктов метаболизма, согласно изобретению культивируют штамм микроскопического гриба Cylindrocarpon magnusianum ИМВ F-100004 на жидкой питательной среде в условиях аэрации при t 22 28°C в течение 30 суток с последующим экстрагированием продуктов метаболизма 70% этиловым спиртом при объемном соотношении компонентов культуральная жидкость : спирт 2,5 : 1, причем перед экстрагированием проводят адсорбцию с помощью активированного угля в течение 6 - 8ч, добавляя его в количестве 0,5г на 250мл культуральной среды. Способ осуществляют следующим образом. Культивируют штамм Cylindrocarpon magnusianum ИМВ F-100004, имеющий такие характеристики: Штамм выделен из корневой системы облепихи. Идентифицирован по Кириленко Т.С. Атлас родов почвенных грибов (Ascomycetes и Fungi imperfecti). - К.: Наук. думка, 1977. - С.127; Пидопличко Н.М. Грибная флора грубых кормов. - К.: Изд-во АН УССР, 1953. - С.485. Штамм депонирован в Институте микробиологии и вирусологии НАН Украины под N ИМВ F-100004. Морфологическая характеристика штамма. При микроскопировании культуры, выращенной на агаризованной среде сусло, среде Чапека, картофельном агаре, гифы 2,0 - 3,0мкм толщиной, неокрашены, часто в тяжевидных пучках, разветвленные. Конидиеносцы одиночные, простые, слаборазветвленные, суживающиеся к верхушке, размеры 10,0 - 20,0 ´ 2,9 - 3,5мкм. Конидии цилиндрические, прямые, реже слегка согнутые, закругленные на концах или тупоконусовидные с сосочком у основания, с 0 - 3 перегородками, чаще с 1 перегородкой, размеры 10,0 - 42,5 ´ 5,3мкм. Хламидоспоры 5,0 - 12,0мкм в диаметре, сначала неокрашенные, затем коричневые, гладкие. шаровидные или грушевидные, интерколярные или верхушечные, одиночные или в коротких цепочках. На жидкой глюкозо-аспарагиновой среде, не сбалансированной по углероду и азоту, в ги фа х находится большое количество включений жировой природы сферической либо овальной формы. На картофельном отваре включения встречаются в меньшем количестве и мельче по размеру. Культуральные свойства штамма. Штамм хорошо растет на агаризованных питательных средах: пивном сусле, картофельном агаре, среде Чапека, жидкой глюкозо-аспарагиновой среде. На агаризованном пивном сусле при 25 - 28°C колонии пушисто-войлочные, белые до кремоватых или телесных. На обратной стороне - светло-коричневые, радиально лучистые. На агаризованной среде Сабуро (пивное сусло + МПА в равных соотношениях (в возрасте 15 суток) колонии 2 - х типов: 1) Диаметр колоний 80мм. На расстоянии 25мм от центра слабо-войлочная, затем (20мм) пушистая белого цвета. На обратной стороне бесцветная или слабо соломенного оттенка. 2) Диаметр колонии 62мм, в центре (20мм) выпуклая, пушистая, слегка кремового оттенка, затем (по кольцам) войлочная светло-оливкового цвета, войлочная пушистая желтовато-кремоватого оттенка, слабовойлочная слегка фиолетового оттенка, край колонии фиолетово-белого оттенка. Обратная сторона - темно-краснокоричневого цвета. При выращивании в стационарных условиях на жидкой глюкозо-аспарагиновой и сахарозоаспарагиновой средах рост слизистый, желеобразный, бесцветный. На среде с сахарозой при добавлении K - Na лимоннокислого либо аммония лимоннокислого культура растет в виде опушенных пеллет или слизистых сгустков. Культуральная жидкость при этом окрашивается в слегка коричневатый цвет. При выращивании на качалках в колбах емкостью 250мл с 50мл питательной среды культура растет в виде пеллет либо слизистых тяжей, окрашенных в слегка соломенный или коричневый цвет. На жидких средах с добавлением органических источников азотного питания (смеси аминокислот, пептона), на средах сложного состава (растительные отвары) рост культуры и пигментообразование усиливаются. Физиологические свойства штамма. Штамм растет на дефицитной по азоту среде и является олигонитротолерантным микрорганизмом. На среде с низким содержанием азота синтезирует небольшое количество соединений белковой природы. Развитие штамма улучшается и ускоряется при добавлении в среду легкодоступных связанных форм азотного питания: нитратного, аммонийного, органического. Из источников питания усваивает глюкозу, сахарозу, крахмал, маннит. Не растет на среде с целлюлозой. В процессе роста в зависимости от состава питательной среды в большей или меньшей степени подкисляет последние (до pH 5,8 - 3,5). Реакция среды остается без изменений (pH 7,0) при выращивании штамма на глюкозо-аспарагиновой среде. На этой среде культура синтезирует биологически активные вещества - комплекс, состоящий из углеводов, жирных кислот, аминокислот, веществ цитокининовой природы, обладающие ростактивирующими свойствами по отношению к сельскохозяйственным растениям. Штамм является микроаэрофильным и мезофильным микроорганизмом. Не требователен к источникам питания. Растет на жидкой глюкозо-аспарагиновой среде в колбах на 0,75л с 0,25л питательной среды при t 22 - 25°C в стационарных условиях. Культура сохраняется без пересевов в течение 6 и более месяцев. Состав среды (г/л): глюкоза - 10,0; аспарагин - 0,02; KH2PO4 - 0,9; K 2HPO4 - 0,3; MgSO 4 - 0,1; K2SO4 - 0,1; MnSO4 - 0,02; FeSO4 - 0,02; CuSO4 - 0,02; вода водопроводная - 1л; pH 7,0. При росте культуры на минеральной среде дефицитной по азоту, pH культуральной жидкости 7,0 - 7,3. На азотсодержащих средах pH снижается до 6,5 - 3,2. Долгосрочное хранение штамма с периодическими пересевами через 6 месяцев и сохранением биологических свойств осуществляется на жидкой питательной среде следующего состава: г/л: глюкоза 10,0, аспарагин - 0,02, KH2PO4 -0,9; K2HPO 4 - 0,3; MgSO 4 - 0,2; FeSO4 - 0,02; CuSO4 - 0,02, pH 7, t 5 - 7°C. Возможно хранение на этой же среде с добавлением агара (20г/л). Микромицет Cylindrocarpon magnusianum ИМВ F-100004 для получения комплекса биологически активных веществ - регуляторов роста растений выращивают на жидкой питательной среде следующего состава (г/л): глюкоза - 10,0; аспарагин - 0,02; KH2PO4 - 0,9; K 2HPO4 - 0,3; MgSO 4 - 0,1; FeSO4 - 0,02; CuSO4 0,02; K2SO4 - 0,1; MnSO 4 - 0,02; вода водопроводная - 1л, pH 7,0. Культивирование проводят в стационарных условиях в колбах емкостью 750мл с 250мл питательной среды при t 22 - 28°C в течение 30 суток в условиях аэрации. Культура по окончании инкубирования слизистая, бесцветная либо слегка кремоватого оттенка, медузовидная. Адсорбцию продуктов жизнедеятельности осуществляют, добавляя в колбу с биомассой и культуральной жидкостью 0,5г активированного угля. Жидкость перемешивают в течение 6 - 8 часов, после чего содержимое колбы фильтруют на воронке Бюхнера с бумажным фильтром в колбу Бунзена. Для экстракции продуктов метаболизма в колбу добавляют 50мл 70% спирта, перемешивают 6 - 8 часов, затем содержимое колбы фильтруют в воронке Бюхнера. Общий выход водно-спиртового элюатарегулятора роста растений составляет 90% за счет потерь при операции фильтрования. Водно-спиртовый раствор регулятора роста хранят в темном месте при комнатной температуре и проверяют его эффективность биологическим методом по способности стимулировать физиологические процессы у высши х растений. Определение биологической активности регулятора роста проводят по измерению длины проростков пшеницы в присутствии препарата по сравнению с контролем. Семена пшеницы предварительно стерилизуют в растворе перекиси водорода в течение 5 минут с последующим промыванием в стерильной дистводе. Препарат для испытаний разбавляют дистиллированной водой в соотношении 1 : 10000. В 8 стерильных чашек Петри раскладывают по 5 штук семена, затем в 4 опытные чашки наливают по 15см 3 раствора препарата, в 4 контрольные - по 15см 3 воды. Чашки инкубируют в термостате при 24°C. Через 7 суток измеряют длину проростков и определяют среднее значение. Биологическую активность выражают в процентах по отношению к контролю. Увеличение длины проростков пшеницы на 15 - 20%. Влияние полученного таким способом регулятора роста растений приведено в таблице. Как видно из приведенного выше, способ прост, дешев, доступен и приводит к получению эффективного регулятора роста растений.
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for producing plant growth regulator
Автори англійськоюPonomarenko Serhii Platonovych, Borovikova Halyna Semenivna, Blyznyuk Svitlana Tymofiivna, Іzhеurоvа Valentyna Vasylivna
Назва патенту російськоюСпособ получения регулятора роста растений
Автори російськоюПономаренко Сергей Платонович, Боровикова Галина Семеновна, Близнюк Светлана Тимофеевна, Изжеурова Валентина Васильевна
МПК / Мітки
МПК: A01N 65/00, A01P 21/00
Мітки: спосіб, рослин, росту, регулятора, одержання
Код посилання
<a href="https://ua.patents.su/5-17558-sposib-oderzhannya-regulyatora-rostu-roslin.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання регулятора росту рослин</a>
Попередній патент: Спосіб хірургічного лікування раку прямої кишки
Наступний патент: Спосіб ущільнення осадів стічних вод
Випадковий патент: Спосіб вирощування картоплі