Спосіб одержання живильного середовища для визначення токсигенності дифтерійних бактерій
Номер патенту: 20495
Опубліковано: 15.07.1997
Автори: Щетініна Валентина Миколаївна, Верезуб Людмила Григорівна, Ждамарова Лариса Анатоліївна, МАНІНА ЖАННА МИКОЛАЇВНА, Ніколаєнко Вероніка Миколаївна, Волянський Юрій Леонідович, Шинкаренко Анна Опанасівна, Мироненко Людмила Григорівна
Формула / Реферат
1. Способ получения питательной среды для определения токсигенности дифтерийных бактерий путем использования сухой среды, состоящей
из автолизата кильки, солей с последующим растворением, кипячением, фильтрацией, внесением нормальной лошадиной сыворотки, отличающийся тем, что для сокращения сроков выявления токсигенных свойств дифтерийных бактерий в качестве белковой основы берут совместный панкреатический перевар фракции № IV отходов гаммаглобулинового производства и 3,0-3,5% крахмала.
2. Способ по п.1, отличающийся тем, что панкреатический перевар фракции № IV освобождают от ионов Fe2+ путем осаждения фосфатной смесью и разводят дистиллированной водой до конечной концентрации аминного азота 160-180 мг%.
3. Способ по п.1 или 2, отличающийся тем, что в качестве стимулятора токсинообразования добавляют 0,10-0,12% трисоксиметиламинометана.
Текст
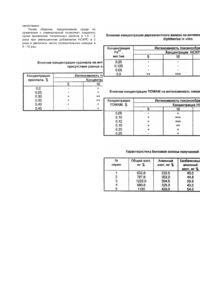
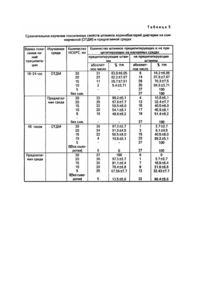
Изобретение относится к медицине, а именно, к микробиологии, в частности, получению питательных сред для выращивания микроорганизмов. Уровень заболеваемости дифтерией в Украине остается относительно высоким, несмотря на проводимые профилактические санитарногигиенические и лечебные мероприятия. Высокая степень патогенности возбудителя дифтерии, приводящая к стремительному развитию тяжелого инфекционного процесса, побуждает к поиску новых или совершенствованию известных способов диагностики и оценки степени риска в зависимости от характеристик Corynebacterium diphtheriae. Используемые способы контроля распространения инфекции включают и такие лабораторные исследования как определение токсигенности бактерий дифтерии, выделяемых от заболевших и бактерионосителей. В частности, немалое значение имеет как можно более ранняя диагностика токсигенных штаммов C.diphtheriae в реакциях иммунопреципитации, а также изыскание возможности снижения стоимости питательных сред, используемых в таких исследованиях. Изложенные обстоятельства явились основанием для разработки нового способа получения плотной питательной среды из непищевого белкового сырья. Актуальность разработки нового способа получения такой среды основывается также на возникших в последние годы осложнениях в приобретении новых питательных сред, производимых в других странах. Известны различные прописи питательных сред для определения токсигенности штаммов C.diphtheriae в реакциях иммунопреципитации in vitro. Среди них такие как сывороточно-мальтозоацетатный агар (Луговая Л.В. Лаб. дело. - 1956. №4. - С.25); Хамачушкин В.В. К методике определения токсигенности микробов in vitro // Лаб. дело. - 1959. - №3. - С.39; Романов Г.В., Шнирсон А.Н.), фосфатно-пептонный агар для определения токсигенности дифтерийных культур (ЖМЭИ. 1956. - 12. - С.34 - 39); "Мартеновский агар для определения токсигенных свойств коринебактерий дифтерии", рекомендованный Приказом МЗ СССР, №450, 1986 "О мерах по предупреждению заболеваемости дифтерией"; среда ОТДМ Дагестанского НИИ питательных сред (Газизова Г.Р. Лабораторное дело. - 1990. - №7. - С.63 - 64). Общим недостатком перечисленных питательных сред является использование в качестве белковой основы мясных продуктов, а также необходимость добавления 20% нативной сыворотки животных, что при обширных эпидемиологических обследованиях значительно повышает их стоимость. Прототипом предлагаемой среды является питательный агар для определения токсигенности дифтерийных микробов (ОТДМ), который выпускается в форме сухой агаризованной среды. Состав ОТДМ: автолизат кильки - 17,5г; агар 12,0г; натрий фосфорнокислый двухзамещенный 0,25г; сода кальцинированная - 0,25г; pH 7,8 - 8,0. Способ приготовления: 30г порошка высыпать в колбу с 1л холодной дистиллированной воды, тща тельно перемешать, прокипятить 5 - 7мин., профильтровать, разлить по 17,0мл в стерильные пробирки, простерилизовать на водяной бане 30мин. Остудить до 45 - 50°C. Добавить по 3,5мл лошадиной сыворотки, разлить в стерильные чашки Петри. Недостатком этой среды является получение ее из пищевого сырья, дефицитности ее из-за разрыва связей после распада Союза, продолжительности сроков обнаружения токсигенных штаммов. В основу изобретения поставлена задача разработать способ получения плотной питательной среды для выделения токсигенных штаммов C.diphtheriae путем использования в качестве белковой основы отходов гаммаглобулинового производства и совокупности ряда факторов и воздействий, которые позволяют сократить сроки выявления токсигенных штаммов, заменить использование дефицитного сырья и удешеви ть стоимость питательных сред. Поставленная задача достигается путем использования в качестве белковой основы панкреатического перевара фракции IV, получаемой как побочный продукт гаммаглобулинового производства. В целях обогащения белковой основы углеводными компонентами проводится одновременное панкреатическое переваривание фракции IV и картофельного крахмала. Для создания условий оптимального токсинообразования проводится освобождение основы от Fe2+ путем добавления фосфатной смеси и вводится стимулятор токсинообразования трисоксиметиламинометан (ТОМАМ). В эксперименте было изучено влияние различных концентраций крахмала, 2-валентного железа и ТОМАМ на интенсивность токсинообразования дифтерийных бактерий in vitro. Для выяснения вопроса о влиянии концентрации крахмала на интенсивность токсинообразования C.diphtheriae in vitro опыт проводился следующим образом: в смесь, содержащую измельченную фракцию IV и бычью поджелудочную железу, вносили крахмал из расчета 0,2; 0,25; 0,30; 0,35; 0,40 и 0,45% крахмала. Образцы подвергали панкреатическому перевариванию при 45° в течение 72 часов с последующим кипячением и фильтрацией. Полученные перевары разводили дистиллированной водой до содержания аминного азота 160 - 180мг%, освобождали от ионов Fe2+, вносили 0,12% ТОМАМ, pH доводили до 7,0 - 7,2 0,1н HCl, агаризовали. Каждый образец делили на 4 части, в которые вносили 5,0; 10,0; 20,0 и 30,0% нормальной сыворотки крупного рогатого скота (НСКРС). Полученные среды, содержащие равные количества аминного азота и ТОМАМ, и различающиеся по количеству крахмала и НСКРС использовали для изучения зависимости токсинообразования C.diphtheriae от содержания крахмала и НСКРС. Определение токсигенности штаммов проводили по методу диск-диффузии, согласно Методическим рекомендациям по применению модифицированной среды Пизу и индикаторных бумажных дисков для идентификации, биохимического типирования и определения токсигенности дифтерийных бактерий (Фельдман Ю.М. и др. - М., 1988). Результаты этого опыта приведены в табл.1. Как видно из табл.1, оптимально линии преципитации образуются при содержании в исходной среде 0,3 - 0,35% крахмала. В данных условиях для обнаружения токсинообразования достаточно присутствия в среде 5% сыворотки. В присутствии более низких и более высоких концентраций крахмала линии преципитации получаются менее четкими и для их проявления требуется большее количество НСКРС. Проведенные опыты позволили установить количество крахмала, включение которого в процесс панкреатического переваривания обеспечивает оптимальное обогащение среды углеводными компонентами. Для изучения влияния концентрации Fe2+ на интенсивность токсинообразования C.diphtheriae in vitro на предлагаемой среде опыт был проведен следующим образом. Белковую основу доводили дистиллированной водой до содержания аминного азота 180мг%. В разведенной таким образом основе содержалось 2,25мкг/мл Fe2+ при определении методом Виноградовой И.Н. и др. (Руководство по микробиологии, клинике и эпидемиологии инфекционных болезней. - Медгиз, 1962). Применяя различные количества фосфа тной смеси было осуществлено ступенчатое извлечение Fe2+ и были получены образцы с содержанием последнего: 0,25мкг/мл; 0,125мкг/мл; 0,06мкг/мл; 0,0мкг/мл. В каждую пробу было внесено 0,12% ТОМАМ. Таким образом, были получены образцы среды с одинаковыми характеристиками по аминному азоту и содержанию ТОМАМ и разным количеством Fe2+. Полученные среды агаризовали (по 100мл каждой). Каждый образец делили на 4 порции (по 25мл), в которые вносили 5, 10, 20 и 30% НСКРС. На каждом образце изучали токсинообразование in vitro. Как свидетельствуют данные, приведенные в табл.2, появление линий преципитации отмечается на средах, в которых содержание Fe2+ не превышает 0,06мкг/мл, а концентрация сыворотки составляет 20 и 30%. Максимальное токсинообразование отмечается при отсутствии обнаруживаемого Fe2+ в среде, причем появление линий преципитации обнаруживается при более низких концентрациях НСКРС (5 и 10%). Таким образом, полученные данные свидетельствуют о том, что наиболее активное токсинообразование наблюдается при максимальном удалении ионов двухвалентного железа из питательной среды. Зависимость интенсивности токсинообразования C.diphtheriae от концентрации ТОМАМ изучалась в следующей постановке опыта. Белковую основу, полученную панкреатическим перевариванием смеси фракции IV и 0,32% картофельного крахмала, освобождали от Fe2+ осаждением фосфатной смесью и доводили дистиллированной водой до содержания аминного азота 180мг%. В 6 флаконов вносили по 100мл полученной жидкости и последовательно добавляли 0,05; 0,1; 0,12; 0,15; 0,20 и 0,25% сухого ТОМАМ. После растворения ТОМАМ pH устанавливали равным 7,0 - 7,2 0,1 н. HCl, и добавляли 2% агара и стерилизовали 20мин при 120° в автоклаве. Содержимое каждого флакона разливали в стерильные чашки Петри, в каждую из которых соответственно вносили 5, 10, 20 и 30% НСКРС. Таким образом, получали ряд сред, содержащих концентрации ТОМАМ в диапазоне 0,05 - 0,25% и НСКРС - 5 - 30,0%. Результаты, отражающие интенсивность токсинообразования в данных условиях, приведены в табл.3. Как видно из табл.3, токсинообразование С. diphtheriae удается зафиксировать в присутствии 5% сыворотки в диапазоне концентраций трисоксиметиламинометана 0,1 - 0,2%. Повышение концентрации НСКРС до 10% дает возможность усилить токсинообразование в пробах с содержанием ТОМАМ 0,1 - 0,12%. В остальных пробах сравнимая активность достигается только при прибавлении 20% НСКРС (0,15% ТОМАМ) и 30% (0,05 и 0,20% ТОМАМ). При концентрации ТОМАМ 0,25% добавление сыворотки не вызывает стимулирования токсинообразования. Таким образом, оптимальной признана концентрация ТОМАМ 0,10 - 0,12%, при которой было достигнуто наиболее активное токсинообразование при содержании сыворотки более низком (10%), чем в остальных случая х (20 30%). Результаты, полученные в описанных экспериментах, позволили принять следующие параметры при конструировании среды для определения токсинообразования C.diphtheriae: содержание крахмала - 0,30 - 0,35% содержание двухвалентного железа – 0 содержание ТОМАМ - 0,10 - 0,12% Способ приготовления питательной среды проводится в два этапа: I. Приготовление белковой основы для питательной среды; II. Приготовление плотной питательной среды для определения токсигенности. Способ приготовления белковой основы 300г фракции IV (свежеполученной или замороженной) заливают 1л дистиллированной воды, доводят до кипения и кипятят при средней интенсивности 30мин. Жидкость сливают, осадок охлаждают воздушным охлаждением и дважды пропускают через мясорубку. Из полученного фарша готовят 10% суспензию на дистиллированной воде. Для этого отвешивают на технических весах по 100г фарша, помещают в четверти, в которые вливают по 1л дистиллированной воды, подогретой до 50°. В приготовленную суспензию добавляют картофельный крахмал из расчета 0,3 - 0,35% (3,0 3,5г на 1л суспензии) и вносят свежую или консервированную хлороформом бычью поджелудочную железу (80г свежей или 100г консервированной на 1л суспензии) и 1% хлороформа (10мл на 1л). pH смеси устанавливают равным 7,8 - 8,0 путем добавления 20% NaOH. Смесь плотно закрывают резиновой пробкой и помещают в термостат при 40 - 45°C. Через 24 часа pH смеси подводят 7,8 - 8,0; через 48 часов смесь встряхивают. Через 72 часа смесь становится прозрачной, ее кипятят 5 - 10мин для инактивации фермента, фильтруют через бумажный фильтр "красная лента" и стерилизуют в автоклаве 30мин при 120°. Полученная белковая основа имеет характеристики, приведенные в табл.4. II. Приготовление питательной среды для определения токсигенности Процесс приготовления питательной среды на полученной основе включает освобождение от ионов Fe2+ и введение стимулятора токсинообразования ТОМАМ, агаризацию и внесение НСКРС. Для освобождения от ионов двухвалентного железа используют фосфатную смесь, состоящую из таких компонентов: Na2HPO4 12H2O - 10г, KH 2PO4 - 2г, H2 O - 100мл и 10% CaCl 2. К 1л белковой основы прибавляют 50мл фосфа тной смеси и 4мл 10% CaCl2, выдерживают при комнатной температуре 30 - 40мин. Образовавшийся осадок отделяют центрифугированием при 6000g в течение 10 15мин. Освобожденную от ионов Fe2+ основу разбавляют дистиллированной водой до концентрации аминного азота 160 - 180мг%, добавляют 0,12 - 0,14% ТОМАМ (1,2 - 1,4 г сухого вещества на 1л) и 2% агара. Среду стерилизуют 20мин при 120°. Перед использованием вносят 8,0 - 10,0% НСКРС. Пример 1. 150г свежеполученной фракции IV залили 1,5л дистиллированной воды, довели до кипения и кипятили 30мин при средней интенсивности. Жидкость слили, осадок охладили воздушным охлаждением и пропустили дважды через мясорубку. На технических весах взвесили 100г полученного фарша, поместили в колбу, прилили 1л дистиллированной воды, нагретой до 50°. В приготовленную суспензию добавили 3,0г картофельного крахмала, внесли 80г свежей бычьей поджелудочной железы и 10мл хлороформа. pH смеси установили 7,9 добавлением 20% NaOH, затем плотно закрыли резиновой пробкой и поместили в термостат при 45°. Через 24 часа pH смеси сдвинулся в кислую сторону (7,0) и был подведен до 7,9 20% NaOH. Через 48 часов смесь несколько раз встряхнули. Через 72 часа смесь стала прозрачной, ее прокипятили 10мин и отфильтровали через бумажный фильтр "красная лента" с последующей стерилизацией в автоклаве 20мин при 120°C. Полученная основа была проанализирована на содержание общего, аминного, безбелкового аминного азота, триптофана и Fe2+. Эти показатели соответственно составили 787,0; 353,0; 44,0мг%; 2,46мкг/мл и 2,96мкг/мл. Для освобождения от ионов Fe2+ к 0,5л полученной основы добавили 25,0мл фосфатной смеси и 2,0мл 4% CaCl2, выдержали при комнатной температуре 35мин. Образовавшийся осадок отделили центрифугированием при 6000g и замеряли объем полученной жидкости (450мл). Основу, освобожденную от ионов Fe2+, разбавили дистиллированной водой до содержания аминного азота 180мг%, соотношение объемов основы и дистиллированной воды рассчитывали по правилу смешения: Всего получено: 432,5 + 450 = 785,5мл среды, освобожденной от Fe2+. Среду разлили в флаконы объемом 100мл по 50мл в каждый. В каждый флакон внесли 60мг сухого трисоксиметиламинометана (ТОМАМ) довели до полного растворения помешиванием стеклянной палочкой и добавили 1% агара. Среду простерилизовали 20мин при 120°, охладили до 45°, после чего в один флакон внесли 5,0мл НСКРС и разлили в стерильные чашки Петри. Остальные флаконы хранили до использования при комнатной температуре. Полученные чашки Петри со средой были использованы для изучения токсинообразования 7 штаммов C.diphtheriae по общепринятой методике, выделенных от носителей токсигенных коринебактерий и больных дифтерией, которые были получены из Харьковской областной СЭС. Из них через 18 - 24 часа образование линий преципитации было зафиксировано у 6 штаммов. Один штамм образовал линии преципитации через 48 часов. Пример 2. 120г замороженной фракции IV залили 1200мл дистиллированной воды, довели до кипения и кипятили 30мин при средней интенсивности. Жидкость слили, обработку осадка с целью получения белковой основы проводили с соблюдением соотношений и последовательности, изложенных в примере №1, но взятое количество крахмала составило 3,5г/л. Полученная в данном примере основа характеризовалась следующими показателями: азот общий - 980мг%; азот аминный 325мг%; безбелковый аминный азот 43мг%; триптофан 3,08мкг/мл; Fe2+ 4,0мкг/мл. Приготовление питательной среды на полученной белковой основе проводилось аналогично примеру 1, но количество внесенного стимулятора токсинообразования ТОМАМ составило в данном случае 50мг на 50мл, т.е. 0,1%. На данной среде было изучено токсинообразование 16 штаммов от больных дифтерией и носителей токсигенных коринебактерий, которые были получены из Харьковской областной СЭС. Через 18 - 24 часа линии преципитации были обнаружены у 13 штаммов. Остальные 3 штамма дали линии преципитации через 48 часов. Для сравнительного изучения питательной среды, получаемой по предлагаемому способу, и коммерческой были использованы токсигенные штаммы, выделенные от 37 больных дифтерией и бактерионосителей. Об интенсивности токсинообразования судили по времени образования линий преципитации на стандартной и предлагаемой среде в присутствии различных количеств сыворотки крупного рогатого скота (табл.5). Как следует из приведенных в табл.5 данных, добавление различных количеств (от 5 до 30%) НСКРС в предлагаемую и контрольную (ОТДМ) среды показало, что при добавлении 20 - 30% сыворотки как в предлагаемую, так и контрольную среду существенных различий не выявлено. Добавление 5,0 - 15,0% сыворотки через 1 сутки дает возможность сократить сроки определения токсигенных свойств коринебактерий дифтерии в 1,5 - 2 раза по сравнению с контрольной средой. Так при добавлении 1% сыворотки через 24 часа На предлагаемой среде линии преципитации по отношению к дифтерийному антитоксину (дисковый метод) выявились у 54,1% штаммов, в то время как при использовании контрольной среды - 5,4%. Через 48 часов на предполагаемой среде при добавлении того же количества сыворотки линии преципитации выявились у 78,4% изученных штаммов, тогда как на коммерческой - 10,8%. Уменьшение количества добавляемой сыворотки до 5% позволило на предлагаемой среде обнаружить преципитационную активность через 24 часа у 48% штаммов С. diphtheriae, через 48 часов у 67,5% штаммов, в то время как на коммерческой среде линии преципитации отсутствовали, что не позволяет выявить штаммы с токсигенными свойствами. Таким образом, предлагаемая среда по сравнению с коммерческой позволяет сократить сроки выявления токсигенных свойств в 1,5 - 2 раза при уменьшенном добавлении НСКРС в 2 раза и увеличить число положительных находок в 5 - 10 раз.
ДивитисяДодаткова інформація
Автори англійськоюVolians`kyi Yurii Leonidovych, Volianskyi Yurii Leonidovych, Shynkarenko Anna Opanasivna, Schetinina Valentyna Mykolaivna, Verezub Liudmyla Hryhorivna, MANINA ZHANNA MYKOLAIVNA, Myronenko Liudmyla Hryhorivna, Zhdamarova Larysa Anatoliivna
Автори російськоюВолянский Юрий Леонидович, Шинкаренко Анна Опанасовна, Щетинина Валентина Николаевна, Верезуб Людмила Григорьевна, МАНИНА ЖАННА НИКОЛАЕВНА, Мироненко Людмила Григорьевна, Ждамарова Лариса Анатолиевна
МПК / Мітки
МПК: C12R 1/16, C12N 1/20, C12Q 1/04
Мітки: бактерій, живильного, токсигенності, одержання, середовища, дифтерійних, визначення, спосіб
Код посилання
<a href="https://ua.patents.su/5-20495-sposib-oderzhannya-zhivilnogo-seredovishha-dlya-viznachennya-toksigennosti-difterijjnikh-bakterijj.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання живильного середовища для визначення токсигенності дифтерійних бактерій</a>
Попередній патент: Спосіб одержання азотвміщуючої лігатури
Наступний патент: Транспортний засіб
Випадковий патент: Композиція інгредієнтів для горілки "імператорська"