Спосіб надання рослині резистентності до склеротиніозу
Формула / Реферат
Способ придания растению резистентности к склеротиниозу, отличающийся тем, что данный способ включает трансформирование указанного растения последовательностью ДНК, кодирующей белок гермин, который обладает оксалатоксидазной активностью, и получение резистентного к склеротиниозу растения.
Текст
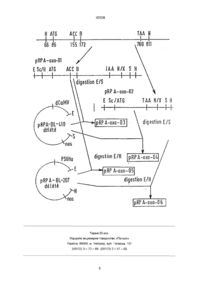
Способ придания растению резистентности к склеротиниозу, отличающийся тем, что данный способ включает трансформирование указанного растения последовательностью ДНК, кодирующей белок термин, который обладает оксалатоксидазной активностью, и получение резистентного к склеротиниозу растения Целью настоящего изобретения является ген, кодирующий оксалатоксидазу, белок, кодируемый этим геном, химерические гены, содержащие этот ген, и их использование для трансформации с тем, чтобы придать им сопротивляемость к грибковым заболеваниям Склеротиниоз является основным грибковым заболеванием, которое поражает большое число двудольных растений Возбудитель Sclerotima sclerotiorum представляет собой многоядный грибок, который проявляет низкую специфичность к хозяину Грибок может поражать растение либо непосредственно на уровне стебля, либо на уровне листьев, а затем распространиться к стеблю, либо на уровне цветковой головки В первых двух случаях растение вянет от прерывания подачи питания В последнем случае вянет цветок, губя урожай Грибок проецирует литические ферменты, которые разрушают клеточную стенку зараженного растения и способствуют их развитию в растении Эти ферменты играют важную роль в патогенезисе, но этого, оказалось, недостаточно Этот грибок также продуцирует щавелевую кислоту (Godov et al , 1990) Эта щавелевая кислота вызывает уменьшение величины рН в зараженных тканях, способствуя гидролизу клеточной стенки литическими ферментами Уменьшение продуцирования щавелевой кислоты или деградация этой щавелевой кислоты должна приводить к замедлению или даже к ингибированию развития грибка Для того, чтобы вырастить резистентное к грибкам растение, можно использовать стратегию детоксификации щавелевой кислоты Деградация этой кислоты ограничит снижение величины внутриклеточного значения рН пораженной ткани растения, посредством чего литические ферменты будут функционировать при некотором значении слишком далеко удаленного от оптимальной для них величины рН, чтобы они могли быть реально активными и эффективными Это приведет к снижению патогенности грибка Оксалатоксидазу, которая катализирует следующую реакцию С2О4Н2 оксалатоксидаза Зоя оксалатоксидаза 2СО 2 + Н 2 О 2 можно использовать для достижения этой цели Оксалатоксидазу выделяют из различных растений, обычно из однодольных растений (Pieta et al , 1982) белок можно, например, очистить из ячменя, используя известные хроматографические методы (Гель-фильтрация через Сефадекс G75 и Mono Q ионообменные гели, фирмы Pharmacia), контролируя ферментативную активность согласно следующему колориметрическому способу (Обзанский и Ричардсон, 1983) Щавелевая кислота + О2 Н 2 О 2 + МВТН -г DMA о2 пероксидаза 2СО 2 + Н 2 О: индамин + Н?О + О 00 о го го 43308 MBTH = З-метил-2-бензотиазолинонгидразон DMA = N, N-диметиланилин Это дает возможность очистить белок, который на акриламидном геле в условиях денатурации имеет молекулярную массу 26000 дальтонов Часть очищенной оксалатоксидазы использовали для получения кроличьих ан тиоксалатоксидазных антител, а остаток белка использовали для определения последовательности нативного белка (N-концевого), либо, после отщепления бромциана, для определения последовательности некоторых внутренних пептидов Получили следующие результаты N-концевой IDPDPLQDF - VADLDGKAVSVNGH S Внутренний пептид № 2 HFQFNVGKTEAY кольцевая ДНК Сравнение пептидных последовательностей, описанных выше, с данными, содержащимися в библиотеке белка Swiss-Prot, дает нам возможность идентифицировать белок пшеницы, называемый Термином (Germme) и о котором сообщили в 1989 г Dratewka-Kos et al Были проведены эксперименты, и они дали нам возможность определить, что кольцевая ДНК, о которой сообщали авторы, кодирует белок из 201 аминокислоты, который проявляет оксалатоксидазную активность Для остального описания экспериментов, представленных в этом патенте, мы будем использовать нуклеотидную нумерацию, показанную на фиг 2 в статье авторов, опубликованной в журнале 1 Biol Chem 264, 4896-4900 Последовательность этой кольцевой ДНК имеет длину 1075 нуклеотидов с нетранслируемым 5'-концом 85 остатков, открытую рамку считывания из 672 нуклеотидов (от положения 86 до 757) и нетранслируемый З'-конец из 318 остатков Сравнение белковой последовательности, выведенной из последовательности кольцевой ДНК, с последовательностью, определенной из нативного белка, показывает, что кольцевая ДНК кодирует не только зрелую оксалатоксидазу, но также и сигнальный пептид из 23 аминокислот в Nконцевой части Оксалатоксидазу поэтому синтезируют в виде предпротеина (сигнальный пептид плюс зрелый пептид), которая претерпевает созревание при удалении сигнального пептида, чтобы выделить зрелый активный фермент Ниже мы будем использовать либо часть, кодирующую предпротеин (нуклеотиды от 86 до 757), либо только часть, кодирующую зрелый протеин (от положения 155 до 757) В последнем случае кодон АУГ (кодирующий метионин) следует поместить перед кодоном АЦЦ (кодирующий треонин, первая аминокислота зрелого протеина) Нападение Sclerotmia sclerotiorum на растения происходит в основном через стебель или через растение, поэтому выгодно постараться выразить оксалатоксидазу в хлорофилловых тканях, и для этого можно использовать промотор из небольшой субъединицы рибулозы 1,5-дифосфаткарбоксилазы Hehanthus annuus (SSUHa, Waksman et al , 1987), либо выразить в различных других тканях растения, а для этого мы можем использовать убихитозныи промотор из РНК 35S вируса мозаики цветной капусты (CaMV 35S), часть которой была удалена, и которую называют "двойным CaMV" Химерические гены согласно изобретению можно, например, сконструировать из следующих элементов А Двойной CaMV промотор, за которым следует часть оксалатоксидазной кольцевой ДНК, кодирующей предпротеин (сигнальный пептид плюс зрелый пептид), и терминатор "nos", полученный из pTi 37 нопалиноинтазного гена (Bevan et al , 1983) В Двойной CaMV промотор, за которым следует часть оксалатоксидазной кольцевой ДНК, кодирующей только зрелый протеин, за которым следует терминатор "nos" С Ген идентичный "А", но с промотором из небольшой субъединицы 1,5-дифосфаткарбоксилазы рибулозы подсолнечника (SSUHa) вместо двойного CaMV D Ген идентичный "В", но с промотором SSUHa вместо двойного CaMV Каждый химерический ген вводят в клетку растения с помощью системы с использованием агробактерии, либо с помощью какой-либо другой системы известной для трансформации клеток растений Растения регенерируют из этих трансформированных клеток Они проявляют повышенную толерантность к Sclerotmia sclerotiorum Пример 1 Получение двух кодирующих последовательностей Предпротеин его получают из описанной выше кольцевой ДНК переваренной с Hind III (в положении 66) Полученный липкий конец делают тупым путем обработки с полимеразой Klenow Эту ДНК затем переваривают с Nhel (в положении 811) Плазмиду pUC 19 (Yamsch Perron et al, 1985) переваривают параллельно с Sacl Полученный липкий конец делают тупым путем обработки с полимеразой Klenow Затем плазмиду переваривают с Xbal (совместима с Nhel) Связывают фрагмент кольцевой ДНК и полученную выше плазмиду Полученную таким образом новую плазмиду называют pRPA-оксо-ОІ, и ее карта представлена на чертеже В Зрелый протеин его получают из описанной выше кольцевой ДНК после переваривания с BstNl (в положении 173) Связывают полученный фрагмент и линкер, имеющий последовательность 5і 31 АТГАЦЦГАЦЦЦАГАЦЦЦТЦТЦЦ ТАЦТГГЦТГГГТЦТГГГАГАГГТ З1 51 Это приводит к видоизменению N-концевой последовательности зрелого протеина, которая проходит от TDPDPLQ до MTDPDPLQ 43308 Этот фрагмент кольцевой ДНК затем переваривают с Nhel (в положении 811) с тем, чтобы его можно было затем связать с плазмидой pUC19, полученной так, как описано в вышеуказанном параграфе Полученную таким образом плазмиду называют PRPA-OKCO-02, и ее карта представлена на фиг 1 Пример 2. Получение химерных генов а Получение векторов, содержащих промотор и терминатор nos, - пример двойного CaMV этот вектор получают из плазмиды pRPA-BL-410, полученной следующим образом Слияние "транзитного пептида SSU маисового гена Ru Bis CO/AroA Транзитный пептид SSU маисового гена Ru Bis CO выведен из EcoRISphl фрагмента 192-bp, он получен из кольцевой ДНК, соответствующей гену SSU маисового гена Ru Bis СО, описанного Lebrun et al , (1987), при сайте Ncol, перекрывающем кодон инициации трансляции, а сайт Sphl соответствует сайту отщепления транзитного пептида Трансляционное слияние между маисовым транзитным пептидом и бактериальным геном EPSPS получают путем обработки конца Sphl полимеразой бактериофага Т4 и путем связывания его с обработанным полимеразой Klenow Ncol концом гена АгоА плазмиды pRPA-BL 104, повторно вырезанной с помощью EcoRI Слияние транзитного пептида SSU маисового Ru Bis CO/ последовательности 22 аминокислот зрелой части SSU маисового Ru Bis CO / гена АгоА, Аналогичным образом EcoRI-Hmd II фрагмент из 228 пар оснований кольцевой ДНК SSU маисового гена RuBisCO связывают с обработанной полимеразой Klenow Ncol концом гена АгоА плазмиды pRPA-BL 104 и повторно вырезают с помощью EcoRI Трансляционное слияние получают между транзитным пептидом SSU маисового RuBisCO, 22 аминокислотами зрелой части SSU маисового RuBisCO И бактериальным геном EPSPS Транзитный пептид SSU подсолнечникового RuBisCO Фрагмент получают из кольцевой ДНК, выделенной Waksman и Freyssmet (1987) Сайт Sphl был создан по способу Zoller и Smith (1984) в сайте отщепления транзитного пептида Полученный таким образом транзитный пептид SSU подсолнечникового RuBisCO представляет собой EcoRISphl фрагмент из 171 пары оснований Слияние транзитного пептида SSU подсолнечникового RuBisCO / последовательностей 22 аминокислот зрелой части SSU маисового RuBisCO/гена АгоА Конструкция, содержащая слияние транзитного пептида SSU маисового RuBisCO /последовательность 22 аминокислот SSU маисового RuBisCO зрелой части маисового гена, вырезали с помощью EcoRI-Sphl из 171 пары оснований, соответствующей транзитному пептиду SSU указанного гена подсолнечника RuBisCO Полученная конструкция проявляет замещение фрагментов EcoRI-Sphl и представляет собой трансляционное слияние "транзитного пептида подсолнечникового RuBisCO /последовательности 22 аминокислот зрелой части SSU маисового RuBisCO /гена АгоА Фрагмент EcoRI-Sall связывают с фрагментом Sall-Sstl, содержащим последовательность 3' nos и правый конец Т-ДНК Полученный EcoRI-Sstl фрагмент, содержащий "транзитный пептид SSU подсолнечникового RuBisCO /последовательность 22 аминокислот зрелой части SSU маисового RuBisCO /гена AroA/3' nos /правый конец Т-ДНК", используют вместо EcoRI-Sstl фрагмента, содержащего правый конец Т-ДНК плазмиды 150 А альфа 2, содержащей двойной CaMV промотор Транскрипционное слияние "двойной CaMV Транзитный пептид SSU подсолнечникового RuBisCO/ последовательность 22 аминокислот зрелой части SSU маисового RuBisCO гена AroA/3' nos в векторе 150 А альфа 2 называют pRPA-BL 294 Слияние "транзитный пептид SSU подсолнечникового RuBisCO /последовательность 22 аминокислот SSU маисового RuBisCO / транзитный пептид SSU маисового RuBisCO /гена АгоА" Вышеуказанную конструкцию вырезают с помощью Ncol-Hmdlll, высвобождающей ген АгоА Затем его связывают с Ncol - Hind III фрагментом 1,5 тыс пар оснований, содержащим слияние "транзитного пептида SSU маисового RuBisCO /гена АгоА" Полученная конструкция проявляет замещение фрагментов Ncol - Hind III и представляет собой трансляционное слияние "транзитного пептида SSU подсолнечникового RuBisCO /последовательности 22 аминокислот SSU RuBisCO зрелой части маисового гена / транзитного пептида SSU маисового RuBisCO /гена АгоА" EcoRI-Sall фрагмент связывают с Sall-Sstl фрагментом, содержащим 3' nos последовательность и правый конец Т-ДНК Полученный EcoRISstl фрагмент, содержащий "транзитный пептид SSU подсолнечникового RuBisCO / последовательность 22 аминокислот SSU RuBisCO зрелой части маисового гена/ транзитный пептид SSU маисового RuBisCO /ген AroA/3' noss/ правый конец Т-ДНК" используют вместо EcoRI-Sstl фрагмента, содержащего правый конец Т-ДНК плазмиды 150 А альфа 2, содержащей двойной CaMV промотор Транскрипционное слияние "двойной CaMV/транзитный пептид SSU подсолнечникового RuBisCO /последовательность из 22 аминокислот SSU RuBisCO зрелой части маисового гена / транзитный пептид SSU маисового RuBisCO / гена AroA/3' nos в векторе 150 А альфа 2 называют pRPA-BL 410 Эту плазмиду переваривают с EcoRI и Sail для того, чтобы удалить структурный ген "оптимизированный транзитный пептид-зрелый EPSPS кодирующий участок", плазмида pRPA-BL410 deleted (см фиг 1) - Пример SSUHa этот вектор получен из плазмиды pRPA-BL-207 (описано в Европейской патентной заявке 0337899), которую переваривают с EcoRI и Hind III для того, чтобы удалить участок, кодирующий нитрилазу, pRPA-BL-207 deleted (см фиг 1) b Конструирование химерных генов pRPAоксо-03, его получают путем переваривания pRPA-оксо-ОІ с EcoRI - Sail Полученный фрагмент, который кодирует предпротеин, затем вставляют между сайтами EcoRI и Sail расположенны 43308 ми ниже двойного CaMV и выше терминатора nos, соответственно PRPA-OKCO-04 его получают путем переваривания рРРА-оксо-02 с помощью EcoRI и Sail Полученный фрагмент, который кодирует зрелый протеин, затем вставляют между сайтами EcoRI и Sail ниже двойного CaMV и выше терминатора nos, соответственно PRPA-OKCO-05 его получают путем переваривания pRPA-OKCo-01 с EcoRI и Hind III ПолученНазвание ный фрагмент, который кодирует предпротеин, затем вставляют между сайтами EcoRI и Hind III ниже по потоку от промотора SSUHa и выше терминатора nos, соответственно pRPA-оксо-Об его получает путем переваривания PRPA-OKCO-02 с EcoRI и Hind III Полученный фрагмент, который кодирует зрелый протеин, затем вставляют между сайтами EcoRI и Hind III ниже по потоку от промотора SSUHa и терминатора nos, соответственно Схематическое представление четырех химерических генов Оксалотоксидазный Промотор кодирующий участок Терминатор PRPA-оксо-ОЗ dCaMV предпротеин nos PRPA-OKCO-04 dCaMV зрелый nos PRPA-OKCO-05 SSUHa предпротеин nos PRPA-оксо-Об SSUHa зрелый nos Пример 3. Получение трансгенного рапса а Трансформация Каждый вектор, как описано выше, вводят в нононкогенный штамм ЕНА 101 Agrobactenum tumefaciens (Hood et al, 1987), несущий космиду pTVK 291 (Koman et al , 1986) Способ трансформации рапса вида Westar по существу основан на том, что описано Boulter et al (1990), при использовании бактериальной концентрации 2,5 х 109 на мл (оптическая плотность 600 нм = I) b Регенерация Способ регенерации по существу основан на том, что описано Boulter et al (1990) Растения высаживают на среде De Block et al (1939) Затем их доводят до стадии цветения в теплице Пример 4 Определение резистивности рапса к Sclerotima sclerotiorum In vitro - Лиственные диски резистентность измеряют путем взвешивания массы трех лиственных дисков после выращивания в течение 11 дней на среде Murashige и Skoog (MS) с гормонами с добавкой 1 миллимоль/л щавелевой кислоты При этих условиях было отмечено, что для лиственных дисков полученных из рапса, модифицированного с помощью одного из химерных генов pRPA-оксо-ОЗ, pRPA-OKCO-04, pRPA-OKCO-05 и pRPA-оксо-Об, масса лиственных дисков существенно возрастает, в то время как в случае лист венных дисков, полученных из немодифицированного рапса, масса не растет или даже падает - Удлинение корня, резистентность измеряли также in vitro путем измерения удлинения корня после выращивания в течение двух дней на воде с добавкой 5 миллимоль/л щавелевой кислоты В этом случае наблюдали, что корни растений рапса, модифицированного одним из химерных генов, pRPA-оксо-ОЗ, PRPA-OKCO-04, способны растя и увеличиваться в длину, в то время как корни немодифицированного рапса не показывают роста при этих условиях In vitro Резистентность in vivo измеряли в теплице после заражения рапсовых растений, полученных после регенерации, как только появились первые цветы, либо путей нанесения спор S sclerotiorum на лепестки, причем заражение листьев происходило естественным образом после отпадения цветков, либо путем непосредственного нанесения мицелия или пропитанных мицелием лепестков на листья Растения, модифицированные одним из химерных генов pRPA-оксо-ОЗ, pRPA-оксо04, PRPA-OKCO-05 и pRPA-оксо-Об, не дают возможности грибку развиваться и не проявляют никаких симптомов гнили, характерных для склеротиниоза, в то время как немодифицированные растения быстро поражаются гнилью, характерной для развития Sclerotima sclerotiorum 43308 Н ДТС АСС В ТДД N 6 86 155 172 760 811 pRPA-oxo-01 Е Sc/H ATG 4 ГАА N/X S Н АСС В digestion E/S pRPA-oxo-02 E Sc/ATG TAA N/X S H digestion E/S pRPA-oxo digestion E/H pRpA-oxo-Ol pRPA-oxo-05 diqestion E/H pRPД-охо-06 Тираж 50 екз. Відкрите акціонерне товариство «Патент» Україна, 88000, м. Ужгород, вул. Гагаріна, 101 (03122) 3-72-89 (03122) 2-57-03
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for imparting plant resistance to sclerostinious
Автори англійськоюFREYSSINET GEORGES, SAILLAND ALAIN
Назва патенту російськоюСпособ придания растению резистентности к склеротиниозу
Автори російськоюФрейсине Джорж, Сайан Ален
МПК / Мітки
МПК: A01N 63/00, C12N 9/02, A01H 5/00, C12N 15/53, C12N 15/09, C12N 15/82, C12N 5/10
Мітки: надання, спосіб, склеротиніозу, резистентності, рослини
Код посилання
<a href="https://ua.patents.su/5-43308-sposib-nadannya-roslini-rezistentnosti-do-sklerotiniozu.html" target="_blank" rel="follow" title="База патентів України">Спосіб надання рослині резистентності до склеротиніозу</a>
Попередній патент: Cпосіб перетворення кетоксиму або альдоксиму у відповідний амід
Наступний патент: Машина прямого перетворення тепла в корисну роботу за особливим термодинамічним циклом з активним використанням кінетичної енергії робочого тіла
Випадковий патент: Спосіб отримання стабілізуючої добавки для асфальтобетонної суміші