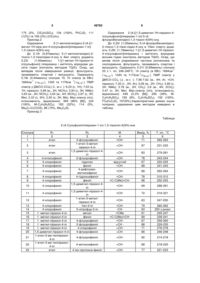
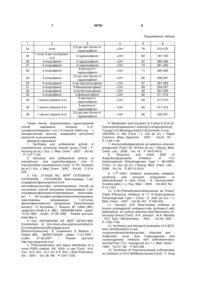
Спосіб одержання похідних 2-(4-сульфонілпіперазин-1-іл)-1,3-тіазолін-4(5н)-ону
Номер патенту: 49783
Опубліковано: 11.05.2010
Автори: Уграк Богдан Іванович, Яременко Федір Георгійович, Карпова Тетяна Олексіївна, Вакула Володимир Миколайович, Тайдаков Ілля Вікторович
Формула / Реферат
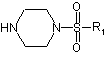
1. Спосіб одержання похідних 2-(4-сульфонілпіперазин-1-іл)-1,3-тіазолін-4(5Н)-ону, який відрізняється тим, що як реагенти використовують моносульфонілпіперазини формули:
та похідні 2-тіоксо-1,3-тіазолідин-4-ону формули:
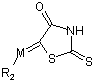 ,
,
де R1 - алкіл, арил або гетарил;
R2 - гідроген, феніл, заміщений феніл або гетарил;
М - СН, С(СН3), СН-С(Ме)=СН, СН-СН=СН або зовсім відсутня.
2. Спосіб за п. 1, який відрізняється тим, що реакцію здійснюють при нагріванні в органічних розчинниках, зокрема у нижчих спиртах.
Текст
1. Спосіб одержання похідних 2-(4сульфонілпіперазин-1-іл)-1,3-тіазолін-4(5Н)-ону, який відрізняється тим, що як реагенти використовують моносульфонілпіперазини формули: O та похідні 2-тіоксо-1,3-тіазолідин-4-ону формули: O NH M R2 S S , де R1 - алкіл, арил або гетарил; R2 - гідроген, феніл, заміщений феніл або гетарил; М - СН, С(СН3), СН-С(Ме)=СН, СН-СН=СН або зовсім відсутня. 2. Спосіб за п. 1, який відрізняється тим, що реакцію здійснюють при нагріванні в органічних розчинниках, зокрема у нижчих спиртах. N S R1 HN S O N N M N N O де R1 алкіл, арил або гетарил; R2 гідроген, феніл, заміщений феніл, або гетарил; М СН, С(СН3), СН-С(Ме)=СН, СН-СН=СН або зовсім відсутня. Сульфонілпіперазини (СП), що містять при термінальному атомі азоту арильні або гетарильні замісники представлені значною кількістю сполук з різноманітними видами фармакологічної дії. Зокрема, при пошуку більш ефективних аналогів антибактеріального препарату Ліпезолід було встановлено, що заміна в ньому морфолільного (11) R1 S UA O залишку на арилсульфоніл-піперазиновий дозволяє одержати сполуки більш активні від прототипу [1, 2]. Заміщені у сульфоновому фрагменті похідні 1-[біс(4-флуорофеніл)метил]піперазину запатентовано як проміжні сполуки в синтезі антигістамінних препаратів [3, 4]. Алкілсульфонілпіперазинові фрагменти є складовими відомих субстанцій для лікування еректильної дисфункції у чоловіків: Силденафіл або Віагра, Верденафіл або Левітра, новий кандидат у ліки з цього класу (SK3530) проходить третю фазу доклінічних випробувань [5, 6]. СП, що містять гетероциклічний залишок як замісник в арил сульфоновому фрагменті, на сьогодні є найбільш селективними антагоністами уротензинових рецепторів [7], що визначають низку кардіоренальних та метаболічних захворювань, таких як гіпертензія, атеросклероз, ниркова недостатність, діабет. N’-2-Піридилзаміщені СП виявились сильними і селективними інгібіторами людської 11 гідроксистероїддегідрогенази типу І [8]; пригнічення саме цього ферменту розглядається як перспективна стратегія пошуку препаратів для покра (19) Корисна модель відноситься до галузі органічної хімії, а саме - хімії гетероциклів і стосується способу одержання похідних 2-(4-сульфонілпіперазин-1-іл)-1,3-тіазолін-4(5Н)-ону формули: R2 49783 (13) U O 3 49783 щення чутливості до інсуліну, а отже, і лікування цукрового діабету типу 2 [9, 10]. Відомо, що значна увага дослідників спрямована до різноманітних 2-аміно-5-арилідентіазолін4-онів та їх N-заміщених, як сполук широкого спектру біологічної дії: протизапальною [11, 12], противірусною [13], протипухлинною [14, 15], але серед описаних сполук немає таких, які б містили в одній молекулі тіазолідинові та сульфопіперазинові фрагменти. На сьогодні для синтезу СП використовувався виключно метод сульфохлорування монозаміщених піперазинів (реакція, як правило, проводиться у СН2Сl2 при кімнатній температурі). Але для 2-(4сульфоніл-піперазин-1-іл)-1,3-тіазол-4(5Н)-онів вихідними сполуками при використанні методу сульфохлорування є малодоступні 2-1Мпіперазиніл-1,3-тіазолінони [16] при синтезі яких з роданіну, як небажані побічні продукти, утворюються N, N'-біс-(тіазолінон-2-іл)піперазини, що є головним недоліком цього методу. Формування зв'язку C-N між піперазиновим і арильним чи гетарильним фрагментами здійснюється, у більшості випадків, шляхом нуклеофільного заміщення атома галогену (брому [17], флуору [2, 8], хлору [8]). Але 2-галогензаміщені тіазолінони не є комерційно доступними сполука 4 ми і одержуються багатостадійним синтезом [18]. Умови реакції нуклеофільного заміщення атома галогену на піперазиновий фрагмент вимагають використання полярних апротонних розчинників (диметилформамід, диметилсульфоксид, сульфолан, N-метилпірролідон та інш.), тривалого нагрівання. До недоліків цієї схеми відносяться низька технологічність, використання дорогих та токсичних розчинників. Задачею корисної моделі є розробка нового технологічного та економічного способу синтезу похідних 2-(4-сульфонілпіперазин-1-іл)-1,3-тіазолін-4(5Н)-онів. Поставлена задача вирішується тим, що як реагенти в синтезі використовують доступні моносульфонілпіперазини та похідні 2-тіоксо-1,3тіазолідин-4-ону, а саму реакцію здійснюють при нагріванні в органічних розчинниках, зокрема у нижчих спиртах. Технічний результат - спрощення синтезу за рахунок зменшення кількості стадій процесу, усунення необхідності використання дорогих і токсичних реагентів та розчинників. Спосіб одержання похідних 2-(4сульфонілпіперазин-1-іл)-1,3-тіазолін-4(5Н)-онів ілюструється схемою: O N M S O SH R2 HN N S R1 O M S N O O спирт R2 S N S R1 + H2S O R2 NH M O N S Необхідні для реалізації цієї схеми 5-ариліден2-тіоксо-1,3-тіазолі-дин-4-они одержано конденсацією Кньовенагеля з роданіну та відповідних альдегідів [18, 19]. Використані моносульфонілзаміщені піперазину синтезовано відомими методами [20]. Хімічна будова всіх одержаних сполук доведена спектральними методами (ЯМР 1Н, 13С; 14), молекулярні маси визначені за даними масспектрометрії електронного удару. Для всіх сполук, де М є метиліденовим фрагментом, замісник R2 має трансоїдне розміщення відносно карбонільної групи, тобто, відносно зв'язку М=С(5) ці сполуки є Z-ізомерами. Це не стосується 2-{4-[(4-хлорофеніл)сульфоніл]піперазин-1іл}-1,3-тіазол-4(5Н)-ону та 5-(1-метилетиліден)-2{4-[(1-метил-1Н-піразол-4-іл)сульфоніл]піперазин1-іл}-1,3-тіазол-4(5Н)-ону, для яких така ізомерія неможлива. Приклад 1 Одержання 5-бензиліден-2-{4-[(4хлорофеніл)сульфоніл]-піперазин-1-іл}-1,3-тіазол4(5Н)-ону. До 0,20г (0,90ммоль) 5-бензиліден-2-тіоксо1,3-тіазолідин-4-ону в 5 мл спирту додають 0,28г (1,07ммоль) 1-[(4хлорофеніл)сульфоніл]піперазину і кип'ятять впродовж семи годин (контроль методом ТШХ). Сірководень, що виділяється під час реакції, дегазують та утилізують відомими методами. Осад, що випав після упарювання частини розчинника та охолодження, фільтрують, промивають спиртом і висушують. Одержують 0,29г (0,65ммоль) сполуки 6. ІЧ спектр (в КВr): 1684см-1 ( C O ), 1352 та 1168см-1 ( S O ). ПМР спектр у ДМСО-ССl4 ( , м.ч.): 7,77 (д., 2Н, Аr); 7,61 (д., 2Н, Аr); 7,59 (с., 1Н, =СН); 7,53 (д., 2Н, Аr); 7,45 (т., 2Н, Аr); 7,35 (т., 1Н, Аr); 4,09 (м., 2Н, NCH2); 3,77 (м., 2Н, NCH2); 3,15 (м., 4Н, NCH2). Мас-спектр (m/z, інтенсивність, віднесення): 448 (0,1% [M]), 272 (13%, M-ClC6H4SO2), 5 49783 175 (2%, ClC6H4SO2), 134 (100%, PhC2S), 111 (12%) та 109 (3%) (СlС6Н4). Приклад 2 Одержання 5-(1-метилетиліден)-2-{4-[(1метил-1Н-піра-зол-4-іл)сульфоніл]піперазин-1-іл}1,3-тіазол-4(5Н)-ону. До 0,15г (0,87ммоль) 5-(1-метилетиліден)-2тіоксо-1,3-тіазолідин-4-ону в 4мл спирту додають 0,23г (1,00ммоль) 1-[(1-метил-1Н-піразол-4іл)сульфоніл] піперазину і кип'ятять впродовж десяти годин (контроль методом ТШХ). Осад, що випадав після завершення реакції, фільтрують, промивають спиртом і висушують. Одержують 0,16г (0,44ммоль) сполуки 15. ІЧ спектр (в КВr): 1684см-1 ( C O ), 1340 та 1176см -1( S O ). ПМР спектр у ДМСО-ССЦ ( , м.ч. ): 8,25 (с, 1Н); 7,63 (а, 1Н, піразол); 3,99 (м., 2Н, NCH2); 3,93 (с, 3Н, NMe); 3,63 (м., 2Н, NCH2); 3,04 (м., 4Н, NCH2); 2,87 (с, 3Н, Me); 2,33 (с, 3Н); 2,00 (с, 3Н, Me). Мас-спектр (m/z, інтенсивність, віднесення): 369 (96% [М]), 224 (100%, M-C4H5N2SO2), 183 (22%), 114 (5%, Me2C=C(CO)S), 86 (70%, Me2C2S). Приклад 3 6 Одержання 2-{4-[(1,5-диметил-1Н-пиразол-4іл)сульфоніл]піперазин-1-іл}-5-(4флуоробензиліден)-1,3-тіазол-4(5Н)-ону. До 0,25г (1,05ммоль) 5-(4-флуоробензиліден)2-тіоксо-1,3-тіазо-лідин-4-ону в 10мл спирту додають 0,29г (1,19ммоль) 1-[(1,5-диметил-1Н-піразол4-іл)сульфоніл]піперазину і кип'ятять впродовж восьми годин (контроль методом ТШХ). Осад, що випав після упарювання частини розчинника та охолодження, фільтрують, промивають спиртом і висушують. Одержують 0,31г (0,69ммоль) сполуки 20 з т. пл. 246-248°С. 14 спектр (в КВr): 1684см-1 ( C O ), 1340 та 1172см-1( S O ). ПМР спектр у ДМСО-ССl4 ( , м.ч. ): 7,56-7,62 (м., 4Н; Аr, =СН, піразол); 7,20 (т., 2Н, Аr); 4,09 (м., 2Н, СН2); 3,80 (с, 3Н, NMe); 3,78 (м., 2Н, СН2); 3,8 (м., 4Н, 2СН2); 2,47 (с, 3Н, Me). Мас-спектр (m/z, інтенсивність, віднесення): 449 (0,3% [М]), 290 (39%, МC5H7N2SO2), 159 (8%, C5H7N2SO2), 152 (100%, FC6H4C2S), 107(9%).Характеристики деяких інших похідних, одержаних цим методом наведено в таблиці. Таблиця 2-(4-Сульфонілпіперазин-1-іл)-1,3-тіазолін-4(5Н)-они Сполука 1 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 R1 2 етил R2 3 4-флуорофеніл 1-етил-3-метилетил піразол-4-іл 1,5-диметил-піразол-4етил іл 4-етоксифеніл 2-флуорофеніл 4-хлорофеніл гідроген 4-хлорофеніл феніл 4-дифлуоро4-хлорофеніл метоксифеніл 4-хлорофеніл 4-гідроксифеніл 4-хлорофеніл феніл 1,5-диметил-піразол-44-хлорофеніл іл 1,3-диметил-піразол-44-хлорофеніл іл 1-етил-3-метил4-хлорофеніл піразол-4-іл 4-хлорофеніл тієн-2-іл 4-хлорофеніл 5-нітрофур-2-іл 1 -метил-піразол-4-іл метил 1 -метил-піразол-4-іл феніл 1 -метил-піразол-4-іл 4-флуорофеніл 1 -метил-піразол-4-іл 2-флуорофеніл 1 -метил-піразол-4-іл 4-хлорофеніл 1,5-диметил-піразол-4-іл 4-флуорофеніл 1-етил-3-ме-тилпіразол4-флуорофеніл 4-іл 1-етил-3-ме-тилпіразол4-метоксифеніл 4-іл етил 4-ізо-пропокси-феніл М 4 =СН Вихід, % 5 71 Т. пл., °С 6 262-263 =CH 87 231-233 =CH 83 279-281 =CHвідсутній =СН 78 67 68 243-244 222-225 241-243 =СН 89 262-264 =СН=С-С(Ме)=СН 78 68 310-312 252-253 =СН 69 288-291 =СН 72 319-321 =СН 63 247-250 =СН-СН=СМе =С-С(Ме)=СН=СH=СН =СН=СН 79 63 61 69 67 68 71 66 260-262 250 з розкл 245-247 239-241 259-260 229-230 276-278 246-248 =СН 82 214-218 =СН 68 218-220 =СН 77 221-223 7 49783 8 Продовження таблиці 1 2 24 етил 26 27 1-етил-3-ме-тилпіразол4-іл 4-хлорофеніл 4-хлорофеніл 28 4-хлорофеніл 29 4-хлорофеніл 30 31 32 33 4-хлорофеніл 4-хлорофеніл 4-хлорофеніл 4-хлорофеніл 34 1-метил-піразол-4-іл 35 1-метил-піразол-4-іл 36 1-метил-піразол-4-іл 25 3 3,5-ди-трет-бутил-4гідроксифеніл 4 5 6 =СН 79 273-275 3-гідроксифеніл =СН 82 187-190 3-гідроксифеніл 2-гідроксифеніл 4-метокси-3гідроксифеніл 3,5-ди-трет-бутил-4гідроксифеніл 4-ізо-пропокси-феніл 4-бензилокси-феніл 4-ізо-бутокси-феніл 3-фенокси-феніл 4-метокси-3гідроксифеніл 3-метокси-4гідроксифеніл 3,5-ди-трет-бутил-4гідроксифеніл =СН=СН 87 73 285-286 261-263 =СН 71 293-295 =СН 66 258-261 =СН=СН=СН=СН 67 69 90 82 291-293 254-257 257-259 211-212 =СН 63 271-273 =СН 64 311-312 =СН 65 235-237 Таким чином, запропоновано одностадійний спосіб одержання похідних 2-(4сульфонілпіперазин-1-іл)-1,3-тіазолін-4(5Н)-ону з використанням простих, комерційно доступних реагентів та розчинників. Джерела інформації: 1. Synthesis and antibacterial activity of oxazolidinones containing triazolyl group [Text] / F. Houxing [et al.] // Eur. J. Med. Chem. - 2007. - Vol.42. - P.1137-1143. 2. Structure and antibacterial activity of arylcarbonyl- and arylsulfonylpipera- zine 5triazolylmethyl oxazolidinones [Text] / A. Ph. Oludotun [et al.] // Eur. J. Med. Chem. - 2007. - Vol.42. - P.214225. 3. Пат. 2118320 RU, МПК6 C07D295/04 ; C07D295/06 ; C07D295/08. Энантиомеры 1-[(4хлорфенил)фенилметил]-4-[(4метилфенил)сульфо- нил]пиперазина, способ их получения, способ получения энантиомеров 1-[(4хлорфенил)фенилметил]пиперазина, энантиомеры 1 -[(4-хлорфе-нил)фенилметил]пиперазина, энантиомеры производных 1-[(4-хлорфенил)фенилметил] пиперазина [Электронный ресурс] / Э. Коссеман, Г. Бодсон, Ж. Гобер (BE), заявитель ЮЦБ С.A. (BE). - №94008618/04 ; заявл. 14.03.1994 ; опубл. 27.08.1998. - Режим доступа: www.fips.ru. 4. Пат. 20070652092 US, МПК7 А61К31/495. Enantiomers of l[(4-chloro-phenyl)phenylmethyl]-4[(4-methylphenyl)sulfonyl]piperazine [Electronicresourse] / E. Cossement, G. Bodson, J. Gobert (BE). - №2007142400 ; заявл. 11.01.2007 ; опубл. 21.06.2007. Режим доступа: http://ep.espacenet.com. 5. Pharmacokinetics and tissue distribution of a novel PDE5 inhibitor, SK- 3530, in rats [Text] / H.H. Yoo , N.S. Kim , G.J. Im, D.H. Kim // Acta Pharmacol. Sin. - 2007. - Vol. 28, N8. - P.1247-1253. 6. Metabolism and excretion of 5-ethyl-2-{5-[4-(2hydroxyethyl)piperazine-l-sulfonyl]-2-propoxyphenyl}7-propyl-3,5-dihydropyrrolo[3,2-d]-pyrimidin-4-one (SK3530) in rats [Text] / J. Lee [et al.] // Rapid Commun. Mass Spectrom. - 2007. - Vol.21, N7. P.1139-1149. 7. Aminomethylpiperazines as selective urotensin antagonists [Text] / M. Hil-fiker [et al.] // Bioorg. Med. Chem. Lett. - 2008. - Vol. 18. - P. 4470-4473. 8. Discovery and Initial SAR of Arylsulfonylpiperazine Inhibitors of 110Hydroxysteroid Dehydrogenase Type 1 (llb-HSDl) [Text] / D. Sun [et al.] // Bioorg. Med. Chem. Lett. 2008. - Vol.18. - P.35113-3516. 9. 11 -HSD1 inhibition ameliorates metabolic syndrome and prevents progression of atherosclerosis in mice [Text] / A. HermanowskiVosatka [etal.] // J. Exp. Med. - 2005. - Vol.202, N4. P.517-527. 10. 2-(S)-Phenethylaminothiazolones as Potent, Orally Efficacious Inhibitors of 11 (3-Hydroxysteriod Dehydrogenase Type 1 [Text] / S. Jean [et al.] // J. Med. Chem. - 2007. - Vol.50, N3. - P.429-432. 11. Johnson, A.R. Slow-binding inhibition of human prostaglandin endopero-xide synthase-2 with darbufelone, an isoform-selective antiinflammatory ditert-butyl phenol [Text] / A.R. Johnson , M.A. Marietta , R.D. Dyer //Biochemistry. - 2001. - Vol.40, N25. P.7736-7745. 12. Synthesis and biological evaluation of 5-[[3,5bis(l,l-dimethylethyl)-4-hydroxyphenyl]methylene]oxazoles, -thiazoles, and imidazoles: novel dual 5-lipoxygenase and cyclooxygenase inhibitors with antiinflammatory activity[Text] / P.С. Unangst [et al.] // J. Med. Chem. 1994. - Vol.37, N2. - P.322-328. 13. Synthesis of thiazolone-based sulfonamides as inhibitors of HCV NS5Bpolymerase [Text] / Y. Ding 9 49783 [et al.] // Bioorg. Med. Chem. Lett. - 2007. -Vol.17.P.841-845. 14. Selective small-molecule inhibitor reveals critical mitotic functions of human CDK1 [Text] / L.T. Vassilev [et al.] // Proc. Nation. Acad. Sci. USA. 2006. - Vol.103, N28. - P.10660-10665. 15. Synthesis of novel thiazolone-based compounds containing pyrazoline moiety and evaluation of their anticancer activity [Text] / D. Havrylyuk [etal.] // Eur. J. Med. Chem. - 2009. Vol.44. - P.1396-1404. 16. A practical access to novel 2-amino-5arylidene-l,3-thiazol-4(5//)-ones viasulfur/nitrogen displacement under solvent-free microwave irradiation [Text] / K. Bourahla [et al.] // Tetrahedron Letters. - 2007. - Vol.48, N33. P.5785-5789. 17. Design and synthesis of thiazole-5hydroxamic acids as novel histonedeacetylase Комп’ютерна верстка О. Рябко 10 inhibitors [Text] / S. -K. Anandan [et al.] // Bioorg. Med. Chem.Lett. - 2007. - Vol.17. - P.5995-5999. 18. Lesyk, R. 4-Thiazolidones: centenarian history, current status and perspectives for modern organic and medicinal chemistry [Text] / R. Lesyk, B. Zi-menkovsky // Cur. Org. Chem. - 2004. - Vol.8, N16. - P.1547-1577. 19. Microwave induced synthesis of the thiazolidine-2,4-dione. Motif and the efficient solvent free-solid phase parallel syntheses of 5-benzylidenethiazolidine-2,4-dione and 5-benzylidene-2-thioxothiazolidine-4-one compounds [Text] / B. R. P. Kumar [et al.] // J. Heterocyclic Chem. - 2006.-Vol.43.-P.897903. 20. Lespagnol, A. Recherches dans la serie des sulfonadides [Text] / A. Lespagnol, Ch. Lespagnol, B. Willecomme // С R. Hebd. Seances Acad. Sci. Ser. С - 1967. - Vol.264. -P.1715-1716. Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of 2-(4-sulfonylpiperazine-1-yl)-1,3-thiazoline-4(5h)-one derivatives
Автори англійськоюVakula Volodymyr Mykolaiovych, Karpova Tetiana Oleksiivna, Taidakov Illia Viktorovych, Uhrak Bohdan Ivanovych, Yaremenko Fedir Heorhiiovych
Назва патенту російськоюСпособ получения производных 2-(4-сульфонилпиперазин-1-ил)-1,3-тиазолин-4(5н)-она
Автори російськоюВакула Владимир Николаевич, Карпова Татьяна Алексеевна, Тайдаков Илья Викторович, Уграк Богдан Иванович, Яременко Федор Георгиевич
МПК / Мітки
МПК: C07D 295/00
Мітки: похідних, одержання, спосіб, 2-(4-сульфонілпіперазин-1-іл)-1,3-тіазолін-4(5н)-ону
Код посилання
<a href="https://ua.patents.su/5-49783-sposib-oderzhannya-pokhidnikh-2-4-sulfonilpiperazin-1-il-13-tiazolin-45n-onu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання похідних 2-(4-сульфонілпіперазин-1-іл)-1,3-тіазолін-4(5н)-ону</a>
Попередній патент: Спосіб лікування хворих зі злоякісними пухлинами головного мозку
Наступний патент: Спосіб синтезу фталоціанінів заліза (іі)
Випадковий патент: Пристрій для дилатації стенозів трубчастих органів