Спосіб одержання 2-оксо-n-арил-1,2,3,4-тетрагідропіримідо [1,2-а]бензімідазол-4-карбоксамідів
Номер патенту: 59601
Опубліковано: 25.05.2011
Автори: Афанасіаді Людмила Михайлівна, Комихов Сергій Олександрович, Руденко Роман Володимирович, Десенко Сергій Михайлович
Формула / Реферат
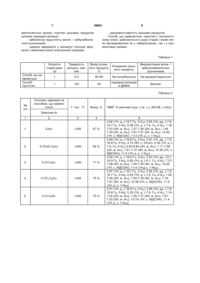
Спосіб одержання 2-оксо-N-арил-1,2,3,4-тетрагідропіримідо[1,2-а]бензімідазол-4-карбоксамідів загальної формули
що включає конденсацію рівномолярних кількостей 2-амінобенімідазолу і малеіміду в органічному розчиннику при кипінні, який відрізняється тим, що в якості малеіміду використовують відповідні заміщенні малеіміди формули , як органічний розчинник використовують N,N-диметилформамід, реакцію конденсації ведуть протягом 2-5 хвилин, а кінцевий продукт виділяють розтиранням з етанолом.
Текст
Спосіб одержання 2-оксо-N-арил-1,2,3,4тетрагідропіримідо[1,2-а]бензімідазол-4карбоксамідів загальної формули Ar N N N H O Ar O N O диметилформамід, реакцію конденсації ведуть протягом 2-5 хвилин, а кінцевий продукт виділяють розтиранням з етанолом. H N O Ar N N N H I O а]бензімідазол-4-карбоксамідів загальної формули І (19) Корисна модель відноситься до області органічної хімії і являє собою спосіб одержання 2-оксоN-арил-1,2,3,4-тетрагідропіримідо[1,2 UA (11) малеіміди формули , як органічний розчинник використовують N,N (13) тим, що в якості малеіміду використовують відповідні заміщенні 59601 що включає конденсацію рівномолярних кількостей 2-амінобенімідазолу і малеіміду в органічному розчиннику при кипінні, який відрізняється U I 3 59601 Ці сполуки - складні азотовмісні речовини, що виконують важливу роль у біоенергетиці людського організму. Наявність двох фармакофорних фрагментів - бензімідазольного і піримідинового - обумовлює перспективність пошуку у низці сполук формули І речовин з різними видами біологічної активності і розробки простих способів їх одержання. До фармакофорних груп, введення яких в молекули потенційних лікарських препаратів надає їм певну біологічну активність, відносять карбоксамідну групу. Введення цієї групи сприяє виявленню снотворного ефекту [А.Т. Солдатенков и др. "Основы органической химии лекарственных веществ", Изд. "БИНОМ", Лаборатория знаний, Москва, 2007]. Піримідиновий фрагмент входить складовою частиною у різні біологічні добавки, знаходить застосування у складі багатьох лікарських препаратів [G. Yang, R. Lu et.al., J. Chem. 18, 435 (2000); Т. Yacuda, Т. Iwamoto et al., Jap. J. Pharmacol, 79, 65 (1999)]. Відомий спосіб одержання структурного аналога 4-феніл-1,2,3,4-тетрагідропіримідо[1,2а]бензімідазол-2-ону формули II [Nawrocka W., Polich J. Chem., 69, № 8, 1158 (1995)]. Ph N N N H O II Спосіб одержання аналога складається із однієї стадії і здійснюється за схемою: Ph NH N NH2 Ph + O OH N N N H O Суміш 1Н-бензімідазол-2-аміну і коричної кислоти у рівномолярних співвідношеннях нагрівають при температурі 150-170 °С упродовж 4 годин. Одержують 4-феніл-1,2,3,4-тетрагідропіримідо[1,2а]бензімідазол-2-он з виходом 70 %. Недоліком відомого способу є тривалий процес - 4 години. У відсутності розчинника реакція проходить, напевне, при сплавленні усіх компонентів при температурі 150-170 °С, яка перевищує температури топлення вихідних речовин. Цей процес завжди супроводжується утворенням смолистих продуктів, які забруднюють цільові продукти реакції і знижують їх якість. Це також являється недоліком відомого способу одержання структурного аналога формули II. Відомий спосіб одержання N-(4метоксифеніл)-2-оксо-1,2,3,4тетрагідропіримідо[1,2-а]бензімідазол-4карбоксаміду загальної формули III [Ю.А. Ковыгин и др., Химия гетероцикл. соедин., № 9, 1404 (2004)]. 4 H N O N N O N H O III Спосіб одержання одностадійний і реалізується за схемою: O H N O NH N NH2 + O N N O N O N H O III Суміш N-(4-метоксифеніл)-малеіміду і 2амінобензімідазолу у діоксані кип'ятять 2 години. Продукт, що випав, відфільтровують, промивають ацетоном, перекристалізовують із N,Nдиметилформаміду (ДМФА). Вихід N-(4метоксифеніл)-2-оксо-1,2,3,4тетрагідропіримідо[1,2-а]бензімідазол-4карбоксаміду складає 64 %. Т. топлення. > 300 °С. Недоліком відомого способу є тривалий процес, пов'язаний із застосуванням горючого, вибухонебезпечного розчинника - діоксану. При контакті з повітрям він утворює пероксиди, які перед застосуванням діоксану необхідно видаляти, наприклад, сульфатом заліза (II) або хлоридом стануму (II), щоб уникнути вибуху. Одержаний N-(4метоксифеніл)-2-оксо-1,2,3,4тетрагідропіримідо[1,2-а]бензімідазол-4карбоксамід потребує очистки шляхом перекристалізації із ДМФА, що не тільки подовжує процес його одержання, але і збільшує енерго- і ресурсозатрати способу. Авторами джерела інформації описаний лише один продукт із виходом 64 %, тому казати про стабільність високих виходів реакції неможливо. При відтворюванні нами методики відомого способу одержання вказаний авторами вихід продукту не підтверджується і сягає лише 40 %. Спосіб одержання сполук формули III обрано нами за прототип як найближчий за технічною суттю. В основу корисної моделі поставлено задачу розробки простого способу одержання 2-окco-Napил-1,2,3,4-тетрагідропіримідо[1,2а]бензімідазол-4-карбоксамідів, загальної формули І, у якому за рахунок зміни умов синтезу (використання вогне- та вибухобезпечного розчинника) можна спростити процес, зменшити його тривалість, витрати розчинника, підвищити якість і вихід кінцевих продуктів. Рішення поставленої задачі забезпечується тим, що у способі одержання 2-оксо-N-арил1,2,3,4-тетрагідропіримідо[1,2-а]бензімідазол-4карбоксамідів, що включає конденсацію рівномолярних кількостей 2-амінобенімідазолу та малеіміду в органічному розчиннику при кипінні, згідно корисної моделі, в якості малеіміду використову 5 ють O відповідні Ar N заміщенні 59601 малеiміди формули O , як органічний розчинник використовують N,N-диметилформамід, реакцію конденсації ведуть протягом 2-5 хвилин, а кінцевий продукт виділяють розтиранням з етанолом. Хімічну структуру сполук формули І за цим способом легко модифікувати, використовуючи різні заміщенні малеiміди. Це дає можливість розширювати асортимент перспективних речовин даної структури з різними біологічними активностями. Вибір в якості середовища для реакції ДМФА обумовлений не тільки тим, що він вогнебезпечний і не вибухає при нагріванні, але і високою температурою кипіння (Ткип=153 °С) у порівнянні з діок 6 саном (Ткип=101 °С). Це сприяє прискореному протіканню хімічної реакції, що, в свою чергу, приводить до значного зменшення часу синтезу до 2-5 хвилин. Висококиплячий, полярний, основний розчинник сприяє прискореному процесу рециклізації, що призводить до значного підвищення виходів цільових продуктів. Крім того, виключається процес очистки кінцевих продуктів. В зв'язку з цим, основні продукти піримідинобензімідазоли вже в процесі синтезу одержують достатньо чистими і не потребують додаткових перекристалізацій. Таким чином, виключаються додаткові витрати органічних розчинників для очистки цільових продуктів, здешевлюється їх вартість. Вихід кінцевих продуктів складає 65-80 %. У способі, що заявляється, цільові продукти одержують одно стадійним методом за схемою: Ar O Ar NH N NH2 O N NH ДМФА N O Суміш 2-амінобензімідазолу і відповідного малеіміду у рівномолярному співвідношенні розчиняють у ДМФА і кип'ятять 2-5 хвилин до тих пір, поки реакційна маса не закристалізується. Після охолодження масу розтирають з етанолом, відфільтровують і сушать. Отримують відповідний 2оксо-N-арил-1,2,3,4-тетрагідропіримідо[1,2а]бензімідазол-4-карбоксамід. У таблиці 1 наведено порівняльні характеристики способу, що заявляється і способу-прототипу. У таблиці 2 дано характеристики сполук, які одержано за способом, що заявляється (температури топлення, виходи цільових продуктів і їх спек1 три Н ЯМР). Приклад 1. Одержання 2-оксо-N-феніл-1,2,3,4тетрагідро-піримідо[1,2-а]бензімідазол-4карбоксаміду. Суміш 0,54 г (3 ммоль) N-фенілмалеіміду і 0,4 г (3 ммоль) 2-амінобензімідазолу у 1 мл ДМФА нагрівають до кипіння і кип'ятять 2 хвилини до тих пір, поки реакційна суміш не закристалізується. Після охолодження масу розтирають з етанолом, відфільтровують, сушать. Вихід продукту складає 0,63 г (67 %). Температура топлення більше 300 1 °С. Спектр Н ЯМР (ДМСО-d6) (м.ч.), КССВ J (Гц): 2.92 (1H, д, J 16.7 Гц, 3-На), 3.50 (1H, дд, J 7.8, 16.7 Гц, 3-Hb), 5.38 (1Н, д, J 7.8, Гц, 4-Нх), 7.18-7.03 (3Н, м, АrH), 7.37-7.26 (2Н, м, АrH), 7.49-7.39 (2Н, м, АrH), 7.61-7.51 (2Н, м, АrH), 10.63 (1Н, с, NHCOAr), 11.5 (1Н, p. c, 1-HNH); Приклад 2. Одержання 2-оксо-N-(2хлорфеніл)-1,2,3,4-тетрагідро-піримідо[1,2а]бензімідазол-4-карбоксаміду. N N H O I Реакцію проводять аналогічно прикладу 1. Для реакції беруть: 0,63 г (3 ммоль) N(2-хлорфеніл)малеіміду і 0,4 г (3 ммоль) 2-амінобензімідазолу. Вихід продукту складає 0,79 г (77 %). Температура топлення більше 300 °С. 1 Спектр Н ЯМР (ДМСО-d6) (м.ч.), КССВ J (Гц): 2.92 (1Н, д, J 16.9 Гц, 3-На), 3.52 (1Н, дд, J 8.1, 16.9 Гц, 3-Hb), 5.60 (1Н, д, J 8.1, Гц, 4-Нх), 7.377.08 (4Н, м, АrH), 7.64-7.40 (4Н, м, АrH), 10.25 (1H, с, NHCOAr), 11.4 (1Н, p. c, 1-HNH). Приклад 3. Одержання 2-оксо-N-(2метоксифеніл)-1,2,3,4-тетрагідро-піримідо[1,2а]бензімідазол-4-карбоксаміду. Реакцію проводять аналогічно прикладу 1. Для реакції беруть: 0,61 г (3 ммоль) N-(2метоксифеніл)-малеіміду і 0,4 г (3 ммоль) 2амінобензімідазолу. Вихід продукту складає 0,79 г (78 %). Температура топлення більше 300 °С. 1 Спектр Н ЯМР (ДМСО-d6) (м.ч.), КССВ J (Гц): 2.84 (1H, д, J 17.2 Гц, 3-На), 3.48 (1Н, дд, J 8.4, 17.2 Гц, 3-Hb), 3.85 (3Н, с, СН3О), 5.69 (1Н, д, J 7.8, Гц, 4-Нх), 6.86-7.80 (8Н, м, АrH), 9.9 (1Н, с, NHCOAr), 11.4 (1Н, р. с, 1-HNH). Решту прикладів наведено у таблиці 2. Дані таблиць 1, 2 і опис корисної моделі показують, що спосіб, який заявляється, має низку суттєвих переваг у порівнянні зі способом-прототипом і дозволяє: - значно зменшити тривалість процесу одержання до 2-5 хвилин (за прототипом 120 хвилин); - підвищити вихід і якість кінцевих продуктів до 65-80 % (за прототипом 64 %); - за рахунок використання висококиплячого основного розчинника -N,N-диметилформаміду 7 59601 виключається процес очистки цільових продуктів шляхом перекристалізації; - забезпечує відсутність вогне- і вибухобезпечних розчинників; - широко варіювати у молекулі сполуки формули І замісники різної електронної природи; 8 - здешевити вартість цільових продуктів. Спосіб, що заявляється, простий у технологічному плані, здійснюється в одну стадію і може легко відтворюватися як у лабораторних, так і у промислових умовах. Таблиця 1 Кількість стадій реакції Тривалість процесу, хвилин 1 2-5 1 120 Спосіб, що заявляється Спосібпрототип Вихід основОчищення цільоного продукту, вого продукту % Використання вогне- і вибухонебезпечних розчинників 65-80 Не потребується Не використовуються 64 перекристалізація із ДМФА Діоксан Таблиця 2 № п/п Сполуки, одержані за способом, що заявляється Т. топ., °С Вихід, % ЯМР Н хімічний зсув, (м. ч.), (КССВ, J (Hz)) 5 2.92 (1Н, д, J 16.7 Гц, 3-На), 3.50 (1Н, дд, J 7.8, 16.7 Гц, 3-Hb), 5.38 (1Н, д, J 7.8, Гц, 4-Нх), 7.187.03 (3Н, м, АrH), 7.37-7.26 (2Н, м, АrH), 7.497.39 (2Н, м, АrH), 7.61-7.51 (2Н, м, АrH), 10.63 (1Н, с, NHCOAr), 11.5 (1Н, р. с, 1-HNH); 2.89 (1Н, д, J 16.8 Гц, 3-На), 3.47 (1Н, дд, J 7.8, 16.8 Гц, 3-Hb), 3.72 (3Н, с, СН3О), 5.34 (1H, д, J 7.8, Гц, 4-Нх), 6.92-6.84 (2Н, м, АrH), 7.17-7.08 (2Н, м, АrH), 7.51-7.37 (4Н, м, АrH), 10.36 (1Н, с, NHCOAr), 11.4 (1Н, р. с, 1-HNH) 2.92 (1Н, д, J 16.9 Гц, 3-На), 3.52 (1Н, дд, J 8.1, 16.9 Гц, 3-Hb), 5.60 (1Н, д, J 8.1, Гц, 4-Нх), 7.377.08 (4Н, м, АrH), 7.64-7.40 (4Н, м, АrH), 10.25 (1Н, с, NHCOAr), 11.4 (1Н,р.с, 1-HNH) 2.87 (1Н, д, J 16.7 Гц, 3-На), 3.56 (1Н, дд, J 7.9, 16.7 Гц, 3-Нb), 5.53 (1Н, д, J 7.8, Гц, 4-Нх), 7.227.08 (2Н, м, АrH), 7.54-7.35 (4Н, м, АrH), 7.797.61 (2Н, м, АrH), 10.36 (1Н, с, NHCOAr), 11.5 (1Н, р. с, 1-НNH) 2.91 (1H, д, J 16.8 Гц, 3-На), 3.49 (1Н, дд, J 7.8, 16.8 Гц, 3-Нb), 5.35 (1Н, д, J 7.8, Гц, 4-Нх), 7.147.05 (2Н, м, АrH), 7.45-7.31 (4Н, м, АrH), 7.617.52 (2Н, м, АrH), 10.74 (1Н, с, NHCOAr), 11.4 (1Н, р. с, 1-HNH) 1 Замісник Аr 1 2 3 4 1. С6Н5 >300 67 % 2. 4-СН3О-С6Н4 >300 66 % 3. 2-Сl-СбН4 >300 77 % 4. 2-CF3-C6H4 >300 75 % 5. 4-Сl-С6Н4 >300 70 % 9 59601 10 Продовження таблиці 2 1 2 3 4 6. 2,4-ді-СН3-С6Н4 >300 65 % 7. 4-СООН-С6Н4 >300 72 % 8. 2,4-ді-СН3О-С6Н3 >300 65 % 9. 3-CF3-C6H4 >300 73 % 10. 2-СН3О-С6Н4 >300 78 % 11. 3,5-ді-СН3О-С6Н3 >300 65 % 12. 4-Cl-3-F-C6H3 >300 78 % 13. 2,4-ді-С1-С6Н3 >300 80 % Комп’ютерна верстка І.Скворцова 5 2.07 (3Н, с, СН3), 2.22 (3Н, с, СН3), 2.91 (1Н, д, J 17.2 Гц, 3-На), 3.52 (1Н, дд, J 8.2, 17.2 Гц, 3Нb), 5.47 (1Н, д, J 8.2, Гц, 4-Нх), 7.22-6.9 (5Н, м, АrH), 7.54-7.37 (2Н, м, АrH), 9.93 (1Н, с, NHCOAr), 11.5 (1Н, р.с, 1-HNH) 2.95 (1Н, д, J 17.0 Гц, 3-На), 3.51 (1Н, дд, J 8.1, 17.0 Гц, 3-Нb), 5.41 (1Н, д, J 8.1, Гц, 4-Нх), 7.15-7.07 (2Н, м, АrH), 7.46-7.38 (2Н, м, АrH), 7.68-7.63 (2Н, м, АrH), 7.90-7.85 (2Н, м, АrH), 10.92 (1Н, с, NHCOAr), 12.0 (2Н, р. с, 1HNH+COOH) 2.81 (1Н, д, J 16.5 Гц, 3-На), 3.47 (1Н, дд, J 8.1, 16.5 Гц, 3-Hb), 3.72 (3Н, с, СН3О), 3.82 (3Н, с, СН3О), 5.60 (1Н, д, J 8.1, Гц, 4-Нх), 6.40-7.60 (7Н, м, АrH), 9.77 (1H, с, NHCOAr), 11.5 (1Н, р. с, 1-HNH) 2.98 (1Н, д, J 17.2 Гц, 3-На), 3.53 (1Н, дд, J 8.4, 17.2 Гц, 3-Нb), 5.40 (1Н, д, J 8.4, Гц, 4-Нх), 7.12-8.03 (8Н, м, АrH), 10.98 (1H, с, NHCOAr), 11.58 (1Н, р. с, 1-HNH) 2.84 (1Н, д, J 17.2 Гц, 3-На), 3.48 (1Н, дд, J 8.4, 17.2 Гц, 3-Нb), 3.85 (3Н, с, СН3О), 5.69 (1Н, д, J 7.8, Гц, 4-Нх), 6.86-7.80 (8Н, м, АrH), 9.9 (1H, с, NHCOAr), 11.4 (1Н, р. с, 1-HNH) 2.90 (1Н, д, J 16.5 Гц, 3-На), 3.53 (1Н, дд, J 7.9, 16.5 Гц, 3-Нb), 3.69 (6Н, с, 2*СН3О), 3.82 (3Н, с, СН3О), 5.35 (1Н, д, J 7.9, Гц, 4-Нх), 6.24-7.43 (7Н, м, АrH), 10.61 (1Н, с, NHCOAr), 11.55 (1Н, р. с, 1-HNH) 2.94 (1Н, д, J 17.2 Гц, 3-На), 3.52 (1Н, дд, J 7.9, 17.2 Гц, 3-Нb), 5.36 (1Н, д, J 7.9, Гц, 4-Нх), 7.12-7.85 (7Н, м, АrH), 10.86 (1Н, с, NHCOAr), 11.55 (1Н, р. с, 1-HNH) 2.93 (1Н, д, J 16.8 Гц, 3-На), 3.54 (1Н, дд, J 8.0, 16.8 Гц, 3-Нb), 5.60 (1Н, д, J 8.0, Гц, 4-Нх), 7.12-7.70 (7Н, м, АrH), 10.38 (1H, с, NHCOAr), 11.56 (1Н, р. с, 1-HNH) Підписне Тираж 24 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of 2-oxo-n-aryl-1,2,3,4-tetrahydropyrimido[1,2-a] benzimidazole-4-carboxamides
Автори англійськоюRudenko Roman Volodymyrovych, Komikhov Serhii Oleksandrovych, Desenko Serhii Mykhailovych, Afanasiadi Liudmyla Mykhailivna
Назва патенту російськоюСпособ получения 2-оксо-n-арил-1,2,3,4-тетрагидропиримидо [1,2-а]бензимидазол-4-карбоксамидов
Автори російськоюРуденко Роман Владимирович, Комихов Сергей Александрович, Десенко Сергей Михайлович, Афанасиади Людмила Михайловна
МПК / Мітки
МПК: C07B 43/00, C07B 41/00
Мітки: 1,2-а]бензімідазол-4-карбоксамідів, спосіб, одержання, 2-оксо-n-арил-1,2,3,4-тетрагідропіримідо
Код посилання
<a href="https://ua.patents.su/5-59601-sposib-oderzhannya-2-okso-n-aril-1234-tetragidropirimido-12-abenzimidazol-4-karboksamidiv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 2-оксо-n-арил-1,2,3,4-тетрагідропіримідо [1,2-а]бензімідазол-4-карбоксамідів</a>
Попередній патент: Спосіб безціликової охорони пластових виробок на крутопохилому заляганні вугільних пластів
Наступний патент: Спосіб профілактики печінкової недостатності у хворих на гострий біліарний панкреатит
Випадковий патент: Стабільний розчин об'єднаних баклофену, сорбіту і налтрексону для перорального застосування