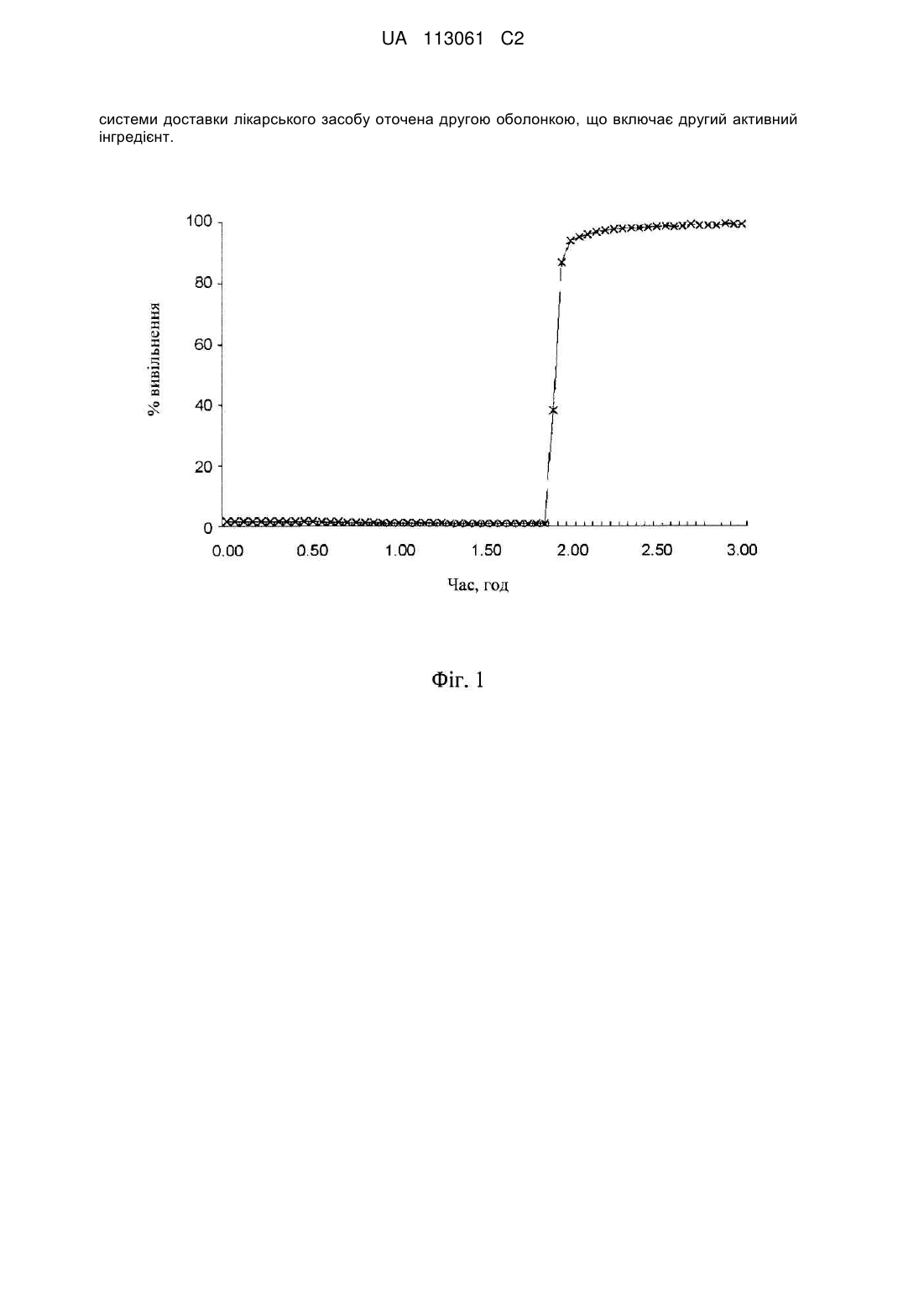
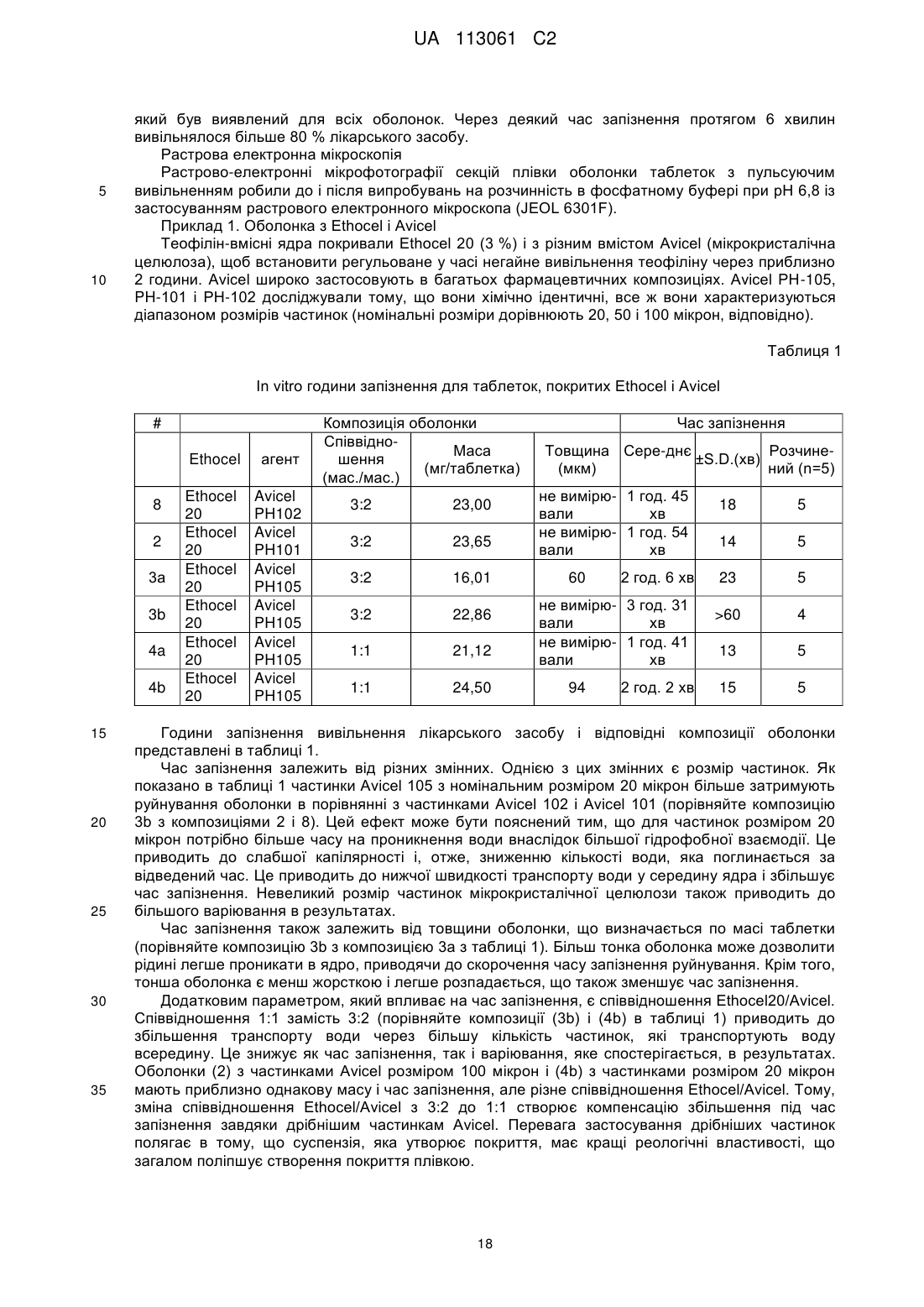
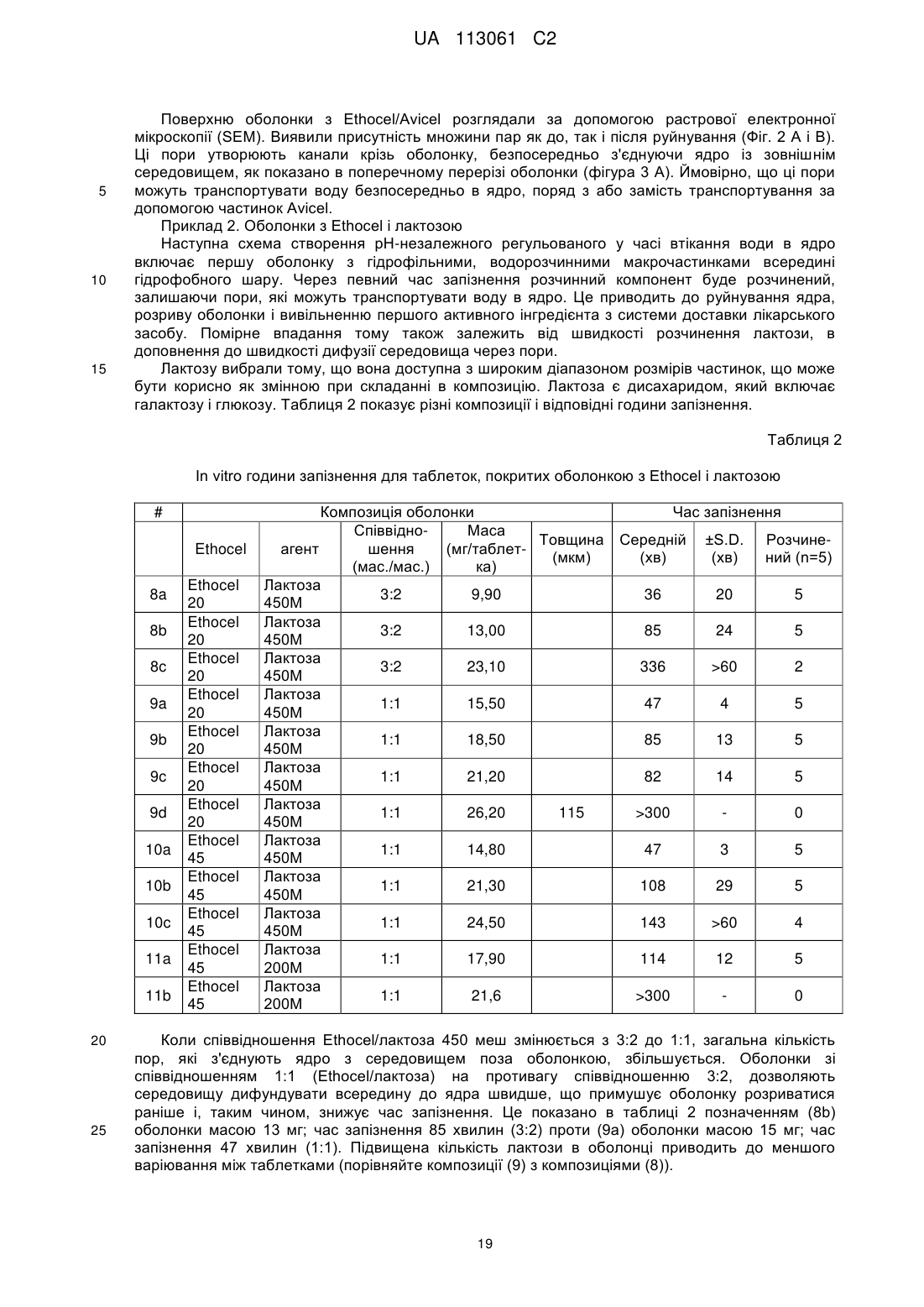
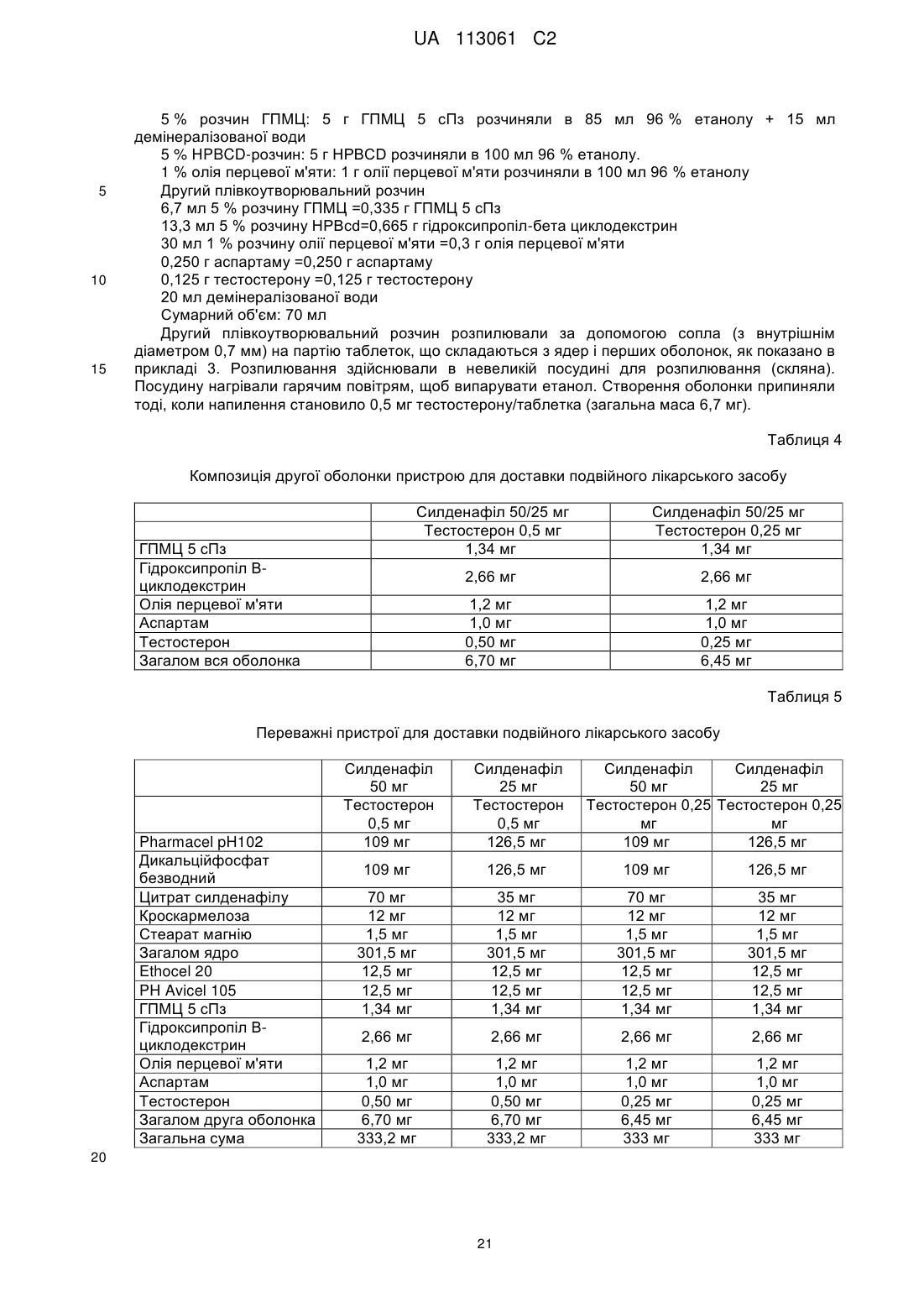
Система доставки лікарського засобу
Номер патенту: 113061
Опубліковано: 12.12.2016
Автори: Блумерс Йоханнес Мартінус Марія, де Лееде Леонардус Герардус Йозеф, Фрейлінк Хендерік Віллем, Ейссенс Анко Корнелус
Формула / Реферат
1. Регульована у часі система доставки лікарського засобу з негайним вивільненням для перорального введення першого активного інгредієнта пацієнту, який потребує цього, яка включає:
ядро, що включає 10-60 мас.% мікрокристалічної целюлози, 20-70 мас.% наповнювача, вибраного з органічної і/або неорганічної солі, і 0,1-30 мас.% першого активного інгредієнта, і
першу оболонку, яка оточує ядро, що включає етилцелюлозу як гідрофобний полімер і мікрокристалічну целюлозу як гідрофільну речовину, де вагове співвідношення гідрофобного полімеру і гідрофільної речовини складає від 1:5 до 5:1.
2. Система за пунктом 1, в якій вказаний наповнювач являє собою неорганічну сіль.
3. Система за будь-яким з пунктів 1-2, в якій вказана неорганічна сіль являє собою безводний двоосновний фосфат кальцію або дигідрат сульфату кальцію.
4. Система за будь-яким з пунктів 1-3, в якій вказана система доставки являє собою таблетку.
5. Система за будь-яким з попередніх пунктів, в якій вказане ядро додатково включає нерозчинний у воді гелеутворювальний дезінтегрант, що включає поперечнозшиту натрію карбоксиметилцелюлозу, натрію крохмальгліколят і/або поперечнозшитий полівінілпіролідон.
6. Система за будь-яким з попередніх пунктів, в якій ядро включає поперечнозшиту натрію карбоксиметилцелюлозу, і де вказана поперечнозшита натрію карбоксиметилцелюлоза присутня в кількості не більше ніж 6 мас.% від загальної маси ядра.
7. Система за будь-яким з попередніх пунктів, в якій перший активний інгредієнт вибраний з групи, яка складається з інгібітора PDE5, агоніста рецептора 5НТ1а і інгібітора нейтральної ендопептидази.
8. Система за пунктом 7, в якій інгібітор PDE5 включає силденафіл.
9. Система за пунктом 7, в якій агоніст рецептора 5НТ1а включає буспірон.
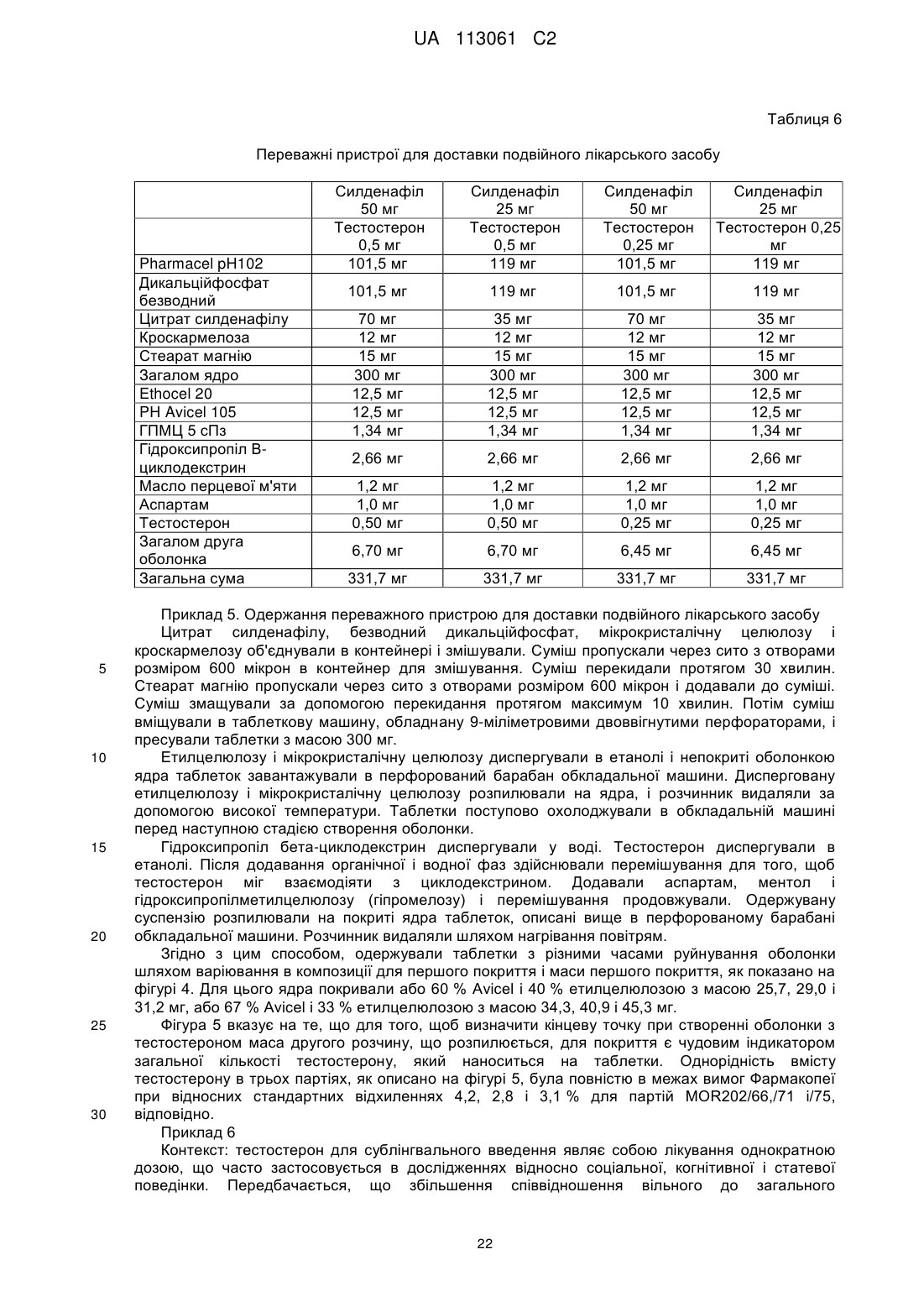
10. Пристрій для доставки подвійного лікарського засобу, що включає регульовану у часі з негайним вивільненням систему доставки лікарського засобу за будь-яким з пунктів 1-9, в якій перша оболонка системи доставки лікарського засобу оточена другою оболонкою, що включає другий активний інгредієнт.
11. Пристрій за пунктом 10, в якому друга оболонка включає гідроксипропілметилцелюлозу.
12. Пристрій за пунктом 10 або пунктом 11, в якому друга оболонка забезпечує негайну доставку другого активного інгредієнта у роті.
13. Пристрій за будь-яким з пунктів 10-12, в якому другий активний інгредієнт являє собою тестостерон або функціональний аналог тестостерону.
14. Пристрій за будь-яким з пунктів 10-13, в якому друга оболонка включає циклодекстрин або похідну сполуку або їх полімер.
15. Пристрій за будь-яким з пунктів 10-14, в якому друга оболонка додатково включає ароматизуючу сполуку.
16. Пристрій за пунктом 15, в якому наявність аромату вказує на те, що пристрій необхідно тримати у роті.
17. Пристрій за будь-яким з пунктів 10-16, в якому зовнішня поверхня другої оболонки є більш грубою, ніж зовнішня поверхня першої оболонки.
18. Пристрій за будь-яким з пунктів 10-17 для застосування в лікуванні у чоловіків або жінок сексуальної дисфункції, відсутності бажання або еректильної дисфункції і, переважно, для застосування при лікуванні зниженого статевого потягу.
19. Пристрій для доставки подвійного лікарського засобу за будь-яким з пунктів 10-18, де ядро включає:
між 100 мг і 150 мг мікрокристалічної целюлози з нормальним розміром частинок 100 мікрон і вологістю від 3,0 до 5,0 %;
між 100 мг і 150 мг дикальційфосфату безводного;
між 25 мг і 100 мг силденафілцитрату;
між 10 мг і 20 мг кроскармелози;
між 1 мг і 2 мг стеарату магнію;
перша оболонка включає:
між 5 мг і 20 мг етилцелюлози 20 сПз;
між 5 мг і 20 мг мікрокристалічної целюлози з номінальним розміром частинок приблизно 20 мікрон і вологістю менше ніж 5,0 %;
друга оболонка включає:
між 1 мг і 2 мг ГПМЦ 5 сПз;
між 2 мг і 3,5 мг гідроксипропіл В-циклодекстрину; і
між 0,1 мг і 1 мг тестостерону.
20. Пристрій для доставки подвійного лікарського засобу за будь-яким з пунктів 10-18, де ядро включає:
між 50 мг і 150 мг мікрокристалічної целюлози з номінальним розміром частинок 180 мікрон і вологістю менше ніж 1,5 %;
між 150 мг і 250 мг дигідрату сульфату кальцію;
між 1 мг і 20 мг Буспіронгідрохлориду;
між 10 мг і 20 мг кроскармелози;
між 1 мг і 10 мг стеарату магнію;
перша оболонка включає:
між 5 мг і 20 мг етилцелюлози 20 сПз;
між 10 мг і 50 мг мікрокристалічної целюлози з нормальним розміром частинок приблизно 20 мікрон і вологістю менше ніж 5 %;
друга оболонка включає:
між 1 мг і 2 мг ГПМЦ 5 сПз;
між 2 мг і 3,5 мг гідроксипропіл В-циклодекстрину; і
між 0,1 мг і 1 мг тестостерону.
21. Пристрій для доставки подвійного лікарського засобу за пунктом 19 або 20, в якому друга оболонка додатково включає між 1 мг і 2 мг олії перцевої м'яти і між 0,5 мг і 1,5 мг аспартаму.
22. Пристрій для доставки подвійного лікарського засобу, що включає регульовану в часі систему доставки лікарського засобу з негайним вивільненням за п. 1, де система включає ядро, що містить 20-50 мас.% мікрокристалічної целюлози від загальної маси ядра з номінальним розміром частинок 100 мікрон і вологістю від 3,0 до 5,0 %;
20-70 мас.% дигідрату сульфату кальцію або дикальційфосфату безводного від загальної маси ядра як наповнювача;
0,1-30 мас.% інгібітора фосфодіестерази 5 (PDE5) або агоніста рецептора 1А 5-гідрокситриптаміну (5НТ1Аrа) від загальної маси ядра;
карбоксиметилцелюлозу, де карбоксиметилцелюлоза присутня в кількості не більше 6 мас.% від загальної маси ядра;
0,5-5 мас.% стеарату магнію від загальної маси ядра;
першу оболонку, що оточує ядро, де вказана перша оболонка включає етилцелюлозу як гідрофобний полімер і мікрокристалічну целюлозу, що має номінальний розмір частинок приблизно 20 мікрон і вологість менше 5,0 %, як гідрофільну речовину; де масове відношення гідрофобного полімеру і гідрофільної речовини становить від 1:5 до 5:1;
де перша оболонка оточена другою оболонкою, що включає 1-30 мас.% гідроксипропілметилцелюлози від загальної маси другої оболонки, 5-50 мас.% гідроксипропіл-бета-циклодекстрину від загальної маси другої оболонки і 0,5-10 мас.% тестостерону як другого активного інгредієнта від загальної маси другої оболонки.
23. Пристрій за пунктом 22, де масове співвідношення гідрофобного полімеру і гідрофільної речовини становить від 1:3 до 2:1.
24. Пристрій за пунктом 22 або 23, де мікрокристалічна целюлоза з номінальним розміром частинок 100 мікрон і вологістю від 3,0 до 5,0 % присутня в кількості 30-50 мас.% від загальної маси ядра.
Текст
Реферат: Винахід стосується регульованої у часі системи доставки лікарського засобу з негайним вивільненням для перорального введення першого активного інгредієнта пацієнту, який цього потребує; пристрою для доставки подвійного лікарського засобу, що включає таку регульовану у часі з негайним вивільненням систему доставки лікарського засобу, в якій перша оболонка UA 113061 C2 (12) UA 113061 C2 системи доставки лікарського засобу оточена другою оболонкою, що включає другий активний інгредієнт. UA 113061 C2 5 10 15 20 25 30 35 40 45 50 55 СИСТЕМА ДОСТАВКИ ЛІКАРСЬКОГО ЗАСОБУ Даний винахід стосується галузі складання лікарського засобу і доставки лікарського засобу. Конкретніше, даний винахід стосується регульованої у часі, з негайним вивільненням системи доставки лікарського засобу. Даний винахід додатково стосується пристрою для доставки подвійного лікарського засобу, що включає регульовану у часі, з негайним вивільненням систему доставки лікарського засобу для регульованого у часі, з негайним вивільненням першого активного інгредієнта і контрольованим вивільненням другого активного інгредієнта. Даний винахід додатково стосується композиції для сублінгвального введення активного інгредієнта. Фармацевтичне дослідження все більше і більше зосереджується на розумних системах доставки лікарського засобу, які поліпшують бажані терапевтичні цілі, мінімізуючи небажані побічні ефекти. Даний винахід описує розумні системи доставки лікарського засобу для складання лікарського засобу в композиції, які забезпечують регульоване вивільнення, такі як композиції з регульованим у часі вивільненням, включаючи композиції для перорального введення. В галузі техніки показані різні розв'язання проблеми контрольованого вивільнення активного інгредієнта. Наприклад, диклофенак є погано розчинним в кислому середовищі, впливаючи на розчинність і поглинання лікарського засобу. Композиція з відстроченим вивільненням, яку також називають системою з кишковорозчинним покриттям, запобігає вивільненню лікарського засобу в кислому середовищі шлунка і дозволяє вивільнення в сприятливішому середовищі тонкого кишечнику. Різні матеріали, наприклад, фталат ацетилцелюлози, фталат гідроксипропілметилцелюлози, фталат полівінілацетату та акрилові полімери застосовують як резистентну до дії шлункового соку, кишковорозчинну оболонку для відстроченого вивільнення лікарського засобу в кишечнику (Xu and Lee, Pharma. Res. 10 (8), 1144-1152 (1993)). Системи з кишковорозчинним покриттям, розчинні при вищих значеннях рН, часто застосовують в системах інтестинальної доставки із запізненням і специфічного вивільнення лікарського засобу в товстій кишці. WO97/25979 описує систему доставки лікарського засобу для доставки в різні частини шлунково-кишкового тракту. Ядро, що містить лікарський засіб, покрите гідрофобним полімером, який містить завантажені в нього гідрофільні, нерозчинні у воді частинки. Ці частинки служать каналами для водного середовища, що входить в ядро, і для вивільнення лікарських засобів шляхом дифузії через ці канали. Додатковий приклад системи з відстроченою доставкою лікарського засобу описаний в патенті WO99/018938. Патент WO99/018938 описує шлунково-кишкову систему доставки, що включає лікарський засіб в комбінації з набухаючою речовиною ядра. Ядро оточене нерозчинною у воді речовиною оболонки, що включає тверді частинки нерозчинної у воді речовини. При контакті з водовмісною рідиною, тверді частинки поглинають рідину і утворюють канали в оболонці, які роблять можливим надходження водовмісної рідини в ядро. Внутрішня оболонка розривається при набуханні ядра, таким чином, вивільняючи лікарський засіб з системи доставки. Розроблені пристрої доставки подвійного лікарського засобу для вивільнення лікарського засобу з 2 різними швидкостями або в 2 різних проміжках часу або вивільнення двох або більше різних лікарських засобів в різні проміжки часу з різних компартементів. Пристрої для доставки подвійного лікарського засобу мають регульовану швидкість вивільнення одного або більше лікарських засобів для того, щоб максимізувати терапевтичну дію цих лікарських засобів. Придатні кандидати лікарських засобів для режиму двофазного введення включають нестероїдні протизапальні лікарські засоби (НПЗЗ) і гіпотензивні, антигістамінні і протиалергійні інгредієнти. У першій фазі лікарський засіб швидко вивільняється, щоб забезпечити максимальне полегшення протягом короткого проміжку часу. За цим йде фаза тривалого вивільнення для того, щоб уникнути необхідності в частому повторному введенні. Придатними пристроями для застосування як біфазної системи вивільнення є спресовані двошарові таблетки і системи "ядро в оболонці", які мають на увазі застосування таблетки з тривалим вивільненням у вигляді спресованого ядра, вся поверхня якого покрита композицією, що розпадається. І ядро таблетки і зовнішня оболонка містять лікарський засіб. В галузі техніки існують деякі біфазні пристрої вивільнення. WO93/009771 описує таблетку з двома імпульсами вивільнення флутаміду для лікування раку простати. Перший імпульс створюється шаром негайного вивільнення, в той час як другий імпульс створюється ядром, яке містить тверду дисперсію флутаміду в носії. Шар негайного вивільнення і ядро відділені за допомогою шару плівки кишково-розчинної оболонки. 1 UA 113061 C2 5 10 15 20 25 30 35 40 45 50 55 60 Мультичастинки також забезпечують біфазну систему вивільнення. WO94/12160 описує капсулу, яка містить множину гранул з різним часом запізнення вивільнення лікарського засобу. Шляхом змішування гранул з різним часом запізнення можна забезпечити пульсуючу доставку лікарського засобу. Лікарський засіб міститься в гранулі разом з осмотичним інгредієнтом. Гранули покриті водопроникною, нерозчинною у воді плівкою, яка дозволяє воді дифундувати в гранулу. Осмотичний інгредієнт розчиняється у воді, примушуючи гранулу збільшуватися в розмірі і, в кінцевому результаті, розриватися з вивільненням лікарського засобу. Осмотичний інгредієнт, який міститься в гранулі, і оболонка гранули являють собою дві змінні, які визначають час запізнення вивільнення лікарського засобу, який міститься в гранулі. WO 98/51287 описує пульсуючу систему на основі множини частинок в готовій лікарській формі. Вивільнення лікарського засобу з частинки контролюється комбінацією шарів з контрольованим вивільненням набухаючих шарів і шарів оболонки. Шар з контрольованим вивільненням являє собою поперечнозшитий полімер полі(акрилової кислоти) з великою молекулярною масою, змішаний з розчинним у воді полімером. Додатковий біфазний пристрій доставки лікарського засобу наданий в WO00/074655, система якого основана на системі доставки лікарського засобу, наданій в WO97/25979. Внутрішня оболонка системи доставки лікарського засобу додатково оточена зовнішньою оболонкою, яка містить додаткову кількість бажаного інгредієнта. Коли пристрій доставки попадає в шлунково-кишковий тракт, зовнішня оболонка вивільняє бажаний інгредієнт, що міститься в ній, і розпадається, оголюючи внутрішню оболонку. Шляхом регулювання параметрів пристрою, таких як матеріал ядра, матеріал носія в оболонці і матеріал частинок, можна регулювати місце здійснення обох імпульсів лікарського засобу. Вищезгадані системи доставки лікарського засобу, будучи ефективними при вивільненні лікарського засобу із запізненням в певних частинах шлунково-кишкового тракту, як, наприклад, тонка кишка або товста кишка, виявилися неефективними для доставки лікарського засобу коротким імпульсом через певний період часу, незалежно від присутності в специфічній частині тіла. Існує чітка необхідність в системі доставки лікарського засобу, яка вивільняє лікарський засіб через визначений проміжок часу (час запізнення) після введення системи доставки лікарського засобу. Крім того, існує потреба в пристрої доставки лікарського засобу, який комбінує систему доставки лікарського засобу, ефективну для доставки лікарського засобу коротким імпульсом через визначений проміжок часу, з системою доставки лікарського засобу, що забезпечує негайне вивільнення лікарського засобу в більш ранній момент часу після введення, переважно, в ротовій порожнині. Тому, даний винахід надає регульовану у часі систему доставки лікарського засобу з негайним вивільненням для перорального введення терапевтично ефективної кількості першого активного інгредієнта потребуючому цього пацієнту, що включає ядро, яке розпадається, що включає целюлозу, наповнювач, вибраний з органічної і/або неорганічної солі, і першого активного інгредієнта, де вказана система додатково включає першу оболонку, яка оточує ядро, вказана перша оболонка, що включає зовнішню поверхню, де вказана перша оболонка додатково включає гідрофобний полімер і розчинну і/або нерозчинну у воді гідрофільну речовину. Ядро згідно з даним винаходом включає: перший активний інгредієнт у відносній кількості, переважно між 0,1 і 60 % (мас./мас.; на основі загальної маси ядра), більш переважно між 0,1 і 30 % (мас./мас.; на основі загальної маси ядра), більш переважно між 5 і 25 % (мас./мас. на основі загальної маси ядра), целюлозу у відносній кількості, переважно між 10 і 60 % (мас./мас. на основі загальної маси ядра), більш переважно між 10 і 50 % (мас./мас. на основі загальної маси ядра (мас./мас. на основі загальної маси ядра), і наповнювач, вибраний з органічної і/або неорганічної солі, у відносній кількості, переважно між 10 і 70 % (мас./мас. на основі загальної маси ядра), більш переважно в кількості між 10 і 60 % (мас./мас. на основі загальної маси ядра). Всюди в даній специфікації термін "що включає" і його граматичні еквіваленти вказують на те, що перераховані компоненти присутні і що інші компоненти можуть бути присутніми або ні. Термін "що включає", переважно, має значення "той, що складається тільки з". Ядро, переважно, спресоване або ущільнене в тверде тіло. Переважно ядро являє собою таблетку. Термін "таблетка" охоплює "капсулу" і "каплету". Переважний розмір ядра системи доставки лікарського засобу згідно з даним винаходом коливається від декількох міліметрів до приблизно одного сантиметра. Додаткові ексципієнти можуть включати розріджувачі, зв'язувальні речовини або гранулюючі інгредієнти, вуглевод, такий як крохмаль, похідну сполуку 2 UA 113061 C2 5 10 15 20 25 30 35 40 45 50 55 60 крохмалю, таку як ацетат крохмалю і/або мальтодекстрин, поліол, такий як ксиліт, сорбіт і/або манітол, лактозу, таку як моногідрат α-лактози, безводна α-лактоза, безводна β-лактоза, висушена розпилюванням лактоза і/або агломерована лактоза, цукор, такий як декстроза, мальтоза, декстрат і/або інулін або їх комбінації, гліданти (сприяючі ковзанню) і мастильні речовини, щоб гарантувати ефективне таблетування, і підсолоджувачі або ароматизатори для посилення смаку. Вказаний перший активний інгредієнт може бути єдиним активним інгредієнтом або сумішшю двох або більше активних інгредієнтів. Переважно, коли кожний з активних інгредієнтів в суміші активних інгредієнтів присутній у відносній кількості між 0,1 і 30 % (мас./мас.), більш переважно між 5 і 25 % (мас./мас.). Переважна регульована у часі система доставки лікарського засобу з негайним вивільненням згідно з даним винаходом включає композицію з негайним вивільненням, що включає спресоване ядро, що містить один або більше активних інгредієнтів, оточене оболонкою, в якій вивільнення активного інгредієнта з ядра є результатом руйнування оболонки після визначеного часу запізнення. Переважно, ядро негайно розпадається після руйнування або розчинення оболонки. Термін целюлоза включає подрібнену в порошок целюлозу, агломеровану целюлозу, мікрокристалічну целюлозу і/або їх комбінації. Термін целюлоза включає очищену целюлозу, метилцелюлозу, гідроксипропілметилцелюлозу і карбокси метилцелюлозу. Порошкоподібна целюлоза складена, головним чином, з целюлози, одержаної шляхом розкладання деревної пульпи. Мікрокристалічна целюлоза включає спеціальний сорт альфа-целюлози. Переважна целюлоза являє собою мікрокристалічну целюлозу. Переважна мікрокристалічна целюлоза має номінальний розмір частинок між 30 і 250 мкм, переважно між 50 і 180 мкм. Додаткова переважна мікрокристалічна целюлоза має вологість між 0,1 і 7,5 %, більш переважно між 1 і 5,0 %. Переважна мікрокристалічна целюлоза вибрана з мікрокристалічної целюлози з номінальним розміром частинок 50 мкм і вологістю від 3,0 до 5,0 %, такою як, наприклад, PH Avicel 101; мікрокристалічної целюлози з номінальним розміром частинок 100 мкм і вологістю від 3,0 до 5,0 %, такою як, наприклад, PH Avicel 102; і мікрокристалічної целюлози з номінальним розміром частинок 180 мкм і вологістю менше 1,5 %, такою як, наприклад, PH Avicel 200. Кількість вказаної мікрокристалічної целюлози становить, переважно більше 10 % (мас./мас.; на основі загальної маси ядра), більш переважно більше 20 % (мас./мас.), більш переважно більше 30 %, найбільш переважно більше приблизно 35 %. Додатково переважно, коли кількість мікрокристалічної целюлози становить менше 60 %, більш переважно менше 50 %, більш переважно менше 45 % (мас./мас., на основі загальної маси ядра). Переважне ядро згідно з даним винаходом включає наповнювач. Вказаний наповнювач, переважно, присутній в кількості між 10 і 70 % (мас./мас.; на основі загальної маси ядра), більш переважно між 20 % і 60 % (мас./мас.), більш переважно між 30 % і 50 % (мас./мас.), такій як, наприклад, 35 % (мас./мас.). Вказаний наповнювач вибраний з групи органічної солі і неорганічної солі. Органічна сіль, переважно, вибрана з цитрату кальцію, цитрату магнію, лактату кальцію, лактату натрію, лактату магнію, фумарату кальцію і фумарату магнію. Найбільш переважним наповнювачем є неорганічна сіль. Неорганічна сіль згідно з даним винаходом, переважно, вибрана з дигідрат сульфату кальцію, силікату кальцію, фосфату кремнію, карбонату кальцію, безводного двоосновного фосфату кальцію, двоосновного моногідрату фосфату кальцію, триосновного фосфату кальцію, фосфату натрію, хлориду натрію, фосфату калію, сульфату калію, хлориду калію, карбонату натрію, карбонату магнію і оксиду магнію. Загальна сума розчинного наповнювача, такого як лактат натрію і хлорид натрію, становить, переважно менше 50 % (мас./мас.; на основі загальної маси ядра). Вибір наповнювача додатково визначається власною стійкістю активного інгредієнта в ядрі в комбінації з наповнювачем або комбінації наповнювачів, як відомий фахівцеві в галузі техніки. Ядро може додатково включати мастильну речовину, таку як стеарат магнію, тальк і т. п. Переважно ядро включає безводний двоосновний фосфат кальцію і стеарат магнію. Кількість вказаного безводного двоосновного фосфату кальцію становить, переважно більше 10 % (мас./мас.; на основі загальної маси ядра), більш переважно більше 20 % (мас./мас.), більш переважно більше 30 %, найбільш переважно більше приблизно 35 %. Додатково переважно, коли кількість безводного двоосновного фосфату кальцію становить менше 70 %, більш переважно менше 60 %, більш переважно менше 50 %, більш переважно менше 45 % (мас./мас., на основі загальної маси ядра). Кількість стеарату магнію становить, переважно між 0,1 % (мас./мас.; на основі загальної маси ядра) і 10 % (мас./мас.), більш переважно між 0,5 і 5 % (мас./мас.). 3 UA 113061 C2 5 10 15 20 25 30 35 40 45 50 55 60 Ядро д одатково може включати один або більше дезінтегрантів, які в чистому вигляді утворюють гель при контакті з водовмісною рідиною. Переважний дезінтегрант включає один або більше з нерозчинних у воді, гелеутворювальних дезінтегрантів. У випадку присутності, вказаний дезінтегрант, такий як, нерозчинний у воді, гелеутворювальний дезінтегрант, переважно, присутній у відносній кількості між 0,5 і 20 % (мас./мас.). Дезінтегранти являють собою речовини або суміші речовин, які сприяють розбиванню або розпаду таблетки. Розбивання таблетки приводить до утворення менших по розміру частинок, з яких інгредієнти, включаючи перший активний інгредієнт, є більш легкодоступними для поглинання, в порівнянні з суцільною таблеткою. Розчинення лікарського засобу може бути значно поліпшене з додаванням дезінтегруючих інгредієнтів в композицію. Переважні дезінтегранти викликають розпад таблетки шляхом вбирання по краплинах, деформації і/або індукції електростатичних сил відштовхування між частинками. Переважний дезінтегрант згідно з даним винаходом вибраний з натрію крохмальгліколяту ® (Primojel®), поперечно зшитої натрієвої солі карбоксиметилцелюлози, наприклад ACDISOL , поперечнозшитого полівінілпіролідону (Crospovidone) і мало-заміщеної гідроксипропілцелюлози (L-HPC) з вмістом гідроксипропоксилу в діапазоні від 5,0 до 16,0 % по масі і виміряним середнім ступенем полімеризації в діапазоні від 350 до 700. Вказана L-HPC, переважно, має частинки малого розміру, переважно, середній розмір частинок становить менше 10 мікронів, більш переважного менше 5 мікронів, такий як, наприклад, LH41. Вказаний нерозчинний у воді, гелеутворювальний дезінтегрант, переважно, присутній у відносній кількості між 0,0 і 6 % (мас./мас.). Кількість вказаних нерозчинних у воді гелеутворювальних дезінтегрантів становить, переважно менше 6 % (мас./мас.; на основі загальної маси ядра), більш переважно менше 5 % (мас./мас.), найбільш переважно менше 4 %. Переважна композиція ядра згідно з даним винаходом включає перший активний інгредієнт, ® ® мікрокристалічну целюлозу, наприклад PHARMACEL pH102 або PHARMACEL pH200, безводний двокальцієвий фосфат, поперечнозшиту натрієву карбоксиметилцелюлозу, наприклад кроскармелозу і стеарат магнію. Мікрокристалічна целюлоза і поперечнозшита натрієва карбоксиметилцелюлоза, переважно, присутні в співвідношенні між приблизно 6:1 (мас./мас.) і 14:1 (мас./мас.), переважно між 7,5 (мас./мас.) і 12,5 (мас./мас.). Переважні співвідношення становлять приблизно 10:1 (мас./мас.) і приблизно 8:1 (мас./мас.). Ефект такого співвідношення полягає в тому, що ядро під час гелеутворення суттєво не розбухає перед розпадом. Переважне співвідношення безводного двоосновного фосфату кальцію і мікрокристалічної целюлози становить між 3:1 (мас./мас.) і 1:3 (мас./мас.), більш переважно між 2:1 (мас./мас.) і 1:2 (мас./мас.), найбільш переважно приблизно 1:1 (мас./мас.). Загальна маса ядра згідно з даним винаходом становить, переважно між 50 і 500 міліграмами, більш переважно між 200 і 400 міліграмами, більш переважно між 300 і 400 міліграмами, приблизно 340 міліграмів. Ядро згідно з даним винаходом оточене першою оболонкою, де вказана перша оболонка включає зовнішню поверхню, де вказана перша оболонка додатково включає гідрофобний полімер і (розчинну і/або нерозчинну у воді) гідрофільну речовину. Перша оболонка, переважно, не включає лікарський засіб. У випадку присутності, пластифікатор, такий як, наприклад, дибутилфталат, триетилцитрат, ацетилтриетилцитрат, дибутилсебацинат, діетилфталат, триацетин і/або трибутилцитрат, переважно, присутній в кількості найбільше 0,5 % (мас./мас.; на основі загальної маси регульованої у часі системи доставки лікарського засобу з негайним вивільненням). Перша оболонка, переважно, не включає пластифікатор. Перша оболонка, переважно, розпилюється на ядро, наприклад, за допомогою сопла. Для цього гідрофобний полімер і розчинну і/або нерозчинну у воді гідрофільну речовину суспендують або розчиняють, наприклад, у воді або органічному розчиннику або їх суміші і розпилюють на ядро до утворення першої оболонки з визначеною середньою товщиною. Переважним органічним розчинником є спирт, наприклад, етанол. Кількість першої оболонки становить, переважно між приблизно 0,5 і 30 % (мас./мас.) загальної маси регульованої в часі системи доставки лікарського засобу з негайним вивільненням, більш переважно між приблизно 1 і 20 % (мас./мас.). Гідрофобний полімер оболонки згідно з даним винаходом, переважно, вибраний з нерозчинних у воді матеріалів оболонки, таких як похідні сполуки целюлози і поліметакрилати, що одержуються, наприклад, шляхом співполімеризації мономерів метакрилату з гідрофобними групами. Переважними поліметакрилатними гідрофобними полімерами є EUDRAGIT® RL, ® EUDRAGIT RS, EUDRAGIT® NE і EUDRAGIT® S. Переважні похідні сполуки целюлози вибрані з етилцелюлози і її похідних сполук. Найбільш переважно гідрофобний полімер для першої оболонки системи доставки лікарського засобу 4 UA 113061 C2 5 10 15 20 25 30 35 40 45 50 55 60 згідно з даним винаходом включає етилцелюлозу. Етилцелюлоза утворює механічно слабку гідрофобну плівку, яка легко розривається. Ядро містить лікарський засіб в комбінації з нерозчинним у воді, гелеутворювальним дезінтегрантом, який приводить до руйнування при контакті з водним середовищем. Утворення пор в гідрофобній плівці і впаданні води в ядро, спричиняють руйнування етилцелюлозної оболонки. Коли оболонка розривається, ядро розпадається протягом декількох хвилин з подальшим вивільненням лікарського засобу. . Переважною етилцелюлозою є ETHOCEL® Гідрофільна речовина згідно з даним винаходом, переважно, є нерозчинною у воді гідрофільною речовиною, переважно, нерозчинним у воді гідрофільним полімером. Додатково переважно, коли вказана перша оболонка містить пори до контакту з водовмісною рідиною. Функція пор як канали, які зв'язують ядро із зовнішньою поверхнею внутрішньої оболонки, полягає в регулюванні надходження водовмісної рідини в ядро. Вказані пори присутні, наприклад, тоді, коли нерозчинна у воді гідрофільна речовина являє собою або включає нерозчинний у воді гідрофільний полімер, переважно, целюлозу. Переважна целюлоза являє собою такі похідні сполуки целюлози як, наприклад, гідроксипропілцелюлоза, поперечнозшита гідроксіетилцелюлоза, поперечнозшита гідроксипропілметилцелюлоза і мікрокристалічна целюлоза. Целюлоза створює канали, які з'єднують ядро, яке містить лікарський засіб, з простором за межами таблетки. Целюлоза, таким чином, контролює швидкість переміщення води через канали в ядро. Коли достатня кількість води досягає ядра, ядро втрачає свою структурну цілісність. Ядро розпадеться з подальшим руйнуванням оболонки і вивільненням лікарського засобу. Переважна целюлоза являє собою мікрокристалічну целюлозу з номінальним розміром частинок між 20 і 200 мікронами і вологістю менше 5 %. Переважна мікрокристалічна целюлоза включає мікрокристалічну целюлозу з номінальним розміром частинок приблизно 150 мікронів і вологістю від 3,0 до 5,0 %, таку як, наприклад, Avicel® PH-102 SCG; мікрокристалічну целюлозу з номінальним розміром частинок приблизно 100 мікронів і вологістю менше 5,0 %, таку як, наприклад Avicel® HFE-102; мікрокристалічну целюлозу з номінальним розміром частинок приблизно 20 мікронів і вологістю менше 5,0 %, таку як, наприклад, Avicel® PH-105. Додатково переважні нерозчинні у воді гідрофільні речовини включають двокальцієвий фосфат. Перевага застосування невеликих частинок розміром менше 50 мікронів, наприклад, Avicel® PH 105, в тому, що суспензія оболонки має кращі властивості текучості, що загалом поліпшує ® умови утворення плівкової оболонки. Переважна перша оболонка включає Ethocel і Avicel PH105 як нерозчинну у воді гідрофільну речовину. Переважні масові співвідношення гідрофобного ®, полімеру оболонки, такого як Ethocel і нерозчинної у воді гідрофільної речовини, такої як Avicel, становлять між 1:5 і 5:1, більш переважно, між 1:4 і 3:1, більш переважно, між 1:3 і 2:1, найбільш переважно приблизно 1:2. В іншому варіанті здійснення даного винаходу гідрофільна речовина згідно з даним винаходом, переважно, являє собою водорозчинну гідрофільну речовину. Ця оболонка, переважно, не містить пор або тільки декілька пор до контакту з водовмісною рідиною. Переважно, коли водорозчинна гідрофільна речовина утворює пори в гідрофобному полімері при контакті з водовмісною рідиною. Переважна водорозчинна гідрофільна речовина включає лактозу, манітол і/або хлорид натрію. Переважною лактозою є PHARMATOSE®. ® Переважна перша оболонка включає Ethocel і лактозу як водорозчинну гідрофільну речовину. Переважні масові співвідношення гідрофобного полімеру оболонки, такого як ®, Ethocel і водорозчинної гідрофільної речовини, такої як лактоза, становить між 1:5 і 5:1, більш переважно між 1:3 і 3:1, більш переважно між 1:2 і 2:1, найбільш переважно приблизно 1:1. Відносна кількість першої оболонки становить переважно між 4 і 20 % (мас./мас.; на основі загальної маси системи доставки лікарського засобу), більш переважно, між 8 і 15 % (мас./мас.), найбільш переважно, приблизно 12 % (мас./мас.). Тому, переважно перша оболонка має масу між 10 і 75 міліграмами, більш переважно між 25 і 50 міліграмами, найбільш переважно, приблизно 40 міліграмів. Регульована в часі система доставки лікарського засобу з негайним вивільненням згідно з даним винаходом дозволяє контролювати вивільнення першого активного інгредієнта після гідратації системи доставки лікарського засобу. Зазначене регульоване в часі негайне вивільнення суттєво не залежить від pН. Момент вивільнення частково контролюється товщиною першої оболонки, що, переважно, розпорошується на ядро. Варіювання в кількості першої оболонки між таблетками становить, переважно, не більше 10 % (між 90 % і 110 %) на основі загальної маси першої оболонки. Більш переважно, варіювання в кількості першої оболонки становить не більше 5 % (між 95 % і 105 %) на основі загальної маси першої оболонки. Фактори (умови одержання), що можуть впливати на внутрішню і міжтаблеткову 5 UA 113061 C2 5 10 15 20 25 30 35 40 45 50 55 60 однорідність першої оболонки, включають, наприклад, швидкість подачі, швидкість розпилювання, патерн розпилювання, тип сопла, в'язкість, температуру сушіння, швидкість потоку повітря і тривалість створення оболонки, як відомо фахівцеві в галузі техніки. При необхідності, контрольовану температурою стадію отвердження, наприклад, термічну обробку при 60-80 °C протягом 1-3 годин, застосовують до першої оболонки, переважно, після нанесення першої оболонки розпилюванням. Крім того, кількість розчинної і/або нерозчинної у воді гідрофільної речовини в першій оболонці й ідентичність розчинної і/або нерозчинної у воді гідрофільної речовини, додатково забезпечують засоби для моделювання моменту часу вивільнення першого активного інгредієнта. Наприклад, таблетка, що включає спресоване ядро і першу оболонку із середньою товщиною приблизно 35 мікрометрів, де оболонка включає Ethocel 20 і лактозу в співвідношенні 3:2, забезпечує вивільнення першого активного інгредієнта приблизно через 36 хвилин після гідратації таблетки, у той час як та ж сама композиція таблетки з першою оболонкою із середньою товщиною приблизно 50 мікрометрів забезпечує вивільнення першого активного інгредієнта приблизно через 84 хвилини після гідратації таблетки. Таблетка, що включає спресоване ядро і першу оболонку із середньою товщиною приблизно 90 мікрометрів, де оболонка включає Ethocel 20 і Avicell PH102 у співвідношенні 3:2, забезпечує вивільнення першого активного інгредієнта приблизно через 105 хвилин після гідратації таблетки. Фахівець в галузі техніки може одержати регульовану в часі систему доставки лікарського засобу з негайним вивільненням згідно з даним винаходом на основі навчального опису і прикладів, наданих у цій заявці. Загальна маса пристрою доставки лікарського засобу згідно із даним винаходом становить, переважно щонайменше 50 міліграмів, більш переважно щонайменше 150 міліграмів, і, переважно між 50 і 500 міліграмами, більш переважно між 150 і 400 міліграмами, більш переважно між 300 і 400 міліграмами, тому що приблизно 301,5 міліграмів, 325 міліграмів або приблизно 340 міліграмів. Регульована в часі система доставки лікарського засобу згідно із даним винаходом забезпечує вивільнення першого активного інгредієнта через приблизно визначений проміжок часу (час запізнення), тому що через приблизно 1 годину після введення, через приблизно 1,5 години, більш переважно через приблизно 2 години, більш переважно через приблизно 2,5 години, більш переважно через приблизно 3 години, більш переважно через приблизно 3,5 години, більш переважно через приблизно 4 години, більш переважно через приблизно 4,5 години, більш переважно через приблизно 5 годин, більш переважно через приблизно 6 годин, більш переважно через приблизно 7 годин, більш переважно через приблизно 8 годин, більш переважно через приблизно 10 годин після введення системи доставки лікарського засобу. Термін "регульована в часі" система доставки лікарського засобу стосується системи доставки лікарського засобу, що забезпечує вивільнення першого активного інгредієнта через визначений проміжок часу, наприклад, через 2 години, при цьому вивільнення не залежить від pН. Визначений проміжок часу встановлюється і не залежить від режиму pН у шлунковокишковому тракті. Термін система доставки лікарського засобу "з негайним вивільненням" стосується системи доставки лікарського засобу, що забезпечує вивільнення значної кількості першого активного інгредієнта в межах визначеного проміжку часу. Система доставки лікарського засобу з негайним вивільненням, наприклад, забезпечує вивільнення більше 60 % першого активного інгредієнта, більш переважно більше 70 %, більш переважно більше 80 % протягом 30 хвилин після руйнування оболонки, більш переважно протягом 20 хвилин, більш переважно протягом 8 хвилин після руйнування оболонки. Способи і засоби для визначення кількості першого активного інгредієнта, що вивільняється із системи доставки лікарського засобу, і часовий інтервал, у межах якого інгредієнт вивільняється, являють собою такі, як, наприклад фармакопейні способи розчинення, відомі фахівцю в галузі техніки, наприклад, тести на розчинність Фармакопеї США (USP) на основі Apparatus 2 (спосіб із застосуванням лопатевої мішалки) і Apparatus 3 (циліндр зі зворотно-поступальним рухом). Вважається, що негайне вивільнення першого активного інгредієнта є результатом релаксації напруги, що викликається вологістю. Рушійною силою для цієї релаксації напруги є кількість енергії, запасеної усередині ядра, оточеного полімерною оболонкою (Van der Voort Maarschalk et al., 1997. Int J Pharmaceutics 151: 27-34; Van der Voort Maarschalk et al., 1997. Pharm Res 14: 415-419; Steendam et al., 2001. J Control Rel 70: 71-82; Laity and Cameron, 2010. Eur J Pharma Biopharm 75: 263-276). Розпад покритого оболонкою ядра згідно із даним винаходом опосередкований релаксацією напруги нелінійним чином. Релаксація напруги опосередкована гідратацією ядра і гідрофільною речовиною в першій оболонці, таким чином, 6 UA 113061 C2 5 10 15 20 25 30 35 40 45 50 55 що відбувається негайний вибух оболонки через визначений проміжок часу. Виявлено, що присутність більше 6 % (мас./мас.) нерозчинного у воді, гелеутворювального дезінтегранта впливає на негайне вивільнення першого активного інгредієнта і приводить до властивостей з тривалішим вивільненням. Термін "перший активний інгредієнт" стосується інгредієнта, що є присутнім у ядрі. Зазначений перший інгредієнт може бути єдиним активним інгредієнтом або сумішшю двох або більше активних інгредієнтів. Перший активний інгредієнт, що є присутнім у ядрі системи доставки лікарського засобу згідно із даним винаходом, може бути будь-яким інгредієнтом, що, переважно, вивільняється через визначений проміжок часу. Прикладами активних інгредієнтів, що, переважно, вивільняються у визначений час після введення, наприклад, рано ранком, є протиастматичні засоби (наприклад, бронхолітичні засоби), протиблювотні засоби, кардіотонічні засоби, судинорозширювальні засоби, протизахитувальні і лікарські засоби проти хвороби Меньєра, противиразкові засоби, кортикостероїди, такі як преднізон, інші протизапальні лікарські засоби, аналгетичні засоби, протиревматичні засоби, протиартричні лікарські засоби; лікарські засоби проти стенокардії; і гіпотензивні засоби. Крім того, інші сполуки, для яких такі композиції можуть бути дуже корисними для поліпшення виконавчості пацієнта, включають седативні засоби, такі як діазепам, антидепресанти й інші діючі на ЦНС сполуки. Іншими класами активних інгредієнтів, що, переважно, складають у композицію в системі доставки лікарського засобу згідно із даним винаходом, є біоактивні білки, пептиди, ферменти, вакцини й олігонуклеотиди. Дуже часто ці типи сполук не стійкі до кислого середовища шлунка. Усе ще додатковим переважним типом активних інгредієнтів, що, переважно, складають у композицію в системі доставки лікарського засобу згідно із даним винаходом, є інгредієнт, що, переважно, вводять у режимі біфазного вивільнення. Композиції за даним винаходом, зокрема, підходять для введення антибіотиків, таких як пеніциліни, цефалоспорини, а також бензодіазипіни, антагоністи кальцію і короткодіючі снодійні засоби. Усе ще додатковим переважним типом активних інгредієнтів, що, переважно, складають у композицію в системі доставки лікарського засобу згідно із даним винаходом, є лікарський засіб, що є частиною медичної комбінації щонайменше двох різних активних інгредієнтів. Варіантами здійснення цих типів активних інгредієнтів є комбінації активних інгредієнтів, де перший активний інгредієнт пом'якшує негативні ефекти другого активного інгредієнта або поліпшує/підсилює дію другого активного інгредієнта. Прикладами є другі активні інгредієнти, що викликають такий побічний ефект як, наприклад, запор, нудота, газ/здуття, печія, біль або судороги. Перший активний інгредієнт надається раніше другого активного інгредієнта. Перший активний інгредієнт пом'якшує вищевказаний побічний ефект другого активного інгредієнта, наприклад, забезпечує проносну дію, знімання нудоти, дегазуючу дію і знімання здуття, антацидну дію, знеболюючу дію і розслаблення м'язів. Усе-таки додатковий переважний приклад представляє собою перший активний інгредієнт, об'єднаний із другим активним інгредієнтом, який контролює і зупиняє дію першого інгредієнта через проміжок часу, необхідний для дії першого інгредієнта. Наприклад, комбінація лікарського засобу проти раку, такого як метотрексат з негайним вивільненням, і "стопорильного" інгредієнта, , такого як L-лейковорин з регульованим у часі вивільненням, може бути з перевагою доставлена системою доставки лікарського засобу згідно із даним винаходом. В усіх цих прикладах другий активний інгредієнт, переважно, складений у композицію в системі доставки лікарського засобу згідно із даним винаходом. Навіть більш переважно, тип активних інгредієнтів, що, переважно, складають у композицію в системі доставки лікарського засобу згідно із даним винаходом, наданий активним інгредієнтом, що має синергічну дію з іншим активним інгредієнтом у тій же самій області захворювання, але який необхідно вивільняти в інший час у порівнянні з іншим активним інгредієнтом, і/або який необхідно вводити в іншій частині тіла в порожнині рота і/або в шлунково-кишковому тракті. Найбільш переважним прикладом є комбінована терапія, переважно, для лікування в чоловіків або жінок: статевої дисфункції, відсутності бажання або еректильної дисфункції. Переважно, зазначене лікування комбінацією є лікуванням зниженого статевого потягу. Переважно, застосовують комбінацію тестостерону або його функціонального аналога і першого активного інгредієнта, де тестостерон або його функціональний аналог надають таким чином, що пік рівня тестостерону в плазмі настає приблизно за 2-6 годин, більш переважно 3-4 години, до піка рівня першого активного інгредієнта в плазмі. Перший активний інгредієнт, переважно, надають у регульованій у часі системі доставки лікарського засобу з негайним вивільненням згідно з даним винаходом. 7 UA 113061 C2 5 10 15 20 25 30 35 40 45 50 55 60 Переважний перший активний інгредієнт, переважно, для лікування в чоловіків або жінок: статевої дисфункції, відсутності бажання або еректильної дисфункції, і, переважно, для лікування зниженого статевого потягу, обрані з групи, що складається з інгібітору PDE5, інгібітору нейтральної ендопептидази (НЕП) і агоністу 5-гідрокситриптамін 1A рецептор (5HT1Ara). Інгібітор PDE5, переважно, обраний з варденафілу, силденафілу і тадалафілу або кожного з інших відомих PDE5-інгібіторів. Додаткові необмежувальні приклади інгібіторів PDE5 являють собою: Е-4021, Е-8010, Е-4010, AWD-12-217 (запрінаст), AWD 12-210, UK-343,664, UK369003, UK-357903, BMS-341400, BMS-223131, FR226807, FR-229934, EMR-6203, Sch-51866, IC485, TA-1790 (аванафіл), DA-8159 (уденафіл), NCX-911 або KS-505a. Інші приклади можуть бути знайдені в WO 96/26940. Типовий приклад для перорального уведення варденафілу наданий у вигляді варденафіл HCl, який хімічно позначається як піперазин, 1-[[3-(1,4-дигідро-5метил-4-оксо-7-пропілімідазо[5,1-/][1,2,4]триазін-2-іл)-4-етоксифеніл]сульфоніл]-4-етил, моногідрохлорид. Інший приклад наведений у вигляді цитрату силденафілу, що хімічно позначають як 1-[[3-(6,7-дигідро-1-метил-7-оксо-3-пропіл-1H-піразоло[4,3-cr|піримідин-5-іл)-4етоксифеніл]сульфоніл]-4-метилпіперазину цитрат. Переважний PDE5-інгібітор згідно із даним винаходом являє собою силденафіл, що, переважно, застосовують у виді цитрату силденафілу (1-[[3-(6,7-дигідро-1-метил-7-оксо-3пропіл-1Hпіразоло[4,3-cr|піримідин-5-іл)-4-етоксифеніл]сульфоніл]-4-метилпіперазину цитрат). Додатковий переважний перший активний інгредієнт для лікування в чоловіків або жінок: статевої дисфункції, відсутності бажання або еректильної дисфункції, і, переважно, для лікування зниженого статевого потягу, є інгібітором нейтральної ендопептидази (НЕП). Переважний НЕП-інгібітор вибраний зі сполук кандоксатрил; кандоксатрилат; складний бензиловий ефір дексекадотрилу ((+)-N-[2(R)-(ацетилтіометил)-3-фенілпропіоніл]гліцину); CGS24128 (3-[3-(біфеніл-4-іл)-2-(фосфонометиламіно)пропіонамідо]пропіонова кислота); CGS-24592 ((S)-3-[3-(біфеніл-4-іл)-2-(фосфонометиламіно)пропіонамідо]пропіонова кислота); CGS-25155 (складний бензиловий ефір N-[9(R)-(ацетилтіометил)-10-оксо-1-азациклодекан-2(S)-ілкарбоніл]4(R)-гідрокси-L-проліну); похідні сполуки 3-(1-карбамоїлциклогексил)пропіонової кислоти, описані в WO 2006/027680; JMV-390-1 (2(R)-бензил-3-(N-гідроксикарбамоїл)пропіоніл-Lізолейцин-L-лейцин); екадотрил; фосфорамідон; ретротіорфан; RU 42827 (2-(меркаптометил)N-(4-піридиніл)бензолпропіонамід); RU-44004 (N-(4-морфолініл)-3-феніл-2(сульфанілметил)пропіонамід); SCH-32615 ((S)-N--[N-(1-карбокси-2-фенілетил)-L-фенілаланіл](3-аланін) і його проліки SCH-34826 ((S)-N--[N-[1-[[(2,2-диметил-1,3-діоксолан-4іл)метокси]карбоніл]-2-феніл-1-етил]-L-фенілаланіл]-(3-аланін); сіалорфін; SCH-42495 (складний етиловий ефір N-[2(S)-(ацетилсульфанілметил)-3-(2-метилфеніл)пропіоніл]-L-метіоніну); спінорфін; SQ-28132 (N-[2-(меркаптометил)-1-оксо-3-фенілпропіл]лейцин); SQ-28603 (N-[2(меркаптометил)-1-оксо-3-фенілпропіл]-(3-аланін); SQ-29072 (7-[[2-(меркаптометил)-1-оксо-3фенілпропіл]аміно]гептанова кислота); тіорфан і його проліки рацекадотрил; UK-69578 (цис-4[[[1-[2-карбокси-3-(2-метоксіетокси)пропіл]циклопентил]карбоніл]амін]циклогексанкарбонова кислота); UK-447841 (2-{1-[3-(4-хлорфеніл)пропілкарбамоіл]-циклопентилметил}-4метоксимасляна кислота); UK-505749 ((R)-2-метил-3-{1-[3-(2-метилбензотіазол-6іл)пропілкарбамоїл]циклопентил}пропіонова кислота); 5-біфеніл-4-іл-4-(3карбоксипропіоніламіно)-2-метилпентанова кислота і складний етиловий ефір 5-біфеніл-4-іл-4(3-карбоксипропіоніламіно)-2-метилпентанова кислота (WO 2007/056546); даглутрил [(3S, 2'R)3-{1-[2'-(етоксикарбоніл)-4'-фенілбутил]-циклопентан-1-карбоніламіно}-2,3,4,5-тетрагідро-2-оксо1H-1-бензазепін-1-оцтова кислота], описана в WO 2007/106708; і їх комбінації. Переважний інгібітор НЕП згідно із даним винаходом є вибірковим відносно НЕП (EC 3.4.24.11) порівняно з розчинною секретованою ендопептидазою (SEP). НЕП руйнує гормон, який називається вазоактивний інтестинальний пептид (ВІП), що поліпшує кровотік у піхву. Нейропептиди, такі як вазоактивний інтестинальний пептид (ВІП) є головними нейромедіаторами в регуляції генітального кровотоку. ВІП й інші нейропептиди руйнуються/метаболізуються під дією НЕП. Таким чином, інгібітори НЕП підсилюють ендогенну судинорозширювальну дію ВІП, яка виробляється під час порушення. Це приводить до посиленого генітального кровотоку і, отже, генітального застою крові. Винахідливо діючі інгібітори НЕП підсилюють стимульовані тазовим нервом і ВІП-індуковані збільшення піхвового і кліторального кровотоку. Крім того, вибіркові інгібітори НЕП підсилюють ВІП і нервопосередковані релаксації окремої стінки піхви. Тому, дії інгібітору НЕП схожі з діями PDE5інгібітору, а саме збільшують піхвовий і кліторальний кровотік. Переважними інгібіторами НЕП є UK-447841 і UK-505749. Додатковим переважним першим активним інгредієнтом, переважно, для лікування в чоловіків або жінок: статевої дисфункції, відсутності бажання або еректильної дисфункції, і, 8 UA 113061 C2 5 10 15 20 25 30 35 40 45 50 55 60 переважно, для лікування зниженого статевого потягу є агоніст 5-гідрокситриптамін 1A рецептора (5-HT1Ara). Переважно, 5-HT1Ara є вибірковим стосовно 5-HT1A рецептора в порівнянні з іншими 5-HT рецепторами і α-адренорецептором і допаміновим рецептором. Необмежувальними прикладами 5-HT1Ara є 8-OH-DPAT, Алнеспірон, AP 521, Буспар, Буспірон, Диппропіл-5-CT, DU-125530, E6265, Ебалзотан, Ептапірон, Флезиноксан, Флібанзерин, Гепірон, Іпсапірон, Лезопітрон, LY293284, LY301317, MKC242, R(+)-UH-301, Репінотан, SR57746A, Сунепітрон, SUN-N4057, Тандоспорин, U-92016A, Урадипіл, VML-670, Залоспірон і Запрасидон. Переважним агоністом рецептора 5HT1a є буспірон. Додатково переважно, коли перший активний інгредієнт у регульованій у часі системі доставки лікарського засобу з негайним вивільненням згідно із даним винаходом являє собою комбінацію двох або більше таких активних інгредієнтів як, але не обмежений ними, два або більше інгібіторів PDE5, два або більше інгібіторів НЕП, два або більше агоністів 5-HT1A рецептора, або комбінацію щонайменше одного інгібітору PDE5 і щонайменше одного інгібітору НЕП, комбінацію щонайменше одного інгібітору PDE5 і щонайменше одного агоніста 5-HT1A рецептора, комбінацію щонайменше одного інгібітору НЕП і щонайменше одного агоніста 5HT1A рецептора і комбінацію щонайменше одного інгібітору PDE5 щонайменше одного інгібітору НЕП і щонайменше одного агоніста 5-HT1A рецептора. Даний винахід додатково описує пристрій для доставки подвійного лікарського засобу, що включає регульовану в часі систему доставки лікарського засобу з негайним вивільненням згідно із даним винаходом, у якій перша оболонка регульованої у часі системи доставки лікарського засобу з негайним вивільненням оточена другою оболонкою, що включає другий активний інгредієнт. Друга оболонка забезпечує вивільнення другого активного інгредієнта в режимі негайного або контрольованого вивільнення. Друга оболонка може бути напресована або напилена на зовнішню поверхню першої оболонки. Способи пресування або напилювання відомі в галузі техніки. Друга оболонка, що оточує першу оболонку, переважно, захищає цілісність першої оболонки, наприклад, під час упаковування або збереження пристрою для доставки подвійного лікарського засобу. Це, переважно, зменшує або мінімізує ушкодження першої оболонки, що зустрічається під час упаковування або збереження, що може впливати на час запізнення при вивільненні першого активного інгредієнта з ядра пристрою для доставки подвійного лікарського засобу. Другу оболонку, переважно, напилюють на зовнішню поверхню першої оболонки. Коли створюють оболонку напилюванням, її, у цілому, складають у композицію так, що вона містить лікарський засіб і плівкоутворювальний інгредієнт таким чином, що лікарський засіб диспергують в плівці, що покриває першу оболонку ядра. Такі плівкоутворювальні інгредієнти відомі в галузі техніки і можуть являти собою, наприклад, гідроксипропілметилцелюлозу, повідон, гідроксіетилцелюлозу, інші модифіковані целюлози, відомі в галузі техніки, поліакрилати, поліметакрилати і поліметил/етилметакрилати. Плівкоутворювальний інгредієнт згідно із даним винаходом, переважно, включає гідроксипропілметилцелюлозу, більш переважно, низькомолекулярну гідроксипропілметилцелюлозу із середньою молекулярною масою менше 20000; більш переважно менше 10000. Оболонка, яка утворюється напилюванням, може бути складена в композицію так, щоб забезпечити стабільне вивільнення протягом невеликого проміжку часу шляхом створення оболонки, яка повільно розчинюється, або щоб забезпечити негайне вивільнення шляхом створення оболонки, що швидко розчинюється. Кількість плівкоутворювального інгредієнта становить, переважно, між 0,05 і 40 % (мас./мас.), на основі загальної маси другої оболонки, більш переважно між 1 і 30 % (мас./мас.), наприклад, приблизно 20 % (мас./мас.). Друга оболонка, переважно, має масу між 0,5 і 5 % (мас./мас.) на основі загальної маси пристрою доставки лікарського засобу. Переважно, зазначена оболонка має масу між 1 % і 3 % і, переважно між 1,5 і 2,5 % (мас./мас.) на основі загальної маси пристрою доставки лікарського засобу. У переважному варіанті здійснення даного винаходу друга оболонка системи доставки лікарського засобу має масу приблизно 1-20 мг на одиницю. Переважно, зазначена друга оболонка має масу приблизно 3-15 мг на одиницю. В найбільш переважному варіанті здійснення даного винаходу зазначена друга оболонка пристрою доставки лікарського засобу за даним винаходом має масу приблизно 4-10 мг на одиницю. Друга оболонка пристрою для доставки подвійного лікарського засобу згідно із даним винаходом, переважно, включає другий активний інгредієнт. Кількість другої оболонки, яку напилюють на зовнішню поверхню першої оболонки, таким чином, визначає кількість другого активного інгредієнта в пристрої для доставки подвійного лікарського засобу. Тому кількість другої оболонки повинна бути контрольованою. Варіювання в кількості другої оболонки між 9 UA 113061 C2 5 10 15 20 25 30 35 40 45 50 55 60 таблетками становить, переважно, не більше 10 % (між 90 % і 110 %), на основі загальної маси другої оболонки. Більш переважно, варіювання в кількості другої оболонки становить не більше 5 % (між 95 % і 105 %), на основі загальної маси другої оболонки. Фактори (умови одержання), що можуть впливати на внутрішньо- і міжтаблеткову однорідність другої оболонки, включають, наприклад, швидкість подачі, швидкість розпилювання, патерн розпилювання, тип сопла, в'язкість, температуру сушіння, швидкість потоку повітря і тривалість створення оболонки, як відомо фахівцю в галузі техніки. Кількість другого активного інгредієнта, переважно, становить між 0,05 і 20 % (мас./мас.) на основі загальної маси другої оболонки, більш переважно між 0,5 і 10 % (мас./мас.). Прикладами відомих ексципієнтів, що можуть бути додані до розпилюваної або пресованої другої оболонки з метою контрольованого вивільнення, є один або більше полімерів або співполімерів, обраних з полімерів акрилової кислоти і метакрилової кислоти і співполімерів, таких як співполімери акрилової кислоти і метакрилової кислоти, метилметакрилатні співполімери, етоксіетилметакрилати, ціаноетилметакрилат, полі(акрилова кислота), полі(метакрилова кислота), метакрилова кислота алкіламідний співполімер, полі(метилметакрилат), поліметакрилат, полі(метилметакрилатний) співполімер, поліакриламід, аміноалкілметакрилатний співполімер, полі(ангідрид метакрилової кислоти), співполімери гліцидилметакрилату і етилцелюлози. Кількість відомих ексципієнтів становить, переважно менше 10 % (мас./мас.) на основі загальної маси другої оболонки, більш переважно менше 5 % (мас./мас.), більш переважно менше 1 % (мас./мас.). Друга оболонка пристрою для доставки подвійного лікарського засобу згідно із даним винаходом, переважно, забезпечує негайну доставку другого активного інгредієнта в роті. Термін "рот" включає проміжок між губами і зубами, проміжок між щокою і зубами, ротову порожнину, яка розмежована за допомогою піднебіння і язика і сублінгвальну область. Другий активний інгредієнт, переважно, вивільняється в сублінгвальній області рота. Термін "негайне вивільнення другого активного інгредієнта" стосується швидкого розчинення другої оболонки в роті, таким чином, що другий активний інгредієнт повністю або суттєво повністю вивільняється протягом короткого проміжку часу усередині рота. Термін "негайне вивільнення другого інгредієнта" указує на те, що щонайменше 50 % другого активного інгредієнта вивільняється протягом 5 хвилин, більш переважно протягом 4 хвилин, більш переважно протягом 3 хвилин, більш переважно протягом 2 хвилин, найбільше переважно протягом 1 хвилини після перорального введення пристрою для доставки подвійного лікарського засобу. Більш переважно, коли щонайменше 70 % другого активного інгредієнта вивільняється протягом 5 хвилин, більш переважно протягом 4 хвилин, більш переважно протягом 3 хвилин, більш переважно протягом 2 хвилин, найбільш переважно протягом 1 хвилини після перорального введення пристрою для доставки подвійного лікарського засобу. Перевага пристрою для доставки подвійного лікарського засобу згідно із даним винаходом полягає в тому, що харчові ефекти мінімізовані. Термін "харчові ефекти" стосується розходження у швидкості і ступені поглинання ліків, що вводять незабаром після їжі (умови з харчуванням), у порівнянні з уведенням за умови обмеження харчування. Вивільнення першого активного інгредієнта не залежить від pН і, тому, навряд чи залежить від харчових ефектів. Крім того, складання другого активного інгредієнта в композицію у вигляді форми композиції з негайним вивільненням також мінімізує вплив харчових ефектів на вивільнення другого активного інгредієнта. Додаткова перевага пристрою для доставки подвійного лікарського засобу згідно із даним винаходом полягає в тому, що він забезпечує два незалежних шляхи дозування в одній таблетці. Додаткова перевага пристрою для доставки подвійного лікарського засобу згідно із даним винаходом полягає в тому, що він забезпечує вільне усмоктування у велике коло кровообігу одного активного інгредієнта (визначеного в даному описі як другий активний інгредієнт) при першому проходженні в комбінації зі шлунково-кишковим усмоктуванням додаткового активного інгредієнта (визначеного в даному описі як перший активний інгредієнт) в одній таблетці. Додаткова перевага пристрою для доставки подвійного лікарського засобу згідно із даним винаходом полягає в тому, що він забезпечує сублінгвальне усмоктування у велике коло кровообігу одного активного інгредієнта (визначеного в даному описі як другий активний інгредієнт) у комбінації зі шлунково-кишковим усмоктуванням додаткового активного інгредієнта (визначеного в даному описі як перший активний інгредієнт) в одній таблетці. Другий активний інгредієнт може бути схожим або несхожим з першим активним інгредієнтом. В одному варіанті здійснення даного винаходу другий активний інгредієнт, наприклад, стероїд, такий як тестостерон, уводять сублінгвальним шляхом за допомогою 10 UA 113061 C2 5 10 15 20 25 30 35 40 45 50 55 пристрою для доставки подвійного лікарського засобу згідно із даним винаходом під час відсутності першого активного інгредієнта. У цьому варіанті здійснення даного винаходу ядро пристрою для доставки подвійного лікарського засобу не включає активний інгредієнт. Другий активний інгредієнт, переважно, не є схожим з першим активним інгредієнтом. Коли другий активний інгредієнт не є схожим з першим активним інгредієнтом, додаткова перевага пристрою для доставки подвійного лікарського засобу згідно із даним винаходом полягає в тому, що розраховане в часі вивільнення першого і другого активних інгредієнтів не накладається в часі, що не спричиняє можливості взаємодій між першим і другим активним інгредієнтом. Прикладом другого активного інгредієнта є метотрексат, що надається у формі композиції з негайним вивільненням, і L-лейковорин, що надається у виді "стопорильного" інгредієнта, у регульованій у часі композиції з негайним вивільненням. Погано розчинні другі активні інгредієнти можуть ефективно усмоктуватися в роті в присутності носія. Придатний носій для погано розчинних активних інгредієнтів, таких як, наприклад, стероїди, такі як тестостерон, прогестерон і естрадіол, НПЗЗ, кардіальні глікозиди, антидіабетики або бензодіазепіни, включає циклодекстрин, їх похідну сполуку або суміш похідних сполук мономерів циклодекстрину або їх полімер. Похідна сполука циклодекстрину являє собою хімічну модифікацію циклодекстрину в гідроксильній ділянці. Полімер циклодекстрину являє собою хімічну похідну сполуку, де кілька мономерів циклодекстрину або похідні сполуки ковалентно з'єднані. Пероральне введення лікарських засобів, що утворюють комплексні сполуки з циклодекстринами або їхніми похідними сполуками, приводить до ефективного поглинання і надходження гормонів у велике коло кровообігу з наступним поступовим усуненням, таким чином, уникаючи швидкої втрати після першого проходження. Придатні циклодекстрини, наприклад, гідроксипропіл-бета-циклодекстрин, полі-бетациклодекстрин і гамма-циклодекстрин, метил-циклодекстрин і ацетонілгідроксипропілциклодекстрин. Додатковий приклад другого активного інгредієнта в пристрої для доставки подвійного лікарського засобу згідно із даним винаходом наданий у виді естрадіолу або аналога або їхньої похідної сполуки, наприклад, для лікування остеопорозу. Зазначений естрадіол або його аналоги можуть бути надані разом з одним або більше додатковими лікарськими засобами, що застосовують у лікуванні остеопорозу як першого активного інгредієнта. Прикладом зазначеного додаткового лікарського засобу є регулятор кальцію, такий як алендронат, клодронат, етидронат, памідронат, ризедронат, тилудронат і/або ібандронат; такі як сіль кальцію, наприклад, фосфат кальцію і/або карбонат кальцію; і/або такий як похідна сполука вітаміну D, наприклад, холекальциферол, кальцитріол і/або альфакальцидол. Зазначений естрадіол або аналог або його похідна сполука як другий активний інгредієнт можуть бути замінені селективним модулятором рецептора естрогену (СМРЕ), наприклад, Ралоксифеном або паратироїдним гормоном, наприклад, рекомбінантним паратироїдним гормоном, таким як терипаратид. СМРЕ і паратироїдний гормон також можуть бути надані з одним або більше додатковими лікарськими засобами, застосовуваними в лікуванні остеопорозу як першого активного інгредієнта, як зазначено вище. Додатковий приклад другого активного інгредієнта в пристрої для доставки подвійного лікарського засобу згідно із даним винаходом наданий у виді нітрогліцерину, наприклад, для лікування стенокардії. Пероральне, наприклад, сублінгвальне, дозування нітрогліцерину, переважно, об'єднане з регульованою в часі системою доставки лікарського засобу з негайним вивільненням, що включає один або декілька додаткових лікарських засобів для лікування стенокардії як першого активного інгредієнта. Зазначений додатковий лікарський засіб для лікування стенокардії являє собою, переважно, таке як бета-блокатор, наприклад, атенолол, піндолол, пропранолол, окспренолол, метопролол і/або бізопролол; антагоніст кальцію, такий як, наприклад, амлодипін, дилтіазем, ніфедипін, беприділ, барнідипін, нікардипін і верапаміл; і/або селективний інгредієнт, що знижує частоту серцевого ритму, наприклад, івабрадин. У найбільш переважному прикладі другий активний інгредієнт являє собою тестостерон або його функціональний аналог. Цей активний інгредієнт, переважно, застосовується в терапії для лікування у чоловіків або жінок: статевої дисфункції, відсутності бажання або еректильної дисфункції, і, переважно, для лікування зниженого статевого потягу. Переважно, вказана терапія є комбінованою терапією разом з першим активним інгредієнтом, в якої тестостерон або функціональний аналог надаються у другій оболонці композиції з негайним вивільненням, і перший активний інгредієнт надається в ядрі регульованої під часі системи доставки лікарського засобу з негайним вивільненням згідно з даним винаходом. 11 UA 113061 C2 5 10 15 20 25 30 35 40 45 50 55 Термін "тестостерон або його функціональний аналог" стосується тестостерону або попередника або метаболіту тестостерону, який забезпечує таку ж або подібну функцію як тестостерон. Переважні попередники тестостерону вибирають з прегненолону, 17αгідроксипрегненолону, прогестерону, 17α-гідроксипрогестерону, дегідроепіандростерону, андростендіону і андростендіолу. Переважні метаболіти тестостерону вибрані з гідроксіандростендіону, гідрокситестостерону, включаючи 2β-, 6β-, 7α-, 12α- і 16αгідрокситестостерон і дигідротестостерон, включаючи 5α- і 5β-дигідротестостерон. Переважний аналог тестостерону здатний зв'язуватися з рецептором андрогену. Найбільш усього переважно, коли вказаний тестостерон або його функціональний аналог є тестостероном. Вказаний "тестостерон або його функціональний аналог" у другій оболонці, переважно, об'єднаний з PDE5-інгібітором, НЕП-інгібітором і/або агоністом рецептора 5-HT1A. Пристрій для доставки подвійного лікарського засобу, що включає регульовану у часі систему доставки лікарського засобу з негайним вивільненням, що включає PDE5-інгібітор, НЕП-інгібітор і/або агоніст рецептора 5-HT1A згідно з даним винаходом, де перша оболонка системи доставки лікарського засобу оточена другою оболонкою, що включає тестостерон або його функціональний аналог, переважно, що забезпечує вивільнення системи доставки лікарського засобу, яка включає PDE5-інгібітор, НЕП-інгібітор і/або агоніст рецептора 5-HT1A, в проміжку між 1,5-5 годинами, більш переважно 2-3 годинами, більш переважно, приблизно через 2,5 години після вивільнення тестостерону або його функціонального аналога. Друга оболонка, що включає стероїд, такий як тестостерон або його функціональний аналог, переважно, включає носій, вибраний з гідроксипропіл-бета-циклодекстрину, полі-бетациклодекстрину, гамма-циклодекстрину і полівінілпіролідону. Переважним полівінілпіролідоном є низькомолекулярний полівінілпіролідон з молекулярною масою максимум 80000. Відповідний полівінілпіролідон, переважно, вибраний з K10, K15, K25, K30 і K50. Найбільш переважно, носієм є гідроксипропіл-бета-циклодекстрин. Наявність погано розчинного стероїду, такого як тестостерон і носій, такий як, циклодекстрин, забезпечує швидку і ефективну доставку тестостерону до слизової, з якої потім стероїд швидко всмоктується в кровотік. Кількість вказаного носія становить, переважно між 0,5 і 70 % (мас./мас.) на основі загальної маси другої оболонки, більш переважно між 2 і 60 % (мас./мас.), більш переважно між 5 і 50 % (мас./мас.). Друга оболонка, переважно, включає ароматизуючу сполуку в доповнення до другого активного інгредієнта і один або декілька ексципієнтів, таких як, наприклад, фарбувальний агент. Вказана ароматизуюча сполука може бути будь-якою натуральною, штучною або синтетичною сполукою або сумішшю сполук, яка є фармацевтично прийнятною. Ілюстративний список ароматизаторів для фармацевтичних застосувань включає циклічні спирти, ефірні олії, синтетичні ароматизуючі олії, ароматизуючі ароматичні сполуки, масла, рідини, олеосмоли і екстракти, що одержуються з рослин, листя, квітів, плодів, стебел, коріння і їх комбінацій. Необмежувальні приклади циклічних спиртів включають ментол, ізоментол, неоментол і неоізоментол. Необмежувальні приклади ароматизуючих олій включають олію м'яти кучерявої, коричну олію, олію грушанки (метилсаліцилат), олію перцевої м'яти, гвоздичну олію, лаврову олію, анісову олію, евкаліптову олію, чебрецеву олію, кедрову олію, мускатну олію, олію запашного перця, олію шавлії, мацисову олію, олію гіркого мигдалю, олію акації і їх комбінації. Відповідні ароматизатори також включають, наприклад, штучні, натуральні і синтетичні фруктові ароматизатори, такі як олії цитрусових (наприклад, лимон, апельсин, лайм і грейпфрут), фруктові есенції (наприклад, лимон, апельсин, лайм,грейпфрут, яблуко, груша, персик, виноград, полуниця, малина, вишня, слива, ананас, абрикос або інші фруктові ароматизатори). Інші корисні штучні, натуральні і синтетичні ароматизатори включають цукор, поліоли, такі як цукрові спирти, штучні підсолоджувачі, такі як аспартам, стевія, сукралоза, неотам, ацесульфам калію і сахарин, шоколад, кава, ваніль, медові порошки і їх комбінації. Інші корисні ароматизатори включають альдегіди і складний ефір, такі як бензальдегід (вишня, мигдаль), цитраль (лимон, вапно), нераль (лимон, лайм), деканаль (апельсин, лимон), С-8 альдегід (цитрусові), С-9 альдегід (цитрусові), С-12 альдегід (цитрусові), толіловий альдегід (вишня, мигдаль), 2,6-диметилоктаналь (незрілий плід), 2-доденаль (цитрусовий мандарин) і їх комбінації. Переважна ароматизуюча сполука є циклічною, така як спирт, наприклад, ментол, ізоментол, неоментол і неоізоментол, переважно, об'єднана з штучним підсолоджувачем, таким як аспартам. Кількість ароматизуючої сполуки становить, переважно між 0,1 і 60 % (мас./мас.) на основі загальної маси другої оболонки, більш переважно між 1 і 40 % (мас./мас.). Наявність ароматизуючої сполуки у другій оболонці пристрою для доставки подвійного лікарського засобу згідно з даним винаходом може маскувати лікарський засіб або ексципієнт з гірким або неприємним смаком. 12 UA 113061 C2 5 10 15 20 25 30 35 40 45 50 55 60 Переважно, коли ароматизуюча сполука у другій оболонці пристрою для доставки подвійного лікарського засобу згідно з даним винаходом швидко зникає з ротової порожнини. Відчуття специфічного аромату в ротовій порожнині вказує пацієнту на те, що друга оболонка не повністю розчинилася і що регульовану у часі систему доставки лікарського засобу з негайним вивільненням, яка охоплена другою оболонкою, необхідно утримувати у роті. Під час застосування другий активний інгредієнт вивільняється спільно з ароматизуючою сполукою з другої оболонки. Пацієнт може легко визначити, що пристрій вивільняє другий активний інгредієнт завдяки наявності аромату (смаку). У кінцевому результаті, здійснюється доставка всієї дози другого активного інгредієнта. У цей момент пристрій також припиняє вивільняти ароматизатор. Зникнення аромату (смаку) вказує на те, що регульовану у часі систему доставки лікарського засобу з негайним вивільненням можна ковтати. Фахівець в галузі техніки розуміє, що ароматизуюча сполука може бути присутньою в першій оболонці замість другої оболонки. У цьому випадку, поява аромату (смаку) вказує на те, що регульовану у часі систему доставки лікарського засобу з негайним вивільненням можна ковтати. Фахівець в галузі техніки додатково розуміє, що перша ароматизуюча сполука може бути присутньою у другій оболонці, в той час як друга ароматизуюча сполука присутня в першій оболонці. При зникненні першого аромату (смаку) і появі другого аромату (смаку), пацієнт розуміє, що пристрій доставив всю дозу другого активного інгредієнта. Додатково, переважно, коли шорсткість зовнішньої поверхні другої оболонки відрізняється від шорсткості зовнішньої поверхні першої оболонки в пристрої згідно з даним винаходом. Пацієнт може бути проінструктований ковтати регульовану у часі систему доставки лікарського засобу з негайним вивільненням тоді, коли відмінність в шорсткості стає очевидною. Це забезпечує достатній час утримання пристрою згідно з даним винаходом у роті так, щоб другий активний інгредієнт в достатній мірі вивільнився і поглинувся. Даний винахід додатково описує застосування ароматизуючої сполуки в пристрої доставки подвійного лікарського засобу для позначення того, що пристрій необхідно тримати у роті доти, доки аромат (смак) не зникає. Даний винахід додатково описує застосування ароматизуючої сполуки в пристрої доставки подвійного лікарського засобу для позначення того, що пристрій необхідно тримати у роті доти, доки аромат (смак) не з'являється. Даний винахід додатково описує спосіб одержання пристрою для доставки подвійного лікарського засобу, що включає першу і другу оболонку, де ароматизуюча сполука присутня у другій оболонці для позначення того, що пристрій необхідно тримати у роті доти, доки аромат (смак) не зникає. Даний винахід додатково описує спосіб одержання пристрою для доставки подвійного лікарського засобу, що включає першу і другу оболонку, де ароматизуюча сполука присутня в першій оболонці для позначення того, що пристрій необхідно тримати у роті доти, доки аромат (смак) не з'являється. Даний винахід додатково описує застосування відмінності в шорсткості між зовнішньою поверхнею першої оболонки і зовнішньою поверхнею другої оболонки в пристрої для доставки подвійного лікарського засобу для позначення того, що пристрій необхідно тримати у роті. Даний винахід додатково описує застосування відмінності в шорсткості між зовнішньою поверхнею першої оболонки і зовнішньою поверхнею другої оболонки в пристрої для доставки подвійного лікарського засобу для позначення того, що пристрій треба ковтати. Даний винахід додатково описує спосіб одержання пристрою для доставки подвійного лікарського засобу, що включає першу і другу оболонки, в якому шорсткість зовнішньої поверхні першої оболонки відрізняється від шорсткості зовнішньої поверхні другої оболонки. У даному винаході виявлено, що активний інгредієнт, присутній у другій оболонці пристрою доставки лікарського засобу, як наведено в даному описі вище, дуже добре всмоктується через слизову оболонку рота. Абсолютне всмоктування, що вимірюється по біодоступності, і швидкість всмоктування були значно вищими в порівнянні з рідиною, що містить таку ж кількість активного інгредієнта. Обидві змінні кількісно визначали шляхом вимірювання концентрації активного інгредієнта в крові пацієнта в різні моменти часу після застосування. Фігура 11 показує результати порівняння 0,5 мг тестостерону в рідкій формі (F1) з 0,5 мг тестостерону в таблетці за даним винаходом (F2). Фігура показує концентрацію тестостерону загальну (А) і вільного тестостерону (В). Композиція таблетки наведена в таблиці 7. Композиція тестостерону в рідкій формі наведена в прикладі 6. Обидві композиції утримували протягом 90 секунд під язиком у здорових добровольців. Зображений профіль всмоктування не був очікуваним. У рідкій фазі активний інгредієнт вже розчинений, тоді як в таблетці активний інгредієнт присутній у вигляді твердої речовини, якій потрібне розчинення до того, як вона стане доступна для 13 UA 113061 C2 5 10 15 20 25 30 35 40 45 50 55 60 всмоктування. Цей аспект не залежить від наявності першої оболонки на ядрі. Перша оболонка може бути присутньою або бути відсутньою. Тому, даний винахід додатково описує таблетку для сублінгвального введення активного інгредієнта, де вказана таблетка, включає ядро і оболонку (зовнішню оболонку) на зовнішній поверхні вказаного ядра і, за бажанням, оболонку, яка відділяє вказану зовнішню оболонку від вказаного ядра (розділова оболонка). У переважному варіанті здійснення даного винаходу вказана зовнішня оболонка включає тестостерон або його функціональний аналог. У переважному варіанті здійснення даного винаходу вказане ядро являє собою таке ядро, як визначене вище в даному описі, для пристрою доставки лікарського засобу з регульованим у часі негайним вивільненням. Переважно, вказана додаткова розділова оболонка являє собою першу оболонку як визначено вище в даному описі для пристрою доставки лікарського засобу і, переважно, вказана зовнішня оболонка є другою оболонкою, як визначено вище в даному описі, для пристрою доставки подвійного лікарського засобу. В особливо переважному варіанті здійснення даного винаходу вказана зовнішня оболонка включає суміш активного інгредієнта в аморфній формі в кількості приблизно 0,1-10 мг; полімер оболонки в кількості приблизно 0,25-25 мг; і воду в кількості приблизно 0,0-10 % мас./мас. від зовнішньої оболонки. Вказаний активний інгредієнт в аморфній формі являє собою, переважно, другий активний інгредієнт, як указано вище в даному описі, для пристрою доставки подвійного лікарського засобу. У переважному варіанті здійснення даного винаходу вказаний активний інгредієнт в аморфній формі являє собою тестостерон або його функціональний аналог. Вказаний функціональний аналог тестостерону являє собою, переважно, функціональний аналог тестостерону, як визначено вище в даному описі. В особливо переважному варіанті здійснення даного винаходу вказаний активний інгредієнт являє собою тестостерон. У цьому варіанті здійснення даного винаходу вказана суміш, переважно, додатково включає циклодекстрин або полівінілпіролідон або їх комбінацію в кількості 0,25-25 мг. У переважному варіанті здійснення даного винаходу вказана суміш включає вказаний активний інгредієнт в кількості приблизно 0,2-5,0 мг; вказаний полімер оболонки в кількості приблизно 0,5-12,5 мг; і воду в кількості приблизно 0,0-5 % мас./мас. на основі зовнішньої оболонки. У цьому варіанті здійснення даного винаходу вказана суміш, переважно, додатково включає циклодекстрин або полівінілпіролідон або їх комбінацію в кількості 0,25-25 мг. У той час як суміш може включати циклодекстрин або полівінілпіролідон або їх комбінацію, переважно, коли вказана суміш включає циклодекстрин. Таблетка з сумішшю, яка містить циклодекстрин і, що не містить полівінілпіролідон, є стійкішими, зокрема, коли активний інгредієнт являє собою тестостерон або його функціональний аналог. І циклодекстрин, і полівінілпіролідон запобігають кристалізації аморфного тестостерону або його функціонального аналога в твердій оболонці при тривалому утриманні і/або впливі різних температур, які можуть зустрітися під час зберігання таблеток. Полімер оболонки для вказаної зовнішньої оболонки, переважно, є плівкоутворювальним інгредієнтом, таким, як указано вище в даному описі для вказаної другої оболонки пристрою доставки подвійного лікарського засобу. Вказана суміш, переважно, додатково включає підсолоджувач і/або смакову добавку, таку як визначено вище в даному описі. У переважному варіанті здійснення даного винаходу вказана зовнішня оболонка складається з вказаної суміші. Таблетка за цим варіантом здійснення може, як вказано в даному описі вище, включати розділову оболонку, яка відділяє вказану зовнішню оболонку від вказаного ядра. Вказана розділова оболонка, у випадку її присутності, переважно, є рН-незалежною оболонкою або рН-залежною оболонкою, переважно, розчинною в кислоті оболонкою або кишково-розчинною оболонкою. В іншому переважному варіанті здійснення даного винаходу вказана розділова оболонка є першою оболонкою, як визначено вище в даному описі, для пристрою доставки лікарського засобу. Вказана розділова оболонка, переважно, включає гідрофобний полімер і гідрофільну речовину, як визначено вище в даному описі, для пристрою доставки лікарського засобу. У цьому переважному варіанті здійснення даного винаходу вказане ядро і вказана додаткова розділова оболонка мають об'єм 50-1000 3 мм . Переважно, вказане ядро включає целюлозу, як визначено вище в даному описі, для пристрою доставки лікарського засобу, наповнювач, такий як органічна і/або неорганічна сіль, як визначено вище в даному описі, для пристрою доставки лікарського засобу і активного інгредієнта. Переважно, вказаний активний інгредієнт є першим активним інгредієнтом, як визначено вище в даному описі, для пристрою доставки лікарського засобу. Даний винахід додатково описує спосіб введення активного інгредієнта пацієнту, де вказаний спосіб включає забезпечення потребуючого цього пацієнта пристроєм для доставки подвійного лікарського засобу або таблеткою згідно з даним винаходом, в якому вказаний пацієнт утримує пристрій для доставки подвійного лікарського засобу або таблетку у роті протягом проміжку часу між 10 секундами і 5 хвилинами, і в якому пацієнт потім ковтає вказаний 14 UA 113061 C2 5 10 15 20 25 30 35 40 45 50 55 60 пристрій для доставки подвійного лікарського засобу або таблетку. У переважному варіанті здійснення даного винаходу вказаний пацієнт утримує пристрій для доставки подвійного лікарського засобу або таблетку у роті протягом проміжку часу між 30 секундами і 2,5 хвилинами до ковтання вказаного пристрою для доставки подвійного лікарського засобу або таблетки. Переважно, вказаний пацієнт утримує пристрій для доставки подвійного лікарського засобу або таблетку у роті протягом проміжку часу від 60 секунд до 90 секунд до моменту ковтання вказаного пристрою для доставки подвійного лікарського засобу або таблетки. У переважному варіанті здійснення даного винаходу вказаний пристрій для доставки подвійного лікарського засобу або таблетка утримуються під язиком протягом вказаного часу. В особливо переважному варіанті здійснення даного винаходу вказаний пристрій для доставки подвійного лікарського засобу або таблетку вміщують під язик, після чого пацієнт без натиску утримує або злегка рухає пристрій для доставки подвійного лікарського засобу або таблетку приблизно протягом 90 секунд. Переважно, коли вказаний пацієнт не ковтає пристрій для доставки подвійного лікарського засобу або таблетку або слину під час періоду утримування у роті і, переважно, під язиком. Пацієнт, переважно, не жує і не кусає пристрій для доставки подвійного лікарського засобу або таблетку. При завершенні часу утримання пристрій для доставки подвійного лікарського засобу або таблетку пацієнт, переважно, ковтає повністю, за бажанням, разом з рідиною, такою як вода. Пристрій для доставки подвійного лікарського засобу або таблетка, що включає тестостерон або його функціональний аналог в зовнішній оболонці або як другий активний інгредієнт, може бути з успіхом застосований для лікування у чоловіків або жінок: статевої дисфункції, відсутності бажання або еректильної дисфункції, і, переважно, для лікування зниженого статевого потягу. Даний винахід, таким чином, додатково забезпечує пристрій для доставки подвійного лікарського засобу або таблетку за даним винаходом для сублінгвального введення тестостерону або його функціонального аналога для лікування у чоловіків або жінок: статевої дисфункції, відсутності бажання або еректильної дисфункції, і, переважно, для лікування зниженого статевого потягу, де вказаний пристрій для доставки подвійного лікарського засобу або таблетка включають ядро і оболонку (зовнішню оболонку) на зовнішній поверхні вказаного ядра і, за бажанням, оболонку, яка відділяє вказану зовнішню оболонку від вказаного ядра (розділову оболонку), де вказана зовнішня оболонка включає вказаний тестостерон або його функціональний аналог. У додатковому переважному варіанті здійснення даного винаходу пристрій для доставки подвійного лікарського засобу або таблетка, що включають тестостерон або його функціональний аналог в зовнішній оболонці або як другий активний інгредієнт, можуть бути з успіхом застосовані для лікування гіпогонадизму у чоловіків. Даний винахід, таким чином, додатково описує пристрій для доставки подвійного лікарського засобу або таблетку за даним винаходом для сублінгвального введення тестостерону або його функціонального аналога для лікування гіпогонадизму у чоловіків, де вказаний пристрій для доставки подвійного лікарського засобу або таблетка включають ядро і оболонку (зовнішня оболонка) на зовнішній поверхні вказаного ядра і, за бажанням, оболонку, яка відділяє вказану зовнішню оболонку від вказаного ядра (розділова оболонка), де вказана зовнішня оболонка включає вказаний тестостерон або його функціональний аналог. У додатковому переважному варіанті здійснення даного винаходу пристрій для доставки подвійного лікарського засобу або таблетка, що включають естроген і/або прогестерон або їх функціональний аналог в зовнішній оболонці або як другий активний інгредієнт можуть бути з успіхом застосовані для лікування гіпогонадизму у жінок. Даний винахід, таким чином, додатково описує пристрій для доставки подвійного лікарського засобу або таблетку за даним винаходом для сублінгвального введення естрогену і/або прогестерону або їх функціонального аналога для лікування гіпогонадизму у жінок, де вказаний пристрій для доставки подвійного лікарського засобу або таблетка включають ядро і оболонку (зовнішня оболонка) на зовнішній поверхні вказаного ядра і, за бажанням, оболонку, яка відділяє вказану зовнішню оболонку від вказаного ядра (розділова оболонка), де вказана зовнішня оболонка включає вказаний естроген і/або прогестерон або їх функціональний аналог. Переважний пристрій для доставки подвійного лікарського засобу згідно з даним винаходом включає: ядро: між 100 мг і 150 мг, переважно між 109 мг і 126,5 мг Pharmacel pH102; між 100 мг і 150 мг, переважно між 109 мг і 126,5 мг дикальційфосфату безводного; між 25 мг і 100 мг, переважно між 35 мг і 70 мг силденафілцитрату; між 10 мг і 20 мг, переважно приблизно 12 мг кроскармелози; 15 UA 113061 C2 5 10 15 20 25 30 35 40 45 50 55 60 між 1 мг і 2 мг, переважно приблизно 1,5 мг стеарату магнію; Перша оболонка: між 5 мг і 20 мг, переважно приблизно 12,5 мг Ethocel 20; між 5 мг і 20 мг, переважно приблизно 12,5 мг Avicel pH 105; Друга оболонка: між 1 мг і 2 мг, переважно приблизно 1,34 мг ГПМЦ 5 сПз між 2 мг і 3,5 мг, переважно приблизно 2,66 мг гідроксипропіл В-циклодекстрину; між 0,1 мг і 1 мг, переважно між 0,25 мг і 0,5 мг тестостерону. Друга оболонка вказаної переважної системи доставки подвійного лікарського засобу, переважно, додатково включає між 1 мг і 2 мг, переважно приблизно 1,34 мг олії перцевої м'яти і між 0,5 мг і 1,5 мг, переважно приблизно 1,0 мг аспартаму. Додатковий переважний пристрій для доставки подвійного лікарського засобу згідно з даним винаходом включає: ядро: між 50 мг і 150 мг, переважно між 75 мг і 125 мг, переважно приблизно 97,5 мг Pharmacel pH 200; між 150 мг і 250 мг, переважно між 175 мг і 225 мг, переважно приблизно 201,5 мг дикальційфосфату безводного; між 1 мг і 20 мг, переважно між 5 мг і 15 мг, переважно приблизно 10 мг буспіронгідрохлориду; між 10 мг і 20 мг, переважно приблизно 13 мг кроскармелози; між 1 мг і 10 мг, переважно між 2 мг і 5 мг, переважно приблизно 4,4 мг стеарату магнію; Перша оболонка між 5 мг і 20 мг, переважно приблизно 14,7 мг Ethocel 20; між 10 мг і 50 мг, переважно між 20 мг і 40 мг, переважно приблизно 29,3 мг pH Avicel 105; Друга оболонка: між 1 мг і 2 мг, переважно приблизно 1,34 мг ГПМЦ 5 сПз між 2 мг і 3,5 мг, переважно приблизно 2,66 мг гідроксипропіл В-циклодекстрину; між 0,1 мг і 1 мг, переважно між 0,25 мг і 0,5 мг тестостерону. Друга оболонка вказаної переважної системи доставки подвійного лікарського засобу, переважно додатково включає між 1 мг і 2 мг, переважно приблизно 1,34 мг олії перцевої м'яти і між 0,5 мг і 1,5 мг, переважно приблизно 1,0 мг аспартаму. ОПИС ФІГУР Фігура 1. In vitro патерн вивільнення оболонки з Ethocel. Фігура являє собою профіль вивільнення однієї таблетки, покритої сумішшю Ethocel 45 і лактози 200 меш (11a). Викид з часом запізнення 1,90 год. ± 12 хв еквівалентний такому з інших оболонок, які описані в таблиці 1-3. Протягом 6 хвилин вивільняється більше 80 % лікарського засобу. Фігура 2. Мікрофотографії растрової електронної мікроскопії (SEM), що показують поверхневі характеристики оболонки. Чорні точки є порами на поверхні. (А) Таблетка, покрита Ethocel/Avicel PH105 (1:1). До і (В) після руйнування є множина пор. (С) Оболонка з Ethocel/лактоза 450m (1:1) містить ледве помітну кількість пор. (D) множина пор утворюється при руйнуванні оболонки. Фігура 3. Мікрофотографії SEM, що показують поперечний розріз першої оболонки до руйнування оболонки. (А) Ethocel/Avicel PH105 (1:1). (В) Ethocel/Лактоза 450m. Фігура 4. Залежність часу руйнування оболонки від середньої маси оболонки таблеток з ядра з силденафілу, що одержуються за допомогою пристрою для нанесення плівки-оболонки з перфорованим барабаном. Дані представлені для перших оболонок з 60 % Avicel і 40 % Ethocel (діапазон маси оболонки 25-32 мг) і для перших оболонок з 67 % Avicel і 33 % Ethocel (діапазон маси оболонки 34-46 мг). Чорні лінії: максимальні значення. Темно-сіра лінія: середні значення. Ясно-сірі лінії: мінімальні значення. Фігура 5. Результати аналізу на вміст тестостерону залежно від маси розчину, який містить тестостерон для другої оболонки. Другий розчин для створення оболонки розпилювали в пристрої для нанесення плівки-оболонки з перфорованим барабаном, результати вказують на те, що розпилювана маса є відповідним параметром при створенні оболонки, для того, щоб одержати однорідності при належному вмісті тестостерону. Фігура 6. Рівні загальної кількості тестостерону, обчислені як середнє геометричне, в сироватці після введення 0,25, 0,50 і 0,75 мг тестостерону сублінгвально. Нормальний діапазон загальної кількості тестостерону становить від 0,14 до 0,66 нг/мл (від 0,5 до 2,3 нмоль/л) (Davison et al., 2005). Щоб перетворити загальну кількість тестостерону в кількість в наномолях на літр, треба помножити на 3,467. 16 UA 113061 C2 5 10 15 20 25 30 35 40 45 50 55 Фігура 7. Рівні вільного тестостерону, обчислені як середнє геометричне, в сироватці після введення 0,25, 0,50 і 0,75 мг тестостерону сублінгвально. Нормальний діапазон вільного тестостерону становить від 0,00072 до 0,0036 нг/мл (від 2,5 до 12,5 пмоль/л) (Davison et al., 2005). Щоб перетворити кількість вільного тестостерону в кількість в пікомолях на літр, треба помножити на 3467. Фігура 8. Вільну фракцію тестостерону при введенні 0,25 мг, 0,50 мг і 0,75 мг вимірювали від моменту часу t=4 хв до t=30 хв. Фігура 9. Вільну фракцію тестостерону при введенні 0,25 мг, 0,50 мг і 0,75 мг, вимірювали від моменту часу t=4 хв до t=30 хв для груп з низьким і високим рівнем ГСПГ. * статистично значуща різниця між введенням 0,25 мг і 0,75 мг (Р=
ДивитисяДодаткова інформація
Назва патенту англійськоюDrug delivery system
Автори англійськоюBloemers, Johannes Martinus Maria, Eissens, Anko Cornelus, Frijlink, Henderik Willem, de Leede, Leonardus Gerardus Jozef
Автори російськоюБлумерс Йоханнес Мартинус Мария, Эйссэнс Анко Корнелус, Фрейлинк Хэндэрик Виллем, дэ Лееде Леонардус Герардус Йозэф
МПК / Мітки
МПК: A61K 9/28, A61K 31/519, A61K 31/00, A61K 31/568, A61K 9/00, A61K 9/20
Мітки: доставки, засобу, лікарського, система
Код посилання
<a href="https://ua.patents.su/51-113061-sistema-dostavki-likarskogo-zasobu.html" target="_blank" rel="follow" title="База патентів України">Система доставки лікарського засобу</a>
Попередній патент: Система утилізації відпрацьованого тепла для насосної системи
Наступний патент: Похідні 5-фтор-4-іміно-3-(заміщеного)-3,4-дигідропіримідин-2(1н)ону
Випадковий патент: Вакуумний агрегат для відкачування газів