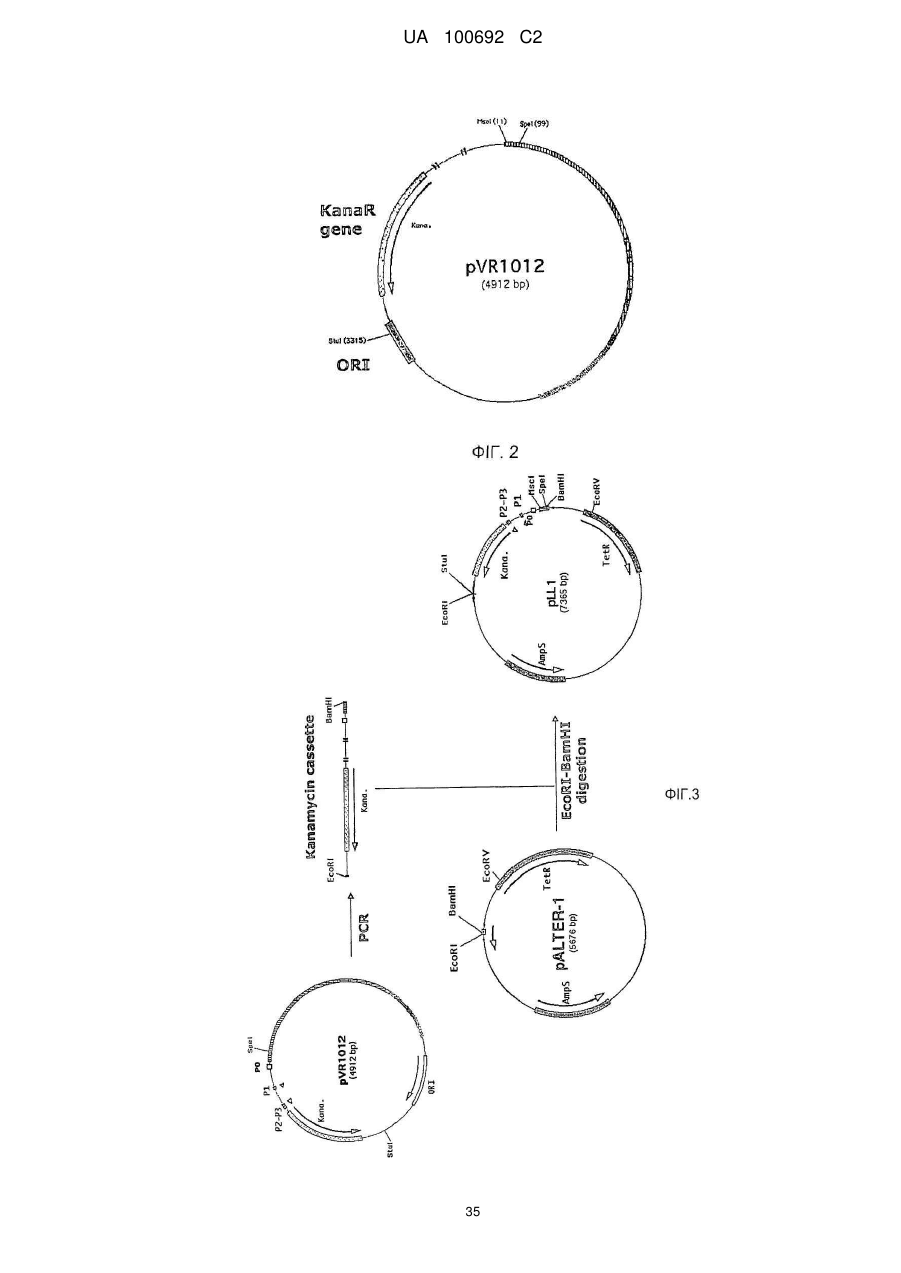
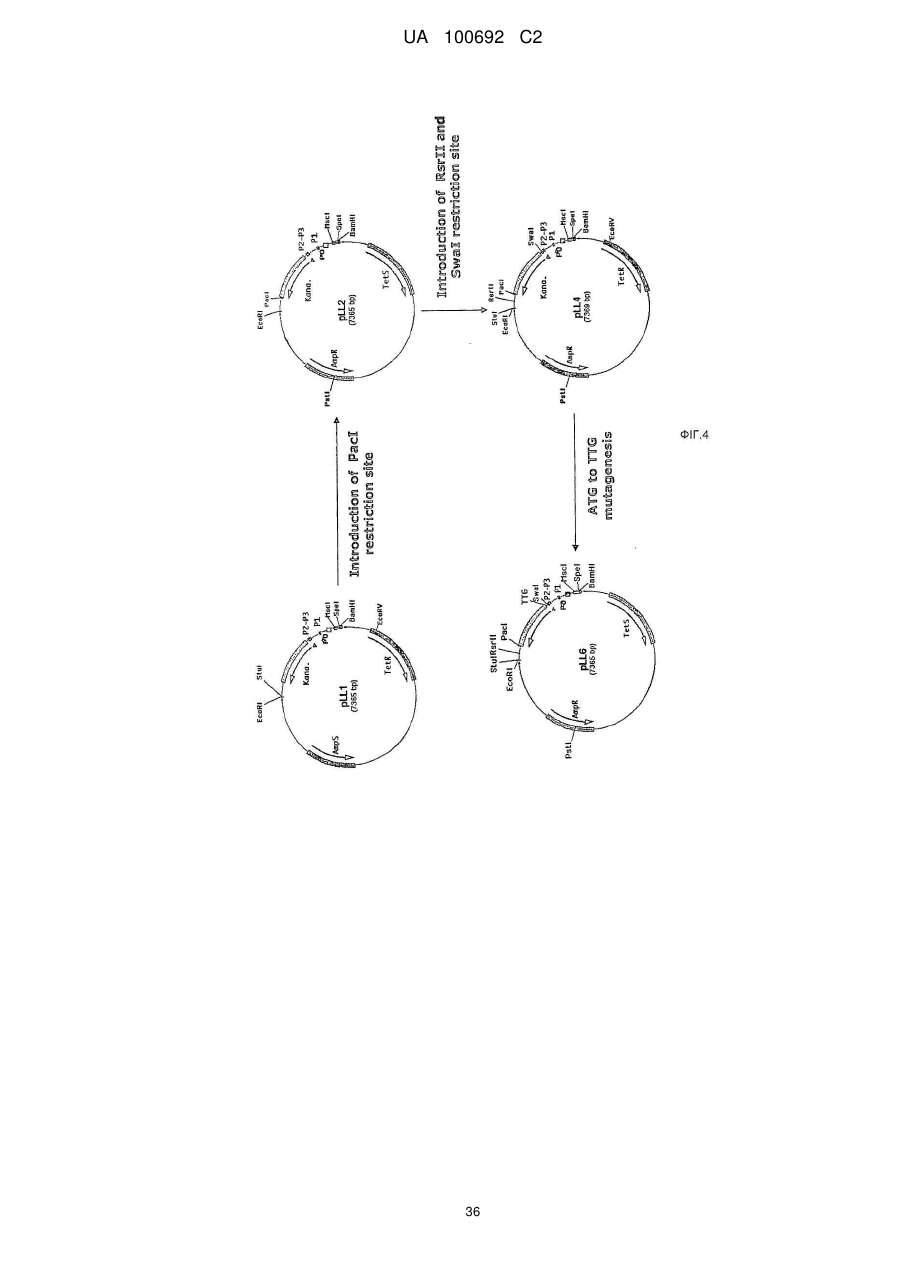
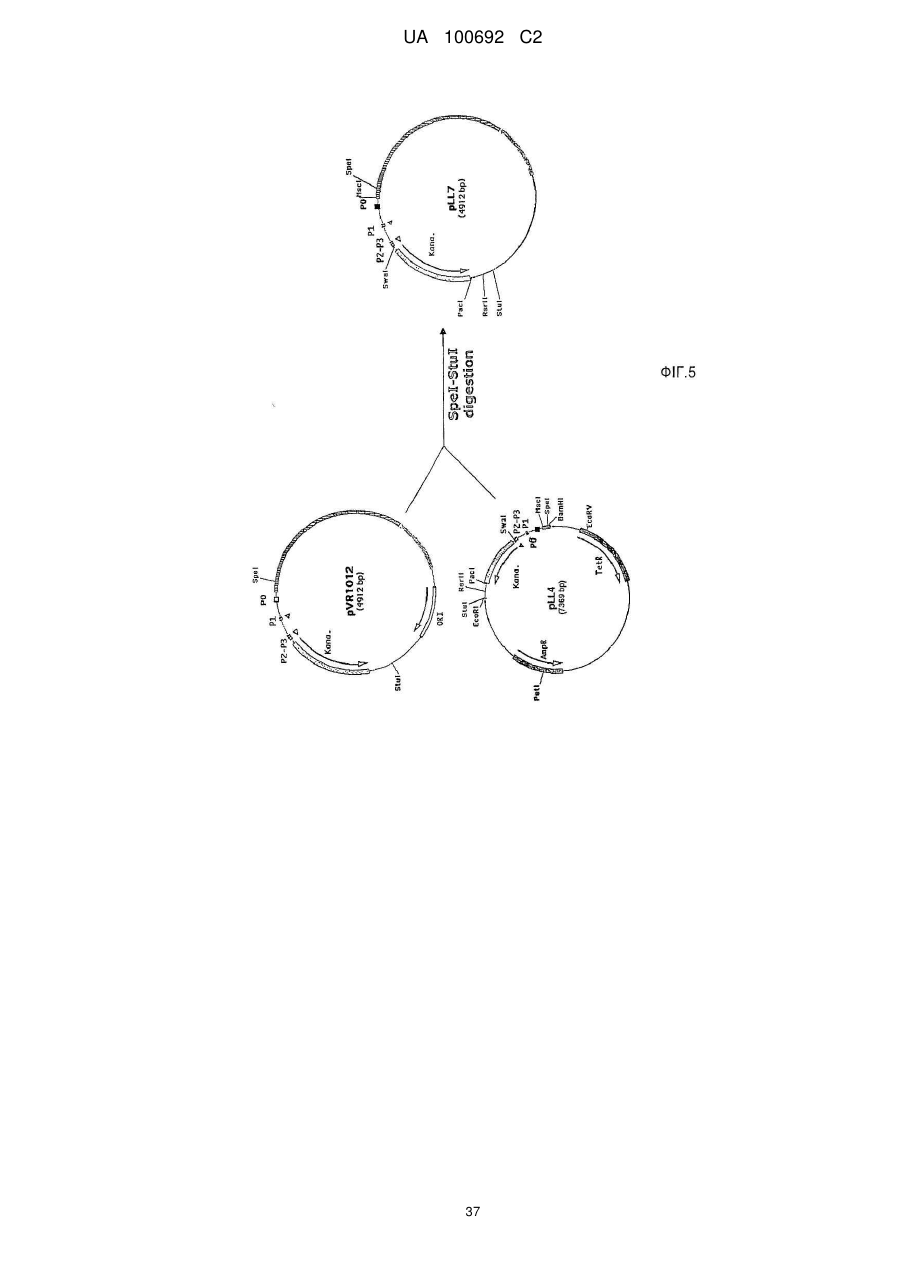
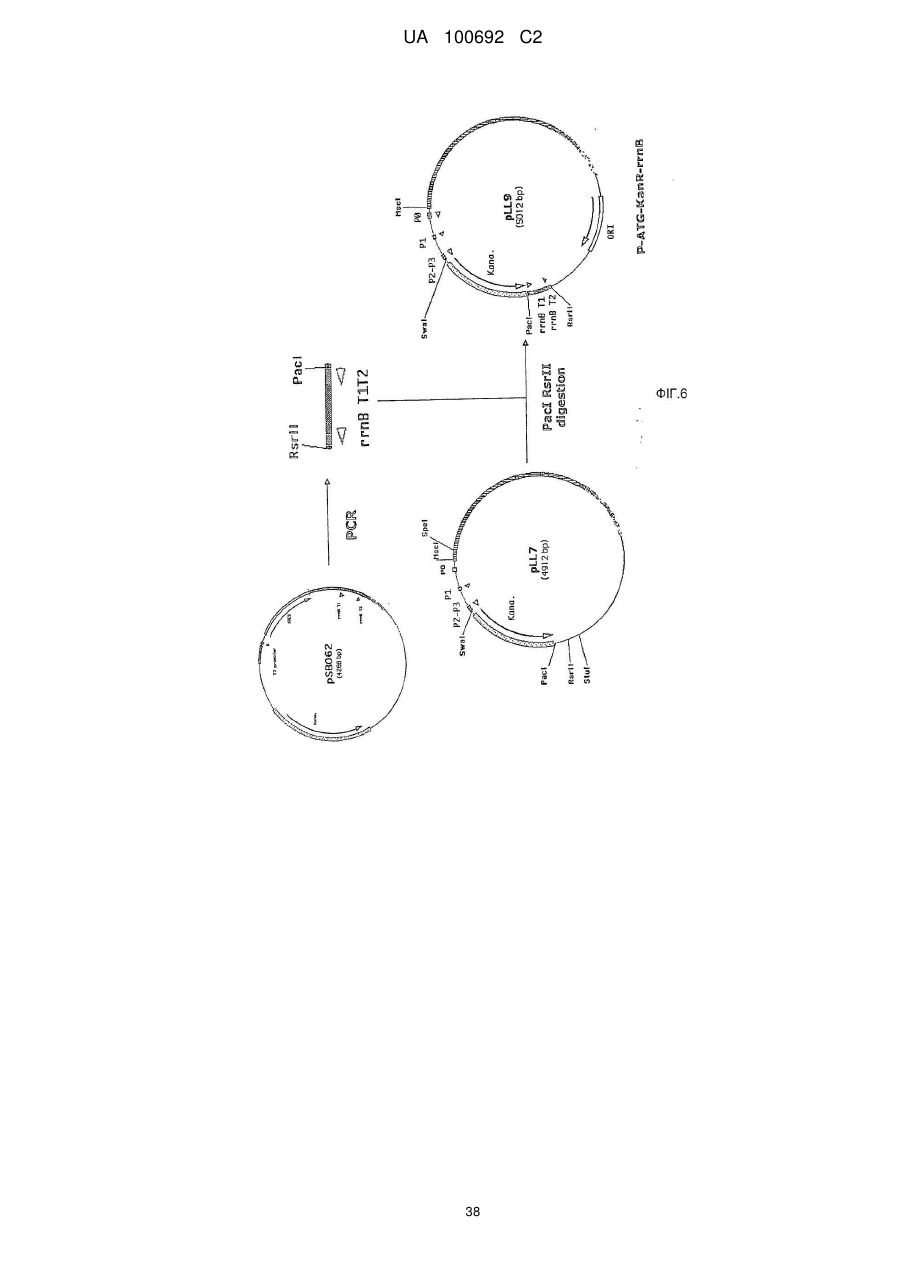
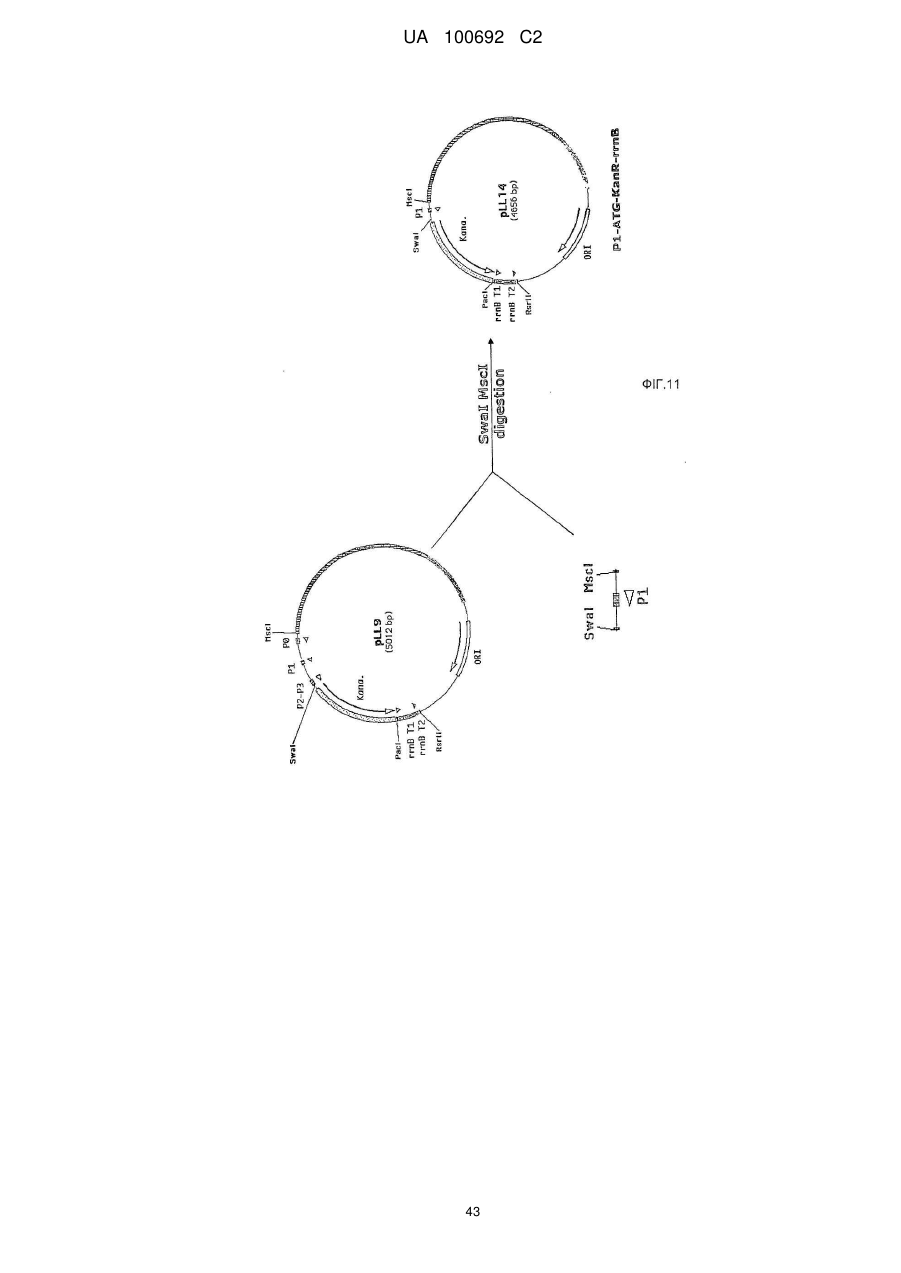
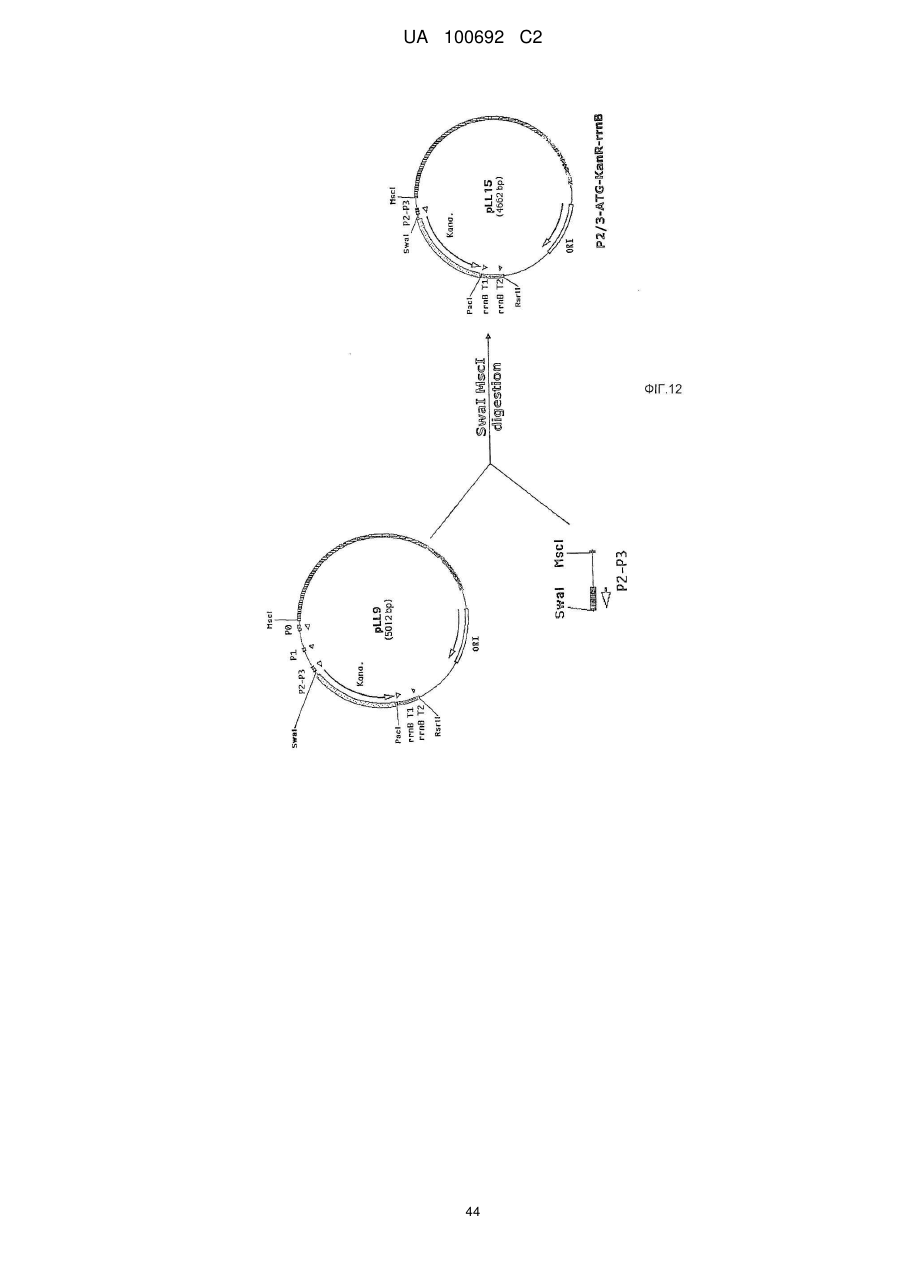
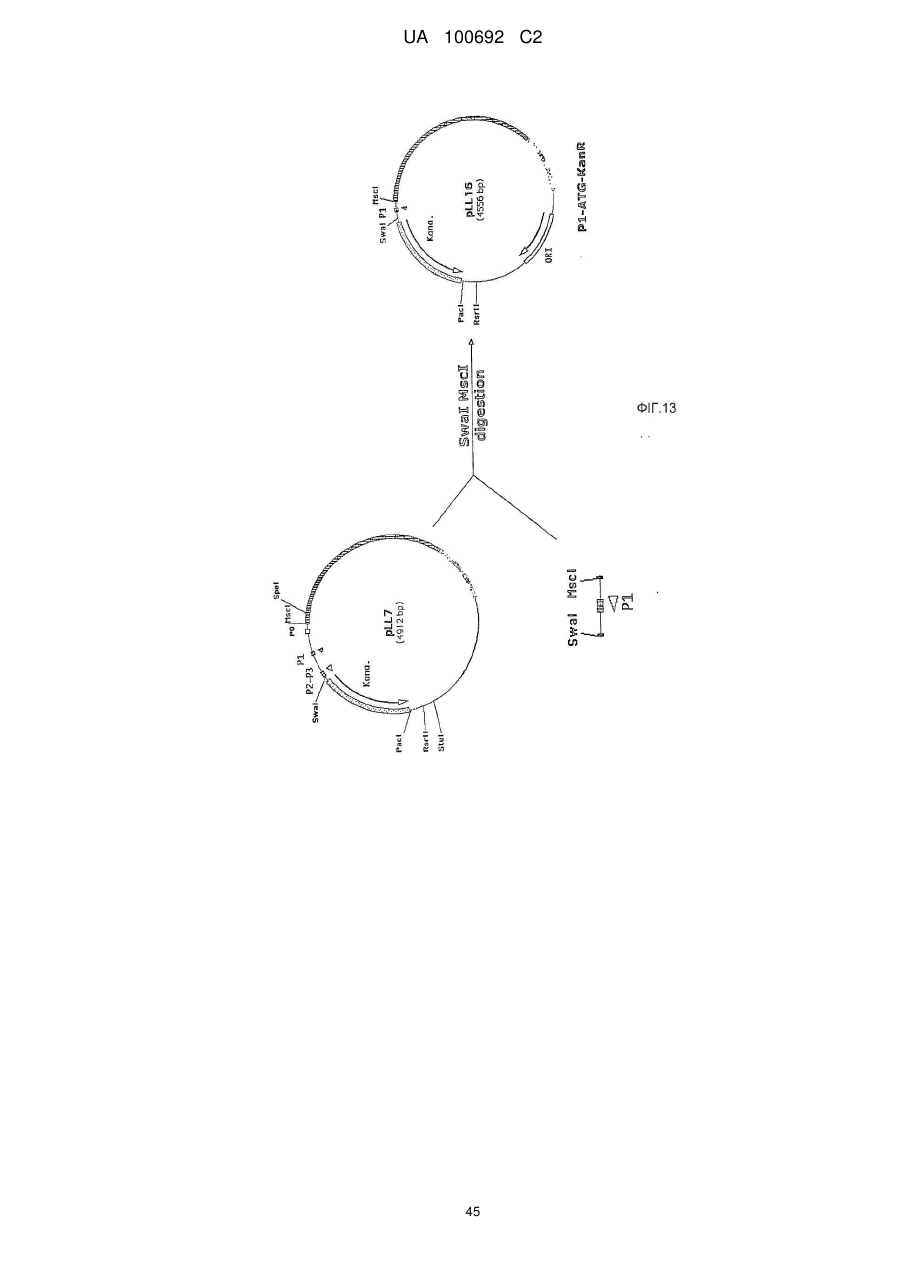
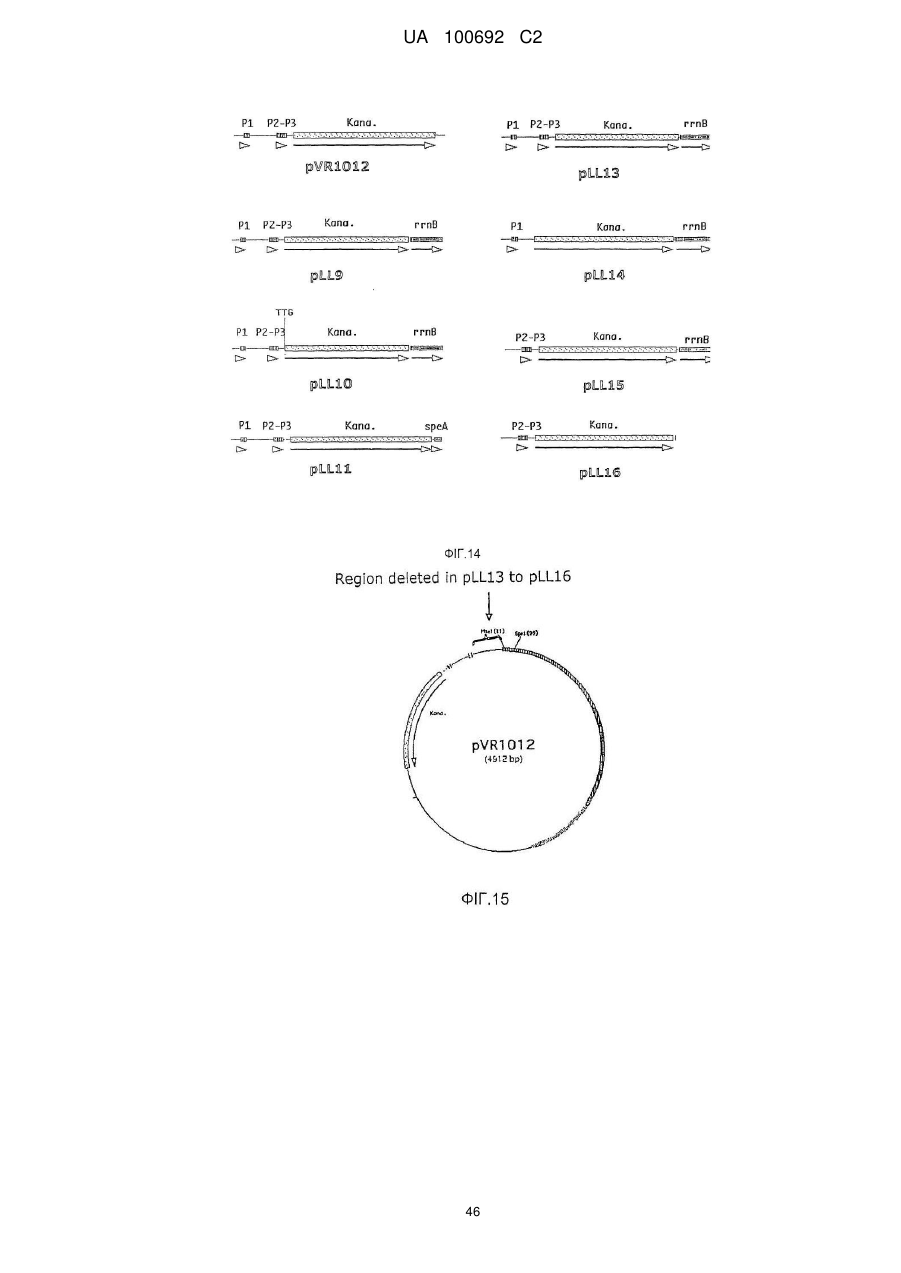
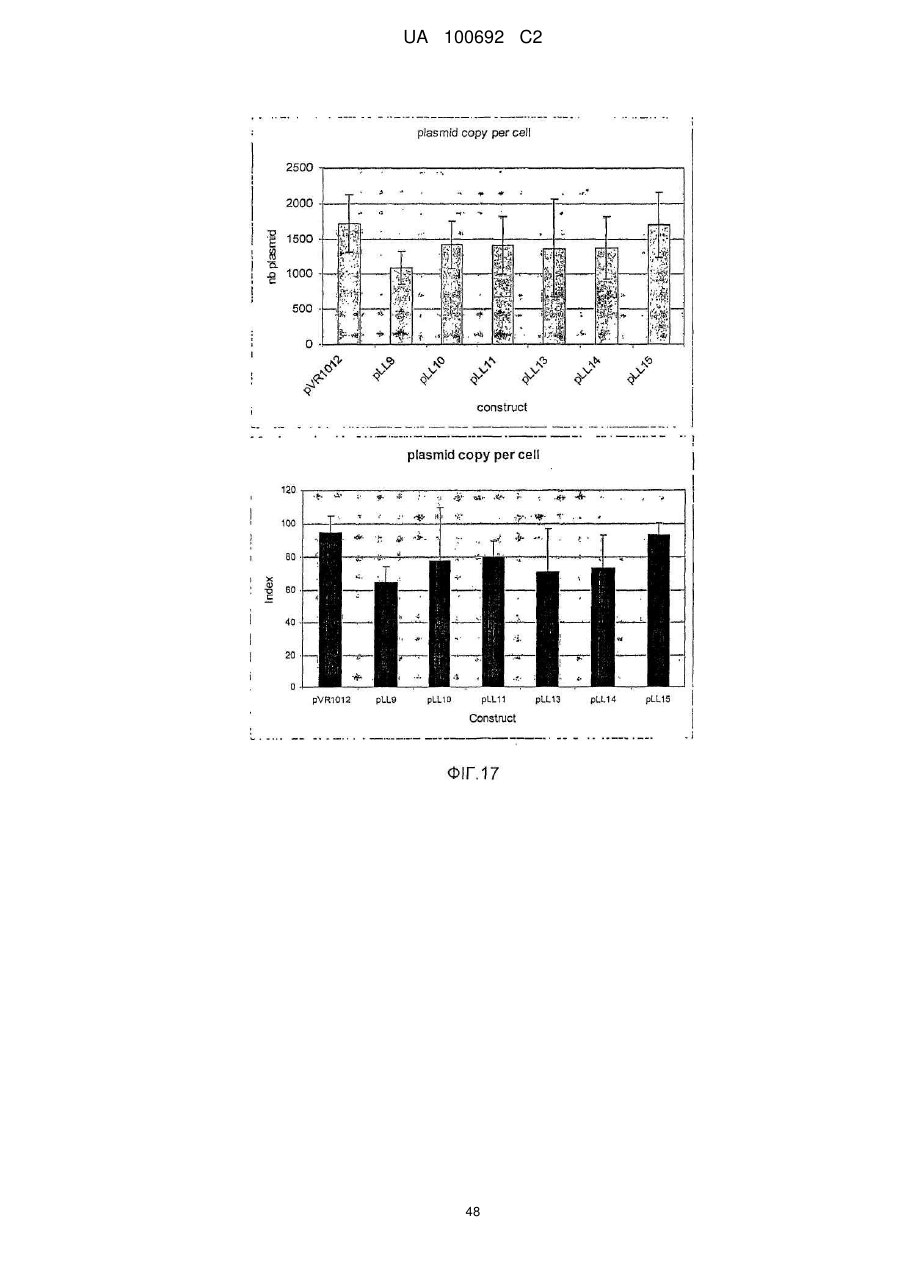
Днк-плазміди, які мають підвищену експресію та стабільність
Формула / Реферат
1. ДНК-плазміда для доставки та експресії антигена, епітопів, іммуногена, пептиду або поліпептиду, що представляють інтерес, що містить ген стійкості до канаміцину (KanaR), яка містить
(а) послідовність промотору, яка або
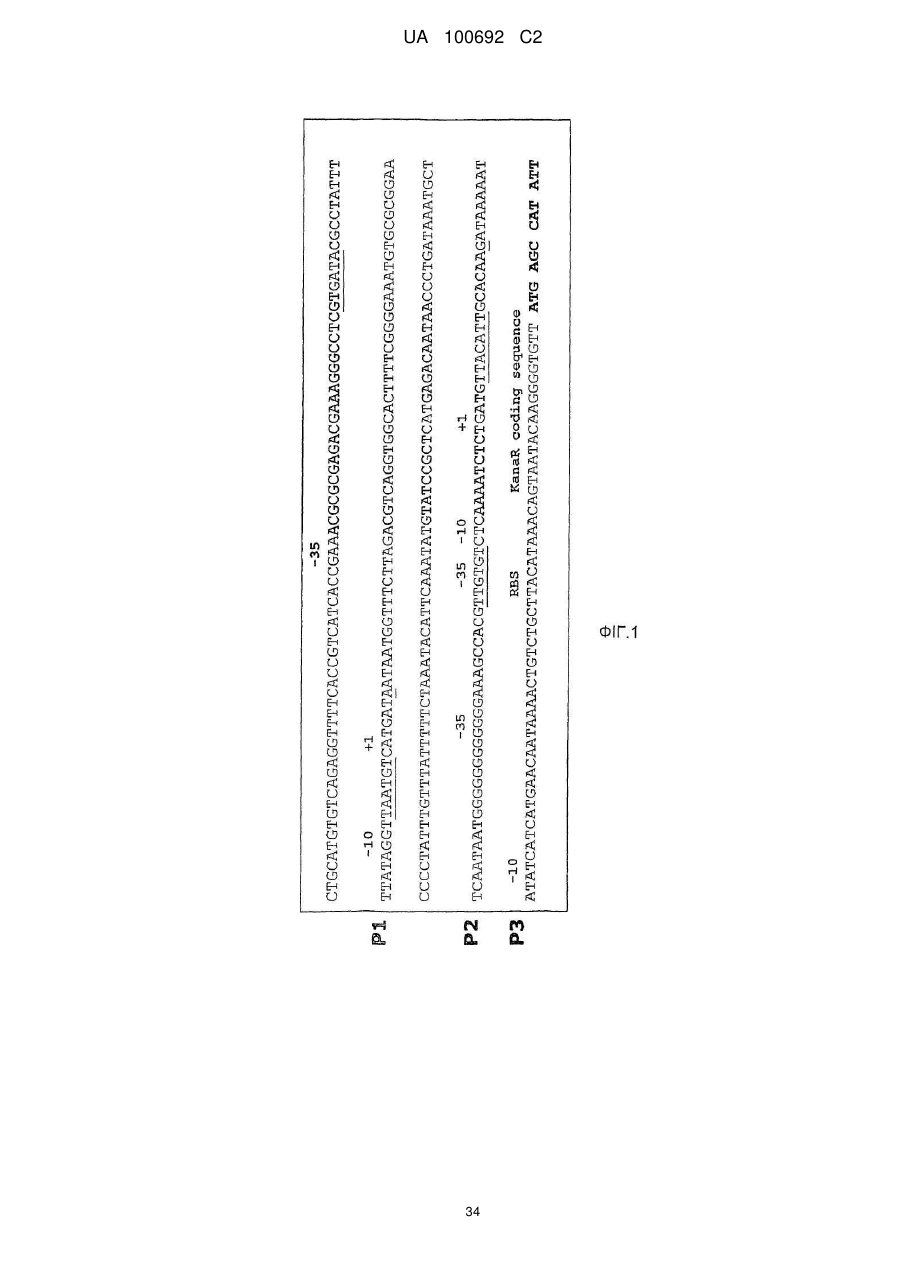
(i) складається з послідовності SEQ ID NO:1 (P1),
(ii) складається з модифікованого природного промотора KanaR з pVR1012, в якому послідовність SEQ ID NO:2 і 3 (P2/3) була видалена з природного промотора для отримання вказаного модифікованого природного промотора, або
(iii) складається з послідовності SEQ ID NO:1, 2, і 3 (P1+P2/P3), або
(iv) складається з послідовності SEQ ID NO:2 і 3 (P2/3); та
(b) ініціаторний кодон TTG або ATG; та,
де експресія KanaR знижується в порівнянні з експресією KanaR, притаманною промотору природного промотора KanaR, присутнього в pVR1012 ((P0, P1 (SEQ ID NO:1), і P2-P3 (SEQ ID NO :2-3)).
2. Плазміда за п. 1, яка відрізняється тим, що додатково містить термінатор транскрипції rrnB T1-T2 (нуклеотиди 532-575 та 707-734 SEQ ID NO:6).
3. Плазміда за п. 1, яка відрізняється тим, що промотор KanaR складається з P1 (SEQ ID NO:1), має ініціаторний кодон ATG та не має термінатора транскрипції.
4. Плазміда за п. 1, яка відрізняється тим, що промотор KanaR складається з P1 (SEQ ID NO:1), має ініціаторний кодон ТTG та не має термінатора транскрипції.
5. Плазміда за п. 1, яка відрізняється тим, що промотор KanaR складається з P1 (SEQ ID NO:1), має ініціаторний кодон ТTG та термінатор транскрипції rrnB T1-T2, представлений нуклеотидами 532-575 та 707-734 з SEQ ID NO:6.
6. Плазміда за п. 1, яка відрізняється тим, що промотор KanaR складається з P1 (SEQ ID NO:1), має ініціаторний кодон ТTG та термінатор транскрипції rrnB T1-T2, представлений нуклеотидами 532-575 та 707-734 з SEQ ID NO:6 та додатково містить ген env котячого вірусу імунодефіциту (FIV).
7. Плазміда за п. 1, яка відрізняється тим, що промотор KanaR складається з P1 (SEQ ID NO:1), має ініціаторний кодон АTG та термінатор транскрипції rrnB T1-T2, представлений нуклеотидами 532-575 та 707-734 з SEQ ID NO:6 та додатково містить ген env котячого вірусу імунодефіциту (FIV).
8. Плазміда за п. 1, яка відрізняється тим, що промотор KanaR складається з P1 (SEQ ID NO:1).
9. Плазміда за п. 1, яка відрізняється тим, що промотор KanaR складається з P1 (SEQ ID NO:1) и P2-P3 (SEQ ID NO:2-3).
10. Плазміда за п. 1, яка відрізняється тим, що промотор KanaR складається з P2-P3 (SEQ ID NO: 2-3).
11. Плазміда за будь-яким з пп. 1-10, яка відрізняється тим, що KanaR не має термінатор транскрипції.
12. Плазміда за будь-яким з пп. 1-10, яка відрізняється тим, що KanaR має термінатор транскрипції.
13. Композиція для доставки та експресії антигена, епітопів, імуногена, пептиду або поліпептиду, що представляють інтерес, яка містить:
(A) плазміду за п. 1, що містить кодуючу послідовність для представляючих інтерес антигена, епітопів, іммуногена, пептиду або поліпептиду, яка функціонально пов'язана з послідовністю контролю експресії, і
(B) фармацевтично або ветеринарно прийнятний переносник, носій або наповнювач.
14. Композиція за п. 13, яка відрізняється тим, що кодуюча послідовність отримана з вірусу або іншого патогена, який інфікує птахів, велику рогату худобу, собак, коней, кішок або свиней, або є його синтетичним варіантом.
15. Спосіб стимуляції імунної відповіді у тварини, що включає введення ефективної кількості композиції за п. 13 в клітини тварини і експресію в клітинах антигена, епітопів, іммуногена, пептиду або поліпептиду, що представляють інтерес
16. Спосіб за п. 15, який відрізняється тим, що твариною є птиця, велика рогата худоба, собака, кінь, кішка або свиня.
17. Спосіб індукування імунної відповіді у тварини, що включає введення ефективного кількості композиції за п. 13 в клітини тварини і експресію в клітинах антигена, епітопів, іммуногена, пептиду або поліпептиду, що представляють інтерес
18. Спосіб за п. 17, який відрізняється тим, що твариною є птиця, велика рогата худоба, собака, кінь, кішка або свиня.
Текст
Реферат: Винахід належить до ДНК-плазміди з підвищеною експресією екзогенних поліпептидів, таких як антиген, епітоп, імуноген, пептид або поліпептид, який становить інтерес, та стабільністю, до способів, придатних для ДНК-вакцинації. UA 100692 C2 (12) UA 100692 C2 UA 100692 C2 5 10 15 20 25 30 35 40 45 50 55 60 Включення до опису винаходу відомостей шляхом посилання Дана заявка включає як посилання попередню заявку США № 60/795324, подану 27 квітня 2006. Всі документи, які тут процитовані або згадані ("процитовані тут документи"), і всі документи, процитовані або згадані в процитованих тут документах, разом з інструкціями виробників, описами, специфікаціями на продукт і технологічні карти для будь-яких продуктів, згаданих тут або в будь-якому документі, включеному тут як посилання, включені до даної заявки як посилання та можуть бути використані для здійснення винаходу. Галузь техніки, до якої відноситься винахід Даний винахід, у цілому, відноситься до ДНК вакцин і способів їхнього застосування. Конкретно, цей винахід відноситься до ДНК плазмід з підвищеною експресією та стабільністю, придатних для ДНК вакцин. Попередній рівень техніки ДНК вакцини, які інакше називаються генетичними, плазмідними або полінуклеотидними вакцинами, представляють відносно просту та економічну можливість перенесення генів для імунізації проти антигенів. Низька токсичність ДНК вакцин стимулює їхню подальшу розробку та додаткові стратегії щодо поліпшення ефективності цього підходу в клінічній практиці (розглядається в Shaw & Strong, Front Biosci. 2006 Jan 1;11:1189-98). ДНК-вакцинація може оминути головні недоліки традиційних вакцин і має потенціал вакцин майбутнього. Однак комерційний продукт усе ще не надійшов на ринок. Одним можливим поясненням цьому може бути технічна невдача в індукуванні ефективної імунної реакції в людей, при цьому безпека також може бути основною проблемою (опубліковано в Glenting & Wessels, Microb Cell Fact. 2005 Sep 6;4:26). Плазміда pVR1020 або 1012 (VICAL Inc.; Luke C. et al., Journal of Infectious Diseases, 1997, 175, 91-97; Hartikka J. et al., Human Gene Therapy, 1996, 7, 1205-1217, див., напр., Патенти США № 5846946; 6451769; 6586409 і 6875748) є ДНК-плазмідним вектором, який застосовують для вставки полінуклеотидної послідовності. Плазміду pVR1020 одержують із pVR1012 і вона містить сигнальну послідовність tPA людини. Знайдено додаткові ДНК-плазміди, описані, наприклад, у Патентах США № 6852705; 6818628; 6586412; 6576243; 6558674; 6464984; 6451770; 6376473 і 6221362. Однак, для ДНК-вакцинації плазміди, в основу яких покладено pVR1012, мають недоліки, такі як нестабільність плазмід і гетерогенність числа копій. Відповідно, існує потреба в ефективній ДНК-вакцині, особливо такій, яка забезпечує експресію антигену-мішені, епітопа, імуногена, пептида або поліпептида, який становить інтерес в кількості, достатній для встановлення захисної реакції. Цитування або ідентифікація будь-якого документа в даній заявці не є визнанням того, що такий документ є прототипом даного винаходу. Сутність винаходу Винахід ґрунтується, частково, на експериментальному спостереженні, що вставка транспозона між промотором гена стійкості до канаміцину та сайтом ініціації трансляції анулює стійкість до канаміцину та при цьому несподівано сприяє підвищенню реплікації плазмідної ДНК. Інакше кажучи, вихід мутантної плазміди (яка містить транспозон) був у три рази вищим у порівнянні з немутантною плазмідою. На підставі чого припустили, що ефективність експресії гена стійкості до канаміцину ("KanaR") впливає на реплікацію плазмідної ДНК у бактеріях, тобто знижена експресія гена стійкості до канаміцину сприяє підвищенню швидкості реплікації плазмідної ДНК. Особливо, висока швидкість експресії KanaR може представляти сильне метаболічне навантаження, яке порушує оптимальну швидкість реплікації плазмідної ДНК і/або транскрипція гена KanaR порушує сайт ініціації реплікації (оріджин реплікації, ORI). Даний винахід відноситься до ДНК-плазміди, яка може містити ген стійкості до канаміцину ("KanaR"), у якій ген стійкості до канаміцину має найменш ефективний промотор для експресії KanaR і/або менш ефективний стартовий кодон. У кращому втіленні, промотор KanaR є промотором P1. Одержана ДНК-плазміда забезпечує більш високі виходи плазмідної ДНК і більш високу стабільність плазміди, ймовірно завдяки зниженій експресії KanaR. Бажано, щоб ДНК-плазміда була pLL10 або pLL14. Даний винахід також відноситься до ДНК-плазміди, яка може містити ген стійкості до канаміцину, в якому транспозон вставлений між промотором KanaR і сайтом ініціації трансляції, що приводить до зниженої експресії KanaR. Одержана ДНК-плазміда забезпечує більш високі виходи плазмідної ДНК і більш високу стабільність плазміди, приблизно завдяки зниженій експресії KanaR. Даний винахід охоплює композиції для доставляння та експресії антигену, епітопа, імуногену, пептида або поліпептида, який становить інтерес, при цьому композиція може включати будь-які ДНК-плазміди, описані тут, і фармацевтично або ветеринарно придатний 1 UA 100692 C2 5 10 15 20 25 30 35 40 45 50 55 60 носій, наповнювач або ексципієнт. У кращому втіленні, носій, наповнювач або ексципієнт можуть сприяти трансфекції та/або підвищувати стабільність вектора або білка. Бажано, антиген, епітоп, імуноген, пептид або поліпептид, який становить інтерес, може бути отриманий із пташиного, бичачого, собачого, кінського, котячого або свинячого вірусу або патогена. Винахід додатково забезпечує способи стимуляції імунної відповіді у тварин, які можуть включати введення ефективної кількості композицій, які тут описуються, в клітини тварини та експресування антигену, епітопа, імуногену, пептида або поліпептида, який становить інтерес, у клітинах. Винахід також забезпечує способи стимуляції та підтримування імунної відповіді у тварини, які можуть передбачати введення ефективної кількості композицій, які тут описуються, у клітини тварини та експресування антигену, епітопа, імуногену, пептида або поліпептида, який становить інтерес, у клітинах. Переважно, твариною може бути птах, бик, собака, кінь, кішка або свиня. Винахід також охоплює набори для здійснення кожного з вищеописаних способів, які можуть включати ДНК-плазміду або описані тут композиції разом з інструкціями для здійснення способів стимуляції або встановлення імунної відповіді у тварини. Слід зазначити, що в даному описі, зокрема, у формулі винаходу та/або параграфах, такі терміни, як "включає", "включений", "який включає" та подібні до них, можуть набувати значень, які надаються таким термінам у патентному законодавстві США, наприклад, вони можуть означати "містить", "містить у собі" і т. і.; а такі терміни, як "складається в основному з" і "складається в основному з" мають значення, які надаються їм у патентному законодавстві США, наприклад, вони охоплюють елементи, не зазначені явно, але виключають елементи, які входять у попередній рівень техніки або які торкаються фундаментальної або нової особливості винаходу. Ці та інші втілення винаходу розкриті в або випливають із і охоплені нижченаведеним докладним описом. Короткий опис креслень Наступний докладний опис, представлений у вигляді приклада, але не призначений для обмеження винаходу тільки описаними специфічними втіленнями, може бути краще зрозумілим у поєднанні із прикладеними кресленнями, на яких: Фіг. 1 ілюструє три потенційних промотори KanaR експресійної касети, як показано в Прикладі 1: P1 (SEQ ID NO: 1), P2 (SEQ ID NO: 2) і P3 (SEQ ID NO: 3). P2 і P3 частково збігаються; Фіг. 2 ілюструє схему pVR1012, демонструючи напрямок транскрипції KanaR і положення оріджин реплікації, ORI; Фіг. 3 ілюструє, як касету KanaR плазміди pVR1012 у Прикладі 1 клонують у мутагенний вектор pALTER-1; Фіг. 4 ілюструє, як сайт рестрикції PacІ у Прикладі 1 був уведений у прямому напрямку ORF KanaR, одержуючи плазміду pLL2, як сайт рестрикції SwaІ був уведений у зворотному напрямку, як сайт рестрикції RsrII був уведений у прямому напрямку, одержуючи pLL4, і, в остаточному підсумку, стартовий кодон трансляції ATG було мутовано з TTG, одержуючи pLL6; Фіг. 5 ілюструє, як мутована касета KanaR pLL4 у Прикладі 1 була клонована в плазміду pVR1012, одержуючи pLL7; Фіг. 6 ілюструє, як термінаторна послідовність rrnВ, ідентифікована в Прикладі 1, була клонована в плазміду pLL7 з використанням PCR з pSB062 і наступним розщепленням PacІ RsrII з формуванням pLL9; Фіг. 7 ілюструє клонування термінаторною послідовності speА, ідентифікованої в Прикладі 1, у плазміду pLL7 шляхом відпалювання синтетичних олігонуклеотидів і розщеплення PacІ RsrII з формуванням pLL11; Фіг. 8 ілюструє, як мутована послідовність ініціації трансляції плазміди pLL6 була клонована в pLL9 за допомогою розщеплення MscІ PacІ з формуванням pLL10; Фіг. 9 ілюструє, як промоторні послідовності P2/P3 (SEQ ID NOS: 2-3) разом з P1 (SEQ ID NO: 1), P1 (SEQ ID NO: 1) і P2/P3 (SEQ ID NOS: 2-3), які були ідентифіковані в Прикладі 1, були клоновані з використанням URS11-URS12 PCR, URS13-URS12 PCR і URS11-URS14 PCR, відповідно; Фіг. 10 ілюструє, як промоторна послідовність P2/P3 (SEQ ID NOS: 2-3) разом з P1 (SEQ ID NO: 1) була клонована в плазміду pLL9 з формуванням pLL13; Фіг. 11 ілюструє, як промоторна послідовність P1 (SEQ ID NO: 1) була клонована в плазміду pLL9 з формуванням pLL14; Фіг. 12 ілюструє, як промоторна послідовність P2/P3 (SEQ ID NOS: 2-3) була клонована в плазміду pLL9 з формуванням pLL15; 2 UA 100692 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фіг. 13 ілюструє, як промоторна послідовність P1 (SEQ ID NO: 1) була клонована в плазміду pLL7 з формуванням pLL16; Фіг. 14 ілюструє деякі похідні pVR1012, отримані з різними придатними промоторами та термінаторами, ідентифіковані в Прикладі 1. Конструкції pLL13, pLL14, pLL15 і pLL16 мають делеції в 192 пару основ між промотором CMV і промотором Kana P1 (SEQ ID NO: 1); Фіг. 15 ілюструє схематичне зображення похідних pVR1012, демонструючи ділянку в 192 п. о., вилучену в конструкціях pLL13-pLL16 Приклада 1; Фіг. 16 ілюструє два графіки здатності бактеріальних колоній до стійкості відносно збільшених концентрацій канаміцину (Kana), відповідно до Приклада 1, при 50 мкл і 100 мкл розведеннях бактеріальних суспензій, відповідно; Фіг. 17 ілюструє графіки плазмідних виходів, отриманих при вирощуванні в лабораторних умовах. Бактеріальні колонії Приклада 1 були вирощені в рідкому середовищі LB з Kana 100 мкг/мл; Фіг. 18 ілюструє плазмідні виходи, виражені як відношення до плазмідному виходу pLL14 (базисна лінія = 100). Експеримент 1 ілюструє 8-15 клонів на конструкцію, Експеримент 2 ілюструє 6 клонів для pVR1012, 2 для pLL14 і 25 для pLL16 і Експеримент 3 (25 клонів для pVR1012, pPB662 і pLL14, і 20 для pLL19); Фіг. 19 ілюструє графіки плазмідних виходів, отримані при вирощуванні в лабораторних умовах. Бактеріальні колонії були вирощені в середовищі EGLI. Плазмідні виходи виражали як відношення до парентерального плазмідного виходу pVR1012 (базисна лінія = 100) і Фіг. 20 ілюструє індивідуальний плазмідний вихід (вказує на середню конструкцію pVR1012), який показує гетерогенність клонів. (*: мутована плазміда) та ілюструє графіки плазмідних виходів трьох різних клонів конструкції, адаптованих EGLI, відповідно до Приклада 1. Варіабельність виражається як індекс, де перший клон вважається 100 % еталоном. Докладний опис винаходу Винахід ґрунтується, частково, на експериментальному спостереженні, що вставлення транспозону між промотором гена стійкості до канаміцину та сайтом ініціації трансляції, анулює стійкість до канаміцину та при цьому несподівано сприяє прискоренню реплікації плазмідної ДНК. Іншими словами вихід мутантної плазміди (яка містить транспозон) був у три рази вищим у порівнянні з немутантною плазмідою. На підставі чого припустили, що ефективність експресії гена стійкості до канаміцину ("KanaR") впливає на реплікацію плазмідної ДНК у бактеріях, тобто, знижена експресія гена стійкості до канаміцину сприяє підвищенню швидкості реплікації плазмідної ДНК. Конкретно, щодо лімітування поживними речовинами, висока швидкість експресії KanaR може бути сильним метаболічним навантаженням, яке порушує оптимальну швидкість реплікації плазмідної ДНК і/або транскрипція гена KanaR порушує оріджин реплікації (ORI). Винахід охоплює будь-яку передбачену ДНК-плазміду, у якій знижена експресія KanaR, що призводить до збільшення плазмідних виходів і більш високої стабільності плазміди у порівнянні, наприклад, із плазмідою pVR1012 або її похідним, без зниженої експресії KanaR. Даний винахід стосується ДНК-плазміди, яка може містити KanaR, у якій ген стійкості до канаміцину включає менш ефективний промотор для експресії KanaR і/або менш ефективний стартовий кодон. У кращому втіленні, промотор KanaR є промотором P1 і стартовим кодоном є ATG. Отримана ДНК-плазміда забезпечує більш високі плазмідні виходи та більш високу стабільність плазміди, ймовірно завдяки зниженій експресії KanaR. Бажано, ДНК-плазмідою може бути pLL10 або pLL14. Даний винахід також стосується ДНК-плазміди, яка може містити ген стійкості до канаміцину, у якому транспозон вставлений між промотором KanaR і ділянкою ініціації трансляції, яка забезпечує знижену експресію KanaR. Отримана ДНК-плазміда забезпечує більш високі плазмідні виходи та більш високу стабільність плазміди, ймовірно завдяки зниженій експресії KanaR. Експресійним вектором є плазмідний вектор або вектор ДНК-плазміди, зокрема, експресійний вектор in vivo. У специфічному, не обмежуючому прикладі, ДНК-плазмідний вектор містить елементи плазмід pVR1020 або 1012 (VICAL Inc.; Luke C. et al., Journal of Infectious Diseases, 1997, 175, 91-97; Hartikka J. et al., Human Gene Therapy, 1996, 7, 1205-1217, див., напр., Патенти США № 5846946; 6451769; 6586409 і 6875748). Плазміду pVR1020 одержують із pVR1012 і вона містить сигнальну послідовність tPA людини. В одному втіленні, людська сигнальна послідовність tPA включає від M(1) амінокислоти до S(23) амінокислоти в Genbank під номером HUMTPA14. В іншому, не обмежуючому прикладі, плазміда, яка застосовується як вектор для вставки полінуклеотидної послідовності, може містити сигнальну пептидну послідовність кінського IGF1 від M(24) амінокислоти до A(48) амінокислоти в Genbank під 3 UA 100692 C2 5 10 15 20 25 30 35 40 45 5055 60 номером U28070. Додаткову інформацію про ДНК-плазміди, які можуть прийматися до уваги або використовуватися в практиці, можна знайти, наприклад, у Патентах США № 6852705; 6818628; 6586412; 6576243; 6558674; 6464984; 6451770; 6376473 і 6221362. В іншому втіленні, плазмідою може бути будь-яка плазміда з геном стійкості до канаміцину, включаючи, але не обмежуючись названими, вектори Clontech: Living Colors pAcGFP1, Living Colors pAcGFP1-C1, Living Colors pAcGFP1-N1, pAmCyan1-C1, pAmCyan1-N1, pAsRed2-C1, pAsRed2-N1, pCMV-DsRed-Express, pDsRed2-1, pDsRed2-C1, pDsRed2-N1, pDsRed-Express-1, pDsRed-Express-C1, pDsRed-Express-N1, pDsRed-Monomer-C1, pDsRed-Monomer-N1, pHcRed11, pHcRed1-C1, pHcRed1-N1/1, pIRES2-DsRed2, pIRES2-DsRed-Express, pLPS-AcGFP1-N Acceptor, Proteasome Sensor, pTimer, pZsGreen1-1, pZsGreen1-C1, pZsGreen1-N1, pZsYellow1-C1 і pZsYellow1-N1; вектори Invitrogen: pCR3, pCR3.1-Uni, pCR1000 і pZErO-2.1, і вектори Stratagene; pCMV-3Tag, pBK-CMV Phagemid, ZAP Express, pCMV-Script, pCMV-Tag, PCR-Script pMC1neo і pMC1neo Poly A. Можна посилатися на патенти США № 6,942,975, 6,887,702, 6,849,442, 6,846,970, 6,825,012, 6,806,399, 6,803,230, 6,790,607, 6,696,278, 6,667,150, 6,624,344, 6,620,990, 6,610,909, 6,585,976, 6,573,437, 6,570,067, 6,562,584, 6,528,703, 6,503,748, 6,475,731, 6,410,317, 6,410,314, 6,387,654, 6,376,744, 6,350,934, 6,303,383, 6,297,054, 6,284,541, 6,258,999, 6,255,560, 6,248,937, 6,235,518, 6,174,708, 6,127,171, 6,121,511, 6,117,651, 6,054,635, 6,037,524, 6,018,103, 5,994,625, 5,981,191, 5,981,182, 5,977,439, 5,925,544, 5,910,488, 5,866,404, 5,851,808, 5,851,804, 5,830,727, 5,824,877, 5,792,935, 5,783,394, 5,750,871, 5,733,753, 5,733,744, 5,731,179, 5,723,746, 5,716,803, 5,712,112, 5,705,361, 5,654,180, 5,599,670, 5,591,577, 5,589,623, 5,569,834, 5,567,599, 5,565,347, 5,504,005, 5,463,174, 5,460,952, 5,436,138, 5,416,250, 5,416,011, 5,378,618, 5,256,568, 5,169,755, 5,137,829, 5,053,335, 5,004,863, 4,935,340, 4,920,054, 4,795,855, 4,782,022, 4,771,002, 4,626,510 і 4,567,146. Даний винахід також охоплює плазміди з генами стійкості до інших антибіотиків, додатково до стійкості до канаміцину, таких як, але не обмежуючись вказаними, ампіцилін, хлорамфенікол, неоміцин і тетрациклін. В одному втіленні, плазмідою може бути будь-яка плазміда з геном стійкості до ампіциліну, включаючи, але не обмежуючись названими, вектори Clontech: Living Colors pAcGFP1, pAmCyan, pAsRed2, pbetagal-Basic, pbetagal-Control, pBI Tet, pBI-G Tet, pBI-L Tet, pCMVbeta, pCMV-Myc & pCMV-HA, pDsRed2, pDsRed-Express, pDsRed-Monomer Vector, pGFP, pGFPuv, pHcRed1, pIRES, pIRESbleo3, pIRESneo3, pIRESpuro3, pLP-IRESneo Acceptor, pLP-LNCX Acceptor, pLP-TRE2 Acceptor, pPUR, pRevTet-Off, pRevTet-Off-IN, pRevTet-On, pSEAP2-Basic, pSEAP2-Control, pTet-Off, pTet-On, pTet-tTS, pTimer, pTimer-1, pTK-Hyg, pTRE2, pTRE2hyg, pTRE2hyg2-6xHN, pTRE2hyg2-HA, pTRE2hyg2-Myc, pTRE2pur, pTRE2pur-6xHN, pTRE2pur-HA, pTRE2pur-Myc, pTRE-6xHN, pTRE-HA, pTRE-Myc, pTRE-Tight, pTRE-Tight-DsRed2, pZsGreen і pZsYellow; вектори Invitrogen: p2Bac, p2Bac/CAT/CAT, pAc5.1/V5-His, pAc5.1/V5-His/Lac, pBADTOPO, pBlueBac, pBlueBac/His, pBlueBac/His/CAT, pBlueBac2, pBlueBac3, pBlueBac4, pBlueBac4/CAT, pcDNA1/Amp, pcDNA3/CAT, pcDNAII, pCMVSport1, pCMVSport2, pCMVSport2.2, pCMVSport4, pCR3, pCR3.1-Uni, pCRBac, pCRT7/CT-Lac, pCRT7/CT-TOPO, pCRT7/NT-E3, pCRT7/NT-TOPO, pDW232, pFastBac1, pMEP4, pMT/Lac, pMT/V5-His-TOPO, pPIC3, pPIC3K, pRBK, pSL301, pSPORT1-CAT, pYesTrp2-RalGDS і pYesTrp2-RalGDS, і вектори Stratagene: PCRScript, pBC Phagemid, pMC1neo і pMC1neo Poly A, pBlueScript II Phagemid і SuperCos I. Посилання може бути подане також на Патенти США № 6,987,006, 6,972,322, 6,916,611, 6,887,702, 6,803,230, 6,790,607, 6,706,524, 6,696,278, 6,667,150, 6,569,678, 6,562,584, 6,544,782, 6,521,449, 6,503,748, 6,486,134, 6,410,317, 6,410,314, 6,387,654, 6,376,192, 6,291,238, 6,255,071, 6,221,630, 6,140,087, 6,127,171, 6,025,193, 6,025,192, 6,010,875, 5,981,279, 5,981,182, 5,955,363, 5,925,544, 5,919,676, 5,912,153, 5,894,060, 5,877,400, 5,866,404, 5,851,808, 5,834,191, 5,830,727, 5,830,690, 5,786,162, 5,776,773, 5,773,697, 5,766,940, 5,733,753, 5,731,193, 5,716,803, 5,705,361, 5,691,155, 5,602,300, 5,527,691, 5,504,005, 5,470,729, 5,436,138, 5,434,065, 5,432,082, 5,378,618, 5,290,691, 5,264,354, 5,256,568, 5,256,546, 5,160,489, 5,151,364, 5,147,789, 5,143,836, 5,126,252, 5,093,251, 5,081,022, 4,997,767, 4,988,622, 4,935,364, 4,920,054, 4,889,806, 4,879,230, 4,876,202, 4,845,031, 4,808,519, 4,766,072, 4,752,574, 4,703,012, 4,634,678,487,835, 4,349,629 і 4,340,674. В іншому втіленні, плазмідою може бути будь-яка плазміда з геном стійкості до хлорамфеніколу, включаючи, але не обмежуючись названими, вектори Clontech: pDNR-Lac Donor Reporter, pDNR-SEAP Donor Reporter, pLP-AcGFP1-C Acceptor, pLP-BacPAK9 Acceptor, pLP-BacPAK9-6xHN Acceptor, pLP-CMV-HA Acceptor, pLP-CMV-Myc Acceptor, pLP-CMVneo Acceptor, pLP-GADT7 AD Acceptor, pLP-GBKT7 DNA-Acceptor, pLP-IRESneo Acceptor, pLP-LNCX Acceptor, pLP-PROTet-6xHN Acceptor, pLP-RevTRE Acceptor, pLPS-AcGFP1-N Acceptor і pLPTRE2 Acceptor; вектори Invitrogen: pLys і pSPORT1-CAT, і вектори Stratagene: pBC Phagemid і PCR-Script. Посилання може бути подане також на Патенти США № 6,916,611, 6,900,010, 4 UA 100692 C2 5 10 15 20 25 30 35 40 45 50 55 60 6,887,702, 6,884,576, 6,846,671, 6,803,230, 6,696,278, 6,673,537, 6,667,150, 6,562,584, 6,548,246, 6,503,748, 6,436,694, 6,420,110, 6,410,317, 6,410,314, 6,391,640, 6,387,654, 6,376,192, 6,331,527, 6,309,883, 6,309,830, 6,291,211, 6,255,071, 6,252,140, 6,221,630, 6,146,871, 6,127,171, 6,107,093, 6,083,750, 6,031,151, 6,025,192, 6,001,564, 5,994,132, 5,994,066, 5,981,182, 5,955,363, 5,932,479, 5,928,891, 5,925,544, 5,925,523, 5,908,747, 5,866,404, 5,851,808, 5,821,093, 5,766,940, 5,733,753, 5,728,571, 5,716,803, 5,707,830, 5,639,644, 5,591,577, 5,470,729, 5,437,988, 5,434,065, 5,256,568, 5,256,546, 5,053,335, 5,004,863, 4,868,111, 4,839,284, 4,752,574 і 4,711,849. В іншому втіленні, плазмідою може бути будь-яка плазміда з геном стійкості до неоміцину, включаючи, але не обмежуючись названими, вектори Clontech: pRevTet-Off Vector, pRevTet-OffIN Vector, pIRES Vector, pIRESbleo3 Vector, pIREShyg3 Vector, pIRESneo3 Vector, pIRESpuro3 Vector, pLP-IRESneo Acceptor Vector, pTet-Off Vector, pTet-On Vector, pIRES2-DsRed-Express Vector, pLXIN Retroviral Vector, pIRES2-DsRed2 Vector, Proteasome Sensor Vector, pLXSN Retroviral Vector, pCMV-DsRed-Express Vector, Living Colors pAcGFP1-C1 Vector, pAmCyan1-C1 Vector, pAsRed2-C1 Vector, pDsRed2-C1 Vector, pDsRed-Express-C1 Vector, pDsRed-Monomer-C1 Vector, pHcRed1-C1 Vector, pZsGreen1-C1 Vector, pZsYellow1-C1 Vector, Living Colors pAcGFP1 Vector, pDsRed2-1 Vector, pDsRed-Express-1 Vector, pHcRed1-1 Vector, pTimer Vector, pZsGreen1-1 Vector, pQCXIX Retroviral Vector, LRCX Retroviral Vector Set, pLNCX2 Retroviral Vector, pLP-LNCX Acceptor Vector, pQCXIN Retroviral Vector, Living Colors pAcGFP1-N1 Vector, pAmCyan1-N1 Vector, pAsRed2-N1 Vector, pDsRed2-N1 Vector, pDsRed-Express-N1 Vector, pDsRed-Monomer-N1 Vector, pHcRed1-N1/1 Vector, pLPS-AcGFP1-N Acceptor Vector, pZsGreen1N1 Vector, pZsYellow1-N1 Vector і VP16 Minimal Domain Vector Set; вектори Invitrogen: pcDNA1/Neo, pcDNA3/CAT (заміщені на pcDNA3.1/CAT), pCR3 (заміщені на pCR3.1), pCR3.1-Uni і pRc/CMV, і вектори Stratagene: pCMV-3Tag Vectors, pCMV-Script Vector, SuperCos I Vector, ZAP Express Vector, pCMV-Tag Vectors, pMC1neo і pMC1neo Poly A Vectors, PCR-Script Cloning Kits, Vitality hrGFP Mammalian Expression Vector, pBK-CMV Phagemid Vector і Lambda ZAP-CMV Vector. Посилання може бути подане також на Патенти США № 7,026,525, 6,942,995, 6,905,818, 6,815,185, 6,806,399, 6,787,687, 6,747,189, 6,673,602, 6,673,537, 6,667,150, 6,624,344, 6,620,990, 6,440,444, 6,429,357, 6,391,633, 6,376,192, 6,316,253, 6,294,187, 6,291,211, 6,255,560, 6,252,140, 6,248,937, 6,232,526, 6,221,630, 6,210,930, 6,207,879, 6,194,636, 6,114,146, 6,096,717, 6,071,512, 5,998,144, 5,985,560, 5,969,211, 5,955,363, 5,955,319, 5,939,288, 5,902,577, 5,894,060, 5,891,634, 5,830,698, 5,807,742, 5,750,871, 5,733,779, 5,665,565, 5,639,663, 5,614,381, 5,583,278, 5,470,726, 5,463,174, 5,416,011, 5,352,605, 5,278,056, 5,256,568, 5,149,636, 5,017,478, 4,957,865, 4,935,340, 4,839,284, 4,792,520, 4,766,066, 4,752,574, 4,740,463, 4,663,285, 4,536,475, 4,513,086, 4,513,085, 4,503,155, 4,468,462, 4,460,688, 4,430,434 і 4,416,994. В іншому втіленні, плазмідою може бути будь-яка плазміда з геном стійкості до тетрацикліну, включаючи, але не обмежуючись названими, вектори Clontech: pRevTet-Off Vector, pRevTet-On Vector, pRevTet-Off-IN Vector, Creator-Compatible PROTet 6xHN Bacterial Expression System, PROTet 6xHN Bacterial Expression System, pTRE-Tight Vector, pTet-Off Vector, pTet-On Vector, Tet-Off Gene Expression System, Tet-On Gene Expression System, Adeno-X Tet-Off Expression System 1, Adeno-X Tet-On Expression System 1, Adeno-X Viral DNA (розщеплений PISce I/I-Ceu I), Creator-Compatible RevTet-Off Retroviral Gene Expression System, CreatorCompatible RevTet-On Retroviral Gene Expression System, pLP-RevTRE Acceptor Vector, pRevTRE Vector, RevTet-Off System, RevTet-On System, pBI Tet Vector, pBI-G Tet Vector, pBI-L Tet Vector, pTet-tTS Vector, pLP-TRE2 Acceptor Vector, pTRE2 Vector, pTRE2hyg Vector, pTRE2pur Vector, Tet System Approved FBS, US-Sourced (гама-опромінені), pTRE-Tight-DsRed2 Vector і VP16 Minimal Domain Vector Set, і вектори Invitrogen: pTet-tTak і pTet-Splice. Послатися можна також на Патенти США № 6,924,101, 6,905,836, 6,777,229, 6,759,236, 6,699,702, 6,699,692, 6,696,278, 6,680,301, 6,673,537, 6,667,150, 6,642,052, 6,620,618, 6,613,528, 6,544,782, 6,541,003, 6,503,748, 6,482,636, 6,440,741, 6,436,694, 6,410,317, 6,392,121, 6,376,192, 6,309,883, 6,303,383, 6,265,562, 6,261,807, 6,221,630, 6,218,181, 6,136,536, 6,127,171, 6,080,575, 6,033,856, 6,022,731, 6,010,875, 5,958,680, 5,955,363, 5,891,718, 5,869,035, 5,866,410, 5,858,762, 5,851,796, 5,849,576, 5,840,521, 5,830,727, 5,830,690, 5,786,162, 5,766,940, 5,637,503, 5,593,860, 5,585,254, 5,527,691, 5,516,669, 5,508,176, 5,384,259, 5,378,618, 5,348,886, 5,290,691, 5,256,568, 5,256,546, 5,166,070, 5,158,891, 5,151,364, 5,147,789, 5,053,335, 4,983,522, 4,879,230, 4,876,202, 4,874,703, 4,778,761, 4,752,574, 4,703,012, 4,680,260, 4,663,285, 4,634,677, 4,631,259, 4,581,335, 4,374,200 і 4,349,629. Термін "плазміда" охоплює будь-яку одиницю транскрипції ДНК (транскриптон), який містить полінуклеотид запропонований винаходом та елементи, необхідні для його експресії in vivo у клітині або клітинах бажаного хазяїна або мішені; і, у цьому зв'язку, примітно, що суперспіралізована або не-суперспіралізована, кільцева плазміда, а також плазміда лінійної форми, охоплюється винаходом. 5 UA 100692 C2 5 10 15 20 25 30 35 40 45 50 55 60 Кожна плазміда включає або складається з, бажано, додатково до полінуклеотиду, який кодує антиген, епітоп або імуноген, функціонально злиту з гетерологічною пептидною послідовністю, варіант, аналог або фрагмент, функціонально пов'язаний із промотором або який перебуває під контролем промотору або перебуває в залежності від промотору. Загалом, бажаним є застосування сильного промотору, функціонального в еукаріотичних клітинах. Кращим сильним промотором є ранній промотор цитомегаловірусу (CMV-IE), узятий від людини або від миші, або, за необхідності, від інших тварин, таких як пацюк або морська свинка. Промотор CMV-IE може включати конкретну промоторну частину, яка може бути пов'язана або може бути не пов'язана з енхансерною частиною. Посилання можна дати на EP-A-260 148, EPA-323 597, Патенти США № 5,168,062, 5,385,839 і 4,968,615, а також на заявку PCT WO87/03905. Промотором CMV-IE є, бажано, CMV-IE людини (Boshart M. et al., Cell., 1985, 41, 521-530) або CMV-IE пацюка. У більш загальних поняттях, промотор має як вірусне, так і клітинне походження. Сильним вірусним промотором, крім CMV-IE, який може бути придатним для застосування в рамках винаходу, є ранній або пізній промотор вірусу SV40 або промотор LTR вірусу саркоми Рауса. Сильним клітинним промотором, який може бути придатним для застосування в рамках винаходу, є промотор гена цитоскелета, такий як, напр., промотор десміну (Kwissa M. et al., Vaccine, 2000, 18, 2337-2344) або промотор актину (Miyazaki J. et al., Gene, 1989, 79, 269-277). Функціональні суб-фрагменти цих промоторів, тобто, частини цих промоторів, які зберігають адекватну промоторну активність, включені до даного винаходу, напр., усічені промотори CMVIE, описані в заявці РСТ WO98/00166 або патенті США № 6,156,567, можуть практично використовуватися у винаході. Промотор у практичному використанні винаходу, отже, включає похідні та суб-фрагменти повнорозмірного промотору, які зберігають достатню промоторну активність і, внаслідок чого, функціонують як промотор, при цьому, бажано, промоторна активність є практично аналогічною до активності істинного або повнорозмірного промотору, з якого похідне або суб-фрагмент отриманий, напр., активність усічених промоторів, описаних у Патенті США №6,156,567, подібна до активності повнорозмірних промоторів CMV-IE. Таким чином, CMV-IE промотор, у практичному застосуванні винаходу, може включати або складатися з, бажано, або складатися із промоторної частини повнорозмірного промотору та/або енхансерної частини повнорозмірного промотору, а також з похідних і суб-фрагментів. Бажано, плазміди включають або складаються, бажано, з інших елементів, які контролюють експресію. Найкращим є включення стабілізуючої послідовності(тей), напр., інтронної послідовності(тей), бажано, першого інтрона hCMV-IE (заявка РСТ WO89/01036), інтрона II гена β-глобіну кролика (van Ooyen et al., Science, 1979, 206, 337-344). Щодо сигналу поліаденілювання (poly) для плазмід і вірусних векторів, крім поксвірусів, застосування може більшою мірою торкатися сигналу poly(A) гена бичачого гормону росту (bGH) (див. Патент США № 5,122,458), або сигналу poly(A) гена кролячого β-глобіну або сигналу poly(A) вірусу SV40. Винахід забезпечує експресію будь-якого пептиду-мішені або поліпетиду, бажано антигену, епітопа, імуногену, пептиду або поліпептиду, який становить інтерес, за допомогою ДНКплазміди запропонованої цим винаходом. Винахід припускає експресію будь-якого антигену, епітопа, імуногену, пептиду або поліпептиду, який становить інтерес, у ДНК-плазмідах, описаних тут. ДНК-плазміди можуть експресувати один або більше антигенів, епітопів або імуногенів, які становлять інтерес. У кращому втіленні, антиген, епітоп, імуноген, пептид або поліпептид одержують із пташиного, бичачого, собачого, кінського, котячого або свинячого вірусу або патогена. В іншому втіленні, антиген, епітоп, імуноген, пептид або поліпептид може бути отриманий з вірусу Західного Нілу. В іншому втіленні, антиген, епітоп, імуноген, пептид або поліпептид може бути отриманий з вірусу або патогена людини. Пташині антигени, епітопи або імуногени винаходу можуть бути отримані з вірусу хвороби Марека (MDV) (напр., серотипів 1 і 2, бажано 1), вірусу псевдочуми птахів (NDV), вірусу хвороби Гамборо або вірусу інфекційного бурситу птахів (IBDV), вірусу інфекційного бронхіту (IBV), вірусу інфекційної анемії або вірусу анемії курчат (CAV), вірусу інфекційного ларинготрахеїту (ILTV), вірусу енцефаломієліту або вірусу енцефаломієліту птахів (AEV або вірусу лейкозу птахів ALV), вірусу геморагічного ентериту індичок (HEV), пневмовірусу (TRTV), вірусу пташиного грипу, вірусу пташиного гідроперикардиту, пташиних реовірусів, Escherichia coli, Mycoplasma gallinarum, Mycoplasma gallisepticum, Haemophilus avium, Pasteurella gallinarum, Pasteurella multocida gallicida, та їх сумішей. Бажано, для MDV імуногеном, бажано є gВ і/або gD, напр., gB і gD, для NDV імуногеном є, бажано, HN і/або F, напр., HN і F; для IBDV імуногеном, бажано, є VP2; для IBV імуногеном є, бажано, S (більш бажано S1) і/або M і/або N, напр., S (або 6 UA 100692 C2 5 10 15 20 25 30 35 40 45 50 55 60 S1) і M і/або N; для CAV імуногеном є, бажано, VP1 і/або VP2; для ILTV імуногеном, бажано, є gВ і/або gD; для AEV імуногеном, бажано, є env і/або gag/pro, напр., env і gag/pro або gag/pro; для HEV імуногеном, бажано, є білок 100K і/або гексон; для TRTV імуногеном, бажано, є F і/або G, і для пташиної чуми імуногеном є, бажано, HA і/або N і/або NP, напр., HA і N і/або NP. Бичачі антигени, епітопи або імуногени, відповідно до винаходу, можуть бути отримані з вірусу BHV-1, BRV, bPI-3 і/або BCV або бичачого патогена, обраного із групи, яка включає, але не обмежуючись, бичачий респіраторно-синцитіальний вірус і вірус діареї великої рогатої худоби. Імуногенами BRSV можуть бути BRSV F або G або N, такі як BRSV F і/або G або N і/або G. BHV-1-імуногенами можуть бути gВ і/або gС і/або gD. BVDV-імуногенами можуть бути білок E0 (gp48) і/або білок E2 (gp53). BVDV може бути типом 1 і/або типом 2. bPI-3-імуногенами можуть бути bPI-3 F і/або HN. Див. також Патенти США № 6,451,770, 6,376,473, 6,224,878, відносно імуногенів бичачих патогенів і молекул нуклеїнових кислот, які їх кодують, та конструкцій, які їх експресують. Собачі антигени, епітопи або імуногени, відповідно до винаходу, можуть бути отримані з вірусу цистицеркозу, вірусу собачої чуми (CDV), вірусу собачого парагрипу 2 типу (CPI-2), собачого герпесвірусу 1 типу (CHV-1), вірусу сказу (рабдовірус), собачого парвовірусу (CPV), собачого коронавірусу (CCV), собачого аденовірусу, Borrelia burgdorferi, Leptospira та їх сумішей. Бажано, для CDV імуногеном є, бажано F і/або HA (див. також Патенти США № 6,309,647, 5,756,102 відносно імуногенів CDV і конструкцій); для CPV імуногеном, бажано, є VP2; для CCV імуногеном, бажано, є S і/або M; для CHV-1 імуногеном, бажано, є gВ і/або gС і/або gD(див. також Патенти США № 5,688,920, 5,529,780, regarding імуногенів CHV і конструкцій); для вірусу сказу імуногеном, бажано, є G (див. також Патент США № 5,843,456 щодо комбінованих композицій проти сказу); для Borrelia burgdorferi імуногеном, бажано, є Osp (див. також Патент США № 6,368,603 щодо комбінованих композицій Osp). Кінські антигени, епітопи або імуногени відповідно до винаходу можуть бути отримані з вірусу EHV-1 і/або EHV-4 або іншого кінського патогена, обраного із групи, яка включає, але не обмежується, вірус кінського грипу (EIV), вірус східного енцефаліту (EEV), вірус західного енцефаліту (WEV), вірус венесуельського енцефаліту (VEV), агент хвороби Лайма, Borrelia burgdorferi, Clostridium tetani, вірус кінського артриту (EAV) і вірус сказу. Антигенами, епітопами або імуногенами можуть бути глікопротеїни EHV, такі як gВ, gD, gВ+gD, gС і gЕ, для EIV імуногеном, бажано, є HA, NP і/або N; для вірусів енцефаліту імуногеном, бажано, є C і/або E1 і/або E2; і для Clostridium tetani імуногеном є всі частини субодиниці C тетанічного токсину. Посилання можна дати на Патенти США № 6,395,283, 6,248,333, 5,338,683, 6,183,750 або імуногени кінських патогенів і молекули нуклеїнових кислот, які їх кодують, і конструкції які їх експресують. Котячі антигени, епітопи або імуногени відповідно до винаходу можуть бути отримані з котячого герпесвірусу 1 типу (FHV-1), котячого кальцивірусу (FCV), вірусу сказу (рабдовірус), котячого парвовірусу (FPV), вірусу котячого інфекційного перитоніту (FIPV), вірусу котячої лейкемії (FeLV), вірусу котячого імунодефіциту (FIV), Chlamydia та їх сумішей. Бажано, для FeLV імуногеном, бажано, є env і/або gag і/або pol, напр., gag/pol; для FPV імуногеном є, бажано, VP2; для FIPV імуногеном, бажано, є S і/або M і/або N, напр., S і M і/або N (див. також Патенти США № 6,348,196 і 5,858,373 і їх імуногени та конструкції); для FHV імуногеном, бажано, є gВ і/або gС і/або gD, напр., gВ і gС і /або gD (див. також Патенти США № 5,338,683, 6,183,750; для герпесвірусних імуногенів і конструкцій, які їх експресують); для FCV імуногеном, бажано, є C; для FIV імуногеном, бажано, є env і/або gag і/або pro, напр., gag/pro, env або env і gag/pro (див. також імуногени та конструкції, розглянуті в Tartaglia et al., патентній заявці США № 08/746,668, поданій 14 листопада 1996 р.); для вірусу сказу імуногеном є, бажано, G. Свинячі антигени, епітопи або імуногени відповідно до винаходу можуть бути отримані з вірусу PRRS і/або свинячого патогена, обраного із групи, яка включає, але не обмежується, вірус псевдосказу, вірус грипу свиней, свинячий парвовірус, вірус інфекційного гастроентериту (коронавірус), свинячий цирковірус, такий як свинячий цирковірус 2 типу, ротавірус, свинячий аденовірус 3 типу, Escherichia coli, Erysipelothrix rhusiopathiae, Bordetella bronchiseptica, Clostridium spp., Salmonella spp., Haemophilus parasuis, Pasteurella multocida, Streptococcus suis, Mycoplasma hyopneumoniae і Actinobacillus pleuropneumoniae. Антигени, епітопи або імуногени свинячих патогенів можуть включати gВ псевдовірусу сказу, gС псевдовірусу сказу, gD псевдовірусу сказу, HA свинячого грипу, NA свинячого грипу, NP свинячого грипу, ORF4 вірусу репродуктивно-респіраторного синдрому свиней, ORF7 вірусу репродуктивно-респіраторного синдрому свиней, ORF5 PRRSV, ORF3 PRRSV, ORF6 PRRSV, відкриті рамки зчитування 5 (ORF5) і 6 (ORF6) PRRSV, відкриті рамки зчитування 5 (ORF5) і 3 (ORF3) і 6 (ORF6) PRRSV, E1 вірусу холери свиней, ген E2 вірусу холери свиней, VP2 парвовірусу, ORF1 свинячого 7 UA 100692 C2 5 10 15 20 25 30 35 40 45 50 55 60 цирковірусу 2 типу або ORF2 свинячого цирковірусу 2 типу. Посилання приводяться на Патенти США № 6,517,843, 6,497,883, 6,391,314, 6,379,676, 6,217,883, 6,207,165 і публікацію патенту США № 2003003112 і WO99/53047, WO99/08706, WO01/83737 і WO00/47756 або імуногени свинячих патогенів, молекули нуклеїнових кислот, які їх кодують, і конструкції, які їх експресують. ДНК-плазміди даного винаходу можуть експресувати один або більше полінуклеотидів вірусу Західного Нілу ("WNV"), які кодують E, prМ, M або комбінації або їх поліпротеїни (напр., E або E і prМ або E і M або E і prМ і M або поліпротеїн E-prM-M або поліпротеїн prM-E або поліпротеїн M-E або, щонайменше, їх епітоп). Відповідно до втілення винаходу, інший вектор або вектори в препараті включають, складаються переважно з або складаються з полінуклеотиду, який кодує, і за відповідних умов вектор експресує один або більше інших протеїнів вірусу WN, напр. prМ, M, prM-M або його епітоп. У даному винаході термін "антиген" або "імуноген" означає речовину, яка викликає специфічну імунну відповідь у тварини-хазяїна. Антиген може включати цілий організм, убитий, ослаблений або живий; субодиницю або частину організму; рекомбінантний вектор, який містить вставку з імуногенними властивостями; частину або фрагмент ДНК, здатний викликати імунну відповідь після презентації тварині-хазяїнові; білок, поліпептид, пептид, епітоп, гаптен або будьяку їхню комбінацію. Альтернативно, імуноген або антиген може включати токсин або антитоксин. Термін "імуногенний білок або пептид" у тому значенні, яке тут використовується, також включає пептиди та поліпептиди, які є імунологічно активними в тому розумінні, що один раз уведені хазяїну, вони здатні індукувати імунну відповідь гуморального та/або клітинного типу, спрямовану проти білка. Бажано білковий фрагмент є фрагментом, який має практично таку ж імунологічну активність, що й загальний білок. Таким чином, білковий фрагмент відповідно до винаходу включає або складається переважно з або складається з, щонайменше, одного епітопа або антигенної детермінанти. Термін епітоп відноситься до ділянки білка, здатної індукувати імунну реакцію гуморального типу (В-клітини) і/або клітинного типу (T-клітини). Термін "імуногенний білок або пептид" додатково припускає делеції, приєднання та заміни в послідовності, оскільки функції поліпептиду полягають у продукуванні імунологічної реакції, як тут визначено. У цьому зв'язку, особливо кращі заміни, у цілому, будуть консервативними за своєю природою, тобто такими замінами, які відбуваються в родині амінокислот. Наприклад, амінокислоти звичайно підрозділяють на чотири родини: (1) кислотні - аспартат і глутамат; (2) основні - лізин, аргінін, гістидін; (3) неполярні-аланін, валін, лейцин, ізолейцин, пролін, фенілаланін, метіонін, триптофан; і (4) незаряджені полярні - гліцин, аспарагін, глутамін, цистин, серин, треонін, тирозин. Фенілаланін, триптофан і тирозин іноді класифікують як ароматичні амінокислоти. Було коректно передбачено, що ізольована заміна лейцину на ізолейцин або валін або навпаки; аспартату на глутамат або навпаки; треоніну на серин або навпаки; або аналогічна консервативна заміна амінокислоти на структурно споріднену амінокислоту, не має основного ефекту на біологічну активність. Білки, які мають практично таку ж амінокислотну послідовність, що й вихідна молекула, але які мають мінорні заміни в амінокислотній послідовності, які практично не впливають на імуногенність білка, перебувають, тим самим, у рамках визначення вихідного поліпептиду. Термін "епітоп" відноситься до ділянки на антигені або гаптені, на яку відповідають специфічні В-клітини та/або Т-клітини. Термін також використовується як взаємозамінний до "антигенної детермінанти" або "сайту антигенної детермінанти". Антитіла, які розпізнають такий епітоп, можуть бути ідентифіковані за допомогою імунологічного аналізу, показуючи здатність одного антитіла блокувати зв'язування іншого антитіла з антигеном-мішенню. "Імунологічна відповідь" на композицію або вакцину представляє розвиток у хазяїні клітинної та/або антитіло-опосередкованої імунної відповіді на композицію або вакцину, які становлять інтерес. Звичайно, "імунологічна відповідь" включає, але не обмежується, один або більше наступних ефектів: продукцію антитіл, В-клітин, T-хелперів і/або цитотоксичних T-клітин, спрямованих специфічно на антиген або антигени, включені до композиції або вакцини, які становлять інтерес. Бажано, хазяїн буде проявляти як терапевтичну, так і захисну імунологічну відповідь, так що стійкість до нової інфекції буде підвищена та/або клінічну важкість протікання захворювання буде знижено. Такий захист буде полягати в як зниженні, так і відсутності симптомів, які проявляються в інфікованого хазяїна, більш швидкому за часом періодом відновлення та/або зниженні титру вірусу в інфікованому хазяїні. Терміни "імуногенний" білок і поліпептид у тому значенні, яке тут використовується, також відноситься до амінокислотної послідовності, яка викликає імунологічну відповідь, як описувалося вище. "Імуногенний" білок або поліпептид, у тому значенні, яке тут 8 UA 100692 C2 5 10 15 20 25 30 35 40 45 50 55 60 використовується, включає повнорозмірну послідовність білка, його аналоги або його імуногенні фрагменти. Під "імуногенним фрагментом" мають на увазі фрагмент білка, який включає один або більше епітопів і, отже, викликає імунологічну відповідь, описану вище. Такі фрагменти можуть бути ідентифіковані, використовуючи будь-які способи картування епітопів, добре відомих з рівня техніки. Див., напр., Epitope Mapping Protocols в Methods in Molecular Biology, Vol. 66 (Glenn E. Morris, Ed., 1996) Humana Press, Totowa, N.J. Наприклад, лінійні епітопи можуть бути визначені, напр., за допомогою одночасного синтезування великої кількості пептидів на твердій основі, причому пептидів, які відповідають частині білкової молекули, і взаємодії пептидів з антитілами, поки пептиди усе ще прикріплені до основ. Такі способи відомі з рівня техніки та описуються, напр., у Патенті США № 4,708,871; Geysen et al. (1984) Proc. Natl. Acad. Sci. USA 81:3998-4002; Geysen et al. (1986) Molec. Immunol. 23:709-715, кожен з яких включений тут як посилання в повному його обсязі. Аналогічно, конформаційні епітопи не важко можна ідентифікувати за допомогою способів визначення просторової конформації амінокислот, таких як,напр., рентгенівська кристалографія та 2-вимірний ядерно-магнітний резонанс. Див., напр., Epitope Mapping Protocols, вище. Способи, особливо ті, що можуть бути застосовні для протеїнів T. parva, повною мірою описані в заявці PCT/US2004/022605, включеній тут як посилання в повному обсязі. Синтетичні антигени також підпадають під визначення, наприклад, поліепітопи, фланковані епітопи та інші рекомбінантні антигени. Див., напр., Bergmann et al. (1993) Eur. J. Immunol. 23:2777-2781; Bergmann et al. (1996) J. Immunol. 157:3242-3249; Suhrbier, A. (1997) Immunol. and Cell Biol. 75:402-408; Gardner et al. (1998) 12th World AIDS Conference, Geneva, Switzerland, Jun. 28-Jul. 3, 1998. Імуногенні фрагменти, для цілей даного винаходу, звичайно включають, щонайменше, близько 3 амінокислот, бажано, щонайменше, близько 5 амінокислот, ще краще, щонайменше, близько 10-15 амінокислот і найкраще 25 або більше амінокислот в молекулі. Не існує особливої верхньої межі для довжини фрагмента, яка повинна включати майже повнорозмірну білкову послідовність або навіть злитий білок, який містить, щонайменше, один епітоп білка. Відповідно, мінімальна структура полінуклеотиду, який експресує епітоп, включає або складається переважно з або складається з нуклеотидів, які кодують епітоп або антигену детермінанту білка або поліпротеїну, який становить інтерес. Полінуклеотид, який кодує фрагмент повного білка або поліпротеїну, більш бажано, включає або складається переважно з або складається мінімум з 21 нуклеотидів, бажано, щонайменше, 42 нуклеотидів, а краще, щонайменше, 57, 87 або 150 послідовних або таких, що перекриваються нуклеотидів послідовності, яка кодує повний білок або поліпротеїн. Процедури визначення епітопів, такі як, складання бібліотек пептидів, які перекриваються (Hemmer B. et al., Immunology Today, 1998, 19 (4), 163-168), Pepscan (Geysen et al., (1984) Proc. Nat. Acad. Sci. USA, 81, 3998-4002; Geysen et al., (1985) Proc. Nat. Acad. Sci. USA, 82, 178-182; Van der Zee R. et al., (1989) Eur. J. Immunol., 19, 43-47; Geysen H.M., (1990) Southeast Asian J. Trop. Med. Public Health, 21, 523-533; Multipin.RTM. Peptide Synthesis Kits de Chiron) і алгоритми (De Groot A. et al., (1999) Nature Biotechnology, 17, 533-561), та в заявці PCT/US2004/022605, кожну з яких включено тут як посилання в повному її обсязі, можуть бути практично використані у винаході, без проведення зайвого експерименту. Інші документи, які цитуються та включені тут, також можуть представляти способи визначення епітопів імуногену або антигену й, тим самим, молекул нуклеїнових кислот, які кодують ці епітопи. "Полінуклеотид" є полімерною формою нуклеотидів будь-якої довжини, які містять дезоксирибонуклеотиди, рибонуклеотиди та аналоги в будь-якій комбінації. Полінуклеотиди можуть мати тривимірну структуру та можуть виконувати будь-яку функцію, відому або невідому. Термін "полінуклеотид" включає дво-, одноланцюгові та трьохспіральні молекули. Якщо інакше не зазначено або не потрібно, будь-яке втілення винаходу, яке описується тут, яке представляє полінуклеотид, охоплює як дволанцюгові форми, так і кожну із двох комплементарних форм, відому або яка є передбаченою для складання дволанцюгової форми ДНК або РНК, або гібридної молекули. Наступні терміни є необмежуючими прикладами полінуклеотидів: ген або фрагмент гена, екзони, інтрони, мРНК, тРНК, рРНК, рибосоми, кДНК, рекомбінантні полінуклеотиди, розгалужені полінуклеотиди, плазміди, вектори, ізольована ДНК із будь-якої послідовності, ізольована РНК із будь-якої послідовності, нуклеїнові кислоти-зонди та праймери. Полінуклеотид може включати модифіковані нуклеотиди, такі як метильовані нуклеотиди та нуклеотидні аналоги, урацил, інші цукри і зв'язуючі групи, такі як фторрибоза та тіолат, та нуклеотидні розгалуження. Послідовність нуклеотидів може бути додатково модифікована після полімеризації, наприклад, за допомогою кон'югації, міченими компонентами. Іншими типами модифікацій, включеними до 9 UA 100692 C2 5 10 15 20 25 30 35 40 45 50 55 60 даного визначення, є кепірування, заміна одного або більше природних нуклеотидів на аналог і впровадження засобів для прикріплення полінуклеотиду до білків, іонів металів, мічених компонентів, інших полінуклеотидів або до твердої основи. Полінуклеотиди можуть бути отримані шляхом хімічного синтезу або з мікроорганізмів. Винахід додатково включає комплементарний ланцюг до полінуклеотиду, який кодує антиген, епітоп, імуноген, пептид або поліпептид, який становить інтерес. Комплементарний ланцюг може бути полімерної та будь-якої довжини, і може містити дезоксирибонуклеотиди, рибонуклеотиди та аналоги в будь-якій комбінації. Терміни "білок", "пептид", "поліпептид" і "фрагмент поліпептиду" використовуються тут як взаємозамінні та відносяться до полімерів амінокислотних залишків будь-якої довжини. Полімер може бути лінійним аборозгалуженим, він може включати модифіковані амінокислоти або амінокислотні аналоги, і він може перериватися хімічними фрагментами інших амінокислот. Терміни також охоплюють амінокислотний полімер, який модифікований природним шляхом або за допомогою втручання; наприклад шляхом формування дисульфідних зв'язків, глікозилювання, ліпідизації, ацетилювання, фосфорилювання або за допомогою будь-якої іншої маніпуляції або модифікації, такої як кон'югація з міченим або біологічно активним компонентом. "Ізольованим" полінуклеотидом або поліпептидом є такий, котрий є практично вільним від матеріалів, з якими він пов'язаний у його нативному середовищі. Під практично вільним мають на увазі, що він, щонайменше, на 50 %, бажано, щонайменше, на 70 %, краще, щонайменше, на 80 % і навіть ще краще, щонайменше, на 90 % є вільним від цих матеріалів. Реакції гібридизації можуть виконуватися за умов різної "суворості". Умови, які підвищують суворість реакції гібридизації, добре відомі. Див. наприклад, "Molecular Cloning: A Laboratory Manual", second edition (Sambrook et al. 1989). Приклади релевантних умов включають (у порядку збільшення суворості): температури інкубації 25 °C, 37 °C, 50 °C і 68 °C; концентрації буфера 10 x SSC, 6 x SSC, 1 x SSC, 0,1 x SSC (де SSC є 0,15 M NaCl і 15 мМ цитратним буфером) та їхні еквіваленти, які використовуються для інших буферних систем; концентрації формаміду 0 %, 25 %, 50 % і 75 %; час інкубації від 5 хвилин до 24 годин; 1, 2 або більше етапів промивання; час промивання після інкубації 1, 2 або 15 хвилин; і розчини для промивання 6 x SSC, 1 x SSC, 0.1 x SSC або деіонізована вода. Винахід додатково охоплює полінуклеотиди, які кодують функціонально еквівалентні варіанти та похідні поліпептидів, які представляють інтерес, і їх функціонально еквівалентні фрагменти, які можуть підвищувати, знижувати або не впливати значною мірою на властивості поліпептидів, що їх вони кодують. Ці функціонально еквівалентні варіанти, похідні та фрагменти проявляють здатність зберігати біологічну активність. Наприклад, зміни в послідовності ДНК, які не змінюють кодовану амінокислотну послідовність, а також ті, які приводять до утворення консервативних замін амінокислотних залишків, однієї або декількох амінокислотних делецій або доповнень, і заміні амінокислотних залишків амінокислотними аналогами, є такими, які не змінюють значною мірою властивості кодованого поліпептида. Консервативними амінокислотними замінами є гліцин/аланін; валін/ізолейцин/лейцин; аспарагін/глутамін; аспарагінова кислота/глутамінова кислота; серин/треонін/метіонін; лізин/аргінін; і фенілланін/тірозин/триптофан. В одному втіленні, варіанти мають, щонайменше, 50 %, щонайменше, 55 %, щонайменше, 60 %, щонайменше, 65 %, щонайменше, 70 %, щонайменше, 75 %, щонайменше, 80 %, щонайменше, 85 %, щонайменше, 86 %, щонайменше, 87 %, щонайменше, 88 %, щонайменше, 89 %, щонайменше, 90 %, щонайменше, 91 %, щонайменше, 92 %, щонайменше, 93 %, щонайменше, 94 %, щонайменше, 95 %, щонайменше, 96 %, щонайменше, 97 %, щонайменше, 98 % або, щонайменше, 99 % гомології або ідентичності до полінуклеотиду або поліпептида, який становить інтерес. Для цілей даного винаходу, ідентичність або гомологію послідовності визначають шляхом порівняння послідовностей при вирівнюванні для того, щоб довести до максимуму перекривання та ідентичність при мінімізації розривів послідовностей. Зокрема, ідентичність послідовностей може бути визначена, використовуючи будь-яку кількість математичних алгоритмів. Необмежуючий приклад математичного алгоритму, який використовується для порівняння двох послідовностей, є алгоритмом Karlin & Altschul, Proc. Natl. Acad. Sci. USA 1990; 87: 2264-2268, модифікований, як описано в Karlin & Altschul, Proc. Natl. Acad. Sci. USA 1993;90: 5873-5877. Іншим прикладом математичного алгоритму, який використовується для порівняння послідовностей, є алгоритм Myers & Miller, CABIOS 1988;4: 11-17. Такий алгоритм включений до програми ALIGN (версія 2.0), яка є частиною пакета програм для вирівнювання послідовностей і перетворення їх на формат GCG. Якщо застосовують програму ALIGN для порівняння амінокислотних послідовностей, можуть бути використані таблиці мас залишків PAM120, "gap 10 UA 100692 C2 5 10 15 20 25 30 35 40 45 50 55 60 length penalty" 12 і "gap penalty" 4. Ще іншим придатним алгоритмом для ідентифікації ділянок локальної подібності послідовностей і вирівнювання є алгоритм FASTA, як описано в Pearson & Lipman, Proc. Natl. Acad. Sci. USA 1988; 85: 2444-2448. Кращим для застосування відповідно до даного винаходу є програмне забезпечення WUBLAST (Washington University BLAST) версії 2.0. Програми, які виконуються WU-BLAST версії 2.0 для деяких платформ UNIX можуть бути завантажені з ftp://blast.wustl.edu/blast/executables. Ця програма заснована на WU-BLAST версії 1.4, якау свою чергу заснована на домені для суспільного користування NCBI-BLAST версії 1.4 (Altschul & Gish, 1996, Local alignment statistics, Doolittle ed., Methods in Enzymology 266: 460-480; Altschul et al., Journal of Molecular Biology 1990; 215: 403-410; Gish & States, 1993;Nature Genetics 3: 266-272; Karlin & Altschul, 1993;Proc. Natl. Acad. Sci. USA 90: 5873-5877; усе з перерахованого включено сюди як посилання). У цілому, порівняння амінокислотних послідовностей виконується шляхом вирівнювання амінокислотної послідовності поліпептиду з відомою структурою з амінокислотною послідовністю поліпептиду невідомої структури. Потім порівнюють амінокислоти в послідовностях і групи амінокислот, які є гомологічними, групують одна з одною. Цей метод детектує консервативні області поліпептидів і підраховує амінокислотні вставки та делеції. Гомологія між амінокислотними послідовностями може бути визначена, використовуючи комерційно доступні алгоритми (див. також опис гомології вище). У доповненні до того, якщо не згадується інше, увага звертається на програми BLAST, gapped BLAST, BLASTN, BLASTP і PSIBLAST, які забезпечуються National Center for Biotechnology Information. Ці програми широко використовуються в рівні техніки для цих цілей і можуть вирівняти гомологічні області із двох амінокислотних послідовностей. У всіх пошукових програмах способи вирівнювання становлять одне ціле з пошуковими базами даних. Проміжки, за необхідності, можуть прибиратися. Стандартний штраф (Q) на обмеження довжини проміжку (gap of length) становить Q=9 для білків і BLASTP, Q=10 для BLASTN, але може змінюватися на будь-яке ціле число. Стандартний штраф на залишок для подовження проміжку (R) становить R=2 для білків і BLASTP, і R=10 для BLASTN, але може змінюватися на будь-яке ціле число. Будь-яка комбінація значень Q і R може використовуватися для вирівнювання послідовностей для підвищення до максимуму збігів та ідентичності при мінімізації gaps послідовностей. Стандартною матрицею порівняння амінокислот є BLOSUM62, але можуть використовуватися також інші матриці порівняння амінокислот, такі як PAM. Альтернативно або додатково, термін "гомологія" або "ідентичність", наприклад, щодо нуклеотидної або амінокислотної послідовності, може показувати кількісну міру гомології між двома послідовностями. Відсоток гомології послідовностей може обчислюватися як (N refNdif)*100/Nref, де Ndif - це загальна кількість не залишків у двох послідовностях при вирівнюванні, і де Nref - це кількість залишків в одній з послідовностей. Таким чином, послідовність ДНК AGTCAGTC буде мати 75 % ідентичність до послідовності AATCAATC (Nref=8; Ndif=2). Альтернативно або додатково, термін "гомологія" або "ідентичність", щодо послідовностей, може розраховуватися за відношенням кількості положень із ідентичними нуклеотидами або амінокислотами до кількості нуклеотидів або амінокислот у більш короткій із двох послідовностей. При цьому вирівнювання двох послідовностей може бути визначене відповідно до алгоритму Wilbur and Lipman (Wilbur & Lipman, Proc Natl Acad Sci USA 1983; 80:726, включеного тут як посилання), наприклад, використовуючи наступні параметри: найкращий вирівняний сегмент (window size) - 20 нуклеотидів, довжина сегмента (word length) - 4 нуклеотиду та штраф на введення делеції (gap penalty) - 4. Автоматизований аналіз і інтерпретація даних про послідовності, включаючи вирівнювання, можуть бути здійснені з використанням комерційно доступних програм (напр., Intelligenetics ™ Suite, Intelligenetics Inc. CA). Якщо зазначено, що РНК-послідовності аналогічні або мають ступінь ідентичності або гомології послідовностей із ДНК-послідовностями, то тімідин (T) у ДНК-послідовності розглядається як еквівалентний до урацилу (U) у РНК-послідовності. Таким чином, РНКпослідовності входять до винаходу та можуть бути отримані із ДНК-послідовностей, оскільки вважається, що тімідин (T) у ДНК-послідовності еквівалентний до урацилу (U) у РНКпослідовності. При цьому, без проведення зайвих експериментів, фахівець у даній галузі може враховувати багато інших програм або посилання при визначенні відсотка гомології. Винахід додатково охоплює полінуклеотиди, що становлять інтерес, що втримуються в молекулі-векторі або експресійному векторі та функціонально пов'язані із промоторним елементом і, за необхідності, з енхансером. "Вектор" відноситься до рекомбінантної ДНК- або РНК-плазміди або вірусу, що включає гетерологічний полінуклеотид, який доставляється до клітини-мішені, як in vitro, так і in vivo. 11 UA 100692 C2 5 10 15 20 25 30 35 40 45 50 55 60 Гетерологічний полінуклеотид може включати послідовність, яка становить інтерес, для лікування, і може, за необхідності, бути у формі експресійної касети. У тому значенні, яке тут використовується, немає необхідності, щоб вектор був здатний дореплікації в основній клітинімішені або суб'єкті. Термін включає вектори для клонування, а також включає вірусні вектори. Термін "рекомбінантний" позначає полінуклеотид напівсинтетичного або синтетичного походження, який або не зустрічається в природі, або прикріплений до іншого полінуклеотиду в порядку, який не зустрічається в природі. "Гетерологічний" означає отриманий з генетично відмінного суб'єкта від того суб'єкта, з яким проводять порівняння. Наприклад, полінуклеотид, який може поміщатися за допомогою методів генної інженерії в плазміду або вектор, отриманий з іншого джерела, і є гетерологічним полінуклеотидом. Промотор, вилучений з його нативної кодуючої послідовності, і функціонально зв'язаний з кодуючою послідовністю, яка відрізняється від нативної послідовності, є гетерологічним промотором. Полінуклеотиди винаходу можуть включати додаткові послідовності, такі як додаткові кодуючі послідовності, у тому ж транспозоні, контролюючі елементи, такі як промотори, ділянки зв'язування рибосом, сайти поліаденілювання, додаткові транспозони під контролем аналогічного або відмінного промотору, послідовності, які забезпечують клонування, експресію, гомологічну рекомбінацію та трансформацію клітини-хазяїна, і будь-яку таку конструкцію, яка може вимагатися для забезпечення втілення даного винаходу. Елементи для експресії антигену, епітопа, імуногену, пептиду або поліпептиду, який становить інтерес, бажано присутні у векторі винаходу. У певному сенсі, він включає, складається переважно з або складається зі стартового кодона (ATG), стоп-кодона та промотору й, за необхідності, також послідовності поліаденілювання для деяких векторів, таких як плазміда, і деяких вірусних векторів, напр., вірусних векторів відрізняються від поксвірусів. Якщо полінуклеотид кодує фрагмент поліпротеїну, напр., пептид, то, бажано, у векторі, ATG поміщають на 5' кінець відкритої рамки та стоп-кодон поміщають на 3'. Можуть бути присутніми також інші елементи для контролю експресії, такі як енхансерні послідовності, які стабілізують послідовності, такі як інтронні та сигнальні послідовності, які забезпечують секрецію білка. Способами виготовлення та/або введення вектора або рекомбінантів або плазміди для експресії продуктів генів винаходу, або in vivo або in vitro, можуть бути будь-які бажані способи, напр., спосіб, який є або аналогічний до способів, описаних в процитованих документах в Патентах США № 4,603,112; 4,769,330; 4,394,448; 4,722,848; 4,745,051; 4,769,331; 4,945,050; 5,494,807; 5,514,375; 5,744,140; 5,744,141; 5,756,103; 5,762,938; 5,766,599; 5,990,091; 5,174,993; 5,505,941; 5,338,683; 5,494,807; 5,591,639; 5,589,466; 5,677,178; 5,591,439; 5,552,143; 5,580,859; 6,130,066; 6,004,777; 6,130,066; 6,497,883; 6,464,984; 6,451,770; 6,391,314; 6,387,376; 6,376,473; 6,368,603; 6,348,196; 6,306,400; 6,228,846; 6,221,362; 6,217,883; 6,207,166; 6,207,165; 6,159,477; 6,153,199; 6,090,393; 6,074,649; 6,045,803; 6,033,670; 6,485,729; 6,103,526; 6,224,882; 6,312,682; 6,348,450 і 6.312,683; патентній заявці США № 920,197, поданій 16 жовтня 1986; WO 90/01543; W091/11525; WO 94/16716; WO 96/39491; WO 98/33510; EP 265785; EP 0 370 573; Andreansky et al., Proc. Natl. Acad. Sci. USA 1996;93:11313-11318; Ballay et al., EMBO J. 1993;4:3861-65; Felgner et al., J. Biol. Chem. 1994;269:2550-2561; Frolov et al., Proc. Natl. Acad. Sci. USA 1996;93:1137111377; Graham, Tibtech 1990;8:85-87; Grunhaus et al., Sem. Virol. 1992;3:237-52; Ju et al., Diabetologia 1998;41:736-739; Kitson et al., J. Virol. 1991;65:3068-3075; McClements et al., Proc. Natl. Acad. Sci. USA 1996;93:11414-11420; Moss, Proc. Natl. Acad. Sci. USA 1996;93:11341-11348; Paoletti, Proc. Natl. Acad. Sci. USA 1996; 93:11349-11353; Pennock et al., Mol. Cell. Biol. 1984; 4:399-406; Richardson (Ed), Methods in Molecular Biology 1995; 39, "Baculovirus Expression Protocols, » Humana Press Inc.; Smith et al. (1983) Mol. Cell. Biol. 1983;3:2156-2165; Robertson et al., Proc. Natl. Acad. Sci. USA 1996;93:11334-11340; Robinson et al., Sem. Immunol. 1997; 9:271; and Roizman, Proc. Natl. Acad. Sci. USA 1996; 93:11307-11312. Процитовані тут і включені сюди як документи посилання, у доповненні до забезпечених векторів, придатних для практичного використання винаходу, можуть також забезпечувати джерела пептидів або їхніх фрагментів, які експресуються векторами, або вектори або включені у винахід композиції. Даний винахід також відноситься до препаратів, які містять вектори, такі як експресійні вектори, напр., до терапевтичних композицій. Препарати можуть включати, складатися переважно з або складатися з одного або більше векторів, напр., експресованих векторів, таких як експресійні вектори in vivo, які містять, які складаються переважно з або складаються з (і бажано експресуючі) одного або більше антигенів, епітопів або імуногенів, які становлять інтерес. Бажано, вектор включає та експресує полінуклеотид, який включає, складається переважно з або складається з полінуклеотиду, який кодує (і бажано експресує) антиген, епітоп, імуноген, пептид або поліпептид, який становить інтерес, у фармацевтично або ветеринарно 12 UA 100692 C2 5 10 15 20 25 30 35 40 45 50 55 60 придатному носії, наповнювачі або ексципієнті. Таким чином, відповідно до втілення винаходу, інший вектор або вектори в препараті включає, складається переважно з або складається з полінуклеотиду, який кодує, і за відповідних умов вектор експресує, один або більше інших білків антигену, епітопа, імуногену, пептиду або поліпептиду, який становить інтерес, або їх фрагменти. Відповідно до іншого втілення, вектор або вектори в препараті включає або складається переважно з або складається з полінуклеотиду(ів), який кодує один або більше білків або його фрагмент(и) антигену, епітопа, імуногену, пептиду або поліпептиду, який становить інтерес, причому вектор або вектори експресують полінуклеотид(и). Препарат винаходу бажано включає, складається переважно з, або складається з, щонайменше, двох векторів, які містять, такі що складаються переважно з або складаються з і які, бажано, також експресують, бажано in vivo за відповідних умов або придатних умов або в придатній клітині-хазяїні, полінуклеотиди з різних ізолятів, які кодують різні білки та/або для різних білків, але бажано аналогічні білки. Препарати, які містять один або більше векторів, які включають, або складаються переважно з або складаються з полінуклеотидів, які кодують і бажано експресують, бажано in vivo, антиген або злитий білок, який становить інтерес, або його епітоп. Винахід також стосується сумішей векторів, які містять, складаються переважно з або складаються з, кодують і експресують, різні антигени, епітопи або імуногени, напр., антиген, епітоп, імуноген, пептид або поліпептид різних видів, таких як, але не обмежуючись вказаними, птахів, собак, кішок, корів, коней, людей і свиней. Відповідно до іншого втілення винаходу, експресійні вектори є експресійними векторами, придатними для експресії білків in vitro у придатній клітинній системі. Експресовані білки можуть бути зібрані в або з культурального супернатанта після секреції або не після секреції (якщо немає секреції, звичайно відбувається або здійснюється клітинний лізис), за необхідності концентровані за допомогою способів концентрації, таких як ультрафільтрація, і/або очищені за допомогою способів очищення, таких як афінна, іонообмінна або гель-хроматографія. "Клітина-хазяїн" позначає прокаріотичну або еукаріотичну клітину, яка генетично змінена або здатна бути генетично зміненою шляхом введення екзогенного полінуклеотиду, такого як рекомбінантна плазміда або вектор. Стосовно генетично змінених клітин, термін відноситься як до початково зміненої клітини, так і до її прогену. Придатні клітини- хазяїни включають, але не обмежуються, клітини нирок дитинчати хом'яка (BHK), клітини раку товстої кишки (Caco-2), клітини COS7, клітини MCF-7, клітини MCF-10A, клітини нирки собаки Madin-Darby (MDCK), клітини бичачої нирки Madin-Darby (MDBK), клітини легені норки (Mv1Lu), клітини MRC-5, клітини U937 і клітини VERO, клітини яєчника китайського хом'ячка (CHO) K1. Полінуклеотиди, які містять бажану послідовність, можуть бути вставлені до придатного вектора клонування або експресії, і вектор, у свою чергу, може бути уведений придатній клітині-хазяїну для реплікації та ампліфікації. Полінуклеотиди можуть бути уведені клітині-хазяїну будь-якими способами, відомими з рівня техніки. Вектори, які містять полінуклеотиди, які становлять інтерес, можуть бути уведені клітині-хазяїну будь-якими шляхами, включаючи спрямоване поглинання, ендоцитоз, трансфекцію, нуклеофекцію, f-зближення, електропорацію, трансфекцію із застосуванням хлориду кальцію, хлориду рубідію, фосфату кальцію, DEAE-декстрану або інших речовин; балістичну трансфекцію; ліпофекцію; та інфекцію (де вектор є інфекційним, наприклад, ретровірусний вектор). Вибір векторів, які вводяться, або полінуклеотидів буде залежати від властивостей клітини-хазяїна. У кращому втіленні, винахід забезпечує введення терапевтично ефективної кількості композиції для доставки та експресії антигену, епітопа, імуногену, пептиду або поліпептиду, який становить інтерес, у клітинку-мішень. Визначення терапевтично ефективної кількості є рутинним дослідженням для фахівця в даній галузі техніки. В одному втіленні, композиція включає експресійний вектор, який містить полінуклеотид, який експресує антиген, епітоп, імуноген, пептид або поліпептид, який становить інтерес, і фармацевтично або ветеринарно придатний носій, наповнювач або ексципієнт. У кращому втіленні, фармацевтично або ветеринарно придатний носій, наповнювач або ексципієнт сприяє трансфекції та/або підвищує стабілізацію вектора або білка. Фармацевтично або ветеринарно придатні носії або наповнювачі або ексципієнти добре відомі фахівцям з рівня техніки. Наприклад, фармацевтично або ветеринарно придатним носієм або наповнювачем або ексципієнтом може бути 0,9 % розчин NaCl (напр., фізіологічний розчин) або фосфатний буфер. Інші фармацевтично або ветеринарно придатні носії або наповнювачі або ексципієнти, які можуть застосовуватися в способах даного винаходу, включають, але не обмежуються, полі-(L-глутамат) або полівінілпіролідон. Фармацевтично або ветеринарно придатні носії або наповнювачі або ексципієнти можуть бути будь-яким з'єднанням або 13 UA 100692 C2 5 комбінацією сполук, що сприяють введенню вектора (або білка, який експресується з вектора винаходу in vitro); бажано, носій, наповнювач або ексципієнт можуть сприяти трансфекції та/або підвищувати стабільність вектора (або білка). Дози та дозові об'єми обговорені тут у загальному описі та можуть також бути легко визначені фахівцем у даній галузі техніки у поєднанні зі знаннями з рівня техніки, без проведення зайвих експериментів. Катіонні ліпіди, які містять сіль четвертинного амонію, які бажано, але не обов'язково, є придатними для плазмід, є ліпідами, які мають наступну формулу: 10 15 20 25 30 35 40 45 50 55 у якій R1 є насиченим або ненасиченим прямолінійним аліфатичним радикалом, що має 1218 атомів вуглецю, R2 є іншим аліфатичним радикалом, який містить 2 або 3 атомів вуглецю та X - це амінна або гідроксильна група, напр., DMRIE. В іншому втіленні, катіонний ліпід може бути пов'язаний з нейтральним ліпідом, напр., DOPE. Серед катіонних ліпідів, перевага віддається DMRIE (N-(2-гідроксиетил)-N, N-диметил-2,3біс(тетрадецилокси)-1-пропанамоній; WO96/34109), бажано пов'язаному з нейтральним ліпідом, бажано DOPE (діолеоіл-фосфатиділ-етаноламін; Behr J. P., 1994, Bioconjugate Chemistry, 5, 382389), з формуванням DMRIE-DOPE. Бажано, наготовлюють суміш із плазміди з ад'ювантом безпосередньо перед і бажано одночасно із введенням препарату або незадовго перед введенням препарату, наприклад, незадовго до або перед введенням, причому перед введенням суміші плазміда-ад'ювант, суміш витримують протягом часу, необхідного для утворення комплексів, напр., протягом між близько 10 і близько 60 хвилинами до ведення, зокрема, приблизно протягом 30 хвилин до ведення. Вагове співвідношення між плазмідою і ад'ювантом DMRIE або DMRIE-DOPE може становити близько 50:близько 1 або близько 1:близько 10, наприклад, близько 10:близько 1 і близько 1:близько 5, і бажано близько 1: близько 1 і близько 1: близько 2, напр., 1:1 і 1:2. Імуногенні композиції та вакцини відповідно до винаходу можуть включати або складатися переважно з одного або більш ад'ювантів. У рамках даного винаходу особливо придатними є: (1) полімер акрилової або метакрилової кислоти, полімер малеїнового ангідриду та похідного алкілену, (2) імуностимуляторна послідовність (ISS), зокрема, олігодезоксирибонуклеотидна послідовність, яка містить один або декілька неметильованих мотивів Cp (Klinman et al., Proc. Natl. Acad. Sci., USA, 1996, 93, 2879-2883; WO98/16247), (3) емульсія "олія у воді", зокрема, емульсія SPT, описана на стор.147 "Vaccine Design, The Subunit and Adjuvant Approach", видане M. Powell, M. Newman, Plenum Press, 1995 р., і емульсія MF59, описана на стор.183 тієї ж публікації, (4) катіонні ліпіди, що містять солі четвертинного амонію, напр., DDA (5) цитокіни, (6) гідроксид алюмінію або фосфат алюмінію, (7) сапонін або (8) інші ад'юванти, обговорювані в будь-якому документі, процитованому або включеному шляхом посилання до даної заявки або (9) будь-які їхні комбінації або суміші. Емульсія "олія у воді" (3), яка особливо придатна для вірусних векторів, може бути приготовлена на основі: легкого рідкого парафіну (типу, передбаченого Європейською фармакопеєю); ізопреноїдної олії, такої як сквалан, сквален; олії, яка утворюється при олігомеризації алкенів, зокрема, ізобутену або децену; складних ефірів кислот або спиртів з лінійною алкільною групою, особливо рослинних олій, етилолеату, пропіленглікольдикаприлату/дикапрату, гліцерилтрикапрілату/трикапрату, пропіленглікольдиолеату; складних ефірів кислот або жирних спиртів з розгалуженим ланцюгом, зокрема, складних ефірів ізостеаринової кислоти Для утворення емульсії олія застосовується разом з емульгаторами. Емульгаторами служать бажано неіонні поверхнево-активні речовини, зокрема: складні ефіри, з одного боку, сорбітану, маніду (наприклад, ангідроманітололеату), гліцерину, полігліцерину або пропіленгліколю й, з іншого боку, олеїнової, ізостеаринової, рицинолевої, оксистеаринової кислот, причому зазначені складні ефіри за необхідності є етоксильованими; або блокспівполімери поліоксипропілен-поліоксиетилен, зокрема, Pluronic, a саме L121. З полімерів типу, що додають, (1) кращими є зшиті полімери акрилової або метакрилової кислоти, зокрема, які зшиті поліалкіленовими ефірами цукрів або багатоатомних спиртів. Такі сполуки відомі за назвою "карбомери" (Pharmeuropa, т. 8, №2, червень 1996 р.). Фахівець може 14 UA 100692 C2 5 10 15 20 25 30 35 40 45 50 55 також звернутися до патенту US-A-2909462, у якому описані такі акрилові полімери, які зшиті полігідроксильованою сполукою, яка містить, щонайменше, 3 гідроксильні групи, бажано не більш 8, при цьому атоми водню, щонайменше, у трьох гідроксилах заміщені аліфатичними ненасиченими радикалами, які містять, щонайменше, 2 атоми вуглецю. Кращими радикалами є радикали з 2-4 атомами вуглецю, наприклад, вініли, аліли та інші ненасичені групи етиленового ряду. Ненасичені радикали можуть самі містити інші заступники, такі як мітив. Особливо придатними є продукти, пропоновані за назвою Carbopol® (BF Goodrich, шт. Огайо, США). Вони зшиті, зокрема, алільним похідним сахарози або алілпентаеритритолом. З них можна вказати, ® зокрема, на Carbopol 974P, 934Р и 971Р. ® Із співполімерів малеїнового ангідриду та похідного алкілену кращими є EMA (Monsanto), які є співполімерами малеїнового ангідриду та етилену, лінійними або зшитими, наприклад, такими, які зшиті дивініловим ефіром. Можна зіслатись до J. Fields і ін., Nature, №186, стор.778780, від 4 червня 1960 р. ® Відносно своєї структури полімери акрилової або метакрилової кислоти та EMA утворені бажано структурними ланками наступної формули: де: - R1 і R2, однакові або різні, означають Н або СН3, - х=0 або 1, бажано х=1, - у=1 або 2, при цьому х+у=2. ® Для EMA х=0, у=2 і для карбомерів х=у=1. Ці полімери розчинні у воді або фізіологічному розчині (NaCl при концентрації 20 г/л), показник рН доведений до 7,3-7,4 їдким натром для одержання розчину ад'юванта, у який будуть уведені експресійні вектори. Концентрація полімеру в кінцевій вакцинній композиції може досягати 0,01-1,5 % (вага/об'єм), зокрема, 0,05-1 % (вага/об'єм), бажано 0,1-0,4 % (вага/об'єм). Цитокін або цитокіни (5) можуть уводитися до композиції або вакцини у вигляді білка або піддаватися спільній експресії в хазяїні разом з імуногеном або імуногенами. Кращою є коекспресія цитокіну або цитокінів або за допомогою того ж вектора, що й вектор, який експресує імуноген, або за допомогою власного вектора. Винахід включає спосіб приготування таких комплексних композицій; наприклад, шляхом змішування активних компонентів, бажано разом і з ад'ювантом, носієм, цитокіном і/або розріджувачем. Цитокіни, які використовуються в даному винаході, включають, але не обмежуються, гранулоцитарний колонієстимулюючий фактор (G-CSF), гранулоцитарно-макрофагальний колонієстимулюючий фактор (GM-CSF), інтерферону α (IFN α), інтерферону β (IFN β), інтерферону γ (IFN інтерлейкіну-1α γ), (IL-1 інтерлейкіну-1 (IL-1 інтерлейкіну-2 (ILα), β β), 2), інтерлейкіну-3 (IL-3), інтерлейкіну-4 (IL-4), інтерлейкіну-5 (IL-5), інтерлейкіну-6 (IL-6), інтерлейкіну-7 (IL-7), інтерлейкіну-8 (IL-8), інтерлейкіну-9 (IL-9), інтерлейкіну-10 (IL-10), інтерлейкіну-11 (IL-11), інтерлейкіну-12 (IL-12), фактора некрозу пухлини α (TNFα), фактора некрозу пухлини β(TNFβ) і трансформуючого фактора росту β (TGF Необхідно розуміти, що β). цитокіни можуть бути уведені разом з і/або послідовно з імуногенною або вакцинною композицією даного винаходу. Так, наприклад, вакцина розглянутої заявки може також містити екзогену молекулу нуклеїнової кислоти, що експресує in vivo придатний цитокін, напр., цитокін, підібраний для того хазяїна, якого вакцинують або в якого виробляється імунна реакція (наприклад, собачий цитокін для препаратів для введення собакам). Бажано, фармацевтичні та/або терапевтичні композиції та/або композиції відповідно до винаходу включають або складаються переважно з або складаються з ефективної кількості, для індукування терапевтичної відповіді, одного або більш експресованих векторів і/або поліпептидів, як тут описується; при цьому, ефективна кількість може бути визначена з даного опису, включаючи документи, включені в нього, і рівень техніки, без проведення додаткових експериментів. У випадку терапевтичних і/або фармацевтичних композицій, заснованих на плазмідному векторі, доза може включати, складатися переважно з або складатися з, загалом, від близько 1 мкг до близько 2000 мкг, бажано від близько 50 мкг до близько 1000 мкг і більш, бажано від 15 UA 100692 C2 5 10 15 20 25 30 35 40 45 50 55 60 близько 100 мкг до близько 800 мкг плазміди, експресуючий антиген, епітоп, імуноген, пептид або поліпептид, який становить інтерес. Якщо терапевтичні та/або фармацевтичні композиції, засновані на плазмідному векторі, уводяться шляхом електропорації, доза плазміди звичайно становить від близько 0,1 мкг доблизько 1мг, бажано від близько 1 мкг до близько 100 мкг, бажано від близько 2 мкг до близько 50 мкг. Дозові об'єми можуть становити від близько 0,1 до близько 2 мл, бажано від близько 0,2 до близько 1 мл. Ці дози та дозові об'єми є придатними для лікування видів ссавців-мішеней. У кращому втіленні, тварину вакцинують двома дозами інактивованої вакцини з інтервалом приблизно в 3-4 тижні за допомогою підшкірного введення, хоча внутрім'язове введення також допускається. Зразки крові збирають на перший і/або другий день після вакцинації та через близько 2-4 тижні після другої вакцинації для визначення рівнів специфічних антитіл за допомогою способів, відомих з рівня техніки, наприклад, реакції нейтралізації вірусів, гальмування гемаглютинації, ELISA або простого радіального гемолізу (SRH). Необхідно відзначити, що для фахівця в даній галузі даний опис забезпечується прикладами та цей винахід ними не обмежується. З наведеного тут опису та знання рівня техніки, фахівець може визначити кількість введень, спосіб введення та дози, використовувані в кожному протоколі введення ін'єкції, без проведення додаткових експериментів. Даний винахід припускає, щонайменше, одне введення тварині ефективної кількості терапевтичної композиції, виготовленої відповідно до винаходу. Твариною може бути самець, самка, вагітна самка та немовля. Введення композиції може здійснюватися різними шляхами, включаючи, але не обмежуючись названими, внутрім'язові (IM), шкірні (ID) або підшкірні (SC) ін'єкції або за допомогою інтраназального або перорального введення. Терапевтична композиція винаходу може також уводитися безголковим ін'єктором (як, наприклад, ін'єкторами Pigjet, Biojector або Vitajet (Bioject, Oregon, USA)). Іншим способом введення плазмідних композицій є електропорація (див., напр. S. Tollefsen et al. Vaccine, 2002, 20, 3370-3378; S. Tollefsen et al. Scand. J. Immunol., 2003, 57, 229-238; S. Babiuk et al., Vaccine, 2002, 20, 33993408; Заявку РСТ WO99/01158). В іншому втіленні, терапевтична композиція доставляється тварині за допомогою генної гармати або бомбардування золотими частками. У кращому втіленні, твариною є хребетна тварина. Одне втілення винаходу представляє спосіб установлення імунної відповіді проти антигену, епітопа, імуногену, пептиду або поліпептиду, який становить інтерес, у тварини, що включає введення композиції для доставки та експресії рекомбінантної вакцини в ефективній кількості для встановлення імунної відповіді. Ще інше втілення винаходу представляє спосіб індукування імунологічної або захисної відповіді у тварини, що містить введення тварині ефективної кількості композиції для доставки та експресії антигену, епітопа, імуногену, пептиду або поліпептиду, який становить інтерес, де композиція включає рекомбінантну вакцину та фармацевтично або ветеринарно придатний носій, наповнювач або ексципієнт. Винахід відноситься до способу встановлення, індукування або стимулювання імунної відповіді тварини, бажано ссавця або хребетного. Інше втілення винаходу є набір для виконання способу індукування імунологічної або захисної відповіді проти антигену, епітопа, імуногену, пептиду або поліпептиду, який становить інтерес, у тварини, причому набір містить рекомбінантну вакцину та інструкції для здійснення спосіб доставки в ефективній кількості для встановлення імунної відповіді у тварини. Далі винахід докладніше описується за допомогою варіантів його здійснення, що приводять у якості не обмежуючих прикладів. Відомості, які підтверджують можливість здійснення винаходу Приклад 1. Вплив ефективності експресії гена стійкості до канаміцину ("KanaR") на ефективність реплікації плазмід у бактерій Наступний приклад ілюструє вплив ефективності експресії гена стійкості до канаміцину ("KanaR") на ефективність реплікації плазмід у бактерій. Перше, аналізують елементи експресійної касети KanaR, а саме промотор(и), сайт ініціації трансляції та сайт термінації транскрипції. При аналізі цих експресованих елементів, ці елементи модифікують і аналізують дію модифікованих елементів на вихід продукції плазміди. Були ідентифіковані чотири потенційних промотори. P3 (SEQ ID NO: 3) був ідентифікований з бази даних і літературних джерел, структура якого описана в GenBank під № X00928 (SEQ ID NO: 4), але не визначена традиційними програмами. P2 (SEQ ID NO: 2) був визначений за допомогою біоінформаційного аналізу та був також знайдений в GenBank під № V00359 (SEQ ID NO: 5). P1 (SEQ ID NO: 1) ставився до додаткового потенційного промотору, що належить до кістяка pVR1012. P0 був іншим потенційним промотором, що належить до кістяка pVR1012. Фіг. 1 показує, як P2 (SEQ ID NO: 2) і P3 частково збігаються. 16 UA 100692 C2 5 10 15 20 25 30 35 В pVR1012 не втримується сигнальної послідовності термінації транскрипції для KanaR. Це може мати безліч можливих наслідків. Багато які транскрипти KanaR можуть бути надмірно довгими та зруйнованими, оскільки вони будуть марної метаболічним навантаженням. Крім того, експресія KanaR може бути недостатньо оптимальної в pVR1012. Транскрипція KanaR може тривати через оріджин реплікації, ORI, та інтерферувати із ініціацією реплікації, як показано схематично на Фіг. 2. Таким чином, були ідентифіковані два відповідні термінатори транскрипції: rrnBT1+T2, що може бути знайдений в GenBank під № U13872 (SEQ ID NO: 6) і використається в багатьох комерційних експресованих векторах, і spe, що має № M31770 (SEQ ID NO: 7). Також, стартовий кодон ATG pVR1012 був поміщений за допомогою TTG для зниження ефективності ініціації трансляції. Таким чином, мета полягала у визначенні дії кожної модифікованої експресійної касети на здатність стійкості до канаміцину та виходи продукції плазмід. Так, похідні PVR1012 генерували із промотором P1 (SEQ ID NO: 1), P2/P3 (SEQ ID NOS: 2-3) або P1 (SEQ ID NO: 1) з P2/P3 (SEQ ID NOS: 2-3), термінаторами транскрипції rrnBT1+T2 або spe, і стартовим кодоном TTG. Для введення таких ДНК-послідовностей, у зворотному та прямому напрямку від ORF KanaR, були потрібні одиничні сайти рестрикції. Такі сайти були знайдені в pVR1012, так що вони були уведені за допомогою сайт-сайт-спрямованого мутагенезу. Спочатку, касета KanaR була клонована в мутагенний вектор pALTER-1, як показано на Фіг. 3. Фіг. 4 демонструє, як сайт рестрикції Pac був уведений у прямому напрямку від ORF KanaR, одержуючи тим самим pLL2, сайт рестрикції Swa був уведений у зворотному напрямку та сайт рестрикції RsrII був уведений у прямому напрямку, одержуючи тим самим pLL4, і, зрештою, стартовий кодон трансляції ATG був мутовано TTG, одержуючи pLL6. Мутовану касету KanaR pLL4 потім клонували в pVR1012 з формуванням pLL7, як показано на Фіг. 5. Термінаторну послідовність rrn потім клонували в pLL7 шляхом ПЦР із pSB062 і послідовного розщеплення Pac RsrII з формуванням pLL9, як показано на Фіг. 6. Фіг. 7 демонструє клонування термінаторною послідовності spe в pLL7 шляхом відпалювання синтетичних олігонуклеотидів і розщеплення RsrII Pac з формуванням pLL11. Потім, мутовану послідовність ініціації трансляції pLL6 клонували в pLL9 за допомогою розщеплення Pac Msc з формуванням pLL10, показано на Фіг. 8. У підсумку, Фіг. 9 ілюструє, як промоторні послідовності P2/P3 (SEQ ID NOS: 2-3) разом з P1 (SEQ ID NO: 1), P1 (SEQ ID NO: 1) і P2/P3 (SEQ ID NOS: 23) були клоновані за допомогою ПЦР URS11-URS12, ПЦР URS13-URS12 і ПЦР URS11-URS14, відповідно. Фіг. 10, 11 і 12 показують, як їх потім водили в pLL9 з формуванням pLL13, 14 і 15, відповідно. Аналогічно, Фіг. 13 показує, як P1 (SEQ ID NO: 1) був уведений в pLL7 з формуванням pLL16. Фіг. 14 показує деякі конструкції, що вийшли. Конструкції pLL13, pLL14, pLL15 і pLL16 містили делецію в 192 п.о. між промотором CMV і промотором KanaR P1 (SEQ ID NO: 1), як проілюстровано на Фіг. 15. Таблиця 1 поєднує ці конструкції. Таблиця 1 Плазміда pVR1012 pLL7 pLL9 pLL10 pLL11 pLL13* pLL14* pLL15* pLL16* pPB662 pLL19* Промотор(и) P0, P1, P2/3 P0, P1, P2/3 P0, P1, P2/3 P0, P1, P2/3 P0, P1, P2/3 P1, P2/3 P1 P2/3 P1 P0, P1, P2/3 P1 Ген KanaR Стартовий кодон ATG ATG ATG TTG ATG ATG ATG ATG ATG ATG ATG Термінатор no no rrn T1-T2 rrn T1-T2 spe rrn T1-T2 rrn T1-T2 rrn T1-T2 немає немає rrn T1-T2 Вставка Розмір плазміди (п. о.) no no no немає немає немає немає немає немає FIV env FIV env 4911 4911 5011 5011 4846 4811 4655 4661 4555 7456 7204 * Конструкції, які мають делеції розміром 192 п.о. між промотором CMV і промотором P1 KanaR 40 Ефективність модифікацій розмірів транскриптів гена KanaR підтверджували за допомогою проведення експериментів нозерн-блотінгу. Вони підтвердили гетерогенність транскриптів pVR1012 KanaR, як показано на плямі. Вони також підтвердили наявність трьох активних промоторів в pLL9, pLL10 і pLL11: одного головного короткого транскрипта з P2/P3 (SEQ ID 17 UA 100692 C2 5 10 15 20 25 NOS: 2-3) і двох більш слабких транскриптів з P0 і P1 (SEQ ID NO: 1). Як припускали, pLL13 генерував два транскрипта та pLL14 і pLL15 тільки один. Потім були протестовані деякі параметри на похідних pVR1012 для оцінки їхніх нових характеристик. Проводили тестування здатність до стійкості збільшених концентрацій канаміцину шляхом першого зараження однієї бактеріальної колонії, що містить кожну конструкцію, pVR1012-pLL15, у середовищі LB і вирощування протягом всієї ночі при 37 °C і 200 RPM. Бактерії в кожній суспензії підраховували за допомогою спектрофотометрії (OD 600 нм). Придатними розведеннями бактеріальних суспензій, 50 або 100 мкл, покривали середовище LB, що містить збільшені концентрації канаміцину. У підсумку, колонії підраховували, результати чого показані на Фіг. 16. Ці результати показують, що бактерії, що містять більшість похідних pVR1012, мали таку ж здатність до стійкості збільшеної концентрації KanaR без адаптації, тому що ріст не порушувався при концентрації 0-800 мкг/мл і було інгібовано при 200 мкг/мл. Бактерії, що містять pLL10 і pLL14, мали значно більш низьку здатність стійкості до канаміцину, при цьому ріст був на 90 % - 100 % подавлений при концентрації 800 мкг/мл, але не при 200 мкг/мл. Так, був зроблений висновок, що відсутність промоторів P2/P3 (SEQ ID NOS: 2-3) або більш низькі ефективності трансляції значно впливали на ферментативну продукцію KanaR, показуючи, що промотори P2/P3 (SEQ ID NOS: 2-3) є найбільш ефективними для експресії KanaR і інгібітор TTG знижує експресію KanaR. Однак, ці мутації як і раніше забезпечують бактеріальну стійкість і ріст у присутності класичних концентрацій KanaR. Здатність до адаптації в середовищі EGLI була протестована на першій суспензії 4 бактеріальних клітин, що містять кожну бактеріальну конструкцію та 10 КУО в LB, і з наступним нанесенням на планшети з EGLI. 25-50 ізольованих колоній, які містять кожну конструкцію, потім наносили на нову планшету з EGLI. Вирощені колонії підраховували, результати показані в Таблиці 2. Плазмідні кістяки pLL10, pLL14 і pLL16 представляли чистий ріст у середовищі, збідненої живильними речовинами, бактерій, що містять їх. Крім того, більш низька виробнича здатність канаміцину пов'язана із кращою здатністю до адаптації на збідненому середовищі в присутності KanaR 100 мкг/мл. Таблиця 2 Ріст на EGLIРіст в EGLI-бульйоні Плазмідна цілісність планшетах Кількість Кількість колоній які клонів які Кількість Відсоток Конструкція виросли / Відсоток виросли / Відсоток визна- ВизнаМутанти Кількість росту Кількість росту чених чених нанесених заражених мутантів мутантів колоній. клонів pVR1012-I 20/30 67 15/15 100 15/15 100 всі pLL9№3, pLL9 22/30 73 15/15 100 3/13 23 №4 і №15 pLL10 40/40 100 15/15 100 0/15 0 — Експеримент pLL11 36/40 90 11/15 73 1/11 9 pLL11№3 1 pLL13№1, pLL13 34/40 85 8/15 53 3/8 38 №3 and №11 pLL14 30/30 100 15/15 100 0/15 0 — pLL15 45/50 90 13/15 87 2/13 15 pLL15№3 і №14 Експеримент pVR1012-II 2 pLL16 11/25 25/25 44 100 6/11 25/25 55 100 1/6 0/25 17 0 pVR1012-III 25/25 100 25/25 100 9/25 36 pPB662 pLL14 pLL19 25/25 25/25 25/25 100 100 100 25/25 25/25 20/25 100 100 80 0/25 0/25 0/20 0 0 0 Експеримент 3 30 pVR1012№10 — pVR1012№2, №4, №8, №9, №11, №13, №14, №18 and №24 — — — Плазмідні виходи, отримані в лабораторних умовах росту, було протестовано на першій вирощеній одній колонії бактерій, що містять кожну конструкцію в середовищі LB з 100 мкг/мл 18 UA 100692 C2 o 5 10 15 20 25 30 35 40 45 KanaR протягом ночі при 37 і 200 RPM. Кількість бактерій у кожній суспензії оцінювали спектрофотометрично, OD600. ДНК із кожної суспензії очищали, використовуючи колонки Eppendorf і розраховували спектрофотометрично, OD260, кожний розчин ДНК тестували двічі. Потім вираховували кількість плазмідних копій у кожній суспензії, результати чого можна побачити на Фіг. 17. Не спостерігали значних відмінностей між різними конструкціями після вирощування в середовищі LB з KanaR 100 мкг/мл. Стабільність плазмід додатково оцінювали шляхом аналіз розщеплення трьох препаратів плазмід, отриманих з кожної конструкції. Плазмідні виходи, отримані в лабораторних умовах росту, тестували першою адаптованою EGLI на твердому середовищі. 15 і 25 колоній, Експеримент A і B відповідно, що містять кожну o конструкцію вирощували протягом ночі в рідкому середовищі EGLI при 37 і 200 RPM. Кількість бактерій у кожній суспензії оцінювали спектрофотометрично, OD 600. DNA з кожної суспензії очищали, використовуючи колонки Qiagen і та підраховували спектрофотометрично, OD260. Кількість плазмідних копій у кожній суспензії потім установлювали, результати чого можна подивитися на Фіг. 19. Результати показують, що конструкції pLL14 і pLL16 є найкращими кандидатами у відношенні плазмідних виходів у лабораторних умовах у середовищі EGLI. Крім того, плазмідні виходи були значно нижче, якщо конструкція містила термінатора транскрипції та ефективний ініціатор трансляції (ATG). Одночасно, плазмідні виходи були вище, якщо конструкції не містили термінатор трансляції або містили недостатньо оптимальний промотор P1 (SEQ ID NO: 1) або недостатньо оптимальний ініціатор трансляції (TTG). Плазмідні виходи були порівнянні в конструкціях pVR1012 і pLL10, показуючи, що низька ефективність трансляції компенсувала негативні ефекти термінатора транскрипції. На підставі цих результатів можна зробити висновок, що чим нижче здатність експресувати KanaR, тим вище плазмідні виходи. Узагальнивши результати тесту, стабільність плазміди додатково оцінювали за допомогою аналізу розщеплення препаратів, що містять кожну плазміду, отриману з кожної конструкції. Таблиця 2 показує результати цього аналізу. Не визначалися мутації після адаптації EGLI для pLL10, pLL14, pLL16 і pLL19, тоді як вона була більш 9 % для кожної конструкції. Також було виявлено, що була підвищена гомогенність плазмідних виходів в pLL14, pLL16 і pLL19 EGLIадаптованих клонів. Фіг. 20 ілюструє різницю між високою гетерогенністю плазмідного виходу в конструкції pVR1012 і низкою гетерогенності в конструкції pLL14 або pLL19. Плазмідні виходи, отримані шляхом ферментації були протестовані першим довільно обраним одним клоном EGLI-адаптованого SCS1/pLL14 для ферментації. Після ферментації, бактерії центрифугували та плазміду екстрагували з аліквоти та двічі визначали кількість, відповідно до способів, розробленим PGEA. Результати показали, що швидкість росту SCS1/pLL14 була значно нижче, ніж звичайно спостерігається в похідних pVR1012, таких як pPB266 і pPB662. Крім того, специфічний плазмідний вихід pLL14 становив 3,1 мг плазміди/г бактеріальної пелети. Цей результат відповідає найкращим результатам, отриманим з похідними pVR1012 після адаптації KanaR і вибору клону, такого як pPB266. Плазмідна стабільність потім оцінювалася за допомогою аналізу розщеплення плазмідних препаратів з кожного ферментованого клону із трьома різними зразками розщеплення. Таблиця 4 подає короткі відомості результатів аналізу всіх плазмід. Результати показують, що рівень експресії KanaR впливає на ефективність реплікації плазмід. Чим нижче експресія, тим вищою є швидкість реплікації в збідненому середовищі та при концентрації KanaR 100 мкг/мл. Низька експресія KanaR може бути отримана шляхом видалення природного промотору (P2/P3 (SEQ ID NOS: 2-3)), забезпечуючи відсутність сигналу кінця транскрипції та змінюючи початок трансляції. Низька експресія KanaR приводить до 50 % підвищенню плазмідних виходів у порівнянні з паретеральною плазмідою pVR1012. Це також приводить до підвищення плазмідної стабільності та гомогенності у виробничих виходах плазмідних конструкцій. 19 UA 100692 C2 Таблиця 4 Назва Промоплазміди тор ATG Аналіз Вирощув. Плазмідні на виходи ("Erlen" Швидкості збільшен. ріст в Egli/ Kana мутації [Kana]: MIC 100) 1600-3200 48** and 51*** 17 to 100 ATG 1600-3200 19 23 TTG 400-800 67 0 ATG 1600-3200 26 9 ATG 1600-3200 35 38 Термінатор Ініціатор транс- трансляції крипції pVR1012 P1+P2/3 немає rrn T1pLL9 P1+P2/3 T2 rrn T1pLL10 P1+P2/3 T2 pLL11 P1+P2/3 Spe rrn T1pLL13* P1+P2/3 T2 Плазмідні виходи (ферментор) ND pLL14* P1 rrn T1T2 ATG 400-800 100 0 3,1 мг/г бактеріальн. пелет pLL15* P2/3 rrn T1T2 ATG 1600-3200 35 15 ND pLL16* P1 немає ATG 98** 0 PLL19* P1 Rrn T1T2 ATG 76*** 0 1,9 мг/г бактеріальн. пелет 2,9 мг/г бактеріальн. пелет * Конструкції, які мають делецію 192 п. о. між промотором CMV і промотором Kana P1. **Результати, отримані в тесті кількісного визначення виходу другої плазміди *** Результати, отримані в тесті кількісного визначення виходу третьої плазміди. 5 10 Плазміду pLL16 додатково досліджували на стійкість до зростаючих концентрацій Kana і плазмідним виходам після ферментації. Також завершували конструкцію pLL17 і pLL18, у якій pLL17 мала промотор P1, стартовий кодон TTG і термінатор rrn T1/2 і pLL18 мала Р1 промотор, стартовий кодон TTG і термінатор. Однак, ці конструкції можуть бути композиціями для одержання, внаслідок низької здатності KanaR. Ці конструкції аналізували за допомогою раніше описаних тестів. Плазмідні виходи тестували після адаптації Kana на обраних конструкціях (напр., pLL14 до -18). Аналіз РНК-транскриптів з гена KanaR всіх конструкцій здійснювали для підтвердження наведеної моделі. Перевертаючи касету KanaR в pVR1012, можна підтвердити, що касета KanaR не впливає на оріджин реплікації. 20 UA 100692 C2 21 UA 100692 C2 22 UA 100692 C2 23 UA 100692 C2 24 UA 100692 C2 25 UA 100692 C2 26 UA 100692 C2 27 UA 100692 C2 28
ДивитисяДодаткова інформація
Назва патенту англійськоюDna-plasmids having increased expression and stability
Автори англійськоюAudonnet, Jean-christophe
Назва патенту російськоюДнк-плазмиды, имеющие повышенную экспрессию и стабильность
Автори російськоюОдоне Жан-Кристоф
МПК / Мітки
МПК: C12N 15/63
Мітки: експресію, підвищену, стабільність, мають, днк-плазміди
Код посилання
<a href="https://ua.patents.su/54-100692-dnk-plazmidi-yaki-mayut-pidvishhenu-ekspresiyu-ta-stabilnist.html" target="_blank" rel="follow" title="База патентів України">Днк-плазміди, які мають підвищену експресію та стабільність</a>
Наступний патент: Прокатна чотиривалкова кліть для прокатки-поділу сортових заготівок
Випадковий патент: Спосіб та пристрій для очистки електродів електролітичних ванн