Спосіб зниження сироваткових рівнів сечової кислоти у людини
Формула / Реферат
1. Спосіб зниження сироваткових рівнів сечової кислоти у людини, який передбачає введення людині від приблизно 0,5 мг до менш ніж 50 мг на день 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі.
2. Спосіб за п. 1, який відрізняється тим, що людині вводять приблизно 20 мг, приблизно 10 мг, або приблизно 5 мг на день 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі.
3. Спосіб за п. 1, який відрізняється тим, що людині вводять від приблизно 0,5 мг до менш ніж 20 мг на день 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі.
4. Спосіб за п. 1, який відрізняється тим, що людині вводять від приблизно 0,5 мг до менш ніж 5 мг на день 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі.
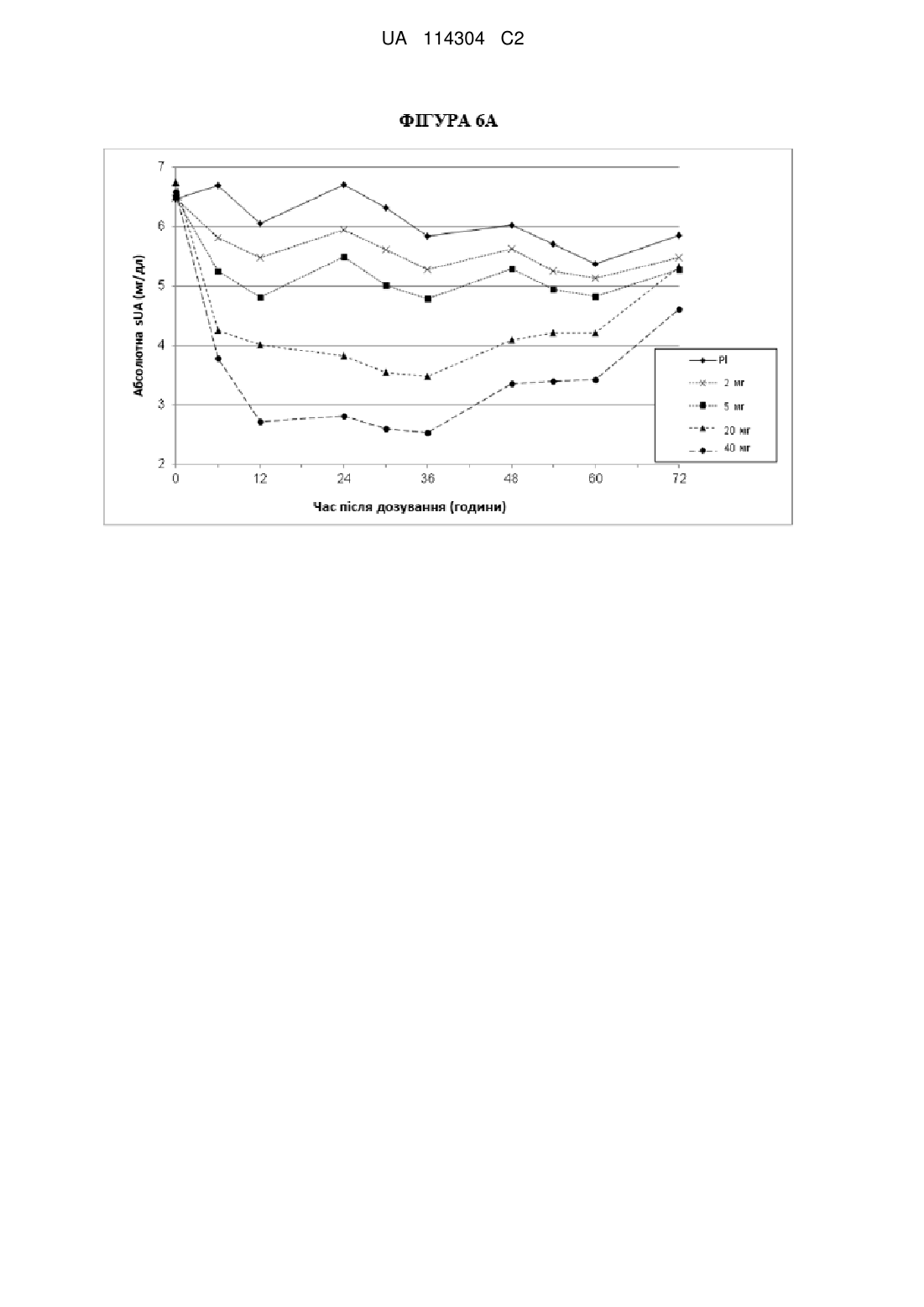
5. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що через 24 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі сироваткові рівні сечової кислоти знижуються принаймні на 1 мг/дл.
6. Спосіб за будь-яким з пунктів 1-4, який відрізняється тим, що через 24 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі сироваткові рівні сечової кислоти знижуються принаймні на 20 % від вихідного рівня.
7. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що застосовується для лікування або профілактики стану, що характеризується патологічними рівнями сечової кислоти в тканині або органі.
8. Спосіб за п. 7, який відрізняється тим, що стан являє собою подагру, рекурентну подагричну атаку, подагричний артрит, гіперурикемію, гіпертонію, серцево-судинне захворювання, ішемічну хворобу серця, синдром Леша-Найяна, синдром Келлі-Сігміллера, захворювання нирок, камені в нирках, ниркову недостатність, запалення суглобів, артрит, сечокам'яну хворобу, отруєння свинцем, гіперпаратиреоз, псоріаз, саркоїдоз, дефіцит гіпоксантин-гуанін-фосфорибозилтрансферази (HPRT) або їхню комбінацію.
9. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що людині вводять другий засіб, ефективний для лікування подагри.
10. Спосіб за п. 9, який відрізняється тим, що другий засіб являє собою інгібітор URAT 1, інгібітор ксантиноксидази, ксантин-дегідрогеназу, інгібітор ксантин-оксидоредуктази або їхні комбінації.
11. Спосіб за п. 10, який відрізняється тим, що інгібітор URAT 1 являє собою 2-((5-бром-4-(4-циклопропіл-1-нафталінил)-4Н-1,2,4-триазол-3-іл)тіо)оцтову кислоту або її фармацевтично прийнятну сіль.
12. Фармацевтична композиція, що містить від приблизно 0,5 мг до менш ніж 50 мг 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі.
13. Фармацевтична композиція за п. 12, яка відрізняється тим, що містить приблизно 20 мг, приблизно 10 мг або приблизно 5 мг 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі.
14. Фармацевтична композиція за п. 12, яка відрізняється тим, що містить від приблизно 0,5 мг до менш ніж 20 мг 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі.
15. Фармацевтична композиція за п. 12, яка відрізняється тим, що містить від приблизно 0,5 мг до менш ніж 5 мг 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі.
Текст
Реферат: Винахід належить до галузі медицини і стосується способу зниження сироваткових рівнів сечової кислоти у людини шляхом введення від приблизно 0,5 до менш ніж 50 мг на день 2-((3(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі, фармацевтичної композиції, яка містить від приблизно 0,5 до менш ніж 50 мг на день 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі. UA 114304 C2 (12) UA 114304 C2 UA 114304 C2 5 10 15 20 25 30 35 40 45 50 55 60 ПЕРЕХРЕСНЕ ПОСИЛАННЯ [001] Дана заявка претендує на пріоритет за заявкою США серійний номер 61/555, 450, поданою 3 листопада 2011 року, і заявкою США 61/616,363, поданою 27 березня 2012 року, які включені сюди за допомогою посилання у всій їхній повноті. РІВЕНЬ ТЕХНІКИ [002] Сечова кислота утворюється в результаті окиснення ксантину. Порушення метаболізму сечової кислоти включають, але не обмежуються ними, поліцитемію, мієлоїдну метаплазію, подагру, рецидив подагри, подагричний артрит, гіперурикемію, гіпертонію, серцево-судинне захворювання, ішемічну хворобу серця, синдром Леша- Найяна, синдром Келлі-Сігміллера, хворобу нирок, камені в нирках, ниркову недостатність, запалення суглобів, артрит, сечокам'яну хворобу, свинцеве отруєння, гіперпаратиреоз, псоріаз або саркоїдоз. СУТНІСТЬ ВИНАХОДУ [003] Деякі варіанти здійснення даного винаходу відносяться до сполуки, що застосовується для зниження рівнів сечової кислоти в сироватці крові людини, де дана сполука являє собою 2((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанову кислоту або її фармацевтично прийнятну сіль. [004] У деяких варіантах здійснення даного винаходу, що відносяться до сполуки, що застосовується, людині вводять менше ніж 100 мг на день 2-((3-(4-ціанонафталін-1-іл)піридин-4іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі. У деяких варіантах здійснення даного винаходу людині вводять менше ніж 50 мг на день 2-((3-(4-ціанонафталін-1іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі. У деяких варіантах здійснення даного винаходу людині вводять близько 40 мг на день 2-((3-(4ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі. У деяких варіантах здійснення даного винаходу людині вводять близько 20 мг на день 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі. У деяких варіантах здійснення даного винаходу людині вводять менше ніж 20 мг на день 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2метилпропанової кислоти або її фармацевтично прийнятної солі. У деяких варіантах здійснення даного винаходу людині вводять близько 5 мг на день 2-((3-(4-ціанонафталін-1-іил)піридин-4іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі. У деяких варіантах здійснення даного винаходу людині вводять менше ніж 5 мг на день 2-((3-(4-ціанонафталін-1іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення даного винаходу людині вводять близько 2 мг на день 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2метилпропанової кислоти або її фармацевтично прийнятної солі. У деяких варіантах здійснення даного винаходу людині вводять менше ніж 2 мг на день 2-((3-(4-ціанонафталін-1-іл)піридин-4іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі. У деяких варіантах здійснення даного винаходу людині вводять близько 1 мг на день 2-((3-(4-ціанонафталін-1іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. [005] У деяких варіантах здійснення даного винаходу, що відносяться до сполуки, яка слугує для застосування, через 24 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)2-метилпропанової кислоти або її фармацевтично прийнятної солі сироваткові рівні сечової кислоти знижуються щонайменше на 0,5 мг/дл. У деяких варіантах здійснення даного винаходу через 24 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі сироваткові рівні сечової кислоти знижуються щонайменше на 0,8 мг/дл. У деяких варіантах здійснення даного винаходу через 24 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі сироваткові рівні сечової кислоти знижуються щонайменше на 1 мг/дл. У деяких варіантах здійснення даного винаходу через 24 години після введення 2-((3(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі сироваткові рівні сечової кислоти знижуються щонайменше на 2 мг/дл. У деяких варіантах здійснення даного винаходу, через 24 години після введення 2-((3-(4-ціанонафталін1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі сироваткові рівні сечової кислоти знижуються щонайменше на 3 мг/дл. [006] У деяких варіантах здійснення даного винаходу, через 48 години після введення 2-((3(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі сироватка сироваткові рівні сечової кислоти знижуються щонайменше на 0,5 мг/дл. У деяких варіантах здійснення даного винаходу, через 48 години після введення 2-((3-(4ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі сироваткові рівні сечової кислоти знижуються щонайменше на 1 мг/дл. У деяких варіантах здійснення даного винаходу, через 48 години після введення 2-((3-(4-ціанонафталін 1 UA 114304 C2 5 10 15 20 25 30 35 40 45 50 55 1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі сироваткові рівні сечової кислоти знижуються щонайменше на 3 мг/дл. [007] У деяких варіантах здійснення даного винаходу, через 72 години після введення 2-((3(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі сироваткові рівні сечової кислоти знижуються щонайменше на 0,5 мг/дл. У деяких варіантах здійснення даного винаходу, через 72 години після введення 2-((3-(4ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі сироваткові рівні сечової кислоти знижуються щонайменше на 1 мг/дл. У деяких варіантах здійснення даного винаходу, через 72 години після введення 2-((3-(4-ціанонафталін1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі сироваткові рівні сечової кислоти знижуються на близько 2 мг/дл. [008] У деяких варіантах здійснення даного винаходу, що відносяться до сполуки, що слугує для застосування, через 24 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)2-метилпропанової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 15 % від початкового рівня. У деяких варіантах здійснення даного винаходу, через 24 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі сироваткові рівні сечової кислоти знижуються щонайменше на 20 % від початкового рівня. У деяких варіантах здійснення даного винаходу, через 24 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі сироваткові рівні сечової кислоти знижуються щонайменше на 30 % від початкового рівня. У деяких варіантах здійснення даного винаходу, через 24 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі сироваткові рівні сечової кислоти знижуються щонайменше на 40 % від початкового рівня. У деяких варіантах здійснення даного винаходу, через 24 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі сироваткові рівні сечової кислоти знижуються на близько 20 % від початкового рівня. У деяких варіантах здійснення даного винаходу через 24 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі сироваткові рівні сечової кислоти знижуються на близько 40 % від початкового рівня. У деяких варіантах здійснення даного винаходу, через 24 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі сироваткові рівні сечової кислоти знижуються на близько 60 % від початкового рівня. [009] У деяких варіантах здійснення даного винаходу, через 48 години після введення 2-((3(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі сироваткові рівні сечової кислоти знижуються на близько 10 % від початкового рівня. У деяких варіантах здійснення даного винаходу, через 48 години після введення 2-((3-(4ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі сироваткові рівні сечової кислоти знижуються щонайменше на 20 % від початкового рівня. У деяких варіантах здійснення даного винаходу, через 48 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі сироваткові рівні сечової кислоти знижуються щонайменше на 30% від початкового рівня. У деяких варіантах здійснення даного винаходу, через 48 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі сироваткові рівні сечової кислоти знижуються на близько 40 % від початкового рівня. У деяких варіантах здійснення даного винаходу, через 48 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі сироваткові рівні сечової кислоти знижуються на близько 50 % від початкового рівня. У деяких варіантах здійснення винаходу, через 72 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі сироваткові рівні сечової кислоти знижуються щонайменше на 15 % від початкового рівня. У деяких варіантах здійснення даного винаходу, через 72 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі сироваткові рівні сечової кислоти знижуються щонайменше на 20 % від початкового рівня. У деяких варіантах здійснення даного винаходу, через 72 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі сироваткові рівні сечової кислоти знижуються на близько 20 % від початкового рівня. У деяких варіантах здійснення даного винаходу, через 72 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її 2 UA 114304 C2 5 10 15 20 25 30 35 40 45 50 55 60 фармацевтично прийнятної солі сироваткові рівні сечової кислоти знижуються на близько 30 % від початкового рівня. [0010] У деяких варіантах здійснення даного винаходу сполука призначена для застосування при лікуванні або профілактики стану, що характеризується патологічними рівнями сечової кислоти в тканині або органі. У деяких варіантах здійснення даного винаходу даний стан являє собою подагру, рецидив подагри, подагричний артрит, гіперурикемію, гіпертонію, серцевосудинне захворювання, ішемічну хворобу серця, синдром Леша-Найяна, синдром КелліСігміллера, хворобу нирок, камені в нирках, ниркову недостатність, запалення суглобів, артрит, сечокам'яну хворобу, свинцеве отруєння, гіперпаратиреоз, псоріаз, саркоїдоз, недостатність гіпоксантин-гуанін-фосфорибозилтрансферази (hypoxanthine-guanine phosphoribosyltransferase (HPRT)) або їхню комбінацію. У певних варіантах здійснення даного винаходу даний стан являє собою подагру. [0011] У деяких варіантах здійснення даного винаходу, що відносяться до сполуки, що слугує для застосування, людині вводять другий засіб, ефективний для лікування подагри. У деяких варіантах здійснення даного винаходу другий засіб являє собою інгібітор URAT 1, інгібітор ксантиноксидази, ксантин-дегідрогеназу, інгібітор ксантин-оксидоредуктази або їхні комбінації. У деяких варіантах здійснення даного винаходу інгібітор URAT 1 являє собою 2-((5бром-4-(4-циклопропіл-1-нафталінил)-4H-1,2,4-триазол-3-іл)тіо)оцтову кислоту або її фармацевтично прийнятну сіль. У деяких варіантах здійснення даного винаходу інгібітор ксантиноксидази являє собою алопуринол або фебуксостат (Febuxostat). [0012] Деякі варіанти здійснення даного винаходу відносяться до способів зниження рівнів сечової кислоти в сироватці крові в організмі людини, що включають введення людині 2-((3-(4ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі. [0013] У деяких варіантах здійснення даного винаходу даний спосіб містить введення менше 100 мг, менше 50 мг на день, близько 40 мг на день, близько 20 мг на день, менше 20 мг на день, близько 5 мг на день, менше 5 мг в день, близько 2 мг на день, менше 2 мг на день або близько 1 мг на день 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі. [0014] У деяких варіантах здійснення даного винаходу сироваткові рівні сечової кислоти знижуються щонайменше на 0,5 мг/дл, щонайменше на 0,8 мг/дл, щонайменше на 1 мг/дл, щонайменше на 2 мг/дл або щонайменше на 3 мг/дл через 24 години після введення 2-((3-(4ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі. У деяких варіантах здійснення даного винаходу сироваткові рівні сечової кислоти знижуються щонайменше на 0,5 мг/дл, щонайменше на 1 мг/дл або щонайменше на 3 мг/дл через 48 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2метилпропанової кислоти або її фармацевтично прийнятної солі. У деяких варіантах здійснення даного винаходу сироваткові рівні сечової кислоти знижуються щонайменше на 0,5 мг/дл, щонайменше на 1 мг/дл або на 2 мг/дл через 72 години після введення 2-((3-(4-ціанонафталін-1іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі. [0015] У деяких варіантах здійснення даного винаходу сироваткові рівні сечової кислоти знижуються щонайменше на 15 % від початкового рівня, щонайменше на 20 % від початкового рівня, щонайменше на 30 % від початкового рівня, щонайменше на 40 % від вихідного рівня, на близько 20 % від початкового рівня або близько 40 % від початкового рівня, на близько 60 % від початкового рівня через 24 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)2-метилпропанової кислоти або її фармацевтично прийнятної солі. У деяких варіантах здійснення даного винаходу сироваткові рівні сечової кислоти знижуються на близько 10 % від початкового рівня, щонайменше на 20 % від початкового рівня, щонайменше на 30 % від початкового рівня, на близько 40 % від початкового рівня або на близько 50 % від початкового рівня через 48 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2метилпропанової кислоти або її фармацевтично прийнятної солі. У деяких варіантах здійснення даного винаходу сироваткові рівні сечової кислоти знижуються щонайменше на 15 % порівняно з вихідним, щонайменше на 20 % від початкового рівня, на близько 20 % від початкового рівня або на близько 30 % від початкового рівня через 72 години після введення 2-((3-(4ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі. [0016] У деяких варіантах здійснення даного винаходу даний спосіб призначений для лікування або профілактики стану, що характеризується патологічними рівнями сечової кислоти в тканині або органі. У деяких варіантах здійснення даного винаходу даний стан являє собою подагру, рецидив подагри, подагричний артрит, гіперурикемію, гіпертонію, серцево-судинне 3 UA 114304 C2 5 10 15 20 25 30 35 40 45 50 55 60 захворювання, ішемічну хворобу серця, синдром Леша-Найяна, синдром Келлі-Сігміллера, хворобу нирок, камені в нирках, ниркову недостатність, запалення суглобів, артрит, сечокам'яну хворобу, свинцеве отруєння, гіперпаратиреоз, псоріаз, саркоїдоз, недостатність гіпоксантингуанін-фосфорибозилтрансферази (HPRT) або їхню комбінацію. У певних варіантах здійснення даного винаходу даний стан являє собою подагру. [0017] У деяких варіантах здійснення даного винаходу способи додатково включають введення другого засобу, ефективного для лікування подагри. У деяких варіантах здійснення даного винаходу другий засіб являє собою інгібітор URAT 1, інгібітор ксантиноксидази, ксантиндегідрогенази, інгібітор ксантин-оксидоредуктази або їхні комбінації. У деяких варіантах здійснення даного винаходу інгібітор URAT 1 являє собою 2-((5-бром-4-(4-циклопропіл-1нафталінил)-4H-1,2,4-триазол-3-іл)тіо)оцтову кислоту або її або фармацевтично прийнятну сіль або складний ефір. У деяких варіантах здійснення даного винаходу інгібітор ксантиноксидази являє собою алопуринол або фебуксостат. [0018] Деякі варіанти здійснення даного винаходу відносяться до застосування сполуки у виготовленні лікарського засобу для зниження сироваткових рівнів сечової кислоти в організмі людини, де дана сполука являє собою 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2метилпропанову кислоту або її фармацевтично прийнятну сіль. [0019] У деяких варіантах здійснення даного винаходу, що відносяться до застосування сполуки у виготовленні лікарського засобу, людині вводять менше 100 мг на день, менше 50 мг на день, близько 40 мг на день, близько 20 мг на день, менше 20 мг на день, близько 5 мг на день, менше 5 мг на день, близько 2 мг на день, менше 2 мг на день або близько 1 мг на день 2((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. [0020] У деяких варіантах здійснення даного винаходу, що відносяться до застосування сполуки при виготовленні лікарського засобу, через 24 години після введення 2-((3-(4ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі сироваткові рівні сечової кислоти знижуються щонайменше на 0,5 мг/дл, щонайменше на 0,8 мг/дл, щонайменше на 1 мг/дл, щонайменше на 2 мг/дл, щонайменше на 3 мг/дл. У деяких варіантах здійснення даного винаходу, через 48 годин після введення 2-((3-(4ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі сироваткові рівні сечової кислоти знижуються щонайменше на 0,5 мг/дл, щонайменше на 1 мг/дл або щонайменше на 3 мг/дл. У деяких варіантах здійснення даного винаходу через 72 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2метилпропанової кислоти або її фармацевтично прийнятної солі сироваткові рівні сечової кислоти знижуються щонайменше на 0,5 мг/дл, щонайменше на 1 мг/дл або на близько 2 мг/дл. [0021] У деяких варіантах здійснення даного винаходу, що відносяться до застосування сполуки при виготовленні лікарського засобу, через 24 години після введення 2-((3-(4ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 15 % від початкового рівня, щонайменше на 20 % від початкового рівня, щонайменше на 30 % від початкового рівня, щонайменше на 40 % від початкового рівня, на близько 20 % від вихідного рівня, на близько 40 % від початкового рівня або на близько 60 % від початкового рівня. У деяких варіантах здійснення даного винаходу, через 48 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі сироваткові рівні сечової кислоти знижуються на близько 10 % від початкового рівня, щонайменше на 20 % від початкового рівня, щонайменше на 30 % від початкового рівня, на близько 40 % від початкового рівня або на близько 50 % від початкового рівня. У деяких варіантах здійснення даного винаходу, через 72 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі сироваткові рівні сечової кислоти знижуються щонайменше на 15 % від початкового рівня, щонайменше на 20 % від початкового рівня, на близько 20 % від початкового рівня або на близько 30 % від початкового рівня. [0022] У деяких варіантах здійснення даного винаходу, що відносяться до застосування сполуки при виготовленні лікарського засобу, даний лікарський засіб призначений для застосування при лікуванні або профілактики стану, що характеризується патологічними рівнями сечової кислоти в тканині або органі. У деяких варіантах здійснення даного винаходу даний стан являє собою подагру, рецидив подагри, подагричний артрит, гіперурикемію, гіпертонію, серцево-судинне захворювання, ішемічну хворобу серця, синдром Леша-Найяна, синдром Келлі-Сігміллера, хворобу нирок, камені в нирках, ниркову недостатність, запалення суглобів, артрит, сечокам'яну хворобу, свинцеве отруєння, гіперпаратиреоз, псоріаз, саркоїдоз, недостатність гіпоксантин-гуанін-фосфорибозилтрансферази (HPRT) або їхню комбінацію. У певних варіантах здійснення даного винаходу даний стан являє собою подагру. 4 UA 114304 C2 5 10 15 20 25 30 35 40 45 50 55 60 [0023] У деяких варіантах здійснення даного винаходу способи додатково включають введення другого засобу, ефективного для лікування подагри. У деяких варіантах здійснення даного винаходу другий засіб являє собою інгібітор URAT 1, інгібітор ксантиноксидази, ксантиндегідрогенази, інгібітор ксантин-оксидоредуктази або їхні комбінації. У деяких варіантах здійснення даного винаходу інгібітор URAT 1 являє собою 2-((5-бром-4-(4-циклопропіл-1нафталінил)-4H-1,2,4-триазол-3-іл)тіо)оцтову кислоту або її фармацевтично прийнятну сіль або складний ефір. У деяких варіантах здійснення даного винаходу інгібітор ксантиноксидази являє собою алопуринол або фебуксостат. КОРОТКИЙ ОПИС КРЕСЛЕНЬ [0024] Нові ознаки, що містяться у винаході, детально викладені у формулі винаходу. Кращого розуміння ознак і переваг даного винаходу можна домогтися, звернувшись до нижченаведеного докладного опису, який містить ілюстративні варіанти здійснення даного винаходу, в яких використані принципи, що лежать в основі винаходу, і прикладених кресленнень, на яких: [0025] На фігурі 1A приведено схематичне представлення послідовності заходів під час клінічного випробування, описаного в прикладі 3. [0026] На фігурі 1В приведено схематичне представлення послідовності заходів під час клінічного випробування, описаного в прикладі 5. [0027] На фігурі 2А представлені значення абсолютних концентрацій сечової кислоти в сироватці крові (мг/дл), виміряних в інтервалі від 0 до 72 год. після введення дози для групи 1 (2 мг, натще). Суб'єкти 1 і 2 отримували препарат плацебо; суб'єкти від 3 до 8 отримували активний препарат. [0028] На фігурі 2B представлена % (процентна) зміна рівня сечової кислоти в сироватці крові від вихідного рівня, виміряна в інтервалі від 0 до 72 год. після введення дози для групи 1 (2 мг, натще). Суб'єкти 1 і 2 отримували препарат плацебо; суб'єкти від 3 до 8 отримували активний препарат. [0029] На фігурі 3А представлені значення абсолютних концентрацій сечової кислоти в сироватці крові (мг/дл), вимірянів інтервалі від 0 до 72 год. після введення дози длягрупи 1 (2 мг, натще). Суб'єкти 1 і 2 отримували препарат плацебо; суб'єкти від 3 до 8 отримували активний препарат. [0030] На фігурі 3B представлена процентна зміна рівня сечової кислоти в сироватці крові від вихідного рівня, виміряна в інтервалі від 0 до 72 год. після введення дози для груп 2 і 3 (5 мг, натще і після їжі, відповідно). Суб'єкти 1 і 2 отримували препарат плацебо; суб'єкти від 3 до 8 отримували активний препарат. [0031] На фігурі 4А представлені значення абсолютних концентрацій сечової кислоти в сироватці крові (мг/дл), виміряні в інтервалі від 0 до 72 год. після введення дози для групи 4 і 5 (20 мг, натще і після їжі, відповідно). Суб'єкти 1 і 2 отримували препарат плацебо; суб'єкти від 3 до 8 отримували активний препарат. [0032] На фігурі 4B представлена процентна зміна рівня сечової кислоти в сироватці крові від вихідного рівня, виміряна в інтервалі від 0 до 72 год. після введення дози для групи 4 і 5 (20 мг, натще і після їжі, відповідно). Суб'єкти 1 і 2 отримували препарат плацебо; суб'єкти від 3 до 8 отримували активний препарат. [0033] На фігурі 5А представлені значення абсолютних концентрацій сечової кислоти в сироватці крові (мг/дл), виміряні в інтервалі від 0 до 72 год. після введення дози для групи 6 (40 мг, натще). Суб'єкти 1 і 2 отримували препарат плацебо; суб'єкти від 3 до 8 отримували активний препарат. [0034] На фігурі 5B представлена процентна зміна рівня сечової кислоти в сироватці крові від вихідного рівня, виміряна в інтервалі від 0 до 72 год. після введення дози для групи 6 (40 мг, натще). Суб'єкти 1 і 2 отримували препарат плацебо; суб'єкти від 3 до 8 отримували активний препарат. [0035] На фігурі 6А представлені значення абсолютних концентрацій сечової кислоти в сироватці крові (мг/дл), виміряні в інтервалі від 0 до 72 год. після введення дози для груп 1, 2, 4 і 6 (2 мг, 5 мг, 20 мг і 40 мг відповідно, всі натще). [0036] На фігурі 6B представлена процентна зміна рівня сечової кислоти в сироватці крові від вихідного рівня, виміряна в інтервалі від 0 до 72 год. після введення дози для груп 1, 2, 4 і 6 (2 мг, 5 мг, 20 мг і 40 мг відповідно, всі натще). [0037] На фігурі 7А представлені значення абсолютних концентрацій сечової кислоти в сироватці крові (мг/дл, середні значення для суб'єктів 1, 2 і 3, що приймали препарат плацебо, і середні значення для суб'єктів від 4 до 12, що приймали активний препарат), виміряні в номінальні моменти часу (дні 0-9 - дозування один раз на день, плюс дні 10-13, після введення 5 UA 114304 C2 5 10 15 20 25 30 35 40 45 50 55 60 дози) для дванадцяти суб'єктів у групі 7 (1 мг, один раз на день протягом 10 днів), як описано в прикладі 6А. [0038] На фігурі 7B представлена процентна зміна рівня сечової кислоти в сироватці крові від вихідного рівня (середні значення для суб'єктів 1, 2 і 3, що приймали препарат плацебо, і середні значення для суб'єктів від 4 до 12, що приймали активний препарат), виміряні в номінальні моменти часу (дні 0-9 - дозування один раз на день, плюс дні 10-13, після введення дози) для дванадцяти суб'єктів у групі 7 (1 мг, один раз на день протягом 10 днів), як описано в прикладі 6А. [0039] На фігурі 8А представлені значення абсолютних концентрацій сечової кислоти в сироватці крові (мг/дл, середні значення для суб'єктів 1, 2 і 3, що приймали препарат плацебо, і середні значення для суб'єктів від 4 до 10, що приймали активний препарат), виміряні в номінальні моменти часу (дні 0-9 - дозування один раз на день, плюс дні 10-13, після введення дози) для десяти суб'єктів у групі 8 (5 мг, прийом один раз на день протягом 10 днів), як описано в прикладі 6В. [0040] На фігурі 8B представлена процентна зміна рівня сечової кислоти в сироватці крові від вихідного рівня (середні значення для суб'єктів 1, 2 і 3, що приймали препарат плацебо, і середні значення для суб'єктів від 4 до 10, що приймали активний препарат), виміряна в номінальні моменти часу (дні 0-9 - дозування один раз на день, плюс дні 10-13, після введення дози) для десяти суб'єктів у групі 8 (1 мг, прийом один раз на день протягом 10 днів), як описано в прикладі 6В. [0041] На фігурі 9А представлені значення абсолютних концентрацій сечової кислоти в сироватці крові (мг/дл, середні значення для суб'єктів 1, 2 і 3, що приймали препарат плацебо, і середні значення для суб'єктів від 4 до 11, що приймали активний препарат), виміряні в номінальні моменти часу (дні 0-9 - дозування один раз на день, плюс дні 10-13, після введення дози) для одинадцяти суб'єктів у групі 9 (10 мг, прийом один раз на день протягом 10 днів), як описано в прикладі 6С. [0042] На фігурі 9B представлена процентна зміна рівня сечової кислоти в сироватці крові від вихідного рівня (середні значення для суб'єктів 1, 2 і 3, що приймали препарат плацебо, і середні значення для суб'єктів від 4 до 11, що приймали активний препарат), виміряна в номінальні моменти часу (дні 0-9 - дозування один раз на день, плюс дні 10-13, після введення дози) для одинадцяти суб'єктів у групі 9 (10 мг, прийом один раз на день протягом 10 днів), як описано в прикладі 6С. [0043] На фігурі 10A представлені середні значення абсолютних концентрацій сечової кислоти в сироватці крові (мг/дл), виміряні в номінальних моментах часу (дні 0-9 - один раз на добу, а також дні 10-13, після введення дози) для груп 7, 8 і 9 (1 мг, 5 мг і 10 мг відповідно, прийом один раз на день протягом 10 днів, групи плацебо об'єднували), як описано в прикладі 6. [0044] На фігурі 10B представлено середнє значення процентної зміни рівня сечової кислоти в сироватці крові від вихідного рівня, виміряної в номінальних тимчасових точках (дні 0-9 дозування один раз на день, плюс дні 10-13, після введення дози) для груп 7, 8 та 9 (1 мг, 5 мг і 10 мг відповідно, прийом один раз на день протягом 10 днів, групи плацебо об'єднували), як описано в прикладі 6. ДОКЛАДНИЙ ОПИС ВИНАХОДУ [0045] Нові ознаки, що містяться у винаході, детально викладені у формулі винаходу. Кращого розуміння ознак і переваг даного винаходу можна домогтися, звернувшись до нижченаведеного докладного опису, який містить ілюстративні варіанти здійснення даного винаходу, в яких використані принципи, що лежать в основі винаходу. [0046] Хоча в даному документі показані і описані переважні варіанти здійснення даного винаходу, компетентному в даній області фахівцеві буде очевидно, що такі варіанти здійснення даного винаходу наведені тільки як приклади. Компетентний фахівець зможе представити собі численні варіації, зміни і заміни, які не виходять за рамки сутності даного винаходу. Слід розуміти, що в практичній реалізації винаходу можна використовувати різні альтернативи до описаних тут варіантів його здійснення. Припускається, що представлені нижче пункти формули винаходу визначають його обсяг, причому цією формулою винаходу охоплені не тільки описані способи і структури, але і їхні еквіваленти. [0047] Використані в цьому документі заголовки розділів слугують тільки організаційним цілям, їх не слід сприймати як обмеження описаного тут предмета обговорення. Деяка фармацевтична термінологія [0048] Терміни "пацієнт", "суб'єкт" або "індивід" вживаються взаємозамінно. При використанні в даному документі, вони відносяться до індивідів, що страждають від розладу і 6 UA 114304 C2 5 10 15 20 25 30 35 40 45 50 55 60 подібними до нього, охоплюють ссавців та нессавців. Жоден із зазначених термінів не вимагає, щоб індивід перебував під опікою та/або під наглядом професійного медика. Ссавці є будь-яким членом класу ссавці, включаючи, але не обмежуючись ними, людину, приматів, таких як шимпанзе, та інші види людиноподібних і нелюдиноподібних мавп; сільськогосподарських тварин, таких як велика рогата худоба, коней, овець, кіз, свиней; домашніх тварин, таких як кролики, собаки і кішки; лабораторних тварин, включаючи гризунів, таких як щури, миші і морські свинки, і подібних до них. Приклади тварин, що не відносяться до ссавців, включають, але не обмежуються ними, птахів, риб і подібних до них. У деяких варіантах здійснення способів і композицій, що пропонуються винаходом, індивідом є ссавець. У переважних варіантах здійснення даного винаходу індивідом є людина. [0049] Терміни "лікувати", "гоєння" або "лікування", а також інші граматичні еквіваленти при використанні в даному документі включають полегшення, ослаблення або поліпшення захворювання або патологічного стану або одного чи більше його симптомів, попередження додаткових симптомів, полегшення або попередження метаболічних причин, що лежать в основі симптомів, придушення захворювання або патологічного стану, наприклад, припинення розвитку захворювання чи патологічного стану, ослаблення захворювання або патологічного стану, викликання регресії захворювання або патологічного стану, позбавлення від патологічного стану, викликаного захворюванням або станом або припинення симптомів захворювання або патологічного стану, і призначені для включення профілактики. Ці терміни додатково включають досягнення терапевтичного ефекту і/або профілактичного ефекту. Під терапевтичним ефектом мається на увазі викорінення або поліпшення основного захворювання, що підлягає лікуванню. Терапевтичний ефект також досягається при викоріненні або поліпшенні одного або більше фізіологічних симптомів, пов'язаних з основним захворюванням, так що у індивіда спостерігається загальне поліпшення, незважаючи на те, що індивід все ще уражений основним захворюванням. Для профілактичного ефекту композиції вводять індивіду, що має підвищений ризик розвитку конкретного захворювання, чи індивіду, який проявляє один або більше фізіологічних симптомів захворювання, навіть у тому випадку, якщо точний діагноз цього захворювання не був встановлений. [0050] Термін "близько" в цілому відноситься до діапазону чисел, які фахівець в даній області техніки буде розглядати еквівалентно наведеним значенням (наприклад, мають ту саму функцію або результат). У багатьох випадках термін "близько" може включати в себе цифри, які округлені з точністю до значущої цифри. У бажаних випадках термін "близько" означає знаходження в межах 10 % від заданого значення або діапазону. [0051] Терміни "вводити", "введення" і подібні до них при використанні в даному документі відносяться до способів, які можна застосовувати для забезпечення доставки сполук або композицій до бажаного місця біологічної дії. Ці способи включають, але не обмежуються ними, пероральні способи, інтрадуоденальні способи, парентеральні ін'єкції (включаючи внутрішньовенні, підшкірні, внутрішньоочеревинні, внутрішньом'язові, внутрішньосудинні ін'єкції або вливання), топічне і ректальне введення. Компетентні фахівці добре знайомі з методиками введення, які можна застосовувати з урахуванням описаних у даному документі сполук і способів. У переважних варіантах здійснення даного винаходу сполуки і композиції, описані в даному документі, вводять перорально. [0052] Терміни "ефективна кількість", "терапевтично ефективна кількість" або "фармацевтично ефективна кількість", що використовуються в даному документі, відносяться до достатньої кількості щонайменше одного засобу або сполуки, що вводиться, що позбавить до деякої міри від одного або більше симптомів захворювання або патологічного стану, що підлягає лікуванню. Результатом може бути зменшення та/або полегшення ознак, симптомів або причин захворювання або будь-яка інша потрібна зміна біологічної системи. Наприклад, "ефективна кількість" для терапевтичних цілей являє собою таку кількість композиції, що містить 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанову кислоту, яка необхідна для клінічно значущого зменшення проявів захворювання. Відповідна "ефективна" кількість може відрізнятися від одного індивіда до іншого. Відповідна "ефективна" кількість в будь-якому конкретному випадку може бути визначена, використовуючи такі методики, як дослідження із збільшенням дози. [0053] Термін "прийнятний" при використанні в даному документі відносно рецептурного складу, композиції або інгредієнта означає відсутність стійкого шкідливого впливу на загальний стан здоров'я індивіда, який отримує лікування. [0054] Термін "фармацевтично прийнятний" при використанні в даному документі відноситься до матеріалу, такого як носій або розбавлювач, який не анулює біологічну 7 UA 114304 C2 5 10 15 20 25 30 35 40 45 50 55 60 активність або властивості 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти, і є відносно нетоксичним, тобто, зазначений матеріал можна вводити індивіду, не ризикуючи викликати небажані біологічні ефекти або руйнівну взаємодію з яким-небудь з компонентів композиції, до складу якої він входить. [0055] Термін "проліки" при використанні в даному документі відноситься до попередника ліків, який після введення індивіду і подальшого всмоктування перетворюється в активний або більш активний різновид за допомогою певного процесу, наприклад метаболічної трансформації. Таким чином, даний термін охоплює будь-яке похідне 2-((3-(4-ціанонафталін-1іл)піридин-4-іл)тіо)-2-метилпропанової кислоти, яка при введенні реципієнту здатна забезпечити прямим або непрямим способом 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанову кислоту або її фармацевтично активний метаболіт або залишок. Деякі проліки мають у своєму структурному складі хімічну групу, яка надає їм меншу активність та/або змінює розчинність або деякі інші властивості лікарської сполуки. Після розщеплення та/або модифікації цієї хімічної групи проліків виникає активні ліки. Проліки часто виявляються застосовними тому, що в деяких ситуаціях їх простіше вводити, ніж батьківські (кінцеві) ліки. Наприклад, вони можуть бути біологічно доступними при пероральному введенні, тоді як батьківські (кінцеві) ліки позбавлені такої властивості. Особливо переважними є такі похідні або проліки, які збільшують біологічну доступність 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти при введенні індивіду (наприклад, дозволяючи сполуці, що була перорально введена, легше всмоктуватися в кров) або підсилюють доставку вихідної сполуки в біологічний компартмент (наприклад, мозок або лімфатичну систему). [0056] Термін " фармацевтично прийнятна сіль" при використанні в даному документі відноситься до солей, які зберігають біологічну ефективність вільних кислот і основ 2-((3-(4ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти і не є біологічно або іншим чином небажаними. 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанова кислота може взаємодіяти з неорганічними або органічними основами, і неорганічними і органічними кислотами з утворенням фармацевтично прийнятної солі. Такі солі можна приготувати in situ під час кінцевого виділення та очищення сполук, запропонованих винаходом, або за допомогою окремої реакції очищеної сполуки, що знаходиться у формі вільної основи, з відповідною органічною або неорганічною кислотою і наступного виділення отриманої таким чином солі. [0057] Термін "фармацевтична композиція" при використанні в даному документі відноситься до біологічно активних сполук, в необов'язковому порядку в суміші з щонайменше одним фармацевтично прийнятним хімічним компонентом, таким як, але не обмежуючись ними, носії, стабілізатори, розріджувачі, диспергуючі засоби, суспендуючі засоби, загусники, наповнювачі тощо. [0058] Термін "носій" при використанні в даному документі відноситься до відносно нетоксичних хімічних сполук або засобів, які полегшують укорінення сполук в клітини або тканини. [0059] Терміни "фармацевтична комбінація", "введення додаткової терапії", "введення додаткового терапевтичного засобу" тощо, при використанні в даному документі, відносяться до фармацевтичної терапії, що є результатом змішування або комбінування більше ніж одного активного інгредієнта, включаючи як фіксовані, так і нефіксовані комбінації активних інгредієнтів. Термін "фіксована комбінація" означає, що як 2-((3-(4-ціанонафталін-1-іл)піридин-4іл)тіо)-2-метилпропанову кислотуд, так і щонайменше один додатковий засіб вводять індивіду одночасно у вигляді єдиного цілого або дозування. Термін "нефіксована комбінація" означає, що 2-((3-(4-ціанонафталін-1-іл) піридин-4-іл)тіо)-2-метілпропанову кислоту і щонайменше один додатковий засіб вводять індивіду у вигляді різних препаратів одночасно, паралельно або слідом один за одним з часовими інтервалами, що варіюються, при цьому таке введення забезпечує ефективний рівень двох або більше сполук в організмі індивіда. Це також застосовно до варіантів терапії за типом коктейлю, наприклад до введення трьох і більше активних інгредієнтів. [0060] Терміни "спільне введення", "вводять в комбінації з" та їхні граматичні еквіваленти тощо, як вони використані в даному документі, означають введення вибраних терапевтичних засобів одному індивіду, включаючи такі схеми лікування, в яких вказані агенти вводять однаковим способом або різними способами, одночасно або в різний час. У деяких варіантах здійснення даного винаходу 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанову кислоту вводять спільно з іншими засобами. Дані терміни охоплюють введення двох або більше засобів тварині таким чином, що обидва засоби та/або їхні метаболіти є наявними в організмі тварини в один і той самий час. Вони включають одночасне введення в різних композиціях, введення в різний час в різних композиціях та/або введення в композиції, що містить обидва 8 UA 114304 C2 5 10 15 20 25 30 35 40 45 50 55 60 засоби. Таким чином, в деяких варіантах здійснення даного винаходу 2-((3-(4-ціанонафталін-1іл)піридин-4-іл)тіо)-2-метилпропанову кислоту та інший засіб (а) вводять в одній композиції. У деяких варіантах здійснення даного винаходу 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2метилпропанова кислота та інший засіб (а) змішані в композиції. [0061] Термін "метаболіт" при використанні в даному документі відноситься до похідного 2((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти, яка утворюється в результаті метаболічної трансформації сполуки. [0062] Термін "активний метаболіт" при використанні в даному документі відноситься до біологічно активного похідного 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти, яка утворюється в результаті метаболічної трансформації сполуки. [0063] Термін "метаболізований" при використанні в даному документі відноситься до суми процесів (включаючи, але не обмежуючись ними, реакції гідролізу та реакції, що каталізуються ферментами), за допомогою яких конкретна речовина перетвориться в організмі. Таким чином, ферменти можуть виробляти специфічні структурні зміни в сполуці. Наприклад, цитохром Р450 каталізує різні окислювальні і відновні реакції, тоді як уридин-дифосфат-глюкуронілтрансферази каталізують перенесення активованої молекули глюкуронової кислоти на ароматичні спирти, аліфатичні спирти, карбонові кислоти, аміни і вільні сульфгідрильні групи. Додаткову інформацію про метаболізм можна отримати із посилання The Pharmacological Basis of Therapeutics, 9th Edition, McGraw-Hill (1996). Способи введення [0064] У деяких варіантах здійснення даного винаходу 2-((3-(4-ціанонафталін-1-іл)піридин-4іл)тіо)-2-метилпропанову кислоту вводять або ізольовано, або в комбінації з фармацевтично прийнятними носіями, наповнювачами чи розріджувачами, у вигляді фармацевтичної композиції. Введення можна здійснювати будь-яким способом, який забезпечує доставку 2-((3(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти до місця дії. Дані способи включають, але не обмежуються ними, доставку в кишечник (включаючи пероральну, а також через шлунковий і дуоденальний зонд, ректальні супозиторії та ректальні клізми), парентеральні способи (ін'єкції або вливання, включаючи внутрішньоартеріальні, внутрішньосерцеві, внутрішньошкірні, інтрадуоденальні, інтрамедулярні, внутрішньом'язові, внутрішньокісткові, внутрішньочеревинні, внутріошньооболонкові, внутрішньосудинні, внутрішньовенні, в склоподібне тіло, епідуральні та підшкірні), інгаляційні, крізьшкірні, крізьслизові сублінгвальні, буккальні та топічні (включаючи нашкірний, дермальний, клізму, очні краплі, вушні краплі, інтраназальний, вагінальний) способи введення, хоча найбільш підходящий спосіб може залежати, наприклад, від конкретного захворювання і стану реципієнта. Тільки як приклад, 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанову кислоту можна вводити місцево в ту область організму, яка потребує лікування, наприклад локальне вливання під час хірургічної операції, топічне накладення кремів або мазей, ін'єкція, катетер або імплантат, причому вказаний імплантат може бути виготовлений, наприклад, з пористого, непористого або желатинозного матеріалу, включаючи мембрани, зокрема, силіконові мембрани, або волокна. Введення також може здійснюватися за допомогою прямої ін'єкції в хвору тканину або хворий орган. [0065] У деяких варіантах здійснення даного винаходу лікарські засоби, придатні для перорального введення, представлені у вигляді дискретних елементів, таких як капсули, крохмальні облатки або таблетки, кожна з яких містить заздалегідь визначену кількість активного інгредієнта, у вигляді порошків або гранул, у вигляді розчину або суспензії у водній рідини або неводній рідині або у вигляді рідкої емульсії типу "масло у воді" або типу "вода в маслі". У деяких варіантах здійснення даного винаходу активний інгредієнт представлений у вигляді болюса, лікарської кашки або пасти. [0066] Фармацевтичні препарати, які можуть бути використані перорально, включають таблетки, набивні капсули, виготовлені з желатину, а також м'які запечатані капсули, виготовлені з желатину і пластифікатору, такого як гліцерин або сорбіт. Таблетки можна виготовити пресуванням або штампуванням, в необов'язковому порядку з одним або більше допоміжними інгредієнтами. Пресовані таблетки можна виготовити пресуванням у відповідній машині активного інгредієнта, який знаходиться у сипучому вигляді, наприклад, у вигляді порошку або гранул, в необов'язковому порядку змішаного зі сполучними речовинами, інертними розріджувачами або змащувачами, поверхнево-активними або диспергуючими засобами. Штамповані таблетки можна виготовити штампуванням у відповідній машині суміші розмеленої в порошок сполуки, зволоженої інертним рідким розріджувачем. У деяких варіантах здійснення даного винаходу таблетки, вкриті оболонкою або рифлені, призначені для повільного або контрольованого вивільнення активного інгредієнта, що міститься в них. Всі 9 UA 114304 C2 5 10 15 20 25 30 35 40 45 50 55 60 лікарські форми для перорального введення повинні бути представлені в дозах, що відповідають такому введенню. Набивні капсули можуть містити активні інгредієнти в суміші з наповнювачем, таким як лактоза, сполучними речовинами, такими як крохмалі, та/або змащуючими речовинами, такими як тальк або стеарат магнію, а також, в необов'язковому порядку, із стабілізаторами. У м'яких капсулах активні сполуки можуть бути розчинені або суспендовані в підходящих рідинах, таких як жирні олії, рідкий парафін або рідкі поліетиленгліколі. У деяких варіантах здійснення даного винаходу туди ж додають стабілізатори. Серцевини драже забезпечені придатними покриттями. У цих цілях можна використовувати концентровані розчини цукру, які в необов'язковому порядку можуть містити гуміарабік, тальк, полівінілпіролідон, карбополовий гель, поліетиленгліколь та/або діоксид титану, лакувальні розчини та підходящі органічні розчинники або суміші розчинників. До таблеток або покриттів драже можуть бути додані барвники або пігменти в цілях ідентифікації або позначення різних комбінацій доз активної сполуки. [0067] У деяких варіантах здійснення даного винаходу фармацевтичні препарати призначені для парентерального введення за допомогою ін'єкції, наприклад, болюсної ін'єкції або безперервного вливання. Лікарські склади для ін'єкції можуть бути представлені в стандартній дозованій формі, наприклад, в ампулах або в багатодозувальних контейнерах з додаванням консерванту. Композиції можуть існувати в таких формах, як суспензії, розчини або емульсії в масляних або водних носіях, а також можуть містити формотворчі засоби, такі як суспендуючі, стабілізуючі та/або диспергуючі засоби. Лікарські склади можуть бути представлені в однодозувальних або в багатодозувальних контейнерах, наприклад, в герметично закритих ампулах і флаконах, а також можуть зберігатися в порошковій формі або у сублімованому (ліофілізованому) стані, вимагаючи тільки додавання стерильного рідкого носія, наприклад, фізіологічного розчину або стерильної апірогенної води безпосередньо перед застосуванням. Зі стерильних порошків, гранул і таблеток раніше описаного типу можна готувати імпровізовані розчини та суспензії для ін'єкцій. [0068] Лікарські склади для парентерального введення включають водні та неводні (масляні) стерильні розчини для ін'єкцій активних сполук, які можуть містити антиоксиданти, буфери, бактеріостатики і розчинені речовини, які надають складу ізотонічність з кров'ю передбачуваного реципієнта; а також водні та неводні стерильні суспензії, які можуть включати суспендуючі засоби і згущуючі агенти. Підходящі ліпофільні розчинники або носії включають жирні олії, такі як кунжутна олія, або синтетичні складні ефіри жирних кислот, такі як етилолеат, або тригліцериди, або ліпосоми. Водні суспензії для ін'єкцій можуть містити речовини, які підвищують в'язкість суспензії, такі як карбоксиметилцелюлоза натрію, сорбіт або декстран. У необов'язковому порядку суспензія може також містити підходящі стабілізатори або засоби, які підсилюють розчинність 2-((3-(4-ціанонафталін-1-іл)піридин-4-чл)тіо)-2-метилпропанової кислоти, що дозволяє домогтися більшої концентрації розчинів у препараті. [0069] Фармацевтичні препарати можуть також бути виготовлені у вигляді депонованих препаратів. Такі лікарські склади тривалої дії можна вводити імплантацією (наприклад, підшкірно або внутрішньом'язово) або за допомогою внутрішньом'язової ін'єкції. Так, наприклад, 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанову кислоту можна включати в лікарські склади з підходящими полімерними або гідрофобними матеріалами (наприклад, у вигляді емульсії в підходящій олії) або з іонообмінними смолами, або у вигляді важкорозчинних похідних, наприклад важкорозчинної солі. [0070] Композиції, призначені для буккального або сублінгвального введення, можуть мати форму таблеток, коржиків, пастилок або гелів, приготованих загальноприйнятим способом. Такі композиції можуть містити активний інгредієнт в ароматичній основі, як сахароза і гуміарабік або трагакант. [0071] Фармацевтичні препарати можуть бути також виготовлені у вигляді ректальних композицій, таких як супозиторії або утримуючі клізми, наприклад, з вмістом традиційних основ для супозиторіїв, таких як масло какао, поліетиленгліколь або інші гліцериди. [0072] Фармацевтичні препарати можна вводити топічні (місцево), тобто несистемним чином. Це включає зовнішнє накладення 2-((3-(4-ціанонафталін-1-чл)піридин-4-чл)тіо)-2метилпропанової кислоти на епідерміс чи на слизову оболонку порожнини рота (защічних), а також закапування у вухо, око і ніс, так щоб сполука незначно проникала в системний кровотік. На відміну від цього системне введення відноситься до перорального, внутрішньовенного, внутрішньочеревному і внутрішньом'язовому введенню. [0073] Фармацевтичні препарати, які підходять для топічного введення, включають рідкі або напіврідкі препарати, пристосовані для проникнення через шкіру до місця запалення, зокрема, це можуть бути гелі, рідкімазі, лосьйони, креми, мазі або пасти, а також краплі, які зручно 10 UA 114304 C2 5 10 15 20 25 30 35 40 45 50 55 60 вводити в око, вухо або ніс. В лікарських складах для топічного введення вміст активного інгредієнта може становити від 0,001 % до 10 % мас./мас., наприклад, від 1 % до 2 % загальної маси композиції. Масовий вміст активного інгредієнта в лікарському складі може доходити до 10 %, але переважно буде містити менше 5 %, більш переважно від 0,1 % до 1 загальної маси ліків. [0074] Для введення фармацевтичних препаратів за допомогою інгаляції зручно застосовувати інсуфлятор (порошковдувач), розпилювальні упаковки небулайзеру, що перебувають під тиском, або інші зручні засоби доставки аерозольних спреїв. Упаковки, що знаходяться під тиском, можуть містити відповідний пропеллент, такий як дихлордифторметан, трихлорфторметан, дихлортетрафторетан, діоксид вуглецю або інший відповідний газ. У разі застосування аерозолю, що знаходиться під тиском, можна використовувати дозатор, тобто клапан, що відмірює певну кількість препарату. В альтернативному варіанті для введення за допомогою інгаляції або інсуффляції (вдування) фармацевтичні препарати можуть мати форму сухої порошкової композиції, наприклад суміші подрібненої сухої сполуки з відповідною порошкової основою, такою як лактоза або крохмаль. Порошкоподібна композиція може бути представлена в стандартній дозованої формі, наприклад, в капсулах, картриджах, желатинових або блістерних упаковках, з яких можна вводити порошок за допомогою інгалятора або інсуффлятора. [0075] Слід розуміти, що, на додаток до інгредієнтів, детально представлених вище, 2-((3-(4ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанова кислота може включати інші агенти, загальноприйняті в даній області і які мають відношення до типу лікарського препарату, про який йде мова, наприклад, лікарські склади, призначені для перорального введення, можуть включати смакові/ароматизуючі агенти. Лікарські форми [0076] 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанову кислоту можна доставляти у везикулах, таких як ліпосоми. 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2метилпропанову кислоту також можна доставляти в організм у системі з контрольованим вивільненням, або систему контрольованого вивільнення можна розмістити в безпосередній близькості від терапевтичного агента. В одному з варіантів здійснення даного винаходу можна використати насос. [0077] Описані в даному документі фармацевтичні композиції також можуть містити активний інгредієнт у формі, придатній для перорального застосування, наприклад у вигляді таблеток, пастилок, коржів, водних або масляних суспензій, диспергуючих порошків або гранул, емульсій, твердих або м'яких капсул, сиропів або еліксирів. Композиції, призначені для перорального застосування, необов'язково виготовляють відповідно до відомого способу, причому такі композиції можуть містити один або більше агентів, обраних із групи, що складається з підсолоджувачів, смакових/ароматичних агентів, агентів, що фарбують, агентів, що консервують, і які включають у композиції для того, щоб створити фармацевтично вишукані препарати із привабливим смаком. Таблетки містять активний інгредієнт у суміші з нетоксичними фармацевтично прийнятними наповнювачами, які зручно застосовувати у виробництві таблеток. Такими наповнювачами можуть бути, наприклад, інертні розріджувачі, такі як карбонат кальцію, карбонат натрію, лактоза, фосфат кальцію або фосфат натрію, гранулюючі і дезинтегруючі агенти, такі як мікрокристалічна целюлоза, кроскармелоза натрію, кукурудзяний крохмаль або альгінова кислота, агенти, що зв'язують, наприклад, крохмаль, желатин, полівінілпіролідон або камедь акації та мастильні агенти, наприклад, стеарат магнію, стеаринова кислота або тальк. Таблетки можуть бути непокритими або покритими на основі відомих методик для маскування смаку ліків або затримання його розпаду та усмоктування в шлунково-кишковому тракті, тобто для забезпечення безперервної дії протягом тривалого часу. Наприклад, при необхідності може бути використаний такий водорозчинний матеріал, що маскує смак, як гідроксипропілметилцелюлоза або гідроксипропілцелюлоза, або такий матеріал, що продовжує дію ліків, як етилцелюлоза або ацетобутират целюлози. Лікарські форми для перорального застосування також можуть бути представлені у вигляді твердих желатинових капсул, у яких активний інгредієнт змішаний з інертним твердим розріджувачем, наприклад з карбонатом кальцію, фосфатом кальцію або каоліном, або у вигляді м'яких желатинових капсул, у яких активний інгредієнт змішаний з водорозчинним носієм, таким як поліетиленгліколь, або з масляним середовищем, наприклад, з арахісовим маслом, рідким парафіном або маслиновим олією. [0078] Водні суспензії містять активний матеріал у суміші з наповнювачами, що підходять для виготовлення водних суспензій. Такі наповнювачі являють собою суспендуючі агенти, наприклад карбоксиметилцелюлозу натрію, метилцелюлозу, гідроксипропілметилцелюлозу, 11 UA 114304 C2 5 10 15 20 25 30 35 40 45 50 55 60 альгінат натрію, полівінілпіролідон, трагакантову камедь та аравійську камедь, диспергуючі або змочувальні агенти можуть являти собою фосфатид, що зустрічається в природі, наприклад, лецитин, або продукти конденсації алкіленоксиду з жирними кислотами, наприклад, поліоксиетиленстеарат, або продукти конденсації етиленоксиду із довголанцюговими аліфатичними спиртами, наприклад, гептадекаетиленоксиетанол, або продукти конденсації етиленоксиду з неповними ефірами, отриманими з жирних кислот, і гекситу, наприклад, поліоксиетиленсорбітмоноолеат, або продукти конденсації етиленоксиду з неповними ефірами, отриманими з жирних кислот, і ангідридів гекситу, наприклад, поліетиленсорбітанмоноолеат. Водні суспензії можуть також містити один або більше консервантів, наприклад, етил- або nпропіл-р-гідроксибензоат, один або більше фарбуючих агентів, один або більше ароматизуючих агентів, а також один або більше підсолоджувачів, таких як сахароза, сахарин або аспартам. [0079] Підходящі фармацевтичні носії включають інертні розріджувачі або наповнювачі, воду та різні органічні розчинники. Якщо бажано, фармацевтичні композиції можуть включати додаткові інгредієнти, такі як смакові/ароматичні добавки, зв'язувальні речовини, наповнювачі та т.п. Так, у таблетки для перорального введення, що містять різні наповнювачі, наприклад, лимонну кислоту, можна також включати різні дезинтегруючі речовини, такі як крохмаль, альгінова кислота та деякі комплексні силікати, а також зв'язувальні агенти, такі як сахароза, желатин та акація. На додаток до цього, з метою таблетування часто виявляються застосовними змащувальні агенти, такі як стеарат магнію, лаурилсульфат натрію і тальк. Тверді композиції подібного типу також можна застосовувати в м'якій і твердій набивних желатинових капсулах. Отже, кращі матеріали включають лактозу або молочний цукор і поліетиленгліколі високої молекулярної маси. Якщо для перорального введення бажані водні суспензії або еліксири, то 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанову кислоту можна об'єднувати з різними підсолоджувачами або смаковими/ароматизуючими агентами, барвниками або пігментами, а також, якщо це бажано, з емульгуючими агентами або суспендуючими агентами разом з розріджувачами, такими як вода, етанол, пропіленгліколь, гліцерин, або їхні комбінаціями. [0080] Масляні суспензії можна одержати, суспендуючи активний інгредієнт у рослинній олії, наприклад, в арахісовій олії, маслиновій олії, кунжутній олії або кокосовій олії, або в мінеральній олії, такій як рідкий парафін. Масляні суспензії можуть містити агент, що згущує, наприклад бджолиний віск, твердий парафін або цетиловий спирт. Для надання пероральному препарату приємного смаку в нього можна додавати підсолоджувачі та смакові/ароматизуючі агенти. Такі композиції можна консервувати, додаючи в них антиоксидант, такий як бутильований гідроксианізол або альфа-токоферол. [0081] Диспергуючі порошки та гранули, що підходять для приготування водних суспензій при додаванні води, містять активний інгредієнт у суміші з диспергуючим або змочувальним агентом, суспендуючим агентом та одним або більше консервантом. Приклади підходящих диспергуючих або змочувальних агентів, а також суспендуючих агентів уже були наведені вище. У складі таких препаратів також можуть бути представлені додаткові наповнювачі, наприклад підсолоджувачі, смакові/ароматизуючі та фарбуючі агенти. [0082] Фармацевтичні композиції також можуть бути представлені у формі емульсій типу "олія у воді". Олійна фаза може бути представлена рослинною олією, наприклад, маслиновою олією, арахісовою олією, або мінеральною олією, наприклад, рідким парафіном або сумішшю цих олій. Підходящі емульгуючі агенти можуть являти собою фосфатиди, що зустрічаються в природі, наприклад соєвий лецитин, складні ефіри або неповні складні ефіри, отримані з жирних кислот та ангідридів гекситу, наприклад, сорбітанмоноолеат, а також продукти конденсації зазначених неповних ефірів з етиленоксидом, наприклад, поліоксиетиленсорбітанмоноолеат. Емульсії також можуть містити підсолоджувачі, смакові/ароматизуючі агенти, консерванти та антиоксиданти. [0083] Сиропи та еліксири можуть містити у своєму складі підсолоджувачі, наприклад гліцерин, пропіленгліколь, сорбіт або сахарозу. Такі препарати можуть також містити засіб, що зменшує роздратування, консервант, смакові/ароматизуючі агенти, фарбуючі агенти та антиоксидант. [0084] Фармацевтичні композиції можуть бути представлені у формі стерильного водяного розчину для ін'єкцій. До числа прийнятних носіїв і розчинників, які можна використати, відносяться вода, розчин Рінгера та ізотонічний розчин хлориду натрію. Стерильний препарат для ін'єкцій може також являти собою стерильну ін'єкційну мікроемульсію типу "олія у воді", активний інгредієнт якої розчинений у олійній фазі. Наприклад, активний інгредієнт спочатку може бути розчинений у суміші соєвої олії та лецитину. Потім олійний розчин вводять у суміш води та гліцерину та піддають обробці для отримання мікроемульсії. Ін'єкційні розчини або 12 UA 114304 C2 5 10 15 20 25 30 35 40 45 50 55 мікроемульсії можна вводити в кровотік індивіда за допомогою локальної болюсної ін'єкції. Альтернативно, може виявитися переважним введення розчину або мікроемульсії таким способом, що дозволяє підтримувати постійну циркулюючу концентрацію 2-((3-(4ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. Для того щоб забезпечити таку постійну концентрацію, можна використовувати пристрій для безперервної внутрішньовенної подачі ліків. Прикладом такого пристрою є внутрішньовенний насос Deltec CADD-PLUS™ моделі 5400. Фармацевтичні композиції можуть бути представлені у формі стерильної ін'єкційної водної або олійної суспензії для внутрішньом'язового та підшкірного введення. Таку суспензію можна виготовити згідно до відомих у даній області способів, застосовуючи підходящі диспергуючі або змочувальні агенти та суспендуючі агенти, які були згадані вище. Стерильний ін'єкційний препарат може також являти собою стерильний розчин або стерильну суспензію в нетоксичному розріджувачі або розчиннику, прийнятному для парентерального введення, наприклад, розчин в 1,3-бутандіолі. На додаток до цього, як розчинник або суспендуюче середовище звичайно використовують стерильні нелеткі олії. Для цієї мети можна використовувати будь-яку легку нелетку олію, включаючи синтетичні моно- або дигліцериди. На додаток до цього, застосування у виготовленні ін'єкційних препаратів знаходять жирні кислоти, такі як олеїнова кислота. [0085] Фармацевтичні композиції також можна вводити у формі супозиторіїв для ректального введення ліків. Такі композиції можна виготовляти, змішуючи активний інгредієнт із підходящим не подразнюючим наповнювачем, що перебуває у твердому стані при звичайній температурі навколишнього середовища, але переходить у рідкий стан після введення в пряму кишку, тобто розплавляється в прямій кишці та вивільняє активний компонент ліків. Такі матеріали включають олію какао, гліцеризований желатин, гідрогенізовані рослинні олії, суміші поліетиленгліколей різної молекулярної ваги, а також складні ефіри жирних кислот і поліетиленгліколю. [0086] Для топічного застосування можна використовувати креми, рідкі мазі, желе, розчини або суспензії й т.д., що містять 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанову кислоту. При використанні в даному документі термін "топічне застосування" може включати рідини для полоскання рота та горла. [0087] Фармацевтичні композиції можна вводити в інтраназальній формі за допомогою топічного застосування підходящих інтраназальних носіїв і пристроїв доставки або за допомогою трансдермальних способів, застосовуючи трансдермальні шкірні бляшки. При введенні ліків за допомогою трансдермальної системи доставки, їх дозування, зрозуміло, буде безперервним на відміну від перемежованого протягом всієї схеми введення лікарського засобу. [0088] Лікарські склади можуть бути зручним чином представлені в стандартній дозованій формі та можуть бути виготовлені кожним зі способів, добре відомих в області фармації. Всі способи включають стадію, протягом якої 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2метилпропанова кислота або її фармацевтично прийнятна сіль, складний ефір, проліки або сольват ("активний інгредієнт") вступає в асоціацію з носієм, що містить один або більше допоміжних інгредієнтів. Загалом, лікарські склади готують, рівномірно та близько вводячи активний інгредієнт в асоціацію зрідкими носіями або тонко здрібненими твердими носіями (або з тими й іншими), а потім при необхідності, надаючи продукту потрібну лікарську форму. Лікарські дозовані форми. [0089] Фармацевтична композиція може бути представлена, наприклад, у формі, придатній для перорального застосування, такій як таблетка, капсула, пігулка, порошок, лікарські склади з уповільненим вивільненням, розчин, суспензія, у формі парентерального введення, такій як стерильний розчин, суспензія або емульсія, у формі, придатній для топічного введення, такій як рідка мазь або крем, або у формі, придатній для ректального введення, такій як супозиторій. Фармацевтична композиція може бути представлена в стандартних дозованих формах, зручних для разового введення точних доз. Фармацевтична композиція може включати загальноприйнятий фармацевтичний носій або наповнювач, а також 2-((3-(4-ціанонафталін-1іл)піридин-4-іл)тіо)-2-метилпропанову кислоту, як активний інгредієнт. На додаток до цього, вона може включати інші лікарські або фармацевтичні агенти, носії, ад'юванти та т.д. [0090] Типові форми для парентерального введення включають розчини або суспензії 2-((3(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти в стерильних водних носіях, наприклад, у водних розчинах пропіленгліколю або декстрози. Такі лікарські форми при бажанні можна відповідним чином забуферизовати. Дози 13 UA 114304 C2 5 10 15 20 25 30 35 40 45 50 55 60 [0091] Кількість фармацевтичної композиції, що вводиться, насамперед, залежить від ссавця, що підлягає лікуванню. У тих випадках, коли фармацевтичну композицію вводять людині, щоденне дозування звичайно визначає лікуючий лікар, при цьому доза варіюється залежно від віку, статі, дієти, ваги, загального стану здоров'я індивіда, від його/її реакції на лікування, від важкості симптомів, від точних показань відносно лікування або від патологічного стану, що підлягає лікуванню, від часу введення, способу введення, розміщення композиції, швидкості виведення, комбінації ліків, а також залежно від експертного рішення лікуючого лікаря. До того ж, залежно від патологічного стану і його важкості може варіюватися спосіб введення. Переважно, щоб фармацевтична композиція була представлена в стандартній дозованій формі. У такій формі препарат підрозділений на стандартні дози, кожна з яких містить відповідну кількість активного компонента, наприклад, ефективну кількість для досягнення потрібного результату. Визначення правильної дози в конкретній ситуації знаходиться в компетенції кваліфікованого фахівця. Звичайне лікування починають із відносно невеликих доз, які менше оптимальної дози 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. Після цього дозу потроху збільшують доти, поки не буде досягнутий оптимальний ефект у даних обставинах. Для більшої зручності загальну добову дозу можна розділити і, якщо це бажано, вводити частинами протягом дня. Кількість і частота введення 2-((3-(4ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти, а також, якщо це застосовно, застосування інших терапевтичних засобів та/або способів лікування повинні регулюватися залежно від експертної оцінки лікуючого клініциста (лікаря) з урахуванням тих факторів, які були описані вище. Таким чином, кількість фармацевтичної композиції, що вводиться, може варіюватися в широких межах. [0092] Введення ліків може здійснюватися в кількості, що становить менше ніж близько 50 мг/кг маси тіла в день (що вводиться у вигляді однократної дози або розділених доз). Конкретна терапевтична доза може включати, наприклад, менше ніж близько 1000 мг 2-((3-(4ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти та переважно включає, наприклад, менше ніж близько 250 мг. Кількість 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2метилпропанової кислоти в стандартній дозі препарату може варіюватися або регулюватися від менше ніж близько 500 мг, переважно від менше ніж близько 100 мг, більш переважно від менше ніж близько 50 мг або від менше ніж 5 мг, залежно від певного застосування. У певних обставинах доза, що виходить за нижню границю вищевказаного діапазону, може виявитися більш ніж достатньою, тоді як в інших випадках можна без яких-небудь шкідливих побічних ефектів застосовувати набагато більші дози, наприклад, підрозділяючи їх на кілька менших доз для введення протягом усього дня. При комбінаторних варіантах застосування, у яких 2-((3-(4ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропановая кислота не є єдиним засобом лікування, може представитися можливість введення меншої кількості сполуки при збереженні терапевтичного або профілактичного ефекту. [0093] У деяких варіантах здійснення даного винаходу 2-((3-(4-ціанонафталін-1-іл)піридин-4іл)тіо)-2-метилпропанову кислоту вводять один раз на день. В інших варіантах здійснення даного винаходу 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанову кислоту вводять два рази на день. У деяких варіантах здійснення даного винаходу 2-((3-(4-ціанонафталін-1іл)піридин-4-іл)тіо)-2-метилпропанову кислоту вводять з їжею. В інших варіантах здійснення даного винаходу 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанову кислоту вводять без їжі. [0094] Терапевтичне дозування 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2метилпропанової кислоти описано в розділі "Способи зниження сироваткових рівнів сечової кислоти", а також для лікування будь-якого з описаних у даному документі захворювань можуть бути використані приклади. Комбіновані терапії [0095] 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанову кислоту або її фармацевтично прийнятну сіль, сольват, поліморф, складний ефір, таутомер або проліки можна застосовувати як єдиний засіб терапевтичного лікування або в комбінації з іншими ліками або способами терапії. [0096] Наприклад, терапевтичну ефективність можна підвищити за допомогою введення ад'юванту(тобто ад'ювант, сам по собі, може мати лише мінімальний терапевтичний ефект, але при його комбінуванні з іншим терапевтичним агентом загальна терапевтична користь для індивіда зростає). Або, тільки як приклад, користь для індивіда можна збільшити за допомогою введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти в сполученні з іншим терапевтичним засобом (також за певною схемою лікування), що також дає лікувальний ефект. Тільки як приклад, при лікуванні подагри посилення лікувального ефекту може відбутися 14 UA 114304 C2 5 10 15 20 25 30 35 40 в результаті додаткового призначення індивідові іншого терапевтичного засобу проти подагри. Або, додаткове лікування або лікування можуть включати, але не обмежуючись ними, фізіотерапію, психотерапію, променеву терапію, накладення компресів на хвору область, відпочинок, зміну дієти та т.д. Незалежно від захворювання, розладу або патологічного стану, що підлягає лікуванню, загальний корисний ефект для індивіда може являти собою адитивний ефект двох видів терапії або терапевтичних засобів, або може являти собою синергічний корисний ефект. [0097] У тих випадках, коли 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанову кислоту вводять у комбінації з іншими терапевтичними засобами, немає необхідності вводити 2((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанову кислоту в одній фармацевтичній композиції з іншими терапевтичними засобами, крім того, можливо, що у зв'язку з різними фізичними та хімічними характеристиками, їх варто вводити різними способами. Наприклад, 2((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанову кислоту можна вводити перорально для створення та підтримки її певного рівня в крові, тоді як інший терапевтичний агент можна вводити внутрішньовенно. Так, 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2метилпропанову кислоту можна вводити паралельно (наприклад, одночасно, власне кажучи одночасно або в рамках єдиного протоколу лікування), послідовно або дозуючи роздільно з іншими терапевтичними засобами. Первісне введення можна здійснювати відповідно до затверджених протоколів, відомими в даній області знань, а потім, ґрунтуючись на ефектах, що спостерігаються, компетентний клініцист може модифікувати дози, способи введення та час введення ліків. [0098] Індивідуальний вибір сполуки та іншого терапевтичного агента буде залежати від діагнозу, встановленого лікарем, від його експертної оцінки загального стану здоров'я індивіда та від відповідного протоколу лікування. У деяких варіантах здійснення даного винаходу додатковий засіб являє собою інгібітор URAT 1, інгібітор ксантиноксидази, ксантиндегідрогенази, інгібітор ксантин-оксидоредуктази, інгібітор пуринової нуклеозидфосфорилази (PNP), інгібітор переносника сечової кислоти, інгібітор переносника глюкози (GLUT), інгібітор GLUT-9, переносник розчинених речовин сімейства 2, інгібітор члена 9 (SLC2A9), інгібітор переносника органічних аніонів (ОАТ), інгібітор OAT-4 або їхньої комбінації. У певних умовах URAT 1 є іонообмінником, що опосередковує транспортування урату. У певних умовах URAT 1 опосередковує транспортування уратів у проксимальних канальцях. У певних умовах URAT I обмінює урат у проксимальному канальці на лактат і нікотинат. У певних умовах ксантиноксидаза окисляє гіпоксантин до ксантину та далі до сечової кислоти. У певних умовах + + ксантиндегідрогеназа каталізує перетворення ксантину, NAD та H2O в урат, NADH та H . У деяких варіантах здійснення даного винаходу додатковий агент являє собою 2-((5-бром-4-(4циклопропіл-1-нафталінил)-4H-1,2,4-триазол-3-іл)тіо)оцтову кислоту, алопуринол, фебуксостат (2-(3-ціано-4-ізобутоксифеніл)-4-метил-1,3-тіазол-5-карбонову кислоту), FYX-051 (4-(5-піридин4-іл-1Н-[1,2,4]триазол-3-іл)піридин-2-карбонітрил), пробенецид, сульфінпіразон, бензбромарон, ацетамінофен, стероїди, нестероїдні протизапальні препарати (NSAID), адренокортикотропний гормон (АСТН), колхіцин, глюкокортикоїд, андроген, інгібітор СОХ-2, агоніст PPAR, напроксен, севеламер, сибутамін, троглитазон, проглитазон, інший агент, що знижує рівень сечової кислоти, лосартан, фіброєву кислоту, бензиодарон, саліцилат, амлодипін, вітамін С або їхні комбінації. N NH NC N 45 50 N N FYX-051 Захворювання [0099] У даному документі описані способи лікування захворювання в індивіда, що страждає від зазначених захворювань, які полягають у введенні зазначеному індивідові ефективної кількості 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі, сольвату, поліморфу, складного ефіру, таутомеру або проліків. [00100] У даному документі також описані способи попередження або затримки початку захворювання в індивіда, що має підвищений ризик розвитку зазначеного захворювання, причому дані способи полягають у введенні зазначеному індивідові ефективної для попередження або затримки початку зазначеного захворювання кількості композиції, що містить 15 UA 114304 C2 5 10 15 20 25 30 35 40 45 50 55 60 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанову кислоту або її фармацевтично прийнятну сіль, сольват, поліморф, складний ефір, таутомер або проліки. [00101] Далі в даному документі описані способи профілактики або лікування будь-якого захворювання або розладу, при якому певну роль грає аномальний рівень сечової кислоти, включаючи, але не обмежуючись ними, гіперурикемію, подагру, подагричний артрит, запальний артрит, захворювання нирок, нефролітіаз (камені в нирках), запалення суглоба, відкладення кристалів урату в суглобах, уролітіаз (каменеутворення в сечовому тракті), відкладення кристалів урату в нирковій паренхімі, синдром Леша-Найяна, синдром Келлі-Сігміллера, загострення подагри, вузлову подагру, ниркову недостатність або їхні комбінації в людини або іншого ссавця. Розкриті в даному документі способи поширюються на застосування 2-((3-(4ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропановойї кислоти у виробництві медикаменту для лікування таких захворювань або розладів. Далі розкриті в даному документі способи поширюються на введення людині ефективної кількості 2-((3-(4-ціанонафталін-1-іл)піридин-4іл)тіо)-2-метилпропанової кислоти для лікування будь-якого такого захворювання або розладу. [00102] Індивіди, які можна лікувати 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2метилпропановою кислотою або її фармацевтично прийнятною сіллю, складним ефіром, проліками, сольватом, гідратом або їхніми похідними, відповідно до способів за даним винаходом, включають, наприклад, індивідів, яким був поставлений діагноз подагри, подагричного артриту, запального артриту, захворювання нирок, нефролітіазу (каменів у нирках), запалення суглоба, відкладення кристалів урату в суглобах, уролітіазу (каменеутворення в сечовому тракті), відкладення кристалів урату в нирковій паренхімі, синдрому Леша-Найяна, синдрому Келлі-Сігміллера, загострення подагри, вузлової подагри, брунькової недостатності або їхніх комбінацій. [00103] У деяких варіантах здійснення даного винаходу індивідові з аномальним рівнем сечової кислоти вводять кількість 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2метилпропанової кислоти, достатню для модуляції аномального рівня сечової кислоти (наприклад, до прийнятного з медичної точки зору рівня). У деяких варіантах здійснення даного винаходу індивід, що отримує лікування 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2метилпропановою кислотою, проявляє аномальні рівні сечової кислоти, при цьому рівень сечової кислоти в крові перевищує припустимий з медичної точки зору діапазон (тобто має місце гіперурикемія). У деяких варіантах здійснення даного винаходу індивід, що отримує лікування 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропановою кислотою, проявляє аномальні рівні сечової кислоти, при цьому рівень сечової кислоти в крові перевищує 360 мкмоль/л (6 мг/дл) для осіб жіночої статі або 400 мкмоль/л (6,8 мг/дл) для осіб чоловічої статі. У деяких варіантах здійснення даного винаходу індивід, що отримує лікування 2-((3-(4ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропановою кислотою, проявляє аномальні рівні сечової кислоти, при цьому рівень сечової кислоти в сечі перевищує припустимий з медичної точки зору діапазон (тобто має місце гіперурикозурія). У деяких варіантах здійснення даного винаходу індивід, що отримує лікування 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2метилпропановою кислотою, проявляє аномальні рівні сечової кислоти, при цьому рівень сечової кислоти в сечі перевищує 800 мг/день (для осіб чоловічої статі) і 750 мг/день (для осіб жіночої статі). [00104] У деяких варіантах здійснення даного винаходу індивід, що отримує лікування 2-((3(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропановою кислотою, (1) проявляє аномальні рівні сечової кислоти та (2) страждає від серцево-судинного захворювання. У деяких варіантах здійснення даного винаходу індивід, що отримує лікування 2-((3-(4-ціанонафталін-1-іл)піридин4-іл)тіо)-2-метилпропановою кислотою, (1) проявляє аномальні рівні сечової кислоти та (2) страждає від аневризми, стенокардії, атеросклерозу, інсульту, цереброваскулярного захворювання, застійної серцевої недостатністі, хвороби коронарних артерій та/або інфаркту міокарда. У деяких варіантах здійснення даного винаходу індивід, що отримує лікування 2-((3(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропановою кислотою, (1) проявляє аномальні рівні сечової кислоти, і (2) проявляє (а) рівні С-реактивного білка (CRP) вище ніж близько 3,0 мг/л, (b) рівні гомоцистеїну вище ніж близько 15,9 ммоль/л, (с) рівні LDL вище ніж близько 160 мг/дл; (d) рівні HDL нижче чим близько 40 мг/дл й/або (е) рівні креатиніні в сироватці вище чим близько 1,5 мг/дл. [00105] У деяких варіантах здійснення даного винаходу індивід, що отримує лікування 2-((3(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропановою кислотою, (1) проявляє аномальні рівні сечової кислоти, і (2) страждає від діабету. У деяких варіантах здійснення даного винаходу індивід, що отримує лікування 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропановою кислотою, (1) проявляє аномальні рівні сечової кислоти, і (2) страждає від діабету типу I. У 16 UA 114304 C2 5 10 15 20 25 30 35 40 45 50 55 деяких варіантах здійснення даного винаходу індивід, що отримує лікування 2-((3-(4ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропановою кислотою, (1) проявляє аномальні рівні сечової кислоти, і (2) страждає від діабету типу II. У деяких варіантах здійснення даного винаходу індивід, що отримує лікування 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2метилпропановою кислотою, (1) проявляє аномальні рівні сечової кислоти, і (2) страждає втратою бета-кліток острівців Лангерганса в підшлунковій залозі. У деяких варіантах здійснення даного винаходу індивід, що отримує лікування 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2метилпропановою кислотою, (1) проявляє аномальні рівні сечової кислоти, і (2) страждає від інсулінорезистентності та/або зниженої чутливості до інсуліну. У деяких варіантах здійснення даного винаходу індивід, що отримує лікування 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2метилпропановою кислотою, (1) проявляє аномальні рівні сечової кислоти, і (2) проявляє (а) рівень глюкози в плазмі натще ≥ 126 мг/дл, (b) рівень глюкози в плазмі ≥ 200 мг/дл через дві години після початку тесту на толерантність до глюкози та/або (с) симптоми гіперглікемії та безсистемного рівня глюкози в плазмі ≥ 200 мг/дл (11,1 ммоль/л). [00106] У деяких варіантах здійснення даного винаходу індивід, що отримує лікування 2-((3(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропановою кислотою, (1) проявляє аномальні рівні сечової кислоти, і (2) страждає від метаболічного синдрому. У деяких варіантах здійснення даного винаходу, індивід, що отримує лікування 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2метилпропановою кислотою, (1) проявляє аномальні рівні сечової кислоти, і (2) страждає від (а) цукрового діабету, порушення толерантності до глюкози, порушення рівня глюкози натще та/або інсулінорезистентноісті, (b) як мінімум від двох з наступних порушень: (i) артеріальний тиск: ≥ 140/90 мм рт. ст., (ii) дисліпідемія: тригліцериди (TG): ≥ 1,695 ммоль/л і холестеринова фракція ліпопротеїдів високої щільності (HDL-C) ≥ 0,9 ммоль/л (чоловіки), ≥ 1,0 ммоль/л (жінки), (iii) центральне ожиріння: співвідношення талія:стегно більше 0,90 (чоловіки), більше 0,85 (жінки) та/або індекс маси тіла більше 30 кг/м, а також (iv) мікроальбумінурія: швидкість виведення альбуміну із сечею ≥ 20 мг/хв. або співвідношення альбумін: креатинін ≥ 30 мг/г. У деяких варіантах здійснення даного винаходу індивід, що отримує лікування 2-((3-(4-ціанонафталін-1іл)піридин-4-іл)тіо)-2-метилпропановою кислотою, (1) проявляє аномальні рівні сечової кислоти, і (2) страждає від (а) інсулінорезистентності (тобто вершина значення інсуліну натще 25 % у осіб, що не страждають діабетом) (b) як мінімум від двох з наступних порушень: (i) центральне ожиріння: окружність талії ≥ 94 см (чоловіки), ≥ 80 см (жінки), (ii) дисліпідемія: TG ≥ 2,0 ммоль/л та/або HDL-C ≥ 1,0 ммоль/л або лікування з приводу дисліпідемії; (iii) гіпертензія: артеріальний тиск ≥ 140/90 мм рт. ст. або прийом гіпотензивних ліків, (iv) рівень глюкози в плазмі натще ≥ 6,1 ммоль/л. У деяких варіантах здійснення даного винаходу індивід, що отримує лікування 2-((3-(4ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропановою кислотою, (1) проявляє аномальні рівні сечової кислоти, і (2) проявляє як мінімум три з наступних порушень: (а) збільшена окружність талії: ≥ 40 дюймів (чоловіки) і 35 дюймів (жінки), (b) підвищений рівень тригліцеридів: більше 150 мг/дл, (с) знижений рівень HDL: менше 40 мг/дл (чоловіки) і менше 50 мг/дл (жінки), (d) підвищений артеріальний тиск: ≥ 130/85 мм рт. ст. або прийом гіпотензивних ліків, (е) підвищений рівень глюкози натще: ≥ 100 мг/дл (5,6 ммоль/л) або прийом ліків з приводу гіперглікемії. [00107] У деяких варіантах здійснення даного винаходу індивід, що отримує лікування 2-((3(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропановою кислотою, (1) проявляє аномальні рівні сечової кислоти, і (2) страждає від захворюванням нирок або ниркової недостатності. У деяких варіантах здійснення даного винаходу індивід, що отримує лікування розкритими в даному документі сполуками, (1) проявляє аномальний рівень сечової кислоти та (2) страждає від олігурії (зменшене вироблення сечі). У деяких варіантах здійснення даного винаходу індивід, що отримує лікування розкритими в даному документі сполуками, (1) проявляє аномальний рівень сечової кислоти та (2) виробляє менше 400 мл сечі в день (дорослі), виробляє менше 0,5 мл/кг/год. сечі (діти) або виробляє менш 1 мл/кг/год. сечі (дитини). Сечова кислота [00108] У певних умовах пурини (аденін, гуанін), що походять із кругообігу їжі та тканин (клітинні нуклеотиди, що піддаються безперервному кругообігу), катаболізуються в організмі людини до кінцевого продукту їхнього окислювання, сечової кислоти. У певних умовах гуанін окисляються до ксантину, який, у свою чергу, далі окисляється до сечової кислоти під впливом ксантиноксидази, а аденозин перетворюється в інозин, що далі окисляється до гіпоксантину. У певних умовах ксантиноксидаза окислює гіпоксантин до ксантину й далі до сечової кислоти. У певних умовах, як частина оберненого процесу, фермент гіпоксантингуанінфосфорибозилтрансфераза (HGPRT/ГГФРТ) утилізує гуанін і гіпоксантин. 17 UA 114304 C2 5 10 15 20 25 30 35 40 [00110] У певних умовах кето-форма сечової кислоти перебуває в рівновазі з енольною формою, що втрачає протон при фізіологічному рівні рН, утворюючи урат. У певних умовах (наприклад, при параметрах сироватки (рН 7,40, 37 °C)) близько 98 % сечової кислоти іонізується в сіль (мононатрію урат). У певних умовах урат являє собою сильний відновлювальний агент, і потужний антиоксидант. У людини близько половини антиоксидантної здатності плазми припадає на сечову кислоту. [00112] У певних умовах більша частина сечової кислоти розчиняється в крові та проходить у нирки, де вона екскретується за допомогою гломерулярної фільтрації та тубулярної секреції. У певних умовах значна частина сечової кислоти реабсорбується нирковими канальцями. Одна зі специфічних особливостей транспортної системи сечової кислоти полягає в тому, що, хоча результуючою активністю тубулярної функції є реабсорбція сечової кислоти, молекула як секретується, так і реабсорбується під час проходження через нефрон. У певних умовах у сегментах S1 та S3 проксимальних канальців переважає реабсорбція, а в сегменті S2 переважає секреція. У певних умовах двохнаправлений транспорт призводить до того, що ліки, які придушують транспортування сечової кислоти, скоріше знижують, чим підвищують екскрецію сечової кислоти, що зменшує їхню терапевтичну корисність. У певних умовах нормальний рівень сечової кислоти в дорослої людини (5,1+/-0,93 мг/дл) близький до меж розчинності урату (~7 мг/дл при 37 °C), що створює тендітний фізіологічний баланс урату. У певних умовах межа норми сечової кислоти для жінок становить близько 1 мг/дл, що трохи нижче відповідного показника для чоловіків. Гіперурикемія [00113] У певних умовах гіперурикемія характеризується перевищенням нормального рівня сечової кислоти в крові, який стабільно зберігається протягом тривалого періоду часу. У певних умовах підвищений рівень урату в крові може являти собою результат посиленого вироблення сечової кислоти (~10-20 %) та/або її зниженої екскреції нирками(~80-90 %). У певних умовах причини гіперурикемії можуть включати: Ожиріння/надлишкову вагу; Надмірне вживання алкоголю; Надлишкове споживання пуринів з їжею (такі продукти, як молюски, ікра, гребінці, сочевиця, боби та червоне м'ясо, особливо лівер - мозок, нирки, рубець, печінка). Деякі ліки, включаючи аспірин у малих дозах, діуретики, ніацин, цилоспорин, піразинамід, етамбутол, деякі ліки, що знижують високий артеріальний тиск і деякі хіміо-терапевтичні засоби проти раку, імунодепресанти та цитотоксичний агенти; Специфічні хворобливі стани, особливо пов'язані з високою швидкістю відновлення клітинної популяції (такі як злоякісні пухлини, лейкози, лімфома або псоріаз), а також хвороби з підвищеним артеріальним тиском, порушення, пов'язані з гемоглобіном, гемолітична анемія, серповидно-клітинна анемія, різні нефропатії, мієлопроліферативні та лімфопроліферативні 18 UA 114304 C2 5 10 15 20 25 30 35 40 45 50 55 60 розлади, гіперпаратиреоз, ниркове захворювання, патологічні стани, пов'язані з інсулінорезистентністю, цукровий діабет, реципієнти при трансплантації та, можливо, захворювання серця; Спадкоємні дефекти ферментів; Порушена ниркова функція (наприклад, посилений кругообіг АІФ, знижена гломерулярна фільтрація урату); Контакт зі свинцем (сатурнізм або "свинцева подагра"). [00114] У деяких випадках гіперурикемія може бути безсимтомною, незважаючи на її зв'язок з наступними патологічними станами: подагра; подагричний артрит; сечокислі камені в сечовому тракті (уролітіаз); відкладення сечової кислоти в м'яких тканинах (подагричні вузли); відкладення сечової кислоти в нирках (сечокисла нефропатія); порушена ниркова функція, можливо, яка веде до гострої та хронічної ниркової недостатності. Подагра. Поширення [00115] Частота подагри в останні два десятиліття зростала, і в Сполучених Штатах Америки цією хворобою уражене до 2,7 % населення у віці 20 років і більше, що в цілому становить більше 5,1 мільйона дорослих американців. Подагрою частіше страждають чоловіка, ніж жінки (3,8 % або 3,4 мільйони чоловіків та 1,6 % або 1,7 мільйони жінок), пік захворюваності припадає на чоловіків, що досягли 40- і 50-літнього віку (хоча напади подагри можуть спостерігатися після статевого дозрівання, коли відбувається підвищення рівня сечової кислоти). У період з 1990 по 1999 роки спостерігалося збільшення поширення подагри з 2,9 до 5,2 на 1000 чоловік, причому найбільший ріст захворюваності прийшовся на ту частину населення, що досягла 65-літнього віку. У жінок напади подагри частіше спостерігаються в постклімактичному віці. У деяких випадках подагра є однією з найпоширеніших форм артриту, і на її частку припадає близько 5 % всіх випадків артриту. У певних умовах в 10-18 % осіб, що страждають від подагри, спостерігаються ниркова недостатність та уролітіаз, які є частими причинами захворюваності та смертності, пов'язаними із цим захворюванням. Основні причини [00116] У більшості випадків подагра пов'язана з гіперурикемією. У деяких випадках в індивідів, що страждають від подагри, з організму виводиться близько на 40 % менше сечової кислоти, ніж в індивідів без подагри при будь-якій даній концентрації урату в плазмі. У деяких випадках рівень урату збільшується доти, поки не буде досягнута точка насичення. У деяких випадках при досягненні точки насичення відбувається випадання кристалічного осаду урату. У деяких випадках кристали твердіють, утворюючи в суглобах і шкірі кристалічні відкладення (подагричні вузлики або тофуси), які викликають запалення суглобів (артрит). У деяких випадках відкладення утворюються в суглобній рідині (синовіальній рідини) та/або вистиланні суглобів (синовіальному вистиланні). Найбільш частими областями таких відкладень є великий палець ноги, стопа, щиколотки та кисті рук (відносно рідкі області відкладень включають вуха та очі). У деяких випадках шкіра навколо ураженого суглоба стає червоною та блискучою, при цьому уражена ділянка стає більш чутливою і болісною при дотику. У деяких випадках частота нападів подагри збільшується. У деяких випадках при відсутності лікування гострі напади подагри призводять до стійкого пошкодження суглоба та наступної інвалідності. У деяких випадках тканинні відкладення урату призводять до гострого запального артриту, хронічного артриту, відкладенню кристалів урату в нирковій паренхімі та уролітіазу. У деяких випадках частота подагричного артриту зростає в 5 разів у осіб з рівнем урату в сироватці від 7 до 8,9 мг/дл і до 50 разів у осіб з рівнем, що становить більше 9 мг/дл (530 мкмоль/л). У деяких випадках в осіб з подагрою розвивається ниркова недостатність і кінцева стадія ниркового захворювання (тобто "подагрична нефропатія"). У деяких випадках подагрична нефропатія характеризується хронічною інтерстиціальною нефропатією, якій сприяє медулярне відкладення мононатрію урату. [00117] У деяких випадках подагра включає хворобливі напади гострого моноартикулярного запального артриту, відкладення кристалів урату в суглобах, відкладення кристалів урату в нирковій паренхімі, уролітіаз (утворення каменів у сечовому тракті) і нефролітіаз (утворення каменів у нирках). У деяких випадках спостерігається вторинна подагра у хворих, що страждають раком, особливо лейкозом, і в осіб з іншими захворюваннями крові (наприклад, поліцитемією, мієлоідною метаплазією і т.д.) 19 UA 114304 C2 5 10 15 20 25 30 35 40 45 50 Симптоми [00118] У деяких випадках напади подагри розвиваються дуже швидко, причому перший напад часто виникає вночі. У деяких випадках симптоми включають раптовий важкий суглобний біль і вкрай виражену больову чутливість в області враженого суглоба, набрякання суглоба та блискучу червону або пурпурну шкіру навколо суглоба. У деяких випадках напади виникають нечасто, тривають по 5-10 днів, причому в проміжках між нападами ніяких симптомів захворювання не спостерігається. У деяких випадках напади стають більш частими та можуть тривати довше, особливо, якщо ніяких заходів з приводу захворювання не приймається. У деяких випадках напади хвороби ушкоджують уражені суглоби, приводячи до їхньої ригідності, набряканню, обмеженню рухів та/або постійного легкого або помірного болю. Лікування [00119] У деяких випадках подагру лікують, знижуючи вироблення сечової кислоти. У деяких випадках подагру лікують, збільшуючи екскрецію сечової кислоти. У деяких випадках для лікування подагри застосовують інгібітори URAT 1, ксантиноксидази, ксантиндегідрогенази, ксантиноксидоредуктази, інгібітор нуклеозидфосфорилази (PNP), інгібітор переносника сечової кислоти, інгібітор переносника глюкози (GLUT), інгібітор GLUT-9, переносник розчинених речовин сімейства 2 (транспортер полегшеної дифузії глюкози), інгібітор білка member 9 (SLC2A9), інгібітор переносника органічних аніонів (ОАТ), інгібітор OAT-4 або їхні комбінації. Загалом, цілями лікування подагри є: i) зменшення болю, набрякання суглобів і тривалості гострого нападу, а також ii) попередження подальших нападів та ушкоджень суглобів. У деяких випадках напади подагри успішно лікують, застосовуючи комбінацію різних способів лікування. У деяких випадках подагра являє собою одну з форм артриту, що найбільше піддаються лікуванню. [00120] i) Лікування нападу подагри. У деяких випадках біль і набрякання, пов'язані з гострим нападом подагри, можна придушувати такими ліками, як ацетамінофен, стероїди, нестероїдні протизапальні препарати (NSAID), адренокортикостероїдний гормон (АКТГ) або колхіцин. У деяких випадках правильне медикаментозне лікування придушує подагру протягом 12-24 год., і через кілька днів після цього лікування можна припинити. У деяких випадках медикаментозне лікування застосовують у сполученні зі спокоєм, рясним споживанням рідини, крижаними обгортаннями, підняттям та/або захистом ураженої області (областей). У деяких випадках вищевказані прийоми лікування не попереджають наступних нападів і не впливають на причини порушень метаболізму сечової кислоти. [00121] ii) Попередження подальших нападів. У деяких випадках з метою попередження подальших нападів подагри намагаються знизити рівень сечової кислоти в сироватці до таких значень, які менше рівня насичення. У деяких випадках це досягається за допомогою зниження вироблення сечової кислоти (наприклад, при призначенні алопуринолу) або за допомогою збільшення екскреції сечової кислоти при призначенні урикозних засобів (наприклад, пробенециду, сульфінпіразону, бензбромарону). [00122] У деяких випадках алопуринол придушує утворення сечової кислоти, призводячи до зниження її рівня як у сироватці, так й у сечі, причому таке лікування стає повністю ефективним через 2-3 місяці. [00123] У певних умовах алопуринол є структурним аналогом гіпоксантину (відрізняючись тільки переміщенням атомів вуглецю та азоту в положення 7 й 8), що придушує дію ксантиноксидази, ферменту, відповідального за перетворення гіпоксантину в ксантин, а ксантин в сечову кислоту. У певних умовах він метаболізується, перетворюючись у відповідний аналог ксантину, алоксантин (оксипуринол), що також є інгібітором ксантиноксидази. У деяких випадках алоксантин, хоча і є сильнішим інгібітором ксантиноксидази, менш прийнятний фармацевтично через його низьку біологічну доступність при пероральному введенні. Повідомлялося про те, що в деяких випадках застосування алопуринолу супроводжувалося летальними реакціями внаслідок гіперчутливості, придушенні кісткового мозку, гепатиту та васкулиту. У деяких випадках частота побічних ефектів може досягати в цілому 20 % від загального числа осіб, що 20 UA 114304 C2 5 10 15 20 25 30 35 40 45 50 55 60 одержують лікування цими ліками. За останні два десятки років, що пройшли після появи алопуринолу, у лікуванні порушень метаболізму сечової кислоти істотного прогресу досягнуто не було. [00124] У деяких випадках екскрецію сечової кислоти підсилюють урикозуричні агенти (наприклад, пробенецид, сульфінпіразон і бензбромарон). У деяких випадках пробенецид викликає збільшення секреції сечової кислоти нирковими канальцями, а при тривалому застосуванні мобілізує запаси урату в організмі. У деяких випадках в 25-50 % осіб, що одержували лікування пробенецидом, не вдавалося досягти зниження рівня сечової кислоти до значень, що становлять менше 6 мг/дл. У деяких випадках нечутливість до пробенециду обумовлена непереносимістю ліків, що супроводжується прийомом саліцилатів і нирковою недостатністю. У деяких випадках непереносимість пробенециду розвивається в третини осіб, що одержують таке лікування. У деяких випадках введення урикозуричних засобів також призводить до розвитку каменів у сечовому тракті, шлунково-кишковій непрохідності, жовтяниці та анемії. Сатурнізм або "свинцева подагра" [00125] У деяких випадках надмірний контакт зі свинцем (свинцеве отруєння або сатурнізм) призводить до "свинцевої подагри", тобто гіперурикемії, індукованої свинцем внаслідок придушення свинцем тубулярного транспорту урату, що призводить до зниження ниркової екскреції сечової кислоти. У певних умовах подагра розвивається більш ніж в 50 % осіб зі свинцевою нефропатією. У ряді випадків гострі напади свинцевої подагри частіше зачіпають колінний суглоб, ніж великий палець ноги. У ряді випадків ниркове захворювання спостерігається частіше і протікає важче при свинцевій подагрі, ніж при первинній подагрі. У певних умовах лікування полягає у виключенні подальшого контакту індивіда зі свинцем, у застосуванні хелатоутворюючих агентів для виведення свинцю, а також у придушенні гострого подагричного артриту та гіперурикемії. У ряді випадків свинцева подагра характеризується менш частими нападами, ніж первинна подагра. У деяких випадках подагра, пов'язана зі свинцем, уражає жінок передклімактеричного віку, тобто ту частину населення, у якої подагра, не пов'язана зі свинцем, зустрічається відносно рідко. Синдром Леша-Найяна [00126] У деяких випадках синдром Леша-Найяна (LNS або синдром Найяна) вражає близько одного з 100000 живонароджених дітей. У деяких випадках причиною LNS є нестача ферменту гіпоксантин-гуанінфосфорибозилтрансферази (HGPRT/ГГФРТ). У деяких випадках LNS являє собою Х-зчеплене рецесивне захворювання. У деяких випадках LNS представлений у немовлят чоловічої статі вже при народженні. У деяких випадках це захворювання призводить до важкої подагри, поганої роботі м'язів і розумової відсталості середнього ступеня, які проявляються на першому році життя. У деяких випадках це захворювання також призводить до аутоагресивної поведінки, тобто нанесенню пошкоджень самому собі (наприклад, прикусу вустів і пальців, до частих ударів головою), що починається на другому році життя. У ряді випадків захворювання також призводить до набрякання суглобів подагричного типу та важких ускладнень у нирках. У деяких випадках захворювання супроводжується неврологічними симптомами, які включають гримаси обличчя, мимовільні рухи (атетоз) і повторювані рухи рук і ніг, схожі на прояви хвороби Гентингтона. Прогноз для хворих з LNS поганий. Як правило, очікувана тривалість життя у хворих з LNS, що не лікуються, становить менше 5 років. У певних випадках очікувана тривалість життя хворих з LNS при лікуванні становить близько 40 років. Гіперурикемія та інші захворювання [00127] У деяких випадках гіперурикемія спостерігається в осіб із серцево-судинним захворюванням (CVD) та/або нирковим захворюванням. У деяких випадках гіперурикемія спостерігається в осіб зі схильністю до гіпертонії, гіпертонією, підвищеною проксимальною реабсорбцією натрію, мікроальбумінурією, протеїнурією, хворобою нирок, ожирінням, гіпертригліцеридемією, низьким рівнем холестеринової фракції ліпопротеїдів високої щільності, гіперінсулінемією, гіперлептинемією, гіпоадипонектинемією, хворобою периферичних, сонних і коронарних артерій, атеросклерозом, застійною серцевою недостатністю, інсультом, синдромом пухлинного лізису, ендотеліальною дисфункцією, окисним стресом, підвищеним рівнем реніну, підвищеним рівнем ендотеліну та/або підвищеним рівнем С-реактивного білка. У деяких випадках гіперурикемія спостерігається в осіб з ожирінням (наприклад, центральним ожирінням), високим артеріальним тиском, гіперліпідемією та/або порушенням рівня глюкози натще. У деяких випадках гіперурикемія спостерігається в осіб з метаболічним синдромом. У деяких випадках подагричний артрит вказує на підвищений ризик гострого інфаркту міокарда. У деяких варіантах здійснення даного винаходу введення 2-((3-(4-ціанонафталін-1-іл)піридин-4іл)тіо)-2-метилпропанової кислоти індивідові застосовують для зниження ймовірності клінічних 21 UA 114304 C2 5 10 15 20 25 30 35 40 45 50 55 60 проявів захворювання або патологічного стану, пов'язаного з гіперурикемією, включаючи, але не обмежуючись ними, схильність до гіпертонії, гіпертонію, підвищену проксимальну реабсорбцію натрію, мікроальбумінурію, протеїнурію, хворобу нирок, ожиріння, гіпертригліцеридемію, низький рівень холестеринової фракції ліпопротеїдів високої щільності, гіперінсулінемію, гіперлептинемію, гіпоадипонектинемію, хворобу периферичних, сонних і коронарних артерій, атеросклероз, застійну серцеву недостатність, інсульт, синдром пухлинного лізису, ендотеліальну дисфункцію, окисний стрес, підвищений рівень реніну, підвищений рівень ендотеліну та/або підвищений рівень С-реактивного білка. [00128] Один варіант здійснення даного винаходу відноситься до способу лікування або профілактики патологічного стану, що характеризується анормальними рівнями сечової кислоти в тканині або органі в індивіда, що містить введення індивідові ефективної кількості 2-((3-(4ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. Інший варіант здійснення даного винаходу відноситься до способу, де патологічний стан являє собою подагру, рецидив подагри, подагричний артрит, гіперурикемію, гіпертонію, серцево-судинне захворювання, ішемічну хворобу серця, синдром Леша-Найяна, синдром Келлі-Сігміллера, хворобу нирок, камені в нирках, ниркову недостатність, запалення суглобів, артрит, сечокам'яну хворобу, свинцеве отруєння, гіперпаратиреоз, псоріаз, саркоїдоз, недостатність гіпоксантин-гуанінфосфорибозилтрансферази (HPRT) або їхню комбінацію. Інший варіант здійснення даного винаходу відноситься до способу, де патологічний стан являє собою подагру. [00129] Ще один варіант здійснення даного винаходу відноситься до способу, що додатково містить введення другого засобу, ефективного для лікування подагри. Інший варіант здійснення даного винаходу відноситься до способу, у якому другий засіб являє собою інгібітор URAT 1, інгібітор ксантиноксидази, ксантин-дегідрогенази, інгібітор ксантин-оксидоредуктази або їхньої комбінації. Інший варіант здійснення даного винаходу відноситься до способу, у якому другий засіб являє собою 2-((5-бром-4-(4-циклопропіл-1-нафталініл)-4H-1,2,4-триазол-3-іл)тіо)оцтову кислоту, алопуринол, фебуксостат, FYX-051 або їхні комбінації. [00130] У деяких варіантах здійснення даного винаходу 2-((3-(4-ціанонафталін-1-іл)піридин4-іл)тіо)-2-метилпропанову кислоту вводять індивідові, що страждає від захворювання або патологічного стану, що вимагає лікування сполукою, що має сечогінний ефект. У деяких варіантах здійснення даного винаходу 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2метилпропанову кислоту вводять індивідові, що страждає захворюванням або патологічним станом, що вимагає лікування сполукою, що має сечогінний ефект, при цьому сечогінний засіб викликає затримку урату в нирках. У деяких варіантах здійснення даного винаходу захворювання або патологічний стан являє собою застійну серцеву недостатність або гіпертонічну хворобу. [00131] У деяких варіантах здійснення даного винаходу введення 2-((3-(4-ціанонафталін-1іл)піридин-4-іл)тіо)-2-метилпропанової кислоти індивідові застосовується для поліпшення рухливості або поліпшення якості життя. [00132] У деяких варіантах здійснення даного винаходу введення 2-((3-(4-ціанонафталін-1іл)піридин-4-іл)тіо)-2-метилпропанової кислоти індивідові можна використати для лікування або зменшення побічних ефектів лікування рака. [00133] У деяких варіантах здійснення даного винаходу введення 2-((3-(4-ціанонафталін-1іл)піридин-4-іл)тіо)-2-метилпропанової кислоти індивідові застосовується для зниження ниркової токсичності цисплатину. Способи зниження сироваткових рівнів сечової кислоти [00134] Деякі варіанти здійснення даного винаходу відносяться до способів зниження сироваткових рівнів сечової кислоти при введенні 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2метилпропанової кислоти. У деяких варіантах здійснення даного винаходу спосіб зниження сироваткових рівнів сечової кислоти в ссавця містить введення 2-((3-(4-ціанонафталін-1іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення даного винаходу ссавцем є людина. У деяких варіантах здійснення даного винаходу спосіб зниження сироваткових рівнів сечової кислоти в організмі людини містить введення людині 2-((3-(4ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти або її фармацевтично прийнятної солі або складнного ефіру. [00135] У деяких варіантах здійснення даного винаходу спосіб зниження сироваткових рівнів сечової кислоти містить введення менше 100 мг 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2метилпропанової кислоти. У деяких варіантах даний спосіб містить введення менше 50 мг 2-((3(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропановоє кислоти. У деяких варіантах здійснення даного винаходу спосіб зниження сироваткових рівнів сечової кислоти містить введення менше 150 мг, менше 125 мг, менше 100 мг, менше 90 мг, менше 80 мг, менше 70 мг, 22 UA 114304 C2 5 10 15 20 25 30 35 40 45 50 55 60 менше 60 мг, менше 50 мг, менше 45 мг, менше 40 мг, менше 35 мг, менше 30 мг, менше 25 мг, менше 20 мг, менше 10 мг або менше 5 мг 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2метилпропанової кислоти. У деяких варіантах здійснення даного винаходу спосіб зниження сироваткових рівнів сечової кислоти містить введення менше 2 мг або менше 1 мг 2-((3-(4ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення даного винаходу спосіб зниження сироваткових рівнів сечової кислоти містить введення не більше 150 мг, не більше 125 мг, не більше 100 мг, не більш 90 мг, не більше 80 мг, не більше 70 мг, не більше 60 мг, не більше 50 мг, не більше 45 мг, не більше 40 мг, не більше 35 мг, не більше 30 мг, не більше 25 мг, не більше 20 мг, не більше 10 мг або не більше 5 мг 2-((3-(4ціанонафталін-1-іл)піридин-4-ил)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення даного винаходу спосіб зниження сироваткових рівнів сечової кислоти містить введення не більше 2 мг або не більше 1 мг 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. [00136] У деяких варіантах здійснення даного винаходу спосіб зниження сироваткових рівнів сечової кислоти містить введення близько 40 мг 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2метилпропанової кислоти. У деяких варіантах даний спосіб містить введення близько 20 мг 2((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. В інших варіантах даний спосіб містить введення близько 5 мг 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2метилпропанової кислоти. У деяких варіантах здійснення даного винаходу спосіб зниження сироваткових рівнів сечової кислоти містить введення близько 150 мг, близько 125 мг, близько 100 мг, близько 90 мг, близько 80 мг, близько 70 мг, близько 60 мг, близько 50 мг, близько 45 мг, близько 40 мг, близько 35 мг, близько 30 мг, близько 25 мг, близько 20 мг, близько 10 мг або близько 5 мг 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти В деяких варіантах здійснення даного винаходу спосіб зниження сироваткових рівнів сечової кислоти містить введення близько 4 мг, близько 3 мг, близько 2 мг, близько 1 мг або близько 0,5 мг 2-((3(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. [00137] У деяких варіантах здійснення даного винаходу спосіб зниження сироваткових рівнів сечової кислоти містить введення менше 100 мг у день 2-((3-(4-ціанонафталін-1-іл)піридин-4іл)тіо)-2-метилпропанової кислоти. У деяких варіантах даний спосіб містить введення менше 50 мг у день 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропановоїкислоти. У деяких варіантах спосіб зменшення сироваткового рівня сечової кислоти містить введення менше 150 мг на день, менше 125 мг на день, менше 100 мг на день, менше 90 мг на день, менше 80 мг на день, менше 70 мг на день, менше 60 мг на день, менше 50 мг на день, менше 45 мг на день, менше 40 мг на день, менше 35 мг на день, менше 30 мг на день, менше 25 мг на день, менше 20 мг на день, менше 10 мг на день або менше 5 мг на день 2-((3-(4-ціанонафталін-1-іл)піридин4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення даного винаходу спосіб зниження сироваткових рівнів сечової кислоти містить введення менше 2 мг на день або менше 1 мг на день 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо-2-метилпропанової кислоти. У деяких варіантах здійснення даного винаходу спосіб зниження сироваткових рівнів сечової кислоти містить введення не більше 150 мг на день, не більше 125 мг на день, не більше 100 мг на день, не більше 90 мг на ень, не більше 80 мг на день, не більше 70 мг на день, не більше 60 мг на день, не більше 50 мг на день, не більше 45 мг на день, не більше 40 мг на день, не більше 35 мг на день, не більше 30 мг на день, не більше 25 мг на день, не більше 20 мг на день, не більше 10 мг на день або не більше 5 мг на день 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2метилпропанової кислоти. У деяких варіантах здійснення даного винаходу спосіб зниження сироваткових рівнів сечової кислоти містить введення не більше 2 мг на день або не більше 1 мг на день 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. [00138] У деяких варіантах здійснення даного винаходу спосіб зниження сироваткових рівнів сечової кислоти містить введення близько 40 мг на день 2-((3-(4-ціанонафталін-1-іл)піридин-4іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення даного винаходу даний спосіб містить введення близько 20 мг на день 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2метилпропанової кислоти. В інших варіантах здійснення даного винаходу даний спосіб містить введення близько 5 мг на день 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення даного винаходу спосіб зниження сироваткових рівнів сечової кислоти містить введення близько 150 мг на день, близько 125 мг на день, близько 100 мг на день, близько 90 мг на день, близько 80 мг на день, близько 70 мг на день, близько 60 мг на день, близько 50 мг на день, близько 45 мг на день, близько 40 мг на день, близько 35 мг на день, близько 30 мг на день, близько 25 мг на день, близько 20 мг на день, близько 10 мг на день або близько 5 мг на день 2-((3-(4-ціанонафталін-1-ил)піридин-4-ил)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення даного винаходу спосіб зниження сироваткового рівня 23 UA 114304 C2 5 10 15 20 25 30 35 40 45 50 55 60 сечової кислоти містить введення близько 4 мг на день, близько 3 мг на день, близько 2 мг на день, близько 1 мг на день або близько 0,5 мг на день 2-((3-(4-ціанонафталін-1-ил)піридин-4ил)тіо)-2-метилпропанової кислоти. [00139] У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 0,3 мг/дл через 24 години після введення 2-((3-(4-ціанонафталін-1-ил)піридин-4-ил)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти і знижуються щонайменше на 0,5 мг/дл через 24 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 0,8 мг/дл через 24 години після введення 2-((3-(4ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 1 мг/дл через 24 години після введення 2-((3-(4-ціанонафталін-1іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти, сироваткові рівні сечової кислоти знижуються щонайменше на 2 мг/дл через 24 години після введення 2-((3-(4-ціанонафталін-1-ил)піридин-4іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 3 мг/дл через 24 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 4 мг/дл через 24 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. [00140] У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 0,5 мг/дл через 48 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 0,8 мг/дл через 48 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 1 мг/дл через 48 години після введення 2-((3-(4ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 2 мг/дл через 48 години після введення 2-((3-(4-ціанонафталін-1іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 3 мг/дл через 48 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4іл)тіо)-2-метилпропанової кислоти. [00141] У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 0,5 мг/дл через 72 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 0,8 мг/дл через 72 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 1 мг/дл через 72 години після введення 2-((3-(4ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 2 мг/дл через 72 години після введення 2-((3-(4-ціанонафталін-1іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 3 мг/дл через 72 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4іл)тіо)-2-метилпропанової кислоти. [00142] У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 0,5 мг/дл через 6 годин, 12 годин, 18 годин, 24 години, 30 годин, 36 годин, 42 години, 48 годин, 54 години, 60 годин, 72 години, 84 години, 96 годин, 108 годин або 120 годин після введення 2-((3-(4-ціанонафталін-1іл)піридин-4-іл)тіо)-2-метилпропановой кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 0,8 мг/дл через 6 годин, 12 годин, 18 годин, 24 години, 30 годин, 36 годин, 42 24 UA 114304 C2 5 10 15 20 25 30 35 40 45 50 55 60 годин, 48 годин, 54 годин, 60 годин, 72 години, 84 години, 96 годин, 108 годин або 120 годин після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 1 мг/дл через 6 годин, 12 годин, 18 годин, 24 години, 30 годин, 36 годин, 42 години, 48 годин, 54 години, 60 годин, 72 години, 84 години, 96 годин, 108 годин або 120 годин після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 2 мг/дл через 6 годин, 12 годин, 18 годин, 24 години, 30 годин, 36 годин, 42 години, 48 годин, 54 години, 60 годин, 72 години, 84 години, 96 годин, 108 годин або 120 годин після введення 2-((3-(4ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 3 мг/дл через 6 годин, 12 годин, 18 годин, 24 години, 30 годин, 36 годин, 42 години, 48 годин, 54 години, 60 години, 72 годин, 84 години, 96 годин, 108 годин або 120 годин після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропановоє кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 4 мг/дл через 6 годин, 12 годин, 18 годин, 24 години, 30 годин, 36 годин, 42 години, 48 годин, 54 години, 60 годин, 72 години, 84 години, 96 годин, 108 годин або 120 годин після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4іл)тіо)-2-метилпропанової кислоти. [00143] У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються на близько 0,5 мг/дл через 24 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються на близько 0,8 мг/дл через 24 години після введення 2-((3-(4ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються на близько 1 мг/дл через 24 години після введення 2-((3-(4-ціанонафталін-1іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються на близько 2 мг/дл через 24 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2метилпропанової кислоти. У деяких варіантах способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються на близько 3 мг/дл через 24 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. [00144] У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються на близько 0,5 мг/дл через 48 годин після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються на близько 0,8 мг/дл через 48 годин після введення 2-((3-(4ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються на близько 1 мг/дл через 48 годин після введення 2-((3-(4-ціанонафталін-1іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються на близько 2 мг/дл через 48 годин після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються на близько 3 мг/дл через 48 годин після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. [00145] У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються на близько 0,5 мг/дл через 72 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються на близько 0,8 мг/дл через 72 години після введення 2-((3-(4ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються на близько 1 мг/дл через 72 години після введення 2-((3-(4-ціанонафталін-1іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються на близько 2 мг/дл через 72 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів 25 UA 114304 C2 5 10 15 20 25 30 35 40 45 50 55 60 сечової кислоти сироваткові рівні сечової кислоти знижуються на близько 3 мг/дл через 72 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. [00146] У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються на близько 0,5 мг/дл через 6 годин, 12 годин, 18 годин, 24 години, 30 годин, 36 годин, 42 години, 48 годин, 54 години, 60 годин, 72 години, 84 години, 96 годин, 108 годин або 120 годин після введення 2-((3-(4-ціанонафталін-1іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються на близько 0,8 мг/дл через 6 годин, 12 годин, 18 годин, 24 години, 30 годин, 36 годин, 42 години, 48 годин, 54 години, 60 годин, 72 години, 84 години, 96 годин, 108 годин або 120 годин після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються на близько 1 мг/дл через 6 годин, 12 годин, 18 годин, 24 години, 30 годин, 36 годин, 42 години, 48 годин, 54 години, 60 годин, 72 години, 84 години, 96 годин, 108 годин або 120 годин після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються на близько 2 мг/дл через 6 годин, 12 годин, 18 годин, 24 години, 30 годин, 36 годин, 42 години, 48 годин, 54 години, 60 годин, 72 години, 84 години, 96 годин, 108 годин або 120 годин після введення 2-((3-(4-ціанонафталін-1іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються на близько 3 мг/дл через 6 годин, 12 годин, 18 годин, 24 години, 30 годин, 36 годин, 42 години, 48 годин, 54 години, 60 годин, 72 години, 84 години, 96 годин, 108 годин або 120 годин після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються на близько 4 мг/дл через 6 годин, 12 годин, 18 годин, 24 години, 30 годин, 36 годин, 42 години, 48 годин, 54 години, 60 годин, 72 години, 84 години, 96 годин, 108 годин або 120 годин після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2метилпропанової кислоти. [00147] У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 10 % від вихідного рівня через 24 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 15 % від вихідного рівня через 24 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 20 % від вихідного рівня через 24 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 30 % від вихідного рівня через 24 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 40 % від вихідного рівня через 24 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 50 % від вихідного рівня через 24 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 60 % від вихідного рівня через 24 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижується щонайменше на 10 %, щонайменше на 20 %, щонайменше на 30 %, щонайменше на 40 %, щонайменше на 50 % або щонайменше на 60 % від вихідного рівня через 24 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)2-метилпропанової кислоти. [00148] У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються на близько 10 % від вихідного рівня через 48 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 20 % від вихідного рівня через 48 26 UA 114304 C2 5 10 15 20 25 30 35 40 45 50 55 60 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 30 % від вихідного рівня через 48 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 40 % від вихідного рівня через 48 годин після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 50 % від вихідного рівня через 48 годин після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 10 %, щонайменше на 20 %, щонайменше на 30 %, щонайменше на 40 %, щонайменше на 50 % або щонайменше на 60 % від вихідного рівня через 48 годин після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. [00149] У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 15 % від вихідного рівня через 72 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 20 % від вихідного рівня через 72 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 30 % від вихідного рівня через 72 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 40 % від вихідного рівня через 72 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 10 %, щонайменше на 15 %, щонайменше на 20 %, щонайменше на 25 %, щонайменше на 30 %, щонайменше на 35 %, щонайменше на 40 %, щонайменше на 50 %, або щонайменше на 60 % від вихідного рівня через 72 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. [00150] У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 10 % від вихідного рівня через 6 годин, 12 годин, 18 годин, 24 години, 30 годин, 36 годин, 42 години, 48 годин, 54 години, 60 годин, 72 години, 84 години, 96 годин, 108 годин або 120 годин після введення 2-((3-(4ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 15 % від вихідного рівня через 6 годин, 12 годин, 18 годин, 24 години, 30 годин, 36 годин, 42 години, 48 годин, 54 години, 60 годин, 72 години, 84 години, 96 годин, 108 годин або 120 годин після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 20 % від вихідного рівня через 6 годин, 12 годин, 18 годин, 24 години, 30 годин, 36 годин, 42 години, 48 годин, 54 години, 60 годин, 72 години, 84 години, 96 годин, 108 годин або 120 годин після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 30 % від вихідного рівня через 6 годин, 12 годин, 18 годин, 24 години, 30 годин, 36 годин, 42 години, 48 годин, 54 години, 60 годин, 72 години, 84 години, 96 годин, 108 годин або 120 годин після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 40 % від вихідного рівня через 6 годин, 12 годин, 18 годин, 24 години, 30 годин, 36 годин, 42 години, 48 годин, 54 години, 60 годин, 72 години, 84 години, 96 годин, 108 годин або 120 годин після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 50 % від вихідного рівня через 6 годин, 12 годин, 18 годин, 24 години, 30 годин, 36 годин, 42 години, 48 годин, 54 години, 60 годин, 72 години, 84 години, 96 годин, 108 годин або 120 годин після введення 2-((3-(4-ціанонафталін-1 27 UA 114304 C2 5 10 15 20 25 30 35 40 45 50 55 60 іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються щонайменше на 60 % від вихідного рівня через 6 годин, 12 годин, 18 годин, 24 години, 30 годин, 36 годин, 42 години, 48 годин, 54 години, 60 годин, 72 години, 84 години, 96 годин, 108 годин або 120 годин після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. [00151] У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються на близько 15 % від вихідного рівня через 24 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються на близько 20 % від вихідного рівня через 24 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються на близько 30 % від вихідного рівня через 24 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропановоє кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються на близько 40 % від вихідного рівня через 24 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються на близько 50 % від вихідного рівня через 24 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються на близько 60 % від вихідного рівня через 24 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. [00152] У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються на близько 10 % від вихідного рівня через 48 годин після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються на близько 15 % від вихідного рівня 48 годин після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються на близько 20 % від вихідного рівня через 48 годин після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються на близько 30 % від вихідного рівня через 48 годин після введення 2-((3-(4ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються на близько 40 % від вихідного рівня через 48 годин після введення 2-((3-(4ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються на близько 50 % від вихідного рівня через 48 годин після введення. В деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються на близько 60 % від вихідного рівня через 48 годин після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. [00153] У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються на близько 10 % від вихідного рівня через 72 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються на близько 15 % від вихідного рівня 72 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються на близько 20 % від вихідного рівня через 72 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропановоє кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються на близько 30 % від вихідного рівня через 72 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні сечової кислоти знижуються на близько 40 % від вихідного рівня через 72 години після введення 2-((3-(4-ціанонафталін-1-іл)піридин-4-іл)тіо)-2-метилпропанової кислоти. У деяких варіантах здійснення способу зниження сироваткових рівнів сечової кислоти сироваткові рівні 28
ДивитисяДодаткова інформація
Автори англійськоюYeh, Li-tain, Quart, Barry D.
Автори російськоюЙэ Ли-таин, Кварт Барри Д.
МПК / Мітки
МПК: A61K 31/44
Мітки: зниження, спосіб, людини, кислоти, рівнів, сироваткових, сечової
Код посилання
<a href="https://ua.patents.su/56-114304-sposib-znizhennya-sirovatkovikh-rivniv-sechovo-kisloti-u-lyudini.html" target="_blank" rel="follow" title="База патентів України">Спосіб зниження сироваткових рівнів сечової кислоти у людини</a>
Попередній патент: Спосіб очищення та сепарації сипучої суміші і пристрій для його здійснення
Наступний патент: Диспенсер
Випадковий патент: Сепаратор