Похідні тетразолу для зниження рівня сечової кислоти
Номер патенту: 104289
Опубліковано: 27.01.2014
Автори: О'Ніл Джеймс Деннен, Шарма Шаліні, Арудчандран Рамачандран
Формула / Реферат
1. Сполука, представлена формулою XLVI
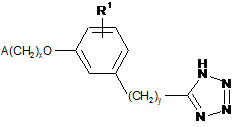 , XLVI
, XLVI
де
х - 1 або 2;
у - 0, 1, 2 або 3;
R1 вибраний з групи, яку складають водень, алкіл, який містить 1 атом або 2 атоми вуглецю, та алкоксигрупа, яка містить 1 атом або 2 атоми вуглецю;
та
А - 2,6-диметилфеніл.
2. Сполука за п. 1, представлена формулою XLVII
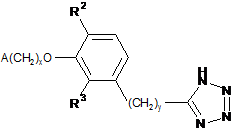 , XLVII
, XLVII
де
х - 1 або 2;
у - 0, 1, 2 або 3;
один із R2 та R3 - водень, а інший вибраний з групи, яку складають водень, алкіл, який містить 1 атом або 2 атоми вуглецю, та алкоксигрупа, яка містить 1 атом або 2 атоми вуглецю; та
А - 2,6-диметилфеніл.
3. Сполука за п. 2, представлена формулою XLVIII
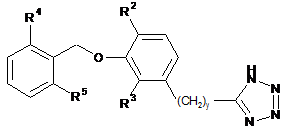 , XLVIII
, XLVIII
де
у - 0, 1 або 2;
один із R2 та R3 - водень, а інший вибраний з групи, яку складають водень, алкіл, який містить 1 атом або 2 атоми вуглецю, та алкоксигрупа, яка містить 1 атом або 2 атоми вуглецю; та
R4 - метил; та
R5 - метил.
4. Сполука за п. 3, де R3 - водень; та R2 вибраний з групи, яку складають водень, метил та метоксигрупа.
5. Сполука за п. 4, вибрана з групи, яку складають:
5-(3-(2,6-диметилбензилокси)феніл)-1H-тетразол;
5-(3-(2,6-диметилбензилокси)бензил)-1H-тетразол;
5-(3-(2,6-диметилбензилокси)-4-метоксибензил)-1H-тетразол;
5-(3-(2,6-диметилбензилокси)фенетил)-1H-тетразол та
5-(3-(2,6-диметилбензилокси)-4-метилбензил)-1H-тетразол.
6. Сполука за п. 3, вибрана з групи, яку складають:
5-(3-(2,6-диметилбензилокси)-2-метилбензил)-1H-тетразол та
5-(3-(2,6-диметилбензилокси)-2-метоксибензил)-1H-тетразол.
7. Спосіб зниження концентрації сечової кислоти у крові ссавця або посилення виділення сечової кислоти з організму ссавця, який включає введення в організм ссавця сполуки, представленої формулою XLVI, в кількості, ефективній для зниження концентрації сечової кислоти у крові ссавця або посилення виділення сечової кислоти з організму ссавця:
 , XLVI
, XLVI
де
х - 1 або 2;
у - 0, 1, 2 або 3;
R1 вибраний з групи, яку складають водень, алкіл, який містить 1 атом або 2 атоми вуглецю, та алкоксигрупа, яка містить 1 атом або 2 атоми вуглецю; та
А - 2,6-диметилфеніл.
8. Спосіб за п. 7, який відрізняється тим, що сполука представлена формулою XLVII
 , XLVII
, XLVII
де
х - 1 або 2;
у - 0, 1, 2 або 3;
один із R2 та R3 - водень, а інший вибраний з групи, яку складають водень, алкіл, який містить 1 атом або 2 атоми вуглецю, та алкоксигрупа, яка містить 1 атом або 2 атоми вуглецю; та
А - 2,6-диметилфеніл.
9. Спосіб за п. 7 або п. 8, який відрізняється тим, що х - 1.
10. Спосіб за п. 9, який відрізняється тим, що сполука представлена формулою XLVIII
 , XLVIII
, XLVIII
де
у - 0, 1 або 2;
один із R2 та R3 - водень, а інший вибраний з групи, яку складають водень, алкіл, який містить 1 атом або 2 атоми вуглецю, та алкоксигрупа, яка містить 1 атом або 2 атоми вуглецю; та
R4 - метил; та
R5 - метил.
11. Спосіб за п. 8 або п. 10, який відрізняється тим, що R3 - водень; та R2 вибраний з групи, яку складають водень, метил та метоксигрупа.
12. Спосіб за п. 11, який відрізняється тим, що сполука вибрана з групи, яку складають:
5-(3-(2,6-диметилбензилокси)феніл)-1H-тетразол;
5-(3-(2,6-диметилбензилокси)бензил)-1H-тетразол;
5-(3-(2,6-диметилбензилокси)-4-метоксибензил)-1H-тетразол;
5-(3-(2,6-диметилбензилокси)фенетил)-1H-тетразол та
5-(3-(2,6-диметилбензилокси)-4-метилбензил)-1H-тетразол.
13. Спосіб за п. 7, який відрізняється тим, що сполука вибрана з групи, яку складають:
5-(3-(2,6-диметилбензилокси)-2-метилбензил)-1H-тетразол та
5-(3-(2,6-диметилбензилокси)-2-метоксибензил)-1H-тетразол.
14. Спосіб лікування або профілактики стану, вибраного з групи, яку складають подагра, гіперурикемія, підвищені рівні сечової кислоти, які не відповідають рівням, при яких звичайно виправданим є діагноз гіперурикемії, дисфункція нирок, камені у нирках, серцево-судинні захворювання, ризик розвитку серцево-судинного захворювання, синдром лізису пухлини, порушення пізнавальної функції, рання стадія дійсної гіпертензії та запалення, спричинене Plasmodium falciparum, в якому здійснюють спосіб за п. 7.
15. Спосіб за п. 7, який відрізняється тим, що ссавцем є людина.
16. Спосіб за п. 7, який відрізняється тим, що згаданій сполуці надана форма, придатна для перорального застосування.
17. Фармацевтична композиція для застосування для зниження концентрації сечової кислоти у крові ссавця або посилення виділення сечової кислоти з організму ссавця, яка містить фармацевтично прийнятний носій та сполуку, яка представлена формулою XLVI, в кількості, ефективній для зниження концентрації сечової кислоти у крові ссавця або посилення виділення сечової кислоти з організму ссавця:
 , XLVI
, XLVI
де
х - 1 або 2;
у - 0, 1, 2 або 3;
R1 вибраний з групи, яку складають водень, алкіл, який містить 1 атом або 2 атоми вуглецю, та алкоксигрупа, яка містить 1 атом або 2 атоми вуглецю; та
А - 2,6-диметилфеніл.
18. Фармацевтична композиція за п. 17, яка відрізняється тим, що згадана сполука представлена формулою XLVII
 , XLVII
, XLVII
де
х - 1 або 2;
у - 0, 1, 2 або 3;
один із R2 та R3 - водень, а інший вибраний з групи, яку складають водень, алкіл, який містить 1 атом або 2 атоми вуглецю, та алкоксигрупа, яка містить 1 атом або 2 атоми вуглецю; та
А - 2,6-диметилфеніл.
19. Фармацевтична композиція за п. 17 або п. 18, яка відрізняється тим, що х - 1.
20. Фармацевтична композиція за п. 19, яка відрізняється тим, що згадана сполука представлена формулою XLVIII
 , XLVIII
, XLVIII
де
у - 0, 1 або 2;
один із R2 та R3 - водень та інший вибраний з групи, яку складають водень, алкіл, який містить 1 атом або 2 атоми вуглецю, алкоксигрупа, яка містить 1 атом або 2 атоми вуглецю; та
R4 - метил; та R5 - метил.
21. Фармацевтична композиція за п. 18 або п. 20, яка відрізняється тим, що R3 - водень; та R2 вибраний з групи, яку складають водень, метил та метоксигрупа.
22. Фармацевтична композиція за п. 21, яка відрізняється тим, що згадана сполука вибрана з групи, яку складають:
5-(3-(2,6-диметилбензилокси)феніл)-1H-тетразол;
5-(3-(2,6-диметилбензилокси)бензил)-1H-тетразол;
5-(3-(2,6-диметилбензилокси)-4-метоксибензил)-1H-тетразол;
5-(3-(2,6-диметилбензилокси)фенетил)-1H-тетразол та
5-(3-(2,6-диметилбензилокси)-4-метилбензил)-1H-тетразол.
23. Фармацевтична композиція за п. 17, яка відрізняється тим, що згадана сполука вибрана з групи, яку складають:
5-(3-(2,6-диметилбензилокси)-2-метилбензил)-1H-тетразол та
5-(3-(2,6-диметилбензилокси)-2-метоксибензил)-1H-тетразол.
24. Фармацевтична композиція за п. 17 для застосування при лікуванні або профілактиці стану, вибраного з групи, яку складають подагра, гіперурикемія, підвищені рівні сечової кислоти, які не відповідають рівням, при яких звичайно виправданим є діагноз гіперурикемії, дисфункція нирок, камені у нирках, серцево-судинні захворювання, ризик розвитку серцево-судинного захворювання, синдром лізису пухлини, порушення пізнавальної функції, рання стадія дійсної гіпертензії та запалення, спричинене Plasmodium falciparum.
25. Фармацевтична композиція за п. 17, придатна для перорального застосування.
Текст
Реферат: Рівні сечової кислоти в організмах ссавців знижуються та виділення сечової кислоти посилюється шляхом введення в організм сполуки формули І. Сполуки за цим винаходом, які спричиняють зниження рівнів сечової кислоти, застосовують для лікування або профілактики різноманітних станів, до яких належать подагра, гіперурикемія, підвищені рівні сечової кислоти, які не відповідають рівням, при яких звичайно виправданим є діагноз гіперурикемії, дисфункція нирок, камені у нирках, серцево-судинні захворювання, ризик розвитку серцево-судинного захворювання, синдром лізису пухлини та порушення пізнавальної функції, рання стадія дійсної гіпертензії та запалення, спричинене Plasmodium falciparwn. R 1 A(CH2)xO H N (CH2)y N N N І 1 У формулі І, х - 1 або 2; у - 0, 1, 2 або 3; та R вибраний з групи, яку складають водень, алкіл, який містить 1 атом або 2 атоми вуглецю, гідроксил, алкоксигрупа, яка містить 1 атом або 2 атоми вуглецю, фтор, хлор, бром та аміногрупа. А - феніл, незаміщений або заміщений одним, UA 104289 C2 (12) UA 104289 C2 двома або трьома замісниками, вибраними з групи, яку складають галоген, алкіл, який містить 1 атом або 2 атоми вуглецю, перфторметил, алкоксигрупа, яка містить 1 атом або 2 атоми вуглецю, та перфторметоксигрупа; або циклоалкіл, який містить в циклі від 3 атомів до 6 атомів, де згаданий циклоалкіл є незаміщеним, або один чи два атоми вуглецю в циклі незалежно один від одного є монозаміщеними метилом або етилом; або 5- або 6-членний гетероароматичний цикл, який містить в циклі 1 гетероатом або 2 гетероатоми, вибрані з групи, яку складають N, S та О, та згаданий гетероароматичний цикл ковалентно приєднаний до решти сполуки через вуглецевий атом циклу. R1 H N A(CH2)xO (I) N (CH2)y N N UA 104289 C2 5 10 15 20 25 30 35 40 45 50 55 60 Передумови створення винаходу Захворювання, спричинені підвищеними рівнями сечової кислоти, належать до двох головних категорій: розладів, спричинених осадженням кристалів сечової кислоти, та захворювань, пов'язаних із патологічним впливом розчинної сечової кислоти. Типовим прикладом захворювання першої категорії є подагричний артрит. Відкладання кристалів уратів у нирках також є звичайною причиною дисфункції нирок. З підвищеними рівнями розчинної сечової кислоти пов'язані різноманітні розлади, в тому числі серцево-судинні та ниркові захворювання. Проявом подагри найчастіше є запалення одного або кількох суглобів тіла, яке спричиняє біль (від слабкого до сильного). Ці явища можуть бути епізодичними та/або хронічними. З часом подагра може спричиняти руйнування хрящів та кісток, розвиток відкладень кристалів сечової кислоти, болі у нирках та порушення їхньої функції, а також утворення каменів у нирках. Подагра може впливати також на інші органи. Причиною подагри є гіперурикемія, наслідком якої є утворення та відкладання кристалів сечової кислоти у тканинах, суглобах, нирках та інших органах. Сечова кислота утворюється в результаті нормального клітинного метаболізму, а також надходить в організм із деяких типів харчових продуктів та напоїв. Підвищені рівні сечової кислоти є результатом надлишкового продукування сечової кислоти, порушення ниркового кліренсу (або поєднання надлишкового продукування та порушення кліренсу), а також є результатом вживання деяких лікарських засобів, які застосовуються для лікування інших розладів (прикладами таких засобів є діуретики, піразинамід, циклоспорин, аспірин у невеликих дозах, нікотинова кислота та леводопа). Певний вплив на розвиток гіперурикемії та подагри чинять патологічні стани численних типів, в тому числі алкоголізм, лейкемія, лімфома, рак легенів, синдром лізису пухлин, куріння, псоріаз, ожиріння, дисфункція нирок, застійна серцева недостатність, голодування, анемія, високий кров'яний тиск, діабет, нерухомість, синдром Леша-Найхана, синдром Дауна, а також порушення функції щитовидної та паращитовидної залоз. За ознаками поступового підвищення тяжкості симптомів подагра, як правило, підрозділяється на чотири стадії: 1) безсимптомна: підвищені рівні сечової кислоти у крові, але без очевидних симптомів; 2) гострий подагричний артрит: раптова поява симптомів, часто в одному суглобі (звичайно у великому пальці ноги), з подальшим поширенням на інші суглоби. До симптомів належать біль, набряк, почервоніння та підвищена температура; 3) міжкритична подагра: безсимптомні фази між нападами подагри; 4) хронічна вузлова подагра: хронічний стан, який може включати часті напади, постійний слабкий біль та запалення суглобів, руйнування хрящової та кісткової тканини, розвиток відкладень кристалів сечової кислоти, дисфункція нирок та утворення каменів у них. До лікарських засобів, які на даний час застосовуються для лікування гострих симптомів подагри, належать нестероїдні протизапальні лікарські засоби, колхіцин та кортикостероїди. Усі ці засоби можуть спричиняти побічні ефекти (від слабких до сильних). Досліджуються інші засоби для лікування згаданих гострих симптомів, в тому числі антитіла та антагоністи запальних цитокінів, таких як інтерлейкін-1. У спробах зменшити частоту або тяжкість майбутніх нападів подагри шляхом зниження рівнів сечової кислоти застосовувалися лікарські засоби інших типів. Трьома основними типами лікарських засобів є інгібітори ксантиноксидази (наприклад, алопуринол), які послаблюють продукування сечової кислоти з ксантину; засоби, які сприяють виведенню сечової кислоти (наприклад, сульфінпіразон, пробенецид, бензбромарон та лозартан), призначені для покращення виведення сечової кислоти шляхом пригнічення повторного поглинання продукованої сечової кислоти у ниркових канальцях внаслідок інгібування переносника 1 сечової кислоти (URAT1) (дивись також опубліковану заявку на патент США № 2007/0010670, дата публікації 11 січня 2007 р. (Japan Tobacco Inc.)) або інших елементів повторного поглинання сечової кислоти; та урикази, наприклад, пегільована уриказа, така як PURICASE (пегільована за Сав'яном (Savient) рекомбінантна уриказа ссавців). Ці лікарські засоби також часто викликають значні та небажані побічні ефекти. Наприклад, опубліковані дані, що алопринол щорічно спричиняє у Європі щонайменше 100 випадків синдрому Стівенса-Джонсона та токсичного некролізу епідермісу та приблизно 30 смертельних випадків на рік (Галеві та ін. "Алопринол є найчастішою причиною синдрому Стівенса-Джонсона та токсичного некролізу епідермісу у Європі та Ізраїлі" – Halevy et al., "Allopurinol is the most common cause of StevensJohnson syndrome and toxic epidermal necrolysis in Europe and Israel", J. Am. Acad. Dermatol. 58(1):25-32, 2008). Пробенецид та бензбромарон вилучені з продажу в численних країнах внаслідок небажаних побічних ефектів, таких як печінкова недостатність у випадку 1 UA 104289 C2 5 10 15 20 25 30 35 40 45 50 55 60 бензбромарону. Сповіщається, що хворі дуже погано додержуються режиму вживання згаданих лікарських засобів (Райдель та ін. "Додержання режиму лікування алопринолом хворими на подагру, що перебувають під наглядом. Ретроспективний аналіз скарг адміністрації" – A.A. Reidel et al., "Compliance with Allopurinol Therapy among Managed Care Enrollees with Gout: A Retrospective Analysis of Administrative Claims", Journal of Rheumatology 2004; 31:1575-1581), припускається, що причиною цього є побічні ефекти та/або відсутність позитивних результатів. Кількість хворих на подагру у США перевищує 5 млн. (National Health and Nutrition Examination Survey 111, 1988-1994). Поширеність гіперурикемії та подагри у США в 1999 році відповідала 41 випадку на 1000 чоловік, а у Великобританії – 14 випадкам на 1000 чоловік (Мікулс та ін. "Епідеміологія подагри. Результати дослідження бази даних із загальної практики по Великобританії за 1990-1999 рр." – T.R. Mikuls et al., "Gout Epidemiology: Results for the UK General Practice Research Database, 1990-1999", Annals of the Rheumatic Diseases 2005; 64:267272). Дані за пізніший час вказують на постійне зростання поширеності у США, Великобританії та в інших країнах (Уоллес та ін. "Зростання поширеності подагри та гіперурикемії за 10 років серед дорослих літнього віку в обстеженій популяції" – K.L. Wallace et al., "Increasing Prevalence of Gout and Hyperuricemia over 10 Years Among Older Adults in a Managed Care Population", Journal of Rheumatology 2004; 31: 1582-1587). Пізніші дані дозволяють припустити, що на даний час понад 5 млн. американців страждають на подагру, яка піддається діагностуванню (Крістмен та ін. "Подагра серед амбулаторного контингенту в США" – E. Krishnan et al., "Gout in Ambulatory Care Settings in the United States", Journal of Rheumatology 2008; 35(3): 498-501). Гіперурикемія та подагра є, зокрема, серйозними наслідками хірургічного втручання у реципієнтів трансплантованих органів (Стемп та ін. "Подагра при трансплантації цільних органів. Складна клінічна проблема" – Stamp L., et al., "Gout in solid organ transplantation: a challenging clinical problem", Drugs (2005) 65(18): 2593-2611). Рівень сечової кислоти часто підвищується у пацієнтів із пересадженими нирками, і звичайні імунодепресивні засоби, такі як циклоспорин, можуть спричинити особливо тяжку гіперурикемію. Пацієнтам із трансплантатами протипоказаний алопуринол із причин його взаємодії з деякими імунодепресантами, такими як азатіоприн, і у зв'язку з руйнуванням кісткового мозку, яке спричиняється такою комбінацією. Крім того, підвищені рівні сечової кислоти можуть сприяти відторгненню трансплантатів (Армстронг та ін. "Чи відіграє сечова кислота патогенну роль при дисфункції трансплантатів та гіпертензії у хворих із трансплантатами нирок?" – Armstrong K.A. et al., "Does Uric Acid Have a Pathogenetic Role in Graft Dysfunction and Hypertension in Renal Transplant Patients?", Transplantation (2005) 80(11): 1565-1571). Отже, існує гостра потреба у безпечних засобах, які знижують гіперурикемію у реципієнтів трансплантатів. До захворювань, пов'язаних із підвищеними рівнями розчинної сечової кислоти, часто належать порушення у серцево-судинній системі: гіпертензія (Сандстром та ін. "Взаємозв'язок між рівнем сечової кислоти у плазмі та поздовжнім поширенням кров'яного тиску та виникненням гіпертензії" – Sundstrom et al., "Relations of serum uric acid to longitudinal blood pressure tracking and hypertension incidence", Hypertension. 45(1):28-33, 2005), прегіпертензія (Сіамела та ін. "Взаємозв'язок між рівнем сечової кислоти у плазмі та прегіпертензією у дорослих жителів США" – Syamela S. et al., "Association between serum uric acid and prehypertension among US adults", J. Hypertens. 25 (8) 1583-1589, (2007), атеросклероз (Ісідзака та ін. "Взаємозв'язок між рівнем сечової кислоти у плазмі, метаболічним синдромом та каротидним атеросклерозом у японців" – Ishizaka et al., "Association between serum uric acid, metabolic syndrome, and carotid atherosclerosis in Japanese individuals", Arterioscler. Thromb. Vasc. Biol. (5):1038-1044, 2005), захворювання периферичних артерій (Шанкар та ін. "Взаємозв'язок між рівнем сечової кислоти у плазмі та захворюванням периферичних артерій" – Shankar A. et al., "Association between serum uric acid level and peripheral artery disease", Atherosclerosis doi 10: 1016, 2007), запалення судин (Зоккалі та ін. "Сечова кислота та дисфункція ендотелію при гіпертензії" – Zoccali et al., "Uric acid and endothelial dysfunction in essential hypertension", J. Am. Soc. Nephrol. 17(5):1466-1471, 2006), серцева недостатність (Страсак та ін. "Сечова кислота у плазмі та ризик смертності від серцево-судинних захворювань. Перспективне довготривале дослідження 83683 австрійців чоловічої статі" – Strasak A.M. et al., "Serum uric acid and risk of cardiovascular mortality: A prospective, long-term study of 83,683 Austrian men", Clin. Chem. 54 (2) 273-284, 2008; Паскуаль-Фігаль "Гіперурикемія та довготривалі наслідки після виписки з клініки у хворих із гострою серцевою недостатністю" – Pascual-Figal, "Hyperuricaemia and long-term outcome after hospital discharge in acute heart failure patients", Eur. J. Heart Fail. 2006 Oct. 23; [електронна публікація перед друком]; Енджел та ін. "Рівні сечової кислоти у плазмі як передвісник смерті у клініці хворих, госпіталізованих із приводу декомпенсованої серцевої недостатності" – Cengel A., et al., "Serum uric Acid Levels as a Predictor of In-hospital Death in 2 UA 104289 C2 5 10 15 20 25 30 35 40 45 50 55 Patients Hospitalized for Decompensated Heart Failure", Acta Cardiol. (Oct. 2005) 60(5): 489-492), інфаркти міокарда (Страсак та ін. – Strasak A.M. et al.; Бос та ін. "Сечова кислота як фактор ризику інфаркту міокарда та інсульту. Дослідження у Роттердамі" – Bos et al., "Uric acid is a risk factor for myocardial infarction and stroke: the Rotterdam study", Stroke. 2006 Jun; 37(6):1503-1507), дисфункція нирок (Сирилло та ін. "Сечова кислота, метаболічний синдром та ниркові захворювання" – Cirillo et al., "Uric Acid, the metabolic syndrome, and renal disease", J. Am. Soc. Nephrol. 17(12 Suppl. 3):S165-168, 2006; Аврам та Крішнан "Гіперурикемія – місце стикання нефрології з ревматологією" – Z. Avram and E. Krishnan, "Hyperuricemia – where nephrology meets rheumatology", Rheumatology (Oxford), 47(7): 960-964, 2008) та інсульти (Бос та ін. – Bos et al., 2006). Сечова кислота є безпосередньою причиною дисфункції ендотелію (Канелліс та ін. "Сечова кислота як медіатор дисфункції ендотелію, запалення та судинних захворювань" – Kanellis, et al., "Uric acid as a mediator of endothelial dysfunction, inflammation, and vascular disease", Semin. Nephrol. 25(1):39-42, 2005; Хосла та ін. "Гіперурикемія спричиняє дисфункцію ендотелію" – Khosla et al., "Hyperuricemia induces endothelial dysfunction", Kidney Int. 67(5):17391742, 2005). У дітей та підлітків рання дійсна гіпертензія пов'язана з підвищеним рівнем сечової кислоти у плазмі, і зниження рівня сечової кислоти за допомогою алопуринолу знижує кров'яний тиск у цих пацієнтів (Файг та Джонсон "Роль сечової кислоти при гіпертензії у дітей" – Feig and Johnson, "The role of uric acid in pediatric hypertension", J. Ren. Nutrition. 17(1): 79-83, 2007; Файг та ін. "Вплив алопуринолу на кровяний тиск у дорослих із недавнім діагнозом істотної гіпертензії" – D.I. Feig et al., "Effect of allopurinol on blood pressure of adolescents with newly diagnosed essential hypertension", JAMA 300(8): 924-932, 2008). Файг та ін. також стверджують, що це є новим терапевтичним підходом, але вказують, що побічні ефекти відомих лікарських засобів для зниження рівня сечової кислоти можуть обмежити їх застосування або заважати йому. При всіх згаданих патологічних станах гіперурикемія є незалежним фактором ризику. Підвищені рівні розчинної сечової кислоти також пов'язані із запальними реакціями або безпосередньо спричиняють такі реакції. Наприклад, сечова кислота переноситься у судинні клітини гладеньких м'язів під впливом переносників органічних кислот, зокрема, переносника уратів URAT1, а потім стимулює продукування у судинних клітинах гладеньких м'язів Среактивного протеїну MCP-1 та інших цитокінів, тим самим стимулюючи проліферацію та інші зміни, пов'язані з атеросклерозом (Прайс та ін. "Судинні клітини гладеньких м'язів людини експресують переносник уратів" – Price et al., "Human vascular smooth muscle cells express a urate transporter", J. Am. Soc. Nephrol. 17(7):1791-1795, 2006; Канг та ін. "Сечова кислота спричиняє проліферацію судинних клітин гладеньких м'язів шляхом входження у клітини під впливом функціонального переносника уратів" – Kang et al., "Uric acid causes vascular smooth muscle cell proliferation by entering cells via a functional urate transporter", Am. J. Nephrol. 2005 25(5):425-433 (2005); Ямамото та ін. "Алопуринол знижує неоінтимальну гіперплазію у моделі лігатури сонної артерії пацюків зі спонтанною гіпертензією" – Yamamoto et al., "Allopurinol reduces neointimal hyperplasia in the carotid artery ligation model in spontaneously hypertensive rats", Hypertens. Res. 29 (11) 915-921, 2006), стимулює продукування IL-1β, IL-6 та TNF-α у мононуклеарних клітинах людини, спричиняє помітне зростання TNF-α при інфузії мишам, активує клітини ендотелію та тромбоцити і підвищує адгезивність тромбоцитів (Кутіньо та ін. "Зв'язок сечової кислоти у плазмі з маркерами запалення, метаболічним синдромом та субклінічним коронарним атеросклерозом" – Coutinho et al., "Associations of Serum Uric Acid with Markers of Inflammation, Metabolic Syndrome, and Subclinical Coronary Atherosclerosis", Amer. J. Hypertens. (2007) 20: 83-89; Левіа та ін. "Сечова кислота при хронічній серцевій недостатності. Маркер хронічного запалення" – Levya F., et al., "Uric Acid in Chronic Heart Failure: A Marker of Chronic Inflammation", Eur. Heart J. (1998) 19(12): 1814-1822). Було показано також, що сечова кислота інгібує біодоступність ендотеліального оксиду азоту та активує систему ренінангіотензин (Перлштайн та ін. "Сечова кислота та стан внутрішньониркової системи ренінангіотензин у людському організмі" – T.S. Perlstein et al., "Uric acid and the state of the intrarenal renin-angiotensin system in humans", Kidney International. 66:1465-1470, 2004). Інокучі та ін. показали, що інтерлейкін-18 (IL-18) та інші запальні агенти відображають локальне запалення, пов'язане з подагрою, та що кристали уратів прискорюють активацію IL-18 (Інокучі та ін. "IL-18 та інші запальні цитокіни у плазмі хворих на подагричний артрит та секреція IL-18, індукована кристалами моногідрату мононатрійурату" – T. Inokuchi et al., "Plasma IL-18 and other inflammatory cytokines in patients with gouty arthritis and monosodium urate monohydrate crystalinduced secretion of IL-18", Cytokine. 33(1): 21-27, 206), яка відіграє причинну роль у нирковій недостатності. Рівень IL-18 та інших цитокінів також значно підвищений у людей, які не хворіють на подагру, а лише мають підвищені рівні сечової кислоти (Руджеро та ін. "Сечова кислота та 3 UA 104289 C2 5 10 15 20 25 30 35 40 45 50 55 60 маркери запалення" – (C. Ruggiero et al., "Uric acid and inflammatory markers", European Heart Journal. 27: 1174-1181, 2006). Гіперурикемія пов'язана також із розладом пізнавальної функції та іншими формами порушення функцій центральної нервової системи (Шретлен та ін. "Сечова кислота та пізнавальна функція у літніх людей при проживанні у будинку для людей похилого віку" – Schretlen D.J. et al., "Serum Uric Acid and Cognitive Function in Community-Dwelling Older Adults", Neuropsychology (Jan. 2007) 21(1): 136-140; Ватанабе та ін. "Оксидативний стрес та мітохондріальна дисфункція у індукованих оксонатом гіперурикемічних мишей" – Watanabe S., et al., "Cerebral Oxidative Stress and Mitochondrial Dysfunction in Oxonate-Induced Hyperuricemic Mice", J. Health Science (2006) 52: 730-737). Підвищені рівні сечової кислоти у плазмі пов'язані також із підвищеним ризиком раку та смертності від раку (Страсак та ін. "Сечова кислота у плазмі та ризик смертності від раку у широкій представницькій групі чоловіків" – Strasak A.M. et al., "Serum uric acid and risk of cancer mortality in a large prospective male cohort", Cancer Causes Control 18 (9) 1021-1029); Страсак та ін., "Роль сечової кислоти у плазмі як антиоксиданта, що запобігає раку. Перспективне дослідження на більш ніж 28000 літніх жінок-австрійок" – Strasak A.M. et al., "The role of serum uric acid as an antioxidant protecting against cancer: prospective study in more than 28,000 older Austrian women", Annals Oncol. 18 (11) 1893-1897; Джі та ін. "Сечова кислота у плазмі та ризик смерті від раку, серцево-судинних захворювань або усіх причин у чоловіків" – Jee S.A. et al. (2004), "Serum uric acid and risk of death from cancer, cardiovascular disease or all causes in men", Eur. J. Cardiovascular Prev. Rehab. 11 (3) 185-191). Підвищені рівні сечової кислоти пов'язані з переддіабетичним станом, резистентністю до інсуліну, розвитком діатебу типу II та підвищеною ймовірністю різноманітних небажаних станів у хворих на діабет, таких як захворювання периферичних артерій, інсульти та підвищений ризик смертності (Йоахімеску та ін. "Сечова кислота у плазмі, смертність та регулювання глюкози у хворих на цукровий діабет типу II. Дослідження бази даних PreCIS" – Ioachimescu A.G. et al. (2007), "Serum uric acid, mortality and glucose control in patients with Type 2 diabetes mellitus: a PreCIS database study", Diabet. Med. 24 (12) 1369-1374; Перрі та ін. "Перспективне дослідження факторів ризику розвитку неінсулінозалежного діабету у чоловіків-британців середнього віку" – Perry I.J. et al. (1995), "Prospective study of risk factors for development of non-insulin dependent diabetes in middle aged British men", BMJ 310 (6979) 560-564; Чен та ін. "Сечова кислота у плазмі та ризик діабету типу II у китайців" – Chien K.-L. et al. (2008), "Plasma uric acid and the risk of Type 2 diabetes in a Chinese community", Clin. Chem. 54 (2) 310-316; Сотен та ін. "Негативні ефекти класичного антиоксиданта – сечової кислоти – в жирових клітинах. Опосередкований оксидазою нікотинамідаденіндинуклеотидфосфату (NADPH) оксидативно-нітрозативний стрес" – Sautin Y.Y. et al. (2007), "Adverse effects of the classic antioxidant uric acid in adipocytes: NADPH oxidase-mediated oxidative/nitrosative stress", Am. J. Physiol. Cell Physiol. 293: C584-C596; Цзен "Незалежний зв'язок рівнів сечової кислоти із захворюванням периферичних артерій у жителів Тайваню, хворих на діабет типу II" – Tseng C.H. (2004), "Independent association of uric acid levels with peripheral artery disease in Taiwanese patients with Type 2 diabetes", Diabet. Med. 21 (7) 724729; Лехто та ін. "Сечова кислота у плазмі як стійкий передвісник інсульту у хворих на інсуліннезалежний цукровий діабет" – Lehto S. et al. (1998), "Serum uric acid is a strong predictor of stroke in patients with non-insulin dependent diabetes mellitus", Stroke 29: 635-639). Підвищені рівні сечової кислоти є визначальною відмінністю синдрому Леша-Найхана. У людей із синдромом нічного апное або з розладами дихання уві сні також визначаються підвищені рівні сечової кислоти (Сайто та ін. "Тканинна гіпоксія при синдромі нічного апное, оцінювана за рівнями сечової кислоти та аденозину" – Saito H. et al., "Tissue hypoxia in sleep apnea syndrome assessed by uric acid and adenosine", Chest 122: 1686-1694, 2002; Вергульст та ін. "Розлади дихання уві сні та сечова кислота у дітей та підлітків із надлишковою вагою та ожирінням" – Verhulst S.L., et al., "Sleep-disordered breathing and uric acid in overweight and obese children and adolescents", Chest 132: 76-80, 2007). Підвищені рівні сечової кислоти пов'язані з прееклампсією (Бейнбрідж та Робертс "Сечова кислота як патогенний фактор при прееклампсії" – Bainbridge S.A. and Roberts J.M., "Uric acid as a pathogenic factor in preeclampsia", Placenta, Dec. 17, 2007). "Сечова кислота є головним чинником запальної реакції, ініційованої P. falciparum у мононуклеарних клітинах периферичної крові людини… Ця запальна реакція, ініційована P. Falciparum, вважається головною причиною у патогенезі малярії…" (PLoS ONE 2009; 4(4):e5194. Epub 2009 Apr. 17). У медицині має місце значна потреба у нових лікарських засобах, придатних для безпечного, зручного та ефективного лікування та профілактики розладів, пов'язаних із 4 UA 104289 C2 5 підвищенням рівня сечової кислоти у крові, незалежно від того, спричиняються ці розлади кристалізацією сечової кислоти чи впливом надлишкових (у порівнянні з індивідуальною або груповою нормою) рівнів розчинної сечової кислоти. Суть винаходу Цей винахід пропонує сполуку, яка представлена формулою R1 H N A(CH2)xO (I) N (CH2)y N 10 15 20 25 30 35 40 45 50 N I 1 У формулі I x – 1 або 2; y – 0, 1, 2 або 3; R вибраний з групи, яку складають водень, алкіл, який містить 1 атом або 2 атоми вуглецю, гідроксил, алкоксигрупа, яка містить 1 атом або 2 атоми вуглецю, фтор, хлор, бром та аміногрупа. A – феніл, незаміщений або заміщений одним, двома або трьома замісниками, вибраними з групи, яку складають галоген, алкіл, який містить 1 атом або 2 атоми вуглецю, перфторметил, алкоксигрупа, яка містить 1 атом або 2 атоми вуглецю, та перфторметоксигрупа; або циклоалкіл, який містить в циклі від 3 атомів до 6 атомів, де згаданий циклоалкіл є незаміщеним, або один чи два атоми вуглецю в циклі незалежно один від одного є монозаміщеними метилом або етилом; або 5- або 6-членний гетероароматичний цикл, який містить в циклі 1 гетероатом або 2 гетероатоми, вибрані з групи, яку складають N, S та O, та згаданий гетероароматичний цикл ковалентно приєднаний до решти сполуки через вуглецевий атом циклу. Цей винахід пропонує спосіб зниження концентрації сечової кислоти у крові пацієнта-ссавця або посилення виділення сечової кислоти з організму згаданого пацієнта-ссавця, який включає введення в організм пацієнта-ссавця сполуки за цим винаходом в кількості, ефективній для зниження концентрації сечової кислоти у крові пацієнта-ссавця або посилення виділення сечової кислоти з організму згаданого пацієнта-ссавця. Цей винахід пропонує сполуку за цим винаходом для застосування з метою зниження концентрації сечової кислоти у крові пацієнтассавця або посилення виділення сечової кислоти з організму згаданого пацієнта-ссавця. Цей винахід пропонує застосування сполуки за цим винаходом у виробництві лікарського засобу для зниження концентрації сечової кислоти у крові пацієнта-ссавця або посилення виділення сечової кислоти з організму згаданого пацієнта-ссавця. Цей винахід пропонує фармацевтичну композицію для застосування з метою зниження концентрації сечової кислоти у крові пацієнтассавця або посилення виділення сечової кислоти з організму згаданого пацієнта-ссавця, яка містить сполуку за цим винаходом в кількості, ефективній для зниження концентрації сечової кислоти у крові пацієнта-ссавця або посилення виділення сечової кислоти з організму згаданого пацієнта-ссавця. Цей винахід пропонує набір, який включає в себе одну або декілька разових пероральних доз сполуки за цим винаходом, та інструкції щодо введення згаданої сполуки для зниження концентрації сечової кислоти у крові пацієнта-ссавця або посилення виділення сечової кислоти з організму згаданого пацієнта-ссавця. Зниження концентрації сечової кислоти, описане в цьому документі, може бути застосоване для лікування або попередження різноманітних патологічних станів, до яких належать подагра (будь-який стан або всі стани, вибрані з групи, до якої входять безсимптомна подагра, гострий подагричний артрит, міжкритична подагра та хронічна вузлова подагра), гіперурикемія, підвищені рівні сечової кислоти, які не відповідають рівням, при яких звичайно виправданим є діагноз гіперурикемії, дисфункція нирок, камені у нирках, серцево-судинні захворювання, ризик розвитку серцево-судинного захворювання та інших наслідків гіперурикемії, порушення пізнавальної функції, рання стадія дійсної гіпертензії та запалення, спричинені Plasmodium falciparum. Цей винахід базується на спостереженні, за яким сполука за цим винаходом інгібує дію URAT1 in vitro, як описано у Прикладі 7. Інгібування дії URAT1 є відомою та визнаною моделлю in vitro зниження вмісту сечової кислоти in vivo. Короткий опис фігур 14 Фіг. 1: Залежний від концентрації інгібувальний вплив Сполуки EB на поглинання C-урату у клітинах лінії hURAT1-HEK. 14 Фіг. 2: Залежний від концентрації інгібувальний вплив Сполуки EС на поглинання C-урату у клітинах лінії hURAT1-HEK. 5 UA 104289 C2 5 10 15 Фіг. 3: Концентрація сполуки EB у плазмі мишей. Фіг. 4: Градуювальна крива для сполуки EB у плазмі пацюків, метод LC-MS. Фіг. 5: Концентрація сполуки EB у плазмі пацюків. Фіг. 6: Градуювальна крива для сполуки EB у плазмі пацюків, метод LC-MS. Фіг. 7: Концентрація сполуки EC у плазмі пацюків. Фіг. 8: Градуювальна крива для сполуки EG у плазмі пацюків, метод LC-MS. Фіг. 9: Концентрація сполуки EG у плазмі пацюків. Детальний опис винаходу Визначення Група 1H-тетразоліл-5-іл та відповідна група 2H-тетразоліл-5-іл можуть існувати як таутомерні форми. Подані у цьому документі назви сполук та структурні формули стосуються 1H-таутомеру. Мається на увазі, що всі такі назви та формули охоплюють обидві таутомерні форми. Таким чином, наприклад, термін "5-(3-(2,6-диметилбензилокси)феніл)-1H-тетразол" охоплює як 5-(3-(2,6-диметилбензилокси)феніл)-1H-тетразол, так і 5-(3-(2,6диметилбензилокси)феніл)-2H-тетразол. Формула I охоплює як формулу I, яка зображена вище, так і її 2H-тетразоліл-5-іл таутомерну форму, зображену поданою нижче формулою I’ R1 (I') A(CH2)xO N NH (CH2)y N N 20 25 30 35 40 45 50 . Термін "алкіл" у значенні, вживаному в цьому описі, означає алкільну групу лінійної або розгалуженої будови. Алкільна група, ідентифікована як така, що містить певну кількість атомів вуглецю, означає будь-яку алкільну групу, яка містить вказану кількість атомів вуглецю. Наприклад, алкіл, який містить три атоми вуглецю, може бути пропілом або ізопропілом; а алкіл, який містить чотири атоми вуглецю, може бути н-бутилом, 1-метилпропілом, 2-метилпропілом або трет-бутилом. Термін "галоген" у значенні, вживаному в цьому описі, означає один або декілька замісників із групи, яку складають атоми фтору, хлору, брому та йоду. Термін "перфтор" у значенні, вживаному в цьому описі, як, наприклад, у складі термінів "перфторметил" або "перфторметоксигрупа", означає, що у вказаній групі усі атоми водню замінені на атоми фтору. Деякі хімічні сполуки характеризуються в цьому описі їх хімічними назвами або дволітерними кодовими назвами, вказаними нижче. Сполуки EB – EI та сполука BD охоплюються формулою I, показаною вище. EB 5-(3-(2,6-диметилбензилокси)феніл)-1H-тетразол; EC 5-(3-(2,6-диметилбензилокси)бензил)-1H-тетразол; ED 5-(3-(2,6-диметилбензилокси)-4-метоксибензил)-1H-тетразол; EF 5-(3-(2,6-диметилбензилокси)фенетил)-1H-тетразол; EG 5-(3-(2,6-диметилбензилокси)-4-метилбензил)-1H-тетразол; BD 5-(4-(2,6-дифторбензилокси)бензил)-1H-тетразол; EH 5-(3-(2,6-диметилбензилокси)-2-метилбензил)-1H-тетразол; EI 5-(3-(2,6-диметилбензилокси)-2-метоксибензил)-1H-тетразол. Сполучний термін "включає" або "містить" у значенні, вживаному в цьому описі, не є обмежувальним. Пункт формули винаходу, де вжито цей термін, може включати додаткові елементи, крім згаданих у цьому пункті. При вживанні у формулі винаходу слово "або" означає "та/або", за винятком випадків, коли таке значення не має сенсу у зв'язку з контекстом. Так, наприклад, фраза "зниження концентрації сечової кислоти у крові пацієнта-ссавця або посилення виведення сечової кислоти з організму згаданогопацієнта-ссавця" є еквівалентною до "зниження концентрації сечової кислоти у крові пацієнта-ссавця та/або посилення виведення сечової кислоти з організму згаданого пацієнта-ссавця". Сполуки за цим винаходом У варіантах здійснення сполуки, способу, застосування або фармацевтичної композиції, описаних вище у розділі "Суть винаходу", сполука представлена формулою XLVI 6 UA 104289 C2 R1 A(CH2)xO (XLVI) H N N (CH2)y N N , 1 де x, y, R та A відповідають наведеним вище визначенням для формули I. У іншому варіанті здійснення цього винаходу сполука представлена формулою XLVII R2 (XLVII) A(CH2)xO H N R3 N 5 10 15 N (CH2)y N , 2 3 де x, y, та A відповідають наведеним вище визначенням для формули I; та один із R та R – водень, а інший вибраний з групи, яку складають водень, алкіл, який містить 1 атом або 2 атоми вуглецю, гідроксил, алкоксигрупа, яка містить 1 атом або 2 атоми вуглецю, фтор, хлор, бром та аміногрупа. У одному з варіантів здійснення цього винаходу у формулі I, формулі XLVI або формулі XLVII x – 1. У іншому варіанті здійснення цього винаходу A – феніл, незаміщений або заміщений одним, двома або трьома замісниками, вибраними з групи, яку складають галоген, алкіл, який містить 1 атом або 2 атоми вуглецю, перфторметил, алкоксигрупа, яка містить 1 атом або 2 атоми вуглецю, та перфторметоксигрупа. У більш конкретному варіанті здійснення цього винаходу A – 2,6-диметилфеніл або 2,6-дифторфеніл. За варіантом, якому віддається перевага, A – 2,6-диметилфеніл. У одному з варіантів здійснення цього винаходу згадана сполука представлена формулою XLVIII R2 R4 (XLVIII) O R5 H N R3 N 20 25 30 N (CH2)y N , 2 3 де y – 0, 1, 2 або 3; один із R та R – водень, а інший вибраний з групи, яку складають водень, алкіл, який містить 1 атом або 2 атоми вуглецю, гідроксил, алкоксигрупа, яка містить 4 5 1 атом або 2 атоми вуглецю, фтор, хлор, бром та аміногрупа; та R та R незалежно один від одного вибрані з групи, яку складають метил, фтор та хлор. У одному з варіантів здійснення цього винаходу у формулі I, формулі XLVI, формулі XLVII або формулі XLVIII y – 0, 1 або 2. У одному з варіантів здійснення цього винаходу у 3 2 формулі XLVII або формулі XLVIII R – водень, та R вибраний з групи, яку складають водень, алкіл, який містить 1 атом або 2 атоми вуглецю, гідроксил, алкоксигрупа, яка містить 1 атом або 2 атоми вуглецю, фтор, хлор, бром та аміногрупа. У більш конкретному варіанті здійснення 3 2 цього винаходу R – водень, та R вибраний з групи, яку складають водень, метил та метоксигрупа. У іншому варіанті здійснення цього винаходу у формулі XLVII або формулі XLVIII 2 3 R – водень, та R вибраний з групи, яку складають, алкіл, який містить 1 атом або 2 атоми 7 UA 104289 C2 5 10 15 20 вуглецю, гідроксил, алкоксигрупа, яка містить 1 атом або 2 атоми вуглецю, фтор, хлор, бром та 2 3 аміногрупа. У більш конкретному варіанті здійснення цього винаходу R – водень, та R вибраний з групи, яку складають метил та метоксигрупа. У ще одному варіанті здійснення цього 4 5 винаходу у формулі XLVIII кожний з R та R – метил або кожний з них – фтор. За варіантом, 4 5 якому віддається перевага, кожний з R та R – метил. У конкретних варіантах здійснення цього винаходу згадана сполука вибрана з групи, яку складають: 5-(3-(2,6-диметилбензилокси)феніл)-1H-тетразол; 5-(3-(2,6-диметилбензилокси)бензил)-1H-тетразол; 5-(3-(2,6-диметилбензилокси)-4-метоксибензил)-1H-тетразол; 5-(3-(2,6-диметилбензилокси)фенетил)-1H-тетразол; 5-(3-(2,6-диметилбензилокси)-4-метилбензил)-1H-тетразол; 5-(4-(2,6-дифторбензилокси)бензил)-1H-тетразол; 5-(3-(2,6-диметилбензилокси)-2-метилбензил)-1H-тетразол; та 5-(3-(2,6-диметилбензилокси)-2-метоксибензил)-1H-тетразол. У деяких варіантах здійснення цього винаходу згадана сполука знаходиться у практично (щонайменше 98 %) чистій формі. Схеми реакцій 1 Сполука формули I, де x – 1 або 2, y – 0-3, R – водень, фтор, бром, хлор, алкоксигрупа, яка містить 1 атом або 2 атоми вуглецю, або алкіл, який містить 1 атом або 2 атоми вуглецю, тобто сполуки формули: R1 H N A(CH2 )xO (CH2) y 25 30 35 40 45 50 N N N (I), де A відповідає поданому вище визначенню, можна одержати за реакцією, наведеною на 1 схемі 1. У реакції за схемою 1 A, x, y та R відповідають поданим вище визначенням. L – відщеплювана група. Сполуку формули II можна перетворити у сполуку формули V за реакцією стадії (a), застосовуючи конденсування за Міцунобу сполуки II зі сполукою III з використанням трифенілфосфіну та діетилазодикарбоксилату або діізопропілазодикарбоксилату. Цю реакцію виконують у прийнятному розчиннику, наприклад, тетрагідрофурані. Для виконання реакції стадії (a) можна застосовувати будь-які звичайні умови виконання реакцій Міцунобу. Сполуку формули V можна також одержати шляхом етерифікування або алкілування сполуки формули II сполукою формули IV як у реакції стадії (a) із використанням прийнятної основи, наприклад, карбонату калію, триетиламіну, піридину тощо. Цю реакцію виконують в апротонному розчиннику, наприклад, N,N-диметилформаміді, ацетонітрилі, дихлорметані тощо. у сполуці формули IV група L включає (але без обмеження) мезилокси-, тозилоксигрупу, хлор, бром, йод, тощо. Для виконання реакції стадії (a) можна застосовувати будь-які звичайні методи етерифікування гідроксильної групи шляхом проведення реакції з галогеном або відщеплюваною групою. Сполуку формули V можна перетворити у сполуку формули I за реакцією стадії (b) шляхом проведення реакції нітрилу з азидом, наприклад, триметилсилілазидом, або з азидом металу, наприклад, азидом натрію, азидом калію, азидом літію, причому перевага серед азидів віддається азиду натрію, у присутності кислоти Льюїса, наприклад, хлориду цинку, хлориду магнію, хлориду алюмінію, тетрахлориду олова тощо. Цю реакцію виконують у розчиннику, наприклад, N,N-диметилформаміді, при температурі у діапазоні від 80°C до 145°C протягом періоду часу від 6 год. до 60 год. В ідеальному випадку в реакції використовується проведення реакції нітрилу із сумішшю азид натрію/хлорид амонію/N,N-диметилформамід при 120°C протягом 24 год. Одержані продукти можна виділити та очистити такими способами як екстракція, випарювання, хроматографія та перекристалізація. Якщо A – феніл, заміщений однією або двома гідроксильними групами, то, як правило, перевага віддається захисту гідроксильних груп. Придатні для цього групи захисту описані в монографії Гріні "Групи захисту в органічному синтезі" (Protective Groups in Organic Synthesis by T. Greene). Групу захисту можна відщеплювати після реакції стадії (b), застосовуючи прийнятні відщеплювальні реагенти, такі як реагенти, описані у вищезазначеній монографії Гріні. Схема реакції 1 8 UA 104289 C2 Reaction Scheme 1 R1 R1 CN (a) (CH2) y A(CH2 )xO CN A-(CH2) xOH (III) (II) (CH2) y A-(CH2) xL HO (V) (IV) (b) R1 H N A(CH2 )xO (CH2) y N N N (I) 1 Сполуку формули I, де x – 1 або 2, y – 0-3, R – гідроксил, тобто сполуки формули: R1 H N A(CH2 )xO (CH2) y 5 10 15 N N N (I), де A відповідає поданому вище опису, можна одержати за реакцією, наведеною на схемі 2. У реакції за схемою 2 A, x та y відповідають поданим вище визначенням. Сполуку формули V можна перетворити у сполуку формули VI за реакцією стадії (c) шляхом оброблення сполуки формули V трибромідом бору або трихлоридом бору, застосовуючи розчинник, наприклад, дихлорметан, протягом періоду часу від 4 год. до 48 год. при температурі від -72°C до 0°C. Для виконання реакції стадії (c) можна застосовувати будь-які звичайні умови проведення таких реакцій деметилування. 1 Сполуку формули VI можна перетворити у сполуку формули I, де R – гідроксил, за реакцією стадії (d) у такий самий спосіб як описано вище для реакції стадії (b). Одержані продукти можна виділити та очистити такими способами як екстракція, випарювання, хроматографія та перекристалізація. Reactionреакції 22 Схема Scheme H3CO HO HO (c) H N (d) (CH2)y-CN (CH2) y (CH2)y -CN N N O-(CH2)x -A O-(CH2)x -A (V) 20 O-(CH2)x-A (VI) (I) 1 Сполуку формули I, де x – 1 або 2, y – 0-3, R – аміногрупа, тобто сполуки формули: 9 N UA 104289 C2 R1 H N A(CH2 )xO (CH2) y 5 10 15 20 N N N (I), де A відповідає поданому вище опису, можна одержати за реакцією, наведеною на схемі 3. У реакції за схемою 3, A, x та y відповідають поданим вище визначенням. P – відщеплювана група. Сполуку формули VII можна перетворити у сполуку формули VIII за реакцією стадії (e) у такий самий спосіб як описано вище для реакції стадії (a). Сполуку формули VIII можна перетворити у сполуку формули IX за реакцією стадії (f) шляхом відновлення нітрогрупи до аміну. Відновлювальними реагентами можуть бути метали, наприклад, Zn, Sn або Fe тощо, та кислота. Нітрогрупу можна також відновити шляхом каталітичного гідрування з одержанням аміну. Серед способів відновлення перевага віддається каталітичному гідруванню. Для виконання реакції стадії (f) можна застосовувати будь-які звичайні умови проведення таких реакцій відновлення. Сполуку формули IX можна перетворити у сполуку формули X за реакцією стадії (g) шляхом введення групи захисту аміногрупи. Придатні для цього групи захисту описані в монографії Гріні "Групи захисту в органічному синтезі" (Protective Groups in Organic Synthesis by T. Greene). Сполуку формули X можна перетворити у сполуку формули XI за реакцією стадії (h) у такий самий спосіб як описано вище для реакції стадії (b). Сполуку формули XI можна перетворити у 1 сполуку формули I, де R – аміногрупа, за реакцією стадії (i) шляхом відщеплення групи захисту аміногрупи. Прийнятні відщеплювальні реагенти можна знайти у вищезазначеній монографії Гріні. Одержані продукти можна виділити та очистити такими способами як екстракція, випарювання, хроматографія та перекристалізація. Схема реакції 3 10 UA 104289 C2 Reaction Scheme 3 O2N O2N H2N (f) (e) (CH2)y -CN (CH2)y -CN (CH2)y -CN O-(CH2)x -A OH O-(CH2)x -A (VIII) (VII) (IX) (g) PHN PHN H N (h) (CH2)y (CH2)y -CN N N N O-(CH2)x -A O-(CH2)x -A (X) (XI) (i) H2N H N (CH2)y N N N O-(CH2)x -A (I) 1 5 Сполуку формули II, де y – 1-3, R – водень, фтор, бром, хлор, алкоксигрупа, яка містить 1 атом або 2 атоми вуглецю, або алкіл, який містить 1 атом або 2 атоми вуглецю, тобто сполуки формули: 1 R CN (CH2)y HO (II) та сполуку формули VII, де y – 1-3, тобто сполуки формули: O2N (CH2)y -CN 10 15 OH (VII) 3 можна одержати за реакцією, наведеною на схемі 4. У реакції за схемою 4 R – водень, фтор, бром, хлор, нітро-, алкоксигрупа, яка містить 1 атом або 2 атоми вуглецю, або алкіл, який 2 містить 1 атом або 2 атоми вуглецю. P – група захисту гідроксилу. R алкільна група, яка містить 1 атом або 2 атоми вуглецю. Y – галоген. Сполуку формули XII можна перетворити у сполуку формули XIII за реакцією стадії (j) спочатку вводячи групи захисту карбоксильної та гідроксильної груп шляхом використання прийнятних груп захисту, таких як групи, описані в монографії Гріні "Групи захисту в органічному синтезі" (Protective Groups in Organic Synthesis by T. Greene). 11 UA 104289 C2 3 5 10 15 20 25 30 35 40 45 50 55 Сполуку формули XIII можна відновити до сполуки формули XIV, де R – водень, фтор, бром, хлор, алкоксигрупа, яка містить 1 атом або 2 атоми вуглецю, або алкіл, який містить 1 атом або 2 атоми вуглецю, з використанням звичайного відновлювального реагента, який перетворює групу складного ефіру у спирт за реакцією стадії (k). При проведенні цієї реакції перевага, як правило, віддається застосуванню алюмогідриду літію (проте без обмеження ним). Цю реакцію проводять у прийнятному розчиннику, такому як тетрагідрофуран або інший подібний розчинник. Для виконання реакції стадії (k) можна застосовувати будь-які звичайні умови проведення таких реакцій відновлення. 3 Сполуку формули XIII можна відновити до сполуки формули XIV, де R – нітрогрупа, шляхом використання відновлювального реагента, який перетворює складний ефір на спирт, проте не відновлює нітрогрупу, наприклад, BH3-THF, NaBH4-AlCl3 тощо. Для виконання реакції стадії (k) можна застосовувати будь-які звичайні умови проведення таких реакцій відновлення. Сполуку формули XIV можна перетворити у сполуку формули XV шляхом заміни гідроксильної групи на галоген, причому перевага серед галогенів віддається брому або хлору. До прийнятних галогенувальних реагентів належать (але без обмеження переліченими нижче сполуками) тіонілхлорид, оксалілхлорид, бром, трибромід фосфору, тетрабромметан тощо. Для виконання реакції стадії (l) можна застосовувати будь-які звичайні умови проведення таких реакцій галогенування. Сполуку формули XV можна перетворити у сполуку формули XVI шляхом проведення реакції сполуки XV із ціанідом лужного металу, наприклад, натрію або калію, або ціанідом міді. Цю реакцію можна проводити у прийнятному розчиннику, наприклад, диметилсульфоксиді, N,Nдиметилформаміді тощо. Для виконання реакції стадії (m) можна застосовувати будь-які звичайні умови одержання нітрилів із галогенідів. Сполуку формули XVI можна перетворити у сполуку формули XVII за реакцією стадії (n) шляхом відщеплення групи захисту гідроксилу, застосовуючи прийнятні відщеплювальні реагенти, такі як реагенти, описані в монографії Гріні "Групи захисту в органічному синтезі" (Protective Groups in Organic Synthesis by T. Greene). Сполука формули XVII є сполукою 1 формули II, де y – 1, та R – водень, фтор, бром, хлор, алкоксигрупа, яка містить 1 атом або 2 атоми вуглецю, або алкіл, який містить 1 атом або 2 атоми вуглецю. Сполука формули XVII є 3 також сполукою формули VII, де y – 1, та R – нітрогрупа. Сполуку формули XVI можна перетворити у сполуку формули XVIII за реакцією стадії (o) шляхом кислотного або основного гідролізу. При проведенні цієї реакції перевага, як правило, віддається застосуванню основного гідролізу, наприклад, із використанням водного розчину гідроксиду натрію в етанолі тощо. Для виконання реакції стадії (o) можна застосовувати будь-які звичайні умови гідролізу нітрилів до карбонових кислот. Сполуку формули XVIII можна відновити з одержанням сполуки формули XIX за реакцією стадії (p). Цю реакцію можна виконувати у такий самий спосіб як описано вище для реакції стадії (k). Сполуку формули XIX можна перетворити у сполуку формули XX за реакцією стадії (q) у такий самий спосіб як описано вище для реакції стадії (l). Сполуку формули XX можна перетворити у сполуку формули XXI за реакцією стадії (r) у такий самий спосіб як описано вище для реакції стадії (m). Сполуку формули XXI можна перетворити у сполуку формули XXII за реакцією стадії (s) у такий самий спосіб як описано вище для реакції стадії (n). 1 Сполука формули XXII є сполукою формули II, де y – 2, та R – водень, фтор, бром, хлор, алкоксигрупа, яка містить 1 атом або 2 атоми вуглецю, або алкіл, який містить 1 атом або 3 2 атоми вуглецю. Сполука формули XVII є також сполукою формули VII, де y – 2, та R – нітрогрупа. Сполуку формули XXI можна гідролізувати у такий самий спосіб як описано вище для реакції стадії (o) з одержанням сполуки формули XXIII за реакцією стадії (t). Сполуку формули XXIII можна відновити з одержанням сполуки формули XXIV за реакцією стадії (u). Цю реакцію можна виконувати у такий самий спосіб як описано вище для реакції стадії (k). Сполуку формули XXIV можна перетворити у сполуку формули XXV за реакцією стадії (v) у такий самий спосіб як описано вище для реакції стадії (l). Сполуку формули XXV можна перетворити у сполуку формули XXVI за реакцією стадії (w) у такий самий спосіб як описано вище для реакції стадії (m). Сполуку формули XXVI можна перетворити у сполуку формули XXVII за реакцією стадії (x) у такий самий спосіб як описано вище для реакції 1 стадії (n). Сполука формули XXVII є сполукою формули II, де y – 3, та R – водень, фтор, бром, хлор, алкоксигрупа, яка містить 1 атом або 2 атоми вуглецю, або алкіл, який містить 1 атом або 3 2 атоми вуглецю. Сполука формули XXVII є також сполукою формули VII, де y – 3, та R – нітрогрупа. 12 UA 104289 C2 Одержані продукти можна виділити та очистити такими способами як екстракція, випарювання, хроматографія та перекристалізація. Reactionреакції 44 Схема Scheme R3 R3 R3 (j) R3 (l) (k) CH2OH CO2R2 CO2H OP OP OH OP (XV) (XIV) (XIII) (XII) CH2Y (m) R3 R3 R3 (q) CH2CH2Y OP R3 (p) (o) CH2CH2OH CH2CO2H OP (XX) CH2CN OP OP (XVIII) (XIX) (XVI) (r) (n) R3 R3 R3 (s) CH2CH2CN OP CH2CN CH2CH2CN OH OH (XXI) (XVII) (XXII) (t) R3 R3 R3 (u) (v) CH2CH2CH2Y CH2CH2CH2OH CH2CH2CO2H OP OP OP (XXIII) (XXIV) (XXV) (w) R3 R3 (x) CH2CH2CH2CN CH2CH2CH2CN OH 5 OP (XXVII) (XXVI) 1 Сполуку формули II, де y – 0, R – водень, фтор, бром, хлор, алкоксигрупа, яка містить 1 атом або 2 атоми вуглецю, або алкіл, який містить 1 атом або 2 атоми вуглецю, тобто сполуки формули: R1 CN (CH2) y 10 HO (II) та сполуку формули VII, де y – 0, тобто сполуки формули: 13 UA 104289 C2 O2N (CH2)y -CN 5 10 15 20 25 30 35 OH (VII) 3 можна одержати за реакцією, наведеною на схемі 5. У реакції за схемою 5 R – водень, нітрогрупа, фтор, бром, хлор, алкоксигрупа, яка містить 1 атом або 2 атоми вуглецю, або алкіл, 2 який містить 1 атом або 2 атоми вуглецю. P – група захисту гідроксилу. R алкільна група, яка 4 містить 1 атом або 2 атоми вуглецю. R – H, хлор або бром. Сполуку формули XXVIII можна перетворити у сполуку формули XXIX за реакцією стадії (y) спочатку вводячи групу захисту гідроксильної групи шляхом використання прийнятних груп захисту, таких як групи, описані в монографії Гріні "Групи захисту в органічному синтезі" (Protective Groups in Organic Synthesis by T. Greene), та після цього гідролізуючи складний ефір 4 з одержанням сполуки формули XXIX, де R – H. 4 Сполуку формули XXVIII можна перетворити у сполуку формули XXIX, де R – хлор або бром, шляхом проведення реакції сполуки формули зі стадії (y) з галогенувальним реагентом, наприклад, тіонілхлоридом, пентахлоридом фосфору, трихлоридом фосфору, бромом, тетрабромметаном тощо. Для виконання реакції стадії (z) можна застосовувати будь-які звичайні умови проведення таких реакцій одержання галогенангідридів карбонових кислот. Сполуку формули XXIX можна перетворити у сполуку формули XXX за реакцією стадії (a") шляхом проведення реакції з аміаком безпосередньо або спочатку обробивши сполуку формули XXIX сполучним реагентом, наприклад, дициклогексилкарбодіімідом, гексафторфосфатом (бензотриазолілокси)трис-(диметиламіно)фосфонію, з подальшим введенням в реакцію з аміаком або подібною сполукою. Для виконання реакції стадії (a") можна застосовувати будь-які звичайні умови ацилування аміаку. Сполуку формули XXX можна перетворити у сполуку формули XXXI за реакцією стадії (b") шляхом дегідратування використовуваних реагентів, наприклад, тіонілхлориду, пентоксиду фосфору, пентахлориду фосфору, оксихлориду фосфору, тетрахлориду водню-трифенілфосфіну, ціанурхлориду тощо. Цю реакцію проводять або без застосування розчинника, або у прийнятному розчиннику, наприклад, N,N-диметилформаміді та аналогічних розчинниках. Для виконання реакції стадії (b") можна застосовувати будь-які звичайні умови проведення таких реакцій дегідрування. Сполуку формули XXXI можна перетворити у сполуку формули XXXII за реакцією стадії (c") шляхом відщеплення групи захисту гідроксилу, застосовуючи прийнятні відщеплювальні реагенти, такі як реагенти, описані у вищезазначеній монографії Гріні "Групи захисту в органічному синтезі" (Protective Groups in Organic Synthesis by T. Greene). Сполука 1формули XXXII є сполукою формули II, де y – 0, та R – водень, фтор, бром, хлор, алкоксигрупа, яка містить 1 атом або 2 атоми вуглецю, або алкіл, який містить 1 атом або 2 атоми вуглецю. 3 Сполука формули XXXII є також сполукою формули VII, де y – 0, та R – нітрогрупа. Одержані продукти можна виділити та очистити такими способами як екстракція, випарювання, хроматографія та перекристалізація. Схема реакції 5 14 UA 104289 C2 Reaction Scheme 5 R3 R3 R3 (a') (y) 2 4 CO2R CO2R CONH2 (z) OH OP OP (XXVIII) (XXIX) (XXX) (b') R3 R3 (c') CN CN OH (XXXII) 5 10 15 20 25 30 35 OP (XXXI) Сполуку формули III, де x – 1 або 2, тобто сполуки формули: A-(CH2)xOH та сполуку формули IV, де x – 1 або 2, тобто сполуки формули: A-(CH2)xL можна одержати за реакцією, наведеною на схемі 6. У реакції за схемою 6 A відповідає поданому вище визначенню. L – відщеплювана група або галоген. Сполуку формули XXXIII можна відновити до сполуки формули XXXIV за реакцією стадії (d'). Цю реакцію проводять, застосовуючи звичайний відновлювальний реагент, наприклад, гідрид лужного металу, такий як алюмогідрид літію. Цю реакцію проводять у прийнятному розчиннику, такому як тетрагідрофуран. Для виконання реакції стадії (d') можна застосовувати будь-які звичайні умови проведення таких реакцій відновлення. Сполука формули XXXIV є сполукою формули III, де x – 1. Сполуку формули XXXIV можна перетворити у сполуку формули XXXV шляхом заміни гідроксильної групи відщеплюваною групою або галогеном, причому перевага серед галогенів віддається брому або хлору. До прийнятних галогенувальних реагентів належать (але без обмеження переліченими нижче сполуками) тіонілхлорид, оксалілхлорид, бром, трибромід фосфору, тетрабромметан тощо. До відщеплюваних груп належать тозилат, мезилат тощо. Для виконання реакції стадії (e') можна застосовувати будь-які звичайні умови проведення таких реакцій. Сполука формули XXXV є сполукою формули IV, де x – 1. Сполуку формули XXXV можна перетворити у сполуку формули XXXVI шляхом проведення реакції сполуки XXXV із ціанідом лужного металу, наприклад, ціанідом натрію або калію. Цю реакцію проводять у прийнятному розчиннику, такому як етанол, диметилсульфоксид, N,Nдиметилформамід тощо. Для виконання реакції стадії (f') можна застосовувати будь-які звичайні умови одержання нітрилів. Сполуку формули XXXVI можна перетворити у сполуку формули XXXVII за реакцією стадії (g') шляхом кислотного або основного гідролізу. При проведенні цієї реакції перевага звичайно віддається застосуванню основного гідролізу, наприклад, із використанням водного розчину гідроксиду натрію. Для виконання реакції стадії (g') можна застосовувати будь-які звичайні умови гідролізу нітрилів. Сполуку формули XXXVII можна відновити з одержанням сполуки формули XXXVIII за реакцією стадії (h'). Цю реакцію можна виконувати у такий самий спосіб як описано вище для реакції стадії (d'). Сполука формули XXXVIII є сполукою формули III, де x – 2. Сполуку формули XXXVIII можна перетворити у сполуку формули XXXIX за реакцією стадії (i') у такий самий спосіб як описано вище для реакції стадії (e'). Сполука формули XXXIX є сполукою формули IV, де x – 2. Одержані продукти можна виділити та очистити такими способами як екстракція, випарювання, хроматографія та перекристалізація. Якщо A – феніл, заміщений однією або 15 UA 104289 C2 двома гідроксильними групами, то, як правило, перевага віддається захисту гідроксильної групи сполуки формули XXXIII. Придатні для цього групи захисту описані в монографії Гріні "Групи захисту в органічному синтезі" (Protective Groups in Organic Synthesis by T. Greene). Схема реакції 6 5 Reaction Scheme 6 (d') A-CO 2H (XXXIII) (e') A-CH2-OH A-CH 2-Y (XXXIV) (XXXV) (f ') (i') (h') (g') A-CH 2-CH 2-Y A-CH 2-CH 2-OH A-CH 2-CO 2H A-CH 2-CN (XXXIX) (XXXVIII) (XXXVII) (XXXVI) 3 10 Сполуку формули XXVIII, де R – водень, нітрогрупа, фтор, бром, хлор, алкоксигрупа, яка 2 містить 1 атом або 2 атоми вуглецю, або алкіл, який містить 1 атом або 2 атоми вуглецю, R – алкільна група, яка містить 1 атом або 2 атоми вуглецю, тобто сполуки формули: R 3 C O2 R2 15 20 OH (XXVIII) 2 3 можна одержати за реакцією, наведеною на схемі 7. У реакції за схемою 7 R та R відповідають поданим вище визначенням. Сполуку формули XII можна перетворити у сполуку формули XXVIII за реакцією стадії (j') шляхом естерифікування сполуки формули XII метанолом або етанолом. Реакцію можна проводити із застосуванням каталізаторів, наприклад, H2SO4, TsOH тощо, або із застосуванням зневоднювального засобу, наприклад, дициклогексилкарбодііміду та аналогічних сполук. Для виконання реакції стадії (j') можна застосовувати будь-які звичайні умови проведення таких реакцій естерифікування. Одержані продукти можна виділити та очистити такими способами як екстракція, випарювання, хроматографія та перекристалізація. Схема реакції 7 Reaction Scheme 7 R 3 R 3 (j') CO 2R 2 CO 2 H OH 25 OH (XII) (XXVIII) 3 Сполуки формули XII, де R – хлор, бром або фтор, тобто сполуки формули: R 3 CO2 H OH (XII) або є наявними на ринку, або можуть бути одержані за методиками, описаними у таких літературних джерелах: 16 UA 104289 C2 5 10 15 20 25 1. 3-Br або F-2-OHC6H3CO2H Canadian Journal of Chemistry (2001), 79(11) 1541-1545. 2. 4-Br-2-OHC6H3CO2H WO 99/16747 або JP 04154773. 3. 2-Br-6-OHC6H3CO2H JP 47039101. 4. 2-Br-3-OHC6H3CO2H WO 96/28423. 5. 4-Br-3-OHC6H3CO2H WO 2001/002388. 6. 3-Br-5-OHC6H3CO2H Journal Compounds and Radiopharmaceuticals (1992), 31 (3), 175-182. 7. 2-Br-5-OHC6H3CO2H та 3-Cl-4-OHC6H3CO2H WO 94/05153 та US 5,519,133. 8. 2-Br-4-OHC6H3CO2H та 3-Br-4-OHC6H3CO2H WO 2002/2018323. 9. 2-Cl-6-OHC6H3CO2H JP 06293700. 10. 2-Cl-3-OHC6H3CO2H Proceedings of the Indiana Academy of Science (1983), Volume date 1982, 92, 145-151. 11. 3-Cl-5-OHC6H3CO2H WO 2002/000633 та WO 2002/044145. 12. 2-Cl-5-OHC6H3CO2H WO 97/45400. 3 Сполуки формули XII, де R – алкоксигрупа, яка містить 1 атом або 2 атоми вуглецю, тобто сполуки формули: CO2 H R 30 35 40 45 50 55 3 OH (XII) 2 можна виготовити за реакцією схеми 8. У схемі реакції за схемою 8 R – алкільна група, яка містить 1 атом або 2 атоми вуглецю. P – група захисту гідроксилу. Сполуку формули XL можна перетворити у сполуку формули XLI за реакцією стадії (k') шляхом введення прийнятної групи захисту фенольної групи. Умови, придатні для введення цієї групи захисту, описані у вищезазначеній монографії Гріні (Protective Groups in Organic Synthesis by T. Greene). Сполуку формули XLI можна перетворити у сполуку формули XLII шляхом окиснення альдегіду до карбонової кислоти. Реакцію можна проводити із застосуванням прийнятних окиснювальних реагентів, наприклад, хлорхромату піридинію, перманганату калію, перманганату натрію тощо. Для виконання реакції стадії (1') можна застосовувати будь-які прийнятні умови проведення таких окиснювальних реакцій. Сполуку формули XLII можна перетворити у сполуку формули XII за реакцією стадії (m'), де 3 R – алкоксигрупа, яка містить 1 атом вуглецю, шляхом відщеплення групи захисту. Умови, придатні для відщеплення групи захисту, описані у монографії Гріні (Protective Groups in Organic Synthesis by T. Greene). Сполуку формули XLII можна перетворити у сполуку формули XLIII шляхом оброблення сполуки формули XLII трибромідом бору або трихлоридом бору із застосуванням розчинника, наприклад, дихлорметану, протягом 4-48 год. при температурі від -72°C до 0°C. Для виконання реакції стадії (n') можна застосовувати будь-які звичайні умови проведення таких реакцій деметилування. Сполуку формули XLIII можна перетворити у сполуку формули XLIV шляхом естерифікування сполуки формули XLIII метанолом або етанолом. Цю реакцію можна проводити із застосуванням каталізаторів, наприклад, H2SO4, TsOH тощо, або із застосуванням зневоднювального засобу, наприклад, дициклогексилкарбодііміду або аналогічних засобів. Для виконання реакції стадії (o') можна застосовувати будь-які звичайні умови проведення таких реакцій естерифікування. Сполуку формули XLIV можна перетворити у сполуку формули XLV шляхом етерифікування або алкілування сполуки формули XLIV етилгалогенідом із застосуванням відповідної основи, наприклад, карбонату калію, гідриду натрію, піридину тощо. Реакцію можна проводити у 17 UA 104289 C2 5 10 звичайних розчинниках, таких як тетрагідрофуран, N,N-диметилформамід, дихлорметан тощо. Реакцію, як правило, виконують при температурі від 0°C до 40°C. Для виконання реакції стадії (p') можна застосовувати будь-які прийнятні умови проведення таких реакцій алкілування. Сполуку формули XLV можна перетворити у сполуку формули XII за реакцією стадії (q'), де 3 R – алкоксигрупа, яка містить 2 атоми вуглецю, шляхом відщеплення групи захисту. Умови, придатні для відщеплення групи захисту, описані у монографії Гріні (Protective Groups in Organic Synthesis by T. Greene). Одержані продукти можна виділити та очистити такими способами як екстракція, випарювання, хроматографія та перекристалізація. Схема реакції 8 Reaction Scheme 8 (k') (m') (l') OP (XL) (XLI) CO2 R OH OP OH (XLII) 2 CO 2R (p') CO2 H 2 (o') OH OH OP OP (XLIV) (XLV) (XII) (n') OC2H 5 OP OCH3 OCH3 OCH3 OCH3 CO 2H CO 2H CHO CHO (XLIII) (q') CO2 H OC2 H5 OH (XII) 3 Сполуки формули XII, де R – алкоксигрупа, яка містить 1 атом або 2 атоми вуглецю, тобто сполуки формули: R 3 CO2 H 15 20 25 30 OH (XII) або є наявними на ринку, або можуть бути одержані за методиками, описаними у таких літературних джерелах: 1. 2-OMe-4-OHC6H3CO2H US 2001/034,343 або WO 97/25992. 2. 5-OMe-3-OHC6H3CO2H J.O.C (2001), 66(23), 7883-7888. 3. 2-OMe-5-OHC6H3CO2H US 6,194,406 (стор. 96) та Journal of the American Chemical Society (1985), 107(8), 2571-2573. 4. 3-OEt-5-OHC6H3CO2H Taiwan Kexue (1996), 49(1), 51-56. 5. 4-OEt-3-OHC6H3CO2H WO 962/6176. 6. 2-OEt-4-OHC6H3CO2H Takeda Kenkyusho Nempo (1965), 24, 221-228. JP 07070025. 18 UA 104289 C2 7. 3-OEt-4-OHC6H3CO2H WO 96/26176. 3 Сполуки формули XII, де R – алкіл, який містить 1 атом або 2 атоми вуглецю, тобто сполуки формули: R 3 CO2 H 5 10 15 20 25 30 35 40 45 50 OH (XII) або є наявними на ринку, або можуть бути одержані за методиками, описаними у таких літературних джерелах: 1. 5-Me-3-OHC6H3CO2H та 2-Me-5-OHC6H3CO2H WO 96/19437. J.O.C. 2001, 66, 7883-7888. 2. 2-Me-4-OHC6H3CO2H WO 85/03701. 3. 3-Et-2-OHC6H3CO2H та 5-Et-2-OHC6H3CO2H J. Med. Chem. (1971), 14(3), 265. 4. 4-Et-2-OHC6H3CO2H Yaoxue Xuebao (1998), 33(1), 67-71. 5. 2-Et-6-OHC6H3CO2H та 2-н-Pr-6-OHC6H3CO2H J. Chem. Soc., Perkin Trans 1 (1979), (8), 2069-2078. 6. 2-Et-3-OHC6H3CO2H JP 10087489 та WO 96/28423. 7. 4-Et-3-OHC6H3CO2H J.O.C. 2001, 66, 7883-7888. WO 95/04046. 8. 2-Et-5-OHC6H3CO2H J.A.C.S (1974), 96(7), 2121-9. 9. 2-Et-4-OHC6H3CO2H та 3-Et-4-OHC6H3CO2H JP 04282345. 10. 1. 3-Et-5-OHC6H3CO2H Адаптувати синтез, описаний у J.O.C. 2001, 66, 7883-7888, із використанням 2етилакролеїну. Застосування у способах лікування Цей винахід пропонує спосіб зниження рівня сечової кислоти в організмі пацієнта-ссавця або посилення виділення сечової кислоти з організму згаданого пацієнта-ссавця. Рівень сечової кислоти в організмі ссавця можна визначити, застосовуючи будь-які відомі способи. У типових випадках визначають рівень сечової кислоти у крові. Сечова кислота може також відкладатися або осаджуватися у тканинах, утворюючи нагромадження (наприклад, відкладення), на які може впливати підвищення або зниження концентрацій сечової кислоти у крові, і які, навпаки, можуть впливати на рівні циркулюючої сечової кислоти. Спосіб зниження рівнів сечової кислоти за цим винаходом може застосовуватися для лікування або попередження різноманітних патологічних станів, до яких належать подагра, гіперурикемія, підвищені рівні сечової кислоти, які не відповідають рівням, при яких звичайно виправданим є діагноз гіперурикемії, дисфункція нирок, камені у нирках, серцево-судинні захворювання, ризик розвитку серцево-судинного захворювання та порушення пізнавальної функції. Зниження рівнів сечової кислоти в результаті застосування сполук за цим винаходом уповільнює розвиток захворювань нирок. З'ясовано, що підвищений рівень сечової кислоти є фактором ризику серцево-судинних захворювань. Показано, що існує значна кореляція між підвищеним рівнем сечової кислоти та порушенням пізнавальної функції у літніх людей (Шретлен та ін. "Сечова кислота та пізнавальна функція у літніх людей при проживанні у будинку для людей похилого віку" – Schretlen D.J. et al., "Serum Uric Acid and Cognitive Function in Community-Dwelling Older Adults", Neuropsychology (Jan. 2007) 21(1): 136-140). Відповідно, спосіб зниження рівнів сечової кислоти за цим винаходом може застосовуватися для лікування або попередження порушень пізнавальної функції, в тому числі порушення пізнавальної функції у людей похилого віку. Добре відомо, що у людей із синдромом Леша-Найхана спостерігаються підвищені рівні сечової кислоти, і вони страждають від численних наслідків такої гіперурикемії, в тому числі від подагри. Таким чином, зниження рівнів 19 UA 104289 C2 5 10 15 20 25 30 35 40 45 50 55 60 сечової кислоти та посилення виділення сечової кислоти за цим винаходом може застосовуватися для лікування хворих із синдромом Леша-Найхана. Нормальний діапазон концентрацій сечової кислоти у крові становить від 3,4 мг/дл до 7,0 мг/дл у чоловіків, від 2,4 мг/дл до 6,0 мг/дл у жінок у передклімактеричному періоді та від 2,5 мг/дл до 5,5 мг/дл у дітей. Утворення та осадження кристалів уратів відбувається, як правило, у чоловіків при рівнях 6,6 мг/дл або вище, а y жінок при рівнях 6,0 мг/дл або вище. Це свідчить, що рівні сечової кислоти, які лежать у межах так званого нормального діапазону, можуть спричиняти негативні наслідки для здоров'я і навіть викликати подагру. Крім того, рівень, який може бути нормальним для населення в цілому, може бути підвищеним для конкретної особи. Серцево-судинні та інші ускладнення, пов'язані з підвищеними рівнями сечової кислоти, можуть виникати при її рівнях у крові, що не виходять за межі цих "нормальних" діапазонів. Тому діагноз гіперурикемії не обов'язково є передумовою сприятливої дії сполук за цим винаходом. Цей винахід охоплює лікування гіперурикемії, пов'язаної з подагрою, гіпертензією, запаленням судин, серцевою недостатністю, артеріально-венозними розладами, інфарктом міокарда, інсультом, прееклампсією, еклампсією, апное, дисфункцією нирок (в тому числі нирковою недостатністю, пізньою стадією ниркової хвороби [ESRD]), трансплантацією органів, застосуванням діуретиків, тіазидів, циклоспорину, аспірину, вітаміну С, нікотинової кислоти, леводопа (L-DOPA), цитотоксичних лікарських засобів та деяких протимікробних засобів (таких як пірозинамід), цирозом, дисфункцією щитовидної залози, дисфункцією паращитовидної залози, раком легенів, анемією, лейкемією, лімфомою, множинною мієломою, синдромом лізису пухлини, дисфункцією щитовидної або паращитовидної залоз, синдромом Леша-Найхана, курінням, споживанням алкоголю та псоріазом. Цей винахід охоплює лікування гіперурикемії, яка може спричинити подагру, утворення кристалів уратів, дисфункцію нирок, порушення діяльності трансплантату або органа після трансплантації, розлади ендотелію (такі як запалення), хронічну серцеву недостатність, артеріально-венозні розлади, прееклампсію, еклампсію, гіпертензію та порушення пізнавальної функції. У варіантах застосування способу за цим винаходом для лікування подагри зменшуються відкладення сечової кислоти у тканинах, в тому числі (але не тільки) подагричні відкладення у суглобах, знижуються також частота та тяжкість нападів подагри. Сполуки за цим винаходом можна вводити в організм будь-яким звичайним шляхом системного введення. Перевага віддається пероральному введенню. Відповідно, перевага віддається лікарським формам лікувальних засобів для перорального застосування. До інших шляхів введення, які можуть бути застосовані згідно із цим винаходом, належать ректальний, парентеральний, ін'єкційний (наприклад, внутрішньовенний, підшкірний, внутрішньом'язовий або внутрішньоочеревинний) або назальний. Подальші варіанти кожного зі способів застосування та лікування за цим винаходом включають введення в організм будь-якого з варіантів сполук, описаних вище. З міркувань уникнення надлишкової інформації опис кожної з таких сполук та кожної групи сполук не повторюється, але вони включені до цього опису варіантів застосування та способів лікування так, якби вони були описані повторно. Спосіб лікування за цим винаходом може застосовуватися для лікування як людей, так і інших ссавців. Оптимальну дозу конкретної сполуки за цим винаходом для конкретного пацієнта може визначити досвідчений клініцист в умовах клініки. У випадку перорального введення сполуку за цим винаходом, як правило, призначають дорослим людям у добовій дозі від 1 мг до 2500 мг, більша перевага віддається дозам від 1 мг до 1200 мг. За іншими варіантами здійснення цього винаходу згадану сполуку вводять в дозі від 400 мг до 1000 мг, від 600 мг до 800 мг, від 600 мг до 1000 мг, або від 100 мг до 300 мг, яка вводиться один раз або двічі на добу. Середня маса тіла дорослої людини становить 60-70 кг, отже, відповідні дози, виражені в мг/кг, становлять приблизно від 0,015 мг/кг до 42 мг/кг, від 0,015 мг/кг до 20 мг/кг, від 6,6 мг/кг до 13 мг/кг, від 10 мг/кг до 13 мг/кг, від 10 мг/кг до 16 мг/кг або від 1,67 мг/кг до 4,3 мг/кг, які вводять один раз або двічі на добу. При лікуванні дітей оптимальну дозу визначає лікар-куратор. У випадку перорального введення мишам сполуку за цим винаходом, як правило, вводять у добовій дозі від 1 мг до 300 мг сполуки на 1 кг маси тіла. Сполуку за цим винаходом можна застосовувати у комбінації з іншими лікарськими засобами, які знижують рівні сечової кислоти. У таких випадках дози сполуки за цим винаходом відповідають вказаним вище значенням. У комбінації зі сполукою за цим винаходом може застосовуватися будь-який звичайний або досліджуваний засіб для зниження рівнів сечової кислоти. Прикладами таких лікарських засобів є інгібітори ксантиноксидази, такі як алопуринол (від 100 мг/доба до 1000 мг/доба, більш типові дози від 100 мг/доба до 300 мг/доба), 20 UA 104289 C2 5 10 15 20 25 30 35 40 45 50 55 фебуксостат (від 40 мг/доба до 120 мг/доба, більш типові дози від 60 мг/доба до 80 мг/доба) та оксипуринол; Puricase/ПЕГ-уриказа (від 4 мг до 12 мг один раз на два тижні шляхом інфузії); засоби, які сприяють виведенню сечової кислоти, такі як сульфінпіразон (від 100 мг/доба до 800 мг/доба), пробенецид (500 мг/доба), лозартан (від 25 мг/доба до 200 мг/доба, більш типові дози від 50 мг/доба до 100 мг/доба), фенофібрат, JTT-552 (інгібітор URAT-1), бензбромарон (від ® 70 мг/доба до 150 мг/доба) та статини, такі як аторвастатин (LIPITOR ). Інші засоби для зниження рівнів сечової кислоти можна застосовувати у звичайних відповідних кількостях або у кількостях, зменшених порівняно зі звичайними або шляхом вживання зменшених доз такого іншого засобу, або шляхом зменшення частоти введення такого іншого засобу. Сполуки за цим винаходом можна застосовувати разом з іншими лікарськими засобами, які застосовуються для полегшення болю, пов'язаного з нападами подагри, наприклад, із нестероїдними протизапальними засобами (НСПЗЗ, NSAID), колхіцином, кортикостероїдами та іншими аналгетиками. Очікується, що в період зниження рівня сечової кислоти у крові сполуки за цим винаходом будуть спричиняти підвищення рівня сечової кислоти у сечі. З метою підвищення показника рН сечі та покращення таким чином розчинності сечової кислоти у комбінації зі сполуками за цим винаходом можна застосовувати, наприклад, цитрати або бікарбонати. В організм пацієнта можна вводити суміш сполуки за цим винаходом або її солі з одним або кількома іншими засобами, які знижують рівні сечової кислоти, аналгетиками та засобами для підвищення рН. В альтернативних варіантах сполуку за цим винаходом або її сіль не змішують з одним або кількома іншими засобами, які знижують рівні сечової кислоти, аналгетиками та засобами для підвищення рН з утворенням суміші, а вводять в організм пацієнта окремо. Якщо активні інгредієнти не змішують один з одним з утворенням єдиної суміші або композиції, то зручно постачати їх у формі набору, який включає в себе одну або кілька одиничних пероральних доз сполуки за цим винаходом, одну або кілька одиничних пероральних доз одного або кількох інших засобів, які знижують рівні сечової кислоти, аналгетиків та засобів для підвищення рН, а також інструкції із застосування сполуки за цим винаходом у комбінації з іншими активними інгредієнтами. Перевага віддається спільному пакуванню компонентів набору, наприклад, у коробці або блістерній упаковці. Фармацевтичні композиції Цей винахід пропонує фармацевтичну композицію, яка містить сполуку за цим винаходом та факультативно фармацевтично прийнятний носій. Подальші варіанти фармацевтичних композицій за цим винаходом містять будь-який з варіантів здійснення описаних вище сполук. З міркувань уникнення непотрібної надлишкової інформації, кожна така сполука та група сполук не описані повторно, але мається на увазі, що вони включені до цього опису фармацевтичних композицій так, якби вони були б включені в разі повторення їх опису. Перевага віддається композиціям, пристосованим для перорального застосування, наприклад, у формі таблеток, таблеток, покритих оболонкою, драже, твердих або м'яких желатинових капсул, розчинів, емульсій або суспензій. Як правило, композиція для перорального застосування містить від 1 мг до 2500 мг, за варіантом, якому віддається більша перевага, від 1 мг до 1200 мг сполуки за цим винаходом. За більш конкретними варіантами здійснення цього винаходу згадана композиція для перорального застосування містить від 400 мг до 1000 мг, від 600 мг до 800 мг, від 600 мг до 1000 мг, або від 100 до 300 мг сполуки за цим винаходом. Для пацієнта зручно проковтнути одну або дві таблетки, таблетки, покриті оболонкою, драже або желатинові капсули на добу. Однак згадана композиція може бути пристосована для введення в організм будь-яким іншим звичайним способом системного введення, в тому числі ректальним, наприклад, у формі супозиторіїв, парентеральним, наприклад, у формі розчинів для ін'єкцій, або назальним. Для виготовлення фармацевтичних композицій активні інгредієнти можна переробляти разом із фармацевтично інертними неорганічними або органічними носіями. Наприклад, як носії для таблеток, таблеток, покритих оболонкою, драже та твердих желатинових капсул можна застосовувати лактозу, кукурудзяний крохмаль або його похідні, тальк, стеаринову кислоту або її солі тощо. Прийнятними носіями для м'яких желатинових капсул є, наприклад, рослинні олії, воски, жири, напівтверді та рідкі поліоли тощо. Однак, у зв'язку з природою активного інгредієнта, у випадку м'яких желатинових капсул, як правило, не потрібні будь-які носії, окрім самого м'якого желатину. Прийнятними носіями для виготовлення розчинів та сиропів є, наприклад, вода, поліоли, гліцерин, рослинні олії тощо. Для супозиторіїв придатними носіями є, наприклад, природні або гідрогенізовані олії, воски, жири, напівтверді або рідкі поліоли тощо. 21 UA 104289 C2 5 Крім того, фармацевтичні композиції можуть містити консерванти, солюбілізатори, стабілізатори, змочувачі, емульгатори, підсолоджувачі, барвники, ароматизатори, солі для регулювання осмотичного тиску, буферні сполуки, покривні речовини або антиоксиданти. Винахід буде більш зрозумілим при розгляді поданих нижче прикладів, які ілюструють описаний винахід, але не обмежують його обсяг. Приклади Приклад 1 CH 3 O CH 3 N HN N N 10 15 20 25 30 5-(3-(2,6-диметилбензилокси)феніл)-1H-тетразол Стадія A: Одержання 3-(2,6-диметилбензилокси)бензонітрилу: Розчин 2,6-диметилбензилового спирту (6,27 г, 46,1 ммоль) та діізопропілазодикарбоксилату (DIAD, 9,24 г, 45,7 ммоль) у безводному THF (30 мл) додавали краплями до розчину 3гідроксибензонітрилу (5 г, 37 ммоль) та трифенілфосфіну (TPP, 11,99 г, 45,7 ммоль) у THF (100 мл) при 0°C. Реакційну суміш нагрівали до кімнатної температури протягом 4 год. або до повного витрачання вихідного матеріалу, розводили діетиловим ефіром, та промивали водою (двічі). Органічний шар сушили над Na2SO4, фільтрували, концентрували, очищали флешхроматографією на колонці із силікагелем (елюент гексан:етилацетат, 2:1), та одержували вказану в заголовку сполуку у вигляді білої твердої речовини. Стадія B: Одержання 5-(3-(2,6-диметилбензилокси)феніл)-1H-тетразолу: Суміш 3-(2,6-диметилбензилокси)бензонітрилу (Стадія A, 3 г, 11,8 ммоль), азиду натрію (0,847 г, 13 ммоль) та хлориду амонію (0,697 г, 13 ммоль) у безводному диметилформаміді (30 мл) нагрівали у атмосфері аргону при 110°C протягом 14 год. або до повного витрачання вихідного матеріалу. До реакційної суміші додавали воду до розчинення всіх твердих речовин; одержаний розчин виливали у розсіл, та екстрагували етилацетатом (двічі). Об'єднані органічні шари промивали розсолом, сушили над Na2SO4, фільтрували, концентрували, очищали флешхроматографією на колонці із силікагелем (елюент хлороформ:метанол, 95:5), та одержували вказану в заголовку сполуку у вигляді білої твердої речовини. 1 H ЯМР (400 МГц, (CD3)2SO): 2,4 (s, 6H); 5,15 (s, 2H); 7,1 (d, 2H); 7,15 (m, 1H); 7,3 (dd, 1H); 7,5 (t, 1H); 7,65 (m, 1H); 7,7 (m, 1H). Приклад 2 CH 3 O CH 3 N HN N N 35 40 5-(3-(2,6-диметилбензилокси)бензил)-1H-тетразол Стадія A: Одержання 2-(3-гідроксифеніл)ацетонітрилу: До розчину 2-(3-метоксифеніл)ацетонітрилу (3,6 г, 25,4 ммоль) у безводному дихлорметані (20 мл) додавали BBr3 (55 мл, 1M розчин у CH2Cl2, 55 ммоль) при -78°C у атмосфері аргону. Реакційну суміш нагрівали до температури навколишнього середовища протягом 48 год., гасили подрібненим льодом, та екстрагували дихлорметаном. Органічний шар сушили над Na2SO4, фільтрували, концентрували, очищали флеш-хроматографією на колонці із силікагелем (елюент CH2Cl2:етилацетат, 4:1), та одержували вказану в заголовку сполуку у вигляді масла. Стадія B: Одержання 2-(3-(2,6-диметилбензилокси)феніл)ацетонітрилу: Розчин 2-(3-гідроксифеніл)ацетонітрилу (Стадія A, 5 г, 37 ммоль) та діізопропілазодикарбоксилату (DIAD, 3,38 г, 16,7 ммоль) у безводному THF (20 мл) додавали краплями до розчину 2,6-диметилбензилового спирту (2,25 г, 16,5 ммоль) та трифенілфосфіну 22 UA 104289 C2 5 10 15 (TPP, 4,3 г, 16,4 ммоль) у THF (30 мл) при 0°C у атмосфері аргону. Реакційну суміш перемішували при кімнатній температурі протягом 16 год. або до повного витрачання вихідного матеріалу. Додавали до суміші силікагель (25 г), розчинники видаляли під зниженим тиском, завантажували залишок у колонку із силікагелем, елюювали сумішшю дихлорметан:гексан (1:1), та одержували світло-жовту кристалічну тверду речовину. Стадія C: Одержання 5-(3-(2,6-диметилбензилокси)бензил)-1H-тетразолу: Суміш 2-(3-(2,6-диметилбензилокси)феніл)ацетонітрилу (Стадія B, 3,2 г, 12,7 ммоль), азиду натрію (1,28 г, 16,7 ммоль) та хлориду амонію (1,08 г, 20,2 ммоль) у безводному диметилформаміді (30 мл) нагрівали у атмосфері аргону при 90°C протягом 9 год. або до повного витрачання вихідного матеріалу, та реакційну суміш концентрували під зниженим тиском (двічі), сушили над Na2SO4, фільтрували, концентрували, очищали флешхроматографією на колонці із силікагелем (елюент дихлорметан:метанол, 9:1), та одержували маслянистий продукт. Одержане масло перемішували із сумішшю етилацетат:гексан (1:2) протягом 10 хв, тверду речовину відфільтровували, та одержували продукт у вигляді білої твердої речовини. 1 H ЯМР (400 МГц, (CD3)2SO): 2,3 (s, 6H); 4,25 (s, 2H); 5,15 (s, 2H); 6,84 (d, 1H); 6,96 (m, 2H); 7,08 (d, 2H); 7,18 (m, 1H); 7,28 (m, 1H). Приклад 3 O CH3 O H N CH3 N N 20 25 30 35 40 45 50 N 5-(3-(2,6-диметилбензилокси)-4-метоксибензил)-1H-тетразол Стадія A: Одержання етил-3-гідрокси-4-метоксибензоату: Розчин 3-гідрокси-4-метоксибензойної кислоти (25 г, 148,67 ммоль) та моногідрату птолуолсульфонової кислоти (3,17 г, 16,66 ммоль) у абсолютному етанолі (300 мл) нагрівали зі зворотним холодильником протягом 6 год. або до повного витрачання вихідного матеріалу. Реакційну суміш концентрували, розводили EtOAc (60 мл), та промивали водою (20 мл). Органічний шар сушили над Na2SO4, фільтрували, концентрували, очищали флешхроматографією на колонці із силікагелем (елюент гексан:етилацетат, 2:1), та одержували вказану в заголовку сполуку. Стадія B: Одержання етил-3-(2,6-диметилбензилокси)-4-метоксибензоату: Розчин етил-3-гідрокси-4-метоксибензоату (Стадія A, 9,10 г, 46,4 ммоль) та діізопропілазодикарбоксилату (DIAD, 10,23 г, 50 ммоль) у безводному THF (20 мл) додавали краплями до розчину 2,6-диметилбензилового спирту (6,94 г, 51 ммоль) та трифенілфосфіну (TPP, 13,27 г, 50 ммоль) у безводному THF (60 мл) при 0°C у атмосфері аргону. Реакційну суміш нагрівали до кімнатної температури протягом 4 год. або до повного витрачання вихідного матеріалу, розводили діетиловим ефіром, та промивали водою (двічі). Органічний шар сушили над Na2SO4, фільтрували, концентрували, очищали флеш-хроматографією на колонці із силікагелем (елюент гексан:етилацетат, 2:1), та одержували вказану в заголовку сполуку. Стадія C: Одержання (3-(2,6-диметилбензилокси)-4-метоксифеніл)-метанолу: До розчину етил-3-(2,6-диметилбензилокси)-4-метоксибензоату (Стадія B, 6,04 г, 19,23 ммоль) у безводному THF (30 мл) додавали краплями LiAlH4 (1M розчин у THF, 0,803 г, 21,16 ммоль) при 0°C у атмосфері аргону. Реакційну суміш перемішували протягом 4 год. або до повного витрачання вихідного матеріалу, після чого повільно гасили 0,1-н. розчином HCl, та додавали до реакційної суміші EtOAc (20 мл). Реакційну суміш фільтрували, та осад промивали EtOAc (25 мл, двічі). Об'єднані органічні шари промивали 0,1-н. розчином HCl, розсолом, сушили над Na2SO4, фільтрували, концентрували, очищали флеш-хроматографією на колонці із силікагелем (елюент гексан:етилацетат, 4:1), та одержували вказану в заголовку сполуку. Стадія D: Одержання 2-((5-(бромметил)-2-метоксифенокси)метил)-1,3-диметилбензолу: До розчину (3-(2,6-диметилбензилокси)-4-метоксифеніл)метанолу (Стадія C, 5,23 г, 20,4 ммоль) та CBr4 (10,16 г, 30,6 ммоль) у безводному CH2Cl2 (20 мл) додавали порціями трифенілфосфін (8,03 г, 30,64 ммоль) при 0°C. Реакційну суміш перемішували протягом 1,5 год., фільтрували, концентрували, очищали флеш-хроматографією на колонці із силікагелем (елюент гексан:етилацетат, 2:1), та одержували вказану в заголовку сполуку. 23 UA 104289 C2 1 5 10 15 20 H ЯМР (400 МГц, (CDCl3): 2,43 (s, 6H); 3,83 (s, 3H); 4,53 (s, 2H); 5,08 (s, 2H); 6,84 (d, 1H); 7,07,03 (dd, 1H); 7,06-7,09 (m, 3H); 7,14-7,18 (m, 1H). Стадія E: Одержання 2-(3-(2,6-диметилбензилокси)-4-метоксифеніл)-ацетонітрилу: Розчин 2-((5-(бромметил)-2-метоксифенокси)метил)-1,3-диметилбензолу (Стадія D, 3,28 г, 9,7 ммоль) та NaCN (0,624 г, 12,7 ммоль) у безводному DMF (20 мл) витримували при 120°C протягом 2,5 год., після чого охолоджували, та розводили EtOAc (50 мл). Органічний шар промивали водою (30 мл), розсолом, сушили над Na2SO4, фільтрували, концентрували, очищали флеш-хроматографією на колонці із силікагелем (елюент гексан:етилацетат, 2:1), та одержували вказану в заголовку сполуку. Стадія F: Одержання 5-(3-(2,6-диметилбензилокси)-4-метоксибензил)-1H-тетразолу: Суміш 2-(3-(2,6-диметилбензилокси)-4-метоксифеніл)ацетонітрилу (Стадія E, 2,17 г, 7,5 ммоль), азиду натрію (0,590 г, 9,1 ммоль) та хлориду амонію (0,486 г, 9,1 ммоль) у безводному DMF (20 мл) витримували при 90°C у атмосфері аргону протягом 16 год. або до повного витрачання вихідного матеріалу, реакційну суміш охолоджували, розводили водою, та екстрагували EtOAc (30 мл, чотири рази). Об'єднані органічні шари промивали розсолом, сушили над Na2SO4, фільтрували, концентрували, очищали флеш-хроматографією на колонці із силікагелем (елюент хлороформ:метанол, 95:5), та одержували напівтвердий продукт. Одержану напівтверду речовину перемішували із сумішшю етилацетат:гексан (1:2, 15 мл) протягом 10 хв, фільтрували, та одержували продукт у вигляді білої твердої речовини. 1 H ЯМР (400 МГц, (CD3)2SO): 2,3 (s, 6H); 3,68 (s, 3H); 4,22 (s, 2H); 4,98 (s, 2H); 6,78-6,81 (dd, + 1H); 6,91-6,93 (d, 1H); 7,05-7,07 (d, 2H); 7,13-7,16 (m, 2H). MS: m/z 325,2 [M+H] . Приклад 4 CH3 O CH3 NH N N N 25 30 35 40 45 50 5-(3-(2,6-диметилбензилокси)фенетил)-1H- тетразол Стадія A: Одержання 3-(3-метоксифеніл)пропаннітрилу: Розчин 1-(2-брометил)-3-метоксибензолу (10 г, 46,4 ммоль), NaCN (2,73 г, 55,8 ммоль) у безводному DMF (20 мл) витримували при 90°C протягом 6 год. або до повного витрачання вихідного матеріалу, реакційну суміш охолоджували, розводили EtOAc (60 мл), та промивали водою (20 мл, тричі), розсолом, органічний шар сушили над Na 2SO4, фільтрували, концентрували, очищали флеш-хроматографією на колонці із силікагелем (елюент гексан:етилацетат, 2:1), та одержували вказану в заголовку сполуку у вигляді масла. Стадія B: Одержання 3-(3-гідроксифеніл)пропаннітрилу: До перемішуваного розчину 3-(3-метоксифеніл)пропаннітрилу (Стадія A, 1,71 г, 10,6 ммоль) у безводному CH2Cl2 (20 мл) додавали BBr3 (1M розчин у CH2Cl2, 5,32 г, 21,2 ммоль) при -78°C у атмосфері аргону. Реакційну суміш перемішували при цій самій температурі протягом 2 год., та потім при 0°C протягом 4 год. або до повного витрачання вихідного матеріалу, гасили льодом, екстрагували EtOAc (30 мл, тричі), об'єднані органічні шари ретельно промивали насиченим розчином NaHCO3, розсолом, сушили над Na2SO4, фільтрували, концентрували, очищали флеш-хроматографією на колонці із силікагелем (елюент гексан:етилацетат, 2:1), та одержували вказану в заголовку сполуку. Стадія C: Одержання 3-(3-(2,6-диметилбензилокси)феніл)пропаннітрилу: Розчин 3-(3-гідроксифеніл)пропаннітрилу (Стадія B, 1,25 г, 8,5 ммоль) та діізопропілазодикарбоксилату (DIAD, 1,87 г, 9,26 ммоль) у безводному THF (10 мл) додавали краплями до розчину 2,6-диметилбензилового спирту (1,27 г, 9,3 ммоль) та трифенілфосфіну (TPP, 2,43 г, 9,26 ммоль) у безводному THF (30 мл) при 0°C у атмосфері аргону. Реакційну суміш нагрівали до кімнатної температури протягом 4 год. або до повного витрачання вихідного матеріалу, розводили діетиловим ефіром, та промивали водою (двічі). Органічний шар сушили над Na2SO4, фільтрували, концентрували, очищали флеш-хроматографією на колонці із силікагелем (елюент гексан:етилацетат, 2:1), та одержували вказану в заголовку сполуку. Стадія D: Одержання 5-(3-(2,6-диметилбензилокси)фенетил)-1H-тетразолу: Суміш 3-(3-(2,6-диметилбензилокси)феніл)пропаннітрилу (Стадія C, 2,62 г, 9,9 ммоль), азиду натрію (0,899 г, 13,8 ммоль) та хлориду амонію (0,740 г, 13,8 ммоль) у безводному DMF (20 мл) 24 UA 104289 C2 5 10 нагрівали у атмосфері аргону при 90°C протягом 16 год. або до повного витрачання вихідного матеріалу, реакційну суміш охолоджували, розводили водою, та екстрагували EtOAc (30 мл, чотири рази). Об'єднані органічні шари промивали розсолом, сушили над Na 2SO4, фільтрували, концентрували, очищали флеш-хроматографією на колонці із силікагелем (елюент хлороформ:метанол, градієнт 95:592,5:7,5), та одержували напівтвердий продукт. Одержану напівтверду речовину перемішували із сумішшю етилацетат:гексан (1:2, 15 мл) протягом 10 хв, фільтрували, та одержували продукт у вигляді білої твердої речовини. 1 H ЯМР (400 МГц, (CD3)2SO): 2,48 (s, 6H); 3,02 (t, 2H); 3,19 (t, 2H); 4,98 (s, 2H); 6,80-6,81 (d, + 1H); 6,86-6,89 (m, 2H); 7,05-7,07 (d, 2H); 7,14-7,23 (m, 2H). MS: m/z 309,2 [M+H] . Приклад 5 CH3 O H N CH3 N N 15 20 25 30 35 40 N 5-(3-(2,6-диметилбензилокси)-4-метилбензил)-1H-тетразол Стадія A: Одержання 2-(3-гідрокси-4-метилфеніл)ацетонітрилу: До перемішуваного розчину 2-(3-метокси-4-метилфеніл)ацетонітрилу (5 г, 31 ммоль) у безводному CH2Cl2 (20 мл) додавали краплями BBr3 (1M розчин у CH2Cl2, 10,02 г, 40 ммоль) при -78°C у атмосфері аргону. Реакційну суміш перемішували при цій самій температурі протягом 2 год., після чого при 0°C протягом 5 год. або до повного витрачання вихідного матеріалу, гасили льодом, екстрагували EtOAc (30 мл, тричі), об'єднані органічні шари ретельно промивали насиченим NaHCO3, розсолом, сушили над Na2SO4, фільтрували, концентрували, очищали флеш-хроматографією на колонці із силікагелем (елюент гексан:етилацетат, 4:1CH2Cl2:гексан, 1:1), та одержували вказану в заголовку сполуку у вигляді злегка забарвленої твердої речовини. Стадія B: Одержання 2-(3-(2,6-диметилбензилокси)-4-метилфеніл)-ацетонітрилу: До перемішуваного розчину 2-(3-гідрокси-4-метилфеніл)ацетонітрилу (Стадія A, 2,18 г, 14,8 ммоль), K2CO3 (2,66 г, 19,2 ммоль) у безводному DMF (20 мл) додавали 2,6диметилбензилхлорид (2,97 г, 19,2 ммоль) при кімнатній температурі у атмосфері аргону. Реакційну суміш перемішували протягом 16 год., розводили EtOAc (40 мл), та промивали водою (20 мл) та розсолом. Органічний шар сушили над Na2SO4, фільтрували, концентрували, очищали флеш-хроматографією на колонці із силікагелем (елюент гексан:етилацетат, 2:1), та одержували вказану в заголовку сполуку у вигляді білої твердої речовини. Стадія C: Одержання 5-(3-(2,6-диметилбензилокси)-4-метилбензил)-1H-тетразолу: Суміш 2-(3-(2,6-диметилбензилокси)-4-метилфеніл)ацетонітрилу (Стадія B, 1,12 г, 4,2 ммоль), азиду натрію (0,400 г, 6,1 ммоль) та хлориду амонію (0,350 г, 6,5 ммоль) у безводному DMF (15 мл) витримували у атмосфері аргону при 90°C протягом 16 год. або до повного витрачання вихідного матеріалу, реакційну суміш охолоджували, розводили водою, та екстрагували EtOAc (30 мл, чотири рази). Об'єднані органічні шари промивали розсолом, сушили над Na2SO4, фільтрували, концентрували, очищали флеш-хроматографією на колонці із силікагелем (хлороформ:метанол 95:592,5:7,5), та одержували напівтвердий продукт. Одержану напівтверду речовину перемішували із сумішшю етилацетат:гексан (1:2, 15 мл) протягом 10 хв, фільтрували, та одержували продукт у вигляді білої твердої речовини. 1 H ЯМР (400 МГц, (CD3)2SO): 2,0 (s, 3H); 2,35 (s, 6H); 4,27 (s, 2H); 5,0 (s, 2H); 6,73-6,75 (dd, + 1H); 7,08-7,1 (m, 3H); 7,15-7,19 (m, 2H). MS: m/z 309,2 [M+H] . Приклад 6 F N O N HN N F 45 5-(4-(2,6-дифторбензилокси)бензил)-1H-тетразол Стадія A: Одержання 2-(4-(2,6-дифторбензилокси)феніл)ацетонітрилу: До розчину 2-(4-гідроксифеніл)ацетонітрилу (5 г, 37,5 ммоль) та K2CO3 (6,74 г, 48,8 ммоль) у безводному DMF (20 мл) додавали 2,6-дифторбензилбромід (7,77 г, 37,5 ммоль). Реакційну суміш перемішували протягом 4 год. при кімнатній температурі, та концентрували у вакуумі. 25 UA 104289 C2 5 10 15 Неочищений залишок розчиняли в EtOAc, та промивали водою та розсолом. Водний шар промивали ще один раз EtOAc. Об'єднані органічні шари сушили над Na 2SO4, фільтрували, концентрували, та одержували вказану в заголовку сполуку у вигляді білої твердої речовини. 1 H ЯМР (270 МГц, CDCl3): 3,65 (s, 2H); 5,1 (s, 2H); 6,9-7,0 (m, 4H); 7,2-7,4 (m, 3H). Стадія B: Одержання 5-(4-(2,6-дифторбензилокси)бензил)-1H-тетразолу: Суміш 2-(4-(2,6-дифторбензилокси)феніл)ацетонітрилу (Стадія A, 5 г, 19,3 ммоль), азиду натрію (1,3 г, 20 ммоль) та хлориду амонію (1,06 г, 20 ммоль) у безводному DMF (60 мл) витримували при 90°C протягом 16 год. Розчинник видаляли у вакуумі, а одержаний маслянистий залишок розподіляли між EtOAc та водою (підкисленою до pH 1 доданням концентрованої HCl). Органічний шар промивали водою, сушили над Na 2SO4, фільтрували, концентрували, та одержували коричневу напівтверду речовину. Очищали флешхроматографією на колонці із силікагелем (елюент хлороформ:метанол, 9:1), та одержували вказану в заголовку сполуку у вигляді світло-кремової твердої речовини. 1 H ЯМР (270 МГц, CDCl3): 4,0 (s, 2H); 5,1 (s, 2H); 6,7-6,9 (m, 4H); 7,0 (d, 2H); 7,2 (m, 1H). Приклад 7 CH3 O H N CH3 N N 20 25 30 35 40 45 50 N 5-(3-(2,6-диметилбензилокси)-2-метилбензил)-1H-тетразол Стадія A: Одержання етил-3-гідрокси-2-метилбензоату: Розчин 3-гідрокси-2-метилбензойної кислоти (5,04 г, 33,12 ммоль) та моногідрату птолуолсульфонової кислоти (0,741 г, 3,89 ммоль) у абсолютному етанолі (150 мл) нагрівали зі зворотним холодильником протягом 16 год. або до повного витрачання вихідного матеріалу. Реакційну суміш концентрували, розводили EtOAc (30 мл), та промивали водою (20 мл). Органічний шар сушили над Na2SO4, фільтрували, концентрували, та очищали флешхроматографією на колонці із силікагелем (елюент гексан:етилацетат, 2:1), та одержували вказану в заголовку сполуку. Стадія B: Одержання етил-3-(2,6-диметилбензилокси)-2-метилбензоату: До перемішуваного розчину етил-3-гідрокси-2-метилбензоату (Стадія A, 3,1 г, 17,22 ммоль) та K2CO3 (3,09 г, 22,38 ммоль) у безводному DMF (15 мл) додавали 2,6-диметилбензилхлорид (3,19 г, 20,66 ммоль) при кімнатній температурі в атмосфері аргону. Реакційну суміш перемішували протягом 16 год., розводили EtOAc (40 мл), промивали водою (20 мл) та розсолом. Органічний шар сушили над Na2SO4, фільтрували, концентрували, очищали флешхроматографією на колонці із силікагелем (елюент гексан:етилацетат, 4:1), та одержували вказану в заголовку сполуку у вигляді білої твердої речовини. Стадія C: Одержання (3-(2,6-диметилбензилокси)-2-метилфеніл)метанолу: До розчину етил-3-(2,6-диметилбензилокси)-2-метилбензоату (Стадія B, 5,94 г, 19,93 ммоль) у безводному THF (35 мл) додавали краплями LiAlH4 (1M розчин у THF, 0,832 г, 21,92 ммоль) при 0°C у атмосфері аргону. Реакційну суміш перемішували протягом 4 год. або до повного витрачання вихідного матеріалу, після чого повільно гасили 0,1-н. розчином HCl при 0°C, та додавали до реакційної суміші EtOAc (20 мл). Реакційну суміш фільтрували, та осад промивали EtOAc (25 мл, двічі). Об'єднані органічні шари промивали 0,1-н. розчином HCl, розсолом, сушили над Na2SO4, фільтрували, концентрували, очищали флеш-хроматографією на колонці із силікагелем (елюент гексан:етилацетат, 2:1), та одержували вказану в заголовку сполуку. Стадія D: Одержання 1-(бромметил)-3-(2,6-диметилбензилокси)-2-метилбензолу: До розчину (3-(2,6-диметилбензилокси)-2-метилфеніл)метанолу (Стадія C, 3,68 г, 14,37 ммоль) та CBr4 (5,25 г, 15,8 ммоль) у безводному CH2Cl2 (20 мл) додавали порціями при 0°C трифенілфосфін (4,14 г, 15,8 ммоль). Реакційну суміш перемішували протягом 4 год., фільтрували, концентрували, очищали флеш-хроматографією на колонці із силікагелем (елюент гексан:етилацетат, 4:1), та одержували вказану в заголовку сполуку. Потім одержану тверду речовину витримували у вакуумі протягом 6 год. до повного висихання. Стадія E: Одержання 2-(3-(2,6-диметилбензилокси)-2-метилфеніл)-ацетонітрилу: Розчин 1-(бромметил)-3-(2,6-диметилбензилокси)-2-метилбензолу (Стадія D, 4,28 г, 13,41 ммоль) та NaCN (0,789 г, 16,10 ммоль) у безводному DMF (20 мл) нагрівали при 120°C протягом 3 год., після чого охолоджували, та розводили EtOAc (50 мл). Органічний шар промивали водою (30 мл), розсолом, сушили над Na2SO4, фільтрували, концентрували, 26 UA 104289 C2 5 10 15 очищали флеш-хроматографією на колонці із силікагелем (елюент гексан:етилацетат, 4:1), та одержували вказану в заголовку сполуку. Стадія F: Одержання 5-(3-(2,6-диметилбензилокси)-2-метилбензил)-1H-тетразолу: Суміш 2-(3-(2,6-диметилбензилокси)-2-метилфеніл)ацетонітрилу (Стадія E, 2,70 г, 10,19 ммоль), азиду натрію (0,795 г, 12,23 ммоль) та хлориду амонію (0,653 г, 12,22 ммоль) у безводному DMF (20 мл) витримували у атмосфері аргону при 90°C протягом 16 год. або до повного витрачання вихідного матеріалу, реакційну суміш охолоджували, розводили водою, та екстрагували EtOAc (30 мл, чотири рази). Об'єднані органічні шари промивали розсолом, сушили над Na2SO4, фільтрували, концентрували, очищали флеш-хроматографією на колонці із силікагелем (елюент хлороформ:метанол, 92,5:7,5), та одержували напівтвердий продукт. Цю напівтверду речовину перемішували із сумішшю етилацетат:гексан (1:2, 15 мл) протягом 10 хв, фільтрували, та одержували продукт у вигляді білої твердої речовини. 1 H ЯМР (400 МГц, (CD3)2SO): 2,01 (s, 3H); 2,32 (s, 6H); 4,24 (s, 2H); 5,01 (s, 2H); 6,78-6,79 (dd, 1H); 7,06-7,08 (d, 2H); 7,12-7,19 (m, 3H). Приклад 8 CH3 O H N CH3 O N CH3 20 25 30 35 40 45 50 N N 5-(3-(2,6-диметилбензилокси)-2-метоксибензил)-1H-тетразол Стадія A: Одержання 3-(2,6-диметилбензилокси)-2-метоксибензальдегіду: Розчин 3-гідрокси-2-метоксибензальдегіду (5,06 г, 32,7 ммоль), 2,6-диметилбензилхлориду (5,04 г, 33,1 ммоль) та K2CO3 (4,78 г, 34,6 ммоль) у безводному DMF (15 мл) перемішували при кімнатній температурі у атмосфері аргону протягом 16 год., після чого розводили EtOAc (40 мл), та промивали водою (20 мл). Органічний шар концентрували, та очищали флешхроматографією на колонці із силікагелем (елюент гексан:етилацетат, 4:1), та одержували вказану в заголовку сполуку у вигляді злегка забарвленої твердої речовини. Стадія B: Одержання (3-(2,6-диметилбензилокси)-2-метоксифеніл)-метанолу: До розчину 3-(2,6-диметилбензилокси)-2-метоксибензальдегіду (Стадія B, 10,6 г, 32,7 ммоль) у безводному THF (40 мл) додавали краплями LiAlH4 (1M розчин у THF, 0,95 г, 23,7 ммоль) при 0°C у атмосфері аргону. Реакційну суміш перемішували протягом 1 год. або до повного витрачання вихідного матеріалу, потім гасили повільним доданням води, після чого до реакційної суміші додавали 1-н. розчин HCl (5 мл), воду (10 мл) та EtOAc (20 мл). Реакційну суміш концентрували, пропускали через коротку колонку із силікагелем, застосовуючи як елюент етилацетат, та одержували вказану в заголовку сполуку у вигляді злегка забарвленої твердої речовини. Стадія C: Одержання 3-(2,6-диметилбензилокси)-2-метоксибензилметансульфонату: До розчину (3-(2,6-диметилбензилокси)-2-метоксифеніл)метанолу (Стадія B, 9,5 г, 32,7 ммоль) та триетиламіну (5,80 г, 57,4 ммоль) у безводному CH2Cl2 (100 мл) додавали краплями метансульфонілхлорид (3,5 мл, 45 ммоль) при 0°C у атмосфері аргону. Реакційну суміш нагрівали до кімнатної температури протягом 6 год. або до повного витрачання вихідного матеріалу, нейтралізували охолодженим 10 % розчином Na2CO3, та екстрагували CH2Cl2. Органічний шар концентрували, очищали флеш-хроматографією на колонці із силікагелем (елюент гексан:метиленхлорид, 2:1), та одержували вказану в заголовку сполуку у вигляді світло-жовтого масла. Стадія D: Одержання 2-(3-(2,6-диметилбензилокси)-2-метоксифеніл)-ацетонітрилу: Одержаний розчин 3-(2,6-диметилбензилокси)-2-метоксибензил-метансульфонату (Стадія C, 8,8 г, 30,26 ммоль) та NaCN (1,60 г, 32,6 ммоль) у безводному DMF (40 мл) нагрівали при 85°C протягом 18 год., після чого охолоджували, та розводили EtOAc (50 мл). Органічний шар промивали водою (30 мл), концентрували, пропускали через коротку колонку із силікагелем, застосовуючи як елюент дихлорметан, та одержували вказану в заголовку сполуку у вигляді жовтої твердої речовини. Стадія E: Одержання 5-(3-(2,6-диметилбензилокси)-2-метоксибензил)-1H-тетразолу: Суміш 2-(3-(2,6-диметилбензилокси)-2-метоксифеніл)ацетонітрилу (Стадія D, 3,2 г, 12,7 ммоль), азиду натрію (0,86 г, 13,2 ммоль) та хлориду амонію (0,696 г, 13,0 ммоль) у безводному DMF (10 мл) витримували у атмосфері аргону при 90°C протягом 16 год. або до повного витрачання вихідного матеріалу, реакційну суміш охолоджували, концентрували під 27 UA 104289 C2 5 10 15 20 25 30 35 40 45 50 55 60 зниженим тиском, очищали флеш-хроматографією на колонці із силікагелем (елюент хлороформ:метанол, 9:1), та одержували напівтвердий продукт. Цю напівтверду речовину перемішували із сумішшю етилацетат:гексан (1:2, 15 мл) протягом 10 хв, фільтрували, та одержували продукт у вигляді білої твердої речовини. 1 H ЯМР (400 МГц, (CD3)2SO): 2,33 (s, 6H); 3,5 (s, 3H); 4,21 (s, 2H); 5,04 (s, 2H); 6,83-6,85 (dd, 1H); 7,05-7,09 (m, 3H); 7,15-7,23 (m, 2H). Приклад 9: Дослідження інгібування URAT1 URAT1 (переносник сечової кислоти-1, Uric Acid Transporter 1) експресується на верхівкових мембранах у ниркових канальцях. Він опосередковує поглинання сечової кислоти із сечі у кров. Інгібування URAT1 спричиняє підвищене виділення сечової кислоти із сечею і тому є потенціальним способом дії лікарських засобів, які знижують концентрацію сечової кислоти у плазмі. Наприклад, пробенецид та бензбромарон застосовуються у клінічних умовах для лікування подагри та гіперурикемії, причому обидва ці засоби впливають на URAT1, знижуючи поглинання сечової кислоти. Однак бензбромарон був відкликаний з ринку у зв'язку з його токсичною дією на печінку за механізмами, незалежними від URAT1, а пробенецид впливає на численні протеїни-переносники, наслідком чого є взаємодія з різноманітними іншими лікарськими засобами. Дослідження in vitro з URAT1 є корисним для ідентифікування сполук, які є потенціально активними щодо зниження рівня сечової кислоти у плазмі. Прийнятний спосіб дослідження включає трансфікування клітин (наприклад, клітин нирок людського ембріона, "HEK") вектором, який кодує людський URAT1, з подальшим визначенням здатності трансфікованих клітин поглинати радіомічену сечову кислоту. Активність сполук як інгібіторів URAT1 оцінюють за їхньою здатністю блокувати поглинання сечової кислоти трансфікованими клітинами. Досліджувані сполуки та реактиви Бензбромарон (Sigma, номер за каталогом B5774), пробенецид (Sigma, номер за каталогом 14 P8761)), DMSO (Sigma, номер за каталогом D-2650), [8- C]-урат (50-60 мКі/ммоль; American Radio Chemicals, номер за каталогом ARC0513). Субклонування hURAT1 у вектор експресії Плазмідний вектор pCMV6-XL5, який містить кДНК hURAT1 (номер за каталогом SC125624), та ветор експресії pCMV6-Neo (номер за каталогом pCMVNEO) одержували від фірми OriGene Technologies, Inc. Повномірну кДНК hURAT1 одержували з вектора pCMV6-XL5 та субклонували у вектор експресії pCMV6-Neo, одержуючи плазміду експресії hURAT1 pCMV6-hURAT1. Послідовності перевіряли шляхом автоматичного аналізу послідовностей ДНК. Культура клітин, трансфекція плазмід експресії URAT1 та встановлення клітин НЕK, які стабільно експресують hURATl Клітини нирок людського ембріона (HEK) лінії 293 (ATTCC, номер за каталогом CRL-1573) висіювали на середовище EMEM, доповнене 10 % FBS та 2 мМ L-глутаміну, та інкубували при 37°C в атмосфері 5 % CO2. Для експериментів із трансфікування клітини висіювали на чашки Петрі діаметром 60 мм, по 1 мл середовища на чашку. Після інкубування протягом 18-24 год. клітини трансфікували плазмідою pCMV6-hURAT1 або вектором експресії pCMV6-Neo, застосовуючи трансфікувальний засіб ліпофектин (Lipofectin) згідно з інструкціями виробника (Invitrogen, номер за каталогом 18292). Після трансфікування клітини вирощували у середовищі EMEM протягом 72 год., а потім відбирали стабільні трансфектанти шляхом додавання 1 мг/мл генетицину (Geneticin) (GIBCO, номер за каталогом 10131). Стабільні трансфектанти, які експресували hURAT1 (нижче позначені як клітини hURAT1-HEK), або клітини, які містили лише вектор експресії pCMV6-Neo (нижче позначені як псевдоклітини НЕK), перевіряли, застосовуючи полімеразну ланцюгову реакцію зворотної транскрипції (RT-PCR). 14 Дослідження поглинання [8- C]-урату Клітини hURAT1-HEK та псевдоклітини HEK висівали у 24-лункові культивувальні планшети 5 з полі-D-лізином (Becton Dickinson, номер за каталогом 354414) у концентрації 310 у 14 середовищі EMEM, та інкубували протягом ночі. Реакційні розчини, які містили [8- C]-урат (55 мКі/ммоль) кінцевої концентрації 50 мкМ з домішкою або без домішки випробовуваної сполуки, виготовляли у сольовому розчині, збалансованому за Хенком (HBSS), який містив 125 мМ глюконату натрію, 4,8 мМ глюконату калію, 1,3 мМ кальцію, 5,6 мМ глюкози, 1,2 мМ сульфату магнію, 1,2 мМ KH2PO4 та 25 мМ HEPES (pH 7,4). Перед початком дослідження поглинання культивувальне середовище видаляли, і клітини інкубували протягом 5 хв у 0,6 мл HBSS. Після видалення HBSS у кожну лунку додавали виготовлені реакційні розчини, і суміш інкубували протягом 5 хв при кімнатній температурі. Потім реакційний розчин видаляли, клітини промивали двічі 0,6 мл охолодженого HBSS, та піддавали лізису з 0,2 мл 0,1 M NaOH протягом 20 хв. Лізати клітин переносили у пробірки для вимірювання сцинтиляції, які містили 1 мл 28
ДивитисяДодаткова інформація
Назва патенту англійськоюTetrazole compounds for reducing uric acid
Автори англійськоюO'Neill, james, Dennen, Sharma, Shalini, Arudchandran, Ramachandran
Автори російськоюШарма Шалини
МПК / Мітки
МПК: A61K 31/41
Мітки: похідні, кислоти, рівня, сечової, тетразолу, зниження
Код посилання
<a href="https://ua.patents.su/51-104289-pokhidni-tetrazolu-dlya-znizhennya-rivnya-sechovo-kisloti.html" target="_blank" rel="follow" title="База патентів України">Похідні тетразолу для зниження рівня сечової кислоти</a>
Попередній патент: Гербіцидна композиція, що містить піроксасульфон, її застосування (варіанти), спосіб боротьби з небажаною рослинністю (варіанти) та препаративна форма гербіциду
Наступний патент: Сполука піразолу, спосіб її одержання і гербіцидна композиція, що її містить
Випадковий патент: Система та касета для виготовлення абразивних виробів












