Гуманізоване антитіло проти il-22ra людини
Формула / Реферат
1. Гуманізоване антитіло, яке зв'язується з людським IL-22RA і включає:
а) варіабельний домен важкого ланцюга, який включає H-CDR1, H-CDR2 і H-CDR3, що складаються з амінокислотних послідовностей SEQ ID NO: 1, 2 і 3, відповідно; і
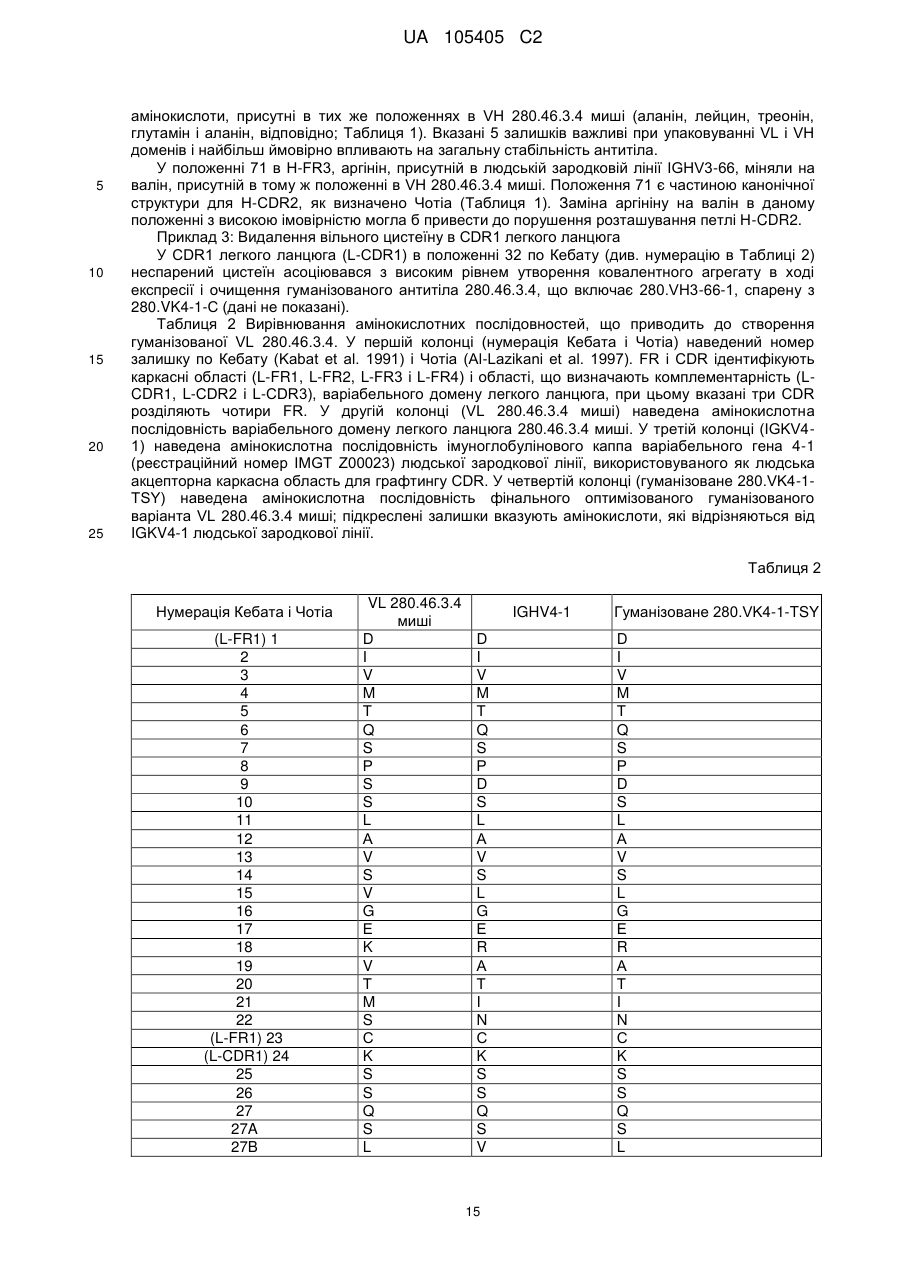
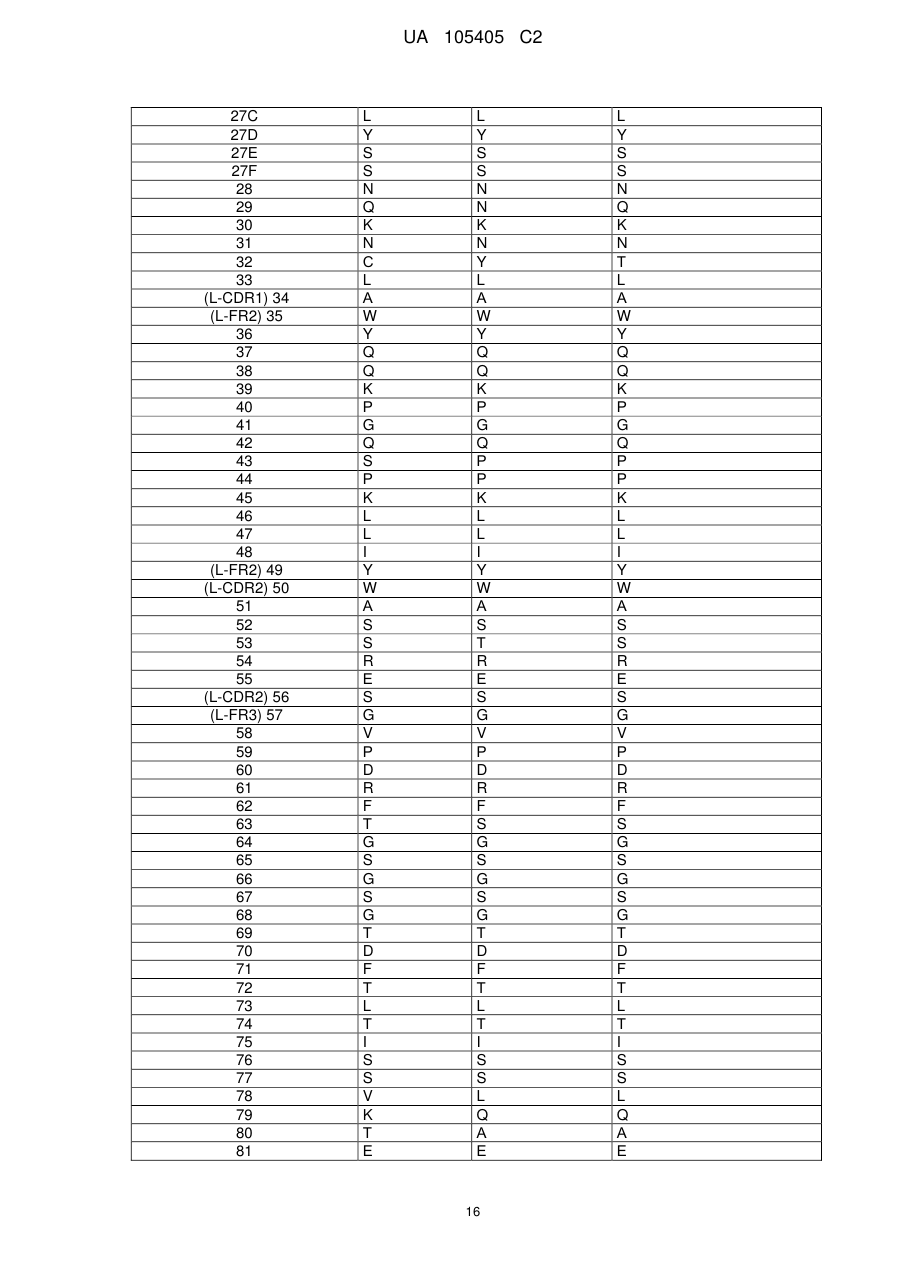
b) варіабельний домен легкого ланцюга, який включає L-CDR1, L-CDR2 і L-CDR3, що складаються з амінокислотних послідовностей SEQ ID NO: 4, 5 і 6, відповідно, або який складається з амінокислотних послідовностей SEQ ID NO: 4, 5 і 7, відповідно.
2. Гуманізоване антитіло за п. 1, де:
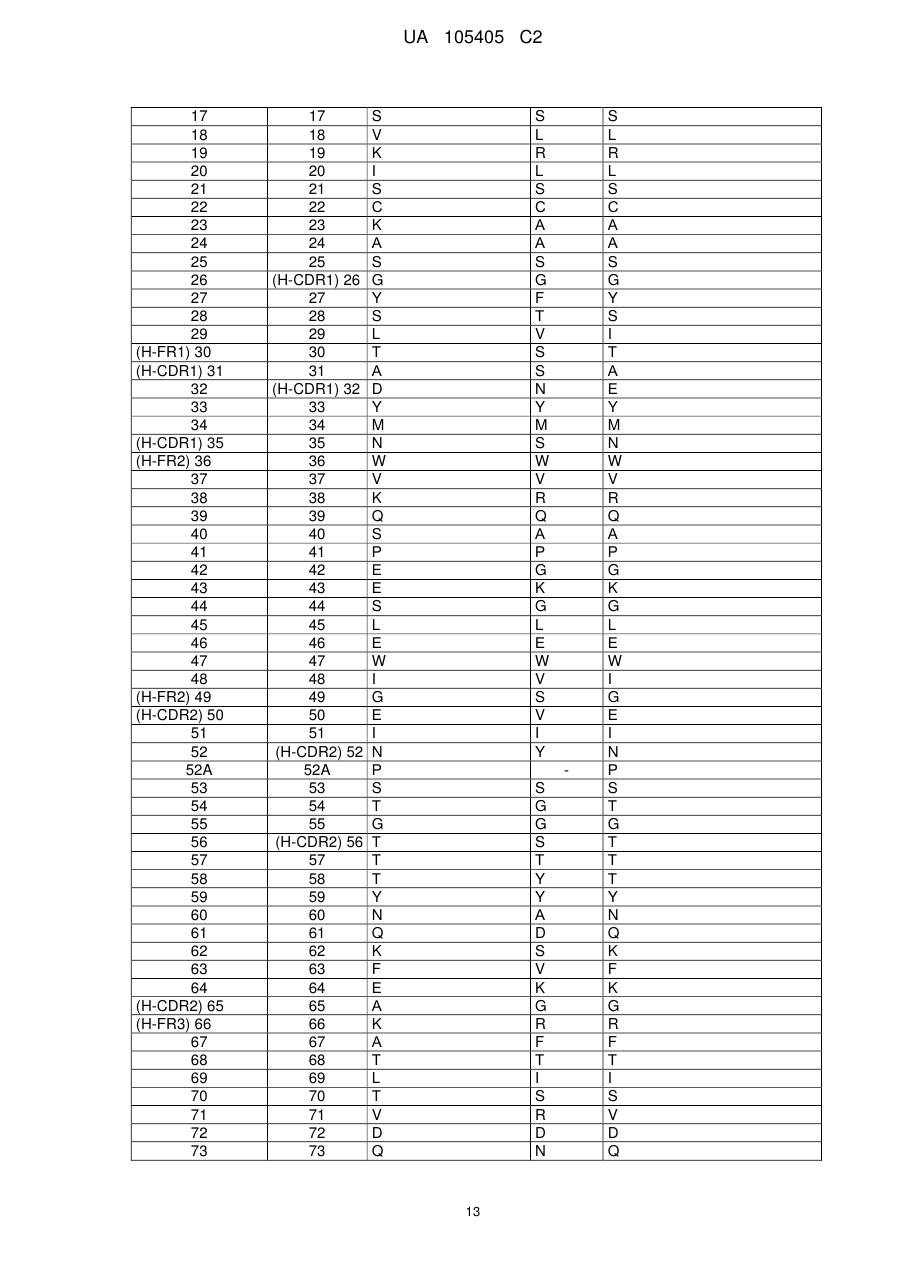
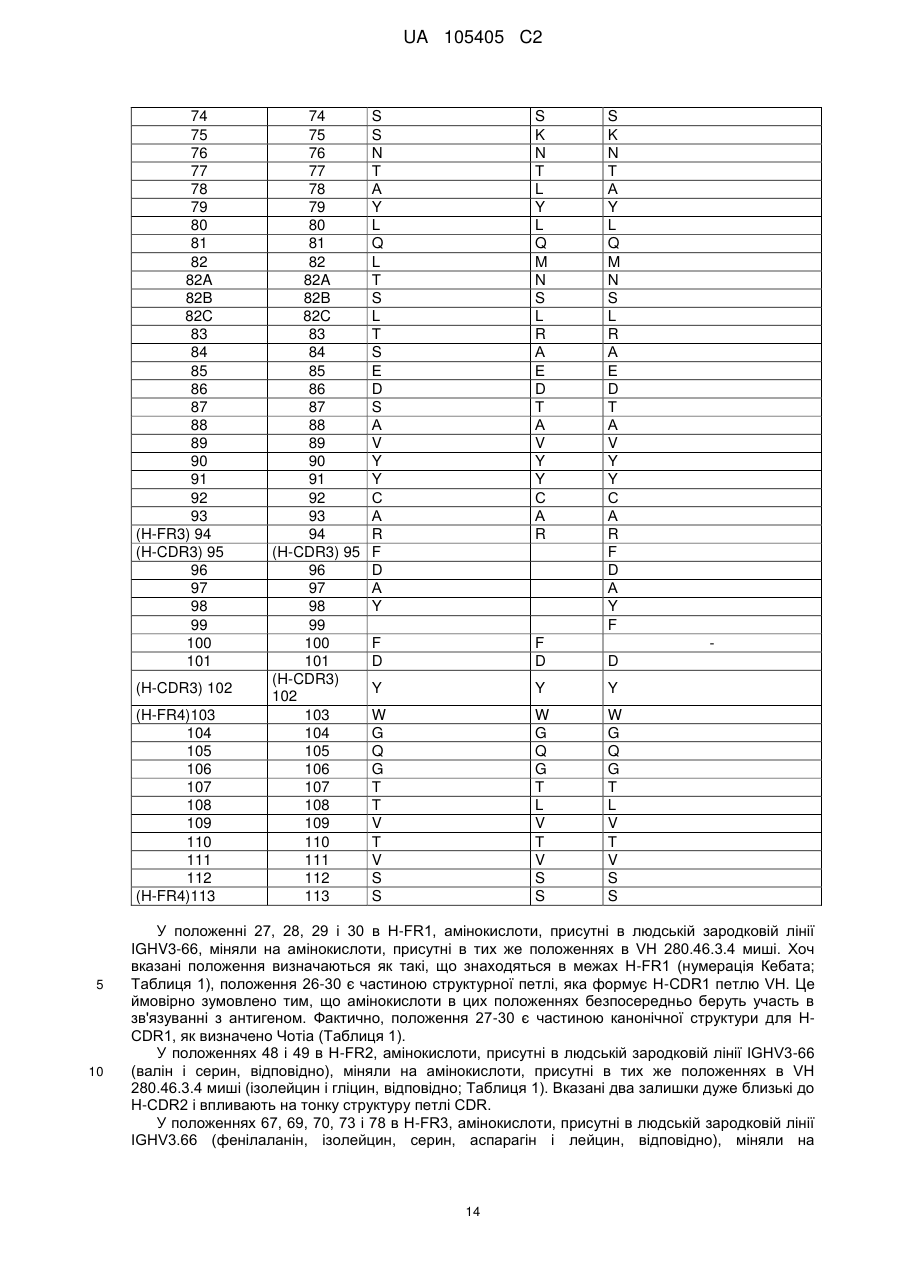
a) вказаний варіабельний домен важкого ланцюга включає каркасні області H-FR1, H-FR2, H-FR3 і H-FR4, що складаються з амінокислотних послідовностей SEQ ID NO: 8, 9, 10 і 11, відповідно, і
b) вказаний варіабельний домен легкого ланцюга включає каркасні області L-FR1, L-FR2, L-FR3 і L-FR4, що складаються з амінокислотних послідовностей SEQ ID NO: 12, 13, 14 і 15, відповідно.
3. Гуманізоване антитіло за п. 1 або 2, де:
a) вказаний варіабельний домен важкого ланцюга складається з амінокислотної послідовності SEQ ID NO: 16, і
b) вказаний варіабельний домен легкого ланцюга складається з амінокислотної послідовності SEQ ID NO: 17.
4. Гуманізоване антитіло за будь-яким з пп. 1-3, де вказане антитіло включає:
a) константну область важкого ланцюга, що складається з амінокислотної послідовності SEQ ID NO: 18, і
b) константний домен легкого ланцюга, що складається з амінокислотної послідовності SEQ ID NO: 19.
5. Гуманізоване антитіло, яке зв'язується з людським IL-22RA і включає важкий ланцюг, який включає або складається з амінокислотної послідовності SEQ ID NO: 20, і легкий ланцюг, який включає або складається з амінокислотної послідовності SEQ ID NO: 21.
6. Полінуклеотид, який кодує важкий ланцюг гуманізованого антитіла за п. 5.
7. Полінуклеотид за п. 6, де вказаний полінуклеотид включає або складається з SEQ ID NO: 22.
8. Полінуклеотид, який кодує легкий ланцюг гуманізованого антитіла за п. 5.
9. Полінуклеотид за п. 8, де вказаний полінуклеотид включає або складається з SEQ ID NO: 23.
10. Полінуклеотид, який кодує важкий ланцюг і легкий ланцюг гуманізованого антитіла за п. 5.
11. Експресійний вектор, який включає:
а) полінуклеотид за п. 6 або 7 і
b) полінуклеотид за п. 8 або 9.
12. Експресійний вектор, який включає полінуклеотид за п. 10.
13. Клітина-хазяїн, трансформована вектором за п. 11 або 12.
14. Клітина-хазяїн за п. 13, де вказана клітина є клітиною СНО.
15. Спосіб одержання гуманізованого антитіла за будь-яким з пп. 1-5, де вказаний спосіб включає культивування клітини-хазяїна за п. 13 або 14 і виділення вказаного антитіла.
16. Фармацевтична композиція, яка включає гуманізоване антитіло за будь-яким з пп. 1-5 або гуманізоване антитіло, одержане згідно зі способом за п. 15.
17. Гуманізоване антитіло за будь-яким з пп. 1-5 або гуманізоване антитіло, одержане згідно зі способом за п. 15, для застосування як лікарського засобу.
18. Гуманізоване антитіло за будь-яким з пп. 1-5 або гуманізоване антитіло, одержане згідно зі способом за п. 15, для застосування в лікуванні псоріазу, псоріатичного артриту або атопічного дерматиту.
19. Застосування гуманізованого антитіла за будь-яким з пп. 1-5 або гуманізованого антитіла, одержаного згідно зі способом за п. 15, для одержання лікарського засобу для лікування псоріазу, псоріатичного артриту або атопічного дерматиту.
Текст
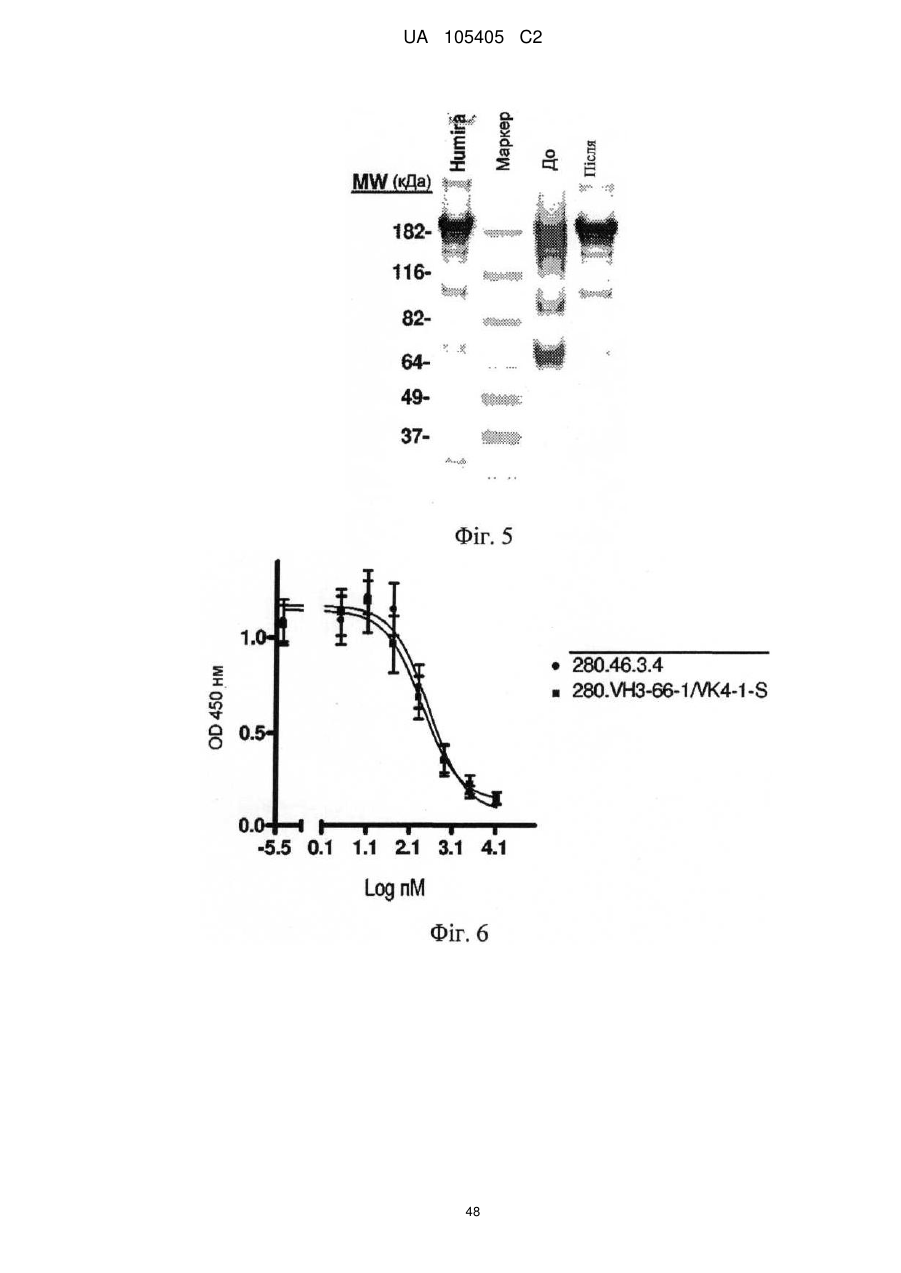
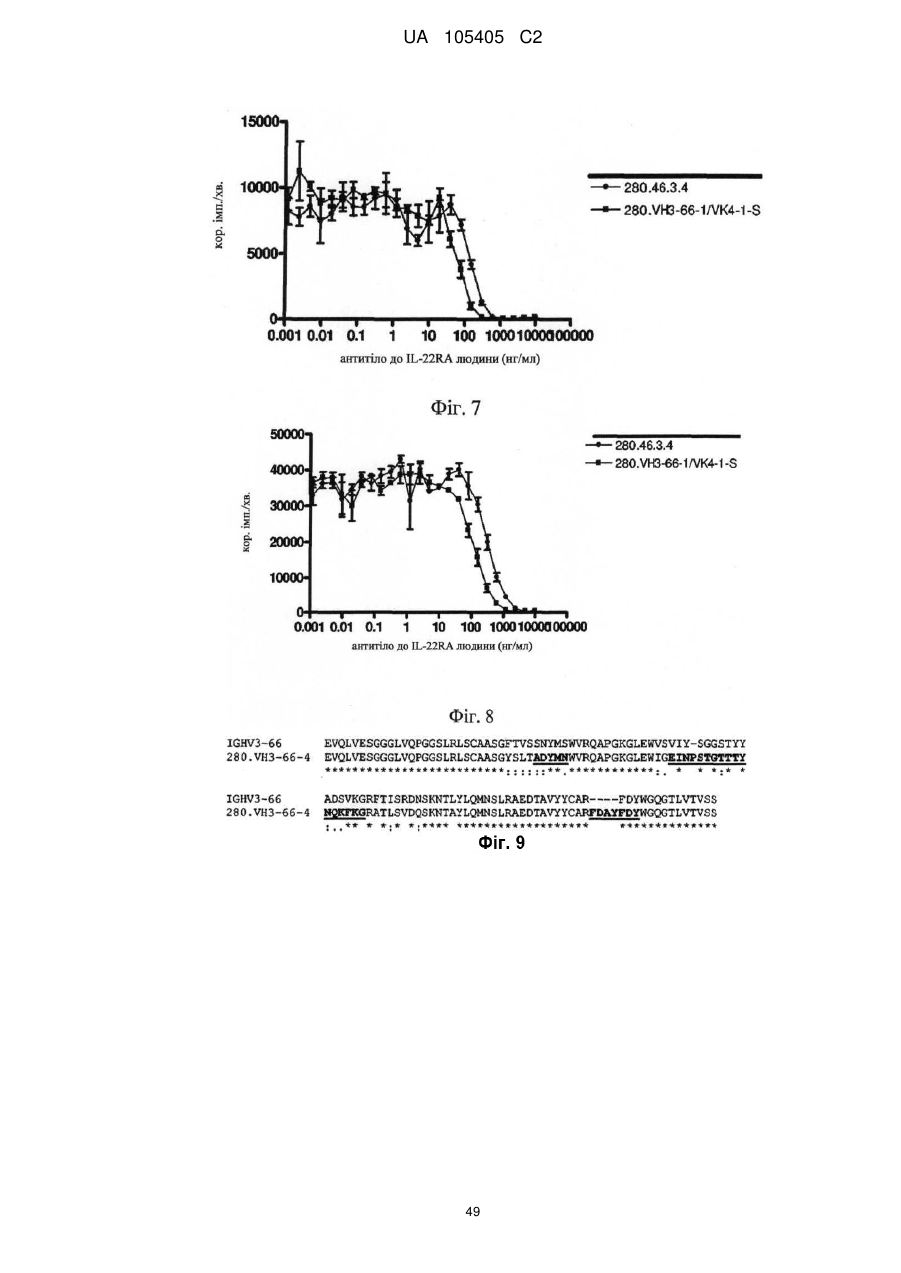
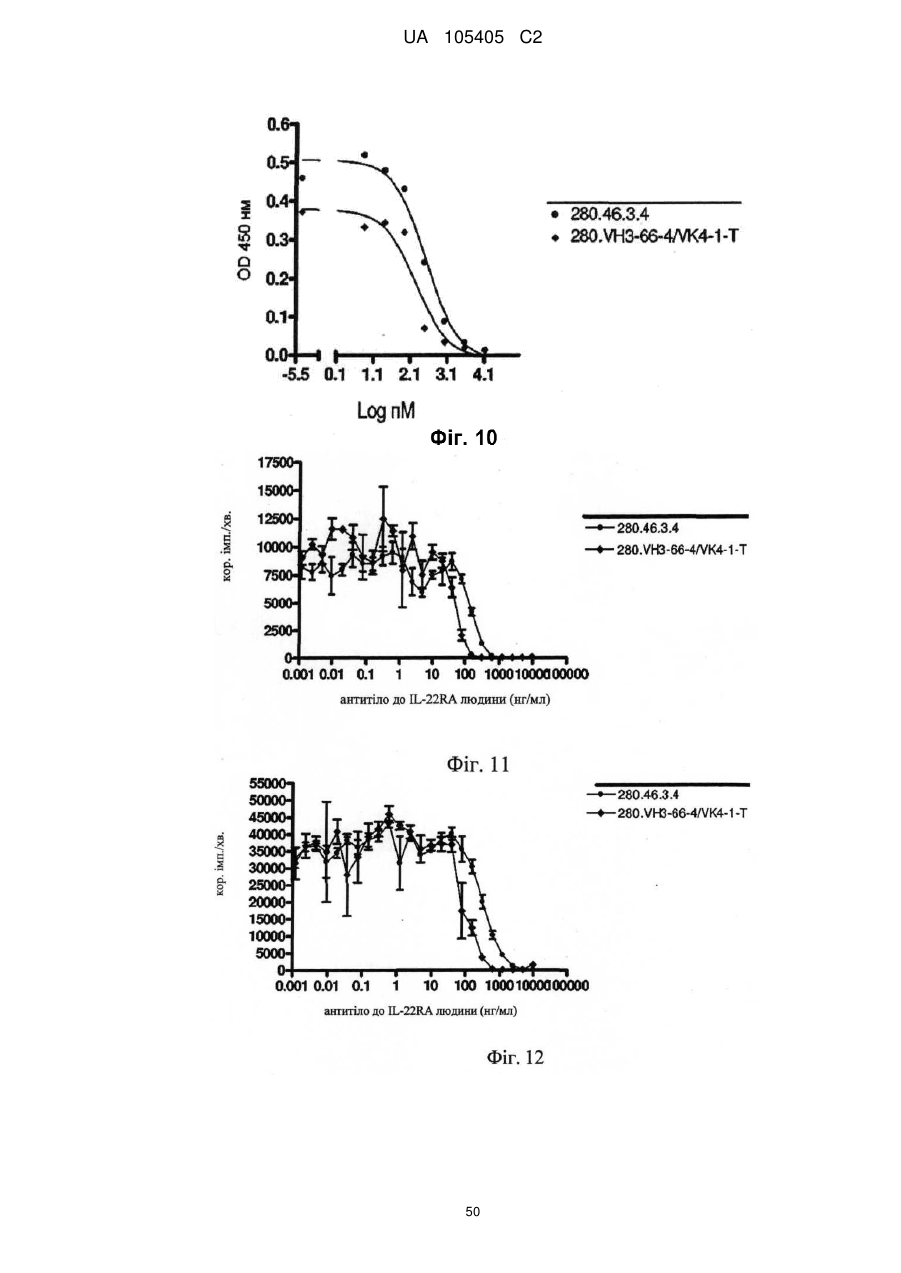
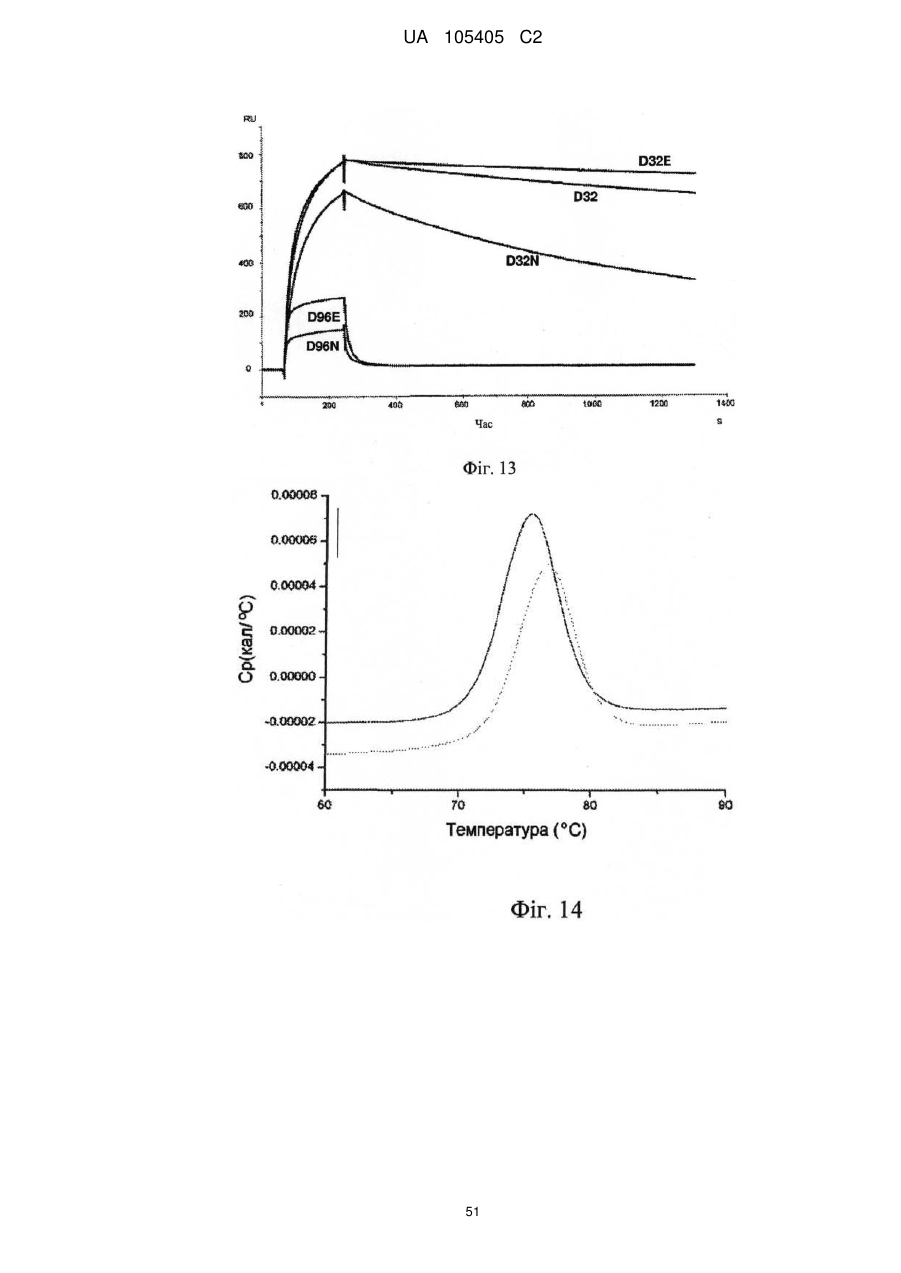
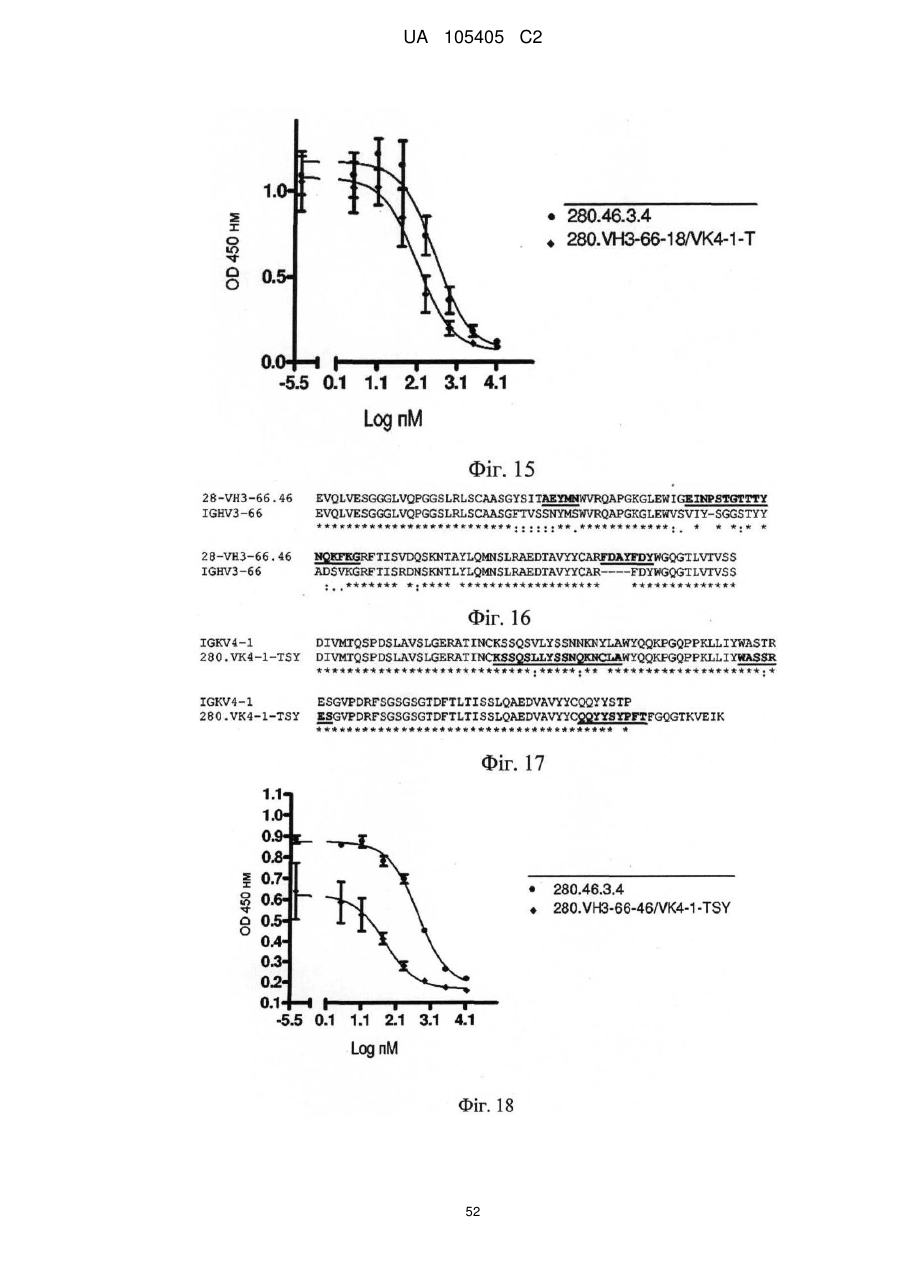
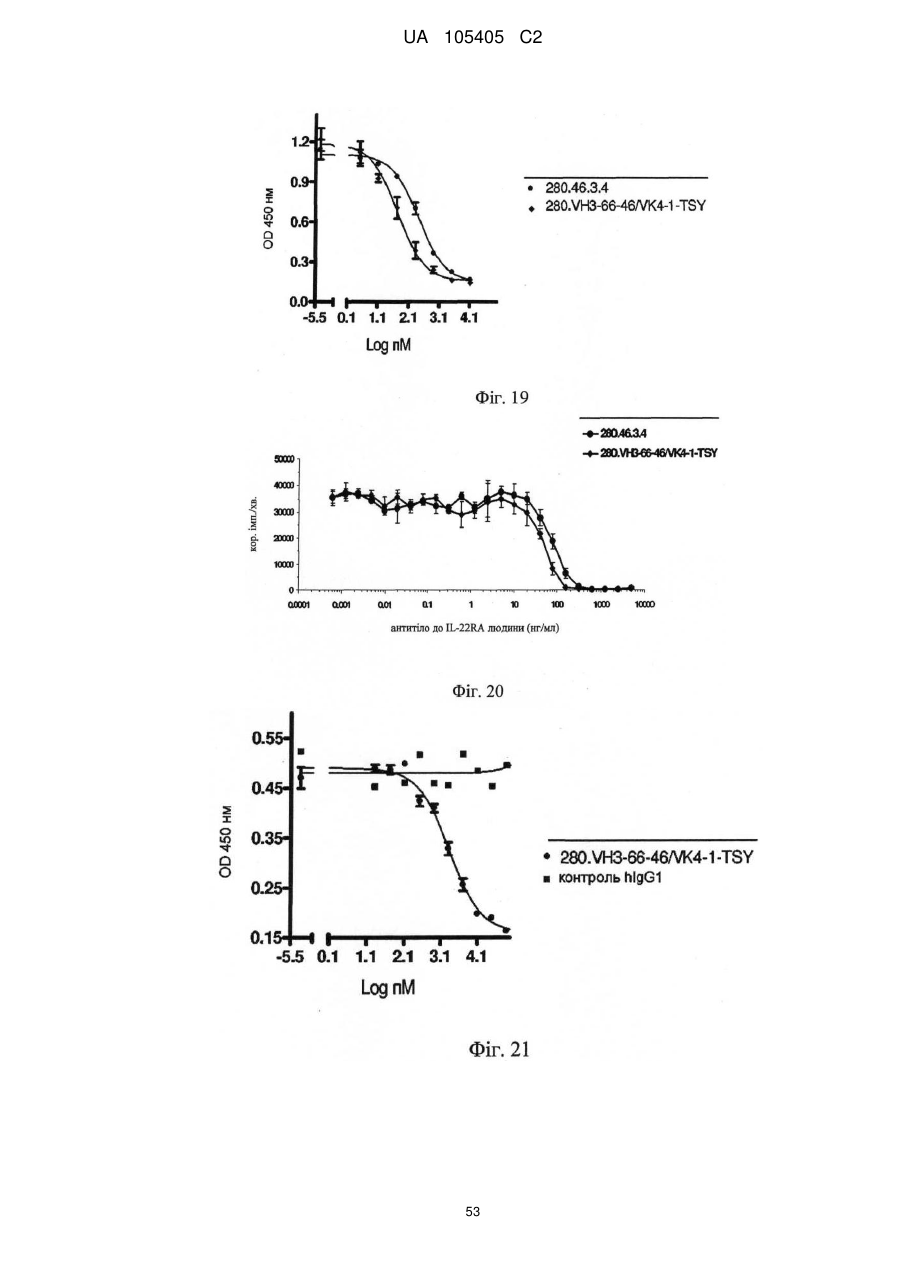
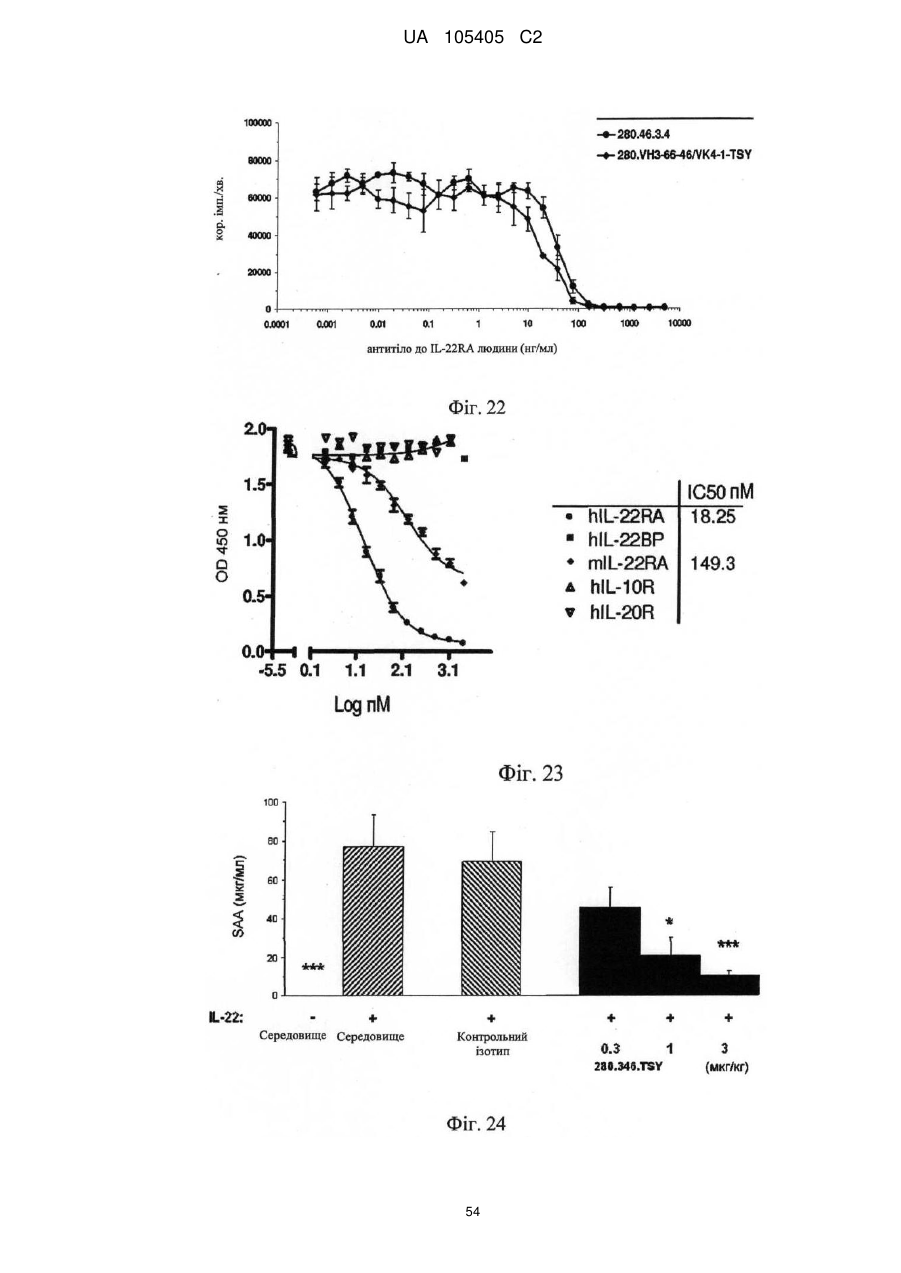
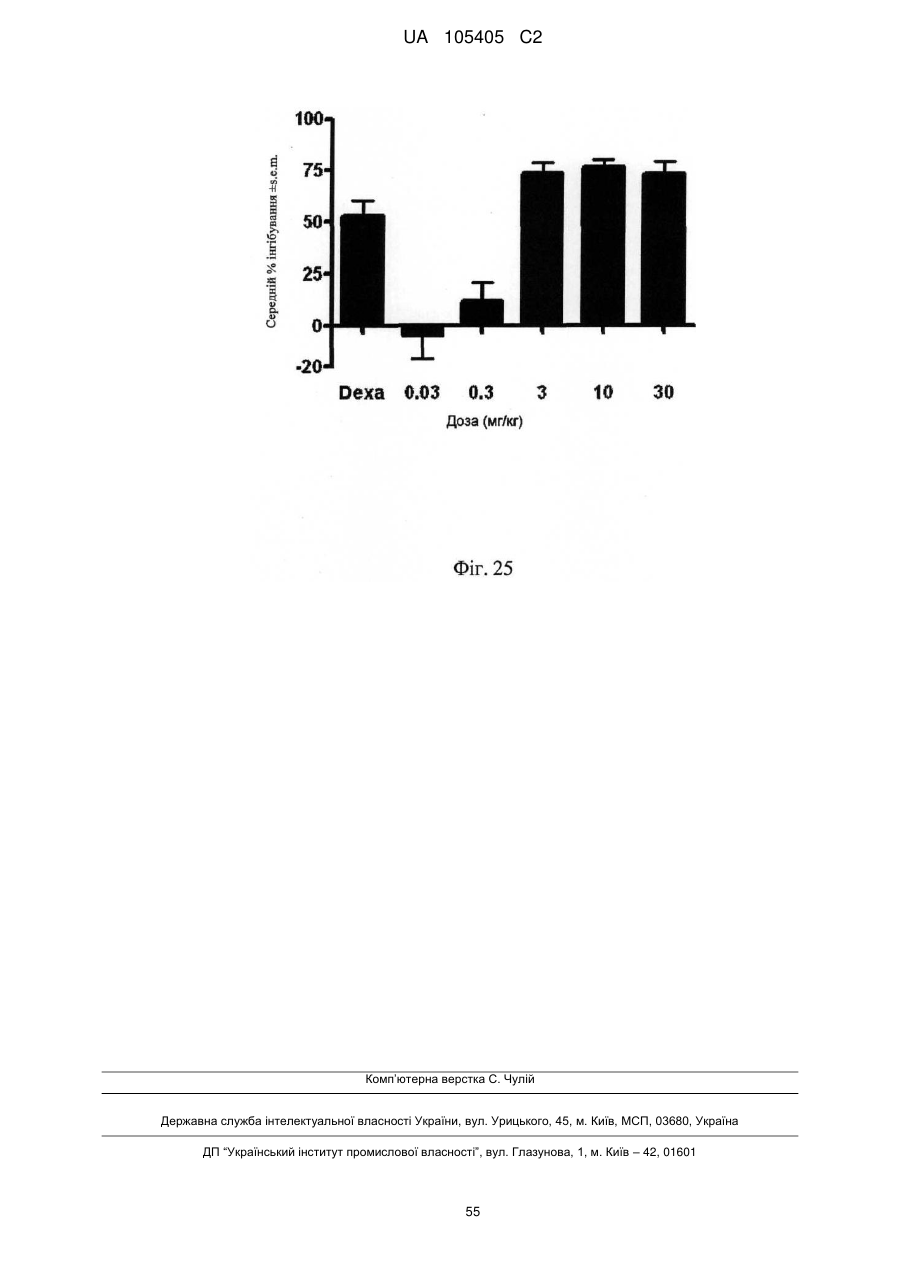
Реферат: Винахід належить до гуманізованого антитіла проти людського IL-22RA і його застосування в лікуванні псоріазу і інших імуноопосередкованих захворювань, таких як псоріатичний артрит і атопічний дерматит. UA 105405 C2 (12) UA 105405 C2 UA 105405 C2 5 10 15 20 25 30 35 40 45 50 55 60 ГУМАНІЗОВАНІ АНТИТІЛА ПРОТИ IL-22RA ЛЮДИНИ Галузь техніки, до якої належить винахід Даний винахід стосується гуманізованих антитіл проти IL-22RA людини і їх застосування в лікуванні псоріазу і інших імуноопосередкованих захворювань, таких як псоріатичний артрит і атопічний дерматит. Рівень техніки IL-22RA (також відомий як IL22R, IL22R1, IL22RA1, CRF2-9 і Zcytor11) належить до сімейства цитокінових рецепторів II типу і є компонентом рецептора IL-20, IL-22 і IL-24. Через свою структурну схожість IL-20, IL-22 і IL-24, разом з IL-19 і IL-26, були об'єднані з IL-10 в так зване "сімейство IL-10" (Kunz S. et al. 2006). IL-10 є основним регулятором імунної відповіді, який опосередковує даунрегуляцію експресії прозапальних цитокінів в макрофагах, Т-клітинах і інших клітинах імунної системи (Moore K.W. et al. 2001). In vitro IL-20 і IL-24 виробляються не тільки активованими імунними клітинами, але також подібною мірою кератиноцитами. In vivo вказані цитокіни переважно експресуються в запалених тканинах. IL-20 і IL-24 можуть передавати сигнал через два комплекси рецепторів, IL-20RA/IL20RB і IL-22RA/IL-20RB (Langer J.A. et al. 2004). Деякі тканини, особливо шкіра, тканини з репродуктивної і дихальної систем, а також різні залози виявилися головними мішенями вказаних медіаторів (Kunz S. et al. 2006). + IL-22 був відкритий як ген, апрегульований CD4 Т-клітинами при активації, і він має 22 % ідентичності амінокислотної послідовності з IL-10; тому спочатку його називали IL-10-подібний Т-клітинний індукований фактор (IL-TIF) (Dumoutier L. et al. 2000). На відміну від IL-10, який регулює функції імунних клітин, IL-22 контролює реакції тканини на імунну систему. IL-22 передає сигнали через гетеродимерний рецептор, сформований IL-22RA і IL-10RB, який з високою мірою експресується в різних тканинах, але він не присутній на імуноцитах. Спочатку IL-22 зв'язується через його IL-22RA-зв'язувальний сайт з позаклітинним доменом IL-22RA і потім IL-10RB зв'язується з областю, створеною при взаємодії IL-22 і IL-22RA, формуючи комплекс цитокінового рецептора з більш високою афінністю до IL-22 (Li J. et al. 2004). Оскільки IL-10RB широко експресується багатьма типами різних клітин, експресія IL-22RA є лімітуючим фактором, який визначає реакцію клітин на IL-22. IL-22RA значно експресується в печінці, а також в шкірі, легенях, підшлунковій залозі і інших периферичних тканинах (Wolk K. et al. 2004; Aggarwal S. et al. 2001). Широкий скринінг різних ліній клітин показав, що на IL-22 реагують тільки ті клітини, які експресують IL-22RA, що вказує на те, що немає ніякого іншого рецептора, який може опосередковувати передачу сигналу IL-22. Розчинний рецептор, званий IL-22-зв'язувальним білком (IL-22BP; також відомий як IL22BP, IL22RA2, IL-22R-α2, CRF2X, CRF2-S1 і CRF2-10), також здатний зв'язуватися з IL-22 як природний антагоніст білка і, ймовірно, забезпечує системну регуляцію активності IL-22 (Kotenko S.V. et al. 2003). IL-22 був виявлений в уражених тканинах пацієнтів з різними хронічними запальними захворюваннями, які включають інфільтрацію активованих Т-клітин, такими як псоріаз, псоріатичний артрит і атопічний дерматит. IL-22 звичайно описують як прозапальний цитокін через його експресію в ділянках пошкоджень у пацієнтів з хронічними запальними захворюваннями і його індукцію таких прозапальних цитокінів, як IL-6, IL-8 і TNF-α (Wolk K. et al. 2004; Andoh et al. 2005; Ikeuchi Н. et al. 2005; Nograles K.E. et al. 2009a; Nograles K.E. et al. 2009b). Нещодавно Zheng зі співр. показав, що IL-22 важливий при опосередковуванні IL-23-індукованого запалення шкіри в моделі псоріазу на мишах, що вказує на його прозапальну роль (Zheng Y. et al. 2007). Враховуючи біологічні ефекти IL-22, включаючи гіперплазію кератиноцитів, індукцію хемокінів і вироблення прозапальних цитокінів в певній тканині, використання антагоністів, які блокують, інгібують, зменшують або нейтралізують активність IL22, наприклад, порушуючи його зв'язування з рецептором, може запобігати інфільтрації патогенних клітин в ділянках запалення. Моноклональні антитіла миші проти IL-22RA людини були раніше описані в заявці на патент PCT WO 2006/047249, поданій 21 жовтня 2005 року. Проте, антитіла миші можуть бути імуногенними і тому переважні гуманізовані антитіла до IL22RA людини. Гуманізовані антитіла, як правило, мають щонайменше три потенційні переваги в порівнянні з мишачими антитілами при використанні в лікуванні людини: (1) оскільки ефекторна частина є людською, вона може краще взаємодіяти з іншими елементами імунної системи людини (наприклад, більш ефективно руйнувати клітини-мішені за допомогою комплементзалежної цитотоксичності (CDC) або антитілозалежної клітинної цитотоксичності (ADCC)); (2) імунна система людини не повинна упізнавати каркасну або константну область гуманізованого антитіла як чужорідну, і тому вироблення антитіл проти такого введеного антитіла повинно бути меншим, ніж проти повністю чужорідного антитіла миші; і (3) антитіла миші, що вводяться, як повідомляли, мали набагато більш короткий період напівжиття в 1 UA 105405 C2 5 10 15 20 25 30 35 40 45 50 55 60 кровотоці людини, ніж людські антитіла. Гуманізовані антитіла, що вводяться, мабуть, будуть мати період напівжиття на зразок природних антитіл людини, що дозволить вводити менші і менш часті дози. Таким чином, з урахуванням вищевикладеного, існує потреба в гуманізованих антитілах проти IL-22RA людини для лікування опосередкованого IL-22 запалення, такого як псоріаз, псоріатичний артрит і атопічний дерматит. Суть винаходу У першому аспекті винахід надає гуманізоване антитіло, яке зв'язується з IL-22RA людини. Гуманізоване антитіло згідно з винаходом включає: a) варіабельний домен важкого ланцюга, що включає H-CDR1, H-CDR2 і H-CDR3, який складається з амінокислотних послідовностей SEQ ID NO: 1, 2 і 3, відповідно, і b) варіабельний домен легкого ланцюга, що включає L-CDR1, L-CDR2 і L-CDR3, який складається з амінокислотних послідовностей SEQ ID NO: 4, 5 і 6, відповідно, або складається з амінокислотних послідовностей SEQ ID NO: 4, 5 і 7, відповідно. У іншому аспекті винахід надає антитіло, описане в даній заявці, в якому: a) вказаний варіабельний домен важкого ланцюга включає каркасні області H-FR1, H-FR2, H-FR3 і H-FR4, які складаються з амінокислотних послідовностей SEQ ID NO: 8, 9, 10 і 11, відповідно, і b) вказаний варіабельний домен легкого ланцюга включає каркасні області L-FR1, L-FR2, L-FR3 і L-FR4, які складаються з амінокислотних послідовностей SEQ ID NO: 12, 13, 14 і 15, відповідно. У іншому аспекті винахід надає антитіло, описане в даній заявці, в якому: a) вказаний варіабельний домен важкого ланцюга складається з амінокислотної послідовності SEQ ID NO: 16, і b) вказаний варіабельний домен легкого ланцюга складається з амінокислотної послідовності SEQ ID NO: 17. У іншому аспекті винахід надає антитіло, описане в даній заявці, де вказане антитіло включає: a) константну область важкого ланцюга, що складається з амінокислотної послідовності SEQ ID NO: 18, і b) константний домен легкого ланцюга, що складається з амінокислотної послідовності SEQ ID NO: 19. У іншому аспекті винахід надає гуманізоване антитіло, яке зв'язується з IL-22RA людини, що включає важкий ланцюг, який включає або складається з амінокислотної послідовності SEQ ID NO: 20, і легкий ланцюг, який включає або складається з амінокислотної послідовності SEQ ID NO: 21. У іншому аспекті винахід надає полінуклеотид, наприклад ДНК, що кодує важкий ланцюг гуманізованого антитіла згідно з даним винаходом. Переважно вказаний полінуклеотид включає або складається з SEQ ID NO: 22. У іншому аспекті винахід надає полінуклеотид, наприклад ДНК, що кодує легкий ланцюг гуманізованого антитіла згідно з даним винаходом. Переважно вказаний полінуклеотид включає або складається з SEQ ID NO: 23. У іншому аспекті винахід надає полінуклеотид, наприклад ДНК, що кодує важкий і легкий ланцюги гуманізованого антитіла згідно з даним винаходом. У іншому аспекті винахід надає вектор, а більш конкретно вектор експресії, який включає: a) полінуклеотид, що кодує важкий ланцюг гуманізованого антитіла згідно з даним винаходом, і b) полінуклеотид, що кодує легкий ланцюг гуманізованого антитіла згідно з даним винаходом. У іншому аспекті винахід надає вектор, а більш конкретно вектор експресії, який включає полінуклеотид, що кодує важкий ланцюг і легкий ланцюг гуманізованого антитіла згідно з даним винаходом. У іншому аспекті винахід надає клітину-хазяїна, переважно клітину CHO, що включає, наприклад, в результаті трансфекції, вектор, зокрема вектор експресії згідно з винаходом. У іншому аспекті винахід надає спосіб одержання гуманізованого антитіла згідно з винаходом, який включає культивування клітини-хазяїна, переважно клітини CHO згідно з винаходом, і виділення гуманізованого антитіла згідно з даним винаходом. У іншому аспекті винахід надає гуманізоване антитіло згідно з даним винаходом для застосування як лікарського засобу, зокрема для застосування в лікуванні псоріазу, псоріатичного артриту або атопічного дерматиту. У іншому аспекті винаходу запропонована фармацевтична композиція, яка включає гуманізоване антитіло згідно з даним винаходом, і її застосування як лікарського засобу, зокрема для застосування в лікуванні псоріазу, псоріатичного артриту або атопічного дерматиту. У іншому аспекті винаходу запропоноване застосування гуманізованого антитіла згідно з даним винаходом або фармацевтичної композиції, що включає вказане антитіло, у виробництві лікарського засобу для лікування псоріазу, псоріатичного артриту або атопічного дерматиту. Опис креслень На Фігурі 1 представлене вирівнювання імуноглобулінового каппа варіабельного гена 4-1 (IGKV4-1) зародкової лінії людини і 280.46.3.4 VL миші (280.46.3.4). 2 UA 105405 C2 5 10 15 20 25 30 35 40 45 50 55 60 На Фігурі 2 представлене вирівнювання імуноглобулінового важкого варіабельного гена 3-66 (IGHV3-66) зародкової лінії людини і 280.46.3.4 VH миші (280.46.3.4). На Фігурі 3 представлене вирівнювання імуноглобулінового каппа варіабельного гена 4-1 (IGKV4-1) зародкової лінії людини і першого варіанта гуманізованого 280.46.3.4 VL (280.VK4-1C). На Фігурі 4 представлене вирівнювання першого варіанта гуманізованого 280.46.3.4 VH (280.VH3-66.1) і імуноглобулінового важкого варіабельного гена 3-66 (IGHV3-66) зародкової лінії людини. На Фігурі 5 показані результати забарвлення кумасі синім очищених на білку А гуманізованих 280.46.3.4 антитіл в електрофорезному ДСН-гелі в неденатуруючих умовах. "Humira" (Adalimumab), комерційне моноклональне антитіло до TNF-α, використовували як стандарт. "Маркер" являє собою стандартні білкові маркери молекулярної ваги (MW), кДа вказані зліва на фігурі. "До" стосується очищених на білку А гуманізованих 280.46.3.4 антитіл, що включають 280.VH3-66-1, спарену з 280.VK4-1-C, що містить, таким чином, неспарений цистеїн в легкому ланцюзі. "Після" стосується очищених на білку А гуманізованих 280.46.3.4 антитіл, що включають 280.VH3-66-1, спарену з 280.VK4-1-S. На Фігурі 6 показані результати аналізу фосфорилування STAT3, виконаного в клітинах гепатоми HepG2 людини для порівняння активності гуманізованого антитіла, експресованого як IgG1/каппа людини, що включає 280.VH3-66-1, спарену з 280.VK4-1-S ( 280.VH3-66-1/VK4-1-S), з вихідним мишачим антитілом 280.46.3.4 (● 280.46.3.4). Результати показують, що гуманізоване антитіло в 1,4 разу більш активне в порівнянні з вихідним мишачим антитілом, яке містить вільний цистеїн, зі значеннями IC50 257,5 пМ і 370,5 пМ, відповідно. На Фігурі 7 показані результати аналізу проліферації, виконаного в трансфікованих рецептором IL-22 людини стабільних клітинах BaF3 для порівняння активності гуманізованого антитіла, експресованого як IgG1/каппа людини, що включає 280.VH3-66-1, спарену з 280.VK41-S ( 280.VH3-66-1/VK4-1-S), з вихідним мишачим антитілом 280.46.3.4 (● 280.46.3.4). Результати показують, що гуманізоване антитіло в 1,7 разу більш активне в порівнянні з вихідним мишачим антитілом, яке містить вільний цистеїн, зі значеннями IC 50 340 пМ і 587 пМ, відповідно. На Фігурі 8 показані результати аналізу проліферації, виконаного в трансфікованих мишачим рецептором IL-22 стабільних клітинах BaF3 для порівняння активності гуманізованого антитіла, експресованого як IgG1/каппа людини, що включає 280.VH3-66-1, спарену з 280.VK41-S ( 280.VH3-66-1/VK4-1-S), з вихідним мишачим антитілом 280.46.3.4 (● 280.46.3.4). Результати показують, що гуманізоване антитіло в 2,1 разу більш активне в порівнянні з вихідним мишачим антитілом, яке містить вільний цистеїн, зі значеннями IC 50 693 пМ і 1473 пМ, відповідно. На Фігурі 9 представлене вирівнювання імуноглобулінового важкого варіабельного гена 3-66 (IGHV3-66) зародкової лінії людини і варіанта 4 гуманізованого 280.46.3.4 VH (280.VH3-66-4). На Фігурі 10 показані результати аналізу фосфорилування STAT3, виконаного в клітинах гепатоми HepG2 людини для порівняння активності гуманізованого антитіла, експресованого як IgG1/каппа людини, що включає 280.VH3-66-4, спарену з 280.VK4-1-T (♦ 280.VH3-66-4/VK4-1-T), з вихідним мишачим антитілом 280.46.3.4 (● 280.46.3.4). Результати показують, що гуманізоване антитіло в 1,8 разу більш активне в порівнянні з вихідним мишачим антитілом, зі значеннями IC50 183,2 пМ і 333,0 пМ, відповідно. На Фігурі 11 показані результати аналізу проліферації, виконаного в трансфікованих рецептором IL-22 людини стабільних клітинах BaF3 для порівняння активності гуманізованого антитіла, експресованого як IgG1/каппа людини, що включає 280.VH3-66-4, спарену з 280.VK41-T (♦ 280.VH3-66-4/VK4-1-T), з вихідним мишачим антитілом 280.46.3.4 (● 280.46.3.4). Результати показують, що гуманізоване антитіло в 1,75 разу більш активне в порівнянні з вихідним мишачим антитілом, зі значеннями IC50 334 пМ і 587 пМ, відповідно. На Фігурі 12 показані результати аналізу проліферації, виконаного в трансфікованих мишачим рецептором IL-22 стабільних клітинах BaF3 для порівняння активності гуманізованого антитіла, експресованого як IgG1/каппа людини, що включає 280.VH3-66-4, спарену з 280.VK41-T (♦ 280.VH3-66-4/VK4-1-T), з вихідним мишачим антитілом 280.46.3.4 (● 280.46.3.4). Результати показують, що гуманізоване антитіло в 2,1 разу більш активне в порівнянні з вихідним мишачим антитілом, зі значеннями IC50 687 пМ і 1473 пМ, відповідно. На Фігурі 13 наведені результати аналізу Biacore, направленого на вимірювання афінності зв'язування з IL-22RA людини набору мутантів, де Asp 32 в H-CDR1 і Asp 96 в H-CDR3 були по окремості мутовані в 280.VH3-66-4. Такі одиночні мутанти були спарені з гуманізованим варіабельним доменом легкого ланцюга 280.VK4-1-T, а потім проаналізовані для вимірювання 3 UA 105405 C2 5 10 15 20 25 30 35 40 45 50 55 60 афінності. D32E: мутація із заміною Asp на Glu в положенні 32 в 280.VH3-66-4 для одержання варіанта 280.VH3-66-18; D32: вихідний варіант 280-VH3-66-4; D32N: мутація із заміною Asp на Asn в положенні 32 в 280.VH3-66-4; D96E: мутація із заміною Asp на Glu в положенні 96 в 280.VH3-66-4; D96N: мутація із заміною Asp на Asn в положенні 96 в 280.VH3-66-4. Результати, представлені на даній фігурі, показують, що мутація D32E підвищувала швидкість асоціації приблизно в 2 рази і знижувала швидкість дисоціації приблизно в 5 разів в порівнянні з вихідним немутованим D32 (280.VH3-66-4). З іншого боку, мутація D96E надавала негативний вплив, зменшуючи афінність приблизно в 500 разів. На Фігурі 14 представлені результати диференціальної скануючої калориметрії (ДСК) мутанта D32E і вихідного немутованого D32, проведеної з метою дослідження їх термостабільності. Мутант D32E (світло-сіра лінія) більш стабільний на 1 градус, ніж вихідне D32 (темно-сіра лінія). На Фігурі 15 представлені результати аналізу фосфорилування STAT3, виконаного в клітинах гепатоми HepG2 людини для порівняння активності гуманізованого антитіла, експресованого як IgG1/каппа людини, що включає 280.VH3-66-18, спарену з 280.VK4-1-T (♦ 280.VH3-66-18/VK4-1-T), з вихідним мишачим антитілом 280.46.3.4 (● 280.46.3.4). Результати показують, що гуманізоване антитіло майже в 3 рази більш активне в порівнянні з вихідним мишачим антитілом, зі значеннями IC50 132,5 пМ і 370,5 пМ, відповідно. На Фігурі 16 показане вирівнювання фінального гуманізованого варіанта VH, 280.VH3-66-46, і імуноглобулінового важкого варіабельного гена 3-66 (IGHV3-66) зародкової лінії людини. На Фігурі 17 показане вирівнювання імуноглобулінового каппа варіабельного гена 4-1 (IGKV4-1) зародкової лінії людини і фінального гуманізованого варіанта VL, 280.VK4-1-TSY. На Фігурі 18 представлені результати аналізу фосфорилування STAT3, виконаного в нормальних кератиноцитах людини для порівняння активності гуманізованого антитіла, експресованого як IgG1/каппа людини, що включає 280.VH3-66-46, спарену з 280.VK4-1-TSY (♦ 280.VH3-66-46/VK4-1-TSY), з вихідним мишачим антитілом 280.46.3.4 (● 280.46.3.4). Результати показують, що гуманізоване антитіло (280.346.TSY, див. Приклад 7) майже в 9 разів більш активне в порівнянні з вихідним мишачим антитілом, зі значеннями IC 50 60,95 пМ і 541,9 пМ, відповідно. На Фігурі 19 представлені результати аналізу фосфорилування STAT3, виконаного в клітинах гепатоми HepG2 людини для порівняння активності гуманізованого антитіла, експресованого як IgG1/каппа людини, що включає 280.VH3-66-46, спарену з 280.VK4-1-TSY (♦ 280.VH3-66-46/VK4-1-TSY), з вихідним мишачим антитілом 280.46.3.4 (● 280.46.3.4). Результати показують, що гуманізоване антитіло (280.346.TSY, див. Приклад 7) майже в 5 разів більш активне в порівнянні з вихідним мишачим антитілом, зі значеннями IC 50 55,16 пМ і 266,3 пМ, відповідно. На Фігурі 20 представлені результати аналізу проліферації, виконаного в трансфікованих рецептором IL-22 людини стабільних клітинах BaF3 для порівняння активності гуманізованого антитіла, експресованого як IgG1/каппа людини, що включає 280.VH3-66-46, спарену з 280.VK41-TSY (♦ 280.VH3-66-46/VK4-1-TSY), з вихідним мишачим антитілом 280.46.3.4 (● 280.46.3.4). Результати показують, що гуманізоване антитіло (280.346.TSY, див. Приклад 7) в 1,7 разу більш активне в порівнянні з вихідним мишачим антитілом, зі значеннями IC50 317 пМ і 545 пМ, відповідно. На Фігурі 21 представлені результати аналізу фосфорилування STAT3, виконаного в клітинах гепатоми HEPA1-6 миші для обчислення активності гуманізованого антитіла, експресованого як IgG1/каппа людини, що включає 280.VH3-66-46, спарену з 280.VK4-1-TSY (● 280. VH3-66-46/VK4-1-TSY). Людський IgG1 використовували як негативний контроль ( контрольний hIgG1). Результати показують, що гуманізоване антитіло (280.346.TSY, див. Приклад 7) здатне інгібувати активність мишачого IL-22 з IC50 в наномолярному діапазоні (2,1 нМ). На Фігурі 22 представлені результати аналізу проліферації, виконаного в трансфікованих мишачим рецептором IL-22 стабільних клітинах BaF3 для порівняння активності гуманізованого антитіла, експресованого як IgG1/каппа людини, що включає 280.VH3-66-46, спарену з 280.VK41-TSY (♦ 280.VH3-66-46/VK4-1-TSY), з вихідним мишачим антитілом 280.46.3.4 (● 280.46.3.4). Результати показують, що гуманізоване антитіло (280.346.TSY, див. Приклад 7) в 6,2 разу більш активне в порівнянні з вихідним мишачим антитілом, зі значеннями IC 50 137 пМ і 849 пМ, відповідно. На Фігурі 23 представлені результати конкурентого ELISA, виконаного з метою вимірювання специфічності 280.346.TSY відносно IL-22RA людини. Мікротитрувальні планшети були покриті людським IL-22RA-ECD (тобто IL-22RA-позаклітинним доменом). Біотинільоване антитіло 4 UA 105405 C2 5 10 15 20 25 30 35 40 45 50 55 60 280.346.TSY додавали в планшет в присутності конкурентів: альфа-рецептора інтерлейкіну 22 людини (hIL-22RA), IL-22-зв'язувального білка людини (hIL-22BP), альфа-рецептора IL-22 миші (mIL-22RA), альфа-рецептора IL-10а людини (hIL-10R) і альфа-рецептора людини IL-20а (hIL20R). Зв'язування з hIL-22RA, нанесеним на планшети, визначали за допомогою додатки кон'югованого з пероксидазою стрептавідину. Виміряні значення IC50 для людського (● hIL22RA) і мишачого (♦ mIL-22RA) IL-22RA становили 18,25 пМ і 149,3 пМ, відповідно. 280.346. TSY не проявляє перехресної реактивності з людським IL-22BP ( hIL-22BP), IL-10R альфа (Δ hIL10R) і IL-20R альфа (V hIL-20R). На Фігурі 24 представлені результати фармакодинамічної активності 280.346.TSY відносно IL-22-індукованого сироваткового амілоїду А у мишей. Різні дози 280.346.TSY вводили підшкірно за 22 години до внутрішньовенної ін'єкції рекомбінантного мишачого IL-22. Контрольним середовищем був PBS, який вводили підшкірно. Забір крові проводили через 6 годин після введення IL-22. Людський IgG1 використовували як негативний контроль (контрольного ізотипу). Сироватковий амілоїд А визначали за допомогою ELISA. 280.346.TSY показав ефективність в даній моделі і дав значення ED50 0,5 мг/кг. Для виконання статистичного аналізу використовували критерій Уїтні: *р
ДивитисяДодаткова інформація
Назва патенту англійськоюHumanized antibodies against human il-22ra
Автори англійськоюBeckmann, Roland, Johnson-Leger, Caroline
Автори російськоюБекманн Роланд, Джонсон-Леджер Керолайн
МПК / Мітки
МПК: A61P 37/00, A61K 39/395, C07K 16/28, C07K 16/46, A61P 17/06
Мітки: антитіло, il-22ra, людини, гуманізоване
Код посилання
<a href="https://ua.patents.su/57-105405-gumanizovane-antitilo-proti-il-22ra-lyudini.html" target="_blank" rel="follow" title="База патентів України">Гуманізоване антитіло проти il-22ra людини</a>
Попередній патент: Спосіб обробки зерна озоном у зернових масах
Наступний патент: Спосіб одержання цис-тетрагалогено-ді-m-ацетиламіноадамантилкарбоксилатів диренію(ііі)
Випадковий патент: Вузол з'єднання елементу, який фіксується, з валом турбомашини