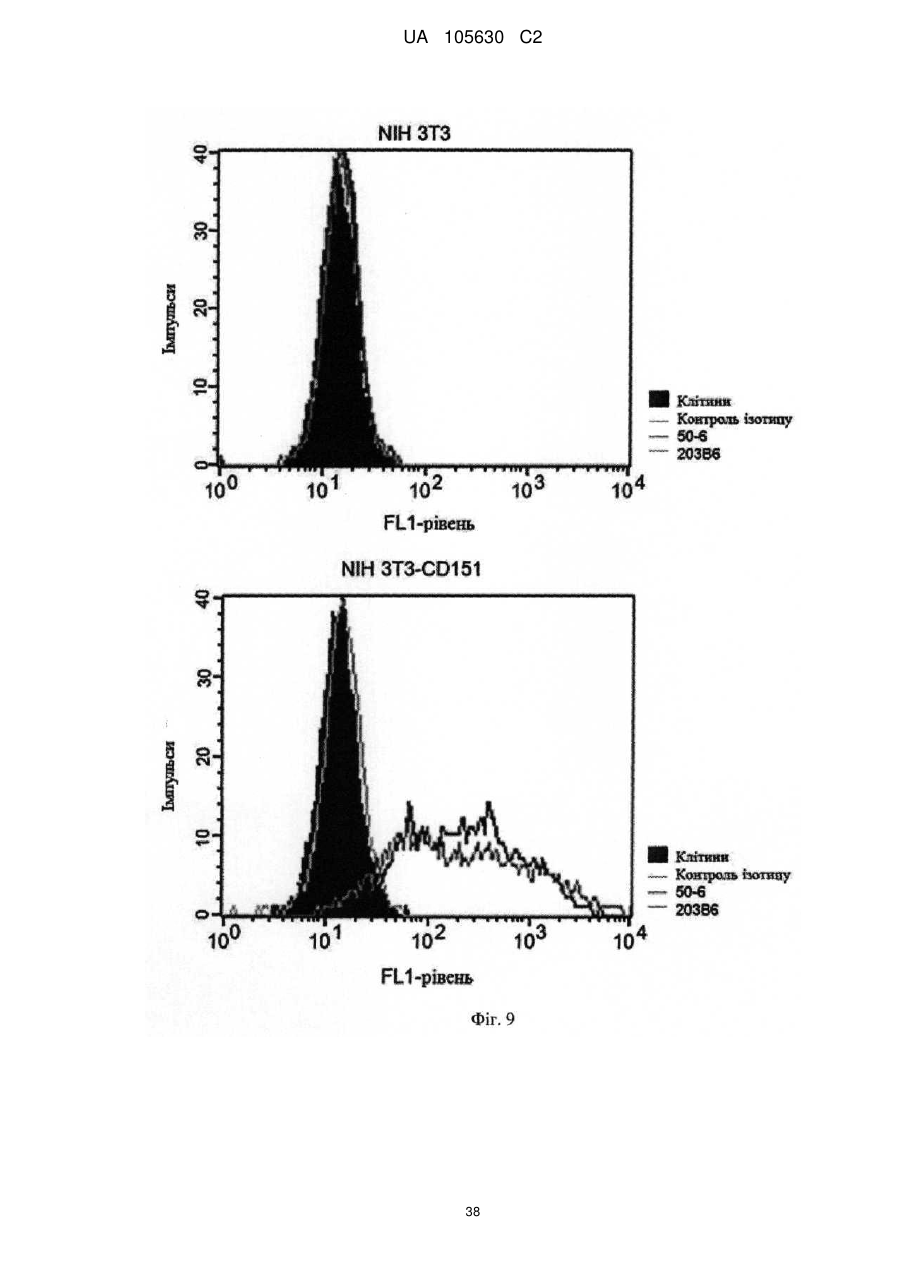
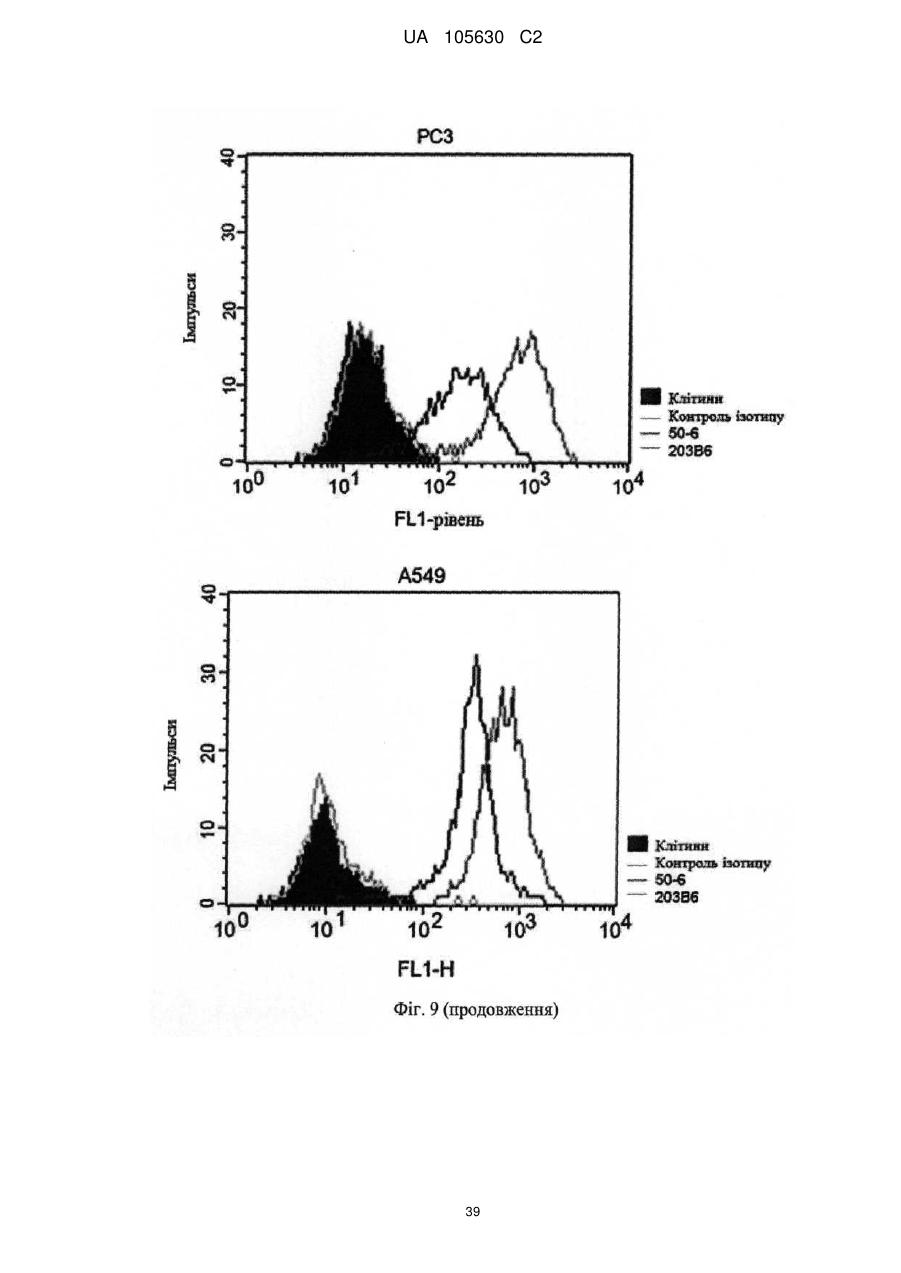
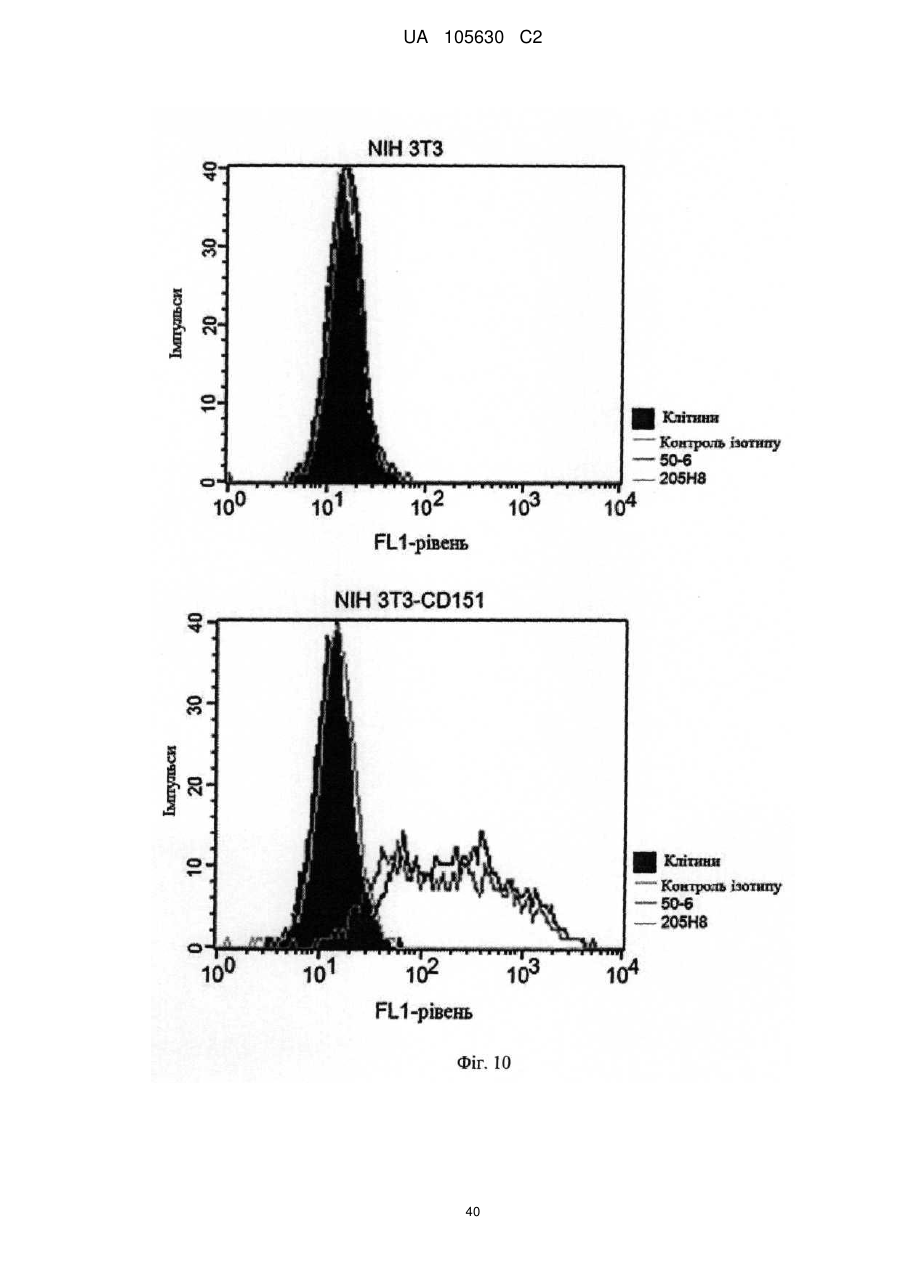
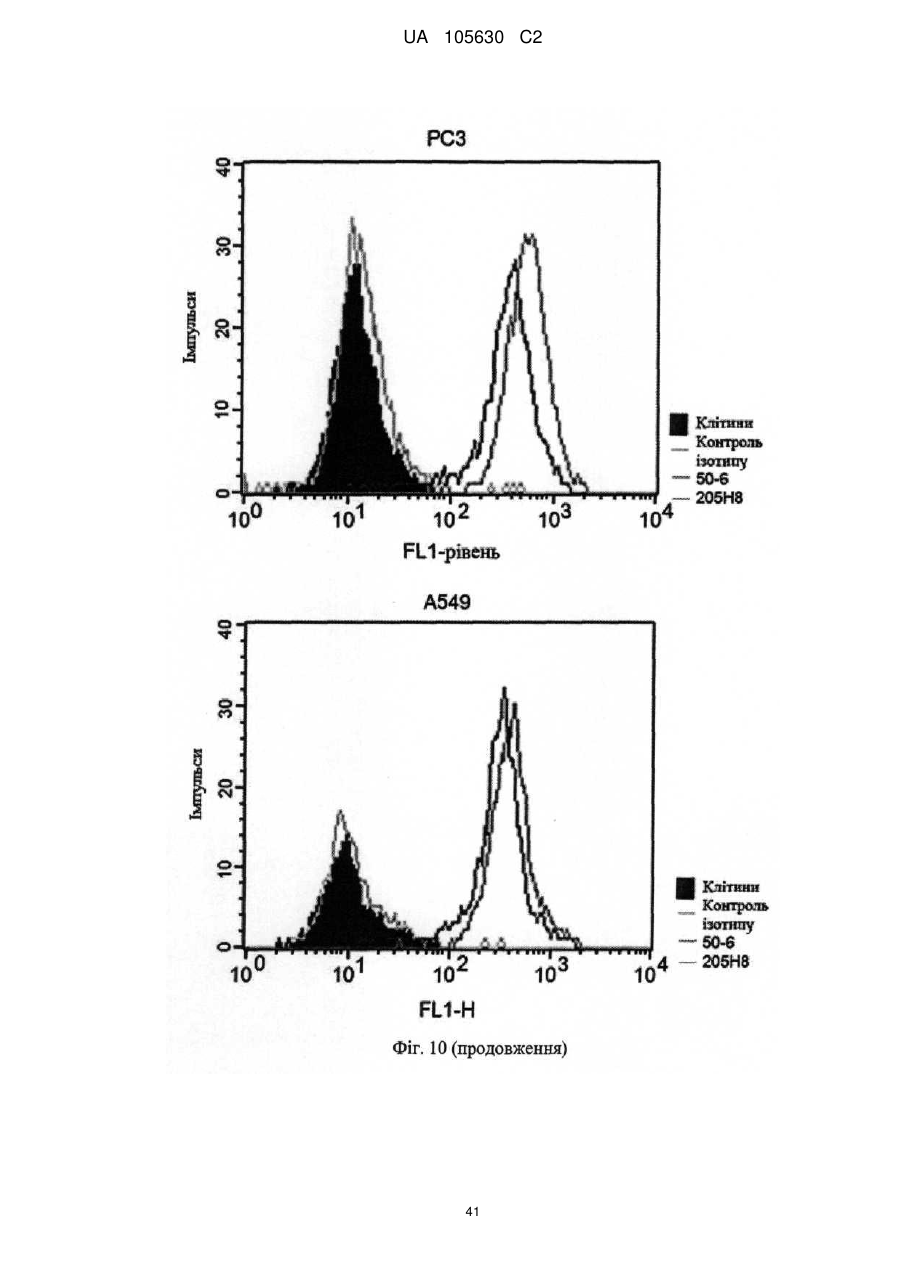
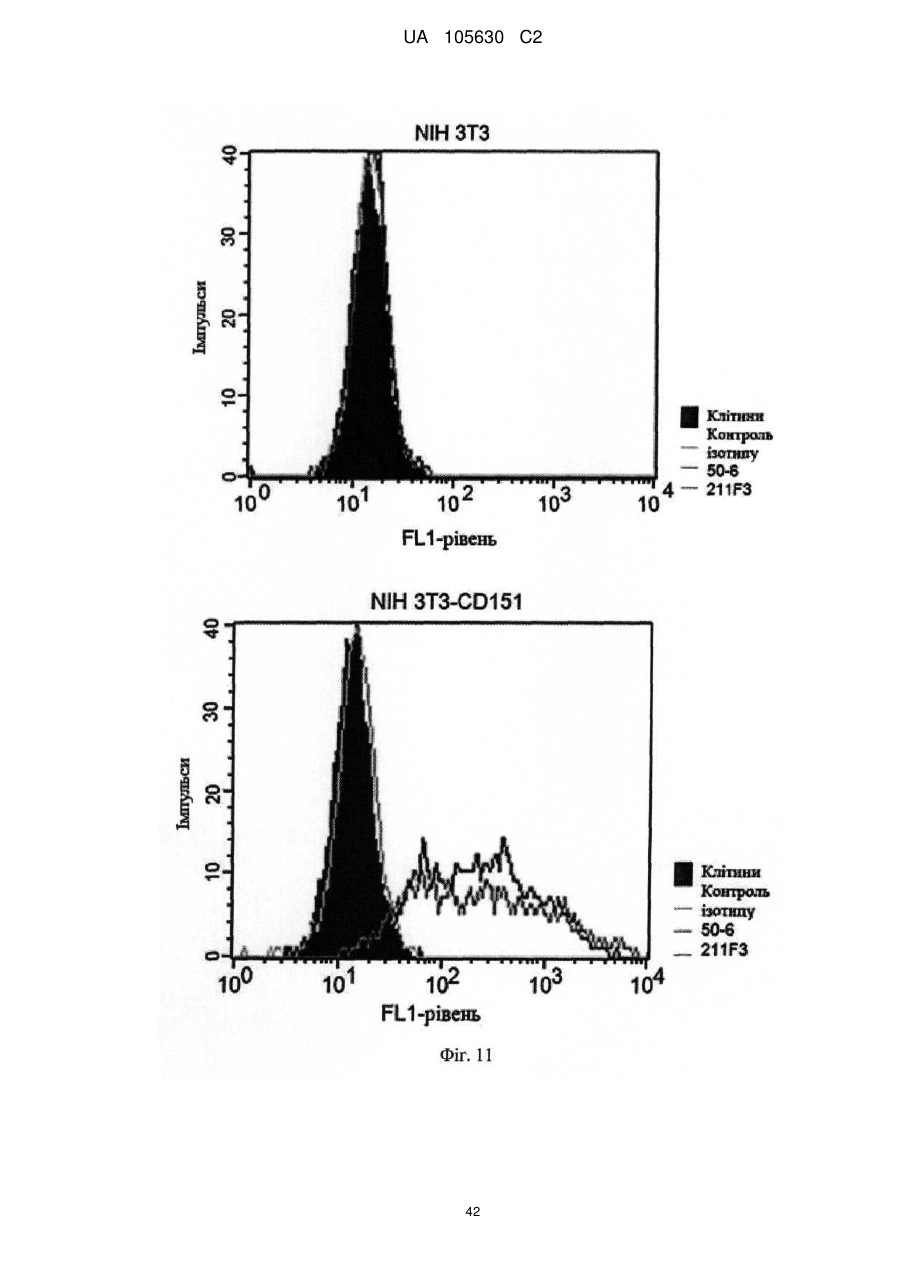
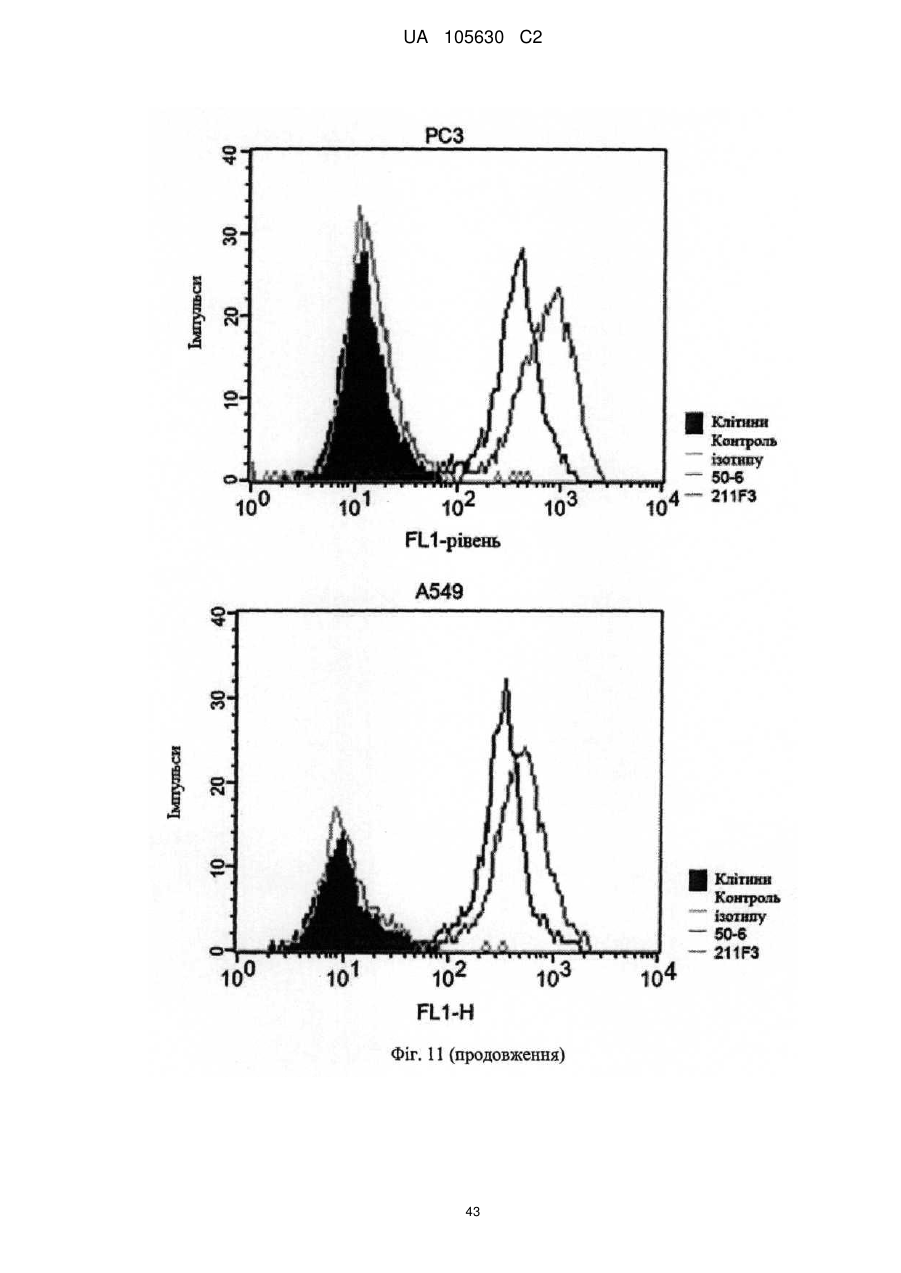
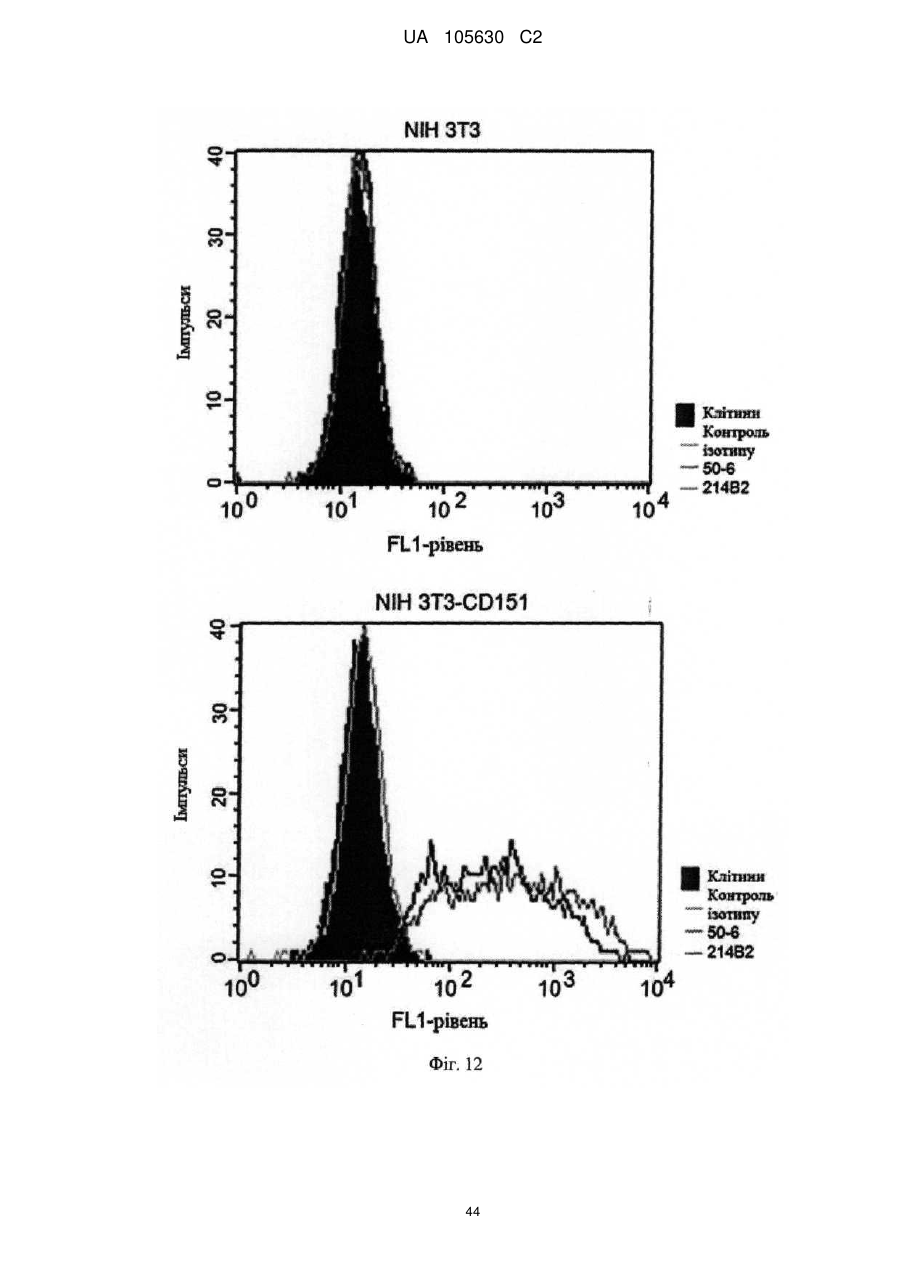
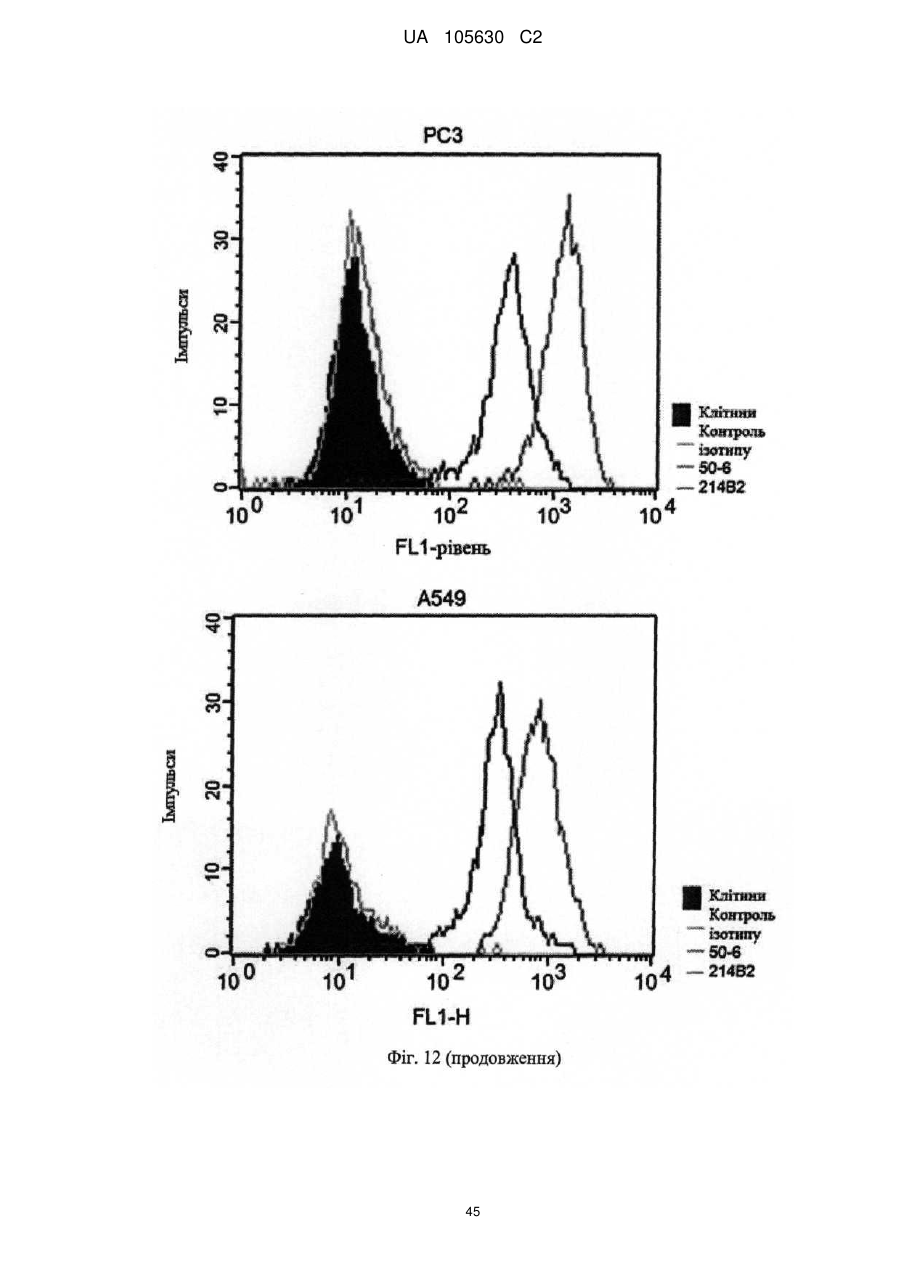
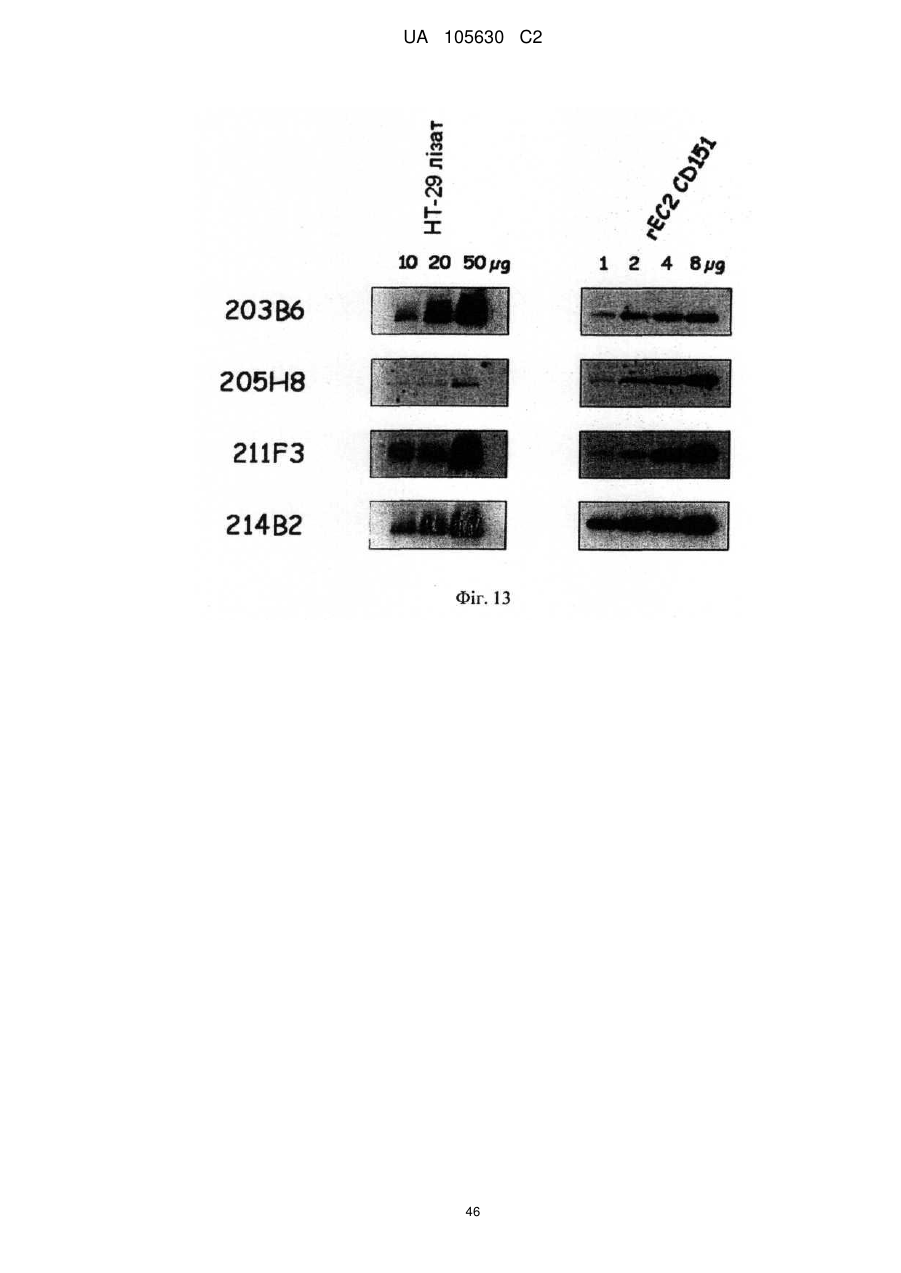
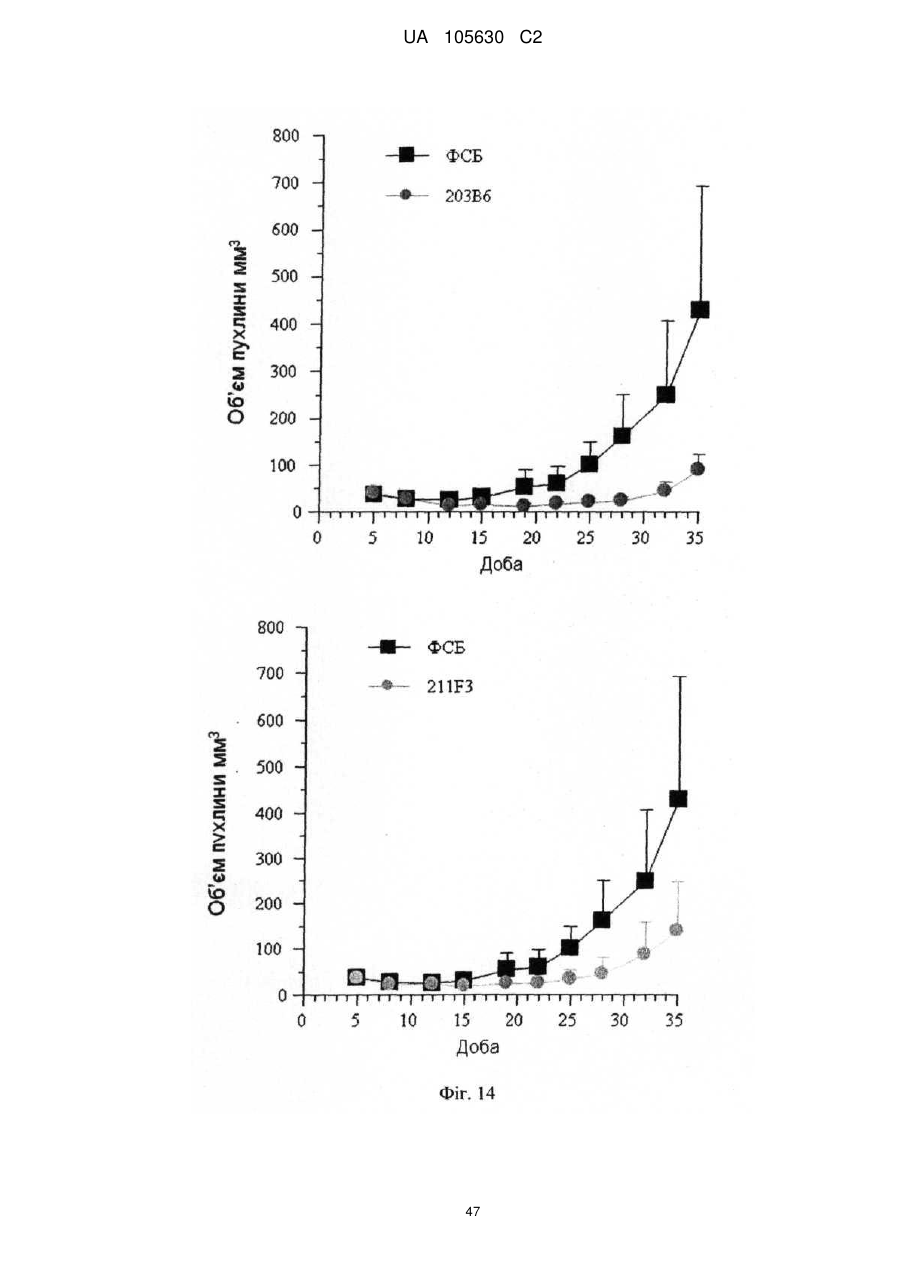
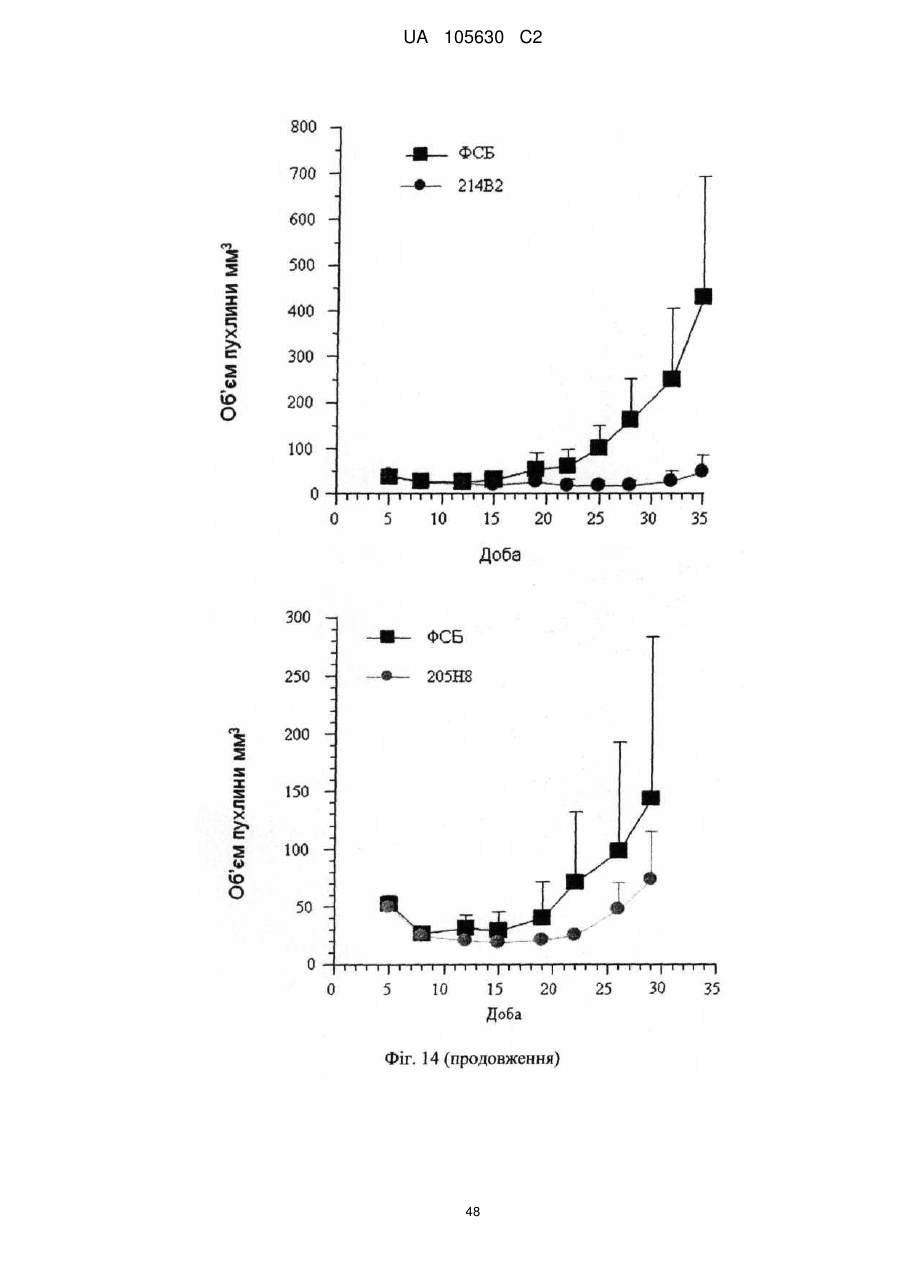
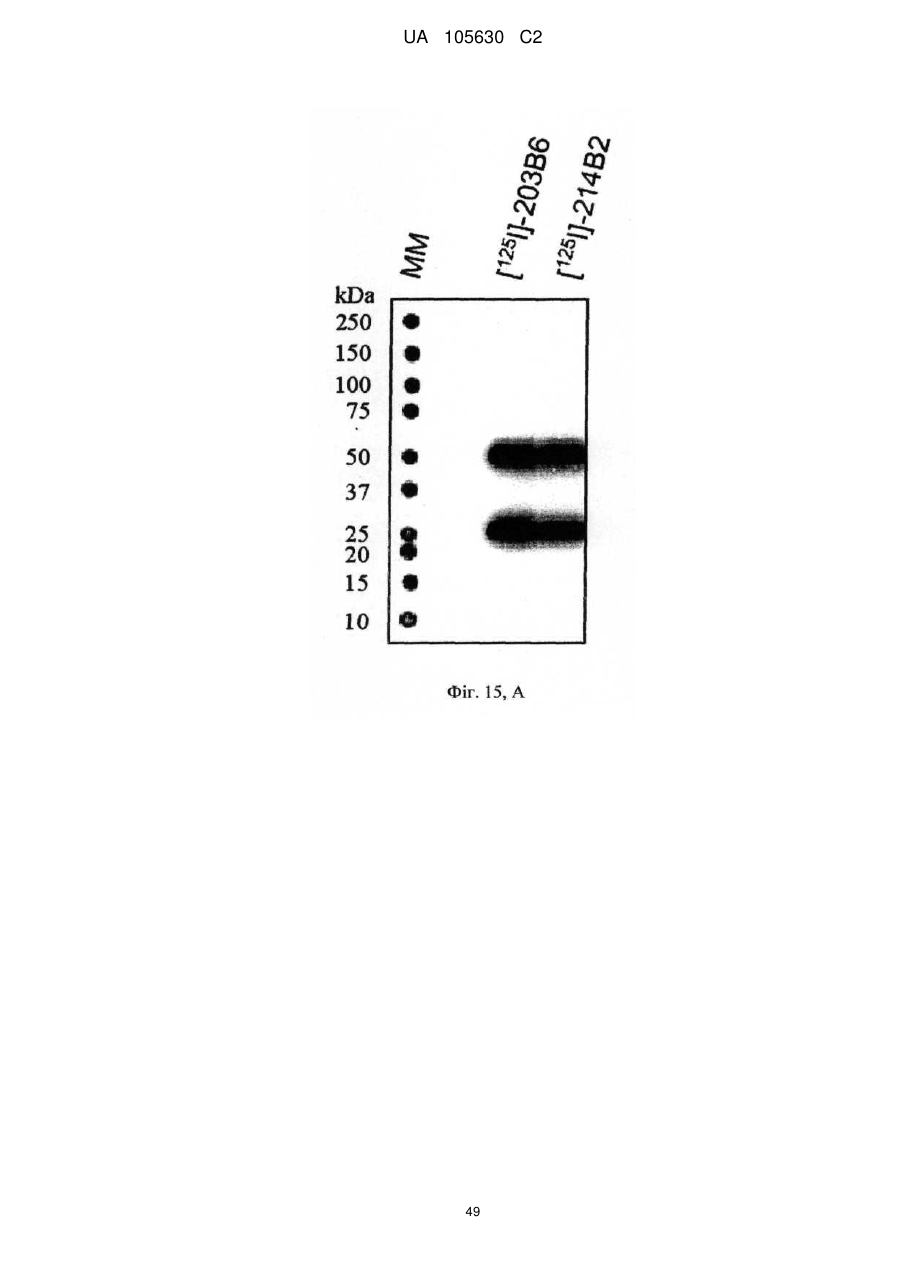
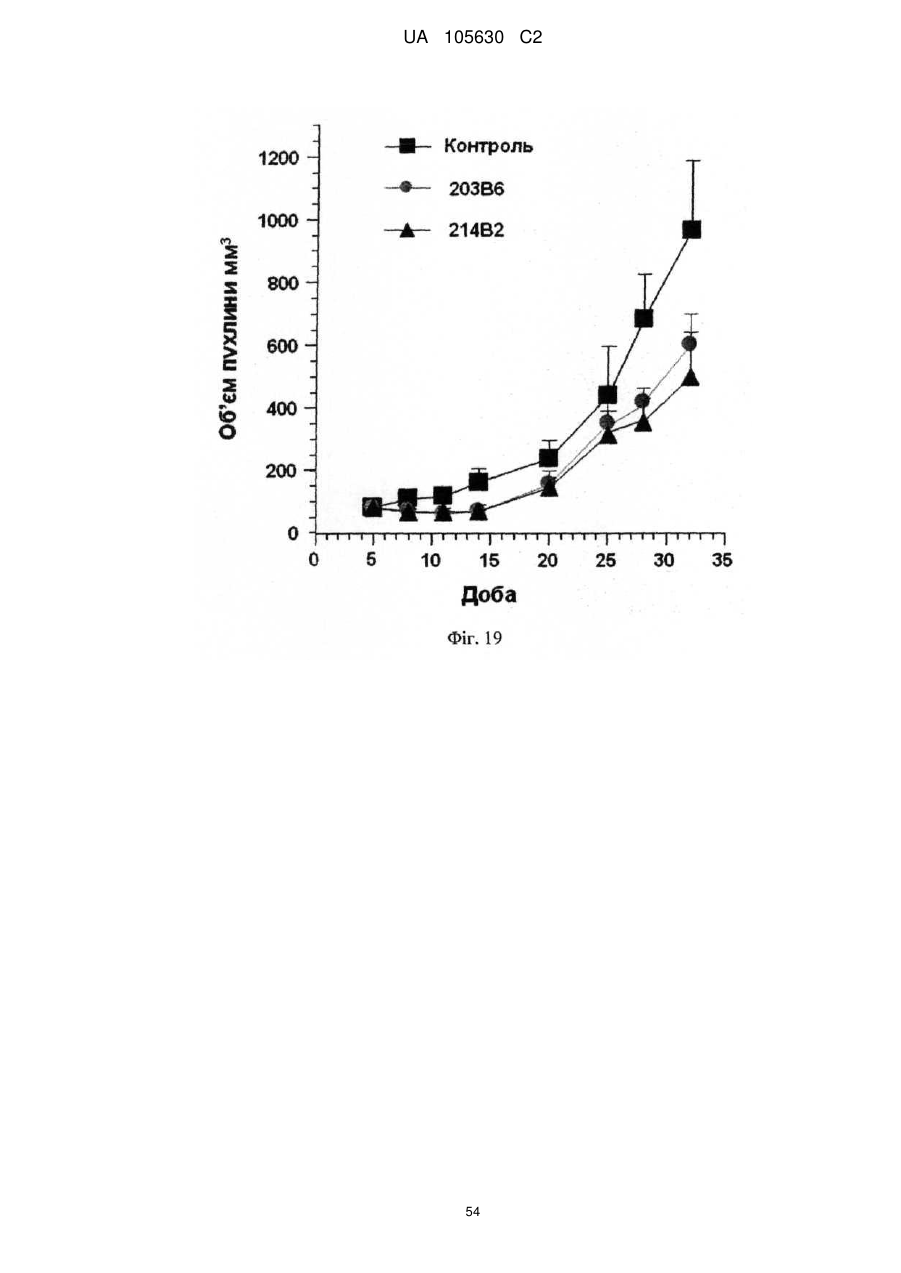
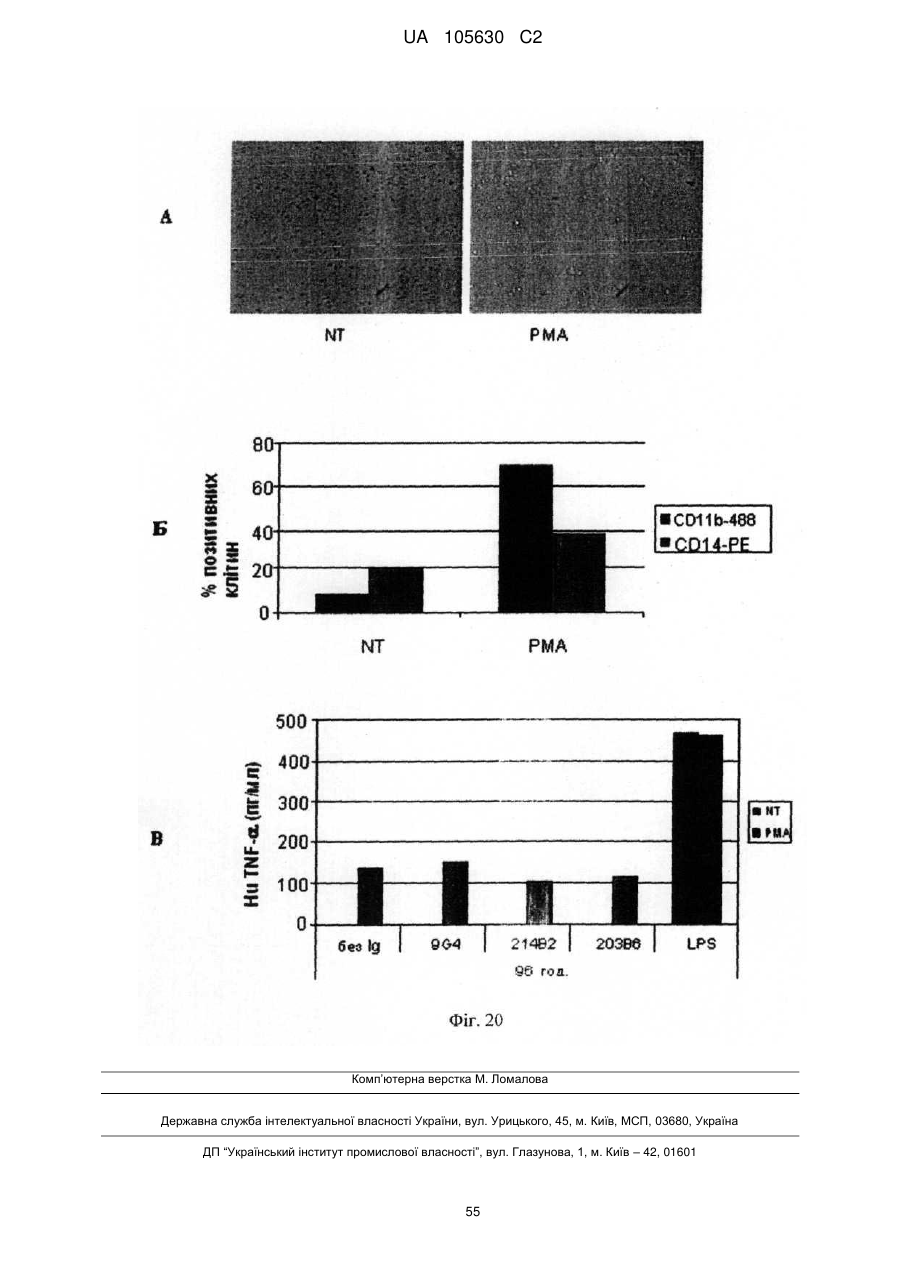
Нові антитіла, які використовуються при лікуванні раку
Формула / Реферат
1. Ізольоване антитіло або одна з його похідних сполук, або функціональних фрагментів, здатне до зв'язування з білком CD151 та здатне інгібувати пухлинний ріст in vivo, яке вибрано з групи, що складається з:
а) антитіла або одної з його похідних сполук, або функціональних фрагментів, що включає:
і) легкий ланцюг, що включає 3 CDR, визначені відповідно до системи нумерації IMGT, CDR-L1 послідовності SEQ ID NО: 1, CDR-L2 послідовності SEQ ID NО: 2 та CDR-L3 послідовності SEQ ID NО: 3, відповідно; та
ii) важкий ланцюг, що включає 3 CDR, визначені відповідно до системи нумерації IMGT, CDR-H1 послідовності SEQ ID NО: 4, CDR-H2 послідовності SEQ ID NО: 5 та CDR-H3 послідовності SEQ ID NО: 6, відповідно;
б) антитіла або одної з його похідних сполук, або функціональних фрагментів, що включає:
і) легкий ланцюг, що включає 3 CDR, визначені відповідно до системи нумерації IMGT, CDR-L1 послідовності SEQ ID NО: 17, CDR-L2 послідовності SEQ ID NО: 18 та CDR-L3 послідовності SEQ ID NО: 19, відповідно; та
ii) важкий ланцюг, що включає 3 CDR, визначені відповідно до системи нумерації IMGT, CDR-H1 послідовності SEQ ID NО: 20, CDR-H2 послідовності SEQ ID NО: 21 та CDR-H3 послідовності SEQ ID NО: 22, відповідно;
в) антитіла або одної з його похідних сполук, або функціональних фрагментів, що включає:
і) легкий ланцюг, що включає 3 CDR, визначені відповідно до системи нумерації IMGT, CDR-L1 послідовності SEQ ID NО: 33, CDR-L2 послідовності SEQ ID NО: 2 та CDR-L3 послідовності SEQ ID NО: 3, відповідно; та
ii) важкий ланцюг, що включає 3 CDR, визначені відповідно до системи нумерації IMGT, CDR-H1 послідовності SEQ ID NО: 4, CDR-H2 послідовності SEQ ID NО: 34 та CDR-H3 послідовності SEQ ID NО: 35, відповідно; та
г) антитіла або одної з його похідних сполук, або функціональних фрагментів, що включає:
і) легкий ланцюг, що включає 3 CDR, визначені відповідно до системи нумерації IMGT, CDR-L1 послідовності SEQ ID NО: 43, CDR-L2 послідовності SEQ ID NО: 44 та CDR-L3 послідовності SEQ ID NО: 45, відповідно; та
ii) важкий ланцюг, що включає 3 CDR, визначені відповідно до системи нумерації IMGT, CDR-H1 послідовності SEQ ID NО: 46, CDR-H2 послідовності SEQ ID NО: 47 та CDR-НЗ послідовності SEQ ID NО: 48, відповідно.
2. Антитіло за п. 1, яке вибрано з групи, що складається з:
а) антитіла або одної з його похідних сполук, або функціональних фрагментів, що включає легкий ланцюг, що включає амінокислотну послідовність SEQ ID NО: 7, та важкий ланцюг, що включає амінокислотну послідовність SEQ ID NО: 8;
б) антитіла або одної з його похідних сполук, або функціональних фрагментів, що включає легкий ланцюг, що включає амінокислотну послідовність SEQ ID NО: 23, та важкий ланцюг, що включає амінокислотну послідовність SEQ ID NО: 24;
в) антитіла або одної з його похідних сполук, або функціональних фрагментів, що включає легкий ланцюг, що включає амінокислотну послідовність SEQ ID NО: 36, та важкий ланцюг, що включає амінокислотну послідовність SEQ ID NО: 37;
г) антитіла або одної з його похідних сполук, або функціональних фрагментів, що включає легкий ланцюг, що включає амінокислотну послідовність SEQ ID NО: 49, та важкий ланцюг, що включає амінокислотну послідовність SEQ ID NО: 50.
3. Мишача гібридома, здатна секретувати антитіло за одним з попередніх пунктів, яка вибрана з групи, що складається з гібридоми, депонованої у CNCM, Інститут Пастера, Париж (Франція) 22 лютого 2008 під номером І-3920; гібридоми, депонованої у CNCM, Інститут Пастера, Париж (Франція) 22 лютого 2008 під номером І-3921; гібридоми, депонованої у CNCM, Інститут Пастера, Париж (Франція) 21 лютого 2008 підномером I-3918, та гібридоми, депонованої у CNCM, Інститут Пастера, Париж (Франція) 21 лютого 2008 під номером І-3919.
4. Ізольована нуклеїнова кислота, яка характеризується тим, що вона вибрана з наведених нижче нуклеїнових кислот:
а) нуклеїнової кислоти ДНК або РНК, що кодує антитіло або одну з його похідних сполук, або функціональних фрагментів за будь-яким з пп. 1 та 2; та
б) нуклеїнової кислоти, комплементарної нуклеїновій кислоті за п. а).
5. Вектор, що включає нуклеїнову кислоту за п. 4.
6. Клітина-хазяїн, що включає вектор за п. 5.
7. Трансгенна тварина, за винятком людини, що включає клітину за п. 6.
8. Спосіб продукування антитіла або однієї з його похідних сполук, або функціональних фрагментів за будь-яким з пп. 1 та 2, який характеризується тим, що включає такі стадії:
а) культивування клітини за п. 6 у придатному культуральному середовищі та у придатних умовах культивування; та
б) виділення антитіл або їх функціональних фрагментів, продукованих за допомогою цього, з культурального середовища або з культивованих клітин.
9. Антитіло або одна з його похідних сполук, або функціональних фрагментів, яке може бути отримане способом за п. 8.
10. Композиція, що включає як активний інгредієнт сполуку, що складається з антитіла або одного з його функціональних фрагментів за будь-яким з пп. 1, 2 та 9 або продуковану гібридомою за п. 3.
11. Композиція за п. 10, яка характеризується тим, що вона додатково включає як комбінований препарат для одночасного, окремого або диференційованого у часі застосування антитіло, цитотоксичний/цитостатичний агент, клітинний токсин або радіоактивний елемент.
12. Композиція за будь-яким з пп. 10 або 11, що є ліками.
13. Застосування антитіла або одного з його функціональних фрагментів за будь-яким з пп. 1, 2 та 9 або продукованого гібридомою за п. 3 та/або композиції за будь-яким з пп. 10-12 у виготовленні ліків, призначених для попередження або лікування раку.
14. Застосування за п. 13, яке характеризується тим, що рак є раком, вибраним з раку простати, раку легені, раку ободової кишки, раку молочної залози або раку підшлункової залози.
15. Спосіб діагностики in vitro захворювань, які характеризуються гіперекспресією або недостатньою експресією білка CD151, починаючи з біологічного зразка, у якому підозрюють аномальну присутність CD151, який характеризується тим, що біологічний зразок вводять в контакт із антитілом за будь-яким з пп. 1, 2 та 10 або продукованим гібридомою за п. 3, причому антитіло при необхідності може бути міченим.
Текст
Реферат: Винахід стосується нових антитіл або одної з їх похідних сполук, або функціональних фрагментів, здатних до зв'язування з білком CD151 та здатних інгібувати пухлинний ріст in vivo. UA 105630 C2 (12) UA 105630 C2 Винахід також стосується способу продукування відповідних антитіл, амінокислотних і нуклеїново-кислотних послідовностей, які кодують ці антитіла, вектору, що кодує відповідну нуклеїнову кислоту, клітин-хазяїв, що включає зазначений вектор та трансгенної тварини, що містить зазначену клітину. Винахід стосується застосування антитіл як ліків для профілактичного та/або терапевтичного лікування раку та способів або наборів для діагностики захворювань, пов'язаних з гіперекспресією білка CD151, а також препаратів та/або композицій, що включають ці антитіла та їх застосування для попередження та/або лікування деяких раків. UA 105630 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід стосується нових антитіл, зокрема, моноклональних антитіл мишачого походження, які є химерними та гуманізованими, і які здатні інгібувати пухлинний ріст, а також амінокислотних та нуклеотидних послідовностей, що кодують ці антитіла. Відповідно до конкретного аспекту, винахід стосується нових антитіл, похідних сполук або функціональних фрагментів, які здатні інгібувати проліферацію пухлинних клітин. Винахід також включає застосування цих антитіл як ліків для профілактичного та/або терапевтичного лікування раку, а також у способах та наборах для діагностики раку. Нарешті, винахід включає препарати та/або композиції, що містять такі антитіла у комбінації, наприклад, з протираковими агентами та/або антитілами, або кон'юговані з токсинами, та їх застосування при запобіганні та/або лікуванні деяких раків. CD151, також називаний PETA-3 або SFA-1, є мембранним білком, що належить до сімейства тетраспаніну (Boucheix and Rubinstein, 2001, Cell Mol. Life Sci. 58, 1189-1205; Hemler, 2001, J. Cell Biol. 155, 1103-1107). У людей CD151 має 253 амінокислоти та включає 4 мембранних фрагмента й 2 позаклітинних домена EC1 (18 амінокислот, послідовність [40-57]) і EC2 (109 амінокислот, послідовність [113-221]), які також називають позаклітинними петлями. Слід зазначити, однак, що в нуклеотидній послідовності дотепер ідентифіковано два варіанти CD151, а саме перший, що має нуклеотиди A та C у положеннях 395 і 409, відповідно [Fitter et al., 1995, Blood 86(4), 1348-1355], та другий, що має у цих же положеннях нуклеотиди G і T замість нуклеотидів A і C [Hasegawa et al., 1996, J. Virol. 70(5), 3258-3263]. В результаті можна спостерігати мутацію у пептидній послідовності, а саме мутацію залишків K (Lys) і P (Pro) у положеннях 132 і 137, відповідно, на залишки R (Arg) і S (Ser) [Fitter et al., 1995, Blood 86(4), 1348-1355/Hasegawa et al., 1996, J. Virol. 70(5), 3258-3263]. CD151 зазнає гіперекспресії при різних раках, таких як, наприклад, раки легенів [Tokuhara et al., 2001, Clin. Cancer Res. 7, 4109-4114], ободової кишки [Hashida et al., 2003, Br. J. Cancer 89, 158-167], простати [Ang et al., 2004, Cancer Epidemiol. Biomarkers Prev. 13, 1717-1721] або підшлункової залози [Gesierich et al., 2005, Clin. Cancer Res. 11, 2840-2852]. Використання нокаут-мишей, які не експресують CD151, й антитіл анти-CD151 та міРНК (малої інтерферуючої РНК) для блокування in vitro функціональності та експресії CD151 у різних типах клітин дало можливість показати, що CD151 залучений у ряді подій, пов'язаних з раком, таких як клітинна адгезія (Nishiuchi et al., 2005, Proc. Natl. Acad. Sci. USA 102, 1939-1944; Winterwood et al., 2006, Mol. Biol. Cell 17, 2707-2721), клітинна рухливість (Kohno et al., 2002, Int. J. Cancer 97, 336-343), міграція клітин (Yauch et al., 1998, Mol. Biol. Cell 9, 2751-2765; Testa et al., 1999, Cancer Res. 59, 3812-3820; Penas et al., 2000, J. Invest. Dermatol. 114, 1126-1135; Klosek et al., 2005, Biochem. Biophys. Res. Commun. 336, 408-416), інвазія клітин (Kohno et al., 2002, Int. J. Cancer 97, 336-343; Shiomi et al., 2005, Lab. Invest. 85, 1489-1506; Hong et al., 2006, J. Biol. Chem. 281, 24279-24292) та ангіогенез (Yanez-Mo et al., 1998, J. Cell Biol. 141, 791-804; Sincock et al., 1999, J. Cell Sci. 112, 833-844; Takeda et al., 2007, Blood 109, 1524-1532). Однією з вартих уваги властивостей тетраспанінів є їх здатність до утворення асоціацій один з одним, а також з великою кількістю інших поверхневих молекул, так що вони утворюють структуровані макромолекулярні комплекси. У межах цих комплексів кожен тетраспанін специфічно асоційований з однією або декількома поверхневими молекулами, утворюючи за допомогою цього первинні комплекси, що складаються з тетраспаніну та молекули-партнера. Тетраспаніни здатні організувати часткові мікродомени плазматичної мембрани, звідки вони можуть рекрутувати своїх молекул-партнерів, які можуть бути функціонально зв'язані. Цей ряд взаємодій, у яких беруть участь тетраспаніни, названий "мережею тетраспанінів" або "тетраспаніновою павутиною". CD151 взаємодіє на поверхні клітин з різними мембранними білками. Зокрема, ідентифіковані високостабільні комплекси, стійкі до дії деяких детергентів, з інтегринами, що є рецепторами ламінінів, конкретніше, з інтегринами α3β1 або α6β4, кращим лігандом яких є ламінін 5 (Yauch et al., 1998, Mol. Biol. Cell 9, 2751-2765; Lammerding et al., 2003, Proc. Natl. Acad. Sci USA 100, 7616-7621). У цій асоціації задіяні позаклітинні домени CD151 та інтегрини. Послідовність QRD [194-196] CD151, локалізована у петлі EC2, дуже важлива у цій асоціації, оскільки мутація цього сайту викликає втрату взаємодії з деякими інтегринами (Kazarov et al., 2002, J. Cell Biol. 158, 1299-1309). Функціональні потрійні комплекси CD151/інтегрин α6β4/c-met (рецептор HGF), крім того, ідентифіковані у пухлинних клітинах (Klosek et al., 2005, Biochem. Biophys. Res. Commun. 336, 408-416). Інгібування експресії CD151 в результаті обробки клітин інтерферуючою РНК приводить в результаті до інгібування клітинного росту та міграції, викликаної HGF. Взаємодії усередині конкретної клітини між CD151 та іншими тетраспанінами, необхідні для утворення мережі тетраспанінів, вважають залежними від мембранної та цитоплазматичної 1 UA 105630 C2 5 10 15 20 25 30 35 40 45 50 55 60 областей CD151, оскільки показано, що делеція петлі EC2 не перериває асоціацію CD151 з іншими тетраспанінами (Berditchevski, 2001, J. Cell Sci. 114, 4143-4151). CD151 здатний до регулювання подій клітинної адгезії, міграції та інвазії за допомогою модулювання різних біохімічних шляхів передачі сигналу, таких як, наприклад, фосфоінозитидний шлях, за допомогою асоціації з PI 4-кіназою (Yauch et al., 1998, Mol. Biol. Cell 9, 2751-2765), шлях передачі сигналу c-Jun за допомогою фосфорилювання FAK, Src, p38MAPK і JNK (Hong et al., 2006, J. Biol. Chem. 281, 24279-24292), фосфорилювання інтегринів PKC (Zhang et al., 2001, J. Biol. Chem. 276, 25005-25013) та активації ГТФаз сімейства Rho (Shigeta et al., 2003, J. Cell Biol. 163, 165-176). Взаємодії гомофільного типу між клітинами також відповідають за підвищення рухливості клітин та експресію металопротеїнази MMP-9 (Hong et al., 2006, J. Biol. Chem. 281, 2427924292). Ці внутрішньоклітинні взаємодії CD151-CD151 викликають активацію c-Jun за допомогою фосфорилювання FAK, Src, p38-MAPK і JNK. Незважаючи на інтерес до білка CD151, на цей час створено два антитіла терапевтичної спрямованості, а саме моноклональні антитіла 50-6 і SFA1.2B4. Ці 2 антитіла мають порівнянні активності. Хоча вони дійсно інгібують утворення метастазів in vivo на тваринних моделях, ефект на пухлинний ріст in vivo не встановлений. Моноклональне антитіло 50-6 (ізотип Igg1), спрямоване на CD151, було отримано у миші шляхом субтрактивних імунізацій клітинами епідермоїдної карциноми людини Hep-3 (Testa et al., 1999, Cancer Res. 59, 3812-3820). Антитіло 50-6 є здатним до інгібування in vitro міграції клітин карциноми шийки матки людини Hela, трансфекованих з одержанням гіперекспресії CD151, та клітин Hep-3 і ангіогенезу в моделі неоваскуляризації хоріоалантоїсної мембрани, викликаної bFGF (основним фактором росту фібробластів). In vivo він інгібує метастази, викликані інокуляцією клітин Hep-3, у 2 моделях курячих ембріонів (Testa et al., 1999, Cancer Res. 59, 3812-3820). У цих моделях інгібиторну активність антитіла 50-6 визначають шляхом вимірювання активності білка huPA (людського активатора плазміногену урокіназного типу) у легеневих екстрактах. Згідно з цими авторами, даний аналіз відібражає наявність людських клітин у легенях. Після аналізу зниження метастазів (дисемінації клітин Hep-3 у легенях курячих ембріонів), яке викликано антитілом 506, у порівнянні з контрольним антитілом оцінюють як 74 % у так званій моделі "спонтанних метастазів", у якій після інокуляції клітин проводять ін'єкцію антитіла, і 57 % у так званій моделі "експериментальних метастазів", у якій клітини та антитіло інокулюють разом. Згідно з авторами, протипухлинні властивості антитіла 50-6, які спостерігали in vivo, очевидно, не пов'язані з цитостатичним або цитотоксичним ефектом, оскільки антитіло не показало ніякого ефекту на проліферацію клітин Hep-3 in vitro. Гібридома, що продукує антитіло 50-6, є в ATCC за номером у каталозі CRL-2696 (гібридома спочатку депонована за номером у каталозі 50-6 [PTA-227]). Моноклональне антитіло анти-CD151 SFA1.2B4 (ізотип Igg1) було отримано у миші після імунізації внутрішньочеревним шляхом клітинами NIH 3T3, трансфекованими людським геном CD151 (Hasegawa et al., 1996, J. Virol. 70, 3258-3263). Антитіло SFA1.2B4 здатне до інгібування in vitro клітинної інвазії та рухливості різних людських пухлинних клітинних ліній (Kohno et al., 2002, Int. J. Cancer 97, 336-343). Воно інгібує in vivo легеневі метастази, викликані лініями раку ободової кишки RPMI14788 та фібросаркоми HT1080, трансфековані таким чином, щоб здійснювати гіперекспресію CD151 (Kohno et al., 2002, Int. J. Cancer 97, 336-343). Інші мишачі антитіла анти-CD151 описані в літературі, такі як, наприклад, моноклональні антитіла 14A2H1 (Ashman et al., 1991, Br. J. Haematol. 79, 263-270; Roberts et al., 1995, Br. J. Haematol. 89, 853-860), TS151 та TS151R (Serru et al., 1999, Biochem. J. 340, 103-111; Geary et al., 2001, Tissue Antigens 58, 141-153; Charrin et al., J. Biol. Chem. 276, 14329-14337; Chometon et al., 2006, Exp. Cell Res. 312, 983-985). Для жодного з цих різних антитіл не описана протипухлинна активність in vivo. У декількох експериментальних дослідженнях показана основна роль тетраспанінів в утворенні метастазів шляхом дії або як супресори, або як стимулятори метастазів. Відповідно, трансфекція тетраспанінів, таких як CD9, CD63 або CD82, знижує метастатичний потенціал ракових ліній. На противагу цьому, експресія тетраспанінів CD151 і Co-029, певно, викликає протилежний ефект. Ці два тетраспаніни, отже, вважають стимуляторами метастазів. Ці результати узгоджуються з різними клінічними дослідженнями, які показали, що у ряді раків (молочної залози, легені, стравоходу, шлунка, печінки, підшлункової залози, ободової кишки, простати, меланоми, …) CD9 і CD82 меншою мірою експресуються у первинних пухлинах, коли присутні метастази, і що зниження їх експресії є прогнозом більш низької ймовірності виживання. При раку легені виявлена кореляція поєднання зниження експресії CD9 і CD82 з 2 UA 105630 C2 5 10 15 20 25 30 35 40 45 50 55 60 вищим метастатичним потенціалом у порівнянні з випадком, коли знижена експресія тільки одного з цих двох антигенів. У декількох ретроспективних дослідженнях показано, що гіперекспресія CD151 поєднана з агресивністю деяких раків, таких як рак легені, ободової кишки та простати, і що її можна розглядати як фактор неблагополучного прогнозу (Tokuhara et al., 2001, Clin. Cancer Res. 7, 4109-4114; Hashida et al., 2003, Br. J. Cancer 89, 158-167; Ang et al., 2004, Cancer Epidemiol. Biomarkers Prev. 13, 1717-1721). У цих випадках середня виживаність дійсно знижена у пацієнтів, що мають пухлини, які експресують CD151, у порівнянні з пацієнтами, у яких не експресується CD151. Гіперекспресія CD151 у різних пухлинних лініях людини (Hela, RPMI14788, A172, HT1080), викликана трансфекцією відповідного гена, викликала підвищення рухливості, міграції та інвазії трансфекованих клітин (Testa et al., 1999, Cancer Res. 59, 3812-3820; Kohno et al., 2002, Int. J. Cancer 97, 336-343). Ці події інгібовані у присутності антитіл анти-CD151. Відповідно до першого аспекту винахід стосується ізольованого антитіла, або однієї з його похідних сполук, або функціональних фрагментів, здатних до зв'язування білка CD151, де зазначене антитіло характеризується тим, що воно включає щонайменше одну CDR, вибрану з CDR послідовності SEQ ID No. 1-6, 17-22, 33-35, 43-48, 59-63, 69-73, 79-81 або 85-89, або щонайменше одну CDR, послідовність якої характеризується щонайменше 80 %, краще 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 1-6, 17-22, 33-35, 43-48, 59-63, 69-73, 79-81 або 85-89. "Функціональний фрагмент" антитіла відповідно до винаходу розуміють як такий, що стосується, зокрема, фрагмента антитіла, такого як Fv, scFV (sc позначає "одноланцюговий"), Fab, F(ab')2, Fab', або scFV-Fc фрагмента, або діатіла, або будь-якого фрагмента, час напівжиття якого може бути підвищений. Такі функціональні фрагменти докладніше розглядаються у описі даного патенту нижче. "Похідну сполуку" антитіла відповідно до винаходу розуміють як таку, що позначає, зокрема, зв'язувальний білок, що включає пептидну рамку зчитування, або "каркас", і щонайменше одну з CDR вихідного антитіла з метою збереження його розпізнавальної спроможності. Такі похідні сполуки добре відомі фахівцям у даній галузі техніки та докладніше описані в описі даного патенту нижче. У кращому випадку винахід включає антитіла, їх похідні сполуки, або їх функціональні фрагменти відповідно до даного винаходу, які є, зокрема, химерними або гуманізованими, тобто отримані шляхом генетичної рекомбінації, або шляхом хімічного синтезу. Відповідно до кращої форми здійснення антитіло, або одна з його похідних сполук, або функціональних фрагментів відповідно до винаходу характеризується тим, що складається з моноклонального антитіла. "Моноклональне антитіло" слід розуміти як антитіло, що походить з популяції по суті гомогенних антитіл. Конкретніше, індивідуальні антитіла популяції ідентичні за винятком деяких можливих мутацій, які можуть бути отримані природним шляхом, і які можуть бути присутніми у мінімальних кількостях. Іншими словами, моноклональне антитіло складається з гомогенного антитіла, отриманого в результаті проліферації тільки одного клітинного клону (наприклад, гібридоми, еукаріотичної клітини-хазяїна, трансфекованої молекулою ДНК, що кодує гомогенне антитіло, прокаріотичної клітини-хазяїна, трансфекованої молекулою ДНК, що кодує гомогенне антитіло, і т.д.), яке звичайно характеризується важкими ланцюгами того самого класу та підкласу та легкими ланцюгами тільки одного типу. Моноклональні антитіла є високоспецифічними та спрямовані на єдиний антиген. Крім того, на противагу препаратам поліклональних антитіл, які звичайно включають різні антитіла, спрямовані на різні детермінанти або епітопи, кожне моноклональне антитіло спрямоване на єдиний епітоп антигену. Тут має бути зрозуміло, що винахід не стосується антитіл у природній формі, тобто, вони не взяті з їх природного оточення, але, імовірніше, їх можна виділити або отримати шляхом очищення, починаючи з природних джерел, або інакше отримати їх шляхом генетичної рекомбінації, або шляхом хімічного синтезу, і вони можуть, відповідно, включати неприродні амінокислоти, як описано у даній заявці нижче. Конкретніше, відповідно до першої форми здійснення винаходу, описане перше антитіло, яке характеризується тим, що включає: I) легкий ланцюг, що включає щонайменше одну CDR, вибрану з CDR-L1, CDR-L2 і CDR-L3, де - CDR-L1 вибрана з CDR послідовності SEQ ID No. 1 або 59, або щонайменше однієї послідовності, яка характеризується щонайменше 80 % ідентичністю після оптимального 3 UA 105630 C2 5 10 15 20 25 30 35 40 45 50 55 60 вирівнювання з послідовністю SEQ ID No. 1 або 59; - CDR-L2 вибрана з CDR послідовності SEQ ID No. 2 або 60, або щонайменше однієї послідовності, яка характеризується щонайменше 80 % ідентичністю після оптимального вирівнювання з послідовністю SEQ ID No. 2 або 60; - CDR-L3 має послідовність SEQ ID No. 3 або щонайменше одну послідовність, яка характеризується щонайменше 80 % ідентичністю після оптимального вирівнювання з послідовністю SEQ ID No. 3; та/або II) важкий ланцюг, що включає щонайменше одну CDR, вибрану з CDR-H1, CDR-H2 і CDRH3, де - CDR-H1 вибрана з CDR послідовності SEQ ID No. 4 або 61, або щонайменше однієї послідовності, яка характеризується щонайменше 80 % ідентичністю після оптимального вирівнювання з послідовністю SEQ ID No. 4 або 61; - CDR-H2 вибрана з CDR послідовності SEQ ID No. 5 або 62, або щонайменше однієї послідовності, яка характеризується щонайменше 80 % ідентичністю після оптимального вирівнювання з послідовністю SEQ ID No. 5 або 62; - CDR-H3 вибрана з CDR послідовності SEQ ID No. 6 або 63, або щонайменше однієї послідовності, яка характеризується щонайменше 80 % ідентичністю після оптимального вирівнювання з послідовністю SEQ ID No. 6 або 63. Відповідно до другої форми здійснення винаходу описане друге антитіло, яке характеризується тим, що включає: I) легкий ланцюг, що включає щонайменше одну CDR, вибрану з CDR-L1, CDR-L2 і CDR-L3, де - CDR-L1 вибрана з CDR послідовності SEQ ID No. 17 або 69, або щонайменше однієї послідовності, яка характеризується щонайменше 80 % ідентичністю після оптимального вирівнювання з послідовністю SEQ ID No. 17 або 69; - CDR-L2 вибрана з CDR послідовності SEQ ID No. 18 або 70, або щонайменше однієї послідовності, яка характеризується щонайменше 80 % ідентичністю після оптимального вирівнювання з послідовністю SEQ ID No. 18 або 70; - CDR-L3 має послідовність SEQ ID No. 19 або щонайменше одну послідовність, яка характеризується щонайменше 80 % ідентичністю після оптимального вирівнювання з послідовністю SEQ ID No. 19; та/або II) важкий ланцюг, що включає щонайменше одну CDR, вибрану з CDR-H1, CDR-H2 і CDRH3, де - CDR-H1 вибрана з CDR послідовності SEQ ID No. 20 або 71, або щонайменше однієї послідовності, яка характеризується щонайменше 80 % ідентичністю після оптимального вирівнювання з послідовністю SEQ ID No. 20 або 71; - CDR-H2 вибрана з CDR послідовності SEQ ID No. 21 або 72, або щонайменше однієї послідовності, яка характеризується щонайменше 80 % ідентичністю після оптимального вирівнювання з послідовністю SEQ ID No. 21 або 72; - CDR-H3 вибрана з CDR послідовності SEQ ID No. 22 або 73, або щонайменше однієї послідовності, яка характеризується щонайменше 80 % ідентичністю після оптимального вирівнювання з послідовністю SEQ ID No. 22 або 73. Відповідно до наступної, третьої форми здійснення винаходу описане третє антитіло, яке характеризується тим, що включає: I) легкий ланцюг, що включає щонайменше одну CDR, вибрану з CDR-L1, CDR-L2 і CDR-L3, де - CDR-L1 вибрана з CDR послідовності SEQ ID No. 33 або 79, або щонайменше однієї послідовності, яка характеризується щонайменше 80 % ідентичністю після оптимального вирівнювання з послідовністю SEQ ID No. 33 або 79; - CDR-L2 вибрана з CDR послідовності SEQ ID No. 2 або 60, або щонайменше однієї послідовності, яка характеризується щонайменше 80 % ідентичністю після оптимального вирівнювання з послідовністю SEQ ID No. 2 або 60; - CDR-L3 має послідовність SEQ ID No. 3 або щонайменше одну послідовність, яка характеризується щонайменше 80 % ідентичністю після оптимального вирівнювання з послідовністю SEQ ID No. 3; та/або II) важкий ланцюг, що включає щонайменше одну CDR, вибрану з CDR-H1, CDR-H2 і CDRH3, де - CDR-H1 вибрана з CDR послідовності SEQ ID No. 4 або 61, або щонайменше однієї послідовності, яка характеризується щонайменше 80 % ідентичністю після оптимального вирівнювання з послідовністю SEQ ID No. 4 або 61; 4 UA 105630 C2 5 10 15 20 25 30 35 40 45 50 55 60 - CDR-H2 вибрана з CDR послідовності SEQ ID No. 34 або 80, або щонайменше однієї послідовності, яка характеризується щонайменше 80 % ідентичністю після оптимального вирівнювання з послідовністю SEQ ID No. 34 або 80; - CDR-H3 вибрана з CDR послідовності SEQ ID No. 35 або 81, або щонайменше однієї послідовності, яка характеризується щонайменше 80 % ідентичністю після оптимального вирівнювання з послідовністю SEQ ID No. 35 або 81. Нарешті, відповідно до останньої форми здійснення винаходу описане четверте антитіло, яке характеризується тим, що включає: I) легкий ланцюг, що включає щонайменше одну CDR, вибрану з CDR-L1, CDR-L2 і CDR-L3, де - CDR-L1 вибрана з CDR послідовності SEQ ID No. 43 або 85, або щонайменше однієї послідовності, яка характеризується щонайменше 80 % ідентичністю після оптимального вирівнювання з послідовністю SEQ ID No. 43 або 85; - CDR-L2 вибрана з CDR послідовності SEQ ID No. 44 або 86, або щонайменше однієї послідовності, яка характеризується щонайменше 80 % ідентичністю після оптимального вирівнювання з послідовністю SEQ ID No. 44 або 86; - CDR-L3 має послідовність SEQ ID No. 45 або щонайменше одну послідовність, яка характеризується щонайменше 80 % ідентичністю після оптимального вирівнювання з послідовністю SEQ ID No. 45; та/або II) важкий ланцюг, що включає щонайменше одну CDR, вибрану з CDR-H1, CDR-H2 і CDRH3, де - CDR-H1 вибрана з CDR послідовності SEQ ID No. 46 або 87, або щонайменше однієї послідовності, яка характеризується щонайменше 80 % ідентичністю після оптимального вирівнювання з послідовністю SEQ ID No. 46 або 87; - CDR-H2 вибрана з CDR послідовності SEQ ID No. 47 або 88, або щонайменше однієї послідовності, яка характеризується щонайменше 80 % ідентичністю після оптимального вирівнювання з послідовністю SEQ ID No. 47 або 88; - CDR-H3 вибрана з CDR послідовності SEQ ID No. 48 або 89, або щонайменше однієї послідовності, яка характеризується щонайменше 80 % ідентичністю після оптимального вирівнювання з послідовністю SEQ ID No. 48 або 89. У загальному розумінні в даній заявці нагадують, що ділянку CDR, або CDR, розуміють як такі, що означають гіперваріабельні ділянки важких та легких ланцюгів імуноглобулінів. Існує три CDR важкого ланцюга та три CDR легкого ланцюга. Термін ділянка CDR, або ділянки CDR, у даній заявці використовують для позначення, залежно від конкретного випадку, однієї з цих ділянок або їх множини, або дійсно сукупності тих ділянок, які містять більшість амінокислотних залишків, відповідальних за зв'язувальну спорідненість антитіла до антигену або до епітопа, який він розпізнає. Відповідно до першого аспекту CDR можуть бути визначені відповідно до системи IMGT (міжнародного проекту з імуногенетики). Унікальна система нумерації IMGT була визначена таким чином, що порівнює варіабельні домени будь-якого антигену, типу ланцюга або виду [Lefranc M.-P., Immunology Today 18, 509 (1997); Lefranc M.-P., The Immunologist, 7, 132-136 (1999); Lefranc, M.-P., Pommié, C., Ruiz, M., Giudicelli, V., Foulquier, E., Truong, L., ThouveninContet, V. and Lefranc, Dev. Comp. Immunol., 27, 55-77 (2003)]. В даній системі нумерації консервативні амінокислоти завжди зберігають одне й те саме положення, такі як цистеїн 23 (1й-CYS), триптофан 41 (консервативний TRP), гідрофобна амінокислота 89, цистеїн 104 (2йCYS), фенілаланін або триптофан 118 (J-PHE або TRP). Унікальна система нумерації IMGT, відповідно, забезпечує стандартизоване визначення границь каркасних областей (FR1-IMGT: положення 1-26, FR2-IMGT: положення 39-55, FR3-IMGT: положення 66-104 і FR4-IMGT: положення 118-128), а також ділянок визначення компліментарності або CDR (CDR1-IMGT: положення 27-38, CDR2-IMGT: положення 56-65 і CDR3-IMGT: положення 105-117). Оскільки "вирізи" або "проміжки" є незайнятими положеннями, довжини CDR відповідно до IMGT стають критичною інформацією. Систему IMGT використовують у двовимірних графічних зображеннях, які потім позначають як "перлинні намиста" IMGT [Ruiz, M. and Lefranc, M.-P., Immunogenetics, 53, 857-883 (2002); Kaas, Q. and Lefranc, M.-P., Current Bioinformatics, 2, 21-30 (2007)], та у тривимірних структурах, називаних IMGT/3D-структура-DB [Kaas, Q., Ruiz, M. and Lefranc, M.-P., T cell receptor and MHC structural data. Nucl. Acids. Res., 32, D208-D210 (2004)]. Відповідно до цього, першого, аспекту перше антитіло, або одна з його похідних сполук, або функціональних фрагментів відповідно до винаходу, включає легкий ланцюг, що включає щонайменше одну CDR, вибрану з CDR-L1, CDR-L2 і CDR-L3 послідовності SEQ ID No. 1, 2 та 3, відповідно, або такої, що характеризується щонайменше 80 %, краще 85 %, 90 %, 95 % та 98 % 5 UA 105630 C2 5 10 15 20 25 30 35 40 45 50 55 60 ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 1, 2 та 3; та/або важкий ланцюг, що включає щонайменше одну CDR, вибрану з CDR-H1, CDR-H2 та CDR-H3 послідовності SEQ ID No. 4, 5 та 6, відповідно, або такої, що характеризується щонайменше 80 %, краще 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 4, 5 та 6. Для більшої ясності, згадані білкові послідовності є такими: SEQ ID No. 1: ASVEYYGTSL SEQ ID No. 2: EAS SEQ ID No. 3: QQSRKAPYT SEQ ID No. 4: GFTFSTYT SEQ ID No. 5: ISSGGGTT SEQ ID No. 6: ATPRIGTGFAY Конкретніше та краще, коли антитіло або його похідні сполуки або функціональні фрагменти відповідно до винаходу включають легкий ланцюг, що включає три CDR, як визначено відповідно до IMGT, послідовності SEQ ID No. 1, 2 та 3, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 1, 2 та 3. Подібним чином краще, коли антитіло, або його похідні сполуки, або функціональні фрагменти відповідно до винаходу включають важкий ланцюг, що включає три CDR, як визначено відповідно до IMGT, послідовності SEQ ID No. 4, 5 та 6, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 4, 5 та 6. Відповідно до того ж аспекту, друге антитіло, або одна з його похідних сполук, або функціональних фрагментів відповідно до винаходу, включає легкий ланцюг, що включає щонайменше одну CDR, вибрану з CDR-L1, CDR-L2 і CDR-L3 послідовності SEQ ID No. 17, 18 та 19, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 17, 18 і 19; та/або важкий ланцюг, що включає щонайменше одну CDR, вибрану з CDR-H1, CDR-H2 і CDRH3 послідовності SEQ ID No. 20, 21 і 22, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 20, 21 і 22. Для більшої ясності, згадані білкові послідовності є такими: SEQ ID No. 17: ATPRIGTGFAY SEQ ID No. 18: SAS SEQ ID No. 19: QQYSSNPT SEQ ID No. 20: GFTLSTSGMG SEQ ID No. 21: IYWDDDK SEQ ID No. 22: ARRDHYGDYSYAMDY Конкретніше та краще, коли антитіло або його похідні сполуки або функціональні фрагменти відповідно до винаходу включають легкий ланцюг, що включає три CDR, як визначено відповідно до IMGT, послідовності SEQ ID No. 17, 18 і 19, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 17, 18 і 19. Подібним чином краще, коли антитіло, або його похідні сполуки, або функціональні фрагменти відповідно до винаходу включають важкий ланцюг, що включає три CDR, як визначено відповідно до IMGT, послідовності SEQ ID No. 20, 21 і 22, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 20, 21 і 22. Також, відповідно до того ж аспекту, третє антитіло, або одна з його похідних сполук або функціональних фрагментів відповідно до винаходу, включає легкий ланцюг, що включає щонайменше одну CDR, вибрану з CDR-L1, CDR-L2 і CDR-L3 послідовності SEQ ID No. 33, 2 та 3, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 33, 2 та 3; та/або важкий ланцюг, що включає щонайменше одну CDR, вибрану з CDR-H1, CDR-H2 і CDRH3 послідовності SEQ ID No. 4, 34 і 35, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 4, 34 і 35. Для більшої ясності, згадані білкові послідовності є такими: SEQ ID No. 33: ASVDYYGTSL SEQ ID No. 34: ISSGGVTT 6 UA 105630 C2 5 10 15 20 25 30 35 40 45 50 55 60 SEQ ID No. 35: TSPRTGTGFAY Конкретніше та краще, коли антитіло, або його похідні сполуки, або функціональні фрагменти відповідно до винаходу, включають легкий ланцюг, що включає три CDR, як визначено відповідно до IMGT, послідовності SEQ ID No. 33, 2 та 3, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 33, 2 та 3. Подібним чином, у кращому випадку антитіло, або його похідні сполуки, або функціональні фрагменти відповідно до винаходу включають важкий ланцюг, що включає три CDR, як визначено відповідно до IMGT, послідовності SEQ ID No. 4, 34 і 35, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 4, 34 і 35. Нарешті, відповідно до того ж аспекту, четверте та останнє антитіло, або одна з його похідних сполук, або функціональних фрагментів відповідно до винаходу, включає легкий ланцюг, що включає щонайменше одну CDR, вибрану з CDR-L1, CDR-L2 і CDR-L3 послідовності SEQ ID No. 43, 44 і 45, відповідно, або такої, що характеризується щонайменше 80 %, краще 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 43, 44 і 45; та/або важкий ланцюг, що включає щонайменше одну CDR, вибрану з CDR-H1, CDR-H2 і CDR-H3 послідовності SEQ ID No. 46, 47 і 48, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 46, 47 і 48. Для більшої ясності, згадані білкові послідовності є такими: SEQ ID No. 43: ENVGTY SEQ ID No. 44: GAS SEQ ID No. 45: GQTYSFPYT SEQ ID No. 46: GYTFTSSS SEQ ID No. 47: IHPNSGNT SEQ ID No. 48: ARARSFYYAMDC Конкретніше та краще, коли антитіло, або його похідні сполуки, або функціональні фрагменти відповідно до винаходу включають легкий ланцюг, що включає три CDR, як визначено відповідно до IMGT, послідовності SEQ ID No. 43, 44 і 45, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 43, 44 і 45. Подібним чином, краще антитіло, або його похідні сполуки, або функціональні фрагменти відповідно до винаходу включають важкий ланцюг, що включає три CDR, як визначено відповідно до IMGT, послідовності SEQ ID No. 46, 47 і 48, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 46, 47 і 48. Відповідно до другого аспекту, ділянки CDR можуть бути визначені відповідно до загальноприйнятого методу Kabat et al. (Kabat et al., Sequences of proteins of immunological interest, 5th Ed., U.S. Department of Health and Human Services, NIH, 1991, і наступні видання). Відповідно до даного, першого методу, перше антитіло, або одна з його похідних сполук, або функціональних фрагментів відповідно до винаходу, включає легкий ланцюг, що включає щонайменше одну CDR, вибрану з CDR-L1, CDR-L2 і CDR-L3 послідовності SEQ ID No. 59, 60 та 3, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 59, 60 та 3; та/або важкий ланцюг, що включає щонайменше одну CDR, вибрану з CDR-H1, CDR-H2 і CDRH3 послідовності SEQ ID No. 61, 62 та 63, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 61, 62 та 63. Для більшої ясності, згадані білкові послідовності є такими: SEQ ID No. 59: RASASVEYYGTSLMH SEQ ID No. 60: EASNVES SEQ ID No. 61: STYTMS SEQ ID No. 62: YISSGGGTTYYPDTVKG SEQ ID No. 63: PRIGTGFAY Конкретніше та краще, коли антитіло, або його похідні сполуки, або функціональні фрагменти відповідно до винаходу включають легкий ланцюг, що включає три CDR, як визначено відповідно до Kabat, послідовності SEQ ID No. 59, 60 та 3, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 59, 60 та 3. 7 UA 105630 C2 5 10 15 20 25 30 35 40 45 50 55 60 Подібним чином, у кращому випадку антитіло, або його похідні сполуки, або функціональні фрагменти відповідно до винаходу включають важкий ланцюг, що включає три CDR, як визначено відповідно до Kabat, послідовності SEQ ID No. 61, 62 та 63, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 61, 62 та 63. Відповідно до того ж аспекту, друге антитіло, або одна з його похідних сполук, або функціональних фрагментів відповідно до винаходу, включає легкий ланцюг, що включає щонайменше одну CDR, вибрану з CDR-L1, CDR-L2 і CDR-L3 послідовності SEQ ID No. 69, 70 та 19, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 69, 70 та 19; та/або важкий ланцюг, що включає щонайменше одну CDR, вибрану з CDR-H1, CDR-H2 і CDRH3 послідовності SEQ ID No. 71, 72 та 73, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 71, 72 та 73. Для більшої ясності, згадані білкові послідовності є такими: SEQ ID No. 69: KASQNVGIAVA SEQ ID No. 70: SASNRYT SEQ ID No. 71: STSGMGVS SEQ ID No. 72: HIYWDDDKRYNPSLKS SEQ ID No. 73: RDHYGDYSYAMDY Конкретніше та краще, коли антитіло, або його похідні сполуки, або функціональні фрагменти відповідно до винаходу включають легкий ланцюг, що включає три CDR, як визначено відповідно до Kabat, послідовності SEQ ID No. 69, 70 та 19, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 69, 70 та 19. Подібним чином, у кращому випадку антитіло, або його похідні сполуки, або функціональні фрагменти відповідно до винаходу включають важкий ланцюг, що включає три CDR, як визначено відповідно до Kabat, послідовності SEQ ID No. 71, 72 та 73, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 71, 72 та 73. Відповідно до того ж аспекту, третє антитіло, або одна з його похідних сполук, або функціональних фрагментів відповідно до винаходу, включає легкий ланцюг, що включає щонайменше одну CDR, вибрану з CDR-L1, CDR-L2 і CDR-L3 послідовності SEQ ID No. 79, 60 та 3, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 79, 60 та 3; та/або важкий ланцюг, що включає щонайменше одну CDR, вибрану з CDR-H1, CDR-H2 і CDRH3 послідовності SEQ ID No. 61, 80 та 81, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 61, 80 та 81. Для більшої ясності, згадані білкові послідовності є такими: SEQ ID No. 79: ASVDYYGTSL SEQ ID No. 80: YISSGGVTTYYPDTIKG SEQ ID No. 81: PRTGTGFAY Конкретніше та краще, коли антитіло, або його похідні сполуки, або функціональні фрагменти відповідно до винаходу включають легкий ланцюг, що включає три CDR, як визначено відповідно до Kabat, послідовності SEQ ID No. 79, 60 та 3, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 79, 60 та 3. Подібним чином, у кращому випадку антитіло, або його похідні сполуки, або функціональні фрагменти відповідно до винаходу включають важкий ланцюг, що включає три CDR, як визначено відповідно до Kabat, послідовності SEQ ID No. 61, 80 та 81, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 61, 80 та 81. Відповідно до того ж аспекту, четверте та останнє антитіло, або одна з його похідних сполук, або функціональних фрагментів відповідно до винаходу, включає легкий ланцюг, що включає щонайменше одну CDR, вибрану з CDR-L1, CDR-L2 і CDR-L3 послідовності SEQ ID No. 85, 86 та 45, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 85, 86 та 45; та/або важкий ланцюг, що включає щонайменше одну CDR, вибрану з CDR-H1, CDR-H2 і CDRH3 послідовності SEQ ID No. 87, 88 та 89, відповідно, або такої, що характеризується 8 UA 105630 C2 5 10 15 20 25 30 35 40 45 50 55 60 щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 87, 88 та 89. Для більшої ясності, згадані білкові послідовності є такими: SEQ ID No. 85: KASENVGTYVS SEQ ID No. 86: GASNRYTGVPD SEQ ID No. 87: TSSSMH SEQ ID No. 88: EIHPNSGNTNNNEKFKG SEQ ID No. 89: ARSFYYAMDC Конкретніше та краще, коли антитіло, або його похідні сполуки, або функціональні фрагменти відповідно до винаходу включають легкий ланцюг, що включає три CDR, як визначено відповідно до Kabat, послідовності SEQ ID No. 85, 86 та 45, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 85, 86 та 45. Подібним чином, у кращому випадку антитіло, або його похідні сполуки, або функціональні фрагменти відповідно до винаходу включають важкий ланцюг, що включає три CDR, як визначено відповідно до Kabat, послідовності SEQ ID No. 87, 88 та 89, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 87, 88 та 89. У даному описі терміни "поліпептиди", "поліпептидні послідовності", "пептиди" та "білки", пов'язані зі сполуками антитіл або їх послідовностями, є взаємозамінними. У даному описі має бути зрозуміло, що винахід не стосується антитіл у природній формі, тобто вони не взяті з їх природного оточення, але могли бути виділені чи отримані шляхом очищення, починаючи з природних джерел або, в іншому випадку, отримані шляхом генетичної рекомбінації, або шляхом хімічного синтезу, і вони можуть, відповідно, містити неприродні амінокислоти, як буде описано нижче. "Відсоток ідентичності" між двома нуклеїново-кислотними або амінокислотними послідовностями, застосовно до даного винаходу, розуміють як такий, що позначає відсоток нуклеотидів або амінокислотних залишків, ідентичних між двома порівнюваними послідовностями, отриманий після найкращого вирівнювання (оптимального вирівнювання), де цей відсоток є винятково статистичним, а відмінності між двома послідовностями випадковим чином розподілені по всій їх довжині. Порівняння послідовностей між двома нуклеїновокислотними, або амінокислотними послідовностями загальноприйнято здійснюють шляхом порівняння цих послідовностей після того, як вони оптимально вирівняні, де можливо здійснювати це порівняння по сегментах або за допомогою "вікна порівняння". Оптимальне вирівнювання послідовностей для порівняння можна, крім проведення його вручну, здійснювати за допомогою алгоритму локальної гомології за Smith and Waterman (1981) [Ad. App. Math. 2:482], за допомогою алгоритму локальної гомології за Neddleman and Wunsch (1970) [J. Mol. Biol. 48:443], за допомогою методу пошуку подібності за Pearson and Lipman (1988) [Proc. Natl. Acad. Sci. USA 85:2444] або за допомогою комп'ютерного програмного забезпечення, що використовує ці алгоритми (GAP, BESTFIT, FASTA і TFASTA в Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Dr., Madison, WI, або за допомогою програмного забезпечення BLAST N або BLAST P). Відсоток ідентичності між двома нуклеїново-кислотними, або амінокислотними послідовностями визначають шляхом порівняння двох оптимально вирівняних послідовностей, у яких порівнювана нуклеїново-кислотна або амінокислотна послідовність може містити додатки або делеції відносно референсної послідовності, для оптимального вирівнювання між цими двома послідовностями. Відсоток ідентичності обчислюють шляхом визначення числа ідентичних положень, у яких нуклеотид або амінокислотний залишок ідентичний між двома послідовностями, ділення цього числа ідентичних положень на сумарне число положень у вікні порівняння, та множення отриманого результату на 100 з метою отримання відсотка ідентичності між двома послідовностями. Наприклад, можна використовувати програму BLAST "BLAST 2 sequences" (Tatusova et al., "Blast 2 sequences-a new tool for comparing protein and nucleotide sequences", FEMS Microbiol Lett. 174:247-250), доступну на інтернет-сайті http://www.ncbi.nlm.nih.gov/gorf/bl2.html, де використовувані параметри, дані за замовчуванням (зокрема, параметри "штраф на відкриття пролому": 5 і "штраф на подовження пролому": 2; де вибраною матрицею є, наприклад, матриця "BLOSUM 62", запропонована програмою), де відсоток ідентичності між двома послідовностями для порівняння обчислюється безпосередньо програмою. Як амінокислотній послідовності, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю з референсною амінокислотною послідовністю, перевагу 9 UA 105630 C2 5 10 15 надають послідовності, що має відносно референсної послідовності деякі модифікації, зокрема, делецію, додання або заміну щонайменше однієї амінокислоти, укорочення або подовження. У випадку заміни однієї, або більш ніж однієї з послідовних, або непослідовних амінокислот перевагу надають замінам, при яких замінені амінокислоти є заміненими "еквівалентними" амінокислотами. Вираз "еквівалентні амінокислоти" у даній заявці призначений для позначення будь-якої амінокислоти, що може бути замінена однією з амінокислот базової структури, але без фундаментальної модифікації біологічних активностей відповідних антитіл, як буде визначено нижче, зокрема, у прикладах. Ці еквівалентні амінокислоти можуть бути визначені або на підставі їх структурної гомології з амінокислотами, якими вони замінені, або на підставі результатів порівняльних тестів на біологічну активність між різними антитілами, які можуть бути отримані. Як необмежуючий приклад, у таблиці 1 нижче наведені можливості замін, що можуть бути здійснені, не спричиняючи в результаті фундаментальної модифікації біологічної активності відповідного модифікованого антитіла, де, звичайно, зворотні заміни є припустимими за тих самих умов. Таблиця 1 Вихідний залишок Заміна(и) Ala (A) Arg (R) Asn (N) Asp (D) Cys (C) Gln (Q) Glu (G) Gly (G) His (H) Ile (I) Leu (L) Lys (K) Met (M) Phe (F) Pro (P) Ser (S) Thr (T) Trp (W) Tyr (Y) Val (V) 20 25 30 35 Val, Gly, Pro Lys, His Gln Glu Ser Asn Asp Ala Arg Leu Ile, Val, Met Arg Leu Tyr Ala Thr, Cys Ser Tyr Phe, Trp Leu, Ala Фахівцям у даній галузі техніки зрозуміло з попереднього рівня техніки, що найбільша варіабельність (довжини та композиції) між 6 ділянками CDR локалізована у трьох CDR важкого ланцюга, конкретніше - в CDR-H3 цього важкого ланцюга. Отже, має бути очевидним, що кращими характеристичними ділянками CDR антитіла відповідно до винаходу повинні бути три CDR важкого ланцюга, і навіть ще краще - ділянка CDR, що відповідає CDR-H3. У конкретній формі здійснення даний винахід стосується мишачого антитіла, або однієї з його похідних сполук, або функціональних фрагментів відповідно до винаходу. Згідно з іншою формою здійснення винаходу, перше антитіло, або одна з його похідних сполук, або функціональних фрагментів, включає легкий ланцюг, що включає три ділянки CDR, як визначено відповідно до IMGT, послідовності SEQ ID No. 1, 2 та 3, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 1, 2 та 3; і важкий ланцюг, що включає три ділянки CDR послідовності SEQ ID No. 4, 5 та 6, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 4, 5 та 6. Згідно з ще однієї іншої формі здійснення винаходу, перше антитіло, або одна з його похідних сполук, або функціональних фрагментів, включає легкий ланцюг, що включає три ділянки CDR, як визначено відповідно до Kabat, послідовності SEQ ID No. 59, 60 та 3, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 10 UA 105630 C2 5 10 15 20 25 30 35 40 45 50 55 60 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 59, 60 та 3; і важкий ланцюг, що включає три ділянки CDR послідовності SEQ ID No. 61, 62 та 63, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 61, 62 та 63. Згідно з ще однією іншою формою здійснення винаходу, перше антитіло, або одна з його похідних сполук, або функціональних фрагментів, відповідно до винаходу включає легкий ланцюг, що має послідовність, що включає амінокислотну послідовність SEQ ID No. 7 або таку, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовністю SEQ ID No. 7, та/або воно включає важкий ланцюг, що має послідовність, що включає амінокислотну послідовність SEQ ID No. 8 або таку, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовністю SEQ ID No. 8. Для більшої ясності, згадані білкові послідовності є такими: SEQ ID No. 7: DIVLSQSPASLALSLGQRATISCRASASVEYYGTSLMHWYQQKPGQPPKLLIYEASNVESGVPAR FSGSGSGTDFSLNIHPVEEDDLAIYFCQQSRKAPYTFGGGTKLEIK SEQ ID No. 8: EVKLVESGGGLVQPGGSLKLSCAASGFTFSTYTMSWVRQTPEKRLEWVAYISSGGGTTYYPDTV KGRFTISRDNARNTLYLQMNSLKSEDTAMYYCATPRIGTGFAYWGQGTLVTVSA Згідно з іншою формою здійснення винаходу, друге антитіло, або одна з його похідних сполук, або функціональних фрагментів, включає легкий ланцюг, що включає три ділянки CDR, як визначено відповідно до IMGT, послідовності SEQ ID No. 17, 18 і 19, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 17, 18 і 19; і важкий ланцюг, що включає три ділянки CDR послідовності SEQ ID No. 20, 21 і 22, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 20, 21 і 22. Згідно з ще однією іншою формою здійснення винаходу, друге антитіло, або одна з його похідних сполук, або функціональних фрагментів, включає легкий ланцюг, що включає три ділянки CDR, як визначено відповідно до Kabat, послідовності SEQ ID No. 69, 70 та 19, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 69, 70 та 19; і важкий ланцюг, що включає три ділянки CDR послідовності SEQ ID No. 71, 72 та 73, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 71, 72 та 73. Згідно з ще однією іншою формою здійснення винаходу, друге антитіло, або одна з його похідних сполук, або функціональних фрагментів, відповідно до винаходу включає легкий ланцюг, що має послідовність, що включає амінокислотну послідовність SEQ ID No. 23 або таку, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовністю SEQ ID No. 23, та/або воно включає важкий ланцюг, що має послідовність, що включає амінокислотну послідовність SEQ ID No. 24 або таку, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовністю SEQ ID No. 24. Для більшої ясності, згадані білкові послідовності є такими: SEQ ID No. 23: DIVMTQSQKFMSTSEGDRVSITCKASQNVGIAVAWYQQKPGQSPKLLIYSASNRYTGVPDRFTGS GSGTDFTLTISNMQSEDLADYFCQQYSSNPTFGAGTKLELK SEQ ID No. 24: QVTLKESGPGILQPSQTLSLTCSFSGFTLSTSGMGVSWIRQPSGKGLEWLAHIYWDDDKRYNPS LKSRLTISKDTSRNQVFLKITSVDTADTATYYCARRDHYGDYSYAMDYWGQGTSVTVSS Згідно з іншою формою здійснення винаходу, третє антитіло, або одна з його похідних сполук, або функціональних фрагментів, включає легкий ланцюг, що включає три ділянки CDR, як визначено відповідно до IMGT, послідовності SEQ ID No. 33, 2 та 3, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 33, 2 та 3; і важкий ланцюг, що включає три ділянки CDR послідовності SEQ ID No. 4, 34 і 35, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 4, 34 і 35. Згідно з ще однією іншою формою здійснення винаходу, третє антитіло, або одна з його похідних сполук, або функціональних фрагментів, включає легкий ланцюг, що включає три 11 UA 105630 C2 5 10 15 20 25 30 35 40 45 50 55 60 ділянки CDR, як визначено відповідно до Kabat, послідовності SEQ ID No. 79, 60 та 3, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 79, 60 та 3; і важкий ланцюг, що включає три ділянки CDR послідовності SEQ ID No. 61, 80 та 81, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 61, 80 та 81. Згідно з ще однією іншою формою здійснення винаходу, третє антитіло, або одна з його похідних сполук, або функціональних фрагментів, відповідно до винаходу включає легкий ланцюг, що має послідовність, що включає амінокислотну послідовність SEQ ID No. 36 або таку, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовністю SEQ ID No. 36, та/або воно включає важкий ланцюг, що має послідовність, що включає амінокислотну послідовність SEQ ID No. 37 або таку, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовністю SEQ ID No. 37. Для більшої ясності, згадані білкові послідовності є такими: SEQ ID No. 36: DIVLTQSPASLALSLGQRATISCRASASVDYYGTSLMQWYQQKPGQPPKLLIYEASNVESGVPAR FSGSGSGTDFSLNIHPVEEDDLAIYFCQQSRKAPYTFGGGTKLEIK SEQ ID No. 37: EVKLVESGGDLVQPGGSLKLSCAASGFTFSTYTMSWVRQTPEKRLEWVAYISSGGVTTYYPDTIK GRFTISRDNAKNTLFLQMNSLKSEDTAMYYCTSPRTGTGFAYWGQGTLVTVSA Згідно з іншою формою здійснення винаходу, четверте антитіло, або одна з його похідних сполук, або функціональних фрагментів, включає легкий ланцюг, що включає три ділянки CDR, як визначено відповідно до IMGT, послідовності SEQ ID No. 43, 44 і 45, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 43, 44 і 45; і важкий ланцюг, що включає три ділянки CDR послідовності SEQ ID No. 46, 47 і 48, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 46, 47 і 48. Згідно з ще однією іншою формою здійснення винаходу, четверте антитіло, або одна з його похідних сполук, або функціональних фрагментів, включає легкий ланцюг, що включає три ділянки CDR, як визначено відповідно до Kabat, послідовності SEQ ID No. 85, 86 та 45, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 85, 86 та 45; і важкий ланцюг, що включає три ділянки CDR послідовності SEQ ID No. 87, 88 та 89, відповідно, або такої, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовностями SEQ ID No. 87, 88 та 89. Згідно з ще однією іншою формою здійснення винаходу, четверте антитіло, або одна з його похідних сполук, або функціональних фрагментів, відповідно до винаходу включає легкий ланцюг, що має послідовність, що включає амінокислотну послідовність SEQ ID No. 49 або таку, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовністю SEQ ID No. 49, та/або воно включає важкий ланцюг, що має послідовність, що включає амінокислотну послідовність SEQ ID No. 50 або таку, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з послідовністю SEQ ID No. 50. Для більшої ясності, згадані білкові послідовності є такими: SEQ ID No. 49: NIVMTQSPKSMSMSVGERVTLSCKASENVGTYVSWYQQKPEQSPKLLIYGASNRYTGVPDRFTG SGSATDFTLTISSVQAEDLADYHCGQTYSFPYTFGGGTKLEIK SEQ ID No. 50: QVQLQQPGSVLVRPGASVKLSCKASGYTFTSSSMHWAKQRPGQGLEWIGEIHPNSGNTNNNEK FKGKATLTVDTSSSTAYVDLSSLSSEDSAVYYCARARSFYYAMDCWGQGTSVTVSS Як зазначено у даній заявці нижче, винахід, таким чином, спрямований на будь-яку сполуку, похідну від антитіла відповідно до винаходу. Конкретніше, антитіло, або одна з його похідних сполук, або функціональних фрагментів, відповідно до винаходу характеризується тим, що ця похідна сполука складається зі зв'язувального білка, що включає пептидний каркас, до якого прищеплена щонайменше одна ділянка CDR так, щоб зберегти, повністю або частково, паратопні розпізнавальні властивості вихідного антитіла. Одна або декілька послідовностей з послідовностей CDR, описаних в даному винаході, 12 UA 105630 C2 5 10 15 20 25 30 35 40 45 50 55 60 може бути також присутня на різних пептидних каркасах, або каркасних ділянках імуноглобулінів. У цьому випадку білкова послідовність дає можливість відтворення пептидного кістяка, сприятливого для укладення привитої ділянки CDR, або ділянок CDR, що дозволяє їм зберігати свої паратопні властивості розпізнавання антигену. Зазвичай, фахівцеві у даній галузі техніки має бути відомо, як визначити тип білкового каркаса, до якого треба прищеплювати щонайменше одну з CDR, що походять від вихідного антитіла. Конкретніше - відомо, що такі каркаси, щоб вони були вибрані, мають відповідати найбільшому числу критеріїв, зазначених нижче (Skerra A., J. Mol. Recogn. 13, 2000, 167-187): - добра філогенетична консервативність; - відома тривимірна структура (як, наприклад, на підставі кристалографії, ЯМР-спектроскопії або будь-якого іншого методу, відомого фахівцям у даній галузі техніки); - малий розмір; - невелика кількість, або відсутність посттрансляційних модифікацій; та/або - простота одержання, експресії та очищення. Джерелом таких білкових каркасів можуть бути, без обмеження, структури, вибрані з: фібронектину, краще – 10-го домену фібронектину типу 3, ліпокаліну, антикаліну (Skerra A., J. Biotechnol., 2001, 74(4): 257-75), білка Z, утвореного з домена B білка A Staphylococcus aureus, тіоредоксину A, а також білків, що мають повторювані мотиви типу "анкіринового повтору" (Kohl et al., PNAS, 2003, vol.100, No. 4, 1700-1705), "повтору армаділла", "лейцин-збагаченого повтору" або "тетратрикопептидного повтору". Можна також згадати каркаси, що походять від токсинів, таких як, наприклад, наведені нижче токсини, виділені зі скорпіонів, комах, рослин, молюсків і т.д., або білкових інгібіторів нейрональної NO синтази (PIN). Як приклад таких гібридних структур, який жодним чином не є обмежуючим, можна згадати інсерцію CDR-H1 (важкого ланцюга) антитіла анти-CD4, а саме 13B8.2, у одній з петель PIN, де отриманий у такий спосіб новий зв'язувальний білок зберігає такі ж зв'язувальні властивості, що й вихідне антитіло (Bes et al., BBRC 343, 2006, 334-344). Для ілюстрації можна також згадати прищеплення CDR-H3 (важкого ланцюга) антитіла проти лізоциму VHH до однієї з петель неокарциностатину (Nicaise et al., 2004). Нарешті, як описано нижче, такі пептидні каркаси можуть включати від 1 до 6 CDR, що мають походження від вихідного антитіла. Краще, але не обов'язково, коли фахівець у даній галузі техніки вибере щонайменше одну CDR, що походить від важкого ланцюга, де останній відомий як принципово відповідальний за специфічність антитіла. Вибір релевантної ділянки (ділянок) CDR повинен бути очевидний фахівцеві в даній галузі техніки, який використовує для цієї мети відомі методики (Bes et al., FEBS letters 508, 2001 67-74). Очевидно, ці приклади жодним чином не є обмежуючими, і будь-яка інша структура, відома або очевидна фахівцеві в даній галузі техніки, повинна бути розглянута як включена до обсягу захисту, запропонованого даною заявкою на патент. Даний винахід, відповідно, стосується антитіла, або однієї з його похідних сполук, або функціональних фрагментів, яке характеризується тим, що його пептидний каркас вибраний з білків, які a) філогенетично добре консервативні, б) мають міцну архітектуру, в) мають добре відому тривимірну молекулярну організацію, г) мають малий розмір та/або д) включають ділянки, які можуть бути модифіковані шляхом делеції та/або інсерції, без зміни властивостей стабільності. Відповідно до кращої форми здійснення, антитіло, або одна з його похідних сполук, або функціональних фрагментів відповідно до винаходу характеризується тим, що пептидний каркас вибраний з І) каркасів, що походять від фібронектину, краще – 10-го домену фібронектину типу 3, ліпокаліну, антикаліну (Skerra A., J. Biotechnol., 2001, 74(4): 257-75), білка Z, утвореного з домена B білка A Staphylococcus aureus, тіоредоксину A, ІІ) білків, що мають повторювані мотиви типу "анкіринового повтору", "повтору армаділла", "лейцин-збагаченого повтору" або "тетратрикопептидного повтору", а також ІІІ) білкових інгібіторів нейрональної NO синтази (PIN). Відповідно до іншого аспекту винаходу, подібним чином згадані функціональні фрагменти антитіла, описані у даній заявці нижче. Конкретніше, винахід спрямований на антитіло, або одну з його похідних сполук, або функціональних фрагментів, де винахід характеризується тим, що цей функціональний фрагмент вибраний з фрагментів Fv, Fab, (Fab')2, Fab', scFV і scFV-Fc та діатіл, а також будьякого фрагмента, час напівжиття якого може бути продовжений, такого як пегільовані фрагменти. Такі функціональні фрагменти антитіл відповідно до винаходу складаються, наприклад, з фрагментів Fv, scFV (sc позначає один ланцюг), Fab, F(ab')2, Fab' або scFV-Fc або діатіл, або 13 UA 105630 C2 5 10 15 20 25 30 35 40 45 50 55 60 будь-якого фрагмента, час напівжиття якого може бути продовжений шляхом хімічної модифікації, наприклад, приєднання полі(алкілен)гліколя, такого як полі(етилен)гліколь (пегілювання") (де пегільовані фрагменти називають Fv-ПЕГ, scFV-пег, Fab-Пег, F(ab')2-ПЕГ або Fab'-Пег) (від позначення "ПЕГ" = полі(етилен)гліколь), або шляхом включення до ліпосоми, мікросфери або PLGA (співполімер молочної та гліколевої кислот), де зазначені фрагменти мають щонайменше одну з характеристичних ділянок CDR відповідно до винаходу й, зокрема, у цілому здатні виявляти активність, навіть часткову, антитіла, від якого вони походять. У кращому випадку ці функціональні фрагменти будуть складатися з часткової послідовності варіабельної області важкого або легкого ланцюга антитіла, від якого вони походять, або включати цю послідовність, де ця часткова послідовність є достатньою для збереження такої ж зв'язувальної специфічності, що й у антитіла, від якого вона походить, і адекватної спорідненості, яка у кращому випадку дорівнює щонайменше 1/100, ще краще - щонайменше 1/10 спорідненості антитіла, від якого вона походить. Такий функціональний фрагмент буде включати щонайменше 5 послідовних амінокислот, краще - 10, 15, 25, 50 або 100 послідовних амінокислот з послідовності антитіла, від якого він походить. У кращому випадку ці функціональні фрагменти є фрагментами типу Fv, scFV, Fab, F(ab')2, F(ab'), scFV-Fc або діатіла, які у цілому мають таку ж іммобілізуючу специфічність, що й антитіло, з якого вони отримані. Відповідно до даного винаходу фрагменти антитіл за винаходом можуть бути отримані, починаючи з антитіл, як описано у даній заявці вище, способами, такими як розщеплення з використанням ферментів, таких як пепсин чи папаїн, та/або шляхом розщеплення дисульфідних містків шляхом хімічного відновлення. Фрагменти антитіла, включені до даного винаходу, можуть бути також отримані методами генетичної рекомбінації, які також добре відомі фахівцям у даній галузі техніки, або шляхом пептидного синтезу за допомогою, наприклад, автоматичних пептидних синтезаторів, таких як ті, що поставляються фірмою Applied Biosystems, і т.д. Відповідно до іншого конкретного аспекту, даний винахід стосується химерного антитіла, або однієї з його похідних сполук, або функціональних фрагментів відповідно до винаходу, яке характеризується тим, що це антитіло також включає константні області легкого ланцюга та важкого ланцюга, що походять від антитіла виду, гетерологічного по відношенню до миші, зокрема, людини. Відповідно до ще одного аспекту винаходу, гуманізоване антитіло, або одна з його похідних сполук, або функціональних фрагментів, характеризується тим, що константні області легкого ланцюга та важкого ланцюга, що походять від людського антитіла, є лямбда- або каппаобластями та гамма-1, гамма-2 або гамма-4 областями, відповідно. Відповідно до іншого аспекту, винахід стосується першої гібридоми миші, здатної секретувати моноклональне антитіло відповідно до даного винаходу, зокрема, гібридоми мишачого походження, депонованої у Національному центрі культур мікроорганізмів (Centre National de Cultures de Microorganismes, CNCM) (Інститут Пастера, Париж, Франція) 22 лютого 2008 за номером I-3920. Ця гібридома була отримана шляхом злиття спленоцитів імунізованих мишей Balb/c та клітинних ліній мієломи Sp 2O Ag 14. Ця гібридома, депонована в CNCM 22 лютого 2008 за номером I-3920, секретує моноклональне антитіло, позначене у даній заявці як 203B6, або одну з його похідних сполук, або функціональних фрагментів. Відповідно до іншого аспекту, винахід стосується другої гібридоми миші, здатної секретувати моноклональне антитіло відповідно до даного винаходу, зокрема, гібридоми мишачого походження, депонованої в Національному центрі культур мікроорганізмів (Centre National de Cultures de Microorganismes, CNCM) (Інститут Пастера, Париж, Франція) 22 лютого 2008 за номером I-3921. Ця гібридома була отримана шляхом злиття спленоцитів імунізованих мишей Balb/c та клітинних ліній мієломи Sp 2O Ag 14. Ця гібридома, депонована в CNCM 22 лютого 2008 за номером I-3921, секретує моноклональне антитіло, позначене в даній заявці як 205H8, або одну з його похідних сполук, або функціональних фрагментів. Відповідно до іншого аспекту, винахід стосується третьої гібридоми миші, здатної секретувати моноклональне антитіло відповідно до даного винаходу, зокрема, гібридоми мишачого походження, депонованої в Національному центрі культур мікроорганізмів (Centre National de Cultures de Microorganismes, CNCM) (Інститут Пастера, Париж, Франція) 21 лютого 2008 за номером I-3918. Ця гібридома була отримана шляхом злиття спленоцитів імунізованих мишей Balb/c та клітинних ліній мієломи Sp 2O Ag 14. Ця гібридома, депонована в CNCM 21 лютого 2008 за номером I-3918, секретує моноклональне антитіло, позначене у даній заявці як 211F3, або одну з його похідних сполук, або функціональних фрагментів. Нарешті, відповідно до іншого аспекту, винахід стосується третьої гібридоми миші, здатної 14 UA 105630 C2 5 10 секретувати моноклональне антитіло відповідно до даного винаходу, зокрема, гібридоми мишачого походження, депонованої в Національному центрі культур мікроорганізмів (Centre National de Cultures de Microorganismes, CNCM) (Інститут Пастера, Париж, Франція) 21 лютого 2008 за номером I-3919. Ця гібридома була отримана шляхом злиття спленоцитів імунізованих мишей Balb/c та клітинних ліній мієломи Sp 2O Ag 14. Ця гібридома, депонована в CNCM 21 лютого 2008 за номером I-3919, секретує моноклональне антитіло, позначене в даній заявці як 214B2, або одну з його похідних сполук, або функціональних фрагментів. Для більшої ясності, у наведеній нижче таблиці 2 підсумовані різні амінокислотні послідовності, що відповідають різним антитілам відповідно до винаходу, де послідовності CDR, визначені відповідно до IMGT, виділені напівжирним шрифтом, а визначені відповідно до Kabat виділені курсивом. Таблиця 2 CDR-L1 CDR-L2 CDR-L3 Легкий ланцюг (VL) Химерна VL CDR-H1 CDR-H2 CDR-H3 Важкий ланцюг (VH) Igg1 химерна VH Igg4 химерна VH 15 20 25 30 35 40 45 203B6 (I-3920) 1 59 2 60 3 3 7 101 4 61 5 62 6 63 8 102 103 205H8 (I-3921) 17 69 18 70 19 19 23 211F3 (I-3918) 33 79 2 60 3 3 36 20 21 22 4 34 35 71 72 73 24 61 80 81 37 214B2 (I-3919) 43 85 44 86 45 45 49 95 46 87 47 88 48 89 50 96 97 Антитіла відповідно до даного винаходу також включають химерні або гуманізовані антитіла. Химерне антитіло (також називане химерою), розуміють як таке, що стосується антитіла, яке включає природну варіабельну область (легкого ланцюга та важкого ланцюга), що походить від антитіла з даного виду, асоційовану з константними областями легкого ланцюга, та константними областями важкого ланцюга антитіла з виду, гетерологічного по відношенню до зазначеного даного виду. Антитіла химерного типу, або їх фрагменти відповідно до винаходу, можуть бути отримані з використанням методів генетичної рекомбінації. Наприклад, химерне антитіло може бути отримане шляхом клонування рекомбінантної ДНК, що включає промотор та послідовність, яка кодує варіабельну область не людського, зокрема, мишачого моноклонального антитіла відповідно до винаходу, та послідовність, яка кодує константну область людського антитіла. Химерне антитіло за винаходом, кодоване таким рекомбінантним геном, може бути, наприклад, химерою миша-людина, де специфічність цього антитіла визначена варіабельною областю, утвореною від мишачої ДНК, а його ізотип визначений константною областю, утвореною від людської ДНК. Для способів отримання химерних антитіл можна зробити посилання, наприклад, на документ Verhoeyn et al. (Bioessays, 8:74, 1988). Гуманізоване антитіло розуміють як таке, що стосується антитіла, що включає ділянки CDR, утворені від антитіла не людського походження, де інші частини молекули антитіла утворені від одного (або більш ніж одного) людського антитіла/антитіл зародкової лінії (ліній). Крім того, деякі з залишків сегментів каркаса (позначеного як FR) можуть бути модифіковані зі збереженням зв'язувальної спорідненості (Jones et al., Nature, 321:522-525, 1986; Verhoeyen et al., Science, 239:1534-1536, 1988; Riechmann et al., Nature, 332:323-327, 1988). Гуманізовані антитіла відповідно до винаходу, або їх фрагменти можуть бути отримані методами, відомими фахівцям у даній галузі техніки (такими як, наприклад, описані в документах Singer et al., J. Immun. 150:2844-2857, 1992; Mountain et al., Biotechnol. Genet. Eng. Rev., 10:1-142, 1992; або Bebbington et al., Bio/Technology, 10:169-175, 1992). Такі гуманізовані антитіла відповідно до винаходу є кращими для застосування у діагностичних способах in vitro або у профілактичному та/або терапевтичному лікуванні in vivo. Інші методи гуманізації також відомі фахівцям у даній галузі техніки, такі як, наприклад, метод "прищеплення CDR", описаний PDL, який є суттю патентів EP 0451261, EP 0682040, EP 0939127, EP 0566 647, або також US 5530101, US 6180370, US 5585089 і US 5693761. Можна також згадати патент US 5639641, або також 6054297, 5886152 і 5877293. 15 UA 105630 C2 5 10 15 20 25 30 35 40 45 50 Крім того, винахід також спрямований на гуманізовані антитіла, утворені з мишачих та химерних антитіл, описаних у даній заявці вище. У кращому випадку, константні області легкого ланцюга та важкого ланцюга, що походять від людського антитіла, є лямбда- або каппа-областями, та гамма-1, гамма-2 або гамма-4 областями, відповідно. У формі здійснення, що відповідає ізотипу Igg1, додатковою характеристикою антитіла є те, що воно володіє ефекторними функціями, такими як АЗКЦ (антитілозалежна клітинна цитотоксичність) та/або КЗЦ (комплементзалежна цитотоксичність). Крім того, як випливає з наведених нижче прикладів, антитіло, якого стосується даний винахід, відрізняється від відомих дотепер антитіл тим, що воно здатне до інгібування проліферації пухлинних клітин. Як зазначено в даній заявці вище, білок CD151 стосується сімейства тетраспанінів і, внаслідок цього, включає два позаклітинні домени EC1 (18 амінокислот, послідовність [40-57]) і EC2 (109 амінокислот, послідовність [113-221]), також називаних позаклітинними петлями. Відповідно до даного винаходу, використовувані антитіла здатні до зв'язування щонайменше одного епітопа, локалізованого у позаклітинному домені. У кращому випадку це антитіло іммобілізується на петлях EC1 та/або EC2. Конкретніше, відповідно до кращої форми здійснення винаходу, описане застосування щонайменше одного антитіла анти-CD151, або одного з його функціональних фрагментів, здатних до зв'язування з епітопом, включеним до позаклітинної петлі 1 (EC1) та/або 2 (EC2), краще - EC2, що відповідає амінокислотам 40-57 і 113-221, відповідно, білка CD151. Петля EC1 [40-57] включає 18 амінокислот і має теоретичну масу 2002,2 Да. Петля EC2 [113-221] має сайт N-глікозилювання (залишок Asn159) та 6 залишків цистеїну, що утворюють 3 дисульфідних містка. Структурна модель петлі EC2 тетраспанінів та, зокрема, CD151 запропонована на основі тривимірної структури петлі EC2 тетраспаніна CD81 (Seigneuret et al., 2001, J. Biol. Chem. 276, 40055-40064). Згідно з цією моделлю тетраспаніни мають спільний, відносно консервативний каркас, що складається з трьох α-спіралей, і специфічний варіабельний домен. Для CD151 цей каркас вважають таким, що складається з трьох областей [113-157] і [209-221], а варіабельний домен вважають таким, що складається з області [158-208]. Варіабельний домен петлі EC2 вважають конкретніше задіяним у специфічні взаємодії CD151 з білками сімейства інтегринів. Експерименти зі спрямованого мутагенезу конкретно показали важливість області [193-208], а точніше, трипептиду QRD [194-196] та залишку цистеїну в положенні 192, у асоціації CD151 з деякими інтегринами, що є рецепторами ламінінів, такими як інтегрини α3β1 або α6β4 (Kazarov et al., 2002, J. Cell Biol. 158, 1299-1309). У навіть ще кращому випадку, даний винахід спрямований на застосування щонайменше одного антитіла анти-CD151, або одного з його функціональних фрагментів, здатних до зв'язування епітопа області EC2. У новому аспекті даний винахід стосується ізольованої нуклеїнової кислоти, яка характеризується тим, що вона вибрана з наведених нижче нуклеїнових кислот: a) нуклеїнової кислоти ДНК або РНК, що кодує антитіло, або однієї з його похідних сполук, або функціональних фрагментів, як визначено вище; б) нуклеїнової кислоти, комплементарної до нуклеїнової кислоти, що визначена вище у п. a); в) нуклеїнової кислоти щонайменше з 18 нуклеотидів, здатних до гібридизації в умовах високої жорсткості щонайменше з однією з нуклеїново-кислотних послідовностей SEQ ID No. 916, 25-32, 38-42, 51-58, 64-68, 74-78, 82-84, 90-94, 98-100 чи 104-106, або з послідовністю, що характеризується щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % ідентичністю після оптимального вирівнювання з цими послідовностями. У таблиці 3 нижче підсумовані різні нуклеотидні послідовності, що відносяться до антитіл відповідно до винаходу, де послідовності CDR, визначені відповідно до IMGT, виділені напівжирним шрифтом, а визначені відповідно до Kabat - виділені курсивом. 16 UA 105630 C2 Таблиця 3 CDR-L1 CDR-L2 CDR-L3 Легкий ланцюг CDR-H1 CDR-H2 CDR-H3 Важкий ланцюг 5 10 15 20 25 30 35 40 45 203B6 (I-3920) 9 64 10 65 11 11 15 12 66 13 67 14 68 16 205H8 (I-3921) 25 74 26 75 27 27 31 28 76 29 77 30 78 32 211F3 (I-3918) 38 82 10 65 11 11 41 12 66 39 83 40 84 42 214B2 (I-3919) 51 90 52 91 53 53 57 54 92 55 93 56 94 58 Терміни нуклеїнова кислота, нуклеїнова або нуклеїново-кислотна послідовність, полінуклеотид, олігонуклеотид, полінуклеотидна послідовність, нуклеотидна послідовність, які використовують у даному описі взаємозамінно, розуміють як такі, що відносяться до точної конкатенації нуклеотидів, модифікованих чи не модифікованих, що дає можливість визначити фрагмент або ділянку нуклеїнової кислоти, яка включає або не включає неприродні нуклеотиди, де ці терміни можуть рівною мірою відповідати двонитковій ДНК, однонитковій ДНК та продуктам транскрипції цих ДНК. У даній заявці має бути також зрозуміло, що даний винахід не стосується нуклеотидних послідовностей в їх природному хромосомному оточенні, тобто у природному стані. Вони є послідовностями, які ізольовані та/або очищені, тобто вони екстраговані прямо або опосередковано, наприклад, шляхом копіювання, з їх оточення щонайменше частково в модифікованому стані. У даній заявці їх також розуміють як такі, що відносяться до ізольованих нуклеїнових кислот, отриманих шляхом генетичної рекомбінації, з використанням, наприклад, клітин-хазяїв, або отриманих шляхом хімічного синтезу. Нуклеїнові послідовності, що характеризуються відсотковою ідентичністю щонайменше 80 %, краще - 85 %, 90 %, 95 % та 98 % після оптимального вирівнювання з кращою послідовністю, розуміють як такі, що позначають нуклеїнові послідовності, що мають відносно до референсної нуклеїнової послідовності деякі модифікації, такі як, зокрема, делеція, укорочення, подовження, химерне злиття та/або заміна, зокрема, точкова заміна. У кращому випадку вони є послідовностями, які кодують такі ж амінокислотні послідовності, що й референсна послідовність, що є наслідком виродженості генетичного коду, або комплементарними послідовностями, які здатні до специфічної гібридизації з референсними послідовностями, краще - в умовах високої жорсткості, зокрема, як визначено у даній заявці нижче. Гібридзація в умовах високої жорсткості означає, що умови температури та іонної сили вибрані таким чином, щоб вони давали можливість підтримувати гібридизацію між двома комплементарними фрагментами ДНК. Для ілюстрації, стадії умов високої жорсткості гібридизації з метою визначення полінуклеотидних фрагментів, описаних вище, у кращому випадку є такими, як описано нижче. Гібридизацію ДНК-ДНК або ДНК-РНК проводять у дві стадії: (1) передгібридизація при 42 °C протягом 3 годин у фосфатному буфері (20 мМ, pH 7,5), що містить 5× SSC (1× SSC відповідає розчину 0,15 M NaCl+0,015 M цитрату натрію), 50 % формаміду, 7 % додецилсульфату натрію (ДСН), 10× розчину Денхардта, 5 % декстрансульфату і 1 % ДНК сперми лосося; (2) власне гібридизація протягом 20 годин при температурі, що залежить від розміру зонда (тобто: 42 °C для зонда розміром більше 100 нуклеотидів), з наступними двома відмиваннями по 20 хвилин при 20 °C у 2 SSC+2 % ДСН, одним відмиванням протягом 20 хвилин при 20 °C у 0,1× SSC+0,1 % ДСН. Останнє відмивання проводять у 0,1× SSC+0,1 % ДСН протягом 30 хвилин при 60 °C для зонда розміром більше 100 нуклеотидів. Умови високої жорсткості, описані вище для полінуклеотида певного розміру, можуть бути адаптовані фахівцем у даній галузі техніки до олігонуклеотидів більшого чи меншого розмірів відповідно до вказівок Sambrook et al., (1989, Molecular cloning: a laboratory manual. 2nd Ed. Cold Spring Harbor). Винахід також стосується вектора, що включає нуклеїнову кислоту відповідно до даного винаходу. Винахід, зокрема, спрямований на клонуючі та/або експресійні вектори, що включають нуклеотидну послідовність відповідно до винаходу. Вектори відповідно до винаходу у кращому випадку включають елементи, які дають 17 UA 105630 C2 5 10 15 20 25 30 35 40 45 50 55 60 можливість експресії та/або секреції нуклеотидних послідовностей у конкретній клітині-хазяїні. Таким чином, вектор повинен включати промотор, сигнали ініціації та термінації транскрипції, а також відповідні ділянки регуляції транскрипції. Він повинен мати здатність до стабільної підтримки у клітині-хазяїні та необов'язково може мати особливі сигнали, що специфічно спрямовують секрецію трансльованого білка. Ці різні елементи повинні бути вибрані та оптимізовані фахівцем у даній галузі техніки залежно від використовуваної клітини-хазяїна. Для здійснення цього нуклеотидні послідовності відповідно до винаходу можуть бути вбудовані до векторів, що автономно реплікуються у вибраному хазяїні, або до інтегративних векторів вибраного хазяїна. Такі вектори отримують способами, звичайно використовуваними фахівцями в даній галузі техніки, і отримані в результаті клони можуть бути введені до придатного хазяїна стандартними способами, такими як ліпофекція, електропорація, тепловий шок, або хімічними способами. Вектори відповідно до винаходу є векторами, наприклад, плазмідного або вірусного походження. Вони застосовні при трансформації клітин-хазяїв з метою клонування або експресії нуклеотидних послідовностей відповідно до винаходу. Винахід також включає клітини-хазяї, трансформовані вектором відповідно до винаходу, або включають його. Клітина-хазяїн може бути вибрана з прокаріотичних або еукаріотичних систем, наприклад, бактеріальних клітин, а також дріжджових клітин, або тваринних клітин, зокрема, клітин ссавців. Можна також використовувати клітини комах, або клітини рослин. Винахід також стосується тварин, за винятком людей, що включають трансформовану клітину відповідно до винаходу. Відповідно до іншого аспекту винахід стосується способу продукування антитіла, або одного з його функціональних фрагментів відповідно до винаходу, який характеризується тим, що включає такі стадії: а) культивування клітини-хазяїна відповідно до винаходу у придатному культуральному середовищі та у придатних умовах культивування; і б) виділення зазначених антитіл або їх функціональних фрагментів, продукованих у такий спосіб, з культурального середовища або з культивовуваних клітин. Трансформовані клітини відповідно до винаходу можна використовувати у способах отримання рекомбінантних поліпептидів відповідно до винаходу. Самі способи отримання поліпептиду відповідно до винаходу в рекомбінантній формі, які характеризуються тим, що вони використовують вектор та/або клітину, трансформовану вектором відповідно до винаходу, є включеними до даного винаходу. У кращому випадку клітину, трансформовану вектором відповідно до винаходу, культивують в умовах, що забезпечують експресію поліпептиду, і виділяють цей рекомбінантний поліпептид. Як зазначено, клітина-хазяїн може бути вибрана з прокаріотичних або еукаріотичних систем. Зокрема, можливо ідентифікувати нуклеотидні послідовності відповідно до винаходу, які сприяють секреції у такій прокаріотичній або еукаріотичній системі. Вектор відповідно до винаходу, що несе таку послідовність, можна, отже, у кращому випадку використовувати при продукуванні рекомбінантних білків, які потрібно секретувати. Дійсно, очищенню цих рекомбінантних білків, які викликають інтерес, сприяє той факт, що вони присутні у надосадовій рідині клітинної культури ймовірніше, ніж усередині клітин-хазяїв. Також можливо отримати поліпептиди відповідно до винаходу шляхом хімічного синтезу. Такий спосіб отримання також включений до сутності винаходу. Фахівцеві в даній галузі техніки відомі способи хімічного синтезу, наприклад, методи, що використовують тверді фази (див., зокрема, Steward et al., 1984, Solid phase peptides synthesis, Pierce Chem. Company, Rockford, 111, 2nd Ed., (1984)), або методи, що використовують часткові тверді фази, шляхом конденсації фрагментів або шляхом загальноприйнятого синтезу в розчині. Поліпептиди, отримані шляхом хімічного синтезу, які можуть містити відповідні неприродні амінокислоти, також включені до винаходу. Антитіла, або одна з їх похідних сполук, або функціональних фрагментів, які можуть бути отримані способом відповідно до винаходу, також включені до даного винаходу. У відповідності до ще одного аспекту, даний винахід стосується антитіла, як описано в даній заявці вище, яке характеризується тим, що воно додатково є біспецифічним, тобто воно здатне специфічно зв'язуватися з людським білком або людським рецептором, іншим, ніж CD151. Біспецифічні або біфункціональні антитіла є другим поколінням моноклональних антитіл, у яких дві різні варіабельні ділянки об'єднані в одній молекулі (Hollinger and Bohlen 1999 Cancer and metastasis rev. 18: 411-419). Їх користь продемонстрована як у галузі діагностики, так і в терапевтичній галузі на підставі їх здатності рекрутувати нові ефекторні функції, або бути 18 UA 105630 C2 5 10 15 20 25 30 35 40 45 50 55 60 спрямованими на безліч молекул на поверхні пухлинних клітин. Ці антитіла можуть бути отримані хімічними способами (Glennie MJ et al. 1987 J. Immunol. 139, 2367-2375; Repp R. et al. 1995 J. Hemat. 377-382), або соматичними способами (Staerz U.D. and Bevan M.J. 1986 PNAS 83, 1453-1457; Suresh M.R. et al. 1986 Method Enzymol. 121: 210-228), а також, краще, за допомогою генно-інженерних методів, які дають можливість підсилити гетеродимеризацію та завдяки цьому полегшують спосіб очищення шуканого антитіла (Merchand et al. 1998 Nature Biotech. 16: 677-681). Ці біспецифічні антитіла можна конструювати у вигляді цілих IgG, таких як біспецифічні Fab'2 фрагменти, у вигляді Fab'ПЕГ, або у вигляді діатіл, або у вигляді біспецифічних scFV фрагментів, а також у вигляді чотиривалентного біспецифічного антитіла, у якому два іммобілізуючі сайти присутні для кожного антигену, на який вони спрямовані (Park et al. 2000 Mol. Immunol. 37(18): 1123-30), або їх фрагментів, як описано у даній заявці вище. Крім економічної переваги, за рахунок того факту, що продукування та введення біспецифічного антитіла є менш витратним, ніж продукування двох специфічних антитіл, застосування таких біспецифічних антитіл має перевагу за рахунок зниження токсичності лікування. Застосування біспецифічного антитіла дійсно дає можливість зменшити загальну кількість циркулюючих антитіл і, в результаті, можливу токсичність. У кращій формі здійснення винаходу біспецифічне антитіло є двовалентним або чотиривалентним антитілом. Нарешті, даний винахід спрямований на антитіло, або одну з його похідних сполук, або функціональних фрагментів, як описано в даній заявці вище, що є ліками. Винахід також стосується фармацевтичної композиції, що включає як активний інгредієнт сполуку, що складається з антитіла, або однієї з його похідних сполук, або функціональних фрагментів, відповідно до винаходу. Краще, коли до антитіла доданий ексципієнт та/або фармацевтично прийнятний носій. У відповідності до ще одного аспекту, даний винахід також стосується фармацевтичної композиції, як описано вище, яка додатково включає у вигляді комбінованого препарату для одночасного, окремого або диференційованого застосування щонайменше одне інше антитіло, цитотоксичний/цитостатичний агент, клітинний токсин або радіоактивний елемент. "Одночасне застосування" розуміють як введення двох сполук композиції відповідно до винаходу, що містяться в одній і тій же фармацевтичній формі. "Окреме застосування" розуміють як введення одночасно двох сполук композиції відповідно до винаходу, що містяться в окремих фармацевтичних формах. "Диференційоване застосування" розуміють як послідовне введення двох сполук композиції відповідно до винаходу, де кожна міститься у окремій фармацевтичній формі. Як правило, композиція відповідно до винаходу значно підвищує ефективність лікування раку. Іншими словами, терапевтичний ефект антитіла відповідно до винаходу несподівано потенціюється за рахунок введення цитотоксичного агента. Іншою, ще однією значною перевагою, яку надає композиція відповідно до винаходу, є можливість застосування менших ефективних доз активного інгредієнта, що дає можливість виключити або зменшити ризик виникаючих вторинних ефектів, зокрема, ефекту цитотоксичного агента. Крім того, ця композиція відповідно до винаходу дозволить швидше досягти бажаного терапевтичного ефекту. "Протиракові терапевтичні агенти" або "цитотоксичні агенти" слід розуміти як речовини, що при введенні пацієнтові лікують, або попереджають розвиток раку у пацієнта. Як необмежуючий приклад таких агентів, можна згадати "алкілувальні" агенти, антиметаболіти, протипухлинні антибіотики, мітотичні інгібітори, інгібітори функції хроматину, антиангіогенні агенти, антиестрогени, антиандрогени або імуномодулятори. Такі агенти, наприклад, згадані у VIDAL на сторінці, присвяченій онкології та гематології, у колонці "Cytotoxiques" (цитотоксичні агенти); такі цитотоксичі сполуки, згадані шляхом посилання на даний документ, згадуються тут як кращі цитотоксичні агенти. "Алкілувальні агенти" відносяться до будь-якої речовини, що здатна ковалентно зв'язувати або алкілувати будь-яку молекулу, краще - нуклеїнову кислоту (наприклад, ДНК) усередині клітини. Як приклади таких алкілувальних агентів, можна згадати азотисті іприти, такі як меклоретамін, хлорамбуцил, мелфалан гідрохлорид, піпоброман, преднімустин динатрійфосфат або естрамустин; оксазофосфорини, такі як циклофосфамід, алтретамін, трофосфамід, сульфофосфамід або іфосфамід; азиридини або етиленіміни, такі як тіотепа, триетиленамін або алтретамін; нітрозосечовини, такі як кармустин, стрептозоцин, фотемустин або ломустин; алкілсульфонати, такі як бусульфан, треосульфан або імпросульфан; триазени, такі як дакарбазин; а також комплекси платини, такі як цисплатин, оксаліплатин або 19 UA 105630 C2 5 10 15 20 25 30 35 40 45 50 55 60 карбоплатин. "Антиметаболіти" відносяться до речовин, які блокують клітинний ріст та/або клітинний метаболізм шляхом втручання у деякі активності, як правило, у синтез ДНК. Як приклад антиметаболітів, можна згадати метотрексат, 5-фторурацил, флоксуридин, 5фтордезоксиуридин, капецитабін, цитарабін, флударабін, цитозин арабінозид, 6-меркаптопурин (6-MP), 6-тіогуанін (6-TG), хлордезоксиаденозин, 5-азацитидин, гемцитабін, кладрибін, дезоксикоформіцин і пентостатин. "Протипухлинні антибіотики" відносяться до сполук, які можуть запобігати або інгібувати синтез ДНК, РНК та/або білків. Приклади таких протипухлинних антибіотиків включають доксорубіцин, даунорубіцин, ідарубіцин, вальрубіцин, мітоксантрон, дактиноміцин, мітраміцин, плікаміцин, мітоміцин C, блеоміцин та прокарбазин. "Мітотичні інгібітори" запобігають нормальному прогресуванню клітинного циклу та мітозу. Як правило, інгібітори мікротрубочок або "таксоїди", такі як паклітаксел та доцетаксел, здатні інгібувати мітоз. Вінкаалкалоїди, такі як вінбластин, вінкристин, віндезин і вінорельбін, також здатні інгібувати мітоз. "Інгібітори функції хроматину" або "інгібітори топоізомераз" відносяться до речовин, які інгібують нормальну функцію білків, ремоделюючих хроматин, таких як топоізомерази I і II. Приклади таких інгібіторів включають для топоізомерази I камптотецин, а також його похідні, такі як іринотекан або топотекан, та для топоізомерази II етопозид, етипозид фосфат і теніпозид. "Антиангіогенні агенти" відносяться до будь-яких ліків, сполук, речовин або агентів, які інгібують ріст кровоносних судин. Приклади антиангіогенних агентів включають, не обмежуючи, разоксин, маримастат, батимастат, приномастат, таномастат, іломастат, CGS-27023A, галофугінон, COL-3, неовастат, BMS-275291, талідомід, CDC 501, DMXAA, L-651582, скваламін, ендостатин, SU5416, SU6668, інтерферон-альфа, EMD121974,інтерлейкін-12, IM862, ангіостатин та вітаксин. "Антиестрогени" або "антиестрогенні агенти" відносяться до будь-якої речовини, яка знижує, антагонізує або інгібує дію естрогенів. Прикладами таких агентів є тамоксифен, тореміфен, ралоксифен, дролоксифен, йодоксифен, анастрозол, летрозол та екземестан. "Антиандрогени" або "антиандрогенні агенти" відносяться до будь-якої речовини, яка знижує, антагонизує або інгібує дію андрогену. Прикладами антиандрогенів є флутамід, нілутамід, бікалутамід, спіронолактон, ципротерону ацетат, фінастерид та цимітидин. Імуномодуляторами є речовини, які стимулюють імунну систему. Приклади таких імуномодуляторів включають інтерферони, інтерлейкіни, такі як алдеслейкін, OCT-43, денілейкін дифлітокс або інтерлейкін-2, фактори некрозу пухлини, такі як тазонермін, або інші типи імуномодуляторів, такі як лентінан, сизофіран, роквінімекс, підотимод, пегадемаза, тімопентин, полі I:C або левамізол у комбінації з 5-фторурацилом. Для додаткових подробиць фахівець у даній галузі техніки зможе послатися на посібник, опублікований French Association of Teachers of Therapeutic Chemistry під заголовком "Traité de chimie thérapeutique, Vol. 6, Médicaments antitumoraux et perspectives dans le traitement des cancers, ed. TEC & DOC, 2003". У особливо кращій формі здійснення композиція у формі комбінованого препарату відповідно до винаходу характеризується тим, що цитотоксичний агент хімічно зв'язаний із зазначеним антитілом для одночасного застосування. У особливо кращій формі здійснення композиція відповідно до винаходу характеризується тим, що цитотоксичний/цитостатичний агент вибраний з інгібітора веретена розподілу або стабілізуючих агентів, краще – вінорельбіну, та/або вінфлуніну, та/або вінкристину. Для полегшення зв'язування цитотоксичного агенту з антитілом відповідно до винаходу можливо, зокрема, ввести спейсерні молекули між двома сполуками, які мають бути зв'язані, наприклад, полі(алкілен)гліколі, такі як поліетиленгліколь, або також амінокислоти, або, у іншій формі здійснення, використовувати активні похідні цитотоксичних агентів, до яких повинні бути введені функціональні групи, здатні взаємодіяти з антитілом відповідно до винаходу. Ці методи зв'язування добре відомі фахівцям у даній галузі техніки, і не потребують докладного опису тут. Відповідно до іншого аспекту, винахід стосується композиції, яка характеризується тим, що щонайменше одне з зазначених антитіл, або одна з їх похідних сполук, або функціональних фрагментів, кон'юговане з клітинним токсином, та/або радіоактивним елементом. У кращому випадку цей токсин, або радіоактивний елемент здатний запобігати росту або проліферації пухлинної клітини, зокрема, до повної інактивації пухлинної клітини. Перевага також надається токсину, що є ентеробактеріальним токсином, зокрема, екзотоксином А Pseudomonas. 20 UA 105630 C2 5 10 15 20 25 30 35 40 45 50 55 60 Радіоактивні елементи (або радіоізотопи), застосовувані в терапії, у кращому випадку – кон'юговані з антитілом, є радіоактивними ізотопами, що випромінюють гамма-промені, краще, коли це йод131, ітрій90, золото199, палладій100, мідь67, вісмут217 і сурма211. Радіоактивні ізотопи, що випромінюють альфа- і бета-проміння, можна також застосовувати у терапії. Токсин або радіоактивний елемент, кон'югований щонайменше з одним антитілом, або його функціональним фрагментом відповідно до винаходу, розуміють як такий, що стосується будьяких засобів, які дають можливість зв'язати цей токсин, або радіоактивний елемент, щонайменше з одним антитілом, зокрема, шляхом ковалентного зв'язування між двома сполуками, з введенням або без введення зв'язуючої молекули. Серед агентів, що дають можливість хімічної (ковалентної), електростатичної, або нековалентної комбінації всіх, або деяких елементів кон'югата, можна згадати, дуже конкретно, бензохінон, карбодіімід і, конкретніше, EDC (етил-3-[3-диметиламінопропіл]-карбодііміду гідрохлорид), дималеімід, дитіобіс-нітробензойну кислоту (DTNB), N-сукцинімідил Sацетилтіоацетат (SATA), агенти, називані "місточковими" агентами, що включають одну або декілька груп з однією або декількома фенілазидними групами, що реагує з ультрафіолетовим випроміненням (УФ), і ще краще N-[-4-(азидосаліциламіно)бутил]-3’-(2’піридилдитіо)пропіонамід (APDP), N-сукцинімідил 3-(2-піридилдитіо)пропіонат (SPDP) та 6гідразинонікотинамід (HYNIC). Інша форма зв'язування, особливо для радіоактивних елементів, може полягати у використанні біфункціонального іонного хелатора. Серед цих хелаторів можна згадати хелатори, утворені з ЕДТА (етилендіамінтетраоцтової кислоти) або ДТПА (діетилентриамінпентаоцтової кислоти), які розроблені для зв'язування металів, зокрема, радіоактивних металів, та імуноглобулінів. Відповідно, ДТПА та її похідні можуть бути заміщені різними групами на вуглецевому ланцюзі, для підвищення стабільності та жорсткості комплексу ліганду та металу (Krejcarek et al. (1977); Brechbiel et al. (1991); Gansow (1991); патент США 4831175). Наприклад, ДТПА (діетилентриамінпентаоцтова кислота) та її похідні, які давно дуже широко застосовують у медицині та біології або у вільній формі, або у формі комплексу з іоном металу, має примітну властивість утворення стабільних хелатів з іонами металів та зв'язування з білками, що викликають терапевтичний або діагностичний інтерес, такими як антитіла, для розроблення радіоімунокон'югатів при терапії раку (Meases et al., (1984); Gansow et al. (1990)). Також, у кращому випадку, щонайменше одне антитіло, що утворює кон'югат, відповідно до винаходу, вибране з його функціональних фрагментів, зокрема, фрагментів, у яких відсутній Fc компонент, таких як scFV фрагменти. Даний винахід додатково включає застосування композиції відповідно до винаходу при виготовленні ліків, призначених для попередження або лікування раку. Даний винахід також стосується застосування антитіла, або однієї з його похідних сполук, або функціональних фрагментів, краще - гуманізованого, та/або композиції відповідно до винаходу у виготовленні ліків, призначених для інгібування проліферації пухлинних клітин. У цілому даний винахід стосується застосування антитіла, або однієї з його похідних сполук, або функціональних фрагментів, краще - гуманізованого, та/або композиції відповідно до винаходу у виготовленні ліків, призначених для попередження або лікування раку. Серед раків, які можна попереджати та/або лікувати, перевага надається раку простати, остеосаркомам, раку легені, раку молочної залози, раку ендометрія, раку ободової кишки, множинній мієломі або раку яєчника, раку підшлункової залози та будь-якому іншому раку. Краще, коли рак є раком, вибраним з раку простати, раку легені, раку ободової кишки, раку молочної залози та/або раку підшлункової залози. У відповідності до ще одного іншого аспекту, даний винахід стосується застосування антитіла відповідно до винаходу у способі діагностики, краще in vitro, захворювань, пов'язаних з рівнем експресії CD151. Конкретніше, винахід спрямований на спосіб діагностики in vitro захворювань, які характеризуються гіперекспресією або недостатньою експресією білка CD151, починаючи з біологічного зразка, у якому підозрюють аномальну присутність білка CD151, де цей спосіб полягає у приведенні цього біологічного зразка в контакт з антитілом відповідно до винаходу, причому можливо, щоб антитіло було відповідним чином міченим. У кращому випадку захворювання, пов'язані з білком CD151 у способі діагностики, є раками. Антитіло, або один з його функціональних фрагментів, може мати форму імунокон'югата або антитіла, міченого з отриманням сигналу, який може бути виявлений та/або кількісно визначений. Антитіла, мічені відповідно до винаходу, або їх функціональні фрагменти включають, наприклад, антитіла, називані імунокон'югатами, які можуть бути кон'юговані, наприклад, з 21 UA 105630 C2 5 10 15 20 25 30 35 40 45 50 55 60 ферментами, такими як пероксидаза, лужна фосфатаза, α-d-галактозидаза, глюкозооксидаза, глюкозоамілаза, карбоангідраза, ацетилхолінестераза, лізоцим, малатдегідрогеназа або глюкозо-6-фосфатдегідрогеназа, або з молекулою, такою як біотин, дигоксигенін або 5бромдезоксиуридин. Флуоресцентні мітки можуть бути також кон'юговані з антитілами або їх функціональними фрагментами відповідно до винаходу і включають, зокрема, флуоресцеїн та його похідні, флуорохром, родамін та його похідні, GFP (зелений флуоресцентний білок), дансил, умбеліферон і т.д. У таких кон'югатах антитіла за винаходом, або їх функціональні фрагменти, можуть бути отримані способами, відомими фахівцям у даній галузі техніки. Вони можуть бути пов'язані з ферментами або флуоресцентними мітками безпосередньо, або за допомогою спейсерної групи, або зв'язувальної групи, такої як поліальдегід, наприклад, глутаральдегід, етилендіамінтетраоцтова кислота (ЕДТА) або діетилентриамінопентаоцтова кислота (ДПТА), або у присутності зв'язуючих агентів, таких як згадані вище для терапевтичних кон'югатів. Кон'югати, що включають мітки флуоресцеїнового типу, можуть бути отримані шляхом взаємодії з ізотіоціанатом. Інші кон'югати можуть також включати хемілюмінесцентні мітки, такі як люмінол та діоксетани, біолюмінесцентні мітки, такі як люцифераза та люциферин, або також радіоактивні мітки, такі як йод123, йод125, йод126, йод133, бром77, технецій99m, індій111, індій113m, галій67, галій68, рутеній95, рутеній97, рутеній103, рутеній105, ртуть107, ртуть203, реній99m, реній101, реній105, скандій47, телур121m, телур122m, телур125m, тулій165, тулій167, тулій168, фтор18, ітрій199, йод131. Способи, відомі фахівцям у даній галузі техніки, які існують для зв'язування радіоактивних ізотопів з антитілами, або безпосередньо, або за допомогою хелатуючого агента, такого як ЕДТА або ДТПА, згаданого вище, можна використовувати для радіоактивних елементів у діагностиці. Таким чином, можна також згадати мічення [I125]Na методом хлораміну T [Hunter W.M. and Greenwood F.C. (1962) Nature 194:495], або також технецієм99m методом Crockford et al. (патент США 4424200), або фіксацію за допомогою ДТПА, як описано Hnatowich (патент США 4479930). Винахід також стосується застосування антитіла відповідно до винаходу у виготовленні ліків, призначених для специфічної спрямованої доставки біологічно активної сполуки до клітин, що експресують, або підвищено експресують білок CD151. Біологічно активну сполуку в даній заявці розуміють як таку, що стосується будь-якої сполуки, здатної модифікувати, зокрема, інгібувати активність клітин, зокрема, їх ріст, проліферацію, або транскрипцію або трансляцію генів. Винахід також стосується реагенту для діагностики in vivo, що включає антитіло відповідно до винаходу, або один з його функціональних фрагментів, краще - мічене, зокрема, радіоактивно мічене, та його застосування у медичній візуалізації, зокрема, при виявленні раку, пов'язаного з експресією або гіперекспресією білка CD151 клітиною. Винахід також стосується композиції у формі комбінованого препарату, або кон'югата антиCD151/токсину, або радіоактивного елементу відповідно до винаходу в якості ліків. Краще, коли до композиції у формі комбінованого препарату, або до кон'югата відповідно до винаходу доданий ексципієнт та/або фармацевтично прийнятний носій. У даному описі фармацевтично прийнятний носій розуміють як такий, що стосується сполуки або комбінації сполук, включених до фармацевтичної композиції, які не викликають побічних реакцій і які, наприклад, дають можливість полегшити введення активної сполуки (сполук), збільшити її час життя або ефективність в організмі, підвищити її розчинність у розчині або поліпшити її зберігання. Такі фармацевтично прийнятні носії добре відомі, та будуть адаптовані фахівцями в даній галузі техніки залежно від природи та способу введення вибраної активної сполуки (сполук). Краще, коли ці сполуки будуть вводити системним шляхом, зокрема, внутрішньовенним шляхом, внутрішньом'язовим, внутрішньошкірним, внутрішньочеревним або підшкірним шляхом, або пероральним шляхом. Ще краще, коли композицію, що включає антитіла відповідно до винаходу, будуть вводити у множині випадків, диференційованих за часом. Оптимальні способи введення, режими дозування та галенові форми можуть бути визначені відповідно до критеріїв, що звичайно приймаються до уваги при визначенні придатного лікування для пацієнта, таких як, наприклад, вік або маса тіла пацієнта, тяжкість його загального стану, переносність лікування та встановлені побічні ефекти. Винахід відноситься, відповідно, до застосування антитіла, або одного з його функціональних фрагментів, у виготовленні ліків, призначених для специфічної спрямованої доставки біологічно активної сполуки до клітин, що експресують або додатково експресують CD151. Інші характеристики та переваги винаходу випливають з іншої частини опису, з прикладами 22 UA 105630 C2 5 10 15 20 25 30 35 40 45 50 55 60 та графічними матеріалами, підписи до яких наведені нижче. ПІДПИСИ ДО ГРАФІЧНИХ МАТЕРІАЛІВ На фіг. 1 показані нуклеотидна та білкова послідовності білка CD151, на яких показані петлі EC1 і EC2. Фіг. 2 є діаграмою, що ілюструє структуру тетраспанінів, до яких належить білок CD151, і дуже конкретно - дві позаклітинні петлі EC1 і EC2. На фіг. 3 показані відповідні послідовності важкого ланцюга та легкого ланцюга антитіла 203B6 відповідно до винаходу. Ділянки CDR, визначені за системою IMGT, показані підкресленим напівжирним шрифтом, тоді як ділянки CDR, визначені відповідно до Kabat, показані в рамках. На фіг. 4 показані відповідні послідовності важкого ланцюга та легкого ланцюга антитіла 205H8 відповідно до винаходу. Ділянки CDR, визначені відповідно до системи IMGT, показані підкресленим напівжирним шрифтом, тоді як ділянки CDR, визначені відповідно до Kabat, показані в рамках. На фіг. 5 показані відповідні послідовності важкого ланцюга та легкого ланцюга антитіла 211F3 відповідно до винаходу. Ділянки CDR, визначені відповідно до системи IMGT, показані підкресленим напівжирним шрифтом, тоді як ділянки CDR, визначені відповідно до Kabat, показані в рамках. На фіг. 6 показані відповідні послідовності важкого ланцюга та легкого ланцюга антитіла 214B2 відповідно до винаходу. Ділянки CDR, визначені відповідно до системи IMGT, показані підкресленим напівжирним шрифтом, тоді як ділянки CDR, визначені відповідно до Kabat, показані в рамках. На фіг. 7A-7Д проілюстрована експресія молекули CD151 у пацієнтів, що страждають раком простати. Кожна буква відповідає дослідженню одного пацієнта, і для кожного пацієнта верхня панель відповідає нормальній тканині, прилеглій до пухлини, а нижня панель відповідає пухлинній тканині. На фіг. 8 проілюстрована експресія молекули CD151 у пацієнтів, що страждають раком легені. Кожна літера відповідає дослідженню одного пацієнта, і для кожного пацієнта верхня панель відповідає нормальній тканині, прилеглій до пухлини, а нижня панель відповідає пухлинній тканині. На фіг. 9 показаний аналіз методом протокової цитометрії розпізнавання CD151 мишачим антитілом 203B6 на поверхні клітин NIH 3T3-CD151, PC3 і A549. На фіг. 10 показаний аналіз методом протокової цитометрії розпізнавання CD151 мишачим антитілом 205H8 на поверхні клітин NIH 3T3-CD151, PC3 і A549. На фіг. 11 показаний аналіз методом протокової цитометрії розпізнавання CD151 мишачим антитілом 211F3 на поверхні клітин NIH 3T3-CD151, PC3 і A549. На фіг. 12 показаний аналіз методом протокової цитометрії розпізнавання CD151 мишачим антитілом 214B2 на поверхні клітин NIH 3T3-CD151, PC3 і A549. На фіг. 13 показані результати оцінювання специфічності антитіл 203B6, 205H8, 211F3 і 214B2 за допомогою вестерн-блотинга. На фіг. 14 проілюстрована протипухлинна активність моноклональних антитіл анти-CD151 у моделі ксенотрансплантата пухлини простати PC3. Клітини PC3 прищеплювали мишам Swiss Nude (n=6) підшкірним шляхом. Через п'ять діб після щеплення клітин миші отримують введенням i.p. шляхом провокаційну дозу 2 мг/мишу антитіла, що тестується з подальшими двома введеннями на тиждень дози 1 мг/мишу цього антитіла. Об'єм пухлини визначають за формулою π/6 × довжина × ширина × товщина. На фіг. 15 показаний аналіз антитіл 203B6 і 214B2, радіоактивно мічених йодом 125, з (A) авторадіографією після електрофорезу в ДСН-ПААГ за відновлювальних умов, та (Б) аналізом за допомогою хроматографії на молекулярних ситах. На фіг. 16 проілюстроване дослідження іммобілізації радіоактивно міченого антитіла 203B6 на клітинах PC3: Визначення константи спорідненості при рівновазі: (A) крива насичення та (Б) графік Скетчарда. На фіг. 17 проілюстроване дослідження іммобілізації радіоактивно міченого антитіла 214B2 на клітинах PC3: Визначення константи спорідненості при рівновазі: (A) крива насичення та (Б) графік Скетчарда. На фіг. 18 показаний ефект антитіл анти-CD151 на функції тромбоцитів, де (A) агрегація тромбоцитів та (Б) активація тромбоцитів (вивільнення серотоніну). На фіг. 19 показаний ефект антитіл анти-CD151 на пухлинний ріст in vivo клітин NCI-H441. На фіг. 20 проілюстрований фенотип A) та маркери диференціації Б) клітин THP-1, культивованих за відсутності та у присутності PMA. В) Ефект антитіл анти-CD151 (214B2 і 23 UA 105630 C2 5 10 15 20 25 30 35 40 45 50 55 60 203B6) на секрецію TNF клітинами THP-1, культивованими за відсутності та у присутності PMA. Антитіло 9G4 використовують як ізотиповий контроль, а ЛПС - як позитивний контроль активації. На фіг. 21 показаний ефект антитіл 241B2 і 203B6 на презентацію антигену. A) поліклональний контроль проліферації, Б) антигенспецифічна проліферація. ПРИКЛАДИ Приклад 1: дослідження експресії молекули CD151 Експресію білка CD151 досліджували за допомогою імуногістохімії (ІГХ) у зразках тканин людини, отриманих від пацієнтів, що страждають раками простати або раком легені. Для цих пацієнтів можна було отримати мікроскопічні препарати з нормальними тканинами, прилеглими до пухлини, і тому вони були включені з метою калібрування рівня експресії в пухлинних тканинах проти нормальних тканин. Для цих експериментів використовують існуючі у продажу мікроскопічні препарати типу "Tissue array". Після депарафінування відкриття антигену проводять за 30 °C за допомогою ферментативного розчину, що включає пепсин (Labvision ref. AP-9007-005). Після цієї стадії слідом іде стадія видалення ендогенних пероксидаз шляхом інкубації зрізів у розчині пероксиду водню (Sigma) 0,3 % у воді. Потім проводять насичення неспецифічних сайтів розчином Ultra-VBlock (Labvision, ref. TA-125-UB), і мічення проводять, використовуючи наявне у продажу мишаче антитіло анти-CD151 (Serotech, Ref. MCA 1856), використовуване у кінцевій концентрації 5 мкг/мл. Мишаче антитіло для контролю ізотипу Igg1 (Dakocytomation, Ref. X0931) використовують як негативний контроль експерименту. Візуалізацію мічення проводять, використовуючи систему візуалізації Envision Dual Link (Dakocytomation, Ref. K4061), і стандарт субстрату пероксидази DAB, що є S3309 від Dakocytomation. Результати, наведені на фіг. 7, показують, що у ряду пацієнтів, у яких розвиваються пухлини простати, проявляється гіперекспресія молекули CD151. Ця гіперекспресія може бути досить значною для 20 % досліджених пацієнтів (пацієнти A і В) або помірною (пацієнти A і Г). Слід зазначити, що, за винятком рівня ендотеліальних клітин, відповідні нормальні тканини простати не експресують CD151, або експресують його тільки неістотно, і що його експресія видається обмеженою структурами залозистого типу. Пацієнт Д є прикладом пухлини, що не експресує CD151. У випадку раку легені (фіг. 8) експресію від помірної (пацієнт A) до помітної (пацієнт Б) спостерігають у деяких клітинах нормальної легеневої тканини. Однак пухлинна тканина виявляє дуже високу щільність інтенсивно мічених клітин (пацієнти А та Б). Пацієнт В є прикладом пухлини, що не експресує CD151. Приклад 2: Створення та добір антитіл Мишей BALB/c імунизували підшкірним шляхом, використовуючи 20×106 клітин NIH 3T3, що експресують на своїй поверхні людський CD151, отриманих шляхом трансфекції геном CD151. Першу імунізацію здійснювали в присутності повного ад'юванта Фрейнда, а подальші дві імунізації - в присутності неповного ад'юванта Фрейнда. За три доби до злиття проводили останню бустер-ін'єкцію 10×106 клітин NIH 3T3-CD151 внутрішньочеревним шляхом. Потім проводили злиття клітин селезінки миші з клітинами мієломи SP2/0-ag14 у співвідношенні 1/1, використовуючи загальноприйняті методики, описані Köhler і Milstein. Потім проводили скринінг антитіл, секретованих до надосадових рідин з гібридом, отриманих в результаті злиття, на їх здатність розпізнавати рекомбінантну позаклітинну петлю EC2 CD151 за допомогою твердофазового імуноферментного аналізу (ELISA) та CD151, що експресується на поверхні пухлинної лінії рака простати людини PC3, за допомогою протокової цитометрії. Для ELISA 96-лункові планшети сенсибілізують протягом ночі при +4 °C рекомбінантною позаклітинною петлею EC2 у концентрації 5 мкг/мл у ФСБ. Після промивання ФСБ лунки насичують 0,5 % розчином желатину у ФСБ протягом 1 години при 37 °C, а потім знову промивають ФСБ. Надосадові рідини культур гібридом оцінюють без розведення (інкубація протягом 1 години при 37 °C). Антитіла, фіксовані до іммобілізованої петлі EC2, виявляють шляхом послідовної інкубації з поліклональним антитілом IgG кози проти миші, кон'югованим з пероксидазою (Jackson/USA, розведення до 1/5000, 1 година при 37 °C), а потім з субстратом пероксидази (TMB, Interchim/France, 10 хвилин при температурі навколишнього середовища). Реакцію зупиняють додаванням 1 M сірчаної кислоти та вимірюють оптичну густину (OD) при 450 нм. Аналізи протокової цитометрії проводять на 96-лункових планшетах. Нерозведені надосадові рідини гібридом додають до 100000 клітин PC3, попередньо поміщених до лунок. Після інкубації протягом 20 хвилин при +4 °C з наступним промиванням додають Alexa488мічене поліклональне антитіло IgG кози проти миші (Molecular Probes, розведення 1/500). 24 UA 105630 C2 5 Інтенсивність флуоресценції (СІФ, середню інтенсивність флуоресценції) визначають за допомогою цитофлуориметра після додаткової інкубації протягом 20 хвилин при +4 °C. По закінченні цього скринінга були відібрані такі 4 гібридоми (критерій добору: OD > 0,5 для ELISA та СІФ > 50 для протокової цитометрії): 203B6, 205H8, 211F3 і 214B2. результати, отримані для цих 4 гібридом, показані в таблиці 4 нижче: Таблиця 4 ELISA OD 450 нм 1,130 0,649 0,959 0,684 Гібридома 203B6 205H8 211F3 214B2 10 15 Цитометрія (PC3) СІФ 975 595 936 1004 Після клонування клон кожної відібраної гібридоми ампліфікували. Ізотипи отриманих антитіл визначали для надосадової рідини кожної культури, використовуючи набір для ізотипування мишачих антитіл (клонотипуюча система SBA, Southern Biotech), а потім остаточну характеристику здійснювали за допомогою ELISA (позаклітинна петля EC2) і за допомогою протокової цитометрії на мишачій лінії NIH 3T3 і стабільному трансфектанті NIH 3T3-CD151, а потім на пухлинних лініях раку легені людини A549, раку простати DU145 і раку підшлункової залози BxPC3 за умов, описаних раніше. Концентрацію антитіла надосадових рідин доводили до 5 мкг/мл для ELISA і до 10 мкг/мл для аналізів протокової цитометрії. Отримані результати показані в таблиці 5 нижче: Таблиця 5 Антитіло антиCD151 25 30 35 40 ELISA OD при 450 нм 203B6 cl1A 205H8 cl1A 211F3 cl1A 214B2 cl1A 20 Ізотип Igg1 K Igg3 K Igg1 K Igg1 K 2,218 1,842 2,301 2,477 NIH3T3 16 16 16 16 Протокова цитометрія СІФ NIH3T3-CD151 A549 DU145 540 675 860 332 388 584 556 481 524 748 820 1332 Bxpc3 768 350 536 849 На фіг. 9, 10, 11 і 12 показані криві розпізнавання для клітин NIH 3T3-CD151, PC3 і A549 шляхом протокової цитометрії, які отримані для антитіл 203B6, 205H8, 211F3 і 214B2. Ці криві порівнянні з отриманими з антитілом анти-CD151 50-6 (ATCC CRL-2696) і демонструють специфічність цих антитіл для CD151. Потім гібридоми були депоновані в CNCM, Національній колекції культур мікроорганізмів, Інститут Пастера, 25 Rue du Docteur Roux, 75724 PARIS Cedex 15. Приклад 3: Специфічність антитіл Специфічність антитіл 203B6, 205H8, 211F3 і 214B2 оцінювали за допомогою вестернблотинга. Петлю EC2 CD151 клонували у векторі pET22b для експресії у розчинній формі в періплазмі Escherichia coli. Продукований білок включає амінокислоти 130-221 пептидної послідовності CD151 людини, до якої приєднаний хвіст Poly-His у C-кінцевому положенні з метою полегшення очищення. Рекомбінантний білок EC2 очищали за допомогою афінної хроматографії з використанням іммобілізованих металів (IMAC) на носії хелатуючої сефарози HP (GE Healthcare). Зростаючі кількості рекомбінантного білка CD151 EC2 (1, 2, 4 і 8 мкг) та клітинного лізату HT29 (10, 20 і 50 мкг сумарних білків) поміщали на 4-12 % акриламідний гель (Biorad). Після електрофорезу (невідновлювальні умови) білки переносили на нітроцелюлозні мембрани. Потім, після перенесення мембрани інкубували з очищеними антитілами 203B6, 205H8, 211F3 та 214B2 (0,5 мкг/мл), а потім з поліклональним антитілом Ig кроля проти миші, зшитим з пероксидазою (GE Healthcare), після чого візуалізували за допомогою хемілюмінесценції. Антитіла 203B6, 205H8, 211F3 та 214B2 розпізнають повнорозмірний білок CD151 та рекомбінантну петлю EC2 на основі вестерн-блотинга (фіг. 13). Антитіло 205H8 має меншу реактивність відносно повнорозмірного білка CD151 за умов аналізу. У порівнянні з сигналом, спостережуваним для антитіл 203B6, 211F3 і 214B2, для антитіла 205H8 був виявлений 25 UA 105630 C2 5 10 15 20 25 30 слабкіший сигнал. Цю відмінність не спостерігають для розпізнавання рекомбінантного білка EC2. Приклад 4: Протипухлинна активність антитіл анти-CD151 у моделі ксенотрансплантату PC3 Матеріал та методи Оскільки спостерігали гіперекспресію CD151 у пухлинних тканинах раку простати за допомогою імуногістохімії на серії зрізів тканини людини, була запланована оцінка антитіл анти-CD151 на ксенотрансплантаті клітин PC3 раку простати. Лінія PC3 є андроген-незалежною лінією простати, отриманою з ATCC та культивовуваною в середовищі F12K (Invitrogen Corporation, Scotland, United Kingdom), 10 % ФСТ (Invitrogen Corporation). Клітини ділять за дві доби до щеплення, тому вони перебувають в експонентній фазі росту. П'ять мільйонів клітин PC3 прищеплюють підшкірно самцям мишей Swiss Nude шеститижневого віку. Через п'ять діб після імплантації вимірюють об'єми пухлин, мишей рандомізують таким чином, щоб сформувати групи, які не є статистично розрізними, та оброблення починають з i.p. ін'єкції провокаційної дози 2 мг антитіла на мишу. Потім тварин обробляють двічі на тиждень дозою 1 мг антитіла на мишу, і пухлини вимірюють двічі на тиждень. Тварини контрольної групи отримують ін'єкцію ФСБ. Об'єми пухлин обчислюють за формулою π/6 × довжина × ширина × висота. Статистичний аналіз проводять за кожним з вимірювань, використовуючи критерій Манна-Уїтні. Результати Результати, показані на фіг. 14, показують, що антитіла 203B6, 214B2 і 211F3 здійснюють значне інгібування пухлинного росту in vivo клітин PC3. Антитіло 205H8, хоча є інгібітором, проявляє помірнішу протипухлинну активність у даній моделі. Приклад 5: Дослідження іммобілізації антитіл анти-CD151 на клітинах PC3 Антитіла анти-CD151 203B6 і 214B2 спочатку мітили йодом-125 у спосіб з використанням хлорамін T. Після мічення антитіла очищали за допомогою хроматографії на молекулярних ситах на колонці PD-10 (GE Healthcare) з метою видалення вільного йоду-125. Радіохімічну чистоту радіоактивно мічених антитіл визначали після очищення шляхом тонкошарової хроматографії на силікагелі, аналітичної хроматографії на молекулярних ситах на колонці Superdex 200 (GE Healthcare) та шляхом авторадіографії після електрофорезу в ДСН-ПААГ. На фіг. 15 показано, що важкі ланцюги (~50 кДа) та легкі ланцюги (~25 кДа) двох антитіл мічені еквівалентно (15A) та підтверджена відсутність вільного йоду-125 після очищення (15Б). Специфічну активність радіоактивно мічених антитіл визначали, використовуючи гаммалічильник (Wallace Wizard 1480, Perkin Elmer). Фізико-хімічні властивості антитіл 203B6 та 214B2, мічених радіоактивно йодом 125 - [125I]203B6 та [125I]-214B2 наведені у таблиці 6 нижче: 35 Таблиця 6 Антитіло Ефективність мічення (%) Питома активність (мКі/мг) Радіохімічна чистота (%) Атоми йоду/антитіло 40 45 50 [125I]-203B6 85,5 10,6 99,7 0,73 [125I]-214B2 78,1 12,7 99,5 0,87 Потім вимірювали спорідненість двох радіоактивно мічених антитіл з їх мішенню CD151 на клітинній поверхні для клітин раку простати PC3. Константу дисоціації KD антитіл визначали способом Скетчарда. Клітини PC3 (1×106 клітин/50 мкл буфера ФСБ, що містить 0,5 % БСА) інкубували в присутності зростаючих концентрацій радіоактивно мічених антитіл від 6 нг/мл до 27 мкг/мл включно протягом 1 години при 4 °C (кінцевий об'єм: 150 мкл). Після інкубації вимірювали сумарну радіоактивність, зв'язану з клітинами (іммобілізоване радіоактивно мічене антитіло), використовуючи гамма-лічильник. Неспецифічну іммобілізацію визначали для кожної тестованої концентрації у присутності надлишку неміченого антитіла (×100). Специфічну іммобілізацію обчислювали шляхом віднімання неспецифічної радіоактивності з сумарної радіоактивності. Криві насичення показані на фіг. 16A та 17A для антитіл [125I]-203B6 і [125I]214B2, відповідно. Криві Скетчарда (фіг. 16Б и 17Б), отримані після оброблення даних з використанням програмного забезпечення Prism, дають можливість визначити константу дисоціації KD двох антитіл (нахил = - 1/KD): - 203B6 KD=12,85±0,99 нМ - 214B2 KD=6,38±0,45 нМ Приклад 6: Дія антитіл анти-CD151 на функції тромбоцитів Агрегація є основною функцією тромбоцитів у процесі згортання крові, наприклад, у 26 UA 105630 C2 5 10 15 20 25 30 35 40 45 50 55 60 відповідь на ушкодження судин. Це явище звичайно передує активації тромбоцитів, у якій задіяна експозиція деяких білків на їх поверхні та секреція змісту їх накопичувальних вакуолів (альфа-гранул та щільних гранул). У світлі того факту, що CD151 експресується на тромбоцитах (Goschnick and Jackson, 2007, Mini-Rev. Med. Chem. 7: 1236-1247), дію антитіл анти-CD151 на функції тромбоцитів оцінювали in vitro, використовуючи тести на активацію та агрегацію тромбоцитів. Для цього дослідження зразки крові брали натще у донорів, використовуючи тринатрію цитрат як антикоагуляційний агент. Центрифугування при 100×g протягом 10 хвилин при 20 °C дає можливість отримати збагачену тромбоцитами плазму (PRP), тоді як збіднену тромбоцитами плазму (PPP) отримують шляхом центрифугування при 1500×g протягом 10 хвилин при 20 °C. Агрегацію тромбоцитів вимірювали у PRP 10 донорів після доведення до 300000 тромбоцитів/мм3 відповідно до принципу Борна (модифікацією прохідного світла) при перемішуванні при 500 об/хв при 37 °C. Тривалість вимірювання становила 5 хвилин для тромбіну та АДФ (позитивні контролі) та 15 хвилин для тестованих антитіл. Активацію тромбоцитів вимірювали у PPP 10 донорів шляхом вимірювання секреції серотоніну (5гідрокситриптаміну або 5-HT), використовуючи ВЕЖХ із флуориметричним детектором. Дію антитіл на функції тромбоцитів визначали для концентрації 10 мкг/мл. Використовували декілька контрольних антитіл: PM6/248 (анти-CD41, інтегрин αIIb) та 14A2.H1 (анти-CD151) як позитивні контрольні антитіла та 9G4 як ізотиповий контроль (IgG1). Агрегацію тромбоцитів, викликану різними тестованими сполуками, оцінюють для кожного донора у вигляді відсотка від агрегації, викликаної тромбіном, що беруть за стандарт (100 %). На фіг. 18A показані середні значення агрегації, отримані для кожної тестованої сполуки. АДФ і антитіло PM6/248, що мають спричинювальну дію, але які менш ефективні, ніж тромбін, викликають порівнянну агрегацію, 30,1±10,5 % і 47,6±12,7 %, відповідно. Варіації в отриманих значеннях рутинно спостерігають при гемостазі, і вони є результатом варіабельності між індивідуумами. Як очікували, антитіло 9G4 не викликає агрегацію тромбоцитів: це антитіло дає можливість визначити поріг виявлення (5 нМ). Агрегація, викликана антитілами анти-CD151 203B6 та 214B2, 7,3±3,2 % та 4,9±1,6 % відповідно, є відносно низькою та близька до порога виявлення. Агрегація, викликана цими двома антитілами, є меншою, ніж для контрольного антитіла 14A2.H1. На фіг. 18Б показані середні значення для серотоніну, що вивільняється тромбоцитами (у нМ) у присутності різних тестованих сполук. Результати, отримані для даного тесту на активацію тромбоцитів, порівнянні з описаними вище. Антитіло 9G4 не викликає активацію тромбоцитів, тоді як тромбін викликає дуже помітне вивільнення серотоніну (~430 нМ). Кількості серотоніну є меншими у присутності АДФ, PM6/248 та 14A2.H1 (середні значення 72,6 нМ, 34,6 нМ та 21,6 нМ, відповідно), але ці сполуки можна класифікувати як активатори тромбоцитів. Вивільнення серотоніну, викликане антитілами анти-CD151 203B6 та 214B2, є дуже низьким: дійсно, середні значення, визначені для цих двох антитіл, у 2,4 та у 3,6 разів нижчі, відповідно, ніж середнє значення для контрольного антитіла анти-CD151 14A2.H1. Як висновок, ці два тести підтверджують, що контрольне антитіло анти-інтегрин αIIb PM6/248, та контрольне антитіло анти-CD151 14A2.H1, здатні викликати агрегацію тромбоцитів in vitro, та викликати активацію тромбоцитів (Roberts et al., 1995, Br. J. Haematol. 89: 853-860; Hornby et al., 1991, Br. J. Haematol. 79: 277-285). На противагу антитілу 14A2.H1, антитіла антиCD151 203B6 та 214B2 викликають дуже низькі рівні агрегації та активації тромбоцитів, які не є значущими у клінічному відношенні для людини. Приклад 7: Дослідження активності антитіл анти-CD151 по відношенню до росту пухлин NCIH441 in vivo Клітини NCI-H441, отримані з ATCC, культивують у середовищі RPMI 1640, до якого додані 10 % ФСТ та 1 % L-глутамін. Клітини ділять за дві доби до щеплення, щоб отримати клітини, що перебувають в експонентній фазі росту на добу щеплення. Десять мільйонів клітин NCI-H441 імплантують у підшкірній локалізації безтимусним мишам Nude. Через п'ять діб після щеплення пухлини є вимірними, і тварин, що несуть пухлини порівнянного розміру, розподіляють на групи по 6. Мишей оброблюють i.p. шляхом провокаційною дозою антитіла 2 мг/мишу, а потім, двічі на тиждень, дозою 1 мг антитіла на мишу. Об'єм пухлини оцінюють двічі на тиждень та обчислюють, використовуючи формулу: π/6 × довжина × ширина × висота. Статистичний аналіз даних проводять при кожному вимірюванні, використовуючи критерій Манна-Уїтні. Результати, показані на фіг. 19, демонструють, що антитіла 203B6 та 214B2 здатні значно (p
ДивитисяДодаткова інформація
Назва патенту англійськоюNovel antibodies used to treat cancer
Автори російськоюHaeuw, Jean-Francois
МПК / Мітки
МПК: C07K 16/30, G01N 33/577, C12P 21/08, A61P 35/00, C12N 5/16, C12N 5/07, C07K 16/28, A61K 39/395
Мітки: раку, лікуванні, використовуються, антитіла, нові
Код посилання
<a href="https://ua.patents.su/57-105630-novi-antitila-yaki-vikoristovuyutsya-pri-likuvanni-raku.html" target="_blank" rel="follow" title="База патентів України">Нові антитіла, які використовуються при лікуванні раку</a>
Попередній патент: Похідні арилсульфоніл піразолін карбоксамідину як антагоністи 5-нт6
Наступний патент: Монтажний профіль для підвісного монтажу плиток на зовнішній стіні
Випадковий патент: Спосіб виготовлення деталі одягу, що має кут