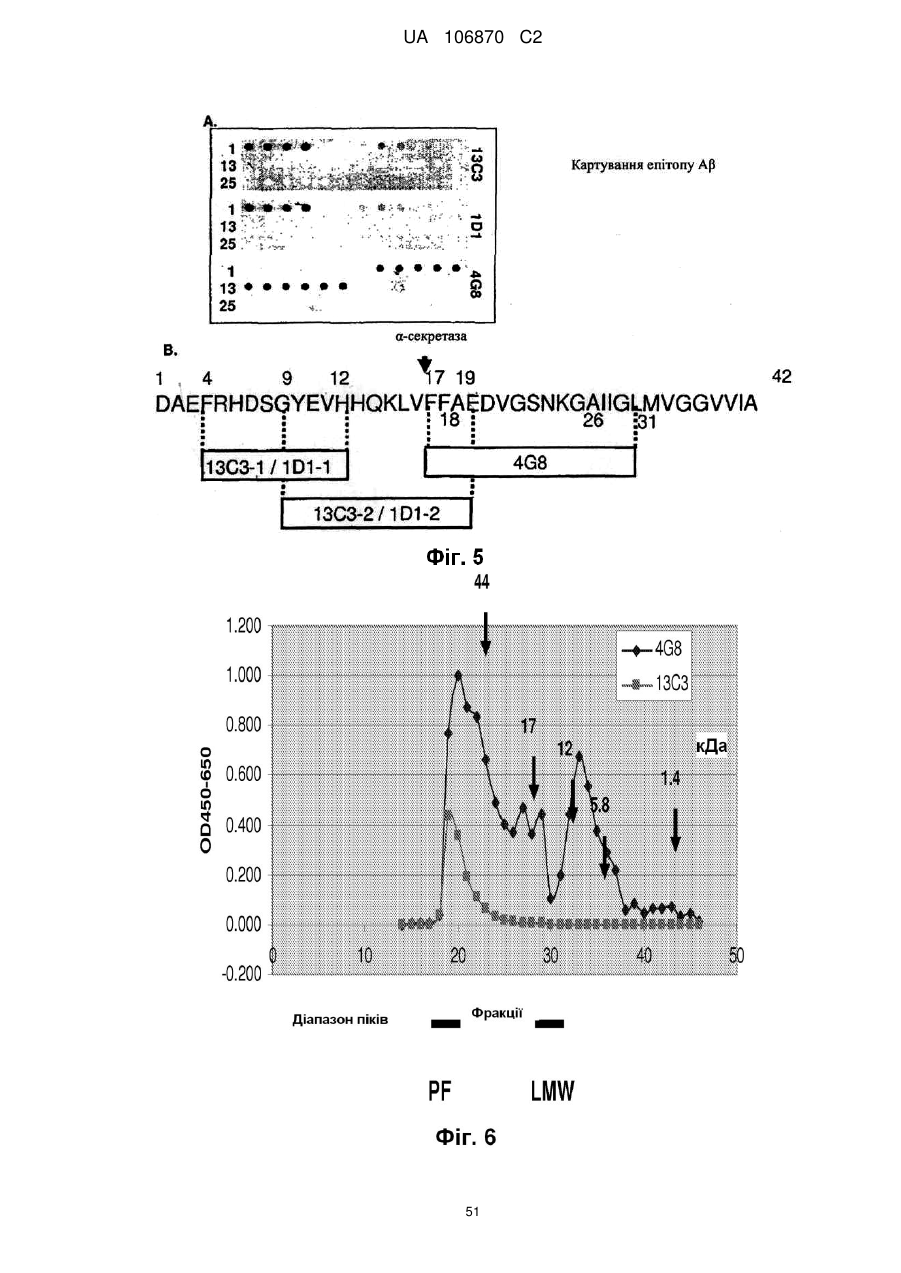
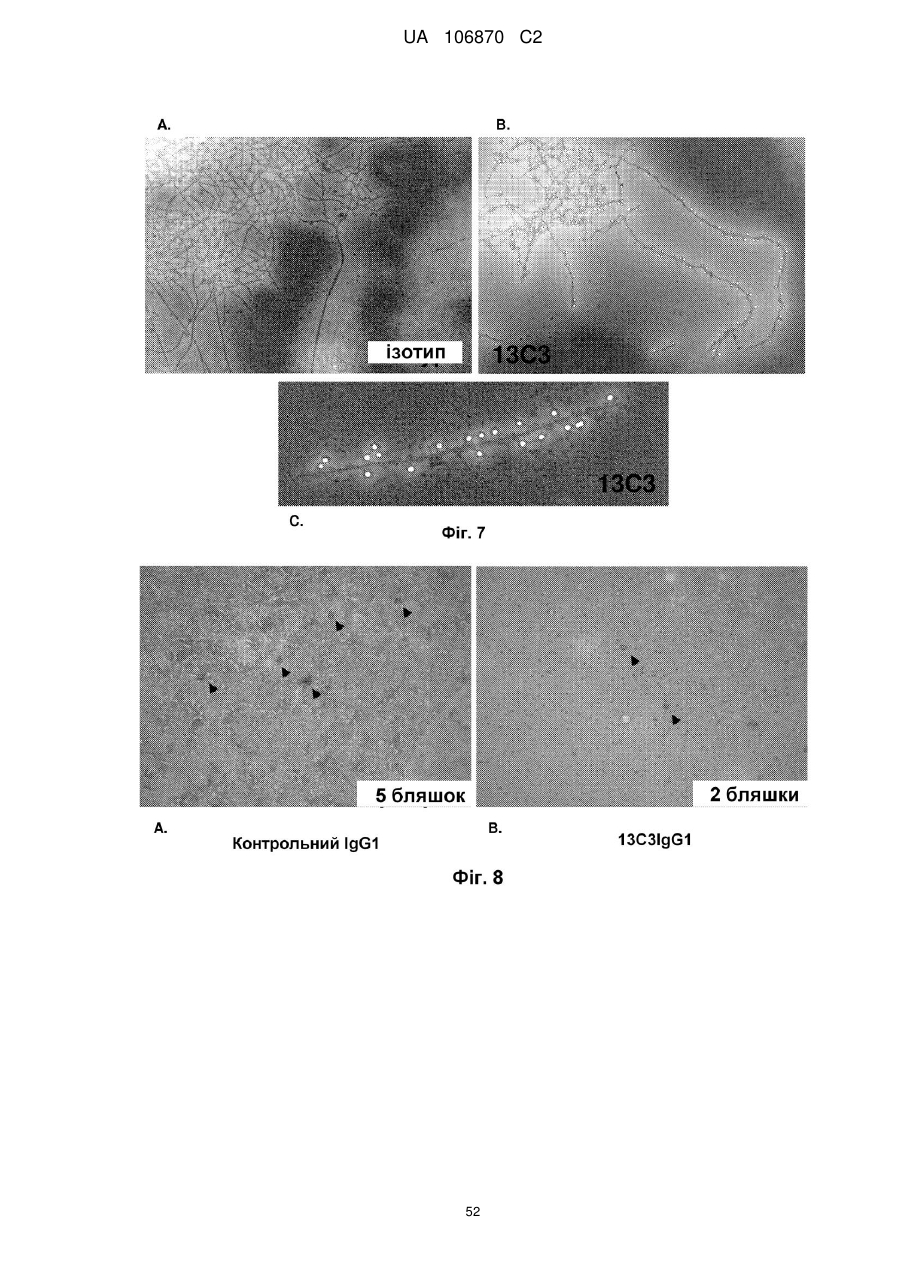
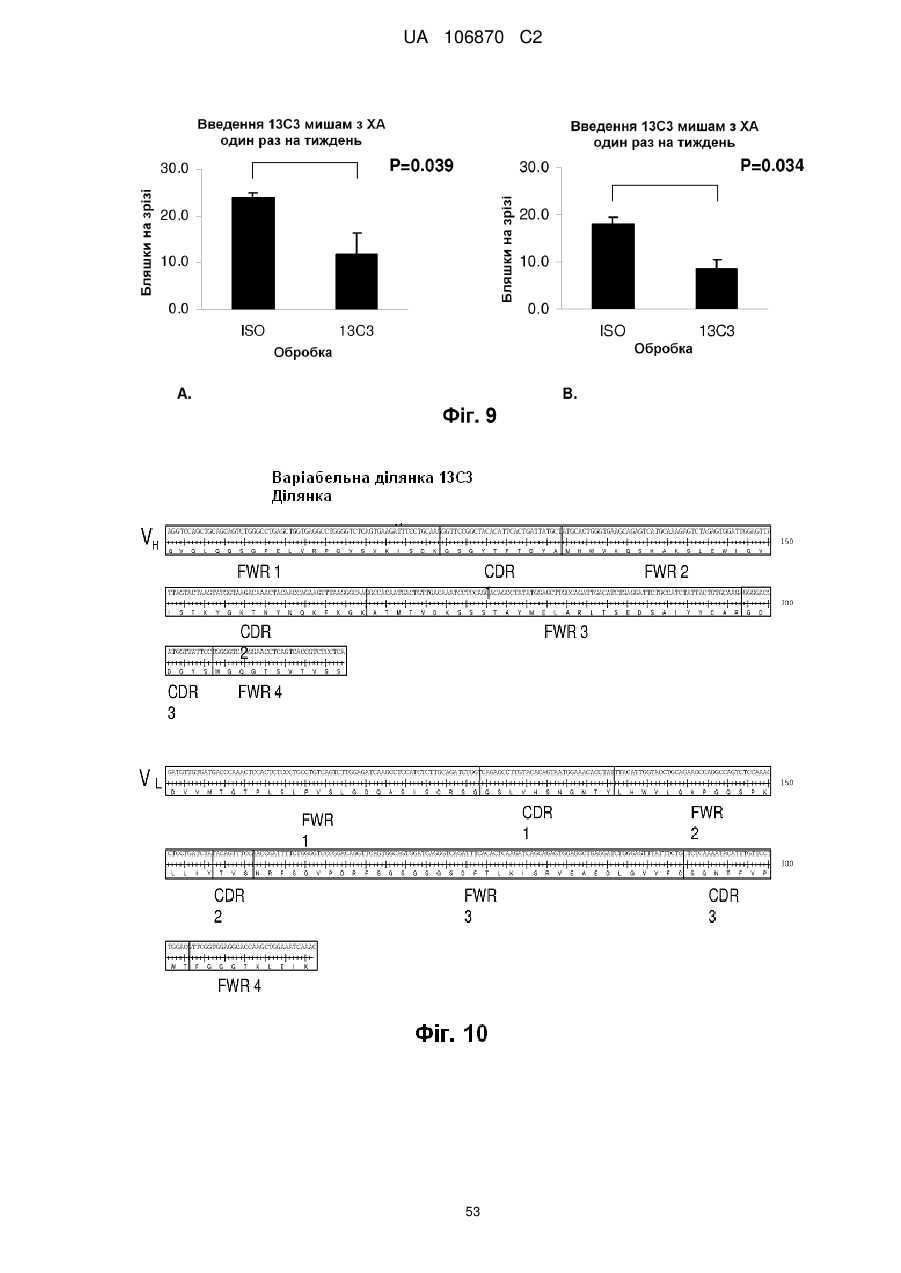
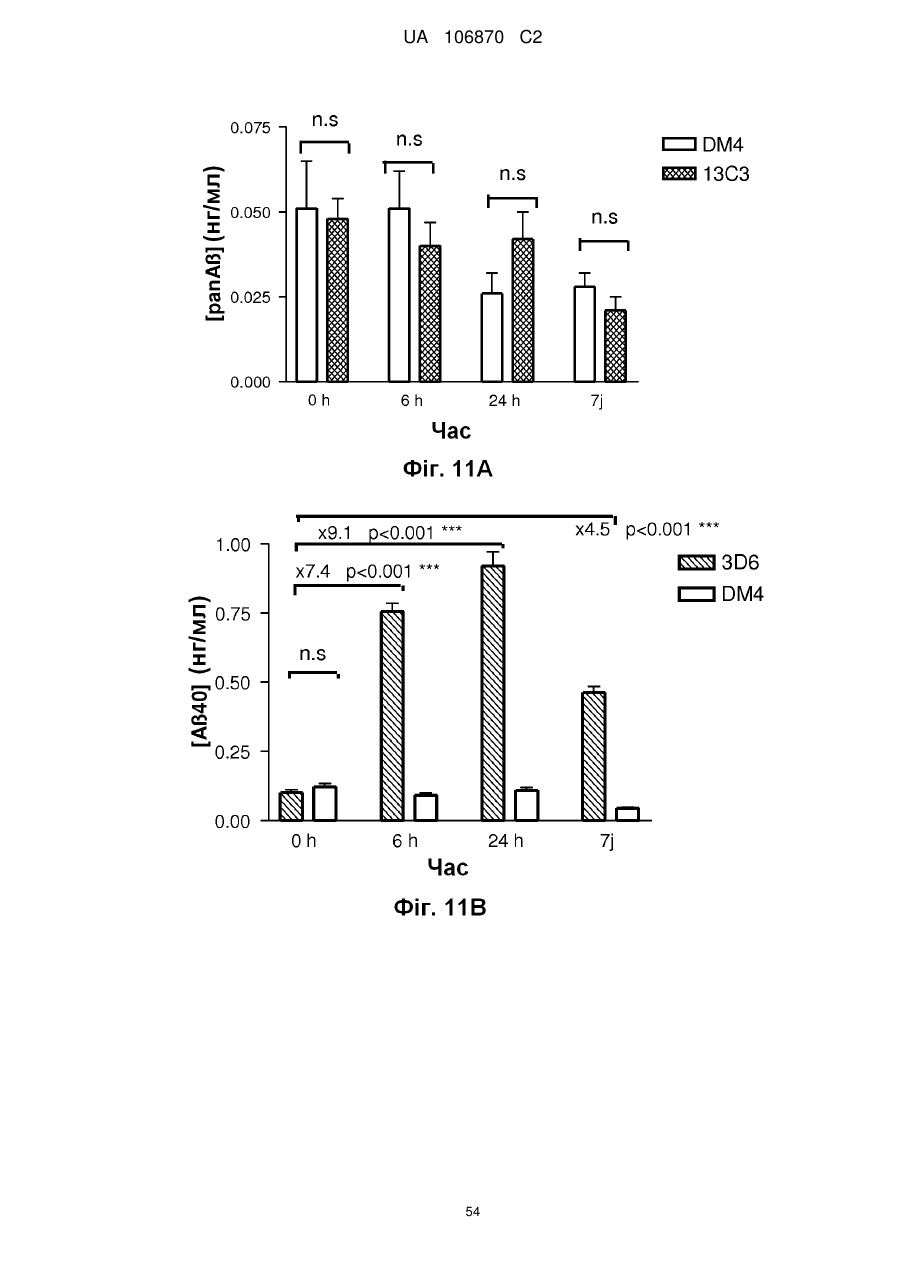
Антитіла, специфічні для протофібрилярної форми бета-амілоїдного білка
Формула / Реферат
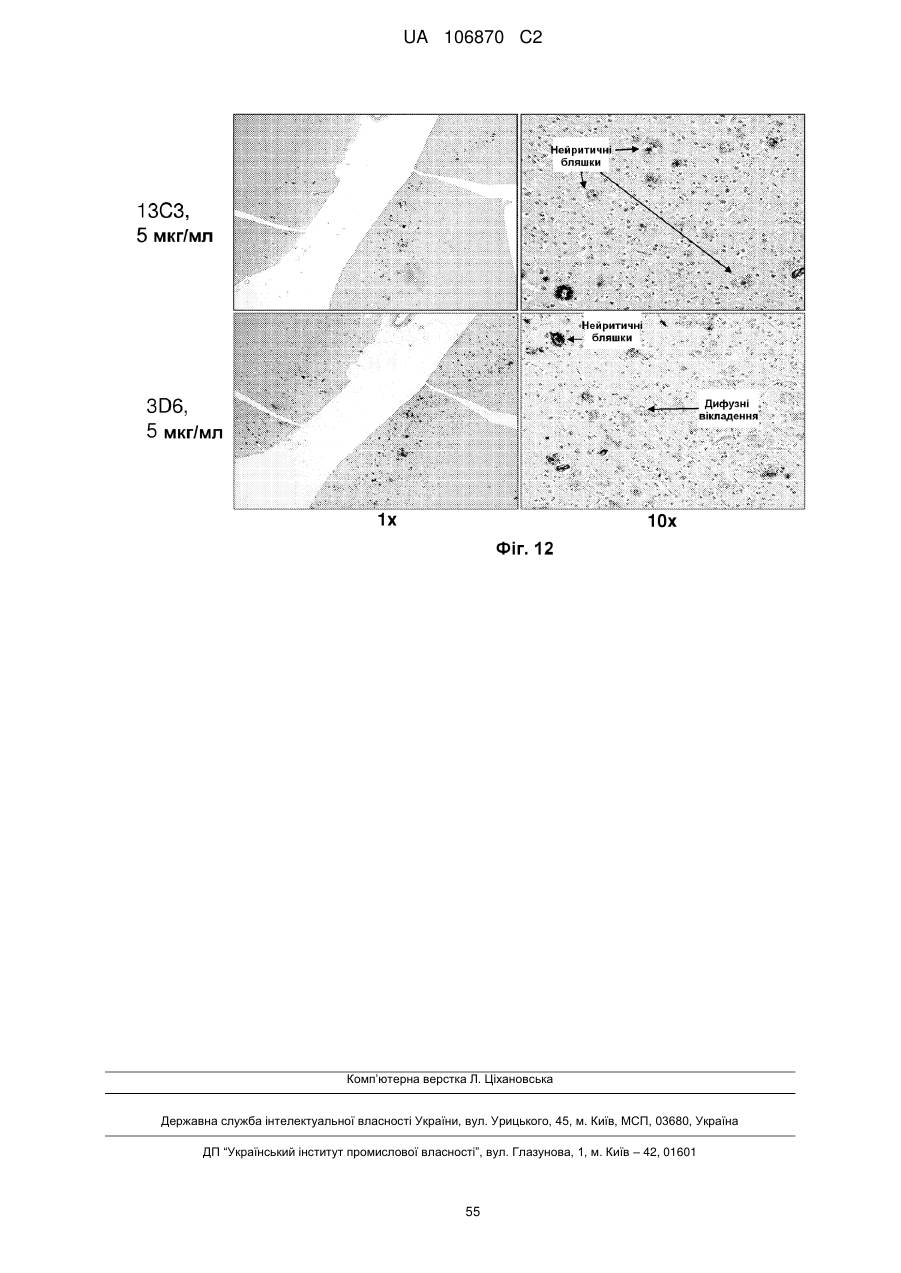
1. Виділене моноклональне антитіло, яке специфічно взаємодіє з конформаційним епітопом протофібрилярної форми пептиду Аβ, де вказане антитіло є антитілом 13С3, яке продукується гібридомою, доступною в АТСС під номером доступу РТА-8830, або його гуманізованим антитілом.
2. Антитіло за п. 1, яке являє собою гуманізоване антитіло 13С3, яке продукується гібридомою, доступною в АТСС під номером доступу РТА-8830.
3. Виділене моноклональне антитіло, яке специфічно взаємодіє з конформаційним епітопом протофібрилярної форми пептиду Аβ, де вказане антитіло містить (і) варіабельний легкий ланцюг, що містить ділянку CDR1 SEQ ID NO: 13, ділянку CDR2 SEQ ID NO: 14 і CDR3 SEQ ID NO: 15, і (іі) варіабельний важкий ланцюг, що містить ділянку CDR1 SEQ ID NO: 20, ділянку CDR2 SEQ ID NO: 21 і CDR3 SEQ ID NO: 22.
4. Антитіло за п. 3, яке являє собою гуманізоване моноклональне антитіло.
5. Антитіло за п. 4, де гуманізоване моноклональне антитіло є гуманізованим варіантом антитіла 13С3, яке продукується гібридомою, доступною в АТСС під номером доступу РТА-8830.
6. Спосіб визначення кількості протофібрилярної форми β-амілоїдного пептиду в зразку тканини або рідини, що включає:
(a) приведення зразка тканини або рідини в контакт з антитілом за будь-яким з пп. 1-5 або його антигензв'язуючим фрагментом, і
(b) визначення кількості протофібрилярної форми β-амілоїдного пептиду у зразку.
7. Набір для визначення протофібрилярної форми β-амілоїдного пептиду, який виявляє більшу афінність відносно протофібрилярної форми β-амілоїдного пептиду, ніж відносно низькомолекулярних форм β-амілоїдного пептиду, виявляючи мінімальну афінність відносно низькомолекулярних форм β-амілоїдного пептиду, що включає в себе:
(a) антитіло за будь-яким з пп. 1-5 або його антигензв'язуючий фрагмент, і
(b) реагент, який зв'язується безпосередньо або не напряму із вказаним антитілом або його антигензв'язуючим фрагментом.
8. Фармацевтична композиція, яка містить антитіло за будь-яким з пп. 1-5 і фармацевтично прийнятний носій.
Текст
Реферат: Винахід належить до виділеного моноклонального антитіла, яке специфічно зв’язується з конформаційним епітопом протофібрилярної форми β-амілоїдного пептиду людини. Також винахід належить до способу визначення кількості протофібрилярної форми β-амілоїдного пептиду, набору для визначення протофібрилярної форми β-амілоїдного пептиду та фармацевтичної композиції, що містить протофібрилярну форму β-амілоїдного пептиду. UA 106870 C2 (12) UA 106870 C2 UA 106870 C2 5 10 15 20 25 30 35 40 45 50 55 60 ПЕРЕХРЕСНІ ПОСИЛАННЯ НА СПОРІДНЕНІ ЗАЯВКИ За даною заявкою вимагається пріоритет попередніх патентних заявок: 60/988481, поданої 16 листопада 2007 року; і 61/019747, поданої 8 січня 2008 року, змісти описів яких включені як посилання. ГАЛУЗЬ ВИНАХОДУ Даний винахід стосується виділеного антитіла, яке специфічно взаємодіє з конформаційними епітопами протофібрилярної форми бета-амілоїдного пептиду людини. Такі антитіла виявляють мінімальну афінність або афінність, що не піддається визначенню, стосовно низькомолекулярних форм бета-амілоїдного пептиду. Антитіла, що описуються в цьому документі, будуть застосовними при діагностиці, лікуванні і/або запобіганні відкладенню бетаамілоїдних бляшок, асоційованому з виникненням і розвитком хвороби Альцгеймера. ПЕРЕДУМОВИ ВИНАХОДУ Бета-амілоїдні пептиди(Аβ), як вважають, є причинним фактором хвороби Альцгеймера ("ХА") внаслідок утворення нерозчинних фібрил із пептидів Аβ і відкладення таких фібрил з утворенням амілоїдних бляшок. Утворення таких бляшок у ділянці головного мозку є критичним для пам'яті та інших когнітивних функцій, що, як вважають, призводить до деменції, асоційованої з даним захворюванням (дивись Selkoe, 1994, J. Neuropathol. Exp. Neurol. 53:438447). Бета-амілоїдні пептиди включають у себе групу пептидів довжиною 39-43 амінокислоти, які утворюються при протеолітичному розщепленні білка-попередника амілоїду (APP) за допомогою і β-секретази, і γ-секретази з аміно- і карбоксикінця, відповідно. Існує, принаймні, п'ять різних ізоформ APP: довжиною 563, 695, 714, 751, і 770 амінокислот, відповідно (дивись Wirak et al., 1991 Science 253:323). Такі ізоформи APP утворюються за допомогою альтернативного сплайсингу первинних транскриптів гена APP. Численні місенс-мутації були виявлені в APP у сім'ях із аутосомно-домінантною хворобою Альцгеймера з раннім початком. Деякі мутації групуються поблизу ділянок розщеплення секретазою і впливають на метаболізм APP, збільшуючи або продукцію, або кількісне співвідношення форм Аβ (наприклад, Аβ42), які виявляють велику схильність до утворення фібрил і швидшу агрегацію, ніж інші форми. Фібрилам із високою молекулярною масою може бути властива нейрональна токсичність, яка з'являється при агрегації розчинних пептидів Аβ у нерозчинні фібрили і згодом включення фібрил в амілоїдні бляшки. Проміжна фібрилярна форма являє собою протофібрилярну (PF) форму, олігомерну форму пептидів Аβ із високою молекулярною масою, які розчинні in vitro, і їх можна виділити у вигляді молекули приблизно 670 кДа. Таким чином, утворення нерозчинних фібрил пептидів Аβ in vitro являє собою кінцевий результат первинної олігомеризації пептиду Аβ для утворення відмінної за структурою розчинної протофібрилярної форми з вищою молекулярною масою. Такі перехідні структури протофібрил є попередниками для амілоїдних волокон, відповідальних за порушення функцій клітини і нейронального ураження при хворобі Альцгеймера (ХА) та інших захворювань, пов'язаних з агрегацією білків. Різні варіанти терапії були запропоновані в спробах запобігти утворенню пептиду Аβ, наприклад, інгібітори для запобігання протеолітичного розщеплення APP. Також залучали стратегії імунотерапії, такі як введення антитіла проти Аβ (щоб спричинити зменшення амілоїдних відкладень) або імунізацію антигенами пептидів Аβ (щоб стимулювати гуморальну відповідь) для того, щоб зменшити розмір і щільність бляшки. У патенті США № 7179463, виданому Lannfelt et al., описаний спосіб лікування хвороби Альцгеймера за допомогою введення антитіла, індукованого проти протофібрили, що містить мутацію Arctic у ділянці, яка кодує пептид Аβ. В описі не показано ніяких пояснень на прикладі індукованого антитіла і не представлено ніякого порівняння з афінністю для форм пептиду Аβ із низькою молекулярною масою. У патентах США №№ 6761888 і 6750324, виданих Schenk et al., описаний ряд антитіл, які розпізнають різні епітопи за амінокислотною послідовністю Аβ42. Для антитіл, специфічних для N-кінця і серединних ділянок Аβ42, показана ефективність відносно зменшення бляшки як ex vivo, так і in vivo. Незважаючи на загальноприйняті дані в галузі лікування і запобігання розвитку хвороби Альцгеймера, залишається необхідність у поліпшених композиціях і способах лікування і/або запобігання розвитку даного захворювання. Композиції і способи за даним винаходом спрямовані на задоволення даних потреб і відповідають їм, описуючи антитіла, специфічні для протофібрилярних форм пептиду Аβ, які у той же час виявляють мінімальну афінність, що піддається визначенню, проти низькомолекулярних форм пептиду Аβ. Фармацевтично ефективні композиції, що містять таке антитіло або антитіла, будуть застосовними для лікування і/або запобігання відкладенню бета-амілоїдної бляшки, яке, як відомо, асоційоване з виникненням і розвитком хвороби Альцгеймера. 1 UA 106870 C2 5 10 15 20 25 30 35 40 45 50 55 60 СУТЬ ВИНАХОДУ Даний винахід стосується виділеного антитіла, яке виявляє специфічне зв'язування з конформаційним епітопом протофібрилярної форми β-амілоїдного пептиду. Мономер βамілоїдного (Аβ) пептиду дикого типу відомий у даній галузі і представлений у цьому документі як SEQ ID № 1. Виділені антитіла за даним винаходом мають афінність до таких повторюваних конформаційних епітопів протофібрилярної форми пептиду Аβ великої молекулярної маси, у той час як виявляють мінімальну або не виявляють ніякої афінності до інших форм пептиду Аβ, таких як мономерна або димерна форми пептиду Аβ. Даний винахід також стосується виділеного антитіла, яке специфічно взаємодіє і виявляє афінність, що піддається вимірюванню, із конформаційним епітопом протофібрилярної форми пептиду Аβ, при цьому протофібрилярний епітоп представлений незахищеною ділянкою Аβпротофібрилярної форми, що містить амінокінцеву ділянку незахищеної ділянки пептиду Аβ. Даний винахід додатково стосується виділеного антитіла, яке специфічно взаємодіє і виявляє афінність з конформаційним епітопом протофібрилярної форми пептиду Аβ, що піддається вимірюванню, при цьому протофібрилярний епітоп представлений незахищеною ділянкою Аβ-протофібрилярної форми, що містить амінокислоти 1-20 (SEQ ID № 2) незахищеної ділянки пептиду Аβ. Даний винахід також стосується виділеного антитіла, яке специфічно взаємодіє і виявляє афінність із конформаційним епітопом протофібрилярної форми пептиду Аβ, що піддається вимірюванню, при цьому протофібрилярний епітоп представлений незахищеною ділянкою Аβпротофібрилярної форми, яка містить амінокислоти 4-12 і 9-20 (SEQ ID №№ 3 і 4, відповідно) незахищеної ділянки пептиду Аβ. Даний винахід частково стосується моноклональних антитіл 13C3, 1D1 і 19A6 і будь-якої афінно зрілої форми 13C3, 1D1 і 19A6. Даний винахід додатково стосується антитіла, яке імітує функціональну специфічність, як описано в цьому документі, для 13C3, 1D1 і 19A6. На додаток, даний винахід також стосується біологічно активних фрагментів і/або мутантів 13C3, 1D1, 19A6 або 13C3-, 1D1- або 19A6-подібного антитіла, що включає у ролі необов'язково необмежуючих прикладів амінокислотні заміни (наприклад, як спрямована форма дозрівання афінності ділянок VH або VL), делеції, вставки, амінокінцеві укорочування і карбоксикінцеві укорочування, такі, що дані мутації забезпечують основу для антитіла або зв'язувальної ділянки, яка зв'язує антитіло, що призводить до появи схожого або поліпшеного варіанту 13C3, 1D1, 19A6 або зв'язувального 13C3-подібне антитіло білка. В одному з варіантів здійснення дана ділянка за винаходом, ділянка VH і VL 13C3, містить амінокислотну послідовність, як зазначено в SEQ ID № 7 (V H) і/або SEQ ID NO: 5 (VL), відповідно. Даний винахід додатково стосується виділеної молекули нуклеїнової кислоти, що містить нуклеотидну послідовність, яка кодує ділянки VH і/або VL антитіла 13C3, 1D1 або 19A6; і, особливо, виділеної молекули нуклеїнової кислоти (полінуклеотиду), що кодує біологічно значущу ділянку 13C3, або афінно зрілий варіант, або іншим чином мутований варіант антитіла 13C3, 1D1 або 19A6. На завершення, один із варіантів здійснення даного винаходу стосується молекули нуклеїнової кислоти, яка містить нуклеотидну послідовність, що кодує ділянку V H і VL 13C, як зазначено в SEQ ID NO: 8 (13C3: ділянка VH) і SEQ ID NO: 6 (13C3: ділянка VL), відповідно. Даний винахід також стосується виділених антитіл 13C3, 1D1 або 19A6, як описано в цьому документі, антитіл, які специфічно взаємодіють і виявляють афінність до конформаційного епітопу протофібрилярної форми пептиду Аβ, що піддається вимірюванню. Даний винахід також стосується гібридоми, здатної продукувати моноклональне антитіло за даним винаходом. Певні гібридоми за даним винаходом включають у себе гібридоми, які продукують представлені як приклад моноклональні антитіла 13C3, 19A6 і 1D1, відповідно. Даний винахід стосується фармацевтично ефективних композицій, які містять виділене антитіло, як описано і додатково визначено в цьому документі: виділене антитіло яке специфічно взаємодіє і виявляє афінність, що піддається вимірюванню, і здатне специфічно зв'язуватися з повторюваним конформаційним епітопом протофібрилярної форми пептиду Аβ, у той же час виявляючи мінімальну афінність або афінність до низькомолекулярних форм Аβ, що не піддається вимірюванню. Такі композиції необов'язково можуть містити один або декілька носіїв, один або декілька ексципієнтів і/або один або декілька хімічних похідних. Даний винахід також стосується способів лікування пацієнтів, страждаючих на хворобу Альцгеймера, що включає введення пацієнту фармацевтично ефективної композиції, яка містить виділене антитіло, що описується в цьому документі, а саме, антитіло яке специфічно взаємодіє і виявляє афінність до повторюваного конформаційного епітопу протофібрилярної форми Аβ пептиду, що піддається вимірюванню, у той же час виявляючи мінімальну афінність 2 UA 106870 C2 5 10 15 20 25 30 35 40 45 50 55 60 або афінність стосовно низькомолекулярних форм Аβ, що не піддається вимірюванню. Дані способи передбачають терапевтичний вплив для того, щоб зменшити кількість амілоїдних відкладень у мозку пацієнта, що страждає на хворобу Альцгеймера. Певні варіанти здійснення даної частини за даним винаходом стосуються способів лікування пацієнта, що страждає на хворобу Альцгеймера, що включає введення фармацевтично ефективної композиції, приготованої з антитілом, що виявляє специфічну афінність (принаймні, у порівнянні з низькомолекулярними формами пептиду Аβ) до конформаційного епітопу протофібрилярної форми пептиду Аβ, особливо, коли протофібрилярний епітоп представлений незахищеною ділянкою Аβ-протофібрилярної форми, яка містить амінокислоти 1-20 (SEQ ID № 2) незахищеної ділянки пептиду Аβ. У певних варіантах здійснення, що стосуються таких терапевтичних і профілактичних способів, які описуються в цьому документі, можна використати представлені як приклади мишачі моноклональні антитіла 13C3, 19A6, 1D1, а також афінно зрілі варіанти будь-якого такого антитіла, химерне антитіло, гуманізоване антитіло, людське моноклональне антитіло і/або будь-яке інше таке антитіло з відомих у даній галузі, включаючи у ролі необмежуючих прикладів антитіло або специфічно зв'язувальні елементи, що розглядаються в цьому документі. Будь-яке таке антитіло або специфічно зв'язувальний елемент можна визначити в даному описі як "13C3-подібне антитіло". Таким чином, термін "13C3-подібне антитіло" призначений, щоб також охопити моноклональне антитіло 13C3, що описується в цьому документі. Даний винахід також стосується способів скринінгу і вибору сполук, які можуть діяти як інгібітор утворення фібрилярної і/або сенільної бляшки, асоційований із хворобою Альцгеймера. Така методологія включає використання антитіла з 13C3-подібними характеристиками (наприклад, специфічна афінність до PF у порівнянні з LMW формами пептиду Аβ) у різних аналізах взаємодії антитіло/пептид/тестована сполука, для того щоб вибрати сполуку, яка модулює процес утворення фібрил і/або бляшки. Даний винахід додатково стосується способів діагностичного аналізу для специфічного визначення рівня вмісту протофібрил у суб'єкта або пацієнта. Такі аналізи можна провести за допомогою будь-яких методик, відомих і доступних фахівцям у даній галузі, включаючи у ролі необмежуючих прикладів Вестерн-блотинги, ELISA, радіоімунологічні аналізи, імуногістохімічні аналізи, імунопреципітації або інші імунохімічні аналізи, відомі в даній галузі. Таким чином, один із варіантів здійснення даної частини винаходу стосується забору зразка тканини у суб'єкта або пацієнта і визначення рівню PF Аβ у зразку, застосовуючи діагностичний набір і відповідний аналіз; при цьому набір містить 13C3-подібне антитіло, дозволяючи таким чином провести специфічне визначення рівнів PF Аβ у зразку тканини. Зразок тканини для аналізу типово являє собою кров, плазму, сироватку, слиз або спинномозкову рідину суб'єкта або пацієнта. На завершення, антитіла за даним винаходом можна використати, принаймні, для наступних застосувань: (1) як профілактичний або терапевтичний засіб для запобігання розвитку або зниження відкладення бляшок, асоційованих із хворобою Альцгеймера, або окремо, або в поєднанні з будь-яким доступним комбінованим лікуванням; (2) для конструювання пептидних імуногенів, які можна використати для того, щоб спричинити утворення антитіл при профілактичних або терапевтичних стратегіях вакцинації, що стосуються лікування хвороби Альцгеймера; (3) для одержання профілактичного або терапевтичного антиідіотипічного антитіла (Ab2), що імітує прихований епітоп(и), з яким зв'язуються антитіла за даним винаходом і (4) для конструювання пептидів, що одержуються з визначальних комплементарність ділянок (CDR) нейтралізуючих антитіл за даним винаходом для застосування також при скринінгу інгібіторів утворення протофібрил для застосування при профілактичному і/або терапевтичному режимах і (5) як діагностичний реагент для того, щоб визначити рівень протофібрилярного Аβ у сироватці або CSF пацієнта з ризиком виникнення ХА. Метою за даним винаходом є одержання антитіл, які специфічно взаємодіють і виявляють афінність до незахищеного конформаційного епітопу протофібрилярної форми пептиду Аβ, який містить амінокислоти 1-20 (SEQ ID № 2) незахищеної ділянки пептиду Аβ. Додатковою метою за даним винаходом є одержання антитіл, які специфічно взаємодіють і виявляють афінність до незахищеного конформаційного епітопу протофібрилярної форми пептиду Аβ, який містить амінокислоти 4-12 і 9-20 (SEQ ID № 3, 4) незахищеної ділянки пептиду Аβ. Іншою метою за даним винаходом є одержання 13C3-подібних антитіл, які запобігають або зменшують Аβ утворення протофібрил, пов'язане з відкладенням бляшок, асоційованим із хворобою Альцгеймера. Іншою метою за даним винаходом є розробка аналізів, що використовують 13C3-подібні антитіла в аналізах взаємодії антитіло/пептид/тестована сполука для того, щоб вибрати сполуки, які будуть застосовними для лікування відкладення бляшок, асоційованих з хворобою Альцгеймера. Як застосовують у цьому документі "Ka" призначений 3 UA 106870 C2 5 10 15 20 25 30 35 40 45 50 55 60 для позначення константи асоціації взаємодії певного антитіла з антигеном, "Kd" призначений для позначення константи дисоціації взаємодії певне антитіло-антиген. Як застосовують у цьому документі, термін "епітоп" або "антигенна детермінанта" стосується ділянки антигену, на який відповідають В і/або Т-клітини, або ділянки молекули, проти якої буде вироблятися антитіло і/або з яким антитіло буде зв'язуватися. Наприклад, епітоп може розпізнаватися антитілом, що визначає епітоп. Епітоп може являти собою або "лінійний епітоп" (де первинна послідовність первинної амінокислоти містить епітоп; типово, принаймні, 3 суміжних амінокислотних залишки, і здебільшого, принаймні, 5 і аж до приблизно від 8 до приблизно 10 амінокислот в унікальній послідовності), або "конформаційний епітоп" (епітоп, де первинна суміжна послідовність амінокислот не є єдиним визначальним компонентом епітопу). Конформаційний епітоп може містити збільшену кількість амінокислот, порівняно з лінійним епітопом, оскільки даний конформаційний епітоп розпізнається трьохмірною структурою пептиду або білка. Наприклад, коли згортається молекула білка для утворення трьохмірної структури, визначені амінокислоти і/або основний ланцюг поліпептиду, що створюють конформаційний епітоп, розташовуються поруч, забезпечуючи розпізнавання епітопу антитілом. Способи визначення конформації епітопів включають як необмежуючі приклади, наприклад, рентгеноструктурний аналіз, двомірну ядерну магнітно-резонансну спектроскопію і спрямоване мічення і спектроскопію електронного парамагнітного резонансу. Дивись, наприклад, Epitope Mapping Protocols in Methods in Molecular Biology, Vol. 66, Glenn Е. Morris, Ed. (1996), опис якої в повному обсязі включений у цей документ як посилання. Як застосовують у цьому документі "специфічне зв'язування" між двома молекулами 6 -1 7 -1 8 -1 9 -1 10 -1 означає афінність, принаймні, 10 M , 10 M , 10 M , 10 M або 10 M . Як застосовують у цьому документі, "протофібрили" являють собою протофібрилярні агрегати, які включають у себе сферичні структури, що містять пептиди Аβ, які, мабуть, являють собою ряд сферичних структур, що створюють нелінійні структури. Термін "виділений", що застосовується у цьому документі, застосовують у цьому документі так, як застосовують його в даній галузі. А саме, стан, в якому виявляють антитіла/специфічно зв'язувальні елементи, молекули нуклеїнової кислоти і таке інше. Антитіла/специфічно зв'язувальні елементи і молекули нуклеїнової кислоти не містять або по суті не містять речовину, з якою вони зв'язані в природі, таку як інші поліпептиди або нуклеїнові кислоти, з якими вони зв'язані в природному навколишньому середовищі, або в навколишньому середовищі, в якому їх одержували (наприклад, культура клітин), коли таке одержання являє собою одержання технологією рекомбінантних ДНК (in vitro) або in vivo. Термін "виділений" охоплює будь-яку форму, що містить ідентифікований та охарактеризований компонент(и) за даним винаходом після видалення з такого первинного навколишнього середовища. Приклади, але без певних обмежень, включають у себе фармацевтичні препарати, препарати з розріджувачами, антитіла/специфічні елементи, що зв'язуються, молекули нуклеїнової кислоти та їхні частини, які були модифіковані (наприклад, глікозильовані антитіла) або in vitro, або in vivo і видалені з такого навколишнього середовища. Як застосовують у цьому документі, термін "рекомбінантне антитіло людини" являє собою життєздатну субпопуляцію "антитіла", одержану різними способами технології рекомбінантних ДНК і трансгеники, що не стосується людини, які добре відомі в даній галузі. Така методологія використовується для одержання антитіла з одного або із зазначених нижче джерел: (i) scFv або альтернативне антитіло, виділене з комбінаторної бібліотеки антитіл людини; (ii) часткове або ціле антитіло, одержане з відповідного експресуючого вектора, постійно або тимчасово трансфікованого в клітину-хазяїна, переважно у клітину-хазяїна ссавця (наприклад, субклонування нуклеотидних послідовностей, що кодують ланцюги V H і VL, в експресуючий вектор у поєднанні з відповідними нуклеотидними послідовностями CH і CL, із тим щоб посилити експресію попередньо визначеної форми антитіла, що виявляє специфічність до PF форми Аβ); і/або (iii) антитіло, виділене з трансгенної тварини, що не стосується людини, яка містить гени імуноглобулінів людини, або за допомогою будь-якої іншої методології, яка ґрунтується на рекомбінантному "змішуванні і поєднанні" послідовності гена імуноглобуліну людини з іншими послідовностями ДНК для того, щоб одержати рекомбінантне антитіло людини, що цікавить. Терміни "суб'єкт" або "пацієнт" призначені, щоб охопити будь-якого члена типу Phylum Chordata, включаючи без обмежень людей та інших приматів, включаючи тих приматів, що не є людиною, таких як шимпанзе, та інші види людиноподібних мавп і мавп; сільськогосподарських тварин, таких як велика рогата худоба, вівці, свині, кози і коні; домашніх тварин, таких як собаки і коти; лабораторних тварин, включаючи гризунів, таких як миші, щури і морські свинки; птахів, включаючи домашніх, диких і мисливських птахів, таких як кури, індички та інші курині птахи, 4 UA 106870 C2 5 10 15 20 25 30 35 40 45 50 55 60 качки, гуси і таке інше. Термін "лікування" захворювання стосується виконання протоколу, який може включати в себе введення одного або декількох лікарських засобів суб'єкту (людині або іншій істоті), із метою зменшення ознак або симптомів захворювання. Зменшення може мати місце до появи ознак або симптомів захворювання, а також після їх появи. Таким чином, "обробка" або "лікування" охоплює "запобігання розвитку" захворювання. У разі хвороби Альцгеймера, "запобігання розвитку" може також мати місце в ситуації, коли курс лікування призначають для того, щоб запобігти або зупинити виникнення симптомів, асоційованих із хворобою Альцгеймера. Крім того, "лікування" не вимагає повного зменшення ознак або симптомів, не вимагає лікування, і безумовно включає в себе протоколи, які мають тільки незначну позитивну дію на суб'єкт. Як застосовують у цьому документі, термін "активний інгредієнт" стосується 13C3-подібного антитіла, яке виявляє афінність і специфічність (наприклад, специфічне зв'язування) щодо амінокінцевої ділянки протофібрилярної структури бета-амілоїду. Як застосовують у цьому документі, терміни "ефективна кількість" або "фармацевтично ефективна кількість" антитіла, як описується в цьому документі, стосується нетоксичної, але достатньої кількості активного інгредієнта для того, щоб забезпечити необхідний біологічний результат. Придатну "ефективну" кількість у кожному окремому випадку може визначити фахівець у даній галузі, використовуючи звичайне експериментування. Як застосовують у цьому документі, терміни "фармацевтично прийнятний" або "фармакологічно прийнятний" означають речовину, яку можна вводити пацієнту способом доставки лікарського засобу нарівні з приготованими біологічними засобами, не викликаючи ніяких небажаних біологічних ефектів або не взаємодіючи шкідливим чином з якими-небудь компонентами композиції, в якій вони містяться (наприклад, "фармацевтично прийнятна композиція"). Як застосовують у цьому документі, фрази "фізіологічно прийнятний носій" і "фармацевтично прийнятний носій", які можуть використовуватися взаємозамінно, означають носій, розріджувач і ексципієнт, які не викликають значних подразнень в організмі та не анулюють біологічну активність і властивості сполуки, що вводиться. Дані фрази охоплюють ад'ювант. Як застосовують у цьому документі, термін "ексципієнт" стосується інертної речовини, що додається у фармацевтичну композицію, щоб додатково полегшити введення активного інгредієнта. Термін "мінімальна афінність", що використовується для порівняння афінності антитіла для протофібрилярної форми пептиду Аβ з афінністю антитіл для інших форм пептиду Аβ, таких як фібрили, складчасті структури і низькомолекулярні олігомери і мономери, вказує на те, що відношення афінності для протофібрилярної форми Аβ до афінності для інших форм Аβ більше ніж приблизно 2. Переважно, відношення більше ніж приблизно 3 або приблизно 4, або приблизно 5. КОРОТКИЙ ОПИС МАЛЮНКІВ На фігурі 1 показаний процес фібрилогенезу Аβ, що включає утворення протофібрилярних олігомерів. На фігурі 2A-B показаний процес фібрилогенезу Аβ та очищення форм Аβ у часові точки 0 (А) і 4 години (В), на що вказує коефіцієнт поглинання при mAU 215 (поглинання @ 215 нм) елююючих об'ємів. У 4 години (В) низькомолекулярна (LMW) форма елюює у вигляді димеру 15 кДа, у той час як величина для протофібрилярної форми елюює при 670 кДа. На фігурі 3A-B показана специфічність моноклональних антитіл 13C3 (А) і 4G8 (В) для протофібрилярної (PF:-*-) і низькомолекулярної (LMW: — —) форм Аβ, на що вказує оптична густина (OD), зчитуваної при 450/650 нм для концентрацій обох форм Аβ PF і LMW, що збільшуються. На фігурі 4A-C показані дані з аналізу зв'язування на системі Biacore®, що демонструють афінність моноклональних антитіл 4G8 (А), 13C3 (В) і контрольного IgG1 (С) для різних концентрацій низькомолекулярної (LMW) форми Аβ від 0,25 мкг/мл LMW Аβ до 4,0 мкг/мл LMW Аβ. На фігурі 5A-B показані дані, що засвідчують розпізнавання епітопів антитілами проти Аβ, описаними вище. На фігурі 5A показаний аналіз вестерн-дот-блот із моноклональними антитілами 13C3 (верхня панель), 1D1 (середня панель) і 4G8 (нижня панель) проти серії пептидів із 13 амінокислот, що перекриваються, як описано в прикладі 5. На фігурі 5B показана амінокислотна послідовність Аβ1-42 (SEQ ID № 1), а також передбачені епітопи для моноклональних антитіл 13C3 і 1D1. 5 UA 106870 C2 5 10 15 20 25 30 35 40 45 50 55 60 На фігурі 6 показана реакційна здатність моноклональних антитіл 13C3 (- -) і 4G8 (-♦-) із фракцією SEC із надосадовою рідиною 7PA2, що секретує олігомери Аβ. Протофібрилярна (PF) і низькомолекулярна (LMW) фракції зазначені по осі х у вигляді виміряної оптичної густини (OD), зчитуваної при 450/650. На фігурах 7A-C показані електронні мікрофотографії при імуноелектронній мікроскопії тонких зрізів, що демонструють афінність моноклонального антитіла 13C3 до повторюваних структур на фібрилах Аβ (В, С). Контрольною імуно-EM є IgG1 (А). На фігурі 8A-B показані дані електронної мікроскопії, що демонструють зниження кількості бляшок у показовій трансгенній миші TgCRND8 після введення контрольного антитіла IgG1 (А) при порівнянні з введенням моноклональних антитіл 13C3 (В). На фігурі 9A-B показано, що введення трансгенним мишам TgCRND8 моноклональних антитіл 13C3 при режимі один раз на тиждень (А) або два рази на тиждень (В) призводить до зменшення утворення сенільних бляшок. На фігурі 10 показані нуклеотидна та амінокислотна послідовності варіабельних ділянок клонованих легкого і важкого ланцюгів для mAb 13C3. На фігурі 11 показано, що короткочасне периферичне введення 13С3 трансгенним мишам APP не призводить до збільшення в плазмі Аβ, на відміну від введення антитіла порівняння 3D6. На фігурі 12 показано, що 13C3 розпізнає амілоїдні старечі бляшки (агреговані) у головному мозку при ХА, а не розсіяні відкладення Аβ на відміну від антитіла порівняння проти Аβ 3D6. ДЕТАЛЬНИЙ ОПИС ВИНАХОДУ Білок-попередник амілоїду (APP) відіграє важливу роль у патогенезі хвороби Альцгеймера (ХА). Протеолітичне розщеплення APP за допомогою β- і γ-секретаз призводить до появи пептидів Аβ (Аβ), які в нормі по довжині знаходяться в діапазоні від 39 до 43 амінокислот довжиною. Виникнення хвороби Альцгеймера характеризується накопиченням олігомерних або агрегованих форм Аβ у головному мозку. Імунологічні композиції за даним винаходом є застосовними для лікування або запобігання розвитку хвороби Альцгеймера, для застосування як реагентів у діагностичних аналізах, а також для конструювання низькомолекулярних інгібіторів амілоїдного відкладення. 13C3-подібні антитіла за даним винаходом можна вводити профілактично загальній популяції ссавців, зокрема, людині, у фармацевтично прийнятному препараті, що розглядається в кількості і/або режимі дозування, достатній для пом'якшення, зменшення або сповільнення виникнення захворювання. Способи профілактичного лікування особливо запитані пацієнтами, які, як відомо, знаходяться в групі генетичного або сімейного ризику виникнення хвороби Альцгеймера. Була визначена безліч генетичних маркерів ризику виникнення хвороби Альцгеймера, включаючи як не обмежуючі приклади мутації APP (наприклад, індійська мутація (Val717Phe), шведські мутації (Lys670Asn, Met671Leu), мутація Хендрікса (Ala692Gly), голландська мутація (Glu693Gln), іранська мутація (Thr714Ala), німецька мутація (Val715Ala) і флоридська мутація (Ile716Val), перераховуючи декілька з них. Додаткові мутації, які можуть зазначати на підвищений ризик виникнення хвороби Альцгеймера, включають у себе мутації в генах пресеніліну (PS1 і PS2) і ApoE4. Даний винахід також стосується терапевтичного впливу за допомогою фармацевтично прийнятних композицій, що містять 13C3-подібне антитіло, для пацієнтів, страждаючих у цей момент на хворобу Альцгеймера, яких можна розпізнати за характерним недоумством, особливо, за наявності чинників ризику, описаних вище, або вже страждаючих від даного захворювання у ступені, достатньому для того, щоб вилікувати, або, принаймні, частково подавити симптоми та ускладнення хвороби Альцгеймера. Способи лікування на основі профілактичного або терапевтичного впливу, що розглядаються в цьому документі, можна використати для вирішення питань, пов'язаних із раннім або пізнім виникненням хвороби Альцгеймера. Із точки зору важливості олігомерних форм Аβ при виникненні хвороби Альцгеймера, даний винахід стосується виділеного антитіла, яке специфічно взаємодіє і виявляє афінність із повторюваним конформаційним епітопом протофібрилярної форми пептиду Аβ, яка піддається вимірюванню. Мономер пептиду Аβ дикого типу (Аβ42; 42-амінокислотна форма) відомий у даній галузі і показаний у цьому документі у вигляді SEQ ID № 1: Asp Ala Glu Phe Arg His Asp Ser Gly Tyr Glu Val His His Gln Lys Leu Val Phe Phe Ala Glu Asp Val Gly Ser Asn Lys Gly Ala Ile lie Gly Leu Met Val Gly Gly Val VaI Ile Ala (SEQ ID № 1). Виділені антитіла за даним винаходом будуть виявляти афінність стосовно повторюваного конформаційного епітопу олігомерної протофібрилярної форми пептиду Аβ із більшою молекулярною масою, у той же час, виявляючи мінімальну афінність щодо інших форм пептиду Аβ, таких як низькомолекулярні мономери і димери. Даний винахід також стосується виділеного антитіла, яке взаємодіє і виявляє афінність із 6 UA 106870 C2 5 10 15 20 25 30 35 40 45 50 55 60 конформаційним епітопом протофібрилярної форми пептиду Аβ, що піддається вимірюванню, при цьому протофібрилярний епітоп представлений незахищеною ділянкою Аβпротофібрилярної форми, який містить амінокінцеву ділянку незахищеної ділянки пептиду Аβ. Даний винахід додатково стосується виділеного антитіла, яке специфічно взаємодіє і виявляє афінність із конформаційним епітопом протофібрилярної форми пептиду Аβ, що піддається вимірюванню, при цьому протофібрилярний епітоп представлений незахищеною ділянкою Аβ-протофібрилярної форми, який містить амінокислоти 1-20 (SEQ ID № 2) незахищеної ділянки пептиду Аβ, як показано нижче: Asp Ala Glu Phe Arg His Asp Ser Gly Tyr Glu Val His His Gln Lys Leu Val Phe Phe (SEQ ID №: 2). Як наведено в цьому документі як приклади, ідентифіковані мишачі моноклональні антитіла, які специфічно виявляють специфічну афінність щодо протофібрилярної (PF) форми пептиду Аβ, у той же час, виявляючи мінімальну афінність щодо низькомолекулярних форм пептиду Аβ. Димерна форма Аβ (15 кДа) згодом полімеризується з утворенням розчинної PF форми Аβ, із молекулярною масою приблизно 670 кДа. Мишей імунізували таким високомолекулярним PF Аβ. Моноклональні антитіла відбирали під час скринінгу за специфічністю до високомолекулярної PF форми пептиду Аβ, у той же час, які виявляють мінімальну здатність або не виявляють здатності зв'язуватися з низькомолекулярними формами Аβ. Дана частина за даним винаходом пояснена на прикладі скринінгу, виділення і характеристик ряду моноклональних антитіл 13C3, індукованих проти високомолекулярної протофібрилярної форми 670 кДа пептиду Аβ (тобто, 13C3, 1D1 і 19A6). Даний ряд моноклональних антитіл виявляє визначену специфічність in vitro, у той же час також зменшуючи асоційоване з хворобою Альцгеймера утворення бляшок у моделі хвороби Альцгеймера на трансгенній миші. Таким чином, у конкретному варіанті здійснення винаходу, виділене антитіло специфічно взаємодіє і виявляє афінність щодо конформаційного епітопу протофібрилярної форми пептиду Аβ, що піддається вимірюванню, при цьому протофібрилярний епітоп представлений незахищеною ділянкою Аβ-протофібрилярної форми, який містить амінокислоти 4-12 (SEQ ID № 3) і 9-20 (SEQ ID №4) і незахищеної ділянки пептиду Аβ: Phe Arg His Asp Ser Gly Tyr Glu Val (SEQ ID № 3); Gly Tyr Glu Val His His Gln Lys Leu Val Phe Phe (SEX ID № 4). Один із варіантів здійснення даного винаходу стосується антитіла, яке містить ділянку V H (SEQ ID № 7) і/або VL (SEQ ID № 5), як описано для 13C3, так, щоб додати їй 13C3-подібну специфічність стосовно PF проти LMW форми пептиду Аβ. Додатковий варіант здійснення являє собою 13C3-подібне антитіло або його біологічно значущий фрагмент, який виявляє специфічність щодо PF форми вище ніж для LMW форми пептиду Аβ. Таким чином, даний винахід також стосується біологічно активних фрагментів і/або мутантів 13C3, 1D1, 19A6 або 13C3-подібного антитіла, що включають, але необов'язково обмежуються, амінокислотними замінами (наприклад, як спрямована форма дозрівання афінності ділянок VH або VL), делеції, вставки, амінокінцеві укорочування і карбоксикінцеві укорочування, такі, що дані мутації забезпечують основу для антитіла або зв'язувальної антитіло ділянки, що призводить до появи схожого або поліпшеного варіанту 13C3, 1D1, 19A6 або зв'язувального 13C3-подібне антитіло білка. Як відмічено в цьому документі, один із варіантів здійснення даної частини за винаходом стосується ділянки VH і/або VL такого антитіла, що містить амінокислотну послідовність, як зазначено в SEQ ID № 7 і/або SEQ ID № 5, відповідно. У даному винаході згадана наявність надмірності кодону, яка може призводити до появи розрізних молекул ДНК, експресуючих ідентичне антитіло або його частину (наприклад, альтернативні молекули нуклеїнової кислоти, що кодують ідентичні ділянки scFv або VH, і/або VL IgG). У контексті даного опису послідовність, що несе один або декілька заміщених кодонів, буде визначатися як вироджена мінливість. Інше джерело мінливості послідовності може мати місце при редагуванні РНК. Таке редагування РНК може призводити до появи іншої форми надмірності кодону, де зміна у відкритій рамці зчитування не призводить до заміни амінокислотного залишку в експресованому білці. Мутації або в послідовності ДНК, або в антитілі, що транслюється, які поліпшують основні фізичні властивості експресованого антитіла, також включені в обсяг даного винаходу. На завершення, даний винахід стосується (i) афінно зрілих варіантів 13C3, 1D1, 19A6 або будь-якого іншого такого 13C3-подібного антитіла, і/або (ii) мутованих форм 13C3, 1D1, 19A6 або будь-якого іншого такого 13C3-подібного антитіла, включаючи як необмежуючі приклади одну або декілька мутацій у ділянках CDR1, CDR2 і/або CDR3, як одержують за допомогою відомих методологій дозрівання афінності і способів рекомбінантної ДНК, відомих для введення сайт-специфічних мутацій. Таким чином, виділені антитіла за даним винаходом являють собою антитіла, які специфічно взаємодіють із конформаційним епітопом протофібрилярної форми пептиду Аβ. Виділені антитіла за даним винаходом будуть виявляти афінність стосовно такого конформаційного епітопу відносно протофібрилярної форми пептиду Аβ із великою 7 UA 106870 C2 5 10 15 20 25 30 35 40 45 50 55 60 молекулярною масою, у той же час, виявляючи мінімальну афінність стосовно інших форм пептиду Аβ, таких як фібрили, складчасті структури і низькомолекулярні олігомери і мономери. Даний винахід також стосується виділеного моноклонального антитіла 13C3. Дана частина винаходу також стосується гібридоми, яка продукує моноклональне антитіло 13C3. Гібридома, яка продукує моноклональне антитіло 13C3, доступна в ATCC під номером доступу PTA-8830. Даний винахід також стосується виділеного моноклонального антитіла 1D1. Дана частина винаходу також стосується гібридоми, яка продукує моноклональне антитіло 1D1. Даний винахід також стосується виділеного моноклонального антитіла 19A6. Дана частина винаходу також стосується гібридоми, яка продукує моноклональне антитіло 19A6. Даний винахід також стосується способів скринінгу і вибору сполук, які можуть діяти як інгібітори утворення фібрилярної і/або сенільної бляшки, асоційованої з хворобою Альцгеймера. Така методологія включає використання антитіла з 13C3-подібною афінністю до PF форми пептиду Аβ у різних аналізах взаємодії антитіло/пептид/тестуюча сполука, для того щоб вибрати сполуку, яка модулює процес утворення фібрил і/або бляшки. Дана сполука може являти собою небілкову органічну або неорганічну молекулу, пептид (наприклад, як потенційна профілактична або терапевтична пептидна вакцина), білок, ДНК (одно- або двониткову) або РНК (таку як siРНК або shRNA). Стане очевидним при розгляді представлення та ідеї даного опису, що будь-який такий пептид або низькомолекулярна сполука, яка ефективно конкурує з 13C3-подібним антитілом за зв'язування з PF формою пептиду Аβ, являє собою можливу сполуку-прототип, що стосується профілактичного або терапевтичного лікування хвороби Альцгеймера. На завершення, аналізи взаємодії можна застосовувати з метою високопродуктивного скринінгу, щоб ідентифікувати сполуки, які займають епітопи або які взаємодіють з епітопами 13C3 PF форми пептиду Аβ і витісняють антитіло. Можна використати різні відомі в даній галузі аналізи, основані на взаємодії антитіло/антиген, які включають у себе та основані на 13C3-подібному антитілі за даним винаходом у ролі основного реагенту під час скринінгу сполук, застосовних для профілактичного або терапевтичного лікування хвороби Альцгеймера (наприклад, невелика неорганічна молекула або кандидат для пептидної вакцини), включаючи у ролі необмежуючих прикладів аналіз ELISA, радіоімунологічний аналіз, аналіз вестерн-блотингу, будь-який гомогенний аналіз, оснований на біологічній взаємодії, що піддається визначенню, що не вимагає стадій розділення або відмивання (наприклад, дивись AlphaScreen від PerkinElmer) і/або основаної на SPR технології (наприклад, дивись BIACore)). Сполуку і/або кандидати для пептидних вакцин, ідентифіковані за допомогою застосування 13C3-подібного антитіла, можна визначити за допомогою різних аналізів. Аналіз може являти собою простий аналіз "так/ні" для визначення чи мають місце зміни здатність утворення відомого комплексу антитіло/антиген або може за своєю природою здійснювати кількісну характеристику, застосовуючи аналіз, такий як аналіз, оснований на ELISA, гомогенний аналіз або оснований на SPR аналіз. На завершення, даний винахід стосується будь-якого такого аналізу, не відносячи до відомої методології, що застосовується, який вимірює здатність тестованої сполуки конкурувати з 13C3-подібним антитілом, відповідним пептидним або білковим міметиком амінокінцевої ділянки епітопу 13C3 PF форми пептиду Аβ. Антитіла, що описуються в цьому документі, можна використати як основні реагенти у великій кількості різних імунологічних аналізів для визначення наявності протофібрилярної форми Аβ у зразку тканини. У загальному випадку, антитіла можна застосовувати в будь-якому типі імунологічного аналізу, як якісному, так і кількісному. Вони включають у себе як двошаровий сендвіч-аналіз, так і одношаровий імунологічний аналіз, а також традиційні аналізи конкурентного зв'язування. Один із варіантів здійснення, що цікавить внаслідок легкого визначення і його кількісної природи являє собою сендвіч-аналіз або аналіз із подвійними антитілами, для яких існує безліч варіантів, всі з яких охоплюються даною частиною даного винаходу. Наприклад, у типовому прямому сендвіч-аналізі, немічене антитіло іммобілізують на твердій основі, наприклад, ямці планшета для мікротитрування, і зразок, який необхідно тестувати, додають до зв'язаної молекули. Через придатний період інкубації протягом періоду часу, достатнього для утворення бінарного комплексу антитіло-антиген, друге антитіло, мічене репортерною молекулою, здатною призводити до появи сигналу, що піддається визначенню, потім додають і продовжують інкубувати, щоб надати достатній час для зв'язування з антигеном у різних ділянках і для утворення потрійного комплексу антитіло-антиген-мічене антитіло. Будьяку речовину, що не брала участь у реакції змивають і наявність антигену визначають, спостерігаючи сигнал, який можна визначити кількісно при порівнянні з контрольним зразком, що містить відому кількість антигену. Зміни прямого сендвіч-аналізу включають у себе одночасний аналіз, в якому і зразок, і антитіло додають одночасно до зв'язувального антитіла, 8 UA 106870 C2 5 10 15 20 25 30 35 40 45 50 55 60 або зворотний сендвіч-аналіз, в якому спочатку об'єднують мічене антитіло і зразок, що досліджується, інкубують і додають немічене поверхневе зв'язувальне антитіло. Дана техніка добре відома фахівцям у даній галузі, і можливість невеликих змін буде явно очевидна. Як застосовують у цьому документі, "сендвіч-аналіз" призначений, щоб охопити всі зміни на основі двошарової методики. Для сендвіч-аналізу за даним винаходом єдиним обмежуючим фактором є те, що обидва антитіла мають різну специфічність зв'язування для протофібрилярної форми Аβ. Таким чином, можлива велика кількість можливих комбінацій. У ролі конкретнішого прикладу, у типовому прямому сендвіч-аналізі первинне антитіло або ковалентно, або пасивно прив'язане до основи. Тверда поверхня звичайно являє собою скло або полімер, причому найбільш загальновживаними полімерами є целюлоза, поліакриламід, нейлон, полістирол, полівінілхлорид або поліпропілен. Тверда основа може знаходитися у вигляді пробірки, кульок, дисків або мікропланшетів, або може являти собою будь-які інші поверхні, придатні для проведення імунологічний аналізу. Процеси зв'язування добре відомі в даній галузі. Після зв'язування комплекс тверда фаза-антитіло промивають у препараті для досліджуваного зразка. Аліквоту рідини організму, що містить досліджувану протофібрілярну форму Аβ, потім додають до комплексу на твердій фазі і інкубують при 25 °C протягом періоду часу, достатнього для зв'язування будь-якої присутньої протофібрилярної форми білка Аβ з антитілом, специфічним для протофібрилярної форми Аβ. Друге антитіло потім додають до комплексу на твердій фазі та інкубують при 25 °C протягом додаткового періоду часу, достатнього для того, щоб друге антитіло зв'язалося з первинним комплексом антитіло-антиген на твердій фазі. Друге антитіло об'єднують із репортерною молекулою, видимий сигнал від якої використовують для реєстрації зв'язування другого антитіла з будь-яким антигеном у зразку. Під терміном "репортерна молекула", що використовується в даному описі, позначають молекулу, яка за своєю хімічною природою забезпечує появу сигналу, що аналітично піддається визначенню, який дозволяє визначити антигензв'язувальне антитіло. Визначення повинне бути, принаймні, таким, що відносно піддається кількісному визначенню, щоб дозволити провести певні кількості антигену в зразку, його можна розрахувати в абсолютних величинах або можна провести в порівнянні зі стандартом (або рядом стандартів), що містить відомий нормальний рівень антигену. Найбільш загальновживаними репортерними молекулами в такому типі аналізу є або ферменти, або флуорофори. У разі ферментативного імунологічного аналізу фермент кон'югують із другим антитілом, часто за допомогою глутаральдегіду або періодату. Як буде з готовністю визнано, проте, існує велика різноманітність різної техніки кон'югування, яка добре відома фахівцям у даній галузі. Загальновживані ферменти включають у себе серед інших пероксидазу хріну, глюкозоксидазу, бета-галактозидазу і лужну фосфатазу. Субстрати, які будуть використовувати зі специфічними ферментами, як правило, вибирають для одержання при гідролізі відповідного ферменту, що піддається визначенню зміни кольору. Наприклад, рнітрофенілфосфат придатний для використання з кон'югатами лужної фосфатази; для кон'югатів пероксидази загальновживаними є 1,2-фенілендіамін або толуїдин. Також можливе застосування флуорогенних субстратів, які призводять до одержання флуоресцентного продукту, а не хромогенні субстрати, згадані вище. У всіх випадках фермент-мічене антитіло додають до комплексу перше антитіло-Аβ протофібрилярний білок і дозволяють здійснитися зв'язуванню з комплексом і потім надлишок реагенту змивають. Потім до потрійного комплексу антитіло-антиген-мічене антитіло додають розчин, що містить відповідний субстрат. Субстрат вступає в реакцію з ферментом, зв'язаним з другим антитілом, даючи кількісний видимий сигнал, який можна далі визначити кількісно, звичайно, спектрофотометрично, щоб оцінити кількість антигену, яка присутня в зразку сироватки. Додатково, флуоресцентні сполуки, такі як флоресцеїн або родамін, можна хімічно зв'язувати з антитілами, не змінюючи їхню зв'язувальну здатність. При активації за допомогою опромінення світлом певної довжини хвилі мічене флуорохромом антитіло поглинає енергію світла, індукуючи збуджений стан у молекулі, після чого йде випромінювання світла при характерній довжині хвилі. Випромінювання виявляється у вигляді характерного кольору, що візуально визначається світловим мікроскопом. Як при імуноферментному аналізі (EIA), флуоресцентноміченому антитілу дозволяють зв'язатися з комплексом перше антитіло-білок протофібрилярної форми Аβ. Після відмивання реагенту, що не зв'язався одержаний потрійний комплекс потім піддають впливу світлом придатної довжини хвилі, і флуоресценція, що спостерігається вказує на наявність антигену. Обидві методики імунофлюоресценції і EIA дуже добре описані в даній галузі і є особливо переважними для даного способу. Проте, інші репортерні молекули, такі як радіоактивні ізотопи, хемілюмінесцентні або біолюмінесцентні молекули також можна застосовувати. Фахівцям у даній галузі буде явно очевидно, як змінити 9 UA 106870 C2 5 10 15 20 25 30 35 40 45 50 55 60 спосіб, щоб він підходив для необхідного використання. В іншому варіанті здійснення досліджуваний зразок (наприклад, кров або спинномозкову рідину людини, що містить протофібрилярну форму Аβ) можна використати в одношаровому імунологічному аналізі, де його приєднують до твердої основи або ковалентно, або нековалентно. Немічене антитіло проти протофібрилярного Аβ білка додають до зразка, зв'язаного з твердою основою. Після придатного періоду інкубації протягом періоду часу, достатнього для утворення бінарного комплексу антитіло-антиген, потім додають друге антитіло, мічене репортерною молекулою, здатною індукувати видимий сигнал, і продовжують інкубацію, надаючи достатній час для утворення потрійного комплексу антитіло-антиген-мічене антитіло. Для одношарового імунологічного аналізу друге антитіло може являти собою універсальне антитіло (тобто, ксеногенне антитіло до імуноглобуліну, особливо, проти (IgM і IgG), зв'язаними з репортерною молекулою), яке здатне зв'язуватися з антитілом, яке є специфічним для протофібрилярної форми білка Аβ, що цікавить. 13C3-подібне антитіло може прийняти одну з численних форм, відомих у даній галузі. Антитіла можуть приймати форму будь-якого типу відповідного фрагмента антитіла, зв'язувальної антитіло ділянки, специфічно зв'язувального елемента, небілкового синтетичного імітатора або будь-якої іншої придатної термінології, відомої в даній галузі, яка означає молекулу, принаймні, по суті зберігаючу специфічність зв'язування/нейтралізуючу активність. Таким чином, термін "антитіло", що використовується в контексті даного опису, призначений охопити у ролі необмежуючих прикладів будь-який специфічний зв'язувальний елемент, клас і/або ізотип імуноглобуліну (наприклад, IgG1, IgG2, IgG3, IgG4, IgM, IgA, IgD, IgE і IgM); і його біологічно значущий фрагмент або специфічний зв'язувальний елемент, включаючи у ролі необмежуючих прикладів Fab, F(ab)2, Fv, і scFv (один ланцюг або залежний елемент). Отже, це є добре відомим у даній галузі, і включеним сюди тільки як огляд, що "антитіло" стосується глікопротеїну, що включає, принаймні, два важких (Н) ланцюги і два легких (L) ланцюги, зв'язані дисульфідними зв'язками, або його антигензв'язувальної ділянки. Важкий ланцюг складається з варіабельної ділянки важкого ланцюга (VH) і константної ділянки важкого ланцюга (CH1, CH2 і CH3). Легкий ланцюг складається з варіабельної ділянки легкого ланцюга (V L) і константної ділянки легкого ланцюга (CL). Варіабельні ділянки як важкого, так і легкого ланцюгів містять каркасні ділянки (FWR) і визначальні комплементарність ділянки (CDR). Чотири ділянки FWR відносно консервативні, тоді як ділянки CDR (CDR1, CDR2 і CDR3) являють собою гіперваріабельні ділянки і розташовуються від NH2-кінця до СООН-кінця, як зазначено нижче: FWR1, CDR1, FWR2, CDR2, FWR3, CDR3, FWR4. Варіабельні ділянки важкого і легкого ланцюгів містять зв'язувальний домен, який взаємодіє з антигеном, тоді як константна ділянка(и) залежно від ізотипу, можуть опосередковувати зв'язування імуноглобуліну з тканиною або факторами організму-хазяїна. При цьому робоче визначення "антитіло" також включає в себе химерні антитіла, гуманізовані антитіла, рекомбінантне антитіло, як антитіла людини, одержані з трансгенної тварини, що не стосується людини, а також антитіла, вибрані з бібліотек із використанням технологій удосконалень, доступних фахівцям. Фрагменти антитіл одержують, використовуючи техніки, добре відомі та доступні фахівцям у даній галузі, як розглядається нижче. Отже, "антитіло" являє собою будь-яку таку молекулу або специфічно зв'язувальний елемент, який специфічно зв'язується з конформаційним епітопом протофібрилярної форми Аβ, як описано в цьому документі. Отже, термін "антитіло" визначає імуноглобулін, або природний, або частково або повністю синтетично одержаний; будь-який поліпептид або білок, що містить зв'язувальний домен, який являє собою або, по суті, гомологічний зв'язувальному домену антитіла. Їх можна одержати з природних джерел або вони можуть являти собою частково або повністю синтетично одержані молекули. Прикладами антитіл є ізотипи імуноглобулінів та їхні ізотипічні підкласи; фрагменти, які містять антигензв'язувальний домен, такий як Fab, scFv, Fv, dAb, Fd і діатіла, як обговорюється без обмеження нижче. У даній галузі відомо, що можливо проводити маніпуляції з моноклональними та іншими антитілами і використати методики технології рекомбінантних ДНК для того, щоб одержати інші антитіла або химерні молекули, які зберігають специфічність початкового антитіла. Такі методики можуть змінювати вбудовування ДНК, що кодує варіабельну ділянку імуноглобуліну або визначальні комплементарність ділянки (CDR) антитіла, у константні ділянки або константні ділянки разом із каркасними ділянками іншого імуноглобуліну. Гібридому або іншу клітину, що продукує антитіло, можна піддавати генетичній мутації або іншим змінам, які можуть змінювати або не змінювати специфічність зв'язування продукованого антитіла. Антитіла можна модифікувати великою кількістю способів, і термін "антитіло" потрібно тлумачити як такий, що охоплює будь-який елемент, що специфічно зв'язується, або речовину, що містить зв'язувальний домен із необхідною специфічністю. Таким 10 UA 106870 C2 5 10 15 20 25 30 35 40 45 50 55 60 чином, даний термін охоплює фрагменти антитіл, похідні, функціональні еквіваленти і гомологи "антитіла", включаючи будь-який поліпептид, що містить зв'язувальний домен імуноглобуліну, або природний, або повністю або частково синтетичний. Такі молекули можуть являти собою зв'язувальний фрагмент, що охоплюється терміном "антигензв'язувальна ділянка" або "специфічно зв'язувальний елемент" антитіла, включаючи у ролі необмежуючих прикладів (i) Fab-фрагмент, моновалентний фрагмент, що складається з доменів VL, VH, CL і CH; (ii) F(ab)2фрагмент, двовалентний фрагмент, що містить два Fab-фрагменти, зв'язаних дисульфідним містком у шарнірній ділянці; (iii) Fd-фрагмент, що складається з доменів VH і CH; (iv) Fvфрагмент, що складається з доменів VL і VH одного плеча антитіла; (v) dAb-фрагмент, який містить домен VH; (vi) виділену визначальну комплементарність ділянки (CDR); (vii) scAb, фрагмент антитіла, що містить VH і VL, а також або CL, або CH; і (viii) штучні антитіла залежно від каркасної структури білка, включаючи у ролі необмежуючих прикладів антитіла поліпептиду фібронектин III типу (наприклад, дивись патент США № 6703199, виданий Koide 9 березня 2004 року і міжнародну заявку PCT Publication № WO 02/32925). Більше того хоча два домени Fvфрагмента, VL і VH, кодуються окремими генами, їх можна об'єднати, використовуючи рекомбінантні способи, за допомогою синтетичного лінкеру, який сприяє їхньому об'єднанню в один білковий ланцюг, в якому ділянки VL і VH сполучаються з утворенням моновалентних молекул (відомих як одноланцюговий Fv (scFv)). В одному з варіантів здійснення варіабельна ділянка легкого ланцюга (VL) для виділених 13C3 або 13C3-подібних антитіл за даним винаходом може містити 113 амінокислот у послідовності пептиду (SEQ ID № 5), який кодується 339 парами нуклеотидів нуклеотидної послідовності (SEQ ID № 6): Asp Val VaI Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly Asp Gln Ala Ser Ile Ser Cys Arg Ser Gly Gln Ser Leu Val His Ser Asn Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile Tyr Thr Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Ser Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Phe Cys Ser Gln Asn Thr Phe Val Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg (SEQ ID № 5) GATGTTGTGATGACCCAAACTCCACTCTCCCTGCCTGTCAGTCTTGGAGATCAAGCCTCCAT CTCTTGCAGATCTGGTCAGAGCCTTGTACACAGTAATGGAAACACCTATTTACATTGG TACCTGCAGAAGCCAGGCCAGTCTCCAAAGCTCCTGATCTATACAGTTTCCAACCGATTT TCTGGGGTCCCGGACAGGTTCAGTGGCAGTGGATCAGGGTCAGATTTCACACTCAAGATC AGCAGAGTGGAGGCTGAGGATCTGGGAGTTTATTTCTGCTCTCAAAATACATTTGTTCCT TGGACGTTCGGTGGAGGCACCAAGCTGGAAATCAAACGG (SEQ ID № 6) У додатковому варіанті здійснення варіабельна ділянка важкого ланцюга (VH) для виділених 13C3 або 13C3-подібних антитіл за даним винаходом може містити 115 амінокислот у послідовності пептиду (SEQ ID № 7), що кодується 345 парами нуклеотидів нуклеотидної послідовності (SEQ ID № 8): Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Arg Pro Gly Val Ser Val Lys Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Asp Tyr Ala Met His Trp Val Lys Gln Ser His Ala Lys Ser Leu Glu Trp Ile Gly Val Ile Ser Thr Lys Tyr Gly Lys Thr Asn Tyr Asn Gln Lys Phe Lys Gly Lys Ala Thr Met Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr Met Glu Leu Ala Arg Leu Thr Ser Glu Asp Ser Ala Ile Tyr Tyr Cys Ala Arg Gly Asp Asp Gly Tyr Ser Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser (SEQ ID № 7); CAGGTCCAGCTGCAGCAGTCTGGGCCTGAGCTGGTGAGGCCTGGGGTCTCAGTGAAGATTT CCTGCAAGGGTTCCGGCTACACATTCACTGATTATGCTATGCACTGGGTGAAGCAGAGT CATGCAAAGAGTCTAGAGTGGATTGGAGTTATTAGTACTAAGTATGGTAAGACAAACTAC AACCAGAAGTTTAAGGGCAAGGCCACAATGACTGTTGACAAATCCTCCAGCACAGCCTAT ATGGAGCTTGCCAGATTGACATCTGAGGATTCTGCCATCTATTACTGTGCAAGAGGGGAC GATGGTTATTCCTGGGGTCAAGGAACCTCAGTCACCGTCTCCTCA (SEQ ID № 8). У додатковому варіанті здійснення каркасні ділянки, FWR1, FWR2, FWR3 і FWR4 ланцюги VL можуть містити амінокислоти, зазначені в SEQ ID № 9, SEQ ID № 10, SEQ ID № 11 і SEQ ID № 12, відповідно, як представлено нижче: Asp Val Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly Asp Gln Ala Ser Ile Ser Cys Arg Ser Gly (SEQ ID № 9); Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile Tyr (SEQ ID № 10); Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Ser Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Phe Cys (SEQ ID № 11); Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg (SEQ ID № 12). У додатковому варіанті здійснення визначальні комплементарність ділянки CDR1, CDR2 і CDR3 ланцюга VL можуть містити амінокислоти, зазначені в SEQ ID № 13, SEQ ID № 14, SEQ ID № 15, відповідно, як представлено нижче: 11 UA 106870 C2 5 10 15 20 25 30 35 40 45 50 55 60 Gln Ser Leu Val His Ser Asn Gly Asn Thr Tyr (SEQ ID № 13); Thr Val Ser (SEQ ID № 14); Ser Gln Asn Thr Phe Val Pro Trp Thr (SEQ ID № 15). У додатковому варіанті здійснення каркасні ділянки, FWR1, FWR2, FWR3 і FWR4 ланцюга VH можуть містити амінокислоти, зазначені в SEQ ID № 16, SEQ ID № 17, SEQ ID №18 і SEQ ID №19, відповідно, як представлено нижче: Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Arg Pro Gly Val Ser Val Lys Ile Ser Cys Lys (SEQ ID № 16); Met His Trp Val Lys Gln Ser His Ala Lys Ser Leu Glu Trp Ile Gly Val (SEQ ID № 17); Ala Thr Met Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr Met Glu Leu Ala Arg Leu Thr Ser Glu Asp Ser Ala Ile Tyr Tyr Cys Ala Arg (SEQ ID № 18); Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser (SEQ ID № 19). У додатковому варіанті здійснення визначальні комплементарність ділянки CDR1, CDR2 і CDR3 ланцюга VH можуть містити амінокислоти, зазначені в SEQ ID № 20, SEQ ID № 21, SEQ ID № 22, відповідно, як представлено нижче: Gly Ser Gly Tyr Thr Phe Thr Asp Tyr Ala (SEQ ID № 20); Ile Ser Thr Lys Tyr Gly Lys Thr Asn Tyr Asn Gln Lys Phe Lys Gly Lys (SEQ ID № 21); Gly Asp Asp Gly Tyr Ser (SEQ ID № 22). Поліклональні або моноклональні антитіла для застосування в описуваних способах лікування можна індукувати відомими методиками. Моноспецифічні мишачі (миші) антитіла, що виявляють специфічність до конформаційного епітопу вибраної мішені, можна очистити з антисироваток ссавців, реакційно-здатних проти даних ділянок, або можна одержувати у вигляді моноклональних антитіл, використовуючи методику Kohler і Milstein (1975, Nature 256: 495-497). Моноспецифічне антитіло, як застосовують у цьому документі, позначається як одиничні молекули антитіл або безліч молекул антитіл із гомогенними характеристиками зв'язування, такі як мишачі моноклональні антитіла, наведені в цьому документі як приклади з рядом моноклональних антитіл 13C3. Гібридомні клітини одержують при змішуванні лімфоцитів селезінки з придатними зливними клітинами, переважно мієломними клітинами, в умовах, які забезпечать утворення стабільних гібридом. Продукуючі антитіло селезінкові клітини і мієломні клітини зливають, вибирають і здійснюють скринінг відносно продукції антитіла. Гібридомні клітини з ямок, що містять антитіло, клонують за допомогою такої методики, як методика в м'якому агарі MacPherson (1973, Soft Agar Techniques, in Tissue Culture Methods and Applications, Kruse and Paterson, Eds, Academic Press). Моноклональні антитіла одержують in vivo за допомогою введення відповідних клітин гібридоми вихідним премійованим мишам, збираючи асцитну рідину через деякий період часу, і приготовляють добре відомими в даній галузі способами. Крім молекул специфічних моноклональних антитіл, описаних вище, антитіла за даним винаходом можуть також знаходитися у вигляді "химерного антитіла", моноклонального антитіла, сконструйованого з варіабельних ділянок, що походять, як кажуть, із мишачого джерела, і константних ділянок, що походять із джерела гаданого організму-хазяїна (наприклад, людини; для огляду, дивись Morrison and Oi, 1989, Advances in Immunology, 44: 65-92). Наприклад, варіабельні послідовності ДНК легкого і важкого ланцюгів (наприклад, SEQ ID № 6 і 8, відповідно) з антитіла гризунів (наприклад, миші) можна клонувати в експресуючий вектор ссавців. Дані легкі і важкі "химерні" експресуючі вектори спільно трансфікують у клітинну лініюреципієнт і вибирають і вирощують за допомогою відомих методик. До даної клітинної лінії можна потім застосовувати відомі методики культивування клітин, призводячи до одержання і легкого ланцюга, і важкого ланцюга химерного антитіла. Такі химерні антитіла, як історично було показано, мають антигензв'язувальну здатність початкового моноклонального антитіла гризунів, у той час як значно зменшуються проблеми імуногенності при введенні організмухазяїну. Логічне удосконалення химерного антитіла являє собою "гуманізоване антитіло", яке, мабуть, знижує імовірність виникнення імунної відповіді проти терапевтичного антитіла при порівнянні із застосуванням химерного або повністю мишачого моноклонального антитіла. Стратегія "гуманізації" мишачого Mab основана на заміні амінокислотних залишків, які відрізняються від залишків у людській послідовності, за допомогою сайт-спрямованого мутагенезу окремих залишків або переносячи цілі визначальні комплементарність ділянки (Jones et al., 1986, Nature 321: 522-526). Дана технологія знову ж добре відома в даній галузі і представлена безліччю стратегій для поліпшення даної технології; а саме, при реалізації стратегій, що включають як необмежуючі приклади "реконструювання" (дивись Verhoeyen, et al., 1988, Science 239: 1534-1536), "гіперхимеризацію" (дивись Queen, et al., 1991, Proc. Natl. Acad. 12 UA 106870 C2 5 10 15 20 25 30 35 40 45 50 55 60 Sci. 88:2869-2873) або "маскування" (Mark, et al., 1994, Derivation of Therapeutically Active Humanized and Veneered anti-CD18 Antibodies Metcalf end Dalton, eds. Cellular Adhesion: Molecular Definition to Therapeutic Potential. New York: Plenum Press, 291-312). Дані стратегії також включають у себе до деякого ступеню порівняння послідовності між послідовностями гризунів і людини для того, щоб визначити чи є певні заміни амінокислот від гризунів для людини придатними в загальному типовому елементі структури. Незалежно від змін, центральна межа, залучена до одержання гуманізованого антитіла, основана на перенесенні CDR, де дані три антигензв'язувальні ділянки як легкого, так і важкого ланцюга ефективно видаляють з експресуючого антитіло клону гризунів і субклонують (або "переносять") в експресуючий вектор, що кодує каркасну ділянку антитіла людини. Наприклад, застосовуючи згадані вище методики, можна експресувати гуманізоване антитіло, де ділянки CDR1, CDR2 і CDR3 варіабельного легкого ланцюга зазначені в SEQ ID №№ 13, 14 і 15, відповідно, і ділянки CDR1, CDR2 і CDR3 варіабельного важкого ланцюга зазначені в SEQ ID №№ 20, 21 і 22, відповідно. Отже, "гуманізоване антитіло" являє собою ефективно сконструйоване антитіло тільки з мишачими CDR (без будь-яких додаткових удосконалень, що одержуються при об'єднанні з однією або декількома із згаданих вище стратегій), причому варіабельна ділянка, що залишилася і вся константна ділянка походить із людського джерела. Даний винахід також стосується виділених молекул нуклеїнової кислоти і відповідних амінокислотних послідовностей, які стосуються ділянок VH і/або VL антитіла 13C3, і конкретніше, виділеної молекули нуклеїнової кислоти (полінуклеотиду), що кодує біологічно значущу ділянку 13C3 або афінно зрілий варіант, або іншим чином мутований варіант 13C3, 1D1, 19A6 або іншого 13C3-подібного антитіла. Дані нуклеїнові кислоти по суті не містять інші нуклеїнові кислоти. Для більшості цілей клонування ДНК є переважною нуклеїновою кислотою. Дані молекули ДНК можна субклонувати в експресуючий вектор і згодом трансфікувати у вибрану клітину-хазяїна, де рекомбінантна клітина-хазяїн забезпечує наявність джерела для істотних рівнів відповідних ділянок 13C3, 1D1, 19A6 або 13C3-, 1D1-, або 19A6-подібного антитіла, або його афінно зрілого варіанту. Такі способи можна використати для безлічі застосувань, таких як одержання scFvs або спільної експресії даних ланцюгів VH і VL у систему експресуючого вектора ссавців, яка кодує ділянки CH і CL людини, як кажуть, антитіла IgG. Виродженість генетичного коду така, що всі, а не дві амінокислоти, більш ніж одного кодону, кодують певну амінокислоту. Це забезпечує основу для конструювання синтетичної ДНК, яка кодує антитіло за даним винаходом, де нуклеотидна послідовність синтетичної ДНК значно відрізняється від нуклеотидних послідовностей, що описуються в цьому документі, але все ж кодують таке антитіло. Такі синтетичні ДНК, як слід розуміти, знаходяться в обсязі даного винаходу. Якщо необхідно експресувати таку синтетичну ДНК у визначеній клітині-хазяїні або організмі, частоту використання кодону такої синтетичної ДНК можна скоректувати, щоб відобразити частоту використання кодону даного певного організму-хазяїна, таким чином призводячи до вищих рівнів експресії антитіла за даним винаходом. Іншими словами, дана надмірність різних кодонів, які кодують певні амінокислоти, входить в обсяг даного винаходу. Отже, даний винахід також стосується таких послідовностей ДНК, які кодують РНК, що містять альтернативні кодони, які кодують подальшу трансляцію ідентичних амінокислот, як показано нижче: А=Ala=аланін: кодони GCA, GCC, GCG, GCU; С=Cys=цистеїн: кодони UGC, UGU; D=Asp=аспарагінова кислота: кодони GAC, GAU Е=Glu=глутамінова кислота: кодони GAA, GAG; F=Phe=фенілаланін: кодони UUC, UUU; G=Gly=гліцин: кодони GGA, GGC, GGG, GGU; Н=His=гістидин: кодони CAC, CAU; I=IIe=ізолейцин: кодони AUA, AUC; AUU; K=Lys-лізин: кодони AAA, AAG; L=Leu=лейцин: кодони UUA, UUG, CUA, CUC, CUG, CUU; M=Met=метіонін: кодони AUG; N=Asp=аспарагін: кодони GAU, GAC; Р=Pro=пролін: кодони CCA, CCC, CCG, CCU; Q=Gln=глутамін: кодони CAA, CAG; R=Arg=аргінін: кодони AGA, AGG, CGA, CGC, CGG, CGU; S=Ser=серин: кодони AGC, AGU, UCA, UCC, UCG, UCU; Т=Thr=треонін: кодони ACA, ACC, ACG, ACU; V=Val=валін: кодони GUA, GUC, GUG, GUU; W=Trp=триптофан: кодони UGG; Y=Tyr=тирозин: кодони UAC, UAU. Такі рекомбінантні експресуючі вектори можна потім стаціонарно або тимчасово трансфікувати у відповідну клітинну лінію для одержання альтернативних антитіл. У даному винаході згадують наявність надмірності кодону, яка може призводити до появи розрізних молекул ДНК, експресуючих ідентичне антитіло або його частину (наприклад, альтернативні молекули нуклеїнових кислот, що кодують ідентичні ділянки scFv або VH і/або VL IgG). У контексті даного опису послідовність, що несе один або декілька заміщених кодонів, буде визначатися як вироджена мінливість. Інше джерело мінливості послідовності може мати місце при редагуванні РНК. Таке редагування РНК може призводити до появи іншої форми надмірності кодону, де зміна у відкритій рамці зчитування не призводить до заміни амінокислотного залишку в експресованому білці. Мутації або в послідовності ДНК, або в 13 UA 106870 C2 5 10 15 20 25 30 35 40 45 50 55 60 антитілі, що транслюється, які поліпшують основні фізичні властивості експресованого антитіла, також включені в обсяг даного винаходу. На завершення, даний винахід стосується (i) афінно зрілих варіантів 13C3, 1D1, 19A6 або будь-якого іншого такого 13C3-подібного антитіла, і/або (ii) мутованих форм 13C3, 1D1, 19A6 або будь-якого іншого такого 13C3-подібного антитіла, включаючи як необмежуючі приклади одну або декілька мутацій у ділянках CDR1, CDR2 і/або CDR3, як одержують за допомогою відомих методологій дозрівання афінності і способів рекомбінантної ДНК, відомих для введення сайт-специфічних мутацій. Такі виділені або очищені молекули нуклеїнової кислоти будуть являти собою ділянки VH і/або VL 13C3-подібного антитіла. Дані нуклеїнові кислоти по суті не містять інших нуклеїнових кислот. Для більшості цілей клонування ДНК є переважною нуклеїновою кислотою. Дані молекули ДНК можна субклонувати в експресуючий вектор і згодом трансфікувати у вибрану клітину-хазяїна, де рекомбінантна клітина-хазяїн забезпечує наявність джерела для істотних рівнів відповідної ділянки 13C3-подібного антитіла або його афінно зрілого варіанту. Такі способи можна використати для безлічі застосувань, таких як одержання scFvs або сумісної експресії даних ланцюгів VH і VL у систему експресуючого вектора ссавців, яка кодує ділянки CH і CL людини, як кажуть, антитіла IgG. Даний винахід також стосується рекомбінантних векторів і рекомбінантних організмівхазяїнів, як прокаріотичних, так і еукаріотичних, які містять молекули нуклеїнової кислоти, що кодують відповідні важкі і/або легкі ділянки 13C3-подібного антитіла. Дані молекули нуклеїнової кислоти, цілком або частково, можна зв'язати з іншими молекулами ДНК (тобто, молекулами ДНК, які включають у себе гени імуноглобуліну, що застосовуються для одержання рекомбінантного антитіла людини), які в природі не пов'язані, з утворенням "молекул рекомбінантної ДНК", які кодують відповідне рекомбінантне антитіло людини. Дані вектори можуть містити ДНК або РНК. Для більшості цілей клонування вектори ДНК є переважними. Типові вектори включають у себе плазміди, модифіковані віруси, бактеріофаги, косміди, штучні хромосоми дріжджів та інші форми епісомної або об'єднаної ДНК. У межах знань фахівців у даній галузі, щоб визначити придатний вектор для перенесення певного гена, одержання рекомбінантного антитіла людини або іншого застосування. Способи субклонування молекули нуклеїнової кислоти, що цікавить, в експресуючі вектори, трансформації або трансфекції клітини-хазяїна, що містить вектори, і способи одержання по суті чистого білка, що включають у себе стадії введення відповідного експресуючого вектора в клітину-хазяїна, і культивування клітини-хазяїна у відповідних умовах добре відомі. Антитіло (таке як рекомбінантне антитіло IgG людини), що таким чином одержується, можна одержувати з клітини-хазяїна загальноприйнятими способами. Будь-який відомий експресуючий вектор можна застосовувати в практиці даної частини винаходу, включаючи будь-який вектор, що містить придатний промотор та інші відповідні елементи регуляції транскрипції. Одержану експресуючу конструкцію переносять у прокаріотичну або еукаріотичну клітину-хазяїна для одержання рекомбінантного білка. Експресуючі вектори визначені в цьому документі як послідовності ДНК, які необхідні для транскрипції клонованої ДНК і трансляції їхньої rnRNA у відповідному організмі-хазяїні. Такі вектори можна використати для експресії еукаріотичної ДНК у різних організмах-хазяїнах таких як бактерії, синьо-зелені водорості, рослинні клітини, клітини комах і клітини тварин. Певним чином сконструйовані вектори дозволяють здійснювати перенесення ДНК між такими організмами-хазяїнами, як клітини бактерії-дріжджів або бактерії-тварини. Відповідним чином сконструйований експресуючий вектор повинен містити: ділянку початку реплікації для автономної реплікації в клітинах-хазяїна, селективні маркери, обмежена кількість застосовних ділянок рестрикційних ферментів, можливість для великого числа піків, і активні промотори. Промотор визначають як послідовність ДНК, яка орієнтує РНК-полімеразу на зв'язування з ДНК та ініціює синтез РНК. Активний промотор являє собою промотор, який викликає ініціацію rnRNA із високою частотою. Методики для таких маніпуляцій можна знайти описаними у Sambrook, et al. (1989, Molecular Cloning. А Laboratory Manual; Cold Spring Harbor Laboratory, Cold Spring Harbor, New York), добре відомі і доступні фахівцям у даній галузі. Експресуючі вектори можуть включати як необмежуючі приклади клонуючі вектори, модифіковані клонуючі вектори, певним чином сконструйовані плазміди або віруси. Комерційно доступні експресуючі вектори ссавців, які можуть підійти, включають як необмежуючі приклади, pcDNA3.neo (Invitrogen), pcDNA3.1 (Invitrogen), pCI-neo (Promega), pLITMUS28, pLITMUS29, pLITMUS38 і pLITMUS39 (New England Bioloabs), pcDNAI, pcDNAIanp (Invitrogen), pcDNA3 (Invitrogen), pMClneo (Stratagene), pXT1 (Stratagene), pSG5 (Stratagene), EBO pSV2-neo (ATCC 37593) pBPV-1(8-2) (ATCC 37110), pdBPV-MMTneo(342-12) (ATCC 37224), pRSVgpt (ATCC 37199), pRSVneo (ATCC 37198), pSV2-dhfr (ATCC 37146), pUCTag (ATCC 37460) і 1ZD35 (ATCC 37565). Також доступна безліч бактеріальних експресуючих векторів, що включають як 14 UA 106870 C2 5 10 15 20 25 30 35 40 45 50 55 60 необмежуючі приклади pCR2.1 (Invitrogen), pET1 Ia (Novagen), lambda gtl 1 (Invitrogen) і pKK2233 (Pharmacia). Крім того, можна використати безліч експресуючих векторів клітин грибів, включаючи як необмежуючі приклади pYES2 (Invitrogen) і експресуючий вектор Pichie (Invitrogen). Також можна використати безліч експресуючих векторів клітин комах, включаючи як необмежуючі приклади pBlueBacIII і pBlueBacHis2 (Invitrogen) і pAcG2T (Pharmingen). Рекомбінантні клітини-хазяїни можуть бути прокаріотичними або еукаріотичними, включаючи як необмежуючі приклади, бактерії, такі як Е. coli, клітини грибів, такі як дріжджі, клітини ссавців, включаючи як необмежуючі приклади клітинні лінії бичачого, свинячого, мавпячого походження, і клітини, що належать гризунам; і клітини комах. Види ссавців, які можуть підійти, -26 включають як необмежуючі приклади L-клітини L-M(TK-) (ATCCCCL1.3), L-клітка L-M (ATCC CCL 1.2), Saos-2 (ATCCHTB-85), 293 (ATCCCRL1573), Raji (ATCC CCL 86), CV-1 (ATCC CCL 70), COS-1 (ATCC CRL1650), COS-7 (ATCC CRL 1651), CHO-K1 (ATCC CCL 61), 3T3 (ATCC CCL 92), NIH/3T3 (ATCC CRL 1658), HeLa (ATCC CCL 2), C127I (ATCC CRL 1616), BS-C-1 (ATCC CCL 26), MRC-5 (ATCCCCL171) і CPAE (ATCC CCL 209). Ще одне удосконалення антитіл, що повторно конструюються, як розглядається вище, являє собою одержання повністю людських моноклональних антитіл. Перше включає в себе використання генетично сконструйованих порід мишей, які мають імунною системою, причому гени мишачих антитіл інактивували і, у свою чергу, замінили набором функціональних людських генів антитіл, залишаючи інші компоненти імунної системи миші незмінними. Такі генетично сконструйовані миші дозволяють здійснювати in vivo природну імунну відповідь і процес дозрівання афінності, який призводить до появи високої афінності повністю людських моноклональних антитіл. Дана технологія, знову ж, добре відома в даній галузі і повністю викладена в деталях у різних публікаціях, що включають як необмежуючі приклади патенти США №№ 5939598; 6075181; 6114598; 6150584 і пов'язані аналоги (видані Abgenix, що описують їх технологію XenoMouse); а також патенти США №№ 5545806; 5569825; 5625126; 5633425; 5789650; 5877397; 5661016; 5814318; 5874299 і 5770429 (видані GenPharm International і доступні через Medarex під егідою "UltraMab Human Antibody Development System"). Дивись також огляд Kellerman і Green (2002, Curr. Opinion in Biotechnology 13: 593597). На закінчення, методики, доступні фахівцям для вибору фрагментів антитіл із бібліотек, застосовуючи технології удосконалення, включаючи як необмежуючі приклади фаговий дисплей, рибосомний дисплей (Hanes and Pluckthun, 1997, Proc. Nat. Acad. Sci. 94: 4937-4942), бактерійний дисплей (Georgiou, et al., 1997, Nature Biotechnology 15: 29-34) і/або дріжджовий дисплей (Kieke, et al., 1997, Protein Engineering 10: 1303-1310), можна використати як альтернативи раніше описаним технологіям для вибору одноланцюгових антитіл, які специфічно зв'язуються з цільовим цитокіном. Одноланцюгові антитіла вибирають із бібліотек одноланцюгових антитіл, одержаних при безпосередньому використанні технології ниткоподібних фагів. Технологія фагового дисплея відома в даній галузі (наприклад, дивись технологію Cambridge Antibody Technology (CAT)), як описано в патентах США №№ 5565332; 5733743; 5871907; 5872215; 5885793; 5962255; 6140471; 6225447; 6,291650; 6492160; 6521404; 6544731; 6555313; 6582915; 6593081, а також інші аналоги патентів США або заявки, які основані на пріоритеті реєстрації заявки GB 9206318, поданої 24 травня 1992; дивись також Vaughn, et al. 1996, Nature Biotechnology 14: 309-314). Одноланцюгові антитіла також можна розробити і сконструювати, використовуючи доступну технологію рекомбінантних ДНК, таку як спосіб ампліфікації ДНК (наприклад, ПЦР), або, можливо, при застосуванні відповідної гібридоми кДНК як матриці. Одноланцюгові антитіла можуть бути моно- або біспецифічними; двовалентними або чотиривалентними. Нуклеотидну послідовність, що кодує одноланцюгове антитіло, можна сконструювати, використовуючи ручний або автоматизований нуклеотидний синтез, клонувати в експресуючу конструкцію, застосовуючи стандартні способи рекомбінантної ДНК, і вбудувати в клітину, щоб експресувати кодуючу послідовність, як описано нижче. Даний винахід додатково стосується заснованої на антитілі фармацевтичної композиції, що містить ефективну кількість 13C3-подібного антитіла або афінно зрілого варіанту, яка передбачає вибране профілактичне або терапевтичне лікування для інгібування утворення фібрильної і/або сенільної бляшки, асоційованого з хворобою Альцгеймера. Основану на антитілі фармацевтичну композицію за даним винаходом можна приготувати будь-якою кількістю стратегій, відомих у даній галузі (наприклад, дивись McGoff and Scher, 2000, Solution Formulation of Proteins/Peptides: In McNaIIy, E.J., ed. Protein Formulation and Delivery. New York, NY: Marcel Dekker; pp. 139-158; Akers and Defilippis, 2000, Peptides and Proteins as Parenteral Solutions. In: Pharmaceutical Formulation Development of Peptides and Proteins. Philadelphia, PA: Talyor and Francis; pp. 145-177; Akers, et al., 2002, Pharm. Biotechnol. 14:41-121). Фармацевтично 15 UA 106870 C2 5 10 15 20 25 30 35 40 45 50 55 60 прийнятна композиція, придатна для введення пацієнту, буде містити ефективну кількість антитіла в препараті, який як зберігає біологічну активність, так і забезпечує максимальну стабільність під час зберігання в межах прийнятного температурного діапазону. Фармацевтичні композиції можуть також включати в себе, залежно від необхідного препарату, фармацевтично приймаємо розріджувачі, фармацевтично прийнятні носії і/або фармацевтично приймаємо ексципієнти, або будь-який такий носій, загальновживаний для приготування фармацевтичних композицій для введення тварині або людині. Розріджувач вибирають так, щоб не вплинути на біологічну активність комбінації. Приклади таких розріджувачів являють собою дистильовану воду, фізіологічний фосфатно-буферний розчин, розчини Рінгера, розчин декстрози і розчин Хенка. Кількість ексципієнта, яка є застосовною у фармацевтичній композиції або препараті за даним винаходом являє собою кількість, яка забезпечує рівномірний розподіл антитіла в композиції, так що вона може рівномірно розповсюджуватися, коли його доставляють суб'єкту, що потребує цього. Він може забезпечувати розбавлення антитіла до концентрації, яка забезпечує сприятливі або лікувальні результати, у той же самий час мінімізуючи будь-які небажані побічні ефекти, які можуть мати місце при дуже високій концентрації. Він може також мати консервуючу дію. Таким чином, для антитіла, що має високу фізіологічну активність, будуть застосовувати більше ексципієнта. З іншого боку, для будь-якого активного інгредієнта(ів), який виявляє нижчу фізіологічну активність, будуть застосовувати меншу кількість ексципієнта. В основному, кількість ексципієнта в композиції буде складати приблизно від 50 % мас. (м.) і 99,9 % м. від загальної композиції. Якщо антитіло виявляє особливо низьку фізіологічну активність, кількість ексципієнта може бути малою до 1 % м. З іншого боку, для антитіла, яке має особливо високу фізіологічну активність, кількість ексципієнта може складати приблизно від 98,0 % до приблизно 99,9 % м. Крім того, антитіло або антитіла можна вводити у вигляді "хімічного похідного" (молекули, яка містить додатковий хімічний фрагмент, який у нормі не є частиною молекули). Такі фрагменти можуть поліпшити розчинність, період напіввиведення, поглинання і т.д. біологічної речовини. Альтернативно, такі фрагменти можуть зменшувати небажані побічні ефекти антитіла. Фармацевтичні композиції можуть включати в себе великі, повільно метаболізуючі макромолекули, такі як білки, полісахариди, полімолочні кислоти, полігліколеві кислоти і співполімери (такі як функціоналізована латексом сефароза, агароза, целюлоза і таке інше), полімерні амінокислоти, амінокислотні співполімери і ліпідні агрегати (такі як масляні краплі або ліпосоми). Додатково, дані носії можуть діяти як імуностимулюючі засоби (тобто, ад'юванти). Для парентерального введення речовини за винаходом можна вводити в зручному для ін'єкцій дозуванні розчину або суспензії речовини в фізіологічно прийнятному розріджувачі з фармацевтичним носієм, який може являти собою стерильну рідину, таку як вода, олії, фізіологічний розчин, гліцерин або етанол. Додатково в композиціях можуть бути присутніми допоміжні речовини, такі як змочувальні речовини або емульгатори, поверхнево-активні речовини, буферизуючі pH речовини і таке інше. Інші компоненти фармацевтичних композицій являють собою компоненти вуглеводневого, тваринного, рослинного або синтетичного походження, наприклад, арахісову олію, соєву олію і мінеральне масло. В основному, гліколі, такі як пропіленгліколь або поліетиленгліколь, є переважними рідкими носіями, особливо, для придатних для ін'єкцій розчинів. Препарат антитіла може знаходитися в рідкій формі або твердій формі. Твердий препарат, як правило, ліофілізують і вносять у розчин перед введенням або для однократного, або багаторазового дозування. Препарати не повинні зазнавати впливу екстремальних значень температури або pH, щоб уникнути теплової денатурації. Таким чином, важливо приготувати композицію антитіла за даним винаходом в діапазоні біологічно придатного pH. Потрібний розчин, буферизований для підтримки відповідного діапазону pH під час зберігання, особливо, для рідких препаратів, що зберігаються протягом тривалішого періоду часу між препаратом і введенням. До цього часу, і для рідких і для твердих препаратів необхідно зберігання при більш низьких температурах (звичайно 2-8 °C), щоб зберегти стабільність протягом триваліших періодів. Приготовані композиції антитіла, особливо, рідкі препарати, можуть містити бактеріостатичну добавку для того, щоб запобігти або знизити до мінімуму протеоліз під час зберігання, включаючи як необмежуючі приклади ефективні концентрації (звичайно
ДивитисяДодаткова інформація
Назва патенту англійськоюAntibodies specific for the protofibril form of beta-amyloid protein
Автори російськоюRavetch, Jeffrey, Fukuyama, Hidehiro
МПК / Мітки
МПК: A61K 39/395, G01N 33/567, G01N 33/53
Мітки: білка, бета-амілоїдного, антитіла, форми, специфічні, протофібрилярної
Код посилання
<a href="https://ua.patents.su/57-106870-antitila-specifichni-dlya-protofibrilyarno-formi-beta-amilodnogo-bilka.html" target="_blank" rel="follow" title="База патентів України">Антитіла, специфічні для протофібрилярної форми бета-амілоїдного білка</a>
Попередній патент: Поліпептид ace2
Наступний патент: Спосіб відпалювання холоднокатаної алюмінієвої смуги
Випадковий патент: Пристрій для відображення звукової та візуальної інформації