Піридиноїлпіперидини як агоністи 5-ht1f
Номер патенту: 77504
Опубліковано: 15.12.2006
Автори: Манкузо Вінсент, Ксу Яо-Ченг, Віктор Франтц, Їнь Бей-Пінь, Коуен Майкл Філіп, Колмен Деніел Тімоти, Чжан Деї, Захерл ДіАнна П'ятт, Лянь Сідні Цзі
Формула / Реферат
1. Сполука формули І:
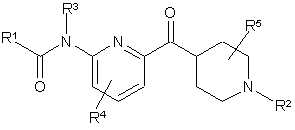 I
I
або її фармацевтично прийнятна сіль з кислотою, де
R1 – С1-С6-алкіл, заміщений С1-С6-алкіл, С3-С7-циклоалкіл, заміщений С3-С7-циклоалкіл, С3-С7-циклоалкіл-С1-С3-алкіл, заміщений С3-С7-циклоалкіл-С1-С3-алкіл, феніл, заміщений феніл, гетероцикл або заміщений гетероцикл;
R2 – водень, С1-С3-алкіл, С3-С6-циклоалкіл-С1-С3-алкіл або групаформули II
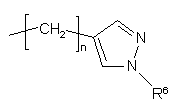 ; II
; II
R3 – водень або С1-С3-алкіл;
R4 – водень, галоген або С1-С3-алкіл;
R5 – водень або С1-С3-алкіл;
R6 – водень або С1-С6-алкіл; та
n – ціле число від 1 до 6 включно.
2. Сполука за п. 1, де R5 – водень та R4 – водень або галоген.
3. Сполука за п. 2, де R4 – водень.
4. Сполука за будь-яким із пп. 1-3, де R2 – водень або С1-С3-алкіл.
5. Сполука за будь-яким із пп. 1-4, де R1 – феніл, заміщений феніл, гетероцикл або заміщений гетероцикл.
6. Сполука за будь-яким із пп. 1-5, де R1 – феніл, заміщений феніл, гетероцикл або заміщений гетероцикл, де згадана гетероциклічна група вибрана з групи, до якої входять фураніл, тіофеніл, піроліл, піролідиніл, піридиніл, N-метилпіроліл, оксазоліл, ізоксазоліл, піразоліл, імідазоліл, триазоліл, оксадіазоліл, тіадіазоліл, тіазоліл, тіазолідиніл, N-ацетилтіазолідиніл, піримідиніл, піразиніл, піридазиніл, ізохінолініл, бензоксазоліл, бензодіоксоліл, бензотіазоліл, хінолініл, бензофураніл, бензотіофеніл та індоліл, і де термін "заміщений" означає циклічну групу, заміщену одним-трьома галогеновими замісниками; або заміщену одним-двома замісниками, незалежно один від одного вибраними з групи, до якої входять галоген, С1-С4-алкіл, С1-С4-алкокси- та С1-С4-алкілтіогрупа, де кожен алкільний, алкоксильний та алкілтіозамісник може бути додатково заміщений незалежно від інших С1-С2-алкоксигрупою або однією-п'ятьма галогеновими групами, незалежно одна від одної вибраними з групи, яка включає фтор та хлор; або заміщену одним замісником, вибраним з групи, до якої входять фенілокси-, бензилокси-, фенілтіо-, бензилтіо- та піримідинілоксигрупа, де згадані фенілокси-, бензилокси-, фенілтіо-, бензилтіо- або піримідинілоксигрупа можуть бути додатково заміщені одним-двома замісниками, вибраними з групи, до якої входять галоген, С1-С2-алкіл та С1-С2-алкоксигрупа; або заміщену одним замісником, вибраним з групи, до якої входять С1-С4-ацил та С1-С4-алкоксикарбоніл, та додатково заміщену 0-1 замісником, вибраним з групи, до якої входять галоген, С1-С4-алкіл, С1-С4-алкокси- та С1-С4-алкілтіогрупа.
7. Сполука за п. 6, де R1 – феніл, заміщений феніл, гетероцикл або заміщений гетероцикл, де згадана гетероциклічна група вибрана з групи, до якої входять піридиніл, індоліл, бензофураніл, фураніл, тіофеніл, бензодіоксоліл і тіазолідиніл, і де термін "заміщений" означає циклічну групу, заміщену одним-трьома галогеновими замісниками; або заміщену одним-двома замісниками, незалежно один від одного вибраними з групи, до якої входять галоген, С1-С4-алкіл, С1-С4-алкокси- та С1-С4-алкілтіогрупа, де кожен алкільний, алкоксильний та алкілтіозамісник може бути додатково заміщений незалежно один від одного С1-С2-алкоксигрупою або однією-п'ятьма галогеновими групами, незалежно одна від одної вибраними з групи, яка включає фтор та хлор; або заміщену одним замісником, вибраним із групи, до якої входять фенілокси-, бензилокси-, фенілтіо-, бензилтіо- та піримідинілоксигрупа, де згадані фенілокси-, бензилокси-, фенілтіо-, бензилтіо- або піримідинілоксигрупа можуть бути додатково заміщені одним-двома замісниками, вибраними з групи, до якої входять галоген, С1-С2-алкіл та С1-С2-алкоксигрупа; або заміщену одним замісником, вибраним з групи, до якої входять С1-С4-ацил та С1-С4-алкоксикарбоніл, та додатково заміщену 0-1 замісником, вибраним з групи, до якої входять галоген, С1-С4-алкіл, С1-С4-алкокси- та С1-С4-алкілтіогрупа.
8. 2,4,6-Трифтор-N-[6-(1-метилпіперидин-4-ілкарбоніл)-піридин-2-іл]-бензамід або фармацевтично прийнятна сіль цієї сполуки з кислотою.
9. Гемісукцинат 2,4,6-трифтор-N-[6-(1-метилпіперидин-4-ілкарбоніл)-піридин-2-іл]-бензаміду.
10. Гідрохлорид 2,4,6-трифтор-N-[6-(1-метилпіперидин-4-ілкарбоніл)-піридин-2-іл]-бензаміду.
11. Фармацевтична композиція, яка містить сполуку за будь-яким із пп. 1-7 та фармацевтичний носій, розріджувач або допоміжну речовину.
12. Сполука за будь-яким із пп. 1-10 для застосування як фармацевтичної речовини.
13. Сполука за будь-яким із пп. 1-10 для застосування в активуванні рецепторів 5-HT1F у ссавців.
14. Сполука за будь-яким із пп. 1-10 для застосування в пригніченні транссудації нейронного протеїну у ссавців.
15. Сполука за будь-яким із пп. 1-10 для застосування в лікуванні або профілактиці мігрені у ссавців.
16. Сполука за будь-яким із пп. 13-15, де згаданим ссавцем є людина.
17. Застосування сполуки за будь-яким із пп. 1-10 у виробництві лікарського засобу для активування рецепторів 5-HT1F у ссавців.
18. Застосування сполуки за будь-яким із пп. 1-10 у виробництві лікарського засобу для пригнічення транссудації нейронного протеїну у ссавців.
19. Застосування сполуки за будь-яким із пп. 1-10 у виробництві лікарського засобу для лікування або профілактики мігрені у ссавців.
20. Застосування сполуки за будь-яким із пп. 1-10 у виробництві лікарського засобу для лікування розладу, пов'язаного з дисфункцією рецепторів 5-HT1F у ссавців.
21. Застосування за п. 20, де згаданим розладом, пов'язаним із дисфункцією рецепторів 5-HT1F, є транссудація нейронного протеїну.
22. Застосування за п. 20, де згаданим розладом, пов'язаним із дисфункцією рецепторів 5-HT1F, є мігрень.
23. Застосування за будь-яким із пп. 17-22, де згаданим ссавцем є людина.
24. Спосіб одержання 2-галоген-6-(піперидин-4-карбоніл)піридину формули III
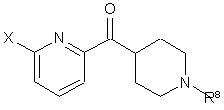 , III
, III
де Х – бром або хлор;
R8 – група захисту аміну, С1-С3-алкіл, С3-С6-циклоалкіл-С1-С3-алкіл або група формули II
 ; II
; II
R6 - водень або С1-С6-алкіл; та
n – ціле число від 1 до 6 включно;
при якому
1) проводять реакцію 2,6-дигалогенпіридину, вибраного з групи, яка включає 2,6-дибромпіридин та 2,6-дихлорпіридин, з н-бутиллітієм, одержують 2-галоген-6-літійпіридин, і далі
2) проводять реакцію згаданого 2-галоген-6-літійпіридину із заміщеним амінокарбонілпіперидином формули IV
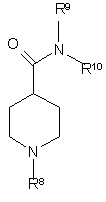 , IV
, IV
де кожен з R9 та R10 – метил, або R9 та R10 разом з атомом азоту, до якого вони приєднані, утворюють азетидиніл, піролідиніл або піперидиніл.
25. Спосіб за п. 24, де Х – бром та згаданий 2,6-дигалогенпіридин є 2,6-дибромпіридин.
26. Спосіб за одним із п. 24 або п. 25, де кожен з R9 та R10 – метил.
27. Спосіб за одним із п. 24 або п. 25, де R9 та R10 разом з атомом азоту, до якого вони приєднані, утворюють піролідиніл.
28. Спосіб за будь-яким із пп. 24-27, де розчинником для стадії 2) є метил-трет-бутиловий простий ефір.
29. Спосіб за будь-яким із пп. 24-27, де розчинником для стадії 2) є толуол.
30. Спосіб одержання 2-бром-6-(піперидин-4-карбоніл)піридину формули III
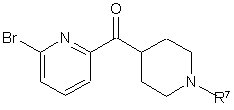 , III
, III
де R7 – С1-С3-н-алкіл або група захисту аміну;
при якому проводять реакцію 2,6-дибромпіридину з н-бутиллітієм одержують 2-бром-6-літійпіридин, і далі проводять реакцію згаданого 2-бром-6-літійпіридину з 4-(N,N'-диметиламіно)карбонілпіперидином формули IV
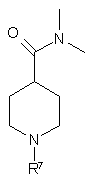 IV
IV
із застосуванням метил-трет-бутилового простого ефіру як розчинника.
Текст
1. Сполука формули І: 77504 2 (11) 1 C2 (54) ПІРИДИНОЇЛПІПЕРИДИНИ ЯК АГОНІСТИ 5-HT1F 3 77504 4 5. Сполука за будь-яким із пп. 1-4, де R1 – феніл, 8. 2,4,6-Трифтор-N-[6-(1-метилпіперидин-4заміщений феніл, гетероцикл або заміщений гетеілкарбоніл)-піридин-2-іл]-бензамід або фармацевроцикл. тично прийнятна сіль цієї сполуки з кислотою. 6. Сполука за будь-яким із пп. 1-5, де R1 – феніл, 9. Гемісукцинат 2,4,6-трифтор-N-[6-(1заміщений феніл, гетероцикл або заміщений гетеметилпіперидин-4-ілкарбоніл)-піридин-2-іл]роцикл, де згадана гетероциклічна група вибрана з бензаміду. групи, до якої входять фураніл, тіофеніл, піроліл, 10. Гідрохлорид 2,4,6-трифтор-N-[6-(1піролідиніл, піридиніл, N-метилпіроліл, оксазоліл, метилпіперидин-4-ілкарбоніл)-піридин-2-іл]ізоксазоліл, піразоліл, імідазоліл, триазоліл, оксабензаміду. діазоліл, тіадіазоліл, тіазоліл, тіазолідиніл, N11. Фармацевтична композиція, яка містить сполуацетилтіазолідиніл, піримідиніл, піразиніл, піридаку за будь-яким із пп. 1-7 та фармацевтичний нозиніл, ізохінолініл, бензоксазоліл, бензодіоксоліл, сій, розріджувач або допоміжну речовину. бензотіазоліл, хінолініл, бензофураніл, бензотіо12. Сполука за будь-яким із пп. 1-10 для застосуфеніл та індоліл, і де термін "заміщений" означає вання як фармацевтичної речовини. циклічну групу, заміщену одним-трьома галогено13. Сполука за будь-яким із пп. 1-10 для застосувими замісниками; або заміщену одним-двома вання в активуванні рецепторів 5-HT1F у ссавців. замісниками, незалежно один від одного вибрани14. Сполука за будь-яким із пп. 1-10 для застосуми з групи, до якої входять галоген, С1-С4-алкіл, вання в пригніченні транссудації нейронного проС1-С4-алкокси- та С1-С4-алкілтіогрупа, де кожен теїну у ссавців. алкільний, алкоксильний та алкілтіозамісник може 15. Сполука за будь-яким із пп. 1-10 для застосубути додатково заміщений незалежно від інших вання в лікуванні або профілактиці мігрені у ссавС1-С2-алкоксигрупою або однією-п'ятьма галогеноців. вими групами, незалежно одна від одної вибрани16. Сполука за будь-яким із пп. 13-15, де згаданим ми з групи, яка включає фтор та хлор; або заміщессавцем є людина. ну одним замісником, вибраним з групи, до якої 17. Застосування сполуки за будь-яким із пп. 1-10 входять фенілокси-, бензилокси-, фенілтіо-, бену виробництві лікарського засобу для активування зилтіо- та піримідинілоксигрупа, де згадані фенілорецепторів 5-HT1F у ссавців. кси-, бензилокси-, фенілтіо-, бензилтіо- або піримі18. Застосування сполуки за будь-яким із пп. 1-10 динілоксигрупа можуть бути додатково заміщені у виробництві лікарського засобу для пригнічення одним-двома замісниками, вибраними з групи, до транссудації нейронного протеїну у ссавців. якої входять галоген, С1-С2-алкіл та С1-С219. Застосування сполуки за будь-яким із пп. 1-10 алкоксигрупа; або заміщену одним замісником, у виробництві лікарського засобу для лікування вибраним з групи, до якої входять С1-С4-ацил та або профілактики мігрені у ссавців. С1-С4-алкоксикарбоніл, та додатково заміщену 0-1 20. Застосування сполуки за будь-яким із пп. 1-10 замісником, вибраним з групи, до якої входять гау виробництві лікарського засобу для лікування логен, С1-С4-алкіл, С1-С4-алкокси- та С1-С4розладу, пов'язаного з дисфункцією рецепторів 5алкілтіогрупа. HT1F у ссавців. 7. Сполука за п. 6, де R1 – феніл, заміщений фе21. Застосування за п. 20, де згаданим розладом, ніл, гетероцикл або заміщений гетероцикл, де згапов'язаним із дисфункцією рецепторів 5-HT1F, є дана гетероциклічна група вибрана з групи, до якої транссудація нейронного протеїну. входять піридиніл, індоліл, бензофураніл, фураніл, 22. Застосування за п. 20, де згаданим розладом, тіофеніл, бензодіоксоліл і тіазолідиніл, і де термін пов'язаним із дисфункцією рецепторів 5-HT1F, є "заміщений" означає циклічну групу, заміщену одмігрень. ним-трьома галогеновими замісниками; або замі23. Застосування за будь-яким із пп. 17-22, де згащену одним-двома замісниками, незалежно один даним ссавцем є людина. від одного вибраними з групи, до якої входять га24. Спосіб одержання 2-галоген-6-(піперидин-4логен, С1-С4-алкіл, С1-С4-алкокси- та С1-С4карбоніл)піридину формули III O алкілтіогрупа, де кожен алкільний, алкоксильний та алкілтіозамісник може бути додатково заміщеX N ний незалежно один від одного С1-С2III алкоксигрупою або однією-п'ятьма галогеновими N групами, незалежно одна від одної вибраними з R8 групи, яка включає фтор та хлор; або заміщену де Х – бром або хлор; одним замісником, вибраним із групи, до якої вхоR8 – група захисту аміну, С1-С3-алкіл, С3-С6дять фенілокси-, бензилокси-, фенілтіо-, бензилциклоалкіл-С1-С3-алкіл або група формули II тіо- та піримідинілоксигрупа, де згадані фенілокси, бензилокси-, фенілтіо-, бензилтіо- або піримідиCH2 нілоксигрупа можуть бути додатково заміщені одN n ним-двома замісниками, вибраними з групи, до II N якої входять галоген, С1-С2-алкіл та С1-С2алкоксигрупа; або заміщену одним замісником, R6 вибраним з групи, до якої входять С1-С4-ацил та 6 R - водень або С1-С6-алкіл; та С1-С4-алкоксикарбоніл, та додатково заміщену 0-1 n – ціле число від 1 до 6 включно; замісником, вибраним з групи, до якої входять гапри якому логен, С1-С4-алкіл, С1-С4-алкокси- та С1-С4алкілтіогрупа. 5 77504 6 1) проводять реакцію 2,6-дигалогенпіридину, виб29. Спосіб за будь-яким із пп. 24-27, де розчиннираного з групи, яка включає 2,6-дибромпіридин та ком для стадії 2) є толуол. 2,6-дихлорпіридин, з н-бутиллітієм, одержують 230. Спосіб одержання 2-бром-6-(піперидин-4галоген-6-літійпіридин, і далі карбоніл)піридину формули III O 2) проводять реакцію згаданого 2-галоген-6літійпіридину із заміщеним амінокарбонілпіпериBr N дином формули IV R9 III N O N R10 IV N R8 , де кожен з R9 та R10 – метил, або R9 та R10 разом з атомом азоту, до якого вони приєднані, утворюють азетидиніл, піролідиніл або піперидиніл. 25. Спосіб за п. 24, де Х – бром та згаданий 2,6дигалогенпіридин є 2,6-дибромпіридин. 26. Спосіб за одним із п. 24 або п. 25, де кожен з R9 та R10 – метил. 27. Спосіб за одним із п. 24 або п. 25, де R9 та R10 разом з атомом азоту, до якого вони приєднані, утворюють піролідиніл. 28. Спосіб за будь-яким із пп. 24-27, де розчинником для стадії 2) є метил-трет-бутиловий простий ефір. До останнього часу теоретичні концепції, що стосуються патофізіології мігрені, базувалися переважно на роботі Грехема та Вольфа [Graham and Wolff, Arch. Neurol. Psychiatry, 39:737-63, 1938]. Ці автори запропонували розглядати як причину головного болю при мігрені розширення позачерепних судин. Цей погляд підтверджувався відомостями про те, що алкалоїди ріжків та суматриптан гідрофільний агоніст 5-НТ1, який не переходить через гематоенцефалічний бар'єр, - спричиняють скорочення гладких м'язів черепних судин, і є ефективними засобами лікування мігрені [Гемфрі та ін. - Humphrey et al., Ann. NY Acad. Sci., 600:587-600, 1990]. Недавня робота Московіча (Moskowitz) показала, однак, що виникнення головного болю при мігрені не залежить від змін діаметра судин [Cephalalgia, 12:5-7, 1992]. Московіч припускає, що невідомі на цей час збудники болю стимулюють ганглії трійчастого нерва, якими іннервована судинна система в мозковій тканині, і спричиняють вивільнення вазоактивних нейропептидів з аксонів на судинах. Ці вивільнені нейропептиди потім активують послідовність явищ, наслідком якої є біль. Це нейрогенне запалення блокується суматриптаном та алкалоїдами ріжків через посередництво механізмів, які включають рецептори 5-НТ, що вважаються близькими до підтипу 5-НТ1D, локалізовані на трійнично-судинних волокнах [Neurology, 43(suppl. 3):S16-S20, 1993]. Дійсно, суматриптан має високу спорідненість до рецепторів 5-НТ1В та 5-НТ1D, від R7 , де R7 – С1-С3-н-алкіл або група захисту аміну; при якому проводять реакцію 2,6-дибромпіридину з н-бутиллітієм одержують 2-бром-6-літійпіридин, і далі проводять реакцію згаданого 2-бром-6літійпіридину з 4-(N,N'диметиламіно)карбонілпіперидином формули IV O N IV N R7 із застосуванням метил-трет-бутилового простого ефіру як розчинника. повідно Kі=10,3нМ та 5,1нМ, активність яких може бути типовою для судинозвужувальної дії. Суматриптан та аналогічні сполуки, які раніше пропонувалися для лікування мігрені, згідно з принципами відомих моделей мігрені, вибиралися переважно на основі цієї судинозвужувальної дії. Серотонін (5-НТ) спричиняє різноманітні фізіологічні ефекти, опосередковані щонайменше сімома класами рецепторів, з яких найбільш гетерогенним виявляється 5-НТ1. Ген людини, який експресує один із цих підтипів рецептора 5-НТ1, що зветься 5-НТ1F, був виділений Као та ін. [Као et al., Ргос. Natl. Acad. Sci. USA, 90:408-412, 1993]. Цей рецептор 5-HT1F виявляє фармакологічний профіль, відмінний від будь-якого серотонергічного рецептора, описаного раніше. Було з'ясовано, що суматриптан, окрім вищезгаданої сильної спорідненості до рецепторів 5-НТ1B та 5-НТ1D, має спорідненість також до підтипу рецептора 5-НТ1F при Kі приблизно 23нМ. Це вказує, що рецептор 5НТ1F може відігравати певну роль у явищі мігрені. В подальшому були розроблені різноманітні агоністи рецептора 5-НТ1F, які виявляють відносну селективність до підкласу рецептора 5-НТ1F, і показано, що така селективність, як правило, послаблює судинозвужувальну дію, характерну для інших сполук, запропонованих як потенціальні засоби для лікування мігрені та пов'язаних із нею розладів. До цих агоністів рецептора 5-НТ1F належать сполуки, описані в таких документах: 7 77504 8 Патенти США №№ 5,708,187 та 5,814,653 описують сімейство заміщених в положенні 6 3аміно(алкіл)-тетрагідрокарбазолів та заміщених в положенні 7 4-аміно(алкіл)циклогепта[7,6b]індолів; Патенти США №№ 5,521,196, 5,721,252, 5,521,197 та WO 96/29075 описують різноманітні сімейства заміщених в положенні 5 піперидин-3-іліндолів та заміщених в положенні 5 1,2,3,6та фармацевтично прийнятних солей цих спотетрагідропіридин-3-іл-індолів; лук із кислотами, де; WO 97/13512 описує сімейство заміщених в R1 - С1-С6-алкіл, заміщений С1-С6-алкіл, С3-С7положенні 5 3-аміноетиліндолів; циклоалкіл, заміщений С3-С7-циклоалкіл, С3-С7WO 98/46570 описує сімейство заміщених в циклоалкіл-С1-С3-алкіл, заміщений С3-С7положенні 5 індолів, піроло[3,2-b]піридинів, бенциклоалкіл-С1-С3-алкіл, феніл, заміщений феніл, зофуранів та бензотіофенів, які мають у положенні гетероцикл або заміщений гетероцикл; 3 такі замісники: октагідроіндолізиніл, октагідроR2 - водень, С1-С3-алкіл, С3-С6-циклоалкіл-С12Н-хінолізиніл, декагідропіридо[1,2-а]азепініл, С3-алкіл або група формули II 1,2,3,5,8,8а-гексагідроіндолізиніл, 1,3,4,6,9,9агексагідро-2Н-хінолізиніл або 1,4,6,7,8,9,10,10аоктагідропіридо[1,2-а]азепініл; WO 98/20875 та WO 99/25348 описують два сімейства заміщених в положенні 5 піперидин-3-ілазаіндолів та заміщених в положенні 5 1,2,3,6тетрагідропіридин-3-іл-азаіндолів; WO 00/00487 описує сімейство заміщених в положенні 5 (піперидин-3-іл або 1,2,3,6тетрагідропіридин-3-іл)індолів, азаіндолів, бензофуранів та бензотіофенів; WO 98/08502 описує сімейство заміщених в положенні 8 1,2,3,4-тетрагідро-2дибензофуранамінів та заміщених в положенні 9 2-аміноциклогепта[b]бензофуранів; WO 98/55115 описує сімейство 3-аміно-1,2,3,4тетрагідро-9Н-карбазол-6-карбоксамідів та 4аміно-10Н-циклогепта[7,6-b]індол-7-карбоксамідів; WO 98/15545 описує вибране сімейство двозаміщених в положеннях 3,5 індолів та бензофуранів; WO 00/00490 описує сімейство заміщених в положенні 5 алілом (піперидин-3-іл або 1,2,3,6тетрагідропіридин-3-іл)індолів, азаіндолів, бензофуранів та бензотіофенів; WO 00/47559 описує сімейство 4-(3-заміщений бензоїл)піперидинів; WO 00/50426 описує сімейство двозаміщених в положеннях 3,5 азабензофуранів; і WO 00/34266 описує сімейство 3-гетероарил5-[2-(арил або гетероарил)-2-оксоетил]індолів. При подальшому дослідженні несподівано виявлено новий та неочевидний клас нових селективних агоністів 5-НТ1F, що мають інші хімічні властивості та характеристики зв'язування з рецептором, які інгібують індуковане пептидами розширення судин і при цьому дозволяють уникнути значного судинозвужувального ефекту, і, отже, є корисними для лікування мігрені та інших розладів, пов'язаних із рецептором 5-НТ1F. Крім того, сполуки за цим винаходом здатні забезпечити підвищену розчинність, що сприяє їх придатності для виготовлення лікарських форм, яким віддається перевага, наприклад, композицій для під'язичного, защічного та/або назального застосування. Цей винахідстосується піридиноїлпіперидинів загальної формули І: R3 - водень або С1-С3-алкіл; R4 - водень, галоген або С1-С3-алкіл; R5 - водень або С1-С3-алкіл; R6 - водень або С1-С6-алкіл; та n - ціле число від 1 до 6 включно. За одним варіантом здійснення, якому віддається перевага, цей винахід стосується піридиноїлпіперидинів загальної формули І: та фармацевтично прийнятних солей цих сполук із кислотами, де; R1 - феніл, заміщений феніл, гетероцикл або заміщений гетероцикл; R2 - водень або С1-С2-алкіл; R3 - водень або метил; та кожен із R4 та R5 - водень. Іншими сполуками, яким віддається перевага, є сполуки формули І, де R - водень. Цей винахід також стосується фармацевтичних композицій, що містять сполуку формули І або її фармацевтично прийнятну сіль із кислотою та фармацевтичний носій, розріджувач або допоміжну речовину. За варіантами здійснення цього аспекту даного винаходу, яким віддається перевага, пропонуються фармацевтичні композиції, що містять сполуку формули І або її фармацевтично прийнятну сіль, придатну для активування рецепторів 5-НТ1F, для пригнічення транссудації нейронного протеїну, для лікування або профілактики мігрені та/або лікування або профілактики неспокою, страху або тривоги в ссавців, особливо у людей. Крім того, цей винахід стосується способу ак 9 77504 10 тивування рецепторів 5-НТ1F у ссавців, особливо у циклоалкіл-С1-С3-алкіл або група формули II людей, який включає введення в організм ссавця, що потребує такого активування, ефективної кількості сполуки формули І або її фармацевтично прийнятної солі з кислотою. Крім того, цей винахід стосується способу пригнічення транссудації нейронного протеїну в ссавців, особливо людей, який включає введення в R6 - водень або С1-С6-алкіл; та організм ссавця, який потребує такого пригнічення, n - ціле число від 1 до 6 включно; ефективної кількості сполуки формули І або її фаякий включає рмацевтично прийнятної солі з кислотою. 1) проведення реакції 2,6-дигалогенпіридину, Крім того, цей винахід стосується способу лівибраного з групи, до якої входять 2,6кування або профілактики мігрені в ссавців, особдибромпіридин та 2,6-дихлорпіридин, з нливо у людей, який включає введення в організм бутиллітієм для одержання 2-галоген-6-літійссавця, який потребує такого лікування або профіпіридину; і подальше лактики, ефективної кількості сполуки формули І 2) проведення реакції 2-галоген-6-літійабо її фармацевтично прийнятної солі з кислотою. піридину із заміщеним амінокарбонілпіперидином Крім того, цей винахід стосується способу ліформули IV кування неспокою, страху або тривоги в ссавців, особливо людей, який включає введення в організм ссавця, який потребує такого лікування або профілактики, ефективної кількості сполуки формули І або її фармацевтично прийнятної солі з кислотою. За іншим аспектом, цей винахід стосується сполуки формули І або її фармацевтично прийнятної солі з кислотою для застосування при активуванні рецепторів 5-HT1F, при пригніченні транссудації нейронного протеїну, при лікуванні або профілактиці мігрені та/або при лікуванні несподе кожен із R9 та R10 - метил, або R9 та R10 ракою, страху або тривоги в ссавців, особливо у люзом з атомом азоту, до якого вони приєднані, дей. Таким чином, цей винахід стосується застоутворюють азетидиніл, піролідиніл або піперидисування сполуки формули І як лікарського засобу ніл. для активування рецепторів 5-НТ1F, для пригніЗа варіантом здійснення цього аспекту даного чення транссудації нейронного протеїну, для лікувинаходу, якому віддається перевага, пропонуєтьвання або профілактики мігрені та/або для лікуся спосіб одержання 2-бром-6-(піперидин-4вання неспокою, страху або тривоги в ссавців, карбоніл)піридину формули III особливо у людей. Крім того, цей винахід стосується застосування однієї або кількох сполук формули І у виробництві лікарського засобу для активування рецепторів 5-НТ1F, для пригнічення транссудації нейронного протеїну, для лікування або профілактики мігрені та/або для лікування неспокою, страху або тривоги в ссавців, особливо у людей. Крім того, цей винахід пропонує способи лікуде R7 - С1-С3-н-алкіл або група захисту аміну; вання розладів, опосередкованих 5-НТ1F, які вклюякий включає проведення реакції 2,6чають введення в організм ссавця, який потребує дибромпіридину з н-бутиллітієм для одержання 2такого лікування, особливо в організм людини, бром-6-літійпіридину, з подальшим проведенням ефективної кількості сполуки формули І або її фареакції 2-бром-6-літійпіридину з 4-(N,N'рмацевтично прийнятної солі з кислотою. диметиламіно)карбонілпіперидином формули IV За іншим аспектом даного винаходу, запропоновано спосіб синтезу сполук формули І та нових проміжних сполук для цього синтезу. За одним варіантом здійснення, цей винахід пропонує спосіб одержання 2-галоген-6-(піперидин-4карбоніл)піридину формули III де X - бром або хлор; R8 - група захисту аміну, С1-С3-алкіл, С3-С6 із застосуванням метил-трет-бутилового простого ефіру як розчинника. Одним з аспектів цього винаходу є спосіб підвищення активації рецепторів 5-НТ1F при уникненні судинозвужувального ефекту з метою лікування 11 77504 12 різноманітних розладів, пов'язаних із послабленою ілюстративний, але необмежувальний приклад, нейротрансмісією серотоніну у ссавців. До цих термін "С1-С4-алкіл" означає нерозгалужену або розладів належать мігрень, болі загального харакрозгалужену вуглеводневу групу, що містить від 1 теру, невралгія трійчастого нерва, зубний біль або атому до 4 атомів вуглецю, в тому числі метил, болі, пов'язані з дисфункцією скроневоетил, н-пропіл, ізопропіл, н-бутил, ізобутил, вторнижньощелепного суглоба, неспокій, страх або бутил та трет-бутил. Термін "С2-С4-н-алкіл" ознатривога, розлад генералізованої тривоги, панічний чає нерозгалужені вуглеводневі групи, що містять розлад, депресія, порушення сну, синдром хронічвід 1 атому до 4 атомів вуглецю, в тому числі меної втоми, передменструальний синдром або синтил, етил, н-пропіл та н-бутил. Термін "С3-С6дром пізньої лютеальної фази, посттравматичний циклоалкіл" означає циклопропіл, циклобутан, цисиндром, втрата пам'яті, деменції, в тому числі клопентил та циклогексил. Термін "С3-С7вікова деменція, соціальна фобія, аутизм, дефіцит циклоалкіл" охоплює також циклогептил. Термін уваги з гіперактивністю, розлад поведінки, розлад "циклоалкілалкіл" означає циклоалкільні групи, імпульсивного контролю, граничний особистісний приєднані до решти молекули через алкільний розлад, обсесивно-компульсивний розлад, передмісток; необмежувальними прикладами таких груп часна еякуляція, еректильна дисфункція, булімія, є циклопропілметил, циклопропілетил, циклопронервова анорексія, алкоголізм, зловживання курінпілпропіл, циклопропілбутил, циклобутилметил, ням, мутизм та трихотиломанія. Сполуки за цим циклобутилетил, циклобутилпропіл, циклопентилвинаходом є корисними також для профілактики і метил, циклопентилетил, циклопентилпропіл, циклікування нападів мігрені. В будь-якому з цих спологексилметил, циклогексилетил та циклогексилпсобів застосовуються сполуки формули І. ропіл. Кожна алкільна, циклоалкільна та У випадках, коли розлади, які можна лікувати циклоалкілалкільна група може бути факультативагоністами серотоніну, є відомими за встановлено заміщена, як вказано в цьому описі. ними та прийнятими класифікаціями; їх класифікаТерміни "алкокси(група)", "фенілокси(група)", цію можна знайти в різноманітних довідкових дже"бензилокси(група)" та "піримідинілокси(група)" релах. Наприклад, на цей час діагностичні означають відповідно алкільну групу, фенільну принципи для ідентифікації багатьох вищезгадагрупу, бензильну групу або піримідинільну групу, них розладів описані в четвертому виданні посібкожна з яких факультативно заміщена замісником, ника з діагностики та статистики розумових розлаприєднаним через атом кисню. дів [Diagnostic and Statistical Manual of Mental Терміни "алкілтіо(група)", "фенілтіо(група)" та "бензилтіо(група)" означають відповідно алкільну Disorders, DSM-IV ], виданому Американською групу, фенільну групу або бензильну групу, кожна Асоціацією психіатрів [1994, American Psychiatric з яких факультативно заміщена замісником, приєAssociation, Washington, D.C.]. Класифікацію багаднаним через атом сірки. тьох згаданих захворювань забезпечує також МіжТермін "С1-С4-ацил" означає формільну групу народна класифікація захворювань, 10 переглянуабо С1-С3-алкільну групу, приєднану через карботе видання [International Classification of Diseases, нільну групу. Термін "С1-С4-алкоксикарбоніл" озна10th Revision, ICD-10]. Пересічному фахівцю відочає С1-С4-алкоксигрупу, приєднану через карбонімо, що існують альтернативні системи номенклальну групу. тури, нозології та класифікації, в тому числі описаТермін "галоген" означає фтор, хлор, бром або ні в DSM-FV та ICD-10, і що в процесі розвитку йод. Галогенами, яким віддається перевага, є наукової медицини виникають нові системи терміфтор, хлор та бром. Галогенами, яким віддається нології та класифікації. більша перевага, є фтор та хлор. Застосування сполуки формули І для активуТермін "гетероцикл" означає насичений або вання рецептора 5-НТ1F, для пригнічення транссуненасичений 5- або 6-членний цикл, що містить від дації нейронного протешу взагалі або, зокрема, 1 гетероатому до 3 гетероатомів, вибраних із грутакої транссудації, викликаної стимулюванням пи, до якої входять азот, кисень та сірка, причому гангліїв трійчастого нерва, та/або для лікування згаданий цикл факультативно є конденсованим із будь-якого з вищеописаних розладів, також є варібензольним циклом. Прикладами гетероциклів, що антами здійснення даного винаходу. відповідають цілям даного винаходу, є фураніл, Аналогічно, застосування сполуки формули І тіофеніл (тієніл), піроліл, піролідиніл, піридиніл, Nабо комбінації декількох сполук формули 1 у вирометилпіроліл, оксазоліл, ізоксазоліл, піразоліл, бництві лікарського засобу для активування рецеімідазоліл, триазоліл, оксадіазоліл, тіадіазоліл, птора 5-НТ1F, для пригнічення транссудації нейтіазоліл, тіазолідиніл, N-ацетилтіазолідиніл, піриронного протеїну взагалі або, зокрема, мідиніл, піразиніл, піридазиніл тощо. До конденсотранссудації, викликаної стимулюванням гангліїв ваних із бензольними циклами гетероциклів налетрійчастого нерва, та/або для лікування будь-якого жать ізохінолініл, бензоксазоліл, бензодіоксоліл, з вищеописаних розладів, також є варіантами бензотіазоліл, хінолініл, бензофураніл, бензотіоздійснення даного винаходу. феніл, індоліл тощо, кожен з яких може бути фаЗагальні хімічні терміни вживаються у цьому культативно заміщеним, а також безперечно наописі у своїх звичайних значеннях. Наприклад, лежать гетероцикли, факультативно заміщені при термін "алкіл" означає розгалужену або нерозгабензольному циклі, якщо згадані гетероцикли конлужену насичену вуглеводневу групу. Термін "нденсовані з бензольними циклами. алкіл" означає нерозгалужену алкільну групу. ТерДо гетероциклів, яким віддається перевага, мін "Сх-Су-алкіл" означає алкільну групу, яка місналежать піридиніл, індоліл, фураніл, бензофуратить в розгалуженій або нерозгалуженій вуглеводніл, тіофеніл, бензодіоксоліл та тіазолідиніл, кожен невій групі від x до у атомів вуглецю, включно. Як 13 77504 14 з яких може бути факультативно заміщеним. CIMS означає мас-спектр із хімічною іонізаЗаміщені алкіл, циклоалкіл, циклоалкілалкіл, цією. алкокси- або алкілтіогрупа означають відповідно АРСІ MS означає мас-спектр із хімічною іоніалкіл, циклоалкіл, циклоалкілалкіл, алкокси- або зацією під атмосферним тиском. алкілтіогрупу, заміщені одним або декількома заТермін "група захисту аміну" у значенні, вжимісниками, вибраними незалежно один від одного ваному в цьому описі, стосується замісників, які з групи, до якої входять галоген, гідроксил та С1звичайно застосовують для блокування або захисС3-алкоксигрупа. Ілюстративними, але необмежуту аміногрупи при проведенні реакції з іншими фувальними, прикладами є трифторметил, пентафнкціональними групами сполуки. До прикладів таторетил, 5-фтор-2-бромпентил, 3ких груп захисту аміну належать форміл, тритил, гідроксипропілокси-, 4-гідроксициклогексилокси-, 2фталімідогрупа, ацетил, трихлорацетил, хлорацеброметилтіо-, 3-етоксипропілоксигрупа, 3-етокси-4тил, бромацетил та йодацетил, блокувальні групи хлорциклогексил тощо. До варіантів заміщення, уретанового типу, наприклад, 9яким віддається перевага, належать заміщення 1флуоренілметоксикарбоніл ("FMOC") тощо, та 5 вибраними незалежно один від одного галогенааналогічні групи захисту аміну. Тип застосовуваної ми або заміщення 1-3 вибраними незалежно один групи захисту аміну не має істотного значення за від одного галогенами та 1-2 замісниками, вибраумови, що захищена (дериватизована) аміногрупа ними незалежно один від одного з групи, до якої є стійкою в умовах проведення подальших реакцій входять гідроксил та С1-С3-алкоксигрупа, або заз функціональними групами, що знаходяться в міщення 1-3 замісниками, вибраними незалежно інших положеннях молекули, і може бути відщеподин від одного з групи, до якої входять гідроксил лена в потрібний момент без порушення стану та С1-С3-алкоксигрупа, за умови, що через один і решти молекули. Додаткові приклади груп, що потой самий атом вуглецю може бути приєднаний не значаються вищезазначеним терміном, [описані в більше ніж один гідроксильний та/або алкоксильмонографії Т.У. Грін "Захисні групи в органічному ний замісник. синтезі" (T.W. Greene, "Protective Groups in Organic Терміни "заміщений феніл" та "заміщений геSynthesis", John Wiley and Sons, New York, N.Y., тероцикл" означають, що ця циклічна група в кож1991, Chapter 7), позначеній в подальших посиному разі заміщена одним або декількома галогеланнях як "Greene"]. новими замісниками, за варіантом, якому Термін "фармацевтичний" або "фармацевтичвіддається перевага, одним-п'ятьма, кожен з яких но прийнятний" при вживанні у цьому описі як привибраний незалежно від інших; або заміщена одкметник означає практично нетоксичний та пракним або декількома замісниками, за варіантом, тично нешкідливий для реципієнта. якому віддається перевага, одним-двома замісниПри вживанні терміну "фармацевтична компоками, незалежно один від одного вибраними з грузиція" додатково мається на увазі, що носій, розпи, до якої входять галоген, С1-С4-алкіл, С1-С4чинник, допоміжні речовини та сіль повинні бути алкокси- та С1-С4-алкілтіогрупа, де кожний з алкісумісними з активним інгредієнтом цієї композиції льних, алкоксильних та алкілтіозамісників може (наприклад, сполукою формули І). Для пересічного бути додатково заміщений незалежно від інших фахівця у цій галузі зрозуміло, що терміни "фарС1-С2-алкоксигрупою або одним-п'ятьма галогеномацевтична суміш" та "фармацевтична композивими замісниками, вибраними з групи, до якої вхоція" в більшості випадків є взаємозамінними, і вони дять фтор та хлор; або заміщена одним заміснивживаються саме так для цілей цієї заявки. ком, вибраним з групи, до якої входять фенілокси-, Термін "сіль кислоти" (або "сіль з кислотою") бензилокси-, фенілтіо-, бензилтіо- та піримідинілоозначає сіль сполуки формули І, одержану шляхом ксигрупа, де згадані фенілокси-, бензилокси-, фепроведення реакції сполуки формули І з неорганінілтіо-, бензилтіо- та піримідинілоксигрупа можуть чною або органічною кислотою. Приклади фармабути додатково заміщені одним-двома замісникацевтично прийнятних солей з кислотами наведено, ми, вибраними з групи, до якої входять галоген, наприклад, [в роботі Берджа та ін. (Berge S.M. et С1-С2-алкіл та С1-С2-алкоксигрупа; або заміщена al., J. Pharm. Sci., 66:1, 1977)]. Оскільки сполуки за одним замісником, вибраним з групи, до якої вхоцим винаходом є амінами, то вони мають основну дять С1-С4-ацил та С1-С4-алкоксикарбоніл, та доприроду і, відповідно, реагують із численними недатково заміщена 0-1 замісником, вибраним з груорганічними та органічними кислотами з утворенпи, до якої входять галоген, С1-С4-алкіл, С1-С4ням фармацевтично прийнятних солей кислот. алкокси- та С1-С4-алкілтіогрупа. Якщо замісником є Оскільки деякі сполуки за цим винаходом у формі галоген, то галогеновими групами, яким віддається вільних амінів при кімнатній температурі є масляперевага, є фтор, хлор та бром. нистими рідинами, перевага віддається перетвоPd2(dba)3 означає трис(дибензилідинацетон)ренню вільних амінів у фармацевтично прийнятні дипаладій(0). солі кислот із міркувань спрощення переробки та BINAP означає 2,2'-біс(дифенілфосфіно)застосування, оскільки такі солі, як правило, при 1,1'бінафтил. кімнатній температурі є твердими речовинами. DMF означає Ν,Ν-диметилформамід. Фармацевтично прийнятні солі кислот за цим HATU означає гексафторфосфат О-(7винаходом одержують, як правило, шляхом проазабензотриазол-1-іл)-N,N,N',N'ведення реакції сполуки формули І з еквімолярною тетраметилуронію. або надлишковою кількістю кислоти. АльтернатиКолідин означає триметилпіридин. вою є одержання напівсолей шляхом проведення HRMS означає мас-спектр високого розрізреакції сполуки формули І з бажаною кислотою нення. при співвідношенні кількостей сполуки та кислоти 15 77504 16 2:1. Реагенти, як правило, змішують у спільному Незважаючи на те, що всі енантіомери, діасрозчиннику, наприклад, в діетиловому простому тереомери та їх суміші корисні як агоністи 5-НТ1F, ефірі, тетрагідрофурані, метанолі, етанолі, ізопроокремим енантіомерам та окремим діастереомепанолі, бензолі тощо. Солі, як правило, випадають рам віддається перевага. Крім того, незважаючи із розчину в осад за час від приблизно 1год до на те, що всі сполуки за цим винаходом корисні як приблизно 10 діб, і їх можна відділити фільтруванагоністи 5-НТ1F, перевага віддається окремим кланям або іншими відомими способами. сам сполук. Такі класи, яким віддається перевага, До неорганічних кислот, звичайно використоописні нижче. вуваних для одержання таких солей, належать 1) R1 - феніл, заміщений феніл, гетероцикл хлористоводнева кислота, бромистоводнева кисабо заміщений гетероцикл; лота, йодистоводнева кислота, сірчана кислота, 2) R1 - заміщений феніл; фосфорна кислота тощо. До органічних кислот, 3) R1 - одно- або двозаміщений феніл, де замізвичайно використовуваних для одержання таких сники незалежно один від одного вибрані з групи, солей, належать n-толуолсульфонова кислота, до якої входять галоген, С1-С4-алкіл, С1-С3метансульфонова кислота, щавлева кислота, nалкоксигрупа, трифторметил, трифторметокси-, бромфенілсульфонова кислота, вугільна кислота, трифторетокси-, фенілокси- та бензилоксигрупа; бурштинова кислота, лимонна кислота, бензойна 4) R1 - одно- або двозаміщений феніл, де замікислота, оцтова кислота тощо. До прикладів таких сники незалежно один від одного вибрані з групи, фармацевтично прийнятних солей належать судо якої входять галоген, С1-С2-алкоксигрупа, трильфат, піросульфат, бісульфат, сульфіт, бісульфторметил, трифторметокси- та трифторетоксигфіт, фосфат, моногідрофосфат, дигідрофосфат, рупа; метафосфат, пірофосфат, хлорид, бромід, йодид, 5) R1 - дво- або три-галогензаміщений феніл; ацетат, пропіонат, деканоат, каприлат, акрилат, 6) R1 - гетероцикл або заміщений гетероцикл; форміат, ізобутират, капроат, гептаноат, пропіо7) R1 - заміщений або незаміщений гетеролат, оксалат, малонат, сукцинат, гемісукцинат, цикл, вибраний з групи, до якої входять фураніл, суберат, себацинат, фумарат, малеат, бутин-1,4тіофеніл, піроліл, піролідиніл, піридиніл, Nдіоат, гексин-1,6-діоат, бензоат, хлорбензоат, меметилпіроліл, оксазоліл, ізоксазоліл, піразоліл, тилбензоат, динітробензоат, гідроксибензоат, меімідазоліл, триазоліл, оксадіазоліл, тіадіазоліл, токсибензоат, фталат, сульфонат, ксилолсульфотіазоліл, тіазолідиніл, N-ацетилтіазолідиніл, піринат, фенілацетат, фенілпропіонат, фенілбутират, мідиніл, піразиніл, піридазиніл, ізохінолініл, бензоксазоліл, бензодіоксоліл, бензотіазоліл, хінолініл, цитрат, лактат, -гідроксибутират, гліколят, тартбензофураніл, бензотіофеніл, індоліл; рат, метансульфонат, пропансульфонат, нафта1 8) R - заміщений або незаміщений гетеролін-1-сульфонат, нафталін-2-сульфонат, манделат цикл, вибраний з групи, до якої входять піридиніл, тощо. До фармацевтично прийнятних солей, яким індоліл, бензофураніл, фураніл, тіофеніл, бензодівіддається перевага, належать солі з хлористовооксоліл та тіазолідиніл; дневою кислотою та бурштиновою кислотою. 9) R1 - заміщений або незаміщений гетероТермін "ефективна кількість" означає певну кіцикл, вибраний з групи, до якої входять піридиніл, лькість сполуки формули І, здатну активувати рефураніл, тіофеніл; цептори 5-НТір та/або пригнічувати транссудацію 10) R1 - одно-, дво- або три-галогензаміщений нейронного протеїну. гетероцикл, причому кожна галогенова група вибТермін "прийнятний розчинник" означає будьрана незалежно від інших; який розчинник (або суміш розчинників), інертний 11) R1 - одно- або двозаміщений гетероцикл, до розглядуваної реакції, який достатньою мірою де один із замісників вибраний з групи, до якої розчиняє реагенти і утворює середовище, в якому входять С1-С2-алкокси-, фенокси- та фенілтіогздійснюється бажана реакція. рупа; Обсяг цього винаходу включає всі енантіоме12) R2 - водень або С1-С3-алкіл; ри, діастереомери та їх суміші. Наприклад, сполу5 13) R2 - водень або метил; ки формули І, де R відрізняється від водню, міс14) R2 - С3-С7-циклоалкіл-С1-С3-алкіл; тять два хіральних центри, один у положенні 4 15) R2 - піразолілалкіл або N-заміщений пірапіперидинового циклу, а другий - у місці приєднан5 золілалкіл; ня R до піперидинового циклу. Як ілюстративний, 16) R2 - піразол-4-іл-етил; але необмежувальний приклад нижче показано 17) R2 - 1-(С1-С3-алкіл)піразол-4-іл-етил; чотири стереоізомери N-[6-(1,2-диметилпіперидин18) R3 - водень; 4-карбоніл)-піридин-2-іл]-ізонікотинаміду, де хіра19) R3 - метил; льні центри позначено зірочками (*), і конфігурації 20) R3 - етил; R та S відповідають поданим позначенням. 21) R4 - водень; 22) R4 - галоген; 23) R4 - фтор або хлор; 4 24) R - С1-С3-алкіл; 25) R4 - метил; 26) R5 - водень; 27) R5 - С1-С3-алкіл; 28) R5 - метил; 29) R2 - водень або метил, а кожний з R3, R4 і 5 R - водень; 17 77504 18 30) R2 - водень або метил, R3 - метил, а кож9), яким віддається перевага, з класами 25) та 26), ний з R4 та R5 - водень; яким віддається перевага; 31) R1 - одно- або двозаміщений феніл, де за52) комбінація будь-якого з класів 1), 2), 8) або місники незалежно один від одного вибрані з гру9), яким віддається перевага, з класами 25) та 28), пи, до якої входять галоген, С1-С2-алкоксигрупа, яким віддається перевага; трифторметил, трифторметокси- та трифтореток53) комбінація будь-якої з комбінацій 46) - 52), сигрупа, R4 - водень або метил, а кожний з R3, R4 яким віддається перевага, з класами 12) та 18), та R5 - водень; яким віддається перевага; 32) R1 - заміщений або незаміщений гетеро54) комбінація будь-якої з комбінацій 46) - 52), цикл, вибраний з групи, до якої входять піридиніл, яким віддається перевага, з класами 12) та 19), індоліл, бензофураніл, фураніл, тіофеніл, бензодіяким віддається перевага; оксоліл та тіазолідиніл, R2 - водень або метил, а 55) комбінація будь-якої з комбінацій 46) - 52), кожний з R3, R4 і R5 - водень; яким віддається перевага, з класами 13) та 18), 33) R1 - заміщений феніл, R2 - водень або меяким віддається перевага; тил, а кожний з R3, R4 і R5 - водень; 56) комбінація будь-якої з комбінацій 46) - 52), 34) R1 - заміщений феніл, R2 - водень або меяким віддається перевага, з класами 13) та 19), тил, R3 - метил, а кожний з R4 і R5 - водень; яким віддається перевага; 35) R1 - одно- або двозаміщений феніл, де всі 57) комбінація будь-якої з комбінацій 46) - 52), замісники незалежно один від одного вибрані з яким віддається перевага, з класами 14) та 18), групи, до якої входять галоген, С1-С2-алкоксигрупа, яким віддається перевага; трифторметил, трифторметокси- та трифтореток58) комбінація будь-якої з комбінацій 46) - 52), сигрупа, R2 - водень або метил, R3 - метил, а кожяким віддається перевага, з класами 14) та 19), ний з R4 і R5 - водень; яким віддається перевага; 36) R1 - дво- або три-галогензаміщений феніл, 59) комбінація будь-якої з комбінацій 46) - 52), R2 - водень або метил, а кожний з R3, R4 і R5 - вояким віддається перевага, з класами 15) та 18), день; яким віддається перевага; та 37) R1 - дво- або три-галогензаміщений феніл, 60) комбінація будь-якої з комбінацій 46) - 52), R2 - водень або метил, R3 - метил, а кожний з R4 і яким віддається перевага, з класами 15) та 19), R5 - водень; яким віддається перевага. 38) R1 - заміщений або незаміщений гетероДодатково до сполук, поданих у прикладах, цикл, вибраний з групи, до якої входять піридиніл, обсяг даного винаходу додатково ілюструють наіндоліл, бензофураніл, фураніл, тіофеніл, бензодіведені нижче сполуки: 2 3 оксоліл, та тіазолідиніл, R - водень або метил, R 1) 4-фтор-N-[6-(1-метил-піперидин-4-карбоніл)-метил, а кожний з R4 і R5 - водень; піридин-2-іл]-бензамід 39) будь-яка сполука, наведена в прикладах; 2) 2,4-дифтор-N-[6-(1-метил-піперидин-440) сполука - сіль із кислотою; карбоніл)-піридин-2-іл]-бензамід 41) сполука - гідрохлорид; 3) N-[6-(1-метил-піперидин-4-карбоніл)42) сполука - дигідрохлорид. піридин-2-іл]-бензамід 43) сполука - гемісукцинат; 4) 2-хлор-4-фтор-Ν-[6-(1-метил-піперидин-444) сполука - сукцинат; та карбоніл)-піридин-2-іл]-бензамід 45) сполука - дисукцинат. 5) 2-хлор-N-[6-(1-метил-піперидин-4-карбоніл)Мається на увазі, що вищезазначені класи піридин-2-іл]-бензамід можна комбінувати з утворенням додаткових кла6) 2,4,6-трифтор-Ν-[6-(піперидин-4-карбоніл)сів, яким віддається перевага, наприклад, шляхом піридин-2-іл]-бензамід комбінування двох або кількох замісників із числа 7) [6-(1-метил-піперидин-4-карбоніл)-піридинтих, яким віддається перевага. Ілюстративними 2-іл]-амід 1Н-5-трифторметил-індол-3-карбонової прикладами комбінацій класів, яким віддається кислоти перевага, з утворенням додаткових класів, яким 8) N-[6-(1-метил-піперидин-4-карбоніл)віддається перевага, є перелічені нижче комбінапіридин-2-іл]-2-трифторметокси-бензамід ції: 9) [6-(1-метил-піперидин-4-карбоніл)-піридин46) комбінація будь-якого з класів 1), 2), 8) або 2-іл]-амід 3-бромтіофен-2-карбонової кислоти 9), яким віддається перевага, з класами 21) та 26), 10) 4-фтор-N-[6-(1-метил-піперидин-4яким віддається перевага; карбоніл)-піридин-2-іл]-2-трифторметил-бензамід 47) комбінація будь-якого з класів 1), 2), 8) або 11) 2,4,6-трифтор-N-[6-(3-метил-піперидин-49), яким віддається перевага, з класами 21) та 27), карбоніл)-піридин-2-іл]-бензамід яким віддається перевага; 12) 2-хлор-6-фтор-N-[6-(1-метил-піперидин-448) комбінація будь-якого з класів 1), 2), 8) або карбоніл)-піридин-2-іл]-бензамід 9), яким віддається перевага, з класами 21) та 28), 13) 2,4,6-трифтор-N-метил-N-[6-(1-метиляким віддається перевага; піпервдин-4-карбоніл)-піридин-2-іл]-бензамід 49) комбінація будь-якого з класів 1), 2), 8) або 14) 2,4,6-трифтор-N-метил-N-[6-(піпервдин-49), яким віддається перевага, з класами 23) та 26), карбоніл)-піридин-2-іл]-бензамід яким віддається перевага; 15) 2,4,6-трифтор-N-метил-N-[6-(1-метил50) комбінація будь-якого з класів 1), 2), 8) або піперидин-4-карбоніл)-піридин-2-іл]-бензамід 9), яким віддається перевага, з класами 23) та 28), 16) 2,4,6-трифтор-N-етил-N-[6-(1-метиляким віддається перевага; піперидин-4-карбоніл)-піридин-2-іл]-бензамід 51) комбінація будь-якого з класів 1), 2), 8) або 17) 2-хлор-4-фтор-N-[6-(піпервдин-4-карбоніл) 19 77504 20 піридин-2-іл]-бензамід 2-іл]-амід циклогексанкарбонової кислоти 18) 2-хлор-4-фтор-N-метил-N-[6-(1-метил46) N-[6-(1-метил-піперидин-4-карбоніл)піпервдин-4-карбоніл)-піридин-2-іл]-бензамід піридин-2-іл]-3-феніл-пропіонамід 19) [6-(1-метил-піперидин-4-карбоніл)-піридин47) 2,6-дифтор-N-[6-(1-метил-піпервдин-42-іл]-амід 1Н-5-фтор-індол-3-карбонової кислоти карбоніл)-піридин-2-іл]-бензамід 20) [6-(1-метил-піперидин-4-карбоніл)-піридин48) 2-етокси-N-[6-(1-метил-піперидин-42-іл]-амід циклопропанкарбонової кислоти карбоніл)-піридин-2-іл]-нікотинамід 21) 3-метил-N-[6-(1-метил-піперидин-449) N-[6-(1-метил-піперидин-4-карбоніл)карбоніл)-піридин-2-іл]-бутанамід піридин-2-іл]-2-фенокси-нікотинамід 22) [6-(1-метил-піперидин-4-карбоніл)-піридин50) [6-(1-метил-піперидин-4-карбоніл)-піридин2-іл]-амід тіофен-2-карбонової кислоти 2-іл]-амід 3-ацетил-тіазолідин-4-карбонової кисло23) [6-(1-метил-піперидин-4-карбоніл)-піридинти 2-іл]-амід фуран-2-карбонової кислоти 51) N-[6-(1-метил-піперидин-4-карбоніл)24) 2-хлор-N-[6-(1-метил-піперидин-4піридин-2-іл]-2-фенілсульфаніл-нікотинамід карбоніл)-піридин-2-іл]-бензамід 52) 5-метокси-N-[6-(1-метил-піперидин-425) [6-(1-метил-піперидин-4-карбоніл)-піридинкарбоніл)-піридин-2-іл]-2-(2,2,2-трифтор-етокси)2-іл]-амід фуран-3-карбонової кислоти бензамід 26) 3,4-дифтор-N-[6-(1-метил-піперидин-453) 2-метокси-6-метил-N-[6-(1-метилкарбоніл)-піридин-2-іл]-бензамід тперидин-4-карбоніл)-піридин-2-іл]-бензамід 27) N-[6-(1-метил-піперидин-4-карбоніл)54) метиловий складний ефір N-[6-(1-метилпіридин-2-іл]-ізонікотинамід піперидин-4-карбоніл)-піридин-2-іл]28) 2-метил-N-[6-(1-метил-піперидин-4терефталамової кислоти карбоніл)-піридин-2-іл]-бензамід 55) [6-(1-метил-піперидин-4-карбоніл)-піридин29) 2-бром-N-[6-(1-метил-піперидин-42-іл]-амід циклобутанкарбонової кислоти карбоніл)-піридин-2-іл]-бензамід 56) 2-(2-хлор-1,1,2-трифтор-етокси)-N-[6-(130) [6-(1-метил-піперидин-4-карбоніл)-піридинметил-піперидин-4-карбоніл)-піридин-2-іл]2-іл]-амід тіофен-3-карбонової кислоти бензамід 31) 2-фтор-N-[6-(1-метил-піперидин-457) 2-хлор-N-[6-(1-метил-піперидин-4карбоніл)-піридин-2-іл]-ізонікотинамід карбоніл)-піридин-2-іл]-бензамід 32) 4-хлор-2-метокси-N-[6-(1-метил-піперидин58) 2,5-дифтор-N-[6-(1-метил-піперидин-44-карбоніл)-піридин-2-іл]-бензамід карбоніл)-піридин-2-іл]-бензамід 33) 2-етокси-N-[6-(1-метил-піперидин-459) 3,4-дифтор-N-[6-(1-метил-піперидин-4карбоніл)-піридин-2-іл]-бензамід карбоніл)-піридин-2-іл]-бензамід 34) N-[6-(1-метил-піпервдин-4-карбоніл)60) 4-фтор-N-[6-(1-метил-піперидин-4піридин-2-іл]-2-фенокси-бензамід карбоніл)-піридин-2-іл]-2-трифторметил-бензамід 35) 5-хлор-2-метокси-N-[6-(1-метил-піперидин61) 2-фтор-N-[6-(1-метил-піперидин-44-карбоніл)-піридин-2-іл]-бензамід карбоніл)-піридин-2-іл]-6-трифторметил-бензамід 36) 2-метокси-N-[6-(1-метил-піперидин-462) 2,3,4-трифтор-Ν-[6-(1-метил-піперидин-4карбоніл)-піридин-2-іл]-4-метилсульфанілкарбоніл)-піридин-2-іл]-бензамід бензамід 63) 2,4,5-трифтор-N-[6-(1-метил-піперидин-437) [6-(1-метил-піперидин-4-карбоніл)-піридинкарбоніл)-піридин-2-іл]-бензамід 2-іл]-амід 2,3-дигідро-бензофуран-7-карбонової 64) [6-(1-метил-піпервдин-4-карбоніл)-пірвдинкислоти 2-іл]-амід 3-хлор-тіофен-2-карбонової кислоти 38) 2-бензилокси-N-[6-(1-метил-піперидин-465) 2,6-дихлор-N-[6-(1-метил-піперидин-4карбоніл)-піридин-2-іл]-бензамід карбоніл)-піридин-2-іл]-бензамід 39) N-[6-(1-метил-піперидин-4-карбоніл)66) 2-фтор-N-[6-(1-метил-піперидин-4піридин-2-іл]-2-пропокси-бензамід карбоніл)-піридин-2-іл]-4-трифторметил-бензамід 40) [6-(1-метил-піперидин-4-карбоніл)-піридин67) [6-(1-метил-піперидин-4-карбоніл)-піридин2-іл]-амід 2,2-дифтор-бензо[1,3]діоксол-42-іл]-амід циклопентанкарбонової кислоти карбонової кислоти 68) N-[6-(1-метил-піперидин-4-карбоніл)41) 4-метокси-2-(2-метокси-етокси)-N-[6-(1піридин-2-іл]-нікотинамід метил-піперидин-4-карбоніл)-піридин-2-іл]Перевага віддається випадкам, коли ссавцем, бензамід який підлягає лікуванню шляхом застосування 42) 5-бром-2-метокси-N-[6-(1-метил-піперидинсполук за цим винаходом, є людина. 4-карбоніл)-піридин-2-іл]-бензамід Сполуки за цим винаходом можна синтезувати 43) 2-(4,6-диметокси-піримідин-2-ілокси)-N-[6шляхом конденсації 6-літіоаніону 2-хлорпіридину з (1-метил-піперидин-4-карбоніл)-піридин-2-іл]метоксиметиламідом 1-заміщеної або N-захищеної бензамід піперидин-4-карбонової кислоти та подальшої за44) N-[6-(1-метил-піперидин-4-карбоніл)міни 2-галогену на аміногрупу, з подальшою кон1 піридин-2-іл]-бутанамід денсацією з відповідним R -ацилзаміщеним гало45) [6-(1-метил-піперидин-4-карбоніл)-піридингенангідридом (дивись Схему 1). 21 77504 22 амінопіридиноїлпіперидину з бажаним R'ацилгалогенангідридом. Як правило, суміш проміжного 2-амінопіридиноїлпіперидину, бажаного R'ацилхлорангідриду, акцептора протонів, наприклад, триетиламіну, діізопропілетиламіну тощо, у прийнятному розчиннику, наприклад, у дихлорметані, THF, МТВЕ тощо, перемішують при температурі, близькій до кімнатної, до завершення реакції, наприклад, протягом приблизно 4год. Потім можна додати сильну основу, наприклад, гідроксид натрію, для нейтралізації реакційної суміші, і очистити кінцевий продукт із застосуванням звичайних процедур обробки. Якщо азот піперидинілу захищений групою захисту аміну, цю групу видаляють після проведення реакції з ацилгалогенангідридом. Цей азот піперидинілу може потім залишатися як вторинний амін у сполуках за цим винаходом, де R2 - водень, або його можна додатково алкілувати за відомими Придатні для виконання реакцій за стадіями способами для одержання сполук за цим винахоцієї схеми умови добре відомі в галузі, а відповідні дом, де R2 є С1-С3-алкіл, С3-С6-циклоалкіл-С1-С3заміни розчинників та реагентів зрозумілі для пеалкіл, або група формули II ресічного фахівця. Наприклад, що стосується початкової конденсації, дивись [J.C.S. Perkin T. (24), 3597-3600 (1997)]. За типовою схемою, 2-хлорпіридин активують шляхом проведення реакції із сумішшю нбутиллітію та 2-диметиламіноетанолу у прийнятному розчиннику, наприклад, у гексані, при -78°С. . Реакція, як правило, завершується приблизно за 7 1год. Потім додають метоксиметиламід 1-R Хоча у галузі добре відомі різні альтернативні заміщеної піперидин-4-карбонової кислоти в оргаспособи алкілування, одну з типових реакцій алкінічному розчиннику, наприклад, у гексані, і перелування виконують шляхом відновлювального мішують, одержуючи проміжний продукт - 2алкілування вторинного аміну прийнятним альдехлорпіридиноїлпіперидин. Реакція, як правило, гідом, органічною кислотою, наприклад, льодяною завершується приблизно за 1год. Якщо бажаним оцтовою кислотою або трифтороцтовою кислотою, 2 замісником R у кінцевому продукті є водень, то та відновлювачем, наприклад, ціаноборгідридом азот піперидинілу слід спочатку блокувати групою натрію або триацетоксиборгідридом натрію, у призахисту аміну; її введення та подальше відщепйнятному розчиннику, наприклад, у метанолі або лення виконують за стандартними методиками, дихлорметані, причому прийнятним альдегідом є добре відомими в галузі. альдегід, який при згаданій реакції забезпечує У типових випадках першу реакцію конденсації утворення бажаного замісника R2. [Michael В. гасять доданням води, і суміш кілька разів екстраSmith, Jerry March, March's Advanced Organic гують прийнятним розчинником, наприклад, етиChemistry: Reactions, Mechanisms and Structure, 5th лацетатом. Одержаний розчин проміжного 2Ed., pp.1185-1187 (sec. 16-12), John Wiley & Sons, хлорпіридиноїл-піперидину можна потім висушити, Inc., New York, 2001]. Як ілюстративний приклад, наприклад, над безводним сульфатом натрію, видля синтезу сполук, де R2 є метил, бажаним альпарити, а потім частково очистити, наприклад, дегідом є формальдегід, а для синтезу сполук, де хроматографією на колонці із силікагелем. R2 є 3-циклопентилпропіл, бажаним альдегідом є Потім цей проміжний 23-циклопентилпропаналь. хлорпіридиноїлпіперидин вводять у реакцію з бенСполуки за цим винаходом, де R3 - метил або зофеноніміном у присутності етил, можна синтезувати за Схемою 2. трис(дибензилідинацетон)-дипаладію(0) (Ра2(dbа)3) як каталізатора та 2,2'біс(дифенілфосфіно)-1,1'-бінафтилу (BINAP) та трет-бутилату натрію у прийнятному розчиннику, наприклад, у толуолі, при температурі кипіння, з метою заміни галогену бензофеноніміногрупою. Після відповідної обробки цей проміжний продукт звичайно вводять у реакцію з хлористоводневою кислотою у прийнятному розчиннику, наприклад, тетрагідрофурані, і потім очищають, одержуючи відповідний проміжний 2амінопіридиноїлпіперидин. На кінцевій стадії процесу за Схемою І вводять у сполуку групу R1 з утворенням амідного зв'язку шляхом проведення реакції проміжного 2 23 Реагенти структури R3-амінокарбоніл-R1 легко одержувати шляхом проведення реакції відповідного R1-ацилгалогенангідриду з бажаним аміном (метиламіном, етиламіном, пропіламіном або ізопропіламіном, наприклад, з 2Μ розчином такого аміну) у прийнятному розчиннику, наприклад, у метанолі. Такі методики широко застосовуються та добре відомі в галузі. Проміжний 2-бромпіридиноїлпіперидин синтезують шляхом проведення реакції спочатку 2,6дибромпіридину, розчиненого у прийнятному органічному розчиннику, наприклад, у дихлорметані, за варіантом, якому віддається перевага, в атмосфері азоту, з 1,1екв. н-бутиллітію, розчиненого у прийнятному розчиннику, наприклад, у гексані, за варіантом, якому віддається перевага, при низькій температурі, наприклад, -78°С. Потім до реакційної суміші додають прийнятний 1-R7-заміщений-Nметокси-N-метил-піперидин-4-карбоксамід. Потім реакцію гасять доданням основи, наприклад, водного розчину NaOH. Одержаний проміжний продукт можна потім очистити стандартними способами, наприклад, шляхом екстракції, видалення розчинника та подальшої хроматографії. Проміжний 2-бромпіридиноїлпіперидин в атмосфері N2 вводять в реакцію з бажаною сполукою, відповідно метиламінокарбоніл-R1, етиламінокарбоніл-R1 або пропіламінокарбоніл-R1, у присутності трис(дибензилідинацетон)дипаладію(0) (Рd2(dbа)3), 2,2'біс(дифенілфосфіно)-1,1'-бінафтилу (BINAP), та трет-бутилату натрію, шляхом змішування реагентів у прийнятному розчиннику, наприклад, у зневодненому толуолі. Реакційну суміш, як правило, нагрівають протягом кількох годин, наприклад, при приблизно 85°С протягом 16год. Можна додавати додатково С1-С2-алкіламінокарбоніл-R1, трис(дибензилідинацетон)-дипаладій(0) (Pd2(dba)3), 2,2'-біс(дифенілфосфіно)-1,1'-бінафтил (BINAP) та трет-бутилат натрію, і продовжувати реакцію протягом аналогічного періоду часу з метою підвищення виходу продукту. Кінцевий продукт потім очищають звичайними способами. Сполуки за цим винаходом, де R4 або R5 відрізняються від водню, можна синтезувати за вищенаведеними схемами із застосуванням відповідних заміщених 2-галогенпіридинів та заміщених піперидинілів як вихідних реагентів. За одним із варіантів, яким віддається перевага, для синтезу проміжного 2бромпіридиноїлпіперидину застосовують нову реакцію конденсації з метою забезпечення високоселективного монозаміщення, а також підвищення виходу бажаного проміжного продукту з меншим вмістом домішок. За іншим варіантом, якому віддається перевага, для перетворення проміжного 2бромпіридиноїлпіперидину в проміжний 2амінопіридиноїлпіперидин при підготовці кінцевої реакції конденсації застосовують більш сприятливу реакцію (дивись Схему 3.) 77504 24 Новий проміжний продукт Ν,Νдиметиламінокарбонілпіперидин - одержують із високим виходом із похідної R7-ізоніпікотинової кислоти шляхом проведення реакції згаданої кислоти з оксалілхлоридом у присутності каталітичної кількості диметилформаміду (DMF) у прийнятному розчиннику, наприклад, у дихлорметані, тетрагідрофурані, дихлоретані, діетиловому простому ефірі тощо, та концентрування для одержання похідної ізоніпекотилхлориду. Одержану речовину потім повторно суспендують у прийнятному розчиннику, наприклад, у тетрагідрофурані, дихлорметані, дихлоретані, діетиловому простому ефірі тощо, і вводять в реакцію з диметиламіном у присутності акцептора протонів, наприклад, ненуклеофільної органічної основи, наприклад, триетиламіну, діізопропілетиламіну тощо, і потім очищають продукт реакції, одержуючи проміжний Ν,Νдиметиламінокарбонілпіперидин. Ν,Ν-диметилкарбонілпіперидини як проміжні продукти за цим винаходом мають істотні переваги у порівнянні з відомими N-захищеними метоксиметиламідами піперидин-4-карбонової кислоти (реагентами Вайнреба - Weinreb); ці переваги полягають у тому, що нові проміжні продукти є негігроскопічними і забезпечують неочікувану підвищену хемоселективність та вихід у подальшій реакції конденсації у порівнянні з реакцією конденсації, виконуваною з застосуванням відповідних реагентів Вайнреба. Це має місце, зокрема, у випадку, коли (як, наприклад, у варіанті, якому віддається перевага) як розчинник застосовується толуол або метил-трет-бутиловий простий ефір (МТВЕ). За варіантом, якому віддається ще більша перевага, як розчинник застосовується МТВЕ. Потім 2,6-дибромпіридин активують шляхом проведення реакції з н-бутиллітієм в охолодженому МТВЕ або толуолі, за варіантом, якому віддається перевага, в МТВЕ, і одержують проміжну сполуку - бромлітійпіридин. Додають проміжний Ν,Ν-диметиламінокарбонілпіперидин і перемішують суміш, наприклад, протягом приблизно 1год при температурі в межах від приблизно -100°С до приблизно -60°С, за варіантом, якому віддається перевага, при приблизно -75°С. За варіантом, якому віддається перевага, реакцію сполучення 25 77504 26 виконують при співвідношенні кількостей 2,6клад, 1-метил-4-(N,N'дибромпіридину до Ν,Νдиметиламіно)карбонілпіперидин є твердою речодиметиламінокарбонілпіперидину від приблизно виною з низькою температурою плавлення, яка 1,0 до приблизно 2,0, за варіантом, якому віддалегко кристалізується та має відносно низьку гігється більша перевага, при співвідношенні від роскопічність, зокрема, у порівнянні з відповідним приблизно 1,3 до приблизно 1,7, за варіантом, реагентом Вайнреба. Проте при поглинанні води якому віддається найбільша перевага, при співвідкристалічна форма цієї сполуки перетворюється у ношенні приблизно 1,5. Потім реакційну суміш гамасло. Для порівняння слід вказати, що 1-метил-4сять насиченим розчином хлориду амонію при (піролідинілкарбоніл)піперидин також є твердою температурі від приблизно -20°С до приблизно речовиною з низькою температурою плавлення, 10°С, після чого нейтралізують хлористоводневою яка легко кристалізується, але є ще менш гігроскокислотою та додають додаткову кількість води. пічною, ніж 1-метил-4-(N,N'Одержаний продукт можна потім виділити за типодиметиламіно)карбонілпіперидин, і утворює більш вими методиками обробки; необмежувальний пристабільні кристали, які зберігають кристалічну фоклад такої методики включає екстракцію водної рму навіть в разі поглинання деякої кількості води. фази дихлорметаном, промивання органічних 1-метил-4-(піперидин-1-іл)карбонілпіперидин, як фракцій підкисленою водою (наприклад, при рН 2), правило, залишається у формі масла. нейтралізацію водного екстракту гідроксидом наВ іншому варіанті способу за цим винаходом, у трію, подальшу екстракцію етилацетатом, висушувищевказаному процесі за Схемою 3 замість 2,6вання органічної фази, наприклад, над сульфатом дибромпіридину можна застосувати 2,6магнію, та концентрування, наприклад, шляхом дихлорпіридин в аналогічних умовах проведення випарювання, випарювання в роторному випарниреакції для одержання відповідного проміжного 2ку тощо. хлорпіридиноїлпіперидину. За іншим варіантом, якому віддається переваЗа ще одним варіантом нового способу синтега, 4-(N,N'-диметиламіно)карбонілпіперидин у зу, якому віддається перевага, як розчинник можна Схемі 3 замінюють заміщеним амінокарбонілпіпезастосувати МТВЕ або толуол, що забезпечує доридином формули IV даткове підвищення хемоселективності в реакції конденсації. Найбільша перевага віддається застосуванню МТВЕ як розчинника. У подальшому варіанті здійснення способу за цим винаходом наступна стадія синтезу передбачає заміну галогену на аміногрупу шляхом проведення реакції проміжного 2-бром-6(піперидинілкарбоніл)піридину, описаного вище, з аміаком та етиленгліколем у присутності оксиду міді (І) як каталізатора. За варіантом, якому віддається перевага, цю реакцію проводять в автоклаві; типові умови проведення включають температуру де R8, R9 та R10 відповідають поданим вище від приблизно 80°С до приблизно 110°С, за варіавизначенням. Серед сполук формули IV перевага нтом, якому віддається перевага, приблизно віддається сполукам, де кожний з R9 та R10 - метил 100°С, та тиск від приблизно 45фунт/дюйм2 до або де R9 та R10 разом з атомом азоту, до якого приблизно 60фунт/дюйм2 (від приблизно 310кПа вони приєднані, утворюють піролідиніл. Особлива до приблизно 414кПа), у типових випадках прибперевага віддається сполукам, де R9 та R10 разом лизно 50фунт/дюйм2 (приблизно 345кПа). Потім з атомом азоту, до якого вони приєднані, утворюаміак видаляють з органічної фракції шляхом вають піролідиніл. куумування. Потім додають водний розчин гідрокСполуки, де R9 та R10 разом з атомом азоту, сиду натрію і екстрагують суміш прийнятним оргадо якого вони приєднані, утворюють азетидиніл, нічним розчинником, наприклад, метил-третпіролідиніл або піперидиніл, можна синтезувати бутиловим ефіром або дихлорметаном, і сушать тими самими способами, як їхні Ν,Ν'екстракт, наприклад, над сульфатом магнію. диметилвмісні аналоги, при заміні диметиламінвЗа варіантом, якому віддається перевага, немісного реагенту, описаного вище, відповідно азеочищений проміжний 2-аміно-6-(1-R7-піперидин-4тидином, піролідином або піперидином. ілкарбоніл)піридин додатково очищають шляхом 4-(піролідинілкарбоніл)піперидини як реагенти кристалізації хлористоводневої солі з подальшою мають додаткову перевагу перед 4-(N,N'нейтралізацією цієї солі гідроксидом натрію, екстдиметиламіно)карбонілпіперидинами, яка полягає ракцією органічним розчинником та видаленням в тому, що вони менш гігроскопічні та утворюють розчинника. більш стабільні кристали, що підвищує зручність Кінцеву реакцію конденсації виконують, як пороботи з реагентами. Аналогічно 4-(N,N'казано на Схемі 1. диметиламіно)карбонілпіперидинам, 4Описані нижче підготовчі синтези та приклади (піролідинілкарбоніл)піперидини забезпечують є ілюстративними, і їх жодним чином не слід розгнеочікуване значне покращення хемоселективнослядати як такі, що обмежують обсяг винаходу. ті та виходу в подальших реакціях конденсації у Підготовчі синтези порівнянні з реакціями, виконуваними із застосуванням відповідних реагентів Вайнреба. Як ілюстративний, але необмежувальний при 27 1. 2-хлор-6-(1-метилпіперидин-4ілкарбоніл)піридин 2-хлорпіридин (1г, 8,8ммоль) додавали до суміші н-бутиллітію (1,6Μ в гексані) (22мл, 35,2ммоль) та 2-диметиламіноетанолу (1,56г, 17,6ммоль) у гексані (20мл при -78°С) і перемішували протягом 1год. Потім додавали метоксиметиламід 1-метил-піперидин-4-карбонової кислоти (3,2г, 17,6ммоль) у гексані (5мл), і перемішували суміш протягом 1год. Гасили реакційну суміш водою і двічі екстрагували етилацетатом, сушили органічний шар над безводним сульфатом натрію, випарювали розчинник і очищали залишок хроматографією на колонці із силікагелем, одержуючи приблизно 1г вказаного в заголовку продукту. 2. 2-Аміно-6-(1-метилпіперидин-4ілкарбоніл)піридин Нагрівали суміш 2-хлор-6-(1-метилпіперидин4-ілкарбоніл)піридину (800мг, 3,35ммоль), бензофеноніміну (729мг, 4,02ммоль), трис(дибензилідинацетон)-дипаладію(0) (61мг, 0,067ммоль), рацемічного 2,2'біс(дифенілфосфіно)-1,1'-бінафтилу (83ммоль, 0,134ммоль) та трет-бутилату натрію (451мг, 4,69ммоль) у толуолі (100мл) зі зворотним холодильником протягом 2год. Випарювали розчинник та повторно розчиняли залишок в етилацетаті, промивали водою, сушили над безводним сульфатом натрію, випарювали розчинник і очищали залишок хроматографією на колонці із силікагелем, одержуючи приблизно 1г проміжного бензофеноніміну. Додавали 1-н. НСl (12мл) до розчину згаданого продукту в THF (50мл) і перемішували при кімнатній температурі протягом 2год. Потім додавали 25мл 1-н. НСl і двічі екстрагували сумішшю гексану з етилацетатом (2:1). Підлуговували водну фазу, екстрагували її дихлорметаном, сушили екстракт над безводним сульфатом натрію, 77504 28 випарювали розчинник і очищали залишок хроматографією на колонці із силікагелем (елюент суміш етилацетат:2Μ ΝΗ3 у метанолі, 90:10), одержуючи приблизно 600мг вказаного в заголовку продукту. Приклади 1. Дигідрохлорид 4-фтор-N-[6-(1-метилпіперидин-4-ілкарбоніл)-піридин-2-іл]-бензаміду Суміш 2-аміно-6-(1-метилпіперидин-4ілкарбоніл)піридину (0,150г), 4фторбензоїлхлориду (0,218г), триетиламіну (0,192мл) та дихлорметану перемішували при кімнатній температурі протягом 4год. Додавали 1-н. водний розчин NaOH для підлуговування реакційної суміші. Екстрагували суміш дихлорметаном, сушили органічну фазу над безводним сульфатом натрію, випарювали розчинник і очищали залишок HPLC, одержуючи вільну основу вказаної в заголовку сполуки. Цю вільну основу повторно розчиняли в діетиловому ефірі і додавали надлишок 1Μ НСI. Випарювали розчинник і сушили залишок у вакуумі, одержуючи 80мг вказаної в заголовку сполуки. Т.пл. 75-80°С; HRMS: 342,1605 (знайдено). (Обчислено 342,1618). 2. Дигідрохлорид 2,4-дифтор-N-[6-(1-метилпіперидин-4-ілкарбоніл)-піридин-2-іл]-бензаміду За способом, аналогічним описаному вище у Прикладі 1, із застосуванням 2,4дифторбензоїлхлориду одержали вказану в заголовку сполуку. Т.пл. 108-110°С; мас-спектр (електророзпилення) m/z=360. 3. 2-хлор-4-фтор-N-[6-(1-метил-піперидин-4ілкарбоніл)-піридин-2-іл]-бензамід За способом, аналогічним описаному вище у Прикладі 1, із застосуванням 2-хлор-4фторбензоїлхлориду одержали вказану в заголовку сполуку. Вільна основа: т.пл. 53-55°С; HRMS: 376,1233 (знайдено). (Обчислено. 376,1228). Дигідрохлорид: т.пл. 243-245°С; HRMS: 376,1238 (знайдено). (Обчислено 376,1228). 4. Моногідрохлорид 2-хлор-6-фтор-N-[6-(1метил-піперидин-4-ілкарбоніл)-піридин-2-іл]бензаміду 29 77504 30 (d, 1H), 7,90 (dd, 1H), 7,81 (d, 1H), 7,76 (dd, 1H), 7,45 (m, 3H), 3,63 (m, 1H), 2,90 (m, 2Н), 2,29 (s, 3Н), 2,07 (m 2H), 1,85 (m, 4H). Одержану вільну основу розчиняли в дихлорметані та додавали 1-н. НСI в діетиловому простому ефірі (0,85мл), випарювали і сушили у вакууЗмішували 2-аміно-6-(1-метилпіперидин-4мі, одержуючи згаданий моногідрохлорид (0,354г). ілкарбоніл)піридин (0,18г, 0,85ммоль), 2-хлор-67. Гідрохлорид N-[6-(1-метил-піперидин-4фтор-бензоїлхлорид (0,318г, 1,65ммоль) та 1,4ілкарбоніл)-піридин-2-іл]-бензаміду діоксан (10мл). Перемішували та нагрівали суміш зі зворотним холодильником. Через 2год реакційну суміш охолоджували до кімнатної температури і концентрували. Вносили суміш у колонку з SCX (10г), промивали метанолом і елюювали 2Μ розчином аміаку в метанолі. Елюат концентрували, і одержували вільну основу вказаної в заголовку сполуки (0,30г, 94%) у вигляді масла. Це масло За способом, аналогічним описаному вище у розчиняли в метанолі (5мл) і обробляли хлоридом Прикладі 1, із застосуванням бензоїлхлориду одеамонію (0,045г, 0,85ммоль). Одержану суміш коцержали вільну основу вказаної в заголовку сполуки. нтрували і сушили у вакуумі, одержуючи вказану в Цю вільну основу знов розчиняли в діетиловому заголовку сполуку. HRMS: знайдено m/z 376,1237; простому ефірі і додавали 1Μ НСI у молярному обчислено m/z 376,1228; т.пл. 155°С (з розкласпіввідношенні 1:1. Випарювали розчинник, і судом). шили залишок у вакуумі, одержуючи вказану в 5. Гідрохлорид 2-бром-N-[6-(1заголовку сполуку. HRMS: 324,1697 (знайдено). метилпіперидин-4-ілкарбоніл)-піридин-2(Обчислено 324,1712). іл]бензаміду 8. Моногідрохлорид 2,4,6-трифтор-N-[6-(1метил-піперидин-4-ілкарбоніл)-піридин-2-іл]бензаміду Для одержання вільної основи вказаної в заголовку сполуки використовували спосіб, аналогічний описаному в Прикладі 1, із застосуванням 2бромбензоїлхлориду. Цей вихідний матеріал (104,8мг) розчиняли в метанолі і додавали 1екв.т (13,9мг) NH4CI. Реакційну суміш обробляли ультразвуком при кімнатній температурі протягом 15хв, після чого концентрували і сушили суміш, одержуючи вказану в заголовку сполуку у вигляді білої твердої речовини. Мас-спектр (іонне розпилення): m/z=402,1 (М+1); 1Н ЯМР (d6-DMSO, млн.-1) 11,15 (1Н, s), 8,37 (1Н, bs), 8,07 (1Н, t, J=7,69, 8,05, 15,74Гц), 7,74 (2Н, m), 7,58 (3Н, m), 3,70 (1Н, bs), 2,87 (2H, m), 2,65 (3Н, s), 2,12 (3Н, m), 1,82 (3Н, m). 6. 2-хлор-N-[6-(1-метил-піперидин-4ілкарбоніл)-піридин-2-іл]-бензамід Змішували 2-аміно-6-(1-метилпіперидин-4ілкарбоніл)піридин (0,223г) та 2хлорбензоїлхлорид (0,175г) в 1,4-діоксані (10мл), і нагрівали суміш зі зворотним холодильником протягом 1год. Розбавляли суміш метанолом (10мл) і вносили в колонку з SCX (10г). Колонку промивали метанолом, елюювали продукт 2Μ NН3 в метанолі, випарювали елюент і очищали продукт на колонці із силікагелем (CH2Cl2 з 2Μ ΝΗ3 у метанолі), одержуючи 0,305г (84%) вказаної в заголовку сполуки: мас-спектр (електророзпилення) m/z=358 (М+1) та 360 (М+2+1); 1Н ЯМР (CDCI3): 8,60 (br s, 1Н), 8,54 Змішували 2-аміно-6-(1-метилпіперидин-4ілкарбоніл)піридин (0,20г, 0,92ммоль), 2,4,6трифторбензоїлхлорид (0,357г, 1,84ммоль) та 1,4діоксан (10мл), і суміш перемішували при нагріванні зі зворотним холодильником. Через 3год реакційну суміш охолоджували до кімнатної температури і концентрували. Вносили суміш у колонку з SCX (10г), промивали метанолом і елюювали 2Μ розчином аміаку в метанолі. Елюат концентрували, і одержували вільну основу вказаної в заголовку сполуки (0,365г, (>100%)) у вигляді масла. Це масло розчиняли в метанолі (5мл) і обробляли хлоридом амонію (0,05г, 0,92ммоль). Одержану суміш концентрували і сушили у вакуумі, одержуючи вказану в заголовку сполуку. HRMS: знайдено m/z 378,1435, обчислено m/z 378,1429; т.пл. 255°С (з розкладом). 9. Моногідрохлорид 2-трифторметил-4-фторN-[6-(1-метил-піперидин-4-ілкарбоніл)-піридин-2іл]-бензаміду Змішували 2-аміно-6-(1-метилпіперидин-4ілкарбоніл)піридин (0,19г, 0,87ммоль), 2трифторметил-4-фторбензоїлхлорид (0,395г,1,74ммоль) та 1,4-діоксан (50мл). Суміш перемі 31 77504 32 шували при нагріванні зі зворотним холодильнизнайдено m/z 408,0384, обчислено m/z 408,0381; ком. Через 3год реакційну суміш охолоджували до т.пл. 195-200°С. кімнатної температури і концентрували. Вносили 12. Дигідрохлорид 1-Н-індол-3-іл-N-[6-(1суміш у колонку з SCX (10г), промивали метанометилпіперидин-4-ілкарбоніл)-піридин-2-іл]лом і елюювали 2Μ розчином аміаку в метанолі. карбоксаміду Концентрували елюат і одержували вільну основу вказаної в заголовку сполуки у вигляді масла (0,241г, 68%). Це масло розчиняли в метанолі (5мл) і обробляли хлоридом амонію (0,031г, 0,59ммоль). Одержану суміш концентрували і сушили у вакуумі, одержуючи вказану в заголовку сполуку. HRMS: знайдено m/z 410,1490, обчислено 410,1491; т.пл. 145-150°С. (і) Проміжний продукт: 1-бензиліндол-3-іл-N-[610. Моногідрохлорид 2-трифторметокси-N-[6(1-метилпіперидин-4-ілкарбоніл)-піридин-2-іл](1-метил-піперидин-4-ілкарбоніл)-піридин-2-іл]карбоксамід бензаміду Змішували 2-аміно-6-(1-метилпіперидин-4ілкарбоніл)піридин (0,18г, 0,84ммоль), 2трифторметоксибензоїлхлорид (0,23г, 1,0ммоль) та 1,4-діоксан (5мл). Суміш перемішували при нагріванні зі зворотним холодильником. Через 3год реакційну суміш охолоджували до кімнатної температури. Вносили суміш у колонку з SCX (10г), промивали метанолом і елюювали 2Μ розчином аміаку в метанолі. Концентрували елюат, і одержували вільну основу вказаної в заголовку сполуки (0,26г, 76%). Цю вільну основу розчиняли в метанолі (10мл) і обробляли хлоридом амонію (0,032г). Одержану суміш концентрували і сушили у вакуумі, одержуючи вказану в заголовку сполуку. HRMS: знайдено m/z 408,1517, обчислено m/z 408,1535; т.пл. 155-160°С. 11. Моногідрохлорид 3-бром-N-[6-(1-метилпіперидин-4-ілкарбоніл)-пірвдин-2-іл]-тіофен-2карбоксаміду Змішували 2-аміно-6-(1-метилпіперидин-4ілкарбоніл)пірвдин (0,104г, 0,48ммоль), 3бромтіофен-2-карбонілхлорид (0,215г, 0,95ммоль) та 1,4-діоксан (10мл). Суміш перемішували при нагріванні зі зворотним холодильником. Через 2год реакційну суміш охолоджували до кімнатної температури і концентрували. Вносили суміш у колонку з SCX (10г), промивали метанолом і елюювали 2Μ розчином аміаку в метанолі. Концентрували елюат, і одержували вільну основу вказаної в заголовку сполуки у вигляді масла (0,152г, 78%). Це масло розчиняли в дихлорметані (10мл), обробляли 1Μ розчином хлороводню в діетиловому простому ефірі, концентрували і сушили у вакуумі, одержуючи вказану в заголовку сполуку. HRMS: Оксалілхлорид (0,18мл, 2,1ммоль) додавали краплями до розчину 1-бензиліндол-3-карбонової кислоти (0,48г, 1,9ммоль) у піридині та CH3CN (5мл кожного), охолодженого на льодяній бані. Перемішували реакційну суміш протягом 2,25год і потім додавали суспензію 2-аміно-6-(1метилпіперидин-4-ілкарбоніл)піридину (0,56г, 1,9ммоль) у CH3CN (5мл) та піридині (12мл). Давали реакційній суміші нагрітися до кімнатної температури протягом ночі. Гасили реакційну масу охолодженою водою (20мл) і розбавляли СНСІ3. Встановлювали значення рН 11 за допомогою Na2CO3, і розділяли шари. Водний шар екстрагували СНСI3 (2x30мл). Органічні фракції об'єднували, сушили над безводним MgSO4, фільтрували і концентрували суміш у вакуумі. Продукт очищали хроматографією на колонці із силікагелем при елююванні сумішшю метанол/СН2СI2 (5:95), а потім сумішшю метанол/CH2Cl2 (10:90), і одержували вказану в підзаголовку сполуку (0,44г, 51%). 1Н ЯМР (CD3OD) 8,45 (d, J=8Гц, 1Н), 8,32 (s, 1H), 8,26 (m, 1H), 7,95 (t, J=8Гц, 1H), 7,72 (d, J=8Гц, 1H), 7,45 (m, 1H), 7,22-7,37 (m, 7H), 5,51 (s,2H), 3,90 (m, 1H), 2,93-3,01 (m, 2H), 2,33 (s, 3H), 2,21-2,31 (m, 2H), 1,92-1,99 (m, 2H), 1,71-1,84 (m, 2H); CIMS (метан) m/z 453 [C28H28N4O2+H]+. (ii) 1Н-індол-3-іл-N-[6-(1-метилпіперидин-4ілкарбоніл)-піридин-2-іл]-карбоксамід Трихлорид алюмінію (106мг, 0,795ммоль) додавали до суспензії 1-бензиліндол-3-іл-N-[6-(1метилпіперидин-4-ілкарбоніл)-піридин-2-іл]карбоксаміду (180мг, 0,398ммоль) у бензолі (6мл), і нагрівали суміш зі зворотним холодильником протягом 1,25год. Потім додавали додатково ще 2екв. трихлориду алюмінію (108мг), і продовжували нагрівання зі зворотним холодильником ще 33 77504 34 5,5год. Охолоджували реакційну суміш до кімнатрагували реакційну суміш CH2Cl2 та Н2О і встановної температури. Потім реакційну суміш виливали лювали рН водного шару 11 за допомогою в охолоджену льодом воду (50мл), після чого розNа2СО3. Розділяли шари і екстрагували водний бавляли етилацетатом. Встановлювали рН розчишар CH2Cl2 (2x50мл). Органічні фракції об'єднувану 11 насиченим Na2CO3, розділяли шари і екстрали, сушили (Na2SO4), фільтрували і концентрували гували водний шар етилацетатом (3x50мл). у вакуумі. Концентрат очищали хроматографією на Органічні фракції об'єднували, сушили над безвоколонці із силікагелем при елююванні сумішшю дним Na2SO4, фільтрували і концентрували суміш CH2Cl2/метанол (градієнт від 95:5 до 90:10), і одеу вакуумі. Проміжний продукт очищали флешржували вільну основу вказаної в заголовку сполухроматографією на колонці із силікагелем при ки (180мг, 83%). 1Н ЯМР (CDCI3, складна суміш елююванні сумішшю СНСІ3/метанол/NH4ОН ротамерів) 8,81 (bs, 1Н), 8,39 (d, J=8Гц, 1Н), 7,82 (93:7:1), і одержували вказану в підзаголовку спо(t, J=8Гц, 1H), 7,71 (d, J=8Гц, 1H), 3,50 (m, 1H), луку (96мг, 67%). 1Н ЯМР (CD3OD) 8,45 (d, J=8Гц, 3,13-3,21 (m, 2H), 2,51 (s, 3H), 2,37-2,48 (m, 4H), 1Н), 8,25 (s, 1H), 8,21 (m, 1H), 7,96 (t, J=8Гц, 1H), 1,95-2,04 (m, 2H), 1,55 та 1,82 (m, 1H), 0,75-0,81, 7,72 (d, J=8Гц, 1H), 7,48 (m, 1H), 7,18-7,27 (m, 2H), 0,90-0,99 та 1,10-1,14 (m, 4H); APCI MS m/z 288 3,90 (m, 1H), 2,94-3,01 (m, 2H), 2,31 (s, 3H), 2,19[C16H21N3O2+H]+. 2,28 (m, 2H), 1,92-2,02 (m, 2H), 1,71-1,84 (m, 2H). Додавали 2,0Μ розчин НСI в діетиловому проCIMS (метан) m/z 363 [С21H22N4О2+H]+. стому ефірі (0,95мл, 1,9ммоль) до розчину згада(ііі) Дигідрохлорид 1Н-індол-3-іл-N-[6-(1ної вільної основи (180мг, 0,626ммоль) в діетилометилпіперидин-4-ілкарбоніл)-піридин-2-іл]вому простому ефірі (10мл) та метанолі (3мл). карбоксаміду Через 2год реакційну суміш фільтрували, і одержували вказану в заголовку сполуку у вигляді твердої речовини світло-жовтого кольору. Rf=0,47 (93:7:1 СНСІ3/метанол/NH4ОН); т.пл. 140-148°С; 1Н ЯМР (CD3OD, складна суміш ротамерів) 8,24 та 8,50 (m, 1Н), 8,05-8,08 (m, 1Н), 7,52 та 7,64 (d, J=8,0Гц, 1Н), 3,98 та 4,16 (m, 1Н), 3,62-3,66 (m, 1H), 3,20-3,28 та 3,44-3,56 (m, 2H), 2,91-3,04 (m, 1H), 2,80 та 2,93 (s, 3H), 2,13-2,29 (m, 2H), 1,57Додавали 2,0Μ розчин НСI в діетиловому про1,79 та 1,92-2,06 (m, 3H), 1,01-1,21 (m, 4H); CIMS стому ефірі (0,46мл, 0,93ммоль) до суспензії 1Н(метан) m/z 288 [C16H21N3O2+H]+; HPLC >99%, індол-3-іл-N-[6-(1-метилпіперидин-4-ілкарбоніл)tR=14,9хв. Елементний аналіз: обчислено для піридин-2-іл]-карбоксаміду (вільної основи) (0,16г, C16H21N3O2·2,3НСI·2,3Н2О: С, 46,57; Н, 6,81; N, 0,44ммоль) в діетиловому простому ефірі (10мл). 10,18; СІ, 19,76. Знайдено: С, 46,43; Н, 6,55; N, Через 2год реакційну суміш фільтрували, і проми10,00; СІ, 19,62. вали тверду речовину діетиловим простим ефі14. Дигідрохлорид 2-метилпроп-1-іл-N-[6-(1ром, одержуючи вказану в заголовку сполуку у метилпіперидин-4-ілкарбоніл)-піридин-2-іл]вигляді твердої речовини жовтого кольору. Час карбоксаміду затримання (Rf)=0,29 (93:7:1 СНСI3/метанол/NН4ОН); т.пл. 200-218°С; 1Н ЯМР (CD3OD, складна суміш ротамерів) 8,38 та 8,49 (s, 1Н), 8,46 (m, 1Н), 8,08-8,10 та 8,18-8,29 (m, 2Н), 7,61 та 7,72 (d, J=8Гц, 1Н), 7,52 (m, 1Н), 7,26-7,32 (m,2Н), 4,01 (m, 1Н), 3,19-3,68 (m, 3Н), 2,97 (m, 1Н), 2,82 та 2,94 (s, 3Н), 2,28-2,32 (m, 2H), 1,68(і) Вільна основа: 3-метилбутаноїлхлорид 2,02 (m, 2Н); CIMS (метан) m/z 363 (0,11мл, 0,90ммоль) додавали краплями до розчи+ [C21H22N4O2+Н] ; HPLC (методика А) 96,7%, ну 2-аміно-6-(1-метилпіперидин-4tR=16,4xв. Елементний аналіз: обчислено для ілкарбоніл)піридину (132мг, 0,45ммоль) та триетиC21H22N4O2·2,1HCl·1,5Η2O: С, 54,12; Η, 5,86; Ν, ламіну (0,19мл, 1,4ммоль) у СН2СI2 (5мл), охоло12,02; СІ, 15,98. Знайдено: С, 54,13; Η, 6,03; Ν, дженого на льодяній бані. Підігрівали реакційну 12,37; СІ, 15,71. суміш до кімнатної температури і перемішували 13. Дигідрохлорид циклопропіл-[6-(1протягом 3год. Розбавляли реакційну суміш метилпіперидин-4-ілкарбоніл)-піридин-2-іл]СН2СI2 і промивали насиченим розчином NaHCO3 карбоксаміду (50мл). Екстрагували водний шар СН2СI2 (2x25мл). Органічні фракції об'єднували, сушили (Na2SO4), фільтрували і концентрували у вакуумі. Продукт очищали хроматографією на колонці із силікагелем при елююванні сумішшю CH2Cl2/метанол (95:5), і одержували вільну основу вказаної в заголовку сполуки (88мг, 64%). 1Н ЯМР (CDCI3) 8,44 Циклопропілкарбонілхлорид (0,08мл, (d, J=8,0Гц, 1Н), 7,81-7,86 (m, 1Н), 7,73 (d, J=7,1Гц, 0,83ммоль) додавали краплями до розчину 21Н), 3,50 (m, 1H), 3,00-3,18 (m, 2H), 2,18-2,46 (m, аміно-(6-піридил)-1-метил-(4-піперидил)-кетону 7H), 1,92-2,01 (m, 2H), 1,52-1,71 (m, 3H), 1,05 (d, (221мг, 0,76ммоль) та триетиламіну (0,32мл, J=6,6Гц, 6Н); CIMS (метан) m/z 304 2,3ммоль) у СН2СІ2 (5мл), охолодженого на льодя[C17H25N3O2+H]+. ній бані. Підігрівали реакційну суміш до кімнатної (іі) Дигідрохлорид: Додавали 2,0Μ розчин НСI температури і перемішували протягом 3год. Екст 35 77504 36 в діетиловому простому ефірі (0,36мл, 0,73ммоль) протягом 16год. Екстрагували реакційну суміш до розчину згаданої вільної основи (88мг, етилацетатом та водним розчином NaOH (0,1-н.). 0,29ммоль) в діетиловому простому ефірі (5мл) та Об'єднували і сушили органічні шари. Концентруметанолі (2мл). Через 2год реакційну суміш концевали і очищали неочищений продукт хроматогрантрували у вакуумі, і одержували вказану в загофією (силікагель, 10%-30% етилацетату в гексані), ловку сполуку у вигляді твердої речовини коричі одержували 2,4,6-трифтор-N-метил-N-[6-(1-третневого кольору. Rf=0,58 (93:7:1 бутоксикарбоніл-піперидин-4-ілкарбоніл)-піридинCDCI3/метанол/NН4ОН); т.пл. 93-95°С; 1Н ЯМР 2-іл]-бензамід (86мг, вихід 44%). Розчиняли 2,4,6-трифтор-N-метил-N-[6-(1(CD3OD, складна суміш ротамерів) 8,35 (m, 1Н), тpет-бутоксикарбоніл-піперидин-4-ілкарбоніл)7,95 (m, 1H), 7,77 (m, 1H), 4,06 та 4,25 (m, 1H), піридин-2-іл]-бензамід у суміші 50% трифтороцто3,43-3,52 та 3,61-3,65 (m, 2H), 3,18-3,28 (m, 2H), вої кислоти з СН2СІ2 (24мл) і перемішували протя2,81-2,94 (m, 3H), 2,21-2,37 (m, 5H), 1,90-2,02 (m, гом 45хв. Видаляли леткі компоненти під зниже2H), 1,03-1,05 (m, 6H); CIMS (метан) m/z 304 ним тиском і екстрагували залишок етилацетатом [C17H25N3O2+H]+; HPLC 98,4%, колонка серії та водним розчином NaOH (2Μ). Органічні шари Symmetry C18, виробник Waters Corporation, об'єднували і сушили над сульфатом натрію. КонMilford, Massachusetts (4,6x250мм). Елементний центрували і очищали залишок хроматографією аналіз: обчислено для C17H25N3O2·1,9HCI·1,2H2O: (силікагель, суміш 6% 2Μ розчину ΝΗ3 в метанолі С, 51,79; Η, 7,49; Ν, 10,66; СІ, 17,08; знайдено: С, з СН2СI2), і одержували 2,4,6-тpифтop-N-мeтил-N51,78; Η, 7,64; Ν, 10,35; СІ, 17,07. [6-(пiпepидин-4-iлкapбoнiл)-пipидин-2-iл]-бeнзaмiд 15. Гідрохлорид 2,4,6-трифтор-N-метил-N-[6(77мг, вихід 85%). (1-метил-піперидин-4-ілкарбоніл)-піридин-2-іл]Розчиняли 2,4,6-трифтор-N-метил-N-[6бензаміду (піперидин-4-ілкарбоніл)-піридин-2-іл]-бензамід (77мг, 0,20ммоль) у метанолі (10мл), додавали 37% водний розчин формальдегіду (0,16мл, 2,0ммоль), льодяну оцтову кислоту (0,34мл, 6,0ммоль) та NaBH3CN (21,9мг, 0,35ммоль). Перемішували реакційну суміш при кімнатній температурі. Екстрагували суміш етилацетатом та водним Розчиняли 2,6-дибромпіридин (3,6г, розчином NaOH (2M), і одержували 2,4,6-трифтор15,3ммоль) у безводному дихлорметані (90мл) в атмосфері азоту. Охолоджували реакційну суміш Ν-метил-Ν-[6-( -гідрокси-(1-метилпіперидин-4до -78°С Дуже повільно додавали за допомогою ілкарбоніл)-метил)-піридин-2-іл]-бензамід. Розчишприца розчин н-бутиллітію в гексані (1,6М, няли 2,4,6-трифтор-N-метил-N-[6-( -гідрокси-(110,5мл, 16,9ммоль). Після завершення додавання метилпіперидин-4-ілкарбоніл)-метил)-піридин-2реакційну суміш перемішували при -78°С протягом іл]-бензамід у безводному СН2СI2 (12мл) і оброб1год. Додавали до реакційної суміші краплями ляли в атмосфері азоту реагентом Десса-Мартіна розчин трет-бутилового складного ефіру 4(Dess-Martin) (127мг, 0,30ммоль) протягом 1год. (метокси-метил-амінокарбоніл)-піперидин-1Екстрагували суміш етилацетатом та 2Μ водним карбонової кислоти (2г, 7,3ммоль) у безводному розчином NaOH. Об'єднували і сушили органічні дихлорметані (10мл). Перемішували реакційну шари. Концентрували і очищали залишок хроматосуміш при -78°С протягом 2год, потім давали їй графією (силікагель, суміш 6% 2Μ розчину ΝΗ3 в повільно нагрітися до кімнатної температури прометанолі з CH2Cl2), і одержували вільний амін вкатягом ночі. Гасили реакційну суміш 0,1-н. водним заної в заголовку сполуки (60,2мг, вихід 77%). Цю розчином NaOH. Розбавляли розчин дихлорметавільну основу розчиняли в метанолі (10мл) і оброном (100мл), переносили в ділильну лійку і струбляли хлоридом амонію (0,032г). Концентрували і шували з 0,1-н. NaOH (60мл). Відділяли органічний сушили у вакуумі, одержуючи вказану в заголовку шар і сушили його над безводним сульфатом насполуку. Мас-спектр (іонне розпилення): m/z=392,0 трію. Випарювали розчинник під зниженим тиском. (М+1); 1Н ЯМР (метанол-d4): 7,85 (m, 2Н), 7,50 (m, Залишок очищали хроматографією на колонці із 1Н), 6,80 (m, 2Н), 3,75 (m, 1Н), 3,52 (d, 2H), 3,47 (s, силікагелем (10%-30% етилацетату в гексані), і 3H), 3,20 (t, 2H), 2,94 (s, 3H), 2,03 (d, 2Н), 1,83 (m, одержували 2-бром-6-(1-трет2Н). бутоксикарбонілпіперидин-4-ілкарбоніл)-піридин 16. Гідрохлорид 2,4,6-трифтор-N-етил-N-[6-(1(2,7г, кількісний вихід). Мас-спектр (іонне розпиметил-піперидин-4-ілкарбоніл)-піридин-2-іл]лення): m/z 370 (М+1). бензаміду Суміш 2-бром-6-(1-третбутоксикарбонілпіперидин-4-ілкарбоніл)-піридину (152мг, 0,41ммоль), N-метил-2,4,6трифторбензаміду (92,6мг, 0,49ммоль), Pd2(dba)3 (9,2мг, 0,01ммоль), BINAP (12,4мг, 0,02ммоль), трет-бутилату натрію (55мг, 0,57ммоль) у безводному толуолі (10мл) нагрівали при 85°С протягом Розчиняли 2,6-дибромпіридин (5,5г, 16год. Охолоджували реакційну суміш до кімнатної 23,2ммоль) у безводному дихлорметані (140мл) в температури, і додавали ще по одній аліквотній атмосфері азоту. Охолоджували реакційну суміш частці N-метил-2,4,6-трифторбензаміду, Pd2(dba)3, до -78°С. Дуже повільно додавали за допомогою BINAP та трет-бутилату натрію в тих самих кількошприца розчин н-бутиллітію в гексані (1,6М, стях. Знов нагрівали реакційну суміш при 85°С ще 15,8мл, 25,3ммоль). Після завершення додавання 37 77504 38 реакційну суміш перемішували при -78°С протягом із силікагелем (елюент CH2Cl2 з 2Μ ΝΗ3 в метано1год. Додавали до реакційної суміші краплями лі), і одержували вказану в заголовку сполуку розчин 1-метил-N-метил-N-метокси-піперидин-4(61мг). Мас-спектр (електророзпилення): m/z=364 карбоксаміду (2г, 11ммоль) у безводному дихлор(M+1); 1Н ЯМР (CDCI3): 8,55 (d, J=8,1Гц, 1Н), 7,92 метані (10мл). Перемішували реакційну суміш при (dd, J=8,0, 8,0Гц 1H), 7,84 (1H, J=8,0Гц, 1H), 6,81 -78°С протягом 2год, потім давали їй повільно на(m, 3H), 3,89 (m, 1H), 3,12 (brd, 2H), 2,81 (m, 2H), грітися до кімнатної температури протягом ночі. 1,85 (m, 2H), 1,74 (br, 2H), 1,61 (m, 2H). Гасили реакційну суміш 0,1-н. водним розчином До розчину вищезгаданої вільної основи у суNaOH. Розбавляли розчин дихлорметаном міші хлористого метилену з метанолом додавали (100мл), переносили в ділильну лійку і струшували 0,17мл 1-н. НСI, випарювали розчинник і сушили у з 2-н. NaOH (50мл). Відділяли органічний шар і вакуумі, одержуючи моногідрохлорид. сушили його над безводним сульфатом натрію, 18. 2,4,6-трифтор-N-[6-(1-етилпіпервдин-4після чого випарювали розчинник під зниженим шкарбоніл)-піридин-2-іл]-бензамід тиском. Залишок очищали хроматографією на колонці із силікагелем (6% 2Μ ΝΗ3 у метанолі/СН2СI2) і одержували 2-бром-6-(1метилпіперидин-4-ілкарбоніл)-піридин (2,3г, вихід 74%). Мас-спектр (іонне розпилення): m/z 283 (М+1). Змішували 2-бром-6-(1-метилпіперидин-4У герметично закритій трубці змішували 2,4,6ілкарбоніл)-піридин (189мг, 0,67ммоль), N-етилтрифтор-N-[6-(піперидин-4-ілкарбоніл)-піридин-22,4,6-трифторбензамід (162мг, 0,80ммоль), іл]-бензамід (26мг), ацетальдегід (42мг), ціаноборPd2(dba)3 (14,6мг, 0,016ммоль), BINAP (19,9мг, гідрид натрію (10мг) та трифтороцтову кислоту 0,032ммоль), трет-бутилат натрію (90,2мг, (16,4мг) у метанолі (2мл) і нагрівали на масляній 0,94ммоль) та безводний толуол (10мл), і нагрівабані при 90°С протягом ночі. Розбавляли суміш ли суміш при 85°С протягом 16год в атмосфері метанолом і вносили в колонку з SCX (10г), проазоту. Охолоджували реакційну суміш до кімнатної мивали колонку метанолом, елюювали продукт 2Μ температури, і додавали додатково N-етил-2,4,6розчином ΝΗ3 у метанолі, випарювали, очищали трифторбензамід, Pd2(dba)3, BINAP та третна колонці із силікагелем (4г, розчинник: дихлорбутилат натрію в тих самих кількостях. Знов нагріметан-2Μ ΝΗ3 у метанолі, градієнтне елюювання), вали реакційну суміш при 85°С ще протягом 16год. і одержували вказану в заголовку сполуку (8,4мг). Екстрагували реакційну суміш етилацетатом та Мас-спектр (іонне розпилення): m/z=392 (М+1); 1Н водним розчином NaOH (0,1-н.). Об'єднували і ЯМР (CDCI3): 8,51 (d, 1Н), 8,42 (br, 1Н), 7,92 (t, 1H), сушили органічні шари. Концентрували і очищали 7,82 (dd, 1H), 6,84 (m, 2H), 3,63 (m, 1H), 3,02 (m, неочищений продукт хроматографією (силікагель, 2H), 2,44 (m, 2H), 2,04 (m, 2H), 1,87 (m, 4H), 1,60 10%-30% етилацетату в гексані), і одержували (m, 5H), 1,11 (t, J=6,8Гц, 3Н). вільну основу вказаної в заголовку сполуки (100мг, Цю вільну основу (8,4мг) розчиняли в суміші вихід 37%). Цю вільну основу розчиняли в метанодихлорметану з метанолом і додавали 0,02мл 1-н. лі (10мл) і обробляли хлоридом амонію (0,032г). розчину НСI у діетиловому простому ефірі, випаКонцентрували і сушили у вакуумі, одержуючи рювали і сушили у вакуумі, одержуючи гідрохловказану в заголовку сполуку. Мас-спектр (іонне рид. 1 розпилення): m/z=406,1 (М+1); Н ЯМР (метанол19. 2,4,6-трифтор-N-[6-(1-пропілпіперидин-4d4): 7,94 (m, 2Н), 7,54 (m, 1Н), 6,88 (m, 2H), 4,12 (q, ілкарбоніл)-піридин-2-іл]-бензамід 2H), 3,86 (m, 1Н), 3,77 (d, 2H), 3,18 (t, 2H), 2,94 (s, 3H), 2,15 (d, 2H), 1,92 (m, 2H). 17. 2,4,6-трифтор-N-[6-(піперидин-4ілкарбоніл)-піридин-2-іл]-бензамід Додавали 1-хлоретилхлорформіат (0,8г) до розчину 2,4,6-трифтор-Ν-[6-(1-метил-піперидин-4ілкарбоніл)-піридин-2-іл]-бензаміду (0,216г) у дихлоретані (10мл), і нагрівали зі зворотним холодильником протягом 1год. Потім додавали додатково 1-хлоретилхлорформіат (1мл), і нагрівали зі зворотним холодильником протягом ночі. Додавали до реакційної суміші метанол (10мл), концентрували до незначного об'єму, знов розбавляли метанолом, вносили в колонку з SCX (10г), промивали колонку метанолом і елюювали 2Μ розчином ΝΗ3 в метанолі, випарювали, очищали на колонці Змішували 2,4,6-трифтор-N-[6-(піперидин-4ілкарбоніл)-піридин-2-іл]-бензамід (50мг), пропіоновий альдегід (80мг), триацетоксиборгідрид натрію (38мг) та оцтову кислоту (21мг) із дихлорметаном (5мл), і перемішували протягом 1,5год. Розбавляли суміш метанолом і вносили в колонку з SCX (10г), промивали колонку метанолом, і елюювали продукт 2Μ розчином ΝΗ3 у метанолі. Продукт очищали на колонці із силікагелем (10г, елюент дихлорметан-2Μ ΝΗ3 у метанолі, градієнтне елюювання), і одержували вказану в заголовку сполуку у формі вільної основи (26мг). Мас-спектр (електророзпилення): m/z=406 (М+1); 1Н ЯМР (CDCI3): 8,52 (d, 1Н), 8,38 (br, 1Н), 7,92 (t, 1H), 7,82 (dd, 1H), 6,82 (m, 2H), 3,61 (br, IH), 3,00 (m, 2H), 2,34 (m, 2H), 2,11 (m, 2H), 1,87 (m, 3Н), 1,60 (m, 5H), 0,90 (t, J=7,3Гц, 3Н). 39 77504 Цю вільну основу (26мг) розчиняли в суміші дихлорметану з метанолом і додавали 0,064мл 1н. розчину НСI у діетиловому простому ефірі, випарювали і сушили у вакуумі, одержуючи гідрохлорид. 20. Дигідрохлорид 2,4,6-трифтор-N-[6-(1циклопропілметил-піперидин-4-ілкарбоніл)піридин-2-іл]-бензаміду Змішували 2,4,6-трифтор-N-[6-(піперидин-4ілкарбоніл)піридин-2-іл]бензамід (0,05г, 0,138ммоль), циклопропілметаналь (0,10г, 1,38ммоль) та дихлорметан (5мл), і перемішували суміш при температурі навколишнього середовища. Через 15хв додавали при перемішуванні льодяну оцтову кислоту (0,02мл, 0,35ммоль), а потім триацетоксиборгідрид натрію (0,038г, 0,18ммоль). Через 3год реакційну суміш розбавляли метанолом (5мл) і вносили в колонку з SCX (10г). Промивали колонку метанолом, елюювали продукт 2Μ розчином ΝΗ3 у метанолі, і концентрували елюат. Залишок очищали флеш-хроматографією при елююванні 10% метанольного розчину аміаку в дихлорметані, і одержували вільну основу вказаної в заголовку сполуки (0,045г, 77%). Цю вільну основу розчиняли в дихлорметані (5мл), обробляли 1Μ розчином хлороводню в діетиловому простому ефірі (0,25мл), і концентрували суміш, одержуючи дигідрохлорид. Т.пл.=140°С; HRMS: одержано m/z 418,1743; обчислено: m/z 418,1742; 1 Н ЯМР (CDCI3): 11,51 (bs, 1Н), 10,34 (bs, 1Н), 8,38 (m, 1H), 8,11 (m, 1H), 7,78 (d, 1H), 7,42 (m, 2H), 3,79 (m, 1H); 3,64 (m, 2H), 2,98 (m, 4H), 2,17 (m, 2H), 1,99 (m, 2H), 1,13 (m, 1H), 0,65 (m, 2H), 0,39 (m, 2H). Підготовчі синтези 3. N-метилізоніпекотинова кислота У реактор для гідрування, виконаний з нержавіючої сталі, завантажували ізоніпікотинову кислоту (1кг, 7,74моль), воду (10л), формальдегід (37% водний розчин, 720г, 8,87моль, 1,15екв.) та зволожений каталізатор Pd/C (10%; 55% паста, 100г). Створювали в реакторі тиск Н2 (3бар (0,3МПа)), і перемішували реакційну суміш протягом ночі зі швидкістю 200-300об/хв при 16-25°С. Припиняли реакцію, та відділяли каталізатор фільтруванням. Промивали фільтрат водою (500мл) і концентрували у вакуумі. Відганяли залишкову воду від залишку, застосовуючи етанол (2x1л). Твердий продукт сушили протягом ночі у вакуумі при 50°С, і одержували вказану в заголовку сполуку у вигляді жовтуватої твердої речовини (1087г, вихід 98,1%). 40 4. Гідрохлорид N-метилізоніпекотилхлориду Суспендували N-метилніпікотинову кислоту (365г, 2,55моль) у СН2СI2 (3500мл), і додавали каталітичну кількість DMF (2мл). Додавали до реакційної суміші оксалілхлорид (435г, 3,42моль, 1,35екв.), підтримуючи температуру 20°С. Нагрівали суспензію зі зворотним холодильником протягом 2год. Охолоджували суміш і концентрували її в роторному випарнику. Залишок знов суспендували у толуолі (1000мл), випарювали і сушили у вакуумі, одержуючи вказану в заголовку сполуку (489г, 96%) у вигляді жовтуватого твердого залишку, який застосовували на наступній стадії без додаткового очищення. 5. N,N'-Диметил-N-метилізоніпекотамід Суспендували гідрохлорид Nметилізоніпекотилхлориду (489г, 2,54моль) у безводному THF (5000мл), і охолоджували суспензію до 0-5°С. Додавали до реакційної суміші краплями диметиламін у THF (2М, 2500мл, 2екв.) та триетиламін (775г, 3екв.), підтримуючи температуру нижче 7°С. Перемішували суспензію протягом 3год при цій температурі, після чого давали реакційній суміші нагрітися до 20°С протягом ночі. Потім охолоджували реакційну суміш до 5°С, і додавали 30% NaOH (600мл) та CH2Cl2 (2л). Відділяли органічний шар від клейкої твердої речовини, що утворилася, і знов розчиняли цю тверду речовину у воді (2л). Екстрагували цей розчин CH2Cl2 (2л). Органічні фракції об'єднували, концентрували до об'єму приблизно 3500мл і двічі промивали водою (500мл). Органічний шар сушили над Na2SO4, фільтрували і концентрували досуха. Одержане масло червоного кольору сушили у вакуумі при кімнатній температурі, і одержували вказану в заголовку сполуку (378,7г, вихід 90%). Обробляли діетиловим простим ефіром і випарювали досуха, одержуючи продукт у вигляді твердої речовини. 6. 2-бром-6-(1-метилпіперид-4-ілкарбоніл)піридин Охолоджували метил-трет-бутиловий простий ефір (МТВЕ) (50мл) (до Tmass=-75°C) в атмосфері 41 77504 42 азоту і додавали н-бутиллітій (2,5Μ в н-гексані, (100мл), перемішували суміш протягом 30хв, і по35мл, 0,875моль), при цьому утворювалася сутім видаляли розчинник під зниженим тиском. спензія білого кольору. Додавали до суспензії краОдержану тверду речовину знов суспендували в плями 2,6-дибромпіридин (20,9г, 0,088моль) в 125мл ізопропанолу і нагрівали зі зворотним холоМТВЕ (210мл) із такою швидкістю, щоб Tmass утридильником протягом 30хв. Охолоджували реакціймувалася на рівні нижче -65°С (40хв). Одержаний ну суміш до кімнатної температури, відділяли осад неоднорідний розчин жовтого кольору перемішуфільтруванням, промивали його 20мл ізопропановали при -70°С протягом 20хв, і одержували однолу і сушили у вакуумі при 50°С, одержуючи 2рідний розчин зеленого кольору. Потім додавали аміно-(6-(1-метилпіперидин-4-ілкарбоніл)-піридинкраплями N',N-диметил-N-метилізоніпекотамід 2НСl (11г, вихід 63% з урахуванням масового вміс(10г, 0,0587моль) в МТВЕ (100мл) із такою швидкіту за даними HPLC). стю, щоб Tmass утримувалася на рівні нижче -65°С 2-аміно-(6-(1-метилпіперидин-4-ілкарбоніл)(20хв). Після завершення додавання суміш перепіридин·2НСl (129,5г) суспендували в етилацетаті мішували при -75°С протягом 1год. Гасили реак(100мл) і додавали 10Μ NaOH (50мл) та воду ційну суміш насиченим розчином хлориду амонію (50мл) для нейтралізації суспензії. Відділяли орга(30мл) при 0-10°С. Нейтралізували реакційну сунічний шар, і екстрагували водну фазу етилацетаміш (рН=7) 37% НСI (15мл) і додавали додатково том (2x150мл). Органічні шари об'єднували, сушиводу (50мл). Відділяли водну фазу декантацією і ли над MgSO4, фільтрували і концентрували під екстрагували її CH2Cl2 (3x500мл). Органічні шари зниженим тиском, одержуючи вказану в заголовку об'єднували і промивали підкисленою водою сполуку (21г). (рН=2) (3x500мл). Потім підлуговували водну фазу Приклади 30% NaOH (pH=12), і екстрагували суміш етилаце21. 2,4,6-трифтор-N-[6-(1-метил-піперидин-4татом (2x500мл). Органічні шари об'єднували, суілкарбоніл)-піридин-2-іл]-бензамід шили над MgSO4, концентрували під зниженим тиском, а потім сушили у вакуумі при кімнатній температурі, одержуючи вказану в заголовку сполуку у вигляді масла (16г, вихід 96%). Мас-спектр (електророзпилення): m/z=283-285 (М+1); 1Н ЯМР: (400МГц, дейтерохлороформ): 1,76 (m, 2H) 1,91 (m, 2H) 2,14 (m, 2H) 2,30 (s, 3Н) 2,90 (d, J=11,85Гц, Додавали триетиламін (10,67мл, 76,70ммоль, 2H) 3,71 (m, 1Н) 7,62 (d, J=7,54Гц, 1Н) 7,67 (t, 2,4екв.) до розчину 2-аміно-(6-(1-метилпіперидин13 J=7,54Гц, 1Н) 7,95 (d, J=7,54Гц, 1Н); С-ЯМР: 4-ілкарбоніл)-піридину (7г, 31,96ммоль, 1екв.) у (100,61МГц, дейтерохлороформ): 28,08; 41,68; безводному THF (100мл) в атмосфері азоту. Дода46,36; 55,08; 121,26; 131,61; 139,25; 141,24; 153,59; вали краплями 2,4,6-трифторбензоїлхлорид (7,46г, 202,23. 5мл, 38,35ммоль, 1,20екв.) при кімнатній темпера7. 2-аміно-(6-(1-метилпіпервдин-4-ілкарбоніл)турі. Через 2год додавали до реакційної суміші піридин додатково 2,4,6-трифторбензоїлхлорид (0,75мл, 2-бром-6-(1-метилпіперидин-4-ілкарбоніл)піперидин (20г, 70,67ммоль, 1екв.) у 73,6мл 7Μ ΝΗ3 в етиленгліколі (530ммоль, 7,5екв.) завантажували в автоклав місткістю 130мл для роботи під тиском і додавали Сu2О (101мг, 0,706ммоль, 0,01екв.) як каталізатор. Герметизували автоклав і нагрівали реакційну суміш при 85°С під тиском приблизно 50фунт/дюйм2 (345кПа) протягом 20год. Охолоджували реакційну суміш до кімнатної температури, переносили органічний шар у колбу місткістю 250мл, і створювали в колбі знижений тиск для видалення аміаку. Додавали воду (70мл) та 30% NaOH (38мл), і потім екстрагували суміш метил-трет-бутиловим простим ефіром (МТВЕ) (5x100мл). Органічні фракції об'єднували і сушили над MgSO4, фільтрували і концентрували під зниженим тиском, одержуючи неочищений 2-аміно-(6(1-метилпіперидин-4-ілкарбоніл)-піридин (18,5г). Неочищений 2-аміно-(6-(1-метилпіперидин-4ілкарбоніл)-піридин (14,5г, 66,2ммоль) суспендували в етанолі (30мл), додавали 2,5Μ розчин НСl в етанолі 0,15екв.) та триетиламін (1,32мл, 0,3екв.) і перемішували суміш ще протягом 3год. Гасили реакційну суміш дистильованою водою (10мл) та 30% NaOH (15мл). Одержану двофазову систему перемішували протягом 1год, після чого розділяли фази. Екстрагували органічну фракцію шляхом додання Н2О (75мл) та оцтової кислоти (12мл), а потім циклогексану (70мл). Промивали органічну фракцію Н2О (50мл), яка містила оцтову кислоту (1мл). Об'єднували усі водні фракції та промивні води, і нейтралізували цю суміш 30% NaOH (15мл). Екстрагували метил-mpem-бутиловим простим ефіром (МТВЕ) (3x50мл). Органічні фракції об'єднували, сушили над MgSO4, фільтрували, концентрували під зниженим тиском і сушили у вакуумі при кімнатній температурі, одержуючи вказану в заголовку сполуку у вигляді твердої речовини світло-коричневого кольору (11,031г, вихід 91%). Мас-спектр (електророзпилення): m/z=378 (M+1); 1Н ЯМР (250МГц, дейтерохлороформ) 1,54 (m, 2H) 2,02 (m, 2H) 2,13 (t, J=11,48Гц, 2Н) 2,29 (s, 3Н) 2,80 (m, J=11,96Гц, 1Н) 3,56 (m, 1H) 4,26 (d, J=7,87Гц, 1H) 6,17 (d, J=8,50Гц, 1H) 6,75 (m, 2H) 7,45 (t, J=7,87Гц, 1Н) 7,53 (m, 1H) 7,95 (s, 1H); 13С-ЯМР: (62,90МГц, дейтерохлороформ) 202,78; 162,6 (dm C-F-сполучення); 162,0 (m C-Fсполучення); 160,1 (m C-F-сполучення); 158,1; 150,0; 139,7; 119,3; 117,9; 110,2 (m C-F 43 77504 44 сполучення); 100,9 (m C-F-сполучення); 55,2; 46,5; розчину в диметилформаміді (DMF)), HATU (57мг, 41,9; 28,1. 0,15ммоль), колідин (19мкл, 0,15ммоль), 2-аміно22. Моногідрохлорид 2,4,6-трифтор-N-[6-(1(6-(1-метилпіперидин-4-ілкарбоніл)-піридин та метил-піперидин-4-ілкарбоніл)-піридин-2-іл]DMF (1,5мл) і перемішували протягом 48год. Розбензаміду бавляли реакційну суміш 10% розчином оцтової кислоти в метанолі (0,5мл). Одержану реакційну суміш вносили в колонку з 2г SCX. Колонку ретельно промивали метанолом і потім елюювали 1Μ розчином аміаку в метанолі. Елюат концентрували, і продукт очищали хроматографією високої продуктивності з детектуванням за масою. Цю процедуру паралельно повторювали для приклаРозчиняли 2,4,6-трифтор-N-[6-(1дів 24-54. метилпіперидин-4-ілкарбоніл)-піридин-2-іл]Приклади 55-58 бензамід (вільну основу) (5г, 23,26ммоль) в ізопропанолі (50мл) при кімнатній температурі і додавали 3,3Μ розчин НСI в діетиловому ефірі (8мл). Нагрівали реакційну суміш зі зворотним холодильником протягом 30хв. Охолоджували реакційну суміш до кімнатної температури і перемішували Нагрівали R-заміщений хлорангідрид кислоти протягом 2год. Одержаний білий осад відфільтро(300мкл 0,5Μ розчину в піридині) до 55°С, додававували і промивали ізопропанолом (5мл). Твердий ли 2-аміно-(6-(1-метилпіперидин-4-ілкарбоніл)залишок сушили під зниженим тиском при 40°С піридин (200мкл 0,5Μ розчину в піридині), і продопротягом ночі, і одержували вказану в заголовку вжували нагрівати реакційну суміш протягом сполуку (5,12г, вихід 93%). Т.пл. 223-224°С (із суб24год. Концентрували реакційну суміш і потім розбавляли її 10% розчином оцтової кислоти в металімацією); 1Н ЯМР (400МГц, d6-DMSO) 1,94 (m, нолі (0,5мл) та метанолом (0,5мл). Одержану реа2H) 2,14 (m, J=11,15Гц, 2Н) 2,74 (s, 3Н) 2,99 (m, кційну суміш вносили безпосередньо в колонку з J=9,19Гц, 2Н) 3,49 (m, J=11,15Гц, 2Н) 3,77 (m, 1Н) 2г SCX. Колонку ретельно промивали метанолом і 7,41 (t, J=8,71Гц, 2Н) 7,78 (d, J=7,43Гц, 1Н) 8,10 (t, потім елюювали 1Μ розчином аміаку в метанолі. J=7,92Гц, 1Н) 8,37 (d, J=6,85Гц, 1Н) 10,50 (s, 1Н) Елюат концентрували, і продукт очищали хромато11,51 (s, 1H); 13С-ЯМР: (100,61МГц, дейтерохлографією високої продуктивності з детектуванням роформ) 200,7; 130,6-158,0 (m, C-F-сполучення); за масою. Цю процедуру паралельно повторювали 150,4; 150,1; 140,2; 118,5; 118,2; 111,9; 101,3 (t, Cдля прикладів 55-58. F-сполучення); 52,8; 42,6; 25,2. Приклади 59-71 23. Гемісукцинат 2,4,6-трифтор-N-[6-(1-метилпіперидин-4-карбоніл)-піридин-2-іл]-бензаміду Додавали бурштинову кислоту (0,25г, 2,148ммоль, 0,5екв.) до розчину 2,4,6-трифтор-N[6-(1-метил-піперидин-4-ілкарбоніл)-піридин-2-іл]бензаміду (вільної основи) (1,62, 4,297ммоль, 1екв.) в ацетоні (16,2мл) при кімнатній температурі. Нагрівали розчин зі зворотним холодильником протягом 30хв. Охолоджували розчин до кімнатної температури, і відділяли фільтруванням білий осад, що утворювався. Цей осад промивали ацетоном (0,2мл) і сушили у вакуумі при 50°С протягом 16год, одержуючи вказану в заголовку сполуку (1,5г, вихід 80%). Т.пл. 198,5°С; мас-спектр (електророзпилення) m/z=495,45. Сполуки за поданими нижче прикладами одержували способами комбінаторної хімії, як описано нижче: Приклади 24-54 Змішували R-заміщену кислоту (300мкл 0,5Μ Нагрівали 2-аміно-(6-(1-метилпіперидин-4ілкарбоніл)-піридин (200мкл 0,5Μ розчину в піридині) до 55°С, потім додавали R-заміщений хлорангідрид кислоти (0,10ммоль) і нагрівали протягом 2год. Концентрували реакційну суміш і потім розбавляли її 10% розчином оцтової кислоти в метанолі (0,5мл) та метанолом (0,5мл). Одержану реакційну суміш вносили безпосередньо в колонку з 2г SCX. Колонку ретельно промивали метанолом і потім елюювали 1Μ розчином аміаку в метанолі. Елюат концентрували, і продукт очищали хроматографією високої продуктивності з детектуванням за масою. Цю процедуру паралельно повторювали для прикладів 59-71. Сполуки, одержані способами рекомбінантної хімії, ідентифікували рідинною хроматографією з мас-спектроскопією на приладі Shimadzu QP8000. Сполуки за прикладами 24-45 та 55-58 хроматографували на колонці Metachem C18 (сорбент monochrom 3мкм, колонка розміром 2,5x25см) із застосуванням градієнту розчинника В від 10% до 90% за 4,5хв, де розчинникА є 0,1% трифтороцтової кислоти у воді, а розчинник В - 0,1% трифтороцтової кислоти в ацетонітрилі. Сполуки за прикладами 46-54 та 59-71 хроматографували на колонці Metachem С18 (сорбент monochrom 5мкм, колонка розміром 4,6x50см) із застосуванням градієнту 45 77504 розчинника В від 10% до 80% за 9хв, де розчинник А - 0,1% трифтороцтової кислоти у воді, а розчинник В - 0,08% трифтороцтової кислоти в ацетонітрилі. 46 47 Підготовчі синтези 7. піперидин 1-метил-4-піролідин-1-іл-карбоніл) 77504 48 Оксалілхлорид (5,08мл, 0,058моль) додавали краплями до суспензії моногідрохлориду 1-метил4-карбоксипіперидину (10г, 0,056моль) у THF (100мл) у присутності каталітичної кількості DMF (0,1мл) при кімнатній температурі. Перемішували протягом 1год і потім нагрівали суміш зі зворотним холодильником до припинення вивільнення газу (приблизно 1год). Охолоджували одержану суспензію білого кольору до 5°С, і додавали краплями розчин піролідину (7,92г, 0,111моль) та триетиламін (16,9г, 0,167моль) протягом 30хв при температурі від 5°С до 13°С. Перемішували суспензію протягом 30хв при 10°С і потім нагрівали до кімнатної температури. Гасили реакційну суміш доданням 30% NaOH (20мл, 0,2моль) та води (10мл). Декантували водний шар і екстрагували його THF (200мл). Об'єднували органічні шари, сушили над Na2CO3 і випарювали у вакуумі при 40°С. Розчиняли одержане масло в циклогексані (200мл). Випарювали розчинник під зниженим тиском при 40°С, і одержували білу тверду речовину (11г). Нагрівали цю речовину (11г) в циклогексані (50мл) зі зворотним холодильником до повного розчинення. Охолоджували розчин до кімнатної температури і перемішували при кімнатній температурі протягом 2год. Фільтрували суспензію, і промивали кристали циклогексаном (10мл). Сушили одержані білі кристали під зниженим тиском при 40°С, і одержували вказаний у заголовку проміжний продукт (7,76г, вихід 75%). 8. 2-бром-6-(1-метилпіперидин-4-ілкарбоніл)піридин Додавали краплями розчин н-бутиллітію (1,9Μ в н-гексані, 4мл, 7,6ммоль) до розчину 2,6дибромпіридину (1,81г, 7,64ммоль) в МТВЕ (20мл) в атмосфері азоту на протязі 20хв, підтримуючи температуру в межах від -72°С до -67°С. Одержаний неоднорідний розчин жовтого кольору перемішували при -70°С протягом 20хв, і одержували однорідний розчин зеленого кольору. Додавали краплями розчин 1-метил-4-(піролідин-1-ілкарбоніл)піперидину (1г, 5,09ммоль) в 10мл МТВЕ на протязі 20хв, підтримуючи температуру нижче 69°С. Перемішували одержану суміш жовтого кольору при -75°С протягом 1год. Гасили реакційну суміш насиченим розчином хлориду амонію (5мл) при температурі від 0°С до 10°С. Підкислювали суміш до рН 2 димлячою НСl (2мл). Екстрагували органічний шар. Промивали водну фазу МТВЕ (50мл), підлуговували водний шар 30% розчином NaOH і екстрагували етилацетатом (2x50мл). Органічні шари об'єднували, сушили над MgSO4, фільтрували і концентрували під зниженим тиском при 40°С, одержуючи вказаний у заголовку проміжний продукт у вигляді масла (1,23г, вихід 85%). Сполуки за цим винаходом корисні для підвищення активності рецепторів 5-HT1F. Посилене активування рецепторів 5-HT1F корисне при лікуванні різноманітних розладів, пов'язаних із послабленою нейротрансмісією серотоніну в ссавців, наприклад, головних болей при мігрені. Дивись патент США №5,708,008, де продемонстровано причинний зв'язок між активацією рецепторів 5НТ1F та мігренню. Для ілюстрування застосування сполук за цим винаходом в лікуванні мігрені визначали їхню здатність до зв'язування підтипу ре 49 77504 50 цептора 5-НТ1F. Здатність сполук за цим винахосцинтиляцій в рідині типу Beckman LS 5000TA. дом зв'язуватися з підтипом рецептора 5-НТ1F виЕфективність підрахунку для [3Н]-5-НТ становила в значали, в основному, як описано в роботі Адгама середньому 45-50%. Характеристики зв'язування та ін. [N. Adham, et al., Proceedings of the National визначали шляхом комп'ютеризованого регресійAcademy of Sciences (USA), 90:408-412, 1993]. ного аналізу (програми Accufit та Accucomp, Підготовка мембран: Lunden Software, Chagrin Falls, OH). Значення ІС50 Мембрани готували з трансфікованих клітин перетворювали у значення Ki, застосовуючи рівLtk (трансфікованих послідовністю рецептора 5няння Ченга-Прусова [Cheng-Prusoff, Biochem. HT1F людини), вирощених до 100% злиття. Клітини Pharmacol, 22:3099-3108 (1973)]. Усі експерименти двічі промивали сольовим розчином із фосфатним виконували із застосуванням трьох паралельних буфером, зіскрібали із чашок для вирощування проб. З'ясовано, що типові сполуки за цим винахокультур у 5мл охолодженого льодом сольового дом при вимірюваннях за вищезгаданою методирозчину з фосфатним буфером і центрифугували кою виявляють високу спорідненість до рецептора 5-НТ1F; значення Kі становлять, наприклад, 300нМ при 200 g протягом 5хв при 4°С. Осад суспендуабо менше. Сполуки за цим винаходом, яким відвали в 2,5мл охолодженого льодом Трис-буфера дається перевага, мають Kі 100нМ або менше. За (20мМ Трис-НСІ, рН 7,4 при 23°С, 5мМ EDTA) і варіантом, якому віддається більша перевага, гомогенізували із застосуванням подрібнювача пропонуються сполуки, які мають Kі 50нМ або метканини Уїтона (Wheaton). Цей лізат потім нше. центрифугували при 200 g протягом 5хв при 4°С Селективність до рецептора 5-НТ1F для осадження грубих фрагментів, які потім відкиСполуки за цим винаходом є відносно селекдали. Надосадову рідину збирали і центрифугувативними до рецептора 5-HT1F, зокрема, в порівли при 40000xg протягом 20хв при 4°С. Одержанянні з іншими субтипами рецепторів 5-НТ, особний осад промивали один раз охолодженим ливо з іншими рецепторами підкласу 5-НТ1, льодом промивальним Трис-буфером і повторно необмежувальними прикладами яких є підтипи суспендували в кінцевому буфері, який містив рецепторів 5-НТ1А, 5-HT1B, 5-HT1D та 5-НТ1Е. Спо50мМ Трис-НСІ та 0,5мМ EDTA, рН 7,4 при 23°С. рідненість до цих інших підтипів рецепторів легко Препарати мембран зберігали на льоду і викорисвизначити шляхом незначного модифікування товували не пізніше ніж через 2год для випробуописаної вище методики випробування зв'язуванвань зв'язування з радіоміченими лігандами. Коння радіоліганду із застосуванням клітин, трансфіцентрації протеїнів визначали за методом кованих бажаним підтипом рецептора замість кліБредфорда [Bradford, Anal. Biochem., 72:248-254, тин, трансфікованих підтипом рецептора 5-НТ1F. 1976]. Ефективність зв'язування для типових сполук за Зв'язування радіоліганду: цим винаходом було визначено в таких випробуВипробування зв'язування [3Н]-5-НТ виконуваваннях, і було з'ясовано, що вони є селективними ли у незначно модифікованих умовах проби з 5до рецептора 5-НТ1F; це означає, що значення НТ1D, описаної Геррік-Девісом та Тайтлом [Herrickспорідненості цих сполук до рецептора 5-HT1F в Davis and Titeler, J. Neurochem., 50:1624-1631, цілому перевищували спорідненість до інших під1988] без застосування маскувальних лігандів. типів рецепторів, зокрема, до підтипів 5-НТ1B та 5Дослідження зв'язування радіоактивного ліганду НТ1D. виконували при 37°С у загальному об'ємі 250мкл Вимірювання утворення сАМР буфера (50мМ Трис, 10мМ MgCl2, 0,2мМ EDTA, Як вказано Вайншенком та ін. [R.L. Weinshank, 10мкМ паргіліну, 0,1% аскорбату, рН 7,4 при 37°С) et al, W093/14201], рецептор 5-НТ1F функціонально у 96-лункових мікролітрових планшетах. Випробусполучений з G-протеїном, як визначено за здатнівання на насичення виконували з використанням стю серотоніну та серотонергічних лікарських ре12 різних концентрацій [3Н]-5-НТ від 0,5нМ до човин до інгібування стимульованого форсколіном 100нМ. Дослідження заміщення виконували з випродукування сАМР в клітинах NIH3T3, трансфікокористанням 4,5-5,5нМ [3Н]-5-НТ. Профіль зв'язуваних рецептором 5-НТ1F. Активність аденілатциквання лікарських речовин у конкурентних експелази визначали за стандартною методикою. Макриментах визначали з використанням 6-12 симальний ефект досягається під впливом концентрацій сполуки. Тривалість інкубації при серотоніну. Значення Еmах визначається шляхом дослідженнях як насичення, так і заміщення стаділення характеристики інгібування для випробоновила 30хв; це значення було добрано, виходячи вуваної сполуки на максимальний ефект та визназ попередніх досліджень, при яких визначено рівчення характеристики інгібування в процентах. [N. новажні умови зв'язування. Неспецифічне зв'язуAdham, et al., цитована вище робота; R.L. вання визначали у присутності 10мкМ 5-НТ. Зв'яWeinshank, et al., Proceedings of the National зування ініціювали шляхом додавання 50мкл Academy of Sciences (USA), 89:3630-3634, 1992; та гомогенізованих мембран (10-20мкг). Реакцію приджерела, цитовані в цій роботі]. пиняли шляхом швидкого фільтрування через поКлітини N1H3T3, трансфіковані рецептором 5передньо імпрегновані (0,5% поліетиленімін) фільНТ1F людини (значення Вmax, оцінене з одноточкотри із застосуванням приладу для збирання клітин вого конкурентного випробування, типу 48R (Brandel, Gaithersburg, MD). Потім фільт488фемтомоль/мг протеїну) інкубували в середори промивали протягом 5с охолодженим льодом вищі DMEM, 5мМ теофіліну, 10мМ HEPES (4-[2буфером (50мМ Трис-НСІ, рН=7,4 при 4°С), сушигідроксіетил]-1-піперазинетансульфонова кислота) ли і вміщували у пробірки, які містили 2,5мл прета 10мкМ паргіліну протягом 20хв при 37°С в атпарату Readi-Safe (Beckman, Fullerton, CA), і вимімосфері 5% СО2. Потім визначали криві дозарювали радіоактивність, застосовуючи лічильник 51 77504 52 реакція для лікарських речовин шляхом додавання збирання дуральних мембран. Зразки мембран цих речовин у 6 різних кінцевих концентраціях із відбирали з обох півкуль, промивали водою та подальшим негайним додаванням форсколіну наносили на предметні стекла. Після висихання (10мкМ). Потім клітини інкубували ще протягом зразки тканини накривали накривними стеклами з 10хв при 37°С в атмосфері 5% СО2. Відсмоктували 70% гліцерино-водною сумішшю. живильне середовище, і реакцію припиняли доДля кількісного визначення кількості барвника данням 100мМ НСl. Для демонстрації конкуренту кожній пробі застосовували флуоресцентний ного антагонізму паралельно визначали криву домікроскоп (фірми Zeiss), обладнаний дифракційза-реакція для 5-НТ із застосуванням фіксованої ним монохроматором та спектрофотометром. Задози метіотепіну (0,32мкМ). Планшети витримувастосовували довжину хвилі збудження приблизно ли при 4°С протягом 15хв і потім центрифугували 535нм та визначали інтенсивність випромінювання на довжині хвилі 600нм. Мікроскоп був обладнаний протягом 5хв при 500 g для осадження фрагменстоликом із механічним рушійним пристроєм і тів клітин, а надосадову рідину розділяли на алікз'єднаний з персональним комп'ютером. Це забезвотні частки та зберігали при -20°С до визначення печувало контрольоване комп'ютером переміщенкількості утвореного сАМР методом радіоімуноаня столика та вимірювання флуоресценції у 25 налізу (із застосуванням комплекту для радіоімуточках кожної проби дуральної оболонки (з кроком ноаналізу сАМР виробництва фірми Advanced 500мкм). Середнє значення та стандартне відхиMagnetics, Cambridge, ΜΑ). Радіоактивність визналення результатів вимірювань визначали за допочали із застосуванням аутогамма-лічильника могою комп'ютера. COBRA фірми Packard, спорядженого програмою Транссудація, індукована електричною стимуобробки даних. З'ясовано, що типові сполуки за ляцією ганглія трійчастого нерва, є іпсілатеральцим винаходом є агоністами рецептора 5-НТ1F у ним ефектом (тобто вона має місце на тій стороні випробуваннях на сАМР, описаних вище. дуральної оболонки, з якої був стимульований Випробування транссудації протеїну ганглій трійчастого нерва). Це уможливлює викоДля визначення здатності сполук за цим винаристання іншої (нестимульованої) половини дураходом до пригнічення транссудації протеїнів було льної оболонки як контролю. Розраховували відвиконано описані нижче випробування, які водноношення кількості транссудаційного протеїну в час є функціональними випробуваннями для нейдуральній оболонці на стимульованій стороні до ронного механізму мігрені. аналогічного показника на нестимульованій стороПацюків лінії Sprague-Dawley, одержаних від ні. Контрольні групи тварин, оброблені сольовим фірми Нагlаn (маса тіла 225-325г), або морських розчином, давали згадане відношення приблизно свинок, одержаних від фірми Charles River 2,0 для пацюків та 1,8 для морських свинок. НаLaboratories (маса тіла 225-325г), анестезували впаки, при застосуванні сполук, які ефективно завнутрішньоочеревинним введенням пентобарбітапобігають транссудації в дуральній оболонці на лу натрію (відповідно 65мг/кг або 45мг/кг) і вміщустимульованій стороні, це відношення має становали в стереотаксичну рамку (фірми David Kopf вити приблизно 1,0. Визначали залежність дозаInstruments) із планкою різака, встановленою на реакція та дозу, яка пригнічує транссудацію на відмітці -3,5мм для пацюків або -4,0мм для морсь50% (ID50). Типові сполуки за цим винаходом виких свинок. Після сагітального розрізу шкіри голоявляли при такому випробуванні значне пригніви вздовж середньої лінії у черепі просвердлювачення транссудації нейронного протеїну. ли дві пари наскрізних білатерально розміщених Звуження підшкірної вени ноги кролика отворів (на 6мм позаду тімені та на 2,0мм і 4,0мм Типові сполуки за цим винаходом випробовувбік від середньої лінії у пацюків; на 4мм позаду вали на звуження підшкірної вени ноги кролика тімені та на 3,2мм і 5,2мм вбік від середньої лінії у для визначення їхньої здатності до опосередковуморських свинок, усі координати відносно брегми). вання звуження судин. Через ці отвори в обидві півкулі вводили пари Самців новозеландських білих кроликів (маса стимульвальних електродів із нержавіючої сталі, тіла 3-6 фунтів, 0,9-1,8кг) (фірма Hazleton, ізольованих по всій довжині, окрім кінців (виробник Kalamazoo, MJ) умертвляли летальною дозою пефірма Rhodes Medical Systems, Inc.); глибина ввентобарбіталу натрію (325мг), яку вводили у вушну дення 9мм (для пацюків) або 10,5мм (для морсьвену. Тканини відділяли від сполучної тканини, ких свинок) від твердої мозкової оболонки. канюлювали in situ поліетиленовими трубками Виділяли стегнову вену, і вводили внутрішньо(РЕ50, зовнішній діаметр=0,97мм) та вміщували у венно дозу випробовуваної сполуки (1мл/кг). Причашки Петрі, які містили модифікований розчин близно через 7хв вводили внутрішньовенно флуоКребса (описаний нижче). У поліетиленові трубки ресцентний барвник Evans Blue (50мг/кг). Барвник були введені кінчики двох голок із нержавіючої утворював комплекс із протеїнами у крові та викосталі для підшкірних ін'єкцій 30-го калібру, зігнутих нував функцію маркера транссудації протеїнів. у формі літери L. Судини обережно проштовхуваТочно через 10хв після ін'єкції випробовуваної ли з канюлі на голки. Потім голки відділяли одна сполуки стимулювали лівий ганглій трійчастого від одної так, щоб нижня була приєднана на різі до нерва протягом 3хв струмом силою 1,0мА (5Гц, стаціонарного скляного стрижня, а верхня з'єднана тривалість імпульсу 4мс) із застосуванням потенна різі з датчиком. ціостата/гальваностата моделі 273 (фірми EG&G Тканини закріплювали у ваннах для органів, Princeton Applied Research). які містили 10мл модифікованого середовища Через 15хв після стимуляції тварин умертвляКребса такого складу: 118,2мМ NaCl, 4,6мМ КСl, ли, та знекровлювали 20мл сольового розчину. 1,6мМ СаСl2·Н2О, 1,2мМ КН2РО4, 1,2мМ MgSO4, Верхню частину черепа видаляли для полегшення 53 77504 54 10,0мМ декстрози та 24,8мМ NaHCO3. Розчини у %max КСl. ваннах для тканини підтримували при температурі Наприклад, суматриптан має скориговану ЕС50 37°С і продували газовою сумішшю, що містила судинозвужування 1,03 10-8Μ (0,66мМ 95% О2 та 5% СО2. До підшкірної вени прикладали ЕС50/64,20%max КСl) та ID50 пригнічення транссудапочаткове оптимальне зусилля спокою 1г. Ізометції 2,6 10-8ммоль/кг, що дає індекс специфічності ричні скорочення реєстрували як зміни зусилля в 0,40. грамах на приладі Beckman Dynograph із застосуТаким чином, процедура визначення індексу ванням датчиківStatham UC-3 та мікромасштабспецифічності для будь-якої конкретної сполуки них допоміжних пристроїв. включає такі операції: Перед обробкою лікарськими речовинами тка1. Вимірювання спорідненості сполуки до ренини витримували до досягнення рівноважного цептора 5-НТ1F із застосуванням описаного вище стану протягом 1-2год. Вимірювали криві кумуляметоду зв'язування радіоліганду; тивна концентрація агоніста - реакція для тканин, 2. Після визначення спорідненості до рецептопри цьому один зразок тканини застосовували для ра 5-НТ1F - визначення, чи є сполука агоністом, одержання не більше ніж двох кривих. Результати частковим агоністом або антагоністом рецептора виражали через середнє значення ЕС50 та макси5-НТ1F за її реакцією в описаному вище випробумальну реакцію, визначену як процентну частку ванні формування сАМР; максимального скорочення тканини як реакції на 3. В разі виявлення, що сполука є агоністом 67мМ КСl, введений початково у кожну ванну для або частковим агоністом з Еmах щонайменше 50%, тканини. вимірювання ефективності сполуки щодо пригніПри цьому випробуванні звуження судин вимічення транссудації протеїну та скорочення підшкірюють два важливі параметри: скорочення підшкірної вени за описаними вище методиками; і рної вени (ЕС50) та максимальне скорочення як 4. Обчислення індексу специфічності за подапроцент максимальної реакції на КСl (%max КCl). ною вище формулою. Скорочення підшкірної вени (ЕС50) є кількісною Незважаючи на те, що для цілей та застосухарактеристикою дози, необхідної для скорочення вань за цим винаходом корисними є сполуки, які тканини на 50% максимальної реакції, яку здатна мають індекс специфічності більше за 1, перевага опосередкувати конкретна сполука. Максимальну віддається більшим значенням індексу специфічреакцію, на яку здатна підшкірна вена, вимірюють ності. Більше значення індексу специфічності вкапісля введення високої концентрації (67мМ) КСl. зує на підвищену ефективність інгібування трансПроцент максимального скорочення під впливом судації нейронного протеїну відносно КСl є відношення максимальної реакції, яку здатна судинозвужування. Таким чином, сполуки, яким опосередкувати конкретна сполука, до максимавіддається перевага, мають індекс специфічності льної реакції, на яку здатна тканина при стимуляції 10 або більше (щонайменше 10), за варіантом, КСl. Для цілей розглядуваного застосування споякому віддається перевага, 100 або більше (щолуку можна розглядати як таку, що не має значнонайменше 100). Сполуки, яким віддається більша го судинозвужувального ефекту, якщо викликане перевага, мають індекс специфічності 1000 або нею максимальне скорочення становить 5% або більше (щонайменше 1000), а сполуки, яким відменше у порівнянні зі скороченням, що спостерігадається ще більша перевага, мають індекс специється у позитивному контролі під впливом 67мМ фічності 5000 або більше (щонайменше 5000). КСl, при концентраціях сполуки до 100мкМ. Лікарські форми З'ясовано, що типові сполуки за цим винахоТип лікарської форми, що застосовується для дом при описаному вище випробуванні на підшкірвведення в організм сполук, використовуваних у ній вені не викликають значного судинозвужувальспособах за цим винаходом, може визначатися ного ефекту. Цим вони значно відрізняються від конкретною застосовуваною сполукою, фармакоківідомих сполук для лікування мігрені, що відповінетичним профілем, бажаним при даному способі дають моделі лікування неврогенного звуження введення, та станом пацієнта. судин при мігрені і вибрані на основі сильної судиЛікарські форми, придатні для перорального, нозвужувальної дії, як, наприклад, суматриптан, під'язичного, назального або ін'єкційного введенкотрий у цьому випробуванні виявляє ЕС50 0,66мМ ня, виготовляють способами, добре відомими у та %max КСl 64,20. фармацевтичній практиці, і містять щонайменше Індекс специфічності одну активну сполуку. [Дивись, наприклад, Специфічність сполук за цим винаходом стоRemington's Pharmaceutical Sciences, (16th ed. совно до опосередкованого 5-НТ1F пригнічення 1980)]. транссудації нейронного протеїну відносно судиЯк правило, лікарська форма за цим винахонозвужувальної дії можна охарактеризувати індекдом включає активний інгредієнт (сполуку формусом специфічності, котрий являє собою відношенли 1) та звичайно змішана з допоміжною речовиня характеристики звуження судин до ною, розріджена допоміжною речовиною або характеристики ефективності пригнічення трансвміщена в такий носій, який може мати форму капсудації нейронного протеїну: сули, саше, паперового пакетика або Іншого конІндекс специфічності=(Скоригована ЕС50 судитейнера. Якщо ця допоміжна речовина виконує нозвужування (М))/(ID50 транссудації (ммоль/кг)) функції розріджувача, вона може являти собою Скоригована характеристика судинозвужувантвердий, напівтвердий або рідкий матеріал, що діє ня враховує максимальне скорочення відносно КСl як основа, носій або середовище для активного для кожної індивідувальної сполуки і визначається інгредієнта. Таким чином, лікарські форми можуть як значення ЕС50 судинозвужування, поділене на мати форму таблеток, пілюль, порошків, пастилок, 55 77504 56 пакетиків-саше, облаток, еліксирів, суспензій, емуКолоїдний діоксид кремнію 10,0 льсій, розчинів, сиропів, аерозолів (у твердому або Стеаринова кислота 5,0 рідкому середовищі), мазей, які містять, наприклад, до 10% (мас.) активної сполуки, м'яких та Вказані компоненти змішують у сухому вигляді твердих желатинових капсул, гелей, супозиторіїв, і пресують у таблетки масою по 240мг. стерильних розчинів для ін'єкцій та стерильних Приклад лікарської форми 3 фасованих порошків. При виготовленні лікарських форм може видаСухий порошок для інгаляції тися необхідним подрібнення активної сполуки перед поєднанням з іншими інгредієнтами для Масова частІнгредієнт забезпечення. відповідного розміру частинок. Якка, % що активна сполука є практично нерозчинною, її 2,4,6-трифтор-N-метил-N-[6звичайно подрібнюють до розміру частинок менше (піперидин-4-карбоніл)-піридин-25 за 200меш (0,07мм). Якщо активна сполука є пракіл]-бензамід тично водорозчинною, то розмір частинок, як праЛактоза 95 вило, доводять шляхом подрібнення до значення, яке забезпечує практично рівномірний розподіл у Активний інгредієнт змішують із лактозою, і лікарській формі, наприклад, до приблизно 40меш одержану суміш вносять у інгаляційний пристрій (0,4мм). За одним варіантом здійснення цього видля сухого порошку. находу, діапазон розмірів частинок становить від Приклад лікарської форми 4 приблизно 0,1мкм до приблизно 100мкм. Деякими прикладами прийнятних допоміжних Таблетки речовин є лактоза, декстроза, сахароза, сорбіт, маніт, різновиди крохмалю, акацієва камедь, фосКількість Інгредієнт фат кальцію, альгінати, трагант, желатин, силікат (мг/таблетку) кальцію, мікрокристалічна целюлоза, полівінілпі2-фтор-N-[6-(1-метил-піперидин-4ролідон, целюлоза, вода, сироп та метилцелюлокарбоніл)-піридин-2-іл]30,0 за. Крім того, лікарські форми можуть містити: ізонікотинамід змащувальні агенти, наприклад, тальк, стеарат Крохмаль 45,0 магнію та мінеральне масло; змочувачі; емульгаЦелюлоза мікрокристалічна 35,0 тори та суспензатори; консерванти, наприклад, Полівінілпіролідон (10% водний рометил- та пропілгідроксибензоати; підсолоджувачі; 4,0 зчин) та смакоароматичні домішки. Сполуки за цим виНатрієва сіль карбоксиметилкрохнаходом можна вводити в лікарські форми, що 4,5 малю забезпечують швидке, пролонговане або відстроСтеарат магнію 0,5 чене вивільнення активного інгредієнта після ввеТальк 1,0 дення в організм пацієнта, із застосуванням споРазом 120мг собів, відомих у галузі. Подані нижче приклади лікарських форм маАктивний інгредієнт, крохмаль та целюлозу ють лише ілюстративний характер і не призначені пропускають через сито 20меш за стандартом для обмеження обсягу цього винаходу. Термін США (розмір отворів 0,84мм) і ретельно змішують. "активний інгредієнт" означає сполуку формули І. З одержаними порошками змішують розчин полівіПриклад лікарської форми 1 нідпіролідону, і пропускають порошки через сито 16меш за стандартом США (розмір отворів 1,1мм). Тверді желатинові капсули Одержані таким чином гранули сушать при 5060°С і пропускають через сито 16меш за стандарКількість Інгредієнт том США. Потім додають до гранул натрієву сіль (мг/капсулу) карбоксиметилкрохмалю, стеарат магнію та тальк, Гідрохлорид 2,4,6-трифтор-N-[6-(1попередньо пропущені через сито 30меш за станметил-піперидин-4-карбоніл)30,0 дартом США (розмір отворів 0,6мм), і після перепіридин-2-іл]-бензаміду мішування пресують суміш на таблетувальній маКрохмаль 305,0 шині в таблетки масою по 120мг. Стеарат магнію 5,0 Приклад лікарської форми 5 Вказані вище інгредієнти змішують і фасують по 340мг у тверді желатинові капсули. Приклад лікарської форми 2 Інгредієнт Таблетки Інгредієнт Монохлорид 2-хлор-6-фтор-N-[6-(1метил-піперидин-4-карбоніл)піридин-2-іл]-бензаміду Целюлоза мікрокристалічна Капсули Кількість (мг/таблетку) 25,0 200,0 Амід [6-(1-метил-піперидин-4карбоніл)піридин-2-іл]-фуран-3карбонової кислоти Крохмаль Стеарат магнію Разом Кількість (мг/капсулу) 40,0 109,0 1,0 150,0мг 57 77504 Активний інгредієнт, крохмаль та стеарат магпіридин-2-іл]-бензаміду нію змішують у сухому вигляді, пропускають через Гліцерин сито 20меш за стандартом США і фасують по Вода 150мг у тверді желатинові капсули. Натрію цитрат Приклад лікарської форми 6 Полівініловий спирт Полівінілпіролідон Суспензії Разом Інгредієнт Кількість Монохлорид 4-фтор-Ν-[6-(1-метилпіперидин-4-карбоніл)-піридин-2-іл]50,0мг 2-трифторметил-бензаміду Ксантанова камедь 4,0мг Наїрієва сіль карбоксиметилцелюлози (11%): мікрокристалічна целюлоза 50,0мг (89%) Сахароза 1,75г Бензоат натрію 10,0мг Ароматизатор та барвник за потребою Очищена вода до 5,0мл Активний інгредієнт, сахарозу та ксантанову камедь змішують у сухому вигляді, пропускають через сито 10меш за стандартом США (розмір отворів 2,0мм) і потім змішують із попередньо приготованим розчином мікрокристалічної целюлози та натрієвої солі карбоксиметилцелюлози у воді. Бензоат натрію, ароматизатор та барвник розбавляють деякою кількістю води і додають при перемішуванні. Потім додають воду в кількості, достатній для одержання необхідного об'єму. Приклад лікарської форми 7 Капсули Інгредієнт 4-хлор-2-метокси-N-[6-(1метилпіперидин-4-карбоніл)піридин-2-іл]-бензамід Крохмаль Стеарат магнію Разом Кількість (мг/капсулу) 15,0 407,0 3,0 425,0мг Активний інгредієнт, крохмаль та стеарат магнію змішують у сухому вигляді, пропускають через сито 20меш за стандартом США і фасують по 425мг у тверді желатинові капсули. Приклад лікарської форми 8 Композиція для внутрішньовенного введення Інгредієнт 2-eтокси-N-[6-(1-метил-піперидин-4карбоніл)-піридин-2-іл]-бензамід Ізотонічний сольовий розчин Кількість 250,0мг 1000мл Приклад лікарської форми 9 Таблетки для під'язичного або защічного вживання Інгредієнт Кількість (мг/таблетку) Гемісукцинат 2,4,6-трифтор-N-[6(1-метил-піперидин-4-карбоніл) 10,0 58 210,5 143,0 4,5 26,5 15,5 410,0мг Гліцерин, воду, цитрат натрію, полівініловий спирт та полівінілпіролідон змішують шляхом безперервного перемішування, підтримуючи температуру приблизно 90°С. Після розчинення полімерів розчин охолоджують приблизно до 50-55°С, і повільно додають активний інгредієнт при перемішуванні. Однорідну суміш виливають у форми, виготовлені з інертного матеріалу, для одержання дифузійної матриці, що містить лікарську речовину, у формі шару товщиною приблизно 2-4мм. Цю дифузійну матрицю потім розрізують для одержання окремих таблеток прийнятного розміру. Приклад лікарської форми 10 Таблетки для під'язичного або защічного вживання Інгредієнт Кількість (мг/таблетку) Гемісукцинат 2,4,6-трифтор-N-[65,0 (еквівалент (1-метил-піперидин-4-карбоніл)вільної основи) піридин-2-іл]-бензаміду Маніт 20 Желатин 2,0 Вода до загального об'єму 100мл Разом 27,0мг Активну сполуку розчиняють у воді, що містить 20% маніту та 2% желатину, для одержання вихідного розчину з концентрацією 500мг/мл (еквівалент вільної основи). Цей розчин розливають аліквотними частками у форми, які вміщують по 100мкл розчину. Потім композицію заморожують при -20°С протягом 3год і піддають сублімаційному сушінню. Приклад лікарської форми 11 Композиція для внутрішньовенного введення Інгредієнт Гемісукцинат 2,4,6-трифтор-N[6-(1-метил-піперидин-4карбоніл)-піридин-2-іл]бензаміду Маніт для парентерального застосування Вода для ін'єкцій до об'єму Кількість на 1,0мл композиції 1,16мг 50,0мг 1,0мл Активну сполуку та маніт розчиняють у воді і потім додають воду до бажаного кінцевого об'єму. Одержаний розчин стерилізують фільтруванням та фасують у прийнятні контейнери в асептичних умовах. Незважаючи на те, що сполуки, використовувані у способах за цим винаходом, можна вводити в організм безпосередньо, тобто без будь-яких домішок, ці сполуки звичайно застосовують у фо 59 77504 60 рмі фармацевтичних композицій, які містять фардом можуть забезпечити особливо сприятливі мацевтично прийнятні допоміжні речовини та щопрофілі розчинності, що спрощує застосування найменше один активний інгредієнт. Ці фармацевпід'язичних або защічних лікарських форм. Такі тичні композиції можна вводити в організм форми звичайно вимагають створення відносно різноманітними шляхами, в тому числі пероральвисоких концентрацій активних інгредієнтів на обним, защічним, ректальним, черезшкірним, підшкімеженій площі поверхні під'язичної або защічної рним, внутрішньовенним, внутрішньом'язовим та слизової оболонки з метою всмоктування активноназальним шляхами. Численні сполуки, викорисго інгредієнта за відносно короткий час контакту товувані у способах за цим винаходом, є ефективлікарської форми зі згаданою поверхнею. Таким ними як в композиціях для ін'єкцій, так і для перочином, дуже висока активність сполук за цим вирального застосування. находом в поєднанні з їхньою високою розчиннісДля черезшкірного введення необхідні засоби тю сприяє їхній придатності для під'язичних або для черезшкірного постачання ("пластирі"). Такі защічних лікарських форм. пластирі для черезшкірного постачання можна За варіантом, якому віддається перевага, спозастосовувати для забезпечення безперервного луки формули І вводять у дозовані одиниці лікарабо періодичного введення сполуки за цим винаських форм, при цьому кожна дозована одиниця ходом у контрольованих кількостях. Конструкція та містить від приблизно 0,001мг до приблизно застосування пластирів для черезшкірного поста100мг, звичайно від приблизно 1,0мг до приблизно чання лікарських засобів добре відомі в галузі. 30мг, активного інгредієнта. Термін "дозовані одиДивись, наприклад, патент США №5,023,252. Такі ниці" означає фізично дискретні одиниці, прийнятні пластирі можуть бути розраховані на безперервне, як однорідні дози для людей та інших ссавців, періодичне постачання лікарських засобів або попричому кожна одиниця містить заздалегідь вистачання за потребою. значену кількість активної сполуки, розраховану на Часто виявляється бажаним або необхідним досягнення бажаного терапевтичного ефекту, у введення фармацевтичної композиції в мозок, поєднанні з однією або кількома прийнятними фапрямим або непрямим шляхом. Способи прямого рмацевтичними допоміжними речовинами, описавведення, як правило, включають введення катеними вище. тера для постачання лікарського засобу в шлуночСполуки, як правило, є ефективними в широкову систему пацієнта з метою обходу гематоенкому діапазоні доз. Наприклад, добові дози звицефалічного бар'єру. Одна з таких придатних для чайно лежать у межах від приблизно 0,0001мг/кг імплантації систем постачання, що використовумаси тіла до приблизно 30мг/кг маси тіла. При ліється для транспортування біологічних чинників у куванні дорослих людей особлива перевага віддаконкретні анатомічні ділянки організму, описана в ється діапазону доз від приблизно 0,1мг/кг/добу до патенті США №5,011,472, який включено до цього приблизно 15мг/кг/добу, застосовуваних у формі опису шляхом посилання. Ефективність постачаноднієї дози або кількох часткових доз. Проте маня гідрофільних лікарських речовин можна підвиється на увазі, що реально застосовувану кількість щити шляхом внутрішньоартеріального вливання сполуки визначає лікар-куратор з урахуванням гіпертонічних розчинів, які тимчасово відкривають релевантних обставин, в тому числі хворобливого гематоенцефалічний бар'єр. стану, який підлягає лікуванню, обраного шляху За одним варіантом здійснення цього винаховведення, конкретної застосовуваної сполуки або ду, якому віддається перевага, пропонується фасполук, віку, маси тіла та індивідуальної реакції рмацевтична композиція, яка містить щонайменше пацієнта, а також тяжкості симптомів захворюванодну активну сполуку, описану вище, у лікарській ня у даного пацієнта, і тому вищезгадані діапазони формі, придатній для вживання защічним та/або дозування жодним чином не обмежують обсяг випід'язичним, або назальним шляхом. Цей варіант находу. В деяких випадках цілком адекватними пропонує застосування активної сполуки спосоможуть виявитися рівні дозування, що лежать нибом, який виключає ускладнення в шлунковожче нижньої межі вищезгаданого діапазону, хоча в кишковій системі, наприклад, передчасний метаінших випадках без будь-яких шкідливих побічних болізм у шлунку та/або в печінці. При цьому споефектів можуть бути використані ще більші дози, собі застосування можна також скоротити час за умови, що такі збільшені дози попередньо бувсмоктування, забезпечуючи прискорення початку дуть поділені на кілька менших доз для вживання терапевтичного ефекту. Сполуки за цим винахопротягом доби. Комп’ютерна верстка О. Гапоненко Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюPyridinoylpiperidins as agonists of 5-ht1f
Автори англійськоюCohen Michael Philip, Victor Frantz, Ying Bai-Ping, Zacherl Deanna Piatt, Zhang Deyi
Назва патенту російськоюПиридиноилпиперидины в качестве агонистов 5-ht1f
Автори російськоюКоуэн Майкл Филип, Виктор Франтц, Инь Бей-Пинь, Захерл ДиАнна Пьятт, Чжан Деи
МПК / Мітки
МПК: A61P 25/20, A61P 15/10, C07D 409/14, A61K 31/506, A61K 31/4545, C07D 401/06, A61P 25/18, C07D 405/14, C07D 401/14, A61P 25/22, A61P 25/06, A61P 25/28, A61P 25/32, A61P 43/00, A61P 25/24, A61P 25/34, A61P 15/00, A61P 17/14, C07D 417/14
Мітки: 5-ht1f, агоністи, піридиноїлпіперидини
Код посилання
<a href="https://ua.patents.su/30-77504-piridinolpiperidini-yak-agonisti-5-ht1f.html" target="_blank" rel="follow" title="База патентів України">Піридиноїлпіперидини як агоністи 5-ht1f</a>
Попередній патент: Тверда дозована форма дезінфекційного засобу, упаковка з нею, спосіб дезінфекції (варіанти)
Наступний патент: Спосіб лікування хронічного обструктивного бронхіту
Випадковий патент: Спосіб отримання мультифероїків на основі потрійних перовскітних оксидів












