Аналог 17-десметилрапаміцину та спосіб його одержання (варіанти)
Формула / Реферат
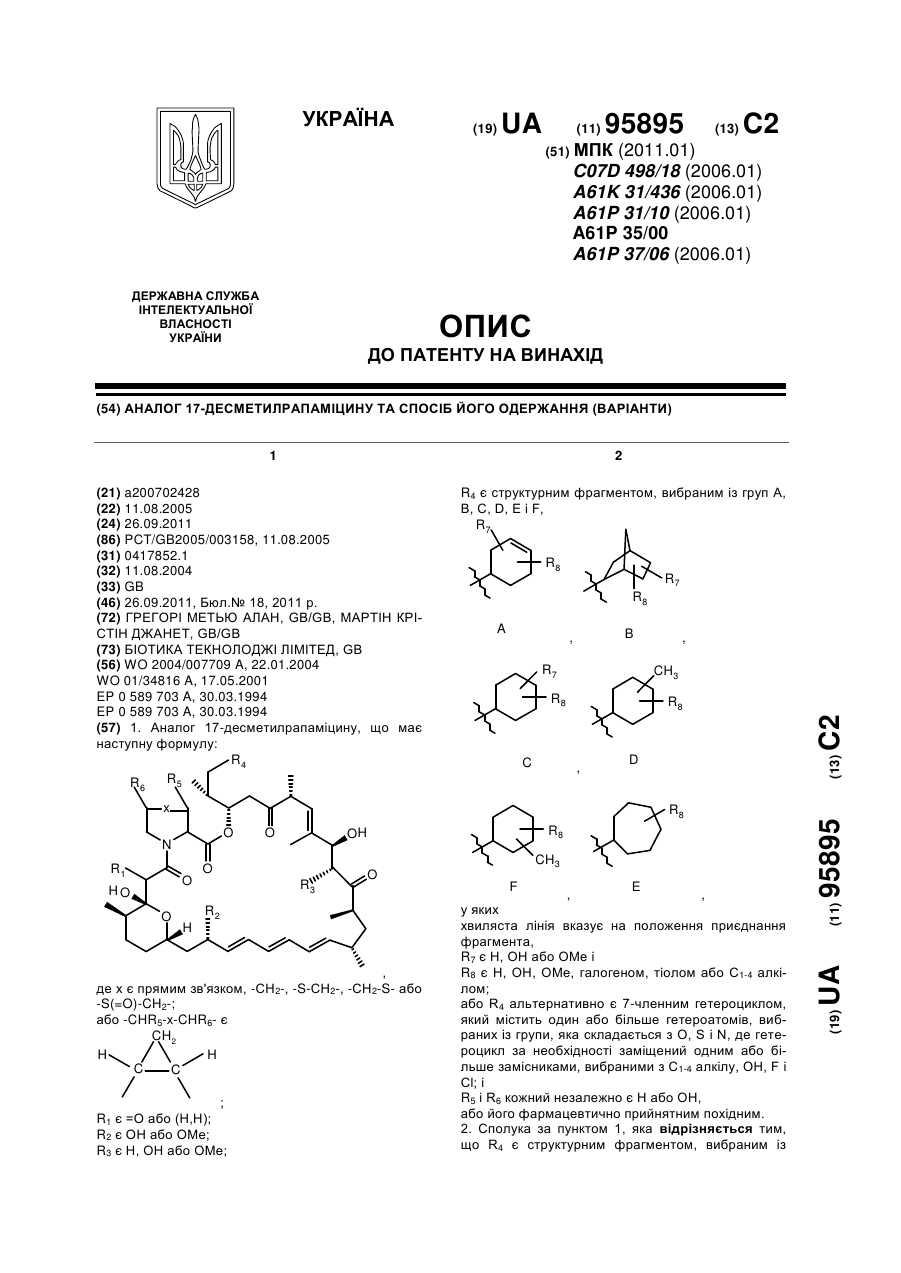
1. Аналог 17-десметилрапаміцину, що має наступну формулу:
 ,
,
де х є прямим зв'язком, -СН2-, -S-СН2-, -СН2-S- або -S(=O)-CH2-;
або -CHR5-x-CHR6- є
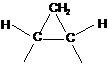 ;
;
R1 є =О або (Н,Н);
R2 є ОН або ОМе;
R3 є Н, ОН або ОМе;
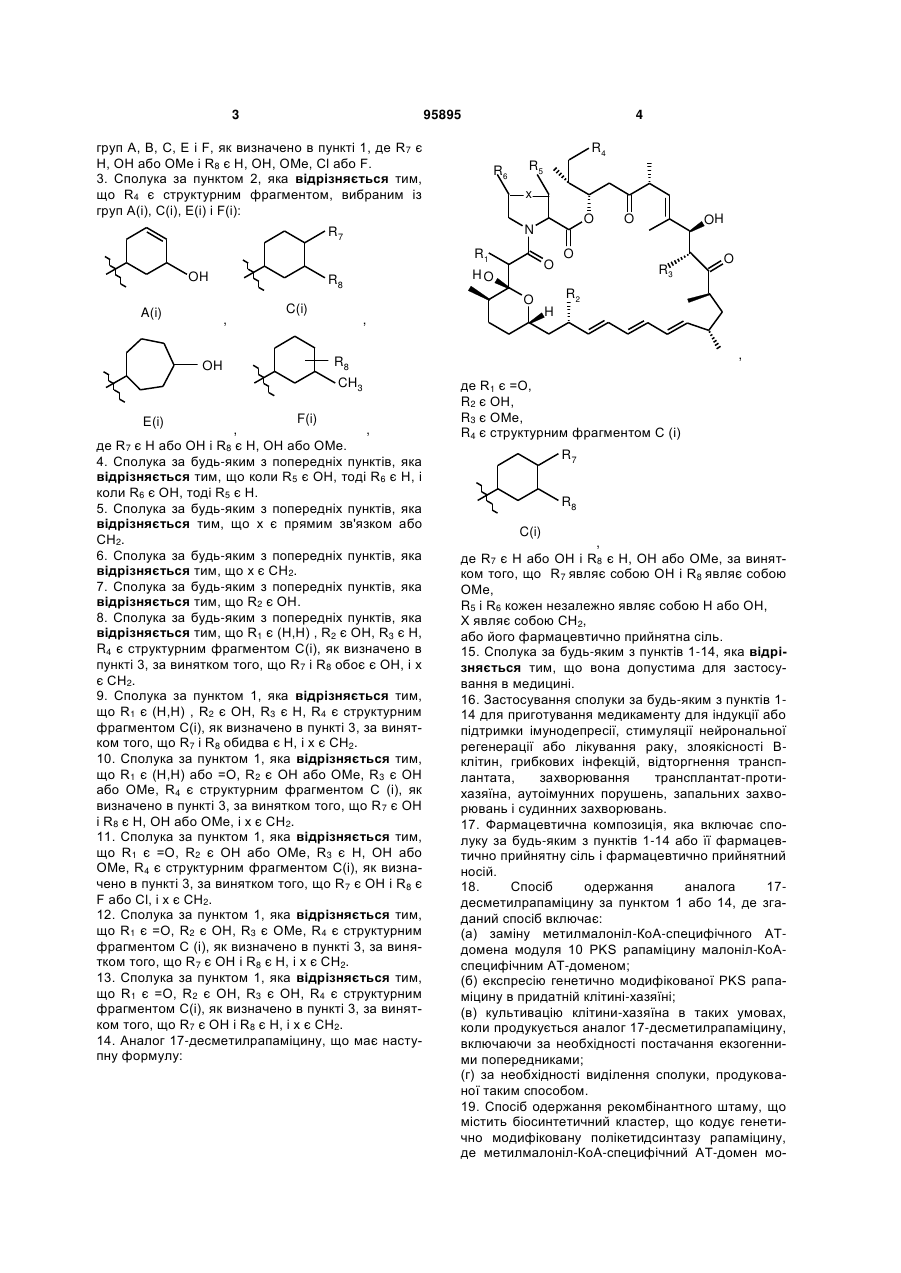
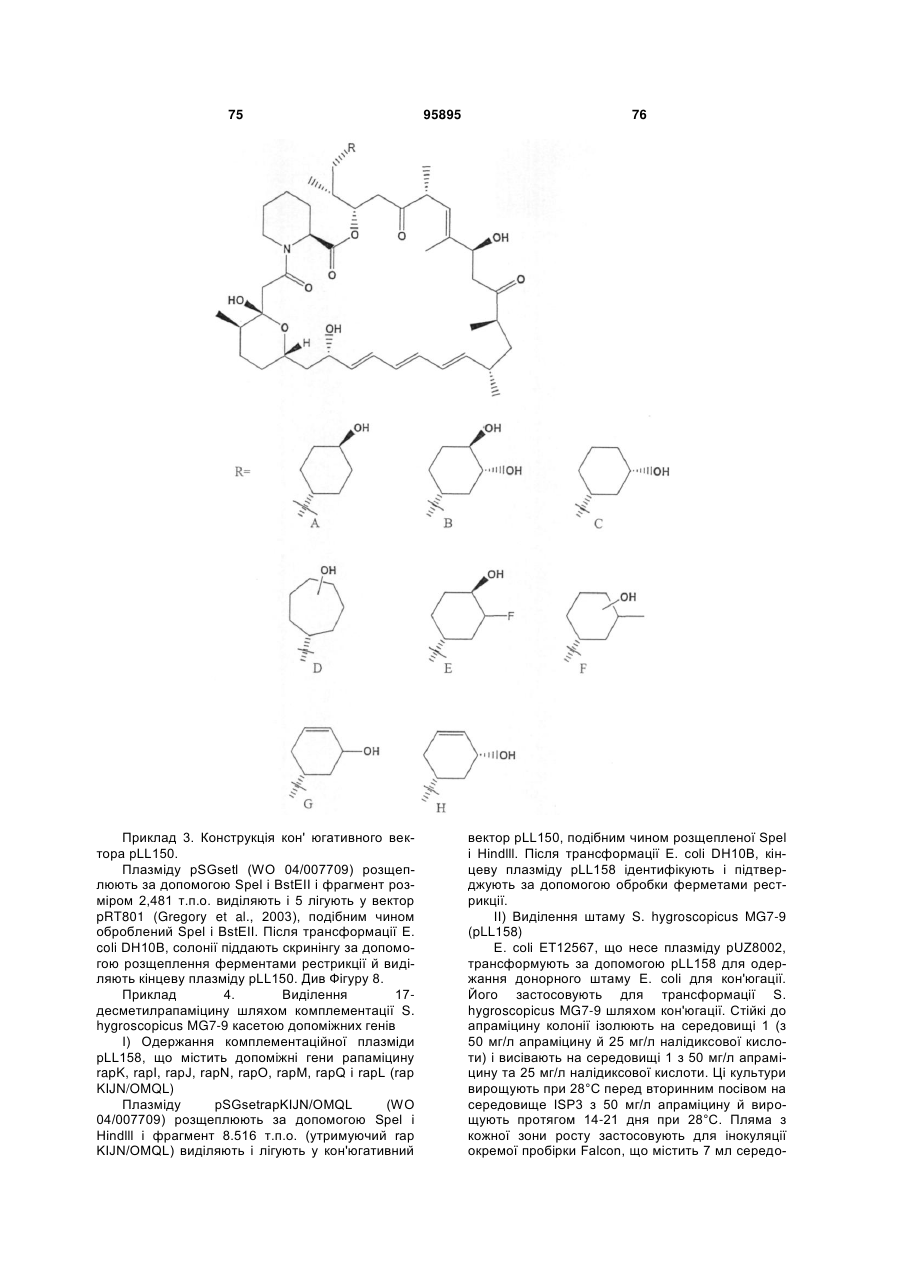
R4 є структурним фрагментом, вибраним із груп А, В, С, D, Е і F,
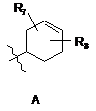 ,
,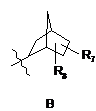 ,
,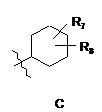 ,
,
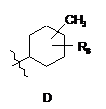 ,
, ,
,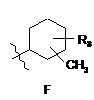 ,
,
у яких
хвиляста лінія вказує на положення приєднання фрагмента,
R7 є Н, ОН або ОМе і
R8 є Н, ОН, ОМе, галогеном, тіолом або С1-4 алкілом;
або R4 альтернативно є 7-членним гетероциклом, який містить один або більше гетероатомів, вибраних із групи, яка складається з О, S і N, де гетероцикл за необхідності заміщений одним або більше замісниками, вибраними з С1-4 алкілу, ОН, F і Сl; і
R5 і R6 кожний незалежно є Н або ОН,
або його фармацевтично прийнятним похідним.
2. Сполука за пунктом 1, яка відрізняється тим, що R4 є структурним фрагментом, вибраним із груп А, В, С, Е і F, як визначено в пункті 1, де R7 є Н, ОН або ОМе і R8 є Н, ОН, ОМе, Сl або F.
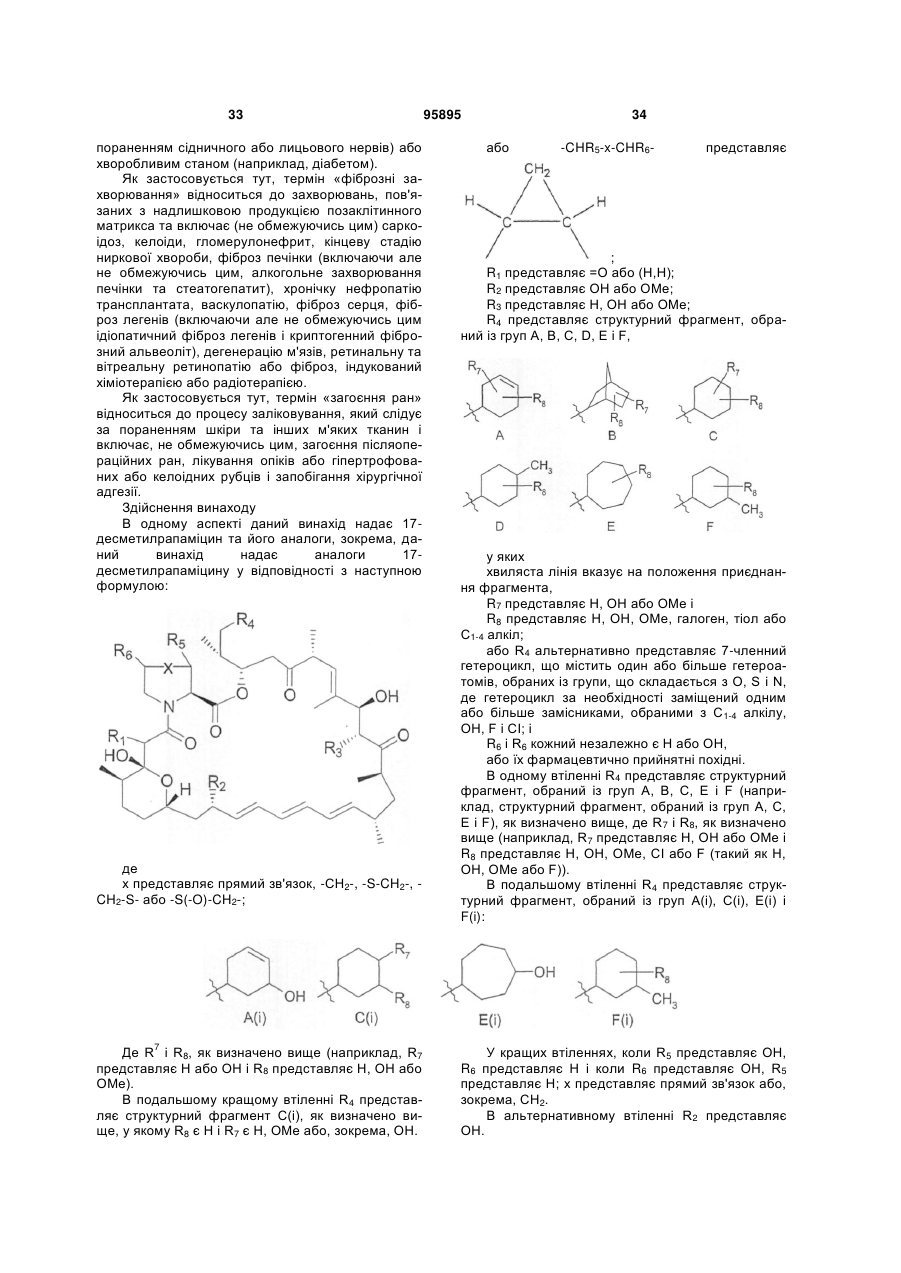
3. Сполука за пунктом 2, яка відрізняється тим, що R4 є структурним фрагментом, вибраним із груп А(і), С(і), Е(і) і F(i):
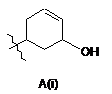 ,
,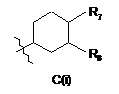 ,
,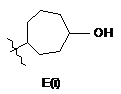 ,
,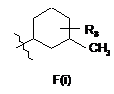 ,
,
де R7 є Н або ОН і R8 є Н, OH або ОМе.
4. Сполука за будь-яким з попередніх пунктів, яка відрізняється тим, що коли R5 є ОН, тоді R6 є Н, і коли R6 є ОН, тоді R5 є Н.
5. Сполука за будь-яким з попередніх пунктів, яка відрізняється тим, що х є прямим зв'язком або СН2.
6. Сполука за будь-яким з попередніх пунктів, яка відрізняється тим, що х є СН2.
7. Сполука за будь-яким з попередніх пунктів, яка відрізняється тим, що R2 є ОН.
8. Сполука за будь-яким з попередніх пунктів, яка відрізняється тим, що R1 є (Н,Н) , R2 є ОН, R3 є Н, R4 є структурним фрагментом С(і), як визначено в пункті 3, за винятком того, що R7 і R8 обоє є ОН, і х є СН2.
9. Сполука за пунктом 1, яка відрізняється тим, що R1 є (Н,Н) , R2 є ОН, R3 є Н, R4 є структурним фрагментом С(і), як визначено в пункті 3, за винятком того, що R7 і R8 обидва є Н, і х є СН2.
10. Сполука за пунктом 1, яка відрізняється тим, що R1 є (Н,Н) або =O, R2 є ОН або ОМе, R3 є ОН або ОМе, R4 є структурним фрагментом С (і), як визначено в пункті 3, за винятком того, що R7 є ОН і R8 є Н, ОН або ОМе, і х є СН2.
11. Сполука за пунктом 1, яка відрізняється тим, що R1 є =O, R2 є ОН або ОМе, R3 є Н, ОН або ОМе, R4 є структурним фрагментом С(і), як визначено в пункті 3, за винятком того, що R7 є ОН і R8 є F або Сl, і х є СН2.
12. Сполука за пунктом 1, яка відрізняється тим, що R1 є =O, R2 є ОН, R3 є ОМе, R4 є структурним фрагментом С (і), як визначено в пункті 3, за винятком того, що R7 є ОН і R8 є Н, і х є СН2.
13. Сполука за пунктом 1, яка відрізняється тим, що R1 є =O, R2 є ОН, R3 є ОН, R4 є структурним фрагментом С(і), як визначено в пункті 3, за винятком того, що R7 є ОН і R8 є Н, і х є СН2.
14. Аналог 17-десметилрапаміцину, що має наступну формулу:
 ,
,
де R1 є =O,
R2 є ОН,
R3 є ОМе,
R4 є структурним фрагментом С (і)
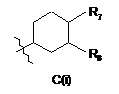 ,
,
де R7 є Н або ОН і R8 є Н, ОН або ОМе, за винятком того, що R7 являє собою ОН і R8 являє собою ОМе,
R5 і R6 кожен незалежно являє собою Н або ОН,
Х являє собою СН2,
або його фармацевтично прийнятна сіль.
15. Сполука за будь-яким з пунктів 1-14, яка відрізняється тим, що вона допустима для застосування в медицині.
16. Застосування сполуки за будь-яким з пунктів 1-14 для приготування медикаменту для індукції або підтримки імунодепресії, стимуляції нейрональної регенерації або лікування раку, злоякісності В-клітин, грибкових інфекцій, відторгнення трансплантата, захворювання трансплантат-проти-хазяїна, аутоімунних порушень, запальних захворювань і судинних захворювань.
17. Фармацевтична композиція, яка включає сполуку за будь-яким з пунктів 1-14 або її фармацевтично прийнятну сіль і фармацевтично прийнятний носій.
18. Спосіб одержання аналога 17-десметилрапаміцину за пунктом 1 або 14, де згаданий спосіб включає:
(а) заміну метилмалоніл-КоА-специфічного AT-домена модуля 10 PKS рапаміцину малоніл-КоА-специфічним АТ-доменом;
(б) експресію генетично модифікованої PKS рапаміцину в придатній клітині-хазяїні;
(в) культивацію клітини-хазяїна в таких умовах, коли продукується аналог 17-десметилрапаміцину, включаючи за необхідності постачання екзогенними попередниками;
(г) за необхідності виділення сполуки, продукованої таким способом.
19. Спосіб одержання рекомбінантного штаму, що містить біосинтетичний кластер, що кодує генетично модифіковану полікетидсинтазу рапаміцину, де метилмалоніл-КоА-специфічний АТ-домен модуля 10 замінений малоніл-КоА-специфічним АТ-доменом.
20. Спосіб за пунктом 18 або 19, який відрізняється тим, що метилмалоніл-КоА-специфічний AT-домен модуля 10 замінений малоніл-КоА-специфічним АТ-доменом з одного з наступних кластерів: рапаміцину, моненсину, FK506, еритроміцину, FK520, амфотерицину, анголаміцину, тілозину, "хіг", FK523, меридаміцину, антаскоміцину, FK525 і тсукубаміцину.
21. Спосіб за пунктом 20, який відрізняється тим, що малоніл-КоА-специфічний АТ-домен вибирають із одного з наступних кластерів: рапаміцину, моненсину та FK506.
22. Спосіб за пунктом 21, який відрізняється тим, що АТ-домен вибирають із групи, що складається з АТ-домена модуля 2 рапаміцину, АТ-домена модуля 3 моненсину, АТ-домена модуля 6 моненсину, АТ-домена модуля 8 моненсину, АТ-домена модуля 3 FK506 і АТ-домена модуля 7 FK506.
23. Спосіб за пунктом 22, який відрізняється тим, що малоніл-КоА-специфічний АТ-домен походить із модуля 2 рапаміцину.
24. Спосіб за будь-яким з пунктів 18-23, який відрізняється тим, що спосіб включає додаткові етапи:
(а) виділення AT, що підлягає введенню як єдиного фрагмента ДНК із придатними фланкуючими ділянками зв'язування рестриктаз,
(б) ампліфікацію та виділення районів послідовності ДНК, гомологічних фланкуючим послідовностям AT-мішені, з використанням підходящих ділянок зв'язування рестриктаз,
(в) лігування разом трьох фрагментів ДНК, описаних в (а) і (б), з одержанням у фазі з рамкою зчитування послідовності лівосторонньої (LHS) гомології з наступним донорним АТ-доменом з наступною правобічною (RHS) гомологією,
(г) введення повної послідовності з (в) у вектор для введення в штам-хазяїн для одержання кінцевої плазміди, де згадана плазміда включає:
(I) оrіТ для кон'югації,
(II) один або більше маркерів стійкості,
(III) чутливий до температури ориджин реплікації, так що інтегранти можна буде відбирати шляхом культивації при 37 °С і
(IV) ориджин реплікації Е. соlі,
(д) трансформацію штаму-хазяїна шляхом кон'югації із застосуванням кінцевої плазміди, як описано в (г) вище,
(e) відбір трансформованих клітин за стійкістю до відповідного антибіотика,
(ж) одержання первинних інтегрантів шляхом культивації при 37 °С із селекцією за допомогою антибіотиків,
(з) скринінг вторинних рекомбінантів шляхом вирощування під час відсутності антибіотика, також при 37 °С,
(і) ідентифікацію потрібного штаму по здатності продукувати цільовий продукт, і
(к) за необхідності підтвердження генетики штаму за допомогою стандартних способів.
25. Спосіб одержання аналога 17-десметилрапаміцину, який відрізняється тим, що згаданий спосіб включає:
(а) одержання рекомбінантного штаму за пунктом 19, у якого метилмалоніл-КоА-специфічний АТ-домен модуля 10 PKS рапаміцину замінений малоніл-КоА-специфічним АТ-доменом, і
(б) подання неприродних вихідних кислот культурі згаданого рекомбінантного штаму в умовах, що підходять для продукції полікетиду.
26. Спосіб одержання аналога 17-десметилрапаміцину, який відрізняється тим, що згаданий спосіб включає:
(а) одержання рекомбінантного штаму за пунктом 19, у якого метилмалоніл-КоА-специфічний АТ-домен модуля 10 PKS рапаміцину замінений малоніл-КоА-специфічним АТ-доменом,
(б) додатково, видалення або інактивацію одного або більше з допоміжних генів рапаміцину, вибраних з rарІ, rapJ, rapK, rapL, rapM, rapN, rapO і rapQ, і
(в) культивацію штаму, отриманого таким чином, за необхідності, у присутності екзогенного попередника, якщо потрібно, для одержання аналога 17-десметилрапаміцину.
27. Спосіб одержання аналога 17-десметилрапаміцину, який відрізняється тим, що згаданий спосіб включає:
(а) одержання рекомбінантного штаму за пунктом 19, у якого метилмалоніл-КоА-специфічний АТ-домен модуля 10 PKS рапаміцину замінений малоніл-КоА-специфічним АТ-доменом,
(б) додатково, видалення або інактивацію одного або більше з допоміжних генів рапаміцину, вибраних з rарI, rapJ, rapK, rapL, rapM, rapN, rapO і rapQ,
(в) повторне введення всіх або частини допоміжних генів рапаміцину in-trans для комплементації або для часткової комплементації делеції,
(г) культивацію штаму, отриманого таким чином, за необхідності, у присутності екзогенного попередника, якщо потрібно, для одержання аналога 17-десметилрапаміцину.
28. Спосіб одержання аналога 17-десметилрапаміцину, який відрізняється тим, що згаданий спосіб включає:
(а) одержання рекомбінантного штаму за пунктом 19, у якого метилмалоніл-КоА-специфічний АТ-домен модуля 10 PKS рапаміцину замінений малоніл-КоА-специфічним АТ-доменом,
(б) додатково, видалення або інактивацію одного або більше з допоміжних генів рапаміцину, вибраних з rарI, rapJ, rapK, rapL, rapM, rapN, rapO і rapQ,
(в) за необхідності повторне введення всіх або частини допоміжних генів in-trans для комплементації або для часткової комплементації делеції,
(г) подання неприродних вихідних кислот згаданому рекомбінантному штаму в умовах, які є придатними для продукції полікетидів.
Текст
1. Аналог 17-десметилрапаміцину, що 8 наступну формулу: AA BB R4 R5 R6 CH3 CH3 x RR 8 8 RR O O 88 OH N F 3 95895 груп А, В, С, Е і F, як визначено в пункті 1, де R7 є Н, ОН або ОМе і R8 є Н, ОН, ОМе, Сl або F. 3. Сполука за пунктом 2, яка відрізняється тим, що R4 є структурним фрагментом, вибраним із груп А(і), С(і), Е(і) і F(i): 4 R4 R6 x A(i) A(i) R OH1 OH HO R88 R , C(i) C(i) O N R77 R OH OH R5 , E(i) E(i) O O O OH O R88 R CH33 CH O R3 R2 F(i) H F(i) R77 R OH OH CH3 3 CH R88 R C(i) C(i) F(i) F(i) , , де R7 є Н або ОН і R8 є Н, OH або ОМе. 4. Сполука за будь-яким з попередніх пунктів, яка відрізняється тим, що коли R5 є ОН, тоді R6 є Н, і коли R6 є ОН, тоді R5 є Н. OH 5. Сполука за будь-яким з попередніх пунктів, яка відрізняється тим, що х є прямим зв'язком або A(i) СН2. 6. Сполука за будь-яким з попередніх пунктів, яка відрізняється тим, що х є СН2. 7. Сполука за будь-яким з попередніх пунктів, яка відрізняється тим, що R2 є ОН. 8. Сполука за будь-яким з попередніх пунктів, яка відрізняється тим, що R1 є (Н,Н) , R2 є ОН, R3 є Н, R4 є структурним фрагментом С(і), як визначено в пункті 3, за винятком того, що R7 і R8 обоє є ОН, і х є СН2. 9. Сполука за пунктом 1, яка відрізняється тим, що R1 є (Н,Н) , R2 є ОН, R3 є Н, R4 є структурним фрагментом С(і), як визначено в пункті 3, за винятком того, що R7 і R8 обидва є Н, і х є СН2. 10. Сполука за пунктом 1, яка відрізняється тим, що R1 є (Н,Н) або =O, R2 є ОН або ОМе, R3 є ОН або ОМе, R4 є структурним фрагментом С (і), як визначено в пункті 3, за винятком того, що R7 є ОН і R8 є Н, ОН або ОМе, і х є СН2. 11. Сполука за пунктом 1, яка відрізняється тим, що R1 є =O, R2 є ОН або ОМе, R3 є Н, ОН або ОМе, R4 є структурним фрагментом С(і), як визначено в пункті 3, за винятком того, що R7 є ОН і R8 є F або Сl, і х є СН2. 12. Сполука за пунктом 1, яка відрізняється тим, що R1 є =O, R2 є ОН, R3 є ОМе, R4 є структурним фрагментом С (і), як визначено в пункті 3, за винятком того, що R7 є ОН і R8 є Н, і х є СН2. 13. Сполука за пунктом 1, яка відрізняється тим, що R1 є =O, R2 є ОН, R3 є ОН, R4 є структурним фрагментом С(і), як визначено в пункті 3, за винятком того, що R7 є ОН і R8 є Н, і х є СН2. 14. Аналог 17-десметилрапаміцину, що має наступну формулу: E(i) E(i) , R88 R де R1 є =O, R2 є ОН, R3 є ОМе, R4 є структурним фрагментом С (і) R7 R8 OH CH3 R8 C(i) E(i) , де R7 є Н або ОН і R8 є Н, ОН або ОМе, за винятком того, що R7 являє собою ОН і R8 являє собою ОМе, R5 і R6 кожен незалежно являє собою Н або ОН, Х являє собою СН2, або його фармацевтично прийнятна сіль. 15. Сполука за будь-яким з пунктів 1-14, яка відрізняється тим, що вона допустима для застосування в медицині. 16. Застосування сполуки за будь-яким з пунктів 114 для приготування медикаменту для індукції або підтримки імунодепресії, стимуляції нейрональної регенерації або лікування раку, злоякісності Вклітин, грибкових інфекцій, відторгнення трансплантата, захворювання трансплантат-протихазяїна, аутоімунних порушень, запальних захворювань і судинних захворювань. 17. Фармацевтична композиція, яка включає сполуку за будь-яким з пунктів 1-14 або її фармацевтично прийнятну сіль і фармацевтично прийнятний носій. 18. Спосіб одержання аналога 17десметилрапаміцину за пунктом 1 або 14, де згаданий спосіб включає: (а) заміну метилмалоніл-КоА-специфічного ATдомена модуля 10 PKS рапаміцину малоніл-КоАспецифічним АТ-доменом; (б) експресію генетично модифікованої PKS рапаміцину в придатній клітині-хазяїні; (в) культивацію клітини-хазяїна в таких умовах, коли продукується аналог 17-десметилрапаміцину, включаючи за необхідності постачання екзогенними попередниками; (г) за необхідності виділення сполуки, продукованої таким способом. 19. Спосіб одержання рекомбінантного штаму, що містить біосинтетичний кластер, що кодує генетично модифіковану полікетидсинтазу рапаміцину, де метилмалоніл-КоА-специфічний АТ-домен мо F(i) 5 дуля 10 замінений малоніл-КоА-специфічним АТдоменом. 20. Спосіб за пунктом 18 або 19, який відрізняється тим, що метилмалоніл-КоА-специфічний ATдомен модуля 10 замінений малоніл-КоАспецифічним АТ-доменом з одного з наступних кластерів: рапаміцину, моненсину, FK506, еритроміцину, FK520, амфотерицину, анголаміцину, тілозину, "хіг", FK523, меридаміцину, антаскоміцину, FK525 і тсукубаміцину. 21. Спосіб за пунктом 20, який відрізняється тим, що малоніл-КоА-специфічний АТ-домен вибирають із одного з наступних кластерів: рапаміцину, моненсину та FK506. 22. Спосіб за пунктом 21, який відрізняється тим, що АТ-домен вибирають із групи, що складається з АТ-домена модуля 2 рапаміцину, АТ-домена модуля 3 моненсину, АТ-домена модуля 6 моненсину, АТ-домена модуля 8 моненсину, АТ-домена модуля 3 FK506 і АТ-домена модуля 7 FK506. 23. Спосіб за пунктом 22, який відрізняється тим, що малоніл-КоА-специфічний АТ-домен походить із модуля 2 рапаміцину. 24. Спосіб за будь-яким з пунктів 18-23, який відрізняється тим, що спосіб включає додаткові етапи: (а) виділення AT, що підлягає введенню як єдиного фрагмента ДНК із придатними фланкуючими ділянками зв'язування рестриктаз, (б) ампліфікацію та виділення районів послідовності ДНК, гомологічних фланкуючим послідовностям AT-мішені, з використанням підходящих ділянок зв'язування рестриктаз, (в) лігування разом трьох фрагментів ДНК, описаних в (а) і (б), з одержанням у фазі з рамкою зчитування послідовності лівосторонньої (LHS) гомології з наступним донорним АТ-доменом з наступною правобічною (RHS) гомологією, (г) введення повної послідовності з (в) у вектор для введення в штам-хазяїн для одержання кінцевої плазміди, де згадана плазміда включає: (I) оrіТ для кон'югації, (II) один або більше маркерів стійкості, (III) чутливий до температури ориджин реплікації, так що інтегранти можна буде відбирати шляхом культивації при 37 °С і (IV) ориджин реплікації Е. соlі, (д) трансформацію штаму-хазяїна шляхом кон'югації із застосуванням кінцевої плазміди, як описано в (г) вище, (e) відбір трансформованих клітин за стійкістю до відповідного антибіотика, (ж) одержання первинних інтегрантів шляхом культивації при 37 °С із селекцією за допомогою антибіотиків, (з) скринінг вторинних рекомбінантів шляхом вирощування під час відсутності антибіотика, також при 37 °С, (і) ідентифікацію потрібного штаму по здатності продукувати цільовий продукт, і 95895 6 (к) за необхідності підтвердження генетики штаму за допомогою стандартних способів. 25. Спосіб одержання аналога 17десметилрапаміцину, який відрізняється тим, що згаданий спосіб включає: (а) одержання рекомбінантного штаму за пунктом 19, у якого метилмалоніл-КоА-специфічний АТдомен модуля 10 PKS рапаміцину замінений малоніл-КоА-специфічним АТ-доменом, і (б) подання неприродних вихідних кислот культурі згаданого рекомбінантного штаму в умовах, що підходять для продукції полікетиду. 26. Спосіб одержання аналога 17десметилрапаміцину, який відрізняється тим, що згаданий спосіб включає: (а) одержання рекомбінантного штаму за пунктом 19, у якого метилмалоніл-КоА-специфічний АТдомен модуля 10 PKS рапаміцину замінений малоніл-КоА-специфічним АТ-доменом, (б) додатково, видалення або інактивацію одного або більше з допоміжних генів рапаміцину, вибраних з rарІ, rapJ, rapK, rapL, rapM, rapN, rapO і rapQ, і (в) культивацію штаму, отриманого таким чином, за необхідності, у присутності екзогенного попередника, якщо потрібно, для одержання аналога 17десметилрапаміцину. 27. Спосіб одержання аналога 17десметилрапаміцину, який відрізняється тим, що згаданий спосіб включає: (а) одержання рекомбінантного штаму за пунктом 19, у якого метилмалоніл-КоА-специфічний АТдомен модуля 10 PKS рапаміцину замінений малоніл-КоА-специфічним АТ-доменом, (б) додатково, видалення або інактивацію одного або більше з допоміжних генів рапаміцину, вибраних з rарI, rapJ, rapK, rapL, rapM, rapN, rapO і rapQ, (в) повторне введення всіх або частини допоміжних генів рапаміцину in-trans для комплементації або для часткової комплементації делеції, (г) культивацію штаму, отриманого таким чином, за необхідності, у присутності екзогенного попередника, якщо потрібно, для одержання аналога 17десметилрапаміцину. 28. Спосіб одержання аналога 17десметилрапаміцину, який відрізняється тим, що згаданий спосіб включає: (а) одержання рекомбінантного штаму за пунктом 19, у якого метилмалоніл-КоА-специфічний АТдомен модуля 10 PKS рапаміцину замінений малоніл-КоА-специфічним АТ-доменом, (б) додатково, видалення або інактивацію одного або більше з допоміжних генів рапаміцину, вибраних з rарI, rapJ, rapK, rapL, rapM, rapN, rapO і rapQ, (в) за необхідності повторне введення всіх або частини допоміжних генів in-trans для комплементації або для часткової комплементації делеції, (г) подання неприродних вихідних кислот згаданому рекомбінантному штаму в умовах, які є придатними для продукції полікетидів. 7 Область техніки, до якої відноситься винахід Даний винахід відноситься до продукції полікетидів і інших природних продуктів і до бібліотек сполук і індивідуальних нових сполук. Тому в одному аспекті даний винахід надає 17десметилрапаміцин та його аналоги, способи їхнього одержання, включаючи рекомбінантні штами та виділення, і застосування сполук за винаходом. В іншому аспекті даний винахід надає застосування цих нових аналогів рапаміцину для індукції або підтримки імунодепресії, стимуляції регенерації нервової тканини або лікування раку, злоякісності В-клітин, грибкових інфекцій, відторгнення трансплантата, захворювання трансплантат-протихазяїна, аутоімунних порушень, запальних захворювань, судинних захворювань та фіброзних захворювань і в регуляції загоєння ран. У конкретному втіленні даний винахід надає способи інженерії біосинтетичних генів, керуючих продукцією рапаміцину, для того, щоб одержувати генетично модифіковані штами, які продукують 17десметилрапаміцин та його аналоги. Винахід також відноситься до способів одержання бібліотеки аналогів 17-десметилрапаміцину шляхом подання такому штаму неприродних вихідних кислот і до бібліотеки сполук, отриманих таким чином, і до генерації похідних штамів, у яких клоновані гени або касети генів експресуються з метою генерації інших аналогів та способам їхнього одержання й засобам, задіяних тут (наприклад, нуклеїновим кислотам, векторам, касетам генів і генетично модифікованим штамам). Рівень техніки Рапаміцин (сиролімус) (Фігура 1) є ліпофільним макролідом, який продукується Streptomyces hygroscopicus NRRL 5491 (Sehgal et al., 1975; Vézina et al., 1975; U.S. 3929992; U.S. 3993749), з 1, 2, 3-трикарбонільною частиною, пов'язаною з лактоном піпеколінової кислоти (Paiva et al., 1991). Інші споріднені макроліди (Фігура 2) включають FK 506 (такролімус) (Schreiber and Crabtree, 1992), FK520 (аскоміцин або імуноміцин) (Wu et al., 2000), FK525 (Hatanaka H. et al., 1989), FK523 (Hatanaka H. et al., 1988), антаскоміцини (Fehr T. et al., 1996) та меридаміцин (Salituro et al., 1995). Для цілей даного винаходу нумерація атомів рапаміцину дана згідно McAlpine et al., (1991) на проти вагу нумераціям згідно Findlay et al., (1980) або th Chemical Abstracts (11 Cumulative Index, 19821986 p60719CS). Полікетидний кістяк рапаміцину синтезується шляхом конденсації «голова-до-хвоста» у цілому семи пропіонатних і семи ацетатних ланок з вихідною ланкою похідного шикімата циклогексанкарбонової кислоти (Paiva et al., 1991). Амінокислотапохідне L-лізина, піпеколінова кислота, конденсується через амідний зв'язок з останнім ацетатом полікетидного кістяка (Paiva et al., 1993), за чим слідує лактонізація з утворенням макроциклу. Район гена розміром 107 тисяч пар основ (т.п.о.), що містить кластер біосинтетичних генів, секвенований (Schwecke et al., 1995). Аналіз із відкритою рамкою зчитування виявив три великі гени, які кодують модульну полікетид-синтазу (PKS) 95895 8 (Aparicio et al., 1996; Schwecke et al., 1995). Розташований між генами PKS, перебуває ген rapP, що кодує білок, з послідовності, яка є подібною, з доменами активації нерибосомальних пептид-синтаз і, як вважається, що діє аналогічним чином (Koenig et аl.,1997). Район, що кодує гени PKS, фланкований по обидва боки 24 додатковими відкритими рамками зчитування кодуючими ферменти, які вважаються необхідними для біосинтезу рапаміцину (Molhar et al., 1996). Вони включають наступні ферменти пост-полікетидної модифікації: дві цитохром Р-450 монооксигенази, які називають RapJ і RapN, зв'язаний фередоксин RapO та три SAMзалежні О-метилтрансферази Rapl, RapM і RapQ. Інші суміжні гени відіграють передбачувану роль у регуляції та експорті рапаміцину (Molhar et al., 1996). Кластер також містить ген rapL, продукт якого RapL, як передбачається, каталізує утворення попередника рапаміцину L-піпеколінову кислоту шляхом циклодеамінації L-лізина (Khaw et al., 1998; Paiva et al., 1993). Полікетидна серцевина рапаміцину збирається дуже великими багатофункціональними білками, які включають полікетид-синтазу Типу І (rap PKS). Цей поліпептидний комплекс включає завантажувальний модуль і чотирнадцять модулів, що надбудовують, де кожний модуль відповідає як за додавання конкретного попередника ацил-коа до зростаючого полікетидного ланцюга так і за ступінь відновлення -кетокарбонільної групи. Кожний модуль здійснює кілька біохімічних реакцій, які проводяться окремими доменами поліпептиду. Всі модулі, що надбудовують, містять домен ацилтрансферази (AT), що вибирає та потім донує ацильну групу попередника домену білка-переносника ацила (АСР), і домен -кетосинтази (KS), що потім додає вже існуючий полікетидний ланцюг до нового ацил-АСР шляхом декарбоксилюючої конденсації. Додаткові домени присутні на деяких модулях, що надбудовують: домени -кеторедуктази (КР), які відновлюють -кето-групи до гідроксилів, домени дегідратази (DH), які діють на гідроксили для одержання подвійних зв'язків, і домени еноілредуктази (ER), які відновлюють подвійні зв'язки з одержанням насичених вуглеців. Передбачено, що присутні в модулях 3 і 6 домени процесингу (обробки) -кето-груп, неактивні, оскільки дія цих доменів не відображена в основній структурі. Кінцевий модуль, що надбудовує (модуль 14), очевидно, не містить доменів обробки -кето-груп. Запуск біосинтезу рапаміцину відбувається шляхом включення 4,5-дигідроксициклогекс-1-енокарбонової кислоти, яка отримана шикіматним шляхом (Lowden, P. A. S., et al. 2001) і є загальною для інших FKBP-зв' язуючих молекул, таких як FK506 і FK520 (Фігура 2). Слідом за біосинтезом полікетида, модуль NRPS, що кодується rapP, включає піпеколінову кислоту (похідне L-лізина), що конденсується через амідний зв'язок з останнім ацетатом полікетидного кістяка (Paiva et al., 1993). За цим слідує лактонізація з утворенням макроциклу. Нуклеотидна послідовність кожного із трьох генів PKS рапаміцину, NRPS-гена, який кодує, та фланкуючі послідовності пізніх генів і відповідних 9 поліпептидів ідентифіковані Aparicio et al., 1996, і Schwecke et al., 1995 і поміщені в NCBI під інвентарним номером Х86780 і виправлення цієї послідовності недавно опубліковані в WO 04/007709. Перший вільний від ферментів продукт кластера біосинтезу рапаміцину названий прерапаміцином (WO 04/007709, Gregory et al., 2004). Одержання повністю доробленого рапаміцину вимагає додаткової обробки полікетид/NRPSсерцевини за допомогою ферментів, які кодуються пізніми генами рапаміцину RapJ, RapN, RapO, RapM, RapQ і Rapl. Рапаміцин має велике фармакологічне значення через широкий спектр активностей, що проявляються цією сполукою; це надає особливого значення необхідності одержання нових аналогів цих ліків. Рапаміцин проявляє помірну протигрибкову активність, в основному проти видів Candida, а також проти нитчатих грибків (Baker et al., 1978; Sehgal et al., 1975; Vézina et al., 1975; U.S. 3929992; U.S. 3993749). Рапаміцин інгібує проліферацію клітин, націлюючись на шляхи трансдукції сигналу в різних типів клітин, тобто шляхом інгібування сигнальних шляхів, необхідних для переходу з G1 в S-Фазу клітинного циклу (Kuo et al., 1992). У Т-клітинах рапаміцин інгібує проведення сигналу від рецептора IL-2 і наступну аутопроліферацію Тклітин, приводячи до імунодепресії. Інгібуючі ефекти рапаміцину не обмежуються Т-клітинами, оскільки рапаміцин інгібує проліферацію багатьох типів клітин ссавців (Brunn et al., 1996). Тому рапаміцин є сильним імунодепресантом із установленими або передбаченими терапевтичними застосуваннями для запобігання відторгнення органа алотранстплантата та для лікування аутоімунних захворювань (Kahan et al., 1991). 40О-(2-гідрокси) етил-рапаміцин (SDZ RAD, Certican, everolimus) є напівсинтетичним аналогом рапаміцину, що проявляє імунодепресивні фармакологічні дії (Sedrani, R. et al., 1998; Kirchner et al., 2000; U.S. 5,665,772). Схвалення цих ліків отримане для Європи в 2003 році та, як очікується, буде отримане в US незабаром. Ефір рапаміцину ССІ-779 (Wyeth-Ayerst) інгібує ріст клітин in vitro та інгібує ріст пухлин in vivo (Yu et al., 2001). CCI-779 у даний час перебуває у фазі III клінічних випробувань. Значення рапаміцину для лікування хронічного плямистого псоріазу (Kirby and Griffiths, 2001), можливе застосування таких ефектів як стимуляція росту аксонів у РС12 клітин (Lyons et al., 1994), блокування проліферативних відповідей на цитокіни в клітин судинної та гладкої мускулатури після механічного поранення (Gregory et al., 1993) і його роль у запобіганні фіброзу алотрансплантату (Waller and Nicholson, 2001) є областями інтенсивних досліджень (Kahan and Camardo, 2001). Недавні повідомлення показують, що рапаміцин зв'язують зі зниженою наявністю рака у хворих з алотранстплантатами органів при тривалій імунодепресивній терапії, ніж у таких при інших імунодепресивних курсах лікування та що ця знижена частота захворювання раком обумовлена інгібуванням ангіогенезу (Guba et al., 2002). Показано, що нейротрофні активності імунофілінових лігандів незалежні від їхньої імунодепресивної активно 95895 10 сті (Steiner et al., 1997) і що стимуляції росту нервової тканини сприяє руйнування комплексу зрілих стероїдних рецепторів, як описано в патентній заявці WO 01/03692. Виявлено побічні дії такі як гіперліпідемия та тромбоцитопенія, а також можливі тератогенні дії (Hentges et al., 2001; Kahan and Camardo, 2001). Рапаміцин діє на сигнальні каскади усередині S6k клітин шляхом інгібування p70 кінази, серин/треонін кінази у вищих еукаріотів, які фосфорилюють рибосомальний білок S6 (Ferrari et al., 1993; Kuo et al., 1992). Білок S6 перебуває в рибосомальній субодиниці 40S та, як вважається, є важливою функціональною ділянкою, залученою у зв'язування тРНК і мРНК. Регуляція трансляції S6k мРНК шляхом фосфорилювання p70 постульована (Kawasome et al., 1998). Рапаміцин інгібує синтез білка шляхом дії на інші пов'язані з ростом події, включаючи активність циклін-залежних кіназ, фосфорилювання модулятора цАМФреспонсивного елемента (CREM) і фосфорилювання білка, який зв'язує фактор елонгації 4Е-ВР1 (PHAS1) (Hung et al., 1996). Ліки індукують накопичення дефосфорильованих видів 4Е-ВР1, які зв'язуються з фактором ініціації трансляції eIF-4E, у такий спосіб придушуючи ініціацію трансляції капзалежних мРНК (Hara et al., 1997; Raught et al., 2001). Вважається, що фармакологічні дії рапаміцину, охарактеризовані на даний момент, опосередковані взаємодією із цитозольними рецепторами, які називають FKBP або імунофілінами. Імунофіліни (цей термін застосовується для позначення білків, що зв'язують імунодепресант) катализують цис і транс- ізомеризацію зв'язків пептидил-пролін і належать до висококонсервативного сімейства ферментів, виявлених у широкої розмаїтості організмів (Rosen and Schreiber, 1992). Дві більші групи ферментів, що належать до сімейства імунофілінів, представлені FKBP та циклофілінами (Schreiber and Crabtree, 1992). Основним внутрішньоклітинним рецептором рапаміцину в еукаріотичних Т-клітин є FKBP12 (DiLella and Craig, 1991) і комплекс, який утвориться, специфічно взаємодіє з білками-мішенями, так щоб інгібувати каскад передачі сигналу в клітині. Аналіз кристалічної структури комплексу FKBP 12-рапаміцин ідентифікував рапаміцин-єднальний фармакофор, який назвали «єднальним доменом» (Van Duyne et al., 1993) (див. Фігуру 1). «Єднальний домен» необхідний для взаємодії з імунофіліном і складається з району С-1 - С-14, включаючи складноефірний зв'язок, кільце похідне піпеколінової кислоти, дикарбоніл і кільце семикеталю. Взаємодія характеризується багатьма гідрофобними контактами та декількома водневими зв'язками, включаючи одну з гідроксильною групою на циклогексановому кільці. Піпеколінове кільце (С2 - N7) глибше всього проникає в білок, де воно оточено висококонсервативними залишками ароматичних амінокислот, що вистилають гідрофобну єднальну порожнину. Обидві карбонільні групи С1 і С8 залучені до утворення водневих зв'язків і С9 карбонільна група висунута в кишеню, утворену трьома зовсім консервативними залишками ароматичних амінокис 11 лот (один тирозин і два фенілаланіна) в FKBP12. Домен комплексу імунофілін-ліганд, що взаємодіє з білками-мішенями, виступає з FKBP. Більшість імунофілінів не представляються прямо залученими в імунодепресивні активності та порівняно мало відомо про їх природні ліганди, хоча кандидати на роль природних лігандів FKBP, які називають FKBP-зв'язаними білками (FA), такі як FAP48 і FAP1, були описані. Специфічна взаємодія FAP з FKBP під час утворення комплексів запобігає рапаміцином залежним від дози чином (Chambraud et al., 1996; Kunz et al., 2000). Очевидно, імунофіліни зайняті в широкому спектрі клітинних активностей, таких як укладання білків, складання та переміщення білків, со-регуляція молекулярних комплексів, включаючи білки теплового шоку, стероїдні рецептори, іонні канали, взаємодії клітини із клітиною та транскрипцію і трансляцію генів (Galat 2000; Hamilton and Steiner 1998). Всі імунофіліни мають властивість організовувати вторинну структуру білків шляхом цис-трансізомеризації зв'язку пептид-проліл і декілька імунофілінів виявлено в ендоплазматичному ретикулюмі, основному місці синтезу білка в клітині. На додаток до FKBP12 (US 5109112), інші імунофіліни включають FKBP12.6 (US 5457182), FKBP13 (Hendrickson et al., 1993; U.S. 5498597), FKBP25 (Hung and Schreiber, 1992; Jin et al., 1992), FKBP14.6 (U.S. 5354845), FKBP52 (U.S. 5763590), FKBP60 (Yem et al., 1992) i FKBP65 (Patterson et al., 2000). Мішень рапаміцин-РКВР12 комплексу ідентифікована в дріжджів як TOR (target of rapamycin) (Alarcon et al., 1999) і білок ссавців відомий як FRAP (FKBP-rapamycin associated protein) або mTOR (mammalian target of rapamycin) (Brown et al., 1994). Ці білки демонструють значну подібність із фосфотрансферазними доменами фосфатидилінозитол 3-кіназ і те спостереження, що крапкова мутація в FKBP 12-рапаміцин зв'язуючому домені (FRB) в mTOR усуває кіназну активність mTOR, надає доказ участі FRB у роботі кіназного домена (Vilella-Bach et al., 1999). Отримано кристалічну структуру FKBP 12-рапаміцину з усіченою формою mTOR, що містить FRB-домен (Chen et al., 1995), визначаючи в такий спосіб «ефекторний» домен рапаміцину (Choi et al., 1996; Liang et al., 1999). Аналіз кристалічної структури виявляє, що білокбілкові контакти досить обмежені в порівнянні із взаємодією між рапаміцином і кожним білком. Ніякі водневі зв'язки між рапаміцином і FRB не ідентифіковані. Взаємодія зосереджена в серії гідрофобних контактів між триєновим районом рапаміцину та в основному ароматичними залишками FRB (Liang et al., 1999). Найбільш глибоко зануреними атомами рапаміцину є метил, з'єднаний із С23 (див. Фігуру 1). Район С23-С24 і циклогексильне кільце рапаміцину утворюють гідрофобні контакти з FRB. Невелика конформаційна зміна рапаміцину очевидна між подвійним та потрійним комплексами (Liang et al., 1999). Виявлено розбіжності між біологічними ефектами аналогів рапаміцину, модифікованих по С16 метокси-групі, та їхньою здатністю зв'язувати FKBP12 і постульоване розташування замісників у 95895 12 С16 на поверхні розділу між FKBP12 і mTOR (Luengo et al., 1995). Аналіз кристалічної структури FKBP12 з не-імунорепресивним 28-О-метилрапаміцином виявляє велике розходження орієнтації циклогексильного кільця, що може призвести до порушення зв'язування mTOR (Kallen et al., 1996). Описано зв'язок між передачею сигналу mTOR і синтезом білка, який перебуває в нейронах, його дія на рівень фосфорилювання білків, включених у контроль трансляції, надлишок компонентів апарата трансляції на транскрипційному та трансляційному рівнях, контроль активності пермеази амінокислот і координація транскрипції багатьох ферментів, включених у метаболічні шляхи (Raught et al., 2001). Чутливі до рапаміцину шляхи передачі сигналу також, очевидно, відіграють важливу роль в ембріональному розвитку мозку, навчанні та формуванні пам'яті (Tang et al., 2002). Дослідження TOR білків у дріжджів також виявляє їхню роль у модуляції чутливих до живильних речовин шляхів передачі сигналу (Hardwick et al., 1999). Подібним чином, mTOR ідентифікований як пряма мішень для дії протеїнкінази В (akt) і як відіграючий ключову роль у передачі сигналу інсуліну (Shepherd et al., 1998; Navé et al., 1999). TOR ссавців також включена в поляризацію актинового цитоскелету та регуляцію ініціації трансляції (Alarcon et al., 1999). Фосфатидилінозит 3-кінази, такі як mTOR, задіяні в декількох аспектах патогенезу пухлин, таких як прогресія клітинного циклу, адгезія, клітинне виживання та ангіогенез (Roymans and Siegers, 2001). Безліч FKBP, присутніх у різних типах клітин, також підкреслює користь виділення нових аналогів FKBP-ліганда з можливо зміненими зв'язуючим та/або ефекторним доменами. Наприклад, саме інгібування ферменту ротамази FKBP52, що утворює частину комплексу стероїдного рецептора, ідентифіковано як механізм, за допомогою якого аналоги рапаміцину (та інші FKBP 12- зв'язуючі сполуки) стримують (moderate) регенерацію нервової тканини і ріст аксонів (WO 01/03692). Фармакокінетичні дослідження рапаміцину та аналогів рапаміцину продемонстрували необхідність розробки нових сполук рапаміцину, які були б більш стабільними в розчині, більш стійкими до метаболічної атаки та/або володіли б поліпшеною біодосяжністю. Багато звертаються до модифікації рапаміцину по хімічно доступних положеннях (див. нижче). Однак цей підхід обмежений усього декількома ділянками, доступними для хімічної модифікації та надалі обмежений у своїй застосовності труднощами вибіркової модифікації по конкретній позиції в присутності інших реакційно-здатних ділянок молекули. Описано ряд аналогів рапаміцину, синтезованих із застосуванням хімічно доступних ділянок. Опис наступних сполук пристосовано до системи нумерації молекули рапаміцину, наведеної на Фігурі 1. Хімічно доступні ділянки молекули для одержання похідних або заміщення включають С40 та С28 гідроксильні групи (наприклад, U.S. №№ 5665772; 5362718), С39 і С16 метокси групи (наприклад WO 96/41807; U.S. 5728710), C32, C26 і 13 С9 кето-групи (наприклад, U.S. №№ 5378836; 5138051; 5665772). Гідрування по С17, С19 та/або С21, спрямоване на триєни, призводить до збереження протигрибкової активності, але до відносної втрати імунодепресивної активності (наприклад, U.S. №№ 5391730; 5023262). Значне поліпшення стабільності молекули (наприклад, утворення оксимів при С32, С40 та/або С28, U.S. №№ 5563145, 5446048), стійкість до метаболичної атаки (наприклад, U.S. №№ 5912253), біодосяжність (наприклад, U.S. №№ 5221670; 5955457; WO 98/04279) і одержання проліків (наприклад, U.S. №№ 6015815; 5432183) досягнуте шляхом дериватизації. Однак, хімічна модифікація вимагає значних кількостей вихідного рапаміцину та, як із сполукою чутливою до кислоти і лугу, з нею важко працювати. Хоча хімічна дериватизація може бути вибірковою по групі, вона навряд чи може бути вибірковою по ділянці. Внаслідок цього, хімічна модифікація часто має потребу в множинних етапах введення та зняття захисту із групи і може призводити до змішаних продуктів з виходами, що варіюють. Біологічні підходи до одержання нових аналогів рапаміцину спочатку були повільними через труднощі, які зустрілися при роботі з організмомпродуцентом (Lomovskaya et al., 1997; Kieser et al., 2000) незважаючи на доступність послідовності кластера генів біосинтезу рапаміцину з S. hygroscopicus (Aparicio et al., 1996; Schwecke et al., 1995). Недавня патентна заявка даного винахідника описує більш широкий спектр аналогів рапаміцину, ніж доступні раніше, шляхом модифікації шляху біосинтезу рапаміцину за допомогою маніпуляції пост-pKS генами, що модифікують (WO 04/007709). Інші аналоги також можуть бути отримані за допомогою подання альтернативних щодо природної вихідних кислот PKS рапаміцину, які включаються в структуру рапаміцину (WO 04/007709). Хоча ці способи відкривають доступ до значно більшого хімічного простору навколо молекули рапаміцину, цей підхід не дозволяє модифікувати центральний кістяк молекули рапаміцину, що кодується генами полікетид-синтази типу І. Описане також виділення аналогів рапаміцину за допомогою біологічних способів, таких як біотрансформація та заснована на фагах генетична модифікація. Виділення мінорних метаболітів як з мутантних штамів і рапаміцин-продукуючих штамів надало невеликі кількості аналогів рапаміцину. Ці штами часто дають малий вихід і продукують суміші аналогів рапаміцину. Описано виділення 27О-десметилрапаміцину та 27десметоксирапаміцину з культурального супернатанта S. hygroscopicus NCIMB 40319 (Box et al., 1995). Протигрибкова активність 27-Одесметилрапаміцину нижче такої рапаміцину, але інгібування FKBP12 РРІазної активності представляється збільшеним. Інгібування ConAстимулюємої проліферації Т-клітин селезінки миші та інгібування LPS-стимулюємої проліферації Вклітин селезінки миші збільшені в порівнянні з рапаміцином (Box et al., 1995). Подібним чином, протигрибкові активності аналогів рапаміцину пролілрапаміцину, 27-О-десметилрапаміцину та 27 95895 14 десметоксирапаміцину (система нумерації молекули рапаміцину, як показано на Фігурі 1) були нижче, ніж у рапаміцину (Wong et al., 1998). Аналоги рапаміцину (16-О-десметилрапаміцин, 27-Oдесметилрапаміцин, 39-О-десметилрапаміцину, 16, 27-O-бісдесметилрапаміцин, пролілрапаміцин, 26-O-десметилпролілрапаміцин, 9деоксорапаміцин, 27-десметоксирапаміцин, 27десметокси-39-O-десметилрапаміцин, 9-деоксо27-десметоксирапаміцин, 28-дегідрорапаміцин, 9деоксо-27-десметокси-39-Oдесметилрапаміцин)також ізольовані з Actinoplanes sp N902-109 після додавання інгібіторів цитохрому Р450 та/або подання попередника культурі або після біотрансформації виділеного рапаміцину (Nishida et al., 1995). Застосування таких інгібіторів, однак, дозволяє тільки націлювати дію конкретного ферменту та не є вибірковим по ділянці, у такий спосіб часто призводячи до сумішей продуктів. Раціональне одержання одного обраного аналога неможливо цим способом. Одержання суміші аналогів рапаміцину скоріше, ніж єдиного продукту, впливає також на вихід. Вимірювали інгібіторну активність сполук на змішану реакцію лімфоцитів (MLR) і виявили невеликий вплив на активність виявляється після втрати метильної групи при С27 та/або С16. Більше значне зменшення активності спостерігалося для 9деоксорапаміцину, до того ж втрата метокси-групи при С27, гідрокси-групи при С28 і заміна групи похідного піпеколінової кислоти на пролільну групу, все це призводить до зменшення активності (Nishida et al., 1995). Подібним чином, описане біотрансформація рапаміцину та виділення 16, 39О-бісдесметилрапаміцину (WO 94/09010). Збереження деякої інгібуючої активності в аналізі проліферації клітин сполуками, модифікованими по циклогексильному кільцю, наприклад, 39-Одесметилрапаміцином і С40 модифікації такі як SDZ RAD і ССІ-779, ідентифікують цей район молекули як мішень при одержанні нових аналогів рапаміцину як з імунодепресивними, так і із протираковими властивостями. Описано нові аналоги рапаміцину після подання циклогександекарбонової кислоти, циклогептанкарбонової кислоти, циклогекс-1енокарбонової кислоти, 3метилциклогексанкарбонової кислоти, циклогекс3-енокарбонової кислоти, 3-гідроксициклогекс-4енокарбонової кислоти та циклогепт-1енокарбонової кислоти до культур дикого типу які продукують рапаміцин S. hygroscopicus, у такий спосіб показуючи гнучкість завантажувального модуля полікетид кінази рапаміцину (P.A.S. Lowden, Ph.D dissertation, University of Cambridge, 1997; Lowden et al., 2004). Ці нові аналоги рапаміцину отримані при конкуренції із природним вихідним матеріалом, 4,5дигідроксициклогекс-1енокарбонової кислоти, що призводить до знижених виходів і змішаних продуктів. Ізольовано два нові сірковмісні аналоги рапаміцину шляхом подання культурі продукуючого рапаміцин S. hygroscopicus NRRL5491 (±) ніпекотинової кислоти для інгібування продукції Lпіпеколінової кислоти та спільної подання сірков 15 місних аналогів піпеколінової кислоти (S)-1,4тіазан-3-карбонової кислоти та (S)-1,4-тіазан-4карбонової кислоти (Graziani et al., 2003). Описано одержання двох рекомбінантних штамів S. hygroscopicus, продукуючих різні аналоги рапаміцину, за допомогою біологічних способів, опосередкованих фаговою технологією (Lomovskaya et al., 1997). У присутності доданих аналогів проліну, S. hygroscopicus rapL делеційний мутант синтезує нові аналоги рапаміцину пролілрапаміцин, 4-гідроксипролілрапаміцин і 4гідроксипроліл-26-десметокси-рапаміцин (Khaw et al., 1998). Подібним чином, ідентифіковані нові аналоги рапаміцину 3-гідроксипроліл-рапаміцин, 3гідроксипроліл-26-десметокси-рапаміцин і транс-3аза-біцикло[3,1,0] гексан-2-карбонова кислота рапаміцин у культурах того ж мутантного штаму, до яких робилися добавки, як описано в WO 98/54308. Активність пролілрапаміцину та 4гідроксипроліл-26-десметокси-рапаміцину вимірювали в аналізі проліферації та інгібуюча активність останньої сполуки була значно нижче такої ж рапаміцину (Khaw et al., 1998). Делеція п'яти послідовних генів rapQONML (відповідальних за постполікетидні модифікації при С16, С27 і продукцію L-піпеколінової кислоти) і їхня заміна маркером стійкості до неоміцину в S. hygroscopicus ATCC29253 за допомогою заснованої на фагах методології привело до продукції 16-О-десметил27-десметоксирапаміцину при подання піпеколінової кислоти (Chung et al., 2001). Ніякої комплементації цього делеційного мутанта не було показано. Надалі, у цій роботі не була виявлена специфічність до місця ні для RapM ні RapQ; тому раціональне створення аналогів рапаміцину, що вимагають метилювання при С16-ОН або С27-ОН, не було здійснено Chung et al. (2001). Заснована на фагах методологія страждає від багатьох недоліків, як описано більш детально нижче, прикладом чого служить вищеописане одержання всього трьох рекомбінантних штамів S. hygroscopicus за період 9 років від розкриття послідовності гена. Це пропонує важкий і затяжний процес одержання генетично модифікованих штамів і значно більш обмежене в застосовності в порівнянні з методологією, розкритої в ранній заявці винахідників даного винаходу (WO 04/007709). Загальноприйняті підходи до маніпуляції що модифікують рапаміцин генами за допомогою біологічних способів включають мутацію або делецію окремих генів у хромосомі штаму-хазяїна або/та вставку окремих генів у вигляді додаткових копій гомологічних або гетерологічних генів або поокремості, або у вигляді касет генів (WO 01/79520, WO 03/048375). Однак, одержання нових аналогів рапаміцину за допомогою таких біологічних способів було обмежено через труднощі трансформації продукуючого рапаміцин організму S. hygroscopicus. Показано, що звичайно застосовувані способи трансформації із плазмідною ДНК або перенос шляхом кон'югації не призводять до успіху в продукуючого рапаміцин штаму (Lomovskya et al., 1997, Schwecke et al., 1995, Kieser et al., 2000). На рівні техніки в даній області до розкриття WO 04/007709 застосовувалася ме 95895 16 тодологія Lomovskya et al. (1997), трудомісткий заснований на фагах спосіб, що серйозно обмежений розміром фрагментів ДНК, що клонуються, які переносяться в S. hygroscopicus (Kieser et al., 2000). Цей спосіб обмежений переносом максимально приблизно 6,4 т.п.о. ДНК, що клонується. Таким чином, при комплементації делеційного мутанта за допомогою цього підходу фахівець обмежений включенням генетичного матеріалу в рамках цього граничного розміру, наприклад, комплементація обмежена двома звичайними функціональними генами (звичайно, розміром приблизно 1 т.п.о. кожний) у додавання до необхідного промотору, районам гомології (якщо потрібно) і маркеру стійкості. WO 04/007709 розкрив перший опис способів рекомбінантної технології для ефективної трансформації таких штамів як Streptomyces hygroscopicus subsp. hygroscopicus NRRL5491, які містять кластер генів біосинтезу рапаміцину. До цього, хоча генетична інформація для кластера генів біосинтезу рапаміцину була доступна з 1995 року (Schwecke et al., 1995), дотепер був досягнутий тільки обмежений прогрес у цій області (Khaw et al., 1998; Chung et al., 2001; WO 01/34816). WO 04/007709 описує способи маніпуляції шляхом біосинтезу рапаміцину та одержання ряду аналогів рапаміцину шляхом комплементації делеційного мутанта, у якого кількість пост-PKS обробки специфічно варіює та за необхідності подання екзогенних вихідних кислот штамам, у яких хоча б rapK вилучений або інактивований. Попередня робота показала, що генами полікетид-синтази (PKS) у принципі можна маніпулювати з метою одержання нових полікетидів. Такі зміни включають: - делеції: показано, що делеція у фазі з рамкою зчитування в ДНК, що кодує частина домена KR у модулі 5 продукуючого еритроміцин (ery) PKS Saccharopolyspora erythraea призводить до утворення аналогів еритроміцину, а саме, 5, дідеокси3--мікарозил-5-оксоеритроноліду В і 5,6-дідеокси5-оксоеритроноліду В (Donadio et al., 1991). - Інактивація окремих доменів: зміна залишків активної ділянки в домені ER модуля 4 в ery PKS шляхом генетичної модифікації відповідної що кодує PKS ДНК і введення її в Saccharopolyspora erythraea призводить до продукції 6,7ангідроеритроміцину С (Donadio et al., 1993). - Перестановки завантажувальних доменів: WO 98/01546 розкриває заміну завантажувального модуля (ery) PKS завантажувальним модулем PKS авермектину (ave) з метою одержання гібридного гена PKS типу І, що включає різні вихідні одиниці для виробництва нових аналогів еритроміцину. Була отримана гібридна тілактонзавантаження/платенолід полікетид-синтаза (Kuhstoss et al., 1996), що успішно переносила специфічність тілактон-завантажувального модуля для метилмалоніл-КоА на молекулу платеноліду. Q Визначення функції KS (Bisang et al., 1999) і маніQ пуляція утримуючими KS завантажувальними модулями розкриті в WO 00/00618. Перестановка завантажувального модуля в шляху біосинтезу спінозіну також була описана в WO 03/070908. 17 - Перестановка AT: Oliynyk et al., (1996) і WO 98/01546 описують перестановку домена AT, де AT модуля 1 еритроміцину був замінений АТдоменом модуля 2 рапаміцину та специфічність модуля 1 для одиниці, що надбудовується, змінилася відповідно. Далі перестановка доменів AT описана, наприклад, для полікетид-синтази еритроміцину (WO 98/01546, Ruan et al., 1997; Stassi et al., 1998) і для полікетид-синтази спінозіну (WO 03/070908). - Перестановка відновлювальних петель: наприклад, описані зміни кількості відновлювальних реакцій для -кето-груп, утворених при кожній конденсації (WO 98/01546, WO 00/01827 і Лао et al., (1997)). - Приклади комбінацій підходів перестановки доменів наведені в McDaniel et al., (1999). - Сайт-специфічний мутагенез: WO 02/14482, Reeves et al., (2001), Reid et al., (2003) і Del Vecchio et al., (2003) показують, що можливо впливати на субстратну специфічність АТ-доменів шляхом вибіркової мутації конкретних залишків. - Стискання кільця: наприклад, застосування неповної модульної полікетид-синтази (Kao et al. 1994) або пересування домена термінуючої ланцюг еритроміцину тіоестерази нижче модулів 1, 2, 3, 5 або 6 (Cortes et al., 1995; Kao et al., 1995; Kao et al., 1996; Bohm et al., 1998) PKS еритроміцину призводить до продукції очікуваних укорочених молекул еритроміцину. - Розширення кільця: вставка модуля рапаміцину в першу ORF (відкриту рамку зчитування) між модулями 1 і 2 PKS еритроміцину веде до продукції очікуваного 16-членного макроліда (Rowe et al., 2001). Модифікації кластерів PKS не обмежуються описаними вище. Однак, було також виявлено, що не всі маніпуляції генами PKS можуть давати передбачені нові аналоги. Коли Donadio et al. (1993) інактивували домен еноіл-редуктази (ER) в PKS еритроміцину ангідро-аналог, що утворився не пройшов повну обробку (процесинг), тому що він більше не був субстратом мікароз-Ометилтрансферази. Подібним чином, заміна вихідної одиниці полікетида запобігає повній елонгації та доробку аналога рифампіцину в Amycolatopsis mediterranei (Hunziker et al., 1998). Якби аналоги рапаміцину можна було одержувати шляхом інженерії генів полікетид-синтази в біосинтетичному кластері, вони були б дуже бажаними, оскільки відповідно до пророкування мали би цікаву біологічну активність. Послідовність кластера біосинтезу рапаміцину вперше опублікована в 1995 році (Schwecke et al.; Aparicio et al., 1996). Незважаючи на цінність наявних у даній області знань щодо маніпуляції PKS, описаних вище, дотепер не було ніяких повідомлень про успішну інженерію серцевини полікетидсинтази кластера рапаміцину. S. hygroscopicus, продуцент рапаміцину, є складним організмом для маніпуляцій (Lomovskaya et al., 1997). Клітина-хазяїн, що модифікували для продукції 17-десметилрапаміцину, заявлена в патенті US 6670168, однак у цьому патенті відсутній якийнебудь опис робочого прикладу того, як ця сполука 95895 18 може бути отримана, крім гіпотези, що такий штам можна конструювати шляхом заміни АТ-домена модуля 10. Той факт, що заміна по цьому положенню може гіпотетично вести до 17десметилрапаміцину, очевидний для будь-якого фахівця в даній області, але не є очевидним, як можна провести таку заміну у світлі труднощів, підкреслених вище, і ніякого пояснення цього ефекту не надано в US 6670168. У світлі відомих труднощів роботи з S. hygroscopicus і при відсутності детального опису того, як такий рекомбінантний штам-хазяїн можна одержати, зрозуміло, що це просто опис того, що ці автори сподіваються досягти, скоріше, ніж розкриття такого штаму. До того ж, US 6670168 не надає ніяких пояснень фахівцеві в даній області щодо того, як можна одержувати й виділяти 17-десметилрапаміцин. Стан даної області техніки щодо біосинтезу аналогів рапаміцину обмежено WO 04/007709, у якому маніпулюють генами, що кодують пост-PKS ферменти, що модифікують, і спорідненими заявками, що описують подання екзогенних вихідних кислот для включення в рапаміцин. Основна відсутність прогресу в інженерії PKS рапаміцину обумовлена технічними труднощами трансформації продукуючого організму S. hygroscopicus NRRL5491. Даний винахід відноситься до виробництва 17десметилрапаміцину та його аналогів. Одержання аналогів 17-десметилрапаміцину вимагає генетичної модифікації PKS рапаміцину. На теперішньому рівні розвитку даної області техніки не є очевидною можливість досягнення генетичної модифікації для виробництва такого штаму. У даному винаході вихідною метою є генетична модифікація S. hygroscopicus MG2-10. S. hygroscopicus MG2-1C продукує попередник рапаміцину (пре-рапаміцин), коли одержує екзогенну кислоту 3,4дигідроксициклогексанкарбонову кислоту, як розкрито в WO 04/007709 і Gregory et al., (2004). Проведено генетичну модифікацію цього організму з метою одержання модифікованого штаму, що продукує десметилпре-рапаміцин при поданні йому екзогенної кислоти -3,4дигідроксициклогексанкарбонової кислоти. Теперішній стан даної області техніки містить відомості, як такий штам можна застосовувати для подальших дослідів як базовий штам для комплементації касетами пізніх генів (WO 04/007709) та/або як базовий штам для подання екзогенних кислот (WO 04/007709) і одержання далі аналогів рапаміцину, але не містить відомостей, як можна одержати такий штам S. hygroscopicus шляхом інженерії PKS. Даний винахід описує, несподіваним чином, успішне застосування методологій інженерії PKS, подібних з такими, описаними в Oliynyk et al., 1996, до PKS рапаміцину. Це є несподіваним результатом, оскільки такі технології рекомбінантних ДНК раніше не застосовувалися успішно до S. hygroscopicus. Отриманий штам для продукції аналогів десметилпре-рапаміцину є корисним базовим штамом для комплементації касетою пізніх генів (WO 04/007709) та/або як базовий штам для подання екзогенних кислот (WO 04/007709). Кожний із цих аналогів рапаміцину далі можна модифікувати шляхом напівсинтезу. Це перша демон 19 страція дійсно комбінаторного способу, який можна застосовувати для одержання бібліотеки аналогів рапаміцину, який можна змінювати на одному або більше з рівнів: рівні інженерії PKS; рівні допоміжних генів; включенні вихідних кислот, включенні амінокислот і далі доступної хімічної функціональності молекули, що залишається доступною для напівсинтезу. Розкриття винаходу В одному аспекті даний винахід надає 17десметилрапаміцин та його аналоги, зокрема, цей винахід надає аналоги 17-десметилрапаміцину формули: де x є прямий зв'язком, -СН2-, -S-CH2-, -CH2-Sабо -S(=O) -СН2-; або -CHR5-x-CHR6- є ; R1 є =O або (H,Н); R2 є ОН або ОМе; R3 є Н, ОН або ОМе; R4 є структурним фрагментом, обраним із груп А, В, С, D, Ε і F, у яких хвиляста лінія вказує на положення приєднання фрагмента, R7 є Н, ОН або ОМе і R8 є Н/ ОН, ОМе, галогеном, тіолом або С1-4 алкілом; або R4 альтернативно є 7-членним гетероциклом, що містить один або більше гетероатомів, 95895 20 обраних із групи, що складається з О, S і N, де гетероцикл за необхідності заміщений одним або більше замісників, обраних з С1-4 алкілу, ОН, F і СІ; і R5 і R6 кожний незалежно є Η або ОН, або їх фармацевтично прийнятні похідні. В іншому аспекті даний винахід надає бібліотеки аналогів 17-десметилрапаміцину, отримані за допомогою способів за даним винаходом. Нові аналоги рапаміцину застосовують прямо, а також як матриці для подальшого напівсинтезу або біоконверсії для одержання сполук, застосовних у якості імунодепресантів, протигрибкових агентів, протиракових агентів, протизапальних агентів, нейрорегенеративних агентів або агентів для лікування відторгнення трансплантата, хвороби трансплантат-проти-хазяїна, аутоімунних порушень, судинних захворювань і фіброзних захворювань або агентів для застосування в регуляції загоєння ран. В подальшому аспекті даний винахід надає застосування 17-десметилрапаміцину або його аналога в медицині. В подальшому аспекті даний винахід надає застосування 17десметилрапаміцину або його аналога в одержанні медикаменту для індукції або підтримки імунодепресії, стимуляції регенерації нервової тканини або лікування раку, злоякісності В-клітин, грибкових інфекцій, відторгнення трансплантата, хвороби трансплантат-проти-хазяїна, аутоімунних порушень, запальних захворювань, судинних захворювань або фіброзних захворювань або в регуляції загоєння ран. В одному втіленні 17-десметилрапаміцин або його аналог застосовують у комбінаційній терапії для індукції або підтримки імунодепресії, стимуляції регенерації нервової тканини або лікування раку, злоякісності В-клітин, грибкових інфекцій, відторгнення трансплантата, хвороби трансплантат-проти-хазяїна, аутоімунних порушень, запальних захворювань, судинних захворювань і фіброзних захворювань або в регуляції загоєння ран. Даний винахід також надає фармацевтичну композицію, що включає 17-десметилрапаміцин або його аналог або фармацевтично прийнятну сіль разом з фармацевтично прийнятним носієм. В подальшому аспекті даний винахід також надає спосіб одержання 17-десметилрапаміцину або його аналога, де згаданий спосіб, включає: (а) заміна метилмалоніл-КоА-специфічного АТ-домена модуля 10 PKS рапаміцину малонілКоА-специфічним АТ-доменом, (б) експресію генетично модифікованої PKS рапаміцину в підходящій клітині-хазяїні, (в) культивацію клітини-хазяїна в таких умовах, що 17-десметилрапаміцин або його аналог продукуються, включаючи за необхідності постачання екзогенними попередниками, (г) за необхідності виділення сполук, отриманих таким способом. У кращому втіленні малоніл-КоА-специфічний АТ-домен вибирають із одного з наступних кластерів: рапаміцину, моненсину, спінозину, FK506, еритроміцину, FK520, амфотерицину, анголаміцину, тілозину, «хіг» ("hyg"), FK523, меридаміцину, 21 антаскоміцину, FK525 і тсукубаміцину. У більш кращому втіленні малоніл-КоА-специфічний АТдомен вибирають із одного з наступних кластерів: рапаміцину, моненсину та FK506. У ще більш кращому втіленні АТ-домен вибирають із групи, що складається з модуля 2 рапаміцину, модуля 3 моненсину, модуля 6 моненсину, модуля 8 моненсину, модуля 3 FK506 і модуля 7 FK506. У найбільш кращому втіленні малоніл-КоА-специфічний АТдомен походить із модуля 2 рапаміцину. Фахівець у даній галузі зрозуміє, що цю трансформацію можна вживати з кожним із числа малоніл-КоА-специфічних ацил-трансферазних доменів будь-який PKS типу І або змішаною NRPS/PKS. Фахівець у даній галузі зрозуміє також, що включення малоніл-КоА за допомогою AT модуля 10 може бути досягнуте шляхом мутування природного rap AT10 з метою зміни його специфічності, наприклад, застосовуючи способи, як описано в WO 02/14482, або шляхом заміни всього модуля 10 модулем, що містить АТ-домен, що специфічний до малоніл-КоА, де згаданий модуль включає природний модуль і комбінований модуль. У додатковому аспекті даний винахід надає спосіб одержання рекомбінантного штаму, що містить біосинтетичний кластер, який кодує генетично модифіковану полікетид-синтазу рапаміцину, де метилмалоніл-КоА-специфічний АТ-домен модуля 10 замінений малоніл-КоА-специфічним АТдоменом. У кращому втіленні малоніл-КоАспецифічний АТ-домен вибирають із одного з наступних PKS кластерів: рапаміцину, моненсину, спінозину, FK506, еритроміцину, FK520, амфотеріцину, анголаміцину, тілозину, «хіг», FK523, меридаміцину, антаскоміцину, FK525 і тсукубаміцину. У більш кращому втіленні малоніл- КоА-спєцифічний АТ-домен вибирають із одного з наступних кластерів: рапаміцину, моненсину та FK506. У ще більш кращому втіленні АТ-домен вибирають із групи, що складається з модуля 2 рапаміцину, модуля 3 моненсину, модуля 6 моненсину, модуля 8 моненсину, модуля 3 FK506 і модуля 7 FK506. У найбільш кращому втіленні малоніл-КоАспецифічний АТ-домен походить із модуля 2 рапаміцину. Хоча генетична модифікація полікетидсинтазного шляху рапаміцину наведена тут на прикладі S. hygroscopicus MG2-10 (одержання якого розкрито в WO 04/007709 і Gregory et al., (2004)), фахівець у даній галузі зрозуміє, що ці способи можна з однаковим успіхом застосовувати до дикого типу S. hygroscopicus NRRL5491 і інших споріднених штамів. Переважно, генетично модифікований штам вибирають із групи, що складається з S. hygroscopicus MG2-10 і S. hygroscopicus NRRL5491. Втілення попередніх аспектів винаходу, надаючи спосіб одержання 17-десметилрапаміцину та його аналогів і спосіб одержання рекомбінантного штаму, який містить біосинтетичний кластер, що кодує генетично модифіковану полікетид-синтазу рапаміцину, включає додаткові етапи: 95895 22 (а) виділення AT, що підлягає введенню як єдиного фрагмента ДНК із підходящими фланкуючими ділянками зв'язування рестриктаз, (б) ампліфікацію та виділення районів послідовності ДНК, гомологічних фланкуючим послідовностям AT-мішені, з використанням підходящих ділянок зв'язування рестриктаз, (в) літування трьох фрагментів ДНК, описаних в (а) і (б) разом з одержанням у фазі з рамкою зчитування послідовності LHS гомології з наступним донорним АТ-доменом з наступною RHS гомологією, (г) введення повної послідовності з (в) у вектор для введення в штам-хазяїна для одержання кінцевої плазміди, де згадана плазміда включає (і) оrіТ для кон'югації, (іі) один або більше маркерів стійкості, (ііі) чутливий до температури ориджин реплікації, так що інтегранти можна буде відбирати при 37°С і (iv) ориджин реплікації Е. coli, (ν) трансформація штаму-хазяїна шляхом кон'югації із застосуванням кінцевої плазміди, як описано в (г) вище, (vi) зідбір трансформованих клітин за стійкістю до відповідного антибіотика, (vii) одержання первинних інтегрантів шляхом культивації при 37°С із селекцією за допомогою антибіотиків, (viii) скринінг вторинних рекомбінантів шляхом вирощування під час відсутності антибіотика, також при 37°С, (іх) ідентифікація потрібного штаму по здатності продукувати цільовий продукт і (х) за необхідності підтвердження генетики штаму за допомогою стандартних способів. В іншому аспекті даний винахід надає спосіб одержання аналога 17-десметилрапаміцину, де згаданий спосіб включає: (а) одержання рекомбінантного штаму, у якого метилмалоніл-КоА-специфічний АТ-домен модуля 10 PKS рапаміцину замінений малоніл-КоАспецифічним АТ-доменом, і (б) подання неприродних вихідних кислот культурі згаданого рекомбінантного штаму в умовах, що підходять для продукції полікетида та (в) за необхідності виділення сполуки, отриманої у такий спосіб. Тому даний винахід надає спосіб одержання аналогів 17-десметилрапаміцину, у які включені неприродні вихідні кислоти. У кращому втіленні в рекомбінантного штаму rapK вилучений або інактивований. В іншому кращому втіленні в рекомбінантного штаму rapK вилучений або інактивований і неприродну вихідну кислоту, що подають при рості штаму, вибирають із групи, що складається із циклогексанкарбонової кислоти, 3метилциклогексанкарбонової кислоти, циклогептанкарбонової кислоти, 3-фтор-4гідроксициклогексанкарбонової кислоти, 4-фтор-3гідроксициклогексанкарбонової кислоти, 3-хлор-4гідроксициклогексанкарбонової кислоти, 3-хлор-4гідроксицикло гексанкарбонової кислоти та 4-хлор3-гідроксициклогексан карбонової кислоти. 23 В одному втіленні штам не є рекомбінантною клітиною-хазяїном S. hygroscopicus, що продукує 17-десметилрапаміцин. В подальшому втіленні штам не є рекомбінантною клітиною-хазяїном S. hygroscopicus, що продукує 17-десметилрапаміцин під час відсутності подання екзогенних попередників. У подальшому аспекті даний винахід надає спосіб одержання аналога 17десметилрапаміцину, де згаданий спосіб включає: (а) одержання рекомбінантного штаму, у якого метилмалоніл-КоА-специфічний АТ-домен модуля 10 PKS рапаміцину замінений малоніл-КоАспецифічним АТ-доменом (як описано більш детально вище), (б) додатково видалення або інактивацію одного або більше допоміжних генів рапаміцину, обраних з rapI, rapJ, rapKr rapL, rapM, rapN, rapO і rapQ, (в) культивація штаму, отриманого таким чином, за необхідності в присутності екзогенного попередника, якщо потрібно, для одержання аналога 17-десметилрапаміцину та (г) за необхідності виділення сполуки, отриманої таким способом. В альтернативному кращому втіленні допоміжними генами, які були вилучені, є rapI, rapJ і rapQ. В альтернативному кращому втіленні допоміжними генами, які були вилучені, є rapJ, rapM і rapQ. У подальшому аспекті даний винахід надає спосіб одержання аналога 17десметилрапаміцину, де згаданий спосіб включає: (а) одержання рекомбінантного штаму, у якого метилмалоніл-КоА-специфічний АТ-домен модуля 10 PKS рапаміцину замінений малоніл-КоАспецифічним АТ-доменом (як описано більш детально вище), (б) додатково видалення або інактивацію одного або більше допоміжних генів рапаміцину, обраних з rapI, rapJ, rapK, rapL, rapM, rapN, rapO і rapQ, (в) повторне введення всіх або частини допоміжних генів in-trans для комплементації або для часткової комплементації делеції, (г) культивацію штаму, отриманого таким чином, за необхідності в присутності екзогенного попередника, якщо потрібно, для одержання аналога 17-десметилрапаміцину та (д) за необхідності виділення сполуки, отриманої таким способом. У кращому втіленні на етапі (б) всі допоміжні гени рапаміцину видаляють або інактивують. В подальшому кращому втіленні рекомбінантний штам генетично комплементують одним або більше допоміжним геном, обраним із групи, що складається з rapI, rapJ, rapK, rapL, rapM, rapN, rapO і rapQ або їхніх гомологів. У конкретному втіленні штам комплементований всіма допоміжними генами. В подальшому кращому втіленні рекомбі.нантний штам генетично комплементований допоміжними генами rapK, rapM, rapN, rapO і rapL або їхніми гомологами. В альтернативному кращому втіленні рекомбінантний штам генетично 95895 24 комплементований допоміжними генами rapK, rapI, rapN, rapO і rapL або їхніми гомологами. У подальшому аспекті винаходу, вищеописані модифікації комбінують, тому даний винахід надає спосіб одержання аналога 17десметилрапаміцину, де згаданий спосіб включає: (а) одержання рекомбінантного штаму, у якого метилмалоніл-КоА-специфічний АТ-домен модуля 10 PKS рапаміцину замінений малоніл-КоАспецифічним АТ-доменом, (б) додатково видалення або інактивацію одного або більше допоміжних генів рапаміцину, обраних з rapI, rapJ, rapK, rapL, rapM, rapN, rapO і rapQ, (в) за необхідності повторне введення всіх або частини допоміжних генів in-trans для комплементації або для часткової комплементації делеції, (г) подання неприродних вихідних кислот згаданому рекомбінантному штаму в підходящих умовах для продукції полікетидів і (д) за необхідності виділення сполуки, отриманої таким способом. У кращому втіленні допоміжний ген(и), які були вилучені або інактивовані, включають rарK. У кращому втіленні на етапі (б) всі допоміжні гени рапаміцину вилучені або інактивовані. У конкретному аспекті даний винахід надає альтернативний спосіб одержання аналогів 17десметилрапаміцину з неприродними вихідними кислотами шляхом генетичної комплементації рекомбінантного штаму, у якого всі допоміжні гени рапаміцину були вилучені або інактивовані, допоміжними генами рапаміцину rapI, rapJ, rapL, rapМ, rapN, rapO і rapQ, або їхніми гомологами, що дає штам, що містить всі допоміжні гени, крім rapK, і подання екзогенних вихідних кислот. У кращому втіленні екзогенною неприродною вихідною кислотою є циклогексанкарбонова кислота. В альтернативному кращому втіленні неприродною вихідною кислотою є 3-метилциклогексанкарбонова кислота. В альтернативному кращому втіленні неприродною вихідною кислотою є циклогептанкарбонова кислота. В альтернативному кращому втіленні неприродну вихідну кислоту вибирають із групи, що складається з 3-фтор-4гідроксициклогексанкарбонової кислоти, 4-фтор-3гідроксициклогексанкарбонової кислоти, 3-хлор-4гідроксициклогексанкарбонової кислоти та 4-хлор3-гідрокси циклогексанкарбонової кислоти. В подальшому втіленні даний винахід надає спосіб одержання аналогів 17десметилрапаміцину з комбінаціями активностей допоміжних генів і неприродних вихідних кислот. У кращому втіленні допоміжними генами, які вилучені, є rapK, rapМ, і rapQ, і неприродною вихідною кислотою, що подається цьому штаму, є циклогексанкарбонова кислота. В альтернативному кращому втіленні неприродною вихідною кислотою, що подається цьому штаму з вилученими rapK, rapМ, і rapQ, є 3-метилциклогексанкарбонова кислота. В альтернативному кращому втіленні неприродною вихідною кислотою, що подається цьому штаму з вилученими rapK, rapМ, і rapQ, є циклогептанкарбонова кислота. У кращому втіленні допоміжними генами, які вилучені, є rapK, rapМ, і rapQ, і 25 неприродну вихідну кислоту, що подається цьому штаму, вибирають із групи, що складається з 3фтор-4-гідроксициклогексанкарбонової кислоти, 4фтор-3-гідроксициклогексанкарбонової кислоти, 3хлор-4-гідроксициклогексанкарбонової кислоти та 4-хлор-3-гідроксициклогексан карбонової кислоти. В подальшому кращому втіленні допоміжними генами, які вилучені, є rapK, rapI і rapQ і неприродну вихідну кислоту, що подається цьому штаму, вибирають із групи, що складається з 3метилциклогексанкарбонової кислоти, циклогексанкарбонової кислоти, циклогептанкарбонової кислоти, 3-фтор-4-гідроксицикло гексанкарбонової кислоти, 4-фтор-3-гідроксициклогексан карбонової кислоти, 3-хлор-4-гідроксициклогексанкарбонової кислоти та 4-хлор-3гідроксициклогексанкарбонової кислоти. У більш кращому втіленні допоміжними генами які вилучені, є rapK, rapI і rapQ і неприродною вихідною кислотою, що подається цьому штаму, є 3метилциклогексанкарбонова кислота. У більш бажаному втіленні допоміжними генами які вилучені, є rapK, rapI і rapQ і неприродною вихідною кислотою, що подається цьому штаму, є циклогексанкарбонова кислота. В альтернативному кращому втіленні допоміжними генами, які вилучені, є rapK і rapМ і неприродну вихідну кислоту, що подається цьому штаму, вибирають із групи, що складається з 3метилциклогексанкарбонової кислоти, циклогексанкарбонової кислоти, циклогептанкарбонової кислоти, 3-фтор-4-гідроксицикло гексанкарбонової кислоти, 4-фтор-3-гідроксициклогексан карбонової кислоти, 3-хлор-4-гідроксициклогексанкарбонової кислоти та 4-хлор-3гідроксициклогексанкарбонової кислоти. У найбільш бажаному втіленні неприродною вихідною кислотою, що подається цьому штаму, є циклогексанкарбонова кислота. В подальшому альтернативному кращому втіленні допоміжними генами, які вилучені, є rapK, rapI і rapМ і неприродну вихідну кислоту, що подається цьому штаму, вибирають із групи, що складається з 3-метилциклогексанкарбонової кислоти, циклогексанкарбонової кислоти, циклогептанкарбонової кислоти, 3-фтор-4-гідрокси циклогексанкарбонової кислоти, 4-фтор-3-гідроксициклогексан карбонової кислоти, 3-хлор-4гідроксициклогексаккарбонової кислоти та 4-хлор3-гідроксициклогексанкарбонової кислоти. У найбільш бажаному втіленні неприродною вихідною кислотою, що подається цьому штаму, є циклогексанкарбонова кислота. В альтернативному кращому втіленні допоміжними генами, які вилучені, є rapK, rapI, rapJ і rapQ і неприродну вихідну кислоту, що подається цьому штаму, вибирають із групи, що складається з 3метилциклогексанкарбонової кислоти, циклогексанкарбонової кислоти, циклогептанкарбонової кислоти, 3-фтор-4-гідроксициклогексанкарбонової кислоти, 4-фтор-3-гідроксициклогексанкарбоновоі кислоти, 3-хлор-4-гідроксициклогексанкарбонової кислоти та 4-хлор-3-гідроксициклогексан карбонової кислоти. У найбільш бажаному втіленні непри 95895 26 родною вихідною кислотою, що подається цьому штаму, є циклогексанкарбонова кислота. В альтернативному кращому втіленні допоміжними генами, які вилучені, є rapK, rapJ, rapM і rapQ і неприродну вихідну кислоту, що подається цьому штаму, вибирають із групи, що складається з 3-метилциклогексанкарбонової кислоти, циклогексанкарбонової кислоти, циклогептанкарбонової кислоти, 3-фтор-4-гідроксициклогексанкарбонової кислоти, 4-фтор-3-гідроксициклогексанкарбонової кислоти, 3-хлор-4-гідроксициклогексанкарбонової кислоти та 4-хлор-3-гідроксициклогексан карбонової кислоти. У найбільш бажаному втіленні неприродною вихідною кислотою, що подається цьому штаму, є циклогексанкарбонова кислота. В подальшому втіленні даний винахід надає спосіб одержання аналогів 17десметилрапаміцину шляхом генетичної комплементації рекомбінантного штаму, у якого всі допоміжні гени рапаміцину вилучені або інактивовані, одним або більше допоміжними генами, обраними з rapI, rapJ, rapK, rapL, rapM, rapN, rapO і rapQ і їхніми гомологами в комбінації з подачею природних або неприродних вихідних кислот. У кращому втіленні згаданий рекомбінантний штам генетично комплементують rapI, rapJ, rapN, rapO і rapL та подають неприродну вихідну кислоту, обрану із групи, що складається із циклогексанкарбонової кислоти, 3-метилциклогексанкарбонової кислоти, циклогептанкарбонової кислоти, 3-фтор-4гідроксициклогексан карбонової кислоти, 4-фтор-3гідроксициклогексанкарбонової кислоти, 3-хлор-4гідроксициклогексанкарбонової кислоти та 4-хлор3-гідроксициклогексанкарбонової кислоти. У кращому втіленні згаданий рекомбінантний штам генетично комплементують rapJ, rapN, rapO і rapL та подають неприродну вихідну кислоту, обрану із групи, що складається із циклогексанкарбонової кислоти, 3-метилциклогексанкарбонової кислоти, циклогептанкарбонової кислоти, 3-фтор-4гідроксициклогексанкарбонової кислоти, 4-фтор-3гідроксициклогексанкарбонової кислоти, 3-хлор-4гідроксициклогексанкарбоковой кислоти та 4-хлор3-гідроксициклогексанкарбонової кислоти. В альтернативному кращому втіленні згаданий рекомбінантний штам генетично комплементують rapJ rapM, rapN, rapO і rapL та подають неприродну вихідну кислоту, обрану із групи, що складається з 3-метилциклогексанкарбонової кислоти, циклогексанкарбонової кислоти, циклогептанкарбонової кислоти, 3-фтор-4гідроксициклогексанкарбонової кислоти, 4-фтор-3гідроксициклогексанкарбонової кислоти, 3-хлор-4гідроксициклогексанкарбонової кислоти та 4-хлор3-гідроксициклогексанкарбонової кислоти. У найбільш бажаному втіленні вихідною кислотою, що подають, є 3-метилциклогексанкарбонова кислота. В альтернативному кращому втіленні згаданий рекомбінантний штам генетично комплементують rapI, rapJ, rapN, rapO, rapQ і rapL та подають неприродну вихідну кислоту, обрану із групи, що складається з 3-метилциклогексанкарбонової кислоти, циклогексанкарбонової кислоти, циклогептанкарбонової кислоти, 3-фтор-4гідроксициклогексанкарбонової кислоти, 4-фтор-3 27 гідроксициклогексанкарбонової кислоти, 3-хлор-4гідроксициклогексанкарбонової кислоти та 4-хлор3-гідроксициклогексанкарбонової кислоти. У найбільш бажаному втіленні вихідною кислотою, що подають, є циклогексанкарбонова кислота. В альтернативному кращому втіленні згаданий рекомбінантний штам генетично комплементують rapJ, rapN, rapO, rapQ i rapL та подають неприродну вихідну кислоту, обрану із групи, що складається з 3-метилциклогексанкарбонової кислоти, циклогексанкарбонової кислоти, циклогептанкарбонової кислоти, 3-фтор-4гідроксициклогексанкарбонової кислоти, 4-фтор-3гідроксициклогексанкарбонової кислоти, 3-хлор-4гідроксициклогексанкарбонової кислоти та 4-хлор3-гідроксициклогексанкарбонової кислоти. У найбільш бажаному втіленні вихідною кислотою, що подають, є циклогексанкарбонова кислота. В альтернативному кращому втіленні згаданий рекомбінантний штам генетично комплементують rapM, rapN, rapO- і rapL і подають неприродну вихідну кислоту, обрану із групи, що складається з 3метилциклогексанкарбонової кислоти, циклогексанкарбонової кислоти, циклогептанкарбонової кислоти, 3-фтор-4-гідроксициклогексанкарбонової кислоти, 4-фтор-3-гідроксициклогексанкарбонової кислоти, 3-хлор-4-гідроксициклогексанкарбонової кислоти та 4-хлор-3гідроксициклогексанкарбонової кислоти. У найбільш бажаному втіленні вихідною кислотою, що подають, є циклогексанкарбонова кислота. В альтернативному кращому втіленні згаданий рекомбінантний штам генетично комплементують rapI, rapN, rapO і rapL та подають неприродну вихідну кислоту, обрану із групи, що складається з 3метилциклогексанкарбонової кислоти, циклогексанкарбонової кислоти, циклогептанкарбонової кислоти, 3-фтор-гідроксициклогексанкарбонової кислоти, 4-фтор-3-гідроксициклогексанкарбонової кислоти, 3-хлор-4-гідроксициклогексанкарбонової кислоти та 4-хлор-3гідроксициклогексанкарбонової кислоти. У найбільш бажаному втіленні вихідною кислотою, що подають, є циклогексанкарбонова кислота. У подальшому аспекті даний винахід надає спосіб одержання бібліотеки аналогів 17десметилрапаміцину, де згаданий спосіб включає: (а) одержання рекомбінантного штаму, у якого метилмалоніл-КоА-специфічний АТ-домен модуля 10 PKS рапаміцину замінений малоніл-КоАспецифічним АТ-доменом, (б) за необхідності видалення або інактивацію одного або більше допоміжних генів рапаміцину, обраних з rapI, rapJ, rapK, rapL, rapM, rapN, rapO і rapQ, (в) за необхідності повторне введення всіх або частини допоміжних генів in-trans для комплементації або для часткової комплементації делеції, (г) подання ряду неприродних вихідних кислот до продукуючої культури згаданого рекомбінантного штаму для одержання ряду аналогів 17десметилрапаміцину, (д) подання природних або нових амінокислот до продукуючої культури згаданого рекомбінантно 95895 28 го штаму в умовах, що підходять для продукції полікетидів, (e) за необхідності, еиділєння сполуки, отриманої таким чином, і (ж) за необхідності, проведення напівсинтезу з виділеними аналогами рапаміцину. Ці та інші втілення винаходу описані більш детально в нижченаведеному описі, прикладах і домаганнях далі. Короткий перелік фігур Фігура 1. Структура рапаміцину: А представляє «зв'язуючий домен» і В представляє «ефекторний домен». Фігура 2. Структури рапаміцину (A), FK506 (В), FK520 (С) і меридаміцину (D). Фігура 3. Генетична модифікація MG2-10 для одержання MG7-9. Фігура 4. Фрагментація 39-десметокси-17десметилпре-рапаміцину при мас спектрометрії. Фігура 5. LC-FT-ICR-MS аналіз десгідроксипрерапаміцину. n Фігура 6. LC-FT-ICR-MS аналіз десгідроксипре-рапаміцину. Фігура 7. Важливі ЯМР-кореляції для 17десметил-39-десгідроксипре-рапаміцину. Фігура 8. Діаграма плазміди pLL150. Визначення Невизначені артиклі "а" і "an" застосовуються тут для посилання на один або більше одного (наприклад, хоча б один) граматичного об'єкта, до якого відноситься артикль. Наприклад, "an analogue" означає один аналог або більш ніж один аналог. Як застосовується тут, термін "аналог(и)" відноситься до хімічних сполук, які є структурно близькими іншому, але котрі злегка відрізняються по композиції (як заміна одного атома іншим або присутність або відсутність конкретної функціональної групи). Як застосовується тут, термін «17десметилрапаміцин і його аналоги» повинен включати сполуки в області домагань формули І нижче: де: x є прямим зв'язком, -СН2-, -S-CH2-, -CH2-Sабо -S(=O)-СН2-; 29 або -CHR5-x-CHR6 95895 представляє ; R1 представляє =O або (Н,Н); R2 представляє ОН або ОМе; R3 представляє Н, ОН або ОМе; R4 представляє структурний фрагмент, обраний із груп А, В, С, D, Ε і F, у яких хвиляста лінія вказує на положення приєднання фрагмента, R7 представляє Н, ОН або ОМе і R8 представляє Н, ОН, OMe, галоген, тіол або С1-4 алкіл; або R4 альтернативно представляє 7-членний гетероцикл, що містить один або більше гетероатомів, обраних із групи, шо складається з O, S і N, де гетероцикл за необхідності заміщений одним або більше замісників, обраних з С1-4 алкілу, ОН, F і СІ; і R5 і R6 кожний незалежно є Η або ОН, або їх фармацевтично прийнятні похідні, на деякі сполуки тут посилаються як на «сполуки за винаходом». Як застосовується тут, термін «фармацевтично прийнятні похідні» включає фармацевтично прийнятні солі (наприклад, солі додаткових кислот). Він також включає посилання на сольвати (тобто гідрати). Як застосовується тут, термін «галоген» включає фтор, хлор, бром і йод. Як застосовується тут, термін «тіол» включає групу SH. Якщо не зазначено зворотнє, С1-4 алкільні групи, згадані тут, можуть бути лінійними або, коли є присутнім достатнє число С-атомів (тобто мінімум 3), розгалуженими. Такі С1-4 алкільні групи додатково можуть бути заміщені одним або більше атомів галогену (наприклад, фтор). Гетероциклічні групи, які може представляти R4, можуть бути повністю насиченими, частково ненасиченими, цілком ароматичними або частково ароматичними за характером. Такі групи можуть також бути моноциклічними або, коли можливо, біциклічними. Гетероциклічні R4 групи, які можуть згадуватися, включають діоксаніл, діоколіл, фураніл, гексагідропіримідиніл, гідантоініл, імідазоліл, 30 ізоксазолідиніл, ізоксазоліл, малеімідо, морфолініл, оксадіазоліл, 1,2- або 1, 3-оксазинаніл, оксазоліл, піперазиніл, піперідиніл, піраніл, піразиніл, піразоліл, пірідиніл, пірідоніл, пірімідиніл, піролідиноніл, піролідиніл, піролініл, піроліл, сульфоланіл, 3-сульфоленіл, тетрагідрофураніл, тетрагідропіраніл, 3,4,5,6-тетрагідропірідиніл, 1,2,3,4тетрагідропірімідиніл, 3,4,5,6-тетрагідропірімідиніл, тетразоліл, тіадіазоліл, тіазолідиніл, тіазоліл, тієніл, тріазоліл і т.п. (наприклад, насичені або частково ненасичені моноциклічні групи, такі як діоксаніл, діоксоліл, гексагідропірімідиніл, гідантоініл, ізоксазолідиніл, малеімідо, морфолініл, піперазиніл, піперідиніл, піролідіноніл, піролідиніл, піролініл, сульфоланіл, 3-сульфоленіл, тетрагідрофураніл, тетрагідропіраніл, 3,4,5,6-тетрагідропірідиніл, 1,2,3,4-тетрагідролірімідиніл, 3,4,5,6тетрагідропірімідиніл, тіазолідиніл і т.п. або особливо, ненасичені моноциклічні групи, які містять один гетероатом, обраний з N, S або особливо O, такі як піперідиніл, піролідиніл, тетрагідрофураніл, тетрагідропираніл і т.п. Однак у конкретному втіленні, що відноситься до сполук за винаходом, R4 представляє структурний фрагмент, обраний із груп А, В, С, D, Ε і F (тобто він не представляє гетероциклічну групу). Як застосовується тут, термін «ген(и), що модифікує» включає гени, необхідні для постполікетид-синтазних модифікацій полікетида, у якості не обмежуючих прикладів, цитохром Р450 монооксигенази, фередоксини та SAM-Залежні Oметилтрансферази. У системі рапаміцину ці гени, що модифікують, включають rapN, rapO, rapМ, rapI, rapQ, та rapJ. Фахівець у даній галузі зрозуміє, що гомологи цих генів існують у споріднених кластерах біосинтетичних генів і застосування цих гомологічних генів у способах за винаходом також розглядається. Як застосовується тут, термін «ген(и) постачання попередником» включає гени, необхідні для постачання природними або неприродними попередниками, гени, необхідні для синтезу будь-яких природним або неприродним чином включених попередників і гени, необхідні для включення будь-яких природним або неприродним чином включених попередників. У якості не обмежуючих прикладів, у системі рапаміцину такі гени включають rapL, rapK, rapP і rapА. Фахівець у даній галузі зрозуміє, що гомологи цих генів існують у споріднених кластерах біосинтетичних генів і застосування цих гомологічних генів у способах за винаходом також розглядається. Як застосовується тут, термін «допоміжний ген(и)» включає посилання на гени, що модифікують, гени постачання попередником або як гени, що модифікують так і гени постачання попередником. Як застосовується тут, термін «попередник» включає природну вихідну кислоту (наприклад, 4,5-дігідроксициклогекс-1-енокарбонову кислоту) і неприродні вихідні кислоти, природним чином включені амінокислоти (наприклад, піпеколінова кислота, пролін), неприродним чином включені амінокислоти, малоніл-КоА та метилмалоніл-КоА. 31 Як застосовується тут, термін «неприродна вихідна кислота» відноситься до будь-якої сполуки, що може бути включена як вихідна кислота в синтез полікетида, що не є вихідною кислотою, що зазвичай обирається цією PKS. Щоб уникнути різночитань, терміни «попередник» і «неприродна вихідна кислота» включають N-ацилцистеамінові тіоефіри олігокетидів (наприклад, дікетидів та трикетидів) і N-ацилцистеамінові тіоефіри або складні ефіри карбонових кислот, які можуть бути включені в кінцевий продукт. Як застосовується тут, термін «природний модуль» відноситься до набору суміжних доменів від KS до АСР-домена, включаючи KS-AT-ACP (у такому порядку) і за необхідності додатково утримуючий один або більше домен, обраний з: домена β-кеторедуктази (KR), KR-домена та домена гідратази (DH), і KR-домена, DH-домена та домена еноілредуктази (ER). Як застосовується тут, термін «комбінаторний модуль» відноситься до набору суміжних доменів, що простирається від однієї точки в природному модулі до відповідної точки в наступному модулі, наприклад, від початку АТ-домена в модулі А до початку АТ-домена в модулі В, або від середини KS-домена в модулі В до середини KS-домена в модулі С. Такі комбінаторні модулі можуть бути «подвійними» або більше, наприклад, можуть містити таке ж число доменів, як два або більше природних модулі. Як застосовується тут, термін «прерапаміцин» відноситься до першого вільного від ферменту продукту, отриманому за допомогою активності полікетид-синтази рапаміцину (що включає rapА, rapВ, і rapС) та rapP до дії кожного з генів, що модифікують, і зокрема до сполуки зі структурою, показаною нижче: Як застосовується тут, термін «аутоімунний розлад(и)» включає, не обмежуючись цим: системну червону вовчанку (SLE), ревматоїдний артрит, міастенію вагітних та розсіяний склероз. 95895 32 Як застосовується тут, термін «запальні захворювання» включає, не обмежуючись цим, псоріаз, дерматити, екзему, себорею, запальні захворювання шлунково-кишкового тракту (включаючи, але не обмежуючись цим, виразковий коліт і хворобу Крона), легеневі запалення (включаючи астму, хронічне обструктивне захворювання легенів, емфізему, синдром гострої дихальної недостатності та бронхіт) і очний увеіт. Як застосовується тут, термін «рак» відноситься до злоякісного новоутворення, яке видається з епітелію, перебуває в шкірі або більш звичайно, у тканинах органів тіла, наприклад, грудях, простаті, легенях, нирках, підшлунковій залозі, шлунку або кишечнику. Рак прагне проникнути в навколишні тканини та поширитися (метастазувати) на віддалені органи, наприклад, кістки, печінка, легені або мозок. Як застосовується тут, термін «рак» включає як метастатичні так і пухлинні типи клітин, такі як, але не обмежуючись цим, меланома, мікроманометр, лейкоз, фібросаркома, рабдоміосаркома та мастоцитома і типи карциноми тканин, такі як, але не обмежуючись цим, рак прямої кишки, рак простати, дрібноклітинний рак легеніє і не-дрібноклітинний рак легенів, рак грудей, рак підшлункової залози, рак сечового міхура, рак нирок, рак шлунка, гліобластома, первинний рак печінки та рак яєчників. Як застосовується тут, термін «злоякісність Вклітин» включає групу порушень, що включає хронічний лімфоцитарний лейкоз (CLL), множинну мієлому, не-Ходжкінську лімфому (NHL). Вони є неопластичними захворюваннями крові та кровотворних органів. Вони викликають дисфункцію кісткового мозку та імунної системи, що робить хазяїна сильно підданим інфекції і кровотечі. Як застосовується тут, термін «судинне захворювання» включає, не обмежуючись цим, гіперпроліферативні судинні порушення (наприклад, рестеноз і оклюзію судини), судинний атеросклероз трансплантата, серцево-судинні захворювання, церебральні судинні захворювання та периферичні судинні захворювання (наприклад, захворювання коронарних артерій, артеріосклероз, атеросклероз, неатероматозний артеріосклероз або порушення судинної стінки). Як застосовується тут, термін «регенерація нервової тканини» відноситься до стимуляції росту нервових клітин і включає ріст аксонів і функціональне відновлення нервових клітин. Захворювання та порушення, при яких регенерація нервової тканини може мати істотне терапевтичне значення, включають, але не обмежуються цим, хворобу Альцгеймера, хворобу Паркінсона, хорею Хаттінгтона, бічний аміотрофічний склероз, тригемінальну невралгію, глоссофарінгальну невралгію, периферичний параліч лицьового нерва, м'язову дистрофію, інсульт, м'язову атрофію, що прогресує, бульбарну успадковану м'язову атрофію, що прогресує, шийний спонділез, синдром ГулленБарра, деменцію, периферичні нейропатії та ушкодження периферичних нервів, обумовлені фізичним пораненням (наприклад, пораненням або травмою спинного мозку, ущемленням або 33 пораненням сідничного або лицьового нервів) або хворобливим станом (наприклад, діабетом). Як застосовується тут, термін «фіброзні захворювання» відноситься до захворювань, пов'язаних з надлишковою продукцією позаклітинного матрикса та включає (не обмежуючись цим) саркоідоз, келоіди, гломерулонефрит, кінцеву стадію ниркової хвороби, фіброз печінки (включаючи але не обмежуючись цим, алкогольне захворювання печінки та стеатогепатит), хронічку нефропатію трансплантата, васкулопатію, фіброз серця, фіброз легенів (включаючи але не обмежуючись цим ідіопатичний фіброз легенів і криптогенний фіброзний альвеоліт), дегенерацію м'язів, ретинальну та вітреальну ретинопатію або фіброз, індукований хіміотерапією або радіотерапією. Як застосовується тут, термін «загоєння ран» відноситься до процесу заліковування, який слідує за пораненням шкіри та інших м'яких тканин і включає, не обмежуючись цим, загоєння післяопераційних ран, лікування опіків або гіпертрофованих або келоідних рубців і запобігання хірургічної адгезії. Здійснення винаходу В одному аспекті даний винахід надає 17десметилрапаміцин та його аналоги, зокрема, даний винахід надає аналоги 17десметилрапаміцину у відповідності з наступною формулою: де x представляє прямий зв'язок, -СН2-, -S-CH2-, CH2-S- або -S(-O)-CH2-; 7 Де R і R8, як визначено вище (наприклад, R7 представляє Η або ОН і R8 представляє Н, ОН або ОМе). В подальшому кращому втіленні R4 представляє структурний фрагмент С(і), як визначено вище, у якому R8 є Η і R7 є Н, ОМе або, зокрема, ОН. 95895 34 або -CHR5-x-CHR6 представляє ; R1 представляє =O або (Н,Н); R2 представляє ОН або ОМе; R3 представляє Н, ОН або ОМе; R4 представляє структурний фрагмент, обраний із груп А, В, С, D, Ε і F, у яких хвиляста лінія вказує на положення приєднання фрагмента, R7 представляє Н, ОН або ОМе і R8 представляє Н, ОН, ОМе, галоген, тіол або С1-4 алкіл; або R4 альтернативно представляє 7-членний гетероцикл, що містить один або більше гетероатомів, обраних із групи, що складається з O, S і N, де гетероцикл за необхідності заміщений одним або більше замісниками, обраними з С1-4 алкілу, ОН, F і СІ; і R6 і R6 кожний незалежно є Η або ОН, або їх фармацевтично прийнятні похідні. В одному втіленні R4 представляє структурний фрагмент, обраний із груп А, В, С, Ε і F (наприклад, структурний фрагмент, обраний із груп А, С, Ε і F), як визначено вище, де R7 і R8, як визначено вище (наприклад, R7 представляє Н, ОН або ОМе і R8 представляє Н, ОН, ОМе, СІ або F (такий як Н, ОН, ОМе або F)). В подальшому втіленні R4 представляє структурний фрагмент, обраний із груп А(і), С(і), Ε(і) і F(i): У кращих втіленнях, коли R5 представляє ОН, R6 представляє Η і коли R6 представляє ОН, R5 представляє Η; x представляє прямий зв'язок або, зокрема, СН2. В альтернативному втіленні R2 представляє ОН. 35 В альтернативному втіленні R4 представляє 6членне кільце з киснем у положенні 4 (тобто тетрагідрофуран-4-іл). Краще втілення сполук за винаходом таке, у якому: R1 представляє (Н,Н) або =O; R2 представляє ОН або ОМе; R3 представляє ОН або OMe; R4 представляє структурний фрагмент С(і), як визначено вище, у якому R7 представляє ОН і R8 представляє Н, ОН або ОМе; і x представляє СН2. У найбільш бажаному втіленні: R1 представляє (Н,Н); R2 представляє ОН; R3 представляє Н; R4 представляє структурний фрагмент С(і), як визначено вище, у якому R7 представляє ОН і R8 представляє Н; і x представляє СН2. У кращому втіленні: R1 представляє (Н,Н); R2 представляє ОН; R3 представляє Н; R4 представляє структурний фрагмент С(і), як визначено вище, у якому обоє R7 і R8 представляють ОН; і x представляє СН2. У найбільш бажаному втіленні: R1 представляє (Н,Н); R2 представляє ОН; R3 представляє Н; R4 представляє структурний фрагмент С(і), як визначено вище, у якому R7 представляє ОН і R8 представляє F; і x представляє СН2. У найбільш бажаному втіленні: R1 представляє =O; R2 представляє ОН або ОМе; R3 представляє Н, ОН або ОМе; R4 представляє структурний фрагмент С(і), як визначено вище, у якому R7 представляє ОН і R8 представляє F або СІ; і x представляє СН2. У найбільш бажаному втіленні: R1 представляє =O; R2 представляє ОН; R3 представляє ОМе; R4 представляє структурний фрагмент С(і), як визначено вище, у якому R7 представляє ОН і R8 представляє Н; і x представляє СН2. У найбільш бажаному втіленні: R1 представляє =O; R2 представляє ОН; R3 представляє ОН; R4 представляє структурний фрагмент С (і), як визначено вище, у якому R7 представляє ОН і R8 представляє Н; і x представляє СН2. У найбільш бажаному втіленні: R1 представляє =O; R2 представляє ОН; R3 представляє ОМе; 95895 36 R4 представляє структурний фрагмент С(і), як визначено вище, у якому R7 представляє ОН і R8 представляє ОМе; і x представляє СН2. В одному втіленні сполука не є 17десметилрапаміцином. У відношенні всіх вищезгаданих втілень сполук за даним винаходом, у яких група R4 представляє заміщене циклогексанове кільце, подальші втілення, які можна згадати, включають такі, у яких відносна стереохімія замісників у циклогексановому кільці така, що кожний із замісників (включаючи полікетидне кільце, до якого приєднана R4 група) може одночасно прийняти екваторіальне положення, коли кільце перебуває в конформації крісла. Таким чином, приклади сполук за винаходом, які можна згадати, включають такі, у яких групи, приєднані до 2-, 4- та/або 6-положенням циклогексанових кілець структурних фрагментів С, D, F, С(і) і F(i) перебувають у транс-положенні відносно полікетидного кільця, приєднаного в положенні 1циклогексанової групи. Далі, інші сполуки за винаходом, які можна згадати, включають такі, у яких групи, приєднані в 3- та/або 5-положеннях циклогексанових кілець структурних фрагментів С, D, F, С(і) і F(i) перебувають у цис-положенні відносно полікетидного кільця, приєднаного в положенні 1циклогексанової групи. Таким чином, ще подальші сполуки за винаходом, які можна згадати, включають такі, у яких, коли група R4 представляє структурний фрагмент С(і), тоді відносно полікетидного кільця, приєднаного в положенні 1циклогексанової групи, група R7 (якщо присутня і особливо якщо є ОН або ОМе групою) володіє транс-стереохімією та група R8 (якщо присутня і особливо якщо є ОН або ОМе групою) володіє цис-стереохімією. Подібним чином, коли група R4 представляє циклогекс-3-енове кільце (наприклад, структурний фрагмент А або А(і)), тоді сполуки за винаходом, які можна згадати, включають такі, у яких відносно полікетидного кільця, приєднаного ε положенні 1- циклогексенового кільця, замісники при 2- та/або 6-положеннях мають трансстереохімію та замісники при 3-положєнні мають цис-стереохімію. Фахівець у даній галузі зрозуміє, що способи, описані тут для одержання 17десметилрапаміцину та його аналогів, застосовні для одержання бібліотек споріднених аналогів. Тому у подальшому аспекті даний винахід надає бібліотеки аналогів 17-десметилрапаміцину, отримані із застосуванням способів за даним винаходом. Зокрема, даний винахід надає бібліотеки аналогів 17-десметилрапаміцину, що відрізняються за однією або більше ознакою: включена вихідна кислота, включена амінокислота, ступінь постPKS обробки та напівсинтетична дериватизація. Нові аналоги рапаміцину застосовні прямо і як затравки для подальшого напівсинтезу або біоконвєрсії з метою одержання сполук, застосовних у якості імунодепресантів, протигрибкових агентів, протиракових агентів, протизапальних агентів, нейрорегенеративних агентів або агентів для лікування відторгнення трансплантата, захворювання трансплантат-проти-хазяіна, аутоімунних пору 37 шень, судинних захворювань і фіброзних захворювань та в регуляції загоєння ран. Способи напівсинтетичної дериватизації рапаміцину та його аналогів добре відомі в даній області і включають (але не обмежені цим) такі модифікації, описані в, наприклад, U.S. 5665772; U.S. 5362718, WO 96/41807; U.S. 5728710, U.S. 5378836; U.S. 5138051; U.S. 5665772, U.S. 5391730; U.S. 5,023262, U.S. 5563145, U.S. 5446048, U.S. 5912253, U.S. 5221670; U.S. 5955457; WO 98/04279, U.S. 6015815 і U.S. 5432183). У подальшому аспекті даний винахід надає застосування 17-десметилрапаміцину або його аналогів у медицині. У подальшому аспекті даний винахід надає застосування 17десметилрапаміцину або його аналогів в одержанні медикаментів для індукції або підтримки імунодепресії, стимуляції регенерації нервової тканини або лікування раку, злоякісності В-клітин, грибкових інфекцій, відторгнення трансплантата, захворювання трансплантат-проти-хазяїна, аутоімунних порушень, запальних захворювань, судинних захворювань і фіброзних захворювань і в регуляції загоєння ран. Також відомо, що аналоги рапаміцину є корисними при лікуванні інших станів, включаючи, але не обмежуючись цим, лімфангіолейоміоматоз і туберозний склероз. Застосування й способи, що включають сполуку за винаходом, також охоплюють ці інші симптоми. Фахівець у даній галузі зможе за допомогою рутинних дослідів визначити здатність цих сполук інгібувати ріст грибків (наприклад, Baker, Η., et al., 1978; NCCLS Reference method for broth dilution antifungal susceptibility testing for yeasts: Approved standard M27-A, 17(9). 1997). Додатково, фахівець у даній галузі зможе за допомогою рутинних дослідів визначити здатність цих сполук інгібувати ріст пухлинних клітин (див Dudkin, L., et al., 2001; Yu et al. 2001). У подальшому аспекті сполуки за даним винаходом застосовні для індукції імунодепресії, аналізи для визначення ефективності сполук щодо цього добре відомі фахівцеві в даній області, наприклад, але не обмежуючись цим, Immunosuppressant activity - Warner, L.M., et al., 1992, Kahan et al. (1991) & Kahan & Camarao, 2001); Allografts - Fishbein, Т.Н., et al., 2002, Kirchner et al. 2000; Autoimmune/Inflammatory/Asthma - Carlson, R.P. et al., 1993, Powell, N. et al., 2001; Diabetes I Rabinovitch, A. et al., 2002; Psoriasis - Reitamo, S. et al., 2001; Rheumatoid arthritis - Foey, Α., et al., 2002; Fibrosis - Zhu, J. et al., 1999, Jain, S., et al., 2001, Gregory et al. 1993. Здатність сполук за даним винаходом індукувати імунодепресію може бути продемонстрована в стандартних тестах, застосовуваних для цієї мети. У подальшому аспекті сполуки за даним винаходом застосовні у зв'язку з антифіброзним, нейрорегенеративним і проти-ангіогенним механізмами, фахівець у даній галузі зможе за допомогою рутинних дослідів визначити здатність цих сполук запобігати ангіогенезу (наприклад, Guba, Μ., et al., 2002). Фахівець у даній галузі зможе за допомогою рутинних дослідів визначити застосов 95895 38 ність цих сполук для лікування гіперпроліферативних судинних порушень, наприклад в ендопротезах судин (наприклад, Morice, M.C., et al., 2002). Додатково, фахівець у даній галузі зможе за допомогою рутинних дослідів визначити нейрорегенеративну здатність цих сполук (наприклад, Myckatyn, Τ.Μ., et al., 2002, Steiner et al. 1997). Даний винахід також надає фармацевтичну композицію, що включає 17-десметилрапаміцин або його аналог, або його фармацевтично прийнятну сіль разом з фармацевтично прийнятним носієм. Вищезгадані сполуки за винаходом або їхній склад можна застосовувати загальноприйнятими способами, наприклад але не обмежуючись цим, їх можна застосовувати парентерально, орально, топікально (включаючи защічне, під'язичне або черезшкірне застосування), за допомогою медичного пристосування (наприклад, ендопротез судини), шляхом інгаляції або ін'єкції (підшкірної або внутрім'язової). Застосування може складатися- з одиничної дози або декількох доз за період часу. Хоча можливо застосовувати сполуку за винаходом саму по собі, бажано включати її у фармацевтичний склад разом з одним або більше прийнятними носіями. Носій(ї) повинні бути «прийнятними» у сенсі їхньої сумісності із сполуками за винаходом та відсутності шкідливої дії на реципієнта. Приклади підходящих носіїв описані більш детально нижче. Сполуки за винаходом можна застосовувати самі по собі або в комбінації з іншими терапевтичними агентами, спільне застосування двох (або більше) агентів дозволяє значно понизити дози кожного з них для застосування, у такий спосіб зменшуючи спостережувані побічні дії. В одному втіленні 17-десметилрапаміцин або його аналог застосовують разом з іншим терапевтичним агентом для індукції або підтримки імунодепресії, для лікування відторгнення трансплантата, захворювання трансплантат-проти-хазяїна, аутоімунних порушень, запальних захворювань, де кращі агенти включають, але не обмежуються цим, імунорегуляторні агенти, наприклад, азатіоприн, кортикостероїди, циклофосфамід, циклоспорін A, FK506, мікофенолат мофетіл, ОКТ-3 і ATG. B альтернативному втіленні 17десметилрапаміцин або його аналог застосовують разом з іншим терапевтичним агентом для лікування раку або злоякісності В-клітин, кращі агенти включають але не обмежені цим, метотрексат, лейковорин, адріаміцин, пренізон, блеоміцин, циклофосфамід, 5-фторурацил, паклітаксель, доцетаксель, вінкрістін, вінбластін, вінорелбін, доксорубіцин, тамоксифен, тореміфрен, мегестрол ацетат, анастрозол, гозерелін, анти-НЕR2 моноклональне антитіло (наприклад, Herceptin), капецитабін, ралоксифен гідрохлорид, інгібітори EGFR (наприклад, Iressa, Tarceva, Erbitux), інгібітори VEGF (наприклад, Avastin), інгібітори протеасом (e.g. Velcade), Glivec або інгібітори hsp90 (наприклад, 17-AAG). До того ж, 17десметилрапаміцин або його аналог можна застосовувати ε комбінації з іншими терапіями, включа 39 ючи але не обмежуючись цим, радіотерапію або хірургію. В одному втіленні 17-десметилрапаміцин або його аналог призначають разом з іншим терапевтичним агентом для лікування судинного захворювання, кращі агенти включають але не обмежуються цим, інгібітори АСЕ, антагоністи рецептора ангіотензину II, похідні фібрової кислоти, інгібітори HMG-KoA редуктази, блокатори -адренергетиків, блокатори кальцієвих каналів, антиоксиданти, антикоагулянти та інгібітори кров'яних пластинок (наприклад, Plavix). В одному втіленні 17-десметилрапаміцин або його аналог призначають разом з іншим терапевтичним агентом для стимуляції регенерації нервової тканини, кращі агенти включають але не обмежуються цим, нєйротрофні фактори, наприклад, фактор росту нервової тканини, фактор росту, отриманий із глії, фактор росту, отриманий з мозку, циліарний нейротрофний фактор і нейротрофін-3. В одному втіленні 17-десметилрапаміцин або його аналог уводять разом з іншим терапевтичним агентом для лікування грибкових інфекцій, кращі агенти включають, але не обмежуються цим, амфотеріцин В, флуцитозин, ехінокандіни (наприклад, каспофунгін, анідулафунгін або мікафунгін), грізеофульвін, імідазольний або тріазольний протигрибковий агент (наприклад, клотримазол, міконазол, кетоконазол, еконазол, бутоконазол, оксіконазол, терконазол, ітраконазол, флуконазол або воріконазол). У спільне введення включені всі способи доставки двох або більше терапевтичних агентів хворому як частина того самого режиму лікування, що очевидно для фахівця в даній області. Хоча два або більше агенти можуть застосовуватися одночасно в єдиному складі, це не є важливим. Агенти можуть уводитися в різних складах і в різний час. Склади можуть перебувати зручним чином в одиничних лікарських формах і можуть бути отримані кожним зі способів, добре відомих фахівцеві в області фармацевтики. Такі способи включають етап одержання суміші активного інгредієнта (сполуки за винаходом) з носієм, що становить один або більше додаткових інгредієнтів. В основному, склади одержують шляхом однорідного та ретельного змішування активного інгредієнта з рідкими носіями або тонко здрібненими твердими носіями або ними обома потім за необхідності, надання продукту форми. Сполуки за винаходом звичайно застосовують орально або кожним з парентеральних шляхів, у вигляді фармацевтичного складу, що включає активний ігредієнт, за необхідності у вигляді додаткової солі нетоксичних органічних або неорганічних кислоти або основи у фармацевтично прийнятній лікарській формі. Залежно від порушення та хворого на лікуванні, а також шляху застосування, композиції можна застосовувати в різних дозах. Наприклад, сполуки за винаходом можна застосовувати орально, защічно або під'язично у формі таблеток, капсул, пігулок (ovules), еліксирів, розчинів або суспензій, які можуть містити віддуш 95895 40 ки або барвні агенти, для негайного, затриманого або контрольованого визільнення. Сполуки за винаходом можна також застосовувати шляхом внутрішньокавернозної ін'єкції. Розчини або суспензії сполук за винаходом, що підходять для орального застосування, можуть також містити наповнювачі, наприклад, N,Nдиметацетамід, диспергуючі засоби, наприклад, полісорбат 80, поверхнево-активні речовини та солюбілізатори, наприклад, поліетиленгліколь, Фозал 50 ПГ (який складається з фосфатиділхоліну, соєвих жирних кислот, етанолу, моно/діглицеридів, пропіленгліколю та аскорбіл пальмітату). Таблетки можуть містити наповнювачі, такі як мікрокристалічна целюлоза, лактоза (наприклад, моногідрат лактози або безводну лактозу), цитрат натрію, карбонат кальцію, двоосновний фосфат кальцію та гліцин, розпушувачі такі як крохмаль (переважно, кукурудзяний, картопляний або тапіоковий крохмаль), крохмаль-гліколат натрію, кроскармелоза натрію та деякі комплексні силікати і зв'язувальні речовини гранул такі як полівінілпіролідон, гідроксипропілметилцелюлоза (НРМС), гідроксипропілцелюлоза (НРС), макрогол 8000, сахароза, желатин і акація. Додатково, можна включати агенти, що змазують, такі як стеарат магнію, стеаринова кислота, гліцерил-бегенат і тальк. Тверді композиції подібного типу можна застосовувати як наповнювачі в желатинових капсулах. Кращі наповнювачі щодо цього включають лактозу, крохмаль, целюлозу, молочний цукор або поліетиленгліколі з високою молекулярною вагою. Для водних суспензій та/або еліксирів сполуки за винаходом можна комбінувати з різними підсолоджувачами або віддушками, барвникам або фарбами, з емульгаторами та/або суспендуючими агентами та з розріджувачами такими як вода, етанол, пропіленгліколь і гліцерин та їхнє сполучення. Таблетки можна одержувати шляхом пресування або формування, за необхідності з одним або більше допоміжними інгредієнтами. Пресовані таблетки можна одержувати шляхом пресування в підходящому агрегаті активного інгредієнта у вільно-текучому вигляді, такому як порошок або гранули, за необхідності змішаного зі зв'язувальною речовиною (наприклад, повідоном, желатином, гідроксиметилцелюлозою), речовиною, що змащує, інертним розріджувачем, консервантом, розпушувачем (таким як крохмаль-гліколат натрію, що поперечно-зшитий повідон, поперечно-зшита карбоксиметилцелюлоза натрію), поверхневоактивним або диспергуючим агентом. Формування таблетки можна одержувати шляхом формування в підходящому агрегаті суміші порошкоподібної сполуки, зволоженої інертним рідким разріджувачем. Таблетки за необхідності можна покривати або наносити на них борозенки і можна формулювати так, щоб надати повільне або контрольоване вивільнення активного інгредієнта, застосовуючи, наприклад, гідроксипропілметилцелюлозу в різних пропорціях для надання бажаного профілю вивільнення. 41 Склади за даним винаходом, що підходять для орального застосування, можуть бути присутніми у вигляді окремих одиниць, таких як капсули, облатки або таблетки, де кожна містить певну кількість активного інгредієнта; як порошки або гранули; як розчин або суспензія у водній рідині або неполярній рідині; або як рідка емульсія олія-в-воді або емульсія воді-в-олії. Активний інгредієнт може також бути присутнім у вигляді пігулки, лікарської кашки або пасти. Склади, що підходять для місцевого застосування через рот включають коржики, що включають активний інгредієнт в ароматизованій основі, звичайно в сахарозі, акції або трагаканті; пастилки, що включають активний інгредієнт в інертній основі, такій як желатин або гліцерин або сахарозу й акацію; полоскання для рота, що включають активний інгредієнт у підходящому рідкому носії. Варто розуміти, що на додаток до інгредієнтів, особливо відзначеним вище, склади за даним винаходом можуть включати інші агенти, загальноприйняті в даній області техніки, що мають відношення до типу розглянутого складу, наприклад, такі, підходящі для орального застосування, можуть включати ароматизуючі агенти. Фармацевтичні композиції, пристосовані для місцевого застосування, можуть бути складені у вигляді мазей, кремів, суспензій, лосьйонів, порошків, розчинів, паст, гелів, імпрегнованих перев'язних матеріалів, спреїв, аерозолів або масел, трансдермальних пристосувань, порошків для присипки та т.п. Ці композиції можна одержувати за допомогою загальноприйнятих способів і містять активний агент. Таким чином, вони можуть також включати сумісні загальноприйняті носії та додаткові засоби, такі як консерванти, розчинники для сприяння проникненню ліків, засобу для зм'якшення в кремах або мазях і етанол або олеіловий спирт у лосьйонах. Такі носії можуть становити від приблизно 1% до приблизно 98% композиції. Звичайно, вони становлять до приблизно 80% композиції. Тільки для ілюстрації, крем або мазь одержують шляхом змішування достатньої кількості гідрофільного матеріалу та води, що містять від приблизно 5-10% по вазі сполуки, у достатніх кількостях для одержання крему або мазі, що мають потрібну консистенцію. Фармацевтичні комозиції, пристосовані для трансдермального застосування, можуть бути присутніми у вигляді окремих пластирів, призначених для перебування в близькому контакті з епідермісом реципієнта протягом довгого періоду часу. Наприклад, активний агент можна доставляти з накладки шляхом іонофорезу. На додаток до зовнішніх тканин, наприклад, до рота та шкіри, композиції звичайно застосовують у вигляді місцевої мазі і крему. При готуванні у вигляді мазі, активний агент можна застосовувати разом з основою мазі, що змішується з парафіном або водою. Альтернативно, активний агент можна готовити у вигляді крему з основою крему типу олія-уводі або вода-в-олії. Для парентерального застосування, рідкі одиничні лікарські форми готовлять із застосуванням 95895 42 активного інгредієнта та стерильного розріджувача, наприклад, але не обмежуючись цим, води, спиртів, поліолів, гліцерину та рослинних олій, причому вода краща. Активний інгредієнт, залежно від розріджувача та застосованої концентрації, можна або суспендувати, або розчиняти в розріджувачі. При готуванні розчинів активний інгредієнт можна розчиняти у воді для ін'єкції та стерилізувати через фільтр перед заповненням підходящої пляшечки або ампули і його герметичним закриттям. Переважно, такі агенти, як місцеві анестетики, консерванти та буферні агенти можна розчиняти в розріджувачі. Для збільшення стабільності композицію можна заморожувати після заповнення пляшечки та видаляти воду під вакуумом. Сухий ліофілізований порошок потім герметично закривають у пляшечці та додаткову пляшечку із водою для ін'єкцій можна поставляти для заповнення рідини перед уживанням. Парентеральні суспензії готовлять, в основному, таким же способом, як розчини, крім того, що активний інгредієнт суспендують у розріджувачі замість того, щоб розчиняти, і стерилізацію не можна проводити шляхом фільтрації. Активний інгредієнт можна стерилізувати шляхом обробки окисом етилену перед суспендуванням у стерильному розріджувачі. Переважно, поверхнево-активна речовина або зволожуючий агент включають у композиції для полегшення однорідного розподілу активного інгредієнта. Сполуки за винаходом можна також застосовувати за допомогою медичних пристосувань, відомих у даній області. Наприклад, в одному втіленні фармацевтичну композиції за винаходом можна застосовувати з безголковим пристосуванням для гіподермальних ін'єкцій, таким як пристосування, розкриті в патентах U.S. №№ 5399163; 5383851; 5312335; 5064413; 4941880; 4790824; або 4596 556. Приклади добре відомих імплантів і модулів, застосовних у даному винаході, включають US 4487 603, що розкриває вживляємий мікроінфузійний насос для подання ліків з контрольованою швидкістю; US 4486194, що розкриває терапевтичне пристосування для застосування медикаментів через шкіру; US 4447233, що розкриває медичний інфузійний насос для доставки ліків з точною швидкістю інфузії; US 4447224, що розкриває вживляємий інфузійний апарат змінного потоку для постійної подання ліків; US 4439196, що розкриває осмотичну систему доставки ліків, що характеризується багатокамерними відділеннями, та US 4475196, що розкриває осмотичну систему доставки ліків. У конкретному втіленні сполуки за винаходом можна застосовувати за допомогою елюююючого ліки протеза судини, наприклад, що відповідає таким, описаним в WO 01/87263 і споріднених публікаціях або описаним Перин (Perin, EC, 2005). Багато інші такі імпланти, системи доставки та модулі відомі фахівцеві в даній області. В альтернативному втіленні даного аспекту, сполуки за винаходом можна давати хворому у вигляді проліків, це особливо застосовно у випадку протиракового агента, але може також застосовуватися для інших випадків. 43 Термін «проліки», як застосовується в цій заявці, відноситься до попередника або похідної форми фармацевтично активної сполуки, яка менш цитотоксична в порівнянні із самими ліками та здатна до ензиматичної активації або перетворення в більше активну батьківську форму (див наприклад, Wilman D.E.V., 1986 і Stella V.J. et al, 1985). Дозування для застосування сполуки за винаходом варіює залежно від конкретної сполуки, наявного захворювання, суб'єкта та природи і тяжкості захворювання та фізичного стану суб'єкта і обраного шляху застосування. Підходящі дозування можуть бути легко встановлені фахівцем у даній області. Композиції можуть містити від 0,1% по вазі, переважно, від 10-60% або більше по вазі сполуки за винаходом залежно від способу застосування. Фахівець у даній галузі легко здогадається, що оптимальна кількість і розподіл індивідуальних дозувань сполуки за винаходом визначається природою та ступенем стану, що підлягає лікуванню, формою, шляхом і місцем застосування та віком і станом окремого суб'єкта для лікування і що терапевт в остаточному підсумку визначить необхідне дозування для застосування. Це дозування можна повторювати так часто, як потрібно. У випадку розвитку побічних ефектів кількість та/або частоту застосування можна змінити або зменшити відповідно до нормальної клінічної практики. В альтернативному аспекті даний винахід надає спосіб одержання 17-десметилрапаміцину або його аналога, де згаданий спосіб включає: (а) заміну метилмалоніл-КоА-специфічного АТдомена модуля 10 PKS рапаміцину малоніл-КоАспецифічним АТ-доменом. (б) експресію генетично модифікованого PKS рапаміцину в підходящій клітині-хазяїні; (в) культивацію клітини-хазяїна в таких умовах, коли продукується 17-десметилрапаміцин або його аналог, включаючи за необхідності подання екзогенних попередників; (г) за необхідносте виділення сполуки, отриманої таким способом. У конкретному втіленні отримана сполука не є 17-десметилрапаміцином. Заміна призводить до включення малоніл-КоА за допомогою модуля 10 PKS рапаміцину та відсутності метильної гілки при С17 у порівнянні з рапаміцином або пре-рапаміцином. У кращому втіленні малоніл-КоА-специфічний АТ-домен вибирають із одного з наступних кластерів полікетид-синтазних генів: рапаміцину, монексину, FK506, еритроміцину, FK520, амфотерицину, анголаміцину, тілозину, «хіг», FK523, меридаміцину, антаскоміцину, FK525 і тсукубаміцину. У більше кращому втіленні малоніл-КоА-специфічний АТдомен вибирають із одного з наступних кластерів: рапаміцину, моненсину або FK506. У більш бажаному втіленні малоніл-КоА-специфічний АТ-домен вибирають із групи, що складається з АТ-домена модуля 2 рапаміцину, АТ-домена модуля 3 моненсину, АТ-домена модуля 6 моненсину, АТ-домена модуля 8 моненсину, АТ-домена модуля 3 FK506 і АТ-домена модуля 7 FK506. У найбільш кращому 95895 44 втіленні малоніл-КоА-специфічний АТ-домен є АТдомена модуля 2 рапаміцину. Варто відмітити, що ряд помилок у закладеній у базу даних послідовності були ідентифіковані, як показано в WO 04/007709. Справжні автори передбачають, що можуть ще бути помилки в закладеній у базу даних послідовності, деякі з яких можуть розташовуватися в районах, застосовуваних у даній роботі для генетичної модифікації кластера. Послідовності в номенклатурі послідовностей представляють послідовності синтезованих олігонуклеотидів, які створені на основі опублікованої послідовності та фрагментів ДНК, амплифікованих за допомогою полімеразної ланцюгової реакції (PCR), які секвенували. Тому вони можуть не бути ідентичними закладеній в базу даних послідовності. Фахівець у даній галузі зрозуміє, що в клонованих фрагментів ДНК, які не були секвеновані, буде послідовність, біологічно вірна для утворення функціональних білків і помилки в послідовності, поміщеної в банк даних, ніяк не вплинуть на це. Також ідентифіковані (NCBI інвентарний номер Х86780) передбачені продукти трансляції PKS генів і (Aparicio et al., 1996) границі доменів і модулів. Фахівець у даній галузі зрозуміє, що є якась розпливчастість у визначенні домена, і границі, як визначено в Schwecke et al., (1995), варто розглядати як приклади того, де границі можуть розташовуватися. Фахівець у даній галузі зрозуміє, що є багато малоніл-КоА-специфічних АТ-доменів у полікетидсинтазах типу І (і змішаних PKS-NRPS), які можна застосовувати як донорів АТ-доменів, і що ця трансформація може бути проведена з кожним із числа вибіркових по малоніл-КоА ацилтрансферазних доменів з будь-якою PKS типу І або змішаних NRPS/PKS. Фахівець у даній галузі зрозуміє, що включення малоніл-КоА за допомогою AT модуля 10 можна здійснити шляхом мутації rapАТ10, так щоб змінити його специфічність, наприклад, застосовуючи способи, як описано в WO 02/14482 або шляхом заміни модуля 10 модулем, що містить АТ-домен, вибірковий по малоніл-КоА, де згаданий модуль включає природний модуль або комбінаторний модуль. Вставка малоніл-КоА-специфічного AT у модуль 10 PKS рапаміцину досягається шляхом вставки ділянок зв'язування рестриктаз, що фланкують донорний домен, і клонування його у фазі з рамкою зчитування в те ж положення, що в ацилтрансферази модуля 10 рапаміцину. Фахівець у даній галузі зрозуміє, що цього можна досягти шляхом застосування ряду ділянок зв'язування ферментів рестрикції та ряду ділянок сполуки (junction). У кращому втіленні малоніл-КоАспецифічний АТ-домен АТ2 рапаміцину вставляють у фрагмент ДНК, фланкований ділянками зв'язування ферментів рестрикції MscI і Avrll. Ділянку MscI уводять у початок АТ-домена, перекриваючи послідовність ДНК, що кодує консервативну послідовність амінокислот PGQ, див нижче. Ділянку Avrll уводять у кінець АТ-домена, перекриваючи послідовність ДНК, що кодує консервативну послідовність амінокислот VLG, див нижче. Фахівець у даній галузі зрозуміє, що в рамках стратегії клону 45 95895 46 вання ділянка MscI метильована і потрібне проведення через такий штам Е. coli як ЕТ12567 для одержання dcm ДНК перед обробкою ферментом рестрикції MscI. Альтернативні втілення включають застосування інших ділянок зв'язування фер ментів рестрикції, наприклад, але не обмежуючись цим, Spel і Avrll, MscI і Bglll, Spel і Bglll. Альтернативною кращою парою ділянок рестрикції є Spel і Avrll. У кращому втіленні полікетид-синтаза рапаміцину з S. hygroscopicus MG2-10 генетично модифікована для одержання малоніл-КоА-специфічного AT у модулі 10. У бажаному втіленні малоніл- КоА AT є АТ2 рапаміцину, як описано в прикладі 1 тут. Фахівець у даній галузі зрозуміє, що є кілька шляхів, за допомогою яких ДНК можна ввести в клітину для того, щоб здійснити генетичну модифікацію генного кластера PKS. У прикладі 1 ми описуємо спосіб кон'югації із застосуванням чутливого до температури ориджину реплікації плазміди. Фахівець у даній галузі зрозуміє, що інші способи також можна застосовувати, наприклад, але не обмежуючись цим, гомологічну рекомбінацію без застосування вектора, здатного до самореплікації, способи, як описано в WO 03/033699. Тому рекомбінантні підходи до одержання модифікованого PKS рапаміцину не слід обмежувати описаними тут. Однак, описані тут способи є кращими способами створення генетично модифікованого кластера PKS. На даний момент не показано успішної генетичної модифікації rapА, rapВ або rapС за допомогою альтернативних способів, описаних вище. У подальшому аспекті даний винахід надає спосіб створення рекомбінантного штаму, що містить генетично модифікований біосинтетичний кластер, що кодує полікетид-синтазу рапаміцину, де метилмалоніл-КоА-специфічний АТ-домен модуля 10 замінений малоніл- КоА -специфічним АТдоменом, як описано вище. У кращому втіленні малоніл- КоА -специфічний АТ-домен обраний з одного з наступних кластерів полікетид-синтазних генів: рапаміцину, моненсину, FK506, еритроміцину, FK520, амфотерицину, анголаміцину, тілозину, «хіг», FK523, мерідаміцину, антаскоміцину, FK525 і тсукубаміцину. У більш кращому втіленні малонілКоА-специфічний АТ-домен вибирають із одного з наступних кластеріз: рапаміцину, моненсину та FK506. У ще більш кращому втіленні АТ-домен вибирають із групи, що складається з модуля 2 рапаміцину, модуля 3 моненсину, модуля 6 моненсину, модуля 8 моненсину, модуля 3 FK506 і модуля 7 FK506. У найбільш кращому втіленні малоніл-КоА-специфічний АТ-домен походить із модуля 2 рапаміцину. Хоча генетична модифікація полікетидсинтазного шляху рапаміцину наведена тут як приклад для S. hygroscopicus MG2-10 (одержання якого розкрите в WO 04/007709 і в Gregory et al., (2004)), фахівець у даній галузі зрозуміє, що ці способи можна так само застосовувати до дикого типу S. hygroscopicus NRRL54 91 і до інших споріднених штамів (див нижче). Переважно, генетично модифікований штам вибирають із групи, що складається з S. hygroscopicus MG2-10 і S. hygroscopicus NRRL5491. У цьому контексті штами, споріднені S. hygroscopicus NRRL5491, включають: Actinoplanes sp. N902-109 (наприклад, FERM ВР-3832), Streptomyces sp. AA6554, Streptomyces hygroscopicus var. ascomyceticus MA 6475 (наприклад, АТСС 14891), Streptomyces hygroscopicus 47 var. ascomyceticus MA 6678 (наприклад, АТСС 55087), Streptomyces hygroscopicus var. ascomyceticus MA 6674, Streptomyces hygroscopicus var. ascomyceticus (наприклад, АТСС 55276), Streptomyces tsukubaensis No.9993 (наприклад, FERM BP-927), Streptomyces hygroscopicus subsp. yakushimaensis, Streptomyces sp. (наприклад, DSM 4137), Streptomyces sp. (наприклад, DSM 7348), Micromonospora n.sp. A92306401 (наприклад, DSM 8429) і Streptomyces sp. MA 6858 (наприклад, АТСС 55098). В одному втіленні штам не є рекомбінантною S. hygroscopicus клітиною-хазяїном, продукуючою 17десметилрапаміцин. В іншому втіленні штам не є рекомбінантною клітиною-хазяїном, продукуючою 17-десметилрапаміцин під час відсутності подання екзогенних попередників. У подальшому втіленні штам не є рекомбінантною клітиною-хазяїном S. hygroscopicus, що містить делецію п'яти суміжних генів, rapQONML. За необхідності, спосіб можна комбінувати зі способами, розкритими в WO 04/007709, для одержання аналогів 17-десметилрапаміцину, які відрізняються від природної структури рапаміцину ступенем обробки пост-PKS ферментами або включенням неприродних вихідних кислот. Втілення попередніх аспектів за винаходом, що надає спосіб одержання 17десметилрапаміцину та його аналогів і спосіб одержання рекомбінантного штаму, що містить біосинтетичний кластер, що кодує сконструйовану полікетид-синтазу рапаміцину, включає наступні етапи: (а) виділення AT з метою ввести його як єдиний фрагмент ДНК із підходящими фланкуючими ділянками зв'язування рестриктаз, (б) ампліфікація та виділення районів послідовності ДНК, гомологічних фланкуючим послідовностям АТ-мішені за допомогою тих же підходящих ділянок зв'язування рестриктаз, (в) літування разом трьох фрагментів ДНК, описаних в (а) і (б), з одержанням у фазі з рамкою зчитування послідовності LHS гомології з наступним донорним AT-доменом з наступної RHS гомологією, (г) введення повної послідовності з (в) у вектор для введення в штам-хазяїн для одержання кінцевої плазміди, де згадана плазміда включає: (1) оrіТ для кон'югації, (2) один або більше маркер стійкості до антибіотика, (3) чутливий до температури ориджин реплікації, так що інтегранти можна буде відбирати при 37°С і (4) ориджин реплікації Е. coli, (д) трансформація штаму-хазяїна шляхом кон'югації із застосуванням кінцевої плазміди, як описано в (г) вище, (e) відбір трансформованих клітин за стійкістю до відповідного антибіотика, (ж) одержання первинних інтегрантів шляхом культивації при 37°С із селекцією за допомогою антибіотика, (з) скринінг вторинних рекомбінантів шляхом вирощування під час відсутності антибіотика, також при 37°С, 95895 48 (і) ідентифікація потрібного штаму по здатності продукувати цільовий продукт і (к) за необхідності, підтвердження генетики штаму за допомогою стандартних способів. Фахівець у даній галузі зрозуміє, що підходящі ділянки зв'язування рестриктаз, на які посилаються на етапі (б), повинні бути такими, щоб три послідовності виявилися у фазі з рамкою зчитування, коли вони ліговані разом, вони не обов'язково є такими ж, як ті дві ділянки, що застосовані для AT; точніше, ділянка зв'язування рестриктаз із правої сторони (RHS) лівостороннього району гомології повина бути такою ж, як ділянка з лівої сторони (LHS) AT, або сумісною з нею, щоб дати послідовність у фазі з рамкою зчитування; ділянка рестрикції з лівої сторони лівостороннього району гомології може бути будь-якою ділянкою, що підходить для проведення наступних етапів клонування. Подібним чином, ділянка з лівої сторони правобічного району гомології повина бути такою ж, як ділянка із правої сторони AT, або сумісною з нею, щоб дати послідовність у фазі з рамкою зчитування; ділянка рестрикції із правої сторони правобічного району гомології може бути будь-якою ділянкою, що підходить для проведення наступних етапів клонування. У подальшому аспекті даний винахід надає спосіб одержання аналога 17десметллрапаміцину, де згаданий спосіб включає: (а) створення рекомбінантного штаму, у якого метилмалоніл- КоА -специфічний АТ-домен модуля 10 PKS рапаміцину замінений малоніл- КоА специфічним АТ-доменом, (б) подання неприродних вихідних кислот культурі згаданого рекомбінантного штаму в умовах, що підходять для продукції полікетида, і (в) за необхідності виділення сполук, отриманих таким способом. Тому даний винахід надає спосіб одержання аналогів 17-десметилрапаміцину, які включають неприродні вихідні кислоти. Зокрема, даний винахід надає включення циклічних і гетеро цикличних вихідних кислот в аналоги 17десметилрапаміцину, де згаданий спосіб включає подання згаданих альтернативних вихідних кислот штаму, що містить генетично модифікований кластер біосинтетичних генів рапаміцину, що відповідальний за синтез серцевини десметилпрепараміцину. В одному втіленні в рекомбінантного штаму ген виробництва попередника вилучений або інактивований. У кращому втіленні геном виробництва попередника, що був вилучений або інактивований, є rapK. У подальшому кращому втіленні в рекомбінантного штаму rapK вилучений або інактивований і неприродну кислоту, що подається при рості штаму, вибирають із групи, що складається із циклогексанкарбонової кислоти, 3метилциклогексанкарбонової кислоти, циклогептанкарбонової кислоти, 3-фтор-4гідроксициклогексанкарбонової кислоти, 4-фтор-3гідроксициклогексанкарбонової кислоти, 3-хлор-4гідроксициклогексанкарбонової кислоти та 4-хлор3-гідроксициклогексанкарбонової кислоти. В одному втіленні штам не є рекомбінантними S. hygroscopicus клітинами-хазяїнами, які продукують 49 17-десметилрапаміцин. У подальшому втіленні штам не є рекомбінантними клітинами-хазяїнами S. hygroscopicus, які продукують 17десметилрапаміцин під час відсутності подання екзогенних попередників. Цей аспект винаходу надає способи ефективного виробництва безлічі базових продуктів шляхом включення неприродних попередників (наприклад, циклічних або гетероциклічних вихідних кислот). Способи можуть також охоплювати подальші аспекти, як описано нижче. Тому в одному аспекті даний винахід надає спосіб одержання аналогів 17десметилрапаміцину, які включають циклічну або гетероциклічну вихідну кислоту, де згаданий спосіб включає: (а) модифікацію згаданого рекомбінантного штаму, що містить генетично модифіковані гени PKS рапаміцину, щоб додатково видалити або інактивувати хоча б один ген виробництва попередника, і (б) подання циклічної або гетероциклічної вихідної кислоти згаданому рекомбінантному штаму. У кращому втіленні рекомбінантний штам одержують із застосуванням способів, описаних в WO 04/007709 і тут. У кращому втіленні, одним з генів виробництва попередника, що був вилучений або інактивований, є rapK. В одному втіленні подавані екзогенні кислоти включають (не обмежуючись цим) циклоалкілкарбонові кислоти або їх прості складні ефіри з розміром кільця, що варіює від 5 до 7 атомів. У кращому втіленні карбоновими кислотами є такі, описані в WO 04/007709. В іншому кращому втіленні неприродними вихідними кислотами є описані в прикладі 2 тут. У більше кращому втіленні неприродні вихідні кислоти, що подаються при рості цього штаму, вибирають із групи, що складається із циклогексанкарбонової кислоти, 3-метилциклогексанкарбонової кислоти, циклогептанкарбонової кислоти, 3-фтор4-гідроксициклогексанкарбонової кислоти, 4-фтор3-гідроксициклогексанкарбонової кислоти, 3-хлор4-гідроксициклогексанкарбонової кислоти та 4хлор-3-гідроксициклогексанкарбонової кислоти. В одному втіленні гетероциклічні вихідні кислоти, які можна подавати, включають (не обмежуючись цим): гетероциклічні карбонові кислоти або їх прості складні ефіри з розміром кільця, що варіює від 5 до 7 атомів, згадані кільця можуть містити один або більше гетероатомів, коли кільце містить більше одного гетероатома, згадані гетероатоми можуть бути однаковими або вони можуть бути різними. Гетероатом можна вибирати із групи, що складається з О, S або N. Коли кільце містить N, він може бути у вигляді вільної основи (NH), у вигляді ацильованого аміну ( N-ацил), у вигляді алкільованого аміну (N-алкіл) або у вигляді алкільованого N-окису (N-алкіл, N-O). Коли кільце містить S, вона може бути у вигляді циклічного тіоефиру, сульфоксиду або сульфону. У всіх вищеописаних гетероциклічних карбонових кислотах, залишок кільця може бути незаміщеним або за необхідності він може містити один або більше замісник, включаючи, але не обмежуючись цим, С1-4 алкіл, ОН, F 95895 50 і СІ. Переважно, в одному втіленні гетероциклична карбонова кислота містить 6-членне кільце з атомом кисню в четвертому положенні. У подальшому кращому втіленні гетероциклічна карбонова кислота є тетрагідро-2Η-піран-4-карбоновою кислотою. У подальшому аспекті даний винахід надає спосіб одержання аналога 17десметилрапаміцину, де згаданий спосіб включає: (а) створення рекомбінантного штаму, у якого метилмалоніл-КоА-специфічний AT-домен модуля 10 PKS рапаміцину замінений малоніл-КоАспецифічним АТ-доменом (як описано більш детально вище), (б) додатково видалення або інактивацію одного або більше з допоміжних генів рапаміцину, обраних з rapI, rapJ, rapK, rapL, rapM, rapN, rapO і rapQ, (в) культивацію штаму, отриманого таким чином, за необхідності в присутності екзогенного попередника, якщо потрібно, для одержання аналога 17-десметилрапаміцину та (г) за необхідності виділення сполуки, отриманої в такий спосіб. У кращому втіленні допоміжними генами, які видаляють або інактивують, є rapI, rapJ і rapQ. З альтернативному кращому втіленні допоміжними генами, які видаляють або інактивують, є rapJ, rapM і rapQ. В альтернативному аспекті даного винаходу, змінений PKS рапаміцину експресують у клітиніхазяїні, у якій один або більше з допоміжних генів рапаміцину вилучений або інактивований. В альтернативному втіленні змінений PKS рапаміцину експресують у клітині-хазяїні, у якій всі допоміжні гени вилучені або інактивовані, наприклад, але не обмежуючись цим, у штамі S. hygroscopicus MG210 (WO 04/007709; Gregory et al., 2004). Фахівець у даній галузі зрозуміє, ґрунтуючись на розкритті, представленому в WO 04/007709, що якщо rapK був вилучений або інактивований, необхідно буде надати екзогенну кислоту для одержання 17десметилрапаміцину або його аналога. У подальшому аспекті даний винахід надає спосіб одержання аналога 17десметилрапаміцину, де згаданий спосіб включає: (а) створення рекомбінантного штаму, у якого метилмалоніл-КоА-специфічний АТ-домен модуля 10 PKS рапаміцину замінений малоніл-КоАспецифічним АТ-доменом (як описано більш детально вище), (б) додатково, видалення або інактивацію одного або більше з допоміжних генів рапаміцину, обраних з rapI, rapJ, rapK, rapL, rapM, rapN, rapO і rapQ, (в) повторну вставку всіх або частини допоміжних генів рапаміцину in-trans для комплементації або часткової комплементації делеції, (в) культивацію штаму, отриманого таким чином, за необхідності в присутності екзогенного попередника, якщо потрібно, для одержання аналога 17-десметилрапаміцину та (г) за необхідності виділення сполуки, отриманої в такий спосіб. У кращому втіленні на етапі (б) видаляють або інактивують всі допоміжні гени рапаміцину. У по 51 дальшому кращому втіленні рекомбінантний штам генетично комплементують одним або більше допоміжними генами, обраними із групи, що складається з rapI, rapJ, rapK, rapL, rapM, rapN, rapO і rapQ або їхніми гомологами. У конкретному втіленні штам комплементують всіма допоміжними генами. У подальшому кращому втіленні рекомбінантний штам генетично комплементують допоміжними генами рапаміцину rapK, rapM, rapN, rapO і rapL або їхніми гомологами. В альтернативному кращому втіленні рекомбінантний штам генетично комплементують допоміжними генами рапаміцину rapK, rapI, rapN, rapO і rapL або їхніми гомологами. Тому в конкретному аспекті за даним винаходом перестановка AT здійснюється в S. hygroscopicus MG2-10 (що розкрито в WO 04/007709 і Gregory et al., (2004)), де всі допоміжні гени були вилучені для одержання штаму, що має потребу в хімічній комплементації за допомогою екзогенних кислот для виробництва продукту рапаміцину. Наприклад, подання циклогексанкарбонової кислоти приводить до виробництва 17десметил-39-десгідроксипре-рапаміцину та подання вихідної кислоти 3, 4дигідроксициклогексанкарбонової кислоти призводить до виробництва 17-десметилпре-рапаміцину. У кращому втіленні штамом, отриманим шляхом перестановки AT в S. hygroscopicus MG2-10 є S. hygroscopicus MG7-9, що створюють, як описано в прикладі 1, шляхом введення ацил-трансферази модуля 2 рапаміцину в модуль 10 з метою заміни природної АТ10. Фахівець у даній галузі зрозуміє, що в S. hygroscopicus MG7-9 відсутня копія rapL і що описана хімічна комплементація не відноситься до додавання піпеколінової кислоти або альтернативної амінокислоти. Це той випадок, коли доповнення складеного середовища росту лізином служить для надання штаму піпеколінової кислоти (за допомогою процесу не розкритого, але виявленого шляхом спостереження виробництва аналогів прерапаміцину). Вирощування цього штаму (S. hygroscopicus MG7-9) призводить до спів-продукції аналогів 17-десметилпролілрапаміцину, спостережуваних у малих кількостях, і подібні спостереження зроблені для інших штамів, дефіцитних по RapL. Екзогенні природні та нові амінокислоти можна включати в молекулу рапаміцину дикого типу шляхом подання їх у середовище росту в безпосередній конкуренції з піпеколіновою кислотою. Фахівець у даній галузі зрозуміє, що подібним чином природні або неприродні амінокислоти можна подавати штамам з вилученим rapL, таким як, але не обмежуючись цим, S. hygroscopicus MG7-9 для того, щоб надати далі нові аналоги рапаміцину. За необхідності один або більше з вилучених допоміжних генів можна ввести в згадану клітинухазяїна під контролем підходящого промотору. У кращому втіленні один або більше з вилучених генів можна ввести в хромосомну ділянку приєднання фага Streptomyces phiBTl (Gregory et al., 2003). Фахівець у даній галузі зрозуміє, що комплементація in-trans не обмежується цією ділянкою приєднання фага, або, дійсно, застосуванням ділянки приєднання. Тому комплементацію вилу 95895 52 чених допоміжних генів також можна провести, не обмежуючись цим, шляхом вставки одного або більше допоміжних генів під контролем підходящого промотору в ділянку приєднання іншого фага, такого як ділянка приєднання фага Streptomyces рhіС31 наприклад, за допомогою застосування похідного pSET152 (Bierman et al., 1992). Таку інтеграцію можна подібним чином робити за допомогою інших доступних функцій інтеграції, включаючи але не обмежуючись цим: вектори, засновані на pSAM2 інтегразі (наприклад, в рРМ927 (Smovkina et al., 1990)), R4 інтегразі (наприклад, в рАТ98 (Matsuura et al., 1996)), VWB інтегразі (наприклад, в рKТ02 (Van Mellaert et al., 1998)), і L5 інтегразі (наприклад, Lee et al., 1991). Фахівець у даній галузі зрозуміє, що є багато фагів актиноміцетів, які, як можна чекати, містять функції інтеграції, які можна перенести у вектор доставки разом з підходящим промотором для одержання далі систем, які можна застосовувати для введення генів в S. hygroscopicus. Дійсно, ще багато фагів S. hygroscopicus ідентифіковано та з них можна одержувати функції інтеграції й застосовувати подібним чином. У міру опису більшого числа фагів, можна чекати, що з'явиться більше доступних інтеграз, які можна буде застосовувати подібним чином. У деяких випадках це може вимагати зміни штаму-хазяїна шляхом додавання специфічного attB ділянки для інтегрази, щоб здійснити високу ефективність інтеграції. Введення допоміжних генів під контролем підходящого промотору також можна провести, але не обмежуючись цим, шляхом гомологічної рекомбінації в нейтральне положення в хромосомі, гомологічної рекомбінації в ненейтральне положення в хромосомі (наприклад, для переривання обраного гена). Вектори, здатні до само-реплікації також можна застосовувати, наприклад але не обмежуючись цим, вектори, що містять Streptomyces початок реплікації з pSG5 (наприклад, pKC1139 Bierman et al., 1992), рІJ101 (наприклад, pIJ487, Kieser et al., 2000) і SCP2* (наприклад, pIJ698, Kieser et al., 2000). Більш, ніж одна з перерахованих вище систем може застосовуватися для генетичної модифікації рекомбінантного штаму з метою одержання аналога 17десметилрапаміцину. Фахівець у даній галузі зрозуміє, що можна також одержувати біосинтетичні шляхи, які будуть продукувати ті ж продукти, як у випадку видалення всіх допоміжних генів і комплементації in trans, шляхом інактивації або видалення кожного допоміжного гена по потребі. Експресія таких генів у згаданої клітини-хазяїна при поданні вільних кислот по потребі веде до продукції аналогів 17-десметилрапаміцину, у які включені природні або неприродні вихідні кислоти та/або в яких змінені рівні пост-полікетидної обробки. У подальшому втіленні змінений PKS рапаміцину можна експресувати у гетерологічній клітиніхазяїні, у якої від природи відсутні допоміжні гени рапаміцину (або їхні еквіваленти) разом з відбором згаданих допоміжних генів. У кращому втіленні хоча б rapK вилучений або, з іншого боку, RapK відсутній у штаму-хазяїна та різноманітні екзогенні карбонові кислоти можна подавати згаданому штаму-хазяїнові для одержання аналогів 17 53 десметилрапаміцину із включеними неприродними вихідними кислотами. У подальшому аспекті за винаходом, вищезгадані модифікації комбінують, тому даний винахід надає спосіб одержання аналога 17десметилрапаміцину, де згаданий спосіб включає: (а) створення рекомбінантного штаму, у якого метилмалоніл-КоА-специфічний АТ-домен модуля 10 PKS рапаміцину замінений малоніл-КоАспецифічним АТ-доменом, (б) додатково, видалення або інактивацію одного або більше з допоміжних генів рапаміцину, обраних з rapI, rapJ, rapK, rapL, rapM, rapN, rapO і rapQ, (в) за необхідності повторну вставку всіх або частини допоміжних генів in trans для комплементації або часткової комплементації делеції, (г) подання неприродних вихідних кислот згаданому рекомбінантному штаму в умовах підходящих для продукції полікетидів, та (д) за необхідності виділення сполуки, отриманої в такий спосіб. У кращому втіленні допоміжний ген(и), які вилучені або інактивовані, включають rapK. У кращому втіленні на етапі (б) видаляють або інактивують всі допоміжні гени рапаміцину. У конкретному аспекті даний винахід надає альтернативний спосіб одержання аналогів 17десметилрапаміцину з убудованими неприродними вихідними кислотами шляхом генетичної комплементації рекомбінантного штаму, у якого вилучені або інактивовані всі допоміжні гени рапаміцину, допоміжними генами рапаміцину rapI, rapJ, rapL, rapM, rapN, rapO і rapQ або їхніми гомологами, з одержанням штаму, що містить всі допоміжні гени крім rapK, і подання екзогенних вихідних кислот. У кращому втіленні екзогенною неприродною вихідною кислотою є циклогексанкарбонова кислота. В альтернативному кращому втіленні неприродною вихідною кислотою є 3метилциклогексанкарбонова кислота. В альтернативному кращому втіленні неприродною вихідною кислотою є циклогептанкарбонова кислота. В альтернативному кращому втіленні неприродні вихідні кислоти вибирають із групи, що складається з 3фтор-4-гідроксициклогексанкарбонової кислоти, 4фтор-3-гідроксициклогексанкарбонової кислоти, 3хлор-4-гідроксициклогексанкарбонової кислоти та 4-хлор-3-гідрокси циклогексанкарбонової кислоти. У подальшому аспекті даний винахід надає спосіб одержання аналогів 17десметилрапаміцину шляхом ферментації рекомбінантного штаму з комбінаціями активностей допоміжних генів і неприродних вихідних кислот. У кращому втіленні вилученими допоміжними генами є rapK, rapМ і rapQ, і неприродною вихідною кислотою, що подається цьому птаму, є циклогексанкарбонова кислота. В альтернативному кращому втіленні неприродною вихідною кислотою, що подається цьому штаму з вилученими генами rapK, rapМ і rapQ, є 3-метилциклогексанкарбонова кислота. В альтернативному кращому втіленні неприродною вихідною кислотою, що подається штаму з вилученими допоміжними генами rapK, rapМ і rapQ, є циклогептанкарбонова кислота. У 95895 54 кращому втіленні вилученими допоміжними генами є rapK, rapМ і rapQ, і неприродну вихідну кислоту, що подається цьому штаму, вибирають із групи, що складається з 3-фтор-4гідроксициклогексанкарбонової кислоти, 4-фтор-3гідроксициклогексанкарбонової кислоти, 3-хлор-4гідроксициклогексанкарбонової кислоти та 4-хлор3-гідрокси циклогексанкарбонової кислоти. У подальшому кращому втіленні вилученими допоміжними генами є rapK, rapI і rapQ, і неприродну вихідну кислоту, що подається цьому штаму, вибирають із групи, що складається з 3метилциклогексанкарбонової кислоти, циклогексанкарбонової кислоти, циклогептанкарбонової кислоти, 3-фтор-4-гідрокси циклогексанкарбонової кислоти, 4-фтор-3-гідроксициклогексанкарбонової кислоти, 3-хлор-4-гідроксициклогексанкарбонової кислоти та 4-хлор-3гідроксициклогексанкарбонової кислоти. У більш бажаному втіленні вилученими допоміжними генами є rapK, rapI і rapQ, і неприродною вихідною кислотою, що подається цьому штаму, є 3метилциклогексанкарбонова кислота. У більш бажаному втіленні вилученими допоміжними генами є rapK, rapI і rapQ, і неприродною вихідною кислотою, що подається цьому штаму, є циклогексанкарбонова кислота. В альтернативному кращому втіленні вилученими допоміжними генами є rapK і rapМ і неприродну вихідну кислоту, що подається цьому штаму, вибирають із групи, що складається з 3метилциклогексанкарбонової кислоти, циклогексанкарбонової кислоти, циклогептанкарбонової кислоти, 3-фтор-4-гідрокси циклогексанкарбонової кислоти, 4-фтор-3-гідроксициклогексан карбонової кислоти, 3-хлор-4-гідроксициклогексанкарбонової кислоти та 4-хлор-3гідроксициклогексанкарбонової кислоти. У найбільш бажаному втіленні неприродною вихідною кислотою, що подається цьому штаму, є циклогексанкарбонова кислота. У подальпому альтернативному кращому втіленні вилученими допоміжними генами є rapK, rapI і rapМ, і неприродну вихідну кислоту, що подається цьому штаму, вибирають із групи, що складається з 3-метилциклогексанкарбонової кислоти, циклогексанкарбонової кислоти, циклогелтанкарбонової кислоти, 3-фтор-4-гідроксициклогексанкарбонової кислоти, 4-фтор-3-гідроксициклогексанкарбонової кислоти, 3-хлор-4-гідроксициклогексанкарбонової кислоти та 4-хлор-3гідроксициклогексанкарбонової кислоти. У найбільш бажаному втіленні неприродною вихідною кислотою, що подається цьому штаму, є циклогексанкарбонова кислота. В альтернативному кращому втіленні вилученими допоміжними генами є rapK, rapI, rapJ і rapQ, і неприродну вихідну кислоту, що подається цьому штаму, вибирають із групи, що складається з 3метилциклогексанкарбонової кислоти, циклогексанкарбонової кислоти, циклогептанкарбонової кислоти, 3-фтор-4-гідроксициклогексанкарбонової кислоти, 4-фтор-3-гідроксициклогексанкарбонової кислоти, 3-хлор-4-гідроксициклогексанкарбонової кислоти та 4-хлор-3 55 гідроксициклогексанкарбонової кислоти. У найбільш бажаному втіленні неприродною вихідною кислотою, що подається цьому штаму, є циклогексанкарбонова кислота. В альтернативному кращому втіленні вилученими допоміжними генами є rapK, rapJ, rapM і rapQ, і неприродну вихідну кислоту, що подається цьому штаму, вибирають із групи, що складається з 3-метилциклогексанкарбонової кислоти, циклогексанкарбонової кислоти, циклогептанкарбонової кислоти, 3-фтор-4-гідроксициклогексанкарбонової кислоти, 4-фтор-3-гідроксициклогексанкарбонової кислоти, 3-хлор-4-гідроксициклогексанкарбонової кислоти та 4-хлор-3гідроксициклогексанкарбонової кислоти. У найбільш бажаному втіленні неприродною вихідною кислотою, що подається цьому штаму, є циклогексанкарбокова кислота. У подальшому аспекті даний винахід надає спосіб одержання аналогів 17десметилрапаміцину шляхом генетичної комплементації рекомбінантного штаму, у якого всі допоміжні гени рапаміцину були вилучені або інактивовані, одним або більше рапаміцин допоміжним геном, обраним з rapI, rapJ, rapK, rapL, rapM, rapN, rapO і rapQ, або їхніми гомологами, у комбінації з подачею природних або неприродних вихідних кислот. У кращому втіленні згаданий рекомбінантний штам генетично комплементують rapI, rapJ, rapN, rapO і rapL, і подають неприродну вихідну кислоту, обрану із групи, що складається із циклогексанкарбонової кислоти, 3метилциклогексанкарбонової кислоти, циклогептанкарбонової кислоти, 3-фтор-4гідроксициклогексанкарбонової кислоти, 4-фтор-3гідроксициклогексанкарбонової кислоти, 3-хлор-4гідроксициклогексанкарбонової кислоти та 4-хлор3-гідроксициклогексанкарбонової кислоти. У кращому втіленні згаданий рекомбінантний штам генетично комплементують rapJ, rapN, rapO і rapL і подають неприродну вихідну кислоту, обрану із групи, що складається із циклогексанкарбонової кислоти, 3-метилциклогексанкарбонової кислоти, циклогептанкарбонової кислоти, 3-фтор-4гідроксициклогексанкарбонової кислоти, 4-фтор-3гідроксициклогексанкарбонової кислоти, 3-хлор-4гідроксициклогексанкарбонової кислоти та 4-хлор3-гідроксициклогексанкарбонової кислоти. В альтернативному кращому втіленні згаданий рекомбінантний штам генетично комплементують rapJ, rapM, rapN, rapO і rapL і подають неприродну вихідну кислоту, обрану із групи, що складається з 3-метилциклогексанкарбонової кислоти, циклогексанкарбонової кислоти, циклогептанкарбонової кислоти, 3-фтор-4-гідроксициклогексанкарбонової кислоти, 4-фтор-3-гідроксициклогексанкарбонової кислоти, 3-хлор-4-гідроксициклогексанкарбонової кислоти та 4-хлор-3гідроксициклогексанкарбонової кислоти. У найбільш бажаному втіленні неприродною вихідною кислотою, що подається цьому штаму, є 3метилциклогексанкарбонова кислота. В альтернативному кращому втіленні згаданий рекомбінантний штам генетично комплементують rapI, rapJ, rapN, rapO, rapQ i rapL і подають вихідну 95895 56 кислоту, обрану із групи, що складається з 3метилциклогексанкарбонової кислоти, циклогексанкарбонової кислоти, циклогептанкарбонової кислоти, 3-фтор-4-гідроксициклогексанкарбонової кислоти, 4-фтор-3-гідроксициклогексанкарбонової кислоти, 3-хлор-4-гідроксициклогексанкарбонової кислоти та 4-хлор-3гідроксициклогексанкарбонової кислоти. У найбільше бажаному втіленні вихідною кислотою, що подається цьому штаму, є циклогексанкарбонова кислота. В альтернативному кращому втіленні згаданий рекомбінантний штам генетично комплементують rapJ, rapN, rapO, rapQ i rapL, і подають вихідну кислоту, обрану із групи, що складається з 3метилциклогексанкарбонової кислоти, циклогексанкарбонової кислоти, циклогептанкарбонової кислоти, 3-фтор-4-гідроксициклогексанкарбонової кислоти, 4-фтор-3-гідроксициклогексанкарбонової кислоти, 3-хлор-4-гідроксициклогексанкарбонової кислоти та 4-хлор-3гідроксициклогексанкарбонової кислоти. У найбільш бажаному втіленні вихідною кислотою, що подається цьому штаму, є циклогексанкарбонова кислота. В альтернативному кращому втіленні згаданий рекомбінантний штам генетично комплементують rapM, rapN, rapO і rapL і подають вихідну кислоту, обрану із групи, що складається з 3метилциклогексанкарбонової кислоти, циклогексанкарбонової кислоти, циклогептанкарбонової кислоти, 3-фтор-4-гідроксициклогексанкарбонової кислоти, 4-фтор-3-гідроксициклогексанкарбонової кислоти, 3-хлор-4-гідроксициклогексанкарбонової кислоти та 4-хлор-3гідроксициклогексанкарбонової кислоти. У найбільш бажаному втіленні вихідною кислотою, що подається цьому штаму, є циклогексанкарбонова кислота. В альтернативному кращому втіленні згаданий рекомбінантний штам генетично комплементують rapI, rapN, rapO і rapL і подають вихідну кислоту, обрану із групи, що складається з 3метилциклогексанкарбонової кислоти, циклогексанкарбонової кислоти, циклогептанкарбонової кислоти, 3-фтор-4-гідроксициклогексанкарбонової кислоти, 4-фтор-3-гідроксициклогексанкарбонової кислоти, 3-хлор-4-гідроксициклогексанкарбонової кислоти та 4-хлор-3гідроксициклогексанкарбонової кислоти. У найбільш бажаному втіленні вихідною кислотою, що подається цьому штаму, є циклогексанкарбонова кислота. У подальшому аспекті даний винахід надає спосіб одержання бібліотеки аналогів 17десметилрапаміцину, де згаданий спосіб включає: (а) створення рекомбінантного штаму, у якого метилмалоніл-КоА-специфічний АТ-домен модуля 10 PKS рапаміцину замінений малоніл-КоАспецифічним АТ-доменом, (б) за необхідності видалення або інактивацію одного або більше з допоміжних генів рапаміцину, обраних з rapI, rapJ, rapK, rapL, rapM, rapN, rapO і rapQ, 57 95895 (в) за необхідності повторну вставку всіх або частини допоміжних генів in trans для комплементації або часткової комплементації делеції, (г) подання ряду неприродних вихідних кислот згаданому рекомбінантному штаму для одержання ряду аналогів 17-десметилрапаміцину, (д) подання природних або нових амінокислот в умовах, що підходять для продукції полікетидів, (д) за необхідності виділення сполук, отриманих таким чином, і (e) за необхідності проведення напівсинтезу із застосуванням виділених аналогів рапаміцину. Даний винахід далі проілюстрований наступними прикладами, які жодним чином не розглядаються як обмежуючі область домагань винаходу. Приклади Матеріали Всі ферменти та реагенти для молекулярної біології отримані з комерційних джерел. Бактеріальні штами та умови росту Escherichia coli DH10B (GibcoBRL) вирощують у середовищі 2xTY як описано в Sambrook et al. (1989) і Ε. coli ET12567(pUZ8002) як описано в Paget et al. (1999) у середовищі 2xTY з канаміцином (25 мг/л). Вектор pUC18 отриманий від New England Biolabs. Вектор pKC1139 описаний в Practical Streptomyces Genetics, Kieser et al.r (2000). Трансформовані клітини Ε. coli відбирають у присутності 100 мг/л ампіциліну або 50 мг/л апраміцину. 58 S. hygroscopicus MG2-10 (WO 04/007709; Gregory et al., 2004) і його похідні підтримують на чашках з агаризованим середовищем 1 (див нижче) при 28°С і культивують в TSBGM (триптичний соєвий бульйон з 1,0% глюкозою та 100 мМ MES, рН 6,0), як описано в (Khaw et al.f 1998), доповненої 50 мг/л апраміцину, коли потрібно. Рідкі культури вирощують при 28°С у колбах Ерленмейєра або в пробірках Falcon на качалці при 300 об/хв. Способи подання екзогенних кислот: Запасні розчини спор для всіх штамів одержують після вирощування на середовищі 1, зберігають в 20% гліцерині (вага/об'єм):10% лактозі (вага/об'єм) у дистильованій воді та зберігають при 80°С. Вегетативні культури одержують шляхом інокуляції 0,1 мл замороженого запасного розчину спор в 50 мл середовища 2 (див. нижче) у колбі на 250 мл. Культуру інкубують від 36 до 48 годин при 28°С, 300 об/хв. Процедура подання екзогенних кислот: Вегетативні культури інокулюють по 0,5 мл в 7 мл середовища 3 у пробірках на 50 мл. Вирощування проводять протягом 7 днів, при 2б°С, 300 об/хв. Подання/додавання обраних карбонових кислот («неприродних вихідних кислот» або «природних вихідних кислот») проводять протягом 24 годин після інокуляції та подають по 1 мМ, якщо не оговорено інакше. Середовище 1 компонент Порошок зернового екстракту Дріжджовий екстракт Карбонат кальцію Сульфат заліза ВАСТО агар Пшеничний крохмаль Вода до Джерело Sigma Difco Sigma Sigma № за каталогом C-8160 0127-17 C5929 F8633 Sigma S2760 Середовище потім стерилізують автоклавуванням при 121°С, 20 хв Середовище 2. Посівне середовище RapV7 Компонент На л Соєве борошно (Nutrisoy) 5г Avedex W80 декстрин (Deymer Ingredients 35 г Ltd) Твердий зерновий екстракт (Corn Steep 4г Solids) (Sigma) Глюкоза 10 г (NH4)2SO4 2г Молочна кислота (80%) 1, 6 мл СаСО3 (Sigma) 7г Довести рН до 7,5 з 1 Μ NaOH Середовище потім стерилізують автоклавуванням при 121°С, 20 хв. Після стерилізації додають 0,16 мл 4% глюкози на кожні 7 мл середовища. На л 2,5 г 3г 3г 0,3 г 20 г 10 г 1л Середовище 3: Середовище MD6 (середовище ферментації) Компонент Соєве борошно (Nutrisoy) Кукурудзяний крохмаль (Sigma) Avedex W80 декстрин (Deymer Ingredients Ltd) Дріжджі (Allinson) Твердий зерновий екстракт (Sigma) KН2РО4 K2НРО4 (NH4)2SO4 NaCl СаСОз (Caltec) MnCL2 4H2O MgSO4 7H2O FeSO4 7H2O ZnSO4 7H2O MES ( морфоліноетан-сульфонова кислота моногідрат) рН доводять до 6,0 за допомогою 1 Μ NaOH На л 30 г 30 г 19 г 3г 1г 2,5 г 2,5 г 10 г 5г 10 г 10 мг 2, 5 мг 120 мг 50 мг 21,2 г 59 95895 Перед стерилізацією додають 0,4 мл амілази (Sigma, BAN250) на 1 л середовища. Середовище стерилізують протягом 20 хв при 121°С. Після стерилізації додають 0,35 мл стерильної 40% фруктози та 0,10 мл L-лізину (140 мг/мл у воді, стерилізовано фільтрацією) на кожні 7 мл. Середовище 4: Посівне середовище RapV7a Компонент На л Соєве борошно (Nutrisoy) 5г Avedex W80 декстрин (Deymer Ingredients 35 г Ltd) Твердий зерновий екстракт (Sigma) 4г (NH4)2SO4 2г Молочна кислота (80%) 1,6 мл СаСО3(Sigma) 7г Довести рН до 7,5 за допомогою 1 Μ NaOH. Середовище потім стерилізують автоклавуванням при 121°C, 20 хв. Середовище 5: MD6/5-1 середовище (середовище ферментації) Компонент Соєве борошно (Nutrisoy) Avedex W80 декстрин (Deymer Ingredients Ltd) Дріжджі (Allinson) Твердий зерновий екстракт (Sigma) KН2РО4 K2НРО4 (NH4)2SO4 NaCl CaCO3 (Caltec) MnCl2 4H2O MgSO4 7H2O FeSO4 7H2O ZnSO4 7H2O SAG 471 На л 15 г 50г 3г 1г 2,5 г 2,5 г 10 г 13 г 10 г 3, 5 мг 15 мг 150 мг 60 мг 0, 1 мл Середовище стерилізують протягом 30 хв при 121°C. Після стерилізації додають 15 г фруктози на л. In vitro біоаналіз протиракової активності Оцінка протиракової активності сполук in vitro на вибірці з 12 ліній пухлинних клітин людини в аналізі проліферації в моношарі проводять у підрозділі онкологічного тестування Інституту експериментальної онкології, Фрайбург (Oncotest Testing Facility, Institute for Experimental Oncology, Oncotest GmbH, Freiburg). Характеристики 12 відібраних ліній клітин підсумовані в таблиці 1. Таблиця 1 Лінії клітин для тестування № 1 2 3 Лінія клітин Характеристики SF-268 CNS, NCI стандарт GXF 251L Шлунок NCI-H460 Легені, NCI стандарт 60 4 5 6 7 8 9 MCF-7 Груди, NCI стандарт MEXF 394NL Меланома Яєчники - р8 5 мутація. АКТ OVCAR-3 ампліфікування. DU145 Простата - PTEN позитивні LNCAP Простата - PTEN негативні UXF 1138L Матка Ліни клітин uncotest відіорані із ксенотрансплантатів пухлин людини, як описано Roth et al. 1999. Походження донорних ксенотрансплантатів описане Fiebig et al. 1992. Інші клітинні лінії або отримані з NCI (H460, SF-268, OVCAR-3, DU145, MDA-MB-231, MDA-MB-468), або закуплені в DSMZ, Braunschweig, Germany (LNCAP). Всі клітинні лінії, якщо не відзначено особливо, вирощують при 37°С у зволоженій атмосфері (95% повітря, 5% СO2) у готовому середовищі ('readymix'), що містить середовище RPMI 1640, 10% сироватки плода корови та 0,1 мг/мл гентаміцину (РАА, Colbe, Germany). Аналіз моношару Модифікований аналіз із пропідій-йодидом застосовують для встановлення дії тестуємих сполук на ріст дванадцяти ліній пухлинних клітин людини (Dengler et al, 1995). Коротко, клітини збирають на експонентній фазі росту культур шляхом обробки трипсином, підраховують і розсіюють у мікротитровані планшети на 96 плоскодонних лунок при щільності клітин залежно від клітинної лінії (5-10000 життєздатних клітин/лунку). Через 24 години витримки, щоб дозволити клітинам досягти експонентного росту, 0,01 мл культурального середовища (6 контрольних лунок на планшет) або культурального середовища, що містить 39-десметоксирапаміцин, додають у лунки. Кожну концентрацію застосовують із потрійним повтором. 39-десметоксирапаміцин застосовують у двох концентраціях (0,001 мм і 0,01 мм). Після 4 днів безперервної інкубації клітинне культуральне середовище в присутності або під час відсутності 39-десметоксирапаміцину заміняють на 0,2 мл розчину водного пропідій йодиду (РІ) (7мг/мл). Для визначення частки живих клітин, клітини роблять проникними шляхом заморожування планшетів. Після відтавання планшетів, вимірюють флуоресценцію за допомогою флуориметра для мікропланшетів Cytofluor 4000 (порушення 530 нм, випущення 620 нм), одержуючи пряму пропорційність загальній кількості життєздатних клітин. Інгібування росту виражають у вигляді співвідношення оброблені/контрольні х100 (% Т/С) і надають для відбору клітинних ліній. Для активних сполук усереднені значення ІК50 (ІС50) і ІК70 за всім списком досліджених клітинних ліній оцінюють шляхом побудови графіків залежності концентрації сполуки від життєздатності клітин, що також надають. Приклад 1. Одержання генетично модифікованого штаму S. hygroscopicus MG7-9 І) Одержання плазміди pALK8 3 Праймери MG308 5'GTCCTAGGTGATGTCCCGGCAACACG-3' (SEQ ID NO:13) і MG309 5'
ДивитисяДодаткова інформація
Назва патенту англійською17-desmethylrapamycin analogues and methods for their roduction
Автори англійськоюGregory Matthew Alan, Martin Christine Janet
Назва патенту російськоюАналог 17-десметилрапамицина и способ его получения (варианты)
Автори російськоюГрегори Метью Алан, Мартин Кристин Джанет
МПК / Мітки
МПК: A61K 31/436, A61P 35/00, A61P 31/10, A61P 37/06, C07D 498/18
Мітки: варіанти, одержання, аналог, 17-десметилрапаміцину, спосіб
Код посилання
<a href="https://ua.patents.su/57-95895-analog-17-desmetilrapamicinu-ta-sposib-jjogo-oderzhannya-varianti.html" target="_blank" rel="follow" title="База патентів України">Аналог 17-десметилрапаміцину та спосіб його одержання (варіанти)</a>
Попередній патент: Спосіб одержання рідких вуглеводнів розщепленням вуглеводню ненафтового походження
Наступний патент: Спосіб і система маршрутизації для систем сільськогосподарських машин
Випадковий патент: Спосіб виготовлення порошкового електролюмінесцентного джерела світла