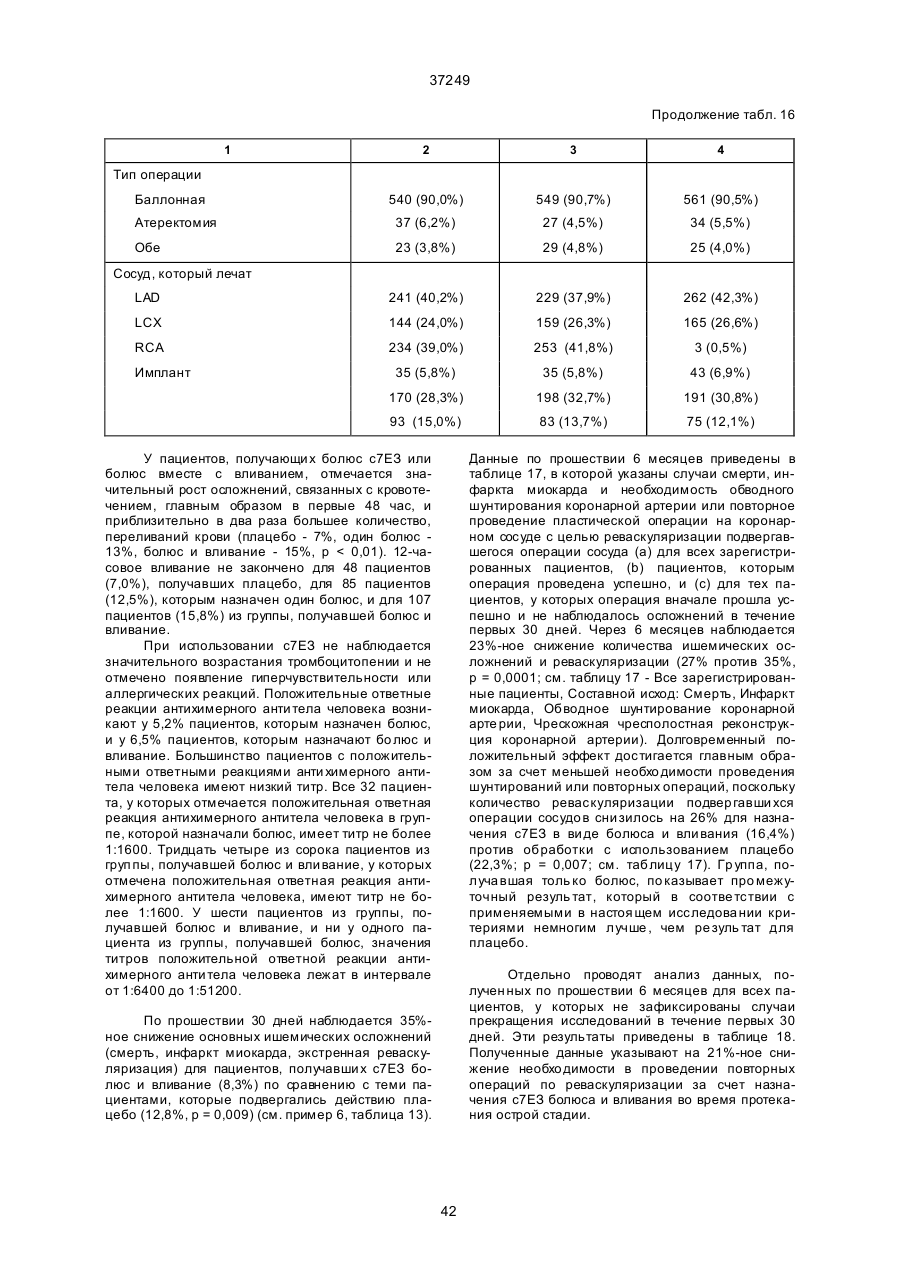
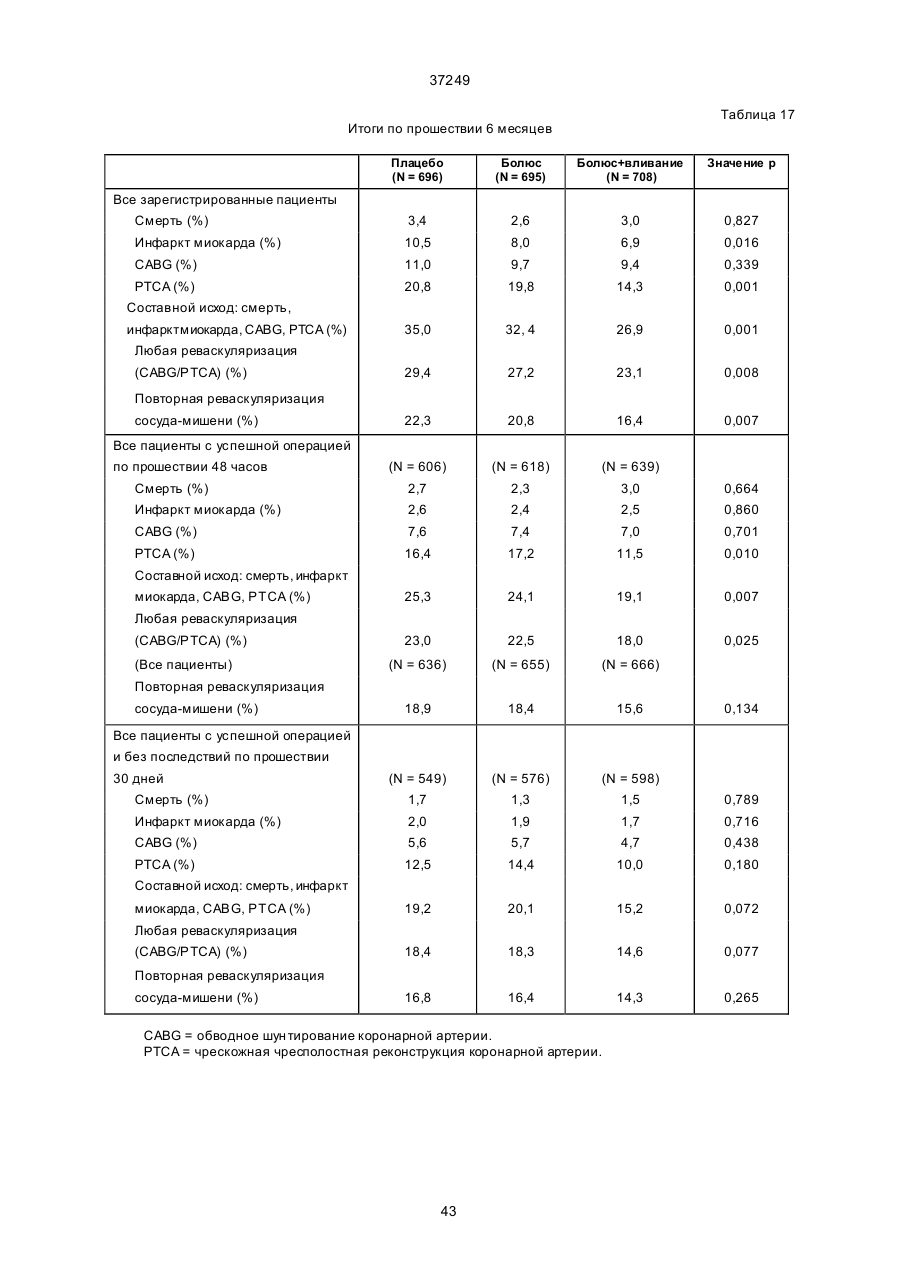
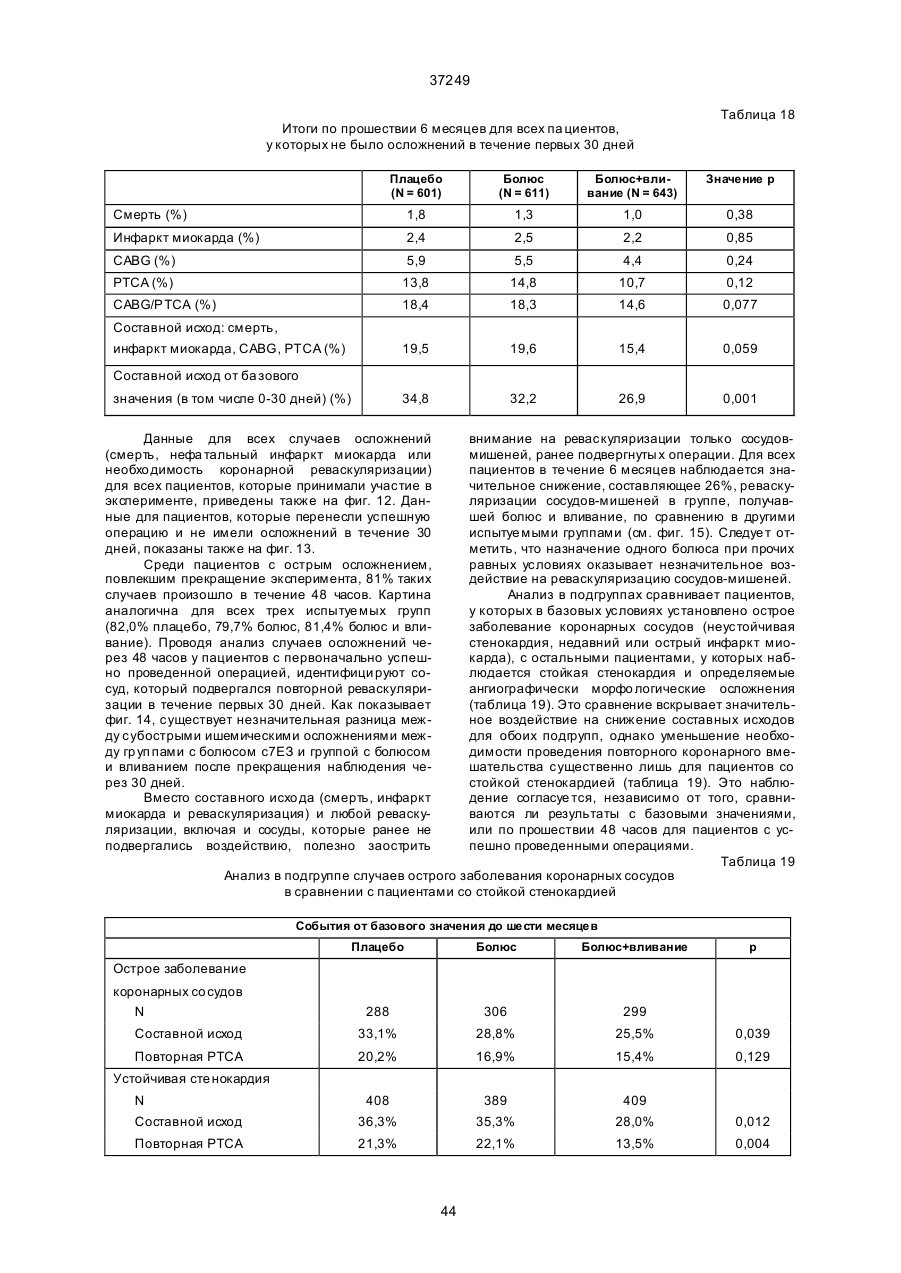
Спосіб інгібування стенозу та/або рестенозу (варіанти), спосіб інгібування рестенозу після проведення операції на коронарній артерії у людини (варіанти), спосіб зниження ймовірності виникнення чи запобігання не
Формула / Реферат
1. Способ ингибирования стеноза и/или рестеноза, заключающийся в назначении пациенту, страдающему от заболевания коронарных артерий, эффективного количества иммуноглобулина или фрагмента иммуноглобулина, обладающего специфичностью к тромбоцитам, причем указанный иммуноглобулин или фрагмент содержит область связывания антигена, не принадлежащую человеку и обладающую специфичностью к тромбоцитам, и константную область человека.
2. Способ по п. 1, отличающийся тем, что указанный иммуноглобулин или фрагмент иммуноглобулина ингибирует агрегацию тромбоцитов.
3. Способ по п. 1, отличающийся тем, что назначают Fab-фрагмент, Fab - фрагмент или F(ab')2 -фрагмент.
4. Способ по п. 1, отличающийся тем, что упомянутый иммуноглобулин или фрагмент иммуноглобулин а является химерным иммуноглобулином или фрагментом химерного иммуноглобулина.
5. Способ по п. 4, отличающийся тем, что назначают химерный Fab-фрагмент, химерный Fab' - фрагмент или химерный F(ab')2 - фрагмент.
6. Способ по п. 1, отличающийся тем, что упомянутая область связывания антигена, не принадлежащая человеку, обладает специфичностью к гликопротеину IIb.
7. Способ по п. 1, отличающийся тем, что упомянутая область связывания антигена, не принадлежащая человеку, обладает специфичностью к гликопротеину IIIa.
8. Способ по п. 1, отличающийся тем, что упомянутая область связывания антигена, не принадлежащая человеку, обладает специфичностью к протеину мембран гранул тромбоцита GMP-140.
9. Способ по п. 1, отличающийся тем, что упомянутая область связывания антигена, не принадлежащая человеку, обладает специфичностью к рецептору витронектина.
10. Способ ингибирования рестеноза после проведения операции на коронарной артерии у человека, заключающийся в назначении человеку эффективного количества иммуноглобулина или фрагмента иммуноглобулина, обладающего специфичностью к тромбоцитам, причем указанный иммуноглобулин или фрагмент содержит область связывания антигена, не принадлежащую человеку и специфичную к тромбоцитам, и константную область человека.
11. Способ по п. 10, отличающийся тем, что указанный иммуноглобулин или фрагмент иммуноглобулина ингибирует агрегацию тромбоцитов.
12. Способ по п. 10, отличающийся тем, что назначают Fab-фрагмент, Fab' - фрагмент или F (ab') 2 -фрагмент.
13. Способ по п. 10, отличающийся тем, что упомянутый иммуноглобулин или фрагмент иммуноглобулина является химерным иммуноглобулином или фрагментом химерного иммуноглобулина.
14. Способ по п. 13, отличающийся тем, что назначают химерный Fab-фрагмент, химерный Fab' - фрагмент или химерный F(ab')2 -фрагмент.
15. Способ по п. 10, отличающийся тем, что операция является пластической операцией на сосудах.
16. Способ по п. 15, отличающийся тем, что операция является чрезкожной чрезполостной пластической операцией на сосудах.
17. Способ по п. 10, отличающийся тем, что операция представляет собой размещение стента.
18. Способ по п. 10, отличающийся тем, что дополнительно включает введение пациенту тромболитического средства или антикоагулянта .
19. Способ по п. 10, отличающийся тем, что дополнительно включает введение пациенту антитромбоцитарного средства.
20. Способ по п. 10, отличающийся тем, что дополнительно включает введение пациенту гепарина.
21. Способ по п. 20, отличающийся тем, что гепарин вводят в количестве, зависящем от веса пациента.
22. Способ по п. 10, отличающийся тем, что упомянутая область связывания антигена, не принадлежащая человеку, обладает специфичностью к гликопротеину IIb.
23. Способ по п. 10, отличающийся тем, что упомянутая область связывания антигена, не принадлежащая человеку, обладает специфичностью к гликопротеину IIIa.
24. Способ по п. 10, отличающийся тем, что упомянутая область связывания антигена, не принадлежащая человеку, обладает специфичностью к протеину мембран гранул тромбоцита GMP-140.
25. Способ по п. 10, отличающийся тем, что упомянутая область связывания антигена, не принадлежащая человеку, обладает специфичностью к рецептору витронектина.
26. Способ снижения вероятности возникновения или предотвращения неострых ишемических осложнений при ангиопластике у человека, заключающийся в назначении человеку эффективного количества иммуноглобулина или фрагмента иммуноглобулина, обладающего специфичностью к тромбоцитам, причем указанный иммуноглобулин или фрагмент содержит область связывания антигена, не принадлежащую человеку и специфичную к тромбоцитам, и константную область человека.
27. Способ по п. 26, отличающийся тем, что указанный иммуноглобулин или фрагмент иммуноглобулина ингибирует агрегацию тромбоцитов.
28. Способ по п. 26, отличающийся тем, что назначают Fab-фрагмент, Fab' - фрагмент или F(ab')2 -фрагмент.
29. Способ по п. 26, отличающийся тем, что упомянутый иммуноглобулин или фрагмент иммуноглобулина является химерным иммуноглобулином или фрагментом химерного иммуноглобулина.
30. Способ по п. 29, отличающийся тем, что назначают химерный Fab-фрагмент, химерный Fab' - фрагмент или химерный F(ab')2 -фрагмент.
31. Способ по п. 26, отличающийся тем, что операция является чрезкожной чрезполостной пластической операцией на сосудах.
32. Способ по п. 26, отличающийся тем, что операция представляет собой размещение стента.
33. Способ по п. 26, отличающийся тем, что дополнительно включает введение пациенту тромболитического средства или антикоагулянта .
34. Способ по п. 26, отличающийся тем, что дополнительно включает введение пациенту антитромбоцитарного средства.
35. Способ по п. 26, отличающийся тем, что дополнительно включает введение пациенту гепарина.
36. Способ по п. 35, отличающийся тем, что гепарин вводят в количестве, зависящем от веса пациента.
37. Способ по п. 26, отличающийся тем, что упомянутая область связывания антигена, не принадлежащая человеку, обладает специфичностью к гликопротеину IIb.
38. Способ по п. 26, отличающийся тем, что упомянутая область связывания антигена, не принадлежащая человеку, обладает специфичностью к гликопротеину IlIa.
39. Способ по п. 26, отличающийся тем, что упомянутая область связывания антигена, не принадлежащая человеку, обладает специфичностью к протеину мембран гранул тромбоцита GMP-140.
40. Способ по п. 26, отличающийся тем, что упомянутая область связывания антигена, не принадлежащая, человеку, обладает специфичностью к рецептору витронектина.
41. Способ ингибирования стеноза и/или рестеноза, заключающийся в назначении пациенту, страдающему от заболевания коронарных артерий,эффективного количества Fab-фрагмента иммуноглобулина мышь-человек, содержащего область связывания антигена, принадлежащую мыши и обладающую специфичностью к тромбоцитам, и константную область человека.
42. Способ по п. 41, отличающийся тем, что указанный Fab-фрагмент иммуноглобулина ингибирует агрегацию тромбоцитов.
43. Способ по п. 41, отличающийся тем, что упомянутый Fab-фрагмент иммуноглобулина является химерным Fab-фрагментом.
44. Способ по п. 41, отличающийся тем, что упомянутая область связывания антигена, принадлежащая мыши, обладает специфичностью к гликопротеину IIb.
45. Способ по п. 41, отличающийся тем, что упомянутая область связывания антигена, принадлежащая мыши, обладает специфичностью к гликопротеину IlIa.
46. Способ по п. 41, отличающийся тем, что упомянутая область связывания антигена, принадлежащая мыши, обладает специфичностью к протеину мембран гранул тромбоцита GMP-140.
47. Способ по п. 41, отличающийся тем, что упомянутая область связывания антигена, принадлежащая мыши, обладает специфичностью к рецептору витронектина.
48. Способ по п. 41, отличающийся тем, что дополнительно включает введение пациенту тромболитического средства или антикоагулянта.
49. Способ по п. 41, отличающийся тем, что дополнительно включает введение пациенту антитромбоцитарного средства.
50. Способ по п. 41, отличающийся тем, что дополнительно включает введение пациенту гепарина.
51. Способ по п. 50, отличающийся тем, что гепарин вводят в количестве, зависящем от веса пациента.
52. Способ ингибирования стеноза и/или рестеноза, заключающийся в назначений пациенту, страдающему от заболевания коронарных артерий, эффективного количества химерного иммуноглобулина или химерного фрагмента иммуноглобулина, обладающего специфичностью к гликопротеину ІІЬ/ІІІа, причем указанный иммуно глобулин или фрагмент содержит область связывания антигена, не принадлежащую человеку и специфичную к гликопротеину ІІЬ/ІІІа, и константную область иммуноглобулина человека
53. Способ по п. 52, отличающийся тем, что указанный иммуноглобулин или фрагмент иммуноглобулина ингибирует агрегацию тромбоцитов.
54. Способ по п. 53, отличающийся тем, что область связывания антигена получают от моноклонального антитела 7ЕЗ.
55. Способ по п. 52, отличающийся тем, что фрагментом иммуноглобулина является фрагмент Fab, Fab' или F(аb')2.
56. Способ ингибирования стеноза и/или рестеноза, заключающийся в назначении пациенту, страдающему от заболевания коронарных артерий, эффективного количества соединения, которое селективно связывается с гликопротеином ІІЬ/ІІІа.
57. Способ по п. 56, отличающийся тем, что соединение представляет собой химерный иммуноглобулин или фрагмент химерного иммуноглобулина, обладающий специфичностью к гликопротеину ІІЬ/ІІІа.
58. Способ по п. 57, отличающийся тем, что указанный иммуноглобулин или фрагмент иммуноглобулина ингибирует агрегацию тромбоцитов.
59. Способ ингибирования стеноза и/или рестеноза после проведения операции на коронарной артерии у человека, заключающийся в назначении человеку эффективного количества химерного иммуноглобулина или химерного фрагмента иммуноглобулина, обладающего специфичностью к гликопротеину ІІЬ/ІІІа, причем указанный иммуноглобулин или фрагмент содержит область связывания антигена, не принадлежащую человеку и специфичную к гликопротеину ІІЬ/ІІІа, и константную область иммуноглобулина человека.
60. Способ по п. 59, отличающийся тем, что операция представляет собой пластическую операцию на сосуде.
61. Способ по п. 60, отличающийся тем, что указанный иммуноглобулин или фрагмент иммуноглобулина ингибирует агрегацию тромбоцитов.
62. Способ по п. 61, отличающийся тем, что область связывания антигена получают от моноклонального антитела 7ЕЗ.
63. Способ по п. 62, отличающийся тем, что фрагмент иммуноглобулина выбирают из группы, включающей фрагменты Fab, Fab' или F(ab ' )2 .
64. Способ ингибирования стеноза и/или рестеноза после проведения операции на коронарной артерии у человека, заключающийся в назначении указанному человеку эффективного количества соединения, которое селективне связывается с GРПЬ/ІІІа.
65. Способ по п. 64, отличающийся тем, что соединение представляет собой химерный иммуноглобулин или фрагмент химерного иммуноглобулина, обладающий специфичностью к гликопротеину ІІЬ/ІІІа.
66. Способ по п. 65, отличающийся тем, что указанный химерный иммуноглобулин или фрагмент химерного иммуноглобулина ингибирует агрегацию тромбоцитов.
67. Способ снижения вероятности возникновения или предотвращения неострых ишемических осложнений при ангиопластике у человека, заключающийся в назначении человеку эффективного количества химерного иммуноглобулина или химерного фрагмента иммуноглобулина, обладающего специфичностью к гликопротеину ІІЬ/ІІІа, причем указанный иммуноглобулин или фрагмент содержит область связывания антигена, не принадлежащую человеку, специфичную к гликопротеину ІІЬ/ІІІа, и константную область иммуноглобулина человека.
68. Способ снижения вероятности возникновения или предотвращения неострых ишемических осложнений при проведении пластических операций на сосудах у человека, заключающийся в назначении указанному человеку эффективного количества соединения, которое селективно связывается с гликопротеином ІІЬ/ІІІа.
69. Способ по п. 68, отличающийся тем, что соединение представляет собой иммуно глобулин или фрагмент иммуноглобулина, обладающий специфичностью к гликопротеину ІІЬ/ІІІа.
70. Способ по п. 69, отличающийся тем, что указанный иммуноглобулин или фрагмент иммуноглобулина ингибирует агрегацию тромбоцитов.
71. Способ по п. 59, отличающийся тем, что операция представляет собой размещение стента.
72. Способ по п. 64, отличающийся тем, что операция представляет собой размещение стента.
73. Способ по п. 64, отличающийся тем, что указанное соединение селективно связывается с гликопротеином ІІЬ/ІІІа и рецептором витронектина.
74. Способ по п. 73, отличающийся тем, что операция является ангиопластикой.
75. Способ по п. 73, отличающийся тем, что операция представляет собой размещение стента.
76. Способ по п. 73, отличающийся тем, что соединение представляет собой химерный иммуноглобулин или фрагмент химерного иммуноглобулина, обладающий специфичностью к гликопротеину ІІЬ/ІІІа и рецептору витронектина, включающий в себя область связывания антигена, не принадлежащую человеку, и, по меньшей мере, часть константной области иммуноглобулина человека.
77. Способ по п. 76, отличающийся тем, что область связывания антигена получают от моноклонального антитела 7ЕЗ.
78. Способ по п. 76, отличающийся тем, что фрагмент химерного иммуноглобулина выбирают из группы, включающей фрагменты Fab, Fab' или F(ab')2.
79. Способ ингибирования стеноза и/или рестеноза, заключающийся в назначении пациенту, страдающему от заболевания коронарных артерий, эффективного количества Fab-фрагмента химерного иммуноглобулина мышь-человек, содержащего вариабельные области мышиной тяжелой и легкой цепей моноклонального антитела 7ЕЗ.
80. Способ по п. 79, отличающийся тем, что пациенту назначают гепарин.
81. Способ по п. 80, отличающийся тем, что гепарин назначают в количестве, зависящем от веса пациента.
82. Способ ингибирования стеноза и/или рестеноза после проведення операции на коронарной артерий у человека, включающий в себя назначение человеку эффективного количества Fab-фрагмента химерного иммуноглобулина мышь-человек, содержащего вариабельные области мышиной тяжелой и легкой цепей моноклонального антитела 7ЕЗ.
83. Способ по п. 82, отличающийся тем, что пациенту дополнительно назначают гепарин.
84. Способ по п. 83, отличающийся тем, что гепарин назначают в количестве, зависящем от веса пациента.
Текст
1. Способ инги бирования стеноза и/или рестеноза, заключающий ся в назначении пациенту, страдающему от за болевания коронарных артерий, эффективного количества иммуноглобулина или фрагмента иммуноглобули на, обладающего специфичностью к тромбоцитам, причем указанный иммуноглобулин или фрагмент содержит область связывания антигена, не принадлежащую че ловеку и обладающую специфичностью к тромбоцитам, и константную область человека. 2. Способ по п. 1, отличающийся тем, что указанный иммуноглобулин или фрагмент иммуноглобули на ингибирует агрегацию тромбоцитов. 3. Способ по п. 1, отличающийся тем, что назначают Fab-фрагмент, Fab' - фрагмент или F(ab')2 фрагмент. 4. Способ по п. 1, отличающийся тем, что упомянутый иммуноглобулин или фрагмент иммуноглобули на является химерным иммуног-лобули ном или фрагментом химерного иммуноглобули на. 5. Способ по п. 4, отличающийся тем, что назначают хи мерный Fab-фрагмент, химерный Fab' фрагмент или химерный F (аb' )2 -фрагмент. 6. Способ по п. 1, отличающийся тем, что упомянутая область связывания антигена, не принадлежащая человеку, обладает специфичностью к гликопротеину IIb. 7. Способ по п. 1, отличающийся тем, что упомянутая область связывания антигена, не принадлежащая человеку, обладает специфичностью к гликопротеину IIIa. 8. Способ по п. 1, отличающийся тем, что упомянутая область связывания антигена, не принадлежащая человеку, обладает специфичностью к протеину мембран гранул тромбоцита GMP-140. 9. Способ по п. 1, отличающийся тем, что упомянутая область связывания антигена, не принадлежащая человеку, обладает специфичностью к рецептору витронектина. 10. Способ ингибирования ресте ноза после проведения операции на коронарной артерии у человека, заключающий ся в назначении человеку эффективного количества иммуноглобулина или фрагмента иммуноглобули на, обладающего специфичностью к тромбоцитам, причем указанный иммуноглобулин или фрагмент содержит область связывания антигена, не принадлежащую че ловеку и специфичную к тромбоцитам, и константную область человека. 11. Способ по п. 10, отличающийся тем, что указанный иммуноглобулин или фрагмент иммуноглобули на ингибирует агрегацию тромбоцитов. 12. Способ по п. 10, отличающийся тем, что назначают Fab-фрагмент, Fab' - фрагмент или F(ab')2 фрагмент. 13. Способ по п. 10, отличающийся тем, что упомянутый иммуноглобулин или фрагмент иммуноглобулина является химерным иммуноглобулином или фрагментом химерного иммуноглобулина. 14. Способ по п. 13, отличающийся тем, что назначают химерный Fab-фрагмент, химерный Fab' фрагмент или химерный F(ab')2 -фрагмент. 15. Способ по п. 10, отличающийся тем, что операция является пласти ческой операцией на сосуда х. 16. Способ по п. 15, отличающийся тем, что операция является чрезкожной чрезполостной пластической операцией на сосуда х. 17. Способ по п. 10, отличающийся тем, что операция представляет собой размещение стента. 18. Способ по п. 10, отличающийся тем, что дополнительно включает введение пациенту тромболитического средства или антикоагулянта. (19) (21) 96062229 (22) 07.11.1994 (24) 15.05.2001 (31) 08/147928 (32) 05.11.1993 (33) US (86) PCT/US94/12779, 07.11.1994 (46) 15.05.2001, Бюл. № 4, 2001 р. (72) Коллер Баррі С. (US), Найт Девід М. (US) (73) СЕНТОКОР ІНК. (US), РІСЕРЧ ФАУНДЕЙШН ОФ СТЕЙТ ЮНІВЕРСІТІ ОФ НЬЮ ЙОРК (US) (56) 1. WO 89/11538 A1, 30.11.1989. 2. WO 90/11783 A1, 18.10.1990. 3. BHATTA CHAR YA S. et al. Chimeric humanized monoclonal antiplatelet antibody JE3 produces prolonged dose-dependent inhibition of platelet function, European Heart journal, 1991, v. 12, no. SUP, LONDON, GB, p. 26. C2 (54) СПОСІБ ІНГІБУВАННЯ СТЕНОЗУ ТА/АБО РЕСТЕНОЗУ (ВАРІАНТИ), СПОСІБ ІНГІБУВАННЯ РЕСТЕНОЗУ ПІСЛЯ ПРОВЕДЕННЯ ОП ЕРАЦІЇ НА КОРОНАРНІЙ АРТЕРІЇ У ЛЮД ИНИ (ВАРІАНТИ), СПОСІБ ЗНИЖЕННЯ ЙМОВІРНОСТІ ВИНИКНЕННЯ ЧИ ЗАПОБІГАННЯ НЕГОСТРИХ ІШЕМІЧНИХ УСКЛАДНЕНЬ ПРИ АНГІОПЛАСТИЦІ У ЛЮД ЕЙ 37249 19. Способ по п. 10, отличающийся тем, что дополнительно включает введение пациенту антитромбоцитарного средства. 20. Способ по п. 10, отличающийся тем, что дополнительно включает введение пациенту гепарина. 21. Способ по п. 20, отличающийся тем, что гепарин вводят в количестве, зависящем от веса пациента. 22. Способ по п. 10, отличающийся тем, что упомянутая область связывания антигена, не принадлежащая человеку, обладает специфичностью к гликопротеину IIb. 23. Способ по п. 10, отличающийся тем, что упомянутая область связывания антигена, не принадлежащая человеку, обладает специфичностью к гликопротеину IІІa. 24. Способ по п. 10, отличающийся тем, что упомянутая область связывания антигена, не принадлежащая человеку, обладает специфичностью к протеину мембран гранул тромбоцита GMP-140. 25. Способ по п. 10, отличающийся тем, что упомянутая область связывания антигена, не принадлежащая человеку, обладает специфичностью к рецептору витронектина. 26. Способ снижения вероятности возникновения или предотвращения неострых ишемических осложнений при ангиопластике у человека, заключающийся в назначении человеку эффективного количества иммуноглобули на или фрагмента иммуноглобулина, обладающего специфичностью к тромбоцитам, причем указанный иммуноглобулин или фрагмент содержит область связывания антигена, не принадлежащую человеку и специфичную к тромбоцитам, и константную область человека. 27. Способ по п. 26, отличающийся тем, что указанный иммуноглобулин или фрагмент иммуноглобули на ингибирует агрегацию тромбоцитов. 28. Способ по п. 26, отличающийся тем, что назначают Fab-фрагмент, Fab' - фрагмент или F(ab')2фрагмент. 29. Способ по п. 26, отличающийся тем, что упомянутый иммуноглобулин или фрагмент иммуноглобули на является хи мерным иммуноглобулином или фрагментом хи мерного иммуноглобулина. 30. Способ по п. 29, отличающийся тем, что назначают химерный Fab-фрагмент, химерный Fab' фрагмент или химерный F(ab')2-фрагмент. 31. Способ по п. 26, отличающийся тем, что операция является чрезкожной чрезполостной пластической операцией на сосуда х. 32. Способ по п. 26, отличающийся тем, что операция представляет собой размещение стента. 33. Способ по п. 26, отличающийся тем, что дополнительно включает введение пациенту тромболитического средства или антикоагулянта. 34. Способ по п. 26, отличающийся тем, что дополнительно включает введение пациенту антитромбоцитарного средства. 35. Способ по п. 26, отличающийся тем, что дополнительно включает введение пациенту ге парина. 36. Способ по п. 35, отличающийся тем, что гепарин вводят в количестве, зависящем от веса пациента. 37. Способ по п. 26, отличающийся тем, что упомянутая область связывания антигена, не при надлежащая человеку, обладает специфичностью к гликопротеину IIb. 38. Способ по п. 26, отличающийся тем, что упомянутая область связывания антигена, не принадлежащая человеку, обладает специфичностью к гликопротеину IІІa. 39. Способ по п. 26, отличающийся тем, что упомянутая область связывания антигена, не принадлежащая человеку, обладает специфичностью к протеину мембран гранул тромбоцита GMP-140. 40. Способ по п. 26, отличающийся тем, что упомянутая область связывания антигена, не принадлежащая человеку, обладает специфичностью к рецептору витронектина. 41. Способ ингибирования стеноза и/или рестеноза, заключающий ся в назначении пациенту, страдающему от за болевания коронарных артерий, эффективного количества Fab-фрагмента иммуноглобули на мышь-человек, содержащего область связывания антигена, принадлежащую мыши и обладающую спе цифичностью к тромбоцитам, и константную область человека. 42. Способ по п. 41, отличающийся тем, что указанный Fab-фрагмент иммуноглобули на ингибирует агрегацию тромбоцитов. 43. Способ по п. 41, отличающийся тем, что упомянутый Fab-фрагмент иммуноглобулина является химерным Fab-фрагментом. 44. Способ по п. 41, отличающийся тем, что упомянутая область связывания антигена, принадлежащая мыши, обладает специфичностью к гликопротеину IIb. 45. Способ по п. 41, отличающийся тем, что упомянутая область связывания антигена, принадлежащая мыши, обладает специфичностью к гликопротеину IІІa. 46. Способ по п. 41, отличающийся тем, что упомянутая область связывания антигена, принадлежащая мыши, обладает специфичностью к протеину мембран гранул тромбоцита GMP-140. 47. Способ по п. 41, отличающийся тем, что упомянутая область связывания антигена, принадлежащая мыши, обладает специфичностью к рецептору витронектина. 48. Способ по п. 41, отличающийся тем, что дополнительно включает введение пациенту тромболитического средства или антикоагулянта. 49. Способ по п. 41, отличающийся тем, что дополнительно включает введение пациенту антитромбоцитарного средства. 50. Способ по п. 41, отличающийся тем, что дополнительно включает введение пациенту ге парина. 51. Способ по п. 50, отличающийся тем, что гепарин вводят в количестве, зависящем от веса пациента. 52. Способ ингибирования стеноза и/или рестеноза, заключающий ся в назначений пациенту, страдающему от за болевания коронарных артерий, эффективного количества химерного иммуноглобули на или химерного фрагмента иммуноглобулина, обладающего специфичностью к гликопротеину ІІb/ІІІа, причем указанный иммуноглобулин или фрагмент содержит область связывания антигена, не принадлежащую че ловеку и специфичную к гликопротеину ІІb/ІІІа, и константную область иммуноглобулина человека. 2 37249 53. Способ по п. 52, отличающийся тем, что указанный иммуноглобулин или фрагмент иммуноглобули на ингибирует агрегацию тромбоцитов. 54. Способ по п. 53, отличающийся тем, что область связывания антигена получают от моноклонального антитела 7ЕЗ. 55. Способ по п. 52, отличающийся тем, что фрагментом иммуноглобули на является фрагмент Fab, Fab' или F(аb')2. 56. Способ ингибирования стеноза и/или рестеноза, заключающий ся в назначении пациенту, страдающему от за болевания коронарных артерий, эффективного количества соединения, которое селективно связывается с гликопротеином IIb/IIIa. 57. Способ по п. 56, отличающийся тем, что соединение представляет собой химерный иммуноглобулин или фрагмент химерного иммуноглобулина, обладающий специфичностью к гликопротеину ІІb/ІІІа. 58. Способ по п. 57, отличающийся тем, что указанный иммуноглобулин или. фрагмент иммуноглобули на ингибирует агрегацию тромбоцитов. 59. Способ ингибирования стеноза и/или рестеноза после проведения операции на коронарной арте рии у человека, заключающийся в назначении человеку эффективного количества хи мерного иммуноглобулина или химерного фрагмента иммуноглобули на, обладающего специфичностью к гликопротеину IIb/IIIa, причем указанный иммуноглобулин или фрагмент содержит область связывания антигена, не принадлежащую че ловеку и специфичную к гликопротеину IIb/IIIa, и константную область иммуноглобули на человека. 60. Способ по п. 59, отличающийся тем, что операция представляет собой пластическую операцию на сосуде. 61. Способ по п. 60, отличающийся тем, что указанный иммуноглобулин или фрагмент иммуноглобули на ингибирует агрегацию тромбоцитов. 62. Способ по п. 61, отличающийся тем, что область связывания антигена получают от моноклонального антитела 7ЕЗ. 63. Способ по п. 62, отличающийся тем, что фрагмент иммуноглобулина выбирают из группы, включающей фрагменты Fab, Fab' или F(ab')2. 64. Способ ингибирования стеноза и/или рестеноза после проведения операции на коронарной арте рии у человека, заключающийся в назначении указанному че ловеку эффективного количества соединения, которое селентивно связывается с GРПb/IIIа. 65. Способ по п. 64, отличающийся тем, что соединение представляет собой химерный иммуноглобулин или фрагмент химерного иммуноглобулина, обладающий специфичностью к гликопротеину IIb/IIIa. 66. Способ по п. 65, отличающийся тем, что указанный химерный иммуноглобулин или фрагмент химерного иммуноглобули на ингибирует агрегацию тромбоцитов. 67. Способ снижения вероятности возникновения или предотвращения неострых ишемических осложнений при ангиопластике у человека, заключающийся в назначении человеку эффективного количества хи мерного иммуноглобули на или химерного фрагмента иммуноглобулина, обладающего специфичностью к гликопротеину IIb/IIIa, при чем указанный иммуноглобулин или фрагмент содержит область связывания антигена, не принадлежащую человеку, специфичную к гликопротеину IIb/IIIa, и константную область иммуноглобулина человека. 68. Способ снижения вероятности возникновения или предотвращения неострых ишемических осложнений при проведении пластических операций на сосуда х у че ловека, заключающий ся в назначении указанному человеку эффективного количества соединения, которое селективно связывается с гли копротеином IIb/IIIa. 69. Способ по п. 68, отличающийся тем, что соединение представляет собой иммуноглобулин или фрагмент иммуноглобули на, обладающий специфичностью к гликопротеину IIb/IIIa. 70. Способ по п. 69, отличающийся тем, что указанный иммуноглобулин или фрагмент иммуноглобули на ингибирует агрегацию тромбоцитов. 71. Способ по п. 59, отличающийся тем, что операция представляет собой размещение стента. 72. Способ по п. 64, отличающийся тем, что операция представляет собой размещение стента. 73. Способ по п. 64, отличающийся тем, что указанное соединение селективно связывается с гликопротеином IIb/IIIa и рецептором витронектина. 74. Способ по п. 73, отличающийся тем, что операция является ангиопластикой. 75. Способ по п. 73, отличающийся тем, что операция представляет собой размещение стента. 76. Способ по п. 73, отличающийся тем, что соединение представляет собой химерный иммуноглобулин или фрагмент химерного иммуноглобулина, обладающий специфичностью к гликопротеину IIb/IIIa и рецептору витронектина, включающий в себя область связывания антигена, не принадлежащую че ловеку, и, по меньшей мере, часть константной области иммуноглобули на человека. 77. Способ по п. 76, отличающийся тем, что область связывания антигена получают от моноклонального антитела 7ЕЗ. 78. Способ по п. 76, отличающийся тем, что фрагмент химерного иммуноглобули на выбирают из группы, включающей фрагменты Fab, Fab' или F(ab')2. 79. Способ ингибирования стеноза и/или рестеноза, заключающий ся в назначении пациенту, страдающему от за болевания коронарных артерий, эффективного количества Fab-фрагмента хи мерного иммуноглобулина мышь-человек, содержащего ва риабельные области мышиной тяжелой и легкой цепей моноклонального антитела 7ЕЗ. 80. Способ по п. 79, отличающийся тем, что пациенту назначают ге парин. 81. Способ по п. 80, отличающийся тем, что гепарин назначают в количестве, зависящем от веса пациента. 82. Способ ингибирования стеноза и/или рестеноза после проведения операции на коронарной арте рии у человека, включающий с себя назначение человеку эффективного количества Fаb-фрагмента хи мерного иммуноглобули на мышь-человек, содержащего ва риабельные области мышиной тяжелой и легкой цепей моноклонального анти тела 7ЕЗ. 3 37249 83. Способ по п. 82, отличающийся тем, что пациенту дополнительно назначают ге парин. 84. Способ по п. 83, отличающийся тем, что гепарин назначают в количестве, зависящем от веса пациента. ____________________ Изобретение относится к медицине, более конкретно - к способам ингибирования стеноза и ресте ноза и снижения вероятности возникновения или предотвращения неострых ишемических осложнений при проведении пластических операций у человека. Агрегация тромбоцитов играет важную роль при образовании сгустков крови. При обычных обстоятельствах сгустки крови служат для предотвращения потери крови из сосудистой системы. Однако при определенных болезненных состояниях сгустки крови могут создавать препятствия потоку крови и полностью его перекрывать, что приводит к некрозу клеток. Например, агрегация тромбоцитов и последующий тромбоз в месте атеросклеротической бляшки является важным причинным фактором в генезисе таких состояний, как стенокардия, острый инфаркт миокарда и повторная закупорка после успешно проведенного тромболиза и пластической операции на сосуда х. Пациентов, подверженных сте нокардии, обычно лечат с использованием тромболитических средств, таких как тканевый активатор плазминогена или стрептокиназа, которые растворяют фибриновый компонент сгустков. Основным осложнением, связанным с фибринолизом, является повторная закупорка вследствие агрегации тромбоцитов, которая приводит к дальнейшему поражению сердца. Поскольку, как известно, рецепто ры гликопротеина (GP)IIb/IIIa отвечают за агрегацию тромбоцитов, то можно ожидать, что реагенты, которые блокируют указанные рецепторы, будут снижать или препятствовать повторной закупорке после применения тромболитической терапии и увеличивать скорость тромболиза. Можно ожидать, что подобные реагенты будут полезны при терапии других заболеваний, связанных с закупоркой сосудов, и терапии тромбоэмболических заболеваний. В одном из подходов к блокированию агрегации тромбоцитов используют моноклональные анти тела, специфичные для рецепторов GPIIb/IIIa. Муриновые моноклональные антитела, которые приводятся в Европейских патентных заявках с номерами 205207 и 206532, обозначенные как 7ЕЗ, подавляют агрегацию тромбоцитов и, вероятно, полезны при лечении тромботических заболеваний человека. Из области техники известно, что муриновые анти тела обладают свойствами, которые могут в значительной степени ограничить их использование в терапии человека. Являясь инородными белками, муриновые антитела способны вызывать иммунные реакции, которые снижают или нивелируют их терапевти ческую эффективность и/или приводят к возникновению аллергических ответных реакций или повышенной чувствительности у пациентов. Потребность в повторном назначении этих лечебных процедур при тромбоэмболических заболеваниях повышает ве роятность возникновения иммунных реакций указанного ти па. Хи мерные антитела со связывающими областями, не принадлежащими человеку, которые соединены с константными областями, принадлежащими человеку, предложены в качестве средств, позволяющих обойти проблемы, вызываемые иммуноактивностью муриновых антител (См. Proc, Natl. Acad. Sci. USA, 81: 6851 (1984) и Международную заявку No. PCT/GB85 00392). Поскольку константная область в значительной степени ответственна за иммуноактивность молекулы антитела, то хи мерные антитела с константными областями человеческого происхождения должны в меньшей сте пени вызывать антимуриновую ответную реакцию у людей. Однако заранее нельзя определить, приведет ли присоединение константной области человека к муриновой связывающей области, обладающей требуемой специфичностью, к снижению иммуноактивности и/или изменению связывающей способности получен ного хи мерного антитела. Настоящее изобретение относится к тромбоцит-специфичным химерным иммуноглобулинам, содержащим вариабельную область или область связывания антигена, не принадлежащую человеку, и константную область, принадлежащую человеку. Хи мерные иммуноглобули ны могут быть специфичными для рецептора GPIIb/IIIa или других компонентов тромбоцита. Указанные анти тела связываются с тромбоцитами и могут блокировать агрегацию тромбоцитов и, таким образом, полезны в качестве антитромботических средств для предотвращения или уменьше ния вероятности закупорки или повторной закупорки сосудов в различных клинических ситуациях (в частности, после тромболитической терапии, которая проводится одновременно с проведением пластической операции на сосуда х) или для предотвращения стеноза или повторного стеноза. Антитромбоцитарные антитела по настоящему изобретению полезны также при получе нии изображения тромба. На фиг. 1 приведен результат анализа по методу назерн-блоттинга тяжелой цепи и легкой цепи мРНК для моноклонального антитела 7ЕЗ с использованием в качестве зондов клонированных вариабельных областей. На фиг. 2 А и 2В схе матично представлены плазмиды p7E3Vк hCк (фиг.2А) и p7E3Vнh C g 4 (фиг.2В), которые содержат химерные генно-инженерные конструкции, кодирующие, соответственно, легкие и тяжелые цепи химерного иммуноглобули на 7ЕЗ. Фиг. 3 иллюстрирует свя зывание химерного иммуноглобулина 7ЕЗ, кодируемого векторами p7E3Vк hCк и p7E3Vнh C g 4 , с тромбоцитами. 4 37249 На фиг. 4 показано подавление агрегации тромбоцитов химерным иммуноглобулином 7ЕЗ (с7ЕЗ). На фиг. 5 приведен график концентрации анти тела в плазме (нг/мл) в зависимости от времени (в днях), который показывает, быстрое первоначальное выведение с7ЕЗ Fab (g1, к) из плазмы пациентов, страдающих от хронического заболевания коронарных со судов, после вве дения дозы 0,25 мг/кг с7ЕЗ Fab в виде внутривенного вливания в течение пяти минут. Фиг. 6 (А-С) поясняет в обобщен ном виде влияние на активность тромбоцитов до зы химерного 7ЕЗ Fab в ви де одного болюса (0,15 мг/кг, 0,20 мг/кг или 0,25 мг/кг) через 2 час после назначения антитела (g1, к ). Зависимая от дозы ответная реакция наблюдается при изучении активности тромбоцитов с точки зрения блокады рецептора (фиг. 6А, вверху), агрегации тромбоцитов (фиг. 6В, посредине) и времени кровотечения (фиг. 6С, внизу). Ли нии соответствуют средним значениям. Фиг. 7 (А-С) иллюстрирует продолжительность антитромбоцитарного воздействия химерного 7ЕЗ Fab (g1, к), назначаемого перед проведением пластической операции на сосудах в ви де одного болюса с дозой 0,25 мг/кг. Линии соответствуют средним значениям от времени ноль (базовая линия) и до 24 часов для блокады рецептора (фиг. 7 А, вверху), агрегации тромбоцитов (фиг. 7В, посредине) и времени кровоте чения (фиг. 7С, внизу). Фиг. 8 (А-С) иллюстрирует суммарную антитромбоцитарную активность одного болюса с дозой 0,25 мг/кг с последующим непрерывным вливанием в течение 12 часов (10 мкг/мин) химерного 7ЕЗ Fab (g1, к) у одиннадцати пациентов. Линии соответствуют средним значениям, определенным для выраженной в процентах бло кады рецептора (фиг. 8 А, вверху), выраженной в процентах степени агрегации тромбоцитов для предварительной дозы (базовая линия во время ноль) (фиг. 8В, посредине) и времени кровотечения (фиг. 8С, внизу). Фиг. 9 иллюстрирует абсолютное изменение в гематокритном числе от базового значения в течение 24 час после окончания вливания для 47 пациентов, описанное в примере 4. Фиг. 10 представляет собой график Каплана-Мейера, который иллюстрирует зависимость вероятности не вызванного необхо димостью повторного чрескожного восстановления сосудо в от времени рандомизации для трех испытуе мых групп. На фиг. 11 в виде диаграммы приведены вероятностные коэффи циенты для 95%-ных доверительных интервалов для ключевых подгрупп (перечислены справа), которых подвергают испытаниям. Данные приведены для основных случаев прекращения проведения испытаний (смерть, нефатальный инфаркт миокарда, экстренная пластическая операция на сосуда х или размещение коронарного стента или внутриаортального баллонного насоса при стойкой ишемии). Кроме того, слева в виде таблицы приведены абсолютные значения по частоте наблюдения основных случаев прекращения испытаний в каждой подгруппе (частота случая (%)). На фиг. 12 приведен график, показывающий долю всех пациентов, у которых отмеченные случаи не выявлены в течение шестимесячного периода наблюдения. На фиг. 13 приведен график, показывающий долю тех пациентов, у которых отмеченные случаи не выявлены в течение шестимесячного периода наблюдения и у которых проведено успешное хирургическое вмешательство, не имевшее последствий по прошествии 30 дней. На фиг. 14 приведен график, показывающий долю тех пациентов, у которых отмеченные случаи не отмечены в течение шестимесячного периода наблюдения, и учиты вающий тех пациентов, у которых отмеченные случаи выявляются через 48 часов после первоначально успешного хирургического вмешательства. На фиг. 15 приведен график, показывающий долю всех пациентов, у которых не отмечены попытки восстановления кровеносных сосудов в подвергнутой операции артерии в течение шестимесячного периода наблюдения. Хи мерные иммуноглобули ны по настоящему изобретению состоят из индивидуальной химерной тяжелой и легкой цепочек иммуноглобули на. Хи мерная тяжелая цепочка включает антиген-связывающую область, получен ную из тяжелой цепочки не принадлежащего человеку анти гена, специфичного для тромбоцитов (в частности, специфичного для рецептора GPIIb/IIIa), которая привязана к константной области тя желой цепочки человека. Химерная легкая цепочка включает антиген-связывающую область, получен ную из тяжелой цепочки не принадлежащего человеку антигена, которая привязана к константной области легкой цепочки человека. Иммуноглобулины по настоящему изобретению могут быть одновалентными, бивалентными или поливалентными. Одновалентные иммуноглобули ны (HL) представляют собой димеры, образованные химерной тяжелой цепочкой, которая связана посредством дисульфидных мостиков с химерной легкой цепочкой. Бивалентные иммуноглобулины представляют собой тетрамеры (H2L2), образованные двумя димерами, связанными по крайней мере с помощью одного дисульфидного мости ка. Могут быть также получены поливалентные иммуноглобули ны, например, за счет агрегации константной области тяжелой цепочки (в частности, константных областей m тяжелой цепочки). Могут быть также получе ны фрагменты хи мерных иммуноглобулинов, та кие как Fab, Fab' или F(ab')2. Не принадлежащие человеку антиген-связывающие области хи мерного иммуноглобулина получают из иммуноглобули нов, специфичных для тромбоцитов. Предпочтительными иммуноглобули нами являются иммуноглобули ны, специфичные для рецепторов GPIIb/IIIa тромбоцитов, которые способны блокировать связывание лиганда с рецепторным комплексом гликопротеина IIb/IIIa. Тромбоз начинается с прилипания тромбоцитов в местах поражения стенок сосуда. Процесс прикрепления тромбоцитов протекает под контролем поверхностных рецепторов тромбоцитов, которые связываются белками внеклеточной матрицы обнажившейся поверхности субэндотелиаль 5 37249 ного слоя, такими как фактор фон Виллебранда, коллаген, фибронектин, витронектин и ламинин. Прилипание тромбоцитов приводит к образованию составленного ими монослоя. Далее, в ответ на действие агониста, такого как эпинефрин, АДФ, коллаген и тромбин, происхо дит активация тромбоцитов. Активация приводит к воздействию рецептора гликопротеина ІІb/IIIa (GPIIb/IIIa) на поверхность тромбоцитов. После этого GPIIb/IIIa на активированных тромбоцитах становится доступен для связывания с фибриногеном, который стимулирует агрегацию тромбоцитов. Связывание GPIIb/IIIa с др угими адгезивными белками, такими как фактор фон Виллебранда, также вызывает сшивку и агрегацию тромбоцитов. Таким образом, связывание адгезивных молекул, таких как фибриноген или фактор фон Виллебранда, к GPIIb/IIIa, вызывающее агрегацию тромбоцитов, представляет собой обычную стадию в процессе образования тромба, что де лает рецептор GPIIb/IIIa привлекательной мишенью для терапевти ческих средств, которые могут помешать взаимодействию GPIIb/IIIa с указанными молекулами. Более того, можно ожидать, что при использовании антиGPIIb/IIIa химерного анти тела будет подавляться агрегация активированных тромбоцитов, при этом процесс первичного прилипания тромбоцитов не нарушается. Селективное инги бирование агрегации тромбоцитов может оказаться желательным, поскольку прилипание тромбоцитов, не сопровождающееся агрегацией, может способствовать остановке кровотечения. Примерами подхо дящих антител, специфичных для тромбоцитов, являются 7ЕЗ и 10Е5 (см. Европейские патентные заявки с номерами 205207 и 206532, описания которых приводятся здесь для справок). Ан титело 7ЕЗ (или взаимодействующее с ним антитело или функционально эквивалентный эпитоп) является наиболее предпочтительным, поскольку, поскольку оно является специфичным для комплексной формы рецептора GPIIb/IIIa. Мо гут также использоваться другие анти тела, специфичные для рецептора GPIIb/IIIa (антигена, который распознает 7ЕЗ), такие как анти тела, специфичные для любого из компонентов IIb или IІІa. Мо гут использоваться антитела, специфичные для други х антигенов тромбоцитов. Например, могут применяться антитела, способные взаимодействовать с протеиновым зерном альфа-мембраны тромбоцита GMP-140, такие как антитело S12 (J. Biol. Chem., 259: 97999804 (1984); Патент США 4783330). Ан тиген-связывающая область химерного анти тела может быть получе на из иммуноглобулина, не принадлежащего человеку. Ан тиген-связывающая область имеет предпочтительно муриновое происхождение, поскольку муриновые антитела против тромбоцитов и, в частности, рецепторов GPIIb/IIIa, доступ ны или могут быть получе ны в муриновых системах. Аль тернативными источниками антиген-связывающи х областей являются другие виды животных или грызунов (см., например, Newman et al., Bio/Technology, 10: 1455-1460 (1992). В одном из вариантов осуществления настоящего изобретения антиген-связывающая область химерного иммуноглобулина содержит по крайней мере часть тромбоцит-специфичного им муноглобулина, не принадлежащего человеку, достаточную для специфического или селективного связывания гена, такую как один или несколько гипервариабельных участков или их частей, выделенных из не принадлежащего человеку иммуноглобули на (см., в частности, Winter, Патент США 5225539; Европейская патентная заявка 0239400; Патент Великобритании 2188638; Adair et al., Международная патентная заявка WO 91/09967; Jolliffe et al., Международная патентная заявка WO 91/09966). В другом варианте осуществления настоящего изобретения химерный иммуноглобулин включает по крайней мере одну хи мерную тяжелую цепочку, содержащую ва риабельный участок, выделенный из тяжелой цепочки не принадлежащего человеку иммуноглобули на, которая соединена с по крайней мере частью константной области тяжелой цепочки человека, и по крайней мере одну хи мерную легкую цепочку, содержащую вариабельный участок, вы деленный из легкой цепочки не принадлежащего человеку иммуноглобули на, которая соединена с по крайней мере частью константной области легкой цепочки человека. Возможны также и другие комбинации вариабельных и константных областей (см., частности, Патент США 5169939). Константные области хи мерных анти тел получают из иммуноглобули нов человека. Константную область тяжелой цепочки можно выбрать из одного из пяти изотипов альфа, дельта, эпсилон, гамма или мю. Более того, тяжелые цепочки различных подклассов (таких как подклассы ІgG тяжелых цепочек) отвечают за различные функции эффектора и, таким образом, выбирая константную область нужной тяжелой цепочки, можно получить химерные антитела с требуемой эффекторной функцией. Предпочтительными константными областями являются гамма 1 (IgG1), гамма 3 (IgG3) и гамма 4 (IgG4). Константная область легкой цепочки может быть типа каппа или лямбда. В общем случае химерные анти тела получают, подготавливая для каждого из компонентов легкой или тяжелой цепи химерного иммуноглобулина ген слияния, включающий первый сегмент ДНК, который кодирует по крайней мере функциональную часть тромбоцит-специфичной вариабельной области, не принадлежащей человеку (например, функционально перестроенный вариабельный участок вместе с соседними сегментами) и связанной со вторым сегментом ДНК, который кодирует по крайней мере часть константной области иммуноглобули на человека. Каждый ген слияния собирают или вводят в вектор экспрессии, получая вектор экспрессии, который содержит ген слияния в способной экспрессироваться форме. В одном из вариантов осуществления настоящего изобретения ДНК, включающая область связывания анти гена, ковалентно соединяется с константной областью посредством интрона. В другом варианте осуществления настоящего изобретения могут быть созданы или получе ны генноинженерные конструкции, у которых отсутствует один или несколько интронов. Затем подвергают трансфекции генами клетки реципиента, способные экспрессировать генные продукты. Подвергнутые трансфекции клетки реципиента выращивают в условиях, позволяющи х провести 6 37249 экспрессию введенных генов, а затем экспрессированные иммуноглобули ны или цепочки иммуноглобулина выделяют. Гены, кодирующие вариабельные области легкой и тяжелой цепей иммуноглобулина, могут быть получены из лимфоидных клеток, которые продуцируют тромбоцит-специфичные антитела. Например, гибридомные клеточные линии являются источником вариабельной области иммуноглобули на для химерных антител по настоящему изобретению. Доступ ны также и другие клеточные линии грызунов. Клеточные линии можно получить, вводя грызун у провокационную пробу тромбоцитов человека, или компонент, содержащий рецептор GPIIb/IIIa, или фракции тромбоцитов, формируя слитые гибридные клетки между клетками, продуци рующими антитела, и клеточной линией миеломы, подвергая гибрид клонированию и отбирая клоны, которые продуци руют анти тела против тромбоцитов или рецептора гликопротеина IIb/IIIa. Константные области можно получить из продуцирующи х анти тела клеток человека, используя стандартные методики клонирования. Иначе, поскольку клонированию подвергают ге ны, представляющие два класса легких цепочек и пять классов тяжелых цепочек, этих клонов легко получают константные области, принадлежащие человеку. Связывающие фрагменты хи мерного антитела, та кие как фрагменты F(ab')2 или Fab, могут быть получе ны путем конструи рования химерного гена тяжелой цепочки в усеченной форме. Например, химерный ген, кодирующий часть F(ab')2 тяжелой цепочки будет включать ДНК последовательности, кодирующие область СН и область "талии" тяжелой цепочки. В качестве альтернативы подобные фрагменты можно получить фер ментативным расщеплением химерного иммуноглобулина. Например, расщеплением с использованием папаина или пепсина можно генерировать, соответственно, фрагменты Fab или F(ab')2. Гены слияния, кодирующие легкие и тяжелые химерные цепочки (или их порции) преимущественно собирают в двух различных векторах экспрессии, которые можно использовать для котрансгенного переноса в клетки реципиента. Каждый вектор содержит два селектируе мых гена - один для селекции в бакте риальной системе, а вто рой в селекции в эукариотной системе, при этом каждый вектор имеет разную пару генов. Указанные векторы позволяют осуществить продуцирование и амплификацию гена слияния в бактериальной системе и последующий котрансгенный перенос в эукариотные клетки и селекцию клеток, подвергнутых котрансгенному переносу. Примерами селектируе мых генов для использования в бактериальной системе являются гены, которые придают устойчивость к действию ампицилина, и гены, которые придают устойчивость по отношению к действию хлорамфеникола. Предпочти тельны два селектируе мых гена: (i) ген ксантангуа нинфосфо рибозилтрансферазы (gpt) и (ii) ген фосфотрансфе разы из Тn5 (обозначают как nео). Селекция с помощью gtp основана на способности фер мента, кодируемого указанным геном, использовать ксантин в качестве субстрата при синте зе пуриновых н уклеотидов; аналогичные эндогенные ферменты та кой способностью не обладают. В среде, содержащей ксантин и микофенольную кислоту, которая блокирует превращение монофосфата инозина в монофосфат ксантина, могут выжить лишь клетки, экспрессирующие ген gpt. Продукт ге на nео блокирует ингибирование синте за белка в эукариотных системах, вызванное анти биотиком G418 и другими антибиотиками этого класса. Две процедуры селекции могут использоваться одновременно или последовательно для отбора экспрессии генов иммуноглобулиновой цепочки, введенных в эукариотную клетку в двух различных ДНК векторах. Предпочти тельной клеточной линий реципиента является клетка миеломы. Клетки миеломы могут синтезировать, осуществлять сборку и секретировать иммуноглобули ны, кодируемые подвергнутыми трансфекции генами иммуноглобули на. Более того, они владеют механизмом гликозилирования иммуноглобули на. Особенно предпочти тельной клеткой реципиента является непродуци рующая линия клеток миеломы, такая как Sp2/0. Указанные клеточные линии продуцируют лишь иммуноглобулин, кодируе мый подвергнутыми трансфекции генами иммуноглобули на. Клетки миеломы могут быть выращены в среде для выращивания культуры или в брюшине мыши, а секретируемый иммуноглобулин может быть выделен из асцитной жидкости. В качестве подходящих клеток реципиента могут служить другие лимфоидные клетки, такие как В-лимфо циты или клетки гибридомы. Существует несколько способов трансфекции лимфоидных клеток векто рами, содержащими гены, кодирующие иммуноглобулин. Предпочтительным способом введения ДНК в лимфоидные клетки является электропорация. При осуществлении этой методики клетки реципиента подвергают воздействию электрических импульсов в присутствии ДНК, которую необходимо ввести (см., например, Potter et al., Proc. Natl. Acad. Sci. USA, 81: 7161 (1984). Другим способом введения ДНК является слияние протопластов. В этом методе для удаления стенок клетки бактерии, которая скрывает рекомбинантнуго плазмиду, содержащую хи мерный ген иммуноглобули на, используют лизоцим. Получен ные сферопласты сливают с клетками миеломы в присутствии полиэтиленгликоля. После слияния протопластов трансфектанты отбирают и выделяют. Еще одним способом, который может использоваться для введения ДНК во многие типы клеток, является осаждение фосфа том кальция. Гены хи мерного иммуноглобули на могут экспрессироваться также в нелимфоидных клетках, та ких как бактерии или дрожжи. При экспрессии в бакте рии тяжелые цепочки и легкие цепочки становятся частью телец включения. Таким образом, цепочки должны быть изолированы и очище ны, а затем собраны в функциональные молекулы иммуноглобули на. Существуют и другие способы для экспрессии в Е . coli (см., в частности, A. Pluckthun, Bio/Technology, 9 : 545-551 (1991); A. Skerra et al ., Bio /Technology, 9: 273-278 (1991), в том числе секрецию из Е. coli в виде слиты х белков, содержащи х си гнальную последовательность. 7 37249 Использование тромбоцит-специфичных химерных иммуноглобулинов. Хи мерные тромбоцит-специфичные антитела по настоящему изобретению полезны в качестве антитромботических терапевтических средств. Например, химерные антитела (или их фрагменты) могут использоваться для подавления агрегации тромбоцитов и образования тромба у пациентов, имеющи х тромб или подверженых риску образования тромба. Антитела могут также использоваться для подавления отклонений в менструальном цикле, вызываемых агрегацией тромбоцитов, которая может предшество вать образованию или преобразованию тромбов. Антитела могут использоваться в различных ситуациях, когда следует предотвратить образование или преобразование (окклюзию) тромбов. Более того, антитела могут использоваться в различных ситуа циях, когда следует подавить (снизить, отсрочить или предотвратить) стеноз или рестеноз. Например, пациенты, подверженные риску или страдающие от заболеваний коронарных артерий, могут почувствовать облегчение при назначении эффективного количества фрагментов химерных антитромбоцитных антител по настоящему изобретению (в частности, химерное антитело GPIIb/IIIa или предпочтительно его фрагмент, такой как хи мерный 7EЗ Fab или F(ab')2), с целью подавления окклюзии, реокклюзии, стеноза и/или рестеноза сосудов. Например, антитела могут назначаться индивидууму (в частности, млекопитающему, такому как человек) для предотвращения тромбоза при легочной эмболии, преходя щего ишемического наруше ния мозгового кровообращения, глубокого венозного тромбоза, при проведении операции по шунтированию коронарной артерии, хирургической операции по установке искусственного клапана сердца или сосуда (в частности, собственного, несобственного или синтетического трансплантанта сосуда). Анти тела по настоящему изобретению могут также назначаться индивидууму с целью предотвращения агрегации тромбоцитов и тромбоза до, во время и после пласти ческих операций на сосудах, которые проводятся методами баллонной коронарной атеректомии, лазерной пластической операции на сосуда х или другими подхо дящими способами. Антитело может назначаться перед проведением пластических операций на сосудах, во вре мя проведения пластических операций на сосудах и после проведения пластических операций на сосуда х. По добная обработка может предотвратить тромбоз и, таким образом, снизить вероятность тромботических осложнений после проведения пластических операций на сосуда х, та ких как смерть, инфаркт миокарда или рецидивы ишемии, которые приводят к необхо димости проведения чрескожной чресполостной реконструкции коронарной арте рии или операции по шунтированию коронарной артерии (в случаях острой ишемии). Кроме того, подобное лечение может привести к более продолжительному положительному воздействию за счет снижения вероятности ишемии или осложнений при проведении хирурги ческого вмешательства на коронарной артерии (в частности, при проведении пластических операций на сосудах), та ких как смерть, инфаркт миокарда или рецидивы ишемии, которые приводят к необходимости проведения чрескожной чресполостной реконструкции коронарной арте рии или операции по шунти рованию коронарной арте рии (при проведении операций по реваскуляризации), что подтверждается уменьшением вероятности воз никновения, отсрочкой или предотвращением стеноза или повторного сужения просвета сосуда. Например, как показано в примере 4, назначение химерного анти-тромбоцитного анти тела (фрагмента химерного 7ЕЗ Fab) в качестве вспомогательной терапии перед проведением пластической операции на кровеносных сосудах (чрескожной чресполостной реконструкции коронарной арте рии) эффективно увеличивает времена кровотечения и снижает индуцируемую агонистом агрегацию тромбоцитов, что подтверждается ex vi vo анализом агрегации тромбоцитов. Результаты исследований, приведенные в примерах 4 и 5, также показывают, что блокада GPIIb/IIIa тромбоцитов и подавление агрегации под действием антитела с7ЕЗ (фрагмента Fab) приводит к in vivo антитромботической эффективности при лечении людей. Результа ты рандомизованного обезличенного анализа с использованием плацебо в качестве контроля при назначении фрагмента химерного анти тела 7ЕЗ приведены в примерах 6 и 7. Данные, представленные в примере 6, свидетельствуют о том, что назначение фрагмента химерного анти тела 7ЕЗ пациентам, которым проводят пластические операции на сосуда х и которые подвержены значительному риску внезапной закупорки (окклюзии) сосудов, может предотвратить внезапную закупорку (окклюзию) сосудов и уменьшить вероятность возникновения острой ишемии. Как далее показано в Примере 7, назначение фрагмента химерного антитела пациентам, которым проводят пласти ческие операции на сосудах и которые подвержены значительному риску вне запной закупорки (окклюзии) сосудов, может позднее уменьшить, отсрочить и/или предотвратить развитие рестеноза. Долговременное полезное воздействие проявляется в снижении вероятности возникновения неострых ишемических осложнений при назначении фрагмента хи мерного анти тела антиGPIIb/IIIa (см. Пример 7) является беспримерным. С целью предотвращения или уменьшения вероятности возникновения стеноза или ресте ноза, могут использоваться дополнительные соединения, которые селективно связываются с рецептором GPIIb/IIIa; полезное клиническое воздействие при этом проявляется в уменьше нии вероятности возникновения неострых ишемических осложнений. После их назначения указанные соединения могут дополнительно препятствовать закупорке или повторной закупорке сосудов. Указанные соединения включают, например, антагонисты GPIIb/IIIa, иммуноглобулин или неиммуноглобулиновые пептиды или белки (в частности, синтетические, рекомбинантные), их аналоги и нуклеиновые кислоты и аналоги нуклеиновых кислот. Пациенты, подверженные риску или страдающие от заболеваний коронарных арте рий, могут ощутить полезное воздействие при назначении эффектив 8 37249 ного количества соединения, которое селективно связывается с рецептором GPIIb/IIIa, тем самым подавляя закупорку, повторную закупорку, сте ноз и/или рестеноз сосудов. Назначение. Агрегация тромбоцитов активирует систему свертывания крови и приводит к фор мированию более устойчивой фибриновой сетчатой структуры и закупоривающего сгустка, которые могут подвергаться лизису под действием тромболитических средств. Ан титела по настоящему изобретению или соединения, которые селективно связываются с рецептором GPIIb/IIIa, могут назначаться индивидууму (в частности, че ловеку) самостоятельно или в сочетании с тромболитическим средством, таким как активатор плазминогена (в частности, клеточный активатор плазминогена, урокиназа, стрептокиназа, рекомбинантный клеточный активатор плазминогена), или антикоагулян том (в частности, антитромбиновым средством), или антитромбоцитарным средством, таким как аспирин, гепарин, гирулог, гирудин или кумариновые антикоагулянты (в частности, вар фарин), например, с целью предотвращения и снижения вероятности повторной закупорки сосудов, которая может возникнуть после тромболиза, и с целью ускорения лизиса сгустка. Соединения, антитело или его фрагмент могут также назначаться до, вместе или после назначения тромболитического средства, антитромбинового средства, антикоагулянта или антитромбоцитарного средства в количествах, достаточных для предотвращения агрегации тромбоцитов, в ре зульта те которой может возникнуть закупорка или повторная закупорка сосуда, и/или для того, чтобы отсрочить или предотвратить развитие сте ноза или рестеноза. Эффективное количество (т.е. количество, достаточное для дости жения желаемого терапевтического эффекта, такое как количество, достаточное для ингибирования агрегации тромбоцитов и тем самым для подавления образования или преобразования тромба, или количество, достаточное для предотвращения или отсрочки развития стеноза или рестеноза или случаев ишемии) соединения или антитела или фрагмента антитела может назначаться парентерально, преимущественно внутривенно, в фармацевти чески приемлемом носителе, таком как стерильный солевой физиологический раствор. Мо гут вводиться буферные добавки. В состав композиции, включающей антитело, могут вхо дить дополнительные добавки, такие как стабилизаторы (в частности, полисорбат 80, в соответствии с Фармакопеей США и Добавлениями к Фармакопее США). Антитело может назначаться в ви де единичной дозы, непрерывно или с помощью нескольких вливаний (в частности, с помощью инъекции болюса с последующим продолжительным вливанием). Иначе соединение или анти тело может назначаться с использованием механизма контролируемого выделения (в частности, с помощью полимера или системы доставки "очажков") или другим подходящим способом. Назначаемое количество зависит от различных факторов, та ких как клинические симптомы, вес индивидуума, и от того, проводится ли назначение других лекарств (в частности, тромболитических средств). При проведении повторной терапии с использованием антитромбоцитарных антител может возникнуть тромбоцитопения, вызванная лекарствами; это явление может быть результатом того, что организм принимает покрытые антителом тромбоциты за чужеродные белки, мобилизует против них ан титела, а затем выводит и х наружу че рез ретикулоэндотелиальную систему быстрее, чем обычно. Вследствие чрезвычайно высокой плотности размещения рецепто ров GPIIb/IIIa на поверхности тромбоцитов (приблизительно 80000 на один тромбоцит) и большого количества тромбоцитов в циркулирующей крови (приблизительно 0,25-0,5 х 106 на один микролитр), тромбоцитопения может оказаться серьезным осложнением при лечении антитромбоцитарными антителами. Использование химерных антитромбоцитарных (в частности, анти-GPIIb/IIIa) антител позволяет обойти эту проблему. Химерные антитромбоцитарные антитела по настоящему изобретению могут свести к минимуму тромбоцитопению (снизить или предотвратить), которая в противном случае могла бы наблюдаться при использовании антитромбоцитарных антител. Например, минимальное сокращение содержания тромбоцитов в крови наблюдается при назначении химерного 7ЕЗ Fab (см., в частности, примеры 6 и 7). Во-вторых, при назначении людям фрагмент хи мерного антитела 7ЕЗ Fab показывает удивительно низкую частоту возникновения индуцируемой иммуногенности по сравнению с его муриновым двойником (см., в частности, примеры 4 и 7). В процессе связывания тромбоцитов большая часть муриновой компоненты антитромбоцитарного хи мерного антитела связывается с поверхностью, в частности, посредством рецептора GPIIb/IIIa, и, та ким образом, становятся недоступ ны для иммунной системы, что делает хи мерные анти тела функционально неразличимыми от анти тел человека, направленных против то го же самого эпитопа. По этой причине другие хи мерные антитромбоцитарные антитела по настоящему изобретению могут также быть неиммуно-генными несмотря на их свя зывающую область муринового антигена. Тромбоцит-специфичные химерные иммуноглобули ны по настоящему изобретению полезны также для визуа лизации тромбов. С этой целью в общем случае более предпочтительно использовать фрагменты антитела. Как указано ранее, химерный ген тяжелой цепочки можно получить в усечен ной форме, с целью получе ния фрагментов хи мерного иммуноглобулина (в частности, Fab, Fab' или F(ab')2) для иммуносцинтиграфии. В указанные молекулы можно ввести метку непосредственно или с помощь хелатирующего агента, та кого как DTPA, с радиоизотопами, такими как 131иод, 125иод, 99mте хнеций или 111индий и получи ть агенты для радиоиммуносцинтиграфии. Иначе методами генной инженерии в сайт химерного анти тела можно вести домен связывания (хелатирования) радиоактивных металлов, с целью получи ть сайт для введения метки. Таким образом, химерный иммуноглобулин может быть создан в виде белка, который содержит не принадлежащую че ловеку тромбоцит-специфичную вариабельную область, константную область человека 9 37249 (предпочтительно усеченную) и домен связывания металла, полученный из связывающего металл белка, такого как металлотионеин. Тромбоцит-специфичный химерный иммуноглобулин или его фрагмент назначают пациенту, у которого подозревают тромб. По прошествии достаточного количества времени, необхо димого для того, чтобы содержащий метку иммуноглобулин локализовался в месте расположения тромба, обнаруживают ге нерируемый меткой сигнал с помощью фотосканирующего устройства, такого как гамма-камера. Обнаруженный сигнал затем превращают в изображение тромба. Изображение позволяет локализовать тромб in vivo и вы работать подхо дящую стратегию терапии. Изобретение далее поясняется следующими примерами, которые его ни в коем случае не ограничивают. Пояснительные примеры. Пример 1. Получение химерного тромбоцитспецифичного IgG4. А. Общая стратегия. Стратегия клонирования вариабельных областей для генов с легкой и тяжелой цепочкой из гибридомы 7ЕЗ основана на образовании связи в геноме между вариабельной областью и соответствующим J-фрагментом (связывающим фрагментом) функционально реаранжированных (и экспрессированных) ге нов Іg. Зонды J-фрагмента ДНК можно использовать для скрининга ге номных библиотек, чтобы выделить ДНК, соединенную с J-фрагментом; ДНК в зачаточной конфигурации (нереаранжированной) также гибридизуется в Jзонды, однако не соединяется с вариабельной областью последовательности и может быть идентифицирована анализом выделенных клонов с использованием фермента рестрикции. Цель стратегии клонирования заключается, таким образом, в вы делении вариабельных областей из реаранжированных генов с тяжелой и легкий цепочкой при использовании JH и Jk. Указанные клоны подвергают исследованию по методу назерн-блоттинга, с целью выяснить, экспрессируется ли их последовательность в гибридоме 7ЕЗ. Клоны, которые содержат экспрессируе мые последовательности, вводят в вектор экспрессии, содержащий константную область человека, и помещают в клетки миеломы мыши для того, что бы определить, получе но ли антитело. Ан титело из продуцирующи х его клеток затем испытывают на предмет специфичности связывания и на функциональность в сравнении в муриновым антителом 7ЕЗ. Депонирование производного клеточной линии муриновой гибридомы 7ЕЗ проводят в Американской коллекции тканевых культур (American Type Culture Collection, 12301 Parklawn Drive, Rockville, MD 20852) 30 мая 1985. Регистрационный номер НВ8832 присвоен после проведения успешных испытаний на жизнеспособность. Для выделения гена вариабельной области тяжелой цепочки из гибридомы 7ЕЗ конструируют геномную библиотеку с разделением по размеру, используя фаговый лямбда вектор gt10. Анализ по методу саузерн-блоттинга 7ЕЗ ДНК, подвергнутой ферментации с EcoRI, с использованием JH-зонда выявляет единственную полосу размером 3,5 тыс. пар оснований, соответствующую преобразованному локусу тя желой цепочки. Вероятно этот фрагмент содержит ген вариабельной области тяжелой цепочки. Из гибридомных клеток 7ЕЗ выделяют ДНК с большим молекулярным весом и подвергают полной ферментации с помощью рестрикционной эндонуклеазы EcoRI. Затем ДНК фракционируют на 0,7%-ном агарозном геле и непосредственно из геля выделяют ДНК размером 34 тыс. пар оснований. После экстракции смесью фе нол/хлороформ и гель-фильтрации через колонку Sephadex G-50 фрагменты размером 3-4 тыс. пар оснований лигируют к плечам лямба gt10 (от компании "Promega Biotech, Inc.") и упаковывают in vitro в частицы фага, используя Packagene от компании "Promega Biotech". Эту библиотеку подвергают прямому скринингу с плотностью приблизительно 30000 тромбоцитов на чашку Петри размером 150 мм, используя JH -пробу, со держащую метку 32Р. Гибридизацию тромбоцитов проводят в 5Х SSC, 50%-ном формамиде, 2Х реагента Денхардта, 200 мкг/мл денатурированной ДНК спермы лосося при температуре 42оС в те чение 18-20 час. Финишную промывку проводят в 0,5 Х SSC, 0,1%-ном додецилсуль фате натрия при температуре 65оС. Позитивные клоны идентифицируют после ауторадиографии. Конструирование геномной библиотеки легкой цепочки. Для выделения гена вариабельной области легкой цепочки 7ЕЗ конструируют ге номную библиотеку в лямбда векторе EMBL-3. ДНК с большим молекулярным весом подвергают частичной ферментации с помощью рестрикционной эндонуклеазы Sаu3А и фракционируют по размеру в градиенте плотности в 10-40%-ном растворе сахарозы. Фрагменты ДНК размером 18-23 тыс. пар оснований лигируют к плечам EMBL-3 и упаковывают in vitro в частицы фага, используя Packagene. Эту библиотеку подвергают скринингу с плотностью приблизительно 30000 тромбоцитов на чашку Петри размером 150 мм, используя Jкпробу. Условия гибридизации и промывки идентичны условиям, которые используют для библиотеки тяжелой цепочки. ДНК зонды. Jн зонд тяжелой цепочки мыши представляет собой фрагмент BamHI/EcoRI размером 2 тыс. пар оснований, который содержит как сегмент J3, так и сегмент J4. JK зонд легкой цепочки мыши представляет собой фрагмент HindIII размером 2,7 тыс. пар оснований, который содержит все пять сегментов Jx. Зонды, содержащие метку Р, получают ферментативным лигированием одноцепочечного разрыва в двухцепочечной ДНК ("ник"-трансляцией) с использованием набора от компании "Amersham, Inc". Свободные нуклеотиды выделят центрифуги рованием через колонку с Sephadex G-50. Удельные активности зондов составляют приблизительно 109 отсчетов в минуту на микрограмм. В. Материалы и методики Если специально не оговаривается, то все части и проценты даны по весу, а температура приведена в градусах Цельсия. Конструирование геномной библиотеки тяжелой цепочки. 10 37249 Анализ по методу назерн-блоттинга. 15 мкг полной клеточной РНК подвергают электропорации на 1% геле агароза/формальдегид (Maniatis et al., Molecular Cloning) и переносят на целлюлозу. Пятна гибридизуют с помощью ДНК зондов, подвергнутых "ник"-трансляции, в 50%ном формамиде, 2Х растворе Денхардта, 5Х SSC и 200 мкг/мл денатурированной ДНК спермы лосося при температуре 42оС в течение 10 час. Финишную промывку проводят в 0,5Х SSC, 0,1%-ном додецилсульфа те натрия при температуре 65оС. Трансфекция ДНК с использованием электропорации. Плазмидную ДНК, которую необходимо подвергнуть трансфекции, дважды очищают центрифуги рованием до наступления равновесия в градиенте растворов бромида этидия/хлорида це-зия. 10-50 мкг ДНК плазмиды добавляют 8 х 106 SP2/0 клеток в забуференном фосфатом солевом физиологическом растворе при охлаждении в бане со льдом и полученные смеси помещают в аппарат для проведения электропорации фирмы "Biorad". Электропорацию проводят при напряжении 200 вольт, и клетки помещают на планшеты для микротитрования с 96 ячейками. Селекцию с использованием подхо дящего лекарства проводят через 48 час и через 1-2 недели определяют колонии, устойчивые к действию лекарства. Количественное определение воспроизводства антитела. Жидкость над осадком тканевой культуры анализируют на содержание белка IgG методом иммуноанализа концентрации частиц с флюо ресцентным возбуждением (Jolley et al., (1984) J. Immunol. Meth. 67: 21), используя стандартные кривые, получен ные для очищенного IgG. Концентрацию химерного анти тела 7ЕЗ с константными областями человека определяют с помощью шариков из полисти рола, покрыты х поученным от козла антителом анти-человек IgG Fc и полученным от козла конъюгированным флюоресцеином анти телом анти-человек IgG Fc. Анализ проводят на автоматизированной уста новке (от компании "Pandex Laboratories, Inc."). Очистка тромбоцит-специфичных хи мерных анти тел lgG4. Жидкость над осадком тканевой культуры концентрируют с помощью ультрафильтрационной мембраны Diaflo YM100 (от компании "Amicon") и помещают на колонку, наполненную белком А-сефарозой. Химерное антитело элюируют из колонки с белком А раствором цитрата натрия в градиенте рН от 6,5 до 3,5. Очищенное антитело концентрируют с помощью ультрафильтрационной мембраны Diaflo YM100. Концентрацию антитела определяют, измеряя поглощение на длине волны 280 нм. Анализ ингибирования связывания. Очищенное антитело (как муриновое 7ЕЗ, так и химерное 7ЕЗ) используют в конкурентном анализе с антителом 7ЕЗ, содержащим метку радиоактивного иода при исследовании связывания тромбоцитов человека. Обогащенную тромбоцитами плазму получают центрифугированием содержащей цитратный буфер цельной крови со скоростью 1875 об/мин в течение 3,5 минут. Ан титело 7ЕЗ, содержащее метку 125I (150000 отсчетов в минуту), до бавляют к разбав ленному до нужной концентрации раствору испытуемого антитела и инициируют реакцию добавлением 150 мкл обогащенной тромбоцитами плазмы. Проводят инкубацию в течение 1-2 час при комнатной температуре и тромбоциты с присоединенным анти телом отделяют от свободного анти тела центрифуги рованием через 30%-ную сахарозу с ускорением 12000 g в течение 4 минут в тр убке для центрифуги рования емкостью 0,4 мл. Крышку трубки, содержащую таблетку тромбоцит/антитело, отрезают и определяют количество отсчетов в счетчике Гейгера. Конкуренцию связывания с тромбоцитами между со держащим иод 7ЕЗ и химерным 7ЕЗ сравнивают с конкуренцией содержащим иод 7ЕЗ и несодержащим метку 7ЕЗ IgG. Подавление агрегации тромбоцитов. Очищенное антитело ТЕЗ или хи мерное антитело ТЕЗ добавляют к содержащей цитратный буфер цельной крови и выдерживают в инкубаторе при температуре 37oС в течение 10 минут. Скорость агрегации тромбоцитов определяют после активации коллагеном или АДФ с помощью агрегометра цельной крови ("Chronolog Corp."). С. Результаты. Клонирование тромбоцит-специфичных вариабельных областей гена. Несколько позитивных клонов выделяют после скрининга из библиотеки тяжелой цепочки и библиотеки легкой цепочки и приблизительно одного миллиона тромбоцитов, используя соответственно, зонды JH и JK. После приблизительно трех раундов очистки тромбоцитов для каждого положительного клона выделяют ДНК бактериофага, подвергают фер мента ции либо с EcoRI (клоны тяжелой цепочки) либо с HindIII (клоны легкой цепочки и фракционируют на 1%-ных агарозных ге лях. ДНК переносят на нитроцеллюлозу и пробы гибридизуют с ДНК зондами JH (тяжелая цепь) или JK (легкая цепь), содержащими метку Р. Для тяжелой цепочки выделяют 2 клона, содержащих фрагменты ДНК EcoRI с массой 3,5 тыс. пар оснований, которые гибридизовались с зондом JH . Два класса фрагментов HindIII с размерами 3,0 и 6,0 тыс. пар оснований идентифицируют с зондом JK. Клонированная ДНК, соответствующая аутентичным областям тяжелой и легкой цепочек из гибридомы 7ЕЗ должна, гибридизоваться в мРНК, выделенную из гибридомы. Нефункциональные ре-аранжировки ДНК в ло кусах как тяжелой, так и легкой цепи не должны экспрессироваться. На фиг. 1 приведены результа ты анализа по методу назерн-блоттинга, которые показывают, что предполагаемый фрагмент EcoRI тяжелой цепочки размером 3,5 тыс. пар оснований и предполагаемый фрагмент HindIII легкой цепочки размером 6,0 тыс, пар оснований оба гибридизуются в соответствующего размера мРНК из гибридомы 7ЕЗ. В субклонированные фрагменты вводят метку Р методом "ник"-трансляции и гибридизуют и х в назерн-блотты, со держащие полную РНК, вы деленную из SP2/0 (партнер слияния гибридомы 7ЕЗ) или из 7ЕЗ, как показано на фиг. 1. Фрагмент тяжелой цепочки EcoRI размером 3,5 тыс. пар оснований гибридизуется с мРНК размером 2 тыс. пар оснований в РНК 7ЕЗ, но не в РНК SP2/0. Аналогично фрагмент легкой цепочки HindIII размером 6,0 тыс. пар оснований гибридизуется с мРНК размером 11 37249 1250 пар оснований в РНК 7ЕЗ, но не в РНК SP2/0. Это корректные размеры для РНК тяжелой и легкой цепочек, соответственно. Поскольку клонированные ДНК-фрагменты содержат последовательности, которые экспрессируются в гибридомах 7ЕЗ, то полученные данные свидетельствуют о том, что клоны содержат корректные последовательности вариабельных областей из гибридомы 7ЕЗ. Однако последний функциональный тест показывает, что указанные последовательности после их объединения с подхо дящими последовательностями константных областей способны направлять синтез антитела со специфичностью и аффинностью, аналогичными для специфичности и аффинности муринового анти тела 7ЕЗ. Векторы и системы экспрессии. V-ге ны предполагаемых легкой и тяжелой цепочек, полученные клонированием из гибридомы 7ЕЗ, присоединяют к генам и G4 константных областей человека в ранее описанных векторах экспрессии (L. Sun et al., Proc. Natl. Acad. Sci. USA 84: 214-218 (1987)). Фрагмент 17-1А Vк HindIII из pSV184DHneo17-1AVк hCк замещают фрагментом HindIII размером 6,0 тыс. пар оснований, соответствующим предполагаемому гену ва риабельной области легкой цепочки из 7ЕЗ. Аналогично фрагмент 17-1А VнEcoRI из pSV2DHgpt17-1AVнh C g 4 , замещают фрагментом EcoRI размером 3,5 тыс. пар оснований, соответствующим предполагаемому гену ва риабельной области тяжелой цепочки из 7ЕЗ. Структуры получен ных плазмид, обозначенных как p7E3Vк hCк и p7E3Vнh C g 4 , приведены на фиг. 2. Для экспрессии химерных генов тяжелой и легкой цепочек две плазмиды котрансгенно переносят в непродуцирующую клеточную линию SP2/0 миеломы мыши. Плазмида легкой цепочки придает устойчивость по отношению к G418, а плазмида тяжелой цепочки придает устойчивость по отношению к микофенольной кислоте и, таким образом, позволяют осуществить двойную селекцию при получе нии клонов, несущих экспрессирующие гены от каждой плазмиды. Колонии, устойчивые к действию G418 и микофенольной кислоты, размножают в устойчивые клеточные линии и хранят в присутствии обоих лекарственных препаратов. Жидкость над осадком тканевых культур указанных клеточных линий анализируют на наличие антитела с помощью флюоресцентного иммуноанализа концентрации частиц, используя полиэтиленовые шарики, покрытые антителом античеловек ІgG Fc, полученным от козла, и тем же самым антителом, содержащим метку флюоресцеина. Из первых десяти проверенных линий для проведения дальнейших исследований выбирают одну (которую обозначают как C-7E3F6), дающую приблизительно 2 мкг/мл. Анализ активности связывания тромбоцитов. После очистки антитела C-7E3F6 на колонке, наполненной белком А - сефарозой анти тело концентрируют и сравнивают с муриновым 7ЕЗ IgG в анализе активности свя зывания. Фиг. 3 показывает, что муриновое 7ЕЗ и C-7E3F6 (предполагаемое химерное антитело) в равной степени конкурируют с содержащим радиоактивную метку 7ЕЗ за связывание тромбоцитов; кривые связывания совпадают, указывая на то, что свя зывающие свойства муринового и хи мерного 7ЕЗ в соответствии с этим критерием являются идентичными. Подавление агрегации тромбоцитов с помощью C-7E3F6. Очищенное C-7E3F6 сравнивают с муриновым 7ЕЗ при проведении функционального анализа, вкотором определяют способность испытуемого анти тела подавлять агрегацию тромбоцитов человека. Результаты этого анализа представлены на фиг. 4 и показывают, что оба антитела при одинаковых концентрациях в равной степени подавляют индуцируемую коллагеном агрегацию тромбоцитов. Кроме того, C-7E3F6 в такой же степени подавляет АДФ-индуцируемую агрегацию тромбоцитов. Результа ты анализов на связывание и подавление агрегации тромбоцитов показывают, что: (1) из гибридомы 7ЕЗ клонированием действительно получе ны корректные гены вариабельной области; и (2) по данным указанных анализов замещение константной области че ловека на муриновые константные области не оказывает воздействия на способность связываться и функциональные характеристики вариабельных областей 7Е3. Анализ с использованием шариков, покрытых фибриногеном. Как оказалось, химерное антитело C-7E3F6 является позитивным при проведении количественного функционального анализа, в котором определяют способность антитела подавлять агглютинацию между тромбоцитами и покрытыми фибриногеном шариками. В. Coller et al., J. Clin. Invest. 73: 325-338 (1983). Пример 2. Продуци рование химерного IgG1 и IgG3. ДНК фрагменты, кодирующие вариабельную область тяжелой цепочки из муринового анти тела 7ЕЗ, присоединяют к константным областям g1 и g3 человека, которые присутствуют в векторах экспрессии pSV2DHgtp17-1AVн-h C g 1 и pSV2DHgtp171AVн - h Cg 3 (Sun et al., Proc. Natl. Acad. Sci. USA 84: 214-218 (1987)), замещая фрагменты 17-1А вариабельных областей тяжелой или легкой цепочки соответствующими фрагментами вариабельной области 7ЕЗ. Полученные хи мерные гены тяжелой цепочки вместе с хи мерными генами легкой цепочки котрансгенно переносят в клетки SP2/0 и получают устойчивые клеточные линии, секретирующие антитела g1,к и g3,к. Пример 3. Первичные исследования по применению хи мерного 7ЕЗ Fab для лечения людей. Получение фрагментов химерного 7ЕЗ Fab. Фрагмент хи мерного 7ЕЗ (с7ЕЗ) получают ферментацией очищенного хи мерного 7ЕЗ IgG (тяжелая цепочка гамма 1, легкая цепочка каппа) с помощью протеолитического фермента папаина. Фрагмент Fab выделяют с помощью нескольких стадий очистки, направленных на получе ние продукта, который свободен от других фрагментов ферментации и других загрязняющи х компонентов (в частности, белка, нуклеиновой кислоты, ви 12 37249 русов). Ко нечный продукт получают в ви де стерильного непирогенного раствора, содержащего 2 мг моноклонального хи мерного 7ЕЗ Fab на миллилитр 0,15 М раствора хлорида натрия, 0,01 М раствора фосфа та натрия с рН 7,2. В некоторые препараты добавляют полисорбат 80 до конечной концентрации 0,001% (вес./об.). Непосредственно перед использованием продукт отфильтровывают через фильтр с размерами пор 0,22 микрон, который слабо связывает белок. Продукт хранят при температуре 2-8оС. Фармакокинетика: вымывание с7ЕЗ Fab из плазмы человека Вымывание фрагмента химерного 7ЕЗ (с7ЕЗ) Fab из плазмы изучают у тре х пациентов, страдающих от хронического заболевания коронарной артерии. После дозы 0,25 мг/кг с 7ЕЗ Fab, которое вводят внутривенно в виде вли вания в течение пяти минут в различные периоды времени, начиная от двух минут и до 72 ч, берут пробы крови. Ожидалось, что некоторые порции анти тела будут находится в плазме в несвязанном состоянии. Для определения этого несвязанного компонента антитела, необхо димо быстро отделить плазму от тромбоцитов, что бы предотвратить последующее связывание ex vi vo. Содержание в плазме свободного с 7ЕЗ Fab определяют твердофазным иммуно-ферментативным анализом (EIA). В этом анализе используют а ффинность выделенного антимуринового 7ЕЗ IgG, которое получат из сыворотки кролика, для твердофазного захвата и систему определения на основе биотинилированного производного того же самого препарата антигена анти-7ЕЗ, получен ного от кролика. Полученные результа ты приведены в таблице 1. Таблица 1 Концентрация 7ЕЗ Fab в плазме пациентов, которым введена доза 0,25 мг/кг Время (*) с7Е3 Fab (мг/мл) Пациент А Пациент В Пациент С До введения дозы ND ND ND 2 минуты не получено 2,554 2,312 5 минут 1,149 1,873 1, 411 10 минут 0,714 1,331 1, 111 15 минут 0,610 0,916 0, 852 20 минут 0,499 0,985 0, 756 30 минут 0,464 0,815 0, 515 45 минут 0,340 0,704 0, 405 1 час 0,309 0,437 0, 195 2 час 0,288 0,262 0, 149 6 час 0,204 0,095 0,105 12 час 0,112 0,072 0,064 24 час 0,065 0,058 0,046 48 час 0,055 1,47 0,175 72 час 0,196 ND 0,076 (*) Промежуток времени между окончанием вливания и моментом отбора пробы крови. Следует отметить, что тромбоциты находятся в контакте с плазмой в течение еще двух минут после того, как отобрана проба крови (т.е. в течение времени, необхо димого для отделения плазмы центрифуги рованием). ND = не обнаружено или находится ниже предела обнаружения данного анализа (0,025 мкг/мл) Если в ви де несвя занного ан ти тела в плазме определяли бы всю вве денн ую до зу 7ЕЗ, то тео рети ческая макси мальная концентрация анти тела составила бы приб лизитель но 6,25 мкг/мл (0 ,25 мг/к г, делен ные на 40 мл плазмы на килограмм). Однако эта тео ретическая максимальная концентрация не могла бы быть получе на, поскольку боль шая часть вве денного анти тела свя зывается с тромбоцита ми. На самом деле при наиболее ранних вре менах проведе ния измерений (2 мин уты ) средняя концентрация с 7ЕЗ Fab в плаз ме (n = 2) соста вляет 2,43 мкг/мл; это значение соответствуе т наблюдаемой максимальной концентрации в плаз ме (Сmах). Данные, получен ные для последующи х после вве дения антитела ин тер валов времени, показывают быстрое первоначаль ное убы ва ние содержания 7ЕЗ Fab в плаз ме. К мо менту проведе ния измерений по прошествии 1 час и 24 час количество оставше гося в плаз ме введенного анти тела (n = 3) составляет, соо тветствен но, 0,5 мкг/мл и 0,1 мкг/мл. Гра фик зависи мости концентрации (нг/мл) анти тела в плазме от времени, приведен ный на фиг. 5, показывае т быст 13 37249 рое перво начальное вымывание с7ЕЗ Fab из плазмы у все х тре х па циентов. Проводят предварительный анализ фармакинетических свойств фрагмента с7ЕЗ Fab. Для того, чтобы удо влетворить результаты, полученные для концентрации в плазме, применяют несколько моделей, в том числе несколько смешанных (случайные и фиксированные эффекты) линейных моделей, а также стандартных двухкомпартментальных и некомпартментальных моделей. Данные о содержание свободного анти тела в плазме неадекватно удовлетворяют стандартным фармакинетическим моделям. Поскольку объектом воздействия с7ЕЗ Fab является рецептор, расположенный на тромбоцитах, то нельзя ожидать, что содержание свободного антитела в плазме не будет каким-либо простым образом связано с его концентрацией по месту его действия. Первоначальное быстрое удаление с7ЕЗ Fab из плазмы частично свидетельствует о быстром связывании анти тела с рецепторами GPIIb/IIIa. Было показано, что из изученных моделей для описания величин концентраций в плазме наиболее подхо дит линейная модель вероятностных эффектов. С помощью этой модели определяют предварительные значения фармакинетических параметров, Clp, Vd и t1/2, которые приведены в таблице 2. Таблица 2 Значения фармакинетических параметров для с7ЕЗ Fab (*) Параметр Отдельные собранные образцы мочи анализируют на наличие свободного 7ЕЗ Fab, используя слегка видоизмененную методику проведения твердофазного иммуноферментативного анализа, рассмотренную ранее. Во всех случаях с7ЕЗ Fab в моче не обнаружено. Преклиническая токсикология. Изучение преклинической токсикологии проводят у 18 обезьян (Cyonomolgus и Rhesus), используя химерные 7ЕЗ Fab. Назначают дозу болюса до 0,6 мг/кг с последующим вливанием в количестве до 0,8 мкг/кг/мин в течение 96 час (включает исследования с гепарином, аспирином и рекомбинантным тканевым активатором плазминогена). У всех обезьян для всех доз и для всех комбинаций антитело 7ЕЗ является безопасными и легко переносится, при этом не наблюдается вызываемых кровотечением осложнений или других вредных эффектов. Эскалация дозы химерного 7ЕЗ Fab у пациентов со стой кой стенокардией. Изучение эскалации дозы проводят, выбрав 52 пациентов, страдающих от стойкой стенокардии (мужчины в возрасте от 43 до 75 лет), которым антитромбоцитарная терапия не назначалась в течение более 10 дней. Назначают различные режимы дозировок. Пациенты получают либо единичные внутривенные дозы болюса в количестве от 0,15 до 0,25 мг/кг химерного 7ЕЗ Fab (20 пациентов) или им назначают болюс с последующим непре-рывнным внутривенным вливанием (10 мкг/мин) в течение от 12 до 96 час (32 пациента). Блокаду рецептора GPIIb/IIIa, агрегацию тромбоцитов в ответ на действие 20 мкМ АДФ (агонист) и времена кровотечения определяют через 2 час после назначения дозы с7ЕЗ Fab в виде болюса (0,15-0,30 мг/кг). Блокаду рецептора и агрегацию тромбоцитов в ответ на действие агониста определяют в соответствии с известной методикой (Н.К. Gold et al., J. Clin. Invest. 86; 651-659 (1990)). Времена кровотечения определяют по методу Simplate. С увеличением дозы наблюдается прогрессирующее усиление блокады рецептора, на что указывает выраженное в процентах количество блокированных рецепто ров (определяют по доступности мест связывания рецептора). Усиление блокады рецептора сопровождается подавлением агрегации тромбоцитов определяется как процент от значения до введения лекарства или от базового значения) и увели чением времени кровотечения. Пиковое значение для всех трех параметров наблюдается для дозы 0,25 мг/кг. Эта доза соответствуе т концентрации в плазме, равной 5 мкг/мл - концентрации, при которой слабое ингибирование наблюдается в обогащенном тромбоцитами образце плазмы, полученном от здорового субъекта, который выдерживают в ин кубаторе в течение 15 минут в кювете агрегометра в присутствии возрастающих концентраций хи мерного 7ЕЗ Fab. (Степень агрегации плазмы здорового субъекта определяют как выраженное в процентах количество све та, прошедшего через кювету. Перед назначением агониста плазма является относительно непрозрачной и процент прошедшего света выбирают за ноль. После добавления в Значение Сlр (пропорции/час) 15,6 Vd (L) 6,8 t1/2 (час) 0,1 (6 мин) (*) Для соответствия получен ных данных применяют линейную модель со случайными эффектами Clp = Величина очищения плазмы определяется как скорость уменьшения концентрации в плазме, деленная на концентрацию, и выражается как скорость в час, т.е. если скорость в данное время остается неизменной в течение часа, то вычисленное значение будет пропорционально количеству лекарства, которое удаляется в течение этого ча са. Vd = Объем распределения определяется как назначенная доза, которую де лят на измеренную концентрацию в плазме, умноженную на объем плазмы. Для проведения расчетов используют объем плазмы 3 л, типичный для человека с массой 70 кг. t1/2 = Полупе риод очищения Пробы мочи у людей. Образцы мочи собирают у трех пациентов, страдающих от стойких заболеваний коронарной арте рии, которым внутривенно вводят 0,25 мг/кг с7ЕЗ Fab (данные по очищению плазмы для этих же трех пациентов приведены ранее). Общий диурез отбирают через следующие промежутки времени после инъекции: от 0 до 2 час, от 2 до 6 час, от 6 до 12 час и от 12 час до 24 час. Кроме того берут также образец мочи до назначения дозы. 14 37249 контрольный образец, не содержащий антитела, агониста АДФ све топропускание прогрессивно увели чивается по мере развития агрегации. Однако если присутствует с7ЕЗ Fab, то наблюдается зависимое от дозы подавление агрегации и полное ингибирование наблюдается при концентрации 5 мкг/мл с7ЕЗ Fab). Определяют продолжительность действия с точки зрения блокады рецептора, подавления агрегации тромбоцитов и времени кровотечения. Пиковое значение воздействия на блокаду рецептора, агрегацию тромбоцитов и время кровотечения наблюдается через 2 час, а затем медленно ослабевает. Времена кровотечения возвращаются к близкому к нормальному значению через 6-12 час. Поскольку пиковое значение блокады рецепторов и функционального ингибирования достигаются при дозе 0,25 мг/кг, исследуют дли тельность подавления тромбоцитов в те чение продолжительного вли вания, которое проводят после назначения этой дозы, с целью определить, можно ли увеличить длительность подавления тромбоцитов. Степень блокады рецептора, степень подавления агрегации тромбоцитов и увеличение времени кровотечения поддерживают в течение продолжительного вливания пяти пациентам, которые получают по 10 мкг/мин химерного 7ЕЗ Fab в течение 72 час после первоначальной дозы 0,25 мг/кг. Восста новление начинается сразу же после того, как вливание прекращают. Аналогичные результаты наблюдаются после вливаний в течение 12, 24 и 96 час. Ни у одного из пациентов не отмечена аллергическая реакция. Не наблюдается серьезных тенденций, вызываемых лечением, в гематологии или в значениях, полученных в хи мической лаборатории. Не наблюдается также каких-либо серьезных случаев кровотечения. Незначительные случае кровотечения являются редкими и включают временное умеренное кровотечение из носа и умеренное выделение крови из десен у больных, страдающи х пе риодонтальными заболеваниями. Результаты испытаний показывают, что хи мерные 7ЕЗ Fab можно назначать пациентам, используя режимы дозировки, которые приводят к глубокому подавлению функций тромбоцитов вплоть до нескольких дней. Данные по иммуногенности. При проведении испытаний с муриновыми 7ЕЗ F(ab') и Fab 150 пациентов) иммунные ответные реакции, которые определяют с помощью чувствительного иммуноферментного анализа, возникают у 16% (24/150) пациентов. Все реакции имеют низкий титр, обычно в интервале от 1:50 до 1:200. Подвергавшаяся обработке группа включает здоровых добровольцев, которым вводят дозы 0,01 - 0,25 мг/кг муринового 7ЕЗ F(ab')2, па циентов, страдающи х неустойчивой стенокардией, которым вводят 0,05 - 0,20 мг/кг муринового 73 F(ab')2, и пациентов, подвергавши хся чрескожной чресполостной реконструкции коронарной артерии, которым назначают 0,1 мг/кг муринового 7ЕЗ F(ab') или 0,15 - 0,35 мг/кг муринового Fab, а также пациентов, страдающи х от стойкой стенокардии, которым с помощью внутривенной инъекции вводят, единичную до зу в ви де болюса с дозой 0,10 0,30 мг/кг муринового 7ЕЗ Fab, и либо единичную дозу болюса в количестве 0,25 мг/кг или 0,30 мг/кг с последующим продолжительным вливанием в течение 12-36 час (0,15 мкг/кг/мин или 10 мкг/мин) муринового Fab либо две инъекции муринового Fab с интервалом в шесть часов (единичный болюс 0,2 мг/кг - 0,30 мг/кг, а затем болюс 0,05 мг/кг). Иммуногенность значительно снижается для хи мерного 7ЕЗ Fab человек - мышь. Ни у одного из 52 пациентов, страдающи х от стойкой стенокардии, которые были отобраны для проведения исследований с эскалацией дозы и которым вводили хи мерные 7ЕЗ Fab (см. выше), не обнаружено иммунной ответной реакции в процессе лечения, что определяют с помощью аналогичного анализа, который пригоден для хи мерного Fab. Обратимость антитромбоцитарной активности. Хи мерный 7ЕЗ Fab (g1, к) медленно отделяется от тромбоцитов, а свободный химерный 7ЕЗ Fab быстро вымывается из плазмы при циркуляции (см. ранее). Таким образом, антитромбоцитарное воздействие хи мерного 7ЕЗ является заметно обратимым при назначении тромбоцитов от случайного донора. Это обратимое или антидотное воздействие при переливании тромбоцитов показано для двух пациентов, которым назначали либо муриновое Fab либо химерное Fab и которым вводят тромбоциты от случайного донора в то время, когда подавление агрегации тромбоцитов у эти х пациентов практи чески закончилось. Восстановление функции тромбоцитов определяют, измеряя времена кровоте чения. Свойство обратимости полезно в те х случаях, когда вследствие кровотечения возникает необхо димость восстановления функций тромбоцитов у пациента. Пример 4. Использование химерного антитела 7ЕЗ для предотвращения тромботических осложнений при избирательной пластической операции на коронарной артерии Чрескожная чресполостная реконструкция коронарной артерии, например, методом баллонной или коронарной атеректомии является эффективным способом увеличения просве та подверженных сте нозу коронарных артерий. Для этой операции существует риск острой закупорки коронарной артерии как в процессе ее проведения, так и после пластической операции на сосуда х. Сообщается, что уровень коронарной окклюзии варьирует приблизительно от 3 до 6% от общего количества случаев проведения избирательной пластической операции на сосуда х (К.М. Detre et ak., Circulation 82: 739-750 (1991)) и она является основной причиной осложнений и смертности при госпитализации. У пациентов, вхо дящих в гр уппу с высоким риском, частота возникновения основных сердечно-сосудистых случаев, вы зываемых тромбозом, составляет 10-20%. Острая коронарная окклюзия в процессе или сразу же после проведения пластической операции на коронарной артерии, видимо, вызывается комбинацией глубокого поражения стенок артерии, в результате чего возникает частичная закупорка "лоскутами инти мы", на которую накладывается процесс формирования тромба, или просто формированием тромба в месте пораже 15 37249 ния стенки сосуда. В моделях животных повторной закупорке после успешного тромболиза предшествуют периоды циклического сокращения и восстановления тока крови через коронарную артерию, которые получи ли название "циклических изменений тока крови". Указанные циклические изменения тока крови представляют собой феномен, практически полностью управляемый тромбоцитами, и возникают вследствие повто ряющего ся накопления и смещения агрегации тромбоцитов в местах воз никновения коронарного сте ноза и поражения эндотелия. Описа ны случаи циклических изменений тока крови у людей после проведе ния пластических операций на коронарных арте риях. Химерное анти тело 7ЕЗ можно использовать для подавления функции тромбоцитов во время проведения пластической операции на сосуда х и тем са мым предотвращать агрегацию тромбоцитов и тромбоз. Хи мерное антитело 7ЕЗ особенно полезно для пациентов, подверженных значитель ному риску развития тромботических закупорок. Этих па циентов можно определить на основе анатомических (в частности, по характе ру поражений в месте возникновения сте ноза, которые наблюдают с помощью ангиографии) или клинических факто ров риска (в частности, ин фаркта миокарда, не устойчивой стенокардии, диабета, женщин в возрасте 65 лет и старше), которые создают предрасположенность к острому коронарному тромбозу и вызывают клинические синдромы острого инфаркта миокарда, нестойкой стенокардии или внезапной закупорки кровеносного со суда . Хи мерное антитромбоцитарное анти тело при избирательной чрескожной чресполостной реконструкции коронарной артерии. Испытание проводят в две стадии. Главной целью первой стадии является определение безопасной и оптимальной дозы химерного 7ЕЗ Fab для пациентов, которым предстоит провести избирательную чрескожную чресполостную реконструкцию коронарной артерии. Вто рую ста дию поводят с целью предварительно оценить безопасность и эффек тивность химерного 7ЕЗ (с 7ЕЗ) при назначении инъекции болюса с последующим различным по длительности вли ванием. Изуче нию на вто рой стадии подвергают па циентов, которым проведена избирательная реконструкция коронарной артерии и которые подвержены значительному риску возникновения ишемических осложнений. Пациенты, вхо дящие в гр уппу с вы соким риском, включают пациентов с неустойчивой сте нокардией или стойкими заболеваниями коронарных ар терий со специфическими поражениями типа В и С. В таблице 3 приведе ны критерии определения пациентов, входящи х в гр уп пу повышенного риска, а в таблице 4 приведены типичные для поражений характеристи ки, которые определяют методом ангиографии. Первичную эффективность определяют как подавление функ ций тромбоцитов и предотвращение возникновения тромботических осложнений. Для проведе ния обеих стадия испытания можно выбирать мужчин в воз расте о т 18 до 76 лет и не способных к де торождению женщин в возрасте от 18 до 76 ле т. Критерии отбора пациентов, подверженных значительному риску возникновения ишемических осложнений Таблица 3 Умеренно высокий риск: 1) Неустойчивая стенокардия при отсутствии специфичных для поражения характеристик 2) Стеноз, характеризующийся наличием одного специфичного поражения типа В 1) Стеноз, характеризующийся не менее, чем двумя специфичными поражениями типа В 2) Неустойчивая стенокардия, которая сопровождается стенозом, характеризующимся наличием по крайней мере одного специфичного поражения типа В 3) Сахар ный диабет, который сопровождается стенозом, характеризующимся наличием по крайней мере одного специфичного поражения типа В 4) Женщи ны в возрасте не менее 65 лет со стенозом, характеризующимся наличием по крайней мере одного специфичного поражения типа В 5) Стеноз, характеризующийся наличием по крайней мере одного специфичного поражения типа С Самый высокий риск: Специфические признаки поражений Таблица 4 Поражения типа А (высокий уровень успеха, >85%; малый риск) - Дискретные (
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for inhibiting stenosis and/or restenosis (variants), method for inhibiting restenosis upon surgery of coronary artery (variants), method for decreasing risk of non-acute ischemic complication upon reconstructive vascular surgery
Автори англійськоюColler Barry C.
Назва патенту російськоюСпособ ингибирования стеноза и/или рестеноза (варианты), способ ингибирования рестеноза после проведения операции на коронарной артерии (варианты), способ снижения вероятности возникновения или предотвращения неострых ишемических осложнений при ангиопластике у человека
Автори російськоюКоллер Барри С.
МПК / Мітки
МПК: A61P 9/00, A61K 39/395, C12N 15/09, C12P 21/08, C07K 16/28, C07K 16/46
Мітки: операції, коронарній, людини, артерії, інгібування, виникнення, проведення, ймовірності, варіанти, стенозу, запобігання, рестенозу, зниження, спосіб
Код посилання
<a href="https://ua.patents.su/58-37249-sposib-ingibuvannya-stenozu-ta-abo-restenozu-varianti-sposib-ingibuvannya-restenozu-pislya-provedennya-operaci-na-koronarnijj-arteri-u-lyudini-varianti-sposib-znizhennya-jjmovirnos.html" target="_blank" rel="follow" title="База патентів України">Спосіб інгібування стенозу та/або рестенозу (варіанти), спосіб інгібування рестенозу після проведення операції на коронарній артерії у людини (варіанти), спосіб зниження ймовірності виникнення чи запобігання не</a>
Попередній патент: Спосіб виготовлення ікри чорної зернистої з натуральних продуктів “фіто лп-4-б”
Наступний патент: Антибактеріальний засіб для місцевого застосування
Випадковий патент: Спосіб поширення реклами через мобільний зв'язок (rbt) "альтернативний гудок"