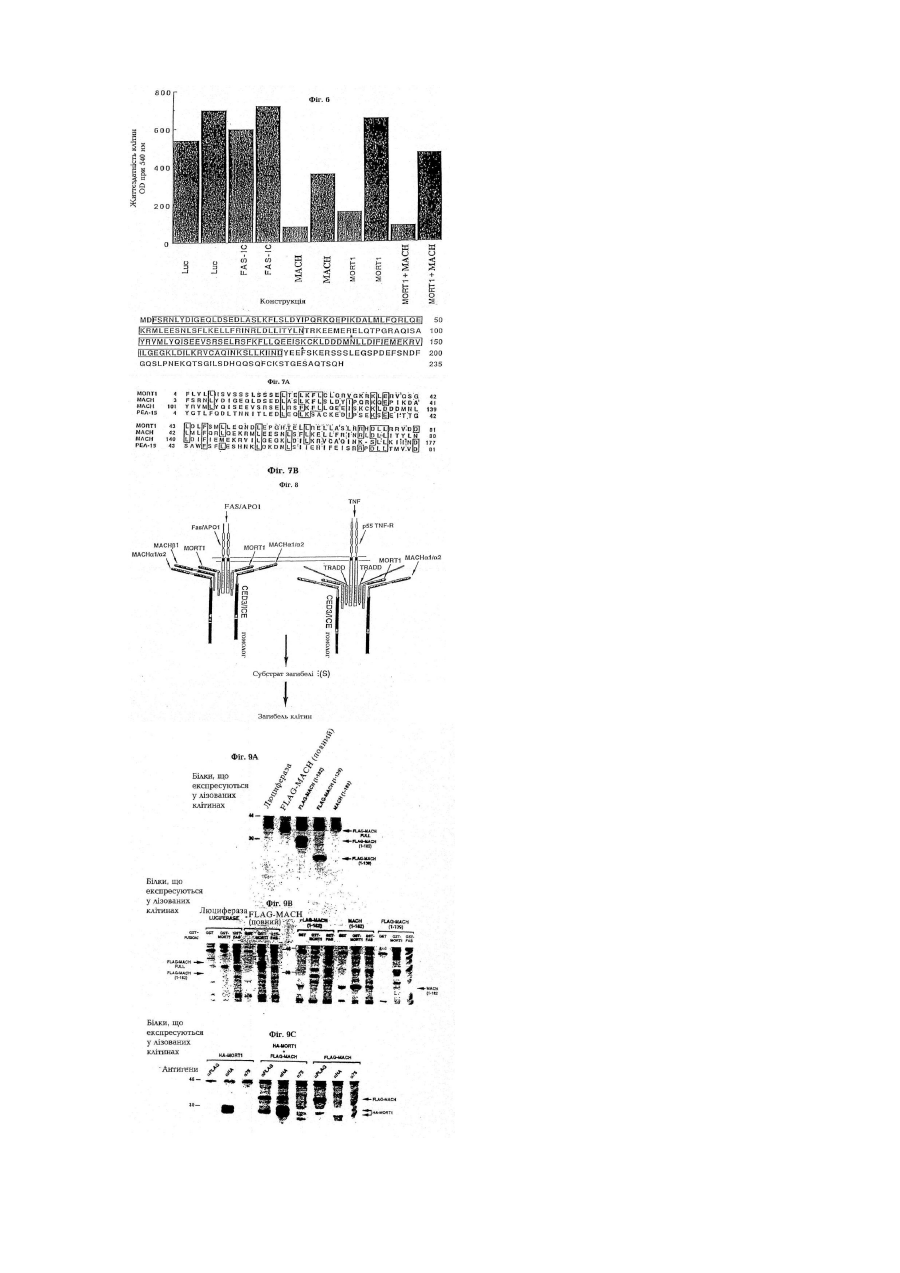
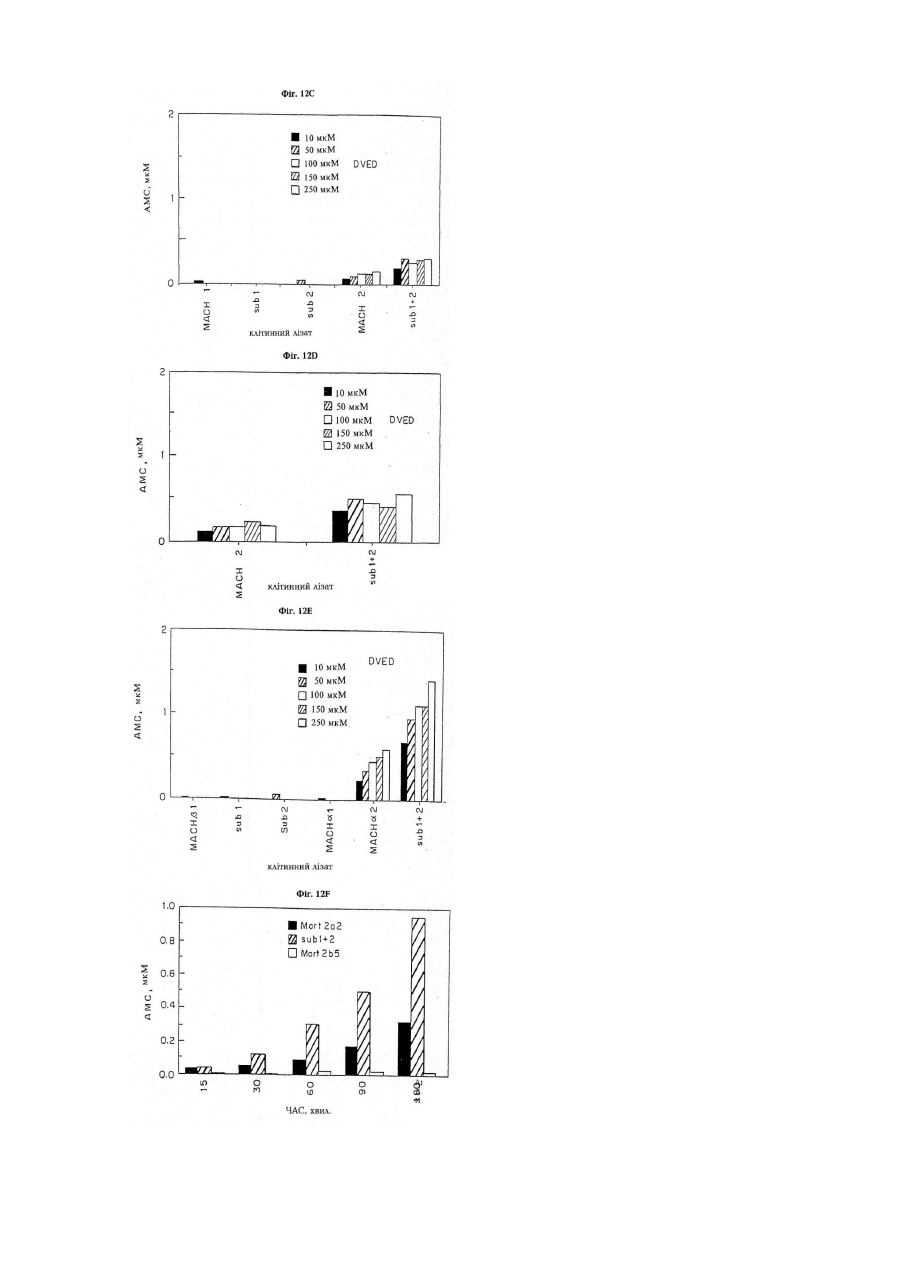
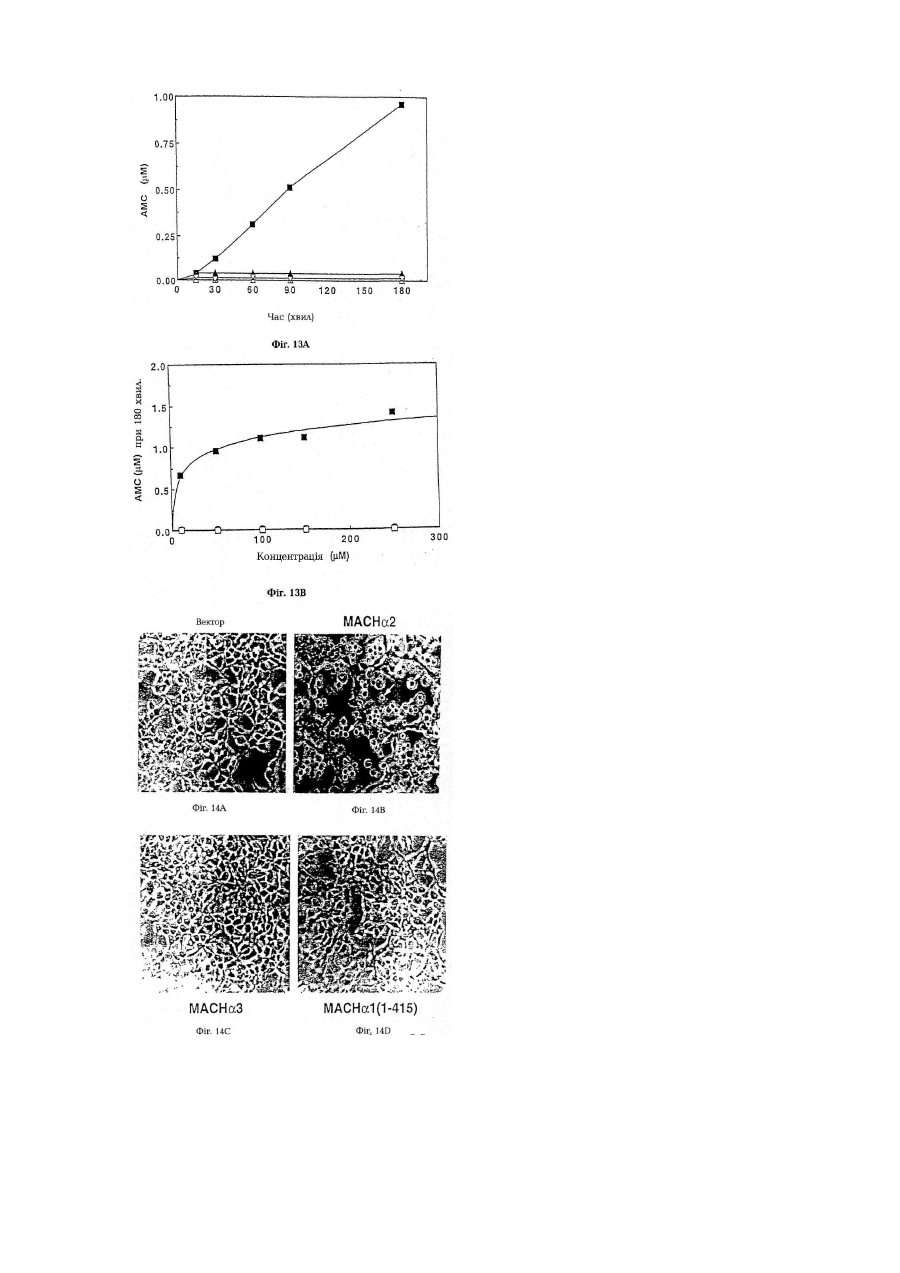
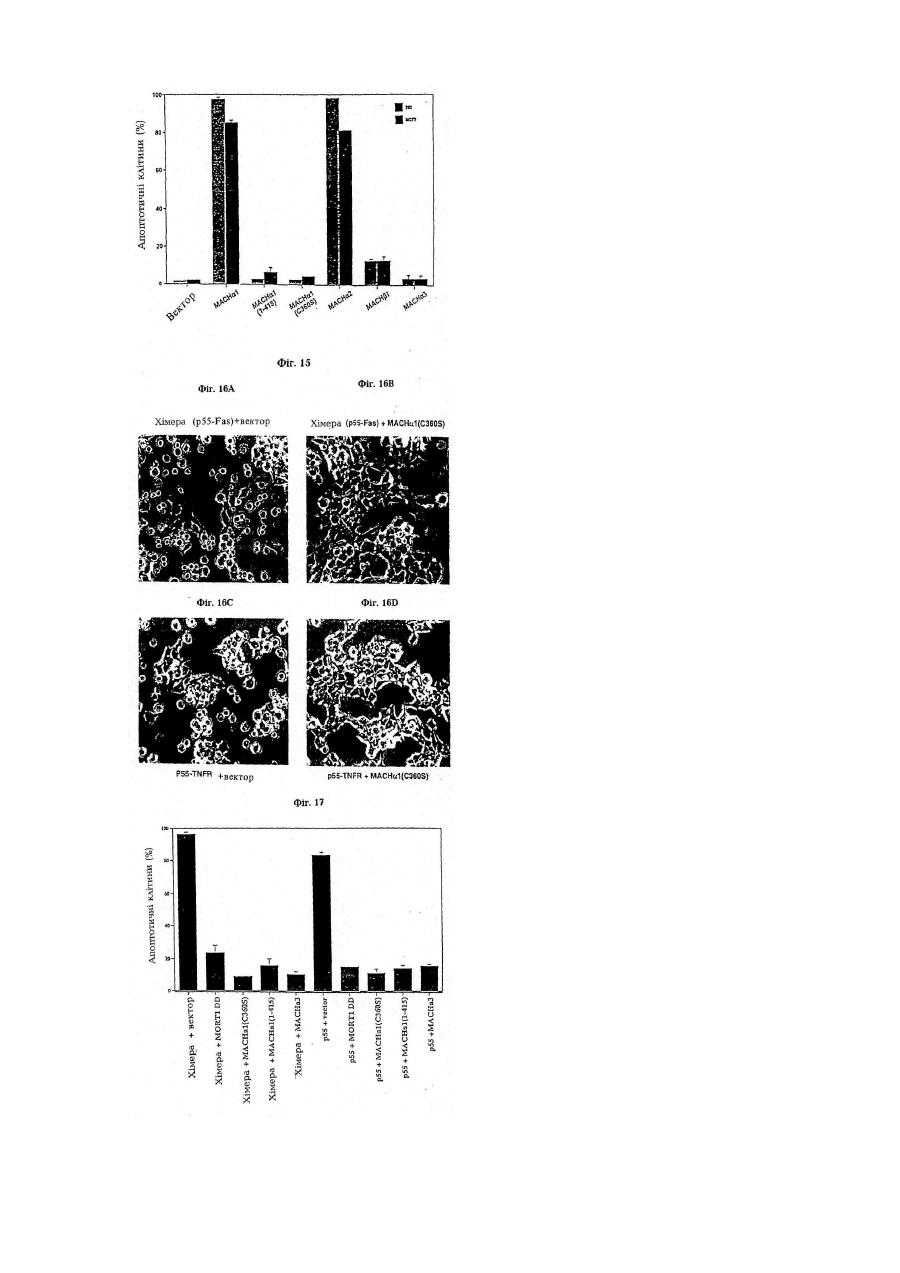
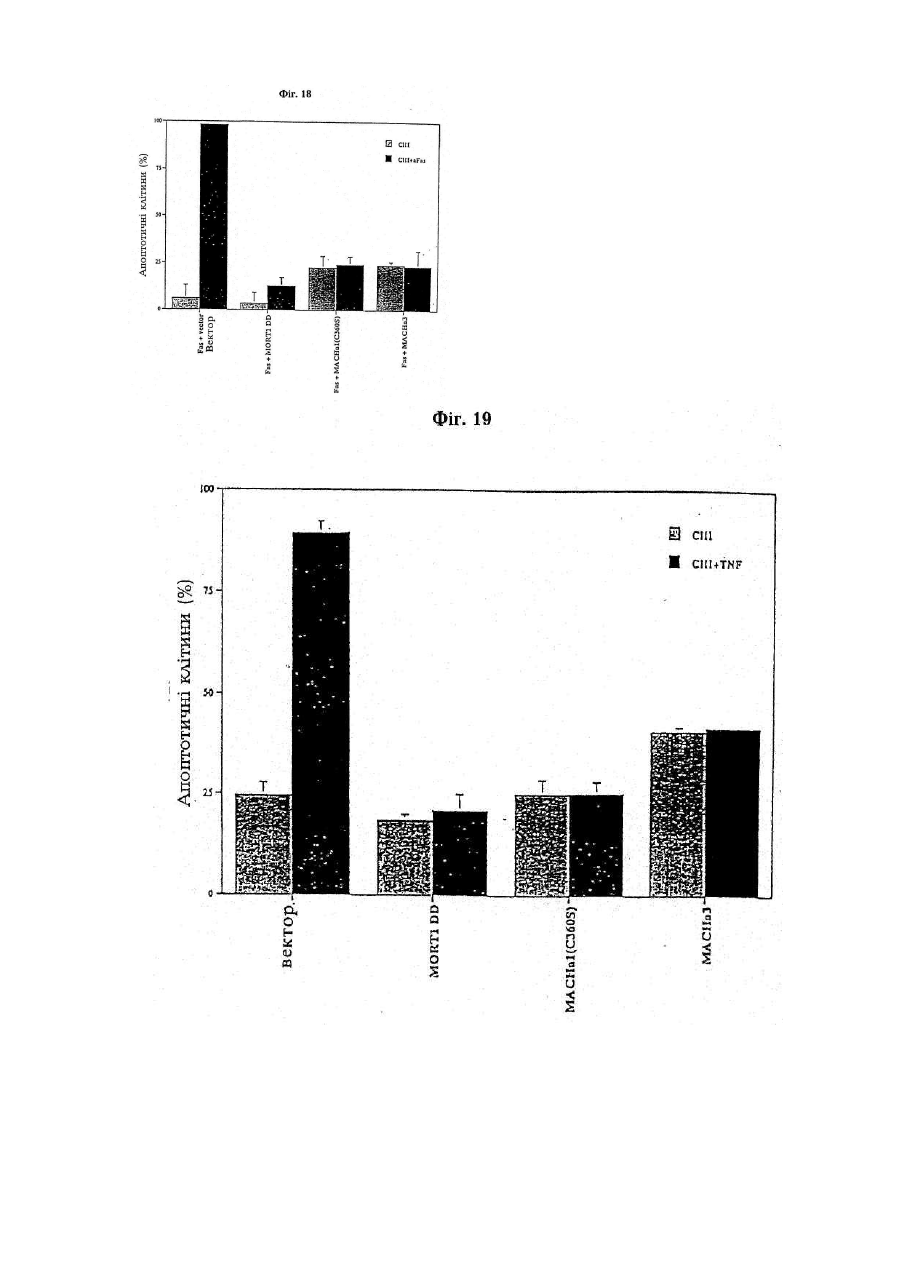
Послідовність днк, що кодує поліпептид, який зв’язується з mort-1 (варіанти), вектор експресії, що включає послідовність днк, клітина- хазяїн, виділений поліпептид та фармацевтична композиція, що містить поліп
Номер патенту: 72423
Опубліковано: 15.03.2005
Автори: Болдін Марк, Воллах Девід, Гольцев Юрій, Гончаров Таня
Формула / Реферат
1. Послідовність ДНК, що кодує поліпептид, який зв'язується з MORT-1, де MORT-1 є білком, який зв'язується з внутрішньоклітинним доменом FAS-R, і який зв'язується з білком TRADD, який зв'язується з внутрішньоклітинним доменом p55-TNF-R, де зазначений поліпептид має:
a) послідовність, що містить залишки 1-182 послідовності SEQ ID №5;
b) послідовність, що містить фрагмент а), де фрагмент зв'язується з MORT-1;
c) послідовність, що містить аналог а) або b), що має не більше ніж десять замін в амінокислотній послідовності а) або b), де кожна зазначена заміна є заміщенням, делецією або інсерцією амінокислоти, де аналог зв'язується з MORT-1 і впливає на внутрішньоклітинний процес передачі сигналу, що ініціюється зв'язуванням FAS ліганду з його рецептором або зв'язуванням TNF з p55-TNF-R; або
d) похідна а), b) або с), яка зв'язується з MORT-1 і впливає на внутрішньоклітинний процес передачі сигналу, що ініціюється зв'язуванням FAS ліганду з його рецептором або зв'язуванням TNF з p55-TNF-R.
2. Послідовність ДНК за п.1, де поліпептид за підпунктом а) пункту 1 представляє нативний білок, який зв'язується з MORT-1.
3. Послідовність ДНК за п.2, що кодує нативний білок, який зв'язується з MORT-1.
4. Послідовність ДНК за п.1, де поліпептид за підпунктом а) пункту 1 є ізоформою білка MACH, вибраною з групи, що включає MACHα1 (SEQ ID NO:7), MACHα2 (SEQ ID NO:18), MACHα3 (SEQ ID NO:20), MACHβ1 (SEQ ID NO:5), MACHβ2 (SEQ ID NO:22), MACHβ3 (SEQ ID NO:8), MACHβ4 (SEQ ID NO:25) і MACHβ5 (SEQ ID NO:34).
5. Послідовність ДНК за п.4, де зазначена ізоформа білка MACH є MACHα1 (SEQ ID NO:7), MACHβ1 (SEQ ID NO:5) або MACHβ3 (SEQ ID NO:8).
6. Послідовність ДНК за п.4, де зазначена ізоформа білка MACH є MACHα1 (SEQ ID NO:7).
7. Послідовність ДНК за п.4, де зазначена ізоформа білка MACH є MACHβ1 (SEQ ID NO:5).
8. Послідовність ДНК за п.4, де зазначена ізоформа білка MACH є MACHβ3 (SEQ ID NO:8).
9. Послідовність ДНК за п.4, що кодує ізоформу білка MACH, вибрану з групи, що складається з MACHα1, MACHα2, MACHα3, MACHβ1, MACHβ2, MACHβ3, MACHβ4 і MACHβ5.
10. Послідовність ДНК за п.9, де зазначена ізоформа білка MACH є MACHα1, MACHβ1 або MACHβ3.
11. Послідовність ДНК за п.9, де зазначена ізоформа білка MACH є MACHα1.
12. Послідовність ДНК за п.9, де зазначена ізоформа білка MACH є MACHβ1.
13. Послідовність ДНК за п.9, де зазначена ізоформа білка MACH є MACHβ3.
14. Вектор експресії , що включає регуляторну послідовність, оперативно пов’язану з послідовністю ДНК за п.1.
15. Вектор експресії за п.14, здатний експресуватися в еукаріотичній клітині-хазяїні.
16. Вектор експресії за п.14, здатний експресуватися в прокаріотичній клітині-хазяїні.
17. Клітина-хазяїн, що містить вектор експресії за п.14, та є еукаріотичною або прокаріотичною.
18. Спосіб одержання поліпептиду, який зв'язується з MORT-1, що включає вирощування трансформованих клітин-хазяїв за п.17, в умовах, придатних для експресії зазначеного поліпептиду і виділення експресованого поліпептиду.
19. Послідовність ДНК, що кодує поліпептид, який зв'язується з MORT-1, де MORT-1 є білком, який зв'язується з внутрішньоклітинним доменом FAS-R, і який зв'язується з білком TRADD, який зв'язується з внутрішньоклітинним доменом p55-TNF-R, причому поліпептид впливає на внутрішньоклітинний процес передачі сигналу, що ініціюється зв'язуванням FAS ліганду з його рецептором або зв'язуванням TNF з p55-TNF-R, де зазначений поліпептид має:
a) послідовність, що містить залишки 1-182 і 221-479 послідовності SEQ ID №7;
b) послідовність, що містить фрагмент а), де фрагмент зв'язується з MORT-1 і впливає на внутрішньоклітинний процес передачі сигналу, що ініціюється зв'язуванням FAS ліганду з його рецептором або зв'язуванням TNF з p55-TNF-R;
c) послідовність, що містить аналог а) або b), що має не більше ніж десять замін в амінокислотній послідовності а) або b), де кожна зазначена заміна є заміщенням, делецією або інсерцією амінокислоти, де аналог зв'язується з MORT-1 і впливає на внутрішньоклітинний процес передачі сигналу, що ініціюється зв'язуванням FAS ліганду з його рецептором або зв'язуванням TNF з p55-TNF-R; або
d) похідна а), b) або с), яка зв'язується з MORT-1 і впливає на внутрішньоклітинний процес передачі сигналу, що ініціюється зв'язуванням FAS ліганду з його рецептором або зв'язуванням TNF з p55-TNF-R.
20. Послідовність ДНК за п.19, де поліпептид за підпунктом а) пункту 19 є нативним білком, який зв'язується з MORT-1 і впливає на внутрішньоклітинний процес передачі сигналу, що ініціюється зв'язуванням FAS ліганду з його рецептором або зв'язуванням TNF з р55-TNF-R.
21. Послідовність ДНК за п.19, де поліпептид за підпунктом а) пункту 19 є ізоформою білка MACH, вибраної з групи, що складається з MACHα1 (SEQ ID NO:7) і MACHα2 (SEQ ID NO:18).
22. Послідовність ДНК за п.19, що кодує нативний білок, який зв'язується з MORT-1 і впливає на внутрішньоклітинний процес передачі сигналу, що ініціюється зв'язуванням FAS ліганду з його рецептором або зв'язуванням TNF з p55-TNF-R.
23. Послідовність ДНК за п.22, що кодує ізоформу білка MACH, вибрану з групи, яка складається з MACHα1 (SEQ ID NO:7) і MACHα2 (SEQ ID NO:18).
24. Виділений поліпептид, який зв'язується з MORT-1, де зазначений поліпептид має послідовність, що включає:
a) залишки 1-182 послідовності SEQ ID №5;
b) аналог а), який відрізняється не більше ніж десятьма амінокислотними замінами в його амінокислотному ланцюзі, де кожна зазначена заміна є заміщенням, делецією і/або інсерцією одної амінокислоти, де аналог зв'язується з білком MORT-1;
c) фрагмент а) або b), де фрагмент зв'язується з білком MORT-1; або
d) похідна а), b) або с), за рахунок модифікації функціональних груп бічного ланцюга або N- або С- термінальних груп одного або більше амінокислотних залишків, без заміни одної амінокислоти на іншу з двадцяти природних амінокислот, що звичайно зустрічаються, де похідна зв'язується з білком MORT-1.
25. Виділений поліпептид за п.24, де зазначена послідовність за підпунктом а) пункту 24 є ізоформою білка MACH, вибраною з групи, що складається з MACHα1 (SEQ ID NO:7), MACHα2 (SEQ ID NO:18), MACHα3 (SEQ ID NO:20), MACHβ1 (SEQ ID NO:5), MACHβ2 (SEQ ID NO:22), MACHβ3 (SEQ ID NO:8), MACHβ4 (SEQ ID NO:25) і MACHβ5 (SEQ ID NO:34).
26. Виділений поліпептид за п.24, де зазначена послідовність за підпунктом а) пункту 24 є MACHα1 (SEQ ID NO:7), MACHβ1 (SEQ ID NO:5) або MACHβ3 (SEQ ID NO:8).
27. Виділений поліпептид за п.24, де зазначена послідовність за підпунктом а) пункту 24 є MACHα1 (SEQ ID NO:7).
28. Виділений поліпептид за п.24, де зазначена послідовність за підпунктом а) пункту 24 є MACHβ1 (SEQ ID NO:5).
29. Виділений поліпептид за п.24, де зазначена послідовність за підпунктом а) пункту 24 є MACHβ3 (SEQ ID NO:8).
30. Виділений поліпептид, який має послідовність, що відповідає підпункту а) пункту 24.
31. Виділений поліпептид, який має послідовність, що відповідає підпункту b) пункту 24.
32. Виділений поліпептид, який має послідовність, що відповідає підпункту с) пункту 24.
33. Виділений поліпептид за п.24, де зазначений аналог за підпунктом b) пункту 24, відрізняється від поліпептиду за підпунктом а) пункту 24 не більше ніж п'ятьма амінокислотними замінами.
34. Виділений поліпептид за п.24, де зазначений аналог за підпунктом b) пункту 24, відрізняється від поліпептиду за підпунктом а) пункту 24 не більше ніж трьома амінокислотними замінами.
35. Виділений поліпептид, який має послідовність, що містить фрагмент поліпептиду за підпунктом а) пункту 24, де фрагмент зв'язується з білком MORT-1.
36. Фармацевтична композиція, що містить фармацевтично прийнятний носій і поліпептид, який зв'язується з білком MORT-1, де поліпептид має послідовність, що включає:
a) залишки 1-182 послідовності SEQ ID №5;
b) аналог а), який відрізняється не більше ніж десятьма амінокислотними замінами в його амінокислотному ланцюзі, де кожна зазначена заміна є заміщенням, делецією і/або інсерцією одної амінокислоти, де аналог зв'язується з білком MORT-1;
c) фрагмент а) або b), де фрагмент зв'язується з білком MORT-1; або
d) похідна а), b) або с), за рахунок модифікації функціональних груп бічного ланцюга або N- або С- термінальних груп одного або більше амінокислотних залишків, без заміни одної амінокислоти на іншу з двадцяти природних амінокислот, що звичайно зустрічаються, де похідна зв'язується з білком MORT-1.
37. Фармацевтична композиція за п.36, де зазначена послідовність за підпунктом а) пункту 36 є ізоформою білка MACH, вибраною з групи, що складається з MACHα1 (SEQ ID NO:7), MACHα2 (SEQ ID NO:18), MACHα3 (SEQ ID NO:20), MACHβ1 (SEQ ID NO:5), MACHβ2 (SEQ ID NO:22), MACHβ3 (SEQ ID NO:8), MACHβ4 (SEQ ID NO:25) і MACHβ5 (SEQ ID NO:34).
38. Фармацевтична композиція за п.36, де зазначена послідовність за підпунктом а) пункту 36 є MACHα1 (SEQ ID NO:7), MACHβ1 (SEQ ID NO:5) або MACHβ3 (SEQ ID NO:8).
39. Фармацевтична композиція за п.36, де зазначена послідовність за підпунктом а) пункту 36 є MACHα1 (SEQ ID NO:7).
40. Фармацевтична композиція за п.36, де зазначена послідовність за підпунктом а) пункту 36 є MACHβ1 (SEQ ID NO:5).
41. Фармацевтична композиція за п.36, де зазначена послідовність за підпунктом а) пункту 36 є MACHβ3 (SEQ ID NO:8).
42. Фармацевтична композиція за п.36, де зазначений поліпептид має послідовність за підпунктом а) пункту 36.
43. Фармацевтична композиція за п.36, де зазначений поліпептид має послідовність за підпунктом b) пункту 36.
44. Фармацевтична композиція за п.36, де зазначений поліпептид має послідовність за підпунктом с) пункту 36.
45. Фармацевтична композиція за п.36, де зазначений аналог за підпунктом b) пункту 36, відрізняється від поліпептиду за підпунктом а) пункту 36 не більше ніж п'ятьма амінокислотними замінами.
46. Фармацевтична композиція за п.36, де зазначений аналог за підпунктом b) пункту 36, відрізняється від поліпептиду за підпунктом а) пункту 36 не більше ніж трьома амінокислотними замінами.
47. Фармацевтична композиція за п.36, де зазначений поліпептид, має послідовність, що містить фрагмент поліпептиду за підпунктом а) пункту 36, де фрагмент зв'язується з білком MORT-1.
Текст
Галузь винаходу Цей винахід взагалі стосується галузі рецепторів, які належать до суперродини рецепторів TNF/NGF, та регуляції їхніх біологічних функцій. TNF/NGF-суперродина рецепторів містить такі рецептори, як р55- і р75рецептори фактора некрозу пухлин (TMF-R, які надалі матимуть назву p55-R і p75-R) та рецептор FAS-ліганду (який також називатиметься FAS/APО1) або FAS-R (надалі FAS-R) та інші. Конкретніше, цей винахід стосується нових білків, які зв'язуються з білком MORT-1 (або FADD), зокрема, стосується одного з таких MORT-1-зв'язуючих білків, який тут має назву МАСН. Таким чином, взагалі, цей винахід стосується нових білків, здатних модулювати або медіювати функцію MORT-1, або інших білків, які просто або опосередковано зв'язуються з MORT-1. Зокрема, цей винахід стосується МАСН, його отримання та застосування, а також різних нових ізоформ МАСН, їх отримання та застосування. Передумови спорідненої галузі знань Фактор некрозу пухлин (TNF-a) та Лімфотоксин (TNF-b) (надалі TNF стосуватиметься як TNF-a, так і TNFb) є мультифункціонапьними про-запальними цитокінами, які утворюються здебільшого мононуклеарними фагоцитами, що мають значний вплив на клітини (Wallach, D. (1986) in: Interferon 7 (Ion Gresser, ed.), pp.83122, Academic Press, London; і Beutier and Cerami (1987)). Як TNF-a, так і TNF-b ініціюють свої ефекти зв'язуванням зі специфічними рецепторами поверхні клітини. Деякі з цих ефектів, ймовірно, є сприятливими для організму: наприклад, вони можуть руйнувати пухлинні або інфіковані вірусом клітини та збільшувати протибактеріальну активність гранулоцитів. У такий спосіб TNF сприяє захистові організму проти пухлин та інфекційних агентів, допомагає видужати в разі пошкодження. Отже, TNF можна використовувати як протипухлинний агент, який під час використання зв’язується з його рецепторами на поверхні пухлинних клітин, ініціюючи цим події, що призводять до загибелі пухлинних клітин. TNF також може використовуватися як протиінфекційний агент. Проте як TNF-a, так і TNF-b мають також несприятливий вплив. Існує доказ того, що надмірне продуціювання TNF-a може зіграти основну патогенну роль за деяких захворювань. Наприклад, відомо, що дія TNF-a, перш за все на судинну систему, є головною причиною симптомів септичного шоку (Тгасеу et аІ., 1986). За деяких захворювань TNF може спричиняти до зниження ваги (кахексії) через супресію активності адипоцитів та індуціювання анорексії, саме тому TNF-a дістав назви кахетину. Його також описано як медіатор пошкодження тканин при ревматичних захворюваннях (BeutІer and Cerami, (1987) і як основний медіатор пошкодження, що спостерігається при реакціях трансплантант-проти-господаря (Rguet et al., 1987). Окрім того, відомо, що TNF бере участь у запальному процесі та під час багатьох інших захворювань. Два різних, незалежно експресованих рецептори, TNF-R р55 і р75, які специфічно зв’язують як TNF-a, так і TNF-b, ініціюють і/або медіюють наведені вище біологічні ефекти TNF. Ці два рецептори мають структурно відмінні внутрішньоклітинні домени, що дозволяє передбачати різне передавання ними сигналу. (Дивись Hohmann et al., 1989; Engelmann et al., 1990; Brockhaus et al., 1990; Leotscher et aІ., 1990; Schall et al., 1990; Nophar et al., 1990; Smith et at, 1990; Heller et al., 1990). Але клітинні механізми, наприклад, різні білки та, можливо, інші фактори, які беруть участь у внутрішньоклітинному передаванні сигналу TNF-R р55 і р75, поки що не виявлено. Саме це внутрішньоклітинне передавання сигналу, що зазвичай відбувається після зв'язування цього ліганду, тобто TNF (a або b), з рецептором, відповідає за початок каскаду реакцій, які врешті призводять до спостережуваного відгуку клітини на дію TNF. Щодо зазначеної вище дії TNF, яка спричиняє до загибелі клітин, у більшості з досі досліджених клітин цей ефект здебільшого запускається функцією TNF-R р55. Антитіла проти внутрішньоклітинного домену (лігандозв'язуючого домену) TNF-R р55 можуть самостійно запускати дію, що спричиняє до загибелі клітин (дивись патент ЕР 412486) та корелює з ефективністю перехресного зв'язування цими антитілами рецептора, що вважають першою стадією в генерації внутрішньоклітинного процесу передавання сигналу. Далі, мутаційні дослідження (Brakebusch et aІ., 1992; Tartaglia et al., 1993) довели, що біологічна функція TNF-R p55 залежить від цілісності його внутрішньоклітинного домену. На цій підставі було припущено, що ініціація внутрішньоклітинного передавання сигналу, який призводить до дії TNF, що спричиняє до загибелі клітин, виникає внаслідок асоціації двох чи більше внутрішньоклітинних доменів TNF-R р55. Окрім того, TNF (a і b) зустрічаються у вигляді гомотримера, тож було припущено, що як такий, він індукує внутрішньоклітинне передавання сигналу через TNF-R р55 завдяки його здатності зв'язуватися і перехресно реагувати з рецепторними молекулами, тобто викликати агрегацію рецептора. Іншим членом суперродини TNF/NGF-рецепторів в FAS-рецептор (FAS-R), який також має назву FASантигену, білок клітинної поверхні, здатний до експресії у різних тканинах, який має гомологію з низкою рецепторів клітинної поверхні, зокрема з TNF-R і NGF-R. FAS-R медіює загибель клітини у формі апоптозу (Itoh et al., 1991) і напевно є негативним селективним агентом аутореактивних Т-клітин, тобто впродовж визрівання Т-клітин, FAS-R медіює апоптопічну загибель Т-клітин, які розпізнають аутологічні антигени. Було також виявлено, що мутації в гені FAS-R (Ірr) спричиняють порушення лімфопроліферації у мишей, подібне до аутоімунного захворювання людини системною червоною волчанкою (SLE) (Watanabe-Fukunaga et al., 1992). Ліганд для FAS-R є, ймовірно, молекулою, пов’язаною з клітинною поверхнею, яку несуть серед інших, кілерні Т-клітини (або цитотоксичні Т-лімфоцити - CTL), і отже, коли такі CTL контактують із клітинами, які несуть FASR, вони здатні індукувати апоптопічну загибель несучих FAS-R клітин. Далі було одержано антитіла, специфічні для FAS-R, причому із здатністю індукувати апоптопічну загибель несучих FAS-R клітин, зокрема, мишачих клітин, трансформованих кДНК, яка кодує FAS-R людини (itoh et al., 1991). Хоча деякі цитотоксичні ефекти лімфоцитів медіюються взаємодією продукованого лімфоцитами ліганду з рецептором клітинної поверхні FAS-R (CD95), який часто зустрічається і має здатність запускати загибель клітин, було виявлено, що різні інші нормальні клітини, крім Т-лімфоцитів, експресують FAS-R на їхній поверхні і можуть загинути через запуск цього рецептора. Є підозра, що неконтрольована індукція такого процесу вбивання клітин сприяє руйнуванню тканин при деяких захворюваннях, наприклад, деструкції клітин печінки в разі гострого гепатиту. Тому виявлення шляхів стримування цитотоксичної активності FAS-R може мати терапевтичний потенціал. На противагу цьому, оскільки також було виявлено, що деякі злоякісні клітини і ВІЛ-інфіковані клітини несуть на своїй поверхні FAS-R, антитіла проти FAS-R або ліганду FAS-R можуть використовуватися для запуску медійованих FAS-R цитотоксичних ефектів у цих клітинах і отже забезпечити засіб боротьби з такими злоякісними або ВІЛ-інфікованими клітинами (дивись Itoh et al., 1991). Отже, винайдення інших шляхів підвищення цитотоксичної активності FAS-R, може мати також терапевтичну перспективу. Уже давно постала потреба у забезпеченні шляху модулювання клітинного відгуку на дію TNF (a або b) і ліганд FAS-R. Наприклад, у вищезгаданих патологічних ситуаціях, де відбувається надекспресїя TNF або ліганду FAS-R, бажано інгібування індукованих рецептором TNF або лігандом FAS-R ефектів, які спричиняють до загибелі клітин, хоча в інших ситуаціях, наприклад, при використанні під час загоєння ран, бажано посилення ефекту TNF, або у випадку FAS-R, в пухлинних або ВІЛ-інфікованих клітинах, бажано підсилення опосередкованого FAS-R ефекту. Лабораторією заявників було запроваджено низку підходів (дивись, наприклад, European Application №№ЕР186833, ЕР308378, ЕР398327 і ЕР412486) для регуляції згубних ефектів TNF, інгібуючи зв'язування TNF з його рецепторами за допомогою антитіл проти TNF або розчинних рецепторів TNF (які по суті є розчинними позаклітинними доменами цих рецепторів) для конкурування щодо зв’язування TNF зі зв'язаними із клітинною поверхнею TNF-R. Далі на підставі того, що зв’язування TNF з його рецепторами необхідне для індукованих TNF клітинних ефектів, лабораторією заявників (дивись, наприклад, ЕРО568925) було здійснено підходи для модулювання цього ефекту TNF через модулювання TNF-R. Коротко, в ЕРО568925 подано опис способу модулювання передавання сигналу і/або розщеплення TNF-R, внаслідок чого пептиди або інші молекули мають змогу взаємодіяти або з самим рецептором, або з ефекторними білками, які взаємодіють з рецептором, і в такий спосіб модулюють нормальну функцію TNF-R. В ЕРО568925 описано конструювання та характеристика різних мутантів рецепторів TNF, які мають мутації в позаклітинних, трансмембранних і внутрішньоклітинних доменах TNF-R р55. Отже, райони у вищезгаданих доменах TNF-R р55 було ідентифіковано як суттєві для функцйовання цього рецептора, тобто зв'язування ліганду (TNF), подальшого передавання сигналу і внутрішньоклітинного передавання сигналу, яке зрештою призводить до спостерігання дії TNF на цих клітинах. Далі описано також низку підходів для виділення та ідентифікації білків, пептидів або інших факторів, які здатні зв'язуватися з різними районами у вищезазначених доменах TNF-R, причому ці білки, пептиди та інші фактори можуть брати участь у регуляції або модулюванні активності TNF-R; низку підходів для виділення і клонування послідовностей ДНК, кодуючих такі білки і пептиди; для конструювання експресуючих векторів з метою отримання цих білків і пептидів; і для отримання антитіл або їхніх фрагментів, які взаємодіють з TNF-R або з вищезазначеними білками і пептидами, що зв'язують різні райони TNF-R, також викладено в ЕРО568925. Проте, ЕРО568265 не дає характеристики фактичних білків і пептидів, що зв'язуються з внутрішньоклітинними доменами TNF-R (наприклад, TNF-R р55) і не дає опису дріжджового двогібридного підходу для виділення та ідентифікації білків і пептидів, що зв'язуються з внутрішньоклітинними доменами TNF-R. Подібно до того ще й досі не описано білки чи пептиди, здатні зв'язувати внутрішньоклітинний домен FAS-R. Отже, у випадку, коли потрібне інгібування ефекту TNF або ліганду FAS-R, було б бажаним зменшення кількості або активності рецепторів TNF або FAS-R на поверхні клітин, тоді як збільшення кількості або активності рецепторів TNF або FAS-R було б бажаним, коли необхідний посилений ефект TNF або ліганду FAS-R. З цією метою промотори як TNF-R р55, так і TNF-R р75 секвенірували, проаналізували та виявили кілька ключових мотивів послідовності, специфічних для різних факторів, що регулюють транскрипцію. Отже експресія цих рецепторів TNF може регулюватися на рівні їхніх промоторів, тобто інгібування транскрипції від цих промоторів для зменшення кількості рецепторів і збільшення транскрипції від цих промоторів для збільшення числа цих рецепторів (ЕР606869 і WO9531206). Таким чином, існує потреба навести повідомлення щодо відповідних досліджень, які стосуються регуляції FAS-R на рівні промотора гена FAS-R. Хоча відомо, що рецептори фактора некрозу пухлин (TNF) і структурно-споріднений рецептор FAS-R запускають у клітинах під час стимуляції лігандів, продукованих лейкоцитами, деструктивні активності, які призводять до їхньої власної загибелі, механізми цього запуску й досі мало зрозумілі. Мутаційні дослідження доводять, що в передаванні сигналу FAS-R і TNF-R p55 (p55-R) для цитотоксичності беруть участь різні райони в їхніх внутрішньоклітинних доменах (Brakebusch et al., 1992; Tartaglia et al., 1993; Itoh and Nagata, 1993). Ці райони ("домени загибелі") мають подібність послщовності. “Домени загибелі” обох рецепторів FASR і p55-R мають тенденцію до самоасоціації. їхня самоасоціація, вочевидь, посилює агрегацію рецепторів, необхідну для ініціації передавання сигналу (дивись Song et al., 1994; Wallach et al., 1994; Boldin et al., 1995) і за високих рівнів експресії рецепторів може призвести до запуску ліганд-незалежного передавання сигналу (Boldin et al., 1995). Отже до появи патенту WO9531544 і цього винаходу не було забезпечено білки, які регулюють дію лігандів, що належать до суперродини TNF/NGF, таку як дія TNF або ліганду FAS-R на клітини медіюванням внутрішньоклітинного процесу передавання сигналу, яке, як визнають, керується здебільшого внутрішньоклітинними доменами (lС) рецепторів, які належать до суперродини рецепторів TNF/NGF, таких як внутрішньоклітинні домени рецепторів TNF, тобто TNF-R р55 і р75 (р55ІС і р75ІС, відповідно), а також FAS-R. Деякі цитотоксичні ефекти лімфоцитів опосередковано взаємодією продукованого лімфоцитами ліганду з FAS-R (CD95), рецептора клітинної поверхні, який часто зустрічається і має змогу запускати загибель клітин (дивись Nagata and Goldstein, 1995). У вбиванні клітин мононуклеарними фагоцитами бере участь пара лігандрецептор - TNF та його рецептор p55-R (CD120) - структурно споріднена з FAS-R і його лігандом (дивись також Vandenabeele et al., 1995). Подібно до інших, індукованих рецепторами ефектів, індукція загибелі клітин рецепторами TNF і FAS-R здійснюється низкою білок-бшкових взаємодій від зв’язування ліганду з рецептором до кінцевої активації функцій ферментативного ефектору, що за цих конкретних рецепторів спричиняє до загибелі клітин. Попередні дослідження виявили взаємодії неферментативний білок-білок, які ініціюють передавання сигналу для загибелі клітин: зв'язування молекул тримірного TNF або ліганду FAS-R з їхніми рецепторами, отримані взаємодії їхніх внутрішньоклітинних доменів (Brakebusch et aІ, 1992; Tartaglia et aІ, 1993; Itoh and Nagata, 1993) підвищували схильність мотивів доменів загибелі до самоасоціації (Boklin et aІ, 1995а) та індукували зв'язування двох цитоплазматичних білків (які також можуть зв'язуватися один з одним) з внутрішньоклітинними доменами рецепторів - MORT-1 (або FADD) з FAS-R (Bofdin et al, 1995b; Chinnaiyan et al., 1995; Kischkel et al, 1995) і TRADD з p55-R (Hsu et al, 1995; Hsu et al, 1996). Три білки, які зв'язуються з внутрішньоклітинним доменом FAS-R і p55-R у районі "домену загибелі", які беруть участь в індукції загибелі клітин рецепторами через гетероасоціацію гомологічних районів і які також незалежно здатні до запуску загибелі клітин, було ідентифіковано способом дріжджового двогібридного скринінга. Одним з них є білок MORT-1 (Boldin et al., 1995b), також відомий як FADD (Chinnaiyan et al., 1995), який специфічно зв'язується з FAS-R. Другий, TRADD (дивись також Hsu et al., 1996), зв'язується з p55-R і третій, RIP (дивись також Stranger et al., 1995), зв'язується як з FAS-R, так і з p55-R. Окрім їхнього зв'язування з FAS-R і p55-R, ці білки також здатні зв'язуватися один з одним, що забезпечує функціональну "перехресну розмову" між FAS-R і p55-R. Ці зв'язування здійснюються через консервативний мотив послідовності, "модуль домену загибелі", загальний для цих рецепторів та їхніх зв'язуючих білків. Окрім того, хоча в дріжджовому даогібридному тесті було наведено, що MORT-1 довільно зв'язується з FAS-R, в клітинах ссавців це зв'язування має місце лише після стимуляції рецептора, що змушує припустити, що MORT-1 бере участь в иніційованих подіях передавання сигналу FAS-R. MORT-1 не містить будь-якого мотиву послідовності, характерного для ферментативної активності, отже його здатність запускати загибель клітин, напевно, не пов’язана з властивою MORT-1 власною активністю, а швидше з активацією деяких інших білків (білка), які зв'язують MORT-1 і діють надалі в каскаді передавання сигналу. Було наведено, що клітинна експресія мутантів MORT-1, які не мають N-кінцевої частини молекули, інгібує індукцію цитотоксичності FAS/APO1 (FASR) або p55-R (Hsu et al., 1996; Chinnaiyan et al., 1996), що свідчить про те, що N-кінцевий район бере участь у передаванні через білок-білкові взаємодії сигналу про дію обох рецепторів, що спричиняє загибель клітин. Нещодавні дослідження довели участь групи цитоплазматичних тіолових протеаз, подібних за структурою до протеази CED3 Caenorhabditis elegans і перетворювального інтерлейкін-1b ссавців ферменту (ICE), в ініціації різних фізіологічних процесів загибелі клітин (огляд в Kumar, 1995 і Henkart, 1996). Також зазначалося, що протеаза (протеази) цієї родини може брати участь у клітинній цитотоксичності, індукованої FAS-R і TNF-R. Було виявлено, що специфічні інгібітори цих протеаз і кодовані двома вірусами білки, які блокують їхню функцію, білок вірусу коров’ячої віспи сrmА і білок р35 бакуловірусу забезпечують захист клітин проти клітинної цитотоксичності (Enari et al., 1995; Los et al., 1996; Tewari et al., 1995; Xue et al., 1995; Beidler et al., 1995). Швидке розщеплення деяких специфічних клітинних білків, ймовірно опосередковане протеазою (протеазами) родини CED3/ICE, спостерігали в клітинах невдовзі після стимуляції FAS-R або рецепторів TNF. До теперішнього часу не було повідомлень про ідентичність специфічної СЕР3/ІСЕ-спорідненої протеази (протеаз) і про механізми активації цих протеаз рецепторами. Метою цього винаходу є забезпечення нових білків, зокрема всіх їхніх ізоформ, аналогів, фрагментів чи похідних, здатних зв'язуватися з MORT-1, який сам зв'язується з внутрішньоклітинним доменом FAS-R, причому ці нові білки впливають на процес внутрішньоклітинного передавання сигналу, зв'язуючи ліганду FAS з його рецептором. Іншою метою цього винаходу є забезпечення антагоністів (наприклад, антитіл, пептидів, органічних сполук або навіть деяких ізоформ) вищезгаданих нових білків, їхніх аналогів, фрагментів і похідних, які можна використовувати для інгібування процесу передавання сигналу або, конкретніше, клітинної цитотоксичності, коли це бажано. Подальшою метою цього винаходу є використання цих нових білків, їхніх аналогів, фрагментів і похідних для виділення та визначення характеристик додаткових білків або факторів, які можуть брати участь в регуляції активності рецепторів, наприклад, інших протеаз, які розщеплюють нові білки, роблять їх біологічно активними, і/або для виділення й ідентифікації інших рецепторів, які знаходяться вище по ходу передавання сигналу, з якими ці нові білки, їхні аналоги, фрагменти і похідні зв'язуються (наприклад, інших рецепторів FAS або споріднених з ними рецепторів), а отже беруть участь в їхньому функціонуванні. Ще однією метою цього винаходу є забезпечення інгібіторів, які можуть вводитися в клітини для зв'язування або взаємодії з протеазами МАСH та інгібування їхньої протеолітичної активності. Крім того, метою цього винаходу є використання вищезгаданих нових білків і їхніх аналогів, фрагментів і похідних як антигенів для отримання до них поліклональних і/або моноклональних антитіл. Ці антитіла в свою чергу можуть використовуватися, наприклад, для очищення нових білків з різних джерел, таких як клітинні екстракти або трансформовані клітинні лінії. Далі, ці антитіла можуть використовуватися з метою діагностики, наприклад, для ідентифікації розладів, пов'язаних з аномальним функціонуванням клітинних ефектів, опосередкованих рецептором FAS-R або іншими спорідненими рецепторами. Подальшою метою цього винаходу є забезпечення фармацевтичних композицій, які містять вищезгадані нові білки або їхні аналоги, фрагменти чи похідні, а також фармацевтичних композицій із вмістом вищезгаданих антитіл або інших антагоністів. Відповідно до цього винаходу виявлено новий білок, МАСH, здатний зв'язуватися або взаємодіяти з MORT-1, який сам зв'язується з внутрішньоклітинним доменом FAS-R. MACH, можливо, функціонує як ефекторний компонент шляху загибелі клітин, ініційованого зв"язуванням ліганду FAS з FAS-R на клітинній поверхні, що відбувається завдяки тому, що принаймні деякі ізоформи MACH є активними внутрішньоклітинними протеазами. Висловлювалося припущення, що протеази родини CED3/ICE причетні до процесу апоптозу, який запускається FAS-R. MORT-1 (або FADD) зв'язується з внутрішньоклітинним доменом FAS-R при активації цього рецептора, а нові білки MACH відповідно до цього винаходу зв'язуються з MORT-1. Білок MACH, клонований і характеризований відповідно до цього винаходу, дійсно існує у вигляді численних ізоформ, причому деякі з них мають район гомології CED3/lCE, який має протеолітичну активність (домен протеолітичної активності), і спричиняє загибель клітин при експресії в них. Отже активація цього нового гомолога CED3/ICE (тобто різних ізоформ MACH, які мають протеолітичний домен) FAS-R (через взаємодію з MORT-1), напевно становить ефекторний компонент опосередненого FAS-R шляху (каскаду реакцій) загибелі клітин. Окрім того, MACH, ймовірно, функціонує також як ефекторний компонент шляху загибелі клітин, ініційованого зв'язуванням TNF з p55-R на клітинній поверхні, що відбувається за допомогою непрямого механізму зв’язування MORT-1 з TRADD, білком, який зв’язується з внутрішньоклітинним доменом p55-R (Hsu et al., 1995), з наступним (або одночасним) зв'язуванням MACH з MORT-1 з активацією MACH до активної протеази, яка бере участь у здійсненні загибелі клітин. Варто також відзначити, що хоча MACH, зокрема ізоформа МАСНa1, виявляє всі ознаки послідовності, вирішальні для функції протеаз СЕD3/lCЕ, вона, проте, дійсно має деякі свої власні ознаки послідовності, які відрізняються і можуть забезпечити її унікальним і можливо тканино/клітинноспецифічним способом дії. MORT-1 ("Медіатор Токсичності Рецептора", Boldin et al., 1995b), який колись мав назву HF1, здатний зв'язуватися з внутрішньоклітинним доменом FAS-R. Цей FAS-ІC-зв'язуючий білок діє як медіатор або модулятор або ліганду FAS-R на клітини медіюванням або модулюванням процесу внутрішньоклітинного передавання сигналу, який зазвичай має місце після зв'язування ліганду FAS-R при клітинній поверхні. Було наведено, що крім своєї FAS-lC-зв'язуючої специфічносгі, MORT-1 має інші характеристики (дивись Приклад 1), наприклад, він має район, гомологічний до районів "домену загибелі" (DD) TNF-R р55 і FAS-R (р55-DD і FAS-DD), і внаслідок цього також здатний до самоасоціації. MORT-1 здатний також активізувати клітинну цитотоксичнють, причому це, можливо, пов'язано з його здатністю до самоасоціації. Також було виявлено, що коекспресія цього району в MORT-1 (HF1), який містить послідовність гомології "домену загибелі" (MORT-1DD, присутній в С-кінцевій частині MORT-1), сильно протидіє індукованій FAS загибелі клітин, як і слід було очікувати на основі його здатності зв'язуватися з "доменом загибелі" FAS-IC. Далі за деяких експериментальних умов було виявлено, що коекспресія частини MORT-1, яка не містить району MORT-DD (N-кінцевої частини MORT-1, амінокислот 1-117, "голівки MORT-1") призводила до відсутності протидії індукованої FAS загибелі клітин і до трохи збільшеної індукованої FAS клітинної цитотоксичності (якщо вона взагалі існувала). Таким чином, ймовірно, що MORT-1 зв'язується також з іншими білками, які беруть участь у процесі внутрішньоклітинного передавання сигналу. Отже, MORT-1 -зв'язуючі білки можуть також діяти як непрямі медіатори або модулятори дії ліганду FAS-R на клітини, медіюючи або модулюючи активність MORT-1; або ці MORT-1-зв'язуючі білки можуть безпосередньо діяти як медіатори або модулятори пов"язаного з MORT-1 внутрішньоклітинного процесу передавання сигналу щляхом медіювання або модулювання активності MORT1, який, як зазначалося вище, має, напевно, незалежну здатність активізувати клітинну цитотоксичність. Ці MORT-1-зв'язуючі білки можуть також використовуватися в будь-якому зі стандартних способів скринінгу для виділення, ідентифікації та визначення характеристик додаткових білків, пептидів, факторів, антитіл тощо, які можуть брати участь у пов'язаному з MORT-1 або FAS-R процесі передавання сигналу або бути елементами інших внутрішньоклітинних процесів передавання сигналу. Такі MORT-1-зв'язуючі білки виділено й описано в цьому винаходу (дивись Приклад 2 і Приклад 3). Деякід цих MORT-1-зв'язуючих білків, які тут матимуть назву MACH, було насамперед клоновано, секвеніровано та частково охарактеризовано як такі, що мають певні якості, а саме: кДНК MACH кодує відкриту рамку зчитування ORF-B; MACH зв’язується з MORT-1 сильно та специфічно; сайт зв'язування MACH в MORT-1 знаходиться проти ходу транскрипції від мотиву "домену загибелі" MORT-1; район ORF-B MACH є його частиною, яка взаємодіє з MORT-1; і MACH здатний до самоасоціації та самостійної індукції клітинної цитотоксичності. Згідно з цим винаходом було показано (зазначалося вище), що MACH дійсно існує у вигляді ряду ізоформ. Окрім того, ORF-B MACH, згадана вище, дійсно є однією з ізоформ MACH, яка тут має назву МАСНb1 (дивись нижче). Таким чином, цей винахід передбачає створення послідовніші ДНК, яка кодує білок, його аналоги або фрагменти, здатні зв'язуватися або взаємодіяти з MORT-1, причому цей білок, його аналоги чи фрагменти здатні медіювати внутрішньоклітинний ефект, що медіюється FAS-R або P55-TNF-R. Зокрема, цей винахід передбачає створення послідовністі ДНК, обраної з групи, яка складається з: (а) послідовності кДНК, яка походить з кодуючого району нативного МORТ-1-зв’язуючого білка; (b) послідовностей ДНК, здатних гібридизуватися с послідовністю (а) за умов помірної суворості і кодуючих біологічно активний MORT-1-зв'язуючий білок; і (с) послідовностей ДНК, які є виродженими внаслідок виродження генетичного коду відносно послодовностей ДНК, визначених в (а) і (b), і які кодують біологічно активний MORT-1-зв'язуючий білок. lншим характерним варіантом згаданої вище послідовності ДНК відповідно до цього винаходу є послідовність ДHК, яка містить щонайменше частину послідовності, що кодує одну ізоформу білка MACH, обрану з ізоформ MACH, які тут мають назву МАСНa1, МАСНa2, МАСНa3, МАСНb1, МACHb2, МАСНb3, МACHb4, МАСНb5. Іншими характерними варіантами послідовності ДНК відповідно до цього винаходу, як визначалося вище, є послідовності ДНК, які кодують: (а) ізоформу MACH, обрану з МАСНa1, МACHb1 і МACHb3, яка має амінокислотну послідовність, наведену в SEQ ID №7, 5 і 8, відповідно і аналогів та фрагментів кожної з них; (b) МАСНa1, яка має амінокислотну послідовність, наведену в SEQ ID №7, та її аналоги і фрагменти; (c) МАСНb1, яка має амінокислотну послідовність, наведену в SEQ ID №5, та її аналоги і фрагменти; (d) MACHb3, яка має амінокислотну послідовність, наведену в SEQ ID №8, та її аналоги і фрагменти. Метою цього винаходу є створення MORT-1-зв'язуючих білків та їхніх аналогів, фрагментів чи похідних, які кодуються будь-якою зі згаданих вище послідовностей винаходу, причому ці білки, фрагменти і похідні здатні зв'язуватися або взаємодіяти з MORT-1 і медіювати внутрішньоклітинний ефект, який медіюеться FAS-R або р55 TNF-R. Характерним варіантом цього винаходу є MORT-1-зв'язуючий білок, його аналоги, фрагменти і похідні, які обрано з принаймні однієї ізоформи MACH групи, яка містить МАСНa1, МАСНa2, МАСНa3, МАСНb1, МАСНb2, МАСНb3, МАСНb4 і МАСНb5, які мають щонайменше частину його амінокислотної послідовності. Цей винахід забезпечує також вектори, які кодують згаданий вище МОRT-1-зв’язуючий білок і його аналоги, фрагменти чи похідні відповідно до цього винаходу, які містять вказану вище послідовність ДНК за цим винаходом, причому ці вектори здатні екслресуватися в придатних еукаріотичних або прокаріотичних юіггинах-господарях; трансформовані еукарїотичні або прокаріотичні ішітини-господарі, які містять такі вектори; і спосіб одержання MORT-1-зв'язуючого білка або аналогів, фрагментів чи похідних відповідно до цього винаходу через вирощування трансформованих клітин-господарів за умов, придатних для експресії вказаного білка, аналогів, фрагментів чи похідних, виконання пост-трансляційних модифікацій цього білка, як це необхідно для отримання цього білка, і екстракції експресованих білка, аналогів, фрагментів чи похідних з культурального середовища трансформованих клітин або клітинних екстрактів трансформованих клітин. Наведені вище визначення призначені для включення всіх ізоформ білка MACH. В іншому аспекті, цей винахід забезпечує також антитіла або їхні активні похідні чи фрагменти, специфічні для МОRТ-1-зв’язуючого білка і його аналогів, фрагментів і похідних відповідно до цього винаходу. Ще одним аспектом винаходу забезпечено різні застосування зазначених вищепослідовностей ДНК або білків, які вони кодують, згідно з цим винаходом, причому ці застосування включають (серед інших): (і) Спосіб модулювання дії ліганду FAS-R або TNF на клітини, які несуть FAS-R або p55-R, який передбачає обробку цих клітин одним чи кількома MORT-1-зв'язуючими білками, аналогами, фрагментами чи похідними відповідно до цього винаходу, здатними зв'язуватися з MORT-1, який зв'язується з внутрішньоклітинним доменом FAS-R, або здатними зв"язуватися з MORT-1, який зв'язується з TRADD, який зв'язується з внутрішньоклітинним доменом p55-R, і внаслідок цього здатними модулювати/медіювати активність FAS-R або р55 TW-R, причому обробка цих клітин передбачає введення в клітини одного чи кількох білків, аналогів, фрагментів або похідних у формі, придатній для внутрішньоклітинного введення, або введення в клітини послідовності ДНК, яка кодує один чи кілька білків, аналогів, фрагментів чи похідних, у формі придатного вектора, який несе цю послідовність, причому цей вектор здатний здійснювати введення цієї послідовності в ці клітини у такий спосіб, що вона експресується в клітинах. (іі) Спосіб модулювання дії ліганду FAS-R або TNF на клітини за пунктом (і) вище, в якому обробка клітин передбачає введення в клітини MORT-1-зв'язуючого білка або його аналоги, фрагментів чи похідних у формі, придатній для внутрішньоклітинного введення, або введення в клітини послідовності ДНК, яка кодує MORT-1зв'язуючий білок або аналоги, фрагменти чи похідні, у формі придатного вектора, який несе цю послідовність, причому цей вектор здатний здійснювати введення цієї послідовності в ці клітини у такий спосіб, що вона експресується в клітинах. (ііі) Спосіб за пунктом (іі) вище, в якому обробку клітин виконують за допомогою трансфекції клгшн рекомбінантним вірусним вектором тварини, яка включає такі стадії: (a) конструювання рекомбінантного вірусного вектора тварини, який несе послідовність, що кодує вірусний поверхневий білок (ліганд), здатний зв’язуватися зі специфічним рецептором клітинної поверхні на поверхні, яка несе FAS-R або p55-R клітини, і другу послідовність, яка кодує білок, обраний з MORT-1-зв'язуючого білка та його аналогів, фрагментів і похідних, який при експресії в цих клітинах здатний модулювати/медіювати активність FAS-R або p55-R; і (b) інфікування цих клітин вектором (а). (і) Спосіб модулювання дії ліганду FAS-R або TNF на клітини, які несуть FAS-R або p55-R, і який передбачає обробку цих клітин антитілами або їхніми активними фрагментами чи похідними, згідно з цим винаходом, причому цю обробку виконують наданням придатної композиції, яка містить ці антитіла, їхні активні фрагменти чи похідні, цим клітинам, причому при експонуванні MORT-1-зв'язуючого білка або його частин з цих клітин на позаклітинній поверхні зазначену композицію готують для позаклітинного застосування, а коли MORT-1-зв'язуючі білки є внутрішньоклітинними, зазначену композицію готують для внутрішньоклітинного застосування. (іі) Спосіб модулювання дії ліганду FAS-R або TNF на клітини, які несуть FAS-R або p55-R, який передбачає обробку зазначених клітин олігонуклеотидною послідовністю, яка кодує антизмістовну послідовність принаймні частини білкової послідовності MORT-1-зв'язуючого білка згідно з цим винаходом, причому ця олігонуклеотидна послідовність здатна інгібувати експресію MORT-1-зв’язучого білка. (iiі) Спосіб за пунктом (іі) вище для обробки пухлинних клітин або ВІЛ-інфікованих клітин чи інших клітин з патологією, що передбачає: (a) конструювання рекомбінантного вірусного вектора тварини, який несе послідовність, що кодує вірусний поверхневий білок, здатний зв'язуватися зі специфічним рецептором поверхні пухлинних клітин або рецептором інших клітин з патологією, і послідовність, яка кодує білок, обраний з MORT-1-зв'язуючого білка, аналогів, фрагментів і похідних згідно з цим винаходом, який при експресії в пухлинній, ВІЛ-інфікованій або іншій клітини з патологією здатний вбити цю клітину; і (b) інфікування пухлинних або ВІЛ-інфікованих чи інших клітин з патологією вектором (а). (і) Спосіб модулювання дії ліганду FAS-R або TNF на клітини, який передбачає застосування рибозимного способу, в якому вектор, який кодує послідовність рибозима, здатний взаємодіяти з клітинною послідовністю мРНК, яка кодує MORT-1-зв'язуючий білок згідно з цим винаходом, вводять в зазначені клітини у формі, яка дозволяє експресію послідовності рибозима в цих клітинах, причому, коли ця послідовність рибозима експресується в клітинах, вона взаємодіє з клітинною послідовністю мРНК і розщеплює її, що призводить до інгібування експреси МORТ-1-зв'язуючого білка в цих клітинах. (іі) Спосіб, обраний зі способу згідно з цим винаходом, в якому MORT-1-зв'язуючий білок, який кодує зазначену послідовність, містить щонайменше одну з ізоформ МАСН, її аналоги, фрагменти чи похідні, згідно з цим винаходом, які здатні специфічно зв'язуватися з MORT-1, який в свою чергу специфічно зв’язується з FAS-ІС, або які здатні зв'язуватися з MORT-1, який в свою чергу зв'язується з TRADD, який в свою чергу зв'язується з р55-ІС. (iiі) Спосіб виділення та ідентифікації білків згідно з цим винаходом, здатних зв'язуватися з білком MORT1, який передбачає застосування дріжджового двогібридного способу, в якому послідовність, що кодує білок MORT-1, знаходиться на одному гібридному векторі, а послідовність з бібліотеки кДНК або геномної ДНК знаходиться на другому гібридному векторі, причому ці вектори використовують для трансформації дріжджових клітин-господарів, і позитивні трансформовані клітини виділяють з подальшою екстракцією другого гібридного вектора для отримання послідовності, яка кодує білок, що зв'язується з білком MORT-1 і уявляє собою MORT-1-зв'язуючі білки. (iv) Спосіб за будь-яким з пунктів (і) - (іх), в якому MORT-1-зв'язуючий білок є ізоформою MACH, яка тут має назву МАСНa1, її аналогами, фрагментами і похідними. (v) Спосіб за будь-яким з пунктів (і) - (іх), в якому MORT-1-зв'язуючий білок є ізоформою MACH, яка тут має назву МАСНb1, її аналогами, фрагментами і похідними. (vi) Спосіб за будь-яким з пунктів (і) - (іх), в якому MORT-1-зв'язуючий білок є ізоформою MACH, яка тут має назву МАСНb3, її аналогами, фрагментами і похідними. Цей винахід забезпечує також фармацевтичну композицію для модулювання дії ліганду FAS-R або TNF на клітини, яка містить за активний інгредієнт будь-який з таких компонентів: (і) МORT-1-зв’язуючий білок згідно з цим винаходом і його біологічно активні фрагменти, аналоги, похідні або суміші; (iі) рекомбїнантний вірусний вектор тварини, який кодує білок, здатний зв'язувати рецептор клітинної поверхні і кодуючий MORT-1-зв'язуючий білок або біологічно активні фрагменти чи аналоги, згідно з цим винаходом; (ііі) олігонуклеотидна послідовність, яка кодує антизмістовну послідовність послідовності МORT-1зв'язуючого білка відповідно до цього винаходу, причому цей олігонуклеотид може бути другою послідовністю рекомбінантного вірусного вектора тварини за пунктом (іі) вище. Цей винахід забезпечує також: I. Спосіб модулювання индукованої MORT-1 дії або нндукованої MORT-1-зв'язуючим білком дії на клітини, який передбачає обробку цих клітин згідно зі способом відповідно до будь-якого з наведених вище пунктів (і) (iх) MORT-1-зв'язуючими білками, їхніми аналогами чи фрагментами, причому ця обробка призводить до посилення або інгібування медійованої MORT-1 дії та внаслідок цього також медійованої FAS-R чи p55-R дії. II. Спосіб, відповідний до наведеного вище, в якому MORT-1-зв’язуючий білок, його аналог, фрагмент чи похідне є тією частиною МОRT-1-зв’язуючого білка, яка специфічно бере участь у зв'язуванні з MORT-1 або з самим MORT-1-зв'язуючим білком, або зазначена послідовність MORT-1-зв'язуючого білка кодує ту частину MORT-1-зв'язуючого білка, яка специфічно бере участь у зв’язуванні з MORT-1 або з самим MORT-1зв'язуючим білком. III. Спосіб, відповідний до наведеного вище, в якому MORT-1-зв'язуючий білок є однією з ізоформ MACH, обраної з МАСНa1, МАСНb1 і МАСНb3, здатної посилювати пов'язану з MORT-1 дію на клітини і отже також посилювати пов'язану з FAS-R або з p55-R дію на клітини. З вищенаведеного, а також з наведеного нижче докладного опису виходить, що MACH можуть використовуватися незалежно від MORT-1-зв'язуючих білків, їхню ідентифікацію і характеристику можна здійснювати будь-якими стандартними способами скринінга, які застосовують для виділення та ідентифікації білків, наприклад, дріжджовим двогібридним способом, способами афінної хроматографії і будь-яким з добре відомих стандартних способів, які використовують з цією метою. Забезпечено також інші аспекти та варіанти цього винаходу, які випливають з подальшого докладного опису винаходу. Слід відзначити, що у всьому описі такі терміни: "Модулювання дії ліганду FAS або TNF на клітини"; "Модулювання дії MORT-1 або MORT-1-зв'язуючого білка на клітини", слід розуміти як такі, що включають обробку як in vitro, так і in vivo. На Фіг.1 наведено взаємодію MORT-1 з FAS-IC та самоасоціацію MORT-1 у трансформованих дріжджах згідно з оцінюванням двогібридним тестом експресії b-галактозідази. На Фіг.2 схематично зображено попередній нуклеотид (SEQ ID №1) та розшифровану амінокислотну послідовність (SEQ ID №2) MORT-1 (HF1), в якій "домен загибелі" підкреслено, так само як і ймовірний стартовий сайт трансляції, тобто підкреслений залишок метіоніну у положенні 49 (жирний шрифт, підкреслений М). Зірочка вказує на стоп-кодон трансляції (нуклеотиди 769-771). На початку та всередині кожної лінії наведено дві цифри, які вказують на відносні положення нукяеотидш та амінокислот послідовності щодо початку послідовності (5¢-кінця), де перша цифра означає нуклеотид, а друга цифра - амінокислоту. Фіг.3 - отримана з клону кДНК попередня часткова нуклеотидна послідовність, яка кодує MORT-1зв'язуючий білок. На Фіг.4А-С схематично зображено кДНК MACH та кодований нею білок. На Фіг.4А, зокрема, наведено структуру кДНК MACH, яка кодує дві відкриті рамки зчитування MACH (ORF-A і ORF-B), причому заштрихована зона ORF-B показує її район із гомологією з білком MORT-1; на Фіг.4В подано розшифровану амінокислотну послідовність; (SEQ ID №5) для району ORF-A MACH, причому підкреслені амінокислотні залишки є районом із гомологією з MORT-1 (відповідає заштрихованому району Фіг.4А); на Фіг.4С міститься нуклеотидна псюяідовшгаь (SEQ ID №4) всієї молекули кДНК MACH (позначеної як MACHb1). Фіг.5 ілюструє результати взаємодії MORT-1 і MACH у трансфікованих дріжджових клітинах. На Фіг.6 наведено діаграму ліганд-незалежного запуску ефектів у клітинах НеLа, що спричиняють до загибелі клітин, трансфікованих тетрациклін-контрольованими експресуючими векторами, які кодують MACH, порівняно з цими ефектами у тих самих клітинах, трансфікованих такими самими векторами, які кодують інші білки, такі як люцифераза (luc, негативний контроль), FAS-IC, MORT-1, та клітинах, котрансфїкованих векторами, які кодують MORT-1 та МАСН. На Фіг.7А та 7В наведено амінокислотну послідовність (SEQ ID №5) (Фіг.7А). На Фіг.7В подано гомологію послідовності модуля MORT у МАСНb1, MORT-1 та РЕА-15 (SEQ lD №6). Фіг.8 - діаграма взаємодій рецептора та мішені, що беруть участь в індукції загибелі клітин FAS/APO1 та р55, причому модуль домену загибелі позначено смугами, модуль MORT - сірим кольором, район CED3/ICE чорним кольором. На Фіг.9А-С подано результати взаємодії in vitro МACHb1 та його делеційних мутантів з MORT-1. На Фіг.9А наведено оцінку експресії цих білків та їхніх молекулярних розмірів імунопреципітацією з клітинних лізатів за допомогою антитіла проти FLAG. На Фіг.9В наведено афінне сполучення цих білків з GST-MORT-1, адсорбованих на глутатіон-агарозних гранулах (або як контроль на GST або GST, злитому із внутрішньоклітинним доменом FAS-APO1). Фіг.9С свідчить про результати імунопреципітацій різних злитих конструкцій MORT-1 та МАСН за допомогою різноманітних специфічних антитіл. Фіг.10 - діаграма різних ізоформ МАСН. Фіг.11 - схематичне колінеарне розміщення (аналіз первинної структури) амінокислотних послідовностей ізоформ МАСН, МАСНa1 (SEQ ID №7), МACHb1 (SEQ ID №5) та МАСНb3 (SEQ ID №8), та різноманітних відомих членів родини протеаз CED/ICE, CED3 (SEQ ID №9), lch-11/Nedd2 (SEQ ID №10), ICErelllI (SEQ ID №11), Tx/lch/ICErellI (SEQ ID №13), CPP-32 (SEQ ID №30), Mcn2a (SEQ ID №31). Амінокислотні залишки пронумеровано як ліворуч, так і праворуч від кожної послідовності. Пунктирні лінії; пропуски у послідовності уможливлюють оптимальне розміщення. Амінокислоти, ідентичні щонайменше у трьох членах родини протеаз CED3/ICE, становлять блоки. Модулі MORT проти ходу транскрипції відносно району гомології CED3/ICE становлять блоки. Сайти С-кінцевих делецій, які використовуються в цьому дослідженні, позначено ламаними лініями. Чотири амінокислотних блоки по ходу транскрипції від району модуля MORT, які варіюють серед різноманітних ізоформ MACH (блоки 1-4), позначено верхніми лініями. У районі гомології СТD3/lСЕ амінокислотні залишки, вирівняні із залишками всередині ICE, які, можливо, беруть участь у каталітичній активності згідно з рентгеноструктурним аналізом, позначено таким чином: залишки, які ймовірно беруть участь у каталізі та відповідають His237, Gly238, Суs285 в ICE, позначено суцільними кружками нижче від лінії розміщення (·). Залишки, які становлять сполучний карман для карбоксилатного бічного ланцюга Р1 Asp та відповідають Аrg178, Gln283, Аrg341 і Ser347 в ICE, позначено білими кружками нижче від лінії розміщення (О). Залишки АІа проти ходу транскрипції від залишків, які відповідають Cys285 та ICE і залишки Arg та Gly по ходу транскрипції відносно Cys, є консервативними в усіх описаних раніше протеазах родини CED3/ICE. Залишки, проксимальні щодо залишків P1-Р4 субстрату, позначено трикутниками нижче від лінії розміщення (D). Відомі раніше ймовірні розщеплення Asp-X та потенційні сайти розщеплення, виявлені у схожих положеннях в MACH, становлять блоки. Стрілки вказують на N- та С-термінальні кінці субодиниць р20 і р10 ICE та субодиниць р17 і р12 СРР32. С-кінці білків позначено зірочками (*). На Фіг.12A-F наведено результати протеазної активності МАСНa1 за 15 хвилин (Фіг.12А), 30 хвилин (Фіг.12В), 60 хвилин (Фіг.12С), 90 хвилин (Фіг.12D), 180 хвилин (Фіг.12Е). На Фіг.12F представлено протеолітичну активність у часі за однієї характерної концентрації субстрату. Фіг.13А та 13В ілюструють протеазну активність району гомології CED3/lCE в МАСНa. А, Кінетика розщеплення отриманого з PARP-послідовності флуорогенного субстрату, Ac-DEVD-AMC (50мкМ), екстрактами E. Coli, які експресують GST-злитий білок району гомології CED3/ICE в МАСНa1 (Ser217 за всім Скінцем цього білка ( )) порівняно з відсутністю розщеплення екстрактами бактерій, експресуючих GST-злитий білок повнорозмірного МАСНa1 (О), або районом гомології CED3/ICE, в якому Суs360 замінено Ser (Ñ), або екстрактами бактерій, експресуючих GST-злиті продукти будь-яких з двох потенційних протеолітичних продуктів району гомології CED3/ICE (Ser217 - Asp373 (D) та Ser375 - Asp479, С-кінця цього білка (▲)). В, Субстратконцентраційна залежність розщеплення Ac-DEVD-AMC. Субстрат інкубували впродовж 180 хвилин з екстрактами бактерій, які експресують GST-злитий продукт району гомології CED3/ICE МАСНa1 ( ). Розщеплення цього субстрату екстрактами інгібували за присутності йодооцтової кислоти (5мМ, ). Ac-YVADAMC, флуорогенний субстрат, який відповідає сайту розщеплення у попереднику IL-b1, не розщеплювали (·). Фіг.14A-D ілюструють загибель клітин, опосередковану МАСНa1 і МАСНa2. На Фіг.15 графічно зображено загибель клітин, опосередковану МАСНa1 і МАСНa2. На Фіг.16A-D наведено морфологію клітин, в яких загибель клітин було індуковано або блоковано. На Фіг.17 подано діаграму, з якої видно, що молекули МАСНa, які містять нефункцюнальний район CED3/lCE, інгібують індукцію загибелі клітин рецептором p55-R. Фіг.18 доводить, що молекули МАСНa, які містять нефункціональний район CED3/ICE, інгібують індукцію загибелі клітин FAS/APO1. На Фіг.19 наведено загибель клітин НеLа, які тимчасово експоесують FAS/APO1. Цей винахід стосується, за першим аспектом, нових MORT-1-зв’язуючих білків, які здатні сполучатися або взаємодіяти з MORT-1, отже, зв'язуватися з внутрішньоклітинним доменом рецептора FAS-R, з яким зв'язуюється MORT-1, або зв'язуватися з внутрішньоклітинним доменом р55 TNF-R, з яким зв'язується білок TRADD (дивись Приклад 2 та наведений вище докладний опис), з яким білок TRADD зв’язує MORT-1. Таким чином, MORT-1-зв'язуючі білки відповідно до цього винаходу розглядаються як медіатори або модулятори FAS-R, що беруть участь, наприклад, у процесі передавання сигналу, який ініціюється сполученням ліганду FAS з FAS-R, і в такий спосіб беруть участь у процесі передавання сигналу, який ініціюється зв'язуванням TNF з p55-R. З MORT-1-зв'язуючих білків згідно з цим винаходом сюди включено щойно виявлені ізоформи MACH, амінокислотні і ДНК-послідовності яких є новими послідовностями, що не зустрічаються в банках даних ДНКпослідовностей або амінокислотних послідовностей "GENBANK" чи "PROTEIN BANK". Конкретніше, згідно з цим винаходом було надано опис кількох гомологів зі ссавців протеази нематод CED3. Вони були зазначені як ізоформи MACH (ізоформи МАСНa і МАСНb), які, хоча і є близькопорідненими, але виявляють дійсно деякі відмінності у структурі та субстратній специфічності, тож можуть мати кілька відмінних функцій у клітинах ссавців. Дійсно, відомі дві різні активності цих протеаз. Основна роль ICE, напевно, полягає в процесуванні попередника IL-1b, тоді як CED3, як було тут наведено, є ефектором програмованої загибелі клітин. Ця остання роль і є, мабуть, роллю принаймні деяких гомологів зі ссавців (деяких ізоформ MACH). Амінокислотна послідовність МАСНa1 виявляє близьку подібність з СРР32, найближчим відомим гомологом із ссавців CED3. Субстратна специфічність MACH також подібна до субстратної специфічності СРР32, за винятком того, що МАСНa1, мабуть, має більш обмежену субстратну специфічність, ніж СРР32. СРР32 розщеплює переважно субстратні пептиди, відповідні до сайту розщеплення в полі-(АДФ-рібоза)-полімеразі (PARP), хоча також має деяку протеолітичну активність стосовно пептиду, відповідного до сайту розщеплення ICE в попереднику lL-1b. Проте, МАСНa1 здатний, напевно, розщеплювати тільки відтворену з PARP послідовність. Ця подібність МАСНa1 з СРР32 і CED3 і відсутність подібності його з ICE узгоджені з ідеєю, що МАСНa1 функціонує подібно до CED3 як регулятор загибелі клітин. МАСНa1 виявляє, щоправда, деякі ознаки послідовності, які відрізняють його від CED3 і СРР32, а також від усіх інших членів родини CED3/ICE. С-кінцева частина МАСНa1, проти ходу транскрипції відносно району гомології CED3/ICE, зовсім не виявляє подібності з цим районом проти ходу транскрипції будь-якого з інших гомологів. Є також деякі унікальні ознаки у відношенні району гомології CED3/ICE цього білка. Ці відмінності припускають, що МАСНa1 належить до еволюційно відмінної гілки цієї родини і що його участь.у загибелі клітин дещо відрізняється від участі наведених вище гомологів CED3/ICE. Одна важлива відмінність може стосуватися способу, яким регулюється функція цієї протеази. Оскільки вони беруть участь у зв'язаних із розвитком процесу загибелі клітин і в індукованому рецептором імунному цитолізі, розщеплення білків протеазами родини CED3/ICE повинно підпорядковуватися регуляції як сигналами, які виникають у клітині, так і сигналами, які виходять від рецепторів клітинної поверхні. В процесах загибелі клітин, що розглядаються, активація таких протеаз, включає в себе, мабуть, механізми, які впливають на експресію генів, і призводять до підвищеного синтезу цих протеаз, а також до пониженого синтезу білків, подібних до BCL-2, які є антагоністами їхньої апоптопічної дії. Проте, це не стосується цитотоксичності, яка запускається FAS-R або рецепторами TNF. Клітини можуть бути вбитими TNF або лігандом FAS-R, навіть коли їхня активність білкового синтезу повністю інгібована (фактично в цьому випадку вони гинуть ефективніше), і залишаються стимул-залежними в цих умовах. Таким чином, активація протеаз родини СED3/lCЕ рецепторами TNF і FAS-R здійснюється за допомогою механізму, який не залежить від білкового синтезу. Унікальні якості послщовності МАСНa1 можуть дозволити їй брати участь у такому механізмі. Наскільки відомо заявникам, до теперішнього часу не було виявлено іншої протеази, яка зв'язує безпосередньо або через адапторний білок із внутрішньоклітинним доменом рецептора поверхні клітини. Хоча на основі способу дії зв'язаних з рецепторами білків, які мають інші ферментативні активності, здається вірогідним, що при зв'язуванні МАСНa1 і MORT-1 стає можливою стимуляція протеазної активності МАСНаї при запуску FAS-R. Це може також дозволити активацію цієї протеази рецептором p55-R через зв'язування MORT-1 TRADD, який зв'язується з p55-R. Було виявлено, що інші члени родини CED3/ICE виявляють повну активність тільки після протеолітичного процесингу, який має місце чи внаслідок розщеплення, чи під дією інших протеаз цієї родини (огляд Kumar, 1995; Henkart, 1996). Цитотоксична дія, яка відбувається внаслідок коекспресії двох основних продуктів МАСНa1, які потенціально здатні до саморозщеплення, на противагу відсутності цитотоксичності в клітинах, які експресують повнорозмірний район гомології CED3/ICE, узгоджується з можливістю, що і МАСНa1 також набуває повної активності лише після процесингу. Ферментативна активність, яка спостерігається в лізатах бактерій, що експресують повнорозмірний район гомології CED3/lCE, певно відображує самопроцесинг білка, продукованого в цих умовах, або процесинг деякими бактеріальними протеазами. У який спосіб здійснюється цей процесинг всередині клітин ссавця і як це може спричинятися запуском FAS-R і p55-R, невідомо і також неясно, який відносний внесок дає протеазна активність МАСНa1 в індуковану FAS-R і TNF-R цитотоксичність. Оцінювання цього внеску ускладнюється тим фактом, що експресія МАСНa1 позбавленого району гомології CED3/ICE, також призводить до помітної цитотоксичності. Припустимо, ця цитотокеичність відображує здатність МАСНb1 зв'язуватися з МАСНa1. Завдяки цій здатності, трансфіковані молекули MACH можуть, при агрегації, виробляти конформаційне змінення в молекулах МАСНa1, які є ендогенними для трансфікованої клітини. Такий механізм може добре пояснювати також цитотоксичність, яка спостерігається, коли молекули, що діяли до цього у процесі відносно MACH (MORT-1, TRADO або домени загибелі клітин p55-R чи FAS-R) надекспресуються в клітинах. Проте зараз неможливо виключити, що цитотоксичність, яка спостерігається при індукованій експресії МАСН чи молекул, які діяли раніше MACH, відображує, крім протеолітичної активності району гомології CED3/ICE в МАСН, також активацію деяких інших механізмів, що, як вважають, беруть участь у цитотоксичній дії FAS-R і p55-R (наприклад, активацію нейтральної або кислої сфінгомієлінази). Неможливо також виключити, що протеолітична активність району гомології СЕD3/lСЕ має інші функції, крім індукції цитотоксичності. Чіткіше розуміння функціювання МАСНa1 має досягатися через ідентифікацію ендогенних субстратних білків, які розщеплюються при активації МАСНa1. Знаходження способів руйнування за бажанням активності МАСНa1, наприклад, експресією інгібїторних молекул, також може сприяти розумінню функції цього білка і правити за спосіб регуляції його активності, коли це бажано. У клітинах, що експресують МАСНa1, цілком можуть існувати природні інгібітори цієї протеази. Було наведено, що існування альтернативно сплайсованих ізоформ для деяких інших членів родини CED3/ICE є способом фізіологічної рестрикції функції цих протеаз. Повідомлялося, що деякі ізоформи цих інших протеаз діють як природні інгібітори повнорозмірних ізоформ, напевно, шляхом утворення неактивних гетеродимерів з ними. Це цілком може мати місце для деяких ізоформ МАСН, наприклад, МАСНa3, в якій відсутній потенціальний N-кінцевий сайт розщеплення, і мутантів МАСНa1, район гомології CED3/ICE яких є дефектним. Експресія таких інгібіторних ізоформ може бути механізмом клітинного самозахисту проти цитотоксичності FAS-R і TNF. Широка гетерогенність ізоформ MACH, яка значно перевищує гетерогенність, що спостерігається для будь-яких інших протеаз родини CED3/lCE, може дозволити особливо витончене настроювання функції активної форми цього білка. Здається також можливим, що деякі ізоформи MACH виконують інші функції. Здатність МACHb1 зв'язуватися як з MORT-1, так і з МАСНa1 висуває можливість, що деякі з цих ізоформ, і можливо також інші ізоформи MACH, справляють не інгібіторну, а швидше посилюючу дію на функцію ферментативно активних ізоформ. Виявляється також можливим, що деякі ізоформи не виконують ролі, яка стосується цитотоксичності, а швидше функціонують як сайти стикування для молекул, що беруть участь в інших, нецитотоксичних діях FAS-R і TNF. Завдяки унікальній здатності FAS-R і TNF-R спричиняти до загибелі клітин, а також здатності рецепторів TNF запускати різні інші ушкоджуючі тканину активності, відхилення від норми функції цих рецепторів може бути особливо шкідливим для організму. Дійсно, було наведено, що як надлишкова, так і недостатня функція цих рецепторів призводить до патологічних проявлень різних захворювань. Ідентифікація молекул, які беруть участь у передаванні сигналу для активності цих рецепторів, і знаходження способів модулювання функції цих молекул є потенційним ключом для нових терапевтичних підходів до цих захворювань. У зв'язку з припустимою центральною роллю МАСНa1 в токсичності FAS-R і TNF вважається, зокрема, важливим приготуванням лікарських засобів, які можуть інгібувати протеолітичну функцію цієї молекули, як це було зроблено для деяких інших членів родини CED3/ICE. Унікальні ознаки послідовності району гомології CED3/lCE в молекулах МАСНa1 можуть дозволити створення лікарських засобів, які можуть впливати на захист від надлишкової імуномедійованої цитотоксичності без протидії процесам фізіологічної загибелі клітин, в яких беруть участь інші члени родини CED3/lCE. Таким чином, цей винахід стосується також послідовності ДНК, яка кодує MORT-1-зв'язуючий білок, і МORТ-1-зв’язуючих білків, кодованих цією послідовністю ДНК. Окрім того, цей винахід стосується послодовностей ДНК, які кодують біологічно активні аналоги, фрагменти і похідні MORT-1-зв'язуючого білка, і кодованих ними аналогів, фрагментів і похідних. Отримання таких аналогів, фрагментів і похідних виконують у стандартний спосіб (дивись, наприклад, Sambrook et al., 1989), в якому в послідовностях ДHК, які кодують MORT-1-зв'язуючий білок, можуть бути делегированi, приєднані або замінені іншими один чи кілька кодонів з утворенням налогів, які мають щонайменше одну заміну амінокислотного залишку порівняно з нативним білком. Поліпептид чи білок, який "в основному відповідає" MORT-1-зв'язуючому білку, включає не тільки МОRТ-1зв’язуючий білок, але також поліпептиди чи білки, які є аналогами МОRТ-1-зв"язуючого білка. Аналоги, які в основному відповідають MORT-1-зв'язуючому білку, є поліпептидами, в яких одну чи кілька амінокислот амінокислотної послідовності MORT-1-зв'язуючого білка замінено іншою амінокислотою, делегировано або вставлено за умов, що отриманий білок виявляє в основному таку ж або вищу біологічну активність, яку має відповідний MORT-1-зв'язуючий білок. Для того, щоб "в основному відповідати" MORT-1-зв'язуючому білку змінення в послідовності MORT-1 зв'язуючих білків, таких як ізоформи MACH, є відносно малими. Хоча кількість змінень може бути більшою за 10, краще мати не більше як 10 змінень, ще краще не більше ніж 5, найкраще не більше за три таких змінень. Хоча можна використати будь-який спосіб для знаходження потенціально біологічно активних білків, які в основному відповідають MORT-1-зв'язуючим білкам, одним з таких способів є використання традиційних способів мутагенезу на ДНК, яка кодує цей білок, що призводять до невеликої кількості модифікацій. Потім білки, експресовані такими клонами, можуть піддати скринінгу на MORT-1-зв'язування і/або на медійовану FAS-R і p55-R активність. "Консервативними" є заміни, що, як передбачається, не повинні змінювати активність цього білка, які необхідно спершу піддати скринінгу як заміни, а також такі, що не повинні значно змінювати розмір, заряд чи конфігурацію цього білка і отже змінювати його біологічні властивості. Консервативні заміни MORT-1-зв'язуючих білків включають аналог, в якому принаймні один амінокислотний залишок у поліпептиді був консервативно замінений іншою амінокислотою. Такі заміни краще виконувати згідно зі списком, наведеним у Таблиці ІА, ці заміни можуть визначатися рутинним експериментуванням для забезпечення модифікованих структурних i функціональних властивостей синтезованої молекули поліпептиду зі збереженням біологічної активності, характерної для MORT-1зв’язуючого білка. Таблиця ІА Вихідний залишок Ala Arg Asn Asp Cys Gln Glu Gly His lle Leu Lys Met Phe Ser Thr Приклад заміни Gly; Ser Lys Gln; His Glu Ser Asn Asp Ala; Pro Asn; Gln Leu; Val lle;Val Arg; Gln; Glu Leu; Tyr; lle Met; Leu; Tyr Thr Ser Trp Tyr Val Tyr Trp; Phe lle; Leu Альтернативно іншою групою замін MORT-1-зв'язуючого білка можуть бути заміни, за яких принаймні один амінокислотний залишок у поліпептиді було видалено та вставлено на його місце інший згідно з Таблицею IB. Типи можливих у поліпептиді замін можуть базуватися на аналізі частоти амінокислотних змін між гомологічними білками різних видів, наведених у Таблиці 1-2 Schuiz et al., G. Е. Principles of Protein Structure, Springer Verlag, New York, NY, 1798 і Фіг. 3-9 Creighton, Т. Е, Proteins: Structure and Molecular Properties, W. H. Freeman and Co., San Francisco, CA 1983. На підставі такого аналізу альтернативні консервативні заміни визначено тут як обміни всередині однієї з наведених нижче п’яти груп: Таблиця IB 1. Невеликі аліфатичні неполярні або слабополярні залишки: Ala, Ser, Thr (Pro, Gly); 2. Полярні негативно заряджені залишки та їхні аміди: Asp, Asn, Glu, Gln; 3. Полярні, позитивно заряджені залишки: His, Arg, Lys; 4. Великі аліфатичні неполярні залишки: Met, Leu, lle, Val (Cys); і 5. Великі ароматичні залишки: Phe, Туr, Тrр. Три амінокислотних залишки в дужках відіграють специфічну роль в архітектурі білка. Gly є єдиним залишком, який не має бокового ланцюга, отже, він надає гнучкості ланцюгу. Проте це має тенденцію до посилення утворення вторинної структури, відмінної від a-спіральної. Pro внаслідок його незвичайної геометрії жорстко натягує ланцюг і, як правило, прагне посилити структури, подібні b-витку, хоча в деяких випадках Cys здатний брати участь в утворенні дисульфідних зв'язків, важливих для укладання білка. Слід відзначити, що Schuls et al., supra, об'єднують Групи 1 і 2 (вище). Зазначимо також, що Туr внаслідок його здатності до утворення водневих зв'язків має значну схожість з Ser і Thr тощо. Консервативні амінокислотні заміни за цим винаходом, зокрема наведені вище, є відомими в цій галузі знань і, як передбачається, повинні зберігати біологічні та структурні властивості поліпептиду після амінокислотних змін. Більшість делецій і замін, пропонованих згідно з цим винаходом, є такими, щр не спричиняють радикальних змінень у характеристиках молекули білка або поліпептиду. "Характеристики" стосуються як змінень у вторинній структурі, наприклад, a-спіраль або b-пластина, так і змінень у біологічній активності, наприклад, зв'язування MORT-1 або медіювання дії ліганду FAS-R або TNF на клітини. Приклади отримання амінокислотних замін у білках, які можна використовувати для отримання аналогів MORT-1-зв'язуючих білків з метою застосовування в цьому винаході, включають будь-які стадії відомих способів, таких як наведено в патенті США RE33653, 4959314, 4588585 і 4737462 Mark et al.; 5116943 Koths et al., 4965195 Namen et al.; 487911 Chong et al.; і 5017691 Lee et al.; і наведено для лізин-заміщених білків у патенті США №4904584 (Shaw et al.). Окрім обговорених вище консервативних замін, які не повинні суттєво змінювати активність MORT-1зв’язуючого білка, будь-які консервативні заміни або менш консервативні та більш випадкові заміни, що призводять до збільшення біологічної активності аналогів MORT-1-зв'язуючих білків, знаходяться в об'ємі цього винаходу. Спеціалісту в цій галузі зрозуміло, що коли точна дія щодо заміни або делеції повинна підтверджуватися, цю дію щодо заміни (замін), делеції (делецій) тощо слід оцінювати рутинними тестами зв’язування і загибелі клітин. Скринінг за допомогою такого стандартного тесту не потребує надмірного експериментування. Припустимими є аналоги, які принаймні зберігають здатність до зв'язування з MORT-1 і внаслідок цього, як зазначалось вище, медіюють активність FAS-R і p55-R (наприклад, за допомогою протеазної активності щонайменше деяких ізоформ МАСН). Таким чином можна отримати аналоги із так званою домінантнегативною дією, а саме аналог, який є дефектним, в стані зв'язування з MORT-1, в наступному передаванні сигналу або протеазної активності після такого зв'язування. Такі аналоги можуть використовуватися, наприклад, для інгібування дії FAS-ліганду за допомогою конкурування з природними MORT-1-зв'язуючими білками. Наприклад, є вірогідним, що ізоформи МАСН, МАСНa2 і МАСНa3, є "природними" аналогами, які правлять за інгібування активності МАСН через конкурування за зв'язування з MORT-1 з активними (протеазними) ізоформами МАСН, що напевно є суттєвим для активації цих ізоформ МАСН. Якщо активні ізоформи МАСН не можуть зв'язуватися з MORT-1, внутрішньоклітинні шляхи передавання сигналу, медійовані FAS-R і р55-R, також будуть інгібуватися. Так само, можна отримати так звані домінант-позитивні аналоги, які будуть правити за посилення дії ліганду FAS або TNF. Вони матимуть такі самі або кращі MORT-1зв'язуючі властивості і такі самі або кращі властивості передавання сигналу, порівняно зі властивостями, які мають природні MORT-1-зв'язуючі білки. На генетичному рівні ці аналоги, як правило, отримують сайт-спрямованим мутагенезом нуклеотидів в ДНК, що кодує MORT-1-зв'язуючий білок, з отриманням внаслідок цього ДНК, яка кодує аналог, з наступним синтезом цієї ДНК і експресією цього поліпептиду в культурі рекомбінантних клітин. Як правило, аналоги виявляють таку саму або збільшену якісну біологічну активність, яку має білок, що трапляється в природі, Ausubel et al., Current Protocols in Molecular Biology, Greene Publications and Wiley Interscience, New York, NY, 1987-1995; Sambrook et al., Motecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor, NY, 1989. Отримання MORT-1-зв'язуючого білка згідно з цією або іншою нуклеотидною послідовностю, що кодує той самий поліпептид, який проте відрізняється від природної послідовності внаслідок змінювань, дозволених відомою виродженістю генетичного коду, може досягатися сайт-спрямованим мутагенезом ДНК, що кодує отриманий раніше аналог або нативну версію MORT-1-зв'язуючого білка. Сайт-спрямований мутагенез дає змогу отримати аналоги за допомогою використання специфічних алігонуклеотидних послідовностей, що кодують послідовність ДНК бажаної мутації, а також значну кількість суміжних нуклеотидів для забезпечення праймерної ітослідовності достатнього розміру та достатньої складності послідовності для утворення стабільного дуплекса з обох боків делеційного сочленування, що перетинається. Як правило, кращий праймер завдовжки близько 20-25 нуклеотидів з близько 5-10 комплементарними нуклеотидами на кожномі боці змінюваної послідовності. Взагалі спосіб сайт-спрямованого мутагенезу є добре відомим в цій галузі та зокрема наводиться у публікаціях Adelman et al., DNA 2: 183 (1983), які подано тут посиланням. Як буде далі зрозуміло, спосіб сайт-спрямованого мутагенезу, як правило, використовує фаговий вектор, який існує як в одноланцюговій, так і в дволанцюговій формі. Типовими векторами, застосовуваними в сайтспрямованому мутагенезі, є такі вектори, як фаг М13, викладений, наприклад, Messing et al., Third Cleveland Symposium on Macromotecules and Recombinant DNA, Editor A. Walton, Elsevier, Amsterdam (1981), опис якого включено тут посиланням. Ці фаги легко доступні комерційно і їхнє застосування, як правило, добре відомо спеціалістам в цій галузі. Як альтернативу для одержання одноланцюгової ДНК можна використати плазмідні вектори із вмістом одноланцюгового початку реплікації фага (Veira et al., Meth. Enzymol. 153:3, 1987). Взагалі сайт-спрямований мутагенез згідно з цим винаходом виконують, отримаючи спочатку одноланцюговий вектор, який містить в своїй послідовності послідовність ДНК, що кодує відповідний той або інший поліпептид. Олігонуклеотидний праймер, який несе бажану мутировану послідовність, отримують синтетично за допомогою автоматизованого ДНК/олігонуклеотидного синтезу. Потім цей праймер спалюють з одноланцюговим вектором, який містить послідовність білка, і піддають дії ДНК-полімеразних ферментів, таких як фрагмент Кленова ДНК-полімерази i Е. соІі, для завершення синтезу ланцюга, який несе мутацію. Таким чином мутована послідовність і другий ланцюг несуть бажану мутацію. Потім цей гетеродуплексний вектор використовують для трансформації придатних клітин, таких як Е. coli JM101, і відбирають клони із рекомбінантними векторами, що несуть аранжування мутованої послідовності. Після добирання такого клона послідовність мутованого MORT-1-зв'язуючого білка може витягуватися та розміщуватися в придатний вектор, який зазвичай переносить або експресує вектор типу, що може використовуватися для трансфекції придатного господаря. Відповідно до цього ген або нуклеїнова кислота, яка кодує MORT-1-зв’язуючий білок, можуть виявлятися, отримуватися і/або модифікуватися in vitro, in situ або in vivo з використанням відомих способів ампліфікації ДНК або РНК, таких як ПЛР і хімічний синтез олігонуклеотидів. ПЛР дозволяє ампліфікацію (збільшення в кількості) специфічних послідовностей ДНК за допомогою ДНК-полімеразних реакцій, що повторюються. Цю реакцію можна використати замість клонування; все, що потрібно для цього, це знання послідовності нуклеїнової кислоти. Для проведення ПЛР конструюють праймери, комплементарні цільовій послідовності. Потім ці праймери отримують автоматизованим синтезом ДНК, Оскільки праймери для гібридизації можуть конструюватися з будь-якою частиною гена, не виключено умови, за яких можливі (переносяться) невірні спарювання в процесі комплементарного спарювання основ. Ампліфікація цих районів з невірним спарюванням може призвести до синтезу мутагенезованого продукту, який спричиняє до утворення пептиду з новими властивостями (тобто може виникати сайт-спрямований мутагенез). Дивись також, наприклад, Ausubel, supra, Ch.16. Також поєднанням синтезу з використанням комплементарної ДНК (кДНК) із застосуванням зворотної транскриптази з ПЛР одержану РНК можна використовувати як вихідний матеріал для синтезу внутрішньоклітинного домену рецептора пролактина без клонування. Окрім того можуть конструюватися ПЛР-праймери для включення нових сайтів рестрикції або інших ознак, таких як термінуючі кодони на кінцях генного сегменту, який має амппіфікуватися. Це припущення сайтів рестрикції на 5'- і 3'-кінцях ампліфікованої генної послідовності дає змогу отримувати сегменти генів, що кодують МОRТ-1-зв’язуючий білок або його фрагмент, спеціально призначений для лігірування інших послідовностей і/або клонуючих сайтів у вектори. ПЛР та інші способи ампліфікації РНК і/або ДНК добре відомі в цій галузі і можуть використовуватися згідно з цим винаходом без надмірного експериментування, на основі наведених тут опису і керівництва. Відомі способи ампліфікації ДНК або РНК включають (але не обмежені ними) полімеразну ланцюгову реакцію (ПЛР) і споріднені способи ампліфікіції (дивись, наприклад, патенти США №№4683195, 4683202, 4800159, 4065188 Mullis et al.; 4795699 і 4921794 Tabor et ai.; 5142033 Innis; 5122464 Wilson et al.; 5091310 innis; 5066584 Gyltensten et al.; 4889818 GeHand et al.; 4994370 et al.; 4766067 Biswas; 4656134 Ringgold; і Innis et al., eds., Per Protocols: A Guide to Method and Applications) і медійовану РНК ампліфікацію, яка використовує антизмістовну РНК до цільової послідовності як матрицю для синтезу дволанцюгової ДНК (патент США №5130238 Malek et al., з товарним знаком NASBA); і імунно-ПЛР, яка об’єднує використання ампліфікації ДНК з позначкою антитіл (Ruzicka et al., Science 260:487 (1993); Sano et al., Science 258:120 (1992); Sano et al., Biotechnigues 9:1378 (1991)), повний зміст цих патентів і публікацій наведено тут посиланням. Подібним чином біологічно активні фрагменти MORT-1-зв'язуючих білків (наприклад, активних фрагментів будь-якої з ізоформ MACH) можна отримувати, як наведено вище з приводу аналогів MORT-1-зв'язуючих білків. Придатні для цього фрагменти MORT-1-зв'язуючих білків є фрагментами, які зберігають MORT-1зв'язуючу здатність і можуть медіювати біологічну активність FAS-R і p55-R, як наведено вище. Згідно з цим можна отримувати фрагменти MORT-1-зв'язуючих білків, які мають домінант-негативну або домінантпозитивну дію, як наведено вище стосовно аналогів. Слід відзначити, що ці фрагменти становлять клас аналогів цього винаходу, а саме, вони є певними частинами MORT-1-зв'язуючих білків, які походять з повнорозмірної послідовності MORT-1-зв’язуючого білка (наприклад, з будь-якої послідовності однієї з ізоформ МАСН), причому кожна з таких части (або фрагментів) має будь-яку з вищенаеедених активностей. Такий фрагмент може бути, наприклад, пептидом. Подібним чином похідні можна отримувати стандартними модифікаціями бокових груп одного чи кількох амінокислотних залишків MORT-1-зв'язуючого білка, його аналогів чи фрагментів, або сполученням MORT-1зв'язуючого білка, його аналогів чи фрагментів з іншою молекулою, наприклад, з антитілом, ферментом, рецептором тощо, як добре відомо в цій галузі. Таким чином, термін "похідні", застосовуваний тут, охоплює похідні, які можна отримувати з функціональних груп, присутніх у вигляді бокових ланцюгів на залишках, або N- чи С-кінцеві групи способами, відомими в цій галузі, і похідні також включені в цей винахід. Похідні можуть мати хімічні частини, такі як вуглеводні або фосфатні залишки, за умов, що така фракція має таку ж або більшу біологічну активність, ніж активність MORT-1-зв'язуючих білків. Наприклад, похідні можуть включати аліфатичні ефіри карбоксильних груп, аміди карбоксильних груп, отримані реакцією з аміаком або з первинними чи вторинними амінами, N-ацільні похідні вільних аміногруп амінокислотних залишків, утворених з ацільною частиною (наприклад, алканоїльною або карбоциклічною ароїльною групою), або О-ацільні похідні вільної гідроксильної групи (наприклад, гідроксильної групи серильного чи треонільного залишку), утворені з ацільними частинами молекул. Термін "похідні" припускає тільки ті похідні, які не замінюють одну кислоту іншою з двадцяти поширених природних амінокислот. Хоча MORT-1-зв'язуючий білок є білком або поліпептидом, він становить послідовність амінокислотних залишків. Поліпептид, яішй містить більшу послідовність, яка містить всю послідовність MORT-1-зв’язуючого білка, згідно з наведеними тут визначеннями також призначений для включення в список таких поліпептидів за умов, що додавання не впливають на основні та нові характеристики цього винаходу, тобто якщо вони зберігають чи збільшують біологічну активність MORT-1-зв'язуючого білка або можуть розщеплюватися з утворенням білка або поліпептиду, який має біологічну активність MORT-1-зв’язуючого білка. Таким чином цей винахід включає в себе, наприклад, злиті білки МORТ-1-зв’язуючого білка з іншими амінокислотами чи пептидами. Новий МORT-1-зв’язуючий білок, його аналоги, фрагменти і похідні мають ряд застосувань, наприклад: (і) MORT-1-зв'язуючий білок, його аналоги, фрагменти і похідні можуть використовуватися для імітації або посилення функції MORT-1 і отже ліганду FAS-R або TNF, в ситуаціях, де бажано, щоб дія ліганду FAS-R або TNF, таких як протипухлинні, протизапальні, антивірусні застосування тощо, де бажана індукована лігандом FAS-R або TNF цитотоксичність. У такому випадку MORT-1-зв'язуючий білок, його аналоги, фрагменти і похідні, які посилюють дію ліганду FAS-R або TNF, тобто цитотоксичну дію, можуть вводитися в клітини стандартними способами, відомими per se. Наприклад, оскільки MORT-1-зв'язуючі білки є внутрішньоклітинними і повинні вводитися тільки в клітини, в яких бажана дія ліганду FAS-R або TNF, необхідна система для специфічного введення цього білка в клітини. Одним зі способів для цього є утворення рекомбінантного вірусу тварини, наприклад, виведеного з Vaccinia, в ДНК якого слід ввести такі два гени: ген, що кодує ліганд, який зв'язується з білками клітинної поверхні, специфічно експресований цими клітинами, наприклад, такими, як gp 120-протеїн вірусу СНІДу (ВІЛ), який специфічно зв'язується з деякими клітинами (СD4-лімфоцитами і спорідненими лейкозами), або будь-який інший ліганд, який зв'язується специфічно з клітинами, які несуть FAS-R або p55-R, тож рекомбінантний вірусний вектор здатний зв’язувати такі несучі FAS-R або p55-R клітини; і ген, який кодує MORT-1-зв'язуючий білок. Таким чином експресія зв'язуючого білка клітинної поверхні на поверхні вірусу націлюватиме цей вірус на пухлинну клітину або іншу несучу FAS-R або p55-R клітину, після чого кодуючи послідовність MORT-1-зв'язуючого білка вводитиметься в клітини за допомогою цього вірусу та за умови експресії в цих клітинах спричинятиме до посилення дії ліганду FAS-R або TNF, що призводить до загибелі пухлинні клітини або інші несучі FAS-R або p55-R клітини, які бажано вбити. Конструювання такого рекомбінантного вірусу тварини є стандартною процедурою (дивись, наприклад, Sambrook et al., 1989). Іншою можливістю є введення послідовностей MORT-1-зв'язуючого білка (наприклад, будь-який з ізоформ MACH) у формі олігонуклеотидів, які можуть адсорбуватися клітинами та експресуватися в них. (іі) Вони можуть використовуватися для інгібування дії ліганду FAS-R або TNF, наприклад, у таких випадках, як пошкодження тканини при септичному шоку, відривання трансплантанту згідно з реакцією трансплантант-проти-господаря або гострому гепатиті, в яких бажано блокувати внутрішньоклітинну реакцію, індуковану лігандом FAS-R, або TNF передавання сигналу FAS-R або р55. У цій ситуації можливо, наприклад, ввести в клітини стандартними способами олігонуклеотиди, що мають антизмістовну кодуючу послідовність для МORT-зв’язуючого білка, які ефективно блокуватимуть трансляцію гттРНК, що кодує MORT-1 або MORT1-зв'язуючий білок, і в такий спосіб блокує її експресію і призводить до інгібування дії ліганду FAS-R або TNF. Такі олігонуклеотиди можуть вводитися в клітини наведеним вище способом із рекомбінантним вірусом, причому другою послідовністю, що переноситься цим вірусом, є олігонуклеотидна послідовність. Іншою можливістю є використання антитіл, специфічних для МОРТ-1-зв’язуючого білка, для інгібування йогоактивності щодо внутрішньоклітинного передавання сигналу. Ще одним зі способів інгібування дії ліганду FAS-R або TNF є нещодавно розроблений підхід з використанням рибозиму. Рибозими є каталітичними молекулами РНК, які специфічно розщеплюють РНК. Рибозими можуть конструюватися для розщеплення цільових РНК на вибір, наприклад, мРНК, які кодують MORT-1-зв'язуючий білок відповідно до цього винаходу. Такі рибозими можуть мати послідовність, специфічну для мРНК MORT-1-зв'язуючого білка, і бути здатними до взаємодії з нею (за допомогою комплементарного зв'язування) з наступним розщепленням цієї мРНК, що призводить до зменшення (повного втрачення) експресії MORT-1-зв'язуючого білка, причому рівень зниженої експресії залежить від рівня експресії рибозиму в клітині-мішені. Для введення рибозимів у визначені клітини (наприклад, клітини, які несуть FAS-R або p55-R) може використовуватися будь-який придатний вектор, наприклад, плазмщний, вірусний (ретровіруений) вектори (вірус тварини), які, як правило, використовують для цього (дивись також (і) вище, причому цей вірус має за другу послідовність кДНК, яка кодує обрану послідовність рибозиму). (Для ознайомлення з оглядом, способами тощо, які стосуються рибозимів, дивись Chen et al., 1992; Zhao and Pick, 1993; Shore et al. 1993; Joseph and Burke, 1993; Shimayama et al., 1993; Cantor et al.,1993; Barinaga, 1993; Crisel et al., 1993 і Koizumi et al., 1993). (iii) MORT-1-зв'язуючий білок, його аналоги, фрагменти чи похідні можуть також використовуватися для виділення, ідентифікації та клонування інших білків того ж класу, тобто білків, що зв'язуються з внутрішньоклітинним доменом FAS-R або з функціонально спорідненими рецепторами, або білків, що зв'язуються з MORT-1 і отже з функціонально спорідненими рецепторами, такими як FAS-R і p55-R і які беруть участь у внутрішньоклітинному передаванні сигналу. При цьому застосуванні може використовуватися двогібридна система дріжджів або нещодавно розроблена система з використанням по Саузерну в несуворих умовах з наступним ПЛР-клонуванням (Wilks et al., 1989). У публікації Wilks et al. наведено ідентифікацію та клонування двох припущених протеінтирозинкіназ через застосування нескладних умов гібридізації по Саузерну з наступним опонуванням за допомогою ПЛР на підставі відомої послідовності мотиву кінази, визначеної послідовності кінази. Цей підхід може застосовуватися в цьому винаході з використанням послідовності MORT-1-зв'язуючого білка (наприклад, будь-якої з ізоформ MACH) для ідентифікації і клонування ізоформ MACH, споріднених МORT-зв’язуючим білкам. (iv) Ще одним з підходів для використання MORT-1-зв'язуючого білка або його аналогів, фрагментів чи похідних цього винаходу є використання їх у способах афінної хроматографії для виділення та ідентифікації інших білків або факторів, з якими вони здатні зв'язуватися, наприклад, MORT-1 або інших білків чи факторів, які беруть участь у внутрішньоклітинному передаванні сигналу. За цього застосування MORT-1-зв’язуючий білок, його аналоги, фрагменти чи похідні цього винаходу можуть відокремлено приєднуватися до матрікс афінної хроматографії з наступним контактуванням із клітинними екстрактами або виділеними білками чи факторами, передбачуваними учасниками процесу внутрішньоклітинного передавання сигналу. Після процедури афінної хроматографії інші білки або фактори, які зв’язуються з MORT-1-зв'язуючим білком чи його аналогами, фрагментами або похідними цього винаходу, можуть елюіруватися, виділятися та характеризуватися. (v) Як відзначалося вище, MORT-1-зв'язуючий білок або його аналоги, фрагменти чи похідні відповідно до цього винаходу можуть також використовуватися як імуногени (антигени) для отримання специфічних для них антитіл. Ці антитіла також можна використовувати для очищення MORT-1-зв'язуючого білка (наприклад, ізоформ MACH) або з клітинних екстрактів, або з ліній трансформованих клітин, які продукують MORT-1зв'язуючий білок або його аналоги чи фрагменти. Далі ці антитіла можуть використовуватися з діагностичною метою для ідентифікації розладів, пов'язаних з аномальним функціонуванням системи ліганду FAS-R або TNF, наприклад, надактивних або малоактивних індукованих лігандом FAS-R або TNF клітинних ефектів. Отже, якщо б ці розлади були пов"язані з порушенням функції системи внутрішньоклітинного передавання сигналу з участю білка MORT-1 або МORТ-1-зв’язуючого білка, такі антитіла могли би бути важливим діагностичним інструментом. Слід відзначити, що виділення і характеристика MORT-1-зв'язуючого білка (наприклад, ізоформ MACH) відповідно до цього винаходу можуть здійснюватися із застосуванням добре відомих стандартних способів скринінгу. Наприклад, один з таких способів скринінгу, дріжджовий двогібридний спосіб, наведений тут (Приклад 1), застосовували для ідентифікації білка MORT-1 і потім МORT-1-зв’язуючих білків (Приклади 2-3) цього винаходу. Також, як зазначено вище і нижче, можуть використовуватися інші способи, такі, як афінна хроматографія, способи гібридизації ДНК тощо, а також добре відомі в цій галузі способи виділення, ідентифікації і характеристики MORT-1-зв'язуючого білка відповідно до цього винаходу або виділення, ідентифікації і характеристики додаткових білків, факторів, рецепторів тощо, здатних зв'язуватися з білком MORT-1 або з МОНТ-1-зв’язуючим білком відповідно до цього винаходу. Як наведено вище, МORТ-1-зв’язуючий білок може використовуватися для отримання антитіл, специфічних для MORT-1-зв'язуючого білка, наприклад, ізоформ МАСН. Ці антитіла або їхні фрагменти можуть використовуватися, як докладно наведено нижче, причому зрозуміло, що в цих застосуваннях антитіла або їхні фрагменти є антитілами, специфічними для MORT-1-зв'язуючих білків. На основі відкриттів, наведених в цьому винаході, можна зробити висновок, що принаймні деякі з ізоформ МАСН (дивись вище і Приклад 3 нижче) є протеазами, спорідненими з протеазами родини протеаз CED3/ICE, Для цих ізоформ МАСН передбачаються такі специфічні застосування в медицині: було виявлено, що вже існують специфічні інгібітори інших протеаз CED3/ICE, деякі з них можуть ефективно блокувати процеси програмованої загибелі клітин. Таким чином, згідно з цим винаходом, можна сконструювати інгібітори, які можуть запобігати індуковану лігандом FAS-R або TNF загибель клітин, шляхи, де беруть участь ізоформи протеази МАСН. Надалі, в зв"язку з унікальними властивостями послідовності цих нових протеаз МАСН, стає можливим конструювання інгібіторів, які будуть високоспецифічними стосовно індукованих THF і лігандом FAS-R ефектів. Відкриття цього винаходу забезпечує також спосіб дослідження механізму, в якому "вбиваюча (кілерна) протеаза" активізується як відгук на дію ліганд FAS-R і TNF, що уможливлює подальшу розробку лікарських засобів, які можуть контролювати ступінь цієї активації. Існують захворювання, в яких такі лікарські засоби можуть допомогти. Серед них гострий гепатит, за якого гостре ушкодження печінки, напевно, відбиває медійовану лігандом FAS-R загибель клітин печінки; аутоімунно-індукована загибель клітин, наприклад, загибель b-клітин острівців Лангерганса підшлункової залози, яка призводить до діабету; загибель клітин при відриванні трансплантанту (наприклад, нирок, серця і печінки); загибель олігодендроцитів у мозку за множинного склерозу; та інгібований СНІДом суїцид Т-клітин, який спричиняє проліферацію вірусу СНІДу і, отже, захворювання СНІДом. Як зазначено, вище і нижче, дві ізоформи MACH, а саме МАСНa2 і МАСНa3, можуть функціонувати як "природні інгібітори" ізоформ протеази MACH, і отже можуть застосовуватися як вищезгадані специфічні інгібітори цих протеаз MACH. Так само й інші речовини, такі як пептиди, органічні сполуки, антитіла тощо, можуть піддаватися скринінгу для отримання специфічних лікарських засобів, здатних інгібувати протеази MACH. Необмежувальний приклад того, як пептидні інгібітори протеаз MACH можуть конструюватися та піддаватися скринінгу, базується на попередніх дослідженнях пептидних інгібіторів протеаз ICE та ІСЕ подібних протеаз, субстратній специфічності ICE та стратегіях аналізу епітопів з використанням пептидного синтезу. Було виявлено, що мінімальною вимогою для ефективного розщеплення пептиду ІСЕ є наявність чотирьох амінокислот ліворуч від сайта розщеплення з більшою перевагою стосовно аспарагінової кислоти у положенні Р1 та з метиламіном праворуч від положення Р1 (Steath et al., 1990; Howard et al., 1991; Thornberry et al., 1992). Окрім того, флуорогенний субстрат пептид (тетрапептид), ацетил-Asp-Glu-Val-Asp-а-(4метилкумарил-7-амід), скорочено позначений як Ac-Devd-AMC, відповідає послідовності в полі-(АДФ-рибоза)полімеразі (PARP), який, як було виявлено, розщеплюється у клітинах одразу після стимуляції FAS-R, а також в інших апоптопічних процесах (Kaufmann, 1989; Kaufmann et al., 1993; Lasebnik et al., 1994), та розщеплюється ефективно СРР32 (членом родини протеаз CED3/ICE) і протеазами МАСН. Оскільки Asp у положенні Р1 субстрату, вочевидь, є важливим, тетралептиди з Asp як четвертого амінокислотного залишку та різні комбінації амінокислот у перших трьох положеннях, можуть швидко скриніруватися на сполучення з активним сайтом протеаз МАСН, наприклад, способом, розробленим Гейсеном (Geysen et al., 1987), в якому велику кількість пептидів на твердих "підкладках" піддавали скринiнгу на специфічну взаємодію з антитілами. Сполучення протеаз МАСН зі специфічними пептидами може бути виявлено у різні добре відомі способи детектування у межах кваліфікації фахівців у цій галузі, такі як радіоактивна позначка протеази МАСН тощо. Було показано, що спосіб Гейсена дає змогу тестувати щонайменше 4000 пептидів кожного робочого дня. Оскільки може виявитися вигідним конструювання пептидних інгібіторів, які вибірково інгібують протеази МАСН без втручання у процеси фізіологічної загибелі клітин, в яких беруть участь інші члени родини протеаз CED3/ICE, можна синтезувати, далі, пул пептидів, які сполучаються з протеазами МАСН у тесті, такому як зазначено вище, у вигляді флуорогенних субстратних пептидів для тестування на вибіркове розщеплення протеазами МАСН без розщеплення іншими протеазами CED/ICE. Потім пептиди, які визначалися як вибірково розщеплювані протеазами МАСН, можуть поворотно чи безповоротно модифікуватися для полегшення їхнього проникнення у клітини та інгібування активності загибелі клітин МАСН. Thornberry et al., (1994) повідомили, що тетрапептид (ацилокси)-метилкетон Ac-Tyr-Val-Ala-Asp-CH2OC(O)-[2,6-(CF)2]Ph є сильним інактиватором ICE. Так само, Milltgan et al., (1995) повідомив, що тетрапептидні інгібітори, які мають хлорметилкетонові (безповоротно) або альдегідні (поворотно) групи, інгібували ICE. Окрім того, було показано, що бензилкарбоксикарбоксил-Аsр-СН2ОС(О)-2,6-діхлорбензол (DCB) інгібує ICE (Mashіma et al., 1995). Так само, тетрапептиди, які вибірково сполучаються з протеазами MACH, можуть модифікуватися, приміром альдегідною групою, хлорметилкетоновою, (ацилокси)-метилкетоновою або СН2ОС(O)-DСВ-групою для отримання пептидного інгібітора ативності протеаз MACH. Хоча деякі специфічні інгібітори інших протеаз CED3/ICE мають змогу потрапляти у клітини, можливо знадобиться збільшення здатності пептидних інгібіторів потрапляти у клітини. Наприклад, пептиди можуть хімічно модифікуватися або замінюватися на їхні похідні для збільшення здатності потрапляти через клітинну мембрану та полегшення транспортування таких пептидів через мембрану до цитоплазми. Muranishi et al., (1991) повідомляв про отримання похідного тиротропин-звільняючого гормону з лауриновою кислотою, ліпофільного лауроїлпохідного, з хорошими характеристиками проникнення через клітинну мембранну. Zacharia et al., (1991) також повідомляли про оксидацію метіоніну до сульфоксиду та замінення пептидного зв'язку її кетометиленовим ізоефіром (СОСН2) для полегшення транспортування пептидів через клітинну мембрану. Це лише деякі з модифікацій та похідних, добре відомих фахівцям у цій галузі. Окрім того, лікарські чи пептидні інгібітори, здатні інгібувати активність загибелі клітин МАСНa1 та МАСНa2, можуть кон’югуватися чи комплексуватися з молекулами, які полегшують входження у клітину. У патенті США 5149782 подано опис кон'югування молекули, яка має транспортуватися через клітинну мембрану, з мембраноущільнювальним агентом, таким як здатні до злиття поліпептиди, поліпептиди, що утворюють іонні канали, інші мембранні поліпептиди, та з довголанцюговими жирними кислотами, приміром, міристиновою кислотою, пальмітиновою кислотою. Ці мембраноущільнювальні агенти вводять молекулярні кон'югати у ліпідний бішар клітинних мембран та полегшують їхнє входження до цитоплазми. Low et al., патент США №5108921 пропонує огляд доступних способів трансмембранної доставки молекул, таких як (але не лише таких) білки та нуклеїнові кислоти, з використанням механізму медійованої рецептором ендоцитотичної активності. Ці рецепторні системи мають системи, які розпізнають галактозу, манозу, манозо6-фосфат, трансферин, асіалослікопротеїн, транскобаламін (вітамін В12), a-2-макроглобуліни, інсулін та інші ітептидні фактори зростання, такі як епідермальний фактор (EGF). Low et al. повідомляє, що рецептори поживних компонентів, таких як рецептори біотину та фолату, можуть вигідно застосовуватися для посилення транспортування через клітинну мембрану завдяки наявності та чисельності рецепторів біотину та фолату на поверхнях мембран більшості клітин та асоційованими із ними (медійованим рецепторами) процесами трансмембранного транспортування. Так комплекс, утворений між сполукою, яка має доставлятися в цитоплазму, та лігандом, таким як біотин чи фолат, приводять до контакту з клітинною мембраною, яка несе рецептори біотину чи фолату, для ініціації опосередкованого рецептором механізму трансмембранного транспортування й, отже, створення можливості надходження бажаної сполуки до цієї клітини. Відомо, що ICE має здатність переносити істотні заміни у положенні Р 2, тож ця толерантність щодо замін використовується для розробки сильної та високовибіркової афінної мітки (тег) (Thornberry et al., 1994). Отже, положення Р2, а також, ймовірно, N-кінець тетрапептидного інгібітору можуть модифікуватися чи використовуватися для створення похідного, наприклад, приєднанням молекули біотину, для посилення здатності цих пептидних інгібіторів потрапляти крізь клітинну мембрану. Окрім того, у цій галузі знань відомо, що злиття бажаної пептидної послідовності з послідовністю лідерного/сигнального пептиду для створення "химерного пептиду" надасть змогу такому "химерному пептиду" транспортуватися через клітинну мембрану до цитоплазми. Як буде зрозуміло фахівцям у цій галузі, пептидні інгібітори протеолітичної активності MACH відповідно до цього винаходу мають також пептидоміметичні лікарські засоби чи інгібітори, які також можуть піддаватися швидкому скринінгу на сполученість з протеазою MACH, для створення, ймовірно, стабільніших інгібіторів. Крім того, має бути зрозуміло, що деякі способи полегшення чи посилення транспортування пептидних інгібіторів через клітинні мембрани, що обговорювалися вище, можливі також безпосередньо для ізоформ MACH, а також для інших пептидів та білків, які виявляють ці ефекти всередині клітин. Що стосується згадуваних у цьому описові антитіл, термін "антитіло" має на увазі поліклональні антитіла, моноклональні антитіла (mAb), химерні антитіла, антиадіотипові (anti-Id) антитіла до антитіл, які можуть бути поміченими, у розчинній чи зв'язаній формі, а також їхні фрагменти, забезпечувані будь-яким відомим способом, таким як (але не лише ним) ферментативне розщеплення, пептидний синтез чи рекомбінантні способи. Поліклональні антитіла є гетерогенними популяціями молекул антитіл, отриманих із сироватки тварин, імунізованих антигеном. Моноклональні антитіла містять по суті гомогенну популяцію антитіл, специфічних щодо антигенів, популяції яких містять по суті східні сайти зв'язування епітопу. mAb можуть отримуватися способами, відомими фахівцям у цій галузі. Дивись, наприклад, Kohler and Milstein, Nature, 256:495-497 (1975); патент США № 4376110; Ausubel et al., eds., Harlow and Lane ANTIBODIES: A LABORATORY MANUAL, Cold Spring Harbor Laboratory (1988); і Colligan et al., eds., Current Protocols in Immunology, Greene Publishing Assoc. and Wiley Interscience N.Y., (1992-1996), зміст яких повністю подано у вигляді посилань. Такі антитіла можуть належати до будь-якого класу імуноглобулінів, зокрема, IgG, IgM, IgE, IgA, GILD та до будь-якого їхнього підкласу. Гібридому, яка продукує mAb відповідно до цього винаходу, можна культивувати in vitro, in situ чи in vivo. Завдяки отриманню високих титрів in vivo чи in situ цьому винаходу на сьогодні надають перевагу серед інших способів отримання. Химерні антитіла є молекулами, різні частини яких походять з різних видів тварин, такими як молекули із наявністю варіабельної області, що походить з мишачого mAb, та константної області з імуноглобуліну людини. Химерні антитіла використовують насамперед для зниження імуногенності при їхньому застосуванні та для збільшення виходів, наприклад, коли мишачі mAb мають більші виходи при використанні гібридом, але більшу імуногенність у людини, отже використовують химерні mab людина/миша. Химерні антитіла та способи їх отримання відомі у цій галузі (Cabilly et al., Proc. Natl. Acad. Sci. USA 81:3273-3277 (1984); Morrison et al., Proc. Natl. Acad. Sci. USA 81:6851-6855 (1984); Boulianne et al., Nature 312:643-646 (1984); Cabilly et al., European Patent Application 125023 (надруковано 14 листопада 1984p.); Neuberger et al., Nature 314:268-270 (1985); Tanigushi et al., European Patent Application 171496 (надруковано 19 лютого 1985p.); Morrison et al., European Patent Application 173494 (надруковано 5 березня 1986p.); Neuberger et al., заявка РСТ WO8601533 (надруковано 13 березня 1986p.); Kudo et al., European Patent Application 184187 (надруковано 11 червня 1986p.); Sahagan et al., J. Immunol. 137:1066-1074 (1986); Robinson et al., International Patent Application No WO8702671 (надруковано 7 травня 1987p.); Liu et al., Proc. Natl. Acad. Sci. USA 84:3439-3443 (1987); Better et al., Science 240:1041-1043 (1988); і Harlow and Lane, ANTIBODIES: A LABORATORY MANUAL, supra, (наведено повністю у посиланнях). Антиідіотипове (anti-Id) антитіло є антитілом, яке розпізнає унікальні детермінанти, здебільшого зв'язані з антигензв’язуючим сайтом антитіла. Id-антитіло може отримуватися імунізацією тварини того ж виду й генетичного типу (наприклад, штаму мишей), що й джерело mAb, до якого отримують anti-Id. Імунізована тварина розпізнаватиме ідіотипову детермінанту імунізуючого антитіла та відповідатиме на неї продуціюванням антитіла до цих ідіотипових детермінант (anti-ld-антитіла). (Дивись, наприклад, патент США №4699880, наведений тут у посиланнях). Anti-Id може також використовуватися як "імуноген" для індукції імунного відгуку в іншій тварині з отриманням так званого анти-антиідіотипового антитіла. Anti-anti-ld може бути епітопно-ідентичним до вихідного mAb, яке індукувало anti-Id. Отже, за допомогою антитіл до ідіотипових детермінант mAb можна ідентифікувати інші клони, які експресують антитіла ідентичної специфічності. Відповідно до цього, mAb, які генеруються проти MORT-1-зв'язуючих білків, їхніх аналогів, фрагментів чи похідних відповідно до цього винаходу, можна використовувати для індукції anti-ld-антитіл у придатних тварин, таких як миші ВАLB/с. Клітини селезінки з таких імунізованих мишей використовують для отримання антиідіотипових гібридів, які секретують антиідіотипові антитіла (anti-Id mAb). Надалі, ці антиідіотипові антитіла можуть сполучатися з носіями, такими як гемоцианін фісурели (KLH) та використовуватися для імунізації додаткових мишей ВАLB/с. Сироватки з цих мишей будуть містити анти-антиідіотипові антитіла, які можуть мати зв’язуючу здатність вихідних mAb, специфічних щодо епітопу MORT-1-зв'язуючого білка або його аналогів, фрагментів чи похідних. Таким чином, anti-Id mAb мають власні ідіотипові епітопи, або ж "ідіотопи", за структурою однакові з оцінюваним епітопом, таким як GRB-протеїн-а. Термін "антитіла" має на увазі також як інтактні молекули, так і їхні фрагменти, такі як, наприклад, Fab і F(ab¢)2, здатні зв'язувати антиген. Фрагменти Fab і F(аb')2 не мають Fc-фрагмента інтактного антитіла, виводяться з кровотоку швидше та можуть мати менше неспецифічне зв'язування з тканиною, ніж інтактне антитіло (Wahl et al., J. Nucl. Med. 24:316-325 (1983)). Має бути зрозумілом, що фрагменти Fab і F(ab¢)2 та інші фрагменти антитіл, застосовувані в цьому винаході, можуть використовуватися для виявлення та кількісного визначення MORT-1-зв'язуючого білка відповідно до описаних тут способів для інтактних молекул антитіл. Такі фрагменти утворюються, як правило, протеолітичним розщепленням із застосуванням таких ферментів, як папаїн (для отримання (Fab-фрагментів) чи пепсин (для отримання F(ab')2-фрагментів). Антитіло "здатне зв’язувати" молекулу, якщо воно має змогу специфічно реагувати з цією молекулою для зв'язування її з антитілом. Термін "епітол" стосується частини будь-якої молекули, здатної бути зв'язаною антитілом, яка може розпізнаватися цим антитілом. Епітопи або "антигенні детермінанти", як правило, складаються з хімічно активних груп поверхні молекули, таких як амінокислоти або цукрові бокові ланцюги, і мають специфічні тримірні структурні характеристики, а також специфічні характеристики заряду. "Антигеном" є молекула або частина молекули, здатна зв'язуватися антитілом і додатково індукувати тварину для продукування антитіла, здатного зв’язуватися з епітопом цього антигену. Антиген може мати один чи кілька епітопів. Специфічна реакція означає, що антиген з високою виборністю реагуватиме з його відповідним антитілом, але не з безліччю інших антитіл, індукованих іншими антигенами. Антитіла, зокрема, фрагменти антитіл, застосовувані в цьому винаході, можна використати для кількісного або якісного виявлення MORT-1-зв'язуючого білка у спробі або для виявлення присутності клітин, експресуючих MORT-1-зв'язуючий білок відповідно до цього винаходу. Це може здійснюватися імунофлуоресцентними способами, які використовують флуоресцентне мічене антитіло (дивись нижче), в поєднанні з мікроскопічними (з використанням світлового мікроскопа), проточно-цитометричними або флуорометричними способами детектування. Антитіла (або їхні фрагменти), застосовувані у цьому винаході, можна використовувати гістологічно, як, наприклад, в імунофлуоресцентній або імуноелектронній мікроскопії, для виявлення in situ MORT-1зв'язуючого білка відповідно до цього винаходу. Виявлення in situ можливе через отримання гістологічного зразка з пацієнта і забезпечення міченого антитіла з цього винаходу до такого зразка. Антитіло (або його фрагменти) здебільшого забезпечують шляхом нанесення або нашаровування міченого антитіла (або його фрагмента) на біологічну пробу. За допомогою такої процедури можна виявити не лише присутність MORT-1зв'язуючого білка, а також його розподіл на обстежуваній тканині. Використовуючи цей винахід, спеціалісти зі звичайною кваліфікацією в цій галузі легко зрозуміють, що різноманітність гістологічних способів (таких як процедури забарвлення) може модифікуватися для досягнення такого детектування in situ. Такі тести на МORT-1-зв'язуючий білок відповідно до цього винаходу звичайно включають інкубування біологічної проби, такої як біологічна рідина, екстракт тканини, свіжозібрані клітини, такі як лімфоцити або лейкоцити, або клітини, інкубовані в культурі тканини, за присутності детектовано міченого антитіла, здатного ідентифікувати цей MORT-1-зв'язуючий білок, і детектування цього антитіла будь-яким із добре відомих у цій галузі способів. Біологічна проба може оброблятися твердофазним супортом чи носієм, таким як нітроцелюлоза, або іншим супортом чи носієм, здатним (мобілізувати клітини, клітинні частки або розчинні білки. Потім супорт чи носій промивають придатними буферами з подальшою обробкою детектовано міченим антитілом згідно з цим винаходом, як наведено вище. Твердофазний супорт чи носій можуть вдруге промиватися буфером для видалення незв'язаного антитіла. Кількість зв'язаної мітки на твердому супорті чи носії може потім визначатися стандартними способами. Під "твердофазним супортом", "твердофазним носієм", "твердим супортом", "твердим носієм", "супортом" чи "носієм" мається на увазі будь-який супорт чи носій, здатний зв'язувати антиген або антитіла. Добре відомі супорти чи носії містять скло, полістирол, поліпропілен, поліетилен, декстран, найлон, амілази, природні та модифіковані целюлози, поліакріламіди, gabbros і магнетит. Для реалізації мети винаходу носій за своєю природою може бути певною мірою розчинним або нерозчинним. Матеріал супорта фактично може мати будьяку можливу структурну конфігурацію, за умов, що він здатний зв'язуватися з антигеном або антитілом. Так, конфігурація супорта чи носія може бути сферичною, у вигляді гранули, циліндричної, як у випадку внутрішньої поверхні тест-пробірки або зовнішньої поверхні стержня. Альтернативно ця поверхня може бути плоскою, такою як пластинка, тест-смужка тощо. Переважно супорти чи носії містять гранули з полістиролу. Спеціалістам у цій галузі напевно відомі інші придатні носії для зв'язування антитіла чи антигену або вони можуть добрати їх за допомогою рутинного експериментування. Зв'язуючу активність конкретної партії наведених вище антитіл відповідно до цього винаходу можна виявити за допомогою добре відомих способів. Спеціалісти в цій галузі зможуть виявити робочі й оптимальні тест-умови для кожного визначення за допомогою рутинного експериментування. Iнші такі стадії, як промивання, перемішування, трусіння, фільтрування тощо, можуть додаватися до цих тестів, що є звичайним і необхідним для конкретної ситуації. Одним із способів, у якому антитіло цього винаходу може детектовано помічатися, являє собою зв'язування його з ферментом і використання в імуноаналізі (ЕІА). Цей фермент, у свою чергу, при експонуванні потім з придатним субстратом реагуватиме з субстатом з утворенням хімічної молекули, яка може детектоватися, наприклад, спектрофотометричним, флуорометричним способами або візуально. Ферменти, які можна використовувати для детектованого мічення антитіл, включають (але не тільки) малатдегідрогеназу, стафілококову нуклеазу, дельта-5-стереідизомеразу, алкогольдегідрогеназу дріжджів, альфа-гліцерофосфатдегідрогеназу, тріозофосфатизомеразу, пероксидазу хріну, лужну фосфатазу, аспарагіназу, глюкозооксидазу, бета-галактозидазу, рибонуклеазу, уреазу, каталазу, глюкозо-6фосфатдегідрогеназу, глюкоамілазу і ацетилхолінестеразу. Детектування може виконуватися колориметричними способами, в яких використовують хромогенний субстрат для ферменту. Детектування може також виконуватися візуальним порівнянням ступеня ферментативної реакції субстата в порівнянні з так само приготованими стандартами. Детектування може виконуватися з використанням будь-якого з безліччі інших імуноаналізів. Наприклад, за допомогою радіоактивного мічення антитіл або фрагментів антитіл можна детектувати R-PTP-азу з застосуванням радіоімуноаналізу (RIA). Добрий опис RIA можна знайти в Laboratory Techniques and Biochemistry in Molecular Biology, by Work, T.S. et al., North Holland Publishing Company, NY (1978) з конкретним посиланням на розділ, що має назву "An Introduction to Radioirnmune Assay and Related Techniques" by Chard, T. (наведений тут як посилання). Радіоактивний ізотоп може детектуватися у такий спосіб, як використання длічильника або сцинтиляційного лічильника або радіоавтографії. Згідно з цим винаходом, антитіло можна також позначити флуоресцентним сполученням. При експонуванні флуоресцентно поміченого антитіла на світлі придатної довжини хвилі його присутність можна детектувати завдяки флуоресценції. До найзвичайніших застосовуваних для помічення поєднань належать ізотіоціанат, флуоресцеїна, родамін, фікоеритрин, фікоціанін, алофікоціанін, офталевий альдегід і флуорескамін. Антитіло можна також детектовано помітити з використанням металів, які випромінюють флуоресценцію, таких як 152Е або інші метали ряду лантанидів. Ці метали можуть приєднуватися до антитіла за допомогою таких хелатуючих метали груп, як діетилентріамінпентаоцтова кислота (ЕТПА). Антитіло може також детектовано помічатися поєднанням його з хемілюмінесцентною сполукою. Присутність хемілюмінесцентно-міченого антитіла визначають потім детектуванням присутності люмінесценції, яка виникає впродовж хімічної реакції. Прикладами найпоширеніших хемілюмінесцентнопозначаючих сполук є люмінол, theromatic складний ефір акрідинія, імідазол, сіль акрідинія і оксалатний ефір. Біолюмінесцентні сполуки також можна використовувати для помічення антитіла відповідно до цього винаходу. Біолюмінесценція являє собою тип хемілюмінесценції, виявленої в біологічних системах, в яких каталітичний білок збільшує ефективність хемілюмінесцентної реакції. Присутність бioлюмінесцентного білка визначають детектуванням присутності люмінесценції. Важливими біолюмінесцентними сполуками для помічення є люцеферін, люціфераза й екворін. Молекулу антитіла відповідно до цього винаходу можна застосовувати для використання в імунометричному аналізі, також відомому як "дво-сайтовий" або "сендвіч"-аналіз. При типовому імунометричному аналізі певну кількість немненого антитіла (або фрагмента антитіла) зв’язують із твердим супортом чи носієм і додають певну кількість детектовано поміченого розчинного антитіла для детектування і/або кількісного визначення трьохкомпонентного комплексу, що утворюється між твердофазним антитілом, антигеном і міченим антитілом. Типові або переважні імунометричні тести містять "прямі" тести, в яких антитіло, зв'язане з твердою фазою, спочатку приводять у контакт з тестованою пробою для екстракції антигену з цієї проби утворенням двокомпонентного комплексу твердофазне антитіло-антиген. Після придатного періоду інкубації твердий супорт чи носій промивають для видалення залишків рідкої проби, яка містить непрореагований антиген, якщо він був присутній, а потім приводять у контакт з розчином, що містить певн кількість міченого антитіла (яке функціонує як "репортерка молекула"). Після другого періоду інкубації для утворення комплексу міченого антитіла з антигеном, зв'язаним з твердим супортом чи носієм через немічене антитіло, твердий супорт чи носій промивають вдруге для видалення непрореагованого міченого антитіла. У "сендвіч"-аналізі іншого типу, який можна також застосовувати з антигенами відповідно до цього винаходу, використовують так звані "одночасні" або "зворотні" тести. "Одночасний" тест включає лише одну стадію інкубації, коли антитіло, зв'язане з твердим супортом чи носієм, і мічене антитіло разом і водночас додають у пробу, що тестують. Після завершення інкубації твердий супорт чи носій промивають для видалення залишку рідкої проби і некомплексованого міченого антитіла. Присутність міченого антитіла, зв'язаного з твердом супортом чи носієм, визначають потім, як у стандартному "прямому" сендвіч-аналізі. У "зворотному" тесті використовують ступінчасте додавання спочатку розчину міченого антитіла до рідкої проби, а потім неміченого антитіла, зв’язаного з твердим супортом чи носієм після придатного періоду інкубації. Після другої інкубації тверду фазу промивають стандартним способом для вивільнення її від залишку тестованої проби і розчину непрореагованого міченого антитіла. Потім мічене антитіло, зв'язане з твердим супортом чи носієм, визначають, як в "одночасному" так і "прямому" аналізах. MORT-1-зв'язуюі білки відповідно до цього винаходу можна отримати у будь-який стандартний спосіб отримання рекомбінантних ДНК (дивись, наприклад, Sambrook et al., 1989 і Ansabel et al., 1987-1995, supra), в якому придатні еукаріотичні або прокарїотичні клітини-господарі, добре відомі в цій галузі, трансформують придатними еукаріотичними або прокаріотичними векторами, які містять послідовності, що кодують ці білки. Тому, цей винахід стосується також екепресуючих векторів і трансформованих господарів, які використовують для отримання білків, згідно з цим винаходом. Як згадувалося вище, ці білки містять також біологічно активні аналоги, фрагменти та похідні, і отже, вектори, які кодують їх, також включають вектори, що кодують аналоги і фрагменти цих білків, а трансформовані господарі включають господарів, які продукують ці аналоги і фрагменти. Похідні цих білків, утворені трансформованими господарями, являють собою похідні, отримані стандартною модифікацією білків або їхніх аналогів чи фрагментів. Цей винахід стосується також і фармацевтичних композицій, які містять рекомбінантні вірусні (що виникають з вірусів тварин) вектори, що кодують MORT-1-зв'язуючі білки, причому такий вектор кодує білок поверхні вірусу, здатний зв'язувати поверхневі білки специфічної клітини-мішені (наприклад, ракових клітин), для спрямування вставлених послідовностей MORT-1-зв'язуючого білка в ці клітини. Інші фармацевтичні композиції відповідно до цього винаходу містять як активний інгредієнт (а) олігонуклеотидну послідовність, яка кодує антизмістовну послідовність послідовності MORT-1-зв'язуючого білка, або (b) лікарські засоби, що блокують протеолітичну активність ізоформ MACH. Фармацевтичні композиції згідно з цим винаходом містять достатню кількість активного інгредієнта для досягнення передбачуваної мети. Крім того, фармацевтичні композиції можуть містити фармацевтично придатні носії, які включають наповнювачі та добавки для полегшення обробки активних поєднань на препарати, котрі можуть використовуватися фармацевтично, і які можуть стабілізувати такі препарати для введення суб’єкту, який потребує їх, також добре відомі спеціалістам в цій галузі. MORT-1-зв'язуючий білок MACH експресується в різних тканинах при значно відмінних рівнях, і, вочевідь, з різними розподілами ізотопів. Ці відмінності можливо сприяють тканиноспецифічним властивостям відгуку на дію ліганд FAS/APO1 і TNF. Як і у випадку з іншими гомологами CED3/ICE (Wang et al. 1994; Alnemri et al., 1995), виявлено, що ізоформи MACH, які містять неповні райони CED3/ICE, (наприклад, МАСНa3), володіють інгібіторною дією на активність коекспресованих молекул МАСНa1 і МАСНa2; також виявлено, що вони інгібують індукцію загибелі клітин FAS/APO1 і p55-R. Експресія таких інгібіторних ізоформ у клітинах може бути механізмом клітинного самозахисту проти опосередненої FAS/APO1 і p55-R цитотоксичності. Широка гетерогенність ізоформ MACH, істотно більша за гетерогенність, яка спостерігається для будь-якої з інших протеаз родини CED2/ICE, повинна уможливлювати особливо тонку настройку активних ізоформ MACH. Можливо також, що деякі з ізоформ MACH виконують інші функції. Здатність МАСНa1 зв'язуватися як з MORT-1, так і з МАСНa1, припускає, що ця ізоформа могла б дійсно посилювати активність ферментативно активних ізоформ. Невелика цитотоксичність, яка спостерігається в культурах 293-EBNA і MCF7, трансфікованих цією ізоформою, і доволі значний цитотоксичний ефект, який виявлено в клітинах НеLа, відображує, певно, активацію ендогенно експресованих молекул МАСНa при зв'язуванні з трансфікованими молекулами МACHb1. Зрозуміло, що деякі ізоформи MACH могли б також функціонувати як сайти стикування для молекул, які беруть участь в інших, нецитотоксичних ефектах FAS/APO1 і рецепторах TNF. Внаслідок унікальної здатності FAS/APO1 і рецепторів TNF спричиняти загибель клітин, а також здатності рецепторів TNF запускати інші активності, що пошкоджують тканини, порушення у функції цих рецепторів могли б бути особливо шкідливими для організму. Дійсно, було показано, що як надмірне, так і недостатнє функціювання цих рецепторів сприяє патологічним виявам різних захворювань (Vassalli, 1992; Nagata and Golstein, 1995). Ідентифікація молекул, які беруть участь в активності передавання сигналу цих рецепторів, і знаходження шляхів модулювання активності цих молекул, могли б стати основою нових терапевтичних підходів. У зв’язку з припустимою центральною роллю МАСНa в опосередненій FAS/APO1 і TNF токсичності є особливо важливим утворення лікарських засобів із здатністю блокувати протеолітичну функцію МАСНa, як це було зроблено для деяких інших білків родини CED/ICE (Thornberry et al., 1995; Enari et al., 1995; Los et al., 1995). Унікальні ознаки гомолога CED/ICE всередині молекул МАСНa дають змогу сконструювати лікарські засоби, які б змогли специфічно впливати на його активність. Такі лікарські засоби могли б забезпечити захист від надмірної імуноопосередненої цитотоксичності за участю МАСНa, без втручання в процеси фізіологічної загибелі клітин, в яких беруть участь інші члени родини CED/ICE. Інші аспекти цього винаходу стануть зрозумілішими з наведених далі прикладів. Цей винахід надалі описуватиметься докладніше в наведених нижче необмежувальних прикладах і відповідних фігурах. Слід також зазначити, що процедури (і) двогібридного скринінга і двогібридного тесту b-галактозидази; (іі) індукованої експресії, метаболічного мічення та імуншреципітацн білків; (ііі) зв'язування in vitro; (iv) оцінки цитотоксичності; і (v) нозерн блотінга і аналізу послідовності, які наведено в Прикладі 1 (дивись також Boldin et al., 1995b) і 2 нижче, у відношенні MORT-1 і MQRT-1-зв'язуючого білка, однаково можуть застосовуватися (з деякими модифікаціями) для відповідного виділення, клонування і визначення характеристик MACH і його ізоформ. Ці процедури, отже, збудовані як повний опис тих самих процедур, які використовують для виділення, клонування і визначення характеристик MACH згідно з цим винаходом, як докладно описано в Прикладі 3 нижче. Приклад 1: Клонування і виділення білка MORT-1, який зв'язується з внутрішньоклітинним доменом FAS-R (і) Двогібридний скринінг і двогібридний тест експресії b-галактозидази Для виділення білків, які взаємодіють з внутрішньоклітинним доменом FAS-R, використовували дріжджову двогібридну систему (Fields and Song, 1989). Коротко, ця двогібридна система являє собою генетичний аналіз на основі дріжджів для виявлення специфічних білок-білкових взаємодій in wvo шляхом відновлення еукаріотичного активатора транскрипції, такого як GAL4, який має два окремих домени, ДНК-зв'язуючий домен і домен активації, причому ці домени при експресії та поєднанні разом утворюють відновлений білок GAL4, здатний зв'язуватися з активуючою послідовностю, що лежить проти ходу транскрипції, яка, в свою чергу, активує промотор, що керує експресією репортерного гену, такого як LacZ або HIS3, експресію якого легко спостерігати в культивованих клітинах. У цій системі гени для передбачуваних взаємодіючих білків клонують в різні експресуючі вектори. В одному експресуючому векторі послідовність передбачуваного білка клонують у фазі з послідовністю ДНК-зв'язуючого домену GAL4 для утворення гібридного білка з ДНК-зв'язуючим доменом GAL4, а в іншому векторі послідовність іншого передбачуваного взіємодіючого білка клонують у фазі з послідовністю домену активації GAL4 для створення гібридного білка з доменом активації GAL4. Потім два гібридних вектори контрансформують у дріжджовий штам-господар, який має репортерний ген LacZ або HIS3 під контролем сайтів зв'язування GAL4 проти ходу транскрипції. Тільки трансформовані клітини (контрансформанти), в яких експресуються ці два гібридних білки, здатні взаємодіяти один з одним, матимуть експресію репортерного гену. За присутності репортерного гену LacZ, клітини-господарі, які експресують цей ген, стануть блакитними при додаванні X-gal до культур. Отже, блакитні колонії свідчать про те, що два клонованих кандидати-білки здатні взаємодіяти один з одним. За допомогою цієї двогібридної системи клонували внутрішньоклітинний домен, FAS-IC, окремо у вектор pGBT9 (який несе ДНК- зв'язуючу послідовність GAL4, отриману з CLONTECH, USA, дивись нижче) для утворення злитих білків з ДНК-зв'язуючим доменом GAL4. Для клонування FAS-R у pGBT9 використовували клон, який кодує повнорозмірну послідовність кДНК FAS-R (WO9531544), з якої внутрішньоклітинний домен (lС) вирізали стандартними процедурами за допомогою різних рестриктаз і потім вбудовували у вектор pGBT9, відкритий в районі його сайтів множинного клонування (MCS), відповідними рестриктазами. Слід відзначити, що FAS-JC простягається від амінокислотного залишку 175 до залишку 319 інтактного FAS-R, причому ця частина, яка містить залишки 175-319, є FAS-IC, вбудований у вектор pGBT9. Потім наведений вище гібридний (химерний) вектор котрансфікували разом з бібліотекою кДНК з клітин HeLa людини, клонований у вектор pGAD GH, який несе активуючий домен GAL4, в дріжджовий штамгосподар НЕ7с (всі наведені вище вектори, pGBT9 і pGAD GH, які несуть кДНК-бібліотеку клітин HeLa, і штам дріжджів куплені в Clonteeh Laboratories, Inc., USA, як частина двогібридної системи MATCHMAKER, № РТ1265-1). Котрансфіковані дріжджі відбирали на здатність зростати в середовищі без гістидину (His середовище), причому вирощування колоній свідчить про позитивні трансформанти. Потім відібрані дріжджові клони тестували на здатність експресувати ген LacZ, тобто на їх активність LACZ, і це виконували шляхом додавання X-gal до культурального середовища, яке катаболізується з утворенням блакитного забарвленого продукту b-галактозидазою, ферментом, який кодовано геном lacZ. Таким чином, блакитні колонії вказували на наявність активного гену lacZ. Для активності гену lacZ необхідно, щоб активатор транскрипції GAL4 був присутнім у активній формі в трансформованих клонах, а саме, щоб ДНК-зв'язуючий домен GAL4, кодований вищевказаним гібридним вектором, правильно поєднувався з активуючим доменом GAL4, кодованим іншим гібридним вектором. Таке поєднання можливе тільки у випадку, якщо два білки, злиті з кожним з доменів GAL4, здатні стабільно взаємодіяти (зв'язуватися) один з одним. Таким чином, His+ і блакитні (LACZ+) колонії, що їх було виділено, є колоніями, які котрансфікувалися вектором, що кодує FAS-lС і вектором, що кодує білковий продукт, який виникає з клітин HeLa людини і має здатність стабільно зв'язуватися з FAS-IC. Плазмідну ДНК з His+, LACZ+ дріжджових колоній виділяли і вводили електропорацією в штам E. coli HB 101 стандартними процедурами з подальшим відбором Leu+ і ампіцилінрезистентних трансформантів, причому ці трансформанти є трансформантами, які несуть гібридний вектор pGAD GH із такими кодуючими послідовностями, як AMPR, так і Lеu2. Отже такі трансформанти є клонами, які несуть послідовності, що кодують нові ідентифіковані білки, здатні зв'язуватися з FAS-IC. Потім з цих трансформованих клітин E. coli виділяли плазмідну ДНК і повторно тестували за допомогою: (а) повторної трансформації їх початкової гібридної плазміди, що містить внутрішньоклітинний домен FASR, (гібридом pGBT9, який несе FAS-IC) в дріжджовий штам HF7, як наведено вище. Для контролю використовували тільки вектори, які несуть послідовності, що кодують сторонній білок, наприклад, рАСТ-ламін або pGBT9, для котрансформації з плазмідою, яка кодує FAS-IC-зв'язуючий білок (тобто MORT-1). Потім котрансформовані дріжджі тестували на зростання на одному His середовищі або з різними рівнями 3амінотріалзола; і (b) повторної трансформації плазмідної ДНК Я початкової FAS-IC-гібридною плазмідою і контрольними плазмідами, наведеними в (А), в дріжджові клітини-господарі штаму SEY526 і визначення LACZ+-активностi (ефективності утворення b-gal, тобто утворення блакитного забарвлення). Аналіз результатів описаних вище тестів виявив, що розподілення росту колоній в Ніs -середовищі було ідентичним розподіленню LACZ-активності, як було відзначено за кольором колоній, тобто Ніs+-колонії були також LACZ+. Далі LACZ-активність в рідкій культурі (кращих умовах культивування) відзначали після трансфекції гібридами з ДНК-зв'язуючим доменом GAL4 і активуючим доменом GAL4 в дріжджі-господарі SFY526, які мають кращу індукованість LACZ активатором транскрипції GAL4, ніж клітини-господарі HF7. За допомогою описаної вище процедури було ідентифіковано, виділено та охарактеризовано білок, який раніше називався MORT-1, а тепер дістав назву MORT-1 ("Медіатор індукованої рецептором токсичності"). Окрім того, слід відзначити, що серед описаних вище двогібридних b-галактозідазних тестів експресію bгалактозідази оцінювали також переважним тестом на фільтрі. У цьому скринінгу було виявлено, що п'ять з близько 3x106 кДНК містять вставку кДНК MORT-1. Потім виділені в такий спосіб клоновані вставки кДНК MORT-1 секвенували за допомогою стандартних процедур секвенування ДНК. Амінокислотну послідовність MORT-1 (SEQ ID No 2) розшифровували з цієї послідовності ДНК. Нумерація залишків у білках, кодованих цими вставками кДНК, відповідає нумерації банку Swiss-Prot. Делеційовані мутанти отримували за допомогою ПЛР, а точкові мутанти-олігонуклеотид-спрямованим мутагенезом (Current Protocols in Molec. Biol., 1994). (іі) Індукована експресія, метаболічне мічення і імунопреципітація білків У клітинах HeLa експресували MORT-1, N-зв'язаний з октапептидом FLAG (FLAG-MORT-1; Eastman Kodak, New Haven, Ct, USA), FAS-IC, FAS-R, p55-R, химеру, яка містить внутрішньоклітинний домен p55-R (амінокислоти 1-168), злитий з трансмембранним і внутрішньоклітинним доменом FAS-R (амінокислоти 153319), і кДНК люціферази як контроль. Експресно проводили з використанням контрольованого тетрацикліном експресуючого вектору в клоні клітин HeLa (HtTa-1), що експресує контрольований тетрацикліном трансактиватор (Gossen and Bujard, 1992); дивись також Boldin et al., 1995). Метаболічне мічення [35Sметіоніном і [35S]-циcтеїном (DUPONT, Wilmington, DE, USA and Amersham, Buckinghamshire, England) виконували через 18 годин після трансфекції подальшим 4-годинним інкубуванням при 37°С в модифікованому Дульбеко середовищі Ігла, яке не містить метіоніну і цистеїну, але містить додатково 2% діалізовану телячу сироватку. Потім клітини лізирували в буфері RIPA (10мМ Трiс-НСІ, рН 7,5, 150мМ NaCI, 1% NP-4G, 1% деоксихолат, 0,1% ДСН і 1мМ ЕДТА) і лізат заздалегідь освітлювали інкубуванням зі сторонньою кролячою антисироваткою (3мкл/мл) і гранулами Protein G-Sepharose (Pharmacia, Uppsala, Sweden; 60мкл/мл). Імунолреципітацію виконували інкубуванням впродовж 1 години при 4°С аліквот 0,3мл лізату з мишачими моноклональними антитілами (5мкл/аліквота) проти октапептиду FLAG (M2; Eastman Kodak), p55-R (№18 і №20); Engelmann et al., 1990) або FAS-R (ZB4; Kamiya Southand Oaks, Ca., USA) або з мишачими антитілами сумісного ізотопу як контролю, з наступним додатковим інкубуванням впродовж 1 години з гранулами Protein G-Sepharose (30мкл/аліквота). (ііі) Зв'язування in vitro Злиті білки глутатіон-S-трансферази (GST) з FAS-IC дикого типу або з мутованим FAS-IC отримували й адсорбували на тлутатіон-агарозних гранулах (дивись Boldin et al., 1995; Current Protocols in Molecular Biology, 1995; Frangioni and Neel, 1993). Зв'язування метаболічно міченого злитого білка FLAG-MORT-1 з GST-FAS-IC оцінювали інкубуванням цих гранул упродовж 2 годин при 4°С з екстрактами клітин HeLa, метаболічно міченими [35S]-метіоніном (60мкКи/мл), які експресують FLAG-MORT-1. Екстракти готували в буфері, який містить 50мМ Тріс-НСІ, рН 7,5, 150мМ NaCI, 0,1% NP-40, 1мМ дитіотреїтил, 1мМ EДТА, 1мМ фенілметилсульфонілфторид, 20мкг/мл Апротиніну, 20мкг/мл Лейпептину, 10мМ фторид натрію і 0,1мМ ванадат натрію (1мл на 5´105 клітин). (iv) Оцінювання цитотоксичності, яка запускається індукованою експресією MORT-1 кДНК MORT-1, FAS-IC, p55-R і люциферази розміщували у контрольованому тетрацикліном експресуючому векторі та трансфікували в клітини HtTA-1 (лінія клітин HeLa) (Gossen and Bujard, 1992) разом з кДНК секретованої плацентарної лужної фосфатази, розміщували під контроль промотора SV40 (вектор pSBC-2, Dirks et ah, 1993), Загибель клітин оцінювали через 40 годин після трансфекції або за допомогою тесту вбирання барвника нейтрального червоного (Wallach, 1994), або специфічно оцінкою загибелі в клітинах, експресуючих трансфнсовані ДНК шляхом визначення кількості плацентарної лужної фосфатази (Berger et al., 1988), секретованої в середовище для вирощування в останні 5 годин інкубування. У другій серії експериментів для аналізу району білка MORT-1, який бере участь у зв'язуванні з FAS-lC, наступні білки експресували тимчасово в клітинах HeLA, які містять контрольований тетрацикліном трансактиватор (HtTA-1), з використанням контрольованого тетрацикліном експресуючого вектора (pUHD103): один FAS-R людини; FAS-R людини, а також N-кінцеву частину MORT-1 (амінокислоти 1-117, "голова MORT-1"); FAS-R людини, а також С-кінцеву частину MORT-1, яка містить район гомологи його "домену загибелі" (амінокислоти 130-245, "MORT-1 DD"); Flag-55.11 (амінокислоти 309-900 білка 55.11), злитого при Nкінці з октапептидом FLAG, причому білок 55.11 є специфічно р55-ІС-зв'язуючим білком. Через 20 годин після трансфекції клітини трипсимізуваян і повторно зисіезям при концентрації 30 000 клітин на лунку. Після 24 годин додаткової інкубації клітини обробляли впродовж 6 годин моноклональним антитілом проти внутрішньоклітинного домену FAS-R (моноклональне антитіло СН-11, Oncor, Gaithersburg, MD, USA) при різних концентраціях (0,001-10мкг/мл моноклонального антитіла), в присутності 10мкг/мл циклогексиміду. Потім визначали життєздатність клітин тестом поглинання нейтрального червоного, і ці результати наведені в відсотках до кількості життєздатних клітин порівняне з клітинами, які інкубували тільки з циклогексимідом (за відсутністю моноклонального антитіла СН-11 проти FAS-R). (v) Нозерн-аналіз і аналіз послідовності Полі А+-РНК виділяли з загальної РНК клітин HeLa (Oligotex-dT-mRNA kit. QІАGEN, Ніlden, Germany), Нозерн-аналіз з використанням кВДК MORT-1 як зонду здійснювали у загальноприйнятні способи (дивись Bolding et al., 1995). Нуклеотидну послідовність MORT-1 визначали в обох напрямках способом дідезокситермінації ланцюгу. Аналіз послідовності кДНК MORT-1, клонований двогібридним способом, показав, що вона кодує новий білок. Подальше застосування двоіібридного тесту дня оцінювання специфічності зв'язування цього білка (MORT-1 означає "Медіатор індукованої рецептором токсичності") з FAS-ІС, з яким він зв'язується, призвело до таких наслідків (Фіг. 1): (а) Білок MORT-1 зв’язується як з людським, так і з мишачим FAS-IC, але не зв'язується з кількома іншими тестованими білками, в тому числі з трьома рецепторами родини рецепторів TNF/NGF (рецепторами TNF р55 і р75 і CD40); (b) Було показано, що замісницькі мутації в положенні 255 (llе) у "домені загибелі" FAS-R знищили передавання сигналу як in vitro, так і in vivo (мутація Ipreg (Watanabe-Fukunga et al., 1992; Itoh and Nagata, 1993), також запобігає зв'язуванню MORT-1 з FAS-1C; (с) Сайт зв'язування MORT1 з FAS-R знаходиться всередині "домену загибелі" цього рецептора; і (d) MORT-1 зв'язується сам з собою. Це сaмозв’язування і зв'язування MORT-1 з FAS-R вiдбувається за участі різних ділянок цього білка: Фрагмент MORT-1, відповідний залишкам 1-117, зв'язується з повнорозмірним MORT-1, але не зв'язується сам з собою і з FAS-lC. Навпаки, фрагмент, відповідний залишкам 130-245, зв'язується з FAS-R, але не зв'язується з MORT1 (Фіг.1). Окрім того, з результатів, наведених на Фіг.1, видно, що район "домену загибелі" FAS-R є вирішальним для самоасоціації FAS-IC, як і район "домену загибелі" p55-R для самоасоціації p55-R=IC. Делеції на обох сторонах цих "доменів загибелі" не впливають на здатність їхньої самоасоціаціі, проте делеція всередині цих "доменів загибелі" дійсно впливає на самоасоціацію. У випадку MORT-1, зв’язування MORT-1 з FAS-IC також залежить від повного "домену загибелі" FAS-R, проте вона також не залежить від районів поза району "домену загибелі" для зв'язування FAS-IC. На Фіг.1 подано взаємодію білків, кодованих конструкціями ДHК-зв’язуючого домену та активуючого домену GAL4 (pGBT9 і pGAD-GH) у трансфікованих дріжджах SFY526, оцінюване тестем експресії bгалактозидази на фільтрах. Конструкції ДНК-зв'язуючого домену мали чотири конструкції людини, чотири конструкції мишачого FAS-IC, в тому числі дві повнорозмірні конструкції із замінюваними мутаціями lІe на Leu або ІІе на Ala у положенні 225 (122N і 1225А відповідає), та три конструкції MORT-1, які (всі) наведено схематично у лівій частині Фіг.1. Конструкції активуючого домену містили три конструкції MORT-1, причому частина MORT-1 відповідає цій частині у конструкціях ДНК-зв'язуючого домену; і конструкцію повнорозмірного FAS-IC людини, причому частина FAS-IC відповідає цій частині у конструкції ДНК-зв'язуючого домену. Bнyтpiшньоклітиннi домени TMF-R р55 людини (залишки 206-426 p55-R-IC), CD-40 людини (CD40, залишки 216-277) та TNF-R р75 людини (р75-1С, залишки 287-461), а також ламін, циклін D та "порожні" вектори GAL4 (pGBT9) відігравали роль негативних контролів у формі конструкцій ДНК-зв'язуючого домену. SNF-1 і SNF-4 були за позитивні контролі у формі конструкцій ДНК-зв’язуючого домену (SNF1) та активуючого домену (SNF4). "Порожні" вектори GAL4 (pGAO-GH) також були негативними контролями у формі конструкцій активуючого домену. Символи "++" та "+" означають розвиток сильного забарвлення протягом 30 і 90 хилин тесті, відповідне; та "-" означає відсутність розвитку забарвлення впродовж 24 годин. Комбінації, які не оцінюються, не тестувалися. Експресія молекул MORT-1, злитих на N-кінці з октапептидом FLAG (FLAG-MORT-1), спричиняла до утворення білків клітин HeLa чотирьох різних розмірів - близько 27, 28, 32 та 34кД. Взаємодію MORT-1 з FASIC in vitro спостерігали, здійснюючи мунопреципітацію білків з екстрактів клітин HeLa, трансфікованих злитим білком FLAG-MORT-1 або кДНК люциферази як контролю, причом імунопреципітацію виконували з антитілом проти FLAG (aFLAG). Також було показано взаємодію sn vitro між MORT-1 та FAS-IC, де MORT-1 міститься у формі злитих білків, помічений метаболічно [32S-метіоніном FLAG-MORT-1, отриманих з екстрактів трансфікованих клітин HeLa, a FAS-IC знаходиться у формі злитих білків людини та миши GST-FAS-ІC, в тому числі одного злитого білка, який має замінювану мутацію у положенні 225 у FAS-IC. причому всі злиті білки GST-FAS-ІС продукувалися в E.colі. GST-злиті білки приєднували до гранул з глутатіону до взаємодії з екстрактами із вмістом білка МORT-1-FLAG, після цієї взаємодії власне і проводили електрофорез у ДСНПААГ. Таким чином, взаємодію in vitro визначали оцінюванням, авторадіографією після електрофорезу в ДСНПААГ, зв’язування [32S]-міченого метаболічно MORT-1, продукованого у трансфікованих клітинах HeLa у вигляді злитого білка з октапептидом FLAG (FLAG-MORT-1), з GST, злитого білка GST з людським або мишачим FAS-lC (GST-hu FAS-IC, GST-mFAS-lC) або злитого білка GST із FAS-ІC, який містить замінювану мутацію lІe на Ala у положенні 225. Було показано, що всі чотири білки FLAG-MORT-1 виявляли здатність зв'язуватися з FAS-ІC при інкубації зі злитим білком GST-FAS-ІС. Як і в дріжджовому двогібридному тесті (Фіг. 1), MORT-1 не зв'язувався зі злитим білком GST-FAS-IC із заміщенням в мутаційному сайті Ір reg (1225А). Білки, кодовані кДНК FLAG-MORT-1, виявили також здатність зв'язуватися з внутрішньоклітинним доменом FAS-R, а також із внутрішньоклітинним доменом химери FAS-R, позаклітинний домен, замінений на домен p55-R (p55-FAS), при коекспресії з цими рецепторами у клітинах HeLa. У цьому разі взаємодія MORT-1 з FAS-IC у трансфікованих клітинах НеLа, тобто іn vivo, яке спостерігається за імунопреципітантами різних трансфікованих клітин HeLa, виявило взаємодію іn vivo та специфічність взаємодії між MОRT-1 і FAS-IC у клітинах, котрансфікованих конструкціями, які кодують ці білки. Так, злитий білок FLAG-МORT-1 експресували та метаболічно мітили [32S]-цистеїном (20мкКи/мл) та [32S]-метіоніном (40мкКи/мл) у клітинах HeLa, окремо або разом з FAS-R людини, химерою FAS-R, в якій внутрішньоклітинний домен FAS-R було замінено на відповідний район людського p55-R ,(p55-FAS)5 або p55-R як негативний контроль. Перехресну імунолреципітацію MORT-1 з коекспресованим рецептором здійснювали з використанням різноманітних специфічних антитіл. Результати довели, що FLAG-WORT-1 здатний зв'язуватися з внутрішньоклітинним доменом химери FAS-R-p55Rs яка має внутрішньоклітинний домен p55-R та внутрішньоклітинний домен FASR, при коексореси з цими рецепторами у клітинах HeLa. Далі, імунопреципітація FLAG-MОRT-1 з екстрактів трансфікованих клітин також призводили до преципітації коекспресованого FAS-R або коекспресованої химери p55-R-FAS. Навпаки, імунопреципітація цих рецепторов призводила до копреципітації FLAG-MORT-1. Нозерн-аналіз з використанням кДНК MORT-1 як зонда виявив єдиний транскрипт із здатністю гібридизуватися у клітинах HeLa. У Нозерн-блотинзі, в якому полі А+-РНК (0,3мкг) з трансфікованих клітин гібридизували з кДНК MORT-1, було виявлено, що розмір РНК-транскрипту (~1,8 т.п.н.) наближений до розміру кДНК MORT-1 (~1702 нуклеотиду). У секвенуючому аналізі було виявлено, що ця кДНК містить відкриту рамку зчитування для приблизно 250 амінокислот. Фіг.2 містить попередню нуклеотидну (SEQ ID №1) та розшифровану амінокислотну послідовність (SEQ ID №2) MORT-1, в якій підкреслено мотив "домену загибелі", а також можливий стартовий залишок Met (положення 49; надрукований жирним шрифтом, підкреслений М) та стоп-кодон трансляції (зірочка під кодоном у положенні 769-771). Цей мотив "домену загибелі" має гомологію з відомими мотивами "доменів загибелі" р55R і FAS-R (p55-DD i FAS-OD). Для визначення точного С-кінця MORT-1 та отримання доказу стосовно точного N-кінця (початкового Met) MORT-1 проводили наведені нижче додаткові експерименти. За допомогою наведених вище способів створили ряд конструкцій, які кодують молекули MORT-1, злиті на їхньому N-кінці з октапептидом FLAG (FLAG-MORT-1), та експресували їх у клітинах HeLa з метаболічним міченням білків за допомогою [32S]-цистеїну та [32S]-метіоніну. Молекули MORT-1-FLAG кодувалися такими кДНК із вмістом різних частин кодуючої MORT-1 послідовності: і) кДНК октепептиду FLAG, з'єднаної з 5'-кінцем кДНК MORT-1, з якою було делеговано нуклеотиди 1-145 SEQ ID 1 (дивись Фіг.2); іі) кДНК октепептиду FLAG, з’єднаної з 5'-кінцем кДНК повнорозмірного MORT-1; ііі) кДНК FLAG, з'єднаної з 5¢-кінцем кДНК MORT-1, з якої було делетовано нуклеотиди 1-145, а також нуклеотиди 832-1701 SEQ ID №1 (Фіг.2), та кодон ССС у положенні 142-144 було мутовано в ТСС дня запобігання початку трансляції в цьому сайті. Після експресії зазначених вище злитих продуктів FLAG-MORT-1 проводили імунопреципітацію, як описано вище, з використанням моноклональних антитіл проти FLAG (М2) або антитіл проти TNF-R р75 як контролю (№9), з наступним електрофорезом у ДСН-ПААГ (на 10% акриламіді) та авторадіографії. Результати цього аналізу з описаними вище злитими продуктами FLAG-MORT-1 підтвердили С-кінець MORT-1 та забезпечили доказ того, що N-кінець MORT-1 може перебувати в положенні 49 послідовності, наведеної на Фіг.2. Дійсно, додаткові експерименти з експресії MORT-1 без октапептиду FLAG, злитого з його 5'-кінцем, довели, що Met49 функціонує як ефективний сайт ініціації трансляції. Пошук, проведений у базах даних "Gene Bank" і "Protein Bank" виявив, що в них немає послідовності, відповідної визначеній послідовності MORT-1. Таким чином MORT-1 являє новий специфічний FAS-ICзв'язуючий білок. Висока експресія р55-ІС призводить до запуску дії, яка спричиняє загибель клітин (Boldin et al., 1995). Експресія FAS-ІС у клітинах HeLa також має таку саму дію, хоча в більш низькому ступені, яку можна детектувати тільки з використанням тесту на чутливість. Проводили аналіз ліганд-незалежного запуску цитоцидних ефектів у клітинах, трансфікованих MОRT-1, а також р55-4С і FAS-IC людини. Дія тимчасової експресії MORT-1, FAS-IC людини, р55-lC людини або люциферази (в якості контролю) на життєздатність клітин HeLa оцінювалии з використанням контрольованого тетрацикліном експресуючого вектора. Життєздатність клітин оцінювали через 40 хвилин після трансфекції цих кДНК за присутності або відсутності тетрацикліну (1мкг/мл, для інгібування експресії), разом з кДНК, яка кодує секретовану плацентарну лужну фосфатазу. Життєздатність клітин визначали тестом поглинання нейтрального червоного або (для специфічного визначення життєздатності конкретних клітин, що експресують трансфіковану ДНК) вимірюванням кількості лужної фосфатази плаценти, секретованої у середовище для вирощування. Вищенаведений аналіз виявив, що експресія MORT-1 у клітинах HeLa призводила до значної загибелі клітин, більшої ніж загибель клітин, спричинена експресією FAS-IC. Ці цитотоксичні ефекти всіх білків р55-ІС, FAS-ІC і MORT-1, певно, пов'язані з районами "доменів загибелі", присутніми в усіх білках і мають схильність до самоасоціації, отже, ймовірно, посилюють цитотоксичні ефекти. У зв'язку з вищенаведеними властивостями MORT-1, а саме специфічним зв'язуванням MORT-1 з конкретним районом FAS-R, який бере участь в індукції загибелі клітин і в зв'язку з фактом, що навіть невелике змінювання структури цього району, яке перешкоджає передавання сигналу (мутація Ір reg), відміняє також зв'язування MORT-1, можна подумати, що цей білок відіграє важливу роль у передаванні сигналу або запуску загибелі клітин. Це підтверджується далі спостережуваною здатністю MORT-1 самостійно запускати цитотоксичну дію. Таким чином, MORT-1 може функціонувати як (і) модулятор самоасоціації FAS-R завдяки його власній здатності зв'язуватися з FAS-R, а також сам із собою, або (іі) бути сайтом стикування для додаткових білків, що беруть участь у передаванні сигналу FAS-R, тобто MORT-1 може бути "стикуючим" білком і отже зв'язувати інші рецептори, крім FAS-R, або (ііі) MORT-1 може бути частиною окремої системи передавання сигналу, яка взаємодіє з передаванням сигналу FAS-R. Для подальшого аналізу районів MORT-1, які беруть участь у зв'язуванні FAS-IC і модулюванні опосередкованих FAS-R клітинних ефектів (цитотоксичності), вищенаведені експерименти проводили з використанням векторів, кодуючих частини MORT-1 ("голову MORT-1", амінокислоти 1-117 і "MORT-1-dd", амінокислоти 130-245) (окремо), з вектором, кодуючим FAS-R людини для котрансфекції клітин HeLa. В цих експериментах різні білки та комбінації білків експресували тимчасово в клітинах НеLа, які містять контрольований тетрацикліном трансактиватор (HtТА-1), шляхом встроювзння послідовностей, які кодують ці білки, в контрольований тетрацикліном експресуючий вектор pUHD10-3. В контрольних трансфекціях використовували вектори, які кодують тільки FAS-R, і вектори, які кодують злитий білок FLAG-55.11 (білок 55.11 являє собою специфічно р55-ІС-зв’язуючий білок, частка якого, що містить амінокислоти 309-900, була злита (на її N-кінці) з октапептидом FLAG). Після періодів трансфекції й інкубації трансфіковані клітини обробляли різними концентраціями моноклонального антитіла проти FAS-R (СН-11), яке специфічно зв’язується з внутрішньоклітинним доменом FAS-R, експресованим клітинами. Це зв’язування антитіла проти FAS-R індукує агрегацію FAS-R на поверхні клітин (а також ліганду FAS-R) і індукує внутрішньоклітинний каскад реакцій передавання сигналу, медійований FAS-IC, що призводить врешті до загибелі клітин (опосередкований FAS-R клітинної цитотоксичкості). Використання концентрації моноклонального антитіла проти FAS-R (СН-11) у діапазоні 0,0110мкг/мл, звичайної концентрації 0,005; 0,05; 0,5 і 5мкг/мл. Клітини обробляли антитілом проти FAS-R в присутності 10мкг/мл циклогексиміду. Результати цього аналізу показують, що експресія FAS-R в трансфікованих клітинах виявляє збільшену чутливість до цитоцидних ефектів антитіл проти FAS-R (порівняйте "fas" і "55.11"). Надалі, коекспресія району MORT-1, який містить район гомології "домену загибелі" і FAS-R ("fas + MORT-1 dd"), сильно перешкоджає індукованій FAS (тобто опосередкованій FAS-R) загибелі клітин, як слід було очікувати на основі здатності району "домену загибелі" (DD) до зв'язування з "доменом загибелі" FAS-R (FAS-DD). Крім того, коекспресія Nкінцевої частини MORT-1 і FAS-R ("fas + MORT-1 he") не перешкоджає опосередкованій FAS-R загибелі клітин і, якщо вона взагалі діє, то трохи збільшує цитотоксичність (тобто злегка збільшує загибель клітин). Таким чином, наведені вище результати зрозуміло доводять, що білок MORT-1 має два окремих райони, які стосуються зв'язування з FAS-ІС і медіювання цитотоксичності FAS-R, Отже, ці результати забезпечують також основу для використання різних частин (тобто активних фрагментів чи аналогів) білка MORT-1 для різних фармацевтичних застосувань. Наприклад, аналоги чи фрагменти або їхні похідні білка MORT-1, які містять по суті тільки С-кінцеву частину MORT-1, яка включає його район "домену загибелі", можна використати для інгібування опосередкованих FAS-R цитотоксичних ефектів у клітинах, які містять FAS-R або тканинах і, отже, захищати ці клітини чи тканини від шкідливої дії ліганду FAS-R у таких випадках, як, наприклад, гострий гепатит. Альтернативно, аналоги чи фрагменти або їхні похідні білка MORT-1, які містять по суті тільки N-кінцеву частину MORT-1, можна використовувати для посилення опосередкованих FAS-R цитотоксичних ефектів у клітинах і тканинах, які містять FAS-R, і, отже, спричиняти до посиленого руйнування цих клітин чи тканин, якщо це бажано, у таких випадках, як, наприклад, пухлинні клітини і аутореактивні Т- і В-клітини. Як докладно описано вище, наведені застосування різних районів MORT-1 можна виконувати з використанням різних рекомбінантних вірусів (наприклад, вірусу коров'ячої віспи) для введення послідовності, що кодує район MORT-1, в специфічні клітини чи тканини, що повинні оброблятися. Окрім того, можливо також приготувати і використати різні інші молекули, такі як антитіла, пептиди і органічні молекули, які мають послідовності або молекулярні структури, відповідні до наведених вище районів MORT-1, для досягнення тих самих бажаних ефектів, медійованих цими районами MORT-1. Окрім того, MORT-1 можна використати для специфічної ідентифікації, виділення і визначення характеристик інших білків, здатних зв'язуватися з MORT-1 (тобто MОRT-1-зв’язуючих білків), дивись Приклади 2 і 3. Приклад 2: Видалення MORT-1-зв'язуючого білка (і) Двогібридний скринінг і двогібридний тест експресії b-галактозидази Аналогічно процедурі, яку описано у Прикладі 1, з використанням внутрішньоклітинного домену р55 TNF-R (р55-lC) і MORT-1 як "приманок" і скринінга бібліотеки В-клітин людини, два клони кДНК, які кодують білковий продукт, здатний зв'язуватися як з MORT-1, так і з р55-ІС. Обидва клони мають ідентичні нуклеотидні послідовності на 5¢-кінці, як наведено на Фіг.3 (SEQ lD №3). (іі) З'язуючі властивості нових клонованих кДНК у двогібридних скринінгах З використанням вищезгаданої дріжджової двогібридної процедури конструкцію, яка містить кДНК нового МОRТ-1-зв’язуючого білка, використовували як "здобич", до якої додавали конструкції ряду "приманок" в окремих реакціях, для визначення специфічності зв’язування MORT-1-зв'язуючого білка, який кодується цією кДНК. Ці "приманки" включали конструкції, кодуючі MORT-1, частини MORT-1 ("голову MORT-1", амінокислоти 1-117, "хвост MORT-1", амінокислоти 130-245), р55-lС (206-426 р55) або його частини ("домен загибелі", 326426 р55; та інші проти ходу транскрипції "домену загибелі", тобто 206-326). Результати наведені в Таблиці 2. Таблиця 2 Приманка Дані експресії b-галактозидази MORT-1 +++ 130-245 MORT-1 + 1-117 MORT-1 206-426 р55 +++ 326-426 р55 +++ 206-326 р55 206-308 р55 206-345 р55 р55 L35lN FAS-lC 233-319 Fas р75ІС CD40 lС pGBT10 SNF1 Циклін D Ламін Наведені вище результати двогібридного тесту експресії в-галактозидази для оцінювання зв'язування клону з великим набором "приманок" підтвердили, що білок, кодований цим клоном, специфічно зв'язується з доменами загибелі як TNF-R р55, так і MORT-1. Взагалі, MORT-1-зв’язуючий білок може використовуватися безпосередньо для модулювання або медіювання зв'язаних з MORT-1 дій на клітини, або опосередковано для модулювання чи медіювання дії ліганду FAS-R на клітини, коли ця дія модулюється або медіюється MORT-1. Це саме є слушним по відношенню до інших внутрішньоклітинних білків або внутрішньоклітинних доменів трансмембранних білків, як спеціально тут продемонструвалося для TNF-R р55. MORT-1-зв'язуючі білки включають білки, які специфічно зв'язуються з цілим білком MORT-1, або білки, які зв'язуються з різними районами білка MORT-1, наприклад, з наведеними виїде N- і С-кінцевими районами MORT-1. MORT-1-зв'язуючі білки, які специфічно зв'язуються з такими районами, можуть використовуватися для модулювання активності цих районів і, отже, специфічної активності MORT-1, визначеної цими районами. Приклад 3: Виділення і характеристика білка MACH, іншого MORT-1-зв'язуючого білка (і) Двогібридний скринінг, двогібридний b-галактозидазний тест, секвенування і аналіз послідовності За допомогою процедури, наведеної в Прикладах 1 і 2, повнорозмірну конструкцію, яка кодує білок MORT1 людини, використовували як "приманку" в дріжджовій двогібридній системі для виділення клону кДНК, кодуючого ще один новий MORT-1-зв'язуючий білок. Цей новий білок спершу визначили як MORT-2, а тепер перейменували і дали назву MACH (тобто MORT-1-асоційований гомолог CED3) на основі його характеристик, докладно описаних нижче. Цей клон кДНК секвенували стандартними способами, наведеними в Прикладах 1 і 2 вийде. Аналіз послідовності за допомогою стандартних процедур і комп'ютерної програми (дивись Приклади 1 і 2) виявив, що ця кДНК є новою послідовністю і кодує новий білок (ні послідовність ДНК, ні амінокислотна послідовність не знайшли в базах даних GENBANK PROTEІNBANK). Далі, кДНК, що кодує MACH, виявила відкриту рамку зчитування ОRF-B, яка має сильну гомологію з наведеним вище районом (5¢ проти ходу транскрипції) мотиву "домену загибелі" білка MORT-1 (дивись Приклад 1). На Фіг.4А-С наведено структуру частини клона кДНК MACH, яка містить ORF-B (235 амінокислотних залишків; Фіг.4А); розшифрована амінокислотна послідовність (SEQ ID №5) ORF-B MACH (Фіг.4В); і нуклеотидна послідовність (SEQ ID №4) молекули кДНК MACH (Фіг.4С). На Фіг.4А заштрихована область ORF-B є районом, який має високу гомологію з районом MORT-1 проти ходу транскрипції від мотиву "домену загибелі" MORT-1, і цей район гомології QRF-B MACH складається з амінокислотних залишків, підкреслених на Фіг.5В. Далі дріжджовий двогібридний тест застосовували для оцінювання специфічності зв'язування MACH з MORT-1, зокрема для визначення району MORT-1, з яким зв'язується MACH, а також для визначення, яка з ORF MACH взаємодіє з MORT-1, причому використовували процедури наведені тут вище в Прикладах 1 і 2. Коротко, готували різні конструкції MORT-1 і MACH для тестування взаємодії білків, кодованих конструкціями ДНК-зв'язуючого домену і активуючого домену GAL4, в трансфікованих SЕY526-дріжджових клітинах з оцінкою за допомогою тесту на фільтрах експресії b-галактозидази. Конструкції з ДНК-зв’язуючим доменом готували у векторах pGTB9, а конструкції активуючого домену готували у векторах pGAD-GM. Для конструкцій активуючого домену використовували кДНК повнорозмірного MACH (MACH), а також конструкцію, яка кодує тільки район ORF-B (MACH В). Контрольними конструкціями активуючого домену були конструкції, які містять кодовану послідовність повнорозмірного MORT-1 (MORT-1, позитивний контроль)), і конструкції, які не мають вставок, тобто "порожні" вектори (pGAD-GM). Для конструкцій ДНК-зв'язуючого домену використовували кДНК повнорозмірного MORT-1 (MORT-1), а також конструкції, які кодують тільки район MORT-1 проти ходу транскрипції (MORT-1-DD, амінокислоти 130-245). Контрольні конструкції ДНК-зв'язуючого домену, сконструйовані для визначення також специфічності зв’язування MACH, містили конструкції, які кодують ламін (Lamin), залишки 287-461 внутрішньоклітинного домену TNF-R р75 людини (human h75 ІС), циклін D (cycD), SNF1, залишки 206-426 внутрішньоклітинного домену TNF-R р55 людини (human h55 1С), район "домену загибелі" внутрішньоклітинного домену FAS-R людини (human Fas DD), залишків 216-277 внутрішньоклітинного домену CD40 людини (human CD40 1С), вектори без вставки або "порожні" вектори pGBT9 (pGBT, негативний контроль) і конструкція, яка кодує район ORF-B MACH (MACH В). У цьому аналізі визначали розвиток забарвлення, причому, що більше розвиток забарвлення, то більшою була взаємодія між конструкціями, які кодують ДНК-зв’язуючий домен і активуючий домен. Розвиток забарвлення відображено символами, де "+++" і "+" вказують на розвиток сильного забарвлення за 30 і 90 хвилин тесту, відповідно, а "--" вказує на відсутність розвитку забарвлення у межах 24 годин тесту. У випадках, коли взаємодію не визначали, нема ніякого символу. Результати різних взаємодій для описаного вище випадку наведено в Таблиці 3, а результати різних взаємодій ізоформ MACH - на Фіг.5. Таблиця 3 Гібрид домену Гібрид ДНКMACH MACH MORT- pGADGH зв'язуючого домену В 1 MORT-1-сполучний +++ +++ +++ --район у MORT-1 MORT1 (-117) MORT1DD ----Тести специфічності Ламін ----р75 ІС людини ----Циклін D SNF1 p55 1С людини FAS DD людини --CD40 lС людини --pGBT9 --MACH В + + --Таким чином, як свідчать результати, наведені вище в Таблиці 3, очевидно, що: (a) MACH зв'язується з MORT-1 дуже сильно і специфічно; (b) сайт зв’язування MACH з MORT-1 знаходиться перед (проти ходу транскрипції) мотивом "домену загибелі" в MORT-1, тобто він знаходиться в районі MORT-1, який визначається амінокислотами 1-117 MORT1; (c) район ORF-B MACH є таким, що взаємодіє з MORT-1 районом білка MACH; і (d) район ORF-B МАСН здатний до самозв'язування (самоасоціації). (ii) Клітинно-цитотоксичні ефекти, опосередковані здатністю сзмоасоцізції білка МАСН Спостереження, що МАСН може самоасоціюватися, зокрема, що район ORF-B МАСН самоасоціюється, а клітинна цитотоксичність, яка спостерігається для внутрішньоклітинних доменів TNF-R р55 і FAS-R, а також для MORT-1 (дивись Приклад 1), припускали, що самоасоціація МАСН може також брати участь у клітинній цитотоксичності. Для дослідження цієї можливості готували конструкції, кодуючі МАСН з застосуванням контрольованого тетрацикліном експресуючого вектора (деталі дивись у Прикладі 1). Ці конструкції використовували для трансфекції клітин HeLa, в яких ці вектори тимчасово експресували. Крім конструкцій МАСН, інші контрольні конструкції використовували для оцінювання дії тимчасової експресії на життєздатність клітин HeLa, з якими можна було б порівнювати дію конструкцій МАСН. Ці інші конструкції включали MORT-1, FAS-IC людини і люциферазу (Luc). Крім того, тестували також котрансфекцію клітин HeLa з використанням конструкцій MORT1 і MACH для визначення того, які ефекти могла б викликати взаємодія між цими білками. Після трансфекції клітини HeLa інкубували і життєздатність клітин оцінювали через 48 годин після трансфекції за присутності або відсутності тетрацикліну (1мкг/мл) для інгібування експресії. Життєздатність клітин визначали тестом поглинання нейтрального червоного. Ці результати наведено на Фіг.6, де відображено у вигляді діаграми ліганд-незалежний запуск цитоцидних ефектів у клітинах, трансфікованих МАСН, порівняно з клітинами, трансфікованими конструкціями, які кодують інші білки, а також котрансфікованими клітинами (MORT-1 + МАСН). Результати наведено у вигляді життєздатності клітин в одиницях OD при 540нм для кожної конструкції, причому для кожної конструкції заштрихований стовпець показує інкубацію клітин за відсутності тетрацикліну, а суцільний стовпець показує інкубацію трансфікованих клітин за присутності тетрацикліну. З результатів, наведених на Фіг.6, видно, що МАСН індукує сильний цитотоксичний ефект у клітинах HeLa, тобто індуковану надекспресію кДНК МАСН у клітинах HeLa, яка призводить до драматичного цитотоксичного ефекту. Цей цитотоксичний ефект, певно, пов'язаний зі здатністю МАСН до самоасоціації. (iii) Нозерн-аналіз За допомогою добре відомих процедур (дивись Приклад 1) проводили Нозерн-аналіз деяких клітинних ліній з використанням кДНК МАСН як зонда. Результати цього аналізу доводять, що у великій кількості клітинних ліній, зокрема, в клітинних лініях СЕМ, Raji, Daudi, HeLa, Alexander, Jurkat і A673 існують два гібридизуючих транскрипти розміром приблизно 3, 2 т.п.н. У зв'язку з вищeкаведeним, білок МАСН, зокрема, білок МАСНb1 (ORF-B MACH), можна використовувати безпосередньо для модулювання або медіювання дії ліганду FAS-R на клітини, коли ця дія модулюється або медіюється MORT-1. Той факт, що MACH специфічно зв’язується з MORT-1, забезпечує специфічний шлях, на якому MACH або ORF-B МАСН можуть використовуватися для модулювання цього специфічного району MORT-1 і отже специфічної активності MORT-1, яка визначена цим районом, розташованим проти ходу транскрипції. Надалі, МАСН або ОRF-В МАСН можуть використовуватися як модулятор або медіатор внутрішньоклітинних ефектів подібно до самого MORT-1 (дивись вище), завдяки здатності MACH до самоасоіуації і самостійної індукції клітинної цитотоксичностї. Подальші аналізи білка МАСН і послідовностей ДНК, кодуючих його, проводили, як наведено нижче. Далі було виявлено, що ORF-B МАСН є тільки однією з ізоформ МАСН. Тому білок МАСН і кодуючі його послідовності ДНК перейменували, як буде зрозуміло з наступного опису. (а) Двогібридний скринінг на білки, які зв'язується з MORT-1, виявив новий білок, що містить загальний мотив послідовності з MORT-1 Як зазначалося вище, для ідентифікації білків, які беруть участь в індукції загибелі клітин MORT-1, використовували двогібридний спосіб для скринікгу бібліотек кДНК на білки, що зв'язуються з MORT-1. Двогібридний скринінг бібліотеки В-клітин людини (Durfee et al., 1993) з використанням кДНК MORT-1 як "приманки" дав клони кДНК самого MORT-1, що відображує здатність цього білка до самоасоціації, а також клони TRADD, з якими ефективно зв'язуються MORT-1 (дивись Приклад 2). Скринінг дав також клони кДНК нової послідовності, продукт якої специфічно зв'язується з MORT-1. Цей білок, який спершу дістав назву МАСН, а пізніше, після того, як було з'ясовано, що він зустрічається у вигляді численних ізоформ (дивись нижче), було перейменовано та названо МАСНb1, також виявив здатність зв'язуватися сам із собою у двогібридному тесті, але не був здатний зв'язуватися з FAS-R. На Фіг.5 наведено результати взаємодії MОRT-1 і MACH у трансфікованих клітинах дріжджів. Коротко, MORT-1 і МАСНb1 та їхні делеційні конструкції, а також МАСНa1, мутант МАСНa1, в якому каталітичний Cys360, було замінено на Ser (МАСНa1 (C360S)), та внутрішньоклітинний домен FAS-R людини (FAS-IC) експресували у трансфікованих дріжджах SFY526 у конструкціях ДНК-зв'язуючого домену та активуючого домену GAL4 (pGBT9 і pGAD-GH). Їхню взаємодію оцінювали, тестуючи експресією b-галактозидази на фільтрах, як описано Boldin et аі., (1995b). Результати наведено як час, необхідний для розвитку сильного забарвлення. ND зазначає, що тест не проводили. Жодна з випробовуваних вставок не взаємодіяла з низкою тестованих негативних контролем, зокрема, з внутрішньоклітинними доменами TNF-R р55 людини, TNF-R р75 та CD40 і ламіном, цикліном D та "порожніми" векторами GAL4. МАСНb1 клонували двогібридним скринінгом міченої GAL4 AD бібліотеки В-клітин людини (Durfee et aІ., 1993) на білки, які зв'язуються з MORT-1, з використанням репортерного штаму дріжджів HF7c. За винятком випадків, коли зазначено інше, всі експериментальні процедури для представлених результатів є аналогічними до описаних вище (дивись також Boldin et аІ., 1995). Делеційний аналіз довів, що МАСНb1 зв'язується з N-кінцевою частиною MORT-1, яка бере участь в індукції загибелі клітин (Chinnaiyan et al., 1995). МАСНb1 також самоасоціювався у трансфікованих дріжджах. Проте, він не зв’язувався з деякими контрольними білками та, на противагу MORT-1, не мав здатності зв'язуватися з FAS-R (Фіг.5). Експресія молекул МACHb1 у клітинах ссавця давала білок 34кДа, який зв'язувався з молекулами MORT-1, коекспресованими з ним. Він також мав змогу зв’язуватися зі злитим білком GST-MORT01 in vitro. Порівняння амінокислотних послідовностей у MACHb1 і MORT-1 виявило спільний мотив послідовності (позначений як "Mort module" (модуль MORT) в цих двох білках, який відрізнявся від мотиву загибелі, через який MORT-1 зв'язується з FAS-R. Цей мотив зустрічається один раз у MORT-1 та двічі в МАСНb1. Такий самий мотив виявлено також в РЕА-15, фосфопротеїні астроциту невідомої функції. Попередні дані припускають, що мотив MORT-1 бере участь у зв'язуванні МАСНb1 (та інших ізоформ MACH) із MORT-1. Фіг.7А містить розшифровану амінокислотну послідовність (SEQ ID №5) МАСНb1. Два модулі MORT становлять блоки, С-кінці двох використаних делеційних мутантів МАСНb1 (Фіг.7) позначено зірочками. Фіг.7В наводить послідовності гомології цих модулів у МАСНb (позначеному як MACH), MORT-1 і гені РЕА-15 (номер доступу X86809). Ідентичні та подібні залишки позначено блоками та затемненими зонами, відповідно. Фіг.8 містить діаграми домену загибелі та модулів MORT і району гомології CED3/ICE у FAS/APO1, МАСНb1 і МАСНa1. Було показано, що район у MORT-1, який містить "модуль MORT”, бере участь в індукції загибелі клітин цим білком (дивись приклад 1). Також показано, що він сприяє, хоча це і не є достатнім, самоасоціації MORT-1 (дивись приклад 1). Як доводить Фіг.5, аналіз зв'язуючих властивостей делеційних конструкцій MACHb1 у трансфікованих дріжджах виявив подібну участь модулів MORT у самоасоціації MACHb1, а також у його зв'язуванні з MORT-1: делеційні конструкції, в яких район нижче (по ходу транскрипції від) модуля MORT був відсутнім, не мали здатності до зв'язування один з одним, хоча зберігали здатність до зв'язування з повнорозмірним MORT-1 та повнорозмірним MACHb1. Подальше скорочення, в якому частину послідовності модуля MORT також булу делетовано, спричиняла до втрати зв'язуючої здатності цих білків. Для подальшого оцінювання участі модулів MORT в цих взаємодіях делеційні мутанти MACHb1, злиті з октапептидом FLAG (FLAG-MACHb1), експресували в клітинах HeLa та оцінювали їх на зв’язування in vitro з продукованим у бактеріях злитим білком глутатioн-S-трансфераза-МОРТ-1 (GST-NORT-1). Як наведено на Фіг.9А-С, було виявлено що подібно до зв'язування, яке спостерігалося з дріжджовому тесті, це зв'язування in vitro залежить від взаємодії району в модулях MACHb1. Фіг.9А та 9В містять результати (авторадіограми) взаємодії in vitro MACHb1 та його делеційних мутантів з MORT-1. Коротко, [32S]-мічений метаболічно MACHb1, MACHb1, злитий на його N-кінці з октапептидом FLAG (FLAG-MACHb1), скорочені на С-кінці мутанти FLAG-MACHb1 та, як контроль люциферазу отримували у трансфікованих клітинах HeLa. Експресію проводили з використанням контрольованого тетрацикліном експресуючого вектора, у клоні клітин HeLa (HtTA-1), який експресує контрольований тетрацикліном трансактиватор. Фіг.9А наводить оцінку експресії цих білків та їхніх модекулярних розмірів імунопреципітацією з клітинних лизатів за допомогою антитіла проти FLAG. Використовували такі антитіла: кролячі антисироватки проти МACHb1 та MORT-1 отримували проти злитих білків GST-MACHb1 та GST-MORT-1. Мишачі антитіла проти окталептиду FLAG (М2) та проти FAS/APO1 (СН11, Yonehara et al., 1989) купували в Eastman Kodak and Oncor (Gaithesburg, MD), відповідно. Мишаче моноклональне антитіло проти епітопу НА (12СА5, Field et al., 1988) та антитіло проти TNF отримували в нашій лабораторії звичайними способами, добре відомими у цій галузі. Фіг.9В показує афінне зв'язування цих білків з GST-MORT-1, адсорбованим на глутатіон-агарозних гранулах (або, як контроль, з GST чи GST, злитим з внутрішньоклітинним доменом FAS/APO1). Фіг.9С містить результати імунопреципітацій різних злитих конструкцій MORT-1 і MACH з використанням різноманітних специфічних антитіл. (b) МАСН зустрічається у множинних ізоформах Нозерн-аналіз з використанням кДНК MACH як зонду виявив транскрипт (транскрипти), який не виявляється у великій кількості, розміром близько 3 т.п.н. у деяких різних клітинних лініях. Коротко, Нозерн блоттинг загальної РНК (14мгк на доріжку) або полі А+-РНК (2мкг) з кількох клітинних ліній проводили з використанням кДНК MACHb1 як зонда. Досліджували клітинні лінії T47D, CEM, Raji, Daudi, HeLa, Alexander, Jurkat і А673, усі, що походять з людини та отримані з карциноми протоків молочної залози, гострого лімфобласного Т-клітинного лейкозу, лімфоми Беркітта, епітелоїдної карциноми, гепатоми людини, гострого Тклітинного та рабдоміосаркоми, відповідно. Довільно дифузійні контури смуги, що гібридизується, на Нозернблотах дають змогу припускати, що ці транскрипти мають гетерогенні розміри в межах від 2,85 до 3,5 т.п.н. Як кількості, так і розміри цих транскриптів змінювалися серед різних тканин людини і не корелірували з експресією MORT-1 (Chinnaiyan et aiM 1995) або FAS/APO1 (Watanabe et aK, 1992). Зонди кДНК радіоактивно мітили за допомогою набору для випадкового праймування (Boehringer Mannheim) та використовували для аналізу численних блотів людини (Clontech) згідно з інструкціями виробника. Наприклад, в яєчку та скелетному м’язі транскрипти MACH ледь детектувалися, хоча ці тканини експресують значну кількість MORT1. На противагу цьому, було виявлено, що мононуклеарні лейкоцити періферичної крові, що перебувають у спокої, в яких експресія MORT-1 є дуже низькою, експресують МАСН за високих рівнів. Активація лектином цих лейкоцитів спричиняє до помітного змінення у розподілі розмірів транскриптів МАСН, разом з індукцією MORT-1. Досліджуючи природу цієї гетерогенності розмірів, бібліотеки кДНК піддавали скринінгу на транскрипти, які гібридизуються з кДНК-зондом MACHb1. МАСНa1 і МАСНa2 клонували з бібліотеки кДНК Charon ВS, яка походить з мРНК тимусу людини. Цю бібліотеку піддавали скринінгу за суворих умов кДНК-зондом MACHb1, міченим за допомогою набору випадкового праймування (Boehringer Mannheim). Інші ізоформи МАСН клонували за допомогою RT-PCR, яку проводили ка спільній РНК з Raji (МАСНa1, a2, a3, b3, b4 і b5) і Daudi (МАСНa2, b2, b3, b4 і b5) лімфобластоїдних клітин людини. Реакцію зворотної транскриптази (RT) здійснювали з oльго-dT-адапторним праймером (5¢-GACTCGAGTCTAGAGTCGAC (T)17-3'; SEQ ID №26) та зворотної транскриптазою Superscript Il (GIBCO-BRL), які використовуються згідно з інструкціями виробника. Перший цикл ПЛР виконували з системою Expand Long Tempiate PCR (Boehringer Mannheim) із застосуванням таких змістового та антизмістового праймерів: 5¢-AAGTGAGCAGATCAGAATTGAG-3¢, який відповідає нуклеотидам 530-551 MACHb1 (SEQ ID №4), і 5¢-GACTCGAGTCTAGAGTCGAC-3' (SEQ ID №27), вiдповідно. Другий цикл виконували з полімеразою Vent (NEB) з використанням таких змістового та антизмістового праймерів "футлярного" типу: 5¢-GAGGATCCCCAAATGCAAACTGGATGATGAC-3¢ (SEQ ID №28) і 5¢GCCACCAGCTAAAAACATTCTCАA-3¢ (відповідає нуклеотидам 962-939 SEQ ID №4) кДНК MACHb1 відповідно. На підтвердження того факту, що МАСНb3 і МАСНb4 мають кодони ініціації, клонували велику 5'-послідовність цих ізоформ з РНК клітин Raji. Реакція RT-PCR, виконувана із використанням оліго-dТ-адапторного праймера. описаного вище, супроводжувалася двома циклами ПЛР (з полімеразою Vent (NEB)) із використанням таких змістового та антизмістового олігонуклеотидів: 5'-TTGGATCCAGATGGACTTCAGCAGAAATCTT-3¢·(SEQ ID №29) і 5¢-ATTCTCAAACCCTGCATCCAAGAG-3' (відповідав нуклеотидам 946-923 SEQ ID №4) в MACHb1. Останній олігонуклеотид є специфічним для b-iзоформ. Серед клонів, отриманих у такий спосіб, клони, що, як з'ясувалося, містять нуклеотиди, які кодують амінокислоти "блоку 2" (їхня присутність відрізняє МАСНb3 і МАСНb4 від MACHb1 і МАСНb2, про що йтиметься нижче), було повністю секвенировано. Нуклеотидні послідовності всіх кяонованих ізоформ визначали в обох напрямках способом дідезокситермінації ланцюга. Отримали лише часткові клони кДНК МАСНa3 і МACHb2. Цей скринінг виявив існування численних ізоформ MACH. Амінокислотні послідовності восьми з цих ізоформ досліджували докладно. Ці результати подано у вигляді діаграм на Фіг.12 та як приклади на Фіг.13, де амінокислотні послідовності трьох з цих ізоформ порівнювали з відомими гомологами. Фіг.10 містить діаграми різних ізоформ МАСН. Райони кодування представлено у вигляді взятих в блоки зон. Різні домени в районах кодування позначено різноманітними затемненнями: модулі MORT-1 (▓); три блоки амінокислотної послідовності, які зустрічаються в різних комбінаціях в цих ізоформах. Наведено положення залишив у районі гомології CED3/ICE, які вважають визначальними каталітичну активність JCE, на підставі рентгенівської (кристалічної) структури. Частини нуклеотидної послідовності МАСНa1, яких немає у послідовностях інших ізоформ, вказано в діаграмах цих ізоформ V-подібними з'єднувальними лініями. Довжина районів кДНК, які, ймовірно, відповідають окремим екзонам, вказано нижче діаграми МАСНa1. Відсутність 65 нуклеотидів, які в МАСНa1 кодують "блок 2" спричиняє до змінення в MACHb1 і МACHb2 рамки зчитування нукяеотидів, які кодують "блок 3". Отже, в цих ізоформах ці нуклеотиди кодують інші амінокислоти, які разом становлять їхній унікальний С-кінцевий район. З іншого боку, в MACHb3 i МACHb4 збережено рамку зчитування "блоку 3", але відсутність нуклеотидів, які кодують район CED3/ICE, та частини 3¢-некодуючого району спричиняє до змінення рамки зчитування нуклеотидів, розташованих далі по ходу транскрипції. Внаслідок цього змінення велика 5'-частина цього некодуючого району по ходу транскрипції насправді кодує 10 амінокислот, які становлять С-кінцевий район, унікальний для цих двох ізоформ (заштриховано). Як походить з фігури, було отримано лише часткові клони кДНК МАСНa3 i МACHb2. lзоформи клонували з бібліотеки кДНК В-клітин людини (MACHb1), з бібліотеки кДНК тимусу людини (МАСНa1 і a2) та з мРНК лімфобластоїдних клітин Raji людини (МАСН2a1, a2, a3, b3, b4 і b5) і Daudi (МАСНa2, b2, b3, b4 і b5). Клонування з мРНК клітин Raji і Daudi виконували за допомогою RT-PCR олігонуклеотидів, що відповідають 3-некодуючому району та послідовності у другому модулі MORT-1 в MACH. Ініціюючий кодон клонів, виділених у такий спосіб, розташовано всередині другого модуля MORT. Послідовність кДНК та амінокислотна послідовність ізоформ MACH представлено у ізерщику послідовностей та ідентифіковано у Таблиці 4. Таблиця 4 Ізоформа Послідовність Амінокислотна MACH МАСНa1 МАСНa2 МАСНa3 MACHb1 МАСНb2 МАСНb3 МАСНb4 МАСНb5 кДНК SEQ ID №14 SEQ ID №17 SEQ ID №19 SEQ ID №4 SEQ lD №21 SEQ ID №23 SEQ ID №24 SEQ ID №33 послідовність SEQ ID №7 SEQ ID №18 SEQ ID №20 SEQ ID №5 SEQ lD №22 SEQ ID №8 SEQ ID №25 SEQ ID №34 Послідовності в різних ізоформах з’вязанa одну з одною таким чином: (а) усі ізоформи МАСН мають спільну N-кінцеву зону, яка складається зі 182 амінокислот та охоплює модулі MORT, хоча варіюють карбокситермінально (3¢-по ходу транскрипції) відносно цих модулів, а також в їхніх некодуючих районах. (b) На підставі їхніх С-кінцевих послідовностей ці ізоформи підрозділяються на дві підгрупи: чотири ізоформи, що становлять підгрупу b, мають різні С-кінці внаслідок змінення рамки зчитування. Дві (MACHb1 і МАСНb2) мають спільний С-кінець, виявлений в ізоформі, спершу клонований у двогібридному скринінгу, а дві (МАСНb3 і МАСНb4) мають інший С-кінець; три ізоформи, що становлять підгрупу a, мають набагато довший С-кінцевий район, який дуже нагадує протеази родини CED3/ICE (дивись нижче). (с) Райони, що знаходяться між районом модуля MORT та С-кінцевим районом, який визначає ці підгрупи, варіюють від однієї ізоформи до другої. Проте, ретельне дослідження довело, що ці проміжні райони складаються з різних комбінацій трьох однакових амінокислотних блоків (блоки 1, 2 і 3). Варіації амінокислотної послідовності серед різних клонів відбивають два типи варіацій у нуклеотидній послідовності, які, ймовірніше, утворюють альтернативним сплайсингом: (а) вставка чи відсутність будь-якої з двох нуклеотидних послідовностей, однієї з 45 нукпеотидів та іншої з 65 нуклеотидів чи обох, нижче нукяеотидів, кодуючих Lys184; (b) присутність додаткової вставиш в районі, який в MACHb1 становить 3¢-некодуючу частину. Ці варіації впливають як на рамку зчитування, так і на довжину білка. Частина ізоформи MACH містить гомолог CED3/ІCE. Пошук в банку даних виявив, що С-кінцевий район ізоформ МАСНa містить блок 3 і послідовність, розташовану по ходу транскрипції від нього, дуже подібний до протеаз родини CED3/ICE. На Фіг.11 цей район порівнюється в MACH, та різноманітних відомих членах цієї родини в людини, а також білка ced3 Caenohabditis elegans, CED3 (Ellis and Horvitz, 1986; Yuan et al., 1993) та відомих протеаз родини CED3/ІCE; CPP32 (Fernandes-Alnemri et aІ., 1994), який також має назву апопаїну (Nicholson et al., 1995) і Yama (Tewari et al., 1995b), Mch2a (Fernandes-Alnemri et al., 1995), Ich-1 (Wang et al., 1994; людський гомолог мишачого білка Nedd2, Kumar et al, 1994), ІСЕrelll (Munday et al., 1995), lCErelll (Mursday et al., 1995), яку також називають ТХ і Ich2 (Faucheu et al., 1995; Kamens et al., 1995), і ICE (Thornberry et al., 1992; Cerretti et al., 1992). На Фіг. 11 схематично зображено колінеарне вирівнювання (аналіз первісної структури) амінокислотних послідовностей ізоформ MACH та різних відомих членів родини протеаз CED3/ICE. Показано амінокислотні послідовності МАСНa1, МАСНb1, МАСНb3, а також протеази CED3 Caenohabditis elegans і відомих людських протеаз родини протеаз CED3/lCE. Вказаний вище С-кінцевий район MACH найбільше подібний до СРР32 (з 41% ідентичністю та 62% гомологією) та CTD3 (з 34% ідентичністю та 56% гомологією). Він виявляє набагато меншу схожість з ICE (з 28% ідентичністю та 50% гомологією) та з її близькоспорідненими гомологами ICErelll (який ще має назву ТХ і Ісh) та ІСЕrellll. Подібність спостерігали майже по всьому району, який бере початок від Туr 226 у блоці 3, до Скінця ізоформ МАСНa. Особливо помітними є два моменти подібності: (a) Усі відомі протеази родини CED3/ICE розщеплюють білки при сайтах, які виявляються присутністю Asp у положенні Р1 та залишку невеликої гідрофобної кислоти при Р1¢. Хоча ця специфічність відрізняється стосовно інших структурних ознак субстрату, що містять природу залишків у положеннях Р2-Р4. Відповідно до цього, залишки активного сайта, який бере участь в каталізі (відповідає His237, Gly238 і Cys285 в ICE), та карман зв'язування для карбоксилатного бокового ланцюга Р1 Asp (Arg179, Gln283, Arg341 та, можливо, також Ser347) є консервативними серед цих протеаз. Як свідчить Фіг. 11, ці залишки (помічені затемненням залишків та суцільними чи порожніми кружками під послідовностями) є також консервативними в МАСНa1. Щоправда, є один виняток - консервативна заміна Ser на Thr в cайті, що відповідає Ser347 lCЕ. Другою не значною, але потенційно важливою, відміною полідовності між ізоформами МАСНa та іншими членами цієї родини протеаз є заміна Arg на Gln залишка, що відповідає Arg287 ICE. Цей залишок, суміжний з передбачуваним каталітичним залишком цистеїну, є повністю консервативним в усіх інших членів родини CED3/ICE. Крім того, частина залишків у сайтах, розташованих поблизу від залишків субстрата Р2-Р4 (помічених трикутниками під послідовностями на Фіг.11), відрізняється в ізоформах МАСНa від виявлених в інших членах родини CED3/ICE. (b) Протеази родини CED3/ICE містять сайти саморозщеплення. Відомо, що деякі з цих протеаз дійсно саморозщеплюються, тож вияв максимальної активності залежить від цього процесу. Їхня повна біоактивна форма складається з двох нековалентно зв’язаних продуктів розщеплення, які відрізняються за розміром (р20 і р17 в lCЕ; р17 і р12 в СРР32, як показано стрілками на Фіг.11). Присутність потенційних сайтів ауторозщеплення в інших членах цієї родини передбачає, що вони також піддаються подібному процесингу, від якого залежить вияв максимальної активності. Такі потенційні сайти ауторозщеплення зустрічаються в МАСНa1 майже там само, що і в СРР32 (дивись затемнені блоки на Фіг.11). Сайт, ідо відповідає N-кінцю еубодиниці р17 СРР32, розташовано у другому консервативному блоці амінокислот, на відстані лише кількох амінокислот проти ходу транскрипції відносно Н-кінця району гомології CED3/ІCE (нижче Asp216). Сайт, що відповідає точці розщеплення між двома субодиницями СРР32, розташовано як і в усіх інших членах родини СРР32, про які відомо, що вони розщеплюються, на відстані кількох амінокислот по ходу транскрипції відносно каталітичного залишка цистеїну (нижнє Asp374). Ця консервативність передбачає, що район гомології CED3/ICE в МАСНa1 є об'єктом для протеолітичного процесингу. Розміри двох очікуваних продуктів цього розщеплення дуже близьки до розмірів двох субодиниць процесованої молекули СРР32. (с) Район гомології CED3/ICE в MACH має протеолітичну активність Для з'ясування, чи має район гомології CED3/ICE в МАСНa протеолітичну активність, заявники експресували район від потенційного сайту розщеплення проти ходу транскрипції цього району, між Asp216 і Ser217, до С-кінця цього білка, в бактеріях у вигляді злитого з GST білка. Бактеріальні лізати тестували на здатність розщеплювати флуорогенні пептидні субстрати, що, як зазначалося вище, розщеплюються іншими гомологами CED3/ICE. Використовували два субстратних пептиди: перший, Ацетил-Аsр-Glu-VаІ-Аsр-а-(4метилкумарил-7-амід) (Ac-DEVD-АМС), відповідає послідовності в полі (АДФ-рибоза) полімеразі (PARP), ядерному білку, який розщеплюється в клітинах перед стимуляцією FAS-R (Tewari et al., 1995b), а також в інших процесах апоптозу (Kaufmann, 1989; Kaufrnann et al., 1993; Lasebnik et al., 1994). Цей флуорогенний субстрат ефективно розщеплюється СРР32. Другий флуорогенний субстрат, Ацетил-Tyr-Val-Asp-AMC (AcYVAD-AMC), відповідає субстратному сайтові для lСЕ в попереднику lL-1b. Цей флуорогенний субстрат розщеплюється ICE. Як показано на Фіг.12A-F і 12А-В, лизати бактерій, експресуючих район гомології CED3/ICE в МАСНa1, ефективно розщеплювали вироблений з послідовності PARP флуорогенний субстрат. Хоча вони не мають вимірюваної протеолітичної активності проти зробленого з послідовності попередника IL-1b флуорогенного субстрату (контролі), Ac-YVAD-AMC, який є сайтом розщеплення lСЕ в попереднику lL-1b (Тhornberrу et al., 1992). Протеолітична активність інгібувалася йодооцтовою кислотою (5мМ), що підтверджую, що її опосередковано тіоловою протеазою. Розщеплення не спостерігали з лизатами, що містять злитий з GST район гомології СЕО3/ІСЕ MACH, в якому каталітичний залишок цистеїну Cys360 було замінено на Ser. Крім того, лизати з бактерій, екепресуючих повнорозмірний білок МАСНa1 у вигляді злитого з GST білка, не розщеплювали Ac-DEVD-AMC, можливо, через відсутність бактеріальних ферментів, здатних до процесингу повнорозмірної молекули. Розщеплення не спостерігали також з лизатами, які містять будь-який з двох потенційних продуктів розщеплення району гомології CED3/ICE. На Фіг.12A-F і 13А подано кінетику розщеплення зробленого з послідовності PERP флуорогенногог субстрату, Ac-DEVD-AMC (50мкМ), екстрактами Е. соІі, екепресуючими злитий з GST білок району гомології CED3/ICE в МАСНa1 (від Ser217 до С-кінця цього білка), порівняно з відсутністю розщеплення екстрактами бактерій, експресуючими GST-злиті білки повнорозмірної молекули МАСНa1 або будь-якої іншої з двох потенційних протеолітичних продуктів району гомології CED3/ICE (від Ser217 до Аsр374 та від Asp374 до Скінця білка). Це також свідчить про залежність від концентрації субстрату розщеплення Ac-DEVD-AMC, інкубованого протягом 180 хвилин з екстрактами бактерій, екепресуючих район гомології CED3/ICE МАСНa1 у злитому з GST білку (дивись Фіг.13В). Розщеплення не спостерігали за присутності йодооцтової кислоти (5мМ). Екстракти не мали активності на Ac-YVAD-AMC, флуорогенному субстрате, який відповідає субстратному сайтові ІСЕ в попереднику ІL-1b. Коротко, злиті з GST білки отримували в бактеріях XL1-bІue з використанням експресуючого вектора pGEX3. Бактерії лізували обробкою ультразвуком у буфері, що містить 25мМ HEPES (рН 7,5), 0,1% 3-[3холамідопропіл)діметиламіно]-1-пропансульфонат, 5мМ ЕДТА та 2мМ ДДТ, з наступним центрифугуванням при 16000g протягом 10 хвилин. Аналіз електрофорезом в ДНС-ПААГ підтвердив присутність однакових рівнів різних злитих білків в лизатах (не показано). Аліквоти 50мкл екстрактів (4мг/мл спільного білка) інкубували за кімнатної температури впродовж вказаних періодів часу в загальному обсязі реакції 500мкл із флуорогенними субстратами за вказаних концентрацій. Вивільнення АМС вимірювали спектрофлуорометрією за збуджувальної довжини хвиль 380нм та довжині хвиль емісії 460нм. Концентрацію АМС визначали за допомогою кривої стандартів. Обидва флуорогенні субстрати отримували з Peptide Institute Inc. (Osaka, Japan). Було показано, що інші протеази CED3/ICE виявляють повну активність лише після протеолітичного процесингу, який здійснюється або саморозщепленням, або через їхнє розщеплення іншими протеазами (огляд Kumar, 1995; Henkart, 1995). Спостереження заявників, що лизати бактерій, що експресують молекули GST-MACHa1, не мають ферментативної активності, на противагу активності, яку спостерігали в лизатах бактерій, експресуючих район гомології CED3/ІCE, передбачає, що для активності МАСНa також потрібний процесинг. Шлях, на якому процесинг МАСНa здійснюється в клітині ссавця, й те, як цей процесинг викликається запусканням FAS-R чи p55-R, невідомі. Було показано, що MORT-1 зв'язується в клітинах з активованим FAS-R разом з іншими білками (Kischkel et аІ., 1995). Ці білки, ймовірно, включають МАСНa1 та інші ізоформи MACH. Цілком вірогідно, що зв'язування MORT-1 в асоціації з MACH з FAS-R об'єднує кілька молекул MACH або індукує конформаційні зміни в них і що ці зміни або запускають аутолітичний процесинг МАСНa, або роблять МАСНa сприйнятливим до розщеплення іншими протеазами. Стимуляція p55-R може запускати самопроцесинг МАСНa подібним, хоча й менш прямим способом шляхом об'єднання кількох молекул TRADD чи індукції конформаційних змінень в них, що, в свою чергу, індукує змінення в утворенні чи стані агрегацн MORT-1 та асоційованої з ним молекули МАСН. Субстратна специфічність МАСНa є напевно досить "орієнтованою на загибель". Хоча МАСНa був би здатний розщеплювати субстратний пептид, який відповідає сайтові розщеплення субстрату загибелі PARP (Aс-DEVD-AMС), МАСНa не виявив протеолітичної активності стосовно пептиду, який відповідає сайтові процесинга попередника IL-1b ICE (Ac-YVAD-AMC). Ідентифікація клітинних білків, які є субстратами для розщеплення МАСНa, зможе з'ясувати більш глибокі події в індукції загибелі клітин цією протеазою. Ймовірними субстратами для розщеплення МАСНa є інші члени родини CED3/ICE, подібні до СРР32 і ICE. Деякі з цих протеаз дійсно процесують після запуску FAS-R або рецепторів TNF (Miura et al, 1995; SchlegeІ et aІ., 1996; Chinnaiyan et al., 1996). Ймовірно, що протеази, які не належать до родини CED3/ICE, також активуються МАСНa, прямо чи внаслідок дії інших протеаз CED3/ІCE. Участь численних протеаз у загибелі клітин узгоджується з відомою здатністю інгібіторів різних протеаз, в тому числі серинових протеаз та інгібітору розщеплення ICE, а також антизмістової кДНК ІСЕ, захищати клітини від індукованої FAS-R та рецептором TNF токсичності (Weitzen and Granger, 1980; Ruggiero et aІ., 1987; Enari et aІ., 1995; Los et al., 1995). Більшість інших ферментів, зокрема фосфоліпази, сфінгоміелінази та протеїнкїнази, можуть брати участь в індукції загибелі клітин TNF-R і FAS-R (дивись Bschen et aІ., 1995; Vandenabeele et al., 1995; Cifone et al., 1995 та посилання в них). Деякі з цих ферментів стають активованими внаслідок протеолітичного розщеплення, індукованого МАСНa. Проте, ймовірним є те, що принаймні частина цих інших зв'язаних із загибеллю клітин активностей стимулюється іншими шляхами передачі сигналу, незалежно від стимуляції МАСНa. Участь понад одного каскаду реакцій в індукції загибелі клітин, деяких спільних для p55-R і FAS/APO1, та деяких, індукованих лише одним з них, узгоджувалися б із повідомленням про наявність як спільних, так і відмінних особливостей процесів загибелі клітин, індукованих цими двома рецепторами (Grell et al., 1994; Schulz-Osthoff et al., 1994; Wong and Goeddel, 1994; Clement and Stamenkovic, 1994). (d) MACHa1 сполучається із MORT-1, а також із MACHb1 Для з'ясування, чи може МАСНa1 зв'язуватися з MORT-1, як MACHb1, спершу досліджували взаємодію цих білків у трансфікованих дріжджах. МАСНa1, напевно, має суттєвий цитотоксичний вплив на дріжджі. Мэй ефект виявлявся у помітному зниженні виходу колоній у дріжджах, які експресували цей білок у векторі з активуючим доменом (АД-векторі) (рівень експресії якого вищий за рівень експресії вектора ДНК-зв'язуючого домену (ДЗД). З іншого боку, MACHb1, в якому каталітичний залишок цистеїну, CyS360, замінювався на Ser (МАСНa1 (C360S)) не був цитотоксичним ані для жодної з клітин ссавця (дивись нижче), ні для дріжджів. Подібно до MACHb1, МАСНa1 (C360S), зв'язувався у трансфікованих дріжджах з MORT-1, також сам із собою. Він також зв’язувався з MACHb1, Також дріжджі, які експресують МАСНa1 дикого типу разом з MORT-1 чи MACHb1, виявляли взаємодію трансфікованих білків. Проте, інтенсивність забарвлення продукту LacZ варіювала серед колоній дріжджів; у дріжджах, трансфікованих МАСНa1 як в АД-, так і ДЗД-векторі, не спостерігали забарвленого продукту, можливо, внаслідок цитотоксичної дії МАСНa1 дикого типу. Але, незважаючи на таке варіювання забарвлення, дріжджі, які експресують МАСНa1 або у сполученні з MORT-1 чи MACHb1, мали повністю позитивні вказівки щодо взаємодії трансфікованих білків. На противагу MACHb1, МАСНa1 не виявляв взаємодії у двогібридному тесті (Фіг.5). Як МАСНa1 (C360S), так і MACHb1 коімунопреципйовалися з MORT-1 з лизатів ембріональних клітин нирок людини 293-EBNA, що свідчило про той факт, що зони зв'язуються з MORT-1 також в клітинах ссавця. Для подальшого тестування з метою визначення, чи може МАСНa1 зв'язуватися з MORT-1 у клітинах ссавця, МАСНa1 або MACHb1, злиті з октаггептидом FLAG, експресували разом із міченими епітопом НА молекулами МОВТ-1. [32S]-мічені метаболічно МАСНa1 і MACHb1, злиті на їхніх N-кінцях з октапептидом FLAG (FLAGMACHa1 і b1), і MORT-1, злитий на його N-кінці з епітопом НА (Rekl et аl., 1988) експресували в клітинах HeLa. Імунопреципітацію цих білків з лизатів клітин здійснювали із застосуванням мишачих моноклональних антитіл проти октапептиду FLAG (М2; Eastman Kodak), епітопу НА (12СА5, Field et aІ, 1988) або рецептора TNF р75 (№9, Bidga et aІ., 1994) як контролю. Білки аналізували за допомогою електрофорезу в ДСН-ПААГ (12% акріламід) з наступною авторадіографією. Як МАСНa1, так і MACHb1 коімунопреципіювалися з MORT-1 з лизатів цих клітин, доводячи те, що вони зв'язуються з MORT-1. Ефективність взаємодії МАСНa1 з MORT-1, ймовірно, нижча за взаємодію MACHb1. (е) Молекули MACH, які містять район гомологи CED3/ICE, здатні медіювати загибель клітин Для з'ясування участі МАСН в індукції загибелі клітин досліджували дію надекспресії різких ізоформ МАСН на життєздатність клітин. Тест проводили трансфікуванням експресуючих векторів МАСН разом із експресуючим вектором b-галактози як маркера трансфекції в ембріональні клітини нирок людини 293-EBNA та клітини карциноми молочної залози MCF7. Коротко, клітини 293-EBNA, клітини карциноми молочної залози людини MCF7 та клітини HeLa HtTA-1 вирощували в модифікованому Дульбекко мінімальному основному середовищі Ігла з додаванням 10% фетальної телячої сироватки, неосновних амінокислот, 100Е/мл пеніциліну та 100мкг/мл стрептоміцину. Чашки для культури тканин (5´105 клітин 293-EBNA, 3´105 клітин MCF7 або 3´105 клітин HeLa в чашках з діаметром 6см) тимчасово трансфікували за способом з преципітацією фосфатом кальцію, використовуючи кДНК вказані білки разом із експресуючим вектором b-галактозидази. В експериментах, представлених на Фіг. 14A-D і 15, кожну чашку трансфікували 3,5мкг вказаної конструкції MACH та 1,5мкг pSV-b-gal. В експериментах, представлених на Фіг. 16A-D і 17-19, кожну чашку трансфікували 2,5мкг вказаної конструкції MACH або MORT-1 (або для контролю пустим вектором) та 1,5мкг pSV-b-gal. Клітини ополіскували кожні 6-10 годин після трансфекції. Клітини 293-EBNA і MCF7 інкубували впродовж ще 18 годин без додаткової обробки. Клітини HeLa інкубували впродовж 26 годин після трансфекції та потім упродовж 5 годин за присутності антитіла проти FAS/APO1 (СН11, 0,5мкг/мл) або TNF (100нг/мл), разом із циклогексимідом (10мкг/мл). Ступінь загибелі клітин наприкінці інкубаційних періодів оцінювали, визначаючи експресії b-галактози, як описано Kumar et al., 1994. Культури, трансфіковані експресуючим вектором МАСНa1 або МАСНa2, мали значну загибель клітин, яка виявлялася в заокругленні клітин, утворенні пухирців, стисканні та нарешті відокремленні клітин від чашки (Фіг.14В). За 20 годин після трансфекції більша частина трансфікованих клітин, ідентифікованих за bгалактозидазним забарвленням (X-GaІ) виявляла конденсовану формологію, типову для апоптозу (Фіг.14В). На противагу цьому, клітини, які експресують порожній вектор, залишилися життєздатними. Зокрема, на Фіг.14A-D наведено морфологію ембріональних клітин нирок людини 293-EBNA, тимчасово експресуючих вказані ізоформи МАСН. Стрілки (Фіг. 14В) вказують клітини, що виявили апоптоз. Фотографії робили кожні 26 годин після трансфекції. Фіг. 15 містить кількісне визначення індукованої МАСН загибелі клітин 293-EBNA (світлі прямокутники) та MCF7 клітин (чорні прямокутники шляхом визначення частини експресуючих b-галактозидазу клітин, що виявляють морфологію апоптозу кожні 20 годин після трансфекції вказаних конструкцій. Дані взято з трьох незалежних експериментів із клітинами 293-EBNA та двох незалежних експериментів з клітинами MCF7 та приведено у вигляді середніх відсотків синіх клітин, що виявляли ознаки апоптозу, від загальної кількості підрахованих синіх клітин (приблизно 500 клітин на пробу). Для дослідження участі району гомології CED3/ІCE в ізоформах МАСНa в їхній апоптопічній дії клітини трансфікували експресуючим вектором для ізоформи MACHb1, яка не має району гомології СЕD3/lСЕ, а також експресуючими векторами для ізоформи МАСНa3, яка не має N-кінцевої частини цього району, та експресуючими векторами для МАСНa1 (C360S) та для С-термінально скороченого мутанту МАСНa1 (МАСНa (1-415)), який не має жодного залишка, які, як вважають, є вирішальними для протеазної функції CED3/ICE (відповідає Ser347 в ICE). Загибель клітин не мала місця (окрім невеликої кількості, яку спостерігали в клітинах 293EBNA і MCF7, трансфікованих порожніми експресуючими векторами) у клітинах 293-EBNA і MCF7, трансфікованих експресуючими векторами для МАСНa3, МАСНa1 (1-415) і МАСНa1 (C360S). Окрім того, клітини, трансфіковані МАСНa1 разом із цими векторами, мали дуже незначну загибель клітин, що свідчить про те, що молекули МАСНa, які містять неповний район CED3/ICE мають негативну домінантну дію на активність молекул дикого типу. Культури, що експресують MACHb1, який взагалі не містить району CED3/ICE, дійсно мали деяку загибель клітин (Фіг.15). Цей ефект MACHb1, який, імовірніше, є результатом активації ендогенних молекул МАСНa1, більшою мірою виявлявся у трансфікованих клітинах HeLa. Окрім того, в клітинах HeLa МАСНa3, МАСНa1 (1-415) і МАСНa1 (C360S) були також трохи цитотоксичними (Фіг.19). Фігура містить діаграму взаємодії рецептора та білка-мішені, які беруть участь в індукції загибелі клітин FAS/APO1 (FAS-R) і p55-R. Активність МАСНa, ймовірно, становить найбранішу ферментативну стадію в каскаді передачі сигналу для цитоцидних дій FAS/APO1 і p55-R. Здатність MACHb1 зв'язуватися як з MORT-1, так і з МАСНa1 передбачає, що ця ізоформа збільшує активність ферментативно активних ізоформ. Можливо, деякі з ізоформ MACH обслуговують додаткові функції. Здатність MACHb1 зв'язуватися як з MORT-1, так і з МАСНa1 передбачає, що ця ізоформа може підсинювати активність ферментативно активних ізоформ. Невелика цитотоксичність, яка спостерігалася в культурах 293-EBNA і MCF7, трансфікованих цією ізоформою, та досить значна цитотоксична дія, яку воно виявляє в клітинах HeLa, можливо, відбиває активацію ендогенно експресованих молекул МАСНa при зв'язуванні з трансфікованими молекулами MACHb1. Зрозуміло, що деякі ізоформи також мали б змогу діяти як сайти стикування для молекул, що беруть участь в інших, нетоксичних ефектах FAS/APO1 та рецепторах TNF. (f) інгібування функції МАСНa запобігає індукції загибелі клітин FAS/APO1 та рецепторам р55 Для оцінювання внеску МАСНa в цитотоксичність FAS/APO1 (FAS-R) і p55-R, МАСНa3, а також нефункціонільні мутанти МАСНa1, МАСН1 (1-415) і МАСНa (C360S), експресували в клітинах, які індукувалися для виявлення цієї цитотоксичності. Індуковану p55-R цитотоксичність запускали в клітинах 293-EBNA тимчасовою надекспресіею цього рецептора, а індуковану FAS/APO1 цитотоксичність - надекспресією химерних молекул, які складаються з позаклітинного домену p55-R та трансмембранного і внутрішньогоклітинного доменів FAS/APO1. За деяких причин, ця химера мала набагато сильнішу фітотоксичну дію, ніж дія нормального FAS/APO1. Цитотоксичну активність у клітинах HeLa також індукували обробкою їх TNF або антитілом проти FAS/APO1 за присутності інгібітору білкового синтезу циклогексиміду. Клітини HeLa робили чутливими до FAS/APО1 тимчасової експресії цього рецептора. В усіх випробовуваних системах МАСНa3 кефункціональкі мутанти МАСНa1 забезпечували ефективний захист проти цитотоксичності. індукованої запуском передачі сигналу FAS/APO1 або p55-R (Фіг.16-19). Такий захист також спостерігали, як повідомлялося раніше (Hsu et al, 1996; Chinnaiyan et al., 1996), у клітинах, трансфікованих Nкінцевим делеційним мутантом MORT-1, який не має МАСН-зв'язуючого району (MORT-1 (92-208)). Ці захисні ефект вказують на те, що МАСНa є необхідним компонентом індукованих як FAS/AP01, так і p55-R каскадів передачі сигналу для загибелі клітин. Зокрема, на Фіг.16A-D подано морфологію клітин 293-EBNA, в яких загибель клітин індукували тимчасовою експресією химери, що складається з внутрішньоклітинного домену p55-R (амінокислоти 1-168), злитого з трансмембранним та внутрішньоклітинним доменами FAS/APO1 (амінокислоти 153-319) (химериp55-R-FAS) (Фіг.16А і 16В), або експресією p55-R (Фіг.16С і 16D), та клітин, які було захищено від цих цитотоксичних ефектів одночасною трансфекціею їх МАСНa1 (C360S) (Фіг.16В і 16D). Фотографії робилися кожні 24 години після трансфекції. Фіг.17 ілюструє визначення кількості загибелі, індукованої в клітинах 293EBNA їхньою трансфекцією химерою p55-R-FAS або p55-R, разом із порожнім вектором, делеційним мутантом MORT-1, позбавленим МАСН-зв'язуючого району (MORT-1 (92-208)), або молекулами МАСНa, які містять нефункціональний район CED3/ICE. На Фіг.18 наведено загибель клітин HeLa, які тимчасово експресують FAS/APO1, індуковану обробкою антитілом проти FAS/APO1 (aFas) та циклогексимідом (СНІ), та її запобігання котрансфекціею MORT1DD (98-208), МАСНa (C360S) або МАСНa3. MACH експресуеться в різних тканинах за помітно відмінних рівнів та, вочевидь, також із різним розподілом ізотопів. Ці відмінності, можливо, сприяють тканиноспецифічним особливостям відгуку на ліганд FAS/APO1 і TNF. Як і у випадку інших гомологів CED3/ICE (Wang et al., 1994; Ainemri, 1995), виявлено, що ізоформи MACH, які містять неповні райони CED3/ICE (наприклад, МАСНa3) інгібують активність коекспресованих молекул МАСНa1 або МАСНa2; також виявлено, що вони інгібують індукцію загибелі клітин, спричинену FAS/APO1 і p55-R. Експресія таких інгібіторних ізоформ може бути механізмом клітинного самозахисту проти опосередкованої FAS/APO1 і TNF цитотоксичності. Велика гетерогенність ізоформ MACH, яка значно перевищує гетерогенність, яка спостерігається для будь-якої з інших протеаз родини СЕD3/lСЕ, має уможливити особливо тонку настройку функції активних ізоформ MACH. Після повного опису наведеного винаходу фахівці цієї галузі мають зрозуміти, що те ж саме може виконуватися у великому діапазоні рівноцінних параметрів, концентрацій та умов без відхилення від ідеї та сфери дії цього винаходу та без надмірного експериментування.
ДивитисяДодаткова інформація
Назва патенту англійськоюDna sequence coding polypeptide which binds to mort-1 (variants), expression vector comprising dna sequence, host-cell, isolated polypeptide and a pharmaceutical composition containing polypeptide (variants) which binds to mort-1, and pharmaceutically acceptable carrier
Назва патенту російськоюПоследовательность днк, которая кодирует полипептид, который связывается с mort-1 (варианты), вектор экспрессии, который включает последовательность днк, клетка- хозяин, выделенный полипептид и фармацевтическая композиция, которая содержит полипептид (варианты), который связывается с mort-1, и фармацевтически приемлемый носитель
МПК / Мітки
МПК: A61K 48/00, A61K 45/00, C07K 16/28, C07K 14/715, A61P 35/00, C07K 14/705, C12N 9/64, C12N 15/09, C12N 5/10, A61P 31/12, C07K 14/47
Мітки: включає, хазяїн, композиція, mort-1, зв'язується, днк, поліпептид, клітина, варіанти, кодує, виділений, містить, експресії, поліп, фармацевтична, вектор, послідовність
Код посилання
<a href="https://ua.patents.su/59-72423-poslidovnist-dnk-shho-kodueh-polipeptid-yakijj-zvyazuehtsya-z-mort-1-varianti-vektor-ekspresi-shho-vklyuchaeh-poslidovnist-dnk-klitina-khazyan-vidilenijj-polipeptid-ta-farmacevtich.html" target="_blank" rel="follow" title="База патентів України">Послідовність днк, що кодує поліпептид, який зв’язується з mort-1 (варіанти), вектор експресії, що включає послідовність днк, клітина- хазяїн, виділений поліпептид та фармацевтична композиція, що містить поліп</a>