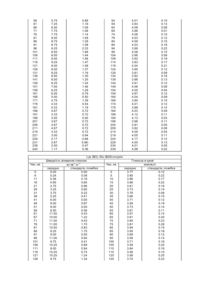
Похідна інсуліну або її фізіологічно прийнятна сіль, попередник похідної інсуліну, днк-послідовність, що кодує попередник, вектор експресії, субстрат, трансформований вектором експресії, фармацевтична композиція
Номер патенту: 65529
Опубліковано: 15.04.2004
Автори: Зайпке Герхард, Ертль Йоханн, Гайзен Карл, Хаберманн Пауль
Формула / Реферат
1. Похідна інсуліну або її фізіологічно прийнятна сіль формули І
, (I)
в якій позначають:
(А1-А5)
амінокислотні залишки в положеннях А1-А5 ланцюга А людського (SEQ ID № 1) або тваринного інсуліну,
(А12-А19)
амінокислотні залишки в положеннях А12-А19 ланцюга А людського (SEQ ID № 2) або тваринного інсуліну,
А21
Asn, Asp, Gly, Ser, Thr або Аlа,
(B8-B18)
амінокислотні залишки в положеннях В8-В18 ланцюга В людського (SEQ ID № 2) або тваринного інсуліну,
(В20-В26)
амінокислотні залишки в положеннях В20-В26 ланцюга В людського (SEQ ID № 2) або тваринного інсуліну,
А8, А9, А10
амінокислотні залишки в положеннях А8, А9 і А10 ланцюга А людського (SEQ ID № 1) або тваринного інсуліну,
В30
гідроксил або амінокислотний залишок у положенні В30 ланцюга В людського (SEQ ID № 2) або тваринного інсуліну,
В1
фенілаланіновий (Рhе) залишок або атом водню,
В3
природний основний амінокислотний залишок,
В27, В28
і В29
амінокислотні залишки в положеннях В27, В28, і В29 ланцюга В людського (SEQ ID № 2) або тваринного інсуліну або відповідно інший природний амінокислотний залишок, причому, принаймні, один з амінокислотних залишків у положеннях В27, В28 і В29 ланцюга В є природним амінокислотним залишком, вибраним з групи: ізолейцин (IIе), аспарагінова кислота (Asp) та глутамінова кислота (Glu), та, принаймні, один з амінокислотних залишків у положеннях В27, В28 та В29 ланцюга В замінений на інший природний амінокислотний залишок, вибраний у відношенні В29 з групи нейтральних або кислих амінокислот, і у відношенні В27 та В28 з групи нейтральних амінокислот.
2. Похідна інсуліну або її фізіологічнo прийнятна сіль згідно з п. 1, яка відрізняється тим, що:
А8
аланін (Аlа),
А9
серин (Ser),
А10
валін (Val) і
В30
аланін (Аlа).
3. Похідна інсуліну або її фізіологічно прийнятна сіль згідно з п. 1, яка відрізняється тим, що:
А8
треонін (Тhr),
А9
серин (Ser) і
А10
ізолейцин (IIе).
4. Похідна інсуліну або її фізіологічно прийнятна сіль згідно з п. 3, яка відрізняється тим, що В30 є аланіном (Аlа) або треоніном (Thr).
5. Похідна інсуліну або її фізіологічно прийнятна сіль згідно з п. 3, яка відрізняється тим, що В30 є треоніном (Thr),
(А1-А5)
амінокислотні залишки в положеннях А1-А5 ланцюга А людського інсуліну,
(А12-А19)
амінокислотні залишки в положеннях А12-А19 ланцюга А людського інсуліну,
(В8-В18)
амінокислотні залишки в положеннях В8-В18 ланцюга В людського інсуліну і
(В20-В26)
амінокислотні залишки в положеннях В20-В26 ланцюга В людського інсуліну.
6. Похідна інсуліну або її фізіологічнo прийнятна сіль за будь-яким з пп. 1-4, яка відрізняється тим, що амінокислотний залишок у положенні В1 ланцюга В є фенілаланіновим (Phe) залишком.
7. Похідна інсуліну або її фізіологічнo прийнятна сіль за будь-яким пп. 1-6, яка відрізняється тим, що амінокислотний залишок у положенні В3 ланцюга В є гістидиновим (His), лізиновим (Lys) або аргініновим (Аrg) залишком.
8. Похідна інсуліну або її фізіологічнo прийнятна сіль за будь-яким з пп. 1-7, яка відрізняється тим, що ланцюг В має послідовність
Phe Val Lys Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu
Tyr Leu Val Cys Gly Glu Arg Gly Phe Phe Tyr Thr Pro Glu Thr.
9. Похідна інсуліну або його фізіологічнo прийнятна сіль за будь-яким з пп. 1-7, яка відрізняється тим, що принаймні один з амінокислотних залишків в положеннях В27, В28 та В29 ланцюга В є ізолейциновим (IIе) залишком.
10. Похідна інсуліну або її фізіологічнo прийнятна сіль згідно з п. 9, яка відрізняється тим, що ланцюг В має послідовність
Phe Val Lys Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu
Tyr Leu Val Cys Gly Glu Arg Gly Phe Phe Tyr IIe Pro Lys Thr.
11. Похідна інсуліну або її фізіологічнo прийнятна сіль згідно з п. 9, яка відрізняється тим, що ланцюг В має послідовність
Phe Val Lys Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu
Tyr Leu Val Cys Gly Glu Arg Gly Phe Phe Tyr Thr IIe Lys Thr.
12. Похідна інсуліну або її фізіологічнo прийнятна сіль згідно з будь-яким з пп. 1-7 та 9, яка відрізняється тим, що амінокислотний залишок в положенні А21 ланцюга А є аспарагіновим (Asp) залишком.
13. Похідна інсуліну або її фізіологічнo прийнятна сіль згідно з п. 12, яка відрізняється тим, що ланцюг А має послідовність
Gly IIe Val Glu Gln Cys Cys Thr Ser IIe Cys Ser Leu Tyr Gln Leu Glu Asn Tyr Cys Asp
і ланцюг В має послідовність
Phe Val Lys Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu Tyr Leu Val Cys Gly
Glu Arg Gly Phe Phe Tyr Thr IIe Lys Thr.
14. Похідна інсуліну або її фізіологічно прийнятна сіль за будь-яким з пп. 1-9, яка відрізняється тим, що принаймні один з амінокислотних залишків в положеннях В27, В28 та В29 ланцюга В є природним амінокислотним залишком, вибраним з групи кислих амінокислот.
15. Похідна інсуліну або її фізіологічнo прийнятна сіль згідно з п. 14, яка відрізняється тим, що амінокислотний залишок в положенні А21 ланцюга А є аспарагіновим (Asp) залишком.
16. Попередник похідної інсуліну за п. 1, який відрізняється тим, що має наступну послідовність
Met Ala Thr Thr Ser Thr Gly Asn Ser Ala Arg Phe Val Lys Gln
His Leu Cys Gly Ser His Leu Val Glu Ala Leu Tyr Leu Val Cys
Gly Glu Arg Gly Phe Phe Tyr Thr IIe Lys Thr Arg Arg Glu Ala
Glu Asp Pro Gln Val Gly Gln Val Glu Leu Gly Gly Gly Pro Gly
Ala Gly Ser Leu Gln Pro Leu Ala Leu Glu Gly Ser Leu Gln Lys
Arg Gly Ile Val Glu Gln Cys Cys Thr Ser IIe Cys Ser Leu Tyr
Gln Leu Glu Asn Tyr Cys Asp
або
Met Ala Thr Thr Ser Thr Gly Asn Ser Ala Arg
Phe Val Lys Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu
Tyr Leu Val Cys Gly Glu Arg Gly Phe Phe Tyr Thr Pro Glu Thr
Arg Arg Glu Ala Glu Asp Pro Gln Val Gly Gln Val Glu Leu Gly
Gly Gly Pro Gly Ala Gly Ser Leu Gln Pro Leu Ala Leu Glu Gly
Ser Leu Gln Lys Arg
Gly IIe Val Glu Gln Cys Cys Thr Ser IIe Cys Ser Leu Tyr Gln
Leu Glu Asn Tyr Cys Asn,
або
Met Ala Thr Thr Ser Thr Gly Asn Ser Ala Arg
Phe Val Lys Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu
Tyr Leu Val Cys Gly Glu Arg Gly Phe Phe Tyr IIe Pro Lys Thr
Arg Arg Glu Ala Glu Asp Pro Gln Val Gly Gln Val Glu Leu Gly
Gly Gly Pro Gly Ala Gly Ser Leu Gln Pro Leu Ala Leu Glu Gly
Ser Leu Gln Lys Arg
Gly IIe Val Glu Gln Cys Cys Thr Ser IIe Cys Ser Leu Tyr Gln
Leu Glu Asn Tyr Cys Asn,
або
Met Ala Thr Thr Ser Thr Gly Asn Ser Ala Arg
Phe Val Lys Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu
Tyr Leu Val Cys Gly Glu Arg Gly Phe Phe Tyr Thr IIe Lys Thr
Arg Arg Glu Ala Glu Asp Pro Gln Val Gly Gln Val Glu Leu Gly
Gly Gly Pro Gly Ala Gly Ser Leu Gln Pro Leu Ala Leu Glu Gly
Ser Leu Gln Lys Arg
Gly IIe Val Glu Gln Cys Cys Thr Ser IIe Cys Ser Leu Tyr Gln
Leu Glu Asn Tyr Cys Asn.
17. Молекула нуклеїнової кислоти, яка відрізняється тим, що має послідовність, що кодує попередник похідної інсуліну згідно з п. 16.
18. Вектор експресії, який містить ДНК-послідовність згідно з п. 17, що вибраний з групи плазмід рІNТ 329, 332 та 333.
19. Штам E.coli K12 W3110, трансформований вектором експресії згідно з п. 18.
20. Фармацевтична композиція, що знижує і відповідно регулює рівень глюкози в крові, яка містить похідну інсуліну як активну речовину і фізіологічнo прийнятний носій, яка відрізняється тим, що вона містить як похідну інсуліну, принаймні, одну похідну інсуліну та/або одну її фізіологічнo прийнятну сіль згідно з одним або декількома з пп. 1-15 в ефективній кількості.
21. Фармацевтична композиція згідно з п. 20, яка відрізняється тим, що вона містить похідну інсуліну та/або її фізіологічнo прийнятну сіль у розчиненій, аморфній та/або кристалічній формі.
22. Фармацевтична композиція згідно з п. 20, яка відрізняється тим, що вона додатково містить допоміжну речовину подовженої дії.
23. Фармацевтична композиція за п. 22, яка відрізняється тим, що допоміжною речовиною подовженої дії є протамінсульфат, при цьому похідна інсуліну та/або її фізіологічнo прийнятна сіль присутня у формі співкристалізату з протамінсульфатом.
Текст
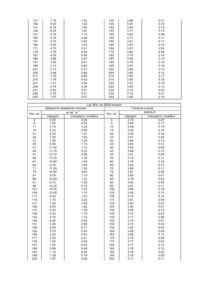
Даний винахід стосується лікування цукрового діабету, зокрема похідні інсуліну або її фізіологічно прийнятної солі, яка виявляє прискорене в порівнянні з людським інсуліном настання дії, попередника цієї похідної інсуліну, ДНК-послідовності, що кодує попередника, вектору експресії, що містить згадану ДНКпослідовність, субстрату, трансформованому згаданим вектором експресії, і фармацевтичної композиції з ефективністю, що знижує і відповідно регулює рівень глюкози в крові. Відомі похідні інсуліну або їх фізіологічно прийнятної солі з прискореним у порівнянні з людським інсуліном настанням дії, в яких амінокислотний залишок у положенні В28 ланцюга В замінений лізином або аргініном. Крім того, ці похідні ще і модифіковані в положеннях В3 і/або А21 (див. Європейський патент 0678522). Задачею винаходу є розширення сортименту похідних інсуліну з прискореним у порівнянні з людським інсуліном настанням дії. Ця задача вирішується за допомогою похідної інсуліну або її фізіологічно прийнятної солі, в якій аспарагін (Asn) у положенні В3 ланцюга В замінений на природний основний амінокислотний залишок і щонайменше один амінокислотний залишок у положеннях В27, В28 або В29 ланцюга В замінений на інший природний амінокислотний залишок, причому аспарагін (Asn) у положенні А21 ланцюга А може бути замінений на Asp, Gly, Ser, Thr або Ala, а фенілаланін (Phe) у положенні В1 ланцюга В і амінокислотний залишок у положенні В30 ланцюга В можуть бути відсутніми. Під «похідною інсуліну» мається на увазі похідна природних інсулінів, а саме людського інсуліну (див. SEQ ID NO 1 =ланцюг А людський інсулін; див. SEQ ID NO 2 =ланцюг В людського інсуліну, протокол послідовностей) або тваринних інсулінів, які відрізняється від відповідного, в іншому такого ж, природного інсуліну заміщенням щонайменше одного природного амінокислотного залишку і/або приєднанням щонайменше одного амінокислотного і/або органічного залишку. Запропонована згідно з винаходом похідна інсуліну або її фізіологічно прийнятна сіль переважно характеризується формулою І в якій позначають: (А1-А5) амінокислотні залишки в положеннях А1-А5 ланцюга А людського (порівн. SEQ ID NO 1) або тваринного інсуліну, (А12-А19) амінокислотні залишки в положеннях А12-А19 ланцюга А людського (порівн. SEQ ID NO 1) або тваринного інсуліну, (В8-В18) амінокислотні залишки в положеннях В8-В18 ланцюга В людського (порівн. SEQ ID NO 2) або тваринного інсуліну, (В20-В26) амінокислотні залишки в положеннях В20-В26 ланцюга В людського (порівн. SEQ ID NO 2) або тваринного інсуліну, А8, А9, А10 амінокислотні залишки в положеннях А8, А9 і А10 ланцюга А людського (порівн. SEQ ID NO 1) або тваринного інсуліну, А21 Asn, Asp, Gly, Ser, Thr або Ala, B30 гідроксил або амінокислотний залишок у положенні В30 ланцюга В людського (порівн. SEQ ID NO 2) або тваринного інсуліну, В1 фенілаланіновий залишок (Phe) або атом водню, В3 природний основний амінокислотний залишок, В27, В28 і В29 амінокислотні залишки в положеннях В27, В28 і В29 ланцюга. В людського (порівн. SEQ ID NO 2) або тваринного інсуліну або відповідно інший природний амінокислотний залишок, причому щонайменше один з амінокислотних залишків у положеннях В27, В28 і В29 ланцюга В замінений на інший природний амінокислотний залишок. З двадцятьох генетично кодуємих амінокислот, що зустрічаються в природі, у контексті даного винаходу амінокислоти гліцин (Gly), аланін (Ala), валін (Val), лейцин (Leu), ізолейцин (Не), серин (Ser), треонін (Thr), цистеїн (Cys), метіонін (Met), аспарагін (Asn), глутамін (Gin), фенілаланін (Phe), тирозин (Туг), триптофан (Тгр) і пролін (Pro) позначаються як нейтральні амінокислоти, аргінін (Arg), лізин (Lys) і гістидин (His) як основні амінокислоти й аспарагінова кислота (Asp) і глутамінова кислота (Glu) як кислі амінокислоти. Похідна інсуліну або її фізіологічно прийнятна сіль згідно з даним винаходом переважно являє собою похідну бичачого інсуліну, свинячого інсуліну або людського інсуліну, а саме похідну інсуліну або її фізіологічно прийнятну сіль формули І, яка відрізняється тим, що в ній позначають: А8 аланін (Ala), А9 серин (Ser), А10 валін (Val) і В30 аланін (Ala) (амінокислотні залишки А8-А10 і В30 бичачого інсуліну) або А8 треонін (Thr), А9 серн (Ser) і А10 ізолейцин (IIе) (амінокислотні залишки А8-А10 людського або свинячого інсулінів), причому В30 позначає аланін (Ala) (амінокислотний залишок В30 свинячого інсуліну) або В30 позначає треонін (Thr) (амінокислотний залишок В30 людського інсуліну, порівн. SEQ ID NO 2). Особливо кращі похідна інсуліну або її фізіологічно прийнятна сіль формули І з аміноксилотними залишками А8-А10 і В30 людського інсуліну, яка відрізняється тим, що в ній позначають: (А1-А5)амінокислотні залишки в положеннях А1-А5 ланцюга А людського інсуліну (порівн. SEQ ID NO 1), (А12-А19) амінокислотні залишки в положеннях А12-А19 ланцюга А людського інсуліну (порівн. SEQ ID NO 1), (В8-В18) амінокислотні залишки в положеннях В8-В18 ланцюга В людського інсуліну (порівн. SEQ ID NO 2), 2). (B20-B26) амінокислотні залишки в положеннях В20-В26 ланцюга В людського інсуліну (порівн. SEQ ID NO Іншими кращими варіантами даного винаходу є: а) похідна інсуліну або її фізіологічно прийнятна сіль, у якої амінокислотним залишком у положенні В1 ланцюга В є фенілаланіновий залишок (Phe), або б) похідна інсуліну або її фізіологічно прийнятна сіль, у якої амінокислотним залишком у положенні ВЗ ланцюга В є гістидиновий (His), лізиновий (Lys) або аргініновий (Arg) залишок, в) похідна інсуліну або її фізіологічно прийнятна сіль, у якої щонайменше один з амінокислотних залишків у положеннях В27, В28 і В29 ланцюга В замінений на один із природних амінокислотних залишків, обраний із групи нейтральних або кислих амінокислот, г) похідна інсуліну або її фізіологічно прийнятна сіль , у якої щонайменше один з амінокислотних залишків у положеннях В27, В28 і В29 ланцюга В являє собою природний амінокислотний залишок, обраний із групи ізолейцин (llе), аспарагінова кислота (Asp) і глутамінова кислота (Glu), і д) похідна інсуліну або її фізіологічно прийнятна сіль, у якої щонайменше один з амінокислотних залишків у положеннях В27, В28 ланцюга В замінений на природний амінокислотний залишок, із яких особливо кращий ізолейциновий залишок (llе). В якості кислих амінокислот переважно застосовуються аспарагінокислотний залишок (Asp) і глутамінокислотний залишок (Glu). Особливо кращі похідна інсуліну або її фізіологічно прийнятна сіль , у якої ланцюг В має послідовність Phe Val Lys Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu Tyr Leu Val Cys Gl y Glu Arg Gl y Phe Phe Tyr Thr Pro Glu Thr (SEQ ID NO 3), наприклад, людський Lys (B3), Glu (В29)-інсулін, або послідовність Phe Val Lys Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu Tyr Leu Val Cys Gl y Glu Arg Gl y Phe Phe Tyr He Pro Lys Thr (SEQ ID NO 5), наприклад, людський Lys (B3), lle (В27)-інсулін, або послідовність Phe Val Lys Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu Tyr Leu Val Cys Gl y Glu Arg Gl y Phe Phe Tyr Thr He Lys Thr (SEQ ID NO 4), наприклад, людський Lys (B3), lle (В28)-інсулін. Особливо кращі також похідна інсуліну або її фізіологічно прийнятна сіль, у якої ланцюг А має послідовність Gly He Val Glu Gln Cys Cys Thr Ser lle Cys Ser Leu Tyr Gln Leu Tyr Gln Leu Glu Asn Tyr Cys Asp (SEQ ID NO 9) і ланцюг В має послідовність Phe Val Lys Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu Tyr Leu Val Cys Gly Glu Arg Gl y Phe Phe Tyr Thr lle Lys Thr (SEQ ID NO 10), (людський Lys (B3), lle (B28), Asp (А21)-інсулін. Запропоновані згідно з винаходом похідні інсуліну переважно можуть бути отримані методами генної інженерії, наприклад, шляхом конструювання вектора експресії, що репліцює і, що містить ДНК-послідовність, яка кодує попередника похідної інсуліну, в якому амінокислотний залишок у положенні А1 ланцюга А зв'язаний з амінокислотним залишком В30 ланцюга В через пептидний ланцюг формули II -R1n-Arg- II, де R1n є пептидним ланцюгом із η амінокислотними залишками і n позначає ціле число від 0 до 34, і ланцюг В в положенні В1 подовжений пептидним ланцюгом формули ІІІ Met-R2 m-(Arg)p- III, де R2m є пептидним ланцюгом із m амінокислотними залишками і m позначає ціле число від 0 до 40, переважно від 0 до 9, і ρ позначає 0, 1 або 2, причому при р=0 пептидний ланцюг R2m переважно закінчується лізином (Lys), експресії у клітині-хазяїні й вивільнення похідної інсуліну з її попередника хімічними і/або ферментативними методами. Переважно клітиною-хазяїном є бактерія, особливо переважно бактерія Е. Соlі. В якості клітини-хазяїна можуть бути використані також дріжджі, особливо переважно дріжджі Saccharomyces cerevisiae. Для одержання похідної інсуліну з амінокислотними послідовностями SEQ ID NO 9 (ланцюг А) і SEQ ID NO 10 (ланцюг В) попередник цієї похідної інсуліну переважно має послідовність Lys (B3), lle (B28), Asp (А21)-препроінсулін. Для одержання похідної інсуліну з амінокислотної послідовністю SEQ ID NO 3 попередник цієї похідної інсуліну переважно має послідовність Для одержання похідної інсуліну з амінокислотною послідовністю SEQ ID NO 5 попередник цієї похідної інсуліну переважно має послідовність Для одержання похідної інсуліну з амінокислотною послідовністю SEQ ID NO 4 попередник цієї похідної інсуліну переважно має послідовність Іншими предметами даного винаходу є названі попередники кращої похідної інсуліну, а саме пептиди з номерами послідовностей SEQ ID NO 11, SEQ ID NO 6, SEQ ID NO 7 і SEQ ID NO 8, ДНК-послідовності, що кодують названі попередники, вектори експресії, що містять ці ДНК-послідовності, а також субстрати, трансформовані цими векторами експресії. Похідні інсуліну формули І одержують головним чином за допомогою генної інженерії шляхом сайтнаправленого мутагенезу стандартними методами. З цією метою конструюють генну стр уктур у, що кодує задану похідну інсуліну формули І, і експримують у субстраті - переважно в бактерії, такої, як Е. Соlі або дріжджі, зокрема, Saccharomyces cerevisiae, - і, у випадку, якщо генна структура кодує злитий білок, вивільняють із злитого білка похідну інсуліну формули І. Відщеплення злитобілкового компонента може відбуватися хімічно за допомогою галогенціану після розчинення клітки. При одержанні за допомогою попередника препроінсуліну, що містить злитобілковий компонент (початкова послідовність), відщеплення злитобілкового компонента відбувається на більш пізній стадії разом із відщепленням С-пептиду. Попередник інсуліну потім піддають окисному сульфітолізу згідно з методом, описаним, наприклад, R.С.Marshall і A.Inglis у: «Practical Protein Chemistry - A Handbook» (видавець A.Darbe) 1986, стор.49-53, із наступним ренатуруванням у присутності тіолу з утворенням справжніх дісульфідних містків, наприклад, згідно з методом, описаним G.Н.Dixon і А.С.Wai-dlow у «Nature» (1960), 721-724. Однак попередники інсуліну можуть бути укладені також і безпосередньо. С-пептид видаляють шляхом триптичного відщеплення - наприклад, згідно з методом, описаним Kemmier et al., в: J. В (1971), стор.6786-6791, і похідну інсуліну формули І очищують за допомогою відомих способів, таких, як хроматографія й кристалізація. У випадку, якщо у формулі І n=0, то триптичне відщеплення служить для розриву пептидного зв'язку між ланцюгами А и В. В цих способах ланцюг В закінчується на С-кінці аргініном або двома аргініновими залишками. Останні можуть бути віддалені ферментативно за допомогою карбоксипептидази В. Запропоновані згідно з винаходом похідні інсуліну мають повну біологічну активність. Це було показано на прикладі їхнього внутрішньовенного введення кроликам і обумовленого цим зниження рівня глюкози у крові (приклади 5 і 6). Прискорене настання дії похідної інсуліну при підшкірному застосуванні було показано за допомогою євгликемічного кламп-метода (euglykaemische Clamp Technik) (приклад 7) після підшкірного введення натщесерце собаці (приклад 7). Були введені 0,3м.е./кг. Препаратом порівняння був людський інсулін. У кламп-методі після ін'єкції інсуліну вимірюють через короткі проміжки часу вміст глюкози у крові і вливають рівно стільки глюкози, скільки необхідно, щоб компенсувати зменшення її зниження. Це має ту перевагу, що у тварин не наступає ніякої зустрічної регуляції, як це мало би місце при сильному падінні вмісту глюкози у крові після введення інсуліну. Кількість і тимчасова залежність улитої глюкози характеризують дію інсуліну. L ys (ВЗ), Glu (В29)-інсулін (SEQ ID NO 3) і Lys (ВЗ), lle (B28)- інсулін (SEQ ID NO 4) показують явно більш швидке настання дії, ніж людський інсулін. Якщо максимальна дія (швидкість уливання глюкози) досягається з людським інсуліном через 100 хвилин, то з L ys (ВЗ), Glu (В29)-інсуліном (SEQ ID NO 3) вона досягається через 80 хвилин, а з Lys (В3), Не (В28)- інсуліном (SEQ ID NO 4) уже через 60 хвилин. З цієї причини зазначені аналоги, якщо їх упорскувати незадовго до прийому їжі, повинні краще, ніж людський інсулін, компенсувати постпрандиальний (=виникаючий після прийому їжі) ріст умісту глюкози у крові. Описані похідні інсуліну придатні для лікування цукрового діабету як типу І, так і типу II, переважно у сполученні з базальним інсуліном. Тому додатковим предметом даного винаходу є також фармацевтична композиція з ефективністю, що знижує і відповідно регулює рівень глюкози у крові і яка містить поряд із фізіологічно прийнятним носієм щонайменше одну запропоновану згідно з винаходом похідну інсуліну і/або її фізіологічно прийнятну сіль в ефективній кількості. В якості фізіологічно прийнятного й сумісного з похідною інсуліну носія придатний стерильний водяний розчин, якому за допомогою добавок гліцерину, повареної солі, глюкози додають ізотонічність по відношенню до крові і який містить поряд із цим ще один із звичайно застосовуваних консервантів, наприклад фенол, мкрезол або ефір п-гідроксибензойної кислоти. Носій може додатково містити буферну речовину, наприклад ацетат натрію, цитрат натрію, фосфат натрію. Для регулювання рН застосовуються розведені кислоти (як правило, соляна кислота), відповідно розчини лугів (як правило, розчин їдкого натру). Крім того, носій може містити іони цинку. В якості фізіологічно прийнятних солей придатні, зокрема, солі лужних металів або амонію. Одна або декілька похідних інсуліну формули І або похідна інсуліну формули І може знаходитися в будь-якій пропорції у суміші з іншими з цієї похідної інсуліну незалежно одна від одної відповідно в розчиненій, аморфній і/або кристалічній формі. Іноді доцільно додати в запропоновану згідно з винаходом композицію необхідну кількість відповідного стабілізатора для запобігання випадання в осад білка в результаті термомеханічного навантаження при контакті з різними матеріалами. Такі стабілізатори загальновідомі. Похідна інсуліну і/або її фізіологічно прийнятна сіль може знаходитися в запропонованій згідно з винаходом композиції у розчиненій, аморфній і/або кристалічній формі. Як уже згадувалося, похідні інсуліну згідно з винаходом характеризуються швидким настання їхньої дії. Звичайно в практиці інсулінової терапії швидкодіючі інсуліни змішують із препаратами, що містять допоміжну речовину продовженої дії (наприклад, NPH-інсулін). В результаті, в залежності від складу, утворюються препарати, профілі дії яких відповідають накладеним окремим профілям, оскільки окремі компоненти в суміші стабільні і ніяк не впливають один на одного. Однак у випадку суміші похідної інсуліну з людським NPHінсуліном доводиться очікувати, що, особливо при тривалому збереженні, відбудеться обмін між розчиненою похідною інсуліну і кристалічним NPH-інсуліном. В результаті як фармокодинаміка інсуліну продовженої дії, так і фармокодинаміка розчиненого швидкодіючого інсуліну змінюється непередбаченим чином. Для запобігання цього доцільно готува ти швидкодіючу похідну із застосуванням допоміжної речовини продовженої дії наприклад, в якості NPH-інсуліну. Ця депо-форма похідної інсуліну може бути потім як завгодно змішана з розчиненою швидко діючою формою, без того щоб склад одної або іншої форми змінювався в результаті обміну під час збереження. Хоча даний винахід по суті стосується швидкодіючих похідних інсуліну, він охоплює також і можливість приготування такого роду похідних із метою забезпечення зміщуваності у вигляді депо-форми, причому переважно допоміжною речовиною продовженої дії є протамінсульфат і похідна інсуліну і/або її фізіологічно прийнятна сіль утворять із протамінсульфатом співкристалізат. Нижче даний винахід докладніше пояснюється на прикладах його здійснення. Приклад 1: Конструювання Lys (В3)-проінсулину в якості вихідної речовини для релевантних винаходу плазмід відповідно до прикладів 2-4. В патенті США 5358857 описаний вектор pINT 90d і PCR-праймери Tir і Insu 11. Ці компоненти служать вихідним матеріалом для конструювання плазміди pINT 125d, що кодує бажаний Lys (В3)-проінсулін. Додатково синтезують праймери Insu 35 із послідовністю 5' ТТТ GTG AAG CAG CAC CTG 3' і Insu 36 із послідовністю 5' CAG GTG CTG CTT CAC AAA 3'. Здійснюють PCR-реакцію з праймерами Тіг і Insu 36 і другу реакцію з праймерами Insu 11 і Insu 35. Матрицею для цього служить pINT 90d-ДHK. Продукти обох PCR-реакцій почасти комплементарні, так, що при об'єднанні їх у третій PCR-реакції з праймерами Тіг і Insu 11 утворюється фрагмент, який кодує варіант проінсуліну, що містить лізин у положенні 3 ланцюга В. Цей PCR-фрагмент осаджують для обчищення в етанолі, сушать і потім переварюють згідно з даними виробників із рестрикційними ферментами Nco 1 і Sal 1 Реакційну суміш розділяють гель-електрофоретично і виділяють цільовий Nco 1/Sal 1-фрагмент. У вищевказаному патенті США описана плазміда pINT 91 d, що кодує міні-проінсулін. Якщо виділити шляхом розчеплення послідовність, що кодує міні-проінсулін, за допомогою ферментів Nco 1 і Sal 1 і виділити ДНК залишкової плазміди, то можна цю ДНК піддати взаємодії з отриманим Nco 1/Sal 1-PCR-фрагментом у ході Τ 4-лігаза-реакції з одержанням плазміди pINT 125d. Останню трансформують в Е. Coli K12, там розмножують і знову виділяють. Після того як структура плазміди підтверджена за допомогою аналізу послідовності ДНК і рестрикційного аналізу, pINT 125d-HK служить у якості матричної ДНК для введення подальших мутацій у цей варіант проінсуліну. Приклад 2: Конструювання Lys (B3) Glu (В29)-проінсуліну Для одержання мутеїну синтезують праймери 329а з послідовністю 5' ТТС ТАС АС А ССС GAG ACC CGC GGC АТС G-3' і 329 b із послідовністю 5' GCC GCG GGT СТС GGG TGT GTA GAA GAA GC 3'. В якості матриці застосовується ДНК плазмід plNT125d і plNT91d. Праймер 329а піддають взаємодії з праймером Insu 11 на матриці plNT91d, а праймер 329b - із Тіr (див. вищенаведений приклад) на матриці plNT125d у PCR-реакції. Тому що обидва PCR-продукти почасти комплементарні, то вони можуть бути об'єднані в безпосередній PCR-реакції і знову піддані взаємодії з праймерами Тіr і Insu 11. Утвориться фрагмент ДНК, що кодує цільовий мутеїн. Цей фрагмент піддається подвійному переварюванню рестрикційними ферментами Nco 1 і Sal 1 і Nco 1/ Sa 1-фрагмент, що утворився, вставляють у ДНК залишкової плазміди plNT91d у ході Τ 4-лігаза-реакції. Утвориться плазміда pINT 329, задану структуру якої після ампліфікації в Е. Coli K12 підтверджують за допомогою рестрикційного аналізу й аналізу ДНК-послідовності. Похідна проінсуліну, що кодується плазмідою, охарактеризована обома амінокислотними замінами і з'єднувальною С-ланкою, що складається з амінокислоти аргінін. Приклад 3: Конструювання Lys (B3) II (В27)-проінсуліну Конструювання робиться згідно з попереднім прикладом із парами праймерів: КВ3 JB 27A 5' ТТС ТАС АТС ССС AAG АСС CGC CG 3' і Insu 11, а також К В3 J 27В 5' СТТ GGG GAT GTA GAA GAA GCC TCG З' і Тіr. В якості матриці в обох PCR-реакціях служить ДНК плазміди plNT125d. PCR- Продукти обох реакцій об'єднують у ході третьої реакції, як описано у прикладі 1, і продукт клонують згідно з прикладом. Одержують плазміду plNT332. Приклад 4: Конструювання Lys (В3) Не (В28)-проінсуліну Конструювання робиться згідно з прикладом 3 із парами праймерів: KB3 JB 28A 5' ТАС АСА АТС AAG ACC CGC CGG GAG-3' I lnslu11, а також KB J B28B 5' GGT CTT GAT TGT GTA GAA GAA GCC TCG-3' iTir. Одержують плазміду plNT333. Експресія сконструйованих варіантів інсуліну. Плазміди pINT 329,332 і 333 трансформують, наприклад, кожну в Е. Coli K12 W3110. Потім рекомбінантні бактерії, що містять плазміди, кожна з яких кодує відповідний варіант, ферментують і одержують таким чином необхідну сировину для одержання відповідного варіанта інсуліну. Приклад 5: Конструювання Lys (В3), lie (B28), Asp (А21)-проінсуліну Конструювання робиться згідно з прикладом 3. Однак замість plNT125d матрицею для PCR-реакції служить ДНК плазміди pINT 333, яка була сконструйована у прикладі 4. При цьому застосовується наступна пара праймерів: P-pint365 5'-TTTTTTGTCGACTATTAGTCGC AGTAGTTCTACC AGCTG-3' iTir. Одержують плазміду plNT365. Приклад 6: Біологічна активність Lys (В3), GIu (В29)-інсуліну після внутрішньовенного введення кроликам Lys (ВЗ), GIu (В29)інсулін 0 100 100 0,25 89,17 89,47 0,5 67,56 58,32 0,75 73,24 66,59 1 73,13 68,21 1,5 78,12 71,95 2 89,47 80,88 3 107,01 94,2 4 104,55 99,78 Вісім кроликів одержували внутрішньовенно зазначені інсуліни (0,2м.е./кг). Протягом наступних чотирьох годин у зазначені моменти часу визначали концентрацію глюкози у крові і перераховували у відсотки від вихідного значення в момент часу 0. Середні значення не показують значної різниці в біологічній активності між людським інсуліном і Lys (В3). GIu (В29)-інсуліном. Приклад 7: Біологічна активність Lys (В3), lie (В27)- і Lys (В3), Не (В28)-інсуліну після внутрішньовенного введення кроликам Шість кроликів одержували внутрішньовенно зазначені інсуліни (0,2м.е./кг). Протягом наступних чотирьох годин у зазначені моменти часу визначали концентрацію глюкози у крові і перераховували у відсотки від вихідного значення в момент часу 0. Середні значення не показують значної різниці в біологічній активності між людським інсуліном, Lys (В3), Не (В27)-інсуліном і Lys (В3), Не (В28)-інсуліном. Lys (B3), lle Lys (B3), lle Час, г Людський інсулін (B27)-інсулін (B28)-інсулін 0 100 100 100 0,33 67,8 62,6 63,3 0,66 54,9 60,6 55,8 1 55,2 66,8 59,3 1,5 63 79,2 66,7 2 77,8 90,9 81,6 3 91,5 96,3 97,2 4 99,5 96 101,6 Приклад 8: Фармакодинаміка Lys (В3), Glu (В29)-інсуліну і Lys (B3), lie (B28)-інсуліну після підшкірного введення собаці Групи з чотирьох собак одержували підшкірні ін'єкції зазначених інсулінів (0,3м.е./кг). Рівень глюкози у крові підтримували в межах від 3,7 до 4ммоля/л шляхом безупинного вливання глюкози. Була показана середня швидкість вливання глюкози ± (стандартна похибка) від моменту ін'єкції (t=0) протягом 240хв. Кламп глюкози при введенні собаці натщесерце швидкодіючих варіантів інсуліну Параметри профілів уливання глюкози Доза: 1x0,3м.е./кг підшкірно при t0(n=4) Час, г Людський інсулін Препарат Людський інсулін фірми Хьохст Lys (В3), Glu (В29)інсулін Lys (В3), lie (B28)інсулін Фаза ікременту Крапка Куто вий коефіцієнт повороту (хв) крапки повороту 43 0,144 tмакс (ХВ) 100 Фаза декременту Крапка Куто вий коефіцієнт повороту (хв) крапки повороту 156 -0,065 33 0,227 80 127 -0,091 16 0,267 60 104 -0,102 Кламп глюкози при введенні собаці натщесерце швидкодіючих варіантів інсуліну Доза: 1х0,3м.е./кг підшкірно при to (середнє ± РЕМ, n=4) Час, хв. 0 6 11 16 21 26 31 36 41 46 51 Людський інсулін фірми Хьохст АГ Швидкість вливання глюкози Глюкоза у крові ммоль/л мг×хв-1×кг-1 Час, хв. середнє стандартн. похибка середнє стандартн. похибка 0.00 0.00 0 3.98 0.07 0.14 0.01 4 3.97 0.04 0.23 0.08 9 3.98 0.08 0.35 0.19 14 3.99 0.04 0.44 0.18 19 4.01 0.05 1.50 0.25 24 3.85 0.08 3.50 0.56 29 3.82 0.13 5.50 0.90 34 3.77 0.13 4.50 0.56 39 3.99 0.07 4.00 1.17 44 4.09 0.11 5.25 0.54 49 3.98 0.06 56 61 66 71 76 81 86 91 96 101 106 111 116 121 126 131 136 141 146 151 156 161 166 171 176 181 186 191 196 201 206 211 216 221 226 231 236 240 Час, хв. 0 6 11 16 21 26 31 36 41 46 51 56 61 67 71 76 81 86 91 96 101 106 111 116 121 126 5.75 7.25 6.50 7.75 7.75 8.50 8.75 8.75 9.25 8.50 8.50 8.00 9.25 8.00 8.00 9.25 8.50 8.50 8.25 7.00 6.25 6.00 5.00 4.75 4.33 5.33 4.67 3.33 3.00 3.67 4.67 4.67 3.33 3.00 2.17 2.67 2.00 1.17 0.89 1.19 1.09 1.08 1.14 1.09 1.29 1.08 2.33 1.68 1.44 1.06 1.47 1.58 1.37 1.19 1.30 1.25 1.24 1.46 1.29 0.79 0.50 1.39 0.54 1.19 0.72 0.72 0.00 0.72 0.72 0.72 0.72 0.94 0.68 0.980.47 0.36 54 59 64 69 74 79 84 89 94 99 104 109 114 119 124 129 134 139 144 149 154 159 164 169 174 179 184 189 194 199 204 209 214 219 224 229 234 239 4.01 3.93 4.08 3.98 4.08 4.03 4.09 4.03 3.99 4.08 3.96 3.92 3.83 4.04 3.95 3.81 3.92 3.86 3.91 4.06 4.05 3.97 4.04 3.95 4.01 3.88 4.03 4.12 4.13 3.98 3.91 3.92 4.09 4.05 4.17 4.00 4.01 4.08 0.10 0.13 0.06 0.01 0.10 0.12 0.15 0.18 0.22 0.10 0.08 0.19 0.17 0.21 0.12 0.09 0.16 0.13 0.12 0.08 0.04 0.12 0.09 0.15 0.12 0.14 0.09 0.11 0.03 0.11 0.05 0.08 0.04 0.11 0.12 0.13 0.05 0.02 Lys (B3), Glu (В29)-інсулін Швидкість вливання глюкози Глюкоза в крові Час, хв. ммоль/л мг×хв-1×кг-1 середнє стандарти, похибка середнє стандарти, похибка 0.00 0.00 0 3.77 0.12 0.24 0.08 5 3.85 0.22 0.36 0.18 10 3.86 0.17 0.95 0.60 15 3.86 0.22 2.75 0.96 20 3.61 0.16 3.25 0.65 25 3.73 0.14 3.75 0.22 30 3.76 0.08 5.25 0.41 35 3.66 0.15 6.00 0.00 40 3.71 0.12 9.00 0.87 45 3.58 0.19 8.00 0.00 50 3.73 0.14 8.50 0.56 55 3.81 0.11 11.50 0.43 60 3.57 0.14 10.00 1.22 65 3.81 0.20 11.50 0.43 70 3.85 0.23 11.00 1.70 75 3.81 0.28 10.50 0.83 80 3.94 0.15 8.25 1.75 85 3.95 0.18 9.00 0.50 90 3.69 0.12 11.00 0.94 95 3.56 0.14 9.75 0.41 100 3.71 0.16 10.25 0.89 105 3.59 0.20 8.00 0.94 110 3.84 0.16 10.25 0.74 115 3.46 0.10 10.25 1.24 120 3.56 0.25 9.75 1.34 125 3.70 0.23 131 136 141 146 151 156 161 166 171 176 181 186 191 196 201 206 211 216 221 226 231 236 240 Час, хв. 0 6 11 16 21 26 31 36 41 46 51 56 61 66 71 76 81 86 91 96 101 106 111 116 121 126 131 136 142 146 151 156 162 166 171 176 181 186 191 196 202 7.75 5.50 6.75 6.25 4.75 5.75 4.75 5.50 4.75 3.75 4.00 2.88 3.25 3.13 2.13 2.06 1.79 1.78 1.41 0.78 0.85 0.76 1.07 1.52 1.44 1.85 1.67 1.14 0.96 0.82 1.03 0.41 0.54 0.94 0.87 0.41 0.84 0.51 0.66 0.62 0.63 0.58 0.36 0.37 0.51 0.47 130 135 140 145 150 155 160 165 169 175 180 185 190 195 200 205 210 215 220 225 230 235 240 Lys (В3), llе (В28)-інсулін Швидкість вливання глюкози мг×хв-1×кг-1 Час, хв. середнє стандартн. похибка 0.00 0.00 0 1.54 0.53 4 3.75 1.24 10 5.25 0.89 15 8.25 1.67 20 7.25 1.63 25 7.50 1.25 30 8.50 1.15 35 11.00 1.12 40 11.75 0.22 45 10.75 0.96 50 11.25 1.78 55 10.50 1.09 60 9.75 1.85 65 11.00 1.50 70 10.50 0.83 75 9.25 1.19 80 10.00 1.22 85 8.75 1.29 90 10.25 0.74 95 10.00 1.22 100 10.50 1.15 105 8.50 1.03 109 7.75 0.22 115 7.50 1.09 120 6.00 1.62 125 4.25 1.29 130 5.33 1.19 135 4.75 1.19 140 4.00 0.94 145 3.25 0.89 150 4.00 0.71 155 3.75 0.54 160 2.25 0.54 165 2.25 0.41 170 1.63 0.48 175 1.54 0.53 180 0.88 0.46 185 1.19 0.54 190 1.28 0.79 195 1.07 0.58 200 3.88 3.97 3.64 3.71 3.82 3.71 3.81 3.67 3.81 3.83 3.75 3.85 3.78 3.81 3.88 3.85 3.85 3.85 3.87 3.85 3.72 3.74 3.56 0.21 0.15 0.15 0.14 0.08 0.11 0.11 0.15 0.04 0.08 0.16 0.14 0.10 0.14 0.13 0.14 0.17 0.18 0.16 0.13 0.23 0.21 0.18 Глюкоза у крові ммоль/л середнє стандартн. похибка 3.74 0.07 3.60 0.17 3.49 0.19 3.53 0.14 3.38 0.18 3.81 0.20 3.64 0.13 3.65 0.12 3.63 0.09 3.68 0.10 3.81 0.09 3.73 0.11 3.78 0.16 3.83 0.14 3.69 0.11 3.81 0.06 3.89 0.01 3.78 0.02 3.83 0.04 3.67 0.11 3.66 0.18 3.59 0.15 3.74 0.10 3.81 0.08 3.83 0.07 3.94 0.07 3.95 0.12 3.70 0.20 3.71 0.08 3.73 0.07 3.74 0.14 3.62 0.05 3.69 0.09 3.80 0.13 3.75 0.05 3.77 0.05 3.77 0.12 3.76 0.10 3.76 0.04 3.76 0.08 3.71 0.11 206 212 217 221 226 231 237 240 0.94 1.41 0.95 0.54 0.72 0.69 0.94 0.88 0.60 1.04 0.60 0.21 0.38 0.38 0.60 0.61 205 210 215 220 225 230 235 240 3.66 3.69 3.74 3.66 3.72 3.75 3.71 3.69 0.08 0.08 0.09 0.17 0.10 0.08 0.03 0.03
ДивитисяДодаткова інформація
Назва патенту англійськоюInsulin derivative or its physiologically acceptable salt, precursor of insulin derivative, dna sequence coding for precursor of insulin derivative, expression vector, substrates transformed by expression vector, pharmaceutical composition
Назва патенту російськоюПроизводное инсулина или его физиологически приемлемая соль, предшественник производного инсулина, последовательности днк, кодирующие предшественник производного инсулина, экспрессирующий вектор, субстрат трансформированный экспрессирующим вектором, фармацевтическая композиция
Автори російськоюHabermann, Paul, Seipke, Gerhard
МПК / Мітки
МПК: C12N 1/19, C07K 14/62, C12P 21/02, C12N 1/21, C12N 15/09, C12N 5/10, C12N 1/15, A61K 38/28, C12N 15/17
Мітки: композиція, днк-послідовність, попередник, трансформований, сіль, кодує, інсуліну, вектором, фізіологічно, похідна, вектор, експресії, субстрат, фармацевтична, похідної, прийнятна
Код посилання
<a href="https://ua.patents.su/9-65529-pokhidna-insulinu-abo-fiziologichno-prijjnyatna-sil-poperednik-pokhidno-insulinu-dnk-poslidovnist-shho-kodueh-poperednik-vektor-ekspresi-substrat-transformovanijj-vektorom-ekspresi.html" target="_blank" rel="follow" title="База патентів України">Похідна інсуліну або її фізіологічно прийнятна сіль, попередник похідної інсуліну, днк-послідовність, що кодує попередник, вектор експресії, субстрат, трансформований вектором експресії, фармацевтична композиція</a>
Попередній патент: Спосіб і пристрій для сушіння та нагрівання
Наступний патент: Медичний лубок і спосіб його одержання
Випадковий патент: Тампон та спосіб його виготовлення