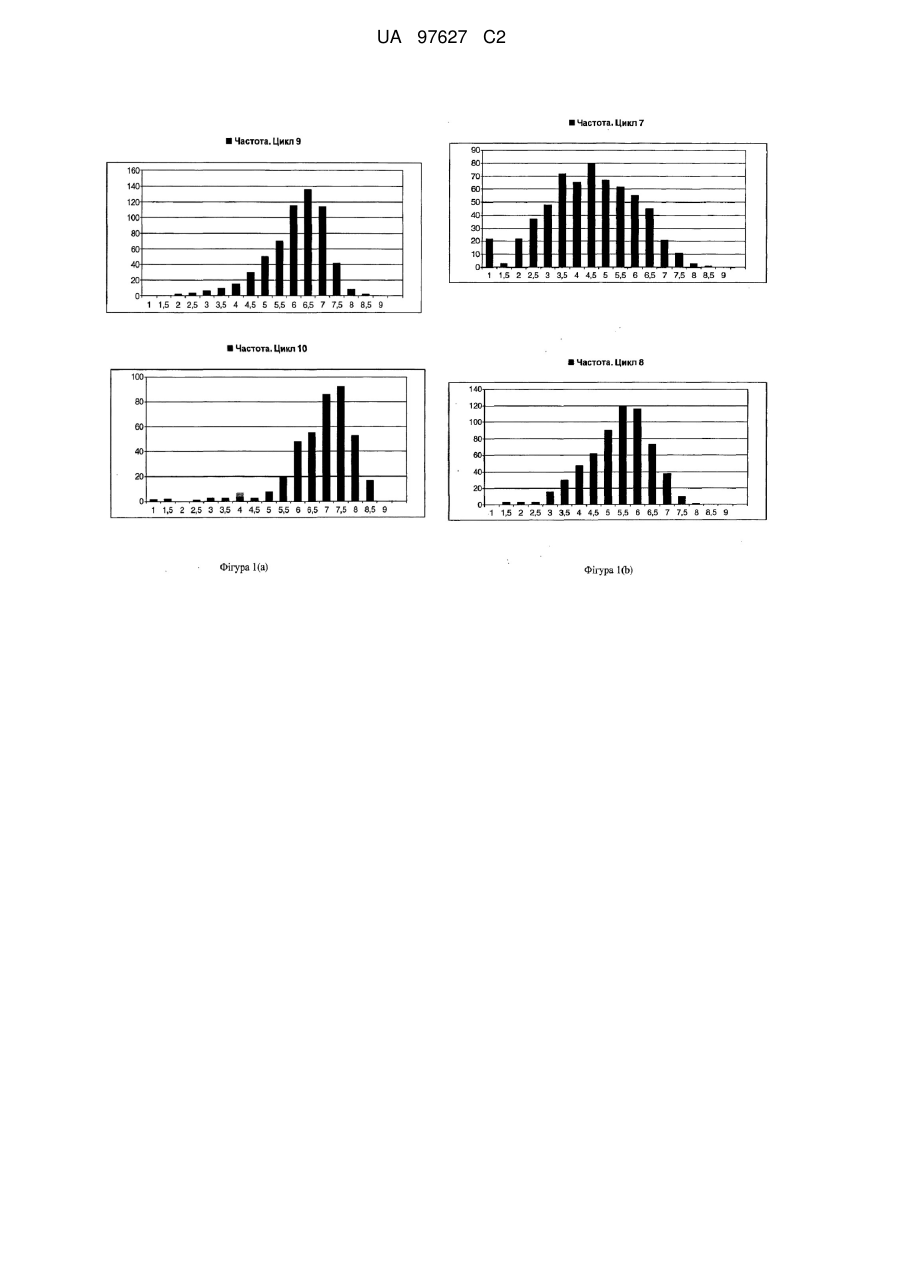
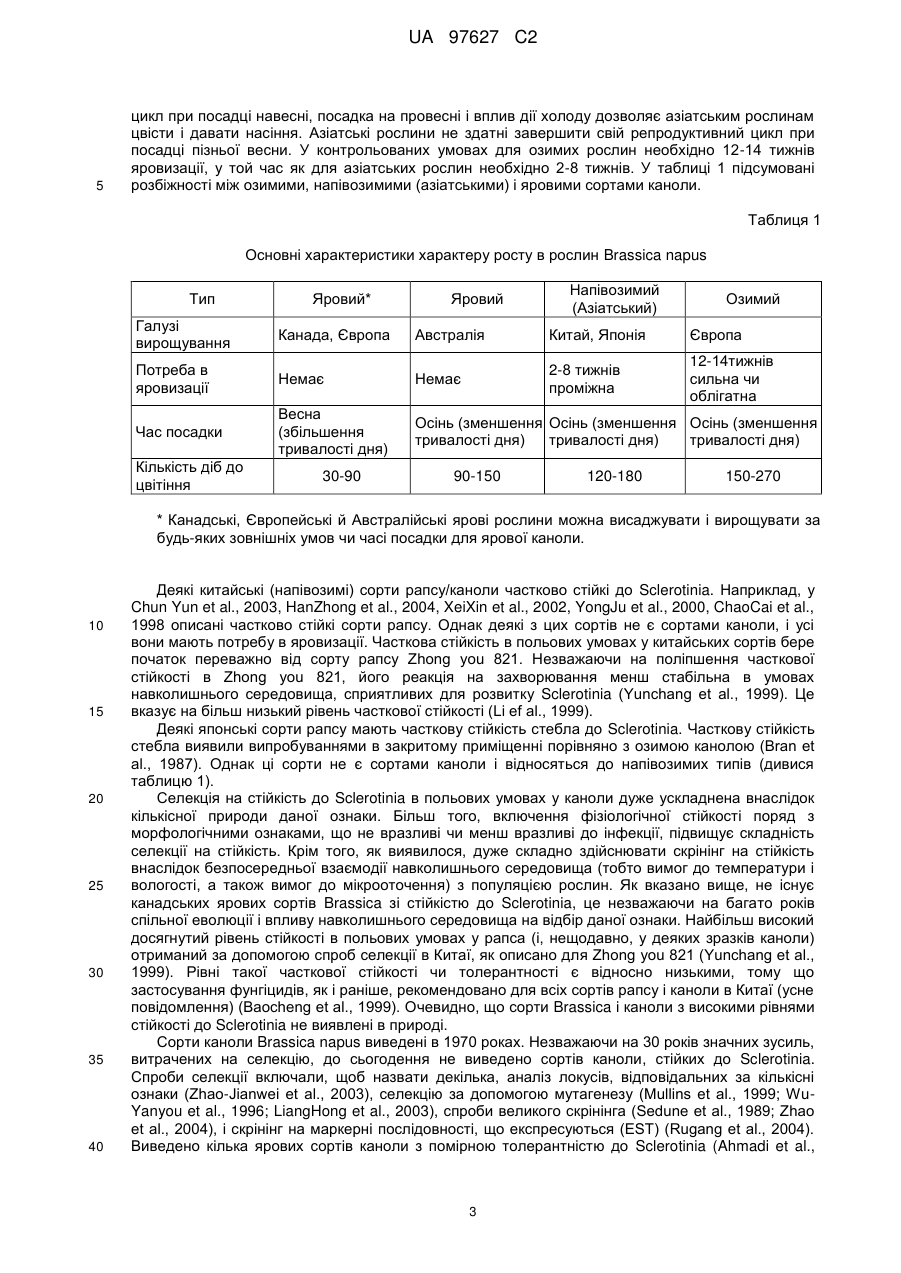
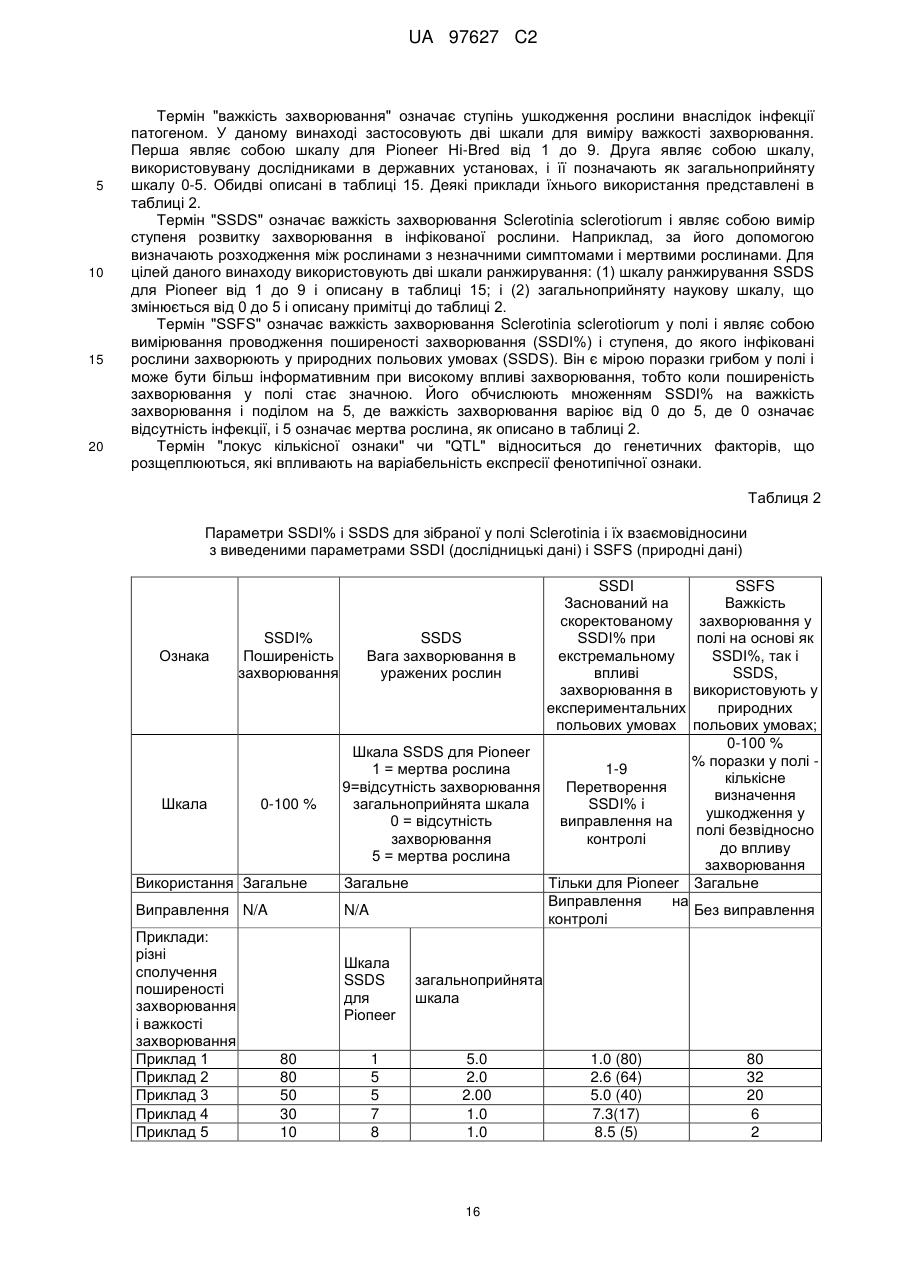
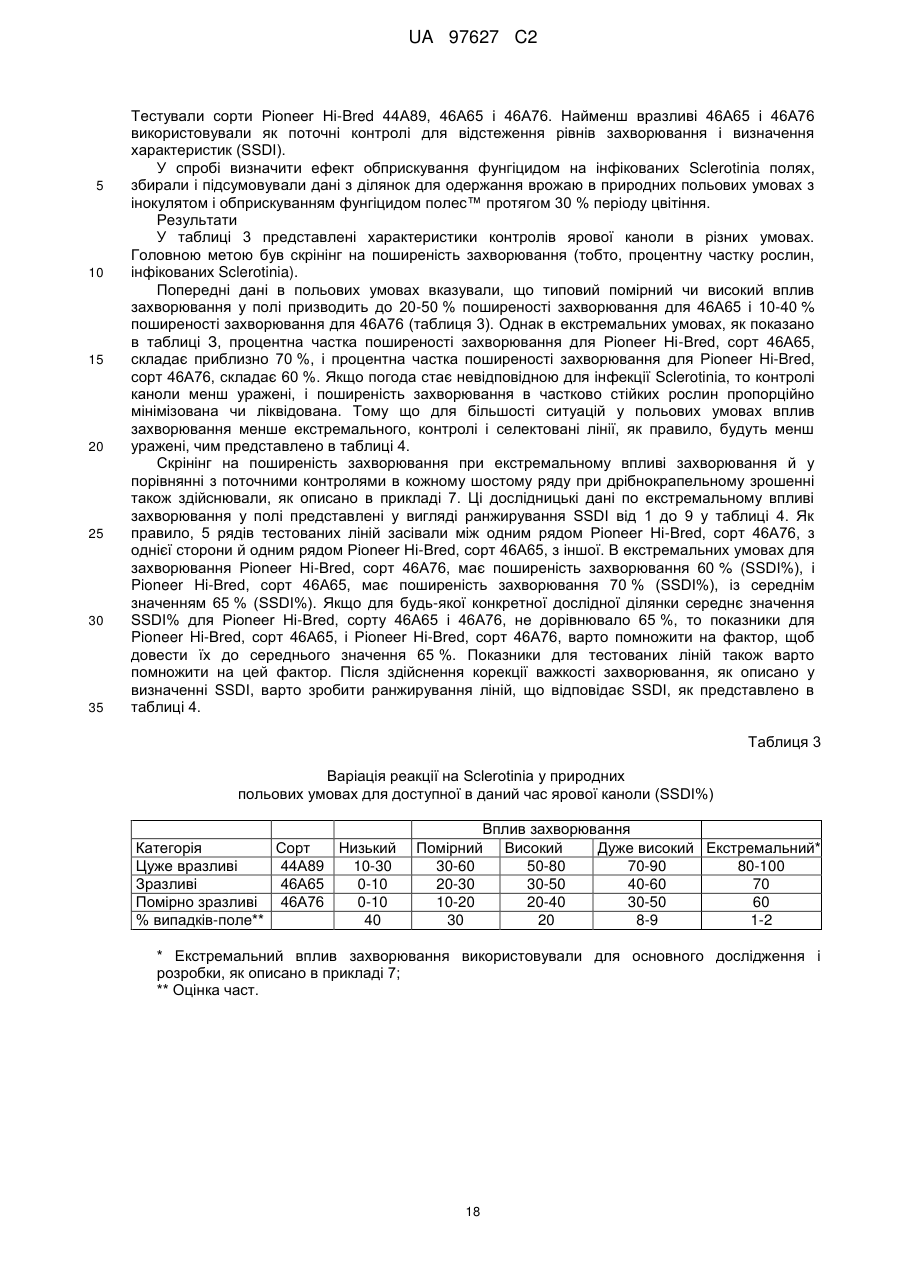
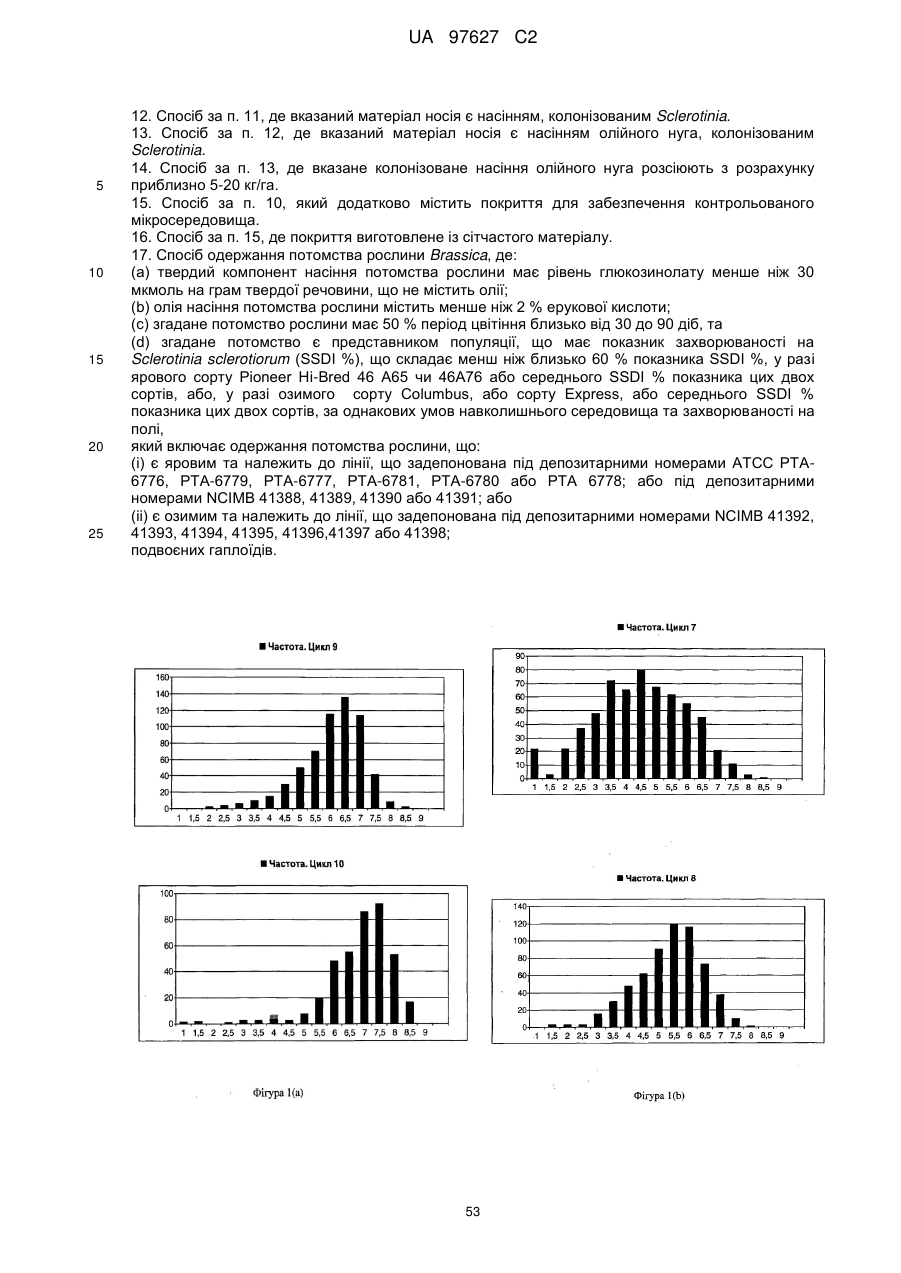
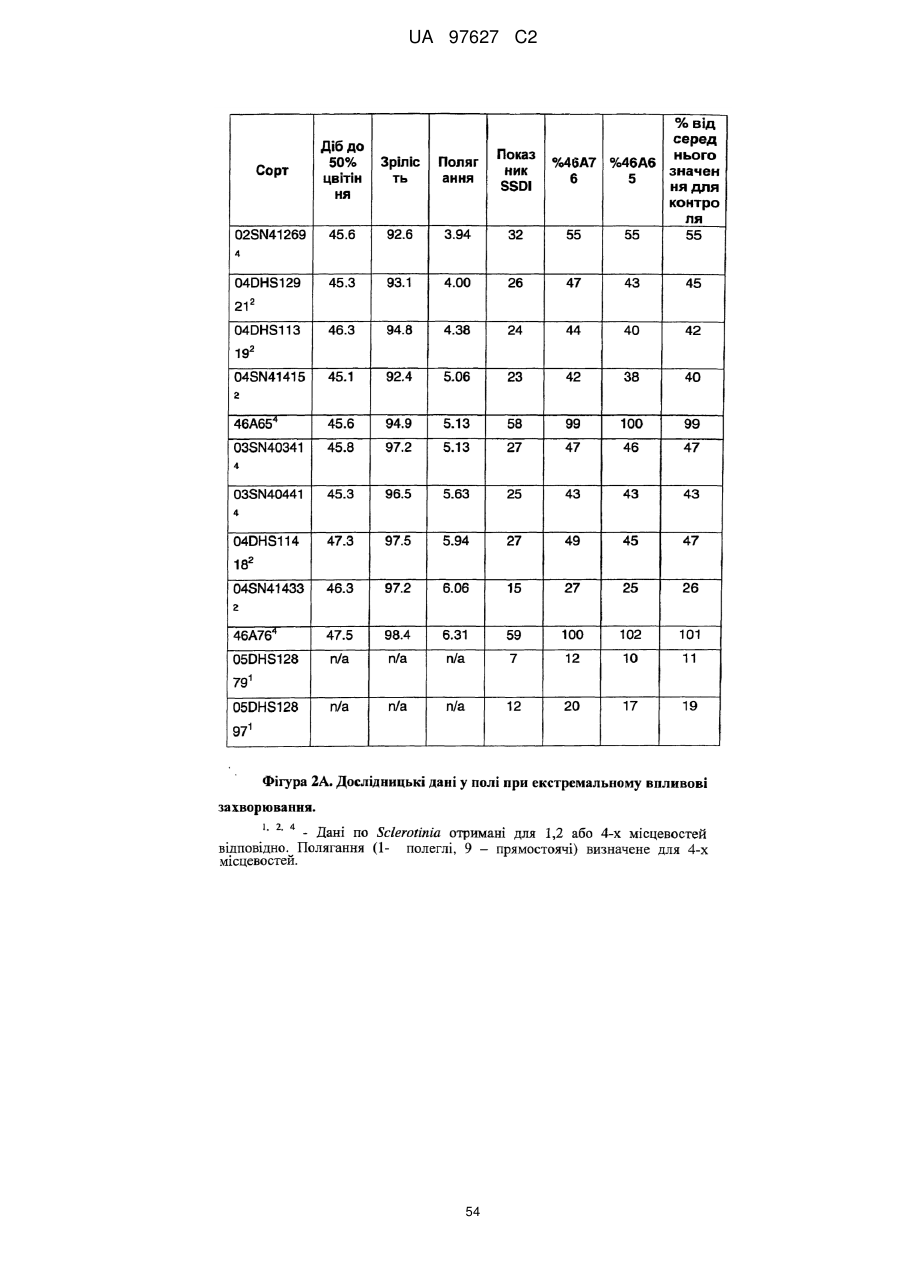
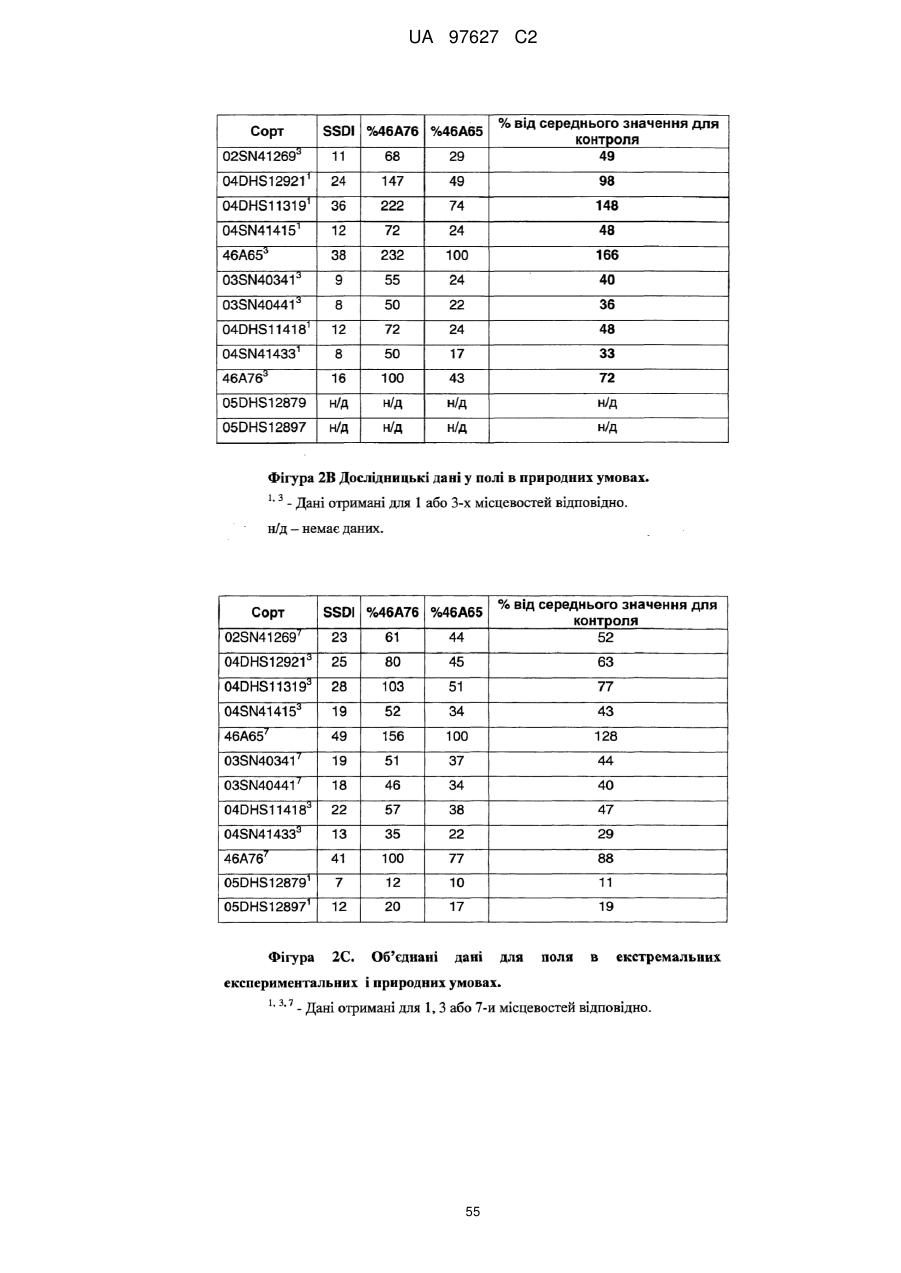
Brassica, стійка до sclerotinia
Номер патенту: 97627
Опубліковано: 12.03.2012
Автори: Шарн Дейв, Пател Джаянтилал, Фалак Ігор, Тулсірам Ломас
Формула / Реферат
1. Потомство рослини, яке одержують за способом, що включає:
(a) схрещування рослини, яка
(і) є яровою та задепонована під депозитарними номерами АТСС РТА-6776, РТА-6779, РТА-6777, РТА-6781, РТА-6780 або РТА 6778; або під депозитарними номерами NCIMB 41388, 41389, 41390 або 41391; або
(іі) є озимою та задепонована під депозитарними номерами NCIMB 41392, 41393, 41394, 41395, 41396,41397 або 41398;
з іншою рослиною Brassica для одержання насіння;
(b) вирощування насіння Brassica з етапу (а) для одержання похідної рослини;
(c) необов'язково повторювання схрещування та вирощування за етапами (а) та (b) для наступних поколінь для одержання додаткових рослин, виведених зі згаданої рослини Brassica; та
(d) відбір рослини-потомка,
де
(а) твердий компонент насіння потомства рослини має рівень глюкозинолату менше ніж 30 мкмоль на грам твердої речовини, що не містить олії;
(b) олія насіння потомства рослини містить менше ніж 2 % ерукової кислоти;
(с) згадане потомство рослини має 50 % період цвітіння близько від 30 до 90 діб, та
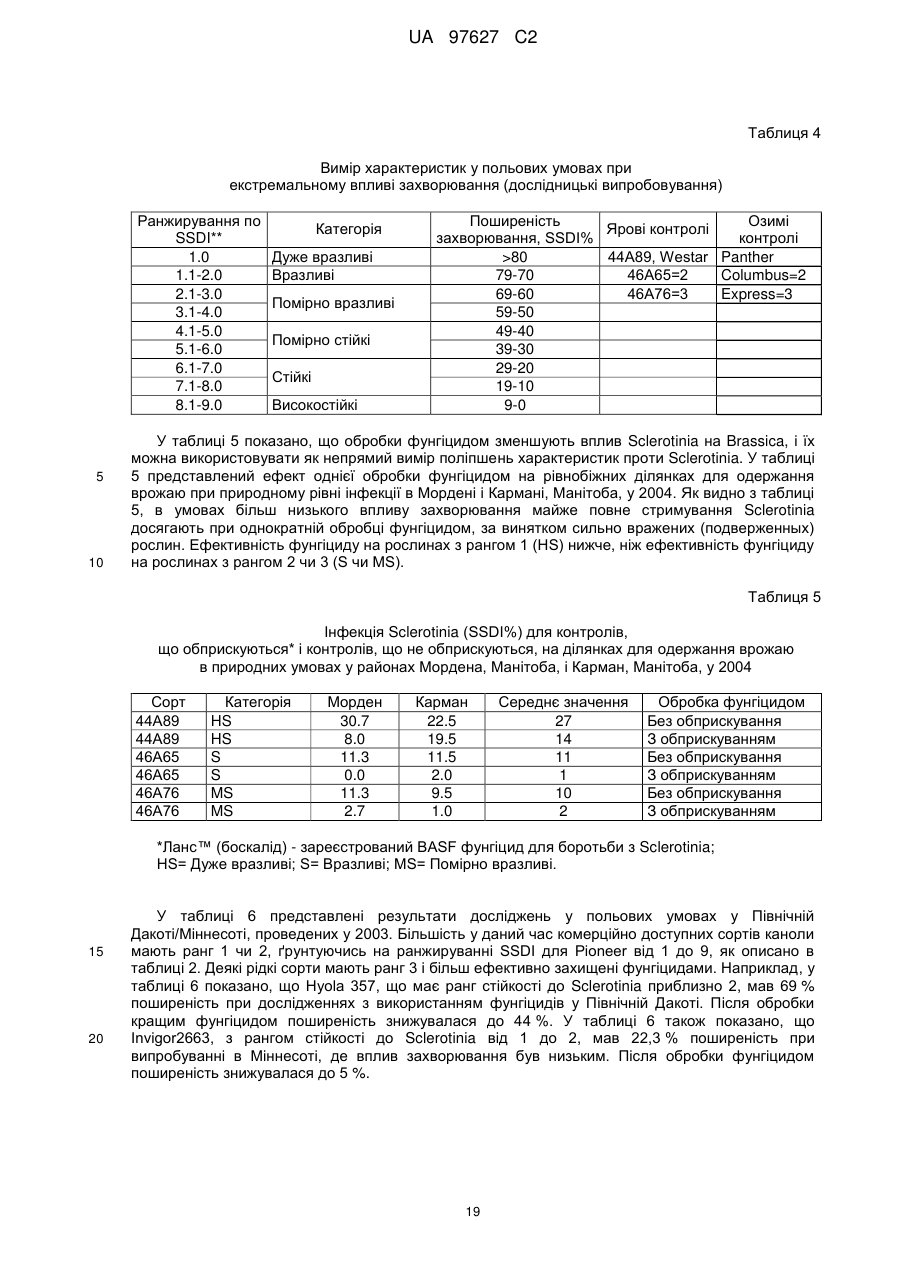
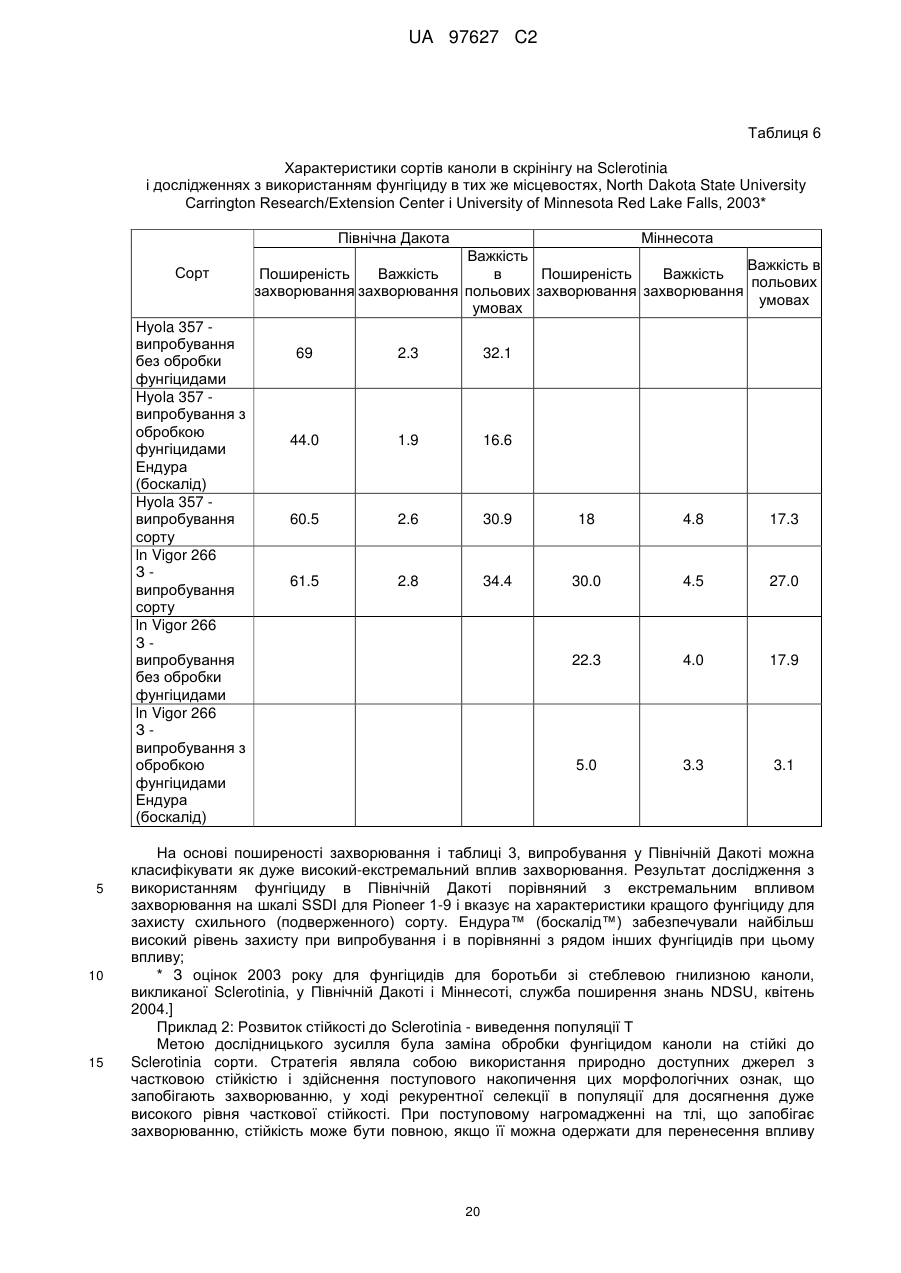
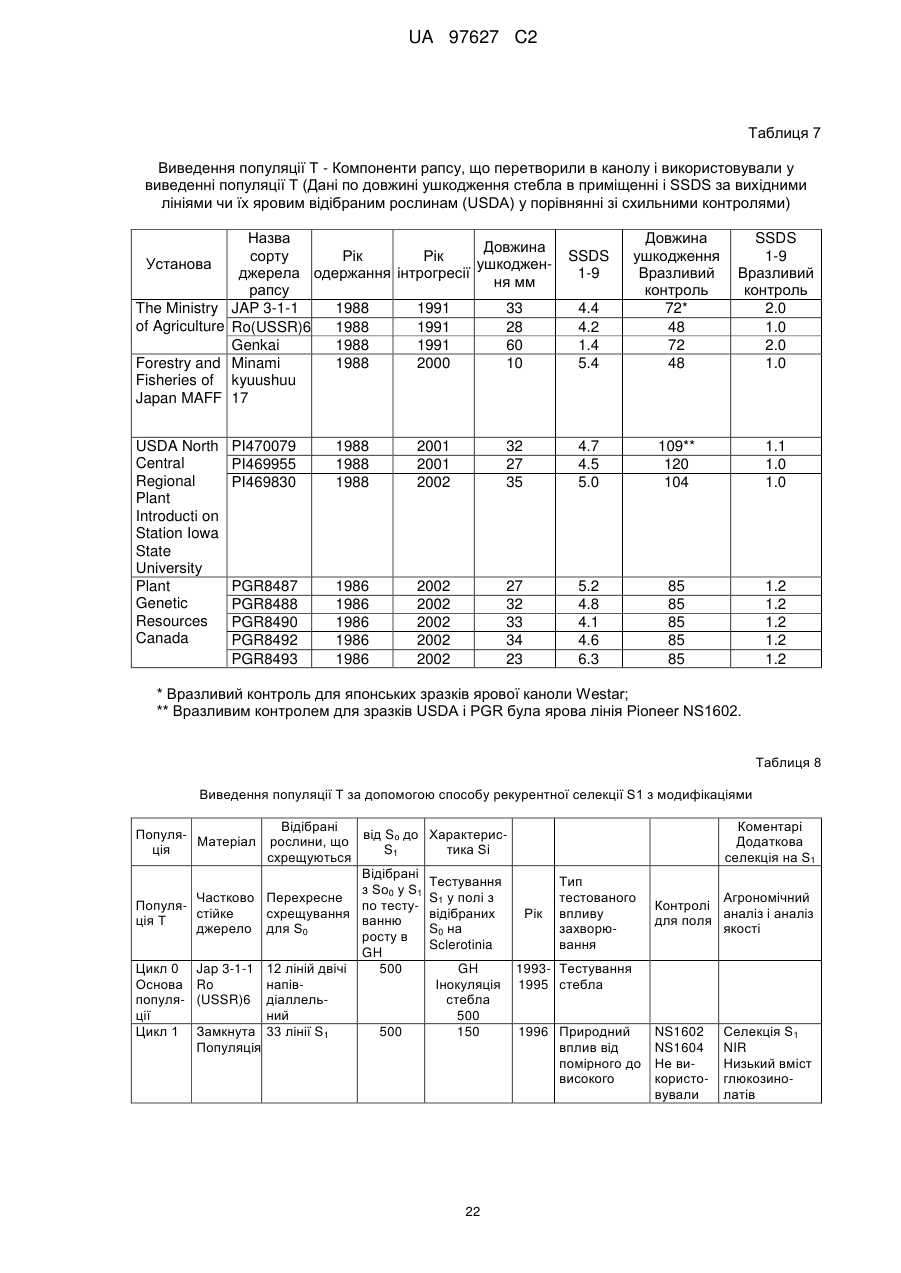
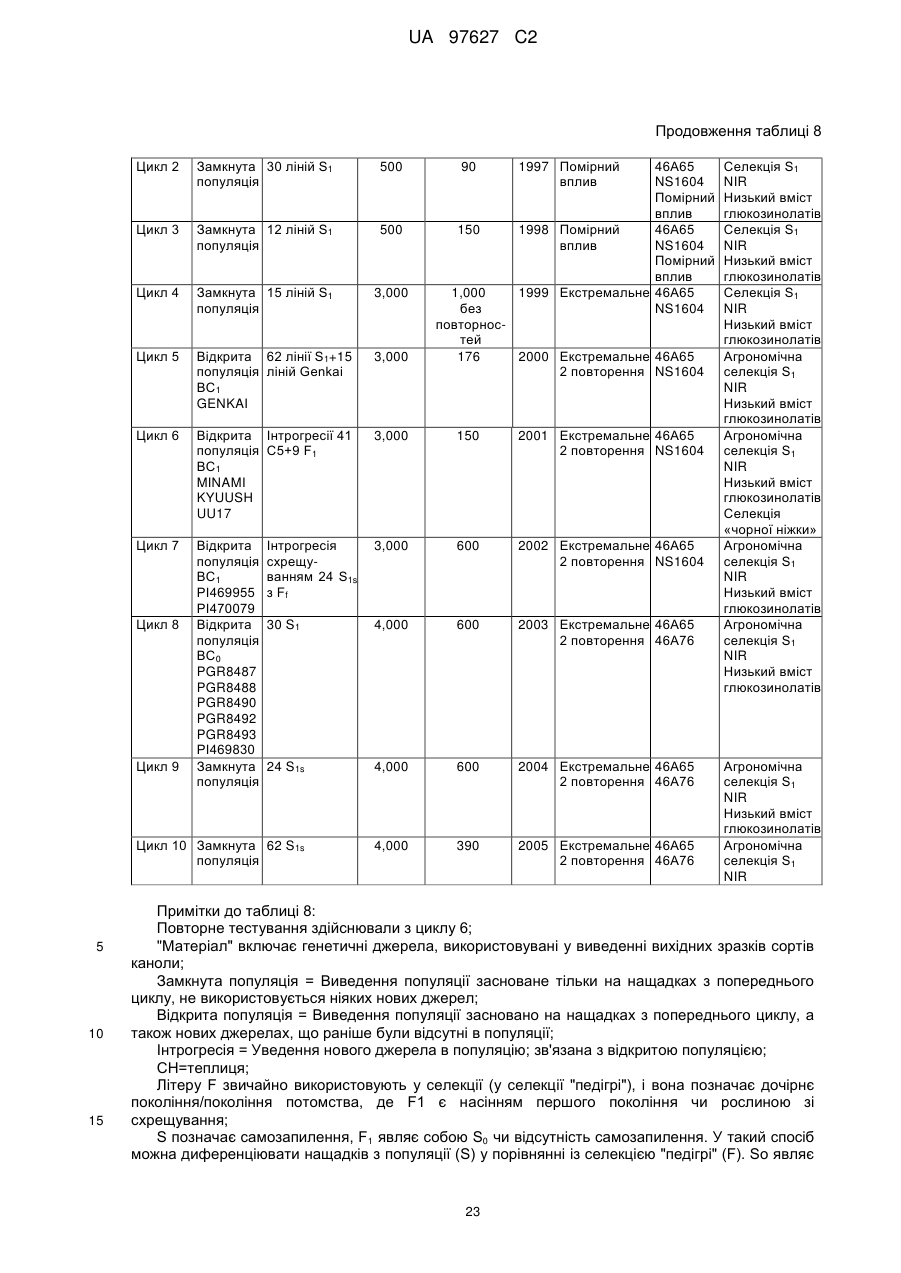
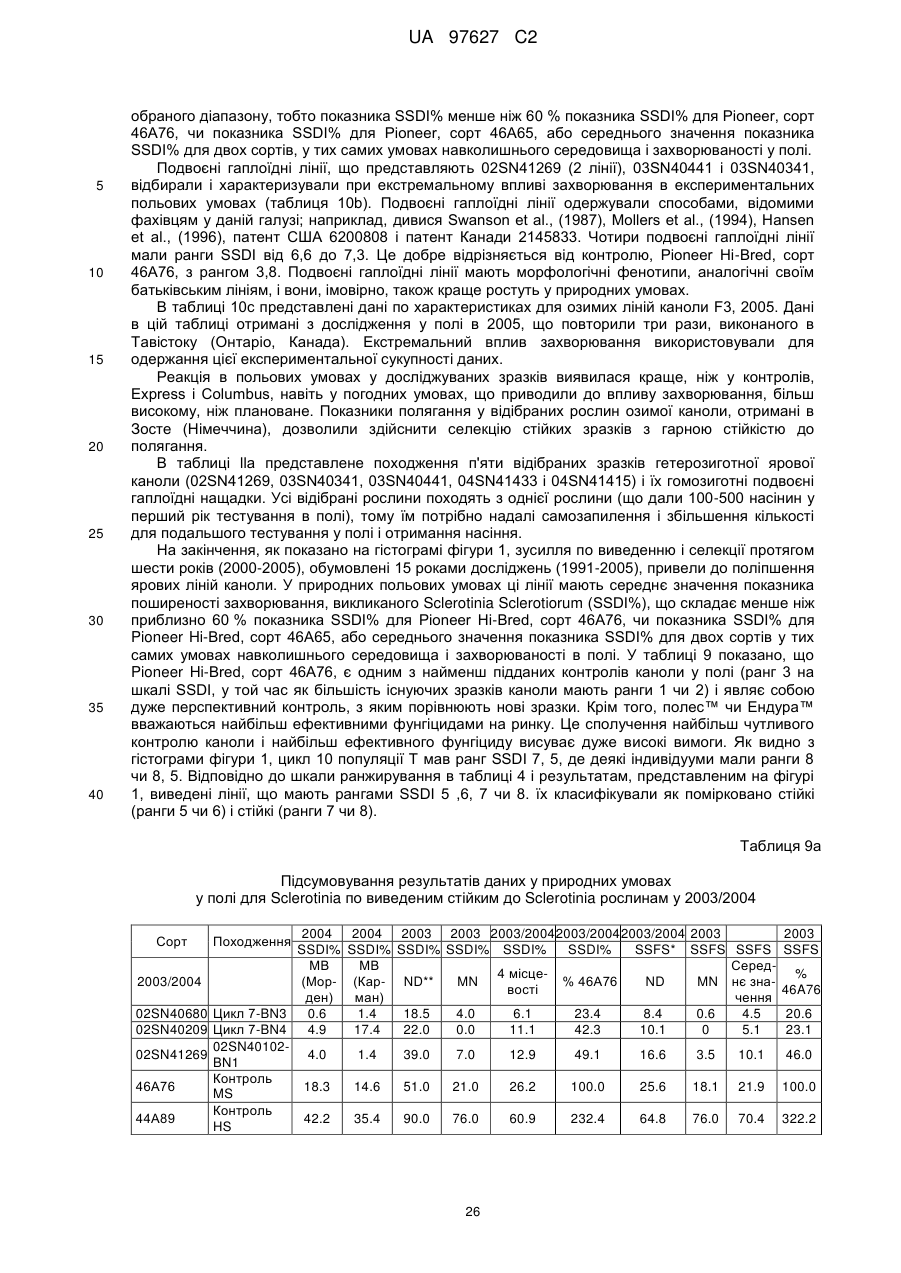
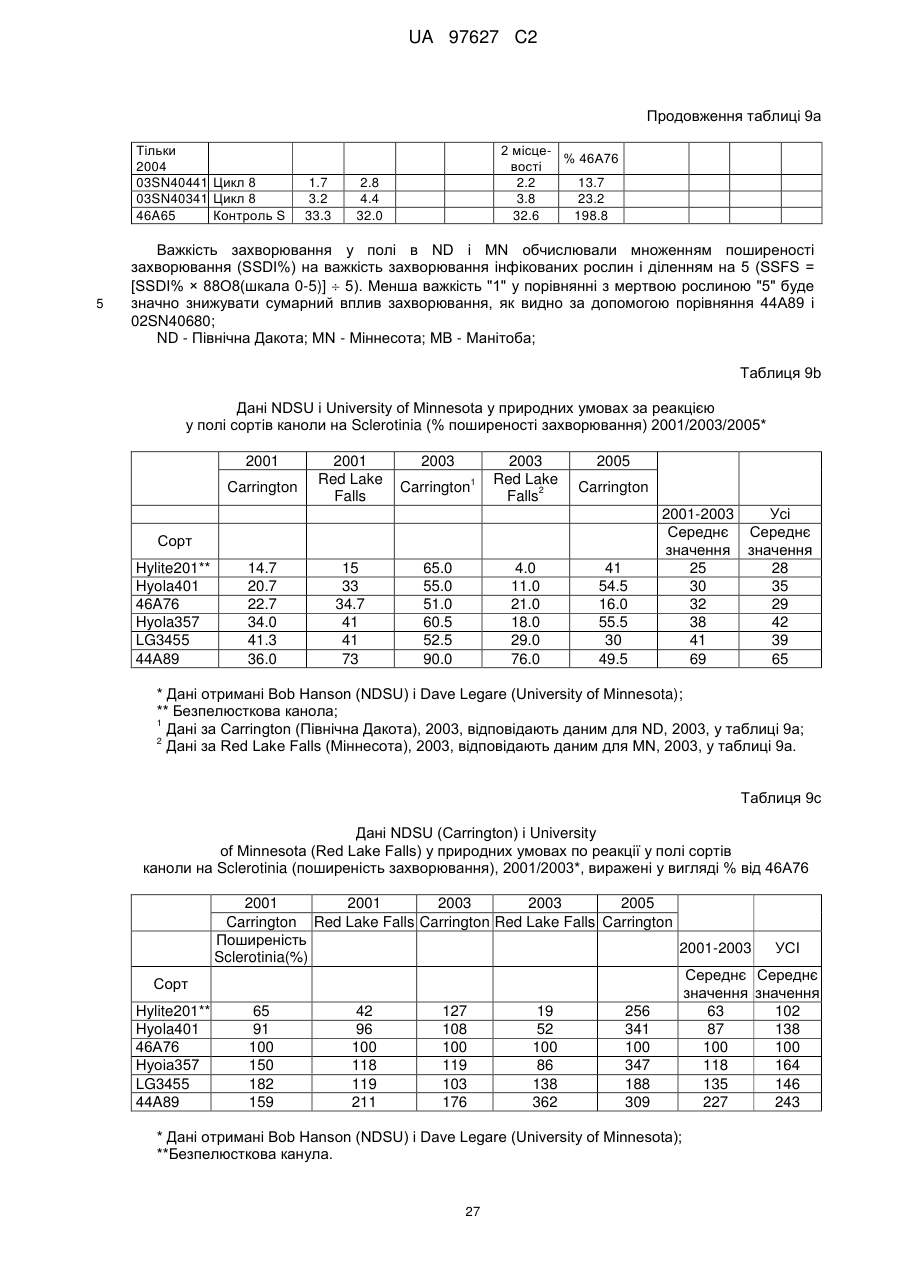
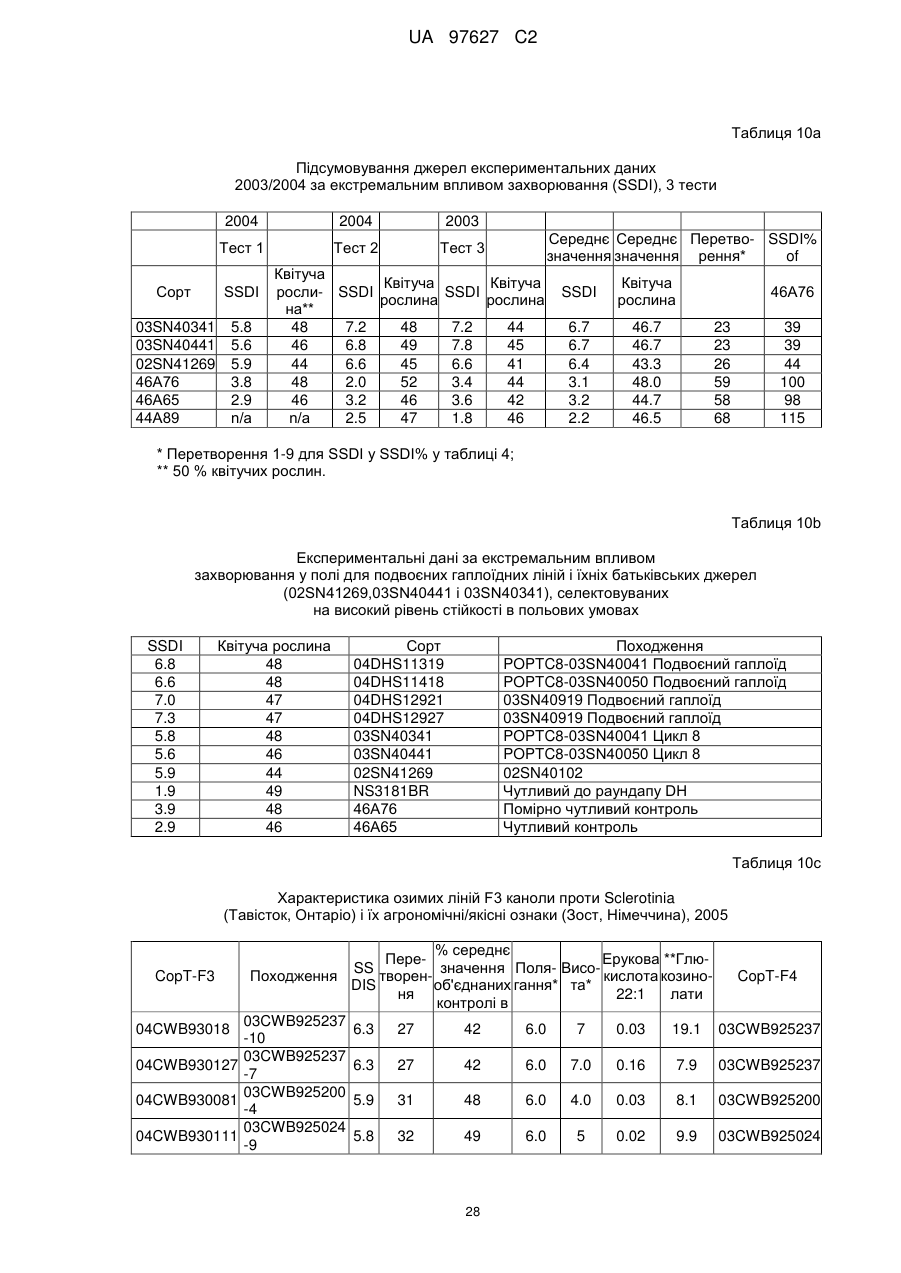
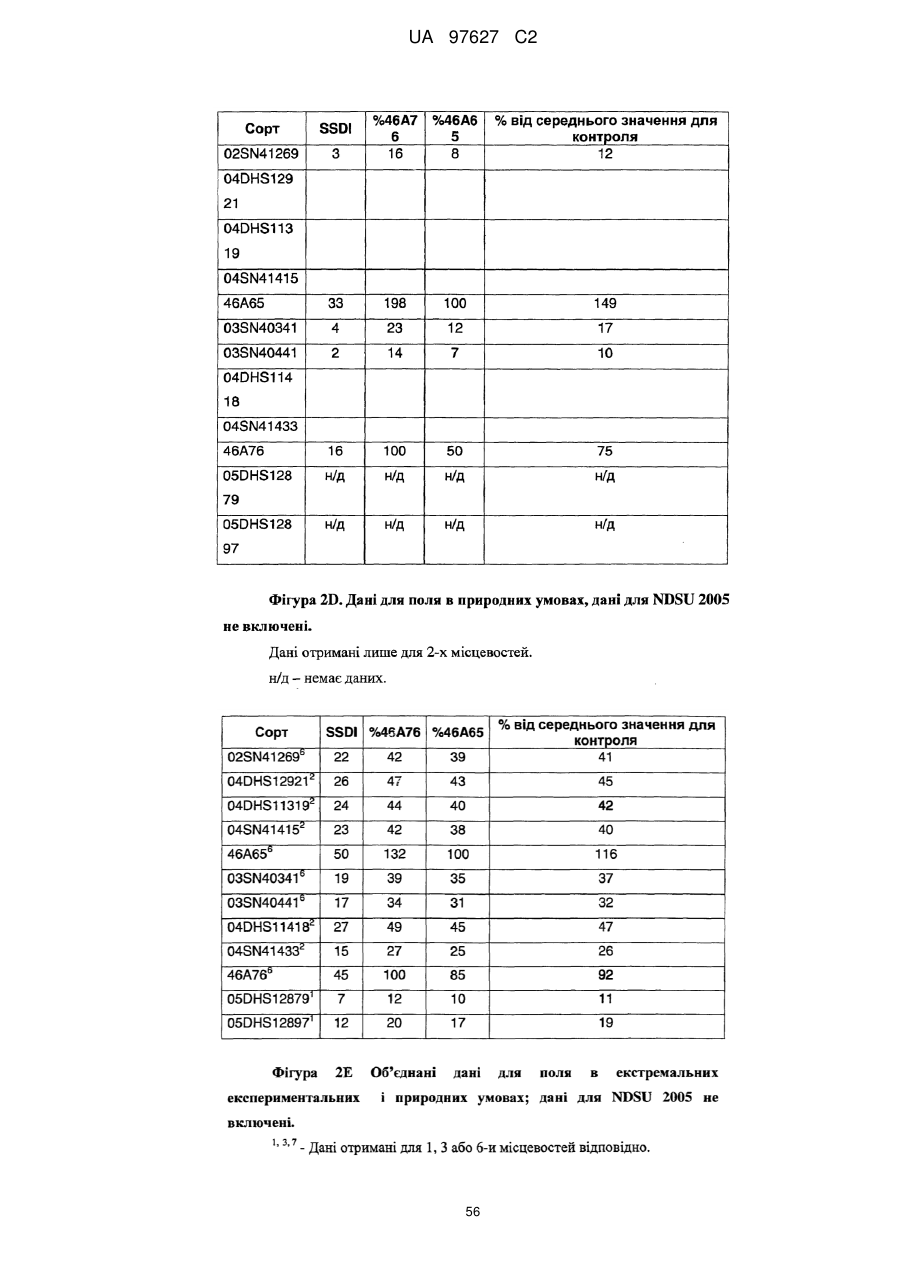
(d) згадане потомство є представником популяції, що має показник захворюваності на Sclerotinia sclerotiorum (SSDI %), що складає менш ніж близько 60 % показника SSDI %, у разі ярового сорту Pioneer Hi-Bred 46 А65 чи 46А76 або середнього SSDI % показника цих двох сортів, або, у разі озимого сорту Columbus, або сорту Express, або середнього SSDI % показника цих двох сортів, за однакових умов навколишнього середовища та захворюваності на полі.
2. Рослина Brassica, яка:
(і) є яровою та є представником популяції, що має середній показник захворюваності на Sclerotinia sclerotiorum (SSDI %), що складає менш ніж близько 60 % показника SSDI % сорту Pioneer Hi-Bred 46А76, або сорту Pioneer Hi-Bred 46A65, або середнього показника SSDI % цих двох сортів за однакових умов навколишнього середовища та захворюваності на полі завдяки стійкості до Sclerotinia рослин за депозитарними номерами АТСС РТА-6776, РТА-6779, РТА-6777, РТА-6781, РТА-6780 чи РТА-6778; або депозитарними номерами NCIMB 41388, 41389, 41390 чи 41391;або
(іі) є озимою та є представником популяції, що має середній показник захворюваності на Sclerotinia sclerotiorum (SSDI %), що складає менш ніж близько 60 % показника SSDI % сорту Columbus, або сорту Express, або середнього показника SSDI % цих двох сортів за однакових умов навколишнього середовища та захворюваності на полі завдяки стійкості до Sclerotinia рослин за депозитарними номерами NCIMB 41392, 41393, 41394, 41395, 41396, 41397 або 41398.
де одержане насіння має рівень глюкозинолату менше ніж 30 мкмоль на грам твердої речовини, що не містить олії, та яке має менше ніж 2 % ерукової кислоти в ендогенному компоненті олії та 50 % період цвітіння близько від 30 до 90 діб.
3. Насіння рослини за будь-яким із пп. 1, 2.
4. Рослинна клітина з рослини за будь-яким із пп. 1, 2.
5. Застосування рослини за будь-яким із пп. 1, 2 для одержання олії або борошна.
6. Спосіб одержання олії, який включає:
(а) роздавлювання насіння, одержаного з рослин за п. 1 або 2; та
(b) екстрагування неочищеної олії з вказаного роздавленого насіння.
7. Спосіб за п. 6, який додатково включає:
(c) рафінування, знебарвлення і/або дезодорацію вказаної неочищеної олії.
8. Рослина за п. 1 або 2, що додатково містить трансген.
9. Рослина за п. 1 або 2, де вказана рослина має чоловічу стерильність.
10. Спосіб скринінгу в полі на стійкість рослини до Sclerotinia, який включає:
(a) інокуляцію рослини, що росте у полі, Sclerotinia;
(b) поливання рослини деіонізованою водою, дистильованою водою, стічною водою або зібраною дощовою водою;
(c) підтримання встановленої граничної величини постійної вологості на рослині; та
(d) оцінювання стійкості рослини до Sclerotinia.
11. Спосіб за п. 10, де інокуляцію проводять із застосуванням матеріалу носія.
12. Спосіб за п. 11, де вказаний матеріал носія є насінням, колонізованим Sclerotinia.
13. Спосіб за п. 12, де вказаний матеріал носія є насінням олійного нуга, колонізованим Sclerotinia.
14. Спосіб за п. 13, де вказане колонізоване насіння олійного нуга розсіюють з розрахунку приблизно 5-20 кг/га.
15. Спосіб за п. 10, який додатково містить покриття для забезпечення контрольованого мікросередовища.
16. Спосіб за п. 15, де покриття виготовлене із сітчастого матеріалу.
17. Спосіб одержання потомства рослини Brassica, де:
(а) твердий компонент насіння потомства рослини має рівень глюкозинолату менше ніж 30 мкмоль на грам твердої речовини, що не містить олії;
(b) олія насіння потомства рослини містить менше ніж 2 % ерукової кислоти;
(с) згадане потомство рослини має 50 % період цвітіння близько від 30 до 90 діб, та
(d) згадане потомство є представником популяції, що має показник захворюваності на Sclerotinia sclerotiorum (SSDI %), що складає менш ніж близько 60 % показника SSDI %, у разі ярового сорту Pioneer Hi-Bred 46 А65 чи 46А76 або середнього SSDI % показника цих двох сортів, або, у разі озимого сорту Columbus, або сорту Express, або середнього SSDI % показника цих двох сортів, за однакових умов навколишнього середовища та захворюваності на полі,
який включає одержання потомства рослини, що:
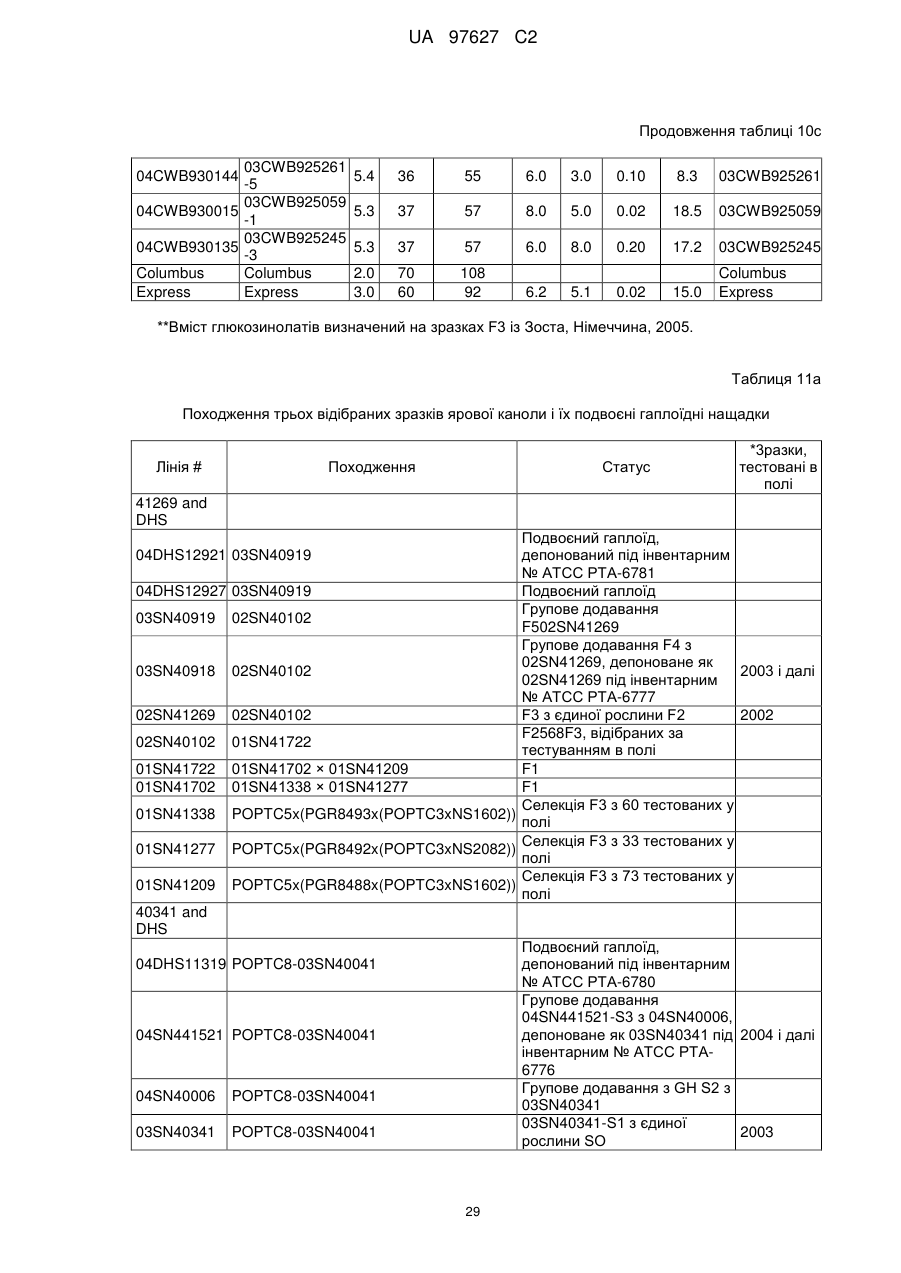
(і) є яровим та належить до лінії, що задепонована під депозитарними номерами АТСС РТА-6776, РТА-6779, РТА-6777, РТА-6781, РТА-6780 або РТА 6778; або під депозитарними номерами NCIMB 41388, 41389, 41390 або 41391; або
(іі) є озимим та належить до лінії, що задепонована під депозитарними номерами NCIMB 41392, 41393, 41394, 41395, 41396,41397 або 41398;
подвоєних гаплоїдів.
Текст
Реферат: Винахід належить до рослин Brassica, що мають середнє значення показника поширеності захворювання, викликаного Sclerotinia sclerotiorum (SSDI %), який складає менше ніж приблизно 60 % показника SSDI % в порівнянні з контрольною рослиною Brassica. Винахід також належить до потомства цих рослин та способів їх відбору. UA 97627 C2 (12) UA 97627 C2 UA 97627 C2 5 10 15 20 25 30 35 40 45 50 55 Цей винахід стосується Brassica, стійкої до Sclerotinia. Винахід також належить до нових способів скрінінга стійкості до Sclerotinia у теплиці й у полі. Sclerotinia інфікує більш 100 видів рослин, включаючи численні економічно важливі сільськогосподарські культури, такі як види Brassica, соняшника, зрілої квасолі, соєвих бобів, польового гороху, сочевиці, латуку і картоплі (Boland and Hall, 1994). Sclerotinia sclerotiorum відповідає за більш ніж 99 % захворювань, викликаних Sclerotinia, у той час як Sclerotinia minor викликає менш ніж 1 % захворювань. Sclerotinia утворює склероції неправильної форми, темні тіла, що перезимовують та можуть зберігатися в ґрунті від чотирьох до п'яти років. Склероції можуть розвиватися з утворенням плодових тіл чи з утворенням міцелію, у залежності від навколишніх умов і типів рослинного покриву. Два типи розвитку викликають два різних типи захворювань. Склероції, що розвиваються з утворенням плодових тіл, утворюють апотеції й аскоспори, які інфікують надземні тканини, що призводить до захворювання стебла, стеблової гнилизни, гнилизни качанів, гнилизни бобів, білої гнилизни і захворювання квіток рослин. Склероції, що розвиваються з утворенням міцелію, утворюють міцелії, що інфікують тканини кореня, викликаючи гнилизну кореневої шийки, кореневу гнилизну і гнилизну основи стебла. Sclerotinia призводить до стеблевої гнилизни, викликаної Sclerotinia, також відомої як біла гнилизна, у Brassica, включаючи канолу. Канола являє собою тип Brassica, що містить низький рівень глюкозинолатів і ерукової кислоти в насінні. Склероції розвиваються з утворенням плодових тіл улітку, створюючи апотеції. Апотеції вивільняють аскоспори, що розносяться вітром і поширюються на відстань аж до одного кілометра. Захворюванню сприяють умови вологого ґрунту (щонайменше, 10 діб при або поблизу нормальної вологоємності) і температури 15-25 °C перед цвітінням каноли та у ході цвітіння. Спори не здатні безпосередньо інфікувати листя і стебла; вони повинні спочатку потрапити на квітки, пелюстки, що опали, і пилок на стеблах і листі. Вік пелюстків впливає на ефективність інфекції, більш старі пелюстки з більшою ймовірністю піддаються інфекції (Heran et al., 1999). Грибні спори використовують частини квітки як джерело їжі по мірі свого проростання й інфікування рослини. Важкість інфекції, викликаної Sclerotinia, у Brassica варіює і залежить від тривалості інфекції і кліматичних умов (Heran et al., 1999). Захворюванню сприяють низькі (холодні) температури і тривалі періоди опадів. Температури між 20 і 25 °C і відносній вологості більш ніж 80 % необхідні для оптимального інфікування рослини (Heran et al., 1999). Для конкретних полів повідомляли про втрати, що варіюють від 5 до 100 % (Manitoba Agriculture, Food and Rural Initiatives, 2004). У середньому, втрати врожаю дорівнюють від 0,4 до 0,5 величини процентної частки інфекції. Наприклад, якщо поле інфіковане на 20 % (20/100 інфікованих рослин), то втрата врожаю може скласти приблизно 10 %. Більш того, Sclerotinia може викликати значні збитки у вологих валках. Sclerotinia sclerotiorum призводить до економічних збитків у фермерів, що вирощують канолу, у Міннесоті і Північній Дакоті в розмірі 17,3, 20,8 і 16,8 мільйонів доларів у 1999, 2000 і 2001 роках відповідно (Bradley et al., 2006). Симптоми інфекції, що викликана Sclerotinia, звичайно розвиваються через кілька тижнів після початку цвітіння. На рослинах розвиваються ділянки ушкодження, від блідо-сірих до білих, на лінії ґрунту чи вище неї, і на більш високих гілках і стручках. Інфекції часто розвиваються на місці з'єднання листа і стебла, тому що там затримуються інфіковані пелюстки. Як тільки рослини інфіковані, гриб продовжує вростати в стебло і проникати в здорову тканину. Інфіковані стебла виглядають знебарвленими і вразливі до розщеплення. Тверді чорні склероції гриба розвиваються усередині інфікованих стебел, гілок чи стручків. Рослини, інфіковані в період цвітіння, дають мало насіння чи не дають його. Рослини з окільцьованими стеблами передчасно в'януть і дозрівають. Сильно інфіковані сільськогосподарські культури часто полягають, роздрібнюються при валкуванні, і роблять валкування тривалішим. Інфекції можуть виникати у всіх надземних частинах рослини, особливо у густих чи полеглих насадженнях, де контактування рослини з рослиною полегшує поширення інфекції. Нові склероції переносять захворювання в наступний сезон. Загальноприйняті способи боротьби з захворюваннями, викликаними Sclerotinia, включають (а) хімічні заходи боротьби, (b) стійкість до захворювання і (с) агротехнічні заходи боротьби, кожний з який описаний нижче. (a) Фунгіциди, такі як беноміл, вінклозолін і іпродіон, залишаються основним засобом боротьби з захворюванням, викликаним Sclerotinia (Morall et al., 1985; Тu, 1983). Останнім часом розроблені додаткові фунгіцидні композиції для застосування проти Sclerotinia, що включають азоксістробін, протіоконазол і боскалід (Johnson 2005). Однак застосування фунгіциду є дорогим і може завдати шкоди споживачу і навколишньому середовищу. Більш того, внаслідок багаторазового застосування виникла стійкість до деяких фунгіцидів. 1 UA 97627 C2 5 10 15 20 25 30 35 40 45 50 55 60 (b) Для певних сортів бобів, сафлору, соняшника і соєвих бобів, досягнутий певний прогрес у розвитку часткової (неповної) стійкості. Часткову стійкість часто визначають як толерантність. Однак успіх у розвитку часткової стійкості виявився дуже обмеженим, ймовірно внаслідок того, що часткова фізіологічна стійкість є мультигенною ознакою, як продемонстровано на бобах (Fuller et al., 1984). На додаток до часткової фізіологічної стійкості, досягнутий певний прогрес у селекції на морфологічні ознаки, щоб запобігти інфекції, що викликана Sclerotinia, такі як прямостояча форма зростання, стійкість до полягання і незначний рослинний покрив. Наприклад, бобові рослини з частковою фізіологічною стійкістю і з прямостоячим положенням, незначним рослинним покривом і невизначеною формою зростання виявилися найкраще здатними протистояти Sclerotinia (Saindon et al., 1993). Для сортів сафлору, що рано дозрівають, показана гарна стійкість до Sclerotinia на полях. На завершення, у соєвих бобів характеристики сорту, такі як висота, раннє дозрівання і значна стійкість до полягання приводять до зменшення захворюваності, в основному внаслідок погіршення умов мікроклімату, сприятливих для захворювання (Boland and Hall 1987; Buzzell et al.,1993). (c) Агротехнічні способи, такі як використання вільних від патогена чи обробленого фунгіцидом насіння, збільшення відстані між рядами, зниження норми висіву насіння для зменшення вторинного поширення захворювання і закопування склероцій для запобігання розвитку з утворенням плодових тіл можуть знижувати захворюваність, викликану Sclerotinia, але не можуть ефективно боротися із захворюванням. Усі генотипи канадської каноли вразливі до стеблевої гнилизни, викликаної Sclerotinia (Manitoba Agriculture, Food and Rural Initiatives, 2004). Вони містять у собі усі відомі ярові генотипи сортів каноли. Також відсутня стійкість до Sclerotinia у австралійських сортів каноли (Hind-Lanoiselet et al., 2004). Деякі сорти з певними морфологічними ознаками краще пристосовані протистояти інфекції, що викликана Sclerotinia. Наприклад, польські сорти (Brassica rapa) утворюють більш слабкий рослинний покрив і, як виявляється, мають значно менші рівні інфікування. Крім того, безпелюсткові сорти (апетальні сорти) у значній мірі не вразливі до інфекції, викликаної Sclerotinia (Okuyama et al., 1995; Fu, 1990). Інші приклади морфологічних ознак, що надають до деякої міри зниження сприйнятливості в польових умовах у генотипів Brassica, включають підвищену стійкість до полягання, знижене збереження пелюстків, розгалуження (менш компактне і/чи більш високе) і раннє опадання листя. Jurke and Fernando (2003) здійснили скрінінг одинадцяти генотипів каноли на поширеність захворювання, викликаного Sclerotinia. Значну варіацію поширеності захворювання пояснювали морфологією рослини, і розходження в збереженні пелюстків ідентифікували як найбільш важливий фактор. Однак ці морфологічні ознаки самі по собі не надають стійкості до Sclerotinia, і всі зразки каноли в Канаді вважаються вразливими до інфекції, викликаної Sclerotinia. Озимі генотипи каноли також вразливі до інфекції, що викликана Sclerotinia. У Німеччині, наприклад, відсутні стійкі до Sclerotinia сорти (Specht, 2005). Німецький сорт Express, що широко культивується, вважається схильним - помірно схильним і належить до групи менш схильних сортів/гібридів (дивись таблицю 4). Обприскування фунгіцидом є єдиним способом боротьби з Sclerotinia для сільськогосподарських культур каноли, вирощуваних в умовах, сприятливих для захворювання в період цвітіння. Типові фунгіциди, що використовуваються для боротьби з Sclerotinia у Brassica, включають роврал™ від Bayer і ронилан™/Ланс™ від BASF. Активний інгредієнт у лансе™ являє собою боскалід, і його продають у США як ендуру™. Фунгіцид варто застосовувати перед появою видимих симптомів стеблової гнилизни і звичайно на стадії 2030 % цвітіння сільськогосподарської культури. Якщо інфекція вже помітна, то немає сенсу в застосуванні фунгіциду, тому що вже занадто пізно для розвитку ефекту. Отже, фермери повинні оцінювати свої поля на ризик захворювання, щоб вирішити, чи варто застосовувати фунгіцид. Це можна здійснити з використанням наданої урядом відомості чи з використанням набору для тестування пелюстків. Будь-який із способів є трудомістким і схильним до помилок (Hind-Lanoiselet 2004; Johnson 2005). Здійснені численні спроби розробки стійких до Sclerotinia рослин Brassica. Природжена стійкість, ймовірно, є більш придатною, економічною і нешкідливою для навколишнього середовища, ніж боротьба з Sclerotinia за допомогою застосування фунгіцидів. Так як ознака є полігенною, вона, ймовірно, є стабільною і не схильною до втрати ефективності, як це може відбуватися з фунгіцидами. Ярова канола (Brassica napus subsp. oleifera var. annua) відрізняється від озимої каноли (Brassica napus subsp. oleifera var. biennis) в основному відсутністю потреби в облігатній яровизації. Азіатські сорти рапсу і каноли мають потребу в яровизації від низької до проміжної і відомі як напівозимі типи. У той час як озима канола не здатна завершити свій репродуктивний 2 UA 97627 C2 5 цикл при посадці навесні, посадка на провесні і вплив дії холоду дозволяє азіатським рослинам цвісти і давати насіння. Азіатські рослини не здатні завершити свій репродуктивний цикл при посадці пізньої весни. У контрольованих умовах для озимих рослин необхідно 12-14 тижнів яровизації, у той час як для азіатських рослин необхідно 2-8 тижнів. У таблиці 1 підсумовані розбіжності між озимими, напівозимими (азіатськими) і яровими сортами каноли. Таблиця 1 Основні характеристики характеру росту в рослин Brassica napus Тип Яровий* Яровий Напівозимий (Азіатський) Озимий Галузі вирощування Канада, Європа Австралія Китай, Японія Європа Потреба в яровизації Немає Немає 2-8 тижнів проміжна 12-14тижнів сильна чи облігатна Час посадки Весна (збільшення тривалості дня) Осінь (зменшення Осінь (зменшення Осінь (зменшення тривалості дня) тривалості дня) тривалості дня) Кількість діб до цвітіння 30-90 90-150 120-180 150-270 * Канадські, Європейські й Австралійські ярові рослини можна висаджувати і вирощувати за будь-яких зовнішніх умов чи часі посадки для ярової каноли. 10 15 20 25 30 35 40 Деякі китайські (напівозимі) сорти рапсу/каноли частково стійкі до Sclerotinia. Наприклад, у Chun Yun et al., 2003, HanZhong et al., 2004, XeiXin et al., 2002, YongJu et al., 2000, ChaoCai et al., 1998 описані частково стійкі сорти рапсу. Однак деякі з цих сортів не є сортами каноли, і усі вони мають потребу в яровизації. Часткова стійкість в польових умовах у китайських сортів бере початок переважно від сорту рапсу Zhong you 821. Незважаючи на поліпшення часткової стійкості в Zhong you 821, його реакція на захворювання менш стабільна в умовах навколишнього середовища, сприятливих для розвитку Sclerotinia (Yunchang et al., 1999). Це вказує на більш низький рівень часткової стійкості (Li ef al., 1999). Деякі японські сорти рапсу мають часткову стійкість стебла до Sclerotinia. Часткову стійкість стебла виявили випробуваннями в закритому приміщенні порівняно з озимою канолою (Bran et al., 1987). Однак ці сорти не є сортами каноли і відносяться до напівозимих типів (дивися таблицю 1). Селекція на стійкість до Sclerotinia в польових умовах у каноли дуже ускладнена внаслідок кількісної природи даної ознаки. Більш того, включення фізіологічної стійкості поряд з морфологічними ознаками, що не вразливі чи менш вразливі до інфекції, підвищує складність селекції на стійкість. Крім того, як виявилося, дуже складно здійснювати скрінінг на стійкість внаслідок безпосередньої взаємодії навколишнього середовища (тобто вимог до температури і вологості, а також вимог до мікрооточення) з популяцією рослин. Як вказано вище, не існує канадських ярових сортів Brassica зі стійкістю до Sclerotinia, це незважаючи на багато років спільної еволюції і впливу навколишнього середовища на відбір даної ознаки. Найбільш високий досягнутий рівень стійкості в польових умовах у рапса (і, нещодавно, у деяких зразків каноли) отриманий за допомогою спроб селекції в Китаї, як описано для Zhong you 821 (Yunchang et al., 1999). Рівні такої часткової стійкості чи толерантності є відносно низькими, тому що застосування фунгіцидів, як і раніше, рекомендовано для всіх сортів рапсу і каноли в Китаї (усне повідомлення) (Baocheng et al., 1999). Очевидно, що сорти Brassica і каноли з високими рівнями стійкості до Sclerotinia не виявлені в природі. Сорти каноли Brassica napus виведені в 1970 роках. Незважаючи на 30 років значних зусиль, витрачених на селекцію, до сьогодення не виведено сортів каноли, стійких до Sclerotinia. Спроби селекції включали, щоб назвати декілька, аналіз локусів, відповідальних за кількісні ознаки (Zhao-Jianwei et al., 2003), селекцію за допомогою мутагенезу (Mullins et al., 1999; WuYanyou et al., 1996; LiangHong et al., 2003), спроби великого скрінінга (Sedune et al., 1989; Zhao et al., 2004), і скрінінг на маркерні послідовності, що експресуються (EST) (Rugang et al., 2004). Виведено кілька ярових сортів каноли з помірною толерантністю до Sclerotinia (Ahmadi et al., 3 UA 97627 C2 5 10 15 20 25 30 35 40 45 50 55 60 2000a; Ahmadi et al., 2000b; BaoMing et al., 1999; і Liu et al., 1991), однак рівень толерантності є низьким і лінії не здатні протистояти високому впливу захворювання. Нещодавно виведена трансгенна канола, що несе ген оксалатоксідази (патент США 6166291 і його виділені патенти); однак існують регламентуючі і соціальні проблеми, пов'язані з трансгенними рослинами. Озимі генотипи каноли зі стійкістю до Sclerotinia також потребують, як відзначено, використання фунгіцидів (Johnson 2005). Отже, необхідно значне технічне втручання людини для виведення сортів каноли, що стійкі до Sclerotinia. Аспект цього винаходу відноситься до рослини Brassica чи групи рослин з поліпшеною стійкістю до Sclerotinia sclerotiorum. В одному з аспектів винахід стосується ярової рослини Brassica napus чи групи рослин, де рослина або група рослин є представниками популяції, де популяція має середнє значення показника поширеності захворювання, викликаного Sclerotinia sclerotiorum, (SSDI%), що складає менш ніж приблизно 60 % показника SSDI% для Pioneer HiBred, сорт 46А76, чи для Pioneer Hi-Bred, сорт 46А65, чи середнього значення показника SSDI% для двох сортів, у тих самих умовах навколишнього середовища і захворюваності у полі. Рослина Brassica napus чи група рослин можуть також бути представниками популяції, де популяція має середнє значення показника поширеності захворювання, викликаного Sclerotinia sclerotiorum, (SSDI%), що складає менш ніж 50 %, 35 % чи 20 % показника для Pioneer Hi-Bred, сорт 46А76, чи для Pioneer Hi-Bred, сорт 46А65, чи середнього значення показника для двох сортів. Інший аспект цього винаходу відноситься до озимої рослини Brassica napus або групи рослин, де рослина чи група рослин є представниками популяції, де популяція має середнє значення показника поширеності захворювання, викликаного Sclerotinia sclerotiorum, (SSDI%), що складає менш ніж приблизно 60 % показника SSDI% для сорту Columbus чи для сорту Express, чи середнього значення показника SSDI% для двох сортів, у тих самих умовах навколишнього середовища і захворюваності у полі. Озима рослина Brassica napus чи група рослин можуть також бути представниками популяції, де популяція має середнє значення показника поширеності захворювання, викликаного Sclerotinia sclerotiorum, (SSDI%), що складає менш ніж 50 %, 35 % чи 20 % показника для сорту Columbus чи для сорту Express, чи середнього значення показника для двох сортів. Інший аспект цього винаходу відноситься до ярової рослини Brassica napus чи групі рослин, де рослина чи група рослин представляє популяцію, що характеризується, щонайменше, наступними ознаками: (а) твердий компонент насіння популяції, що містить глюкозинолат у кількості менш ніж 30 мкмоль на грам твердої речовини, що не містить олії, (b) олія з насіння рослини, що містить менш ніж 2 % ерукової кислоти, (с) 50 % період цвітіння між приблизно 3090 добами, і (d) показник SSDI%, що становить менш ніж приблизно 60 % показника SSDI% для Pioneer Hi-Bred, сорт 46А76, чи для Pioneer Hi-Bred, сорт 46А65, чи середнього значення показника для двох сортів, у тих самих умовах навколишнього середовища і захворюваності у полі. Рослина Brassica napus може також бути представником популяції, де популяція має середнє значення показника поширеності захворювання, викликаного Sclerotinia sclerotiorum, (SSDI%), що складає менш ніж 50 %, 35 % чи 20 % показника для Pioneer Hi-Bred, сорт 46А76, чи для Pioneer Hi-Bred, сорт 46А65, чи середнього значення показника для двох сортів. Інший аспект цього винаходу відноситься до озимої рослини Brassica napus чи групи рослин, де рослина або група рослин представляє популяцію, що характеризується, щонайменше, наступними ознаками: (а) твердий компонент насіння популяції, що містить глюкозинолат у кількості менш ніж 30 мкмоль на грам твердої речовини, що не містить олії, (b) олія з насіння популяції, що містить менш ніж 2 % ерукової кислоти, (с) 50 % період цвітіння між приблизно 3090 добами, і (d) показник SSDI%, що складає менш ніж приблизно 60 % показника SSDI% для сорту Columbus чи для сорту Express, чи середнього значення показника SSDI% для двох сортів, у тих самих умовах навколишнього середовища і захворюваності у полі. Озима рослина Brassica napus чи група рослин можуть також бути представниками популяції, де популяція має середнє значення показника поширеності захворювання, викликаного Sclerotinia sclerotiorum, (SSDI%), що складає менш ніж50 %, 35 % чи 20 % показника для сорту Columbus чи для сорту Express, чи середнього значення показника для двох сортів. Рослина Brassica napus може представляти ярову лінію Brassica napus, як вказано далі: (a) Групове додавання S3 з 03SN40341, депоноване під інвентарним № АТСС РТА-6776; чи подвоєна гаплоїдна лінія, отримана з 03SN40341 і депонована під інвентарним № АТСС РТА6780. (b) Групове додавання S3 з 03SN40441, депоноване під інвентарним № АТСС РТА-6779; чи подвоєна гаплоїдна лінія, отримана з 03SN40441 і депонована під інвентарним № АТСС РТА6778. 4 UA 97627 C2 5 10 15 20 25 30 35 40 45 50 55 60 (c) Групове додавання F4 з 02SN41269, депоноване під інвентарним № АТСС РТА-6777; чи подвоєна гаплоїдна лінія, отримана з 02SN41269 і депонована під інвентарним № АТСС РТА6781. (d) Група S2, позначена 04SN41433, депонована під інвентарним № NCIMB 41389, чи подвоєна гаплоїдна лінія, отримана з 04SN41433 і депонована під інвентарним № NCIMB41391. (e) Група S2, позначена 04SN41415, депонована під інвентарним № NCIMB41388, чи подвоєна гаплоїдна лінія, отримана з 04SN41415 і депонована під інвентарним № NCIMB41390. (Дивися також таблицю 11а). Рослина Brassica napus може представляти озиму лінію Brassica napus, як вказано далі: (a) Групове додавання F4 лінії 04CWB930128, депоноване під інвентарним № NCIMB41396. (b) Групове додавання F4 лінії 04CWB930127, депоноване під інвентарним № NCIMB41395. (c) Групове додавання F4 лінії 04CWB930081, депоноване під інвентарним № NCIMB41393. (d) Групове додавання F4 лінії 04CWB930111, депоноване під інвентарним № NCIMB41394. (e) Групове додавання F4 лінії 04CWB930144, депоноване під інвентарним № NCIMB41398. (f) Групове додавання F4 лінії 04CWB930015, депоноване під інвентарним № NCIMB41392. (g) Групове додавання F4 лінії 04CWB930135, депоноване під інвентарним № NCIMB41397. (Дивися також таблицю 11b). Інший аспект цього винаходу відноситься до рослини-нащадка будь-якої з рослин Brassica з вищезгаданих аспектів, де рослина-нащадок характеризується, щонайменше, наступними ознаками: (а) твердий компонент насіння рослини, що містить глюкозинолат у кількості менш ніж 30 мкмоль на грам твердої речовини, що не містить олії, (b) олія з насіння рослини, що містить менш ніж 2 % ерукової кислоти, (с) 50 % період цвітіння між приблизно 30-90 добами, і (d) рослина-нащадок є представником популяції, Pioneer Hi-Bred, сорт 46А76, чи для Pioneer HiBred, сорт 46А65, чи середнього значення показника для двох сортів, де рослина-нащадок має яровий характер росту, чи (2) показника SSDI% для сорту Columbus чи для сорту Express, чи середнього значення показника SSDI% для двох сортів, де рослина-нащадок має озимий характер росту, у тих самих умовах навколишнього середовища і захворюваності у полі. Рослина-нащадок Brassica napus може також представляти популяцію, що має величину середнього значення поширеності Sclerotinia менш ніж 50 %, 35 % чи 20 % показника SSDI% для (1) Pioneer Hi-Bred, сорт 46А76, чи Pioneer Hi-Bred, сорт 46А65, або середнього значення показника для двох сортів, де рослина-нащадок має яровий характер росту, чи (2) для сорту Columbus чи сорту Express, або середнього значення показника для двох сортів, де рослинанащадок має озимий характер росту, у тих самих умовах навколишнього середовища і захворюваності у полі. Інший аспект винаходу відноситься до рослини Brassica napus чи групи рослин, де рослина чи група рослин має фізіологічні ознаки, або сполучення морфологічних і фізіологічних ознак, що функціонують синхронно в напрямку зниження розвитку захворювання, де рослина чи група рослин є представниками популяції, де вказана популяція має показник SSDI%, що складає менш ніж приблизно 60 % показника SSDI% для (1) Pioneer Hi-Bred, сорт 46А76, чи Pioneer HiBred, сорт 46А65, чи середнього значення показника для двох сортів, де популяція має яровий характер росту, чи (2) для сорту Columbus чи сорту Express, чи середнього значення показника для двох сортів, де популяція має озимий характер росту, у тих самих умовах навколишнього середовища і захворюваності у полі. Інший аспект винаходу відноситься до нащадків кожної з рослин Brassica napus, розглянутих вище, де вказані нащадки, отримані виділенням ознаки, що надає стійкість до Sclerotinia за допомогою подвоєної гаплоїдії, і де однорідна популяція, що містить зазначених нащадків, має показник SSDI%, що складає менш ніж приблизно 60 % показника SSDI% для (1) Pioneer HiBred, сорт 46А76, чи Pioneer Hi-Bred, сорт 46А65, або середнього значення показника для двох сортів, де популяція має яровий характер росту, чи (2) для сорту Columbus чи сорту Express, або середнього значення показника для двох сортів, де популяція має озимий характер росту, у тих самих умовах навколишнього середовища і захворюваності у полі. Більш того, винахід також стосується подвоєної гаплоїдної лінії, отриманої з будь-якої з рослин Brassica napus, розглянутих вище, насіння будь-якої з рослин, роздробленим насінням Brassica napus будь-якої з рослин, рослинним кліткам будь-якої з рослин і клітинному рослинному матеріалу будь-якої з рослин, наприклад, матеріалу пилка чи яйцеклітин. Інший аспект винаходу відноситься до способу скрінінга на стійкість рослини до Sclerotinia у контрольованих умовах навколишнього середовища, що включає (а) інокуляцію рослини, що росте в контрольованих умовах навколишнього середовища, тампоном з PDA з низьким вмістом поживних речовин, що містять міцелій Sclerotinia, і (b) скрінінг на стійкість рослини до Sclerotinia. Тампон можна прикріплювати до рослини ентомологічною голкою. Тампон може мати розмір 5 UA 97627 C2 5 10 15 20 25 30 35 40 45 50 55 60 приблизно 3 мм. Контрольовані умови навколишнього середовища можуть включати контрольовану вологість. Інший аспект винаходу відноситься до способу скрінінга рослини, що росте у полі, на стійкість до Sclerotinia, що включає (а) інокуляцію рослини Sclerotinia, (b) полив рослини водою, де вода містить низьку кількість чи позбавлена іонів, що могли б зв'язуватися з щавлевою кислотою, (с) підтримка заздалегідь визначеної граничної величини постійної вологості на рослині, і (d) скрінінг на стійкість рослини до Sclerotinia. Інокуляцію можна здійснювати з використанням матеріалу носія. Носій може бути насінням, таким як насіння олійного нуга, колонізованими Sclerotinia, і їх можна розсіювати з розрахунку приблизно 5-20 кг/га. Вода може бути деіонізованою водою, дистильованою водою, стічною водою чи зібраною дощовою водою. Спосіб може далі включати застосування сітчастого покриття для забезпечення контрольованого мікрооточення. Інший аспект винаходу відноситься до способу одержання наступного покоління лінії Brassica napus 03SN40341, який має показник SSDI%, що складає менш ніж приблизно 60 % показника SSDI% для Pioneer Hi-Bred, сорт 46А76, чи для Pioneer Hi-Bred, сорт 46А65, або середнього значення показника для двох сортів, у тих самих умовах навколишнього середовища і захворюваності у полі, що включає (а) схрещування лінії Brassica napus 03SN40341 із самою собою чи з іншою рослиною Brassica для одержання насіння Brassica нащадків, отриманого з лінії Brassica 03SN40341, (b) вирощування насіння Brassica napus зі стадії (а) для одержання додаткової рослини Brassica, отриманої з лінії Brassica 03SN40341, (с), не обов'язково, повторення схрещування і вирощування зі стадій (а) і (b) для наступних поколінь для одержання додаткових рослин, отриманих з лінії Brassica napus 03SN40341, і (d) вібір рослини-нащадка, де вказана рослина представляє популяцію рослин, що мають показником SSDI%, що складає менш ніж приблизно 60 % показника SSDI% для Pioneer Hi-Bred, сорт 46А76, чи для Pioneer Hi-Bred, сорт 46А65, або для середнього значення показника для двох сортів, у тих самих умовах навколишнього середовища і захворюваності у полі. Винахід також стосується аналогічних способів для ліній 03SN40441, 02SN41269, 04DHS12921, 04DHS11319, 04DHS11418, 04SN41433, 04SN41415, 05DHS12897 і 04DHS12879. Популяція, представлена рослиною-нащадком, може мати показник SSDI%, що складає менш ніж приблизно 50 %, 35 % чи 20 % показника SSDI% для Pioneer Hi-Bred, сорт 46А76, чи для Pioneer Hi-Bred, сорт 46А65, або для середнього значення показника для двох сортів, у тих самих умовах навколишнього середовища і захворюваності у полі. Інший аспект винаходу відноситься до способу одержання наступного покоління лінії Brassica napus 04CWB930127, що має показник SSDI%, який складає менш ніж приблизно 60 % показника SSDI% для сорту Columbus чи для сорту Express, чи середнього значення показників для двох сортів, у тих самих умовах навколишнього середовища і захворюваності у полі, що включає (а) схрещування лінії Brassica napus 04CWB930127 із самою собою чи з іншою рослиною Brassica для одержання насіння Brassica нащадків, отриманих з лінії Brassica 04CWB930127, (b) вирощування насіння Brassica napus зі стадії (а) для одержання додаткової рослини Brassica, отриманої з лінії Brassica 04CWB930127, (с), не обов'язково, повторення схрещування і вирощування зі стадій (а) і (b) для наступних поколінь для одержання додаткових рослин, отриманих з лінії Brassica napus 04CWB930127, і (d) відбір рослини-нащадка, де вказана рослина представляє популяцію рослин, що має показник SSDI%, який складає менш ніж приблизно 60 % показника SSDI% для сорту Columbus чи сорту Express, чи середнього значення показника для двох сортів, у тих самих умовах навколишнього середовища і захворюваності у полі. Винахід також відноситься до аналогічних способів, для ліній 04CWB930128, 04CWB930081, 04CWB930111, 04CWB930144, 04CWB930135 і 04CWB930015. Популяція, представлена рослиною-нащадком, може мати показник SSDI%, що складає менш ніж приблизно 50 %, 35 % чи 20 % показника SSDI% для сорту Columbus чи сорту Express, або середнього значення для двох сортів, у тих самих умовах навколишнього середовища і захворюваності у полі. Інший аспект цього винаходу відноситься до застосування ярової рослини Brassica napus, де рослина є представником популяції, що має показник SSDI%, що складає менш ніж приблизно 60 % показника SSDI% для Pioneer Hi-Bred, сорт 46А76, чи для Pioneer Hi-Bred, сорт 46А65, чи середнього значення показника для двох сортів, у тих самих умовах навколишнього середовища і захворюваності у полі, для вирощування сільськогосподарської культури для одержання олії і кормового борошна, або для селекції нової лінії Brassica. Рослину можна позначити як 03SN40341, 03SN40441, 02SN41269, 04DHS12921, 04DHS11319 чи 04DHS11418, де насіння представників депоновані під інвентарним № АТСС: РТА-6776, РТА-6779, РТА-6777, РТА-6781, РТА-6780 чи РТА-6778, відповідно, вказані насіння депоновані 8 червня 2005 чи 6 UA 97627 C2 5 10 15 20 25 30 35 40 45 50 55 60 приблизно в цей час; або його можна позначити як 04SN41433, 04SN41415, 05DHS12897 чи 04DHS12879, де насіння представників депоновані під інвентарним № NCIMB 41389, 41388, 41391 чи 41390, відповідно. Інший аспект даного винаходу відноситься до застосування озимої рослини Brassica napus, де рослина є представником популяції, що має показник SSDI%, що складає менш ніж приблизно 60 % показника SSDI% для сорту Columbus чи для сорту Express, чи середньому значенню показника для двох сортів, у тих самих умовах навколишнього середовища і захворюваності у полі, для вирощування сільськогосподарської культури для одержання олії і кормового борошна, чи для селекції нової лінії Brassica. Рослину можна позначити як 04CWB930127, 04CWB930128, 04CWB930081, 04CWB930111, 04CWB930144, 04CWB930135 чи 04CWB930015, де насіння представників депоновані під інвентарним № NCIMB: 41395, 41396, 41393, 41394, 41398, 41397 чи 41392, відповідно. Інший аспект цього винаходу відноситься до способу одержання олії каноли, що включає (а) роздавлювання насіння, одержаного (виробленого) рослиною Brassica napus, яке можна позначити як 03SN40341, 03SN40441, 02SN41269, 04DHS12921, 04DHS11319 чи 04DHS11418, де насіння представників депоновані під інвентарним № АТСС: РТА-6776, РТА-6779, РТА-6777, РТА-6781, РТА-6780 чи РТА-6778, відповідно, де вказана насіння депоновано 8 червня 2005 або приблизно в цей час; чи його можна позначити як 04SN41433, 04SN41415, 05DHS12897 або 04DHS12879, де насіння представників депоноване під інвентарним № NCIMB 41389, 41388, 41391 чи 41390, відповідно; або нащадком будь-якої з зазначених рослин, де рослина чи рослина-нащадок є представниками популяції, що має показник SSDI%, який складає менш ніж приблизно 60 % показника SSDI% для Pioneer Hi-Bred, сорт 46А76, чи для Pioneer Hi-Bred, сорт 46А65, або середнього значення показника для двох сортів, у тих самих умовах навколишнього середовища і захворюваності у полі; (Ь) екстракцію неочищеної олії з вказаного роздробленого насіння, і, не обов'язково, (с) рафінування, знебарвлення і дезодорацію вказаної неочищеної олії для одержання олії каноли. Інший аспект цього винаходу відноситься до способу одержання олії каноли, що включає (а) роздавлювання насіння, одержаного рослиною Brassica napus, яке можна позначити як 04CWB930127, 04CWB930128, 04CWB930081, 04CWB930111, 04CWB930144, 04CWB930135 чи 04CWB930015, де насіння представників депоновані під інвентарним № NCIMB: 41395, 41396, 41393, 41394, 41398, 41397 чи 41392, відповідно, чи яке може бути нащадком кожного з зазначених рослин, де рослина чи рослина-нащадок є представниками популяції, що має показник SSDI%, який складає менш ніж приблизно 60 % показника SSDI% для сорту Columbus чи для сорту Express, або середнього значення показника для двох сортів, у тих самих умовах навколишнього середовища і захворюваності у полі; (b) екстракцію неочищеної олії з вказаного роздробленого насіння, і, не обов'язково, (с) рафінування, знебарвлення і дезодорацію вказаної неочищеної олії для одержання олії каноли. Інший аспект цього винаходу відноситься до рослини Brassica napus, як розглянуто вище, що додатково має рівень стійкості до чорної ніжки (Leptosphaeria maculans) більш ніж у Pioneer Hi-Bred, сорт 46А76, у тих самих умовах навколишнього середовища і захворюваності у полі. Рослину можна позначити як 03SN40341, 03SN40441, 02SN41269, 04DHS12921, 04DHS11319 чи 04DHS11418, де насіння представників депоновані під інвентарним № АТСС: РТА-6776, РТА-6779, РТА-6777, РТА-6781, РТА-6780 чи РТА-6778, відповідно, де вказана насіння депоновано 8 червня 2005 або приблизно в цей час; чи його можна позначити як 04SN41433, 04SN41415, 05DHS12897 чи 04DHS12879, де насіння представників депоновано під інвентарним № NCIMB 41389, 41388, 41391 чи 41390, відповідно; або воно може бути нащадком будь-якої з зазначених рослин, де рослина чи рослина-нащадок є представниками популяції, що має показник SSDI%, який складає менш ніж приблизно 60 % показника SSDI% для Pioneer Hi-Bred, сорт 46А76, чи для Pioneer Hi-Bred, сорт 46А65, або середнього значення показника для двох сортів, у тих самих умовах навколишнього середовища і захворюваності у полі, і додатково має середній рівень стійкості до чорної ніжки більш ніж рівень для Pioneer Hi-Bred, сорт 46А76, у тих самих умовах навколишнього середовища і захворюваності у полі. Також представлені рослинні клітки з рослини. Фігура 1 являє собою гістограму 5-10 циклів популяції Τ від 2000-2005 при екстремальному впливі захворювання в експериментальних польових умовах. Вісь Υ являє собою частоту у нащадків. Вісь X являє собою ранжирування 1-9 по SSDI для Sclerotinia, як описано в таблиці 4. На фігурі 2 представлені агрономічні дані і дані для Sclerotinia для конкретних стійких до Sclerotinia ярових ліній каноли. Дані для Sclerotinia представлені у вигляді % для 46А76, 46А65 і їхнього середнього значення. Частина А містить агрономічні дані і дані для Sclerotinia при екстремальному захворювання в експериментальних польових умовах. Частина В містить дані для поля в природних умовах. Частина С містить об'єднані результати частини А і частини В. 7 UA 97627 C2 5 10 15 20 25 30 35 40 45 50 55 Частина D являє собою частину В, де дані одного випробування у полі в природних умовах (NDSU 2005) опущені. Частина Ε містить об'єднані результати частини А і частини D. І. Короткий огляд У цьому винаході описані перші лінії каноли з низьким вмістом ерукової кислоти і низьким вмістом глюкозинолата, що мають яровий чи озимий характер розвитку і мають високий рівень стійкості в польових умовах до Sclerotinia. Стійкість у польових умовах заснована на нагромадженні звичайної часткової фізіологічної стійкості до Sclerotinia у сполученні з морфологічними ознаками, що функціонують синхронно в напрямку зниження розвитку захворювання. Існує кілька аспектів цього винаходу. Перший аспект полягає в розробці стійких до Sclerotinia ліній каноли. Цей аспект винаходу описаний у прикладах 1, 2, 3, 4, 8 і 9. Це є першим повідомленням про ярові лінії каноли, що мають середній рівень поширеності Sclerotinia менш ніж приблизно 60 % від рівня поширеності для Pioneer Hi-Bred, сорт 46А76, чи для Pioneer Hi-Bred, сорт 46А65, або середнього значення показника для двох сортів у тих самих умовах навколишнього середовища і захворюваності у полі, як вимірено за допомогою показника SSDI%; чи про озимі лінії каноли, що мають середній рівень поширеності Sclerotinia менш ніж приблизно 60 % від рівня поширеності для сорту Columbus чи сорту Express, або середнього значення показника для двох сортів у тих самих умовах навколишнього середовища і захворюваності у полі, як вимірено за допомогою показника SSDI%. Безпосереднє технічне втручання людини для генетичного маніпулювання і поступового нагромадження численних фізіологічних і морфологічних ознак протягом шести років зусиль по виведенню і селекції (2000-2005), обумовлене 15 роками досліджень (19912005), привело до створення ярових ліній каноли зі стійкістю до Sclerotinia. Колекції насіння, що представляють поліпшені лінії, отримані, як докладно описано в інших місцях даного документа, включаючи таблиці 11а і 11b. Другий аспект винаходу полягає в розробці ліній каноли зі сполученням стійкості до Sclerotinia і стійкості до чорної ніжки. Зусилля по виведенню і селекції, описані в прикладах 1, 2, 3 і 4, не тільки призвели до одержання ліній зі стійкістю до Sclerotinia, але також привели до одержання ліній, що мають стійкість до чорної ніжки. Поступове нагромадження численних фізіологічних і морфологічних ознак протягом шести років зусиль по виведенню і селекції, обумовлене п'ятнадцятьма роками досліджень, привело до створення ліній зі стійкістю до Sclerotinia, і також зі стійкістю до чорної ніжки. Цей аспект винаходу описаний у прикладі 5. Третій аспект винаходу полягає в розробці способів скрінінга на стійкість до Sclerotinia у теплиці чи фітотроні й у полі. Розробка цих способів була одним із критичних факторів успіху в розробці стійких до Sclerotinia ліній і стійких до чорної ніжки ліній за винаходом, що описані у прикладах 1, 2, 3, 4 і 5. Цей аспект описаний у прикладах 6 і 7. II. Способи селекції каноли У програмах селекції каноли використовують способи, такі як масова і рекурентна селекція, зворотне схрещування, селекція "педігрі" і одержання подвоєних гаплоїдів. Для загального опису селекції рапсу і каноли дивися R.K. Downey and G.F.W. Rakow, 1987: Rapeseed and Mustard (In: Fehr, W.R. (ed.), Principles of Cultivar Development, 437-486. New York: Macmillan and Co.); Thompson, K.F., 1983: Breeding winter oilseed rape Brassica napus. Advances in Applied Biology 7:1-104; і Oilseed Rape, Ward, et al., Farming Press Ltd., Wharefedale Road, Ipswich, Suffolk (1985), кожна з яких наведена тут як посилання. Схрещування між двома різними гомозиготними лініями приводить до однорідної популяції гібридних рослин (також названих гібридними рослинами F1), що може бути гетерозиготною за багатьма генними локусами. Схрещування двох гетерозиготних рослин, що відрізняються за рядом генних локусів, буде приводити до популяції рослин, що генетично різні і будуть однорідними. Незважаючи на походження, рослини, що піддавали самозапиленню і відбирали за типом протягом багатьох поколінь, стають гомозиготними майже по всіх генних локусах і дають однорідну популяцію потомства дійсно чистої лінії. Термін "інбредний", як застосовують тут, стосується гомозиготної рослини чи колекції гомозиготних рослин. Рядовим фахівцям стане зрозуміло, що деяка залишкова гетерозиготність може існувати у інбредних рослин. Вибір способів виведення чи селекції залежить від способу розмноження рослин, успадкуванню ознаки(ознак), що піддають поліпшенню, і типу комерційно використовуваного сорту (наприклад, гібридний сорт F1, сорт чистої лінії і т.д.). Для дуже добре наслідуваних ознак вибір кращих індивідуальних рослин, оцінюваних в одному місці, буде ефективним, у той час як для ознак з низкою спадковістю селекція повинна бути заснована на середніх величинах, отриманих з повторних оцінок сімейств споріднених рослин. Популярні способи селекції 8 UA 97627 C2 5 10 15 20 25 30 35 40 45 50 55 60 звичайно містять селекцію "педігрі", модифіковану селекцію "педігрі", масову селекцію і рекурентну селекцію. Складність спадкування впливає на вибір способу селекції. Як правило, селекцію починають зі схрещування двох генотипів, кожний з який може мати одну чи декілька необхідних характеристик, що відсутні в іншому генотипі, чи які доповнюють інший генотип. Якщо два первинні батьки не забезпечують усіх необхідних характеристик, то можна включити інші джерела за допомогою здійснення більшої кількості схрещувань. У кожному наступному дочірньому поколінні, від F1 до F2, від F2 до F3, від F3 до F4, від F4 до F5 і т.п., рослини піддають самозапиленню для підвищення гомозиготності лінії. Як правило, у програмі селекції використовують п'ять чи більш поколінь селекції і самозапилення для одержання гомозиготної рослини. Селекцію "педігрі" звичайно використовують для поліпшення самозапильних сільськогосподарських культур. Двох батьків, що мають придатні, взаємодоповнюючі ознаки, схрещують для одержання F1. Популяцію F2 отримують за допомогою самозапилення одного чи декількох F1 чи за допомогою спорідненого запилення двох F1. Селекцію кращих індивідуумів можна починати в популяції F2; потім, починаючи в F3, відбирають кращі індивідууми в кращих сімействах. Повторне тестування сімейств можна починати в поколінні F4 для поліпшення ефективності селекції ознак з низькою спадкоємністю. На пізній стадії інбридингу (тобто, F6 і F7), кращі лінії чи суміші фенотипічно аналогічних ліній тестують на потенційне одержання в якості нових сортів. Селекцію зі зворотним схрещуванням використовують для перенесення генів для легко успадкованих, дуже добре успадкованих ознак від батька-донора в необхідний, оптимально, гомозиготний сорт, що використовують у якості рекурентного батька. Джерело ознак, що піддають перенесенню, називають батьком-донором. Після початкового схрещування, відбирають індивідууми, що володіють необхідною ознакою чи ознаками батька-донора, і потім повторно схрещують (піддають зворотному схрещуванню) з рекурентним батьком. Отримана рослина, як очікують, має ознаки рекурентного батька плюс необхідну ознаку чи ознаки, перенесені від батька-донора. Цей спосіб широко використовують для селекції стійких до захворювання сортів. Кожна програма селекції каноли повинна включати періодичну, об'єктивну оцінку ефективності процедури селекції. Критерії оцінки варіюють у залежності від мети і вимог, але повинні включати вигоду від селекції за рік на основі порівнянь із придатним стандартом, загальну величину перспективних селекційних ліній і кількість успішних сортів, отриманих на одиницю витрат (наприклад, за рік, на витрачений долар і т.п.). Різні способи рекурентної селекції використовують для поліпшення кількісно наслідуваних ознак, контрольованих багатьма генами. Використання рекурентної селекції в самозапилюваних сільськогосподарських культурах залежить від простоти запилення і кількості гібридних нащадків з кожного успішного схрещування. Масову селекцію і рекурентну селекцію можна використовувати для поліпшення популяцій чи само- або перехресно запилюваних сільськогосподарських культур. Генетично варіабельну популяцію гетерозиготних індивідуумів чи ідентифікують чи одержують за допомогою перехресного схрещування декількох різних батьків. Кращі рослини відбирають на основі індивідуальної переваги, перспективного потомства чи відмінної схрещуваності. Селектовувані рослиниперехресно схрещують для одержання нової популяції, у якій продовжують здійснювати додаткові цикли селекції. Спосіб одержання покоління одного насіння у вузькому сенсі належить до посадки популяції, що розщеплюється, збиранню зразка по одному насінню з рослини і використанню однонасінного зразка для посадки наступного покоління. Коли популяцію одержують з F2 до необхідного рівня інбридингу, тоді кожна з рослин, з яких отримані лінії, буде приводити до різних індивідуумів F2. Кількість рослин у популяції знижується з кожним поколінням унаслідок нездатності до проростання для деяких насінь чи внаслідок нездатності деяких рослин давати, щонайменше, одне насіння. У результаті не усі рослини F2, початково взяті як зразки в популяції, будуть представлені у вигляді нащадків, коли одержання покоління буде закінчено. У способі з використанням множини насіння, селекціонери каноли звичайно збирають один чи декілька стручків чи довгих стручків з кожної рослини в популяції й обмолочують їх разом для утворення маси насіння. Частину маси використовують для посадки наступного покоління, і частину залишають у запасі. Спосіб позначають як модифіковане одержання покоління одного насіння чи спосіб зі змішуванням стручків. Спосіб з множиною насіння використовують для зменшення трудовитрат при зборі врожаю. Значно швидше обмолочувати стручки машиною, щоб потім узяти вручну по одному насінню з 9 UA 97627 C2 5 10 15 20 25 30 35 40 45 50 55 60 кожного для способу з одним насінням. Спосіб з використанням множини насіння також уможливлює посадку однакової кількості насіння з популяції кожного покоління інбридингу. Збирають достатню кількість насіння для компенсації тих рослин, що не проростають чи не дають насіння. При необхідності можна використовувати подвоєний гаплоїдний спосіб для виділення однорідних ліній, у такий спосіб підвищуючи забезпечення насінням з необхідним генотипом. Молекулярні маркери, що включають способи, такі як електрофорез ізоферментів, поліморфізми довжин рестрикціонних фрагментів (RFLP), випадковим чином ампліфіковані поліморфні ДНК (RAPD), полімеразна полецюгова реакція з довільними праймерами (AP-PCR), фінгерпринтінг ампліфікованої ДНК (DAF), ампліфіковані галузі з охарактеризованою послідовністю (SCAR), поліморфізми довжин ампліфікованих фрагментів (AFLP), прості повторювані послідовності (SSR) і поліморфізми одиночних нуклеотидів (SNP), можна використовувати в способах селекції рослин. Одне з застосувань молекулярних маркерів полягає в мапуванні локусів кількісних ознак (QTL). Мапування QTL являє собою застосування маркерів, що, як відомо, тісно зв'язані з аллелями, що мають вимірні ефекти на кількісну ознаку. Селекція в процедурі виведення заснована на нагромадженні маркерів, зв'язаних з аллелями, що мають позитивний ефект, і/чи елімінацією маркерів, зв'язаних з аллелями, що мають негативний ефект, з генома рослин. Молекулярні маркери можна також використовувати в ході процедури селекції для селекції якісних ознак. Наприклад, маркери, тісно зв'язані з аллелями, чи маркери, що містять послідовності в межах фактично цікавлячих аллелей, можна використовувати для селекції рослин, що містять цікавлячі аллелі, у ході програми селекції за допомогою зворотного схрещування. Маркери можна також використовувати для відбору генома рекурентного батька і проти маркерів батька-донора. З використанням цього способу можна мінімізувати кількість генома батька-донора, що залишається в селектовуваних рослинах. Його також можна використовувати для зменшення кількості зворотних схрещувань з рекурентним батьком, необхідних для програми зворотного схрещування. Використання молекулярних маркерів у процедурі селекції часто називають селекцією, посиленою генетичними маркерами, чи маркердопоміжної селекції (MAS). Одержання подвоєних гаплоїдів (Swanson et al., 1987) можна також використовувати для одержання інбредних рослин у програмі селекції. Після здійснення схрещування можна використовувати способи з одержанням подвоєних гаплоїдів для швидкого одержання гомозиготної рослини. У Brassica napus використовують спосіб культивування мікроспор для одержання гаплоїдних ембріонів. Гаплоїдні ембріони потім регенерують у придатних середовищах у виді гаплоїдних проростків, подвоювання хромосом яких приводить до подвоєних гаплоїдних рослин. Це може мати переваги внаслідок того, що з процедури виключають покоління із самозапиленням, необхідні для одержання гомозиготної рослини з гетерозиготного джерела. Система контролю запилення й ефективний перенос пилка від одного батька до іншого забезпечують поліпшену селекцію рослин і ефективний спосіб одержання насіння і рослин гібридів каноли. Наприклад, система цитоплазматичної чоловічої стерильності Ogura (cms), розроблена за допомогою злиття протопластів редьки (Raphanus sativus) і рапсу (Brassica napus), являє собою один з найбільш часто використовуваних способів одержання гібридів. Вона дає стабільну експресію ознаки чоловічої стерильності (Ogura, 1986; Pelletier et al., 1983) і ефективний ядерний ген-відновлювач (Pellan-Dourme et al., 1988). При розробці поліпшених нових гібридних сортів Brassica селекціонери використовують самонесумісні (SI), що мають цитоплазматичну чоловічу стерильність (CMS) і ядерну чоловічу стерильність (NMS) рослини Brassica як жіночого батька. При використанні цих рослин селекціонери намагаються поліпшити ефективність одержання насіння і якість гібридів F1, і зменшити витрати на селекцію. Коли гібридизацію проводять без використання рослин SI, CMS чи NMS, то тяжче отримати і виділити необхідні ознаки в потомстві (покоління F1) унаслідок того, що батьки можуть піддаватися як перехресному запиленню, так і самозапиленню. Якщо один з батьків є рослиною SI, CMS чи NMS, то він нездатний виробляти пилок, буде відбуватися тільки перехресне запилення. При видаленні пилка одного з батьківських сортів при схрещуванні селекціонер рослин упевнений в одержанні гібридного насіння однорідної якості за умови, що батьки мають однорідну якість, і селекціонер здійснює одиночне схрещування. Один із випадків одержання гібридів F1 включає схрещування жіночого батька CMS Brassica із продукуючим пилок чоловічим батьком Brassica. Для ефективного відтворення, однак, чоловічий батько гібрида F1 повинен мати ген відновлення фертильності (ген Rf). Наявність гена Rf означає, що покоління F1 не буде цілком чи частково стерильним так, що може 10 UA 97627 C2 5 10 15 20 25 30 35 40 45 50 55 60 відбуватися самозапилення або перехресне запилення. Самозапилення покоління F1 для одержання декількох наступних поколінь важливо, щоб гарантувати, що необхідна ознака успадковується та стабільна, і що виділено новий сорт. Прикладом рослини Brassica, що має цитоплазматичну чоловічу стерильність і його використовують для селекції, є рослина з цитоплазматичною чоловічою стерильністю Ogura (OGU) (R. Pellan-Delourme et al., 1987). Відновлювач фертильності для рослин з цитоплазматичною чоловічою стерильністю Ogura перенесений від Raphanus sativus (редька) до Brassica у Instil. National de Recherche Agricole (INRA) у Rennes, Франція (Pelletier et al., 1987). Ген-відновлювач Rf1, що походить з редьки, описаний у WO92/05251 і в Delourme et al., (1991). Розроблено поліпшені версії цього відновлювача. Наприклад, дивися WO98/27806 для олійних культур Brassica, що містять поліпшений ген-відновлювач фертильності для цитоплазматичної чоловічої стерильності Ogura, що приведений тут як посилання. Інші джерела й удосконалення стерильності CMS у каноли включають рослину з цитоплазматичною чоловічою стерильністю Polima, а також ті, котрі описані в патенті США 5789566, послідовність ДІЖ, що передає цитоплазматичну чоловічу стерильність, мітохондріальний геном, ядерний геном, мітохондрії і рослина, що містять зазначену послідовність і спосіб одержання гібридів; патенті США 5973233, система одержання цитоплазматичної чоловічої стерильності в гібридах каноли; і WO97/02737, система одержання цитоплазматичної чоловічої стерильності в гібридах каноли; патентній заявці ЕР 0 599042А, способи введення гена-відновлювача фертильності й одержання за допомогою цього гібридів F1 рослин Brassica; патенті США 6229072, система одержання цитоплазматичної чоловічої стерильності в гібридах каноли; патенті США 4658085, гібридизація з використанням цитоплазматичної чоловічої стерильності, цитоплазматичної стійкості до гербіцидів і стійкості до гербіцидів з ядерних генів; усі з яких наведені тут. Багатообіцяючі перспективні селекційні лінії звичайно тестують і порівнюють із придатними стандартами в навколишньому середовищі, що представляє комерційну цільову область(і). Кращі лінії є кандидатами для нових комерційних ліній; і ті, котрі усе ще позбавлені деяких з ознак, можна використовувати як батьків для одержання нових популяцій для подальшої селекції. Для більшості ознак справжня генотипічна цінність може маскуватися іншими привхідними ознаками рослини чи факторами навколишнього середовища. Один зі способів ідентифікації кращої рослини полягає в дослідженні його характеристик у порівнянні з іншими експериментальними рослинами і з однією чи декількома широко вирощуваними стандартними лініями. Якщо одиночне дослідження непереконливе, то повторні дослідження забезпечують кращу оцінку генетичної цінності. Селекціонер використовує різні способи для полегшення визначення того, які рослини варто відбирати з популяцій, що розщеплюються, і, в остаточному підсумку того, які лінії будуть використовувати з комерційними цілями. На додаток до знання зародкової плазми й інших навичок, що використовує селекціонер, частина процедури селекції залежить від планування експерименту в сполученні з використанням статистичного аналізу. Планування експерименту і статистичний аналіз використовують для полегшення визначення того, які рослини, які сімейства рослин, і, нарешті, які лінії значно краще або відрізняються по одному чи декільком інтересуючим (цікавлячи) ознакам. Способи планування експерименту використовують для контролювання помилки так, що розходження між двома лініями можна визначити більш точно. Статистичний аналіз включає обчислення середніх величин, визначення статистичної значимості джерел варіації й обчислення придатних компонентів варіації. Значимість на рівні п'яти й одного відсотків, як правило, використовують для визначення того, чи є відмінність, що існує для даної ознаки, дійсним, чи воно виникає внаслідок впливу навколишнього середовища чи експериментальної помилки. Належне тестування повинне детектувати будь-які основні помилки і встановлювати рівень переваги чи поліпшення в порівнянні з лініями, що існують. На додаток до володіння кращими характеристиками, повинна існувати потреба в новій лінії, що сумісна з промисловими стандартами, чи яка створює новий ринок. Впровадження нової лінії, як правило, буде приводити до додаткових витрат для виробника насіння, фермера, обробного підприємства і споживача, на спеціальну рекламу і маркетинг, зміну способів одержання насіння і комерційного виробництва, і використання нового продукту. Тестування, що передує випуску в продаж нової лінії, повинне враховувати дослідницькі витрати і витрати на розробку, а також технічну перевага кінцевої лінії. Для ліній, що розмножуються насінням, одержання насіння повинне бути здійсненне без витрат праці і економічно. Переважно, залишкова гетерозиготність не повинна перевищувати 5 %. 11 UA 97627 C2 5 10 15 20 25 30 35 40 45 50 55 Ці стадії, що приводять до останньої стадії маркетингу і розподілу, як правило, займають приблизно від шести до дванадцяти років від часу здійснення першого схрещування. Таким чином, розробка нових ліній, таких як лінії за цим винаходом, є тривалим за часом процесом, що вимагає точного перспективного планування, ефективного використання ресурсів і мінімальних змін у напрямку. Отже, необхідно значне технічне втручання людини. Більш того, як результат розвитку систем стерильності, отримані лінії, які можна використовувати як сорт із відкритим запиленням (тобто, сорту чистої лінії, проданого фермеру для посадки) і/чи в якості стерильної інбредної рослини (жіночої), використовуваної для одержання насіння гібрида F1. В останньому випадку, може знадобитися придатна схрещуваність з відновлювачем (чоловічим). Отримане насіння гібрида можна потім продавати фермеру для посадки. Одержання гібридного насіння каноли можна досягти з використанням цитоплазматичної чоловічої стерильності. При цьому типі одержання гібрида використовують 3 інбредні лінії: лінію відновлювача, А-лінію і В-лінію. Лінію відновлювача, також названу R-лінією, використовують як чоловічу рослину при одержанні гібридного насіння. Лінія відновлювача містить домінантні ядерні гени, відомі як гены-відновлювачі, що відповідають за фертильність гібрида. R-лінію схрещують з А-лінією для одержання гібридного насіння F1. А-лінія має чоловічу стерильність завдяки цитоплазмі і завдяки невідновлювальним аллелям у ядерному геномі. Внаслідок того, що А-лінія має чоловічу стерильність, вона не може самовідтворюватися. Для одержання Α-лінії розроблена В-лінія. В-лінія, також названа підтримуючою лінією, є генетичним еквівалентом Алінії, за винятком того, що В-лінія має нормальну цитоплазму і володіє, таким чином, чоловічою фертильністью. Α-лінію запилюють за допомогою В-лінії. Насіння, що розвивається на рослинах А-лінії, збирають і їхнє потомство схрещують з R-лінією для одержання гібридного насіння F1. Одержання гібрида каноли по програмі селекції рослин каноли включає три стадії: (1) селекцію рослин з різних пулів зародкової плазми для початкових селекційних схрещувань; (2) самозапилення селектовуваних рослин із селекційних схрещувань протягом декількох поколінь для одержання серій інбредних ліній, що, хоча відрізняються одна від одної, виводяться в чистоті і високооднорідні; і (3) схрещування селектовуваних інбредних ліній з іншими інбредними лініями для одержання гібридів. У ході процесу інбридингу у каноли життєздатність ліній знижується. Життєздатність відновлюється, коли дві різні інбредні лінії схрещують для одержання гібрида. Важливий наслідок гомозиготності і гомогенності інбредних ліній полягає в тому, що гібрид між визначеною парою інбредних рослин завжди буде однаковим. Як тільки ідентифікували інбредні рослини, що дають кращий гібрид, гібридні насіння можна відтворювати невизначену кількість часу за умови підтримки гомогенності інбредних батьків. Схрещуваність лінії, а також характеристики лінії як такої, є чинником у селекції поліпшених ліній каноли, які можна використовувати в якості інбредних. Схрещуваність позначає внесок лінії як батька при схрещуванні з іншими лініями для утворення гібридів. Гібриди, одержувані з метою відбору кращих ліній, позначають як аналітичні схрещування. Один зі способів виміру схрещуваності здійснюють з використанням селекційних показників. Селекційні показники засновані на сумарному середньому значенні кількості аналітичних схрещувань. Це середнє значення потім виправляють для виключення ефектів навколишнього середовища і виправляють на відомі генетичні взаємини між лініями. Одержання гібридного насіння вимагає інактивації пилка, виробленого жіночим батьком. Неповна інактивація пилка дає можливість самозапилення. Це насіння, що виникло шляхом випадкового самозапилення, можна ненавмисно зібрати й упакувати з гібридним насінням. Аналогічно, внаслідок того, що чоловічого батька вирощують поруч з жіночим батьком у полі, існує також імовірність того, що насіння, що виникло шляхом самозапилення чоловічої рослини, можна ненавмисно зібрати й упакувати з гібридними насіннями. Після посадки насіння з гібридної тари можливо ідентифікувати і селектувати ці рослини, що виникли шляхом самозапилення. Ці рослини, що виникли шляхом самозапилення, будуть генетично еквівалентні одній з інбредних ліній, використовуваних для одержання гібрида. Хоча існує можливість влучення інбредного насіння у тару з гібридним насінням, подія є рідкою внаслідок того, що пильнують, щоб уникнути таких влучень. Ці рослини, що виникли шляхом самозапилення, може ідентифікувати і селектувати фахівець у даній галузі, або за допомогою візуальних чи молекулярних способів. Рослини каноли Brassica napus без якої-небудь системи чоловічої чи стерильності самонесумісності, як показано, звичайно є самофертильними з приблизно 70-90 відсотками нормально утворюваного насіння у результаті самозапилення. Процентну частку перехресного запилення можна додатково збільшити, якщо популяції загальновизнаних обпилювачів комах 12 UA 97627 C2 5 10 15 20 25 30 35 40 45 50 55 запильників на даній ділянці вирощування мають більшу чисельність. Таким чином, відкрите запилення часто використовують для комерційного одержання каноли. III. Визначення Одиниці, приставки і символи можна позначати в прийнятій для них формі СІ. "Придатний контроль", як застосовують тут, означає генотип Brassica, що забезпечує основу для оцінки стійкості до Sclerotinia для експериментальної лінії. Придатний контроль вирощують у тих же умовах навколишнього середовища, включно вплив захворювання, як експериментальну лінію, і він має приблизно той же ступінь зрілості, як експериментальна лінія. Наприклад, для ярової каноли очікують, що придатний контроль дозріває в межах +/- 10 діб, звичайно +/- 5 діб для експериментальної лінії. Стандарти ступеня зрілості добре відомі фахівцю в даній галузі. Придатний контроль звичайно являє собою широкодоступний чи широко вирощуваний сорт. Термін "придатний контроль" може фактично позначати множину придатних сортів. Наприклад, для ярових генотипів каноли, кожний із сортів Pioneer Hi-Bred 46A76 і 46А65 є придатним контролем; середні характеристики для двох сортів є також придатним контролем. Для озимих генотипів каноли, кожна з загальнодоступних ліній Columbus і Express є придатним контролем, а також середні характеристики для двох сортів. Термін "канола" означає рослину Brassica, де олія повинна містити менш ніж 2 % ерукової кислоти, і твердий компонент насіння повинен містити менш ніж 30 мікромоль будь-якого одного чи будь-якої суміші з 3-бутенілглюкозинолата, 4-пентенілглюкозинолата, 2-гідроксі-3бутенілглюкозинолата і 2-гідроксі-4-пентенілглюкозинолата на грам висушеної на повітрі твердої речовини, що не містить олії. Термін "схрещуваний" чи "схрещування" у контексті даного винаходу означає злиття гамет за допомогою запилення для одержання потомства (тобто клітин, насіння або рослин). Термін відноситься як до статевого схрещування (запилення однієї рослини іншою), так і до самозапилення (самозапилення, тобто, коли пилок і яйцеклітина походять з тої самої рослини). Термін "нормальна вологоємність" означає, що верхні 4 дюйми ґрунту, чи приблизно верхні 4 дюйми ґрунту, цілком насичені вологою, але без стоячої води чи з невеликою її кількістю. Термін "стійкість у польових умовах" означає стійкість, обмірювану в польових умовах. Він відображує стійкість рослини чи цілої популяції рослин при впливі шкідника чи патогена в природних польових умовах. Стійкість у польових умовах можна вимірювати на всіх стадіях розвитку рослини і можна виразити в термінах ефекту на зібраний врожай, або вона може відображати цілеспрямовану оцінку в ході стадії зростання, коли рослина найбільш піддана розвитку захворювання. Термін "генетично зчеплений (зв'язаний) відноситься до генетичних локусів, що знаходяться у нерівновазі по зчепленню і, як статистично виявлено, не розподіляються незалежним образом. Генетично зчеплені локуси розподіляються залежним образом від 51 % до 99 % часу чи виражаються будь-якою цілочисленною величиною між цими значеннями, переважно, щонайменше, 60 %, 70 %, 80 %, 90 %, 95 % чи 99 %. Термін "інбредний", який застосовують тут, відноситься до гомозиготної рослини чи колекції гомозиготних рослин. Рядовим фахівцям стане зрозуміло, що в інбредних рослин може існувати деяка залишкова гетерозиготність. Термін "інтрогрессія" відноситься до введення необхідного генетичного локусу в, щонайменше, одне потомство рослини за допомогою статевого схрещування між батьківськими рослинами, і де, щонайменше, одна з батьківських рослин володіє необхідним генетичним локусом у своєму геномі. Термін "часткова стійкість листя" означає ступінь стійкості листя до Sclerotinia у порівнянні з реакцією листя на враженій рослині. При наявності часткової стійкості листів захворювання розвивається більш повільно на рослині чи в меншому ступені в порівнянні з враженою рослиною. Термін "маркер" чи "молекулярний маркер" відноситься до генетичного локусу, що використовується як контрольна точка при ідентифікації генетично зчеплених локусів, таких як QTL (локуси кількісних ознак). Термін також відноситься до послідовностей нуклеїнових кислот, комплементарних геномним послідовностям, таких як нуклеїнові кислоти, використовувані як зонди. Термін "часткова стійкість стебла" чи "стійкість стебла" означає неповну стійкість стебла. Він означає ступінь стійкості стебла до Sclerotinia у порівнянні з реакцією стебла в враженої рослини. При частковій стійкості стебла захворювання розвивається більш повільно на рослині чи в меншому ступені в порівнянні з враженою рослиною. Однак у випадку рослини, що має "часткову стійкість стебла", рослина хворіє (у порівнянні з повною стійкістю). 13 UA 97627 C2 5 10 15 20 25 30 35 40 45 50 55 60 Термін "повна стійкість" означає стійку реакцію, при якій розвиток аспекту захворювання, звичайний прояв симптому чи розмноження патогена, цілком припиняється (у порівнянні з частковою стійкістю). Термін "рекурентна селекція" означає систему селекції з метою підвищення частоти придатних генів кількісно наслідуваної характеристики за допомогою повторної гібридизації і циклів селекції. Термін "ступінь зрілості" чи "доба до досягнення зрілості" означає кількість діб від посадки насіння до збору врожаю. Ступінь зрілості буде значно варіювати між генотипами й усередині них, у залежності від місця, сезону вирощування і дати посадки насіння. Термін "популяція", як застосовують тут, означає внутріселекційну групу рослин чи групу індивідуумів, що мають загальний пул генів. Популяція може бути гомогенною (генетично однорідною), такою як популяція F1, отримана схрещуванням гомозиготних батьків; або генетично різною, такою як потомство популяції, що розщеплюється, отриманої самозапиленням гетерозиготної рослини чи схрещуванням гетерозиготних батьків. Більш того, гомогенну популяцію можна піддати селекції, щоб одержати гомозиготність майже по всіх генних локусах і отримати однорідну популяцію потомства справжньої чистої лінії. Термін "селекція популяції" відноситься до поліпшення популяції, здійснюваному за допомогою селекції з використанням індивідуумів з тієї ж самої популяції як батьків. Селекція популяції може означати здійснення рекурентної селекції в межах популяції. Термін "ярова Brassica" чи "ярова канола" означає рослину Brassica, що не має потреби в яровизації. Термін "морфологія, що сприяє інфекції Sclerotinia" чи "фенотип, що сприяє інфекції Sclerotinia" означає фенотип Brassica, при якому інфекція Sclerotinia може виникнути і розвитися більш легко в порівнянні з фенотипом Brassica, що менш вразливий інфекції Sclerotinia. Наприклад, морфологія, що сприяє інфекції Sclerotinia, може включати, щонайменше, один з наступних морфологічних ознак: густе розгалуження, низьке розгалуження, збільшена тривалість цвітіння, висока схоронність пелюстків, висока ступінь схоронності листя і вразливість до полягання чи нагинання. Ці морфологічні ознаки є гарним джерелом початкової інокуляції з пелюстків і підвищенню вологості в оточенні рослини. На противагу цьому, рослини, що мають морфологічні ознаки, що менше сприяють інфекції Sclerotinia, можуть включати, щонайменше, один з наступних ознак: низька схоронність пелюстків, безпелюстковий фенотип, гарна стійкість до полягання, менш компактне розгалуження, високе розгалуження і раннє опадання листя. Ці морфологічні ознаки знижують інокуляцію з пелюстків, а також рівень вологості в оточенні рослини. Термін "поширеність захворювання" означає кількість рослин у вибірці, вражених захворюванням. Його, як правило, представляють у виді процентної частки рослин, уражених захворюванням, стосовно сумарної кількості рослин у вибірці. Термін "SSDI%" означає процентну частку поширеності захворювання, викликаного Sclerotinia sclerotiorum, і її вимірюють як процентну частку рослин у популяції, інфікованих Sclerotinia sclerotiorum. Термін "SSDI" означає ранжирування від 1 до 9 і вимір поширеності захворювання, викликаного Sclerotinia Sclerotiorum, при контрольованому екстремальному впливі захворювання в експериментальних польових умовах, як описано в прикладі 7 і таблиці 4. За допомогою SSDI вимірюють процентну частку рослин, що інфіковані Sclerotinia sclerotiorum у популяції, у порівнянні з придатним контрольним сортом. Для ярової каноли придатний контроль являє собою Pioneer Hi-Bred, сорт 46А76, і/чи Pioneer Hi-Bred, сорт 46A65. Для озимої каноли придатний контроль являє собою Columbus і/чи Express. Наприклад, для ярової каноли 5 рядів тестованих ліній засівають між одним рядом Pioneer Hi-Bred, сорт 46А76, з однієї сторони і Pioneer Hi-Bred, сорт 46А65, з іншої. Як правило, в екстремальних умовах для захворювання Pioneer Hi-Bred, сорт 46А76, має поширеність захворювання 60 % (SSDI%), і 46A65 має поширеність захворювання 70 % (SSDI%), із середнім значенням 65 % (SSDI%). Якщо на якій-небудь конкретній дослідницькій ділянці середнє значення SSDI% для Pioneer HiBred, сорт 46А65, і Pioneer Hi-Bred, сорт 46А76, не складає 65 %, показники для Pioneer Hi-Bred, сорт 46А65, і Pioneer Hi-Bred, сорт 46А76, варто помножити на фактор, щоб довести їхнє середнє значення до 65 %. Показники для тестованих ліній також варто помножити на цей фактор. Потім варто зробити ранжирування ліній, що відповідає SSDI%, як представлено в таблиці 4. Наприклад, якщо середнє значення для контролів складає 70 %, варто використовувати фактор 65/70 для зниження процентної частки поширеності захворювання, вимірюваної для експериментальних ліній, що ростуть між контролями, внаслідок перевищення планованого впливу захворювання. Навпаки, якщо середнє значення складає 60 %, варто 14 UA 97627 C2 5 10 15 20 25 30 35 40 45 50 55 використовувати фактор 65/60 для відповідного збільшення (корекції) SSDI% для експериментальних ліній унаслідок зниження впливу захворювання в порівнянні з планованим. Хоча планована поширеність захворювання складає 65 %, очікується відхилення від планованої поширеності внаслідок великої вибірки рослин, змін навколишнього середовища і змін інокулята, таким чином, корекції за допомогою контролів дозволяють порівнювати лінії всередині ділянки і запобігають неправильній класифікації реакції в польових умовах. Екстремальний вплив захворювання в експериментальних польових умовах, як описано в прикладі 7, широко використовували для одержання стійких до Sclerotinia ліній за винаходом, тому що умови, що підходять для Sclerotinia, не виникають у природі передбачуваним чином. Таким чином, намагаючись прискорити селекцію і забезпечити відтворені умови, використовували екстремальний вплив захворювання в експериментальних польових умовах. Ранжирування по SSDI для досліджень після корекції на поширеність додатково коректують, приймаючи в розрахунок важкість захворювання. Таким чином, після корекції SSDI%, як пояснено вище, корекції SSDS також здійснені. Середнє значення SSDS в інфікованих рослин для контролів (показники 1-8) порівнюють зі значенням для експериментальних зразків. Якщо середнє значення показника SSDS краще в експериментальної лінії (наприклад, ранг 3 для контролів у порівнянні з 4 для експериментальної лінії), то SSDI% коректують множенням на 3/4. Наприклад, якщо SSDI% експериментальної лінії складав 20 %, 3/4 множили на 20 %=15 %. Це відповідає рангу 7,5 на шкалі SSDI. Навпаки, якщо SSDS для експериментальних зразків складав 2 (більш уражені) проти 3 для контролів, то SSDI% варто помножити на 3/2. Наприклад, якщо SSDI% складав 20 %, те при множенні на 3/2 повинний дорівнювати 30 %. Це відповідає рангу 6,0 на шкалі SSDI. Термін "екстремальний вплив захворювання в експериментальних польових умовах" означає контрольовані умови для дослідження захворювання, як описано в прикладі 7. Наприклад, екстремальний вплив захворювання одержують застосуванням насіння олійного нуга у вигляді носія, що мімікрує колонізовані Sclerotinia пелюстки. Природний інокулят може бути присутнім у полі у вигляді резервного інокулята. Відсоток поширеності захворювання тестованих рослин коректують на використовувані контролі, як описано вище, і представляють у вигляді показника SSDI від 1 до 9. Однак у цих екстремальних умовах рослини більш вразливі інфікуванню Sclerotinia, щонайменше, з наступних причин: (1) при екстремальному впливі захворювання в експериментальних польових умовах рослини піддаються впливу вологості, обумовленої дрібнокрапельним зрошенням, що сприяє розвитку Sclerotinia, (2) при екстремальному впливі захворювання в експериментальних польових умовах рослини знаходяться в напівзакритому навколишньому середовищі завдяки штучному навісу, що забезпечує умови постійної вологості, сприятливі для розвитку Sclerotinia, і (3) при екстремальному впливі захворювання в експериментальних польових умовах використовують шість рядів різних тестованих рослин на кожній ділянці, таким чином, будь-який ряд тестованих рослин, з специфічним морфологічним фенотипом, може знаходитися в оточенні двох різних рядів рослин з іншими морфологічними фенотипами. Отже, будь-які переваги морфологічного фенотипу, що менше вразливий інфекції Sclerotinia (наприклад, високе розгалуження), знижуються внаслідок того, що кожний ряд може бути оточений рослинами, що мають інший морфологічний фенотип (наприклад, низьке розгалуження). Навпаки, рослина, що росте в природних польових умовах (1) не знаходиться під штучним навісом, що забезпечує постійну вологість, і (2) його вирощують на ділянках в оточенні рослин з таким же морфологічним фенотипом, що забезпечує виявлення всіх переваг морфології. Отже, відібрані рослини, що мають морфологію, яка менше піддана інфікуванню Sclerotinia, наприклад, високим розгалуженням, функціонують значно краще в природних польових умовах у порівнянні з екстремальним впливом захворювання в експериментальних польових умовах. Термін "природні польові умови для захворювання" означає умови на ділянках для одержання врожаю на зрошуваних чи незрошуваних полях. Інфікування відбувається за допомогою пелюстків, колонізованих міцелієм. Ділянки для одержання врожаю дають приклад популяції рослин, що відображує природні умови, аналогічні полям фермерів. SSDI% використовують для вираження процентної частки інфікованих рослин при повторних дослідженнях. На додаток до SSDI%, можна збирати дані по індивідуальних рослинах для відображення ваги (SSDS) на різних шкалах (шкала 1-9 для Pioneer і загальноприйнята шкала 0-5). Можна також оцінювати інші параметри, що додатково кількісно визначають вплив захворювання, наприклад, важкість захворювання Sclerotinia sclerotiorum у полі (SSFS), як описано нижче і представлено в таблиці 2. SSFS може бути інформативним, особливо при високому впливі захворювання в природних польових умовах. 15 UA 97627 C2 5 10 15 20 Термін "важкість захворювання" означає ступінь ушкодження рослини внаслідок інфекції патогеном. У даному винаході застосовують дві шкали для виміру важкості захворювання. Перша являє собою шкалу для Pioneer Hi-Bred від 1 до 9. Друга являє собою шкалу, використовувану дослідниками в державних установах, і її позначають як загальноприйняту шкалу 0-5. Обидві описані в таблиці 15. Деякі приклади їхнього використання представлені в таблиці 2. Термін "SSDS" означає важкість захворювання Sclerotinia sclerotiorum і являє собою вимір ступеня розвитку захворювання в інфікованої рослини. Наприклад, за його допомогою визначають розходження між рослинами з незначними симптомами і мертвими рослинами. Для цілей даного винаходу використовують дві шкали ранжирування: (1) шкалу ранжирування SSDS для Pioneer від 1 до 9 і описану в таблиці 15; і (2) загальноприйняту наукову шкалу, що змінюється від 0 до 5 і описану примітці до таблиці 2. Термін "SSFS" означає важкість захворювання Sclerotinia sclerotiorum у полі і являє собою вимірювання проводження поширеності захворювання (SSDI%) і ступеня, до якого інфіковані рослини захворюють у природних польових умовах (SSDS). Він є мірою поразки грибом у полі і може бути більш інформативним при високому впливі захворювання, тобто коли поширеність захворювання у полі стає значною. Його обчислюють множенням SSDI% на важкість захворювання і поділом на 5, де важкість захворювання варіює від 0 до 5, де 0 означає відсутність інфекції, і 5 означає мертва рослина, як описано в таблиці 2. Термін "локус кількісної ознаки" чи "QTL" відноситься до генетичних факторів, що розщеплюються, які впливають на варіабельність експресії фенотипічної ознаки. Таблиця 2 Параметри SSDI% і SSDS для зібраної у полі Sclerotinia і їх взаємовідносини з виведеними параметрами SSDI (дослідницькі дані) і SSFS (природні дані) SSDI Заснований на скоректованому SSDI% при екстремальному впливі захворювання в експериментальних польових умовах SSFS Важкість захворювання у SSDI% SSDS полі на основі як Ознака Поширеність Вага захворювання в SSDI%, так і захворювання уражених рослин SSDS, використовують у природних польових умовах; 0-100 % Шкала SSDS для Pioneer % поразки у полі 1 = мертва рослина 1-9 кількісне 9=відсутність захворювання Перетворення визначення Шкала 0-100 % загальноприйнята шкала SSDI% і ушкодження у 0 = відсутність виправлення на полі безвідносно захворювання контролі до впливу 5 = мертва рослина захворювання Використання Загальне Загальне Тільки для Pioneer Загальне Виправлення на Виправлення N/A N/A Без виправлення контролі Приклади: різні Шкала сполучення SSDS загальноприйнята поширеності для шкала захворювання Ріопееr і важкості захворювання Приклад 1 80 1 5.0 1.0 (80) 80 Приклад 2 80 5 2.0 2.6 (64) 32 Приклад 3 50 5 2.00 5.0 (40) 20 Приклад 4 30 7 1.0 7.3(17) 6 Приклад 5 10 8 1.0 8.5 (5) 2 16 UA 97627 C2 5 10 15 20 25 30 35 40 45 50 55 60 SSDI% являє собою процентну частку рослин у популяції, інфікованих Sclerotinia. SSDS являє собою ранжирування ступеня розвитку захворювання в ураженої рослини. У винаході використовують дві шкали. Шкала SSDS для Pioneer змінюється від 1 (мертва рослина) до 9 (відсутність захворювання), і загальноприйнята шкала змінюється від 0 (відсутність захворювання) до 5 (мертва рослина). Для подробиць шкали SSDS для Pioneer дивися таблицю 15. Загальноприйнята шкала представлена, як вказано далі: 0 = відсутність захворювання; 1 = поверхневі ушкодження чи враження дрібних відгалужень; 2 = омертвіння великих відгалужень; 3 = головне стебло окільцьоване, щонайменше, на 50 %; 4 = головне стебло окільцьоване, але рослина дає гарне насіння; 5 = головне стебло окільцьоване, значне зниження врожайності. SSDI являє собою ранжирування від 1 до 9, як описано в таблиці 4, і він скоректований на SSDI% для контрольних сортів 46А65 і/чи 46А76 для ярової каноли, і контрольних сортів Express і/чи Columbus для озимої каноли. Це ранжирування використовують тільки при контрольованому екстремальному впливе захворювання в експериментальних польових умовах. Його обчислюють множенням SSDI%, що спостерігають, на фактор X, де фактор X є чинником, що доводить середнє значення SSDI% для придатних контролів до 65 %. Корекцію на важкість здійснюють після корекції на поширеність. SSDI потім обчислюють відповідно до шкали в таблиці 4. Для прикладів 1-5, допущення полягають у тому, що середнє значення SSDI% для контролів=65 % і середнє значення SSDS для контролів=4 для обчислення розміру SSDI. SSFS є мірою, як поширеності захворювання, так і його важкості при природному впливі захворювання у полі. Його обчислюють, як вказано далі: SSFS = [SSDI% × SSDS(шкала 0-5)] 5. IV. Приклади Стеблова гнилизна, викликана Sclerotinia, розвивається у каноли за допомогою колонізованих пелюстків в умовах підвищеної вологості при цвітінні. Опалі пелюстки дозволяють Sclerotinia інфікувати листя каноли, спрямовуючи її до стебел. Гриб викликає обумовлену Sclerotinia стеблеву гнилизну. Рослина передчасно гине, що призводить до втрати врожаю приблизно на 50 %. Канола піддана стеблевій гнилизні, що викликає Sclerotinia. В роки з періодами підвищеної вологості втрата для каноли може бути дуже значною. Для зменшення чи запобігання цієї втрати фермери, як правило, використовують одну чи дві обробки фунгіцидом у залежності від тривалості вологого періоду. Приклад 1: Визначення характеристик контролів каноли при низькому, помірному, високому, дуже високому й екстремальному впливі захворювання в експериментальних польових умовах Методи і матеріали У спробі визначити рівень толерантності до Sclerotinia у доступних у даний час сортів ярової каноли в умовах низької,помірної, високої і дуже високої захворюваності Sclerotinia, одержували дані в природних польових умовах протягом багатьох років, включаючи загальнодоступні ділянки для одержання врожаю. Дані підсумовані в таблиці 3. Дані для 44А89 і 46А65 отримані із дослідження в природних умовах у п'ятьох повторностях у Міннесоті в 2001 (Jurke and Fernando, 2003). Дані для Pioneer Hi-Bred, сорт 46А76, є оцінкою на підставі реакції аналогічних зразків у тому ж самому випробовуванні в Міннесоті, а також даних по Північній Дакоті в 2003. Дані за характеристиками контролів каноли в умовах екстремального впливу захворювання отримані при цьому дослідженні. Озимі лінії каноли Columbus і Express включали в дослідницькі випробовування при екстремальному впливі захворювання як поточні контролі. Як показано в таблиці 4 і таблиці 10с, вони є схильними(подверженными) чи помірковано схильними лініями. Екстремальні умови захворювання є рідкими, але вони можуть виникати, і метою є скрінінг ліній у таких умовах. Екстремальний вплив захворювання виникає при наявності 20-30 діб постійної вологості і температури у середньому від 20 °C до 25 °C. Рослини, інфковані Sclerotinia в екстремальних умовах, звичайно мають потребу в двох обробках фунгіцидом для опору захворюванню. У середньому, фунгіциди забезпечують 10-14 діб захисту на обробку. Скрінінг відібраних рослин в екстремальних умовах гарантує, що відібрані рослини зможуть опиратися звичайному впливі захворювання. Унаслідок того, що екстремальні умови для захворювання в природі виникають рідко, створили у полі штучні екстремальні умови, як описано в прикладі 7. Вони включали штучний інокулят у формі колонізованого Sclerotinia насіння олійного нуга, використання зрошення і використання сітчастого покриття для підтримки вологого навколишнього середовища. 17 UA 97627 C2 5 10 15 20 25 30 35 Тестували сорти Pioneer Hi-Bred 44А89, 46А65 і 46А76. Найменш вразливі 46А65 і 46А76 використовували як поточні контролі для відстеження рівнів захворювання і визначення характеристик (SSDI). У спробі визначити ефект обприскування фунгіцидом на інфікованих Sclerotinia полях, збирали і підсумовували дані з ділянок для одержання врожаю в природних польових умовах з інокулятом і обприскуванням фунгіцидом полес™ протягом 30 % періоду цвітіння. Результати У таблиці 3 представлені характеристики контролів ярової каноли в різних умовах. Головною метою був скрінінг на поширеність захворювання (тобто, процентну частку рослин, інфікованих Sclerotinia). Попередні дані в польових умовах вказували, що типовий помірний чи високий вплив захворювання у полі призводить до 20-50 % поширеності захворювання для 46А65 і 10-40 % поширеності захворювання для 46А76 (таблиця 3). Однак в екстремальних умовах, як показано в таблиці З, процентна частка поширеності захворювання для Pioneer Hi-Bred, сорт 46А65, складає приблизно 70 %, і процентна частка поширеності захворювання для Pioneer Hi-Bred, сорт 46А76, складає 60 %. Якщо погода стає невідповідною для інфекції Sclerotinia, то контролі каноли менш уражені, і поширеність захворювання в частково стійких рослин пропорційно мінімізована чи ліквідована. Тому що для більшості ситуацій у польових умовах вплив захворювання менше екстремального, контролі і селектовані лінії, як правило, будуть менш уражені, чим представлено в таблиці 4. Скрінінг на поширеність захворювання при екстремальному впливі захворювання й у порівнянні з поточними контролями в кожному шостому ряду при дрібнокрапельному зрошенні також здійснювали, як описано в прикладі 7. Ці дослідницькі дані по екстремальному впливі захворювання у полі представлені у вигляді ранжирування SSDI від 1 до 9 у таблиці 4. Як правило, 5 рядів тестованих ліній засівали між одним рядом Pioneer Hi-Bred, сорт 46А76, з однієї сторони й одним рядом Pioneer Hi-Bred, сорт 46А65, з іншої. В екстремальних умовах для захворювання Pioneer Hi-Bred, сорт 46А76, має поширеність захворювання 60 % (SSDI%), і Pioneer Hi-Bred, сорт 46А65, має поширеність захворювання 70 % (SSDI%), із середнім значенням 65 % (SSDI%). Якщо для будь-якої конкретної дослідної ділянки середнє значення SSDI% для Pioneer Hi-Bred, сорту 46А65 і 46А76, не дорівнювало 65 %, то показники для Pioneer Hi-Bred, сорт 46А65, і Pioneer Hi-Bred, сорт 46A76, варто помножити на фактор, щоб довести їх до середнього значення 65 %. Показники для тестованих ліній також варто помножити на цей фактор. Після здійснення корекції важкості захворювання, як описано у визначенні SSDI, варто зробити ранжирування ліній, що відповідає SSDI, як представлено в таблиці 4. Таблиця 3 Варіація реакції на Sclerotinia у природних польових умовах для доступної в даний час ярової каноли (SSDI%) Категорія Сорт Низький Цуже вразливі 44А89 10-30 Зразливі 46А65 0-10 Помірно зразливі 46А76 0-10 % випадків-поле** 40 Вплив захворювання Помірний Високий Дуже високий Екстремальний* 30-60 50-80 70-90 80-100 20-30 30-50 40-60 70 10-20 20-40 30-50 60 30 20 8-9 1-2 * Екстремальний вплив захворювання використовували для основного дослідження і розробки, як описано в прикладі 7; ** Оцінка част. 18 UA 97627 C2 Таблиця 4 Вимір характеристик у польових умовах при екстремальному впливі захворювання (дослідницькі випробовування) Ранжирування по SSDI** 1.0 1.1-2.0 2.1-3.0 3.1-4.0 4.1-5.0 5.1-6.0 6.1-7.0 7.1-8.0 8.1-9.0 5 10 Категорія Дуже вразливі Вразливі Помірно вразливі Помірно стійкі Стійкі Високостійкі Поширеність Озимі Ярові контролі захворювання, SSDI% контролі >80 44А89, Westar Panther 79-70 46А65=2 Columbus=2 69-60 46А76=3 Express=3 59-50 49-40 39-30 29-20 19-10 9-0 У таблиці 5 показано, що обробки фунгіцидом зменшують вплив Sclerotinia на Brassica, і їх можна використовувати як непрямий вимір поліпшень характеристик проти Sclerotinia. У таблиці 5 представлений ефект однієї обробки фунгіцидом на рівнобіжних ділянках для одержання врожаю при природному рівні інфекції в Мордені і Кармані, Манітоба, у 2004. Як видно з таблиці 5, в умовах більш низького впливу захворювання майже повне стримування Sclerotinia досягають при однократній обробці фунгіцидом, за винятком сильно вражених (подверженных) рослин. Ефективність фунгіциду на рослинах з рангом 1 (HS) нижче, ніж ефективність фунгіциду на рослинах з рангом 2 чи 3 (S чи MS). Таблиця 5 Інфекція Sclerotinia (SSDI%) для контролів, що обприскуються* і контролів, що не обприскуються, на ділянках для одержання врожаю в природних умовах у районах Мордена, Манітоба, і Карман, Манітоба, у 2004 Сорт 44А89 44А89 46А65 46А65 46А76 46А76 Категорія HS HS S S MS MS Морден 30.7 8.0 11.3 0.0 11.3 2.7 Карман 22.5 19.5 11.5 2.0 9.5 1.0 Середнє значення 27 14 11 1 10 2 Обробка фунгіцидом Без обприскування З обприскуванням Без обприскування З обприскуванням Без обприскування З обприскуванням *Ланс™ (боскалід) - зареєстрований BASF фунгіцид для боротьби з Sclerotinia; HS= Дуже вразливі; S= Вразливі; MS= Помірно вразливі. 15 20 У таблиці 6 представлені результати досліджень у польових умовах у Північній Дакоті/Міннесоті, проведених у 2003. Більшість у даний час комерційно доступних сортів каноли мають ранг 1 чи 2, ґрунтуючись на ранжируванні SSDI для Pioneer від 1 до 9, як описано в таблиці 2. Деякі рідкі сорти мають ранг 3 і більш ефективно захищені фунгіцидами. Наприклад, у таблиці 6 показано, що Нуоlа 357, що має ранг стійкості до Sclerotinia приблизно 2, мав 69 % поширеність при дослідженнях з використанням фунгіцидів у Північній Дакоті. Після обробки кращим фунгіцидом поширеність знижувалася до 44 %. У таблиці 6 також показано, що Invigor2663, з рангом стійкості до Sclerotinia від 1 до 2, мав 22,3 % поширеність при випробуванні в Міннесоті, де вплив захворювання був низьким. Після обробки фунгіцидом поширеність знижувалася до 5 %. 19 UA 97627 C2 Таблиця 6 Характеристики сортів каноли в скрінінгу на Sclerotinia і дослідженнях з використанням фунгіциду в тих же місцевостях, North Dakota State University Carrington Research/Extension Center і University of Minnesota Red Lake Falls, 2003* Північна Дакота Сорт Hyola 357 випробування без обробки фунгіцидами Hyola 357 випробування з обробкою фунгіцидами Ендура (боскалід) Hyola 357 випробування сорту ln Vigor 266 Звипробування сорту ln Vigor 266 Звипробування без обробки фунгіцидами ln Vigor 266 Звипробування з обробкою фунгіцидами Ендура (боскалід) 5 10 15 Міннесота Важкість Важкість в Поширеність Важкість в Поширеність Важкість польових захворювання захворювання польових захворювання захворювання умовах умовах 69 2.3 32.1 44.0 1.9 16.6 60.5 2.6 30.9 18 4.8 17.3 61.5 2.8 34.4 30.0 4.5 27.0 22.3 4.0 17.9 5.0 3.3 3.1 На основі поширеності захворювання і таблиці 3, випробування у Північній Дакоті можна класифікувати як дуже високий-екстремальний вплив захворювання. Результат дослідження з використанням фунгіциду в Північній Дакоті порівняний з екстремальним впливом захворювання на шкалі SSDI для Pioneer 1-9 і вказує на характеристики кращого фунгіциду для захисту схильного (подверженного) сорту. Ендура™ (боскалід™) забезпечували найбільш високий рівень захисту при випробування і в порівнянні з рядом інших фунгіцидів при цьому впливу; * З оцінок 2003 року для фунгіцидів для боротьби зі стеблевою гнилизною каноли, викликаної Sclerotinia, у Північній Дакоті і Міннесоті, служба поширення знань NDSU, квітень 2004.] Приклад 2: Розвиток стійкості до Sclerotinia - виведення популяції Τ Метою дослідницького зусилля була заміна обробки фунгіцидом каноли на стійкі до Sclerotinia сорти. Стратегія являла собою використання природно доступних джерел з частковою стійкістю і здійснення поступового накопичення цих морфологічних ознак, що запобігають захворюванню, у ході рекурентної селекції в популяції для досягнення дуже високого рівня часткової стійкості. При поступовому нагромадженні на тлі, що запобігає захворюванню, стійкість може бути повною, якщо її можна одержати для перенесення впливу 20 UA 97627 C2 5 10 15 20 25 30 35 40 45 50 захворювання максимальної тривалості, починаючи від опадання пелюстків до кінця цвітіння, і, таким чином, за її допомогою можна опиратися патогену без істотного ушкодження рослини. Морфологічні ознаки, що запобігають захворюванню, включають, наприклад, гарну стійкість до полягання і твердий стовбур (стебло), більш пізнє дозрівання, високе розгалуження, більш низьку схоронність пелюстків і швидке опадання листя. Фізіологічні ознаки в основному являють собою сильну часткову стійкість стебла, яка може бути пов'язаною з деякою стійкістю листя. Таким чином, розвиток захворювання, що знижено морфологічними ознаками, додатково знижено там, де є присутньою стійкість стебла і/чи листя. Сумарний вплив гриба на стебло знижено чи мінімізовано тоді, коли сильна часткова стійкість стебел сполучається з морфологічними ознаками, що зменшують вплив захворювання. Під час відсутності придатних морфологічних ознак, сумарні характеристики знижені, але все ще значно кращі, ніж у контролів каноли. Екстремальний вплив захворювання виникає в тривалі періоди придатних для інфекції Sclerotinia погодних умов. Як правило, це відбувається при температурах між 20 °C і 25 °C і відносній вологості більш ніж 80 %. У цих умовах відбувається оптимальне інфікування рослини (Негап et al., 1999). Крім вологості, іншим індикатором вологого рослинного покриву є вільна вологість чи абсолютна вологість на рослинах. Методи і матеріали У таблицях 7 і 8 описані компоненти, використовувані при розвитку стійкості в польових умовах у популяції Т, і способи, використовувані для розвитку і скрінінга стійкості в польових умовах. Починаючи з 1986 придбана зародкова плазма рапсу Brassica napus в урядових закладах у США (United States Department of Agriculture), Японії (Ministry of Fishery and Natural Resources) і Канади (Plant Genetic Resources). Рапс багатий глюкозинолатами та еруковою кислотою і, таким чином, не є сортом каноли. Його позначають як подвійний високий. На відміну від цього, сорти каноли Brassica napus мають низький вміст ерукової кислоти і низький вміст глюкозинолатів, і її також позначають як подвійний низький. її визначають як рослину Brassica, у якій олія повинна містити менше ніж 2 % ерукової кислоти, і твердий компонент насіння повинний містити менше ніж 30 мікромоль будь-якої однієї чи будь-якої суміші з 3-бутенілглюкозинолата, 4пентенілглюкозинолата, 2-гідроксі-3-бутенілглюкозинолата і 2-гідроксі-4-пентенілглюкозинолата на грам висушеної на повітрі твердої речовини, що не містить олії. Придбану зародкову плазму рапсу охарактеризували на реакцію стебла на Sclerotinia (таблиця 7). Ряд маючих часткову стійкість стебла відібраних рослин рапсу схрещували з лініями сортів каноли, і відбирали нащадків з частковою стійкістю стебла й ознаками сортів каноли (низький вміст ерукової кислоти і/чи низький вміст глюкозинолатів). Лінії сортів каноли, що мали часткову стійкість стебла, використовували для додаткового дослідження і виведення популяції. Джерела стійкості до Sclerotinia, використані у виведенні поліпшених ярових ліній каноли, перераховані в таблиці 7. Надходження з USD А (США) і MAFF (Японія) також використовували при виведенні поліпшених озимих ліній каноли. У 1991 році в Pioneer почали програму селекції популяції для рекомбінації зразків каноли з фізіологічною частковою стійкістю стебла і морфологічною невразливістю в польових умовах. Вивели популяцію Т. Подробиці циклів від 0 до 10 представлені в таблиці 8. Кожен цикл описаний у рядку таблиці. У кожнім рядку описаний використовуваний матеріал, перехресне схрещування для одержання S0, збільшення кількості насіння і селекція в теплиці S0 для одержання S1, з наступним тестуванням S1 у полі і селекцією, що включає агрономічний аналіз і аналіз якості. У перших чотирьох циклах використовували замкнуту популяцію, як описано в таблиці 8. Додаткову варіабельність фізіологічної часткової стійкості стебла вводили в цикли 5, 6, 7 і 8 (таблиця 8). Лінії тестували згідно способам селекції в теплиці і полі, як описано в прикладах 6 і 7. Відбирали нащадків, що мають високий рівень стійкості, і досліджували постійне поліпшення у полі (фігура 1). Згідно способу приклада 6, тільки селектовані в теплиці на стійкість стебла нащадки адаптували до поля. 21 UA 97627 C2 Таблиця 7 Виведення популяції Τ - Компоненти рапсу, що перетворили в канолу і використовували у виведенні популяції Τ (Дані по довжині ушкодження стебла в приміщенні і SSDS за вихідними лініями чи їх яровим відібраним рослинам (USDA) у порівнянні зі схильними контролями) Установа The Ministry of Agriculture Forestry and Fisheries of Japan MAFF USDA North Central Regional Plant Introducti on Station Iowa State Universitу Plant Genetic Resources Canada Назва Довжина сорту Рік Рік ушкодженджерела одержання інтрогресії ня мм рапсу JAP 3-1-1 1988 1991 33 Ro(USSR)6 1988 1991 28 Genkai 1988 1991 60 Minami 1988 2000 10 kyuushuu 17 4.4 4.2 1.4 5.4 Довжина ушкодження Вразливий контроль 72* 48 72 48 SSDS 1-9 Вразливий контроль 2.0 1.0 2.0 1.0 SSDS 1-9 PI470079 PI469955 PI469830 1988 1988 1988 2001 2001 2002 32 27 35 4.7 4.5 5.0 109** 120 104 1.1 1.0 1.0 PGR8487 PGR8488 PGR8490 PGR8492 PGR8493 1986 1986 1986 1986 1986 2002 2002 2002 2002 2002 27 32 33 34 23 5.2 4.8 4.1 4.6 6.3 85 85 85 85 85 1.2 1.2 1.2 1.2 1.2 * Вразливий контроль для японських зразків ярової каноли Westar; ** Вразливим контролем для зразків USDA і PGR була ярова лінія Pioneer NS1602. Таблиця 8 Виведення популяції Τ за допомогою способу рекурентної селекції S1 з модифікаціями Відібрані від So до рослини, що S1 схрещуються Відібрані з So0 у S1 Частково Перехресне Популяпо тестустійке схрещування ція Т ванню джерело для S0 росту в GH Цикл 0 Jap 3-1-1 12 ліній двічі 500 Основа Ro напівпопуля- (USSR)6 діаллельції ний Цикл 1 Замкнута 33 лінії S1 500 Популяція ПопуляМатеріал ція Коментарі Додаткова селекція на S1 Характеристика Si Тестування S1 у полі з відібраних S0 на Sclerotinia GH Інокуляція стебла 500 150 22 Рік Тип тестованого впливу захворювання Агрономічний Контролі аналіз і аналіз для поля якості 1993- Тестування 1995 стебла 1996 Природний вплив від помірного до високого NS1602 NS1604 Не використовували Селекція S1 NIR Низький вміст глюкозинолатів UA 97627 C2 Продовження таблиці 8 Цикл 2 Замкнута 30 ліній S1 популяція 500 90 Цикл 3 Замкнута 12 ліній S1 популяція 500 150 Цикл 4 Замкнута 15 ліній S1 популяція 3,000 Цикл 5 Відкрита 62 лінії S1+15 популяція ліній Genkai BС1 GENKAI 3,000 Цикл 6 Відкрита Інтрогресії 41 популяція С5+9 F1 BС1 MINAMI KYUUSH UU17 3,000 150 2001 Екстремальне 46А65 2 повторення NS1604 Цикл 7 Відкрита популяція ВС1 РІ469955 РІ470079 Відкрита популяція ВС0 PGR8487 PGR8488 PGR8490 PGR8492 PGR8493 РІ469830 Замкнута популяція Інтрогресія схрещуванням 24 S1s з Ff 3,000 600 2002 Екстремальне 46А65 2 повторення NS1604 30 S1 4,000 600 2003 Екстремальне 46А65 2 повторення 46А76 24 S1s 4,000 600 2004 Екстремальне 46А65 2 повторення 46А76 Цикл 10 Замкнута 62 S1s популяція 4,000 390 2005 Екстремальне 46А65 2 повторення 46А76 Цикл 8 Цикл 9 5 10 15 1997 Помірний вплив 46А65 NS1604 Помірний вплив 1998 Помірний 46А65 вплив NS1604 Помірний вплив 1999 Екстремальне 46А65 NS1604 1,000 без повторностей 176 2000 Екстремальне 46А65 2 повторення NS1604 Селекція S1 NIR Низький вміст глюкозинолатів Селекція S1 NIR Низький вміст глюкозинолатів Селекція S1 NIR Низький вміст глюкозинолатів Агрономічна селекція S1 NIR Низький вміст глюкозинолатів Агрономічна селекція S1 NIR Низький вміст глюкозинолатів Селекція «чорної ніжки» Агрономічна селекція S1 NIR Низький вміст глюкозинолатів Агрономічна селекція S1 NIR Низький вміст глюкозинолатів Агрономічна селекція S1 NIR Низький вміст глюкозинолатів Агрономічна селекція S1 NIR Примітки до таблиці 8: Повторне тестування здійснювали з циклу 6; "Матеріал" включає генетичні джерела, використовувані у виведенні вихідних зразків сортів каноли; Замкнута популяція = Виведення популяції засноване тільки на нащадках з попереднього циклу, не використовується ніяких нових джерел; Відкрита популяція = Виведення популяції засновано на нащадках з попереднього циклу, а також нових джерелах, що раніше були відсутні в популяції; Інтрогресія = Уведення нового джерела в популяцію; зв'язана з відкритою популяцією; СН=теплиця; Літеру F звичайно використовують у селекції (у селекції "педігрі"), і вона позначає дочірнє покоління/покоління потомства, де F1 є насінням першого покоління чи рослиною зі схрещування; S позначає самозапилення, F1 являє собою S0 чи відсутність самозапилення. У такий спосіб можна диференціювати нащадків з популяції (S) у порівнянні із селекцією "педігрі" (F). So являє 23 UA 97627 C2 5 10 15 20 25 30 35 40 45 50 55 60 собою F1 і часто використовується в популяційній селекції для вказівки на кількість самозапилюваних поколінь; S1 y популяційній селекції еквівалентно F2 у селекції "педігрі"; Приклади різних способів, як вказано далі: Зразки джерела для перехресного схрещування 0 року для одержання S0, самозапилення/відбору S0, селекції S1 у полі в замкнутій популяції; Перехресне схрещування 1 року S1 для одержання S0, самозапилення/відбору S0, селекції S1 у полі; приклад замкнутого циклу (цикли 1-4 і цикл 9, 10); Перехресне схрещування 2 роки S1 з 1 року і нові джерела - спосіб ВС0 (цикл 8) чи приклад відкритого циклу (цикл 8); Перехресне схрещування S1 з 1 року і нові джерела, вже піддані схрещуванню з популяцією Τ - спосіб ВС1 (цикли 5, 6, 7); приклад відкритого циклу (цикли 5, 6, 7). Результати Фігура 1 являє собою гістограму ліній, отриманих у циклах 5-10, для популяції Т, показуючи розвиток у напрямку до стійкості до Sclerotinia, отриманої при екстремальному впливі захворювання в експериментальних польових умовах, як вимірено в порівнянні з контролями в циклах 5-10. З кожним роком поліпшення популяції Τ процентна частка поширеності захворювання знижувалася, і середнє значення для популяції поліпшувалося на шкалі SSDI 1-9. Вісь Υ являє собою частоту в нащадків, і на осі X представлене ранжирування стійкості до Sclerotinia на шкалі SSDI 1-9, як описано в таблиці 4. На фігурі 1 показано, що середнє значення і мода для популяції для кожного циклу постійно поліпшувалися. Наприклад, мода для популяції покращилася від 2,5 у циклі 5 до 5,5 у циклі 8, до 7,5 у циклі 10. Крім того, індивідуальні відібрані рослини в циклах 7, 8 і 9 мали ранги 7,5, 8,0 і 8,5. Відбирали нащадків, що мають високі рівні стійкості, і досліджували постійне поліпшення в полі. Ступінь поширеності захворювання в тестах, представлених на фігурі 1, вимірювали при екстремальному впливі захворювання в експериментальних польових умовах. Це є найбільш високим можливим впливом захворювання в природному оточенні в полі. Цей рівень захворювання рідко виникає на полях фермерів (таблиця 3). Отже, очікують, що зразки, відібрані в цьому тесті, будуть зростати значно краще при більш низькому і більш звичайному впливу захворювання. Наприклад, при типовому помірному впливу захворювання у полі поширеність захворювання для Pioneer Hi-Bred, сорту 46А65 і 46А76, як правило, складає 2030 % і 10-20 %, відповідно (таблиця 3). Однак при екстремальному впливі захворювання рівень поширеності захворювання складає 70 % і 60 %, відповідно (таблиця 3). Рослина з частковою стійкістю в польових умовах має (і) знижений розвиток захворювання на рослині, (іі) значно затриманий початок захворювання і (ііі) стійкість до розвитку захворювання протягом більш тривалого часу, коли інокулят знаходиться в безпосередньому контакті зі стеблом. Якщо сприятливі для захворювання умови продовжують зберігатися, спостерігають значне зменшення впливу захворювання у частково стійких рослин (таблиця 3 і фігура 1). У таблиці 9 описані деякі з ліній з поліпшеною стійкістю в польових умовах і показані їхні характеристики у полі в природних умовах у тестах, виконаних незалежними третіми особами. Дані для 2004 року по SSDI% отримані в Манітобі у дослідженнях у відкритому полі при помірному впливі захворювання (як визначено характеристиками для 2 з 3 контролів). Деякі з тих же самих ліній тестували в University of Minnesota (MN) при високому впливі в 2003 (2 з 2 контролів) і в Північній Дакоті (ND) при впливу від дуже високого до екстремального в 2003, відповідно до таблиці 3. Усі стійкі у полі лінії мають рівень часткової стійкості стебла значно вищий, ніж у контролів. Варто звернути увагу, що у всіх чотирьох місцевостях характеристики кожної з п'яти перерахованих ліній добре відповідали вимогам даної формули винаходу, тобто, мали середнє значення показника поширеності захворювання, викликаного Sclerotinia Sclerotiorum, (SSDI%), що складає менше ніж приблизно 60 % показника SSDI% для Pioneer HiBred, сорт 46А76, у тих самих умовах навколишнього середовища і захворюваності в полі. Відібрані рослини популяції Τ також тестували при екстремальному впливі захворювання в експериментальних польових умовах (таблиця 10а і таблиця 10b). Відібрану рослину 02SN41269 вводили в цикл 8. Відібрану рослину 03SN40441 з циклу 8 використовували для виведення в циклі 9 у сполученні з 03SN40341 і 22 лініями S1 з попереднього циклу 8, як описано в таблиці 8. Ці три лінії (тобто 02SN41269, 03SN40341 і 03SN40441) широко використовували в схрещуванні, і для нащадків популяції Τ зворотно прослідковується частина їхньої генетичної стійкості до одного чи декількох з них. У таблиці 10а представлені результати трьох тестів (два в 2004 і один у 2003) при екстремальному впливі захворювання в експериментальних польових умовах для 03SN40341, 24 UA 97627 C2 5 10 15 20 25 30 35 40 45 50 55 60 03SN40441 і 02SN41269. У середньому, 03SN40341, 03SN40441 і 02SN41269 мали поширеність захворювання (SSDI%) 39 %, 39 % і 44 %, відповідно, у порівнянні з 46А76. При цих екстремальних умовах рослини більш вразливі Sclerotinia, щонайменше, із причин, розглянутих вище при визначенні "екстремального впливу захворювання в експериментальних польових умовах". На відміну від цього, рослина, що росте в природних польових умовах (1) не покрита штучним навісом, який забезпечує постійну вологість, і (2) її вирощують на ділянках, оточених рослинами з тим же самим морфологічним фенотипом, що дозволяє проявитися всім перевагам морфології. Отже, відібрані рослини, що мають морфологію, яка менш сприяє інфекції Sclerotinia, наприклад, високим розгалуженням, ростуть значно краще в природних польових умовах у порівнянні з екстремальним впливом захворювання в експериментальних польових умовах. Наприклад, у середньому, у природних польових умовах 03SN40341, 03SN40441 і 02SN41269 мали поширеність захворювання 23,2 %, 13,7 % і 49,1 %, відповідно, у порівнянні з 46А76, як показано в таблиці 9. Отже, 02SN41269 має морфологію, що більш сприяє інфекції Sclerotinia, ніж 03SN40341 і 03SN40441. 02SN41269 більш схильний до полягання в порівнянні з 03SN40341 і 03SN40441 (фігура 2А). На фігурі 2А показано, що 04DHS12921, подвоєна гаплоїдна лінія 02SN41269, а також подвоєний гаплоїд 04DHS11319 також вразливі до полягання більше, ніж контроль 46А65 та інший тестуємий матеріал. Низька стійкість до полягання може дискредитувати характеристики стійкості до Sclerotinia у порівнянні із сукупностями даних у природних умовах, особливо, при достатку вологи чи надлишковому зрошенні, таких як NDSU-Carrington2005. В експериментальних сукупностях даних обходять стійкість до полягання і надають показники, що віддображують потенціал генетичної стійкості в сполученні з морфологією. Ефект морфології при екстремальному впливі захворювання в експериментальних польових умовах у порівнянні з природними польовими умовами можна показати з використанням контрольних сортів 46А76,46А65 і 44А89 як приклади. 46А76 є одним з найменш вразливих сортів в дослідженнях сортів на стійкість до Sclerotinia в дослідженнях, що організовані університетом у Північній Дакоті і Міннесоті (таблиця 9, дані 2003 року). 46А76 має морфологію, що менш сприяє інфекції Sclerotinia у порівнянні з 46А65 чи 44А89. Морфологія включає характеристики, такі як високе розгалуження і дуже гарну стійкість до полягання. При розгляді показників SSDI% при екстремальному впливі захворювання в експериментальних польових умовах (таблиця 10а) 44А89 складає 115 % від 46А76, і 46А65 складає 98 % від 46А76. Однак у природних дослідженнях у 2004 (таблиця 9), 44А89 складає 232 % від 46А76 і 46А65 складає 199 % від 46А76. Це ясно показує, що 46А76 є високим стандартом для виміру стійкості в польових умовах, особливо, у природних польових умовах, у порівнянні з іншими контролями каноли. Це також показує розходження між природними польовими результатами й експериментальними польовими результатами при екстремальному впливі захворювання. При екстремальному впливі захворювання в експериментальних польових умовах піддаються дослідженню всі генотипи, і воно являє собою найгірший сценарій, тобто такий, котрий звичайно виникає тільки в 1-2 % у природному оточенні у полі (дивися таблицю 3). Лінія, що добре росте в цих екстремальних умовах, як очікують, росте, щонайменше, також добре в природному оточенні в полі. Долучення контрольних сортів, таких як 44А89 і 46А76, допомагає в оцінці тестування навколишнього середовища і надійності отриманих даних. Наприклад, у таблицях 9Ь і 9с порівнюються результати, отримані на контрольних лініях на тестованих ділянках у Північній Дакоті і Міннесоті в 2001,2003 і 2005. Ці ділянки є вибіркою з ділянок з більш високим впливом захворювання, крім сукупності даних по роках із залишковими рівнями захворюваності (Bradley, et al., 2006). Низький рівень поширеності захворювання для 46А76 у 2005 (NDSU-Carrington) указує на те, що умови навколишнього середовища можуть ускладнювати оцінку захворювання, як припустив дослідник Bob Hanson (NDSU). У цьому випадку, надлишкове зрошення приводить як до надлишкового полягання більш ранніх ліній, так і до затримки дозрівання більш пізніх ліній, сприяючи лініям, що пізно дозрівають, таким як 46А76. Таблиці 9b і 9с дозволяють припустити, що дані, зібрані на ділянці NDSU-Carrington 2005 не узгодяться з даними, отриманими на тій же ділянці, а також на ділянках у Міннесоті в попередні два роки (дивися також Bradley, et al., 2006). На фігурі 2 представлені дані численних досліджень ярових ліній як при екстремальному впливі захворювання, так і в природних польових умовах. Загальні експериментальні дані при екстремальному впливі захворювання у полі одержували, якнайбільше, у чотирьох тестах. Дані для полів у природних умовах збирали, якнайбільше, у трьох місцевостях, включаючи ділянку в Північній Дакоті, розглянуту вище (дані 2005). При видаленні результатів одиночного дослідження, що відрізнялося, (фігури 2D і 2Е) усі тестовані лінії чітко добре зростають у межах 25 UA 97627 C2 5 10 15 20 25 30 35 40 обраного діапазону, тобто показника SSDI% менше ніж 60 % показника SSDI% для Pioneer, сорт 46А76, чи показника SSDI% для Pioneer, сорт 46А65, або середнього значення показника SSDI% для двох сортів, у тих самих умовах навколишнього середовища і захворюваності у полі. Подвоєні гаплоїдні лінії, що представляють 02SN41269 (2 лінії), 03SN40441 і 03SN40341, відбирали і характеризували при екстремальному впливі захворювання в експериментальних польових умовах (таблиця 10b). Подвоєні гаплоїдні лінії одержували способами, відомими фахівцям у даній галузі; наприклад, дивися Swanson et al., (1987), Mollers et al., (1994), Hansen et al., (1996), патент США 6200808 і патент Канади 2145833. Чотири подвоєні гаплоїдні лінії мали ранги SSDI від 6,6 до 7,3. Це добре відрізняється від контролю, Pioneer Hi-Bred, сорт 46А76, з рангом 3,8. Подвоєні гаплоїдні лінії мають морфологічні фенотипи, аналогічні своїм батьківським лініям, і вони, імовірно, також краще ростуть у природних умовах. В таблиці 10с представлені дані по характеристиках для озимих ліній каноли F3, 2005. Дані в цій таблиці отримані з дослідження у полі в 2005, що повторили три рази, виконаного в Тавістоку (Онтаріо, Канада). Екстремальний вплив захворювання використовували для одержання цієї експериментальної сукупності даних. Реакція в польових умовах у досліджуваних зразків виявилася краще, ніж у контролів, Express і Columbus, навіть у погодних умовах, що приводили до впливу захворювання, більш високому, ніж плановане. Показники полягання у відібраних рослин озимої каноли, отримані в Зосте (Німеччина), дозволили здійснити селекцію стійких зразків з гарною стійкістю до полягання. В таблиці llа представлене походження п'яти відібраних зразків гетерозиготної ярової каноли (02SN41269, 03SN40341, 03SN40441, 04SN41433 і 04SN41415) і їх гомозиготні подвоєні гаплоїдні нащадки. Усі відібрані рослини походять з однієї рослини (що дали 100-500 насінин у перший рік тестування в полі), тому їм потрібно надалі самозапилення і збільшення кількості для подальшого тестування у полі і отримання насіння. На закінчення, як показано на гістограмі фігури 1, зусилля по виведенню і селекції протягом шести років (2000-2005), обумовлені 15 роками досліджень (1991-2005), привели до поліпшення ярових ліній каноли. У природних польових умовах ці лінії мають середнє значення показника поширеності захворювання, викликаного Sclerotinia Sclerotiorum (SSDI%), що складає менше ніж приблизно 60 % показника SSDI% для Pioneer Hi-Bred, сорт 46А76, чи показника SSDI% для Pioneer Hi-Bred, сорт 46А65, або середнього значення показника SSDI% для двох сортів у тих самих умовах навколишнього середовища і захворюваності в полі. У таблиці 9 показано, що Pioneer Hi-Bred, сорт 46А76, є одним з найменш підданих контролів каноли у полі (ранг 3 на шкалі SSDI, у той час як більшість існуючих зразків каноли мають ранги 1 чи 2) і являє собою дуже перспективний контроль, з яким порівнюють нові зразки. Крім того, полес™ чи Ендура™ вважаються найбільш ефективними фунгіцидами на ринку. Це сполучення найбільш чутливого контролю каноли і найбільш ефективного фунгіциду висуває дуже високі вимоги. Як видно з гістограми фігури 1, цикл 10 популяції Τ мав ранг SSDI 7, 5, де деякі індивідууми мали ранги 8 чи 8, 5. Відповідно до шкали ранжирування в таблиці 4 і результатам, представленим на фігурі 1, виведені лінії, що мають рангами SSDI 5 ,6, 7 чи 8. їх класифікували як помірковано стійкі (ранги 5 чи 6) і стійкі (ранги 7 чи 8). Таблиця 9а Підсумовування результатів даних у природних умовах у полі для Sclerotinia по виведеним стійким до Sclerotinia рослинам у 2003/2004 Сорт 2003/2004 02SN40680 02SN40209 02SN41269 46А76 44А89 2004 SSDI% МВ (Морден) Цикл 7-BN3 0.6 Цикл 7-BN4 4.9 02SN401024.0 BN1 Контроль 18.3 MS Контроль 42.2 HS Походження 2004 SSDI% МВ (Карман) 1.4 17.4 2003 2003 2003/2004 2003/2004 2003/2004 2003 SSDI% SSDI% SSDI% SSDI% SSFS* SSFS SSFS Серед4 місцеND** MN % 46А76 ND MN нє знавості чення 18.5 4.0 6.1 23.4 8.4 0.6 4.5 22.0 0.0 11.1 42.3 10.1 0 5.1 2003 SSFS % 46A76 20.6 23.1 1.4 39.0 7.0 12.9 49.1 16.6 3.5 10.1 46.0 14.6 51.0 21.0 26.2 100.0 25.6 18.1 21.9 100.0 35.4 90.0 76.0 60.9 232.4 64.8 76.0 70.4 322.2 26 UA 97627 C2 Продовження таблиці 9а Тільки 2004 03SN40441 Цикл 8 03SN40341 Цикл 8 46A65 Контроль S 5 1.7 3.2 33.3 2 місце% 46А76 вості 2.2 13.7 3.8 23.2 32.6 198.8 2.8 4.4 32.0 Важкість захворювання у полі в ND і MN обчислювали множенням поширеності захворювання (SSDI%) на важкість захворювання інфікованих рослин і діленням на 5 (SSFS = [SSDI% × 88О8(шкала 0-5)] 5). Менша важкість "1" у порівнянні з мертвою рослиною "5" буде значно знижувати сумарний вплив захворювання, як видно за допомогою порівняння 44А89 і 02SN40680; ND - Північна Дакота; MN - Міннесота; MB - Манітоба; Таблиця 9b Дані NDSU і University of Minnesota у природних умовах за реакцією у полі сортів каноли на Sclerotinia (% поширеності захворювання) 2001/2003/2005* 2001 Carrington 2001 Red Lake Falls 2003 Carrington 1 2003 Red Lake 2 Falls 2005 Carrington Сорт Hylite201** Hyola401 46A76 Hyola357 LG3455 44А89 14.7 20.7 22.7 34.0 41.3 36.0 15 33 34.7 41 41 73 65.0 55.0 51.0 60.5 52.5 90.0 4.0 11.0 21.0 18.0 29.0 76.0 41 54.5 16.0 55.5 30 49.5 2001-2003 Усі Середнє Середнє значення значення 25 28 30 35 32 29 38 42 41 39 69 65 * Дані отримані Bob Hanson (NDSU) і Dave Legare (University of Minnesota); ** Безпелюсткова канола; 1 Дані за Carrington (Північна Дакота), 2003, відповідають даним для ND, 2003, у таблиці 9а; 2 Дані за Red Lake Falls (Міннесота), 2003, відповідають даним для MN, 2003, у таблиці 9а. Таблиця 9с Дані NDSU (Carrington) і University of Minnesota (Red Lake Falls) у природних умовах по реакції у полі сортів каноли на Sclerotinia (поширеність захворювання), 2001/2003*, виражені у вигляді % від 46А76 2001 2001 2003 2003 2005 Carrington Red Lake Falls Carrington Red Lake Falls Carrington Поширеність 2001-2003 УСІ Sclerotinia(%) Середнє Середнє Сорт значення значення Hylite201** 65 42 127 19 256 63 102 Hyola401 91 96 108 52 341 87 138 46А76 100 100 100 100 100 100 100 Нуоіа357 150 118 119 86 347 118 164 LG3455 182 119 103 138 188 135 146 44A89 159 211 176 362 309 227 243 * Дані отримані Bob Hanson (NDSU) і Dave Legare (University of Minnesota); **Безпелюсткова канула. 27 UA 97627 C2 Таблиця 10а Підсумовування джерел експериментальних даних 2003/2004 за екстремальним впливом захворювання (SSDI), 3 тести 2004 2004 2003 Тест 1 Тест 2 Тест 3 Сорт SSDІ 03SN40341 03SN40441 02SN41269 46А76 46А65 44А89 5.8 5.6 5.9 3.8 2.9 n/а Середнє Середнє Перетво- SSDI% значення значення рення* of Квітуча Квітуча Квітуча росли- SSDI SSDI рослина рослина на** 48 7.2 48 7.2 44 46 6.8 49 7.8 45 44 6.6 45 6.6 41 48 2.0 52 3.4 44 46 3.2 46 3.6 42 n/а 2.5 47 1.8 46 SSDI Квітуча рослина 6.7 6.7 6.4 3.1 3.2 2.2 46.7 46.7 43.3 48.0 44.7 46.5 46А76 23 23 26 59 58 68 39 39 44 100 98 115 * Перетворення 1-9 для SSDI у SSDI% у таблиці 4; ** 50 % квітучих рослин. Таблиця 10b Експериментальні дані за екстремальним впливом захворювання у полі для подвоєних гаплоїдних ліній і їхніх батьківських джерел (02SN41269,03SN40441 і 03SN40341), селектовуваних на високий рівень стійкості в польових умовах SSDI 6.8 6.6 7.0 7.3 5.8 5.6 5.9 1.9 3.9 2.9 Квітуча рослина 48 48 47 47 48 46 44 49 48 46 Сорт 04DHS11319 04DHS11418 04DHS12921 04DHS12927 03SN40341 03SN40441 02SN41269 NS3181BR 46А76 46А65 Походження POPTC8-03SN40041 Подвоєний гаплоїд POPTC8-03SN40050 Подвоєний гаплоїд 03SN40919 Подвоєний гаплоїд 03SN40919 Подвоєний гаплоїд POPTC8-03SN40041 Цикл 8 POPTC8-03SN40050 Цикл 8 02SN40102 Чутливий до раундапу DH Помірно чутливий контроль Чутливий контроль Таблиця 10с Характеристика озимих ліній F3 каноли проти Sclerotinia (Тавісток, Онтаріо) і їх агрономічні/якісні ознаки (Зост, Німеччина), 2005 CopT-F3 04CWB93018 04CWB930127 04CWB930081 04CWB930111 % середнє ПереЕрукова **ГлюSS значення Поля- ВисоПоходження творенкислота козиноDIS об'єднаних гання* та* ня 22:1 лати контролі в 03CWB925237 6.3 27 42 6.0 7 0.03 19.1 -10 03CWB925237 6.3 27 42 6.0 7.0 0.16 7.9 -7 03CWB925200 5.9 31 48 6.0 4.0 0.03 8.1 -4 03CWB925024 5.8 32 49 6.0 5 0.02 9.9 -9 28 CopT-F4 03CWB925237 03CWB925237 03CWB925200 03CWB925024
ДивитисяДодаткова інформація
Назва патенту англійськоюSclerotinia-resistant brassica
Автори англійськоюTulsieram, Lomas, Falak Ihor, Sharn Dave, Patel, Jayantilal
Назва патенту російськоюBrassica, стойкая к sclerotinia
Автори російськоюТулсирам Ломас, Фалак Игор, Шарн Дейв, Пател Джаянтилал
МПК / Мітки
МПК: A01H 1/04, C12N 15/82, A01H 5/00
Мітки: стійка, sclerotinia, brassica
Код посилання
<a href="https://ua.patents.su/59-97627-brassica-stijjka-do-sclerotinia.html" target="_blank" rel="follow" title="База патентів України">Brassica, стійка до sclerotinia</a>
Попередній патент: Місткість із засобом, що забезпечує звукове закривання (варіанти), та спосіб забезпечення звукової індикації
Наступний патент: Спосіб отримання fc-фрагмента імуноглобуліну, вільного від початкового метіонінового залишку, в масовому масштабі
Випадковий патент: Кормушка