Спосіб приготування стандартизованого концентрату фактору віллебранда людини та концентрат, одержаний цим способом
Текст
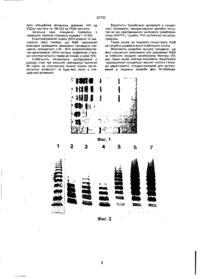
1. Спосіб приготування стандартизованого концентрату фактору Віллебранда людини з крюосадженоі фракції плазми, що попередньо очищена на гідроксиді алюмінію, який включає дві послідовні стадії' іонообмінної хроматографії на смолі типу макропористого вінілового полімеру, що має групи діетиламіноетилу, який відрізня Цей винахід стосуєгься процесу приготування у промисловому масштабі концентрату стандартизованого фактора фон ВІлебранда людини, що має дуже високу чистоту, високоспецифічну дію та великий вміст мультимерів з високою молекулярною вагою, який призначено, зокрема, для використання з терапевтичною метою. Фактор фон ВІлебранда (ФфВ) - найбільша відома молекула, що циркулює у плазмі Вона існує у вигляді низки великих мультимерів з дисульфідними зв'язками, базова одиниця яких має молекулярну вагу близько 260 кілодальтонів (кД). Найменша форма ФфВ у плазмі являє собою димер приблизно 440-500 кД, а найбільшими формами є мультимери такого димеру, молекулярна вага яких сягає аж до 20 мільйонів дальтонів, Впорядкована структура субодиниць, що зв'язані між собою, може бути клітинно специфічною, ФфВ синтезується й полімеризується у мегакаріоцитах та клітинах ендотелію. Цей фактор відіграє значну роль у гемостазі, виконуючи дві різні функції він транспортує й стабілізує Фактор VIII у потоці крові і, як адгезивний білок, забезпечує розповсюдження, прикріплення й агрегацію тромбоцитів на с/бендо ється тим, що додатково проводять стадію очищення за допомогою афінної хроматографії на колонці з желатин-сефа розою, причому колонка приведена у рівновагу буферним розчином, що використовується як елюювальний на попередній стадії 2 Спосіб за п. 1, який відрізняється тим, що фільтрат після колонки з желатин-сефарозою, яка містить фактор Віллебранда, збирають, розливають по флаконах індивідуальних дозувань і потім ліофілізують. 3. Концентрат фактору Віллебранда, одержаний способом за п. 1 або 2, зі специфічною активністю, що відповідає 345 Eg СВА/мг білка і 186-220 EgR Со/мг білка, який характеризується відношенням активності, що вимірюється в одиницях СВА, до кількості антигену, рівним, принаймні, 1,5 та який складається більше ніж на 65-80% з мультимірних форм з високою молекулярною масою. телію судин, таким чином, сприяючи швидкому загоєнню ушкоджених судин Уроджена нестача ФфВ чи структурна аномалія цього фактора призводять до хвороби фон ВІлебранда, яка спочатку набуває форми кровотечі, зокрема шкірних та з слизових оболонок Клінічні форми, що їх набуває це захворювання, вельми різноманітні і викликають значні проблеми у разі хірургічного втручання. Лікування хвороби фон ВІлебранда є важливим для корегування аномалій первинного гемостазу (часу кровотечі) та коагуляції (час активованого цефаліну і дії Фактору VIII). Лікування хвороби здійснюють шляхом замісної терапії з використанням багатих на ФфВ похідних плазми людини (наприклад, осадженої заморожуванням фракції плазми чи концентратів Фактору VIII, що містять достатню кількість ФфВ). Однак, ці продукти не є стандартизованими для лікування хвороби фон Вілебранда. Крім того, недостатньо очищені фракції плазми крові, особливо ті, що їх було осаджено заморожуванням, не виключають ризику вірусного зараження, оскільки їх часто не піддають ніякій ефективній обробці, що інактивує віруси. Ще вони спричинюють появу надлишку контамінуючих білків, які зовсім не О CM со CM 150 од РК/мл). Таким чином, механічної дії ультра фільтрування, яка була б потрібною для концентрування продукту, можна уникнути Елюйовану у такий спосіб фракцію піддають афінній хроматографії на гелі, що є похідним желатину, у тому самому зрівноважувальному буферному розчині, уникаючи таким чином етапу діалізу чи ультрафільтрації для модифікації складу солі, ця колонка відіграє важливу роль й утриманні молекул залишкового фібронектину, який все ще забруднює ФфВ. Вибір гелю-похідного желатину не є вирішальним, одпак придашими є GelatinSepharose, Gelatin-Ultrogei®, Gelatin-Spherodex ® та Gelatm-FractogeKD. GeSatin-Sepharose [желатннсефароза] може є кращим вибором, оскільки він утримує від 5 до 10 мг фібронекшну/мл гелю за умов, що використовуються у цьому винаходу. За умов, що використовуються, внсокоочищений ФфВ не зв'язується з гелем І, отже, елююється у фільтраті; оскільки желатино-афінний етап не викликає надмірного розрідженая ФфВ фракції, продукт можна одержувати безпосередньо, тобто немає необхідності у виконанні етапу концентрації, наприклад, ультрафільтрації Відсутність протеолітичних ферментів у кінцевому продукті робить його дуже стабільним під час стерильного фільтрування й висушування заморожуванням, отже немає потреби у стабілізуючих агентах. Концентрат фактору фон Вілебранда, одержаний із застосуванням процесу ВІДПОВІДНО ДО ЦЬОГО винаходу, має виключ-ю високий коефіцієнт очищення, що понад 10,000 разів бьчошє порівняно з первісною плазмою, і його специфічна дія становить 345 од КЗД/мг протеїну (одиниці виміру колаген зв'язувальної дії), та > 100 сд РКАлг протеїну (одиниці дії кофактору ристоцетину) Внесок кожного етапу хроматографії очищення ФфВ проілюстровано на фіг. 1, де кріопреципітат; ряд 2 SO-обробленний кріопреципітат; ряд З- незв'язана фракція DEAE fractogel; ряд 4: перший елюат ФфВ, ряд 5: другий елюат ФфВ, ряд 6 незв'язана желатинова фракція, ряд 7. стандарт. Fbn = фібронектин; lgG= імуноглобулін; АІЬ = альбумін. Важливо зазначити, що підвищення якості продукту під час послідовних етапів очищення спостерігали як функцію від частини високомолекулярних мультимерів (молекулярних форм ФфВ з високою біологічною ктивністю), як це детектували, виконуючи електрофорезний аналіз. Цікавим є те, що цей, аналіз показує, поступове збагачення на мультимери > 4 (фіг. 2): ультимений розподіл фракцій очищення ффВ. Ряд 1: нормальна плазма; ряд 2: кріопреципітат; ряд 3: SD-оброблений кріопреципітат, ряд 4. незв'язана фракція DEAEFractogel; ряд 5. перший елюат ФфВ; ряд 6. другий елюат ФфВ; ряд 7 незв'язана желатинова фракція), що представляє 79% полімерів ФфВ, хоча кріопреципітація елімінує половину їх. Несподівано виявилось, що саме хроматографія на DEAE-Fractogel TSK 650 сприяє такому селективному утриманню дуже великих мультимерів і вилучає з фільтратом форми малого розміру, з ненормальною структурою {що пройшли частковий протеоліз) та низькою активністю Стандартизований концентрат ФфВ високої чистоти, з високою специфічною активністю та високим вмістом мультимерів з великою молекулярною вагою, який одержують у процесі відповідно до цього винаходу, є, таким чином, особливо підхожим для терапевтичного застосування при лікуванні різноманітних форм хвороби фон Вілебранда, як вже підтверджено попередніми клінічними дослідженнями. Попередні клінічні випробування показали, що цей концентрат забезпечував ефективне зменшення часу кровотечі. Тести in vitro підтвердили, що його біохімічні й фізіологічні властивості є ідентичними до властивостей нативної молекули, зокрема, це стосується його здатності згущувати кров'яні тромбоцити у приладі переливання крові та його здатності зв'язувати in vivo ендогенний Фактор VIII. Завдяки своїй високій чистоті, ФфВ, одержаний у процесі відповідно до цього винаходу, можна застосовувати у різноманітних лабораторних дослідженнях (тонкий структурний аналіз, функціональні дослідження, діагнози тощо) та для продукування специфічних антитіл. Концентрат ВІДПОВІДНО до цього винаходу може також використовуватись як стабілізатор у продукуванні Фактору VIII клітинами, які було трансформовано шляхом генної інженери, а також у очищенні Фактору VIM, продукованого у такий спосіб Наведений далі приклад Ілюструє одну з форм втілення цього винаходу, не обмежуючи, однак, його обсягу. ПРИКЛАД Вихідний матеріал Кріопреципітат готується з свіжої плазми, зібраної у присутності цитрату натрію (4%) або ЦФД (цитрату, фосфату, декстрози) протикоагуляційного розчину та замороженої максимум на 6 27732 годин після одержання Плазму заморожують при 6О°С, потім зберігають при -35°С Партії плазми об'ємом 1800 - 2000 літрів зливають у 4000-літрові парти для кожного здійснення процесу Щоб розтопити плазму, її приміщують у камери з регульованою температуру на 12 годин, забезпечуючи повтьне, однорідне нагрівання до -7°С, потім розтоплюють у контрольованій термостатом посудині при 0 - 2°С, безперервно перемішуючи Цей Крюпрециштат (який складає близько 9 г/л плазми) одержують шляхом холодного центрифугування Після центрифугування одержаний крюпрециштат знов розчиняють та адсорбують на гідроксиді алюмінію, щоб вилучити деякі забруднювачі, тобто компоненти протромбжового комплексу (особливо Фактор VII) та Фактор XII Потім верхній шар, що відстоявся, охолоджують до І5°С (що частково вилучає фібриноген та фібронектин) Така обробка дозволяє одержати від 80 до 86% суміші Фактору VIII/ФфВ з крюпреципітату, специфічна активність Фактору VIII становить 0 7 МО/мг, а специфічна активність ФфВ - 0,6 од РК/мг (активність кофактору ристоцетину) й 1,2 од КЗД/мг (колаген зв'язувальна дія) Обробка для інактивування вірусів Розчин, що містить суміш Фактору VIII/ФфВ піддають обробці розчини и ком-дєтергентом який як відомо, є ефективним у руйнуванні вірусів з ЛІПІДНОЮ оболонкою (Horowits et a l , Transfusion, 1985, 25 516), і інкубуванню протягом 8 годин при 25°С в присутності 0,3% три-н-бутил фосфату (TnBP)Ta1%Tween80 Після цієї обробки одержують 95% активності Фактору VIII та ФфВ, що її виміряно на попередньому етапі Можна використати елеістрофорез, щоб переконатись у тому, що ФфВ все ще перебуває у мільтимерній формі Процес хроматографічного розподілу Очищення ФфВ одержаного у процесі очищення Фактору VIII, викладено Заявником у Європейській патентній заявці № ЕР 0 359 593 Перша хроматографія виконується на колонці DEAE Fractogel® TSK 650 (Тип 3 чи М) (Мегск) Зрівноважувальний буферний розчин містить тринатрій цитрат (0,01 М), хлорид кальцію (0 001 М), гліцин (0,12 М), L-лізин (0,016 М) та 0,11 М хлориду натрію) ФфВ, Фактор VIII та фібронектин утримуються колонкою, забруднюючі протеїни (в основному фібриноген та якась КІЛЬКІСТЬ IgG), слабко зв'язані або не зв'язані колонкою, та стерилізуючі віруси агенти вилучаються кількома послідовними промиваннями тим самим буферним розчином Колонка використовується при ЛІНІЙНІЙ ШВИД КОСТІ потоку 100 см/год За цих робочих умов використовувана колонка має ємність утримання ФфВ приблизно 75% від введеної кількості (виміряно як антиген, Ад), решта втрачається у фільтраті Зв'язувальна спроможність відповідає 45 од ФфВ аг/мл гелю ФфВ десорбуеться з колонки при збільшенні концентрації NaCt у буферному розчині до 0,15 М Зібрана фракція ФфВ містить від ЗО до 35% первісного ФфВ, 40% його залишається співадсорбованим з Фактором VIII, який буде співелюйовано при другому збільшенні концентрації NaCI у буферному розчині до 0,25 М і потім співочищено Фракція що містить ФфВ елюйована з першої колонки, знову вводиться у другу ідентичну колонку після незначного розведення зрівноважувальним буфером, яке потрібне для регулювання іонної сили фракції ФфВ у бік зменшення до еквіваленту 0 11 М хлориду натрію Оскільки забруднювачі та Фактор VIII, які конкурували з ФфВ за місця адсорбції у першій колонці, майже повністю вилучено під час першого етапу хроматографії, зв'язувальна спроможність другої колонки виявляється значно більшою 320 од ФфВ аг/мл гелю ФфВ десорбується шляхом збільшення концентрації NaCI у буферному розчині до 0 17 М Друга хроматографія дає концентрацію, у 8 10 разів більшу, ніж попередня, що виключає потребу у будь-яких додаткових етапах концентрування, що проводиться наприклад, шляхом ультрафільтрування При використанні стандартних методів було виявлено, що елюат містить такі КІЛЬКОСТІ ФфВ чи має такі активності - Антиген (А§) 88±9 МО/мл - Ристоцетин кофактор (РК) 97± 19 МО/мл - Колаген зв'язувальна дія (КЗД) 149± 13 МО/мл - Високомолекулярні мультимери (>4 мультимери) 79 % КІЛЬКІСТЬ ОДИНИЦЬ КЗД (колаген зв'язувальної дії) визначається EL1SA, як описано Brown та Bosak (Tromb Res 1986, 43 303) Стандартна плазма відкалібрована проти 2-го Британського Стандарту (86/717) використовувалась як опорна для вираження величин у міжнародних одиницях Відношення КЗД/аг, яке дорівнює 1,69, показує, що активність ФфВ добре збереглася Це відповідає високому процентному вмісту мультимерів з великою молекулярною вагою (79%) і вигідно відрізняється від нативного ФфВ (70%) з плазми Елекрофорезний аналіз цього ФфВ елюату показує наявність незначного забруднення фібронектином та інгібітором інтер-альфа трипсину, інгібітором серин-протеази Потім другий елюат ФфВ піддають третьому етапу очищення на колонці желатин-Сефарози СІ4В (Pharmacia), зрівноваженій елюювальним буферним розчином і попередньої колонки з метою вилучення фібронектину Цей афінний хроматографічний гель має фібронектин утримувальну ємність понад 5 мг/мл, що дає змогу зменшити вміст цього забруднювача у фракції ФфВ до недетектованого рівня ( 10 000. Електрофорезнии аналіз (SDS-агароза та сканування смуг) показує, що ФфВ, одержаний внаслідок проведення зазначеної процедури очищення, складається з 65 - 80% високомолекулярних мультнмерів, тобто частину, порівнянну з тією, що спостерігається у первісній плазмі, а саме 70%. Стабільність концентрату досліджували у рідкому стані при кімнатній температурі протягом 24 годин: не спостерігали жодної ознаки протеолітичної активності чи будь-якої зміни у специфічній активності. Фиг. 1 4 Фиг. 2 27732 ДП "Український інститут промислової власності" (Укрпатент) Україна, 01133, Київ-133, бульв. Лесі Українки, 26 (044) 295-81-42, 295-61-97 Підписано до друку StQty 2001 p. Формат 60x84 1/8. Обсяг І) -// обл.-вид.арк Тираж 50 прим. Зам. fy/6 УкрІНТЕІ, 03680, Київ-39 МСП, вул. Горького, 180. (044) 268-25-22
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for preparation of a standardized human von willebrand factor concentrate and a concentrate prepared thereby
Автори англійськоюBurnouf Miryana, BURNOUF THIERRY
Назва патенту російськоюСпособ приготовления стандартизированного концентрата фактора виллебранда человека и концентрат, полученный этим способом
Автори російськоюБюрнуф Мирьяна, Бюрнуф Тьерри
МПК / Мітки
МПК: C07K 14/47, A61P 7/00, A61K 38/00, C07K 14/435, C07K 14/755, A61K 35/16, A61P 7/04, C07K 1/18, C07K 14/745, C07K 1/22
Мітки: цим, стандартизованого, одержаний, концентрат, спосіб, концентрату, фактору, способом, приготування, віллебранда, людини
Код посилання
<a href="https://ua.patents.su/6-27732-sposib-prigotuvannya-standartizovanogo-koncentratu-faktoru-villebranda-lyudini-ta-koncentrat-oderzhanijj-cim-sposobom.html" target="_blank" rel="follow" title="База патентів України">Спосіб приготування стандартизованого концентрату фактору віллебранда людини та концентрат, одержаний цим способом</a>
Попередній патент: Система поверхневого електричного нагрівання
Наступний патент: Спосіб лікування раку сечового міхура
Випадковий патент: Спосіб одержання магнітного шаруватого матеріалу