Синтез a-хлор- або фторкетонів
Номер патенту: 57001
Опубліковано: 16.06.2003
Автори: Тшаєн Девід М., Фрей Лайза Ф., Тілльєр Річард Д., Доллінг Ульф Х.
Формула / Реферат
1. Спосіб одержання ![]() -хлор- або фторкетону формули І
-хлор- або фторкетону формули І
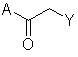 (I),
(I),
де Υ являє собою хлор або фтор, і А являє собою вуглецевий нуклеофіл, що включає:
(а) взаємодію металоорганічного реагенту формули II
А - Μ (II),
де Μ являє собою Li або Mg, зі сполукою формули III
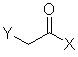 (III),
(III),
де Χ являє собою -NR(OR1), R та R1 кожен незалежно є лінійним або розгалуженим С1-3-алкілом, С3-6-циклоалкілом, або необов'язково заміщені С1-3-алкоксигрупою, фенілом, заміщеним фенілом, де замісник у фенілі вибирають з-поміж F, Сl, Вr, метилтіогрупи, -ОН, метоксигрупи, амінотіогрупи та С1-3-алкілу, в органічному апротонному розчиннику, і
(б) взаємодію, без додаткового очищення, продукту зі стадії (а) з водним розчином кислоти G, з одержанням фази органічного апротонного розчинника, що містить сполуку формули І, і водної фази розчинника, що містить сполуку формули III'
HNR(OR1) · G (III').
2. Спосіб за п. 1, в якому Υ є хлором, та кислоту G вибирають з групи, що складається з хлористоводневої, бромистоводневої, сірчаної, метансульфонової, толуолсульфонової, фосфорної кислоти.
3. Спосіб за п. 1, в якому органічний апротонний розчинник вибраний з групи, що складається з діетилового ефіру, ди-н-бутилового та діізопентилового ефірів, анізолу, циклічних ефірів, таких як тетрагідропіран, 4-метил-1,3-діоксан, тетрагідрофурфурилметиловий ефір, етиловий ефір, фуран і тетрагідрофуран або їх суміш.
4. Спосіб за п. 1, у якому вуглецевий нуклеофіл А є необов'язково заміщеним:
(1) фенілом,
(2) 3,4-диметоксифенілом,
(3) бензофуранілом,
(4) фуранілом,
(5) імідазолілом,
(6) індолілом,
(7) ізотіазолілом,
(8) піразинілом,
(9) піразолілом,
(10) піридилом,
(11) піримідилом,
(12) піролілом,
(13) тіазолілом,
(14) тієнілом,
(15) триазолілом,
(16) С1-10-алкілом,
(17) С2-3-алкенілом,
(18) С2-3-алкінілом,
де замісник вибирають з-поміж F, Сl, Вr, метилтіогрупи, -ОН, метоксигрупи, амінотіогрупи, С1-3-алкілу, С2-3-алкенілу та С2-3-алкінілу.
5. Спосіб за п. 4, а якому вуглецевий нуклеофіл є необов'язково заміщеним
(1) фенілом,
(2) 3,4-диметоксифенілом,
(3) бензофуранілом,
(4) тієнілом,
(5) С1-10-алкілом,
(6) С2-3-алкенілом,
(7) С2-3-алкінілом,
де замісник вибирають з-поміж F, Сl, Вr, метилтіогрупи, -ОН, метоксигрупи, амінотіогрупи та С1-3-алкілу.
6. Спосіб за п. 1, в якому R та R1 кожен вибирають з-поміж лінійного або розгалуженого С1-3-алкілу, С3-6-циклоалкілу, або необов'язково заміщені С1-3-алкоксигрупою, фенілом, заміщеним фенілом, де замісник у фенілі вибирають з-поміж F, Сl, Вr, метилтіогрупи, -ОН, метоксигрупи, амінотіогрупи та С1-3-алкілу.
7. Спосіб за п. 1, у якому сполука формули І являє собою
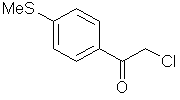 ,
,
сполука формули II являє собою
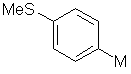
та X являє собою -NСН3(ОСН3).
8. Спосіб одержання ![]() -хлор або фторкетону формули І
-хлор або фторкетону формули І
 (I),
(I),
де Υ являє собою хлор або фтор, і
А являє собою вуглецевий нуклеофіл, що включає:
(а) взаємодію металоорганічного реагенту формули II
А - Μ (II),
де Μ являє собою Li або Mg, зі сполукою формули III
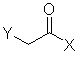 (III),
(III),
де Χ являє собою -NR(OR1), R та R1 кожен незалежно є лінійним або розгалуженим С1-3-алкілом, С3-6-циклоалкілом, або необов'язково заміщені С1-3-алкоксигрупою, фенілом, заміщеним фенілом, де замісник у фенілі вибирають з числа F, Сl, Вr, метилтіо, -ОН, метоксигрупи, амінотіогрупи та С1-3-алкілу, в органічному апротонному розчиннику, і
(б) взаємодію, без додаткового очищення, продукту зі стадії (а) з водним розчином кислоти G з одержанням фази органічного апротонного розчинника, що містить сполуку формули І, і водної фази розчинника, що містить сполуку формули III'
HNR(OR1) · G (III'),
відділення органічної фази з одержанням сполуки формули І та ацилювання водної фази, що містить гідрохлорид HNR(OR1), хлорацетилхлоридом у двофазній суміші водної основи та нереакційноспроможного водонерозчинного органічного розчинника з одержанням сполуки формули III, де двофазну суміш рециклюють та проводять реакцію з сполукою формули II, щоб безперервно повторювати одержання сполуки формули І.
Текст
1 Спосіб одержання а -хлор- або фторкетону формули І (І), де Y являє собою хлор або фтор, і А являє собою вуглецевий нуклеофіл, що включає (а) взаємодію металоорганічного реагенту формули II А - М (II), де М являє собою Li або Мд, зі сполукою формули (НІ), де X являє собою -NR(OR1), R та R1 кожен незалежно є ЛІНІЙНИМ або розгалуженим Сі з-алкілом, Сз б-циклоалкілом, або необов'язково заміщені Сі з-алкоксигрупою, фенілом, заміщеним фенілом, де замісник у фенілі вибирають з-поміж F, СІ, Вг, метилтюгрупи, -ОН, метоксигрупи, амінотюгрупи та Сі з-алкілу, в органічному апротонному розчиннику, і (б) взаємодію, без додаткового очищення, продукту зі стадії (а) з водним розчином кислоти G, з одержанням фази органічного апротонного розчинника, що містить сполуку формули І, і водної фази розчинника, що містить сполуку формули III' HNR(OR1) G (III1) 2 Спосіб за п 1, в якому Y є хлором, та кислоту G вибирають з групи, що складається з хлористоводневої, бромистоводневої, сірчаної, метансульфонової, толуолсульфонової, фосфорної кислоти 3 Спосіб за п 1 , в якому органічний апротонний розчинник вибраний з групи, що складається з діетилового ефіру, ди-н-бутилового та дмзопентилового ефірів, анізолу, циклічних ефірів, таких як тетрапдропіран, 4-метил-1,3-дюксан, тетрапдрофурфурилметиловий ефір, етиловий ефір, фуран і тетрапдрофуран або їх суміш 4 Спосіб за п 1, у якому вуглецевий нуклеофіл А є необов'язково заміщеним (1) фенілом, (2) 3,4-диметоксифенілом, (3) бензофуранілом, (4) фуранілом, (5) імідазолілом, (6) ІНДОЛІЛОМ, (7) ізотіазолілом, (8) піразинілом, (9) піразолілом, (10) піридилом, (11) піримідилом, (12) піролілом, (13) тіазолілом, (14) ТІЄНІЛОМ, (15) триазолілом, (16) Сі ю-алкілом, (17) Сг з-алкенілом, (18) Сг з-алкінілом, де замісник вибирають з-поміж F, СІ, Вг, метилтюгрупи, -ОН, метоксигрупи, амінотюгрупи, Сі залкілу, Сг з-алкенілу та C-z з-алкінілу 5 Спосіб за п 4, а якому вуглецевий нуклеофіл є необов'язково заміщеним (1) фенілом, (2) 3,4-диметоксифенілом, (3) бензофуранілом, (4) ТІЄНІЛОМ, (5) Сі ю-алкілом, (6) Сг з-алкенілом, (7) Сг з-алкінілом, де замісник вибирають з-поміж F, СІ, Вг, метилтюгрупи, -ОН, метоксигрупи, амінотюгрупи та Сі залкілу О о о 1^ ю 57001 4 1 6 Спосіб за п 1, в якому R та R кожен вибирають A - M (II), з-поміж ЛІНІЙНОГО або розгалуженого Сі з-алкілу, де М являє собою Li або Мд, зі сполукою формули Сз б-циклоалкілу, або необов'язково заміщені С-і залкоксигрупою, фенілом, заміщеним фенілом, де замісник у фенілі вибирають з-поміж F, СІ, Вг, метилтюгрупи, -ОН, метоксигрупи, амінотюгрупи та Сі з-алкілу (НІ). де X являє собою -NR(OR ), R та R кожен неза7 Спосіб за п 1, у якому сполука формули І являє лежно є ЛІНІЙНИМ або розгалуженим Сі з-алкілом, собою Сз б-циклоалкілом, або необов'язково заміщені Сі MeS з-алкоксигрупою, фенілом, заміщеним фенілом, де замісник у фенілі вибирають з числа F, СІ, Вг, метилтю, -ОН, метоксигрупи, амінотюгрупи та Сі залкілу, в органічному апротонному розчиннику, і (б) взаємодію, без додаткового очищення, продукту зі стадії (а) з водним розчином кислоти G з одесполука формули являє собою ржанням фази органічного апротонного розчинниMeS. ка, що містить сполуку формули І, і водної фази розчинника, що містить сполуку формули III' HNR(OR1) G (III1), відділення органічної фази з одержанням сполуки та X являє собою -NCH3(OCH3) формули І та ацилювання водної фази, що містить 8 Спосіб одержання а -хлор або фторкетону фопдрохлорид HNR(OR1), хлорацетилхлоридом у рмули І двофазній суміші водної основи та нереакційноспроможного водонерозчинного органічного розчинника з одержанням сполуки формули III, де двофазну суміш рециклюють та проводять реакцію з (І), сполукою формули II, щоб безперервно повторюде Y являє собою хлор або фтор, і вати одержання сполуки формули І А являє собою вуглецевий нуклеофіл, що включає (а) взаємодію металоорганічного реагенту формули II Ця заявка стосується вдосконаленого способу одержання а-хлоркетонів, таких як 4(метилтю)-2-хлорацетофенон, сполук, які є проміжними сполуками, придатними для одержання певних нестероідних протизапальних засобів Див , наприклад, WO 95/00501, що її опубліковано 5 січня 1995р , яку включено до опису як посилання Синтез а-хлоркетонів, таких як 4-(метилтю)2-хлорацетофенон 1, MS e можливий шляхом ацилювання за ФриделемКрафтсом тюанізолу похідними хлороцтової кислоти та шляхом прямого галогенування 4(метилтю)ацетофенону, однак обидва ці підходи є проблематичними Наприклад, у той час як ацилювання тюанізолу за Фриделем-Крафтсом із застосуванням ацетилхлориду-АІСЬ є ефективним способом (вихід >90%, 100 1 пара орто), використання АІСІз-хлорацетилхлориді таким не є (вихід 10%) дигалогенованого кетону, який тяжко вилучили шляхом кристалізації Більш ТОГО, численні літературні регламентовані методики синтезу кетонів на основі ацилювання металоорганічних реагентів часто не є застосовними для синтезу а-галогенованих кетонів Див Comprehensive Orhamc Synthesis, Pergamon 1991, т і , 397 та Fnour G , Cahiez G , NOrmant J F , Synthesis 37, 1984, або ванадійорганічні реагенти - Нігао Т , Misu D, Yao К , Agawa T , Tetrahedron Lett 929, 1986 He дивно, що реакції металоорганічних реагентів 2 (M=Li, MgBr, ZnBr/CI, MnCI тощо) з різноманітними похідними хлороцтової кислоти 3 (наприклад хлорангідрид, ангідрид, імідазолід та нітрил кислоти) вели до 1 з низьким виходом, в основному внаслідок надприєднання та/або енолізацм продукту реагентом MS e 2 2а HfeMgBr 2Ь M*U З за Х-С! ЗЬ Х=Ша{0Ме) Несподівано, вдалося знайти новий і ефективний синтез 1 та інших а-хлоркетонів шляхом реакції М-метокси-М-метилхлорацетаміду ЗЬ з металоорганічними реагентами Винахід стосується способу одержання ахлор або а-фторкетонів, таких як 4-(метилтю)-2хлорацетофенон, сполук, що є проміжними спо 57001 луками, придатними для одержання нестероідних протизапальних засобів У одному аспекті винахід стосується способу одержання а-хлор або фторкетону формули І О (І) де Y являє собою хлор або фтор, і А являє собою вуглецевий нуклеофіл, що включає (а) взаємодію металоорганічного реагенту формули II А - М (II) де М являє собою Li або Мд, з сполукою формули III, О (ПІ) 1 де X являє собою -NR(OR ), R та R1 кожен незалежно є ЛІНІЙНИМ або розгалуженим Сі залкілом, Сз б-циклоалкілом, утворюють кільце або необов'язково заміщені С і з-алкоксигрупою, фенілом, заміщеним фенілом, де замісник у фенілі вибирають з числа F, СІ, Вг, метилтю, -ОН, метоксигрупи, амінотюгрупи та Сі з-алкілу, в органічному апротонному розчиннику, і (б) взаємодію, без додаткового очищення, продукту з стадії (а) з водним розчином кислоти G, з одержанням фази органічного апротонного розчинника, що містить сполуку формули І, і водної фази розчинника, що містить сполуку формули III' HNR(OR1)-G (III') У більш прийнятному аспекті цього винаходу Y є хлором Водну та органічну фази можна поділити за допомогою стандартних засобів розподілу рідина/рідина, таких як декантація або центрифугування Для цілей цього опису кислота G включає хлористоводневу, бромистоводневу, сірчану, метансульфонову, толуолсульфонову, фосфорну кислоту тощо, але не обмежується ними Для цілей цього опису органічний апротонний розчинник включає ефірні розчинники, що включають діетиловий ефір, ди-н-бутиловий та дмзопентиловий ефіри, анізол, ЦИКЛІЧНІ ефіри, такі як тетрапдропіран, 4-метил-1,3-дюксан, тетрапдрофурфурилметиловий ефір, етиловий ефір, фуран татетрапдрофуран, але не обмежуються ними Для цілей цього опису вуглецевий нуклеофіл А визначено так, що він включає необов'язково заміщений (1) феніл, (2) 3,4-диметоксифеніл, (3) бензофураніл, (4) фураніл, (5) імідазоліл, (6) ІНДОЛІЛ, (7) ізотіазоліл, (8) піразиніл, (9) піразоліл, (10) піридил, (11) піримідил, (12) піроліл, (13) тіазоліл, (14)ТІЄНІЛ, (15) триазоліл, (16) Сі ю-алкіл, (17) Сг з-алкеніл, (18) Сг з-алкініл, де замісник вибирають з-поміж F, СІ, Вг, метилтюгрупи, -ОН, метоксигрупи, амінотюгрупи, Сі з-алкілу, Сг з-алкенілута C-z з-алкінілу Реакційній стадії (а) дають можливість протікати, аж доки вона не буде по суті завершена протягом 10 хвилин - 3 годин Мольне відношення сполуки формули II до сполуки формули III як правило становить 1 1 чи більше (тобто надлишкова КІЛЬКІСТЬ сполуки формули II), більш прийнятно від 1 1 до 1,2 1 Реакцію можна проводити при температурі від -ЗО до 20°С, більш прийнятно від Одо 10°С Реакційній стадії (б) дають можливість протікати, аж доки вона по суті не завершиться протягом 5 хвилин - 3 годин, як правило порядку 15хвил Мольне відношення кислоти до сполуки формули III як правило становить 1 1 або більше (надлишок кислоти), більш прийнятно від 1 1 до 1,2 1 Реакцію можна проводити при температурі від -10 до 20°С, більш прийнятно від 0 до 5°С У рамках цього аспекту, існує варіант способу, в якому сполука формули І являє собою MaS. сполука формули II являє собою MeS та X являє собою -NCH3(OCH3) У другому аспекті винахід стосується способу одержання сполуки формули III де X являє собою -NR(OR1), де R та R1 описано вище, який включає ацилювання пдрохлориду HNR(OR1) хлорацетилхлоридом в двофазній суміші водної основи та нереакційноспроможного водонерозчинного органічного розчинника з одержанням сполуки формули III Для цілей цього опису, основа включає як органічні основи, включаючи піридин, три-Сі залкіламш, так і неорганічні основи, включаючи гідроксид натрію, гідроксид калію, карбонат чи бікарбонат натрію, або карбонат чи бікарбонат калію Для цілей цього опису, нереакційноспроможні водонерозчинні органічні розчинники включають толуол, метил-трет-бутиловий ефір (МТВЕ), гексан, гептан, метиленхлорид, дихлоретан, дихлорбензол, монохлорбензол, але не обмежуються ними Реакції дозволяють протікати, аж доки вона по суті не завершиться протягом 5 хвилин - 1 години Мольне відношення HNR(OR1) до хлора 57001 цетилхлориду як правило становить 1 1 або більше (тобто, надлишок хлорацетилхлориду), більш прийнятне від 1,1 1 до 1,21 Реакцію проводять при температурі від -10 до 20°С, більш прийнятне від 0 до 5°С Більш прийнятна методика одержання сполуки формули III включає відділення від продукту реакційної стадії (б) водної фази розчинника, причому зазначена водна фаза розчинника містить сполуки формули III', та взаємодію, без додаткового очищення, водної фази розчинника з хлорацетилхлоридом у двофазній суміші водного К2СО3 та МТВЕ або толуолу з одержанням сполуки формули III Реакції дозволяють протікати, аж доки вона по суті не завершиться протягом 5-50 хвилин Мольне відношення сполуки III' до К2СО3 як правило становить від 1 2 до 1 3 (тобто, надлишок основи), більш прийнятно 1 2,5 Концентрація хлорацетилхлориду в органічному розчиннику (МТВЕ або толуолі) становить 0,2-0,5М, більш прийнятно 0,5М Відношення органічного розчинника до водного розчину становить від 1 1 до 2 1 (надлишок органічного розчинника), більш прийнятно 1 1 Реакцію проводять при температурі від 10 до 5°С, більш прийнятно від 0 до 5°С Одна з цілей винаходу полягала в тому, щоб розробити практичний синтез аміду ЗЬ Повідомлялося про неводне ацилювання (EtsN, CH2CI2) пдрохлориду г\І,О-диметилпдроксиламіну хлорацетилхлоридом Див Nuzillard J -М , Boumendjeil G , Massiot G , Tetrahedron Lett, 30 (29) 3779, 1989 Це здійснювали шляхом ацилювання пдрохлориду г\І,О-диметилпдроксиламіну хлорацетилхлоридом з використанням двофазної суміші водного К2СО3 і толуолу/МТВЕ Високочистий амід ЗЬ виділяли з дуже добрим виходом (95%) після вилучення розчинника (коли як розчинник використовували МТВЕ) В великомасштабних випробуваннях амід ЗЬ (одержаний з використанням толуолу як розчинника) використовували безпосередньо у вигляді розчину в толуолі (після азеотропного сушіння) для реакцій з металоорганічними реагентами Реакція аміду ЗЬ з реактивом Гриньяра 2а (1М розчин в ІТФ, 1,2екв, одержаний з 4бромтюанізолу) протікала чисто і швидко в ТГФ (реакція закінчилась за 1,5год при 25°С) з одержанням, після водної обробки (2 н НСІ), 4(метилтю)-2-хлорацетофенону 1 з виходом 90% [Вихід визначали шляхом КІЛЬКІСНОГО аналізу ВЕРХ органічного шару після обробки, порівняно з стандартним розчином підданого хроматографії кетону 1] Не спостерігалося надприєднання, та єдиними значними (>0,5%) побічними продуктами були ті, що продукувались при одержанні реактиву Гриньяра [Побічні продукти при утворенні реактиву Гриньяра включали ВІДПОВІДНИЙ фенол (окислення) та біарил (гомосполучення) КІЛЬКІСТЬ першого було значно знижено шляхом знегажування розчинника для реакції, і для гасіння використовували НСІ) Неочищений продукт кристалізували з суміші толуол-гексан (1 2) з одержанням 1 з 80% виходом (чистота >98% згідно з аналізом ВЕРХ) 8 Недолік, часто пов'язаний з використанням г\І-метокси-г\І-метиламідів для синтезу кетонів, полягає у високій вартості пдрохлориду N,0диметилпдроксиламшу Хоча водна обробка регенерує г\І,О-диметилпдроксиламін (або його пдрохлоридну сіль), існує мало, якщо існує, повідомлень відносно його добування з водного екстракту Тепер можливим є рециклювання цього матеріалу шляхом прямого ацилювання N,0диметилпдроксиламшу у водному екстракті з хлорацетилхлоридом Таким чином, після обробки (води НСІ) водний екстракт реагував з хлорацетилхлоридом-КгСОз з одержанням аміду 3 у чистий спосіб (вихід 80% на основі первісне використаного пдрохлориду N,0диметилпдроксиламшу) Цей матеріал повторно використовували в реакціях з реактивом Гриньяра 2а з одержанням 1 без втрат у виході або у чистоті продукту Наведені далі приклади призначені для того, щоб проілюструвати, а не обмежити винахід, у тому вигляді, як він тут описаний Приклад 1 Методика одержання 4-(метилтю)-2хлорацетофенону (1) MeS, MS S 2а МаМдВг 2Ь Розчин ІЧ-метокси-ІЧ-метилхлорацетаміду ЗЬ (26,8г, 195ммоль) в толуолі (250мл, див посилання 9) розбавляють знегаженим ТГФ (530мл) і суміш охолоджують до 0°С Протягом ЗО хвилин (температура розчину
ДивитисяДодаткова інформація
Назва патенту англійськоюSynthesis of 0100090000039d00000002001c00000000000500000009020000000005000000020101000000050000000102ffffff00050000002e0118000000050000000b0200000000050000000c02600160011200000026060f001a00ffffffff000010000000c0ffffff2600000020010000860100000b00000026060f000c004d61746854797065000030001c000000fb0280fe0000000000009001000000020002001053796d626f6c00774000000066040a638f49f5779849f5770100000000003000040000002d01000008000000320a000134000100000061790a00000026060f000a00ffffffff0100000000001c000000fb021000070000000000bc02000000cc0102022253797374656d000000000a000000040000000000ffffffff0100000000003000040000002d01010004000000f001000003000000000000ef00000000-chloro of fluoroketones
Назва патенту російськоюСинтез a-хлор- или фторкетонов
МПК / Мітки
МПК: C07C 319/00, C07D 317/54, C07C 45/00, C07D 333/22, C07C 259/00, C07C 45/45
Мітки: фторкетонів, синтез, a-хлор
Код посилання
<a href="https://ua.patents.su/6-57001-sintez-a-khlor-abo-ftorketoniv.html" target="_blank" rel="follow" title="База патентів України">Синтез a-хлор- або фторкетонів</a>
Попередній патент: Аміди карбамоїлкарбоксилової кислоти, спосіб їх отримання та засіб боротьби з грибами
Наступний патент: Одноківшовий двогусеничний екскаватор
Випадковий патент: Труна збірно-розбірна










