Сполука 2-метил-7-(пара-толіл)-[1,3]тіазоло[4,5-d]піридазин-4(5н)-он, що проявляє [сa2+]і-десенситизуючу активність
Номер патенту: 70455
Опубліковано: 11.06.2012
Автори: Соловйов Анатолій Иванович, Демченко Анатолій Михайлович, Демченко Сергій Анатолійович, Бобкова Людмила Станіславівна, Зеленский Сергій Миколайович, Зеленський Дмитро Сергійович
Формула / Реферат
Сполука 2-метил-7-(пара-толіл)-[1,3]тіазоло[4,5-d] піридазин-4(5H)-он структурної формули:
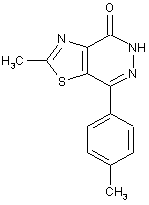 ,
,
що проявляє [Са2+]і -десенситизуючу активність.
Текст
Реферат: 2+ Сполука 2-метил-7-(пара-толіл)-[1,3]тіазоло[4,5-d] піридазин-4(5H)-он, що проявляє [Са ]ідесенситизуючу активність. UA 70455 U (12) UA 70455 U UA 70455 U Корисна модель належить до фармацевтичної хімії та медицини, а саме до одержання біологічно активної речовини 2-метил-7-(пара-толіл)-[1,3]тіазоло[4,5-d]піридазин-4(5H)-он формули: O N NH H3 C N S CH3 5 10 15 20 25 30 35 40 45 , 2+ що проявляє здатність впливати на тонус кровеносних судин як [Са ]і десенситайзер, що дозволяє передбачити можливість її використання в практичній медицині для лікування судинних дисфункцій, а саме при вазоспастичних станах різного ґенезу. Відомо, що дисфункція ендотелію сприяє розвитку тромбозу, неоангіогенезу, ремоделювання судин, внутрішньо-судинної активації тромбоцитів та лейкоцитів. Ендотеліальна вистилка судин регулює місцеві процеси гемостазу, проліферації, міграції клітин крові в судинну стінку та судинний тонус. При дисфункції ендотелію має місце дисбаланс між факторами, що забезпечують ці процеси. Дисфункція ендотелію є обов'язковим компонентом патогенезу хронічної серцевої недостатності (ХСН) [1-4]. Артеріальна гіпертензія (АГ) продовжує домінувати серед серцево-судинних захворювань та основних причин смертності і втрати працездатності населення, незважаючи на інтенсивні дослідження патогенезу та створення цілого ряду нових лікарських препаратів (інгібітори ангіотензинперетворюючого ферменту та блокатори симпатичної нервової системи, Са2+блокатори, діуретики, b-блокатори тощо) [5]. Тривалий час основну роль у розвитку генералізованого вазоспазму приписували нейрогенним впливам [6,7]. На даний час стало зрозумілим, що головна, якщо не вирішальна, роль в його розвитку належить місцевим регуляторним механізмам, локалізованим на рівні ефекторних елементів, тобто ендотелію та гладеньких м'язів (ГМ) судинної стінки [5]. Визначений рівень техніки вказує на необхідність принципово нових лікарських засобів із направленою дією для лікування судинних дисфункцій, а саме - створення принципово нового 2+ класу [Са ]і десенситайзерів. Так звані кальцієві десенситайзери - це сполуки, що мають здатність розслаблювати гладенькі м'язи судин без супутнього зниження [Ca2+]і [5]. Як найближчий аналог вибраний хелеритрин (Chelerytrine chloride-1,2-диметокси-12-метил[1,3]бензодіоксоло[5,6-с]-фенантридин хлорид) [8]. 2+ Хелеритрин характеризується наступними показниками [Са ]і десенситизуючої активності, визначеної при одночасній реєстрації скорочувальної активності та внутрішньоклітинної концентрації іонів кальцію: -5 у концентрації 10 моль/л викликає розслаблення ГМ аорти щурів попередньо активованих фенілефрином, на 30 %; одночасно з ефектом розслаблення ГМ відсутнє зниження концентрації внутрішньоклітинних 2+ іонів кальцію ([Са ]і), рівень якої не тільки не знижується, але дещо зростає, тобто має місце 2+ яскраво виражений ефект дисоціації між концентрацією [Са ]і та силою скорочень судин. Основним недоліком хелеритрину є його токсичність. Так, гостра токсичність хелеритрину (ЛД50) складає 20 мг/кг (білі миші-самці масою 17-19 г). В основу корисної моделі поставлено задачу пошуку нової хімічної речовини, що проявить 2+ [Са ]і-десенситизуючу дію, а також буде характеризуватися низькою токсичністю. Поставлена задача вирішується тим, що як нова хімічна речовина запропонована сполука 2метил-7-(пара-толіл)-[1,3]тіазоло[4,5-d]піридазин-4(5H)-он (сполука 1, шифр ІФТ000077). 2+ Оцінку [Са ]і-десенситизуючої активності 2-метил-7-(пара-толіл)-[1,3]тіазоло[4,5d]піридазин-4(5H)-ону (сполука 1) проводили за методом одночасної реєстрації скорочувальної активності гладеньких м'язів (ГМ) сегментів кровоносних судин та внутрішньоклітинної концентрації іонів кальцію у гладеньком'язових клітинах (ГМК) деендотелізованих судин грудного відділу аорти щурів-самців лінії Вістар-Кіото масою (230±30) г на фоні активації фенілефрином. 1 UA 70455 U -5 5 10 15 20 25 Сполука 1 у концентрації 10 моль/л викликає розслаблення гладеньких м'язів судин в середньому на (107,4±5) % відносно максимального значення скорочення судин фенілефрином -7 (10 моль/л) при статистично достовірній відсутності зниження рівня внутрішньоклітинного 2+ кальцію, тобто може бути класифікована як Са ]і десенситайзер. Вимірювання внутрішньоклітинної концентрації кальцію проводили флуоресцентним методом з використанням барвника Fura-2 за співвідношенням: 2+ [Ca ]i=Kd(R-Rmin)/(Rmax-R)(l380(F)/I380(B)), де Kd - константа дисоціації Fura-2 з кальцієм; R=I340nm/l380nm - відношення інтенсивності флюоресценції при опроміненні досліджуваного об'єкту ультрафіолетом з довжиною хвилі 340 nm (I340nm) та 380 nm (I380nm) відповідно; Rmin - відношення інтенсивностей при відсутності у міоплазмі іонів кальцію; Rmax - граничне значення R, виміряне при насичуючій концентрації 2+ [Са ]і I380(F) та І380(В) - значення I340nm та I380nm при відсутності та при насиченій концентрації 2+ [Са ]і. Для реєстрації флуоресцентного сигналу використовували неінвертований флуоресцентний мікроскоп ЛЮМАМ-И2. Перед початком дослідів вимірювальну апаратуру прогрівали впродовж 30 хв. Досліджувані речовини (сполука 1) та хелеритрин (сполука 2) використовувалися в -5 концентраціях 10 моль/л. 2+ На фіг .1 показана оригінальна крива скорочення та [Са ]і у гладеньком’язових клітинах деендотелізованих фрагментів-кілець грудного відділу аорти щурів на фоні активації -7 фенілефрином (РЕ, 10 моль/л) при дії 2-метил-7-(пара-толіл)-[1,3]тіазоло [4,5-d]піридазин-5 4(5H)-ону (сполука 1) у концентрації 10 моль/л. 2+ На фіг .2 показана оригінальна крива скорочення та [Са ]і у гладеньком’язових клітинах деендотелізованих фрагментів-кілець грудного відділу аорти щурів на фоні активації -7 -5 фенілефрином (РЕ, 10 моль/л) при дії хелеритрину (сполука 2) у концентрації 10 моль/л. Таблиця 2+ Характеристики [Са ]і-десенситизуючої активності 2-метил-7-(пара-толіл)-[1,3]тіазоло[4,5-5 d]піридазин-4(5H)-ону (сполука 1) та хелеритрину (сполука 2) у концентраціях 10 моль/л на фоні 10-7моль активації фенілефрином у концентрації /л Сполука 1 2 2+ Розслаблення ГМ сегментів кровоносних судин, % 107,4±5 30 Зміни [Са ]і у ГМК деендотелізованих судин грудного відділу аорти щурів відсутні не значне зростання 2+ 30 35 40 45 50 Як показано в табл. 1, сполука 1 проявляє [Са ]і-десенситизуючу активність та за силою розслаблення ГМ перевищує хелеритрин. Гостру токсичність визначали за методом "Up-and-Down" [9] на білих безпородних мишахсамцях масою (1749) г при внутрішньо-шлунковому шляху введення. Середньо-смертельна доза для мишей-самців за ліміт-тестом для сполуки 1 становить понад 2000 мг/кг (ІУ клас токсичності за класифікацією Сидорова). Приклади конкретного виконання Приклад 1. Синтез 2-метил-7-(пара-толіл)-[1,3]тіазоло[4,5-d]піридазин-4(5H)-ону (сполука 1). До розчину 1.377 г (0,005 моль) метил 5-(пара-толіл)-2-метил-1,3-тіазоло-4-карбоксилату в 10 мл етанолу додавали 0,01 моль гідразин-гідрату. Реакційну суміш нагрівали на водяній бані протягом чотирьох годин, після чого охолоджували. Осад, що утворився, відфільтровували, промивали o 1 охолодженим етанолом, сушили. Вихід 1.02 г (79 %). Тпл 259-61 С. Спектри ЯМР H (Bruker-300, робоча частота 300 МГц, розчинник ДМСОЧ-d6, внутрішній стандарт - ТМС): 2,36 с (3Н, СН3), 2,84 с (3Н, СН3), 7,34 та 7.60 д-д (4Н, С6Н4), 13,2 с (1Н, NH). Приклад 2. Визначення скорочувальної активності гладеньких м'язів (ГМ) сегментів кровоносних судин та внутрішньоклітинної концентрації іонів кальцію у ГМК деендотелізованих судин грудного відділу аорти щурів-самців на фоні активації фенілефрином. Ізольовані гладеньком'язові препарати з грудного відділу аорти були отримані від дорослих щурів лінії Вістар масою (230±30) г. Сегменти аорти довжиною (1.0-1.5) см відрізали, очищували від сполучної тканини. Після препарування сегменти судин вивертали, та поміщали у завантажувальний розчин (mМ 122 NaCl, 4,7 KСl, 2,5 СаСl2, 1,2 MgCl2, 11,6 HEPES, 11,5 glucose, 2 UA 70455 U 5 10 15 20 25 30 35 40 pH 7,3-7,4; 2,5 % DMSO, 5 mg/ml Pluronic F-127) барвника Fura 2-AM (10 М) при температурі (18-22) °С в захищеному від світла місці на 2 год. Після завантаження зразки судин переносили в розчин Кребса та промивали 30 хв. Потім зразки обробляли фенілефрином (0.1 М). Випробуваний зразок фіксували на гачках датчика скорочень у робочій камері при температурі 36 °C під навантаженням (0,3-0,4) г та перфузували розчином Кребса зі швидкістю 1 мл/хв. протягом 30 хв. Вимірювання проводили за допомогою флуоресцентного методу. Для реєстрації флуоресцентного сигналу використовували неінвертований флуоресцентний мікроскоп ЛЮМАМ-2. Вимірювали відношення R (Ratio340nm/380nm), що відображає зміни концентрації внутрішньоклітинного кальцію, та силу скорочень судини (Force, mN) (фіг. 1, 2). Приклад 3. Визначення токсичності сполук. Гостру токсичність вивчали при внутрішньо-шлунковому шляху введення (білі безпородні миші-самці масою (17-19) г, кількість в кожній групі по 5 осіб) розрахованих доз сполук 1,2 за два прийоми за допомогою металевого зонду (за один прийом 0,4 мл, інтервал між введеннями - 45 хв.). Досліджувані сполуки готували безпосередньо перед введенням експериментальним тваринам, індивідуальні дози розраховували для кожної тварини з урахуванням маси тіла та об'єму суспензії, що була однаковою для всіх тварин. Спостереження за тваринами проводили протягом 14 діб. Контроль виникнення/зникнення клінічних ознак токсичності проводили: у перший день після введення суспензій протягом першої години безперервно, а потім через 2, 3, 5 год.; у наступні 13 днів кожну тварину обстежували два рази на добу. Усі тварини, що вижили по завершенню експерименту, були знеживлені шляхом цервікальної дислокації під ефірним наркозом. Гостру токсичність (ЛД50) розраховували згідно з ліміт-тестом методом "Up-and-Down". 1. Testamariam В. Elevated glucose impairs endotheliummdependent relaxation by activating proo tein kinase С / B. Testamariam, M. L. Brown, R. A. Cohen // J. Clin. Invest.-1991. - V. 87. - P. 1643-1648. 2. Кравчун П.Г., Крапивко С.А., Лесовая М.А. Эндотелиальная дисфункция у больных хронической сердечной недостаточностью и сопутствующим сахарным диабетом 2-го типа и ее коррекция магния оротатом / Медицина сьогодні і завтра.-2009. -№ 3-4. - С. 48-52. 3. Gibbons G. Н. Endothelial function as a determinant of vascular function and structure: an therapeutic target / Am. J. Cardiol.-1997. - V. 79. - P. 3-8. 4. Агеев Ф.Т. Роль эндотелиальной дисфункции в развитии и прогрессировании сердечнососудистых заболеваний // Сердечная недостаточность.-2003. - № 1. - С. 22-25. 5. Соловйов А.І., Зеленський С. М. Нові підходи до фармакологічної корекції артеріальної гіпертензії // Журнал Артериальная гипертензия / Программа профилактики АГ в Украине.2011.- № 1 (15). 6. Віничук С.М. Судинні захворювання нервової системи. - К.: Наукова думка, 1999. - 250 с. 7. Малахов В.А., Ескин А.Р. Роль эндотелиальной дисфункции в формировании и прогрессировании начальных форм сосудистых заболеваний головного мозга / Неврология. режим доступу Неврологический портал. 8. Catalog Research Biochemical International.-1997/1998. - Chelerytrine chloride. - C.194. 9. OECD Guideline for Testing of Chemical. OECD Guideline 425. Acute Oral Toxicity: Up-andDown Procedure // Approved: June 1998, Adopted: March 2006. - Paris: OECD. - 2006.-P. 27. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 45 Сполука 2-метил-7-(пара-толіл)-[1,3]тіазоло[4,5-d] піридазин-4(5H)-он структурної формули: O N NH H3 C N S CH3 , 3 UA 70455 U 2+ що проявляє [Са ]і -десенситизуючу активність. Комп’ютерна верстка Л.Литвиненко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 4
ДивитисяДодаткова інформація
Назва патенту англійськоюCompound 2-methyl-7-(para-tolyl)-[1,3]thiazolo[4,5-d]pyridazine-4(5h)-one exhibiting [ca2+]i -desensitizing activity
Автори англійськоюDemchenko Serhii Anatoliiovych, Bobkova Liudmyla Stanislavivna, Zelenskyi Serhii Mykolaiovych, Soloviiov Anatolii Ivanovych, Zelenskyi Dmytro Serhiiovych, Demchenko Anatolii Mykhailovych
Назва патенту російськоюСоединение 2-метил-7-(пара-толил)-[1,3]тиазоло[4,5-d]пиридазин-4(5н)-он, проявляющий [са2+]i-десенситизирующую активность
Автори російськоюДемченко Сергей Анатолиевич, Бобкова Людмила Станиславовна, Зеленский Сергей Николаевич, Соловьев Анатолий Иванович, Зеленский Дмитрий Сергеевич, Демченко Анатолий Михайлович
МПК / Мітки
МПК: A61K 31/517, C07D 421/00
Мітки: проявляє, 2-метил-7-(пара-толіл)-[1,3]тіазоло[4,5-d]піридазин-4(5н)-он, сполука, активність, сa2+]і-десенситизуючу
Код посилання
<a href="https://ua.patents.su/6-70455-spoluka-2-metil-7-para-tolil-13tiazolo45-dpiridazin-45n-on-shho-proyavlyaeh-sa2i-desensitizuyuchu-aktivnist.html" target="_blank" rel="follow" title="База патентів України">Сполука 2-метил-7-(пара-толіл)-[1,3]тіазоло[4,5-d]піридазин-4(5н)-он, що проявляє [сa2+]і-десенситизуючу активність</a>
Попередній патент: Електромеханічний пристрій для технологічної обробки матеріалів
Наступний патент: Тест-система імуноферментна для кількісного визначення фібриногену в плазмі крові людини
Випадковий патент: Спосіб екстракції речовин рослинного походження










