Похідні 3-арил-2-(діарилгідроксиметил)-4-оксо-3,4-дигідрохіназоліну, які виявляють протисудомну активність
Номер патенту: 95531
Опубліковано: 10.08.2011
Автори: Левашов Дмитро Вікторович, Штриголь Сергій Юрійович, Шемчук Леонід Антонович, Черних Валентин Петрович
Формула / Реферат
Похідні 3-арил-2-(діарилгідроксиметил)-4-оксо-3,4-дигідрохіназоліну загальної формули
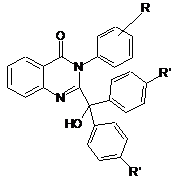 ,
,
де R= о-МеО-
R'=Н- або n-Ме-,
які виявляють протисудомну активність.
Текст
Похідні 3-арил-2-(діарилгідроксиметил)-4оксо-3,4-дигідрохіназоліну загальної формули 2 3 95531 діарею, порушення функцій печінки та підшлункової залози, ізольований ступорозний стан, атаксію, тремор, шкірні висипи, ангіоневротичний набряк, анемію, тромбоцитопенію, збільшення часу кровотечі, лейкопенію тощо. Задачею винаходу є розширення арсеналу протисудомних засобів для покращення якості протисудомної терапії. Поставлена задача вирішується шляхом створення як протисудомних засобів похідних 3-арил2-(діарилгідроксиметил)-4-оксо-3,4дигідрохіназоліну загальної формули: R O N R' N HO R' , R' де R=о-МеО-, R'=H- або n-Ме-. Сполуки, які заявляються, синтезовані шляхом взаємодії 3-арил-2-карбетоксі-4-оксо-3,4дигідрохіназолінів з арилмагнійгалогенідами. Цільові продукти являють собою білі кристалічні речовини, розчинні у диметилсульфоксиді (ДМСО), диметилформаміді (ДМФА), нерозчинні у воді, етанолі та гексані. Будова одержаних сполук підтверджена за допомогою елементного аналіза, 1 ЯМР- Н-спектроскопії. Авторами вперше було виявлено протисудомну дію похідних 3-арил-2-(діарилгідроксиметил)-4оксо-3,4-дигідрохіназоліну в експериментах на мишах із моделлю судом, викликаних тіосемікарбазидом. Протисудомні властивості похідних 3-арил-2(діарилгідроксиметил)-4-оксо-3,4-дигідрохіназоліну не відомі з джерел літератури. Винахід ілюструється наступними прикладами: Приклад 1 Одержання варіанту заявленої сполуки 3-(ометоксіфеніл)-2-(дифенілгідроксиметил)-4-оксо3,4-дигідрохіназоліну (сполука І) при R=H та R= оМеО-. 2,92 г (0,01 моль) 3-(о-метоксіфеніл)-2карбетокси-4-оксо-3,4-дигідрохіназоліну розчиняли у тетрагідрофурані та по краплям додавали до розчину чотирикратну кількість фенілмагнійброміду. Перемішували протягом години, гідролізували реакційну суміш насиченим розчином амонію хлориду, відокремлювали органічний шар та відганяли розчинник. Осад (сполука 1) перекристалізовували із етанолу. Вихід 3,69 г (85%). Т.пл. 145°С. 1 Спектр ЯМР Н, , м.д.: 3,20 с (3Н, ОМе), 6,50 д (1Н, Аr), 6,60 м (2Н, Аr), 6,70 д (1H, Аr), 7,20-7,30 м (11Н, Аr, ОН), 7,50 м (2Н, 6-СН, 8-СН), 7,70 т (1Н, 7-СН), 8,20 д (1Н, 5-СН). Знайдено, %: С 77,40; H 5,11; N 6,46. Вирахувано, %: С 77,39; H 5,11; N 6,45. С28Н22N2О3. 4 Приклад 2 Одержання варіанту заявленої сполуки 3-(ометоксіфеніл)-2-(ди(-nметилфеніл)гідроксиметил)-4-оксо-3,4дигідрохіназоліну (сполука II) при R=H та R=n-Ме-. 2,92 г (0,01 моль) 3-(о-метоксифеніл)-2карбетокси-4-оксо-3,4-дигідрохіназоліну розчиняли у тетрагідрофурані та по краплям додавали до розчину чотирикратну кількість nтолуілмагнійброміду. Перемішували протягом години, гідролізували реакційну суміш насиченим розчином амонію хлориду, відокремлювали органічний шар та відганяли розчинник. Осад (сполука 1) перекристалізовували із етанолу. Вихід 3,93 г (85%). Т.пл. 175°С. 1 Спектр ЯМР Н, , м.д.: 2,20 с (6Н, СН3), 3,20 с (3Н, ОМе), 6,50 д (1Н, Аr), 6,60 д (1Н, Аr), 6,70 д (1Н, Аr), 7,20 м (5Н, Аr, ОН), 7,3 м (4Н, Аr), 7,50 м (2Н, 6-СН, 8-СН), 7,70 т (1Н, 7-СН), 8,20 д (1Н, 5СН). Знайдено, %: С 77,88; Н 5,68; N 6,05, С30Н26N2О3. Вирахувано, %: С 77,89; Н 5,68; N 6,06. Приклад 3 Вивчення протисудомної дії 3-(ометоксифеніл)-2-(дифенілгідроксиметил)-4-оксо3,4-дигідрохіназоліну (сполука І) і 3-(ометоксифеніл)-2-(ди(-nметилфеніл)гідроксиметил)-4-оксо-3,4дигідрохіназоліну (сполука II) проводили у співставленні з препаратом порівняння депакіном на білих мишах самцях масою 10-15 г на моделі судом, яку відтворювали введенням тіосемікарбазиду підшкірно в дозі 25 мг/кг [5]. Для визначення протисудомної активності сполук І і II вводили внутрішньоочеревинно у вигляді суспензії із твіном-80 у дозі 100 мг/кг за 15-20 хв до введення тіосемікарбазиду. Препаратом порівняння вибрано депакін [6] (Sanofi, Франція). .Він містить вальпроат натрію, який інгібує руйнування та стимулює синтез ГАМК. Тому обрання цього препарату відповідає ГАМК-негативному механізму експериментальних судом. Депакін уводили внутрішньошлунково у дозі 150 мг/кг також за 15-20 хв до введення тіосемікарбазиду. Контрольні миші отримували відповідну кількість води для ін'єкцій. Лабораторних тварин розподілили на 5 груп. Перша група - контрольна патологія для похідних 3-арил-2-(діарилгідроксиметил)-4-оксо-3,4дигідрохіназоліну (судомний синдром): 7 тварин, що отримували підшкірно розчин тіосемікарбазиду в дозі 25 мг/кг; друга група - 7 тварин, що отримували перед уведенням тіосемікарбазиду сполуку І в дозі 100 мг/кг внутрішньоочеревинно; третя група - 7 мишей, що отримували перед уведенням тіосемікарбазиду сполуку II у дозі 100 мг/кг внутрішньоочеревинно; четверта група - контрольна патологія для депакіну (судомний синдром): 9 тварин, що отримували підшкірно розчин тіосемікарбазиду в дозі 25 мг/кг; п'яту групу склали 6 мишей, яким уводили депакін у дозі 150 мг/кг внутрішньошлунково і через 15-20 хв - тіосемікарбазид дозі 0,1 мг/кг підшкірно. 5 95531 Як показники протисудомної дії вибрано латентний період першого клонічного судомного нападу, тяжкість судом у балах [7], кількість клонічних і тонічних судом на 1 мишу, кількість тварин із клонічними та тонічними судомами, тривалість життя після введення тіосемікарбазиду (час загибелі), а також летальність у %. У разі обліку результатів у 6 вигляді середня±стандартна помилка статистичну достовірність міжгрупових відмінностей розраховували за критерієм t Стьюдента, у разі реєстрації результатів в альтернативній формі (наявність або відсутність певної ознаки) - за кутовим перетворенням Фішера. Результати дослідження наведені у таблиці 1. Таблиця 1 Вивчення протисудомної активності заявлених сполук Показник Латентний період клоніко-тонічних судом, хв Тяжкість судом, бали Кількість клонічних і тонічних судом на 1 мишу Кількість тварин із клонічними судомами,% Кількість тварин із тонічними судомами, % Час загибелі, хв Летальність, % Похідні 3-арил-2-(діарилгідроксиметил)-4-оксо-3,4Депакін, 150 мг/кг дигідрохіназоліну, 100 мг/кг Контроль (n=8) Сполука І (n=7) Сполука II (n=7) Контроль (n=9) Дослід (n=6) 56,5±4,4 90,0±13,2* 80,4±6,6** 64,5±3,3 57,8±2,8 6,00±0 5,71±0,29 5,42±0,30 6,00±0 5,31±0,28* 2,5±0,57 3,29±0,81 2,86±0,99 3,80±0,47 2,33±0,42* 8/8 100 8/8 100 8/8 100 9/9 100 6/6 100 8/8 100 87,5 6/7 87,5 6/7 9/9 100 6/6 100 73,6±8,4 8/8 100 138±24,1* 8/8 100 98,9±16,7* 6/7 87,5 99,2±14,1 9/9 100 79,8±7,2 6/6 100 Примітки. У числівнику - кількість тварин із наявністю ознаки, у знаменнику - загальна кількість тварин у групі; * - відмінності вірогідні відносно контрольної патології (р≤0,05); ** - відмінності вірогідні відносно контрольної патології (р≤0,01). # Наведено значення для 6 загинувши тварин без урахування миші, яка вижила. З результатів дослідження, наведених у таблиці 1, видно, що введення тіосемікарбазиду в дозі 25 мг/кг мишам контрольної групи в середньому через 56,5 хв спричинило початок клонічних та тонічних судомних нападів, які спостерігались у всіх мишей та закінчувались загибеллю усіх тварин. У середньому на 1 мишу було зареєстровано 2,5 клонічних та тонічних нападів, тяжкість яких складала 6,0 балів. Середній час загибелі тварин з моменту введення судомної отрути становив 73,6 хв. У групі тварин, які отримували сполуку 1, спостерігалось достовірне збільшення латентного періоду судомних нападів у середньому в 1,59 рази та часу життя в 1,88 рази у порівнянні з аналогічним показником у групі контрольної патології. Спостерігалася тенденція до зменшення тяжкості судом. У групі тварин, які отримували сполуку II, спостерігалось достовірне збільшення латентного періоду судомних нападів у середньому в 1,42 рази. Час життя також збільшився - в 1,34 рази (без урахування тварини, яка вижила), тяжкість судом зменшилась. Показник летальності на 12,5% нижче за аналогічний показник в групі контрольної патології (1 тварина з 7 вижила). Введення тіосемікарбазиду четвертій групі тварин (контрольна патологія для депакіну) через в середньому 64,5 хв. призвело до розвитку в усіх тварин тонічних та клонічних судомних нападів середньою тяжкістю 6,0 балів. Середній час загибелі тварин з моменту введення конвульсанту становив 99,2 хв. Профілактичне введення депакіну мишам четвертої групи не привело до достовірного збільшення тривалості латентного періоду судомних нападів та часу загибелі тварин. Референспрепарат лише вірогідно зменшив тяжкість судом (з 6,0±0 до 5,31±0,28, р
ДивитисяДодаткова інформація
Назва патенту англійською3-aryl-2-(diarylhydroxymethyl
Автори англійськоюLevashov Dmytro Viktorovych, Shtryhol Serhii Yuriiovych, Shemchuk Leonid Antonovych, Chernykh Valentyn Petrovych
Назва патенту російськоюПроизводные 3-арил-2-(диарилгидроксиметил)-4-оксо-3,4-дигидрохиназолина, которые проявляют противосудорожную активность
Автори російськоюЛевашов Дмитрий Викторович, Штриголь Сергей Юрьевич, Шемчук Леонид Антонович, Черных Валентин Петрович
МПК / Мітки
МПК: A61K 31/505, A61P 25/08, C07D 239/91
Мітки: 3-арил-2-(діарилгідроксиметил)-4-оксо-3,4-дигідрохіназоліну, протисудомну, активність, похідні, виявляють
Код посилання
<a href="https://ua.patents.su/4-95531-pokhidni-3-aril-2-diarilgidroksimetil-4-okso-34-digidrokhinazolinu-yaki-viyavlyayut-protisudomnu-aktivnist.html" target="_blank" rel="follow" title="База патентів України">Похідні 3-арил-2-(діарилгідроксиметил)-4-оксо-3,4-дигідрохіназоліну, які виявляють протисудомну активність</a>
Попередній патент: Електростатичний генератор
Наступний патент: Домашня базова станція
Випадковий патент: Анти-cd48 антитіло та його застосування








