Спосіб одержання заміщених біфенілів
Формула / Реферат
1. Спосіб одержання заміщених біфенілів формули І
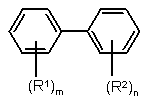 , (I)
, (I)
у якій замісники мають наступні значення:
R1 - нітро, аміно або NHR3;
R2 - ціано, нітро, галоген, С1-С6-алкіл, С2-С6-алкеніл, С2-С6-алкініл, С1-С6-алкокси, С1-С6-галоалкіл, (С1-С6-алкіл)карбоніл або феніл;
R3 - С1-С4-алкіл, С2-С4-алкеніл або С2-С4-алкініл;
m = 1 або 2, причому у випадку, коли m = 2, обидва залишки R1 можуть мати різні значення;
n = 0, 1, 2 або 3, причому у випадку, коли n = 2 або 3, залишки R2 можуть мати різні значення;
який відрізняється тим, що сполука формули II
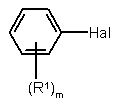 , (II)
, (II)
у якій Hal означає галоген і R1 і m мають вищевказані значення, у присутності основи і паладієвого каталізатора, вибраного із групи: а) паладій-триарилфосфін або триалкілфосфіновий комплекс із паладієм у ступені окислення нуль, b) сіль паладію в присутності триарилфосфіну або триалкілфосфіну як ліганду комплексу або с) металевий паладій, необов'язково нанесений на носій, у присутності триарилфосфіну або триалкілфосфіну у розчиннику, взаємодіє з дифенілборною кислотою (III)
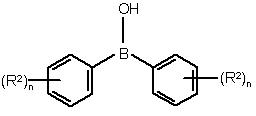 , (III)
, (III)
у якій R2 і n мають зазначені вище значення,
причому використовувані триарилфосфіни або триалкілфосфіни можуть бути заміщеними.
2. Спосіб за п. 1, який відрізняється тим, що як сполуку (II) використовують 2-нітрохлорбензол.
3. Спосіб за п. 1 або 2, який відрізняється тим, що вихідною сполукою (III) є дифенілборна кислота, яка заміщена тільки в 4-положенні.
4. Спосіб за п. 1 або 2, який відрізняється тим, що використовують дифенілборну кислоту (III), яка як єдиний замісник у 4-положенні має фтор, хлор або метилову групу.
5. Спосіб за п. 1 або 2, який відрізняється тим, що вихідною сполукою (III) є ди-(4-хлорфеніл)-борна кислота.
6. Спосіб за пп. 1-5, який відрізняється тим, що як паладієвий каталізатор а) за п. 1 застосовують тетракіс(трифенілфосфін)паладій або тетракіс(три-трет-бутилфосфін)паладій.
7. Спосіб за пп. 1-5, який відрізняється тим, що застосовують паладієвий каталізатор b) за п. 1.
8. Спосіб за пп. 1-5, який відрізняється тим, що як паладієвий каталізатор с) за п. 1 застосовують металевий паладій на активованому вугіллі в присутності трифенілфосфіну, фенільні групи якого разом заміщені від 1 до 3 сульфонатними групами.
9. Спосіб за п. 7, який відрізняється тим, що як солі паладієвого каталізатора b) застосовують хлорид паладію, ацетат паладію або хлорид бісацетонітрил паладію.
10. Спосіб за п. 7, який відрізняється тим, що застосовують паладієвий каталізатор b), у якому від 6 до 60 еквівалентів трифенілфосфіну застосовують як еквівалент солі паладію.
11. Спосіб за п. 1, який відрізняється тим, що застосовують від 0,001 до 1,0 мол. % паладієвого каталізатора у перерахунку на сполуку (II).
12. Спосіб за п. 1, який відрізняється тим, що взаємодію здійснюють при температурі від 50 до 120 °С.
13. Спосіб за п. 1, який відрізняється тим, що взаємодію здійснюють у суміші води і органічного розчинника.
14. Спосіб за п. 13, який відрізняється тим, що як органічний розчинник застосовують простий ефір.
15. Спосіб за п. 1, який відрізняється тим, що взаємодію здійснюють при тиску від 1 до 6 бар.
Текст
1. Спосіб одержання заміщених біфенілів формули І 2 3 87561 4 13. Спосіб за п.1, який відрізняється тим, що взаємодію здійснюють у суміші води і органічного розчинника. 14. Спосіб за п.13, який відрізняється тим, що як органічний розчинник застосовують простий ефір. 15. Спосіб за п.1, який відрізняється тим, що взаємодію здійснюють при тиску від 1 до 6 бар. Даний винахід відноситься до способу одержання заміщених біфенілів формули І здійснюється зі зменшеною концентрацією паладієвого каталізатора. У відповідності з цим був знайдений зазначений на початку спосіб. Дифенілборну кислоту (III) одержують за допомогою реакції необов'язково заміщеного фенілмагнійхлориду V із триалкілборатом, переважно триметилборатом, у тетрагідрофурані як розчиннику відповідно до нижченаведеної схеми 1. (I) у якій замісники мають наступні значення: R1 нітро, аміно або NHR3; R2 ціано, нітро, галоген, С1-C6-алкіл, С2-С6алкеніл, С2-С6-алкініл, С1-C6-алкокси, С1-C6галоалкіл, (С1-C6-алкіл)карбоніл або феніл; R3 СгС4-алкіл, С2-С4-алкеніл або С2-С4-алкініл; m 1 або 2, причому у випадку, коли m=2, обидва залишки R1 можуть мати різні значення; n 0, 1, 2 або 3, причому у випадку, коли n=2 або 3, залишки R2 можуть мати різні значення; який відрізняється тим, що сполука формули II (II) у якій Hal означає галоген і R1 і m мають наведені вище значення, у присутності основи і паладієвого каталізатора, вибраного із групи: а) паладійтриарилфосфінового або триалкілфосфінового комплексу з паладієм у ступені окислювання нуль, b) сіль паладію в присутності триарилфосфіну або триалкілфосфіну в якості комплексного ліганду або с) металевого паладію необов'язково нанесеного на носій, у присутності триарилфосфіну або триалкілфосфіну в розчиннику взаємодіє з дифенілборною кислотою (III) (III) у якій R2 і n мають наведені вище значення, причому використовувані триарилфосфіни або триалкілфосфіни можуть бути заміщеними. З Tetrahedron Lett. 32, стор.2277 (1991) можна зробити висновок, що реакція сполучення відбувається між фенілборною кислотою і хлорбензолом при застосуванні каталізатора [1,4-біс(дифенілфосфан)бутан]паладій(ІІ)дихлорид з виходом тільки в 28%. З ЕР-А 0 888 261 відомий спосіб одержання нітробіфенілену за допомогою взаємодії хлорнітробензолену з фенілборною кислотою в присутності паладієвого каталізатора і основи. Для цього способу необхідна дуже висока концентрація каталізатора. Тому в основу даного винаходу покладена задача, надати рентабельний і технічно здійснюваний у промисловому масштабі спосіб регіоселективного одержання заміщених біфенілів, що R4 означає СгС4-алкіл, переважно метил. Для гарного виходу дифенілборної кислоти (III) є важливим застосування тільки 0,7екв. триалкілборату, у перерахуванні на використовуваний хлорбензол (IV). З кількістю застосування приблизно в 1,1екв. триалкілборату утворюється фенілборна кислота як описано в ЕР-А 0 888 261. Таке зменшення кількості застосування триалкілборату має певні несподівані переваги відносно одержання нітробіфенілів (І). Просторово-часовий вихід підвищується. Вартість застосовуваної сировини внаслідок зменшення кількості дорогого триметилборату знижується. На відміну від фенілборних кислот (III) використовуваних ЕР-А 0 888 261, дифенілборні кислоти є розчинними в тетрагідрофурані, що приводить до поліпшення тепловідводу під час реакції, що супроводжується низькою витратою охолодної здатності. Це у свою чергу приводить до підвищеної надійності способу. Температура реакції в цій стадії процесу становить від 10 до 30°С, переважно від 15 до 25°С. Заміщені біфеніли отримані даним способом мають наступні переважні замісники: R1 нітро, аміно, метиламіно, пропіламіно, бутиламіно, аліламіно або пропаргіламіно, особливо переважно нітро, аміно або метиламіно, винятково переважно нітро або аміно; R2 ціано, нітро, фтор, хлор, бром, метил, етил, пропіл, бутил, аліл, пропаргіл, метокси, етокси, трифторметил або феніл, особливо переважно фтор, хлор, метил або метокси, винятково переважно фтор або хлор; R3 метил, етил, пропіл, бутил, аліл або пропаргіл, особливо переважно метил, етил або аліл, винятково переважно метил; m 1; n 0,1 або 2, переважно 0 або 1, найбільш переважно 1. Проведення наступного однорідно каталізованого Suzuki біарил-перехресного сполучення відбувається відповідно до схеми 2. 5 При цьому починають переважно з дифенілборних кислот формули (III), у яких R2 і n мають наведені вище значення. Крім того, кращими вихідними речовинами є дифенілборні кислоти (III), у яких n означає 0 або 1 і особливо 1. Зовсім особливо кращі ди-(4-метилфеніл)борна кислота, ди-(4-фторфеніл)-борна кислота і насамперед ди-(4-хлорфеніл)-борна кислота як вихідна сполука (III). Переважно починають зі сполуки (II), що має єдину нітро- або аміногруппу (m=1), особливо 4нітрохлорбензол або 4-амінохлор-бензол і насамперед 2-нітрохлорбензол або 2-амінохлорбензол. Сполука (II) використається, у перерахуванні на дифенілборні кислоти (III) (еквіваленти дифенілборної кислоти), звичайно в еквімолярній кількості, переважно з до 20-процентним, переважно з до 50-процентним надлишком. Як основи можуть застосовуватися органічні основи, наприклад, третинні аміни. Переважно застосовують, наприклад, триетиламін або диметилциклогексиламін. Як основи застосовують переважно гідроксиди лужних металів, гідроксиди 5 лужноземельних металів, карбонати лужних металів, карбонати лужноземельних металів, гідрокарбонати лужних металів, ацетати лужних металів, ацетати лужноземельних металів, алкоголяти лужних металів і алкоголяти лужноземельних металів, в суміші ι особливо індивідуально. Як основи особливо кращі гідроксиди лужних металів, гідроксиди лужноземельних металів, карбонати лужних металів, карбонати лужноземельних металів і гідрокарбонати лужних металів. Як основи особливо кращі гідроксиди лужних металів, наприклад, гідроксид натрію і гідроксид калію, а також карбонати лужних металів і гідрокарбонати лужних металів, наприклад, карбонат літію, карбонат натрію і карбонат калію. Основи використаються в способі відповідно до винаходу переважно з вмістом від 100 до 500 моль-%, особливо переважно від 150 до 400 моль%, у перерахуванні на дифенілборні кислоти (III). Придатними паладієвими каталізаторами є комплекси паладій-ліганди з паладієм у ступені окислювання нуль, солі паладію в присутності ліганд комплексу або металевого паладію необов'язково нанесеного на носій, переважно в присутності ліганд комплексу. Придатними комплексними лігандами є нейтральні ліганди, такі як триарилфосфіни і триалкілфосфіни, які необов'язково можуть бути заміще 87561 6 ними в арильних кільцях, такі як трифенілфосфін (ТРР), ди-1-адамантил-н-бутилфосфін, три-трет.бутилфосфін (TtBP) або 2(дициклогексилфосфіно)біфеніл. Крім того, у літературних джерелах також описані інші особливо реактивні комплексні ліганди з інших структурних класів, такі як 1,3-біс-(2,6діізопропілфеніл)-4,5-Н2-імідазолійхлорид (порівн. наприклад, G. A. Grasa et al., Organometallics 2002, 21, 2866) і трис-(2,4-ди-трет.-бутилфеніл)-фосфіт (порівн. A. Zapf etal., Chem. Eur. J. 2000, 6, 1830). Реактивність комплексних ліганд може бути підвищена за допомогою додавання четвертинної солі амонію, такої як тетра-н-бутиламонійбромід (ТВАВ) (порівн. наприклад, D. Zim et al., Tetrahedron Lett. 2000, 41, 8199). Якщо буде потреба може бути поліпшена водорозчинність паладієвого комплексу за допомогою різних замісників, таких як сульфокислота або сольові групи сульфокислоти, карбонова кислота або сольові групи карбонової кислоти, фосфонова кислота, фосфоній або сольові групи фосфонової кислоти, пералкіламонієві, гідроксі і поліефірні групи. З комплексів паладій-ліганд із паладієм у ступені окислювання 0 застосовують переважно тетракіс(трифенілфосфін)паладій і поряд з ним тетракіс[три(о-толіл)фосфіни]паладій. У солях паладію, які застосовуються в присутності комплексних ліганд, паладій звичайно перебуває в ступені окислювання 2+. Переважно застосовують хлорид паладію, ацетат паладію або хлорид бізацетонітрилпаладію. Особливо переважно застосовується хлорид паладію. Як правило комбінують від 6 до 60, переважно від 15 до 25, еквіваленти зазначених вище ліганд комплексу, особливо трифенілфосфін і три-трет.бутилфосфін, з еквівалентом солі паладію. В ЕР-А 0 888 261 описане застосування від 2 до 6 еквівалентів трифенілфосфіну на еквівалент паладієвого каталізатора. Застосування високого надлишку ліганд можна знайти в літературних джерелах у загальному як невигідне, тому що внаслідок цього очікується дезактивація каталітично активного комплексу (порівн. наприклад, J. Hassan et al., Chem. Rev. 2002, 102, 1359). Таким чином, несподіваним виявилося, що високий надлишок комплексних ліганд у комбінації з незначним використанням каталізатора веде до підвищення загального виходу способу даного винаходу і разом з тим до поліпшення рентабельності. Металевий паладій застосовують переважно в порошкоподібному виді або на носії, наприклад, у вигляді паладію на активованому вугіллі, паладію на оксиді алюмінію, паладію на карбонаті барію, паладію на сульфаті барію, паладію на карбонаті кальцію, паладію на алюмосилікатах, таких як монтморилоніт, паладій на Si2 і паладій на карбонаті кальцію, у кожному випадку з вмістом паладію від 0,5 до 12мас-%. Ці каталізатори поряд з паладієм і носієм можуть містити інші легуючі домішки, наприклад, свинець. При застосуванні металевого паладію нанесеного необов'язково на носій, особлива перевага 7 віддається спільному застосуванню вищевказаних комплексних ліганд, особливо застосуванню паладію на активованому вугіллі в присутності трифенілфосфіну в якості комплексного ліганду, причому фенільні групи трифенілфосфіну переважно заміщені разом від однієї до трьох сульфонатними групами. У способі відповідно до винаходу паладієвий каталізатор застосовується з низьким вмістом від 0,001 до 1,0 моль-%, переважно від 0,005 до 0,5 моль-% або від 0,01 до 0,5 моль-% і особливо від 0,005 до 0,05 моль-%, у перерахуванні на сполуку (II). Незначне використання солі паладію в комбінації з високим використанням комплексних ліганд представляє істотну перевагу у витратах виробництва цього способу в порівнянні зі способами рівня техніки. Спосіб відповідно до винаходу можна здійснювати у двофазній системі з водної фази і твердої фази, тобто каталізатора. При цьому водна фаза може поряд з водою також містити водорозчинний органічний розчинник. Для способу відповідно до винаходу придатними органічними розчинниками є прості ефіри, такі як диметоксіетан, диметиловий ефір діетиленгліколю, тетрагідрофуран, діоксан і mpem.бутилметиловий ефір, вуглеводні, такі як н-гексан, н-гептан, циклогексан, бензол, толуол і ксилол, спирти, такі як метанол, етанол, 1-пропанол, 2пропанол, етиленгліколь, 1-бутанол, 2-бутанол і трет.-бутанол, кетони, такі як ацетон, етилметилкетон і iзо-бутилметилкетон, аміди, такі як диметилформамід, диметилацетамід і N-метилпіролідон, кожний окремо або в суміші. Кращими розчинниками є прості ефіри, такі як диметоксіетан, тетрагідрофуран і діоксан, вуглеводні, такі як циклогексан, толуол і ксилол, спирти такі як етанол, 1-пропанол, 2-пропанол, 1-бутанол і трет.-бутанол, кожний окремо або в суміші. В особливо кращому варіанті способу відповідно до винаходу використають воду, один або декілька нерозчинних у воді або один або декілька розчинних у воді розчинників, наприклад, суміші з води і діоксану або води і тетрагідрофурану або води, діоксану і етанолу або води, тетрагідрофурану і метанолу або води, толуолу і тетрагідрофурану, переважно води і тетрагідрофурану або води, тетрагідрофурану і метанолу. Загальна кількість розчинника становить звичайно від 3000 до 500 і переважно від 2000 до 700г на моль сполуки (II). Доцільно спосіб здійснюють шляхом додавання сполуки (II), дифенілборних кислот (III), основи, а також каталітичної кількості паладієвого каталізатора в суміш із води і одного або декількох інертних органічних розчинників і перемішування при температурі від 50°С до 120°С, переважно від 70°С до 110°С, особливо переважно від 90°С до 100°С, протягом від 1 до 50, переважно від 2 до 24 годин. Залежно від використовуваного розчинника і температури встановлюють тиск від 1 бар до 6 бар, переважно від 1бар до 4бар. 87561 8 Переважно реакція проводиться у воді і тетрагідрофурані. Проведення реакції можна здійснювати у звичайні придатні для подібного способу пристроях. Після закінченої взаємодії паладієвий каталізатор, отриманий у вигляді твердої речовини, наприклад, за допомогою фільтрації відділяється і вихідний продукт звільняється від розчинника або розчинників. У продуктах, які не є повністю водорозчинними, водорозчинні паладієві каталізатори або комплексні ліганди відділяються повністю з вихідного продукту при розділенні водної фази. Потім може бути здійснене наступне очищення відомими для фахівця в даній області методами і для кожного продукту відповідними методами, наприклад, за допомогою перекристалізації, дистиляції, сублімації, зонної плавки, кристалізації з розплаву або хроматографії. Способом відповідно до винаходу можна одержати, наприклад: 4'-хлор-2-нітробіфеніл, 4'-хлор-2-амінобіфеніл, 4'-фтор-2-нітробіфеніл, 4'-фтор-2-амінобіфеніл, 4'-метил-2-нітробіфеніл, 4'-метил-2-амінобіфеніл, 4'-метокси-2-нітробіфеніл, 4'-метокси-2-амінобіфеніл, 4'-бром-2-нітробіфеніл, 4'-бром-2-амінобіфеніл, 3'-фтор-2-нітробіфеніл, 3'-фтор-2-амінобіфеніл, 3'-хлор-2-нітробіфеніл, 3'-хлор-2-амінобіфеніл, 3'-бром-2-нітробіфеніл, 3'-бром-2-амінобіфеніл, 3'-метил-2-нітробіфеніл, 3'-метил-2-амінобіфеніл, 3'-метокси-2-нітробіфеніл, 3'-метокси-2-амінобіфеніл, 4'-феніл-2-нітробіфеніл, 4'-феніл-2-амінобіфеніл, 4'-трифторметил-2-нітробіфеніл, 4'-трифторметил-2-амінобіфеніл, 4'-фтор-4-нітробіфеніл, 4'-фтор-4-амінобіфеніл, 4'-хлор-4-нітробіфеніл, 4'-хлор-4-амінобіфеніл, 4'-бром-4-нітробіфеніл, 4'-бром-4-амінобіфеніл, 4'-метил-4-нітробіфеніл, 4'-метил-4-амінобіфеніл, 4'-ціано-4-нітробіфеніл, 4'~ціано-4-амінобіфеніл, 2-нітробіфеніл, 2-амінобіфеніл, 4-нітробіфеніл, 4-амінобіфеніл. Спосіб відповідно до винаходу надає сполуки І з дуже високим кількісним виходом при дуже гарній чистоті. Біфеніли, отримані способом відповідно до винаходу, придатні як вихідний продукт для заміщених біфеніламінів, які у свою чергу є проміжни 9 ми продуктами для фунгіцидних діючих речовин для захисту рослин (порівн. наприклад, ЕР-А 545 099). Синтез 4'-хлор-2-нітробіфенілу Приклад 1: ди-(4-хлорфеніл)-борна кислота Розчин з 120г триметилборату і 590г тетрагідрофурану охолоджували до 11°С До нього протягом 2 годин додавали дозовано 1000г 20мас.-%ого розчину з 4-хлорфенілмагнійхлориду в тетрагідрофурані. При цьому була встановлена температура 20-21°С. Після повного додавання реакційний розчин перемішували ще 1 годину при 20°С. Потім реакційну суміш обробляли 621г 10%-ой водною соляною кислотою і перемішували протягом 30 хвилин при 40°С. Після розділення фаз одержували 1500г розчину ди-(4-хлорфеніл)борної кислоти в тетрагідрофурані (взаємодія 87%). Органічна фаза може бути далі перероблена як вихідна сировина або ди-(4-хлорфеніл)борна кислота може бути ізольована за допомогою колонкової хроматографії на силікагелі із сумішами з етилового ефіру оцтової кислоти і циклогексану. Приклад 2: реакція ди-(4-хлорфеніл)-борної кислоти і 1-хлору-2-нітробензолу Автоклав наповнювали 240г 20мас.-%-ого водного натрового лугу при 15-20°С. До нього додавали дозовано 539г 9-10мас.-%-ого розчину ди-(4хлорфеніл)-борної кислоти в діоксані при 18-22°С протягом 26 хвилин. Після остаточного додавання реакційний розчин перемішували 40 хвилин при 18-22°С. До реакційного розчину додавали 2,4г 50мас.-%-ого розчину трифенілфосфіну в діоксані. Після остаточного додавання реакційний розчин перемішували 30 хвилин при 18-22°С. Потім до реакційного розчину додавали 117мг (бизацетонітрил)-паладій(ІІ)хлориду і 84г 1-хлору-2нітробензолу. Реакційний розчин нагрівали протягом 11,5 годин до 100°С. При цьому в автоклаві встановлювали підвищений тиск в 3,7бар. Після остаточної взаємодії ди-(4-хлорфеніл)борної кислоти реакційний розчин охолоджували до 40-45°С і в автоклаві зменшували тиск до нормального. Реакційний розчин екстрагували 250г 10мас.-%-ою водною соляною кислотою. Після розділення фаз одержували розчин 4-хлор-2'нітробіфенілу в діоксані (взаємодія 99%). Діоксан видаляли за допомогою дистиляції у вакуумі і 4хлор-2'-нітробіфеніл можна було ізолювати за допомогою кристалізації з розплаву. Приклад 3: реакція ди-(4-хлорфеніл)-борної кислоти і 1-хлор-2-нітробензолу В автоклав завантажували 495г мас-20%-ого водного натрового лугу при 15-20°С. До нього дозовано додавали 1000г 11мас.-%-ого розчину ди(4-хлорфеніл)-борної кислоти в тетрагідрофурані при 18-22°С протягом 30 хвилин. Після остаточного додавання реакційний розчин перемішували 30 хвилин при 18-22°С. До реакційного розчину додавали 3,5г 50мас.-%-ого розчину трифенілфосфіну в тетрагідрофурані. Після повного додавання реакційний розчин перемішували 30 хвилин при 20-21°С. Потім до реакційного розчину додавали 0,9г паладій(ІІ)хлориду в 227г розплавленого 1-хлору-2 87561 10 нітробензолу. Реакційний розчин нагрівали протягом 6-8 годин до 100°С. При цьому в автоклаві встановлювали підвищений тиск в 3,0бар. Після повної взаємодії ди-(4-хлорфеніл)борної кислоти в автоклаві зменшували тиск до нормальний і реакційний розчин охолоджували до 40-50°С. Реакційний розчин екстрагували 450г 10мас.-%-ою водною соляною кислотою. Після поділу фаз одержували розчин 4-хлор-2'нітробіфенілу в тетрагідрофурані (взаємодія 99%). Приклад 4: реакція ди-(4-хлорфеніл)-борної кислоти і 1-хлор-2-нітробензолу В колбу з чотирма горлечками поміщали 770г 22мас.-%-ого водного натрового лугу при 20°С. До нього дозували 2045г 13мас.-%-ого розчину ди-(4хлорфеніл)-борної кислоти в тетрагідрофурані при 20°С протягом 30 хвилин. Після повного додавання реакційний розчин перемішували 30 хвилин при 20°С. До реакційного розчину додавали 9,8г трифенілфосфіну, 1,7г паладій(ІІ)хлориду і 273г розплавленого 1-хлору-2-нітробензолу. Реакційний розчин кип'ятили протягом 20 годин зі зворотним холодильником. Після повної взаємодії 4-хлорфенілборної кислоти реакційний розчин охолоджували 40°С і потім екстрагували 255г 35мас.-%-ою водною соляною кислотою. Після розділення фаз одержували розчин 4-хлор-2'-нітробіфенілу в тетрагідрофурані (взаємодія 99%). Приклад 5: реакція 4-хлорфенілборною кислоти і 1-хлор-2-нітробензолу В 4м3 реактор поміщали 1773кг 13мас.-%-ого розчину 4-хлорфенілборної кислоти в тетрагідрофурані при 18-22°С. Протягом 20 хвилин при помішуванні дозували 538кг 25мас.-%-ого водного натрового лугу і 140кг води при 22-30°С. Після повного додавання реакційний розчин перемішували 30 хвилин при 22-25°С. До реакційного розчину додавали 2,28кг трифенілфосфіну, 372г паладій(ІІ)хлориду і 252кг розплавленого 1-хлор-2нітробензолу. Реакційний розчин нагрівали протягом 18 годин до 66°С. Після повної взаємодії 4хлорфенілборної кислоти реакційний розчин охолоджували до 45°С і екстрагували 794кг 10мас.-%ою водною соляною кислотою. Після поділу фаз одержували розчин 4-хлор-2'-нітробіфенілу в тетрагідрофурані (взаємодія 99%). Приклад 6: реакція ди-(4-хлорфеніл)-борної кислоти і 1-хлор-2-нітробензолу В автоклав поміщали 177г 20мас.-%-ого водного натрового лугу при 15°С. До нього дозували 415г 9-10мас.-%-ого розчину ди-(4-хлорфеніл)борної кислоти в тетрагідрофурані при 18-20°С протягом 30 хвилин. Після повного додавання реакційний розчин перемішували 30 хвилин при 1820°С. До реакційного розчину додавали 0,24г 50мас.-%-ого розчину три-трет. -бути л фосфіну в тетрагідрофурані. Після повного додавання реакційний розчин перемішували 30 хвилин при 1820°С. Потім до реакційного розчину додавали 104мг 10мас.-%-ого розчину паладій(ІІ)хлориду в 10мас.-%-ой водній соляній кислоті і 91г 85мас.-%ого розчину 1-хлор-2-нітробензолу в тетрагідрофурані. Реакційний розчин нагрівали протягом 12 11 87561 годин до 100°С. При цьому встановлювали підвищений тиск в 3,5бар. Після повної взаємодії ди-(4-хлорфеніл)борної кислоти реакційний розчин охолоджували до 40-50°С і в автоклаві знижували тиск до нормального. Реакційний розчин екстрагували 125г 10мас.-%-ой водної соляної кислоти. Після розділення фаз одержували розчин 4-хлор-2'нітробіфенілу в тетрагідрофурані (взаємодія 85%). Приклад 7: реакція ди-(4-хлорфеніл)-борної кислоти і 1-бром-2-аніліну В автоклав поміщали 240г 20мас.-%-ого водного натрового лугу при 20°С. До нього дозували 539г 9-10мас.-%-ого розчину ди-(4-хлорфеніл)борної кислоти в тетрагідрофурані при 20°С протягом 30 хвилин. Після повного додавання реакційний розчин перемішували 30 хвилин при 20°С. До реакційного розчину додавали 1,3г 50мас.-%-ого розчину трифенілфосфіну в тетрагідрофурані. Комп’ютерна верстка Т. Чепелева 12 Після повного додавання реакційний розчин перемішували 30 хвилин при 20°С. Потім до реакційного розчину додавали 320мг 10мас.-%-ого розчину паладій(ІІ)хлориду в 10мас.-%-ой соляної кислоти і 108г 85мас.-%-ого розчину 1-брому-2-аніліну в тетрагідрофурані. Реакційний розчин нагрівали протягом 12 годин до 100°С. При цьому в автоклаві встановлювали підвищений тиск в 3,5бар. Після повної взаємодії ди-(4-хлорфеніл)борної кислоти реакційний розчин охолоджували до 40-50°С і в автоклаві знижували тиск до нормального. Після поділу фаз органічну фазу екстрагували 100г 20мас.-%-ого водного натрового лугуОдержували розчин 4-хлор-2'-амінобіфенілу в тетрагідрофурані (взаємодія 85%). Тетрагідрофуран видаляли за допомогою дистиляції у вакуумі і 4хлор-2'-амінобіфеніл можна було ізолювати за допомогою кристалізації. Підписне Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for producing substituted biphenyls
Автори англійськоюEngel Stefan, Oberding Tanja
Назва патенту російськоюСпособ получения замещенных бифенилов
Автори російськоюЭнгель Штефан, Обердинг Таня
МПК / Мітки
МПК: C07C 201/00, C07C 205/00
Мітки: спосіб, одержання, заміщених, біфенілів
Код посилання
<a href="https://ua.patents.su/6-87561-sposib-oderzhannya-zamishhenikh-bifeniliv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання заміщених біфенілів</a>
Попередній патент: Поворотний пристрій до протеза стегна
Наступний патент: Картер косильної балки дискової косарки (варіанти), спосіб його виготовлення та дискова косарка
Випадковий патент: Енергозберігаючий електрообогрівач "екостар"










