Спосіб оцінки параметрів молекул імуноглобуліну класу igg у зразках сироватки крові
Номер патенту: 95297
Опубліковано: 25.12.2014
Автори: Стойка Ростислав Степанович, Думич Тетяна Ігорівна, Томін Андрій Миколайович, Білий Ростислав Олександрович, Магорівська Ірина Богданівна
Формула / Реферат
Спосіб оцінки параметрів молекул імуноглобуліну класу IgG у зразках сироватки крові, що виконується шляхом імуноферментного аналізу, зокрема оцінки вмісту глікозильних детермінант, каталітичної активності, здатності утворювати супрамолекулярні комплекси, тощо, який відрізняється тим, що для прямої оцінки параметрів молекул імуноглобуліну IgG в зразках сироватки крові як імуносорбент використовують фрагменти антитіл (наприклад F(ab)2 чи Fab) до Fc ділянки досліджуваних імуноглобулінів.
Текст
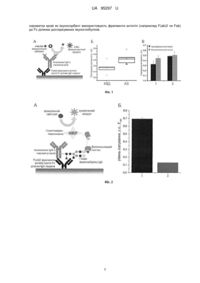
Реферат: Спосіб оцінки параметрів молекул імуноглобуліну класу IgG у зразках сироватки крові виконується шляхом імуноферментного аналізу, зокрема оцінки вмісту глікозильних детермінант, каталітичної активності, здатності утворювати супрамолекулярні комплекси, тощо. Для прямої оцінки параметрів молекул імуноглобуліну IgG в зразках сироватки крові як імуносорбент використовують фрагменти антитіл (наприклад F(ab)2 чи Fab) до Fc ділянки досліджуваних імуноглобулінів. UA 95297 U (54) СПОСІБ ОЦІНКИ ПАРАМЕТРІВ МОЛЕКУЛ ІМУНОГЛОБУЛІНУ КЛАСУ IgG У ЗРАЗКАХ СИРОВАТКИ КРОВІ UA 95297 U UA 95297 U 5 10 15 20 25 30 35 40 45 50 55 Корисна модель належить до галузі імунології, клітинної біології, клінічної діагностики, біоорганічної хімії і може використовуватись для оцінки параметрів імуноглобулінів класу IgG у зразках сироватки крові, зокрема таких як наявність каталітичної активності, стан глікозилювання, здатність утворювати супрамолекулярні комплекси (напр. при наявності ревмофактору). Відомі методи імуноферментного аналізу, у яких як імуносорбент використовують рекомбінанті антигени, до яких планують визначати наявність антитіл [1, 2]. Також відомі методи імуноферментного аналізу, спрямовані на оцінку наявності людських імуноглобулінів класу IgG певного класу, у них як імуносорбуючий агент для оцінки людських антитіл класу IgG використовують антитіла до людського IgG [3], які згодом інкубують з антигеном, а наявність антигену виявляють за допомогою антитіл до нього [4]. Спільним недоліком даних підходів є те, що використання анти-людських IgG як імуносорбенту дозволяє лише оцінювати присутність людських антитіл за їх зв'язуванням із конкретним антигеном, а оскільки самі антитіла до імуноглобулінів класу IgG (які виступають як імуносорбент) володіють спільними властивостями з людськими імуноглобулінами класу IgG (які виступають як аналіт), оцінка спільних для даних імуноглобулінів властивостей (наприклад, стану глікозилювання) стає неможливою. В основу корисної моделі поставлено задачу розробки корисної моделі для оцінки параметрів молекул імуноглобуліну класу IgG у зразках сироватки крові. Поставлена задача вирішується тим, що як імуносорбент для зв'язування досліджуваних молекул імуноглобуліну IgG сироватки із поверхнею імунологічного планшету використовують фрагменти антитіл (наприклад F(ab)2 чи Fab) до Fc ділянки досліджуваної молекули імуноглобуліну IgG, які сорбують на поверхню імунологічного планшету. Дані F(ab)2 чи Fab фрагменти зв'язуються із Fc ділянкою антитіл і дозволяють аналізувати такі параметри імуноглобулінів сироватки крові як стан глікозилювання, адже глікозилювання імуноглобулінів IgG відбувається по залишку Asp297 у складі Fc фрагменту [5] (який відсутній у молекулах F(ab)2 чи Fab імуносорбуючих антитіл і не спричиняє хибно-позитивних реакцій); оцінка каталітичної активності, яка зазвичай притаманна F(ab)2 ділянкам аналізованих антитіл сироватки крові [6] (і які не задіяні у зв'язуванні з імуносорбуючими антитілами); чи оцінка здатності імуноглобулінів IgG сироватки крові утворювати супрамолекулярні комплекси, наприклад, із молекулами IgМ, як це має місце при утворенні ревмофактору. Запропонований метод відрізняється від раніше описаних тим, що: - як імуносорбуючий агент для зв'язування імуноглобулінів класу IgG із сироватки крові використовують F(ab)2 фрагменти антитіл, специфічні проти Fc фрагментів імуноглобулінів IgG людини. - для аналізу досліджуваних IgG людини використовують зразки сироватки крові без додаткової очистки/виділення фракції IgG. На Фіг. 1 зображено: А - Схема здійснення імуноферментного аналізу за допомогою запропонованої корисної моделі для визначення сіалідазної активності імуноглобулінів класу IgG сироватки крові. Б - результати оцінки сіалідазної активності імуноглобулінів класу IgG сироватки крові у групі клінічно здорових донорів (КЗД) та пацієнтів із автоімунними захворюваннями (AЗ). В - порівняння результатів визначення сіалідазної активності для зразків імуноглобулінів із сіалідазною активністю у зразках сироватки крові (1) та в очищених препаратах IgG, виділених із сироватки крові людини (2) за допомогою імуноферментної детекції (згідно із запропонованою корисною моделлю) чи за допомогою флуориметричного методу (як описано в [6]). На Фіг. 2 зображено: А - Схема здійснення імуноферментного аналізу за допомогою запропонованої корисної моделі для визначення ступеня глікозилювання імуноглобулінів класу IgG сироватки крові. Б - результати оцінки рівня сіалування очищених препаратів IgG сироваткакрові людини до (1) та після (2) десіалування за допомогою нейрамінідази C.perfringens, 20mU, 12 год., 37 °C. На Фіг. 3 зображено: А - Схема здійснення імуноферментного аналізу за допомогою запропонованої корисної моделі для визначення наявності супрамолекулярних комплексів у складі імуноглобулінів класу IgG сироватки крові. Б - результати оцінки наявності ревмофактору (комплексу IgG з ІgМ) у сироватці крові у групі клінічно здорових донорів (КЗД) та пацієнтів із ревматоїдним артритом (РА). Можливість реалізації способу показано на наступних прикладах. Приклад 1. Виявлення абзимів із сіалідазною активністю у препаратах сироватки крові людини. 1 UA 95297 U 5 10 15 20 25 30 35 40 45 50 55 60 А. У 96-лунковий планшет вносили по 50 мкл зразку F(ab) 2 фрагментів IgG (H+L) (Jackson Laboratories, 109-006-003) із концентрацією 2 млг/мл у 100 мМ карбонатно/бікабонатному буфері, рН 9,6. Інкубували 12 годин при 4 °C. Відмивали 3 рази 10 мМ TBS-Tween20 (0,05 %), 0,1 мМ СаСІ2, 0,1 мМ MgCI2 (TBST). Блокували 3 % желатином (SERVA, 22151) у TBST по 100 мкл/лунку протягом 2 годин при 37 °C. Відмивали 3 рази TBS-T. По 50 мкл досліджуваного зразоку сироватки у TBST вносили (1:1000) у лунки планшету. Інкубували 1 годину при 37 °C. Відмивали 3 рази TBST. Б. У кожну лунку додавали 50 мкл реакційного буферу: 0,1 мМ СаСІ 2, 0,1 мМ МgСІ2, 0,05 мМ 4-метилумбеліферил-N-ацетилнейрамінату натрію (Biosynth, M5507) у PBS 1х, рН 7,4. Інкубували 4 години при 37 °C. Реакцію зупиняли додаванням 150 мкл холодного (4 °C) Sбуферу (133 мМ гліцину, 60 мМ NaCI, 83 мН Na2CO3). Вміст кожної лунки переносили в окрему мікропробірку із 1,3 мл S-буферу і вимірювали значення флуоресценції зразків при 430нм (довжина хвилі збудження 365 нм). Обчислення ензиматичної активності здійснювали за калібрувальною кривою для сіалідази Clostridium perfhngens, та через перерахунок у кількість розщепленого субстрату за стандартами розчину продукту розщеплення, 4-метилумбеліферолу (Sigma, M1381). Приклад 2. Вивчення глікозилювання імуноглобулінів класу G у препаратах сироватки крові людини. Проводили процедури як у прикладі 1А. У кожну лунку вносили по 50 мкл біотинільованого лектину SNA, специфічного до залишків сіалових кислот (SNAF-biotin, Vector, B-1395) у розведенні 1:20 000. Інкубували 1 годину при кімнатній температурі. Відмивали 3 рази TBST. У лунки вносили по 50 мкл стрептавідину (1:10000) Jackson Laboratories, 016-030-084, міченого пероксидазою хрону та інкубували 1 годину при кімнатній температурі. Відмивали 3 рази TBST. Для детектування інтенсивності зв'язування, вносили по 50 мкл ТМБ (3,3',5,5'-тетраметилбензидин) (SIGMA, T2885) та інкубували 10 хвилин у темряві. Реакцію зупиняли додавання 25 % сульфатної кислоти (по 50 мкл) та вимірювали поглинання при 450 нм. Приклад 3. Виявлення імунних комплексів у препаратах сироватки крові людини. Проводили процедури як у прикладі 1А. У кожну лунку вносили по 50 мкл мічених пероксидазою хрону антитіл до імуноглобуліну IgМ, мічених пероксидазою хрону (анти-IgM-HRP) у розведенні 1:50000. Інкубували 1 годину при кімнатній температурі. Відмивали 3 рази TBST. Для детектування інтенсивності зв'язування, вносили по 50 мкл ТМБ (3,3',5,5'-тетраметилбензидин) (SIGMA, T2885) та інкубували 10 хвилин у темряві. Реакцію зупиняли додавання 25 % сульфатної кислоти (по 50 мкл) та вимірювали поглинання при 450 нм. Джерела інформації: 1. Семиноженко В.П., Шевчук О.А., Софронов А.І., Співак М.Я., Міхалап С.В., Ганова Л.О., Кисельова К.О., Іванська Н.В., Терещенко М.І., Горлов І.Ю., Вудмаска М.І., Мойса Л.М., et al. Патент України на корисну модель 78417, assignee. Тест-система імуноферментна для якісного та напівкількісного аналізу та визначення авідності антитіл класу IgG до цитомегаловірусу людини (DIA-CMV-IgG-av). 2. Доан С.І., Пархоменко Л.В., Тимохіна Л.В. Патент України на корисну модель 79026, assignee. Тест-система імуноферментна для визначення антитіл проти поверхневих полісахаридів S. aureus. 3. Essig U, Klostermann S, Kowalewsky F, Stubenrauch KG, Vogel R, Wessels U. ANTI-HUMAN IgG1 ANTIBODY. In: Google Patents; 2014. 4. Gan SD, Patel KR. Enzyme Immunoassay and Enzyme-Linked Immunosorbent Assay. J Invest Dermatol 2013; 133:e12. 5. Butler M, Quelhas D, Critchley AJ, Carchon H, Hebestreit HF, Hibbert RG, Vilarinho L, Teles E, Matthijs G, Schollen E, Argibay P, Harvey DJ, et al. Detailed glycan analysis of serum glycoproteins of patients with congenital disorders of glycosylation indicates the specific defective glycan processing step and provides an insight into pathogenesis. Glycobiology 2003; 13:601-622. 6. Bilyy R, Tomin A, Mahorivska I, Shalay O, Lohinskyy V, Stoika R, Kit Y. Antibody-mediated sialidase activity in blood serum of patients with multiple myeloma. J Мої Recognit 2011; 24:576-584. ФОРМУЛА КОРИСНОЇ МОДЕЛІ Спосіб оцінки параметрів молекул імуноглобуліну класу IgG у зразках сироватки крові, що виконується шляхом імуноферментного аналізу, зокрема оцінки вмісту глікозильних детермінант, каталітичної активності, здатності утворювати супрамолекулярні комплекси, тощо, який відрізняється тим, що для прямої оцінки параметрів молекул імуноглобуліну IgG в зразках 2 UA 95297 U сироватки крові як імуносорбент використовують фрагменти антитіл (наприклад F(ab)2 чи Fab) до Fc ділянки досліджуваних імуноглобулінів. 3 UA 95297 U Комп’ютерна верстка Д. Шеверун Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 4
ДивитисяДодаткова інформація
Автори англійськоюTomin Andrii Mykolaiovych, Stoika Rostyslav Stepanovych
Автори російськоюТомин Андрей Николаевич, Стойка Ростислав Степанович
МПК / Мітки
МПК: G01N 33/53
Мітки: спосіб, оцінки, молекул, крові, імуноглобуліну, класу, параметрів, зразках, сироватки
Код посилання
<a href="https://ua.patents.su/6-95297-sposib-ocinki-parametriv-molekul-imunoglobulinu-klasu-igg-u-zrazkakh-sirovatki-krovi.html" target="_blank" rel="follow" title="База патентів України">Спосіб оцінки параметрів молекул імуноглобуліну класу igg у зразках сироватки крові</a>
Попередній патент: Машинка закатна напівавтоматична для закупорювання скляної тари при домашній консервації
Наступний патент: Спосіб хірургічного лікування пухлин прямої кишки
Випадковий патент: Спосіб лікаря кончаковської оздоровлення організму пацієнта