Високоефективні кон’югати та гідрофільні зшиваючі агенти (лінкери)
Номер патенту: 108598
Опубліковано: 25.05.2015
Автори: Сінгх Раджіва, Чарі Раві В. Дж., Вільхельм Шарон Д., Ковтун Єлєна
Формула / Реферат
1. Сполука формули (1) або (1'):
Z-X1-(-CH2-CH2-O-)n-Yp-D, (1)
D-Yp-(-CH2-CH2-O-)n-X1-Z, (1')
де:
Z є реакційноздатним карбоксильним ефіром, вибраним з групи, що складається з N-сукцинімідилу, N-сульфосукцинімідилу, N-фталіміду, N-сульфофталімідилу, 2-нітрофенілу, 4-нітрофенілу, 2,4-динітрофенілу, 3-сульфо-4-нітрофенілу, 3-карбокси-4-нітрофенілу і складного ефіра тетрафторфенілу або галоацетаміду;
D є майтанзиноїдом;
X є аліфатичною структурною одиницею;
Y є аліфатичною структурною одиницею, приєднаною до майтанзиноїду через тіоефірний зв'язок;
де зазначена аліфатична структурна одиниця, яку представляють X або Y, є нерозгалуженою або розгалуженою алкільною групою, що має 1-20 атомів вуглецю в ланцюзі, циклічною алкільною групою, що має 3-10 атомів вуглецю, нерозгалуженою або розгалуженою алкенільною групою, що має 2-15 атомів вуглецю в ланцюзі, або нерозгалуженою або розгалуженою алкінільною групою, що має 2-15 атомів вуглецю в ланцюзі;
l дорівнює 0 або 1;
р дорівнює 0 або 1; і
n є цілим числом від 1 до 2000.
2. Кон'югат агента, який зв'язується із клітиною, і цитотоксичного майтанзиноїду формули (2) або (2'):
CB-[X1-(-CH2-CH2-O-)n-Yp-D]m, (2)
[D-Yp-(-CH2-CH2-O-)n-X1]m-CB, (2')
де:
СВ є агентом, який зв'язується із клітиною і є антитілом;
D є майтанзиноїдом;
X є аліфатичною структурною одиницею, приєднаною до агента, який зв'язується із клітиною через амідний зв'язок;
Y є аліфатичною структурною одиницею, приєднаною до майтанзиноїду через тіоефірний зв'язок;
де зазначена аліфатична одиниця, яку представляють X або Y, є нерозгалуженою або розгалуженою алкільною групою, що має 1-20 атомів вуглецю в ланцюзі, циклічною алкільною групою, що має 3-10 атомів вуглецю, нерозгалуженою або розгалуженою алкенільною групою, що має 2-15 атомів вуглецю в ланцюзі, або нерозгалуженою або розгалуженою алкінільною групою, що має 2-15 атомів вуглецю в ланцюзі;
l дорівнює 0 або 1;
р дорівнює 0 або 1; і
m є цілим числом від 2 до 15; і
n є цілим числом від 1 до 2000.
3. Кон'югат за п. 2, в якому зазначений агент, який зв'язується із клітиною, представлений одноланцюговим антитілом, фрагментом антитіла, який специфічно зв'язується із клітиною-мішенню, моноклональним антитілом, одноланцюговим моноклональним антитілом, біспецифічим антитілом, фрагментом, який специфічно зв'язується із клітиною-мішенню.
4. Кон'югат за п. 2, в якому зазначений агент, який зв'язується із клітиною, представлений моноклональним антитілом зі зміненою поверхнею, одноланцюговим моноклональним антитілом зі зміненою поверхнею або фрагментом моноклонального антитіла зі зміненою поверхнею, який специфічно зв'язується із клітинкою-мішенню.
5. Кон'югат за п. 2, в якому зазначений агент, який зв'язується із клітиною, представлений гуманізованим моноклональним антитілом, гуманізованим одноланцюговим моноклональним антитілом або фрагментом гуманізованого моноклонального антитіла, який специфічно зв'язується із клітинкою-мішенню.
6. Кон'югат за п. 2, в якому зазначене антитіло представлене химерним антитілом, фрагментом химерного антитіла, доменом цього антитіла або фрагментом домену цього антитіла.
7. Кон'югат за п. 2, в якому зазначене антитіло представлене MY9, анти-В4, С242 або антитілом, яке зв'язується з антигеном, вибраним з групи, що складається з ЕрСАМ, CD2, CD3, CD4, CD5, CD6, CD11, CD19, CD20, CD22, CD26, CD30, CD33, CD37, CD38, CD40, CD44, CD56, CD79, CD105, CD138, рецепторами EphA, рецепторами EphB, EGFR, EGFRvIII, HER2, HER3, мезотеліном, білком Cripto, інтегрином альфаvбета3, інтегрином альфаvбета5, інтегрином альфаvбета6.
8. Кон'югат за п. 2, в якому зазначене антитіло представлене гуманізованим, людським антитілом або антитілом зі зміненою поверхнею, яке вибирають з-поміж антитіл Мy9-6, В4, С242, N901, DS6, які зв'язуються з рецептором ЕрhА2, антитіл, які зв'язуються з CD38, антитіл, які зв'язуються з IGF-IR, CNTO 95, В-В4, трастузумабу, пертузумабу, біватузумабу, сибротузумабу або ритуксимабу.
9. Кон'югат за п. 2, в якому зазначений агент, який зв'язується із клітиною, зв'язується із клітиною-мішенню, яку вибирають з-поміж пухлинних клітин, клітин, інфікованих вірусом, клітин, інфікованих мікроорганізмами, клітин, інфікованих паразитами, аутоімунних клітин, активованих клітин, мієлоїдних клітин, активованих Т-клітин, В-клітин або меланоцитів, клітин, які експресують один або декілька з-поміж наступного: IGF-IR, CanAg, EGFR, MUC1, MUC16, VEGF, TF, ЕрСАМ, CD2, CD3, CD4, CD5, CD6, CD11, CD11a, CD18, CD19, CD20, CD22, CD26, CD30, CD33, CD37, CD38, CD40, CD44, CD56, CD70, CD79, CD105, CD138, рецептори EphA, рецептори EphB, EGFRvIII, HER2/neu, HER3, мезотелін, білок Cripto, інтегрин aльфavбeтa3, інтегрин альфаvбета5, інтегрин альфаvбетаb і Аро2; або клітин, які експресують рецептор інсуліноподібного фактора росту, рецептор епідермального фактора росту або рецептор фолату.
10. Кон'югат за п. 9, в якому пухлинні клітини є клітинами, які вибирають з-поміж клітин раку молочної залози, клітин раку передміхурової залози, клітин раку яєчників, клітин колоректального раку, клітин раку шлунка, клітин плоскоклітинного раку, клітин дрібноклітинного раку легень та із клітин раку яєчок.
11. Сполука за п. 1, що представлена формулою, вибраною з групи:
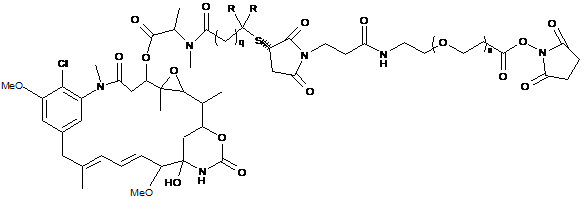 ;
;
 ;
;
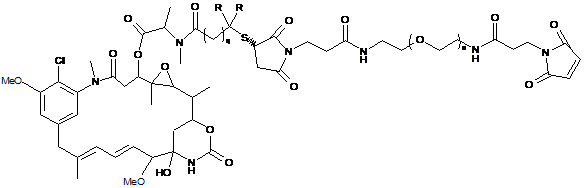 ;
;
 і
і
 ,
,
де n є цілим числом від 1 до 2000; R означає Н, q дорівнює 1 або R означає СН3 і q=2.
12. Кон'югат, представлений формулою, вибраною з групи:
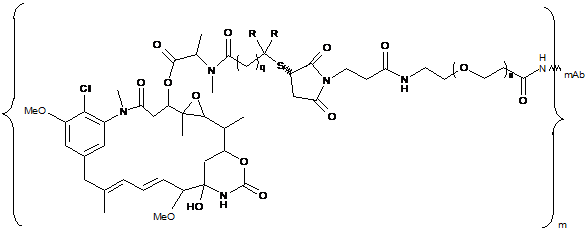 ;
;
 ;
;
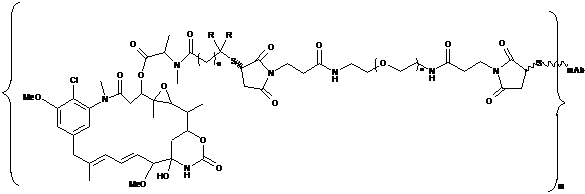 ;
;
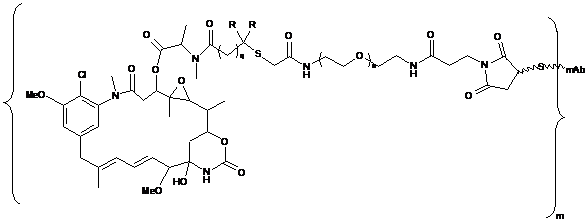 і
і
 ,
,
де n є цілим числом від 1 до 2000; m - ціле число від 2 до 15; mАb є моноклональним антитілом; R означає Н, q=l або R означає СН3 і q=2.
13. Сполука за п. 1 або 11, де n є цілим числом від 1 до 14.
14. Сполука за п. 13, де n є цілим числом від 1 до 4.
15. Кон'югат за будь-яким з пп. 2-10 та 12, де n є цілим числом від 1 до 14.
16 Кон'югат за п. 15, де n є цілим числом від 1 до 4.
17. Фармацевтична композиція для лікування пухлин, автоімунних захворювань, відторгнення трансплантатів, реакції трансплантатів проти носія, вірусних інфекцій та паразитарних інфекцій, чутливих до даної фармацевтичної композицій, яка містить ефективну кількість кон'югата майтанзиноїд-агент, що зв'язується із клітиною, за пп. 2, 12, 15 або п. 16 або його фармацевтично прийнятної солі або його сольвату і фармацевтично прийнятну основу, розріджувач або ексципієнт.
18. Спосіб лікування пухлин, автоімунних захворювань, відторгнень трансплантатів, реакції трансплантатів проти носія, вірусних інфекцій та паразитарних інфекцій, чутливих до лікування зазначеним способом, який передбачає парентеральне введення пацієнтові, який цього потребує, ефективної дози кон'югата за пп. 2, 12, 15 або 16.
19. Спосіб за п. 18, який відрізняється тим, що у ньому зазначену пухлину вибирають з-поміж одного або декількох видів раку легені, крові, плазми, молочної залози, товстої кишки, передміхурової залози, нирок, підшлункової залози, мозку, кісток, яєчників, сім'яників та органів лімфатичної системи.
20. Спосіб за п. 18, який відрізняється тим, що у ньому зазначена пухлина експресує одне або декілька з-поміж наступного: IGF-IR, FOLRL, CanAg, EGFR, EphA2, MUC1, MUC16, VEGF, TF, MY9 антитіл, анти-В4 антитіл, ЕрСАМ, CD2, CD3, CD4, CD5, CD6, CD11, CD11a, CD18, CD19, CD20, CD22, CD26, CD30, CD33, CD37, CD38, CD40, CD44, CD56, CD70, CD79, CD105, CD138, EphA, EphB, EGFRvIII, HER2/neu, HER3, мезотелін, білок Cripto, інтегрин альфаvбета3, інтегрин альфаvбета5, інтегрин aльфavбeтa6, Аро2 і антигени.
Текст
Реферат: UA 108598 C2 (12) UA 108598 C2 Зшиваючі агенти, для приєднання лікарських засобів до агентів, які зв'язуються із клітиною, модифікують із одержанням гідрофільних зшиваючих агентів, шляхом включення спейсера на основі поліетиленгліколю. Дієвість або ефективність кон'югатів агента, який зв'язується із клітиною, і лікарського засобу несподівано підсилюється в декілька разів у різних типах ракових клітин, включаючи ті клітини, які експресують низьке число антигенів на клітинній поверхні, або ті ракові клітини, які є стійкими до лікування. UA 108598 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки, до якої відноситься винахід Даний винахід має відношення до нових зшиваючих агентів, для приєднання лікарських засобів (наприклад, цитотоксичних лікарських засобів) до агентів, які зв'язуються із клітинами (наприклад, до антитіл), таким чином, щоб зшиваючий агент збільшував активність лікарського засобу. Особливо, даний винахід має відношення до застосування нових гідрофільних зшиваючих агентів, причому таких зшиваючих агентів, які в декілька разів підсилюють дієвість або ефективність кон’югатів, утворених агентами, які зв'язуються із клітинами, і лікарським засобом, у багатьох різних ракових клітинах, включаючи ті клітини, які експресують невелике число антигенів на клітинній поверхні або в пухлинах, стійких до лікування. Рівень техніки Кон’югати антитіл із цитотоксичними лікарськими засобами розробляють із метою одержати націлені на певну мішень терапевтичні засоби. Антитіла проти різних пухлинних антигенів клітинної поверхні кон’югують з різними цитотоксичними засобами, які інгібують багато важливих клітинних мішеней, таких як мікротрубочки (майтанзиноїди, ауристатини, таксани: патенти США №№ 5,208,020; 5,416,064; 6,333,410; 6,441,163; 6,340,701; 6,372,738; 6,436,931; 6,596,757; 7,276,497), DNA (каліхеаміцин, доксорубіцин, аналоги CC-1065; патенти США №№ 5,475,092; 5,585,499; 5,846,545; 6,534,660; 6,756,397; 6,630,579). Кон’югати антитіл з деякими із цих цитотоксичних лікарських засобів активно досліджують у клініках для лікування раку (Richart, A.D., і Tolcher, A.W., 2007, Nature Clinical Practice, 4, 245-255). Кон’югати антитіло-цитотоксичний засіб звичайний одержують за допомогою вихідної модифікації реакційноздатних груп на антитілах, таких як аміногрупи лізину, або групи цистеїну (одержані за допомогою відновлення природних дисульфідних зв'язків або за допомогою створення шляхом генно-інженерних прийомів додаткових неприродних цистеїнових залишків на антитілах за допомогою молекулярно-біологічних методів). Таким чином, антитіла спочатку модифікують гетеробіфункціональними зшиваючими реагентами, такими як ті, що описані вище, для прикладу можна навести SPDB, SMCC і SIAB (патент США № 6,913,758 і патентна публікація США № 20050169933) для включення зшиваючого агента, з реакційноздатною групою, такого як змішаний піридилдисульфід, малеінімід або галогенацетамід. Включену в антитіло реакційноздатну групу зшиваючого агента, потім кон’югують із цитотоксичним засобом, який містить реакційноздатну групу, таку як тіолова група. Інший спосіб кон’югації полягає в проведенні реакції між похідними цитотоксичного засобу, який містить групу, здатну реагувати з тіоловою групою (таку як галогенацетамід або малеінімід), і тіоловою групою на агентові, яка зв'язується із клітиною. Тіолові групи включають в агент, що зв'язується із клітинами, такий як антитіло, шляхом відновлення природних дисульфідних залишків (R. Singh et al., Anal. Biochem., 2002, 304, 147-156), або шляхом відновлення включених дисульфідних груп (за допомогою SPDP, сукцинімідил-3-(2-піридилдитіо)пропіонату, з наступним відновленням дитіотреітолом, D. G. Gilliland et al., Proc. Natl. Acad. Sci USA., 1980, 77, 4539-4543), або за допомогою включення додаткових неприродних цистеїнових залишків (J. B. Stimmel et al., J. Biol. Chem., 2000, 275, 30445- 30450), або шляхом включення тіолових груп у реакції з 2-імінотіоланом (R. Jue et al., Biochemistry, 1978, 17, 5399-5406), або складним ефіром метил-3-меркаптопропіонімідату (T.Р. King et al, Biochemistry, 1978, 17, 1499-1506). Кон’югати антитіло-цитотоксичний засіб з дисульфідними або тіоефірними зв'язками розщеплюються усередині клітин, приблизно в лізосомах, доставляючи активний цитотоксичний засіб усередину ракової клітини (H. K. Erickson et al., 2006, Cancer Research, 66, 4626-4433). Крім того, що кон’югати антитіло-цитотоксичний засіб з відновлюваним дисульфідним зв'язком убивають клітини-мішені, вони також убивають сусідні антиген-негативні клітини в змішаних популяціях антиген-негативних і антиген-позитивних клітин in vitro і in vivo у моделях із ксенотрансплантатами, що дозволяє припустити участь, цитотоксичного засобу, який вивільнився в клітині-мішені в поліпшенні ефективності у відношенні сусідніх клітин, які не експресують антиген, у пухлинах з експресією гетерогенних антигенів (Y. V. Kovtun et al., Cancer Research, 2006, 66, 3214-3221). Незважаючи на те, що кон’югати антитіло-цитотоксичний лікарський засіб продемонстрували свою здатність убивати клітини in vitro і мають протипухлинну активність in vivo, їхня ефективність ослаблена в багатьох випадках, особливо, у випадку, коли експресія антигену на раковій клітині-мішені є низькою, або коли клітини-мішені стійкі до обробки. Це часто має місце в клінічній практиці й приводить до низької чи до помірної протипухлинної активності в пацієнтів. Перспективний підхід до спроб обійти стійкість клітин полягає в синтезі нових лікарських засобів, які несуть гідрофільні або ліпофобні функціональні групи (дивися, G. Szokacs et al., Nature Reviews, 5; 219-235, 2006). Однак це трудомісткий спосіб, і деякі аналоги необхідно синтезувати, і часто модифікація в структурі лікарського засобу приводить до втрати 1 UA 108598 C2 5 10 15 20 25 30 35 40 45 50 55 біологічної активності. Таким чином, існує необхідність в іншому підході. Розкриття винаходу Даний винахід спрямований на розв'язання проблеми стійкості до лікарських засобів шляхом створення нових зшиваючих агентів, для приєднання лікарських засобів до агента, здатного зв'язатися із клітинами, таким чином, щоб зшиваючий агент, збільшував активність лікарського засобу. Таким чином, даний винахід удосконалить спосіб, за допомогою якого лікарські засоби приєднують до агента, який зв'язується із клітиною, таким чином, що створений зшиваючий агент, забезпечує кон’югати, активні у відношенні до широкого діапазону пухлин, особливо, у пухлинах з низькою експресією антигену або в пухлинах, стійких до лікарського засобу. Даний винахід заснований на новому відкритті того факту, що якщо традиційні зшиваючі агенти (наприклад, SMCC, SIAB тощо, описані в патентній публікації США № 20050169933) модифікують із утворенням гідрофільних зшиваючих агентів, шляхом включення спейсера, який представляє собою поліетиленгліколь [PEG n, (-CH2CH2O)n)], то дієвість або ефективність кон’югатів, що зв'язуються із клітиною агента - лікарського засобу несподівано підсилюється в кілька разів у ракових клітинах різних типів, включаючи клітини, які експресують низьку кількість антигенів на клітинній поверхні. Крім того, що ці PEG-вмісні кон’югати, у порівнянні з описаними раніше кон’югатами, несподівано виявилися більш ефективними відносно клітинних ліній, стійких до обробки лікарськими засобами. Крім того, у випадку кон’югатів з антитілами, включення гідрофільних зшиваючих агентів, дозволило здійснити кон’югацію аж до 15 молекул лікарського засобу на молекулу антитіла з високим виходом і без агрегації або преципітації. Ці кон’югати з гідрофільними зшиваючими агентами, з аж до 15 молекул лікарського засобу, пришитими на молекулу антитіла, зв'язуються з високою спорідненістю з антигеном-мішенню ( так само як це робить немодифіковане антитіло). Відповідно, даний винахід пропонує сполуку формули (1) або специфічну сполуку формули (1'): Z-Xl-(-CH2-CH2-O-)n-Yp-D (1) D-Yp-(-CH2-CH2-O-)n-Xl-Z (1') у якій: Z представляє реакційноздатною функціональною групою, яка може утворювати амідний або тіоефірний зв'язок з агентом, який зв’язуються із клітиною; D є лікарським засобом; X є аліфатичною, ароматичною або гетероциклічною структурною групою, приєднаною до агента, який зв'язується із клітиною, за допомогою тіоефірного зв'язку, амідного зв'язку, карбамінового зв'язку або простого ефірного зв'язку; Y є аліфатичною, ароматичною або гетероциклічною структурною групою, приєднаною до лікарського засобу за допомогою ковалентного зв'язку, який вибирають із групи, яка охоплює тіоефірний зв'язок, амідний зв'язок, карбаміновий зв'язок, простий ефірний зв’язок, амідний зв’язок, вуглець-вуглецевий зв’язок й гідразоновий зв'язок; l дорівнює 0 або 1; p дорівнює 0 або 1; і n є цілим числом від 1 до 2000. Інший аспект даного винаходу є кон’югатом агента, який зв’язується із клітиною, і лікарського засобу, формули (2), або специфічної сполуки, який має формулу (2'): CB-[Xl-(-CH2-CH2-O-)n-Yp-D]m (2) [D-Yp-(-CH2-CH2-O-)n-Хl]m-CВ (2') у якій, CB є агентом, який зв'язується із клітиною; D є лікарським засобом; X є аліфатичною, ароматичною або гетероциклічною структурною групою, приєднаною до агента, який зв’язується із клітиною за допомогою тіоефірного зв’язку, амідного зв’язку, карбамінового зв’язку або простого ефірного зв’язку; Y є аліфатичною, ароматичною або гетероциклічною структурною групою, приєднаною до лікарського засобу за допомогою ковалентного зв’язку, який вибирають із групи, яка охоплює тіоефірний зв’язок, амідний зв’язок, карбаміновий зв'язок, простий ефірний зв’язок, амідний зв’язок, вуглець-вуглецевий зв’язок й гідразоновий зв’язку; l дорівнює 0 або 1; p дорівнює 0 або 1; 2 UA 108598 C2 5 10 15 20 25 30 35 40 45 50 55 m є цілим числом від 2 до 15; і n є цілим числом від 1 до 2000. Інший аспект даного винаходу представлений сполукою формули (3), або специфічною сполукою формули (3'): Z-Xl-(-CH2-CH2O-)n-Y-D (3) D-Y-(-CH2-CH2O-)n-Xl-Z (3') у якій: Z представляє реакційноздатною функціональною групою, яка може утворювати амідний або тіоефірний зв'язок з агентом, який зв’язуються із клітиною; D є лікарським засобом; X є аліфатичною, ароматичною або гетероциклічною структурною групою, приєднаною до агента, який зв'язується із клітиною за допомогою тіоефірного зв’язку, амідного зв’язку, карбамінового зв’язку або простого ефірного зв’язку; Y є аліфатичною, неароматичною гетероциклічною або ароматичною гетероциклічною структурною групою, приєднаною до лікарського засобу за допомогою дисульфідного зв’язку; l дорівнює 0 або 1; і n є цілим числом від 1 до 14. Інший аспект даного винаходу пропонує кон’югат агента, який зв’язується із клітиною, і лікарського засобу формули (4), або специфічної сполуки формули (4'): CB-(Xl-(-CH2-CH2O-)n-Y-D)m (4) [D-Y-(-CH2-CH2O-)n-Хl]m-CB (4') у якій, CB є агентом, який зв'язується із клітиною; D є лікарським засобом; X є аліфатичною, ароматичною або гетероциклічною структурною групою, приєднаною до агента, який зв'язується із клітиною за допомогою тіоефірного зв’язку, амідного зв’язку, карбамінового зв’язку або простого ефірного зв’язку; Y є аліфатичною, ароматичною або гетероциклічною структурною групою, приєднаною до лікарського засобу за допомогою дисульфідного зв’язку; l дорівнює 0 або 1; і m є цілим числом від 3 до 8; і n є цілим числом від 1 до 14. Ще один додатковий аспект даного винаходу представляє спосіб лікування рака, чутливого до лікування за допомогою зазначеного способу. Спосіб передбачає парентеральне введення пацієнтові який цього потребує ефективної дози композиції, яка містить кон’югат формули (2) або (4). Короткий опис креслень На Фіг. 1 показана структурна формула типових PEG-вмісних тіосукцинімідильних кон’югатів даного винаходу (mАb = моноклональное антитіло). На Фіг. 2 показана структурна формула типових PEG-вмісних тіоацетамідильних кон’югатів даного винаходу. На Фіг. 3 показана структурна формула типових PEG-вмісних дисульфідних сполук даного винаходу. На Фіг. 4 показані схеми синтезу PEG-вмісних з’єднаних за допомогою тіосукцинімідильного зв’язку кон’югатів даного винаходу. На Фіг. 5 показана схема синтезу PEG-вмісних з’єднаних за допомогою тіосукцинімідильного зв’язку кон’югатів даного винаходу. На Фіг. 6 показані схеми синтезу PEG-вмісних з’єднаних за допомогою дисульфідного зв’язку сполук даного винаходу: a) Синтез PEG-вмісної з'єднаної за допомогою дисульфідного зв’язку сполуки для одностадійної кон'югації з агентом, який зв'язується із клітиною; і b) Синтез гетеробіфункціональної PEG-вмісної з'єднаної за допомогою дисульфідного зв’язку поперечносшиваючої сполуки. На Фіг. 7 наведена методика проведення кон'югації для PEG-вмісних з’єднаних за допомогою тіосукцинімідильного зв’язку кон’югатів даного винаходу (одностадійна кон'югація). На Фіг. 8 наведена методика кон'югації для PEG-вмісного з'єднаного за допомогою тіосукцинімідильного зв'язку кон’югата даного винаходу (двухстадійна кон'югація). На Фіг. 9 наведена методика кон'югації для PEG-вмісного з'єднаного через тіоефірний зв'язок (з'єднаного через тіоацетамідильний зв'язок) кон’югата даного винаходу (одностадійна кон'югація). На Фіг. 10 наведена методика проведення кон'югації для PEG-вмісного з'єднаного через 3 UA 108598 C2 5 10 15 20 25 30 35 40 45 50 55 60 тіоефірний зв'язок (з'єднаного через тіоацетамідильний зв'язок) кон’югата даного винаходу (двухстадійна кон'югація). На Фіг. 11 наведена методика проведення кон'югації для PEG-вмісного з'єднаного за допомогою дисульфідного зв'язку кон’югата даного винаходу (одностадійна кон'югація). На Фіг. 12 наведена методика проведення кон'югації для PEG-вмісного з'єднаного за допомогою дисульфідного зв'язку кон’югата даного винаходу (двухстадійна кон'югація). На Фіг. 13 показана схема синтезу PEG-вмісної, реакційноздатної за сульфгідрильною групою, з'єднаної за допомогою тіосукцинімідильного зв'язку сполуки даного винаходу. На Фіг. 14 наведена методика проведення кон'югації для PEG-вмісного з'єднаного за допомогою тіосукцинімідильного зв'язку кон’югата даного винаходу (одностадійна кон'югація). На Фіг. 15 наведена методика проведення кон'югації для PEG-вмісного, з'єднаного за допомогою тіосукцинімідильного зв'язку кон’югата даного винаходу (двухстадійна кон'югація). На Фіг. 16 показана схема синтезу для PEG-вмісної, реакційноздатної за сульфгідрильною групою, з'єднаної через тіоацетамідильний зв'язок сполуки даного винаходу; a) Синтез PEGвмісної, реакційноздатної за сульфгідрильною групою, з'єднаної через тіоацетамід сполуки для 1- східчастої кон'югації; і b) Синтез гетеробіфункціональної PEG-вмісної, реакційноздатної за сульфгідрильною групою поперечнозшиваючої сполуки для кон'югації у дві стадії. На Фіг. 17 наведена методика проведення кон'югації для PEG-вмісних з'єднаних через тіоацетамідильний зв'язок кон’югатів даного винаходу (одностадійна кон'югація). На Фіг. 18 наведена методика проведення кон'югації для PEG-вмісних з'єднаних за допомогою тіоацетамідильного зв’язку кон’югатів даного винаходу (двухстадійна кон'югація). На Фіг. 19 показана схема синтезу для PEG-вмісної, реакційноздатної за сульфгідрильною групою, з'єднаної через тіоефірний зв'язок сполуки даного винаходу: a) Синтез PEG-вмісної, реакційноздатної за сульфгідрильною групою, з'єднаної через тіоацетамідильний зв'язок сполуки для 1- східчастої кон'югації; і b) Синтез гомобіфункціональної PEG-вмісної, реакційноздатної за сульфгідрильною групою поперечнозшиваючої сполуки для кон'югації у дві стадії. На Фіг. 20 наведена методика проведення кон'югації для PEG-вмісного з'єднаного через тіоацетамідильний зв'язок кон’югата даного винаходу (одностадійна кон'югація). На Фіг. 21 наведена методика проведення кон'югації для PEG-вмісного з'єднаного через тіоацетамідильний зв'язок кон’югата даного винаходу (двухстадійна кон'югація). На Фіг. 22 наведені результати мас-спектрометричного аналізу (MS) деглікозильованого кон’югата HuАb-PEG4-Mal-Dm (у середньому 10,7 молекул DM1/Ab). На Фіг. 23 наведені результати гель-хроматографії (SEC) кон’югата HuАb-PEG4-Mal-Dm (у середньому 10,7 молекул DM1/Ab). На Фіг. 24 показано, що зв'язування кон’югата HuАb-PEG4-Mal-Dm (10,7 молекул майтанзиноїду/антитіло), визначене методом FACS, не відрізняється від зв'язування немодифікованого антитіла. На Фіг. 25 показаний цитотоксичний ефект кон’югатів анти-EpCAM антитіло-майтанзиноїд на клітини COLO205-MDR з мультилікарською резистентністю. На Фіг. 26 показаний цитотоксичний ефект кон’югатів анти-CanАg антитіло-майтанзиноїд на клітини COLO205-MDR з мультилікарською резистентністю. На Фіг. 27 показаний цитотоксичний ефект кон’югатів анти-CD56 антитіло-майтанзиноїд на клітини Molp-8 множинної мієломи. На Фіг. 28 показаний цитотоксичний ефект кон’югатів анти-EpCAM антитіло-майтанзиноїд на клітини HCT15. На Фіг. 29 показаний цитотоксичний ефект кон’югатів анти-EpCAM антитіло-майтанзиноїд на клітини COLO205 mdr. На Фіг. 30 показана протипухлинна активність кон’югатів анти-EpCAM антитіло-майтанзиноїд на ксенотрансплантатах HCT15 in vivo. На Фіг. 31 показана протипухлинна активність кон’югатів анти-EpCAM антитіло-майтанзиноїд на ксенотрансплантатах COLO205 mdr in vivo. На Фіг. 32 показана протипухлинна активність кон’югатів анти-EpCAM антитіло-майтанзиноїд на ксенотрансплантатах COLO 205 in vivo. На Фіг. 33 показана протипухлинна активність кон’югатів анти-CanАg антитіло-майтанзиноїд на ксенотрансплантатах COLO 205 mdr in vivo. На Фіг. 34 показане зв'язування кон’югата анти-CanАg антитіло (huc242)-PEG24-Mal-Dm1 з аж до 17 молекул D/A. На Фіг. 35 показана дієвість in vitro кон’югатів анти-CanАg антитіло (huc242)-PEG24-Mal-Dm1 з від 4 до 17 молекул D/A відносно клітин COLO 205. 4 UA 108598 C2 5 10 15 20 25 30 35 40 45 50 55 На Фіг. 36 показана дієвість in vitro кон’югатів анти-CanАg антитіло (huc242)-PEG24-Mal-Dm1 з від 4 до 17 молекул D/A відносно клітин (pgp+) COLO205-MDR з множинною фармацевтичною стійкістю. На Фіг. 37 показаний цитотоксичний ефект кон’югатів анти-EGFR антитіло-майтанзиноїд на клітини UO-31. На Фіг. 38 показана фармакокінетика в плазмі крові антитіло-PEG4-Mal-Dm. Здійснення винаходу Цей винахід розкриває нові знахідки, які полягають у тому, що кон’югати агента, який зв’язується із клітинами, такого як антитіло, з'єднаного з лікарськими засобами, наприклад, цитотоксичними засобами, за допомогою зшиваючих агентів, на основі поліетиленгліколю або поліетиленоксиду ((-CH2CH2O)n), демонструють у кілька раз більш високу, ніж можна було б очікувати, цитотоксичність стосовно ракових клітин-мішеней, у порівнянні із загальновідомими кон’югатами агентів, що зв'язуються із клітиною, з лікарським засобом, з типовими аліфатичними, зшиваючими агентами й подібним навантаженням лікарського засобу. Важливо, що кон’югати, описані в цьому винаході, є засобами, потужними або високоефективними у відношенні до ракових клітин, які мають мультилікарську резистентність (mdr) і які погано сприйнятливі до лікування за допомогою цитотоксичних лікарських засобів. Терапія раку зазнає труднощів у пошуках підходів до подолання механізмів стійкості до лікарських засобів, що часто зустрічається після множинних циклів лікування за допомогою різних хемотерапевтичних засобів. Один з таких механізмів, який спостерігається у ракових клітинах і називається мультилікарською резистентністю, викликається посиленням експорту лікарських засобів через Atp-Зв’язуючі касетні транспортери (ABC) (C. Drumond, B.I. Sikic, J. Clin. Oncology, 1999, 17, 1061-1070, G, Szokacs et al., Nature Reviews, 5; 219-234, 2006). Терапії, які допоможуть подолати ці механізми стійкості до лікарських засобів, такі як перешкоджаючі витоку лікарських засобів з ракових клітин або, що обходять цей ефект, були б надзвичайно корисні. Цитотоксичність PEGз'єднаних кон’югатів агента, який зв’язується із клітинами, і цитотоксичних лікарських засобів оцінюють по реакції ракових клітин з мультилікарською резистентністю для того, щоб протестувати, чи надають PEG- зшиваючі агенти, яку-небудь перевагу у відношенні цих стійких клітин. У цих аналізах у відношенні mdr-клітин, PEG-вмісні кон’югати агента, який зв’язується із клітинами, і цитотоксичних лікарських засобів продемонстрували несподівану високу ефективність при знищенні mdr-клітин у порівнянні зі значно менш ефективними кон’югатами, отриманими за допомогою традиційних зшиваючих агентів. Крім того, кон’югати запропоновані даним винаходом також демонструють суттєво більш високу протипухлинну активність у моделях на тваринах, створених із застосуванням пухлинних клітин з мультилікарською резистентністю. Застосування гідрофільних зшиваючих агентів, на основі поліетиленгліколю або поліетиленоксиду (PEG або PEO; (-CH2-CH2O)n) також дозволяє включити досить велике число молекул лікарських засобів у молекулу агента, який зв’язується із клітиною, з високим рівнем мономерів білка, рівним більш ніж 90% при концентраціях, рівних більш ніж 1 мг/мл, що бажане для терапевтичного застосування. Крім того, поліетиленгліколь (PEG)-з'єднані кон’югати агента, який зв’язується із клітинами, що несуть цитотоксичний лікарський засіб у широкому діапазоні навантажень (від невеликої величини, рівної 2, до значного числа, такого як 15 приєднаних молекул лікарського засобу на агент, що зв'язується із клітиною), демонструють значне посилення цитотоксичного ефекту стосовно ракових клітин-мішеней, ніж можна було б очікувати, виходячи зі стехіометричного збільшення доставки лікарського засобу, заснованої на збільшенні навантаження лікарського засобу кон’югатів. Описані в цьому винаході кон’югати агента, який зв’язується із клітиною, і лікарського засобу, що несуть PEG-спейсери, демонструють суперстехіометричне збільшення в цитотоксичності стосовно ракових клітинмішеней, ефективність збільшувалася аж до в 260-650 раз (див. наприклад, Фіг. 29) у порівнянні з кон’югатами, одержуваними загальноприйнятим шляхом, з подібним навантаженням лікарським засобом. Таким чином, в одному з аспектів винаходу описані лікарські засоби з зшиваючими агентами, які несуть поліетиленгліколевий спейсер (-CH2CH2O)n і реакційноздатну групу, здатну реагувати з агентом, який зв’язуються із клітиною. У цьому аспекті передбачена конкретна модифікована сполука формули (1), або сполука формули (1'): Z-Xl-(-CH2-CH2-O-)n-Yp-D (1) D-Yp-(-CH2-CH2-O-)n-Xl-Z (1') у якій: Z є реакційноздатною функціональною групою, яка може утворювати амідний або 5 UA 108598 C2 5 10 15 20 25 30 35 40 45 50 55 тіоефірний зв'язок з агентом, який зв’язуються із клітиною; D є лікарським засобом; X є аліфатичною, ароматичною або гетероциклічною структурною групою, приєднаною до агента, який зв’язується із клітиною за допомогою тіоефірного зв’язку, амідного зв’язку, карбамінового зв’язку або простого ефірного зв’язку; Y є аліфатичною, ароматичною або гетероциклічною структурною групою, приєднаною до лікарського засобу за допомогою ковалентного зв'язку, який вибирають із групи, яка складається з тіоефірного зв’язку, амідного зв’язку, карбамінового зв’язку, простого ефірного зв’язку, амідного зв'язку, вуглець-вуглецевого зв’язку та гідразонового зв’язку; l дорівнює 0 або 1; p дорівнює 0 або 1; і n є цілим числом від 1 до 2000. Бажано, ковалентний зв'язок, через який Y приєднаний до лікарського засобу, є тіоефірним зв’язком або амідним зв'язком. Бажано, n є цілим числом від 1 до 100. Ще більш бажано, n є цілим числом від 1 до 14. У найбільш кращому аспекті n є цілим числом від 1 до 4. У другому аспекті винаходу описані нові кон’югати агента, який зв’язується із клітинами, і лікарських засобів з зшиваючими агентами на основі поліетиленгліколю (-CH2-CH2O)n. Ці кон’югати більш ефективні стосовно ракових клітин, ніж кон’югати, отримані за допомогою традиційних зшиваючих агентів, і мають еквівалентне навантаження лікарським засобом. У цьому кращому аспекті спеціально передбачений кон’югат агента, який зв’язується із клітиною, і лікарського засобу формули (2), або сполуки формули (2'): CB-[Xl-(-CH2-CH2-O-)n-Yp-D]m (2) [D-Yp-(-CH2-CH2-O-)n-Хl]m-CВ (2') у якій: CB є агентом, який зв’язується із клітиною; D є лікарським засобом; X є аліфатичною, ароматичною або гетероциклічною структурною групою, приєднаною до агента, який зв’язується із клітиною за допомогою тіоефірного зв’язку, амідного зв’язку, карбамінового зв’язку або простого ефірного зв’язку; Y є аліфатичною, ароматичною або гетероциклічною структурною групою, приєднаною до лікарського засобу за допомогою ковалентного зв'язку, який вибирають із групи, яка складається з тіоефірного зв’язку, амідного зв’язку, карбамінового зв'язку, простого ефірного зв’язку, амідного зв'язку, вуглець-вуглецевого зв’язку та гідразонового зв’язку; l дорівнює 0 або 1; p дорівнює 0 або 1; і m є цілим числом від 2 до 15; і n є цілим числом від 1 до 2000. Бажано, ковалентний зв'язок є тіоефірним зв’язком або амідний зв'язок. Бажано, m є цілим числом від 3 до 8. Бажано, n є цілим числом від 1 до 100. Ще більш бажано, n є цілим числом від 1 до 14. У найбільш кращому аспекті, n є цілим числом від 1 до 4. Даний винахід також заснований на новому відкритті того, що у випадку кон’югатів антитіл, у яких антитіло приєднане до цитотоксичних лікарських засобів через дисульфідні зв’язки, існує важлива кореляція між числом приєднаних лікарських засобів і довжиною поліетиленгліколевого спейсера на посилення дієвості або ефективності імунокон’югата. Додаткова перевага такої конструкції зшиваючого агента, полягає в одержання бажаної високої частки мономера й мінімальної агрегації кон’югатів антитіло - лікарський засіб. Таким чином, в одному з аспектів даний винахід заснований на важливому відкритті того, що, якщо поліетиленгліколевий спейсер для з'єднаного через дисульфідний зв'язок кон’югата складається з 2-8 ланок етиленоксиду й число приєднаних лікарських засобів варіює від 3 до 8, то це приводить до утворення кон’югатів антитіло - лікарський засіб з найвищою біологічною дієвістю або ефективністю, а також забезпечує бажаний високий вміст мономера. У кращому аспекті описані цитотоксичні лікарські засоби, приєднані через дисульфідні групи (-S-S-), які несуть короткі поліетиленгліколеві спейсери ((CH 2CH2O)n=1-14) з функціональною групою, здатною реагувати з агентом, який зв’язуються із клітиною. У цьому кращому аспекті спеціально передбачена модифікована цитотоксична сполука формули (3) або сполука формули (3'): Z-Xl-(-CH2-CH2O-)n-Y-D (3) D-Y-(-CH2-CH2O-)n-Xl-Z (3') 6 UA 108598 C2 5 10 15 20 25 30 35 40 45 50 55 у якій; Z є реакційноздатною функціональною групою, яка може утворювати амідний або тіоефірний зв'язок з агентом, який зв’язуються із клітиною; D є лікарським засобом; X є аліфатичною, ароматичною або гетероциклічною структурною групою, приєднаною до агента, який зв’язується із клітиною за допомогою тіоефірного зв’язку, амідного зв’язку, карбамінового зв’язку або простого ефірного зв’язку; Y є аліфатичною, неароматичною або гетероциклічною структурною групою, приєднаною до лікарського засобу за допомогою дисульфідного зв'язку; l дорівнює 0 або 1; і n є цілим числом від 1 до 14. Бажано, n є цілим числом від 2 до 8. В іншому кращому аспекті описані кон’югати агента, який зв’язується із клітинами, і лікарських засобів, приєднаних через дисульфідну групу (-S-S-), що несуть поліетиленгліколеві спейсери ((CH2-CH2O)n=1-14) з навантаженням лікарським засобом у вузькому діапазоні, рівному 3-8 молекулам, які демонструють досить високоефективну біологічну активність стосовно ракових клітин, мають бажані біологічні властивості, з високим виходом кон'югації, з високою часткою мономера та з мінімальною агрегацією білків. У цьому кращому аспекті передбачений кон’югат агента, який зв’язується із клітиною, і лікарського засобу формули (4), або сполука формули (4'): CB-(Xl-(-CH2-CH2O-)n-Y-D)m (4) [D-Y-(-CH2-CH2O-)n-Хl]m-CB (4') у якій: CB є агентом, який зв’язується із клітиною; D є лікарським засобом; X є аліфатичною, ароматичною або гетероциклічною структурною групою, приєднаною до агента, який зв’язується із клітиною за допомогою тіоефірного зв’язку, амідного зв’язку, карбамінового зв’язку або простого ефірного зв’язку; Y є аліфатичною, ароматичною або гетероциклічною структурною групою, приєднаною до лікарського засобу за допомогою дисульфідного зв'язку; l дорівнює 0 або 1; m є цілим числом від 3 до 8; і n є цілим числом від 1 до 14. Бажано, m є цілим числом від 3 до 6. Також бажано, n є цілим числом від 2 до 8. У цьому винаході лікарські засоби є ліпофільними молекулами, при кон'югації з агентами, які зв'язуються із клітинами, такими як антитіла, часто відбувається втрата в їхньому виході через агрегацію або преципітацію білків. Збільшення числа молекул лікарських засобів на молекулу агента, який зв’язується із клітиною, звичайно приводить до погіршення агрегації й преципітації білків, і, як наслідок, до низького процентного вмісту мономерів і низького виходу. На відміну від поведінки звичайних кон’югатів із загальноприйнятими зшиваючими агентами, застосування PEG- зшиваючих агентів, приводить до бажаного поліпшення в процентному вмісті мономерів (>90% мономерів) і збільшення виходу (>70%) кон’югатів агента, який зв’язується із клітинами, з лікарськими засобами у високих концентраціях, рівних 1 мг/мл або більше, які корисні при терапевтичних застосуваннях. Крім того, ці кон’югати стабільні при тривалому зберіганні при 40 °C. У всіх аспектах «аліфатичну структурну одиницю» визначають як алкільну, алкенільну або алкинільну групу. Алкільна група представлена аліфатичною вуглеводневою групою, яка може бути нерозгалуженою або розгалуженою, що бажано має від 1 до 20 атомів вуглецю в ланцюзі або в циклі, що бажано має від 3 до 10 атомів вуглецю. Переважні алкільні групи мають від 1 до 12 атомів вуглецю в ланцюзі. Термін «розгалужена» означає, що один або кілька радикалів нижчих алкілів, таких як метил, етил або пропіл приєднані до лінійного алкільного ланцюга. Типові алкільні групи включають метил, етил, н-пропіл, ізопропіл, н-бутил, трет-бутил, н-пентил, 3-пентил, октил, ноніл, децил, циклопентил і циклогексил. Алкенільна група представлена аліфатичною вуглеводневою групою, що містить вуглецевий-вуглець-вуглецевий подвійний зв'язок, і яка може бути нерозгалуженою або розгалуженою, що бажано має від 2 до 15 атомів вуглецю в ланцюзі. Більш кращі алкенільні групи мають 2 до 12 атомів вуглецю в ланцюзі; і більш бажано приблизно від 2 до 4 атомів вуглецю в ланцюзі. Типові алкенільні групи включають етеніл, пропеніл, н-бутеніл, ізобутеніл, 2еніл, н-пентеніл, гептеніл, остеніл, ноненіл, десеніл. 7 UA 108598 C2 5 10 15 20 25 30 35 40 45 50 55 60 Алкинільна група представлена аліфатичною вуглеводневою групою, яка містить вуглецевий-вуглець-вуглецевий потрійний зв'язок, і яка може бути нерозгалуженою або розгалуженою, що бажано має від 2 до 15 атомів вуглецю в ланцюзі. Кращі алкинільні групи мають від 2 до 12 атомів вуглецю в ланцюзі; і більш бажано від 2 до 4 атомів вуглецю в ланцюзі. Типові алкинільні групи включають етиніл, пропиніл, н-бутиніл, 2-бутиніл, 3-метилбутиніл, нпентиніл, гептиніл, октиніл і десиніл. Так, як застосовано в цій заявці, термін «ароматична структурна одиниця» означає заміщену або незаміщену арильну групу, яка складається з ароматичної моноциклічної або поліциклічної системи вуглецевоводневих кілець із від 6 до 14 атомів вуглецю, бажано з від 6 до 10 атомів вуглецю. Типові арильні групи включають феніл і нафтил. Замісники включають, але не обмежуються, алкільні групи, галогени, нітро-, аміно-, гідрокси- і алкоксигрупи. Галогени включають атоми фтору, хлору, брому і йоду. Атоми фтору й хлору кращі. Так, як застосований у цій заявці, термін «гетероциклічна структурна одиниця» означає насичені, частково ненасичені або ненасичені, неароматичні стабільні від 3-х до 14-ти, бажано, від 5-ти до 10-членні моно-, бі- або поліциклічні кільця, у яких, щонайменше, один член кільця є гетероатомом, або ароматичні, бажано від 5-ти до 10-членні моно-, бі- або поліциклічні кільця, що несуть, щонайменше, один гетероатом. Звичайно, гетероатоми включають, але не обмежуються, кисень, азот, сірку, селен і фосфор атоми. Кращі гетероатоми представлені киснем, азотом і сіркою. Кращі гетероциклічні структурні одиниці включають, але не обмежуються, піролідиніл, піразолідиніл, імідазолідиніл, оксираніл, тетрагідрофураніл, диоксоланіл, тетрагідропіраніл, диоксаніл, диоксоланіл, піперидил, піперазиніл, морфолініл, піраніл, імідазолиніл, піролініл, піразолініл, тіазолідиніл, тетрагідротіопіраніл, дитіаніл, тіоморфолініл, дигідропіраніл, тетрагідропіраніл, дигідропіраніл, тетрагідропіридил, дигідропіридил, тетрагідропіринідиніл, дигідротіопіраніл, азепаніл, піроліл, піридил, піразоліл, тієніл, піримідиніл, піразиніл, тетразоліл, індоліл, хінолініл, пуриніл, імідазоліл, тієніл, тіазоліл, бензотіазоліл, фураніл, бензофураніл, 1,2,4-тіадиазоліл, ізотіазоліл, триазоіл, тетразоліл, ізохіноліл, бензотієніл, ізобензофурил, піразоліл, карбазоліл, бензимідазоліл, і ізоксазоліл, піридил-н-оксид, а також конденсовані системи, отримані в результаті конденсації з фенільною групою. Аліфатичні, ароматичні та гетероциклічні структурні одиниці, представлені символами X і Y, можуть також мати заряджений замісник. Заряджений замісник може бути негативно заряджений, тоді його вибирають, але, не обмежуючись, з карбоксилата, сульфоната й фосфатів, або може бути позитивно заряджений, тоді його вибирають із третинної або четвертинної аміногрупи. Так, як застосовано в цій заявці, під виразом «приєднаний до агента, який зв’язується із клітиною» розуміють молекулу кон’югата, що включає, щонайменше, одне похідне лікарського засобу, пов'язане з агентом, який зв’язується із клітиною, через підходящу групу, що зшиває, або через її попередника. Кращими зшиваючими групами, є тіолові групи або дисульфідний зв'язок або їх попередників. Так, як застосовано в цій заявці, термін «попередник» даної групи означає будь-яку групу, яка може привести до утворення такої групи в результаті зняття захисту, хімічної модифікації або, сполучної реакції. Наприклад, попередник може бути відповідним чином захищеною функціональною групою, у якості прикладів можна привести тіоефір або тіоефір у якості попередника тіолової групи. Так, як застосовано в цій заявці, термін «реакційноздатна функціональна група» означає аміно-, тіолову або гідроксильну реакційноздатну функціональну групу. Інакше кажучи, реакційноздатна функціональна група може реагувати з аміно-, сульфгідрильною(тіоловою) або гідроксильною групою, що присутня на агентові, що зв'язується із клітиною. Наприклад, для реакційноздатної функціональної аміногрупи, функціональна група може бути реакційноздатним складним ефіром карбонової кислоти (включаючи N-сукцинімідні, N-сульфосукцинімідні, Nфталімідильні, N-сульфофталімідильні, 2-нітрофенільні, 4-нітрофенільні, 2, 4-динітрофенільні, 4-нітрофенільні, 4-нітрофенільні, тетрафторфенільні ефіри), реакційноздатним похідним сульфонової кислоти, або реакційноздатним тіоефіром з утворенням амідного зв’язку; для реакційноздатної функціональної тіолової групи, функціональна група може являти собою малеінімід, галогенацетамід або вінілсульфон з утворенням тіоефірного зв’язку; і для реакційноздатної функціональної гідроксильної групи, функціональна група може являти собою реакційноздатний ефір карбонової кислоти з одержанням ефірного зв’язку. A. МОДИФІКОВАНІ ЛІКАРСЬКІ ЗАСОБИ ТА МОДИФІКОВАНІ АГЕНТИ, ЩО ЗВ'ЯЗУЮТЬСЯ ІЗ КЛІТИНОЮ, ЯКІ НЕСУТЬ ГІДРОФІЛЬНІ ЗШИВАЮЧІ АГЕНТИ Зшиваючий агент, представлений будь-якою хімічною групою, здатною стабільно, 8 UA 108598 C2 5 10 15 20 25 30 35 40 45 50 55 60 ковалентно приєднувати лікарський засіб, такий як майтанзиноїд, до агента, який зв’язується із клітиною. Зшиваючі агенти, можуть зазнати розщеплення яке індукується кислотою, розщеплення, яке індукується світлом розщеплення, яке індукується пептидазою, розщеплення, яке індукується естеразою та розщеплення дисульфідних зв'язків, або суттєво стійкими до нього в умовах, при яких лікарський засіб або агент, що зв'язується із клітиною, залишаються активними. На Фіг. 1, 2 і 3 наведені структурні формули типових кон’югатів даного винаходу. Придатні поперечнозшиваючі реагенти, які включають гідрофільні ланцюги PEG, які формують зшивки між лікарським засобом і агентом, який зв’язується із клітиною, добре відомі в цій галузі техніки або комерційно доступні (наприклад, у компанії «Quanta Biodesign», Powell, Ohio). Підходящі PEG-вмісні поперечнозшиваючі агенти також можна синтезувати з комерційно доступних PEG, застосовуючи стандартні методики хімічного синтезу, відомі фахівцям у цій галузі техніки. Може бути проведена реакція між лікарськими засобами й біфункціональними PEG-вмісними поперечнозшиваючими агентами з одержанням сполуки, яка має формулу (1), Z Xl-(-CH2-CH2-O-)n-Yp-D, за допомогою способів, описаних у цьому документі. Наприклад, лікарський засіб майтанзиноїд, який містить тіолові групи може вступити в реакцію з поперечнозшиваючим агентом на основі біс-малеініміду, який несе PEG-спейсер, з одержанням лікарського засобу майтанзиноїду, з'єднаного через тіоефірний зв'язок з PEG-спейсером (дивися, наприклад, фігуру 13). Цей модифікований майтанзиноїд, що несе PEG-спейсер, і термінальна малеінімідо-група можуть потім прореагувати з агентом, який зв’язується із клітиною, як показано, наприклад, на Фіг. 14, забезпечуючи кон’югат агента, який зв’язується із клітиною, та лікарський засіб формули (2) даного винаходу. Напроти, агент, що зв'язується із клітиною, може першим прореагувати з одним з кінців біфункціонального PEG, що містить поперечнозшиваючий агент, що несе реакційноздатні аміногрупи, такі як ефір N-Гідроксисукциніміду, з одержанням модифікованого агента, який зв’язується із клітиною, ковалентно зв'язаного з агентом, що зшиває через амідний зв'язок (дивися, наприклад, фігуру 15). На наступній стадії майтанзиноїд взаємодіє з малеінімідним замісником на іншому кінці PEG-спейсера з одержанням кон’югата агент, що зв'язується із клітиною, в лікарський засіб даного винаходу. На Фіг. 16 і 17 наведені приклади синтезу поперечнозшиваючого агента на основі PEG і його реакція з майтанзиноїдом через тіоацетамідну зшивку. Малеінімідний замісник потім включають в PEG, що дає можливість проводити реакцію з агентом, який зв’язуються із клітиною, через тіоефірний зв'язок. Напроти, як показано, наприклад, на Фіг. 18, спочатку агент, що зв'язується із клітиною, приєднують до поперечнозшиваючого PEG-агента через тіоефірний зв'язок. Модифікований агент, що зв'язується із клітиною, потім реагує з майтанзиноїдним лікарським засобом з одержанням кон’югата. Синтез гомобіфункціонального PEG поперечнозшиваючого агента, у якого обидва кінці PEG-спейсера містять йодацетамідне угруповання, яке здатне утворювати зв'язок, як із цитотоксичним лікарським засобом, так і з агентом, який зв’язуються із клітиною, через тіоефірні зв’язки з одержанням кон’югата, що містить гідрофільний PEGспейсер, показаний, наприклад, на Фіг. 19. Методика кон'югації, яка забезпечує кон’югати запропоновані даним винаходом, наведена, наприклад, на Фіг. 20 і 21. Фахівцям у цій галузі техніки відомо, що інші PEG-вмісні поперечнозшиваючі агенти, що несуть різні реакційноздатні групи, можуть бути легко синтезовані за допомогою способів, описаних у цьому документі. Наприклад, лікарський засіб, що несе гідроксильну групу, таку як 19-деметилмайтанзиноїди (патент США № 4,361,650) може вступати в реакцію з агентом, що зшиває на основі йодоацетил-PEG (Фіг. 5) у присутності основи, такої як карбонат калію, приєднуючи майтанзиноїд через ефірний зв'язок. У такий же спосіб, аміновмісний майтанзиноїд (синтезований так, як описано в патенті США № 7,301,019) може вступати в реакцію з йодоацетил-PEG (показано на Фіг. 5), у присутності основи, такої як піридин або тріетиламін, забезпечуючи майтанзиноїд, з'єднаний з PEG через амідний зв'язок. Для того щоб зв'язати лікарський засіб з PEG через амідний зв'язок карбокси-PEG (показано на Фіг. 5) може вступати в реакцію з аміновмісним майтанзиноїдом у присутності засобу, що конденсує, такого як дициклогексилкарбодиімід, забезпечуючи PEG-майтанзиноїд, зв'язаний через амід. Для того щоб приєднати лікарський засіб до PEG-спейсера через карбаматний зв'язок, спочатку проводять реакцію PEG з дифосгеном, забезпечуючи PEG-хлорформіат, який може потім прореагувати з аміновмісним майтанзиноїдом, у присутності основи, такої як триетиламін, з одержанням з'єднаного через карбамат PEG-майтанзиноїда. Приклади підходящих зшиваючих агентів, включають зшиваючі агенти, які мають Nсукцинімідил-ефірну або N-сульфосукцинімідил-ефірну групу для проведення реакції з агентом, який зв’язуються із клітиною, а також засновані на малеініміді або галогенацетилі групи для реакції з лікарським засобом. PEG-спейсер може бути включений у кожний з 9 UA 108598 C2 5 10 15 20 25 30 35 40 45 50 55 60 поперечнозшиваючих агентів, відомих у цій галузі техніки, за допомогою способів, описаних у цьому документі. Поперечнозшиваючі реагенти, які включають групи на основі малеініміду, які можуть бути вставлені з PEG-спейсером, включають, але не обмежуються, N-сукцинімідил-4(малеінімідометил)-циклогексанкарбоксилат (SMCC), N-сукцинімідил-4-(N-малеінімідометил)циклогексан-1-карбокси-(6-амідокапроат), який є «довголанцюговим» аналогом SMCC (LCSMCC), N-сукцинімідний ефір κ-малеінімідоундеканової кислоти (KMUA), N-сукцинімідний ефір γ-малеінімідоолійної кислоти (GMBS), сукцинімідний гідроксисукцинімідний ефір εмалеінімідокапронової кислоти (EMCS), μ-малеінімідобензоіл-N-гідроксисукцинімідний ефір (MBS), N-(-малеінімідоацетокси)-сукцинімідний ефір (AMAS), сукцинімідил-6-(βмалеінімідопропіонамідо)гексаноат (SMPH), N-сукцинімідил-4-(n-малеінімідофеніл)-бутират (SMPB) і N-(n-малеінімідофеніл)ізоціанат (PMPI). Поперечнозшиваючі реагенти, які включають галогенацетильну групу, включают N-сукцинімідил-4-(йодоацетил)-амінобензоат (SIAB), Nсукцинімідил-йодоацетат (SIA), N-сукцинімідил-бромацетат (SBA) і N-сукцинімідил-3(бромацетамідо)пропіонат (SBAP) Інші поперечнозшиваючі реагенти, позбавлені атому сірки, також можуть бути застосовані в способі винаходу. Такі зшиваючі агенти, можуть бути отримані з функціональних груп на основі дикарбонових кислот. Підходящі функціональні групи на основі дикарбонових кислот включають, але не обмежуються, α, ω-дикарбонові кислоти загальної формули, наведеної нижче: HOOC-А'p-E'q-(CH2CH2O)nG'r-COOH де A' є необов’язково лінійною або розгалуженою алкільною, алкенільною або алкинільною групою, яка має від 2 до 20 атомів вуглецю, E' є необов'язково циклоалкільною або циклоалкенільною групою, яка має від 3 до 10 атомів вуглецю, G' є необов'язково заміщеною або незаміщеною ароматичною групою, яка несе від 6 до 10 атомів вуглецю, або заміщеною або незаміщеною гетероциклічною групою, у якій гетероатом вибирають з поміж N, O або S, і в якій кожний з p, q і r дорівнює 0 або 1, за умови, що кожний p, q, і r не є нуль в один і той же час, n є цілим числом від 1 до 2000. Багато з зшиваючих агентів, розкриті в цьому документі, детально описані в патентній публікації США № 20050169933. В іншому аспекті винаходу агент, що зв'язується із клітиною, модифікують у реакції біфункціонального поперечнозшиваючого реагенту з агентом, який зв’язуються із клітиною, одержуючи таким способом ковалентне приєднання молекули зшивки до агента, який зв’язується із клітиною. Так як застосовується в цьому документі, «біфункціональний поперечнозшиваючий реагент» є будь-якою хімічною групою, яка ковалентно з'єднує агент, який зв’язується із клітиною, з лікарським засобом, таким як лікарські засоби, описані в цьому документі. У кращому аспекті винаходу, частина з'єднуючого угрупування забезпечується лікарським засобом. При цьому лікарський засіб включає з'єднуюче угрупування, яке є частиною молекули зшиваючого агента, більшого розміру, ніж молекула, яка була застосована для приєднання агента, який зв’язується із клітиною, до лікарського засобу. Наприклад, для утворення майтанзиноїду DM1, бічний ланцюг при C-3-Гідроксильній групі майтанзину модифікують для того, щоб мати вільну сульфгідрильну групу (SH). Ця тіольована форма майтанзину може взаємодіяти з модифікованим агентом, який зв’язуються із клітиною, і формувати кон’югат. Отже, кінцева зшивка складена із двох компонентів, один з яких забезпечений поперечнозшиваючим реагентом, тоді як інший забезпечений бічним ланцюгом від DM1 . В іншому аспекті винаходу лікарський засіб з'єднаний з агентом, який зв’язується із клітиною, через дисульфідний зв'язок. Молекула зшивки включає реакційноздатну хімічну групу, яка може прореагувати з агентом, який зв’язуються із клітиною. Кращі реакційноздатні хімічні групи для реакції з агентом, який зв’язуються із клітиною, є N-сукцинімідними ефірами та Nсульфосукцинімідними ефірами. Додатково, молекула зшиваючого агента, включає реакційноздатну хімічну групу, бажано, дитіопіридильну групу, яка може прореагувати з лікарським засобом з утворенням дисульфідного зв’язку. Найкращі молекули зшиваючого агента, включають, наприклад, N-сукцинімідил-3-(2-піридилдитіо)-пропіонат (SPDP) (див., наприклад, Carlsson et al., Biochem. J, 173: 723-737 (1978)), N-сукцинімідил-4-(2-піридилдитіо)бутаноат (SPDB) (див. наприклад, патент США № 4,563,304), N-сукцинімідил-4-(2-піридилдитіо)пентаноат (SPP) (див., наприклад, реєстраційний номер за CAS 341498-08-6), та інші реакційноздатні поперечнозшиваючі агенти, такі як ті, що описані в патенті США № 6,913,748 включеному до даного документа у всій своїй повноті шляхом посилання. Напроти, як розкрито в патенті США № 6,441,163 B1, лікарський засіб може бути початково модифікованим для введення реакційноздатного ефіру, що підходить для реакції з агентом, 10 UA 108598 C2 5 10 15 20 25 30 35 40 45 50 55 60 який зв’язується із клітиною. Реакцію цих лікарських засобів, що містять активоване угруповання в зшивці з агентом, який зв’язується із клітиною, забезпечує інший спосіб одержання кон’югата агента, який зв’язується із клітиною, і лікарського засобу. Для зв'язування siRNA, siRNA може бути з'єднана з поперечнозшиваючим агентом даного винаходу за допомогою способів, звичайно застосовуваних для модифікації олігонуклеотидів (дивися, наприклад, публікації патенту США 20050107325 і 20070213292). Таким чином, siRNA у своєї 3'або 5'-фосфорамідитній формі вступає в реакцію з одним з кінців поперечнозшиваючого агента, що несе гідроксильну функціональну групу, з одержанням ефірного зв'язку між siRNA і поперечнозшиваючим агентом. У такий же спосіб, реакція фосфорамідиту siRNA з поперечнозшиваючим агентом, який несе термінальну аміногрупу, приводить до утворення зв’язку між поперечнозшиваючим агентом і siRNA через амін. B. АГЕНТИ, ЩО ЗВ'ЯЗУЮТЬСЯ ІЗ КЛІТИНОЮ Застосовані в цьому винаході агенти, які зв'язуються із клітинами, є білками (наприклад, білками імуноглобулінами й білками неімуноглобулінами), які зв'язуються специфічно з антигенами-мішенями на ракових клітинах. Ці агенти, що зв'язуються із клітинами, включають наступні агенти: - антитіла, включаючи: - антитіла зі зміненою поверхнею (патент США № 5,639,641); - гуманізовані або повністю людські антитіла (гуманізовані або повністю людські антитіла вибирають, але не обмежуються, з поміж humy9-6, hub4, huc242, hun901, DS6, CD38, IGF-IR, CNTO 95, B-B4, трастузумаб, биватузумаб, сибротузумаб, пертузумаб і ритуксимаб (дивися, наприклад, патенти США №№ 5,639,641, 5,665,357 і 7,342,110; попередня заявка на патент США № 60/424,332, міжнародна заявка на патент WO 02/16,401, патентна публікація США номер 20060045877, патентна публікація США номер 20060127407, патентна публікація США № 20050118183, Pedersen et al., (1994) J. Mol. Biol. 235, 959-973, Roguska et al., (1994) Proceedings of National Academy of Sciences, Vol 91, 969-973, Colomer et al., Cancer Invest., 19: 49-56 (2001), Heider et al., Eur. J. Cancer, 31A: 2385-2391 (1995), Welt et al., J Clin. Oncol, 12: 1193-1203 (1994), and Maloney et al., Blood, 90: 2188-2195 (1997)); і - фрагменти антитіл (епітопи), що зв'язуються з епітопом, такі як sfv, Fab, Fab' і F(ab') 2 (Parham, J. Immunol. 131:2895-2902 (1983); Spring et al., J. Immunol. 113:470-478 (1974); Nisonoff et al., Arch. Biochem. Biophys. 89:230-244 (1960)). Додаткові агенти, що зв'язуються із клітинами, включають інші білки, що зв'язуються із клітиною, і поліпептиди, у якості прикладів можна привести, але не обмежуючись: - білки з анкериновими повторами (білки Darpin; Zahnd et al., J. Biol. Chem., 281, 46, 3516735175, (2006); Binz, H.K., Amstutz, СТР. & Pluckthun, A. (2005) Nature Biotechnology, 23, 12571268) або білки, подібні до білків з анкериновими повторами, або синтетичні пептиди, описані, наприклад, у патентній публікації США № 20070238667; у патенті США № 7,101,675; у патентах WO/2007/147213; і WO/2007/062466); - інтерферони (наприклад, α, β, γ); - лімфокіни, такі як IL-2, IL-3, IL-4, IL-6; - гормони, такі як інсулін, TRH (гормони, що вивільняють тиреотропін), MSH (меланоцитостимулюючий гормон), стероїдні гормони, такі як андрогени й естрогени; і - фактори росту й колонієстимулюючі фактори, такі як EGF, TGF-α, IGF-1, G-CSF, M-CSF і GM-CSF (Burgess, Immunology Today 5:155-158 (1984)). У тому випадку, якщо агент, що зв'язується із клітиною, є антитілом, то він зв'язується з антигеномом, який є поліпептидом і може являти собою трансмембранну молекулу (наприклад, рецептор) або ліганд, такий як фактор росту. Типові антигени включають такі молекули, як ренін; гормон росту, включаючи гормон росту людини та бичачий гормон росту; фактор, що вивільняє гормон росту; паратиреоїдний гормон; тіреостимулюючий гормон; ліпопротеїни; альфа-1-антитрипсин; A-ланцюг інсуліну; B-ланцюг інсуліну; проінсулін; фолікулостимулюючий гормон; кальцитонін; лютеінізуючий гормон; глюкагон; фактори згортання крові, такі як фактор vmc, фактор IX, тканевий фактор (TF), і фактор фон Вілебранда; анти-фактори згортання крові, такі як білок C; атриальний натрійуретичний фактор; легеневий сурфактант; активатор плазміногену, такі як урокіназа або активатор плазміногену сечі людини або тканинного типу (tPa); бомбезин; тромбін; гемопоетичний фактор росту; фактор некрозу пухлини альфа й бета; енкефаліназа; RANTES (експресується й секретується нормальними М-клітинами при активації); запальний білок макрофагів людини (Mip-1-Альфа); сироватковий альбумін, такий як людський сироватковий альбумін; антимюлерівска субстанція; A-ланцюг релаксину; B-ланцюг релаксину; прорелаксин; мишачий пов'язаний з гонадотропіном пептид; білок мікроорганізмів, такий як бета- лактамаза; ДНКаза; Ige; цитотоксичний асоційований з T-лімфоцитами антиген 11 UA 108598 C2 5 10 15 20 25 30 35 40 45 50 55 60 (CTLA), такий як CTL A-4; інгібін; активін; фактор росту ендотелію судин (VEGF); рецептори гормонів або факторів росту; білок А або D; ревматоїдні фактори; нейротрофічний фактор, такий як кістковий нейротрофічний фактор (BDNF), нейротрофін-3, -4, -5 або -6 (NT-3, NT4, NT-5 або NT-6), або фактор росту нервів, такий як NGF-β; тромбоцитарний фактор росту (PDGF); фактор росту фібробластів, такий як afgf і bfgf; епідермальний фактор росту (EGF); трансформуючий фактор росту (TGF), такий як Tgf-альфа й Tgf-бета, включаючи Tgf-βl, TGF-β2, TGF- β3, TGF-β4 або TGF-β5; інсулін-подібний фактор росту-I і -II (IGF-I і IGF-II); des(1-3)-IGF-I (IGF-I мозку), білки, що зв'язують інсулін-подібний фактор росту, EpCAM, GD3, FLT3, PSMA, PSCA, Mucl, MUC16, STEAP, CEA, TENB2, рецептори EphА, рецептори EphВ, рецептор фолату, Folrl, мезотелин, білок Cripto, альфаvбета6, інетгрини, VEGF, VEGFR, рецептор трансферину, IRTA1, IRTA2, IRTA3, IRTA4, IRTA5; Cd-білки, такі як CD2, CD3, CD4, CD5, CD6, CD8, Cdl 1, CD14, CD19, CD20, CD21, CD22, CD23, CD25, CD26, CD28, CD30, CD33, CD36, CD37, CD38, CD40, CD44, CD52, CD55, CD56, CD59, CD70, CD79, CD80, CD81, CD103, CD105, CD134, CD137, CD138, CD152; еритропоетин; остеоіндуктивні фактори; імунотоксини; кістковий морфогенетичний білок (BMP); інтерферон, такий як інтерферон-альфа, -бета й -гама; колонієстимулюючі фактори (CSF), наприклад, M-CSF, GM-CSF, і G-CSF; інтерлейкіни (IL), наприклад, від IL-1 до IL-10; супероксиддисмутаза; рецептори T-клітин; білки поверхні мембрани; комплемент-залежний стимулятор гемолізу; вірусний антиген, такий як, наприклад, частина оболонки HIV; транспортні білки; хомінг-рецептори; адресини; регуляторні білки; інтегрини, такі як CD1 1a, CD1 1b, CD1 1c, CD18, ICAM, VLA-4 і VCAM; асоційований з пухлиною антиген, такий як рецептор HER2, HER3 або HER4; і фрагменти кожного з перерахованих вище поліпептидів, аднектини, які імітують дію антитіл (заявка США 20070082365), або антитіло, яке зв'язується з одним або декількома асоційованими з пухлиною антигенами або рецептори клітинної поверхні, які розкриті в патентній публікації США № 20080171040 або в патентній публікації США № 20080305044 і включені у всій повноті шляхом посилання. Додатково, GM-CSF, який зв'язується з мієлоїдними клітинами, може бути застосований у якості агента, який зв’язується з ураженими клітинами при гострому мієлогенному лейкозі. IL-2, який зв'язується з активованими T-клітинами, може бути застосований для попередження відторгнення трансплантата, для терапії й попередження реакції трансплантата проти хазяїна, і для лікування гострого T-клітинного лейкозу. MSH, який зв'язується з меланоцитами, може бути застосований для лікування меланоми. Фталева кислота може бути застосована для напрямку до рецептора фолевої кислоти, який експресується в пухлині яєчника й інших пухлинах. Епідермальний фактор росту може бути застосований для напрямку до клітин сквамозних раків, таких як рак легенів, голови й шиї. Соматостатин може бути застосований для напрямку до нейробластом і пухлин інших типів. Доставка до клітин раку молочної залози й сім’яників може бути успішно здійснена за допомогою естрогену (або аналогів естрогену) або андрогену (або аналогів андрогену), відповідно, застосованого як агента, який зв’язується із клітинами. Кращі антигени для антитіл, охоплені даним винаходом, включають Cd-білки, такі як CD2, CD3, CD4, CD5, CD6, CD8, CD11, CD 14, CD18, CD19, CD20, CD 21, CD22, CD 25, CD26, CD28, CD30, CD33, CD36, CD37, CD38, CD40, CD44, CD52, CD55, CD56, CD70, CD79, CD80, CD81, CD103, CD105, CD134, CD137, CD138 і CD152; членів родини рецептора Erbb, таких як рецептор EGF, рецептори HER2, HER3 або HER4; молекули клітинної адгезії, такі як LFA-I, Mac1, p 150.95, VLA-4, ICAM-I, VCAM, EpCAM, інтегрин альфа4/бета7 і інтегрин альфаv/бета3, включаючи як його альфа-, так і або бета-субодиниці (наприклад, анти-CD1 1a, анти-CD 18 або анти-CD1 1b антитіла); фактори росту, такі як VEGF; тканевий фактор (TF); TGF-β; альфаінтерферон (альфа-IFN); інтерлейкін, такий як IL-8; Ige; антигени групи крові Apo2, рецептор смерті; рецептор flk2/flt3; рецептор ожиріння (OB); mp1-рецептор; CTLA-4; білок C і т.п. Найкращими мішенями в цьому документі є IGF-IR, CanАg, EphА2, Muc1, MUC16, VEGF, TF, CD19, CD20, CD22, CD33, CD37, CD38, CD40, CD44, CD56, CD138, CA6, Her2/neu, EpCAM, CRIPTO (білок, який продукується на високому рівні в більшості клітин раку молочної залози людини), білки Darpin, інтегрин альфаv/бета3, інтегрин альфаv/бета5, інтегрин альфаv/бета6, TGF-β, CD1 1a, CD18, Apo2 і C242 або антитіло, яке зв'язується з одним або декількома асоційованими з пухлиною антигенами або рецепторами клітинної поверхні, розкритими в патентній публікації США № 20080171040 або патентній публікації США № 20080305044, і які включені у всій своїй повноті шляхом посилань. Кращі антигени для антитіл, охоплюваних даним винаходом, також включають Cd-білки, такі як CD3, CD4, CD8, CD19, CD20, CD34, CD37, CD38, CD46, CD56 і CD138; членів родини рецептора Erbb, такі як рецептор EGF, рецептори HER2, HER3 або HER4; молекули клітинної адгезії, такі як LFA-1, Mac1, p 150.95, VLA-4, ICAM-I, VCAM, EpCAM, інтегрин альфа4/бета7 і 12 UA 108598 C2 5 10 15 20 25 30 35 40 45 50 55 60 інтегрин альфаv/бета3, включаючи як його альфа-, так і або бета-субодиниці (наприклад, антиCD1 1a, анти-CD18 або анти-CD1 1b антитіла); фактори росту, такі як VEGF; тканевий фактор (TF); TGF-β; альфа-інтерферон (альфа-IFN); інтерлейкін, такий як IL-8; Ige; антигени групи крові Apo2, рецептор смерті; рецептор flk2/flt3; рецептор ожиріння (OB); mp-рецептор; CTLA-4; білок C і т.п. Найкращі мішені в цьому документі представлені IGF-IR, CanАg, EGF-R, EphА2, Muc1, MUC16, VEGF, TF, CD19, CD20, CD22, CD33, CD37, CD38, CD40, CD44, CD56, CD138, CA6, Her2/neu, CRIPTO (білок, який продукується на високому рівні в більшості клітин рака молочної залози людину), інтегрин альфаv/бета3, інтегрин альфаv/бета5, TGF-β, CD1 1a, CD 18, Apo2, EpCAM і C242. Методики із застосуванням моноклональних антитіл дозволяють одержувати специфічний агент, який зв'язується із клітинами, у формі моноклонального антитіла. Зокрема, добре відомі в цій галузі техніки методики представлені методиками для створення моноклональних антитіл, одержуваних шляхом імунізації мишей, пацюків, хом'яків або будь-якого іншого ссавця антигеном, що представляють інтерес, таким як інтактні клітини-мішені, антигени, ізольовані із клітин-мішеней, повний вірус, ослаблений повний вірус, і вірусні білки, такі як білки вірусної оболонки. Також можуть бути застосовані сенсибілізовані клітини людини. Інший спосіб створення моноклональних антитіл передбачає застосування бібліотек фагових sfv (одноланцюгова варіабельна область), специфічних sfv людину (дивися, наприклад, Griffiths et al, патент США № 5,885,793; Mccafferty et al., WO 92/01047; Liming et al., WO 99/06587). Вибір відповідного агента, який зв’язується із клітиною залежить від конкретної популяції клітин, на яку він націлений, але, у цілому, кращі моноклональні антитіла і їх, що зв'язуються з епітопом фрагменти, якщо підходящі варіанти доступні. Наприклад, моноклональне антитіло My9 є антитілом до мишачого Igg2а, яке специфічно до антигену CD33, виявленого в клітинах гострого мієлолейкозу (AML) (Roy et al. Blood 77:24042412 (1991)), і може бути застосоване для лікування Aml-Пацієнтів. У такий же спосіб, моноклональне антитіло анти-B4 є мишачим Igg1, який зв'язується з антигеном CD19 на Bклітинах (Nadler et al., J. Immunol. 131, 244-250 (1983)) і може бути застосований, за умови, що клітини-мішені є B-клітинами або ураженими клітинами, які експресують цей антиген, такий як у неходжкінскої лімфоми або при хронічному лімфобластному лейкозі. Антитіло N901 є моноклональним антитілом до мишачого Igg1, який зв'язується з CD56, виявленим на клітинах дрібноклітинного раку легень й на клітинах інших пухлин нейроендокринного походження (Roy et al. J. Nat. Cancer Inst. 88:1136-1145 (1996)); huc242 є антитілом, яке зв'язується з антигеном CanАg; трастузумаб є антитілом, яке зв'язується з HER2/neu; і антитіло до Egf-Рецептору зв'язується з Egf-Рецептором. C. ЛІКАРСЬКІ ЗАСОБИ Лікарські засоби, застосовані в цьому винаході, є цитотоксичними лікарськими засобами, здатними до приєднання до агента, який зв’язується із клітиною. Приклади підходящих лікарських засобів включають майтанзиноїди, DNA-зв’язуючі лікарські засоби, такі як CC-1065 і його аналоги, каліхеаміцини, доксорубіцин і його аналоги, алкалоїди барвінку, криптофіцини, доластатин, ауристатин і їх аналоги, тубулізин, епотілони, таксоіди й siRNA. Кращими майтанзиноїдами є майтанзиноїди, описані в патентах США №№ 5,208,020; 5,416,064; 6,333,410; 6,441,163; 6,716,821; RE39,151 і 7,276,497. Кращими аналогами CC-1065 є аналоги, описані в патентах США №№ 5,475,092; 5,595,499; 5,846,545; 6,534,660; 6,586,618; 6,756,397 і 7,049,316. Кращими доксорубіцинами і його аналогами є ті, що описані в патенті США № 6,630,579. Кращі таксоіди є описані в патентах США №№ 6,340,701; 6,372,738; 6,436,931; 6,596,757; 6,706,708; 7,008,942; 7,217,819 і 7,276,499. Каліхеаміцини описані в патентах США №№ 5,714,586 і 5739,116. Сполуки алкалоїду барвінку, сполуки доластатина й сполуки криптофіцину докладно описані в WOO 1/24763. Ауристатин включає ауристатин E, ауристатин EB (AEB), ауристатин EFP (AEFP), монометил-ауристатин E (MMAE), і вони описані в патенті США № 5,635,483, Int. J. Oncol. 15:367-72 (1999); Molecular Cancer Therapeutics, vol. 3, № 8, р. 921-932 (2004); Номер заявки США 11/134826, патентні публікації США №№ 20060074008, 2006022925. Сполуки тубулизина описані в патентній публікації США № 20050249740. Сполуки криптофіцину описані в патентах США №№ 6,680,311 і 6,747,021. Епотилони описані в патентах США №№ 6,956,036 і 6,989,450. siRNA докладно описані в патентних публікаціях США №№: 20070275465, 20070213292, 20070185050, 20070161595, 20070054279, 20060287260, 20060035254, 20060008822, 20050288244, 20050176667. Аналоги й похідні Фахівці в галузі техніки цитотоксичних засобів легко зрозуміють, що кожне із цитотоксичних 13 UA 108598 C2 5 10 15 20 25 30 35 40 45 50 55 60 засобів, описаних у цьому документі, може бути модифіковане таким чином, що одержувана сполука як і раніше зберігає специфічність і/або активність вихідних сполук. Фахівцеві також зрозуміло, що багато із цих сполук можуть бути застосовані замість цитотоксичних засобів, описаних у цьому документі. Таким чином, цитотоксичні засоби даного винаходу включають аналоги й похідні сполук, описаних у цьому документі. Агент, що зв'язується із клітиною, може бути кон’югованим із цитотоксичним лікарським засобом за допомогою раніше описаних способів (патенти США №№ 6,013,748; 6,441,1631 і 6,716,821; патентна публікація США № 20050169933; і WO2006/034488 A2). D. ТЕРАПЕВТИЧНЕ ЗАСТОСУВАННЯ Кон’югати агента, який зв’язується із клітиною, і лікарського засобу (наприклад, імунокон’югати) цього винаходу також можуть бути застосовані в комбінації з хемотерапевтичними засобами. Такі хіміотерапевтичні засоби описані в патентіСША № 7,303,749. Кон’югати агента, який зв’язується із клітиною, і лікарського засобу (наприклад, імунокон’югати) сьогодення винаходи можуть бути введені in vitro, in vivo і/або ex vivo для лікування пацієнтів і/або для регуляції росту обраних популяцій клітин, включаючи, наприклад, рак легенів, крові, плазми, молочної залози, товстої кишки, передміхурової залози, бруньки, підшлункової залози, мозку, кісток, яєчників, сім’яників, і органів лімфатичної системи; аутоімунних захворювань, таких як системний вовчак, ревматоїдний артрит і розсіяний склероз; відторгнення трансплантата, такі як відторгнення ниркового трансплантата, відторгнення печіночного трансплантата, відторгнення легеневого трансплантата, відторгнення серцевого трансплантата й відторгнення трансплантата кісткового мозку; реакції «трансплантат проти хазяїна»; вірусних інфекцій, таких як Cmv-Інфекція, Hiv-Інфекція й AIDS; і паразитарні інфекції, такі як лямбліоз, амебіаз, шистосомоз і їм подібні. Бажано, імунокон’югати й хемотерапевтичних засобів винаходу вводять in vitro, in vivo і/або ex vivo для лікування раку в пацієнта й/або регуляції росту ракових клітин, включаючи, наприклад, рак крові, плазми, легені, молочної залози, товстої кишки, передміхурової залози, нирок, підшлункової залози, мозку, кісток, яєчників, сім’яників, і органів лімфатичної системи; більш бажано рак легені, товстої кишки, передміхурової залози, плазми, крові або товстої кишки. У найбільш кращому аспекті, рак є множинною мієломою. «Регуляція (модуляція) росту обраних популяцій клітин» включає інгібування проліферації обраних популяцій клітин (наприклад, популяцій клітин множинної мієломи, таких як клітини MOLP-8, клітини ОPM2, клітини H929 і їм подібні) для того, щоб вони відхилилися від шляху, що приводить до збільшення числа клітин; зниження швидкості збільшення клітинного розподілу в порівнянні з, наприклад, неопрацьованими клітинами; знищення обраних популяцій клітин; і/або попередження обраних популяцій клітин (таких як ракові клітини) від метастазування. Ріст обраних популяцій клітин можна регулювати in vitro, in vivo або ex vivo. У способах даного винаходу кон’югати агента, який зв’язується із клітиною, і лікарського засобу (наприклад, імунокон’югати) може бути введені in vitro, in vivo або ex vivo. Кон’югати агента, який зв’язується із клітиною, і лікарського засобу (наприклад, імунокон’югати) можуть бути застосовані з підходящими фармацевтично прийнятними основами, розріджувачами й/або ексипієнтами, які добре відомі фахівцем у цій галузі техніки й можуть бути визначені ними залежно від клінічної ситуації. Приклади підходящих основ, розріджувачів і/або ексипієнтів включають: (1) фосфатно-сольовий буфер Дульбекко, ph приблизно 6,5, який може містити приблизно від 1 мг/мол до 25 мг/мол людського сироваткового альбуміну, (2) 0,9% сольового розчину (0,9% мас./об'єм Nac1), і (3) 5% (мас./об'єм) декстрози. Сполуки й композиції, описані в цьому документі, можуть бути введені в підходящій формі, бажано парентерально, більш бажано внутрішньовенно. Для парентерального введення сполуки або композиції можуть бути водними або неводними стерильними розчинами, суспензіями або емульсіями. у якості розчинника або основи можуть бути застосовані пропіленгліколь, рослинні олії й придатні для введення за допомогою ін'єкції органічні ефіри, такі як етил олеат. Композиції також можуть містити допоміжні лікарські засоби, емульгатори або диспергуючі засоби. Композиції також можуть бути у формі стерильної твердої композиції, яка може бути розчинена або диспергована в стерильній воді або будь-який іншої придатної для введення за допомогою ін'єкції стерильного середовища. Термін «терапевтично ефективна кількість» кон’югатів агента, який зв’язується із клітиною, і лікарського засобу (наприклад, імунокон’югатів), описаних у цьому документі, означає схему приймання лікарського засобу для регуляції росту обраних популяцій клітин і/або лікування захворювання пацієнта, яку вибирають залежно від безлічі факторів, включаючи вік, вагу, стать, 14 UA 108598 C2 5 10 15 20 25 30 35 40 45 50 55 60 режим харчування й медичні умови пацієнта, вага захворювання, спосіб уведення й фармакологічні фактори, таких як активність, ефективність, фармакокінетичний і токсикологічний профілі конкретної застосованої сполуки. «Терапевтично ефективна кількість» також може бути визначене шляхом відсилань до стандартних медичних довідників, таким як «Настільний довідник лікаря» (Physicians Desk Reference) 2004 року. Краще, якщо пацієнтом буде тварина, ще краще ссавець, найкраще - людина. Пацієнт може бути чоловічої або жіночої статі, і може бути дитиною або дорослим. Нижче наведені приклади підходящих методик введення кон’югатів агента, який зв’язується із клітиною, і лікарського засобу (наприклад, імунокон’югатів). Кон’югати можна вводити щодня протягом приблизно 5-ти днів внутрішньовенно, як у вигляді внутрішньовенного болюсного введення щодня протягом приблизно 5 днів, або у вигляді безперервної інфузії протягом приблизно 5 днів. Напроти, кон’югати можна вводити один раз на тиждень протягом шести тижнів або довше. Альтернативно, кон’югати можуть бути введено один раз на дві або на три тижні. Болюсні дозування рівні приблизно від 50 до 400 мл нормального сольового розчину, до якого може бути додане приблизно від 5 до 10 мл людського сироваткового альбуміну. Дозування безперервної інфузії дорівнюють приблизно від 250 до 500 мл нормального сольового розчину, до якого може бути додане приблизно від 25 до 50 мл людського сироваткового альбуміну, на 24-годинний період. Дози дорівнюють приблизно від 10 мг до 1000 мг/кг на персону, внутрішньовенно (у діапазоні приблизно від 100 нг до 100 мг/кг). Через приблизно від одного до чотирьох тижнів після лікування пацієнт може одержати другий курс лікування. Специфічні клінічні протоколи відносно способів уведення, ексипієнтів, розріджувачів, дозувань і часу може бути визначені фахівцем залежно від клінічної ситуації. Сполуки й кон’югати (наприклад, імунокон’югати) також можуть бути застосовані для виробництва лікарського засобу, корисного для лікування або ослаблення важкості порушень, таких як, ті, що характеризуються аномальним ростом клітин (наприклад, раку). Даний винахід також забезпечує фармацевтичні набори, які включають один або кілька контейнерів, у які поміщено один або кілька інгредієнтів фармацевтичних сполук і/або композицій даного винаходу, включаючи, один або декілька імунокон’югатів і одне або декілька хемотерапевтичних засобів. Такі набори також можуть включати, наприклад, інші сполуки й/або композиції, обладнання(обладнання) для введення сполуки й/або композиції, і письмові інструкції у формі, передбаченої для контрольованого державними органами виробництва, застосування або торгівлі фармацевтичними або біологічними виробами. Терапії раку й застосовувані при цьому режими введення лікарських засобів, способи введення й рекомендоване застосування відомі в цій галузі техніки й описані в такім джерелі як «Настільний довідник лікаря» (PDR). PDR розкриває дози лікарських засобів, які застосовують при лікуванні різних раків. Режим уведення й дозування цих вищевказаних хемотерапевтичних лікарських засобів, які терапевтично ефективні, залежить від конкретного раку, який передбачається лікувати, ваги захворювання й інших факторів, відомих лікарям, що спеціалізуються в цій галузі техніки й можуть бути визначені лікарями. Наприклад, видання 2006 року Настільного довідника лікаря розкриває, що таксотер (див. стор. 2947) є інгібітором деполімеризації тубуліну; доксорубіцин (див. стор. 786), доксил (див. стор. 3302) і оксаліплатин (див. стор. 2908) є засобами, які взаємодіють з DNA, іринотекал (див. стор. 2602) є інгібітором топоізомерази I, ербітукс (див. стор. 937) і тарцева (див. стор. 2470) взаємодіють із рецептором епідермального фактора росту. Зміст PDR прямо включено в даний документ у всій своїй повноті шляхом посилання. Фахівець у цій галузі техніки може скористатися даними PDR, застосовуючи один або декілька з наступних параметрів для визначення режиму введення й дозувань хемотерапевтичних засобів і кон’югатів, які можуть бути застосовані відповідно до ідей цього винаходу. Ці параметри включають: 1. Повний покажчик a) за виробниками; b) за виробами (за назвою компанії або торговельному найменуванню лікарського засобу); c) покажчик за групами лікарських засобів (наприклад, «антигістаміни», «DNA-алкілюючі засоби», таксани тощо); d) загальний хімічний покажчик (загальновживані назви лікарського засобу, які не є торговими марками); 2. кольорове зображення лікарських препаратів; 3. інформація про виріб, відповідно до системи маркування FDA; a) інформація про хімічний склад; b) функція/дія; 15 UA 108598 C2 5 10 15 20 25 30 35 40 45 50 55 60 c) показання й протипоказання; d) попереднє випробування, побічні ефекти, запобіжний заходи. Повне розкриття кожної з вищенаведених посилань, патентних заявок і патентів прямо включені шляхом відсилань у всій своїй повноті, включаючи, без обмежень, опис, формулу винаходу й реферат, а також будь-які фігури, таблиці або креслення, які в них знаходяться, . ПРИКЛАДИ Не будучи зв'язаними яким-небудь певним аспектом, описані способи синтезу з'єднаних через поліетиленгліколь ((CH2CH2O)n) лікарських засобів з різними реакційноздатними зшиваючими агентами для кон'югації з агентом, який зв’язуються із клітинами. Ці способи кон'югації включають одностадійну кон'югацію антитіла з лікарськими засобами, такими як майтанзиноїди, з'єднаного через зшиваючий агент, на основі поліетиленгліколя ((CH 2CH2O)n) за допомогою реакції N-гідроксисукцинімідної (NHS) реакційноздатної групи. Крім того, описані способи синтезу лікарських засобів, які містять дисульфідні групи з'єднані через поліетиленгліколь ((CH2CH2O)n), з різними реакційноздатними зшиваючими агентами для кон'югації з антитілом. Ці способи кон'югації включають одностадійну кон'югацію антитіла з лікарськими засобами, такими як майтанзиноїд, з'єднаними з агентом, що зшиває на основі поліетиленгліколя ((CH2CH2O)n), що несуть дисульфідну групу, за допомогою реакції з Nгідроксисукцинімідною (NHS) реакційноздатною групою. Наступні приклади не призначені для обмеження даного винаходу, а наведені тільки для ілюстративних цілей. ПРИКЛАД I Кон'югація антитіла з декількома молекулами майтанзиноїду, приєднаного на одну молекулу антитіла, за допомогою дисульфідних зшиваючих агентів, які містять традиційні аліфатичні вуглецеві спейсери: У двостадійному способі кон'югації антитіла з декількома молекулами майтанзиноїду DM4 або DM1, гуманізоване антитіло початково модифікують із комерційно доступним гетеробіфункціональним зшиваючим агентом (SPDB), що містять як аміно-реакційноздатну Nгідроксисукцинімідну групу ( NHS-група), так і тіоло-реакційноздатну 2-піридилдитіогруппу (SSPy-група), для включення декількох молекул зшиваючого агента, у молекулу антитіла (як описано в W.C. Widdison et al., J. Med. Chem., 2006, 49, 4392-4408). Після включення реакційноздатних зшиваючих агентів, у молекулу антитіла, на другій стадії реакції додають майтанзиноїд DM4 або DM1 з реакційноздатною тіоловою групою до модифікованого зшиваючим агентом, антитіло для кон'югації майтанзиноїду з антитілом через дисульфідні зв’язки. У специфічному прикладі гуманізоване антитіло в концентрації, рівної 5-10 мг/мл, модифікують, застосовуючи 15-кратний молярний надлишок комерційно доступного гетеробіфункціонального зшиваючого агента з -(CH2)-n алкільними групами (таким як SPDB, SPP, SPDP) у водному буферному розчині при ph 6,5-8 протягом 0, 3-х годин за температури навколишнього середовища й потім очищають за допомогою гель-фільтрації (застосовуючи, наприклад, хроматографію на SEphАdex G25), і одержують модифіковане антитіло, що має в середньому 8-12 груп зшиваючого агента, на одну молекулу антитіла з високим виходом (звичайно вихід дорівнює 80-90%). Приєднання груп оцінюють, реєструючи звільнення 2-1 -1 тіопиридона по його поглинанню при 343 нм (ε343 нм = 8080 M cm ) після додавання надлишку 1, 4-дитіотреітолу (DTT) до невеликої аліквоти зразка антитіла, модифікованого агентом, що зшивають. Після реєстрації приєднання реакційноздатної групи до антитіла, антитіло, модифіковане агентом, що зшивають, кон’югують у концентрації, рівної 2,5 мг/мл, з надлишком майтанзиноїду DM4 (1, 7-кратний молярний надлишок DM 4-тіолу стосовно реакційноздатному агентові, що зшиває) при pН 6,5. Однак у ході реакції кон'югації між антитілом і майтанзиноїдом спостерігають преципітацію, і одержують поганий вихід кон’югатів антитіло-майтанзиноїд (вихід 38-60%) при очищенні кон’югатів антитіло-майтанзиноїд за допомогою гель-фільтрації. Число приєднаних молекул майтанзиноїду на одну молекулу антитіла визначають шляхом виміру поглинання при 252 нм і 280 нм і застосовуючи коефіцієнти екстинкції для майтанзиноїду й антитіла при 252 нм і 280 нм. Крім преципітації й низького виходу кон’югатів антитіломайтанзиноїд при ~1-1,5 мг/мл, число включених молекул майтанзиноїду на одну молекулу антитіла було істотне нижче (у середньому 5,2-5,5 молекул майтанзиноїду на одну молекулу антитіла), чим очікували виходячи із суттєво більш високого середнього числа вихідних реакційноздатних груп зшиваючого агента, включеного на одну молекулу антитіла (8-12 реакційноздатних груп зшиваючого агента, на одну молекулу антитіла), що дозволяє припустити преципітацію майтанзиноїд-несучих кон’югатів антитіла з більш високим числом. В іншому прикладі гуманізоване антитіло початково модифікують гетеробіфункціональним зшиваючим агентом, SPDB для включення 11-ти піридилдитіолових груп на одну молекулу антитіла, яке в 16 UA 108598 C2 5 10 15 20 25 30 35 40 45 50 55 60 ході другої реакції з 1, 7-кратним молярним надлишком DM майтанзиноїд-тіолу демонструє значну преципітацію в реакційній суміші, що приводить до дуже низького виходу (70%) з дуже високою фракцією мономерів (>90%). Як приклад, гуманізоване антитіло в концентрації, рівної 8 мг/мл, модифікували реагентом Pyss-PEG4-NHS при декількакратному молярному надлишку стосовно концентрації антитіла в буфері з ph 8 протягом 1-ї години при 30 °C і потім очищали за допомогою гельфільтрації. Аналізуючи звільнення 2-тіопиридону в аліквотах, застосовуючи надлишок дитіотреітолу, оцінювали число приєднаних дитіопіридильних груп на одну молекулу антитіла, яке було рівне ~4-16, виходячи із чого додавали 1, 4-кратний молярний надлишок DM4 майтанзиноїд-тіолу до кожного розчину модифікованого дитіопіридил-PEGn- зшиваючим агентом, антитіла на стадії кон'югації при ph 6,5, протягом ночі при 25 °C, і потім кон’югат очищали за допомогою гель-фільтрації (Фіг. 12). Скінченні величини включеного майтанзиноїду на одне антитіло для різних сумішей кон'югації з різним вихідним включенням зшиваючих агентів, варіюють у середньому від 3 до 9 молекул майтанзиноїду на одну молекулу антитіла, без спостережуваної преципітації, з виходом >70% і дуже високим вмістом мономерів (>90% мономерів, згідно з результатами гель-хроматографії на TSK-GEL G3000 HPLC, із застосуванням 20%-ного ізопропанолу або 0,4 M перхлорату натрію). Визначено, що кількість лікарського засобу, що не вступив у реакцію кон'югації, у кінцевих кон’югатах було менше ніж 0,6% по даним Hisep Mixed-Mode хроматографії (стовпчик Hisep, «Supelco»), що вказує на те, що майтанзиноїди ковалентно приєднані до антитіла. В іншому прикладі гуманізоване антитіло в концентрації, яка дорівнює 8 мг/мл, модифікують реагентом Pyss-PEG4-NHS у декількакратному молярному надлишку стосовно концентрації антитіла в буфері з pН 6,5 протягом 1,5 годин при 25 °C і потім очищають за допомогою гель-фільтрації. За оцінками число несучих дитіопіридил-PEGn груп зшиваючого агента, у зразках антитіла було рівне 6-18 на одну молекулу антитіл, які потім взаємодіють із 1,3-1, 7-кратним молярним надлишком DM майтанзиноїд-тіолу при ph 6,5, 25 °C протягом ночі, і потім їх очищають за допомогою гельфільтрації. Не спостерігають ніякої преципітації, і в кінцевих зразках кон’югатів антитіломайтанзиноїд при ~1-2 мг/мол вміст мономерів високо (>90%), що вказує на відсутність агрегації, і високе число, рівне від ~3,1 до 7,1, ковалентно приєднаних молекул майтанзиноїду на одне антитіло з дуже низьким вмістом, що не вступив у реакцію кон'югації майтанзиноїду (99% кількість мономерів (Фіг. 23). ПРИКЛАД V Різновиди антитіл, що несуть високе число молекул майтанзиноїду, і немодифіковані антитіла характеризуються подібним зв'язуванням, певним методом FACS: Зв'язування несучих високе число молекул майтанзиноїду кон’югатів деяких антитіл порівнювали за допомогою методу проточної цитометрії зі зв'язуванням немодифікованих антитіл з різними мішенями, такими як EpCAM, CanАg і CD56. Коротенько, антиген-позитивні клітини інкубують з кон’югатами або немодифікованими антитілами при 4 °C, потім з 19 UA 108598 C2 5 10 15 20 25 30 35 40 45 50 55 60 кон’югатами вторинне антитіло-FITC при 4 °C, фіксованими формальдегідом (1%-ним в PBS) і аналізують за допомогою методу проточної цитометрії. Не спостерігали ніяких істотних відмінностей між зв'язуванням кон’югата й зв'язуванням немодифікованого антитіла для всіх проаналізованих кон’югатів. Наприклад, як показано на Фіг. 24, кон’югат Ab-PEG4-Mal-Dm, який несе 10,7 молекул майтанзиноїду, зв'язується з антиген-позитивними клітинами з високою спорідненістю, подібним зі спорідненістю немодифікованого антитіла. ПРИКЛАД VI Дослідження in vitro цитотоксичності майтанзиноїдних кон’югатів антитіл з тіоефірними й дисульфідними зшиваючими агентами, містять поліетиленоксидні спейсери (PEGn, або (-CH2CH2-O)n): Цитотоксичні ефекти кон’югатів антитіла-майтанзиноїд з тіоефірними й дисульфідними зшиваючими агентами, містять PEG n-спейсери, звичайно досліджують, застосовуючи аналіз WST-8 на виживання клітин після 4-5 днів безперервної інкубації ракових клітин з кон’югатами. Ракові клітини, які експресують антиген (~1000-5000 клітини на комірку) інкубують в 96коміркових планшетах у середовищі регулярного росту, що містить ембріональну бичачу сироватку, з різними концентраціями кон’югатів антитіло-майтанзиноїд протягом приблизно 5-ти днів. Потім додають реагент WST-8 і вимірюють поглинання планшета при 450 нм через ~2-5 годин. Фракцію клітин, що вижили, відкладають проти концентрації кон’югата для визначення величини IC50 (концентрація, необхідна для 50%-ної загибелі клітин) кон’югата. На Фіг. 25 показане посилення ефективності кон’югатів анти-EpCAM Ab-майтанзиноїд зі збільшеним навантаженням лікарським засобом для PEG 4-з'єднаного тіоефірного кон’югата (Ab-PEG4-Mal-Dm), який також демонструє підвищену ефективність у порівнянні із з'єднаними тіоефірной зв'язком SMCC-DM1 і з'єднаними дисульфідной зв'язком SPDB-DM4 кон’югатами при подібних навантаженнях лікарськими засобами, рівними приблизно 4 молекули майтанзиноїду на одне антитіло, стосовно EpCAM антиген-позитивним COLO205 клітинам з множинною фармацевтичною стійкістю (клітинам COLO205-MDR). Ефективність з'єднаного через тіоефірний зв'язок кон’югата анти-EpCAM Ab-PEG4-Mal-Dm при навантаженнях майтанзиноїдом, які дорівнюють 4,1 і 7,8 молекул, є новим й потенційно багатообіцяючим при терапевтичних застосуваннях відкриттям. На Фіг. 26 показані цитотоксичні активності кон’югатів анти-CanАg Ab-майтанзиноїд у відношенні CanАg антиген-позитивних клітин COLO205-MDR. Знову, тіоефір-з'єднані кон’югати Ab-PEG4-Mal-Dm і Ab-PEG2-Mal-Dm1 продемонстрували підвищену ефективність у порівнянні із з'єднаними тіоефірним зв'язком кон’югатами Ab-smcc-dm1 з подібними навантаженнями майтанзиноїдом. На Фіг. 27 показані цитотоксичні активності кон’югатів анти-CD56 антитіло-майтанзиноїд з PEG-вмісними тіоефірними й дисульфідними, зшиваючими агентами у відношенні CD 56експресуючих клітин Molp-8 множинної мієломи. З'єднані через тіоефірний зв'язок PEG 4кон’югати з 7,7 молекулами лікарських засобів на одне антитіло (Ab-PEG4-Mal-Dm) демонстрували несподіване 100-кратне збільшення цитотоксичної ефективності (величина IC 50 рівна 0,019 нМ) у порівнянні з кон’югатами, що несуть 3,8 молекул лікарських засобів (IC 50 = 1,9 нМ). На Фіг. 28 показане посилення ефективності кон’югатів анти-EpCAM Ab-майтанзиноїд, що несуть PEG4-з'єднаний тіоефірний кон’югат (Ab-PEG4-Mal-Dm), у порівнянні із загальноприйнятим з'єднаним тіоефірним зв'язком SMCC-DM1 при подібних навантаженнях лікарським засобом, рівних приблизно 4 молекулам майтанзиноїду на одне антитіло стосовно EpCAM-позитивним клітинам HCT 15 з множинною фармацевтичною стійкістю. Висока ефективність з'єднаного через тіоефірний зв'язок кон’югата анти-EpCAM Ab-PEG4-Mal-Dm є новим й потенційно багатообіцяючим при терапевтичних застосуваннях відкриттям. На Фіг. 29 показане посилення ефективності кон’югатів анти-EpCAM Ab-майтанзиноїд, що несуть PEG 4-з'єднаний тіоефірний кон’югат (Ab-PEG4-Mal-Dm), у порівнянні із загальноприйнятим з'єднаним тіоефірним зв'язком SMCC-DM1 при подібних навантаженнях лікарським засобом, рівних приблизно 4 молекулам майтанзиноїду на одне антитіло стосовно EpCAM-позитивним клітинам COLO 205 з множинною фармацевтичною стійкістю. Зросла ефективність з'єднаного через тіоефірний зв'язок кон’югата анти-EpCAM Ab-PEG4-Mal-Dm є новим й потенційно багатообіцяючим при терапевтичних застосуваннях відкриттям. На Фіг. 37 показане потужне посилення в цитотоксичності кон’югата анти-EGFR Abмайтанзиноїд з гідрофільним з'єднаним тіоефірним зв'язком PEG 4- зшиваючим агентом (AbPEG4-Mal-Dm) у порівнянні з негідрофільним кон’югатом SMCC-DM1 з 3,7 молекулами майтанзиноїду/Ab стосовно Egfr-позитивним клітинам UO-31 ниркової карциноми людини. Ефективність PEG4-Mal-Dm1 була приблизно в 10 раз вище в порівнянні з ефективністю 20 UA 108598 C2 5 10 15 20 25 30 35 40 45 50 55 60 кон’югата SMCC-DM1 із традиційним зшиваючим агентом. ПРИКЛАД VII Фармакокінетика in vivo: Фармакокінетику в плазмі гуманізованого кон’югата анти-CD56 антитіло (Ab)-PEG4-Mal-Dm, що містить гідрофільний PEG4-зшиваючий агент, і несе 6,7 D/A (молекул майтанзиноїду/антитіло), порівнювали з фармакокінетикою кон’югата Ab-smcc-dm1, що містить традиційний зшиваючий агент, з аліфатичним вуглецевим ланцюгом і який несе 4 молекули D/A (Фіг. 38 A). Мишам CD1 уводили за допомогою болюсної внутрішньовенної ін'єкції, одним введенням, приблизно 5 мг/кг кон’югатів (доза, розрахована за антитілом; 3 миші на групу). Зразки плазми збирали в декількох тимчасових крапках аж до 4-го тижня. У зразках плазми методом ELISA визначали концентрацію антитіл і концентрацію кон’югатів. Для визначення антитіл методом ELISA, зразки плазми додавали до титраційним мікропланшетам, що містять покриті, іммобілізовані козячі антитіла до Igg людину (H+L), промивають, і реєструють, застосовуючи кон’югацію з пероксидазою хріну козячі антитіла до Igg людини (Fcγ). Для визначення концентрації кон’югатів, зразки плазми додають до титраційних мікропланшетів, які містять покриті, іммобілізовані козячі антитіла до Igg людини (H+L), промивають, і реєструють, застосовуючи біотинілювання анти-майтанзин антитіла й кон’югований з лужною фосфатазою стрептавидин. Результати, як по визначенню концентрації антитіл, так і по визначенню концентрації кон’югатів методом ELISA, демонструють, що кон’югат Ab-PEG4-Mal-Dm з гідрофільним PEG4-зшиваючим агентом, несуть високе навантаження 6,7 DM1/Ab, добре зберігаються в плазмі протягом 4-тижневого періоду дослідження. На Фіг. 38 показана фармакокінетика in vivo кон’югата антитіло-майтанзиноїд із застосуванням PEG4-зшиваючого агента, з високим навантаженням майтанзиноїдом (6,7 молекул DM1/Ab) у порівнянні з кон’югатом зі стандартним зшиваючим агентом, несуть 4 молекули DM1/Ab. Навіть із високим навантаженням майтанзиноїдом PEG 4-з'єднаний тіоефірний кон’югат (Ab-PEG4-Mal-Dm) з 6,7 молекулами майтанзиноїду/Ab мав більш тривалий час напівжиття, ніж традиційний кон’югат. В іншому прикладі фармакокінетику в плазмі 3 3 кон’югата гуманізованого C242 Ab-PEG4-Mal- H-DM1 з H-міченим DM1 (з 3,3 молекулами 3 майтанзиноїду/Ab) порівнювали з некон’югованим антитілом і з кон’югатом Ab-smcc- H-DM1, що містять традиційний зшиваючий агент, з аліфатичним вуглецевим ланцюгом і який несе подібне навантаження, рівне 4,2 молекулам D/A, у мишах CD-1 у дозі, рівної 10-12 мг/кг 3 внутрішньовенно (Фіг. 38 B). Кон’югат Ab-PEG4-Мal- H-DM1 зберігався в плазмі в більш високих концентраціях протягом 4-х тижнів у порівнянні з кон’югатом із традиційним Smcc-зшиваючим агентом з подібним навантаженням майтанзиноїдом, що було показано як за допомогою виміру концентрації антитіл (ELISA; Фіг. 38 B), так і за допомогою вимірювання концентрації кон’югата 3 (рахунок імпульсів від H-мітки). Час напівжиття PEG4-Mal-з'єднаного кон’югата було рівне 16 днів у порівнянні з 12,6 днів для Smcc-з'єднаного кон’югата й, таким чином, було значно вдосконалене стосовно кон’югату SMCC (Фіг. 38 B). Важливо, що площа під кривою (AUC) для кон’югата Ab-PEG4-Mal-Dm з 3,3 молекулами D/A при внутрішньовенному уведенні в дозі 10 мг/кг (AUC = 38790 год.мкг/мол) було подібна площі під кривою для некон’югованого антитіла при такому же внутрішньовенному уведенні в дозі, рівної 12 мг/кг (AUC = 38798 год.мкг/мол) і значно краще, така для кон’югата Ab-smcc-dm1 з 4,2 молекулами D/A при внутрішньовенному уведенні в дозі 10 мг/кг (AUC = 25910 год.мкг/мл) у мишей CD-1 (Фіг. 38 B). ПРИКЛАД VIII Порівняння in vivo протипухлинної активності кон’югатів анти-EpCAM-майтанзиноїд, mub38.1-MCC-DM1 і кон’югатів mub38.1-PEG4-Mal-Dm у відношенні стійких до лікарських засобів ксенотрансплантатів рака товстої кишки (HCT15) Протипухлинний ефект кон’югатів mub38.1-MCC-DM1 і mub38.1-PEG4-Mal-Dm досліджували на моделі ксенотрансплантатів карциноми товстої кишки людини, HCT15, яка, як було показано, характеризується оверекспресією P-глікопротеїну й стійка до різних лікарських засобів. Клітини HCT15 уводять за допомогою підшкірної ін'єкції в область під праву лопатку мишам SCID (1 3 107 клітин на тварину). Після того, як об'єм пухлини досягав розміру, рівного приблизно 140 мм ( через 9 днів після інокуляції клітин пухлини), миші були випадковим чином розподілені відносно об'єму пухлини й розділені на три групи (по 5 тварин на групу), кожну групу обробляли шляхом внутрішньовенного болюсного ведення або mub38.1-MCC-DM1 (20 мг білка кон’югата/кг), або mub38.1-PEG4-Mal-Dm (20 мг білка кон’югата/кг) або розчину фосфатносольового буфера (контроль на розчинник). За ростом пухлини стежили, вимірюючи розмір пухлини двічі в тиждень. Розмір пухлини розраховували за формулою: довжина ширина висота ½. Середня зміна в об'ємі пухлини показана, наприклад, на Фіг. 30. У контрольній групі, що 21 UA 108598 C2 3 5 10 15 20 25 30 35 40 45 50 55 одержувала PBS, об'єм пухлини досягав розміру, рівного 600 мм на день 20, після інокуляції клітин. Лікування за допомогою mub38.1-MCC-DM1 привело до затримки росту пухлини на 15 днів. Лікування за допомогою mub38.1-PEG4-Mal-Dm продемонструвала більш сильний протипухлинний ефект: у двох з п'яти тварин спостерігали повну ремісію пухлини, що тривав 44 дня, і в трьох тварин спостерігали затримку росту пухлини на 32 дня. Таким чином, кон’югат сьогодення винаходу, mub38.1-PEG4-Mal-Dm, значно більш ефективний, ніж mub38.1-MCC-DM1 у цієї ксенотрансплантатної моделі раку товстої кишки людини. ПРИКЛАД IX Порівняння протипухлинної активності in vivo кон’югатів анти-EpCAM-майтанзиноїд (mub38.1-MCC-DM1 і mub38.1-PEG4-Mal-dm) у відношенні стійких до лікарських засобів ксенотрансплантатів раку товстої кишки (COLO205-MDR) Протипухлинний ефект кон’югатів mub38.1-MCC-DM1 і mub38.1-PEG4-Mal-Dm досліджували на моделі ксенотрансплантата карциноми товстої кишки людини, COLO205-MDR, яка була створена для оверекспресії P-глікопротеїну. COLO205-MDR клітини вводили за допомогою підшкірної ін'єкції в область під праву лопатку мишам SCID (1 107 клітин на тварину). Після 3 того, як об'єм пухлини досягав розміру, рівного приблизно 170 мм (через 8 днів після інокуляції клітин), мишей випадковим чином розподіляли по трьом групам (по 6 тварин на групу), кожну групу обробляли за допомогою єдиного внутрішньовенного болюсного введення або mub38.1MCC-DM1 (20 мг білка кон’югата/кг), або mub38.1-PEG4-Mal-Dm (дозування антитіла – 20 мг/кг) або розчину фосфатно-сольового буфера (контроль на розчинник). Ріст пухлини контролювали шляхом виміру розміру пухлини двічі на тиждень. Розмір пухлини розраховували за формулою: довжина ширина висота ½. Середня зміна в об'ємі пухлини показана, наприклад, на Фіг. 31. У контрольній групі, що 3 одержувала PBS, пухлини виростали до приблизно 1000 мм на 38-й день. Лікування за допомогою mub38.1-MCC-DM1 приводило до затримки росту пухлини на 14 днів. Лікування за допомогою mub38.1-PEG4-Mal-Dm мало виражений протипухлинний ефект, який виражався в повній регресії пухлини у всіх шести тварин (Фіг. 31). Подібний експеримент проводили у відношенні ксенотрансплантатів COLO 205. Знову, лікування за допомогою B38.1-PEG4-Mal-Dm виявилося більш ефективним і привело до повної регресії пухлини, тоді як для стандартного кон’югата SMCC була показана тільки помірна затримка росту пухлини (Фіг. 32). Схожі результати були отримані для кон’югатів гуманізованого анти-CanАg антитіла (Фіг. 33). Таким чином, кон’югат сьогодення винаходу, mub38.1-PEG4-Мal-DM1 значно більш ефективний у порівнянні з кон’югатом mub38.1-MCC-DM1, отриманим із застосуванням раніше описаного зшиваючого агента, у цієї ксенотрансплантатній моделі раку товстої кишки людини. ПРИКЛАД X Аналіз довжини PEG: Одержали декілька кон’югатів AB-PEG4-MAl-DMx, застосовуючи зшиваючі агенти, на основі PEG4, PEG8, PEG12, PEG24 і з різним числом Dmx, включеного на одне антитіло. Фіг. 34 демонструє, що кон’югат Ab-PEG24-Mal-Dm1 з дуже високим навантаженням, рівної 17,1 молекул D/A, показав таке ж зв'язування з антиген-експресуючими раковими клітинами, як і немодифіковане антитіло (зв'язування визначали в гнізді для виміру відносної середньої інтенсивності флуоресценції RMF за допомогою методу проточної цитометрії). Крім того, по даним аналізу зв'язування із клітинами, проведеного за допомогою проточної цитометрії, кон’югати Ab-PEG8-Mal-Dm1 і Ab-PEG12-Mal-Dm1, що несуть від 4 до 8 молекул D/A демонстрували таке ж зв'язування, як і немодифіковані антитіла. Кон’югати AB-PEGN-MAL-DMX, отримані із застосуванням зшиваючих агентів, на основі PEG4, PEG8, PEG12, PEG24 мали потужну цитотоксичність стосовно антиген-позитивним клітинам. На Фіг. 35 показано, що кон’югати анти-CanАg антитіла-(huc242)-PEGn-Мal-DM1 із числом молекул D/A, рівним від 4 до 17, убивають CanАg антиген-позитивні клітини COLO205 з ефективністю IC 50, рівної приблизно 0,1-0,5 нМ при інкубації протягом 5-ти днів. Кон’югатами huc PEGн-Mal-Dm1, які несуть від 4 до 17 молекул D/A, ефективно знищують pgp-експресуючі стійкі до лікарських засобів клітини COLO205-MDR з IC50, яка дорівнює приблизно від 0,05 до 0,5 нМ (Фіг. 36). Кон’югат PEG 24-MalDm1 з високим навантаженням, 17,1 молекул D/A, мав потужнішу цитотоксичність у порівнянні з кон’югатом PEG24-Mal-Dm1 з 4 молекулами D/A (Фіг. 34, 36). 22 UA 108598 C2 ФОРМУЛА ВИНАХОДУ 5 10 15 20 25 30 35 40 45 50 55 60 1. Сполука формули (1) або (1'): Z-X1-(-CH2-CH2-O-)n-Yp-D, (1) D-Yp-(-CH2-CH2-O-)n-X1-Z, (1') де: Z є реакційноздатним карбоксильним ефіром, вибраним з групи, що складається з Nсукцинімідилу, N-сульфосукцинімідилу, N-фталіміду, N-сульфофталімідилу, 2-нітрофенілу, 4нітрофенілу, 2,4-динітрофенілу, 3-сульфо-4-нітрофенілу, 3-карбокси-4-нітрофенілу і складного ефіра тетрафторфенілу або галоацетаміду; D є майтанзиноїдом; X є аліфатичною структурною одиницею; Y є аліфатичною структурною одиницею, приєднаною до майтанзиноїду через тіоефірний зв'язок; де зазначена аліфатична структурна одиниця, яку представляють X або Y, є нерозгалуженою або розгалуженою алкільною групою, що має 1-20 атомів вуглецю в ланцюзі, циклічною алкільною групою, що має 3-10 атомів вуглецю, нерозгалуженою або розгалуженою алкенільною групою, що має 2-15 атомів вуглецю в ланцюзі, або нерозгалуженою або розгалуженою алкінільною групою, що має 2-15 атомів вуглецю в ланцюзі; l дорівнює 0 або 1; р дорівнює 0 або 1; і n є цілим числом від 1 до 2000. 2. Кон'югат агента, який зв'язується із клітиною, і цитотоксичного майтанзиноїду формули (2) або (2'): CB-[X1-(-CH2-CH2-O-)n-Yp-D]m, (2) [D-Yp-(-CH2-CH2-O-)n-X1]m-CB, (2') де: СВ є агентом, який зв'язується із клітиною і є антитілом; D є майтанзиноїдом; X є аліфатичною структурною одиницею, приєднаною до агента, який зв'язується із клітиною через амідний зв'язок; Y є аліфатичною структурною одиницею, приєднаною до майтанзиноїду через тіоефірний зв'язок; де зазначена аліфатична одиниця, яку представляють X або Y, є нерозгалуженою або розгалуженою алкільною групою, що має 1-20 атомів вуглецю в ланцюзі, циклічною алкільною групою, що має 3-10 атомів вуглецю, нерозгалуженою або розгалуженою алкенільною групою, що має 2-15 атомів вуглецю в ланцюзі, або нерозгалуженою або розгалуженою алкінільною групою, що має 2-15 атомів вуглецю в ланцюзі; l дорівнює 0 або 1; р дорівнює 0 або 1; і m є цілим числом від 2 до 15; і n є цілим числом від 1 до 2000. 3. Кон'югат за п. 2, в якому зазначений агент, який зв'язується із клітиною, представлений одноланцюговим антитілом, фрагментом антитіла, який специфічно зв'язується із клітиноюмішенню, моноклональним антитілом, одноланцюговим моноклональним антитілом, біспецифічим антитілом, фрагментом, який специфічно зв'язується із клітиною-мішенню. 4. Кон'югат за п. 2, в якому зазначений агент, який зв'язується із клітиною, представлений моноклональним антитілом зі зміненою поверхнею, одноланцюговим моноклональним антитілом зі зміненою поверхнею або фрагментом моноклонального антитіла зі зміненою поверхнею, який специфічно зв'язується із клітинкою-мішенню. 5. Кон'югат за п. 2, в якому зазначений агент, який зв'язується із клітиною, представлений гуманізованим моноклональним антитілом, гуманізованим одноланцюговим моноклональним антитілом або фрагментом гуманізованого моноклонального антитіла, який специфічно зв'язується із клітинкою-мішенню. 6. Кон'югат за п. 2, в якому зазначене антитіло представлене химерним антитілом, фрагментом химерного антитіла, доменом цього антитіла або фрагментом домену цього антитіла. 7. Кон'югат за п. 2, в якому зазначене антитіло представлене MY9, анти-В4, С242 або антитілом, яке зв'язується з антигеном, вибраним з групи, що складається з ЕрСАМ, CD2, CD3, CD4, CD5, CD6, CD11, CD19, CD20, CD22, CD26, CD30, CD33, CD37, CD38, CD40, CD44, CD56, CD79, 23 UA 108598 C2 5 10 15 20 CD105, CD138, рецепторами EphA, рецепторами EphB, EGFR, EGFRvIII, HER2, HER3, мезотеліном, білком Cripto, інтегрином альфаvбета3, інтегрином альфаvбета5, інтегрином альфаvбета6. 8. Кон'югат за п. 2, в якому зазначене антитіло представлене гуманізованим, людським антитілом або антитілом зі зміненою поверхнею, яке вибирають з-поміж антитіл Мy9-6, В4, С242, N901, DS6, які зв'язуються з рецептором ЕрhА2, антитіл, які зв'язуються з CD38, антитіл, які зв'язуються з IGF-IR, CNTO 95, В-В4, трастузумабу, пертузумабу, біватузумабу, сибротузумабу або ритуксимабу. 9. Кон'югат за п. 2, в якому зазначений агент, який зв'язується із клітиною, зв'язується із клітиною-мішенню, яку вибирають з-поміж пухлинних клітин, клітин, інфікованих вірусом, клітин, інфікованих мікроорганізмами, клітин, інфікованих паразитами, аутоімунних клітин, активованих клітин, мієлоїдних клітин, активованих Т-клітин, В-клітин або меланоцитів, клітин, які експресують один або декілька з-поміж наступного: IGF-IR, CanAg, EGFR, MUC1, MUC16, VEGF, TF, ЕрСАМ, CD2, CD3, CD4, CD5, CD6, CD11, CD11a, CD18, CD19, CD20, CD22, CD26, CD30, CD33, CD37, CD38, CD40, CD44, CD56, CD70, CD79, CD105, CD138, рецептори EphA, рецептори EphB, EGFRvIII, HER2/neu, HER3, мезотелін, білок Cripto, інтегрин aльфavбeтa3, інтегрин альфаvбета5, інтегрин альфаvбета і Аро2; або клітин, які експресують рецептор інсуліноподібного фактора росту, рецептор епідермального фактора росту або рецептор фолату. 10. Кон'югат за п. 9, в якому пухлинні клітини є клітинами, які вибирають з-поміж клітин раку молочної залози, клітин раку передміхурової залози, клітин раку яєчників, клітин колоректального раку, клітин раку шлунка, клітин плоскоклітинного раку, клітин дрібноклітинного раку легень та із клітин раку яєчок. 11. Сполука за п. 1, що представлена формулою, вибраною з групи: O R O MeO O O q N O Cl R O S O O O n N H N O O N N O O O MeO 25 HO N H O ; O R O O Cl MeO R O q N O S O N H O O O n O N N O O MeO HO N H O ; 24 UA 108598 C2 O R O S q O N n N H N O O MeO O O O N O Cl R O N H N O O O MeO N H HO O ; O R O Cl S q O O N N H n N H O O MeO O O N O R N O O N H HO MeO O і O R O Cl q S I O N H n N H O O MeO O O N O R N O MeO 5 N H HO O , де n є цілим числом від 1 до 2000; R означає Н, q дорівнює 1 або R означає СН3 і q=2. 12. Кон'югат, представлений формулою, вибраною з групи: O R O O Cl MeO R O q N O S O N O O N H H N n mAb O N O O MeO HO N H O m 25 ; UA 108598 C2 O R O O O S q N O Cl R O MeO n N H O H N mAb O N O MeO O R O O m R q S O O MeO N n N H N O ; O O O O N O Cl N H HO S N N H mAb O O O N H HO MeO O m O R O O Cl R O O q N S O O MeO n N H O O N N H N ; S mAb O O HO MeO N H O і m O R O O Cl MeO R O O q N S O N H O O n N H S mAb N O MeO HO N H O m 26 , UA 108598 C2 5 10 15 20 25 де n є цілим числом від 1 до 2000; m - ціле число від 2 до 15; mАb є моноклональним антитілом; R означає Н, q=l або R означає СН3 і q=2. 13. Сполука за п. 1 або 11, де n є цілим числом від 1 до 14. 14. Сполука за п. 13, де n є цілим числом від 1 до 4. 15. Кон'югат за будь-яким з пп. 2-10 та 12, де n є цілим числом від 1 до 14. 16. Кон'югат за п. 15, де n є цілим числом від 1 до 4. 17. Фармацевтична композиція для лікування пухлин, автоімунних захворювань, відторгнення трансплантатів, реакції трансплантатів проти носія, вірусних інфекцій та паразитарних інфекцій, чутливих до даної фармацевтичної композицій, яка містить ефективну кількість кон'югата майтанзиноїд-агент, що зв'язується із клітиною, за пп. 2, 12, 15 або п. 16 або його фармацевтично прийнятної солі або його сольвату і фармацевтично прийнятну основу, розріджувач або ексципієнт. 18. Спосіб лікування пухлин, автоімунних захворювань, відторгнень трансплантатів, реакції трансплантатів проти носія, вірусних інфекцій та паразитарних інфекцій, чутливих до лікування зазначеним способом, який передбачає парентеральне введення пацієнтові, який цього потребує, ефективної дози кон'югата за пп. 2, 12, 15 або 16. 19. Спосіб за п. 18, який відрізняється тим, що у ньому зазначену пухлину вибирають з-поміж одного або декількох видів раку легені, крові, плазми, молочної залози, товстої кишки, передміхурової залози, нирок, підшлункової залози, мозку, кісток, яєчників, сім'яників та органів лімфатичної системи. 20. Спосіб за п. 18, який відрізняється тим, що у ньому зазначена пухлина експресує одне або декілька з-поміж наступного: IGF-IR, FOLRL, CanAg, EGFR, EphA2, MUC1, MUC16, VEGF, TF, MY9 антитіл, анти-В4 антитіл, ЕрСАМ, CD2, CD3, CD4, CD5, CD6, CD11, CD11a, CD18, CD19, CD20, CD22, CD26, CD30, CD33, CD37, CD38, CD40, CD44, CD56, CD70, CD79, CD105, CD138, EphA, EphB, EGFRvIII, HER2/neu, HER3, мезотелін, білок Cripto, інтегрин альфаvбета3, інтегрин альфаvбета5, інтегрин aльфavбeтa6, Аро2 і антигени. 27 UA 108598 C2 28
ДивитисяДодаткова інформація
Назва патенту англійськоюPotent conjugates and hydrophilic linkers
Автори англійськоюChari, Ravi V. J., Kovtun, Yelena, Singh, Rajeeva, Wilhelm, Sharon, D.
Автори російськоюЧари Рави В. Дж.
МПК / Мітки
МПК: A61K 39/395, C12N 15/62, A61P 37/00, C07K 19/00, A61P 35/00
Мітки: лінкери, гідрофільні, зшиваючі, кон'югати, агенти, високоефективні
Код посилання
<a href="https://ua.patents.su/60-108598-visokoefektivni-konyugati-ta-gidrofilni-zshivayuchi-agenti-linkeri.html" target="_blank" rel="follow" title="База патентів України">Високоефективні кон’югати та гідрофільні зшиваючі агенти (лінкери)</a>
Попередній патент: Спосіб регуляції ненасиченості жирних кислот олії насіння
Наступний патент: Приготований корм для жуйних, спосіб одержання корму і поліпшуючий перетравлювання кормовий матеріал
Випадковий патент: Переналагоджуваний шліцьовий притир












