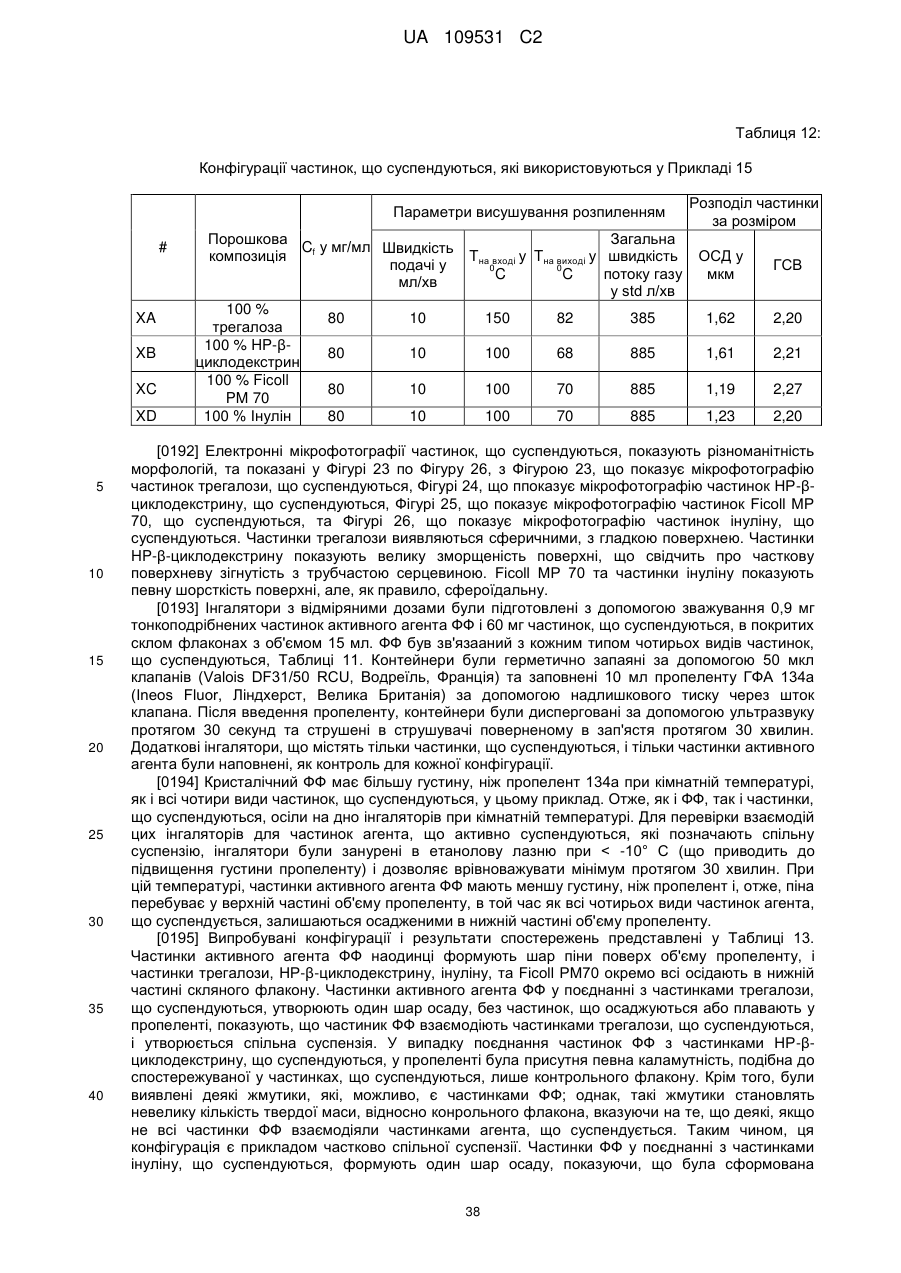
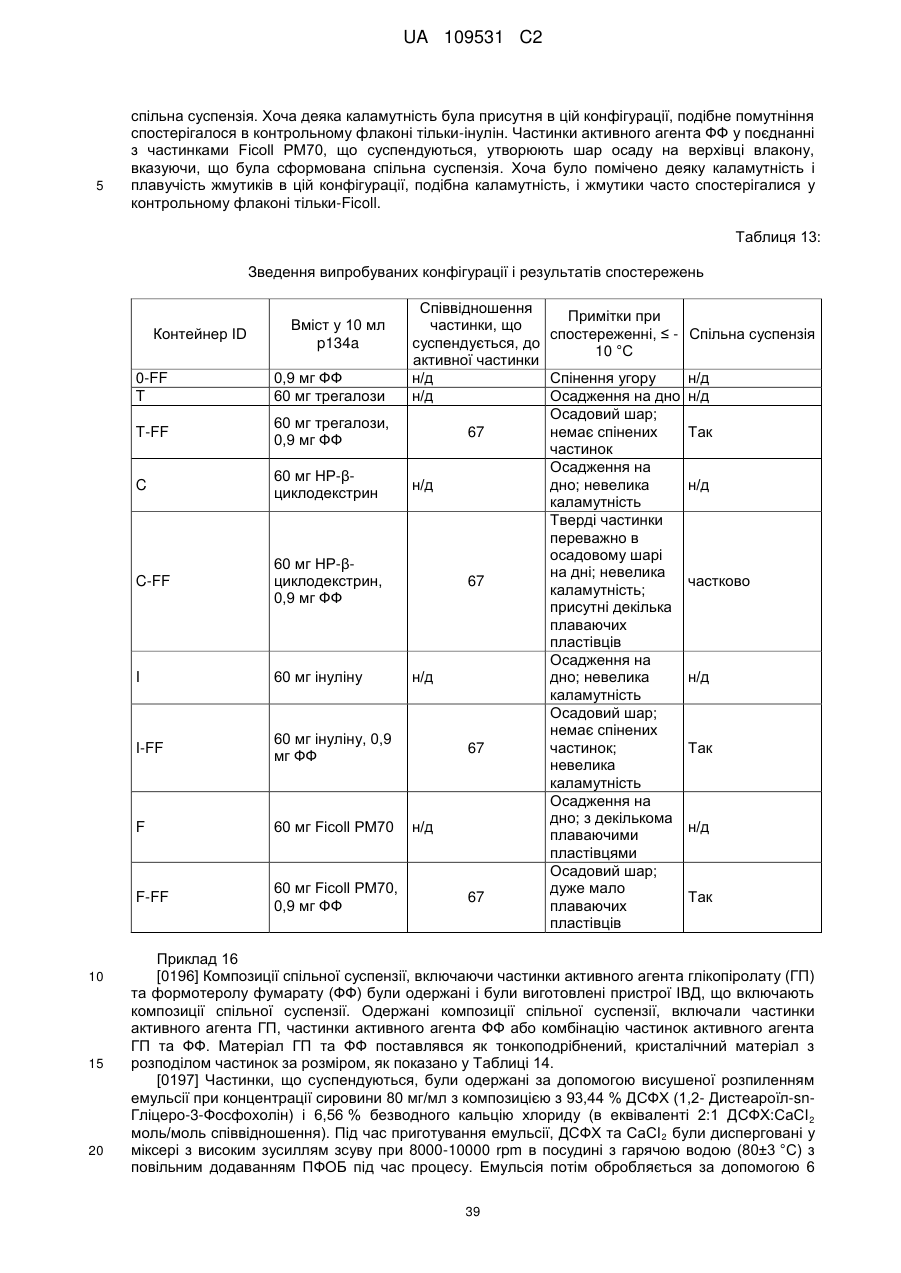
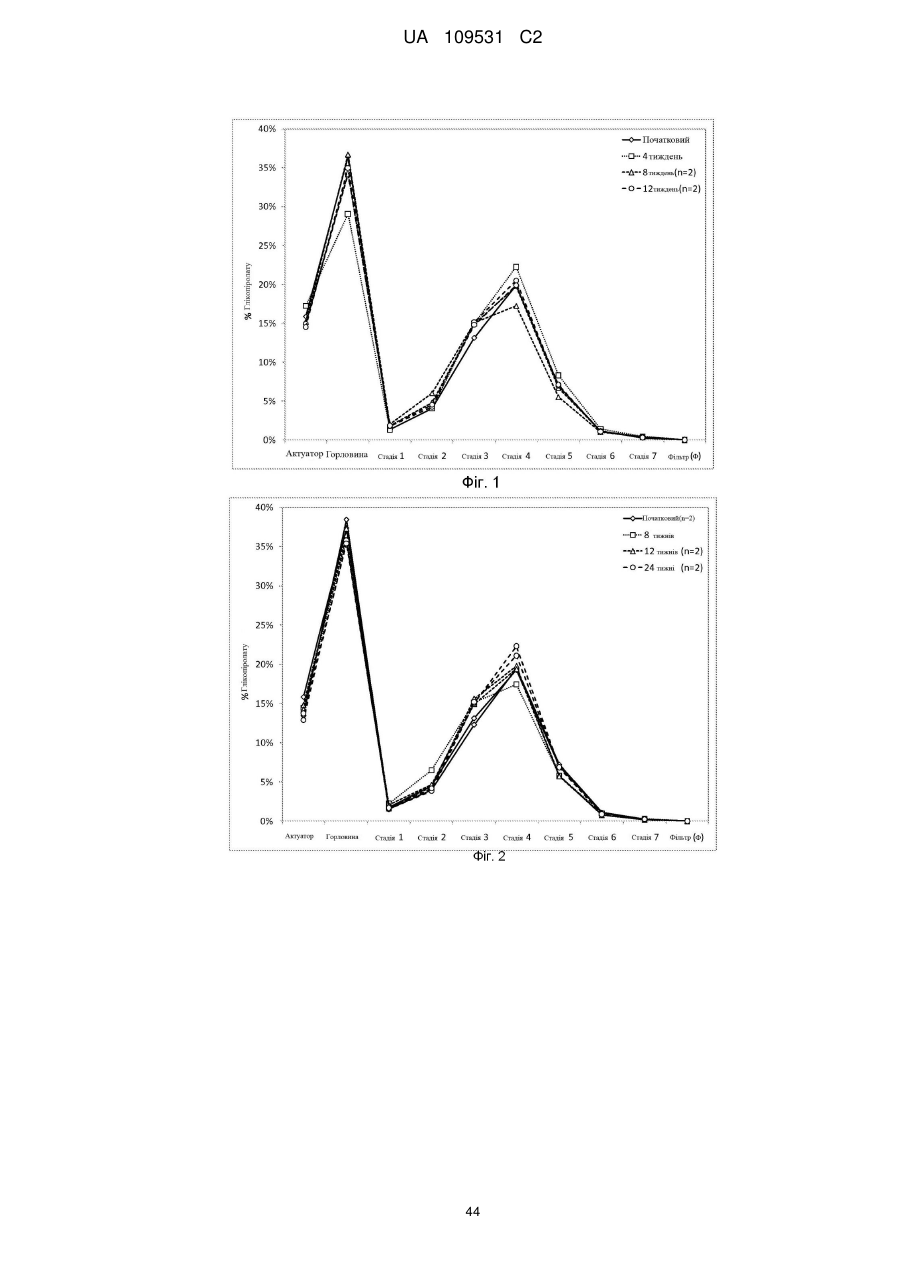
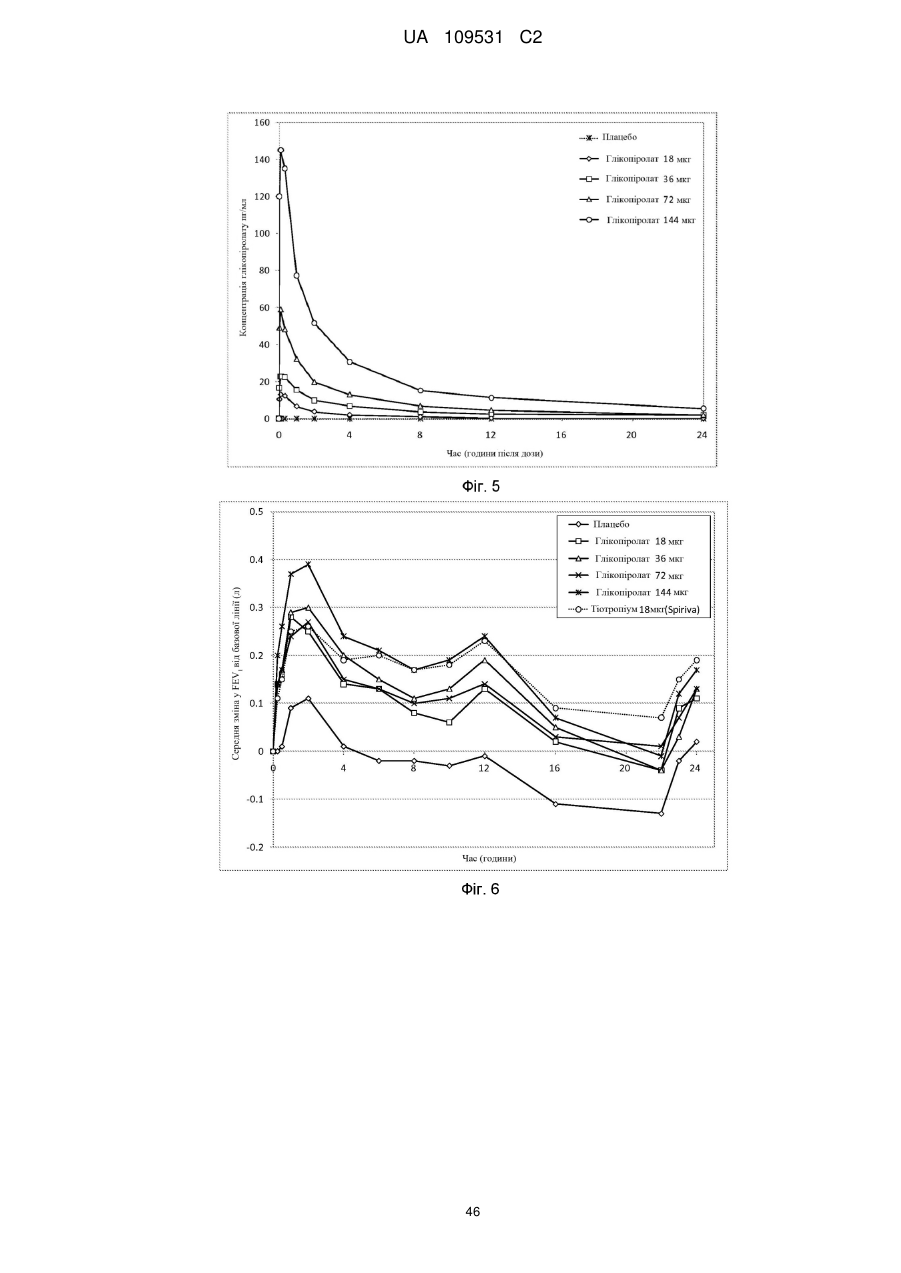
Композиції для легеневої доставки мускаринових антагоністів тривалої дії та агоністів адренергічних рецепторів b2 тривалої дії та пов’язані способи і системи
Номер патенту: 109531
Опубліковано: 10.09.2015
Автори: Двіведі Сарваджна Кумар, Хартман Майкл Стівен, Джоші Відя Б., Сміт Едріен Едвард, Верінг Рейнхард
Формула / Реферат
1. Фармацевтична композиція, яка може бути доставлена з інгалятора з відміряними дозами, що включає:
суспензійне середовище, яке включає фармацевтично прийнятний пропелент;
множину частинок активного агента, що містять активний агент, вибраний з глікопіролату та формотеролу та будь-яких їх фармацевтично-прийнятних солей, естерів, ізомерів або сольватів; та
множину придатних до вдихання частинок, що суспендуються, які включають сухий фосфоліпідний матеріал у вигляді частинок, який практично нерозчинний у пропеленті, де множина частинок, що суспендуються, включає перфоровані мікроструктури, та множина частинок активного агента спільно розміщена з множиною придатних до вдихання частинок, що суспендуються, у суспензійному середовищі для утворення спільної суспензії.
2. Фармацевтична композиція за п. 1, де частинки активного агента включають глікопіролат, включаючи будь-які його фармацевтично прийнятні солі, естери, ізомери або сольвати.
3. Фармацевтична композиція за п. 2, де фармацевтично прийнятна сіль, естер або ізомер глікопіролату вибраний з групи, яка включає: фторид, хлорид, бромід, йодид, нітрат, сульфат, фосфат, форміат, ацетат, трифторацетат, пропіонат, бутират, лактат, цитрат, тартрат, малат, малеат, сукцинат, бензоат, п-хлорбензоат, дифеніл-ацетат або трифенілацетат, o-гідроксибензоат, п-гідроксибензоат, 1-гідроксинафталін-2-карбоксилат, 3-гідроксинафталін-2-карбоксилат, метансульфонат та бензолсульфонат.
4. Фармацевтична композиція за п. 3, де фармацевтично прийнятна сіль, естер або ізомер глікопіролату являє собою 3-[(циклопентил-гідроксифенілацетил)окси]-1,1-диметилпіролідиній бромід.
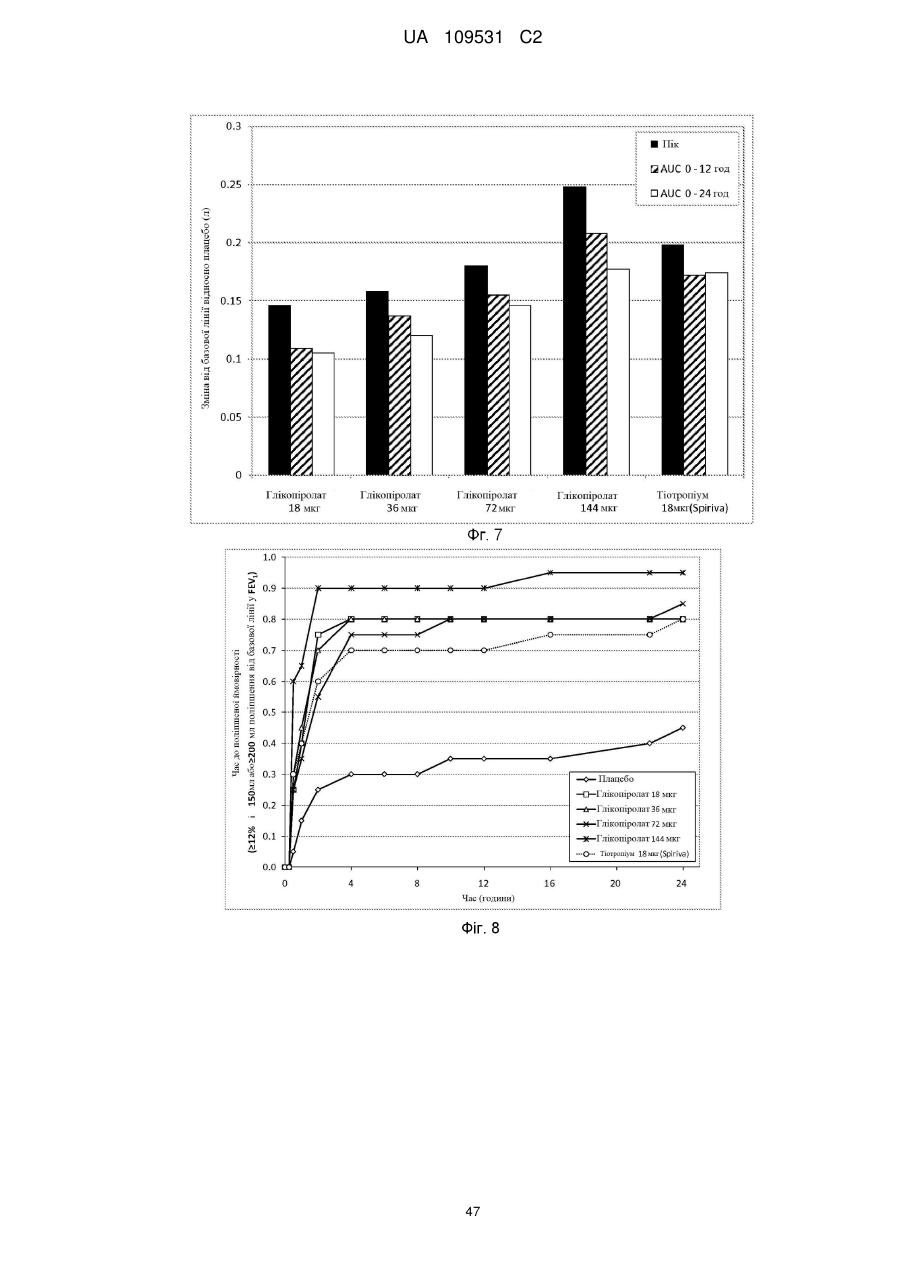
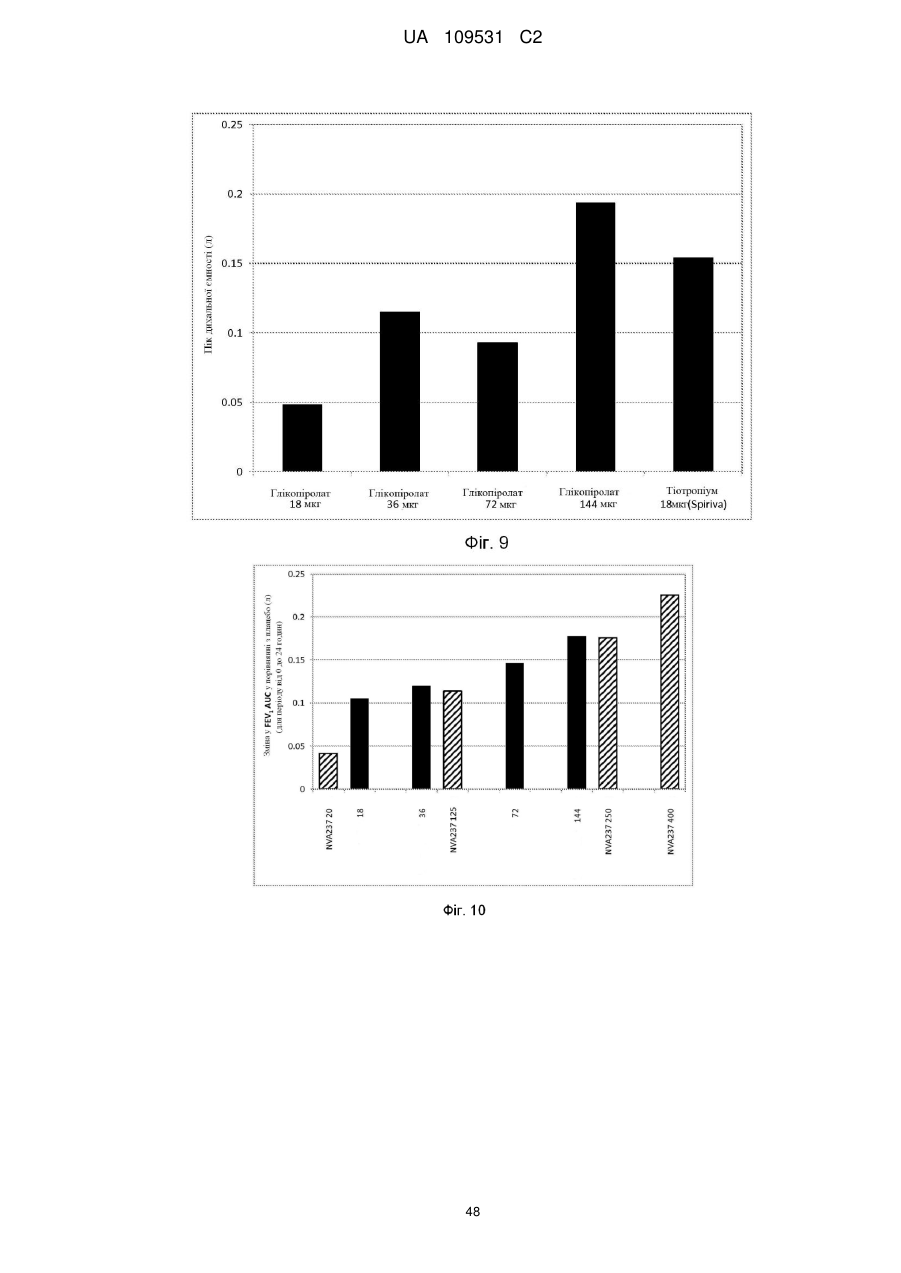
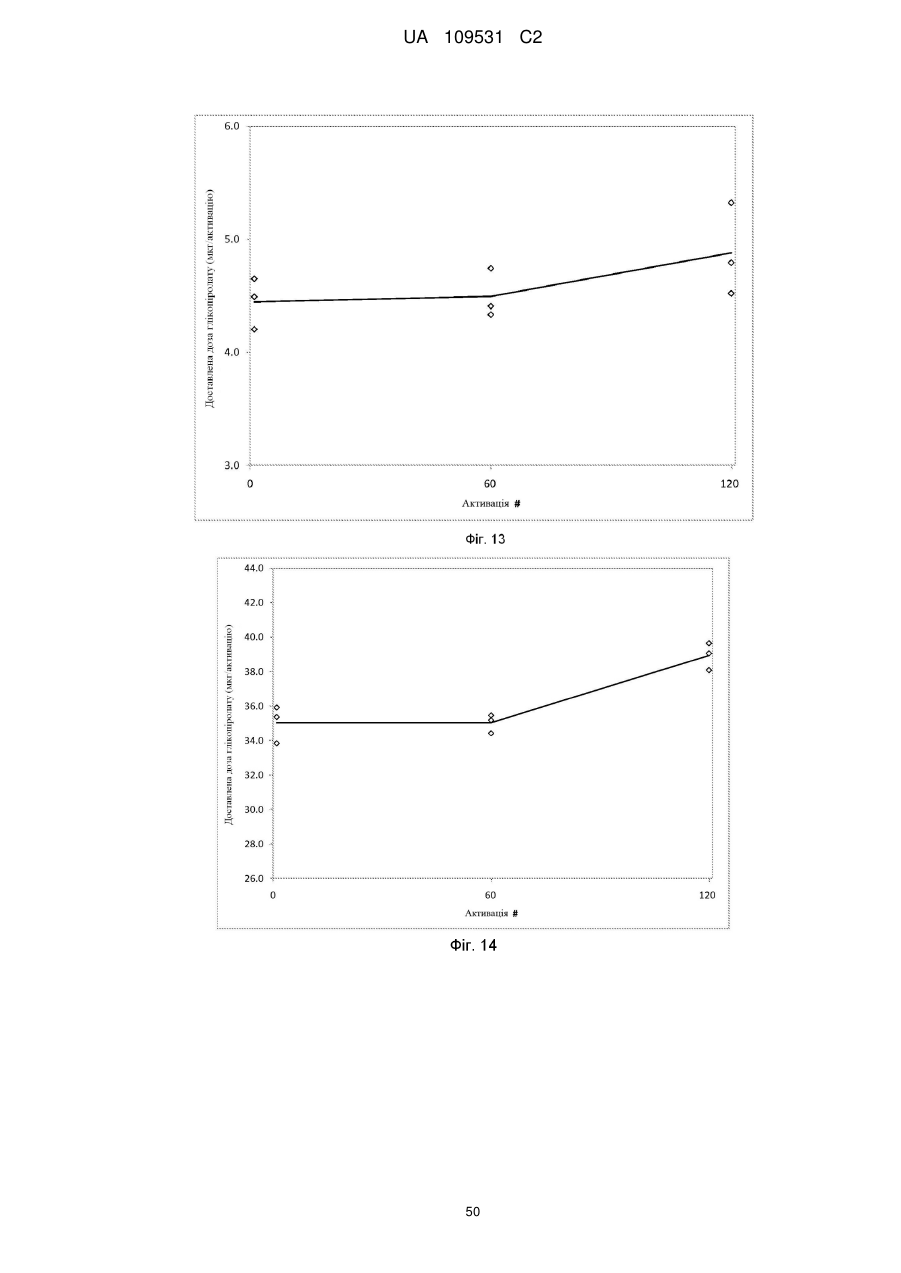
5. Фармацевтична композиція за п. 2, де частинки активного агента глікопіролату включені в суспензійне середовище в концентрації, достатній для забезпечення доставленої дози глікопіролату на активацію інгалятора з відміряними дозами, вибраної з між 2 мкг та 200 мкг на активацію, між 10 мкг та 150 мкг на активацію і між 15 мкг та 80 мкг на активацію.
6. Фармацевтична композиція за п. 2, де концентрація глікопіролату, включеного в спільну суспензію, є між 0,04 мг/мл та 2,25 мг/мл.
7. Фармацевтична композиція за п. 2, де принаймні 90 % частинок активного агента глікопіролату за об′ємом мають оптичний діаметр 7 мкм чи менше.
8. Фармацевтична композиція за п. 2, де принаймні 50 % частинок активного агента глікопіролату за об′ємом мають оптичний діаметр 5 мкм чи менше.
9. Фармацевтична композиція за п. 1, де частинки, що суспендуються, містять сіль кальцію, бажано хлорид кальцію.
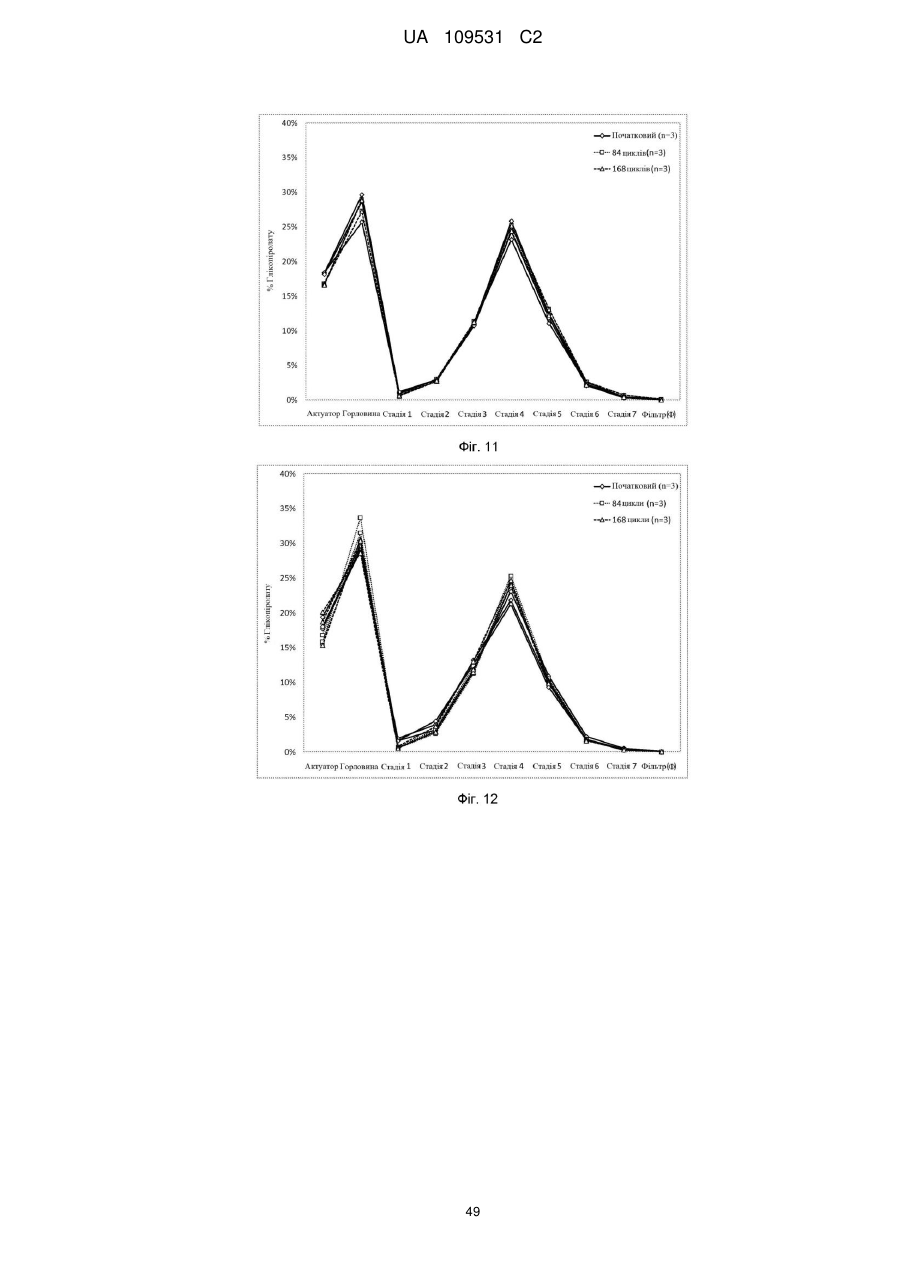
10. Фармацевтична композиція за п. 1, де перфоровані мікроструктури включають ДСФХ (1,2-дистеароїл-sn-гліцеро-3-фосфохолін).
11. Фармацевтична композиція за п. 1, де перфоровані мікроструктури включають ДСФХ та хлорид кальцію.
12. Фармацевтична композиція за п. 1, де частинки, що суспендуються, показують об′ємний середній оптичний діаметр між 0,5 мкм та 15 мкм.
13. Фармацевтична композиція за п. 1, де пропелент включає пропелент, вибраний з пропеленту ГФА, пропеленту ПФС та їх комбінацій, і де пропелент, в основному, вільний від додаткових компонентів.
14. Фармацевтична композиція за п. 1, де загальна маса частинок, що суспендуються, перевищує загальну масу частинок активного агента та співвідношення загальної маси частинок, що суспендуються, до загальної маси частинок активного агента, вибране з між 10 та 200, між 60 та 200, між 15 та 60 та між 15 та 170.
15. Фармацевтична композиція за п. 1, де частинки, що суспендуються, залишаються спільно розміщеними з частинками активного агента, навіть, коли до них прикладені сили плавучості, підсилені центрифугуванням при прискоренні, вибраному з прискорень принаймні 1 g, принаймні 10 g, принаймні 50 g та принаймні 100 g.
16. Фармацевтична композиція за п. 1, де частинки активного агента включають формотерол, включаючи будь-які його фармацевтично прийнятні солі, естери, ізомери або сольвати.
17. Фармацевтична композиція за п. 16, де фармацевтично прийнятна сіль, естер або ізомер формотеролу вибраний з групи, яка включає: солі хлористоводневої, бромистоводневої, сірчаної, фосфорної кислот, фумарової, малеїнової, оцтової, молочної, лимонної, винної, аскорбінової, бурштинової, глутарової, глюконової, трикарбалілової, олеїнової, бензойної, п-метоксибензойної, саліцилової, о- і п-гідроксибензойної, п-хлорбензойної, метансульфонової, п-толуолсульфонової і 3-гідрокси-2-нафталін карбонових кислот.
18. Фармацевтична композиція за п. 17, де фармацевтично прийнятна сіль, естер або ізомер формотеролу являє собою формотеролу фумарат.
19. Фармацевтична композиція за п. 16, де частинки активного агента формотеролу включені у композицію в концентрації, достатній для забезпечення доставленої дози формотеролу, вибраної з між 1 мкг та 30 мкг, між 0,5 мкг та 10 мкг, між 2 мкг та 5 мкг, між 2 мкг та 10 мкг, між 5 мкг та 10 мкг і між 3 мкг та 30 мкг на активацію інгалятора з відміряними дозами.
20. Фармацевтична композиція за п. 16, де частинки активного агента формотеролу, включені у композицію в концентрації, достатній для забезпечення доставленої дози формотеролу, вибраної з до 30 мкг, до 10 мкг, до 5 мкг, до 2,5 мкг, до 2 мкг або до 1,5 мкг на активацію інгалятора з відміряними дозами.
21. Фармацевтична композиція за п. 16, де концентрація формотеролу, включеного в спільну суспензію, вибрана з між 0,01 мг/мл та 1 мг/мл, між 0,01 мг/мл та 0,5 мг/мл і між 0,03 мг/мл та 0,4 мг/мл.
22. Фармацевтична композиція за п. 16, де принаймні 90% частинок активного агента формотеролу за об′ємом мають оптичний діаметр 5 мкм чи менше.
23. Фармацевтична композиція за п. 16, де принаймні 50% частинок активного агента формотеролу за об′ємом мають оптичний діаметр 2 мкм чи менше.
24. Фармацевтична композиція за п. 16, де загальна маса частинок, що суспендуються, перевищує загальну масу частинок активного агента та співвідношення загальної маси частинок, що суспендуються, до загальної маси частинок активного агента, вибране з до 15, до 17, до 20, до 30, до 40, до 50, до 60, до 75, до 100, до 150 та до 200.
25. Фармацевтична композиція за п. 16, де частинки, що суспендуються, залишаються спільно розміщеними з частинками активного агента, навіть, коли до них прикладені сили плавучості, підсилені центрифугуванням при прискоренні, вибраному з прискорень принаймні 1 g, принаймні 10 g, принаймні 50 g та принаймні 100 g.
26. Фармацевтична композиція, яка може бути доставлена з інгалятора з відміряними дозами за п. 1 або п. 19, де активний агент, включений у фармацевтично прийнятну спільну суспензію, є хімічно стабільним впродовж періоду в принаймні 18 місяців, коли зберігається при 5°C.
27. Iнгалятор з відміряними дозами за п. 26, де активний агент є хімічно стабільним впродовж періоду в принаймні 18 місяців, коли зберігається при 25 °C.
28. Фармацевтична композиція за п. 16, де швидкість утворення N-(2-гідрокси-5-(1-(2-гідрокси-5-(1-гідрокси-2-(1-(4-метоксифеніл)пропан-2-іламіно)етил)феніламіно)-2-(1-(4-метоксифеніл)пропан-2-іламіно)етил)феніл)ацетаміду всередині фармацевтично прийнятної спільної суспензії не перевищує 0,15 %, після піддавання контейнера температурі в 40 ºC та відносній вологості 75 % впродовж періоду в один місяць.
29. Фармацевтична композиція за п. 16, де швидкість утворення N-(2-гідрокси-5-(1-(2-гідрокси-5-(1-гідрокси-2-(1-(4-метоксифеніл)пропан-2-іламіно)етил)феніламіно)-2-(1-(4-метоксифеніл)пропан-2-іламіно)етил)феніл)ацетаміду всередині фармацевтично прийнятної спільної суспензії не перевищує 0,5 %, після піддавання контейнера температурі в 40 ºC та відносній вологості 75 % впродовж періоду в один місяць.
30. Фармацевтична композиція за будь-яким з пп. 1-29, у якій активний агент представлений у кристалічній або в цілому кристалічній формі.
31. Композиція за будь-яким з пп. 1-30 для застосування у медицині.
32. Композиція за будь-яким з пп. 1-30 для застосування у лікуванні легеневого захворювання або розладу.
33. Композиція за п. 32, де легеневе захворювання або розлад, вибрані з принаймні одного з наступних: астми, ХОПЗ, хронічного бронхіту, емфіземи, бронхоектазу, алергічного риніту, синуситу, легеневої вазоконстрикції, запалення, алергій, ускладненого дихання, респіраторного дистрес-синдрому, легеневої гіпертензії, запалення легень, пов’язаного з муковісцидозом, і легеневої обструкції, пов’язаної з муковісцидозом.
34. Композиція за п. 33, де легеневе захворювання або розлад являє собою ХОПЗ.
Текст
Реферат: Винахід стосується фармацевтичної композиції, яка може бути доставлена з інгалятора з відміряними дозами, що включає: суспензійне середовище, яке включає фармацевтично прийнятний пропелент; множину частинок активного агента, вибраного з глікопіролату та формотеролу та будь-яких їх фармацевтично-прийнятних солей, естерів, ізомерів або сольватів; та множину здатних до вдихання частинок, що суспендуються, які включають сухий UA 109531 C2 (12) UA 109531 C2 фосфоліпідний матеріал у вигляді частинок, який практично нерозчинний у пропеленті, де множина частинок, що суспендуються, включає перфоровані мікроструктури, та множина частинок активного інгредієнта спільно розміщена з множиною здатних до вдихання частинок, що суспендуються, у суспензійному середовищі для утворення спільної суспензії. Винахід також стосується застосування вказаної композиції та інгалятора її доставки. UA 109531 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки [0001] Цей опис в основному стосується фармацевтичних композицій та способів доставки активних агентів через дихальні шляхи. У деяких аспектах, цей опис відноситься до композицій, способів, та систем для легеневої доставки мускаринових антагоністів та агоністів адренергічних рецепторів β2 тривалої дії за допомогою інгалятора з відміряними дозами. Рівень техніки [0002] Способи цільової доставки ліків, що доставляють активний агент на місце прикладання дії є часто бажаними. Наприклад, цільова доставка активних агентів може знижувати небажані побічні ефекти, зменшувати потреби в дозуванні та зменшувати терапевтичні витрати. У контексті доставки респіраторним шляхом, інгалятори є добре відомими пристроями для доставки активного агента до дихальних шляхів суб'єкта, і декілька різних інгаляторних систем зараз є комерційно доступними. Три звичайні інгаляторні системи включають інгалятори сухих порошків, небулайзери та інгалятори з відміряними дозами (пристрої ІВД). [0003] Пристрої ІВД можна використовувати для доставки ліків у солюбілізованій формі або як суспензію. Зазвичай, пристрої ІВД використовують відносно високий тиск пару пропеленту для виштовхування розпилених краплин, що містять активний агент в дихальні шляхи, коли ІВД є активований. Інгалятори сухих порошків загалом залежать від дихальних зусиль пацієнта для введення ліків у формі сухого порошку в дихальні шляхи. З іншого боку, небулайзери формують лікувальний аерозоль, який підлягає інгаляції прикладеною енергією до рідкого розчину або суспензії. [0004] Пристрої ІВД – це пристрої активної доставки, які використовують тиск, утворений пропелентом. Зазвичай, як пропеленти в ІВД системах використовували хлорфторвуглеці (ХФВ) через їхню низьку токсичність, бажаний тиск пару та придатність для формування стабільних суспензій. Однак, традиційні пропеленти ХФВ зрозуміло мають негативний вплив на довкілля, що викликало розвиток альтернативних пропелентів, які, як важають, є більш безпечними для довкілля, таких як перфторовані сполуки (ПФСи) та гідрофторалкани (ГФАи). [0005] Активний агент, який треба доставити за допомогою суспензії ІВД, звичайно доставляється як дрібнодисперсна частинка, диспергована в пропеленті або комбінації з двох або більше пропелентів (тобто, "системі" пропеленту). Для того щоб формувати дрібнодисперсні частинки, активний агент зазвичай є тонкоздрібненим. Дрібнодисперсні частинки активного агента суспендують в пропеленті або системі пропеленту, що має тенденцію до швидкої агрегації або флокуляції. Це особливо вірно для активних агентів присутніх у тонкоподрібненій формі. В свою чергу, агрегація чи флокуляція цих дрібнодисперсних частинок може ускладнювати доставку активного агента. Наприклад, агрегація чи флокуляція можуть призводити до механічних збоїв, таких як ті, які можуть бути викликані непрохідністю отвору клапану аерозольного балону. Небажана агрегація чи флокуляція частинок ліків також може призвести до швидкого осадження або відстоювання частинок ліків, і такі характеристики можуть призвести до несумісної доставки доз, які можуть бути особливо болісними з сильнодіючими, низькими дозами медикаментів. Інша проблема, пов'язана з такими композиціями ІВД суспензії, відноситься до росту кристалів ліків під час зберігання, що призводить до зниження з плином часу аерозольних властивостей та однорідності дози, доставленої такими пристроями ІВД. Зовсім нещодавно були запропоновані такі підходи до вирішення проблеми як описані в патенті США № 6,964,759 для ІВД композицій, що містять антихолінергіки. [0006] Одним з підходів для покращення якості аерозолів в інгаляторах сухих порошків було включення частинок тонкодисперсних носіїв, таких як лактоза. Використання таких дрібнодисперсних ексципієнтів для пристроїв ІВД широко не досліджувалось. Нова доповідь Young et al., "The influence of micronized particulates on the aerosol ization properties of pressurized metered dose inhalers"; Aerosol Science 40, сс. 324-337 (2009), показує, що використання таких носіїв на основі дрібнодисперсних частинок у пристроях ІВД насправді призводить до зниження якості аерозолю. [0007] У традиційних ХФВ системах, коли активний агент присутній у ІВД композиції суспендований в пропеленті або системі пропеленту, часто використовуються поверхневоактивні речовини для покриття поверхонь активних агентів для того, щоб мінімізувати або запобігти проблемі агрегації та підтримати в основному однорідну дисперсію. Використання поверхнево-активних речовин в такий спосіб іноді відноситься до "стабілізування" суспензії. Однак, багато поверхнево-активних речовин, які є розчинними і тому ефективними в ХФВ системах, є неефективними в ГФА та ПФС системах пропелентів, бо такі поверхнево-активні речовини виявляють різні характеристики розчинності в не-ХФВ пропелентах. Короткий опис графічних матеріалів 1 UA 109531 C2 5 10 15 20 25 30 35 40 45 50 55 60 [0008] ФІГ. 1 являє собою графік, який показує розподіл частинок за розміром, введених за допомогою ілюстративної композиції спільної суспензії згідно з цим описом, яка включає глікопіролат, мускариновий антагоніст тривалої дії, як активний агент. Спільна суспензія пристроїв ІВД піддається умовам температурної циклічності (поперемінно 6 год. час утримування при -5 або 40 °C) протягом 12 тижнів. [0009] ФІГ. 2 являє собою графік, який показує розподіл частинок за розміром, введених за допомогою ілюстративної композиції спільної суспензії згідно з цим описом, яка включає глікопіролат, мускариновий антагоніст тривалої дії, як активний агент. Спільна суспензія пристроїв ІВД піддається умовам температурної циклічності (поперемінно 6 год. час утримування при -5 або 40 °C) протягом 24 тижнів. [0010] ФІГ. 3 показує мікрофотографію, що ілюструє морфологію розмаїття частинок, що суспендуються, отриманих згідно з Прикладом 5. [0011] ФІГ. 4 являє собою фотографію з двох флаконів, що дозволяє візуалізувати спільну суспензію, сформовану з використанням частинок активного агента, сформованих з використанням глікопіролату та частинок, що суспендуються, сформованих з використанням сахариду. [0012] ФІГ. 5 являє собою графік, який показує рівень концентрації сироватки глікопіролату, досягнутий протягом періоду в 24 години після одноразового введення чотирьох різних доз глікопірролату, доставлених з композиції спільної суспензії як описано тут. [0013] ФІГ. 6 являє собою графік, на якому зображені середні зміни FEV1 від базисної лінії (у літрах) досліджені у пацієнтів протягом періоду в 24 години після отримання одноразового введення вказаної дози глікопірролату, сформованого у спільній суспензії, як описано тут. У цьому дослідженні, Spiriva (18 мкг Тіотропіуму) була включена як активний контроль, і середня зміна у FEV1 від базисної лінії (у літрах), досліджена у пацієнтів, які отримують одноразове введення Spiriva також зображена. [0014] ФІГ. 7 являє собою гістограму, яка зображує пікову зміну у FEV1 від базисної лінії (у літрах), досліджену у пацієнтів після отримання одноразового введення вказаної дози глікопіролату, сформованого у спільній суспензії, як описано тут, порівняно з плацебо, областю під кривою FEV1 протягом 12 годин після дозування, і областю під кривою FEV1 протягом 24 годин після дозування, порівняно з плацебо через чотири розраховані дози. У цьому дослідженні, Spiriva (18 мкг Тіотропіум) включена як активний контроль і результати після одноразового введення Spiriva для зазначених вище параметрів, також зображені на фігурі. [0015] ФІГ. 8 являє собою графік, який показує кількість пацієнтів, які досягли більшої ніж 12 % зміни у FEV1 від базисної лінії та поліпшення 150 мл зміни від базисної лінії або абсолютного поліпшення 200 мл від базисної лінії, незалежно від % зміни у FEV1 від базисної лінії, після отримання одноразового введення вказаної дози спільної суспензії глікопіролату, як описано тут. У цьому дослідженні, Spiriva (18 мкг Тіотропіум) включена як активний контроль і результати після одноразового введення Spiriva для зазначених вище параметрів також зображені на цій фігурі. [0016] ФІГ. 9 являє собою гістограму, яка зображує пікову зміну у об'ємі вдиху, досліджену у пацієнтів після отримання одноразового введеннявказаної дози спільної суспензії глікопіролату, як описано тут. У цьому дослідженні, Spiriva (18 мкг Тіотропіум) включена як активний контроль і результати після одноразового введення Spiriva для зазначених вище параметрів також зображені на цій фігурі. [0017] ФІГ. 10 являє собою гістограму, що наводить зміни у FEV 1 AUC отримані у пацієнтів після отримання одноразового введення вказаної дози спільної суспензії глікопіролату, як описано тут. Результати досягнені за допомогою спільної суспензії глікопіролату згідно з цим описом наведено у порівнянні зі зміною у FEV1 AUC, описані в опублікованому дослідженні у пацієнтів, які отримували порошкову композицію глікопіролату не одержану згідно з дослідженнями запропонованими тут. [0018] ФІГ. 11 являє собою графік, який показує розподіл частинок за розмірами ілюстративної спільної суспензії глікопіролату, отриманої згідно з цим описом, що містить 4,5 мкг/активацію доставленої дози глікопіролату та 6 мг/мл частинок, що суспендуються, і піддається умовам циклічної зміни температури (поперемінно 6 год. час утримування при -5 або 40 °C). [0019] ФІГ. 12 являє собою графік, який показує розподіл частинок за розміром ілюстративної спільної суспензії глікопіролату, отриманої згідно з цим описом, що містить 36 мкг/активацію доставленої дози глікопіролату та 6мг/мл частинок, що суспендуються, і піддається умовам циклічної зміни температури (поперемінно 6 год. час утримування при -5 або 40 °C). [0020] ФІГ. 13 являє собою графік, який показує доставлену дозу протягом строку служби 2 UA 109531 C2 5 10 15 20 25 30 35 40 45 50 55 60 контейнера ілюстративної спільної суспензії глікопіролату, отриманої згідно з цим описом, що містить 4,5 мкг/активацію доставленої дози глікопіролату та 6мг/мл частинок, що суспендуються. [0021] ФІГ. 14 являє собою графік, який показує доставлену дозу протягом строку служби контейнера ілюстративної спільної суспензії глікопіролату, отриманої згідно з цим описом, що містить 36 мкг/активацію доставленої дози глікопіролату та 6мг/мл частинок, що суспендуються. [0022] ФІГ. 15 являє собою графік, який показує розподіл частинок за розміром ілюстративної спільної суспензії глікопіролату, отриманої згідно з цим описом, що містить 36 мкг/активацію доставленої дози глікопіролату та 6мг/мл частинок, що суспендуються, і піддається 12 місяцям зберігання при 25 °C/60 % відносної вологості. [0023] ФІГ. 16 являє собою графік, який показує середню доставлену дозу протягом строку служби контейнера ілюстративної спільної суспензії глікопіролату, отриманої згідно з цим описом, що містить 32 мкг/активацію доставленої дози глікопіролату та 6мг/мл частинок, що суспендуються, і піддається умовам циклічної зміни температури (поперемінно 6 год. час утримування при -5 або 40 °C). [0024] ФІГ. 17 являє собою графік, який показує розподіл частинок за розміром ілюстративної спільної суспензії глікопіролату, отриманої згідно з цим описом, що містить 32 мкг/активацію доставленої дози глікопіролату та 6мг/мл частинок, що суспендуються, і піддається умовам циклічної зміни температури (поперемінно 6 год. час утримування при -5 або 40 °C). [0025] ФІГ. 18 являє собою графік, який показує розподіл частинок за розміром ілюстративної спільної суспензії глікопіролату, отриманої згідно з цим описом, що містить 24 мкг/активацію доставленої дози глікопіролату та 6мг/мл частинок, що суспендуються, і 0 піддається 6 тижням зберігання при 50 °C/відносну вологість повітря та 12 тижнів при 40 C. [0026] ФІГ. 19 являє собою фотографію, що дозволяє візуалізувати композиції спільної суспензії, отриманої згідно з цим описом, які включають формотеролу фумарат частинок активного агента. [0027] ФІГ. 20 являє собою графік, який показує однорідність доставленої дози, досягнута за допомогою формотеролу фумарату композиції спільної суспензії, отриманої згідно з цим описом. [0028] ФІГ. 21 являє собою графік, який показує аеродинамічний розподіл частинок за розміром, визначений за допомогою каскадної закупорки ілюстративного формотеролу фумарату спільної суспензії композиції, одержаного згідно з цим описом і витриманого протягом трьох місяців при 25 °C/ 75 % ВВ, без захисної плівки, або при 40 °C / 75 %ВВ із захисною плівкою. [0029] ФІГ. 22 являє собою графік, на якому зображена хімічна стабільність ілюстративної композиції спільної суспензії, включаючи формотеролу фумарат як активний агент. Результати зображені на цій фігурі дозволяють порівнювати хімічну стабільність формотеролу фумарату, досягнуту в композиції спільної суспензії, сформованій на основі кристалічного формотеролу фумарату, з хімічною стабільністю композицій суспензії, отриманих з використанням висушеного розпиленням формотеролу фумарату. [0030] ФІГ. 23 по ФІГ. 26 являють собою електронні мікрознімки частинок, що суспендуються, отримані з різних матеріалів, з Фігурою 23, що зображує мікрофотографію трегалози частинок, що суспендуються, Фігура 24 зображує мікрофотографію HP-β-циклодекстринових частинок, що суспендуються, Фігура 25 зображує мікрофотографію Ficoll MP 70 частинок, що суспендуються, та Фігура 26 зображує мікрофотографію інулінових частинок, що суспендуються. [0031] ФІГ. 27 показує графік, що зображує аеродинамічний розподіл частинок за розміром, визначений за допомогою каскадної закупорки ілюстративної композиції спільної суспензії, отриманої згідно з цим описом та включає частинки глікопіролату активного агента. [0032] ФІГ. 28 показує графік, що зображує аеродинамічний розподіл частинок за розміром, визначений за допомогою каскадної закупорки ілюстративної композиції спільної суспензії, отриманої згідно з цим описом та включає формотеролу фумарат частинок активного агента. [0033] ФІГ. 29 показує графік, що зображує однорідність доставлених доз досягнуту за допомогою вкрай низьких доз формотеролу фумарату композиції спільної суспензії, отриманої згідно з цим описом. [0034] ФІГ. 30 показує графік, що зображує розподіл частинок за розміром глікопіролату (вгорі) та формотеролу (внизу), досягнуті за допомогою ілюстративної спільної суспензії у порівняннні з розподілом частинок за роміром, що досягається завдяки композиціям, включаючи або глікопіролат або один формотеролу фумарат. ДОКЛАДНИЙ ОПИС [0035] Цей опис пропонує композиції, способи, та системи доставки респіраторним шляхом 3 UA 109531 C2 5 10 15 20 25 30 35 40 45 50 55 60 активних агентів за допомогою пристрою ІВД. В особливих варіантах втілення, композиції, способи та системи описані тут адаптовані для доставки респіраторним шляхом активних агентів, обраних з мускаринових антагоністів тривалої дії ("МАТД") та агоністів адренергічних рецепторів β2 тривалої дії ("ААТД"). У деяких варіантах втілення, активні агенти МАТД або ААТД можуть бути ефективними або дуже ефективним і, таким чином, отримані при низьких концентраціях і доставлені в малих дозах. Фармацевтичні композиції, описані тут, можуть бути отримані для легеневої або назальної доставки за допомогою пристрою ІВД. Способи, описані тут, включають способи стабілізації композицій, що включають активні агенти МАТД або ААТД для доставки респіраторним шляхом, так як і способи легеневої доставки активних агентів МАТД та ААТД за допомогою пристрою ІВД. Також тут описані тут способи виготовлення пристрою ІВД для доставки активних агентів МАТД або ААТД. [0036] У конкретних варіантах втілення, способи описані тут включають способи лікування легеневої хвороби або розладу, що піддається лікуванню шляхом доставки активних агентів МАТД або ААТД через пристрій ІВД. Наприклад, і композиції, і способи і системи описані тут можуть бути використані для лікування запальних або обструктивних легеневих хвороб або станів. У деяких варіантах втілення, композиції, способи та системи описані тут можуть бути використані для лікування пацієнтів, що страждають від захворювання або розладу обраного з астми, хронічного обструктивного пульмонольного захворювання (ХОПЗ), загострення гіперерактивності дихальних шляхів, яке є наслідком іншої лікарської терапії, алергічного риніту, синуситу, легеневої вазоконстрикції, запалення, алергій, ускладненого дихання, респіраторного дистрес-синдрому, легеневої гіпертонії, легеневої вазоконстрикції, та будь-яких інших хвороб органів дихання, станів, особливостей, генотипу або фенотипу, які можуть бути прийнятні для введення МАТД або ААТД, одного або в комбінації з іншими способами лікування. У деяких варіантах втілення, композиції, системи та способи, описані тут, можуть бути використані для лікування легеневого запалення та обструкції пов'язаної з муковісцидозом. Як використано тут, терміни "ХОПЗ" та "хронічне обструктивне пульмональне захворювання " охоплюють хронічний обструктивний розлад легень (ХОРЛ), хронічне обструктивне захворювання дихальних шляхів (ХОЗДШ), хронічне обмеження повітряного потоку (ХОПП) та хронічне обструктивне захворювання органів дихання (ХОЗОД) та включає хронічний бронхіт, бронхоектазію, та емфізему. Як використано тут, термін "астма" відноситься до астми будь-якого типу або походження, включаючи обидві внутрішню (неалергічну) астму та зовнішню (алергічну) астми, м'яку астму, помірну астму, важку астму, бронхіотичну астму, астму, викликану фізичними навантаженнями, професійної астми і астми спричиненої наступними бактеріальними інфекціями. Зрозуміло, що астма також охоплює синдром бронхообструкції. [0037] Добре зрозуміло, що варіанти втілення описані тут є ілюстративними. Нижченаведений більш детальний опис різних варіантів втілення не обмежує обсяг цього винаходу, але є лише зразком різних варіантів втілення. Крім того, порядок етапів або дій способів, описаних разом з варіантами втілення, що описані тут, може бути змінений фахівцем у цій галузі, не виходячи при цьому за обсяг цього опису. Іншими словами, якщо специфічний порядок етапів або дій необхідний для придатних операцій варіантів втілення, порядок або використання специфічних етапів або дій може бути змінений. I. Визначення [0038] Якщо конкретно не визначено інше, технічні терміни, які використано тут, мають своє звичайне значення, як визначено в галузі. Нижченаведені терміни конкретно визначені для більшої зрозумілості. [0039] Термін "активний агент" використовується тут для включення будь-якого агента, ліків, сполуки, композиції чи іншої субстанції, які можуть бути використані на, або введені людині чи тварині і бути МАТД чи ААТД. Термін "активний агент" може бути використаний взаємозамінно разом з термінами, "ліки", "фармацевтичний агент", "медикамент", "лікувальна речовина", або "терапевтичний агент." [0040] Терміни "сполучений, " "сполучений з" або "сполучення" відносяться до взаємодії або відносин між хімічною сполукою, композицією, або структурою за умови близькості до поверхні, такої як поверхня іншої хімічної сполуки, композиції, або структури. Сполучення включає, наприклад, адсорбцію, адгезію, ковалентне зв'язування, водневе зв'язування, іонне зв'язування та електростатичне тяжіння, сили Ліфшица-Ван дер Ваальса та полярні взаємодії. Термін "прилипання" або "адгезія" є формою сполучення і використовується як загальний термін для всіх сил, які мають тенденцію, щоб заставити частинку або масу прилипнути до поверхні. "Прилипання" також відноситься до приведення та утримування частинок в контакті одна з одною, таким чином, шо в основному не спостерігається розділення між частинками відповідно до їх різної плавучості у пропеленті за нормальних умов. В одному варіанті втілення, частинки, що приєднуються до або зв'язуються з поверхнею охоплюється терміном "прилипання." 4 UA 109531 C2 5 10 15 20 25 30 35 40 45 50 55 60 Нормальні умови можуть включають зберігання при кімнатній температурі або при силі прискорювання відповідно до тяжіння. Як описано тут, частинки активного агента можуть сполучатися з частинками, що суспендуються, для утворення спільної суспензії, де по суті не видно розділення між частинками, що суспендуються, та частинками активного агента або їх флокулятів, пов'язаних з відмінностями у плавучості у пропеленті. [0041] "Частинки, що суспендуються", відносяться до матеріалу або комбінацій матеріалів, які придатні для доставки респіраторним шляхом, і діють як a носій для частинки активного агента. Частинки, що суспендуються, взаємодіють з частинками активного агента для полегшення повторюваних доз, доставки або транспортування активного агента на цільове місце доставки, тобто, дихальні шляхи. Частинки, що суспендуються, описані тут, дисперговані в суспензійному середовищі, включаючи пропелент або пропелентну систему, і можуть бути сконфігуровані відповідно до будь-якої форми, розміру або характеристики поверхні, прийнятних для досягнення бажаної стабільності суспензії або активної дії агента доставки. Ілюстративні частинки, що суспендуються, включають частинки, що показують розмір частинок, що полегшує респіраторну доставку активного агента та мають фізичні конфігурації, прийнятні до отримання та доставки стабілізованих суспензій, як описано тут. [0042] Термін "спільна суспензія" відноситься до суспензії з двох або більше типів частинок, що мають різні композиції в суспензійному середовищі, де один тип частинок сполучається принаймні частково з одним чи більше типів частинок. Сполучення приводить до досліджуваних змін в одній чи більше характеристиках принаймні одного з окремих типів частинок, суспендованих у суспензійному середовищі. Характеристики, змінені за допомогою сполученн, можуть включати, наприклад, одну чи більше швидкість агрегації або флокуляції, швидкість і характер розділення, тобто осадження чи відстоювання, густину піни або осадового шару, адгезію до стінок контейнера, адгезію до компонентів клапану, і швидкість та рівень дисперсії при струшуванні. [0043] Ілюстративні способи для оцінювання того, що присутня спільна суспензія може включати наступне: Якщо один тип частинок має пікнометричну густину більшу ніж у пропеленту та інший тип частинок має пікнометричну густину меншу ніж у пропеленті, візуальне спостереження за властивостями відстоювання або осадження може бути використане для визначення наявності спільної суспензії. Термін "пікнометрична густина" відноситься до густини матеріалу, з якого створені частинки, за винятком порожнин всередині частинок. В одному варіанті втілення, матеріали мажуть бути отримані або переміщені в прозорий флакон, звичайно скляний флакон, для візуального спостереження. Після початкового струшування флакон залишається недоторканим протягом достатнього часу для утворення осаду або шару піни, звичайно 24 години. Якщо спостерігається, що осад або шар піни повність або у більшій частині являє собою рівномірний однорідний шар, присутня спільна суспензія. Термін "спільна суспензія" включає окремі спільні суспензії, де більшість зі щонайменше двох типів частинок сполучаються одна з одною, однак, можуть спостерігатись деякі розділення (тобто, менше ніж більшість) щонайменше двох типів частинок. [0044] Ілюстративний тест спільної суспензії може бути проведений при різних температурах пропеленту, щоб підкреслити поведінку осадження або відстоювання типів частинок з густиною, близькою до густини пропеленту при кімнатній температурі. Якщо різні типи частинок мають однакову природу розділення, тобто весь осад або вся піна, наявність спільної суспензія може бути визначено шляхом вимірювання інших характеристик суспензії, таких як швидкість агрегації або флокуляції, швидкість розділення, густину піни або осадового шару, адгезію до стінок контейнера, адгезію до компонентів клапану, а швидкість та рівень дисперсії при струшуванні, і порівнюючи їх з відповідними характеристиками подібних окремих типів частинок, що суспендуються. Різні аналітичні способи, як правило, відомі фахівцю у цій галузі можуть бути використані для вимірювання цих характеристик. [0045] У контексті композиції, що містить або пропонує агрегати, що вдихаються, частинки, краплі, і т.д., такі як композиції описані тут, термін "доза дрібнодисперсних частинок" або "ДДЧ" відноситься до дози, яка або у загальній масі або фракції номінальної дози або виміряної дози, знаходиться у межах, придатних для вдихання. Доза, що перебуває у респіраторному діапазоні вимірюється in vitro як доза, що відкладаються за шийкою платформи каскадного імпактора, тобто, сума доставлених доз на стадії 3 через фільтр у Імпакторі Наступного Покоління, що працює при швидкості потоку 30 л/хв. [0046] У контексті композиції, що містить або забезпечує агрегати, що вдихаються, частинки, краплі, і т.д., такі як композиції описані тут, термін "фракція дрібнодисперсних частинок" або "ФДЧ" відноситься до частинки доставленого матеріалу по відношенню до доставленої дози (тобто, кількості, що виходить з актуатора пристрою доставки, такого як ІВД), що знаходиться у здатних до розпилювання межах. Кількість доставленого матеріалу в органи дихання 5 UA 109531 C2 5 10 15 20 25 30 35 40 45 50 55 60 вимірюється in vitro як кількість матеріалу, що відкладаються за шийкою платформи каскадного імпактора, наприклад, сума доставлених матеріалів на стадії 3 крізь фільтр у Імпакторі Наступного Покоління, що працює при швидкості потоку 30 л/хв. [0047] Як використано тут, термін "інгібувати" відноситься до вимірюваної ослабленої тенденції виникнення явища, симптому вбо кондиції або в якій мірі це явище, симптом або стан виникають. Термін "інгібують" або будь-яка його форма, використовується в найширшому сенсі і включає в себе мінімізацію, запобігання, скорочення, пригнічення, припинення, приборкуваня, стримування, обмеження, повільний прогрес тощо. [0048] "Масовий середній аеродинамічний діаметр" або "МСАД" як використано тут, відноситься до аеродинамічного діаметру аерозолю, нижче якого 50 % від маси аерозолю, що складається з частинки з аеродинамічним діаметром меншим ніж МСАД, з МСАД розрахованим відповідно до монографії 601 Фармакопеї США ("USP"). [0049] Коли згаданий в цьому документі термін "оптичний діаметр" вказує на розмір частинок, як вимірюється за допомогою дифракції Фраунгофера з використанням лазерної дифракції аналізатора розміру частинок, обладнаного сухопорошковим дозатором (наприклад, Sympatec GmbH, Клаусталь-Целлерфельд, Німеччина). [0050] Термін "трансформація медійованого розчину" відноситься до явища, у якому більш розчинна форма твердого матеріалу (тобто частинки з малим радіусом кривизни (a рушійна сила для дозрівання Оствальда), або аморфний матеріал) розчиняється та рекристалізується в більш стабільну кристалічну форму що може співіснувати в рівновазі зі своїм насиченим розчином пропеленту. [0051] "Пацієнт" відноситься до тварини, у якої активні агенти МАТД або ААТД матимуть терапевтичний ефект. В одному варіанті втілення, пацієнт є людиною. [0052] "Перфоровані мікроструктури" відноситься до частинок, що суспендуються, які включають структурну матрицю, що показує, визначає або включає прогалини, пори, дефекти, порожнини, простори, проміжні простори, прорізи, отвори або діри, які дозволяють оточуючим суспензійним середовищам проникати, заповнювати або наповнювати мікроструктури, такі як ці матеріали і препарати описані в патенті США № 6,309,623 до Weers, et al. Основна форма перфорованих мікроструктур, як правило, не є суттєвою, і будь-яка загальна конфігурація, яка забезпечує бажані характеристики композицій, розглянута тут. Відповідно, в одному варіанті втілення, перфоровані мікроструктури можуть включати приблизно сферичні форми, такі як порожні, що суспендуються, висушені мікросфери. Однак, сплющені, гофровані, деформовані або зламані частинки будь-якої первинної форми або аспектного співвідношення також можуть бути сумісні. [0053] Як і у випадку частинок, що суспендуються, описаних тут, перфоровані мікроструктури можуть бути утворені з будь-яких біосумісних матеріалів, які істотно не погіршуються або розчиняються в обраному суспензійному середовищі. Хоча широке розмаїття матеріалів може бути використане для утворення частинок, у деяких варіантах втілення, структурна матриця пов'язана з, або включає, поверхнево-активну речовину, таку як, фосфоліпід або фторовану поверхнево-активну речовину. Хоча це і не потрібно, включення сумісної поверхнево-активної речовини в перфорованій мікроструктурі або, або більш загально, частинки, що суспендуються, можуть поліпшити стабільність дихальної дисперсії, збільшити легеневе осадження та полегшити приготування суспензії. [0054] Термін "суспензійне середовище", як тут використовується, відноситься до речовини, що забезпечує безперервну фазу, в якій частинки активного агента та частинки, що суспендуються, можуть бути дисперговані для забезпечення отримання композиції спільної суспензії. Суспензійне середовище, що використовується в композиціях спільної суспензії, описане тут, включає пропелент. Як використано тут, термін "пропелент" відноситься до однієї чи більше фармакологічно інертних речовин, які чинять досить високий тиск пари при нормальній кімнатній температурі, щоб рухати ліки від контейнера ІВД до пацієнта при активації дозуючого клапану ІВД. Таким чином, термін "пропелент" відноситься, як до одного пропеленту, так і до комбінації з двох чи більше різних пропелентів, які утворюють "пропелентну систему." [0055] Термін "прийнятний для вдихання" загалом відноситься до частинок, агрегатів, крапель, і т.д. такого розміру, що їх можна вдихати і досягати дихальні шляхи легенів. [0056] Коли використовується для позначення композицій спільної суспензії, описаних тут, терміни "фізична стабільність" та "фізично стабільний" відносяться до композицій, які є стійкими до однієї або більше з агрегації, флокуляції, та змін розміру частинок внаслідок трансформацій, опосередкованих розчином, і здатні істотно підтримати МСАД частинок, що суспендуються, і доз на основі дрібнодисперсних частинок. В одному варіанті втілення, фізична стабільність може бути оцінена через піддавання композицій прискореним умовам деградації, таким як циклічна зміна температури, як описано тут. 6 UA 109531 C2 5 10 15 20 25 30 35 40 45 50 55 60 [0057] Коли мова йде про активні агенти, термін "діючий" позначає активні агенти, які є терапевтично ефективними при або нижчих дозах, що варіюють від приблизно 0,01 мг/кг до приблизно 1 мг/кг. Типові дози діючих активних агентів зазвичай становлять від приблизно 100 мкг до приблизно 100 мг. [0058] Коли мова йде про активні агенти, термін "сильнодіючий" позначає активні агенти, які є терапевтично ефективними при або нижчих дозах від приблизно 10 мкг/кг. Типові дози сильнодіючих активних агентів зазвичай становлять до приблизно 100 мкг. [0059] Терміни "стабільність суспензії" та "стабільна суспензія" відносяться до суспензійних композицій, здатних підтримувати властивості спільна суспензії частинок активного агента та частинок, що суспендуються, протягом періоду часу. В одному варіанті втілення, стабільність суспензії може бути виміряна за допомогою однорідності доставленої дози, досягнутої за допомогою композицій спільної суспензії описаних тут. [0060] Термін "в основному нерозчинний" означає, що композиція або повністю нерозчинна в особливому розчиннику або погано розчиняється в цьому ж особливому розчиннику. Термін "в основному нерозчинний" означає, що певний розчин має розчинність менше ніж одна частина на 100 частин розчинника. Термін "в основному нерозчинний" включає визначення "малорозчинний" (від 100 до 1000 частин розчинника на 1 частину розчиненої речовини), "дуже малорозчинний" (від 1000 до 10,000 частин розчинника на 1 частину розчиненої речовини) та "практично нерозчинний" (більш ніж 10,000 частин розчинника на 1 частину розчиненої речовини) як показано в Таблиці 16-1 Remington: The Science and Practice of Pharmacy, 21 st ed. Lippincott, Williams & Wilkins, 2006, p. 212. [0061] Термін "поверхнево-активна речовина, " як використано тут, відноситься до будьякого агента, який краще поглинається поверхнею розділення між двома фазами, що не змішуються, такими як поверхня розділення між водою та органічним розчином полімеру, поверхня розділення вода/повітря або поверхня розділення органічний розчинник/повітря. Поверхнево-активні речовини, як правило мають гідрофільну частину та ліпофільну частину, такі, що, при абсорбції на мікрочастинки, вона мають тенденцію представляти утворення безперервній фазі, що не притягує частинки з аналогічним покриттям, тим самим зменшуючи агломерацію частинок. У деяких варіантах втілення, поверхнево-активні речовини можуть також сприяти адсорбції ліків і підвищувати біодоступність ліків. [0062] "Терапевтично ефективна кількість" – це кількість сполуки, яка досягає терапевтичного ефекту за допомогою інгібування хвороби або розладу у пацієнта, або профілактичного інгібування, або запобігання настанню хвороби або розладу. Терапевтично ефективна кількість може являти собою кількість, яка послаблює до певної міри один чи декілька симптомів захворювання або розладу у пацієнта; повертає до нормального частково або повністю один чи більше фізіологічних або біохімічних параметрів, пов'язаних з або збудником хвороби або розладу; та/або зменшує ймовірність виникнення хвороби або розладу. [0063] Терміни "хімічно стабільний" та "хімічна стабільність" відносяться до спільної суспензії композицій, де окремі продукти деградації активного агента залишаються нижче меж, встановлених нормативними вимогами, протягом терміну придатності продукту для використання людиною (наприклад, 1 % загальної площі хроматографічного піка ОВH інструкція Q3B(R2)) і є прийнятним масовим балансом (наприклад, як визначено в ОВH інструкція Q1 E) між оцінкою активного агента та загальною деградацією продуктів. II. Фармацевтичні композиції [0064] Композиції описані тут являються спільними суспензіями, які включають суспензійне середовище, що включає пропелент, активні агенти МАТД або частинки ААТД, та частинки, що суспендуються. Звісно, при бажанні, композиції описані тут можуть включати один чи більше додаткових елементів. Крім того, можуть використовуватися описані тут варіації та комбінації компонентів композицій, що описані тут. Наприклад, два або більше різновиди частинок, що суспендуються, можуть бути використані в композиції для отримання та доставку обраних активних агентів МАТД або ААТД. Як альтернатива, наприклад, композиції описані тут можуть включати два або більше різновидів частинок активного агента. У деяких таких варіантах втілення, композиції можуть включати активні агенти МАТД або ААТД частинок спільно суспендованих з частинками, що суспендуються, де, на додаток до матеріалу активного агента включеного у частинки активного агента, принаймні деякі частинки, що суспендуються, включені в обрані активні агенти МАТД або ААТД. Ще додатково, при бажанні, композиції описані тут можуть включати два або більше різновиди частинок, що містять обрані активні агенти МАТД або ААТД у комбінації з двома або більше різновидами частинок, що суспендуються. [0065] Було встановлено, що у композиціях згідно з цим описом, частинки активного агента показують сполучення з частинками, що суспендуються, так, що відділення частинок активного агента від частинок, що суспендуються, є, в основному, попередженим, результатом є спільне 7 UA 109531 C2 5 10 15 20 25 30 35 40 45 50 55 60 розміщення частинок активного агента та частинок, що суспендуються, в суспензійному середовищі. Як правило, за рахунок густоти відмінності між різними видами частинок та середовища, в якому вони суспендовані (наприклад, пропелент або пропелентна система), сили плавучості спричиняють відстоювання частинок з нижчою густиною, ніж у пропеленту та осадження частинок з більшою густиною ніж у пропеленту. Таким чином, у суспензіях, які включають суміш частинок, що відрізняються по своїй густині, при осадженні або відстоюванні, поведінка кожного типу частинок може різнитися і може привести до розділення різних типів частинок в пропеленті. [0066] Однак, комбінації пропеленту, частинок активного агента та частинок, що суспендуються, описані тут, забезпечують спільні суспензії, де частинки активного агента та частинки, що суспендуються, спільно розміщені в пропеленті (тобто, частинки активного агента сполучають з частинками, що суспендуються, так, щоб частинки, що суспендуються, і частинки активного агента не показували суттєвого розділення відносно одна одної, наприклад шляхом диференційованого осадження або відстоювання, навіть після часу, достатнього для утворення піни або шару осаду). В особливих варіантах втілення, наприклад, композиції, описані тут, формують спільні суспензії, де частинки, що суспендуються, залишаються сполученими з частинками активного агента, коли їх піддають дії сил плавучості підсилених температурними коливаннями та/або центрифугуванням при прискореннях до та понад, наприклад, 1 г, 10 г, 35 г, 50 г, та 100 г. Однак, спільні суспензії, описані тут, не можуть бути визначені або обмежені конкретною пороговою силою сполучення. Наприклад, спільна суспензія, як розглянуто тут, може бути успішно досягнута там, де частинки активного агента сполучають з частинками, що суспендуються, так щоб не було суттєвого розділення частинок активного агента та частинок, що суспендуються, в безперервній фазі, сформованій за допомогою суспензійного середовища у типових умовах використання пацієнтом. [0067] Композиції спільної суспензії згідно з цим описом забезпечують бажані характеристики отримання та доставки активних агентів МАТД та ААТД. Наприклад, у деяких варіантах втілення, коли присутні в контейнері ІВД, спільні суспензії, як описано тут, можуть інгібувати або зменшувати одну чи більше з наступних дій: флокуляцію матеріалу активного агента; диференціальне осадження або відстоювання частинок активного агента та частинок, що суспендуються; трансформації матеріалу активного агента, опосередковані розчином; та втрати активного агента на поверхнях системи закриття контейнеру, зокрема, компонентах дозуючого клапану. До того ж, композиції, як описано тут, забезпечують хімічну стабільність для активних агентів, що містяться тут. Такі властивості допомагають досягти і зберегти ефективність аерозолю, як спільної суспензії доставленої з ІВД, так, щоб бажана фракція дрібнодисперсних частинок, доза на основі дрібнодисперсних частинок та характеристики однорідності доставленої дози були досягнуті і, значною мірою, зберігалися протягом часу випорожнення контейнера ІВД, в якому міститься спільна суспензія. Крім того, про що свідчать варіанти втілення докладно описані тут, спільні суспензії згідно з цим описом можуть забезпечити стабільну композицію, яка забезпечує постійне дозування та респіраторні характеристики доставки для активних агентів МАТД та ААТД, при використанні відносно простого суспензійного середовища ГФА, яке не вимагає модифікації шляхом додавання, наприклад, спільних розчинників, антирозчинників, солюбілізуючих агентів або ад'ювантів. [0068] Забезпечення спільної суспензії згідно з цим описом може також спростити розробку, доставку та дозування активних агентів МАТД та ААТД. Не обмежуючись конкретною теорією, вважається, що після досягнення спільної суспензії частинок активного агента та частинок, що суспендуються, доставка та дозування активного агента, що міститься в такій дисперсії, можуть бути суттєво регульованими через контроль розміру, складу, морфології і відносної кількості частинок, що суспендуються, і менше залежати від розміру і морфології частинок активного агента. [0069] Відповідно, фармацевтичні композиції, описані тут, забезпечують доставку активних агентів МАТД та ААТД з ІВД. Доставка композицій спільної суспензії, описана тут, забезпечує бажані фармакокінетичні та фармакодинамічні характеристики, та ІВД доставку фармацевтичних композицій, описаних тут, прийнятну для лікування пацієнтів, що страждають від запальної або обструктивної легеневої хвороби або стану, який реагує на введення активних агентів МАТД або ААТД. В особливих варіантах втілення, фармацевтичні композиції, описані тут, можуть бути використані у лікуванні хвороби або стану обраного з астми, ХОЗЛ, загострення гіперерактивності дихальних шляхів, наслідком є інша лікарська терапія, алергічного риніту, синуситу, легеневої вазоконстрикції, запалення, алергії, ускладнення дихання, респіраторного дистрес-синдрому, легеневої гіпертонії, легеневої вазоконстрикції, емфіземиа, та будь-яка іншої хвороби органів дихання, стану, особливості, генотипу або фенотипу, які можуть реагувати на введення МАТД або ААТД, одного або в комбінації з іншими 8 UA 109531 C2 5 10 15 20 25 30 35 40 45 50 55 60 способами лікування. У деяких варіантах втілення, композиції, системи та способи, описані тут, можуть бути використані для лікування легеневого запалення та обструкції пов'язаної з муковісцидозом. (i) Суспензійне середовище [0070] Суспензійне середовище включене в композицію, описану тут, включає один чи більше пропелентів. В основному пропеленти, придатні для використання як суспензійні середовища, являють собою такі гази пропеленту, які можуть бути скраплені під тиском при кімнатній температурі, та при інгаляції або місцевому використанні, є безпечними та токсично нешкідливими. Крім того, бажано, щоб вибраний пропелент був відносно інертним з частинками, що суспендуються, або частинками активного агента. Ілюстративні сумісні пропеленти включають гідрофторалкани (ГФАи), перфторовані сполуки (ПФСи), та хлорфторвуглеці (ХФВі). [0071] Специфічні приклади пропелентів, які можуть бути використані для утворення суспензійного середовища спільних суспензій, описані тут, включають 1,1,1,2-тетрафторетан (CF3CH2F) (ГФА-134a), 1,1,1,2,3,3,3-гептафтор-n-пропан (CF3CHFCF3) (ГФА-227), перфторетан, монохлор-фторметан, 1,1 дифторетан, та їх комбінації. Ще додатково, прийнятні пропеленти включають, наприклад: коротколанцюгові вуглеводні; Ci-4 хлорфторвуглеці, що містять водень, такі як CH2CIF, CCI2FCHCIF, CF3CHCIF, CHF2CCIF2, CHCIFCHF2, CF3CH2CI, та CCIF2CH3; Ci-4 фторвуглеці, що містять водень (наприклад, ГФАи), такі як CHF 2CHF2, CF3CH2F, CHF2CH3, та CF3CHFCF3; та перфторвуглеці, такі як CF3CF3 і CF3CF2CF3. [0072] Специфічні фторвуглеці, або класи фторованих сполук, які можуть бути використані як суспензійне середовище включають, але не обмежуючись цим, фторгептан, фторциклогептан, фторметилциклогептан, фторгексан, фторциклогексан, фторпентан, фторциклопентан, фторметилциклопентан, фтордиметил-циклопентани, фторметилциклобутан, фтордиметилциклобутан, фторметил-циклобутан, фторбутан, фторциклобутан, фторпропан, фторетери, фторетери та фтортриетиламіни. Ці сполуки можуть бути використані поодинці або в комбінації з більш леткими пропелентами. [0073] На додаток до вищезгаданих фторвуглеців та гідрофторалканів, різні ілюстративні хлорфторвуглеці та заміщені фторовані сполуки можуть також використовуватися як суспензійне середовище. В цьому відношенні, FC-11 (CCI3F), FC-11 B1 (CBrCI2F), FC-11 B2 (CBr2CIF), FC12B2 (CF2Br2), FC21 (CHCI2F), FC21 B1 (CHBrCIF), FC-21 B2 (CHBr2F), FC-31 B1 (CH2BrF), FC113A (CCI3CF3), FC-122 (CCIF2CHCI2), FC-123 (CF3CHCI2), FC-132 (CHCIFCHCIF), FC-133 (CHCIFCHF2), FC-141 (CH2CОВHCIF), FC-141 B (CCI2FCH3), FC-142 (CHF2CH2CI), FC-151 (CH2FCH2CI), FC-152 (CH2FCH2F), FC-1112 (CCIF=CCIF), FC-1121 (CHCI=ХФВI) та FC-1131 (CHCI=CHF) можуть також використовуватися, визнаючи при цьому можливі супутні екологічні проблеми. Як такий, кожна з цих сполук може бути використана, поодинці або в комбінації з іншими сполуками (тобто, менш леткі фторвуглеці) для утворення стабілізованих суспензій, описаних тут. [0074] У деяких варіантах втілення, суспензійне середовище може бути утворене з одного пропеленту. У інших варіантах втілення, комбінація пропелентів ("пропелентна система") може бути використана для утворення суспензійного середовища. У деяких варіантах втілення, відносно летючі сполуки можуть бути змішані з компонентами з нижчим тиском пари для отримання суспензійного середовища, що має специфічні фізичні характеристики, обрані для поліпшення стабільності або підвищення біодоступності диспергованого активного агента. У деяких варіантах втілення, сполуки з нижчим тиском пари включатимуть фторовані сполуки (наприклад фторвуглеці), що мають точку кипіння вищу ніж приблизно 25 °C. У деяких варіантах втілення, фторовані сполуки з нижчим тиском пари для використання у суспензійному середовищі можуть включати перфтороктилбромід CsFi7Br (ПФОБ або перфлуброн), дихлорфтороктан C8F16CI2, перфтороктилетан C8F17C2H5 (PFOE), перфтордецилбромід C10F21Br (PFDB) або перфторбутилетан C4F9C2H5. У деяких варіантах втілення, ці сполуки з нижчим тиском пари присутні на відносно низькому рівні. Такі сполуки можуть бути додані прямо в суспензійне середовище або можуть бути сполучені з частинками, що суспендуються. [0075] Суспензійне середовище включене в композиції, як описано тут, може бути утворене з пропеленту або пропелентної системи яка, в основному, вільна від додаткових матеріалів, включаючи, наприклад, антирозчинники, солюбілізуючі агенти, спільні розчинники або ад'юванти. Наприклад, у деяких варіантах втілення, суспензійне середовище може бути утворене з не-ХФВ пропеленту або пропелентної системи, такої як ГФА пропелент або пропелентної системи, яка, в основному, вільна від додаткових матеріалів. Такі варінати втілення спрощують отримання та виготовлення фармацевтичних композиції, прийнятних для доставки респіраторним шляхом активних агентів МАТД або ААТД. [0076] Однак, у інших варіантах втілення, що залежать від вибору пропеленту, властивостей частинок, що суспендуються, або природи активного агента, який треба доставити, суспензійне 9 UA 109531 C2 5 10 15 20 25 30 35 40 45 50 55 60 середовище, яке використовують, може включати матеріали на додаток до пропеленту або пропелентної системи. Такі додаткові матеріали можуть включати, наприклад, один чи більше прийнятних антирозчинників, солюбілізуючих агенти, спільних розчинників або ад'ювантів для регулювання, наприклад, тиску пари композиції або стабільності, або розчинності частинок, що суспендуються. Наприклад, пропан, етанол, ізопропіловий спирт, бутан, ізобутан, пентан, ізопентан або диалкіловий етер, такі як диметиловий етер, можуть бути включені з пропелентом у суспензійне середовище. Крім того, суспензійне середовище може містити леткимй фторвуглець. У інших варіантах втілення, один або обидва полівінілпіролідон ("ПВП") або поліетиленгліколь ("ПЕГ") можуть бути додані до суспензійного середовища. Додаючи ПВП або ПЕГ в суспензійне середовище можна досягти одієї чи більше бажаних функціональних характеристик, і в одному прикладі, ПВП або ПЕГ може бути доданий до суспензійного середовища як інгібітор росту кристалів. В основному, де використовується леткий спільний розчинник або ад'ювант, такий ад'ювант або спільний розчинник може бути обраний з відомих гідровуглецевих чи фторвуглецевих матеріалів і його вміст може становити до приблизно 1 % ваг./ваг. суспензійного середовища. Наприклад, коли спільний розчинник або ад'ювант включені у суспензійне середовище, спільний розчинник або ад'ювант можуть включати менше ніж приблизно 0,01 %, 0,1 %, або 0,5 % ваг./ваг. суспензійного середовища. Де ПВП або ПЕГ включені у суспензійному середовищі, такі компоненти можуть бути включені до приблизно 1 % ваг./ваг., або вони можуть включати менше ніж приблизно 0,01 %, 0,1 %, або 0,5 % ваг./ваг. суспензійного середовища. (ii) Частинки активного агента [0077] Частинки активного агента, включені у спільні суспензії, які описані тут, утворюються, щоб бути здатними для диспергування та суспендування в суспензійному середовищі і за розміром полегшують доставку прийнятних для вдихання частинок зі спільної суспензії. В одному варіанті втілення, таким чином, частинки активного агента пропонуються як тонкоздрібнений матеріал, де принаймні 90 % частинок матеріалу активного агента за об'ємом мають оптичний діаметр приблизно 7 мкм або менше. У інших варіантах втілення, частинки активного агента пропонуються як тонкоздрібнений матеріал, де принаймні 90 % частинок активного агента за об'ємом мають оптичний діаметр, обраний з ряду приблизно 6 мкм до приблизно 1 мкм, приблизно 5 мкм до приблизно 2 мкм, та приблизно 4 мкм до приблизно 3 мкм. В додаткових варіантах втілення, частинки активного агента пропонуються як тонкоздрібнений матеріал, де принаймні 90 % частинок активного агента за об'ємом мають оптичний діаметр обраний з 6 мкм або менше, 5 мкм або менше, та 4 мкм або менше. У іншому варіанті втілення, частинки активного агента пропонуються як тонкоздрібнений матеріал, де принаймні 50 % частинок матеріалу активного агента за об'ємом мають оптичний діаметр близько 5 мкм або менше. У інших варіантах втілення, частинки активного агента пропонуються як тонкоздрібнений матеріал, де принаймні 50 % частинок активного агента за об'ємом мають оптичний діаметр обраний з ряду приблизно 4 мкм до приблизно 1 мкм, приблизно 3 мкм до приблизно 1 мкм, та приблизно 2,5 мкм до приблизно 1 мкм. У іншому варіанті втілення, частинки активного агента пропонуються як тонкоздрібнений матеріал, де принаймні 50 % частинок активного агента за об'ємом мають оптичний діаметр обраний з 4 мкм або менше, 3 мкм або менше, та 2 мкм або менше. [0078] У конкретних варіантах втілення, матеріал активного агента, що використовується як або для утворення частинок активного агента, може бути повністю або, в основному, кристалічним, тобто, більшість молекул активного агента розташовані у структурі, що регулярно повторюється, протягом тривалого діапазону або зовнішніх площинах поверхонь. У іншому варіанті втілення, частинки активного агента можуть бути присутні в обох: і кристалічному, і аморфному станах. В ще іншому варіанті втілення, частинки активного агента можуть бути присутні у, по суті, аморфному стані, тобто, частинки активного агента у загальному мають некристалічний характер і не мають розташування молекул, що регулярно повторюється, зберігається протягом тривалого діапазону. Прийнятні ексципієнти для отримання частинок активного агента включають описані тут, у сполученні з частинками, що суспендуються. У конкретних варіантах втілення, наприклад, частинки активного агента можуть бути отримані з одного чи більше ліпідів, фосфоліпідів, вуглеводів, амінокислот, органічних солей, пептидів, протеїнів, алдітолів, штучних або природних полімерів, або матеріалів поверхнево-активної речовини, як описано, наприклад, у сполученні з частинками, що суспендуються. У інших варіантах втілення, частинки активного агента утворюються винятково з тонкоподрібненого матеріалу активного агента. [0079] Оскільки описані композиції уможливлюють отримання та відтворювану доставку дуже низьких доз активних агентів, у деяких варіантах втілення, активні агенти включені в композиції, описані тут, можуть бути обрані з одного чи більше діючих або сильнодіючих 10 UA 109531 C2 5 10 15 20 25 30 35 40 45 50 55 60 активних агентів. Наприклад, у деяких варіантах втілення, композиції описані тут можуть включати діючий активний агент, який доставляється одноразовим введенням дози, обраної з між приблизно 100 мкг та приблизно 100 мг на дозу, приблизно 100 мкг та приблизно 10 мг на дозу, та приблизно 100 мкг і 1 мг на дозу. У інших варіантах втілення, композиції описані тут можуть включати діючий або сильнодіючий активний агент, який доставляється при дозі, обраній з до приблизно 80 мкг на одноразове введення дози, до приблизно 40 мкг на одноразове введення дози, до приблизно 20 мкг на одноразове введення дози, до приблизно 10 мкг на одноразове введення дози або між приблизно 10 мкг та приблизно 100 мкг на одноразове введення дози. Крім того, у деяких варіантах втілення, композиції описані тут можуть включати сильнодіючий активний агент, який доставляється при дозі, обраній з між приблизно 0,1 та приблизно 2 мкг на одноразове введення дози, приблизно 0,1 та приблизно 1 мкг на одноразове введення дози, та приблизно 0,1 та приблизно 0,5 мкг на одноразове введення дози. [0080] У деяких варіантах втілення, активний агент включений в композиції, описані тут, являє собою активний агент МАТД. Композиції включають активний агент МАТД, в особливих варіантах втілення, активний агент МАТД може бути обраний з, наприклад, глікопіролату, дексіпіроніуму, тіотропіуму, троспіуму, аклідиніуму, даротропіуму, включаючи будь-які фармацевтично прийнятні солі, естери, ізомери або його сольвати. [0081] Глікопіролат може бути використаний для лікування запальної або обструктивної легеневих хвороб та розладів таких як, наприклад, описані тут. Як антихолінергік, глікопіролат діє як бронходилататор і забезпечує антисекреторний ефект, що є перевагою для використання в терапії легеневої хвороб та розладів, що характеризуються підвищеним виділенням слизу. Глікопіролат являє собою сіль четвертинного амонію. Де прийнятно, глікопіролат може бути використаний у формі солей (наприклад лужного металу або солей аміну, або як додаткових солей кислот) або як естери, або як сольвати (гідрати). Крім того, глікопіролат може бути у будьякій кристалічній формі або ізомерній формі, або суміші ізомерних форм, наприклад чистому енантіомері, сіміші енантіомерів, рацематі або його суміші. В цьому відношенні, форма глікопіролату може бути обрана для оптимізації активності та/або стабільності глікопіролат та/або для мінімізації розчинності глікопіролату у суспензійному середовищі. Придатні протиіони є фармацевтично прийнятними проти іонами, включаючи, наприклад, фторид, хлорид, бромід, йодид, нітрат, сульфат, фосфат, форміат, ацетат, трифторацетат, пропіонат, бутират, лактат, цитрат, тартрат, малат, малеат, сукцинат, бензоат, p-хлорбензоат, дифеніл-ацетат або трифенілацетат, o-гідроксибензоат, p-гідроксибензоат, 1-гідроксинафталін-2-карбоксилат, 3гідроксинафталін-2-карбоксилат, mетансульфонат та бензолсульфонат. В особливих варіантах втілення композицій, описаних тут, бромідна сіль глікопіролату, а саме 3-[(циклопентилгідроксифенілацетил)окси]-1,1-диметилпіролідин бромід, використовується та може бути отримана згідно з методиками, викладеними в патенті США № 2,956,062. [0082] Композиції, описані тут, включають глікопіролат, у деяких варіантах втілення, композиції можуть включати достатню кількість глікопіролату для забезпечення цільвої доставленої дози, обраної з між приблизно 10 мкг та приблизно 200 мкг на активацію ІВД, приблизно 15 мкг та приблизно 150 мкг на активацію ІВД, та приблизно 18 мкг і 144 мкг на активацію ІВД. В інших таких варіантах втілення, композиції включають достатню кількість глікопіролату для забезпечення дози, обраної з до приблизно 200 мкг, до приблизно 150 мкг, до приблизно 75 мкг, до приблизно 40 мкг, або до приблизно 20 мкг на активацію. В ще додаткових варіантах втілення, композиції включають достатню кількість глікопіролату для забезпечення дози обраної з приблизно 18 мкг на активацію, 36 мкг на активацію, або приблизно 72 мкг на активацію. Для того щоб досягти цільові доставлені дози, як описано тут, композиції, описані тут, включають глікопіролат як активний агент, У конкретних варіантах втілення, кількість глікопіролату, включена в композиції може бути обрана з, наприклад, між приблизно 0,04 мг/мл та приблизно 2,25 мг/мл. [0083] У інших варіантах втілення, тіотропіум, включаючи будь-які фармацевтично прийнятні солі, естери, ізомери або його сольвати, може бути обраний як активний агент МАТД для включення в композицію, як описано тут. Тіотропіум - відомі, антихолінергічні ліки тривалої дії, прийнятні для використання при лікуванні хвороб або розладів, пов'язаних з легеневим запаленням або обструкцією, такими як ті, що описані тут. Тіотропіум, включаючи кристал та фармацевтично прийнятні соляні форми тіотропіуму, описаний, наприклад, в патенті США № 5,610,163, патенті США № RE39820, патенті США № 6,777,423, та патенті США № 6,908,928. Композиції, описані тут, включають тіотропіум, у деяких варіантах втілення, композиції можуть включати достатню кількість тіотропіуму для забезпечення доставленої дози, обраної з між приблизно 2,5 мкг та приблизно 50 мкг, приблизно 4 мкг та приблизно 25 мкг, приблизно 2,5 мкг та приблизно 20 мкг, приблизно 10 мкг та приблизно 20 мкг, та приблизно 2,5 мкг та приблизно 11 UA 109531 C2 5 10 15 20 25 30 35 40 45 50 55 60 10 мкг на активацію ІВД. В інших таких варіантах втілення, композиції включають достатню кількість тіотропіуму для забезпечення доставленої дози, обраної з до приблизно 50 мкг, до приблизно 20 мкг, до приблизно 10 мкг, до приблизно 5 мкг, або до приблизно 2,5 мкг на активацію ІВД. В ще додаткових варіантах втілення, композиції включають достатню кількість тіотропіуму для забезпечення доставленої дози, обраної з приблизно 3 мкг, 6 мкг, 9 мкг, 18 мкг, та 36 мкг на активацію ІВД. Для того щоб досягти доставлені дози, як описано тут, композиції, описані тут, включають тіотропіум як активний агент, у конкретних варіантах втілення, кількість тіотропіуму включена в композиції може бути обрана з, наприклад, між приблизно 0,01 мг/мл та приблизно 0,5 мг/мл. [0084] У деяких варіантах втілення, композиції, описані тут, включають активний агент ААТД. У таких варіантах втілення, активний агент ААТД може бути обраний з, наприклад, бамбутеролу, кленбутеролу, формотеролу, салметеролу, кармотеролу, мілветеролу, індакатеролу, і адамантилових похідних β2 агоністів, що містять салігенін або індол, та будьяких фармацевтично прийнятних солей, естерів, ізомерів або їх сольватів. У деяких таких варіантах втілення, формотерол обраний як активний агент ААТД. Формотерол може бути використаний для лікування запальної або обструктивної легеневої хвороб та розладів, таких як, наприклад, ті, що описані тут. Формотерол має хімічну назву (±)-2-гідрокси-5-[(1 RS)-I гідрокси-2-[[(1 RS) -2-(4-метоксифеніл)-1 -метилетил]-аміно]етил] форманілід, і зазвичай використовується у фармацевтичній композиції як рацемічний фумарат дигідрату солі. Де прийнятно, формотерол може бути використаний у формі солей (наприклад лужного металу або солей аміну або як додаткових солей кислот) або як естери, або як сольвати (гідрати). Крім того, формотерол може бути у будь-якій кристалічній формі або ізомерній формі або суміші ізомерних форм, наприклад, чистому енантіомері, сіміші енантіомерів, рацематі або його суміші. В цьому відношенні, форма формотеролу може бути обрана для оптимізації активності та/або стабільності формотеролу та/або для мінімізації розчинності формотеролу у суспензійному середовищі. Фармацевтично прийнятні солі формотеролу включають, наприклад, солі неорганічних кислот, такі як хлористоводневої, бромводневої, сірчаної та фосфорної кислоти, та органічних кислот, таких як фумарова, малеїнова, оцтова, молочна, лимонна, винна, аскорбінова, бурштинова, глутамінова, глюконова, трикарбалілова, олеїнова, бензойна, pметоксибензойна, саліцилова, o- та p-гідроксибензойна, p-хлорбензойна, метансульфонова, pтолуолсульфонова та 3-гідрокси-2-нафталін карбонова кислоти. Гідрати формотеролу описані, наприклад, в патенті США № 3,994,974 та патенті США № 5,684,199. Специфічні кристалічні форми формотеролу та інші агоністи β2 адренергічних рецепторів описані, наприклад, в WO95/05805, та специфічні ізомери формотеролу описані в патенті США № 6,040,344. [0085] У конкретних варіантах втілення, формотероловий матеріал використовують для утворення формотеролових частинок, які являють собою формотеролу фумарат, і, в одному такому варіанті втілення, формотеролу фумарат присутній у формі дигідрату. Композиції описані тут включають формотерол, у деяких варіантах втілення, композиції, описані тут, включають формотерол при концентрації, яка досягає цільової доставленої дози, обраної з між приблизно 1 мкг та приблизно 30 мкг, приблизно 1 мкг та приблизно 10 мкг, приблизно 2 мкг та 5 мкг, приблизно 2 мкг та приблизно 10 мкг, приблизно 5 мкг та приблизно 10 мкг, та 3 мкг та приблизно 30 мкг на активацію ІВД. У інших варіантах втілення, композиції описані тут можуть включати формотерол у кількості, достатній для отримання наміченої доставленої дози, обраної з до приблизно 30 мкг, до приблизно 10 мкг, до приблизно 5 мкг, до приблизно 2,5 мкг, до приблизно 2 мкг, або до приблизно 1,5 мкг на активацію. Для того щоб одержати цільові доставлені дози, як описано тут, композиції, описані тут, включають формотерол як активний агент, У конкретних варіантах втілення, кількість формотеролу включена в композиції може бути обрана з, наприклад, між приблизно 0,01 мг/мл та приблизно 1 мг/мл, між приблизно 0,01 мг/мл та приблизно 0,5 мг/мл, та між приблизно 0,03 мг/мл і приблизно 0,4 мг/мл. [0086] Коли фармацевтичні композиції спільної суспензії, описані тут, включають активний агент ААТД, у деяких варіантах втілення, активний агент може бути салметеролом, включаючи будь-які фармацевтично прийнятні солі, естери, ізомери або його сольвати. Салметерол може бути використаний для лікування запальної або обструктивної легеневих хвороб та розладів таки як, наприклад, ті, що описані тут. Салметерол, фармацевтично прийнятні солі салметеролу, та способи його одержання описані, наприклад, в патенті США №4,992,474, патенті США №5,126,375, та патенті США №5,225,445. [0087] У деяких варіантах втілення, де салметерол включений як активний агент ААТД, композиції, описані тут, можуть включати салметерол при концентрації, яка досягає доставлену дозу, обрану з між приблизно 2 мкг та приблизно 120 мкг, приблизно 4 мкг та приблизно 40 мкг, приблизно 8 мкг та 20 мкг, приблизно 8 мкг та приблизно 40 мкг, приблизно 20 мкг та приблизно 40 мкг, та 12 мкг та приблизно 120 мкг на активацію ІВД. У інших варіантах втілення, композиції 12 UA 109531 C2 5 10 15 20 25 30 35 40 45 50 55 60 описані тут можуть включати салметерол у кількості, достатній отримання доставленої дози, обраної з до приблизно 120 мкг, до приблизно 40 мкг, до приблизно 20 мкг, до приблизно 10 мкг, до приблизно 8 мкг, або до приблизно 6 мкг на активацію ІВД. Для того щоб одержати цільові доставлені дози, як описано тут, композиції, описані тут, включають салметерол як активний агент, У конкретних варіантах втілення, кількість салметеролу включена в композиції може бути обрана з, наприклад, між приблизно 0,04 мг/мл та приблизно 4 мг/мл, між приблизно 0,04 мг/мл та приблизно 2,0 мг/мл, та між приблизно 0,12 мг/мл та приблизно 0,8 мг/мл. Наприклад, композиції описані тут можуть включати достатню кількість салметеролу для отримання наміченої доставленої дози, обраної з між приблизно 4 мкг та приблизно 120 мкг, приблизно 20 мкг та приблизно 100 мкг, та між приблизно 40 мкг, та приблизно 120 мкг на активацію ІВД. У ще інших варіантах втілення, композиції, описані тут, можуть включати достатню кількість салметеролу для отримання наміченої доставленої дози, обраної з до приблизно 100 мкг, до приблизно 40 мкг, або до приблизно 15 мкг на активацію ІВД. [0088] Однак, матеріал активного агента включений в композиції, описані тут, може бути аморфним або, в основному, аморфним, У конкретних варіантах втілення матеріал активного агента використовується як або в утворенні частинок активного агента, включених в композиції, описані тут, які є в основному або повністю кристалічними. Матеріал активного агента, який в основному або повністю кристалічний, може бути обраний для покращення хімічної стабільності активних агентів МАТД або ААТД, коли отримання в композиції описані тут. Таким чином, у конкретних варіантах втілення, матеріал активного агента включений в композиції, описані тут, являє собою тонкоздрібнений, кристалічний МАТД матеріал. В одному такому варіанті втілення, частинки активного агента утворюють винятково тонкоздрібнений, кристалічний МАТД матеріал, такий як тонкоздрібнений кристалічний матеріал обраний з глікопіролату, дексіпіроніуму, тіотропіуму, троспіуму, аклідиніуму, даротропіуму, та будь-яких фармацевтично прийнятних солей, естерів або його сольватів. В інших конкретних варіантах втілення, матеріал активного агента, включений в композиції, описані тут, являє собою тонкоздрібнений, кристалічний матеріал ААТД. В одному такому варіанті втілення, частинки активного агента утворюють винятково тонкоздрібнений, кристалічний матеріал ААТД, такий як тонкоздрібнений кристалічний матеріал, обраний з бамбутеролу, кленбутеролу, формотеролу, салметеролу, кармотеролу, мілветеролу, індакатеролу, та агоністів β2, що містять салігенін, індол і похідні адамантилу і будь-які фармацевтично прийнятні солі, естерів або його сольватів. [0089] Будь-який прийнятний процес може бути використаний для отримання тонкоподрібненого матеріалу активного агента як або в формулюванні частинок активного агента, включених в композиції, описані тут. Множину процесів може бути використано для створення частинок активного агента, прийнятних для використання у композиціях спільної суспензії, описаних тут, включаючи, але не обмежуючись цим, мікронізацію за допомогою процесів молоття або подрібнювання, процесів кристалізації або перекристалізації, та процесів, що використовують осадження з надкритичних або майже надкритичних розчинників, сушіння розпиленням, розпилювальної сублімаційної сушки, або ліофілізації. Патент посилається на прийнятні способи отримання тонкоздрібнених частинок активного агента, описані, наприклад, у патенті США № 6,063,138, патенті США № 5,858,410, патенті США № 5,851,453, патенті США № 5,833,891, патенті США № 5, 707,634, та міжнародній патентній публікації №. WO 2007/009164. Де частинки активного агента включають матеріал активного агента сформований з одного чи більше ексципієнтів чи ад'ювантів, тонкоздрібнені частинки активного агента можуть бути утворені з використанням одного чи більше попередніх процесів і такі процеси можуть використовуватися для отримання частинок активного агента, що мають бажане розподілення розмірів частинок і конфігурацію частинок. (iii) Частинки, що суспендуються [0090] Частинки, що суспендуються, включені в композиції спільної суспензії, описані тут, діють для полегшення стабілізації та доставки активного агента, включені в композиції. Хоча можуть бути використані різні форми частинок, що суспендуються, частинки, що суспендуються, звичайно формуються з фармакологічно інертних матеріалів, які прийнятні для інгаляції і є, в основному, нерозчинними в обраному пропеленті. Як правило, більшість частинок, що суспендуються, мають розмір у межах прийнятних для вдихання. В особливих варіантах втілення, внаслідок цього, МСАД частинок, що суспендуються, не перевищить приблизно 10 мкм, але не нижче приблизно 500 нм. В альтернативному варіанті втілення, МСАД частинок, що суспендуються, є між приблизно 5 мкм та приблизно 750 нм. В ще іншому варіанті втілення, МСАД частинок, що суспендуються, є між приблизно 1 мкм та приблизно 3 мкм. Коли використовується варіант втілення для назальної доставки з ІВД, МСАД частинок, що суспендуються, є між 10 мкм та 50 мкм. [0091] Для того, щоб одержати здатні до вдихання частинки, що суспендуються, в описаних 13 UA 109531 C2 5 10 15 20 25 30 35 40 45 50 55 60 межах МСАД, частинки, що суспендуються, звичайно показують об'ємний середній оптичний діаметр між приблизно 0,2 мкм та приблизно 50 мкм. В одному варіанті втілення, частинки, що суспендуються, демонструють об'ємний середній оптичний діаметр, що не перевищує приблизно 25 мкм. У іншому варіанті втілення, частинки, що суспендуються, демонструють об'ємний середній оптичний діаметр, обраний з між приблизно 0,5 мкм та приблизно 15 мкм, між приблизно 1,5 мкм та приблизно 10 мкм, та між приблизно 2 мкм та приблизно 5 мкм. [0092] Концентрація частинок, що суспендуються, включених в композицію згідно з цим описом, може бути скоригована, в залежності від, наприклад, кількості частинок активного агента та суспензійного середовища, що використовуються. В одному варіанті втілення, частинки, що суспендуються, включені у суспензійне середовище при концентрації обраній з приблизно 1 мг/мл до приблизно 15 мг/мл, приблизно 3 мг/мл до приблизно 10 мг/мл, 5 мг/мл до приблизно 8 мг/мл, та приблизно 6 мг/мл. У іншому варіанті втілення, частинки, що суспендуються, включені у суспензійному середовищі при концентрації до приблизно 30 мг/мл. В ще іншому варіанті втілення, частинки, що суспендуються, включені у суспензійне середовище при концентрації до приблизно 25 мг/мл. [0093] Відносна кількість частинок, що суспендуються, до частинок активного агента обрана для досягнення спільної суспензії, як розглянуто тут. Композиції спільної суспензії можуть бути досягнуті, коли кількість частинок, що суспендуються, як виміряно за масою, перевищує кількість частинок активного агента. Наприклад, у конкретних варіантах втілення, співвідношення загальної маси частинок, що суспендуються, до загальної маси частинок активного агента може бути між приблизно 3:1 та приблизно 15:1, або, як альтернатива, від приблизно 2:1 and 8:1. Як альтернатива, співвідношення загальної маси частинок, що суспендуються, до загальної маси частинок активного агента може бути більше приблизно 1, такі як до приблизно 1,5, до приблизно 5, до приблизно 10, до приблизно 15, до приблизно 17, до приблизно 20, до приблизно 30, до приблизно 40, до приблизно 50, до приблизно 60, до приблизно 75, до приблизно 100, до приблизно 150, та до приблизно 200, в залежності від характеру частинок, що суспендуються, та частинок активного агента, що використовуються. В додаткових варіантах втілення, співвідношення загальної маси частинки, що суспендуються, до загальної маси частинок активного агента може бути обрана з між приблизно 10 та приблизно 200, між приблизно 60 та приблизно 200, між приблизно 15 та приблизно 60, між приблизно 15 та приблизно 170, між приблизно 15 та приблизно 60, приблизно 16, приблизно 60, та приблизно 170. [0094] У інших варіантах втілення, кількість частинок, що суспендуються, як виміряно за масою, менша ніж кількість частинок активного агента. Наприклад, в особливих варіантах втілення, маса частинок, що суспендуються, може складати лише 20 % загальної маси частинок активного агента. Однак, у деяких варіантах втілення, загальна маса частинок, що суспендуються, також може приблизною або точною до загальної маси частинок активного агента. [0095] Частинки, що суспендуються, прийнятні для використання в композиції, описані тут, можуть бути утворені з одного чи більше фармацевтично прийнятного матеріалу або ексципієнтів, які прийнятні для інгаляційної доставки і і суттєво не деградують або розчиняються у суспензійному середовищі. В одному варіанті втілення, перфоровані мікроструктури, як визначено тут, можуть бути використані як частинки, що суспендуються. Ілюстративні ексципієнти, які можуть бути використані при одержанні частинок, що суспендуються, описаних тут, включають, але не обмежуючись цим (a) карбогідрати, наприклад, моносахариди такі як фруктоза, галактоза, глюкоза, D-маноза, сорбоза, тощо; дисахариди, такі як сахароза, лактози, трегалози, целлобіози, тощо; циклодекстрини, такі як 2-гідроксипропіл-β-циклодекстрин; та полісахариди, такі як рафіноза, мальтодекстрини, декстрани, крохмалі, хітин, цитосан, інулін, тощо; (b) амінокислоти, такі як аланінова, гліцинова, аргінінова, аспарагінова кислота, глутамінова кислота, цистеїн, лізин, лейцин, ізолейцин, валін, тощо; (c) металеві та органічні солі отримані з органічних кислот та основ, таких як натрію цитрат, натрію аскорбат, магнію глюконат, натрію глюконат, трометамін гідрохлорид, тощо; (d) пептиди та протеїни, такі як аспартам, трилейцин, людський сироватковий альбумін, колаген, желатин, тощо; (e) алдітоли, такі як манітол, ксиліт, тощо; (f) штучні або природні полімери або їх комбінації, такі як полілактиди, полілактид-гліколіди, циклодекстрини, поліакрилати, метилцелюлоза, карбоксиметилцелюлоза, полівінілові спирти, поліангідриди, полілактами, полівінілпіролідони, гіалуронова кислота, поліетиленгліколі; та (g) поверхнево-активні речовини включаючи фторовані і nнефторовані сполуки, такі як насичені та ненасичені ліпіди, неіонні детергенти, неіонні блокспівполімери, іонні поверхнево-активні речовини та їх комбінації. В особливих варіантах втілення, частинки, що суспендуються, можуть включати сіль кальцію, таку як кальцію хлорид, як описано, наприклад, у патенті США № 7,442,388. 14 UA 109531 C2 5 10 15 20 25 30 35 40 45 50 55 60 [0096] Крім того, фосфоліпідів з природних та штучних джерел можуть бути використані при отриманні частинок, що суспендуються, прийнятних для використання в композиціях, описаних тут. В особливих варіантах втілення, вибрані фосфоліпіди будуть мати точку фазового 0 переходу від гелю до кристалічної фази вище ніж приблизно 40 C. Ілюстративні фосфоліпіди являють собою відносно довгий ланцюг (тобто, C16-C22) насичених ліпідів і можуть включати насичені фосфоліпіди, такі як насичені фосфатидилхоліни з довжиною ацилового ланцюга 16 C або 18 C (пальмітоїл та стеароїл). Ілюстративні фосфоліпіди включають фосфогліцериди такі як дипальмітоїлфосфатидилхолін, дистероїлфосфатидилхолін, диарахідоїлфосфатидилхолін, дибегеноїлфосфатидилхолін, дифосфатидил гліцерол, коротколанцюгові фосфатидилхоліни, довголанцюгові насичені фосфатидилетаноламіни, довголанцюгові насичені фосфатидилсерини, довголанцюгові насичені фосфатидилгліцероли, та довголанцюгові насичені фосфатидилінозитоли. Додаткові ексципієнти описані в міжнародній патентній публікації №. WO 96/32149 та патентах США №6,358,530, 6,372,258 і 6,518,239. [0097] В особливих варіантах втілення, частинки, що суспендуються, можуть утворюватися за допомогою одного чи більше ліпідів, фосфоліпідів або сахаридів, як описано тут. У деяких варіантах втілення, частинки, що суспендуються, включають одну чи більше поверхневоактивних речовин. Використання частинок, що суспендуються, формування або введення однієї чи більше поверхнево-активних речовин може сприяти поглинанню обраного активного агента, тим самим збільшуючи біодоступність. Частинки, що суспендуються, описані тут, такі як, наприклад, частинки, що суспендуються, сформовані за допомогою одного чи більше ліпідів, можуть бути сформовані для застосування бажаної шорсткості (нерівності) поверхні, яка може додатково знижувати взаємодії між частинками та покращує аерозолізацію за рахунок зменшення області поверхні доступної для взаємодії частинка-частинка. В додаткових варіантах втілення, якщо прийнятно, ліпід, що природно залягає у легені може бути використаний у формуванні частинок, що суспендуються, як такі частинки, що суспендуються, які мають потенціал для зменшення опсонізації (і тим самим зниження фагоцитозу альвеолярними макрофагами), забезпечуючи тим самим довготриваліше контрольоване вивільнення частинок у легенях. [0098] В іншому аспекті, частинки, що суспендуються, використовують в композиціях, описаних тут, можуть бути обрані для збільшення стабільності при зберіганні обраного активного агента, подібного до описаного в міжнародній патентній публікації WO 2005/000267. Наприклад, в одному варіанті втілення, частинки, що суспендуються, можуть включати фармацевтично прийнятні ексципієнти стабілізації скла, що мають Tg принаймні 55 °C, принаймні 75 °C, або принаймні 100 °C. Склоутворювачі прийнятні для використання в композиції, описані тут, включають, але не обмежуючись цим, один чи більше з трилейцину, натрію цитрату, фосфату натрію, аскорбінової кислоти, інуліну, циклодекстрину, полівінілпіролідону, манітолу, сахарози, трегалози, лактози, та, проліну. Приклади додаткових склоутворюючих ексципієнтів описані в патентах США № RE 37,872, 5,928,469, 6,258,341. [0099] Частинкам, що суспендуються може бути наданий бажані дизайн, форма та розмір, щоб забезпечити бажані стабільність та характеристики доставленого активного агента. В одному ілюстративному варіанті втілення, частинки, що суспендуються, включають перфоровані мікроструктури, як описано тут. Де перфоровані мікроструктури використовуються як частинки, що суспендуються, в композиції, описані тут, вони можуть бути утворені використовуючи один чи більше ексципієнтів, як описано тут. Наприклад, в особливих варіантах втілення, перфоровані мікроструктури можуть включати принаймні один з нижченаведених: ліпідів, фосфоліпідів, неіоногенних детергентів, неіоногенних блокспівполімерів, іонних поверхнево-активних речовин, біосумісних фторованих поверхнево-активних речовин та їх комбінацій, особливо тих, які випробувані для легеневого використання. Конкретні поверхневоактивні речовини, які можуть бути використані при отриманні перфорованих мікроструктур включають полоксамер 188, полоксамер 407 та полоксамер 338. Інші конкретні поверхневоактивні речовини включають олеїнову кислоту або їх лужні солі. В одному варіанті втілення, перфоровані мікроструктури включають більше ніж приблизно 10 % ваг./ваг. поверхневоактивної речовини. [0100] У деяких варіантах втілення, частинки, що суспендуються, можуть бути отримані шляхом формування водомасляної емульсії, з використанням фторвуглецевої олії (наприклад, перфтороктил броміду, перфтордекаліну), яка може бути емульгована за допомогою поверхнево-активної речовини, такої як довголанцюговий насичений фосфоліпід. Одержаний перфторвуглець у водній емульсії може бути потім оброблений за допомогою гомогенізатора високого тиску, щоб зменшити розмір краплі олії. Перфторвуглецеву емульсію можна вводити в розпилювальну сушарку, необов'язково з розчином активного агента, якщо це бажано, включати активний агент в матриці з перфорованих мікроструктур. Як добре відомо, розпилювальна 15 UA 109531 C2 5 10 15 20 25 30 35 40 45 50 55 60 сушка є однокроковим процесом, який перетворює рідку субстанцію у суху порошкоподібну форму. Розпилювальну сушку використовували для забезпечення порошкового фармацевтичного матеріалу для різних шляхів введення, включаючи інгаляцію. Умови роботи розпилювальної сушарки (такі як вхідна і вихідна температури, швидкість подачі, тиск розпилення, швидкість потоку сухого повітря та конфігурація патрубка) можуть бути пристосовані для отримання бажаного розміру частинок, одержуючі на виході сухі мікроструктури. Такі способи отримання перфорованих мікроструктур описан, наприклад, в патенті США № 6,309,623 to Weers et al. [0101] Перфоровані мікроструктури, як описано тут, також можуть бути утворені шляхом ліофілізації та подальшого помелу або мікронізації. Ліофілізація являє собою процес сублімаційного сушіння в якому вода сублімується з композиції, після того як її заморожують. Цей процес робить можливим сушіння без підвищених температур. В ще додаткових варіантах втілення, частинки, що суспендуються, можуть бути отримані з використанням процесу розпилювальної сублімаційної сушки, таким як описаний в патенті США 5,727,333. [0102] Крім того, частинки, що суспендуються, як описано тут, можуть включати наповнювачі, такі як полімерні частинки. Полімерні полімери можуть бути отримані з біосумісних та/або полімерів, що біорозкладаються, співполімерів або сумішей. В одному варіанті втілення, можуть бути використані полімери, здатні утворювати аеродинамічні світлі частинки, такі як функціональні поліетери привитих співполімерів та поліангідриди, що біорозкладаються. Наприклад, можуть бути використані об'ємні полімери, що руйнуються, на основі поліестерів, що включають полі(гідрокси кислоти). Полігліколева кислота (ПГК), полімолочна кислота (ПМК) або їх співполімери можуть бути використані для утворення частинок, що суспендуються. Поліестер може включати заряджену або функціональну групу, таку як аміно кислота. Наприклад, частинки, що суспендуються, можуть бути утворені з полі(D, L-молочної кислоти) та/або полі(D, L-молочної-спів-гліколевої кислоти) (PLGA), які включають в себе поверхневоактивні речовини, такі як DPPC. [0103] Інші потенційні кандидати полімерів для використання в частинках, що суспендуються, можуть включати поліаміди, полікарбонати, поліалкілени, такі як поліетилен, поліпропілен, полі(етиленгліколь), полі(етиленоксид), полі(етилентерефталат), полівінілові сполуки, такі як полівінілові спирти, полівінілові етери, і полівінілові естери, полімери акрилової та метакрилової кислоти, целюлози та інші полісахариди, та пептиди або протеїни, або їх співполімери або суміші. Полімери можуть бути вибрані і змінені, щоб мати відповідні швидкості стабілізації та деградації in vivo для різних контрольованих застосувань доставки ліків. [0104] Композиції, описані тут, можуть включати два чи більше різновиди частинок, що суспендуються. Навіть більше, композиції згідно з цим описом можуть включати частинки, що суспендуються, які включають глікопіролат включений в частинки, що суспендуються. Якщо активний агент включений в частинки, що суспендуються, частинки, що суспендуються, будуть розміром, прийнятним для вдихання та можуть бути сформовані і одержані з використанням, наприклад, способів та матеріалів, описаних тут. [0105] Композиції сформовані згідно з даною заявкою можуть інгібувати деградацію активного агента включеного тут. Наприклад, у конкретних варіантах втілення, композиції, описані тут, інгібують одне чи більше флокуляцій, агрегацій та трансформацій матеріалу активного агента, включеного в композиції, опосередкованих розчином. Фармацевтичні композиції, описані тут, є прийнятними для доставки респіраторним шляхом та пристроєм ІВД таким чином, щоб досягти бажаної однорідності доставленої дози ("ОДД") активних агентів ААТД та МАТД, включаючи діючі та сильнодіючі агенти ААТД та МАТД через випорожнення контейнера ІВД. Як докладно описано в прикладах включених сюди, навіть при доставці дуже низьких доз активних агентів МАТД або ААТД, композиції описані тут можуть досягти ОДД для активного агента ± 30 %, або краще через випорожнення контейнера ІВД. В одному такому варіанті втілення, композиції описані тут досягли ОДД для активного агента ± 25 %, або краще через випорожнення контейнера ІВД. У ще одному такому варіанті втілення, композиції, описані тут, досягали ОДД для активного агента ± 20 %, або краще через випорожнення контейнера ІВД. [0106] Фармацевтичні композиції, описані тут, також служать для істотного збереження продуктивності ФДЧ і ДДЧ через випорожнення контейнера ІВД, навіть після того, як піддаються прискореним умовам деградації. Наприклад, композиції згідно з цим описом підтримують хоча б 80 %, 90 %, 95 %, або більше, вихідної продуктивності ФДЧ та ДДЧ через випорожнення контейнера ІВД, навіть після піддавання прискореним умовам деградації. Композиції, описані тут, забезпечують додаткову перевагу досягнення такої продуктивності при одержанні композицій з використанням не-ХФВ пропелентів. У конкретних варіантах втілення, композиції, описані тут, досягають бажано однієї або всіх намічених ОДД, ФДЧ та ДДЧ характеристик під 16 UA 109531 C2 5 10 15 20 25 30 35 40 45 50 55 60 час отримання з суспензійного середовища, включаючи лише один чи більше не-ХФВ пропелентів і без потреби змінювати характеристики не-ХФВ пропеленту, так, як додаванням, наприклад, одного чи більше спільних розчинників, антирозчинників, солюбілізуючих агентів, ад'ювантів або інших змінених матеріалів пропеленту. [0107] В одному варіанті втілення, композиції спільної суспензії, як описано тут, включають: суспензійне середовище, що містить фармацевтично прийнятний ГФА пропелент; множину частинок активного агента, що містить глікопіролат, включаючи будь-які фармацевтично прийнятні солі, естери, ізомери або його сольвати, суспендовані у суспензійному середовищі при концентрації, достатній для забезпечення доставленої дози глікопіролату між приблизно 20 мкг та приблизно 150 мкг на активацію інгалятора з відміряними дозами; та множину прийнятних для вдихання частинок, що суспендуються, включаючи перфоровані мікроструктури, як описано тут, що показують об'ємний середній оптичний діаметр між приблизно 1,5 мкм та приблизно 10 мкм, де перфоровані мікроструктури сполучають з множинучю частинок активного агента для утворення спільної суспензії. В одному такому варіанті втілення, частинки активного агента глікопіролату утворюють матеріал кристалічного глікопіролату. В іншому такому варіанті втілення, співвідношення загальної маси частинок, що суспендуються, до загальної маси частинок активного агента, обране з між приблизно 3:1 та приблизно 15:1 та між приблизно 2:1 і 8:1. У ще одному такому варіанті втілення, частинки активного агента глікопіролату утворюють матеріал кристалічного глікопіролату та співвідношення загальної маси частинки, що суспендуються, до загальної маси частинок активного агента, обране з між приблизно 3:1 та приблизно 15:1 та між приблизно 2:1 і 8:1. У ще інших таких варіантах втілення, частинки активного агента глікопіролату утворюють матеріал кристалічного глікопіролату, принаймні 90 % глікопіролату частинок активного агента за об'ємом мають оптичний діаметр менше ніж 7 мкм, та співвідношення загальної маси частинок, що суспендуються, до загальної маси частинок активного агента, обране з між приблизно 3:1 та приблизно 15:1 та між приблизно 2:1 і 8:1. [0108] У іншому варіанті втілення, композиції спільної суспензії, як описано тут, включають: суспензійне середовище, що включає фармацевтично прийнятний ГФА пропелент; множину частинок активного агента містять тіотропіум, включаючи будь-які фармацевтично прийнятні солі, естери, ізомери або його сольвати, суспендовані у суспензійному середовищі при концентрації, достатній для забезпечення доставленої дози глікопіролату між приблизно 5 мкг та приблизно 40 мкг на активацію інгалятора з відміряними дозами; та множину прийнятних для вдихання частинок, що суспендуються, включають перфоровані мікроструктури, як описано тут, що показують об'ємний середній оптичний діаметр між приблизно 1,5 мкм та приблизно 10 мкм, де перфоровані мікроструктури сполучають з множинучю частинок активного агента для утворення спільної суспензії. В одному такому варіанті втілення, частинки активного агента тіотропіуму утворюються з кристалічного матеріалу тіотропіуму. В іншому такому варіанті втілення, співвідношення загальної маси частинок, що суспендуються, до загальної маси частинок активного агента, обране з між приблизно 3:1 та приблизно 15:1 та між приблизно 2:1 і 8:1. У ще одному такому варіанті втілення, частинки активного агента тіотропіуму утворюються з кристалічного матеріалу тіотропіуму та співвідношення загальної маси частинок, що суспендуються, до загальної маси частинок активного агента, обране з між приблизно 3:1 та приблизно 15:1 та між приблизно 2:1 і 8:1. У ще інших таких варіантах втілення, частинки активного агента тіотропіуму утворюються з кристалічного матеріалу тіотропіуму, принаймні 90 % частинок активного агента тіотропіуму за об'ємом мають оптичний діаметр менше ніж 7 мкм, та співвідношення загальної маси частинок, що суспендуються, до загальної маси частинок активного агента, обране з між приблизно 3:1 та приблизно 15:1 та між приблизно 2:1 і 8:1. [0109] У іншому варіанті втілення, композиції спільної суспензії, як описано тут, включають: суспензійне середовище, що містить фармацевтично прийнятний пропелент ГФА; множину частинок активного агента, що містять формотерол, включаючи будь-які фармацевтично прийнятні солі, естери, ізомери або його сольвати, суспендовані у суспензійному середовищі при концентрації достатній для забезпечення доставки дози формотеролу між приблизно 0,5 мкг та приблизно 10 мкг на активацію інгалятора з відміряними дозами; та множину прийнятних для вдихання частинок, що суспендуються, які містять перфоровані мікроструктури, як описано тут, показують об'ємний середній оптичний діаметр між приблизно 1,5 мкм та приблизно 10 мкм, де перфоровані мікроструктури сполучають з множинучю частинок активного агента для утворення спільної суспензія. В одному такому варіанті втілення, частинки активного агента формотеролу утворені з кристалічного матеріалу формотеролу. В іншому такому варіанті втілення, співвідношення загальної маси частинок, що суспендуються, до загальної маси частинок активного агента, обране з між приблизно 3:1 та приблизно 15:1 та між приблизно 2:1 і 8:1. У ще одному такому варіанті втілення, частинки активного агента формотеролу утворені з 17 UA 109531 C2 5 10 15 20 25 30 35 40 45 50 55 60 кристалічного матеріалу формотеролу та співвідношення загальної маси частинок, що суспендуються, до загальної маси частинок активного агента, обране з між приблизно 3:1 та приблизно 15:1 та між приблизно 2:1 і 8:1. У ще інших таких варіантах втілення, частинки активного агента формотеролу утворені з кристалічного матеріалу формотеролу, принаймні 90 % частинок активного агента формотеролу за об'ємом мають оптичний діаметр менше ніж 7 мкм, та співвідношення загальної маси частинок, що суспендуються, до загальної маси частинок активного агента, обране з між приблизно 3:1 та приблизно 15:1 та між приблизно 2:1 і 8:1. [0110] В одному варіанті втілення, композиції спільної суспензії, як описано тут, включають: суспензійне середовище, що містить фармацевтично прийнятний пропелент ГФА; множину частинок активного агента, що містять формотерол, включаючи будь-які фармацевтично прийнятні солі, естери, ізомери або його сольвати, суспендовані у суспензійному середовищі при концентрації достатній для забезпечення доставленої дози формотеролу між приблизно 2 мкг та приблизно 10 мкг на активацію інгалятора з відміряними дозами; та множину прийнятних для вдихання частинок, що суспендуються, які містять перфоровані мікроструктури, як описано тут, показують об'ємний середній оптичний діаметр між приблизно 1,5 мкм та приблизно 10 мкм, де перфоровані мікроструктури сполучають з множинучю частинок активного агента для утворення спільної суспензія. В одному такому варіанті втілення, частинки активного агента формотеролу утворені з кристалічного матеріалу формотеролу. В іншому такому варіанті втілення, співвідношення загальної маси частинок, що суспендуються, до загальної маси частинок активного агента, обране з між приблизно 3:1 та приблизно 15:1 та між приблизно 2:1 і 8:1. У ще одному такому варіанті втілення, частинки активного агента формотеролу утворені з кристалічного матеріалу формотеролу та співвідношення загальної маси частинок, що суспендуються, до загальної маси частинок активного агента, обране з між приблизно 3:1 та приблизно 15:1 та між приблизно 2:1 і 8:1. У ще інших таких варіантах втілення, частинки активного агента формотеролу утворені з кристалічного матеріалу формотеролу, принаймні 90 % частинок активного агента формотеролу за об'ємом мають оптичний діаметр менше ніж 7 мкм, та співвідношення загальної маси частинок, що суспендуються, до загальної маси частинок активного агента, обране з між приблизно 3:1 та приблизно 15:1 та між приблизно 2:1 і 8:1. [0111] У іншому варіанті втілення, композиції спільної суспензії як описано тут включають: суспензійне середовище що містить фармацевтично прийнятний пропелент ГФА; множину частинок активного агента, що містять салметерол, включаючи будь-які фармацевтично прийнятні солі, естери, ізомери або його сольвати, суспендовані у суспензійному середовищі при концентрації достатній для забезпечення доставленої дози салметеролу між приблизно 8 мкг та приблизно 40 мкг на активацію інгалятора з відміряними дозами; та множину прийнятних для вдихання частинок, що суспендуються, які містять перфоровані мікроструктури, як описано тут, показують об'ємний середній оптичний діаметр між приблизно 1,5 мкм та приблизно 10 мкм, де перфоровані мікроструктури сполучають з множинучю частинок активного агента для утворення спільної суспензії. В одному такому варіанті втілення, частинки активного агента салметеролу утворені з кристалічного матеріалу салметеролу. В іншому такому варіанті втілення, співвідношення загальної маси частинок, що суспендуються, до загальної маси частинок активного агента, обране з між приблизно 3:1 та приблизно 15:1 та між приблизно 2:1 і 8:1. У ще одному такому варіанті втілення, частинки активного агента салметеролу утворені з кристалічного матеріалу салметеролу та співвідношення загальної маси частинок, що суспендуються, до загальної маси частинок активного агента, обране з між приблизно 3:1 та приблизно 15:1 та між приблизно 2:1 і 8:1. У ще інших таких варіантах втілення, частинки активного агента салметеролу утворені з кристалічного матеріалу салметеролу, принаймні 90 % частинок активного агента салметеролу за об'ємом мають оптичний діаметр менше ніж 7 мкм, та співвідношення загальної маси частинок, що суспендуються, до загальної маси частинок активного агента, обране з між приблизно 3:1 та приблизно 15:1 та між приблизно 2:1 і 8:1. III. Системи інгаляторів з відміряними дозами [0112] Як описано відносно способів запропонованих тут, композиції, описані тут, можуть бути використані в системі ІВД. Пристрої ІВД сконфігуровані для доставки певної кількості медикаментів у формі аерозолю. В одному варіанті втілення, система ІВД включає контейнер, заповнений рідкофазною композицією під тиском, розміщений в актуаторі із загубником для вдихання. Система ІВД може включати композиції, описані тут, які включають суспензійне середовище, глікопіролат та принаймні один різновид частинок, що суспендуються. Контейнер, що використовується в ІВД є будь-яким з будь-якої прийнятної конфігурації, та в одному ілюстративному варіанті втілення, контейнер може мати об'єм, що варіює від приблизно 5 мл до приблизно 25 мл, такий як, наприклад, контейнер, що має об'єм 19 мл. Після струшування 18 UA 109531 C2 5 10 15 20 25 30 35 40 45 50 55 60 пристрою, загубник вставляється в рот пацієнта між губами і зубами. Пацієнт звичайно глибоко видихає, щоб випорожнити легені і потім робить повільний глибокий вдих, чим приводиться до дії картридж. [0113] Всередині ілюстративного картриджу є дозуючий клапан, що включає дозуючу камеру здатну утримувати певний об'єм композиції (наприклад, 63 мкл або будь-який інший придатний об'єм доступний в комерційно прийнятних дозуючих клапанах), який вивільняється у розширювальну камеру на дистальному кінці штока клапана при активуванні. Актуатор містить контейнер і також може включати канал з патрубка актуатора для отримання штоку клапана дозуючого клапану. При активуванні, зазначений об'єм композиції переміщається в розширювальну камеру, з патрубка актуатора у спрей, який втягується в легені пацієнта на високій швидкості. IV. Способи [0114] Тут запропоновані способи отримання фармацевтичних композицій для доставки респіраторним шляхом активних агентів МАТД та МАТД. В особливих варіантах втілення, такі способи включають кроки отримання суспензійного середовища, частинок активного агента, обраних з частинок активного агента, що включають МАТД, та частинок активного агента, що включають ААТД, і одного чи більше різновидів частинок, що суспендуються, як описано тут, та з'єднування таких елементів для утворення композиції, де частинки активного агента сполучають з частинками, що суспендуються, та спільно розміщені з частинками, що суспендуються, в суспензійному середовищі такому як утворена спільна суспензія. В одному такому варіанті втілення, сполучення частинок глікопіролату та частинок, що суспендуються, є таким, що вони не розділяються внаслідок їхньої різної плавучості у пропеленті. Як буде зрозуміло, спосіб може включати отримання двох або більше різновидів частинок, що суспендуються, у комбінації з частинками активного агента. У іншому варіанті втілення, спосіб може включати отримання двох або більше різновидів частинок активного агента та з'єднування двох або більше різновидів частинок активного агента з одним або більше різновидами частинок, що суспендуються, у спосіб, що приводить до отримання спільної суспензії. У деяких варіантах втілення, частинки активного агента, в основному, складаються з активних агентів МАТД або ААТД, як описано тут. [0115] У конкретних варіантах втілення способів отримання стабілізованої композиції активних агентів МАТД або ААТД для легеневої доставки, цей опис пропонує способи інгібування трансформації активних агентів МАТД або ААТД, опосередкованих розчином, у фармацевтичній композиції для легеневої доставки. В одному варіанті втілення одержують суспензійне середовище, як описано тут, таке як суспензійне середовище утворене за допомогою пропеленту HF. Частинки, що суспендуються, також одержують або готують, як описано тут. Також отримують частинки активного агента, і суспензійне середовище, частинки, що суспендуються, та частинки активного агента комбінують для утворення спільної суспензії, де частинки активного агента сполучають з частинками, що суспендуються, та спільно розміщенують з частинками, що суспендуються, в безперервній фазі сформованій за допомогою суспензійного середовища. У порівнянні з частинками активного агента, що містяться в тому ж суспензійному середовищі за відсутності частинок, що суспендуються, було з'ясовано, що спільні суспензії згідно з цим описом проявляють більш високу стійкість до трансформацій, опосередкованих розчином, що призводить до незворотної агрегації кристалів, і таким чином може привести до покращеної стабільності та однорідності дозування. [0116] В додаткових варіантах втілення, способи для утворення стабільних композицій активних агентів МАТД та ААТД для легеневої доставки включають для зберігання ФДЧ та/або ДДЧ композиції через випорожнення контейнера ІВД. У конкретних варіантах втілення способи для зберігання ФДЧ та/або ДДЧ забезпечений фармацевтичною композицією для легеневої доставки, прийнятна для вдихання спільна суспензія, як описано тут, забезпечує підтримання ДДЧ та/або ФДЧ у межах ± 20 %, ± 10 %, або навіть ± 5 % початкового ДДЧ та/або ФДЧ, відповідно, через випорожнення контейнера ІВД. Така продуктивність може бути досягнута навіть після піддавання спільної суспензії прискореним умовам деградації. В одному варіанті втілення одержують суспензійне середовище, як описано тут, таке як суспензійне середовище утворене за допомогою пропеленту ГФА. Частинки, що суспендуються, також одержують або готують, як описано тут. Частинки активного агента також отримують, і суспензійне середовище, частинки, що суспендуються, та частинки активного агента комбінують для утворення спільної суспензії, де частинки глікопіролату сполучають з частинками, що суспендуються, та спільно розміщують з частинками, що суспендуються, в суспензійному середовищі. Навіть після впливу такої композиції на одну чи більше циклічних змін температури, спільна суспензія підтримує ДДЧ або ФДЧ в межах ± 20 %, ± 10 %, або навіть ± 5 % відповідних значень виміряних перед впливом композиції на одну чи більше циклічних змін температури. 19 UA 109531 C2 5 10 15 20 25 30 35 40 45 50 55 60 [0117] Описані способи отримання ІВД для легеневої доставки активних агентів МАТД або ААТД. Спосіб одержання ІВД може включати заповнення контейнера, як описано тут, частинками активного агента та частинками, що суспендуються. Клапан актуатора може бути приєднаний до кінця контейнера і контейнер герметичний. Клапан актуатора може бути адаптований для диспергування виміряної кількості глікопіролату фармацевтичної композиції на активацію. Контейнер може бути заряджений фармацевтично прийнятним суспензійним середовищем, таким як пропелент, як описано тут. Після чого частинки активного агента та частинки, що суспендуються, дають стабільну спільну суспензію у суспензійному середовищі. [0118] У способах, пов'язаних з легеневою доставкою активних агентів МАТД або ААТД з використанням композицій, описаних тут, композиції можуть бути доставлені за допомогою ІВД. Таким чином, в особливих варіантах втілення таких способів, одержують ІВД заповнений композицією, описаною тут, і активні агенти МАТД або ААТД вводять пацієнту через легеневу доставку за допомогою активації ІВД. Наприклад, в одному варіанті втілення, після струшування пристрою ІВД, загубник вставляється у рот пацієнта між губами та зубами. Пацієнт звичайно глибоко видихає, щоб випорожнити легені і потім робить повільний глибокий вдих, чим приводиться до дії картридж ІВД. При активуванні, зазначений обсяг композиції йде в розширювальну камеру, з патрубка актуатора і у високошвидкісний спрей, який потрапляє в легені пацієнта. В одному варіанті втілення доза активного агента, доставлена через випорожнення контейнера ІВД не більше ніж на 30 % більше, ніж середня доставлена дози і не менше ніж на 30 % менше, ніж середня доставлена дози. Таким чином, також запропоновані способи досягнення бажаної ОДД глікопіролату отримані з ІВД. У таких варіантах втілення, спосіб може включати досягнення ОДД для глікопіролату, доставленого з ІВД, обраного з, наприклад, ОДД ± 30 %, або краще, ОДД ± 25 %, або краще, і ОДД ± 20 %, або краще. [0119] Пропонуються способи лікування пацієнтів, що страждають від запальної або обструктивної легеневої хвороби. У конкретних варіантах втілення, такі способи включають легеневу доставку фармацевтичної композиції, описану тут, і у деяких таких варіантах втілення, легеневе введення фармацевтичної композиції завершується за допомогою доставки композиції з використанням ІВД. Хвороби або стани, що підлягують лікуванню, можуть бути обрані з будь-якої запальної або обструктивної легеневої хвороби або стану, який реагує на введення агента МАТД або ААТД. В особливих варіантах втілення, фармацевтичні композиції, описані тут, можуть бути використані у лікуванні хвороби або розладу обраного з астми, ХОЗЛ, загострення гіперерактивності дихальних шляхів, що є наслідком іншої лікарської терапії, алергічного риніту, синуситу, легеневої вазоконстрикції, запалення, алергій, ускладненого дихання, респіраторного дистрес-синдрому, легеневої гіпертонії, легеневої вазоконстрикції, емфіземи, та будь-яких інших хвороб органів дихання, стану, особливостей, генотипу або фенотипу, які можуть бути прийнятні для введення МАТД або ААТД, одного або в комбінації з іншими способами лікування. У деяких варіантах втілення, фармацевтичні композиції, описані тут, можуть бути використані для лікування легеневого запалення та обструкції пов'язаної з муковісцидозом. [0120] Крім того, фармацевтичні композиції згідно з цим описом доставлені з ІВД забезпечують бажану фармакодинамічну (ФД) продуктивність. В особливих варіантах втілення, легенева доставка фармацевтичної композиції, описана тут, приводить до швидкого, значного поліпшення в об'ємі легень, який може бути охарактеризований поліпшенням у пацієнтів обсягу форсованого видиху за секунду (FEV1). Наприклад, в особливих варіантах втілення, запропоновані способи досягнення клінічно значимого збільшення у FEV 1, де такі способи включають забезпечення композиції спільної суспензії, що включає активний агент ААТД або МАТД, як описано тут, і введення таких композицій пацієнту, що страждає від легеневого запалення або непрохідності за допомогою пристрою ІВД. Для цілей цього опису, клінічно значиме збільшення у FEV1 є будь-яким збільшенням 100 мл чи більше, та у деяких варіантах втілення способи, описані тут, введення композицій згідно з цим описом пацієнту приводить до клінічно значимого збільшення у FEV1 протягом 1 години або менше. В інших таких варіантах втілення, способи для введення композиції, як описано тут, пацієнту за допомогою пристрою ІВД приводять до клінічно значимого збільшення у FEV1 протягом 0,5 години або менше. Композиції надані та доставлені у таких варіантах втілення можуть включати композицію, що містить активний агент МАТД або композицію, що містить активний агент ААТД, як описано тут. [0121] В додаткових варіантах втілення, способи запропоновані для досягнення росту FEV 1, більше ніж 100 мл. Наприклад, у деяких варіантах втілення, способи, описані тут, включають способи досягнення FEV1 150 мл чи більше протягом періоду часу обраного з 0,5 години або менше, 1 години або менше, та 1,5 години або менше. У інших варіантах втілення, способи описані тут включають способи досягнення FEV 1 200 мл чи більше протягом періоду часу обраного з 0,5 години або менше, 1 години або менше, та 1,5 20 UA 109531 C2 5 10 15 20 25 30 35 40 45 50 55 60 години або менше, і 2 години або менше. У деяких таких варіантах втілення, композиція, що включає активний агент ААТД або МАТД, як описано тут, запропонована і вводиться пацієнту, що страждає від легеневого запалення або обструкції, за допомогою ІВД. [0122] У ще додаткових варіантах втілення, запропоновані способи досягнення та підтримання клінічно значимого зростання в FE\Λ. В особливих варіантах втілення, при введенні однієї дози активного агента ААТД або МАТД, одержаного в композиції, як описано тут, пацієнту за допомогою ІВД, клінічно значиме збільшення у FEV1 досягається протягом періоду часу обраного з 0,5 години або менше, 1 години або менше, та 1,5 години або менше, і клінічно значиме збільшення у FEV1 збергіється до 12 годин або більше. У деяких таких варіантах втілення, зростання у FEV1 може бути обране зі зростання у 150 мл чи більше, 200 мл чи більше і 250 мл чи більше, та зростання у FEV1 залишається клінічно значущим для періоду часу обраного з аж до 4 годин, аж до 6 годин, аж до 8 годин, аж до 10 годин, та аж до 12 годин, або більше. У деяких таких варіантах втілення, композиція включає активний агент ААТД або МАТД, як описано тут, запропонована та вводиться пацієнту, що відчуває легеневе запалення або обструкцію за допомогою ІВД. [0123] Композиції, системи та способи, описані тут, прийнятні не лише для досягнення бажаної фармакодинамічної ефективності протягом коротких періодів часу, а й для досягнення таких результатів у високого відсотку пацієнтів. Наприклад, способи, запропоновані тут, для досягнення 10 % чи більшого зростання у FEV1 у 50 % чи більше пацієнтів, що відчувають легеневе запалення або обструкцію. Наприклад, в особливих варіантах втілення, способи досягнення 10 % чи більшого зростання у FEV1 у пацієнта включають забезпечення композиції спільної суспензії, що містить активний агент ААТД або МАТД, як описано тут, і введення такої композиції за допомогою ІВД пацієнту, що страждає від легеневого запалення або обструкції. У деяких таких варіантах втілення, введення композиції приводить до 10 % чи більшого зростання у FEV1 протягом періоду часу обраного з 0,5 години або менше, 1 години або менше, 1,5 години або менше, та 2 годин у 50 % чи більше пацієнтів. В інших таких варіантах втілення, введення композиції приводить до 10 % чи більше зростання у FEV1 протягом періоду часу обраного з 0,5 години або менше, 1 години або менше, 1,5 години або менше, та 2 або менше годин у 60 % чи більше пацієнтів. У ще інших таких варіантах втілення, введення композиції приводить до 10 % чи більше зростання у FEV1 протягом періоду часу обраного з 0,5 години або менше, 1 години або менше, 1,5 години або менше, та 2 годин або менше у 70 % чи більше пацієнтів. В ще інших таких варіантах втілення, введення композиції приводить до 10 % чи більше зростання у FEV1 протягом періоду часу обраного з 0,5 години або менше, 1 години або менше, 1,5 години або менше, та 2 або менше годин у 80 % чи більше пацієнтів [0124] У конкретних варіантах втілення, способи, описані тут, полегшують лікування пацієнтів, що відчувають легеневе запалення або обструкцію, де такі способи включають забезпечення композиції спільної суспензії, що містить активний агент ААТД або МАТД, як описано тут, і введення таких композицій пацієнту, що страждає від легеневого запалення або обструкції за допомогою ІВД і в результаті значна частина таких пацієнтів відчуває зростання від базисної лінії у FEV1 принаймні 200 мл або 12 %, чи більше, зростання від базисної лінії у FEV1,пов'язане із загальним зростанням у FEV1 принаймні 150 мл. У деяких таких варіантах втілення, введення композиції приводить до будь-якого зростання від базисної лінії у FEV1 принаймні 200 мл або 12 %, чи більше, зростання від базисної лінії у FEV1 пов'язаного із загальним зростанням у FEV1 принаймні 150 мл протягом періоду часу обраного з 1 години або менше, 1,5 години або менше, 2 годин або менше, та 2,5 годин або менше у 50 % чи більше пацієнтів. В інших таких варіантах втілення, введення композиції приводить до зростання від базисної лінії у FEV1 принаймні 200 мл або 12 %, чи більше, зростання від базисної лінії у FEV1 пов'язаного із загальним зростанням у FEV1 принаймні 150 мл протягом періоду часу обраного з 1 години або менше, 1,5 години або менше, 2 годин або менше, та 2,5 годин або менше у 60 % чи більше пацієнтів. У ще інших таких варіантах втілення, введення композиції приводить або до зростання від базисної лінії у FEV1 в принаймні 200 мл або 12 %, чи ще більшого зростання, зростання від базисної лінії у FEV1 пов'язане із загальним зростанням у FEV1 принаймні 150 мл протягом періоду часу обраного з 1,5 години або менше, 2 годин або менше, 2,5 годин або менше, та 3 годин або менше у 70 % чи більше пацієнтів. В ще інших таких варіантах втілення, введення композиції приводить до будь-якого зростання від базисної лінії у FEV1 принаймні 200 мл або 12 %, чи більше, зростання від базисної лінії у FEV1 пов'язаного із загальним зростанням у FEV1 принаймні 150 мл протягом періоду часу обраного з 1,5 години або менше, 2 годин або менше, 2,5 годин або менше, та 3 годин або менше у 80 % чи більше пацієнтів. [0125] У деяких варіантах втілення, фармацевтичні композиції згідно з цим описом доставлені з ІВД зпбезпечують поліпшення в об'ємі легені, який може бути охарактеризований поліпшенням в об'ємі вдиху (ОВ), який визначається як максимальний об'єм газу, який може 21 UA 109531 C2 5 10 15 20 25 30 35 40 45 50 55 60 бути прийнятий в легені при повній інгаляції після нормального видиху. Наприклад, в особливих варіантах втілення, запропоновані способи досягнення клінічно значимого збільшення у ОВ, де такі способи включають забезпечення композиції спільної суспензії, що містить активний агент ААТД або МАТД, як описано тут, і введення таких композицій пацієнту, що страждає від легеневого запалення або обструкції, за допомогою ІВД. Для цілей цього опису, клінічно значиме збільшення у ОВ є будь-яким збільшенням на 70 мл чи більше, та у деяких варіантах втілення способи, описані тут, введення композицій, згідно з цим описом, пацієнту приводять до клінічно значимого збільшення у ОВ протягом 2 години або менше. В інших таких варіантах втілення, способи для введення композиції, як описано тут, пацієнту за допомогою ІВД приводять до клінічно значимого збільшення у ОВ протягом 1 години або менше. В інших таких варіантах втілення, введення композицій пацієнту, згідно з цим описом, приводить до зростання у ОВ на 100 мл чи більше протягом періоду часу обраного з 1 години або менше та 2 годин або менше. У ще інших таких варіантах втілення, введення композицій пацієнту, згідно з цим описом, приводить до зростання у ОВ на 150 мл чи більше протягом періоду часу обраного з 1 години або менше та 2 годин або менше. В навіть додаткових таких варінатах втілення, введення композицій пацієнту, згідно з цим описом, приводить до зростання у ОВ на 300 мл чи більше протягом періоду часу обраного з 1 години або менше та 2 годин або менше. Композиції забезпечені та доставлені у таких варіантах втілення, можуть включати композицію, що містить активний агент МАТД, або композицію, що містить активний агент ААТД, як описано тут. [0126] В особливих варіантах втілення способів, описаних тут, композиції забезпечують включення активного агента МАТД. У таких варіантах втілення, активний агент МАТД може бути обраний з, наприклад, глікопіролату, дексіпіроніуму, тіотропіуму, троспіуму, аклідиніуму, та даротропіуму, включаючи будь-які фармацевтично прийнятні солі, естери, ізомери або його сольвати. У конкретних варіантах втілення способів, описаних тут, композиція явлює собою композицію спільної суспензії, як описано тут, яка включає глікопіролат або будь-яку фармацевтично прийнятну сіль, естер, ізомер або його сольват. В інших конкретних варіантах втілення способів, описаних тут, композиція явоює собою композицію спільної суспензії, як описано тут, яка включає тіотропіум або будь-яку фармацевтично прийнятну сіль, естер, ізомер або його сольват. Де глікопіролат або тіотропіум обраний як активний агент для використання в одержаних композиції, або введеня як частина описаних способів, кількість глікопіролату або тіотропіуму включена в композицію, може бути обрана з, наприклад, тих кількостей, що конкретно вказані стосовно фармацевтичних композицій, описаних тут. [0127] В додаткових варіантах втілення способів, описаних тут, композиції забезпечують включення активного агента ААТД. У таких варіантах втілення, активний агент ААТД може бути обраний з, наприклад, бамбутеролу, кленбутеролу, формотеролу, салметеролу, кармотеролу, мілветеролу, індакатеролу, та агоністів β2, що містять саліциловий спирт або індол, і похідних адамантилу, вкоючаючи будь-які фармацевтично прийнятні солі, естери, ізомери або його сольвати. У конкретних варіантах втілення способів, описаних тут, композиція являє собою композицію спільної суспензії, як описано тут, що включаює формотерол або будь-яку фармацевтично прийнятну сіль, естер, ізомер або його сольват. В інших конкретних варіантах втілення способів, описаних тут, композиція являє собою композицію спільної суспензії, як описано тут, що включаює салметерол або будь-яку фармацевтично прийнятну сіль, естер, ізомер або його сольват. Де формотерол або салметерол обраний як активний агент для використання в одержаних композиціях, або введення як частина способів, описаних тут, кількість формотеролу або салметеролу включена у композицію може бути обрана з, наприклад, тих кількостей, що конкретно вказані стосовно фармацевтичних композицій, описаних тут. [0128] Композиції, способи та системи описані тут забезпечують бажану ефективність дози та відповідь дози для активних агентів МАТД або ААТДs одержаних для легеневої доставки. Наприклад, легенева доставка глікопіролату для лікування станів, таких як ХОЗЛ була раніше запропонована або опублікована в Schroeckenstein et al., J. Allergy Clin. Immunol., 1988; 82(1): 115-119, Leckie et al., Exp. Opin. Invest. Drugs, 2000; 9(1): 3-23, Skorodin, Arch. Intern. Med., 1993; 153: 814-828, Walker et al., Chest, 1987; 91 (1): 49-51, and International Patent PublОВation WO/1997/039758. Ці посилання публікують мнімально ефективну дозу для глікопіролату 200 мкг - 1,000 мкг. Такі потреби в дозуванні відповідно до клінічних результатів людини опубліковані в Bannister et al. у патенті США № 7,229,607, де суб'єктам давали 480 мкг дози глікопіролату Як описано в Прикладі 6, зазначеному тут, композиції глікопіролату отримані згідно з цим описом та доставлені суб'єктам-людям за допомогою ІВД досягають швидкого початку дії та клінічно значимих поліпшень FEV1 і ОВ, відповідно до способів деталізованих тут, навіть при доставці значно менших доз глікопіролату (найбільша разова доза доставлена в дослідженні склала 144 мкг). 22 UA 109531 C2 5 10 15 20 25 30 35 40 45 50 55 60 [0129] Singh et al. [D Singh, P A Corris, and S D Snape. "NVA237, a once-daily inhaled antimuscahnic, provides 24-hour bronchodilator efficacy in patients with moderate to-severe COPD" Poster presented at the American Thoracic Society International Conference, Сан-Дієго, Каліфорнія, травень 19-24, 2006] опубліковано клінічну роботу, де глікопіролат вводили суб'єктам-людям за допомогою легеневої доставки при дозах 20 мкг, 125 мкг, 250 мкг, і 400 мкг. Хоча такі дози коливалися нижче 200 мкг порогу попередньо опублікованого, як також детально зазначено в Прикладі 6, композиції глікопіролату одержані та доставлені, як описано тут, ще досягають відносно поліпшеної ефективності дози. Наприклад, зміни у FEV1 AUC досягнуті за допомогою спільних суспензії глікопіролату, як описано та оцінено в клінічних випробуваннях описаних в Прикладі 6 порівняні з тими, що досягнені за допомогою композиції Singh et al. на Фігурі 10. 18 мкг доза глікопіролату з Прикладу 6 забезпечує значно кращу бронходиляторну реакцію ніж 20 мкг доза опублікована в Singh et al., та 36 мкг і 144 мкг дози глікопіролату з Прикладу 6 зпбнзпечують порівняну бронходиляторну реакцію з 125 мкг та 250 мкг дозами, відповідно, опублікованими в Singh et al. [0130] В особливих варіантах втілення, пропонуються способи досягнення бажаних фармакодинамічних ефектів, де способи включають введення композиції спільної суспензії, як описано тут, пацієнту за допомогою інгалятора з відміряними дозами, де спільна суспензія включаює частинки активного агента глікопіролату, як описано тут, пацієнту за допомогою інгалятора з відміряними дозами, так щоб доставлена доза, яка вводиться пацієнту, не перевищувала 150 мкг глікопіролату. В одному варіанті втілення, запропоновано спосіб досягнення клінічно значимого збільшення в FEV1, де спосіб включає введення спільної суспензії пацієнту, як описано тут, яка включає частинки активного агента глікопіролату, за допомогою інгалятора з відміряними дозами, так щоб пацієнту вводилися доставлені дози не більше ніж 150 мкг глікопіролату. В одному такому варіанті втілення, пацієнту вводяться доставлені дози не більше ніж 100 мкг глікопіролату, і у іншому варіанті втілення пацієнту вводяться доставлені дози не більше ніж 80 мкг глікопіролату. Навіть там, де дози не більше ніж 80 мкг, не більше ніж 100 мкг глікопіролату, або не більше ніж 150 мкг, глікопіролат вводиться пацієнту, в особливих варіантах втілення, клінічно значиме збільшення у FEV1 досягається через 1 годину або раніше. У деяких таких варіантах втілення, клінічно значиме збільшення в FEV1 досягається через 0,5 години або раніше. [0131] В додаткових варіантах втілення, способи запропоновані для досягнення збільшення в FEV1 більшого ніж 100 мл, де способи включають введення пацієнту спільної суспензії, як описано тут, яка включає частинки активного агента глікопіролату, за допомогою інгалятора з відміряними дозами, так щоб доставлена доза, яка вводиться пацієнту, не перевищувала 150 мкг глікопіролату. Наприклад, у деяких варіантах втілення, запропоновані способи досягнення FEV1 для 150 мл або більше протягом періоду часу обраного з 0,5 години або менше, 1 години або менше, і 1,5 години або менше, де способи включають введення спільної суспензії пацієнту, як описано тут, яка включає частинки активного агента глікопіролату, за допомогою інгалятора з відміряними дозами, так щоб пацієнту вводилися доставлені дози не більше ніж 150 мкг глікопіролату. У інших варіантах втілення, способи, описані тут, включають способи досягнення FEV1 для 200 мл або більше протягом періоду часу обраного з 0,5 години або менше, 1 години або менше, та 1,5 години або менше, та 2 годин або менше, де способи включають введення спільної суспензії пацієнту, як описано тут, яка включає частинки активного агента глікопіролату, за допомогою інгалятора з відміряними дозами так, щоб доставлена доза, яка вводиться пацієнту, не перевищувала 150 мкг глікопіролату. [0132] У ще додаткових варіантах втілення, запропоновані способи дозягнення та підтримання клінічно значимого зростання в FEV1, де способи включають введення пацієнту спільної суспензії, як описано тут, яка включає частинки активного агента глікопіролату, за допомогою інгалятора з відміряними дозами, так щоб доставлена доза, яка вводиться пацієнту, не перевищувала 150 мкг глікопіролату. У деяких таких варіантах втілення, при введенні однієї доставленої дози глікопіролату не більше ніж 150 мкг, клінічно значиме збільшення у FEV1 досягається протягом періоду часу, обраного з 0,5 години або менше, 1 години або менше, та 1,5 години або менше, та клінічно значиме збільшення у FEV1 збергіється до 12 годин чи довше. Наприклад, в особливих варіантах втілення, збільшення в FEV1 може бути обране зі збільшення в 150 мл чи більше, 200 мл чи більше і 250 мл чи більше, і збільшення в FEV 1 залишається клінічно значущим для періоду часу, обраного з аж до 4 годин, аж до 6 годин, аж до 8 годин, аж до 10 годин, та аж до 12 годин, чи більше. [0133] Також запропоновані способи досягнення зростання від базисної лінії у FEV 1 на принаймні 200 мл або 12 %, чи більше, зростання від базисної лінії у FEV1 пов'язане із загальним зростанням у FEV1 на принайні 150 мл, де способи включають введення пацієнту спільної суспензії, як описано тут, яка включає частинки активного агента глікопіролату, за 23 UA 109531 C2 5 10 15 20 25 30 35 40 45 50 55 60 допомогою інгалятора з відміряними дозами, так щоб доставлена доза, яка вводиться пацієнту, не перевищувала 150 мкг глікопіролату. У деяких таких варіантах втілення, введення доставленої дози не більш ніж 150 мкг глікопіролату зі спільної суспензії, як описано тут, за допомогою інгалятора з відміряними дозами приводить до будь-якого зростання від базисної лінії у FEV1 принаймні 200 мл або 12 %, чи більше, зростання від базисної лінії у FEV1 пов'язане із загальним зростанням у FEV1 принаймні 150 мл протягом періоду часу обраного з 1 години або менше, 1,5 години або менше, 2 годин або менше, та 2,5 годин або менше у 50 % чи більше пацієнтів. В інших таких варіантах втілення, введення доставленої дози не більше ніж 150 мкг глікопіролату зі спільної суспензії, як описано тут, за допомогою інгалятора з відміряними дозами приводить до зростання від базисної лінії у FEV1 принаймні 200 мл або 12 %, чи більше, зростання від базисної лінії у FEV1 пов'язане із загальним зростанням у FEV1 принаймні 150 мл протягом періоду часу обраного з 1 години або менше, 1,5 години або менше, 2 годин або менше, та 2,5 годин або менше у 60 % чи більше пацієнтів. У ще інших таких варіантах втілення, введення доставленої дози не більш ніж 150 мкг глікопіролату зі спільної суспензії, як описано тут, за допомогою інгалятора з відміряними дозами приводить до будь-якого зростання від базисної лінії у FEV1 принаймні 200 мл або 12 %, чи більше, зростання від базисної лінії у FEV1 пов'язане із загальним зростанням у FEV 1 принаймні 150 мл протягом періоду часу обраного з 1,5 години або менше, 2 годин або менше, 2,5 годин або менше, та 3 годин або менше у 70 % чи більше пацієнтів. В ще інших таких варіантах втілення, введення доставленої дози не більше ніж 150 мкг глікопіролату зі спільної суспензії, як описано тут, за допомогою інгалятора з відміряними дозами приводить до будь-якого зростання від базисної лінії у FEV1 принаймні 200 мл або 12 %, чи більше, зростання від базисної лінії у FEV1 пов'язане із загальним зростанням у FEV1 принаймні 150 мл протягом періоду часу обраного з 1,5 години або менше, 2 годин або менше, 2,5 годин або менше, та 3 годин або менше у 80 % чи більше пацієнтів. [0134] Запропоновані способи досягнення клінічно значимого збільшення у ОВ, де способи включають введення пацієнту спільної суспензії, як описано тут, яка включає частинки активного агента глікопіролату, за допомогою інгалятора з відміряними дозами, так, щоб доставлена доза, яка вводиться пацієнту, не перевищувала 150 мкг глікопіролату. У деяких таких варіантах втілення, введення доставленої дози не більше ніж 150 мкг глікопіролат зі спільної суспензії, як описано тут, за допомогою інгалятора з відміряними дозами приводить до клінічно значимого зростання у ОВ протягом 1 години або менше. В інших таких варіантах втілення, введення доставленої дози не більше ніж 150 мкг глікопіролату зі спільної суспензії, як описано тут, за допомогою інгалятора з відміряними дозами приводить до зростання у ОВ 100 мл чи більше протягом періоду часу обраного з 1 години або менше та 2 годин або менше. У ще інших таких варіантах втілення, введення доставленої дози не більш ніж 150 мкг глікопіролату зі спільної суспензії, як описано тут, за допомогою інгалятора з відміряними дозами приводить до зростання у ОВ 150 мл чи більше протягом періоду часу обраного з 1 години або менше та 2 годин або менше. В ще інших таких варінатах втілення, введення доставленої дози не більше ніж 150 мкг глікопіролату зі спільної суспензії, як описано тут, за допомогою інгалятора з відміряними дозами приводить до зростання у ОВ 300 мл чи більше протягом періоду часу обраного з 1 години або менше та 2 годин або менше. [0135] Конкретні приклади включені сюди лише для ілюстрування цілей і не повинні розглядатися як такі, що обмежують цей опис. Крім того, композиції, системи та способи, описані тут, були описані відносно його деяких варіантів втілення, і багато деталей були сформульовані в цілях ілюстрації, фахівцю у цій галузі має бути зрозуміло, що винахід піддається додатковим варіантам втілення і що деякі деталі, описані тут, можуть бути змінені без відхилення від основних принципів винаходу. Будь-які активні речовини і реагенти, що використовуються в нижченаведених прикладах або комерційно доступні, або можуть бути отримані у відповідності зі стандартними процедурами у літературі фахівцем в галузі органічного синтезу. Весь зміст всіх публікацій, патентів і заявок на видачу патентів включено в цей опис шляхом посилання. Приклад 1 [0136] Частинки активного агента формують глікопіролат (Піролідин, 3((циклопентилгідроксифенілацетил)окси)-1,1 -диметил-, бромід) були утворені за допомогою тонкоподрібненого глікопіролату з використанням струменевого млину. Розподіл частинок за розміром тонкоподрібненого глікопіролату (ГП) був визначений за допомогою лазерної дифракції. 50 % за об'ємом тонкоздрібнених частинок показують оптичний діаметр менший ніж 2,1 мкм, 90 % за об'ємом були менші ніж 5 мкм. [0137] Частинки, що суспендуються, були одержані наступним чином: було отримано 500 мл фторвуглецю-у водній емульсії ПФОБ (перфтороктил бромід) стабілізований за допомогою 24 UA 109531 C2 5 10 15 20 25 фосфоліпіду. 18,7 г фосфоліпіду, ДСФХ (1,2-Дистеароїл-sn-Гліцеро-3-Фосфохолін), та 1,3 г хлориду кальцію було гомогенізовано в 400 мл гарячої води (75 °C) з використанням змішувача з великим зусиллям зсуву. 100 мл ПФОБ були повільно додані під час гомогенізації. Результуюча груба емульсія була потім додатково гомогенізована з використанням гомогенізатора високого тиску (Модель C3, Avestin, Оттава, Канада) при тиску до 170 МПа протягом 5 проходжень. [0138] Емульсію висушували розпиленням в азоті, використовуючи такі умови сушіння розпиленням: Температура на вході 95 °C, температура на виході 72 °C, швидкість подачі емульсії 2,4 мл/хв, загальний потік газу 525 Л/хв. Розподіл частинок за розміром частинок, що суспендуються, був визначений за допомогою лазерної дифракції. 50 % за об'ємом частинок, що суспендуються, були менші ніж 2,9 мкм, Геометричне Стандартне Відхилення розрозділення склало 1,8. [0139] Інгалятори з відміряними дозами були підготовлені шляхом зважування цільових мас тонкоздрібнених ГП частинок та частинок, що суспендуються, у алюмінієвому контейнері (Presspart, Блекберн, Велика Британія) з ємністю 19 мл, покритого фторованим етиленовим полімером (ФЕП). Цільові маси та цільові доставлені дози, що допускають 20 % осадження в актуаторі, наведені в Таблиці 1 для п'яти різних конфігурацій (конфігурації з 1A по 1 C представляють різні суспензії ГП частинок та частинок, що суспендуються; конфігурація 1D представляє ГП частинки поодинці; конфігурація 1 E представляє частинки, що суспендуються, поодинці). Контейнери були герметично запаяні за допомогою 63 мкл клапанів (# BK 357, Bespak, Кінгс-Лінн, Велика Британія) та заповнені 12,4 г ГФА 134a (1,1,1,2-тетрафторетан) (Ineos Fluor, Ліндхерст, Велика Британія) за допомогою надлишкового тиску через шток клапана. Після введення пропеленту, контейнери дисперговані за допомогою ультразвуку протягом 15 секунд та струшені в струшувачі поверненому в зап'ястя протягом 30 хвилин. Контейнери були обладнані поліпропіленовими актуаторами з 0,3 мм отворами (# BK 636, Bespak, Кінгс-Лінн, Велика Британія). Додаткові інгалятори для візуального спостереження за якістю суспензії були отримані з використанням скляних флаконів. Таблиця 1: Результати для спільних суспензій глікопіролату Прикладу 1 Частинки, що Конфігурація ID ГП (мг/кон.) суспендуються (мг/кон.) 1A 3,4 61 1B 4,1 61 1C 4,1 15 1D 4,1 0 1E 0 61 30 35 40 45 Цільова Доставлена доставлена доза (мкг) доза (мкг) 16,5 17,8 20 19,4 20 19,4 20 11,1-15,3 ФДЧ (%) МСАД (мкм) 41,3 42,0 42,7 27,0 53,6* 3,7 3,9 3,2 3,3 3,2 * На основі аналізу ДСФХ. [0140] Ефективність аерозолю оцінювалася незабаром після вироблення відповідно до USP (Фармакопея США Монографія 601). Імпактор Наступного Покоління (ІНП), що працює при швидкості потоку 30 Л/хв використовувався для визначення розрозділення частинок за розміром. Контейнери-зразки закріпляли в актуаторі з довома відпрацьованими активаціюми та двома додатковими відпрацьованими попередніми активаціюми. П'ять приводів були зібрані в ІНП з причепленою горловиною USP. Клапан, актуатор, горловина, ковпачки ІНП, платформи, та фільтр були промиті мірним дисперсним розчинником. Розчини зразків були проаналізовані з використанням методу хроматографії для визначеня конкретних ліків. Фракція дрібнодисперсних частинок була визначена з використанням суми стадій 3 через фільтр. Однорідність доставленої дози через використання тестування проводилася з використанням Пристрою Відбору Однорідних Зразків, як описано в Фармакопеї США . Інгалятори були поміщені та заправлені, як описано раніше. Два активацію були відібрані та проаналізовані на початку, середині та кінці застосування. [0141] Візуальне спостереження конфігурацій спільної суспензії (1A, 1 B, 1 C) не показало осадження кристалів ліків. Суспензія флокулює повільно та формує гомогенний, одиничний шар піни подібний до конфігурації компаратора 1 E, до якої увійшли частинки, що суспендуються, суспендовані поодинці. На відміну від цього, тонкоздрібнені частинки ГП поодинці (конфігурація 1D) флокулюються та осаджуються швидко. Конфігурація 1B не показала ознак розділення Частинок ГП від частинок, що суспендуються, навіть після центрифугування при 35г протягом 20 25 UA 109531 C2 5 10 15 20 25 30 35 40 45 50 55 хвилин. Було отримано подібний результат (наприклад, відсутність розділення частинок ГП) при центрифугуванні аж до 200г. Конфігурація 1C (низька конфігурація суспендування) показала невелику кількість кристалів ГП, що осіла після центрифугування при 35г протягом 20 хвилин. [0142] У той час як конфігурації спільної суспензії досягають доставлену дозу в межах 10 % цільових, ГП частинки суспендовані поодинці показали набагато вищу варіативність у доставленій дозі у діапазоні значно нижчому від цільового. Фракція дрібнодисперсних частинок порівняно з конфігурацією 1D була поліпшена на більш ніж 50 %. МСАДs конфігурацій спільної суспензії були прийнятні та залежали від суспензійної концентрації частинок, що суспендуються. Однорідність доставлених доз за рахунок використання була перевірена на конфігураціях 1 B та 1 C. Усі індивідуально доставлені дози були в межах ±20 % від середнього значення. Результати показали, що кристали препарату що формують частинки ГП, сполучені з частинками, що суспендуються, спільна суспензія була сформована, і ефективність аерозолю спільної суспензії в основному визначалася за допомогою частинок, що суспендуються. [0143] Сполучення між кристалами ГП та частинками, що суспендуються, було достатньо сильним, щоб подолати сили плавучості, як було зазначено, що кристали ГП не відділяються від перфорованих мікроструктур і осідання кристалів сповільнюється. Приклад 2 [0144] Частинки глікопіролату (ГП) були сформовані за допомогою мікронізації з використанням струминного млину. Частинки, що суспендуються, були одержані як описано у Прикладі 1. Розподіл частинок за розміром тонкоподрібненого ГП був визначений за допомогою лазерної дифракції. 50 % за об'ємом тонкоздрібнених частинок показують оптичний діаметр менший ніж 1,7 мкм, 90 % за об'ємом показують оптичний діаметр менший ніж 4,1 мкм. П'ять різних партій інгаляторів з відміряними дозами були зроблені з різних серій. Для конфігурацій 2A, 2B та 2C загальна концентрація ДСФХ, CaCI 2, та ГП в сировині становить 40 мг/мл, для конфігурацій 2D і 2E ця концентрація була подвоєна. [0145] Інгалятори з відміряними дозами були підготовлені за вагою цільової маси ГП частинок та частинок, що суспендуються, у контейнери, як описано у Прикладі 1. Додаткові ексципієнти не використовувалися. Цільові маси становили 4 мг / контейнер для ГП частинок та 60 мг / контейнер для частинок, що суспендуються, у результаті співвідношення частинок, що суспендуються, до частинок ГП становило15 для конфігурацій 2A та 2D. Цільові маси становили 5,1 мг / контейнер для ГП частинок і 51 мг / контейнер для частинок, що суспендуються, у результаті співвідношення частинок, що суспендуються, до частинок ГП становило 10 для конфігурації 2B. Цільові маси становили 8 мг / контейнер для ГП частинок і 60 мг / контейнер для частинок, що суспендуються, у результаті співвідношення частинок, що суспендуються, до частинок ГП склало 7,5 для конфігурацій 2C і 2E. Пропелент та система закриття контейнера були як описані у Прикладі 1. [0146] Кристали ГП були поміщені у ГФА 134a у контейнер під тиском і були врівноважені протягом 3 тижнів при кімнатній температурі, щоб визначити їх розчинність в пропеленті. Проби фільтрують під тиском при температурі навколишнього середовища через фільтри з отворами шириною 0,22 мкм. Фільтрат випарювали і ГП розчиняли у метанолі і аналізували за допомогою хроматографії. Розчинність 0,17±0,07 мкг/г була визначена. Використовуючи це значення було встановлено, що 2,1 мкг або 0,05 % ГП, присутні у контейнері, розчиняються у пропеленті. В попередніх статтях досліджено, що мікрокристалічний матеріал з виміряною розчинністю у пропеленті не буде фізично стабільним внаслідок трансформацій, опосередкованих розчином [N. C. Miller, The Effects of Water in Inhalation Suspension Aerosol Formulations, in: P. A. Byron, Ed., Respiratory Drug Delivery, CRC Press, 1990, p 250], або, що активи з розчинністю вище 0,1 мкг/г повинні бути одержані з ад'юванту, щоб запобігти a трансформаціям, опосередкованих розчином [P. Rogueda, Novel Hydrofluoroalkane Suspension Formulations for Respiratory Drug Delivery, Expert Opin. Drug DeNv. 2, 625-638, 2005]. [0147] Заповнені інгалятори з відміряними дозами зберігалися клапаном донизу без упаковки при двох різних умовах: 1) в холодильнику при 5 °C; і 2) при кімнатній температурі 25 °C / 60 % ВВ. Ефективність аерозолю та однорідність доставленої дози тестували, як описано у Прикладі 1 у різні моменти часу. Результати, які наведені у Таблиці 2, показують стабільну фракцію на основі дрібнодисперсних частинок за умов зберігання в холодильнику та при кімнатній температурі. 26 UA 109531 C2 Таблиця 2: Фракція на основі конфігурацій дрібнодисперсних частинок у Прикладі 2 # Зберігання ФДЧ у % 2 місяці 3 місяці 51 52 48 51 46 49 54 54 46 49 Початкова 2A 2B 2C 5 10 15 20 25 30 35 40 45 5 °C 25 °C/60 % ВВ 25 °C/60 % ВВ 5 °C 25 °C/60 % ВВ 49 50 51 6 місяців 48 49 [0148] Конфігурації 2C та 2E були піддані тесту на циклічну зміну температури. Контейнери були піддані чергуванню температур -5 °C та 40 °C кожні 6 годин загальною тривалістю дванадцять тижнів. Фракція дрібнодисперсних частинок склала 53 % для обох конфігурацій на початку дослідження… Після дванадцять тижнів циклювання ФДЧ не змінився, тобто при 55 % для конфігурації 2C та при 53 % для конфігурації 2E. [0149] Однорідність доставлених доз за рахунок використання була перевірена на 1, 2 та 6 часових точках місяців. Усі індивідуально доставлені дози були в межах ±20 % від середнього значення. Фігури 1 і 2 показують розподіл частинок аерозолю за розміром, як виміряно за допомогою ІНП для конфігурацій 2A та 2B, відповідно. Також показана кількість ліків відновлених з актуатора, і з індукційного каналу (горловина) і його адаптер для загубника. Відновлення мас виражається у відсотках від номінальної дози. Для конфігурації 2A, аеродинамічний розподіл за розміром окремих частинок повторює показаний на 4, 8 та 12 тижнях та на 8, 12 і 24 тижнях для конфігурації 2B. Хоча є виміряні фракції суспендовного ГП, розчинені у пропеленті, немає ніяких доказів укрупнення розмірів розрозділення. Крім того, про що свідчать ці Приклади, ефективність аерозолю спільної суспензії на прийнятній частинці, що суспендується, відносно ГП більшою мірою визначається за допомогою частинок, що суспендуються. Приклад 3 [0150] Кілька подібних партій частинок, що суспендуються, були зроблені, як описано у Прикладі 1. Частинки, що суспендуються, були об'єднані з частинками глікопіролату (ГП), які були тонко подрібнені в різній мірі, з використанням двох різних типів струменевих млинів з різними параметрами помелу. Оптичний діаметр і розподіл тонкоздрібнених частинок ГП за розміром був визначений за допомогою лазерної дифракції. У таблиці 3 наведені значення d50 та d90 для різних партій тонкоподрібненого матеріалу, що використовуються, d 50 та d90 позначають розмір частинок, при якому сукупний обсяг розрозділення, повідомлений за допомогою пристрою для розподілення частинок за розміром, досягає 50 % та 90 % відповідно. [0151] Дванадцять різних партій інгаляторів з відміряними дозами були одержані, як описано у Прикладі 1. У всіх випадках суспензійна концентрація ГП частинок у ГФА 134a була в діапазоні 0,32-0,45 мг/мл та суспензійна концентраціїя частинок, що суспендуються, була в діапазоні 5,86,1 мг/мл. Конфігурації вважалися досить схожими для об'єднання даних для мета-аналізу представленого в цьому Прикладі. [0152] Заповнені інгалятори з відміряними дозами зберігалися клапаном донизу без упаковки при двох різних умовах: в холодильнику при 5 °C і контрольованій кімнатній температурі 25 °C / 60 % ВВ. Ефективність аерозолю тестували, як описано у Прикладі 1, у різні моменти часу. Результати не показали статистично значимого тренду в залежності від часу аж до дванадцяти тижнів зберігання. Не було виявлено жодної помітної різниці між зберіганням при кімнатній температурі та в холодильнику. Відповідно, результати різних стресових умов та часових точок були об'єднані, щоб визначити як розподіл частинок за розміром тонкоподрібненого матеріалу впливає на ефективність аерозолю. [0153] У Таблиці 3 наведені результати мета-аналізу МСАД. У першій колонці описуються шість різних конфігурацій. У другій колонці показано скільки окремих партій були використані при складанні даних для відповідної конфігурації. Третя колонка показує кількість окремих визначень МСАД використовується для розрахунку середнього МСАД для відповідної конфігурації. Колонки чотири і п'ять показують d 90 та d50 тонкоподрібненого матеріалу, що використовується для виробництва спільних суспензій. Результати сортуються за значенням d 90 від грубого до дрібнодисперсного. Останні дві колонки показують середні МСАД і стандартне відхилення. 50 27 UA 109531 C2 Таблиця 3: Об'єднані результати МСАД для 12 спільних суспензій глікопіролату, відсортовані за d90 тонкоздрібнених частинок глікопіролату. ID партії 3A 3B 3C 3D 3E 3F 5 10 15 20 25 30 Кількість партій 3 2 1 1 3 2 Кількість вимірювань МСАД 21 9 6 4 20 10 D90 (мкм) d50 (мкм) Середній МСАД SD 5,0 4,9 4,8 4,3 4,1 3,5 1,8 2,1 1,8 1,7 1,6 1,7 4,0 4,1 3,6 3,5 3,7 3,6 0,28 0,37 0,12 0,22 0,28 0,10 [0154] Ці результати показують слабку залежність МСАД на d 90 тонкоподрібненого матеріалу. Аналогічний аналіз для d50 не показав статистично значимий тренд. Можна зробити висновок, що зміни у розподілі за розміром тонкоподрібненого матеріалу (наприклад, різні партії тонкоподрібненого матеріалу, або викликані трансформаціями, опосередкованими розчином) приводять лише до незначних змін в розподілі за об'ємом випущеного аерозолю з інгалятора з виміряними дозами. Приклад 4 [0155] Частинки тонкоподрібненого глікопіролату (ГП) були перевірено сформовані, як описано у Прикладі 1. Оптичний діаметр тонкоздрібнених частинок ГП був визначений і 50 % за об'ємом тонкоздрібнених частинок ГП були менші ніж 1,7 мкм, 90 % за об'ємом були менші ніж 3,8 мкм. [0156] П'ять партій частинок, що суспендуються, були зроблені, як описано у Прикладі 1. Партії відрізнялися за концентраціями, CF, і об'ємною часткою ПФОБ, VПФОБ, живильною емульсією до сушіння розпиленням, починаючи з 20 мг/мл до 160 мг/мл та 20 % до 40 %, відповідно. Різні конфігурації описані в Таблиці 4. [0157] Інгалятори з відміряними дозами були підготовлені за вагою цільової маси тонкоподрібненого ГП та частинок, що суспендуються, в покритих склом флаконах з об'ємом 15 мл. Цільові концентрації суспензій та частинок, що суспендуються, та до коефіціентів ГП, наведених в Таблиці 4 для 26 різних випробуваних флаконів. Контейнери були герметично запаяні за допомогою 63 мкл клапанів (Valois, Les Vaudreuil, Франція) та заповнені 10 г або 12 г ГФА 134a (1,1,1,2-тетрафторетан) (Ineos Fluor, Ліндхерст, Велика Британія) за допомогою надлишкового тиску через шток клапана. Після введення пропеленту, контейнери диспергували за допомогою ультразвуку протягом 15 секунд та струшували в струшувачі, який активується дією зап'ястя, протягом 30 хвилин. [0158] Як описано у Прикладі 1, тонкоздрібнені частинки ГП, сформовані окремо, швидко флокулюються та осаджуються. Скляні флакони в цьому прикладі залишали осідати протягом принаймні 24 год. без струшування і потім вони були перевірені шляхом візуального спостереження чи були спільно суспендовані повністю кристал, частинки ГП. Для флаконів відмічених "Так" у Таблиці 4, частинки ГП не були виявлені на дні флаконів, за винятком дуже небагатьох чужорідних частинок у деяких флаконах. Іноді чужорідні частинки було також видно у подібній дуже низькій кількості у флаконах, заповнених лише частинками, що суспендуються. Для флаконів відмічених "Частково", фракцію частинок ГП було видно на дні флакону. 28
ДивитисяДодаткова інформація
Назва патенту англійськоюCompositions for pulmonary delivery of long-acting muscarinic antagonists and long-acting b2 adrenergic receptor agonists and associated methods and systems
Автори англійськоюVehring, Reingard, Hartman, Michael, Steven, Smith, Adrian, Edward, Joshi, Vidya, B., Dwivedi, Sarvajna, Kumar
Автори російськоюВеринг Рейнхард, Хартман Майкл Стивен, Смит Эдриен Эдвард, Джоши Видя Б., Двиведи Сарваджна Кумар
МПК / Мітки
МПК: A61K 31/137, A61K 31/4015, A61M 15/00, A61K 9/10, A61P 11/00, A61K 9/12, A61K 9/16
Мітки: агоністів, тривалої, доставки, мускаринових, адренергічних, легеневої, композиції, пов'язані, антагоністів, системі, дії, способи, рецепторів
Код посилання
<a href="https://ua.patents.su/60-109531-kompozici-dlya-legenevo-dostavki-muskarinovikh-antagonistiv-trivalo-di-ta-agonistiv-adrenergichnikh-receptoriv-b2-trivalo-di-ta-povyazani-sposobi-i-sistemi.html" target="_blank" rel="follow" title="База патентів України">Композиції для легеневої доставки мускаринових антагоністів тривалої дії та агоністів адренергічних рецепторів b2 тривалої дії та пов’язані способи і системи</a>
Попередній патент: Композиції, способи та системи для доставки респіраторним шляхом двох чи більше активних агентів
Наступний патент: Макроциклічні інгібітори серинових протеаз гепатиту с
Випадковий патент: Спосіб виробництва низькожирної вершкової пасти