Ізольована послідовність днк, що кодує epsps фермент, ізольована послідовність днк, що кодує білок, який виявляє epsps активність, рекомбінантна двониткова молекула днк, спосіб одержання генетично трансформованих рослин
Номер патенту: 32548
Опубліковано: 15.02.2001
Автори: Беррі Джерард Френсіс, Кішор Ганеш Мерті, Педжетт Стефен Роджерс
Текст
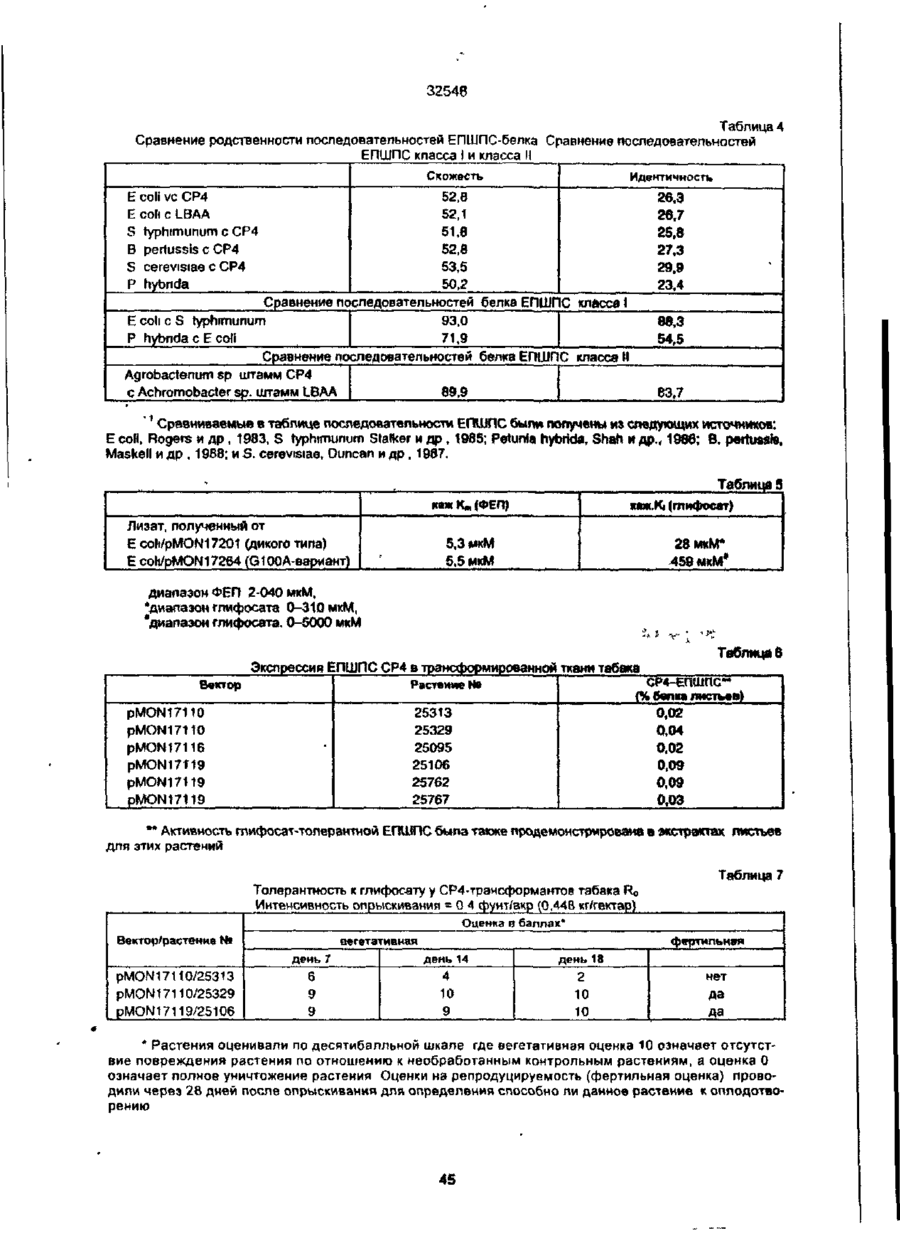
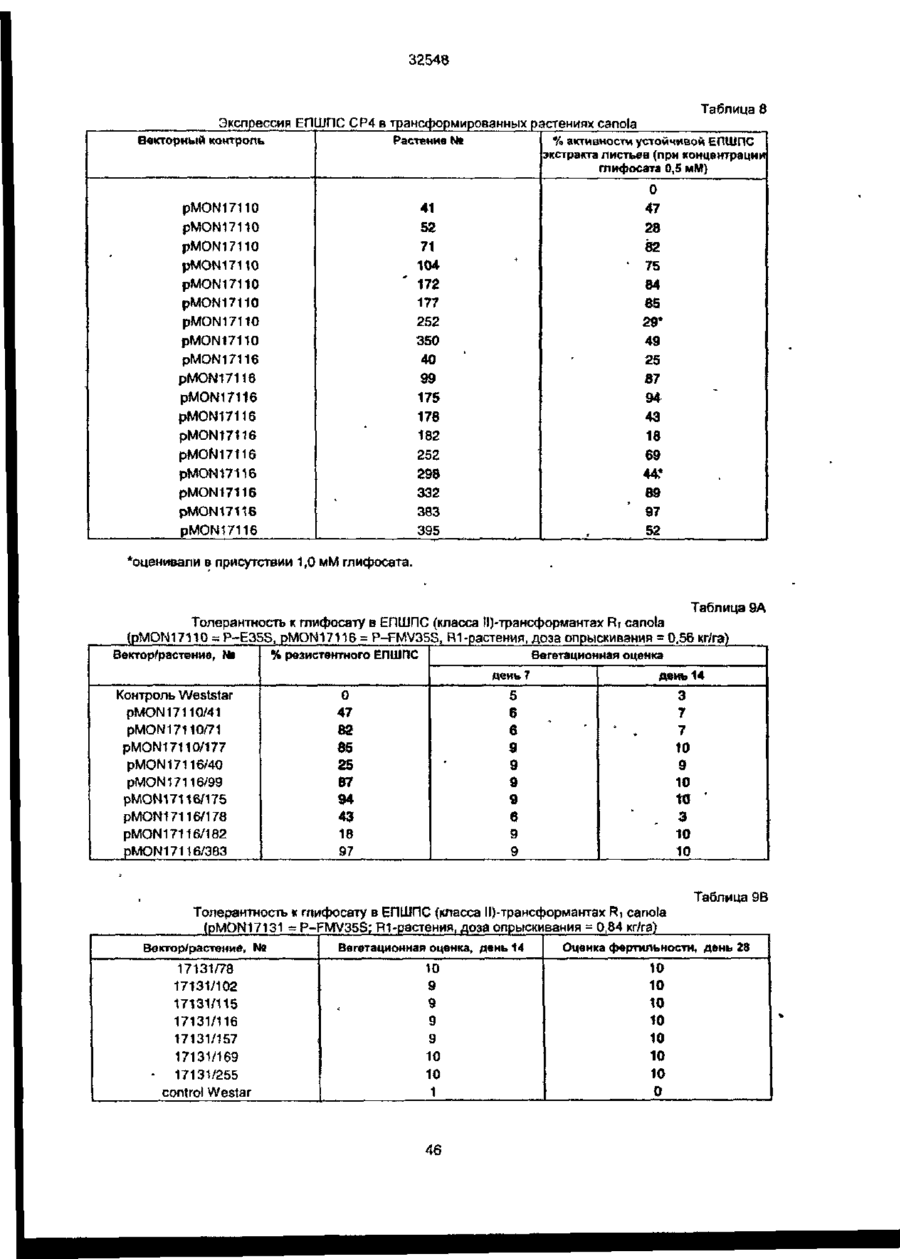
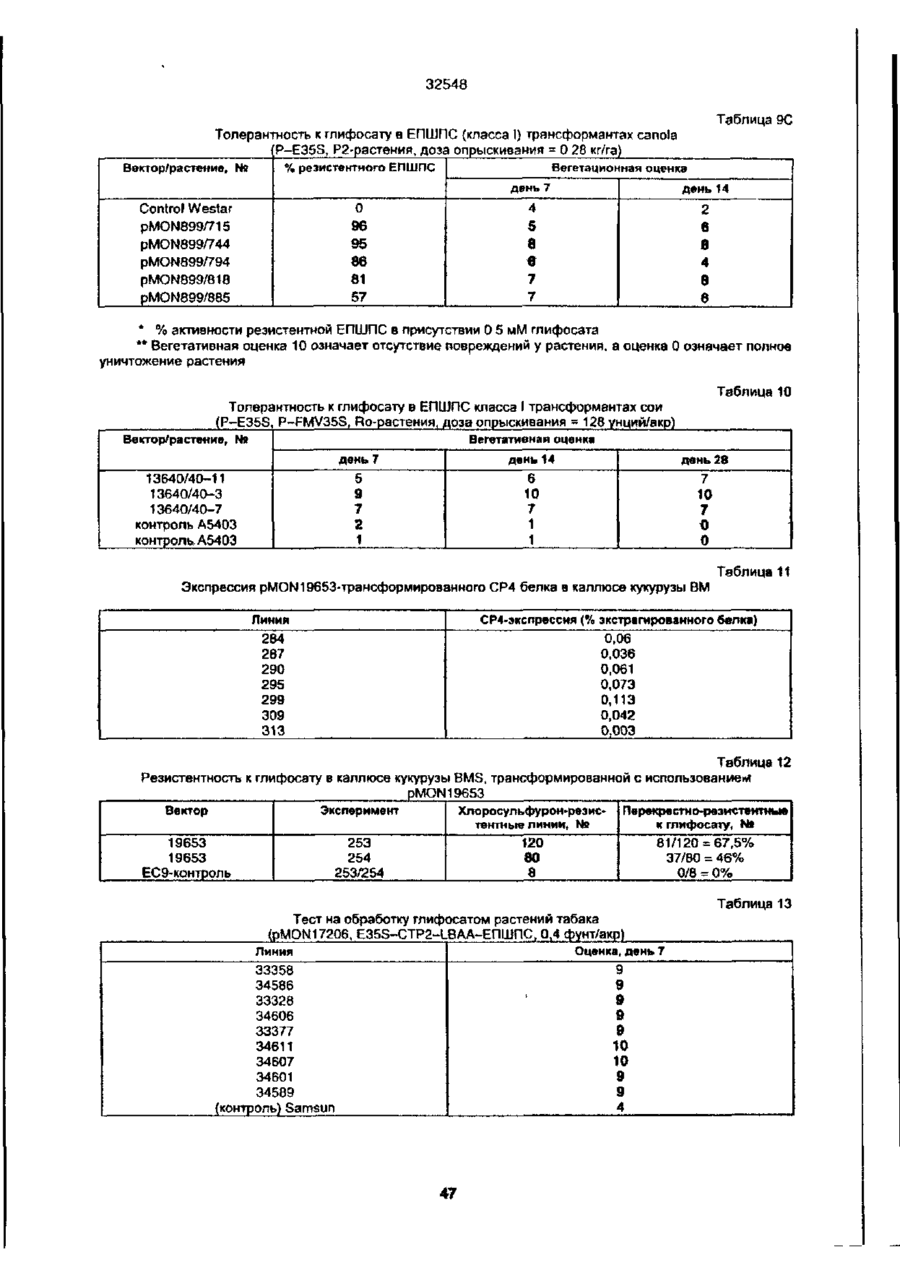
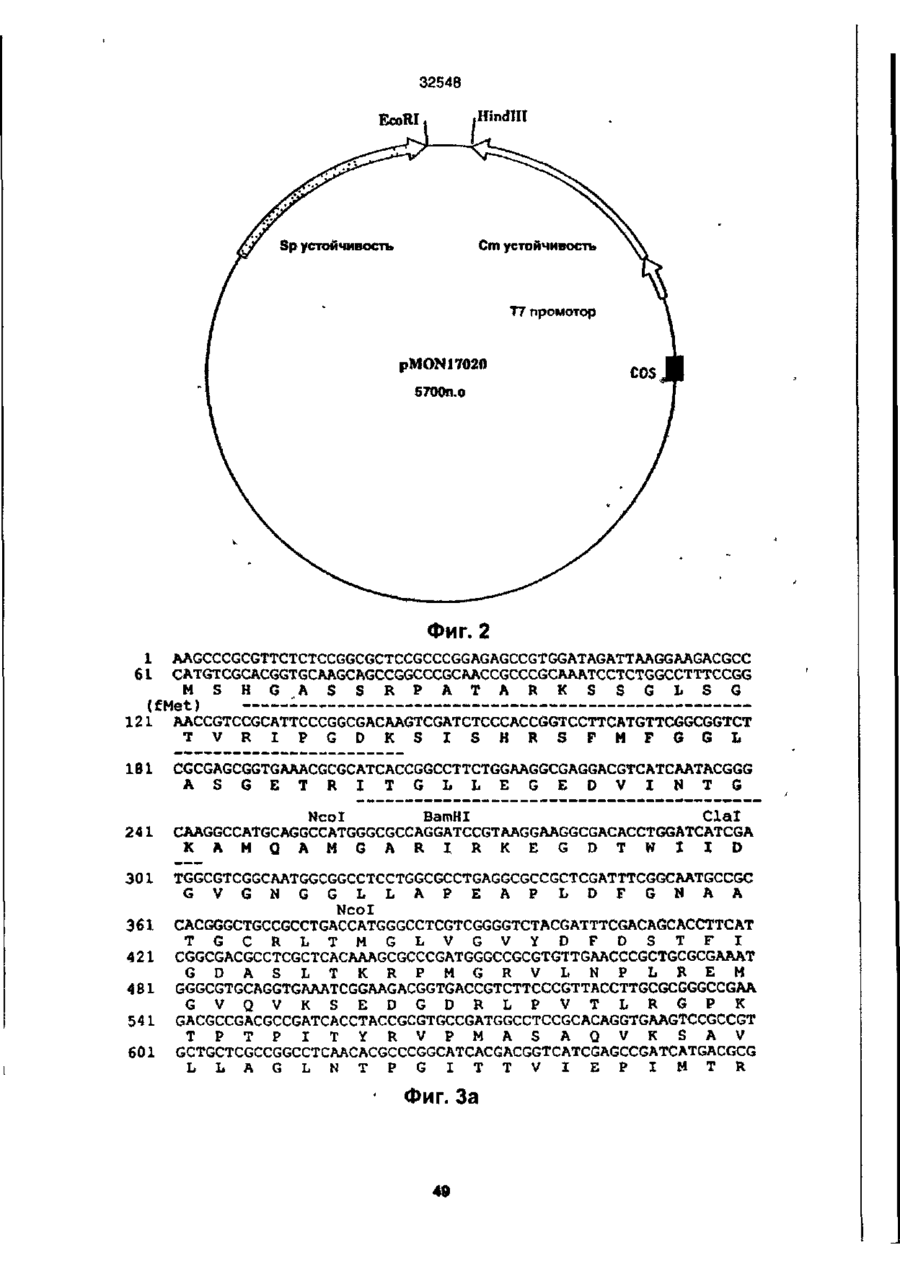
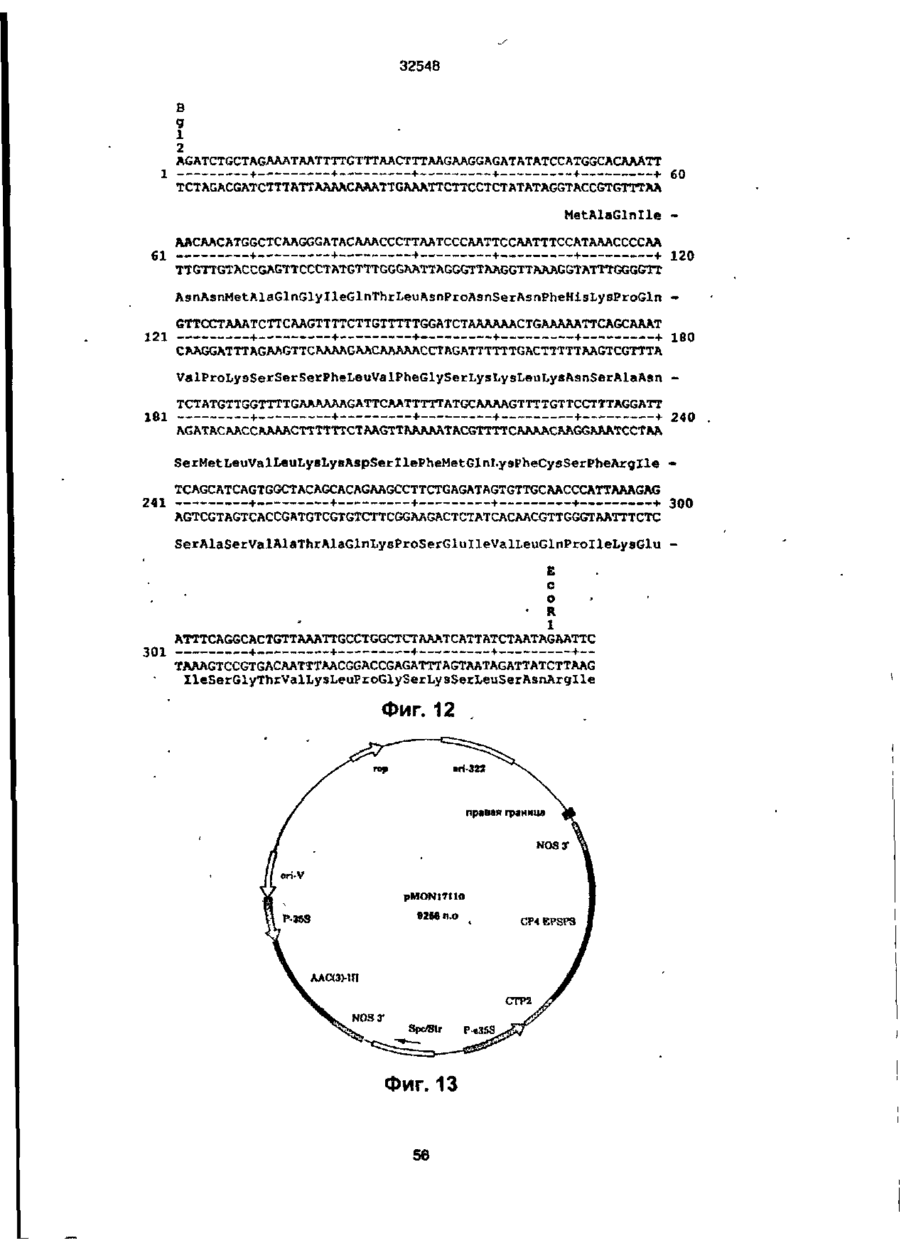
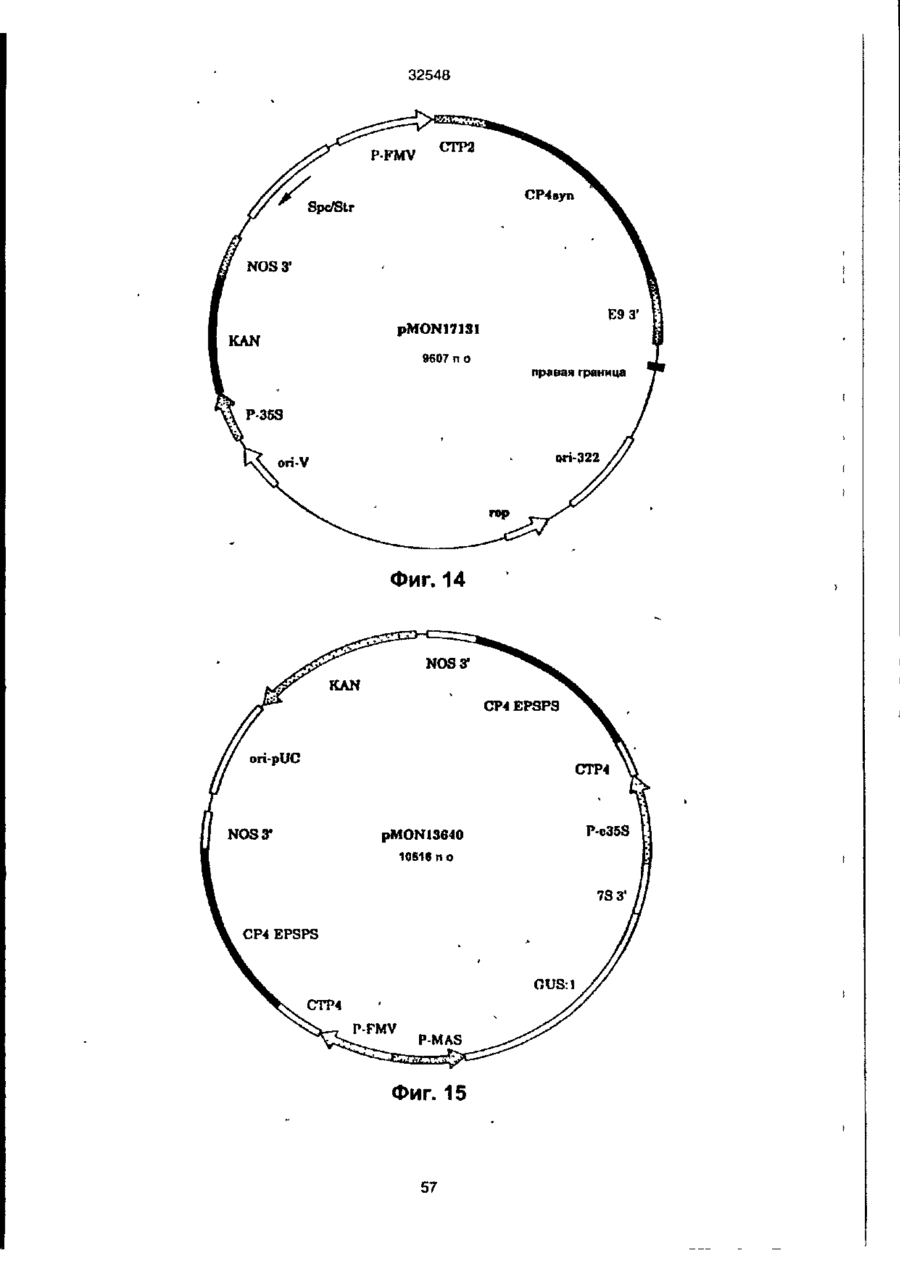
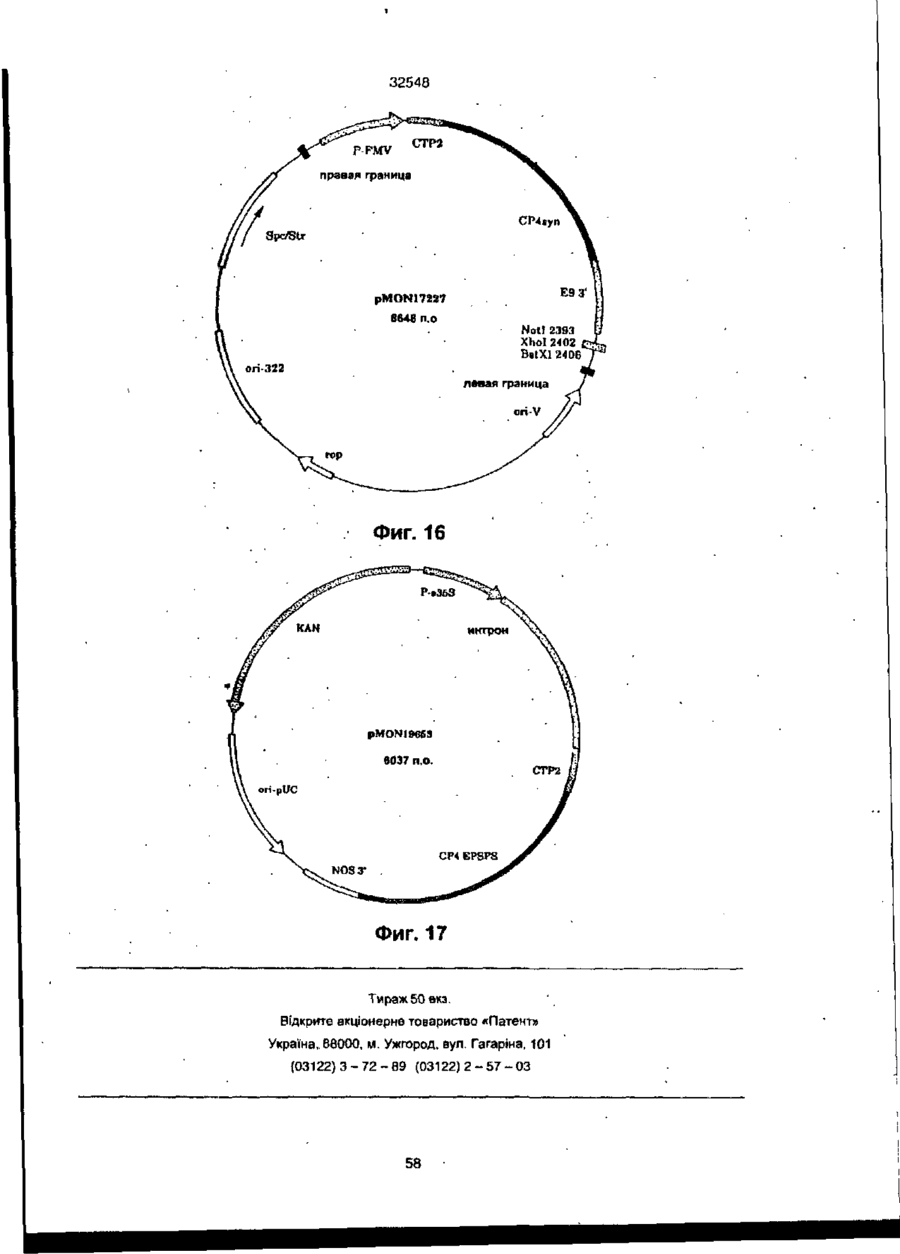
УКРАЇНА UA (ID 32548 аз) С2 (51) 7 C12N15/54, 15/62, 15/82 МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ ДЕРЖАВНИЙ ДЕПАРТАМЕНТ ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ ДО ПАТЕНТУ НА ВИНАХІД (54) ІЗОЛЬОВАНА ПОСЛІДОВНІСТЬ ДНК, ЩО КОДУЄ EPSPS ФЕРМЕНТ, ІЗОЛЬОВАНА ПОСЛІДОВНІСТЬ ДНК, ЩО КОДУЄ БІЛОК, ЯКИЙ ВИЯВЛЯЄ EPSPS АКТИВНІСТЬ, РЕКОМБІНАНТНА ДВОНИТКОВА МОЛЕКУЛА ДНК, СПОСІБ ОДЕРЖАННЯ ГЕНЕТИЧНО ТРАНСФОРМОВАНИХ РОСЛИН (21)94041118 (22)28.08.1991 (24) 15.02.2001 (31)576537 , • (32)31.08.1990 . (33) US • (86) PCT/US91/06148, 28.08.1991 (46) 15.02.2001, Бюп. № 1, 2001 р. (72) Беррі Джерард Френсіс (US), Кішор Ганеш Мерті (US), Педжетт Стефен Роджерс (US) (73) МОНСАНТО КОМПАНІ (US) (56) ЄР 0213571 А2, 15.04.87. " .7 ЕР 0293358 А2,30.11.88. . • US 4769061 А1, 06.09.88. . * • ':•' SU 1165314 А1, 07.07.85. . SU 1170991 А1. 07.08.85, (57) 1. Изолированная последовательность ДНК, кодирующая EPSPS фермент, имеющая Кп для фосфоенолпируеата (ФЕП) между 1-150 мкМ и Kj (глифосат)/Кп, (ФЕП) отношение между 3-500, причем указанная последовательность ДНК способна гибридизоваться с зондом ДНК, выбранным из группы последовательностей, включающей SEQ ID № 2, SEQ ID № 4 и SEQ ID № 6. 2. Последовательность ДНК по п. 1, отличающаяся тем, что указанный Km для фосфоенолпирувата находится между 2-25 мкМ. 3. Последовательность ДНК по п. 1, отличающая' ся тем, что указанное отношение К/Кт находится между 6-250. 4. Изолированная последовательность ДНК, кодирующая белок, который проявляет EPSPS активность, причем указанный белок способен взаимодействовать с антителами, индуцированными против фермента EPSPS класса II. 5. Последовательность ДНК по п. 4, отличающаяся тем, что указанный белок способен взаимодействовать с антителами, индуцированными против фермента EPSPS класса І1, выбранного из группы, состоящей из SEQ ID N» 3, SEQ ID № 5 и SEQ ID №7. 6. Последовательность ДНК по n, 5, отличающаяся тем, что указанные антитела индуцированы против фермента EPSPS класса И SEQ ID № 3. 7. Рекомбинантная двунитевэя молекула ДНК, состоящая из последовательности-, а) промотора, который функционирует в клетках растений, чтобы вызвать продукцию последовательности РНК, в) последовательности структурной ДНК, которая вызывает продукцию последовательности РНК, кодирующей фермент EPSPS класса И, и с) З'-нетранспируемой области, которая функционирует в клетках растений, вызывая присоединение отрезка из полиаденилнуклеотидов к З'-концу последовательности РНК, где промотор является гетерологичным по отношению к последовательности структурной ДНК и вызывает достаточную экспрессию слитого полипептида для усиления толерантности к глифосату клеток растений, трансформированных указанной молекулой ДНК. 8. Молекула ДНК по п. 7, отличающаяся тем, что указанная последовательность структурной ДНК кодирует слитый полипептид, представляющий собой аминоконцевой хлоропластный транзитный пептид и фермент EPSPS класса II. 9. Молекула ДНК по п. 8, отличающаяся тем, что указанная последовательность структурной ДНК, кодирующая фермент EPSPS класса II, выбрана из группы, состоящей из SEQ ID № 2, SEQ ID № 4 и SEQ ID №6. 10. Молекула ДНК по л. 9, отличающаяся тем, что указанная последовательность является SEQ ID № 2. 11. Молекула ДНК по п. 8, отличающаяся тем, что промотором является промотор ДНК вируса растений. 12. Молекула ДНК по п. 11, отличающаяся тем, что промотор выбран из группы, состоящей из промоторов CaMV35S и FMV35S. 13. Способ получения генетически трансформированных растений, которые являются толерантными к гербициду глифосату, отличающийся тем, что осуществляют следующие стадии: а) вставку в геном растительной клетки рекомбинантной двукитовой молекулы ДНК, состоящей из: і) промотора, который функционирует в клетках растений, вызывая продукцию последовательности РНК, ti) последовательности структурной ДНК, которая вызывает продукцию последовательности РНК% кодирующей слитый полипептид, состоящий из аминоконцевого хлоропластного транзитною пептида и фермента EPSPS класса Н, ні) З'-нетранслируемой последовательности ДНК, которая,, функционирует в клетках растений, вызывая присоединение последовательности попиаденилнуклеотидов к З'-концу последовательности РНК, где промотор является гетерологичным по отношению о 00 ю см со осат-толерантной ЕПШПС, необходимое для поддержания каталитической активности в растении, можно было уменьшить, либо можно было получить повышенную толерантность при том же уровне экспрессии Проведенные ранее исследования показали, что ЕПШПС-ферменты, происходящие от различных источников, широко варьируются а отношении степени их чувствительности к ингибированию глифосатом. Исследования зависимости активности растительных и бактериальных ЕПШПСферментоа от концентрации глифосата показали, что степень их восприимчивости к-глифосату варьируется в очень широких пределах. Однако какой-либо корреляции между степенью восприимчивости и испытуемыми видами обнаружено не было (Schulz и др., 1985) Было также установлено, что активность ЕПШПС, происходящей от 32548 Pseudomonas sp PG2982, не подвержена ингибированию гпифосатом, однако более подробно об указанных исследованиях не сообщается (Fitzgibbon, 1988) Хотя в литературе и сообщается в общих чертах о природной толерантности, однако при этом нет каких-либо конкретных указаний относительно кинетического преимущества натуральных бактериальных глифосат-толерантных ЕПШПС-ферментов по сравнению с мутантными ЕПШПС-ферментами, а также не имеется характеристик каких-либо генов Аналогично этому нет каких-либо сообщений, касающихся экспрессии натуральных глифосат-толерантных ЕПШПС-ферментов в растениях в целях сообщения им устойчивости к глифосату Настоящее изобретение относится к ДНКмолекуле, включающей в себя ДНК-последовательность, кодирующую кинетически эффективную, глифосат-толерантную ЕПШП-синтазу. Использование ЕПШП-синтаэ настоящего изобретения позволяет снизить количество сверхсинтеэируемого ЕПШП С-фермента в трансгенном растении, необходимое для поддержания каталитической активности фермента и, кроме того, позволяет наделить его толерантностью к глифосату Эта и другие ЕПШП-синтазы, описанные в настоящей заявке, представляют собой новый класс ЕПШПСферментов, обозначаемых далее ЕПШПС-ферментами класса II. Ферменты этого класса имеют небольшую гомологию с известными бактериальными или растительными ЕПШПС-ферментами и проявляют толерантность к глифосату, сохраняя при этом Km (ФЕГТ) В приемлемых пределах. Для ферментов ЕПШПС настоящего изобретения приемлемый диапазон значений Km (ФЕП) составляет от 1 до 150 мкМ, предпочтительно в пределах 1-35 мкМ, а наиболее предпочтительно 2-25 мкМ. Эти кинетические константы определялись в аналитических УСЛОВИЯХ, ОПределеННЫХ Н Ж Vma* фермеНИ Є та, предпочтительно, должно составлять, по крайней мере, 15% неингибированного растительного фермента, а более предпочтительно - более чем 25% Ki для глифосата ЕПШПС настоящего изобретения предпочтительно имеет значения в пределах 25-10000 мкМ. Отношение КУКт находится в пределах 3-500, а более предпочтительно - в пределах 6-250. Значение V ^ составляет предпочтительно от 2 до 100 ед/мг (мкМ/мин мг при 25°С), а значение Km для шикимат-3-фосфата составляет предпочтительно от 0,1 до 50 мкМ. Гены, кодирующие ферменты ЕПШПС класса II, были выделены из трех (3) различных бактерий: Agrobactenum tumefaciens sp штамм СР4, Achromobacter sp. штамм LBAA, и Pseudomonas sp штамм PG2982. Было установлено, что гены ЕПШПС класса И, происходящие от LBAA и PG2982, являются идентичными, а белки, кодируемые этими двумя генами, очень похожи на белок СР4 и имеют с ним приблизительно на 84% идентичных аминокислот. Ферменты ЕПШПС класса II могут быть легко дифференцированы от ферментов ЕПШПС класса I благодаря их неспособности реагировать с поликлональными антитипами, полученными от ЕПШПС класса І в условиях, при которых другие ферменты ЕПШПС класса I должны легко реагировать с антителами класса I. Другие ЕПШПС-ферменты класса II могут бьпъ легко выделены и идентифицированы с помощью нуклеиновокислотного зонда, полученного от одного из генов ЕПШПС класса II, описанных ниже, с использованием стандартной техники гибридизации. Зонд, полученный таким образом от штамма СР4, был использован для выделения ЕПШПС-генов класса II из штаммов LBAA и PG2982 Эти гены могут быть также адаптированы для усиления экспрессии в растениях с помощью известной методологии Указанный зонд может быть также использован для идентификации гомологичных генов в бактериях, выделенных de novo из почвы. Ферменты ЕПШПС класса II предпочтительно гибридизируют с транспортным пептидом хлоропласта (ТПХ) для доставки белка в хлоропласты растения, в которое он может быть введен. Химерные гены, кодирующие этот гибридный белок ТПХ-ЕПШП класса И", могут быть получены с использованием соответствующего промотора и сайта З'-полиаденилирования для введения в нужное растение стандартными способами. Таким образом, в одном из своих вариантов настоящее изобретение относится к новому классу ЕПШП-синтаз с низким значением Km для фосфоенолпирувата (ФЕП), с высоким отношением VmaVKi И ВЫСОКИМ ЗНЗЧЄНИЄМ К| ДЛЯ ГЛИфОСЭТЭ, КО торые при их введении в растение сообщают этому растению толерантность к гпифосату, сохраняя при этом каталитическую активность и поддерживая метаболизм растения, в основном, в нормальном состоянии. В данном обсуждении понятие "высокоэффективные ЕПШПС" относится к их эффективности в присутствии глифосата. В своем другом варианте настоящее изобретение относится к двухцепочечной ДНК-молекуле, содержащей ДНК-последовательность, кодирующую фермент ЕПШПС класса И Эта ДНК-последовательность была получена из трех источников: agrobactenum sp. штамм СР4, Achromobacter sp. штамм LBAA и Preudomonas sp. штамм PG2982. В еще одном варианте настоящего изобретения рассматривается нуклеиновокислотный зонд, происходящий от гена ЕПШПС класса И и подходящий для использовании в скрининге на наличие генов ЕПШПС класса И в других источниках, который осуществляют с помощью анализа способности ДНК-последовательности от другого источника гибридизироваться с зондом. В следующем варианте настоящего изобретения описываются трансгенные растения и трансформированные растительные клетки, которым сообщают толерантность к гпифосату путем введения гена ЕПШПС класса Н в геном растения. В другом варианте настоящего изобретения раскрывается рекомбинэнтная двухцепочечная ДНК-молекула, которая включает в себя последовательно: a) промотор, функция которого в растительной клетке заключается в том, что он стимулирует продуцирование РНК-последовательности, b) структурную ДНК-последовательность, которая стимулирует продуцирование РНК-последовательности, кодирующей фермент ЕПШПС класса II, c) 3' нетранслируемую область, функция которой в растительной клетке заключается в добав 32548 лении участка полиаденилнуклеотитов к 3' - концу РН К- последовательности; где промотор является гетерологичным по отношению к структурной ДНК-последовательности и обладает способностью стимулировать достаточную экспрессию гибридного полипептида для усиления їлифосат-толерантности растительной клетки, трансформированной с использованием указанной ДНК-молекулы В еще одном варианте настоящего изобретения раскрывается способ селективной борьбы с сорняками, произрастающими на полях с сельскохозяйственными культурами, который заключается в том, что на поля высаживают семена культурных растений или саженцы культурных растений, трансформированных с помощью гена ЕПШПС класса II в целях сообщения им толерантности к глифосату, которая позволяет обрабатывать культурное растение глифосат-содержащими гербицидами в целях избирательного уничтожения глифосат-восприимчивых сорняков, сохраняя при этом само культурное растение Другие варианты, цели и преимущества настоящего изобретения будут раскрыты ниже в процессе описания изобретения, сопровождающегося иллюстрациями, представленными ниже На фиг 1 показана ДНК-поспедовательность (SEQ tD № 1) для непроцессировэнного промотора вируса мозаики норичника шишковатого (FMV35S) На фиг 2 показан космидный вектор клонирования pMON17020 На фиг 3 показана структурная ДНК-последовательность (SEQ (D № 2) для гена ЕПШПС класса II, происходящего от бактериального изолята Agrobactenum sp штамма СР4, и выведенная аминокислотная последовательность (SEQ Ю №.3) На фиг 4 показана структурная последовательность ДНК (SEQ ID Na-4) для гена ЕПШПС класса И, происходящего от бактериального изопята Achromobacter sp. штамма LBAA, и выведенная аминокислотная последовательность (SEQ ID No 5) На фиг 5 показана структурная ДНК-последовательность (SEQ ID №6) для гена ЕПШПС класса II, происходящего от бактериального изолята Pseudomonas sp. штамма PG2982, и выведенная аминокислотная последовательность (SEQ ID № 7) На фиг. 6 показано Вestfit-сравнение аминокислотной последовательности ЕПШПС Е coif (SEQ ID №.8) с аминокислотной последовательностью для СР4-ЕПШПС (SEQ ID № 3) На фиг 7 показано сравнение (Bestfil) аминокислотной последовательности ЕПШПС СР4 (SEQ ID № 3) с аминокислотной последовательностью для ЕПШПС LBAA (SEQ ID Ns 5) На фиг. 8 показана структурная ДНК-последовательнбсть (SEO ID № 9) для гена ЕПШПС класса II СР4 На фиг. 9 показана ДНК-последовательность (SEQ ID Ns" 10) транспортного пептида хлоропласта (СТР) и кодированная аминокислотная последовательность (SEQ ID № 11), происходящая от ЕПШПС-ТПХ Azabidopsis thaliana и содержащая Sphl-сайт рестрикции в области процессинга хлоропласта, обозначаемый далее СТР2. На фиг 10 показана ДНК-пооледовательность (SEQ ID № 12) транспортного пептида хлоропласта и кодированная аминокислотная последовательность {SEQ ID №13), происходящая от ЕПШПС-гена Azabidopsis thaliana и содержащая EcoRI-сайт рестрикции внутри зрелой области ЕПШПС, обозначаемой далее СТРЗ. На фиг 11 показана ДНК-последовательность (SEQ ID № 14) транспортного пептида хлоропласта и кодированная аминокислотная последовательность (SEQ ID №'.15), происходящая от ЕПШПС-ТПХ Petunia hybrida и содержащая Sphlсайт рестрикции в области процессинга хлоропласта, в которой в области процессинга проводили замену аминокислот Cys-Met (обозначаемой далее СТР4). На фиг 12 показаны ДНК-последовательность (SEQ ID №.16) транспортного пептида хлоропласта и кодированная аминокислотная последовательность III/NOS З'-ген кодирует резистентностъ к гентамицину, которая позволяет проводить отбор трансформированных клеток растения pMON979 также содержит полигенный экспрессирующий кластер (0 95 ко), состоящий из усиленного промотора CaMV 35S (Kay и др , 1987), несколько уникальных рестриюдионных сайтов, и NOS З'-конец (P-ETVCaMV35S/NOS 3') Оставшиеся pMON979-flHKсегменты были точно такими же как и в pMON886 Плаэмида pMON886 состояла из следующих сегментов ДНК Первым из них был 0,93 кЬ-Aval встроенный EcoRV-фрагмент, выделенный из транспозона Тп7, который кодирует резистентность к спектиномицину/стрептомицину (Spc/Str), которая является детерминантной для селекции в Е coli и Agrobactenum tumefaciens. Этот фрагмент соединяют с 1,61 кЬ-сегментом ДНК, кодирующим химерную резистентностъ к канамицину, позволяющую производить отбор трансформированных клеток растения Химерный ген (P-35S/KAN/NOS 3') состоит из промотора вируса мозаики цветной капусты (CaMV)35S, гена неомицин-фосфотрансферазы типа II и 3" - нетранслируемой области гена нопалинсинтазы (NOS 3') (Fraley и др , 1983) Следующий сегмент представлял собой 0,75 кЬ onV, содержащий сайт инициации репликации от плазмиды RK2 Этот сегмент соединяли с 3,1 кЬ Sall-Pvul-сегментом из pBR322 (on 322), который вносил сайт инициации репликации для поддерживания в Е coll и bom-сайт для конъюгативного переноса в клетки Agrobactenum tumefaciens. Следующий сегмент представлял собой 0,36 xb- PvulBcll-фрэгмент от pTi T37, несущий правый край Т ДНК нопапин-типа (Frafey и др , 1985) Вектор pMON977 является аналогичным pMON981 за исключением того, что в нем вместо промотора FMV35S присутствует промотор Р-ЕпCaMV35S (см ниже) Ппазмидэ pMON981 содержит следующие ДНК-сегменты 0,93 кЬ-фрапиент, выделенный из 15 32548 содержащей в данном случае прШ-ген (устойчивость ,к канамицину, KAN) от ТпЭОЗ, который является селектируемым маркером в Е coli СТР4-ЕПШПС-геиный гибрид экслрессируется от промотора РFMV35S и содержит фрагмент последовательности полиаденилирования NOS 3', и от второго кластера, состоящего из E35S-npoMOTopa. СТР4~СР4-генного гибрида и последовательности NOS 3'. Ген детектируемого маркера G (Tefferson и др, 1987) экспрессируеіся от промотора маннопинсинтээы (P-MAS), и З'-последовательностей гена запасного белка сои 7S (Schuler и др, 1982) Могут быть также получены аналогичные плазмиды, в которых СТР~СР4ЕПШПС-гибриды экспрессируются от усиленного промотора или других растительных промоторов. Могут быть также изготовлены и другие векторы, подходящие для доставки свободной ДНК в растения, и не выходящие, при этом, за рамки объема и сущности настоящего изобретения. Регенерация растений Если экспрессия гена ЕПШПС класса II успешно осуществляется в трансформированных клетках (или протопластах), то эти клетки (или протопласты) могут быть регенерированы в целые растения. Выбор методики для стадии регенерации не является решающим для настоящего изобретения, при этом могут быть выбраны подходящие схемы для соответствующих хозяев, таких как бобовые (люцерна, соя, клевер, и т п ), зонтичные (морковь, сельдерей, пастернак), крестоцветные (капуста, редька, семя рапса, и т п ) , тыквенные (дыня и огурец), злаковые (пшеница, рис, кукуруза и т п.), пасленовые (картофель, табак, томат, перец), различные культуры, а также деревья, такие, как тополь или яблоня, ореховые культуры или виноградные растения См.» например, Ammirato, 1984; Shimamoto 1989, Fromm 1990; Vasie 1990. Для более ясного понимания настоящего изобретения, ниже приводится подробное описание его практического осуществления, однако приведенные примеры не должны рассматриваться как некое ограничение настоящего изобретения И каждому специалисту понятно, что в описанные методы и гены могут быть внесены различные модификации и изменения, которые однако не выходят за рамки объема и сущности настоящего изобретения В приведенных ниже примерах ЕПШПС-активность в растениях оценивали следующим способом Образцы ткани собирали и сразу замораживали в жидком азоте Один грамм ткани молодых листьев замораживали в ступке с жидким азотом и пестиком тонко измельчали в порошок. Затем этот порошок переносили во вторую ступку, добавляли экстрагирующий буфер (1 мл/г) и образец измельчали еще 45 сек Экстрагирующий буфер для Canoia включает в себя 100 мМ Трис, 1 мМЭДТК, 10% глицерина, 5 мМ ДТТ. 1 мМ ВАМ, 5 мМ аскорбата, 1,0 мг/мл БСА, рН 7,5 (4°С). Экстрагирующий буфер для табака включает в себя 100 ММ Трис, 10 мМ ЭДТК, 35 мМ ЭДТК, 35 мл KCI, 20% глицерина, 5 мМ ДТТ, 1 мМ ВАМ, 5 мМ аскорбата, 1,0 мг/мл БСА, рН 7,5 (4°С) Полученную смесь переносили в пробирки для микроцентрифугирования и центрифугировали 5 минут Полученные супернатанты обессоливали на роторных колонках G-50 (Pharmacia), предварительно уравновешенных экстрагирующим буфером (без БСА), транспозона Тп7, кодирующего бактериальную резистентность к спектиномицину/стрептомицину [Spc/Str. детерминанта для селекции в Е coli и Agrobactenum tumefaaens (Fling и др , 1985)]; химерный ген устойчивости к канамицину, сконструированный для экспрессии в растении в целях осуществлений селекции трансформированной ткани и состоящий из 0,35 ко-промотора вируса мозаики цветной капусты (P-35S) (Odelt и др., 1985), 0,83 кЬ-гена неомицин-фосфотрансферазы типа II (KAN), и 0,25 кЬ-3' - нетранслируемой области гена нопалинсинтазы (NOS 3') (РгаЧу и др , 1983), 0,75 кЬ-сайта инициации репликации от плазмиды RK2 (onV) (Stalker и др , 1981), 3,1 кЬ Satl-Pvul-сегмента pBR322, который обеспечивает наличие области инициации репликации для выдерживания в Е colt (оп-322) и bom-сайта для конъюгативного переноса в клетки Agrobacterium lumefaciens и 0,36 Kb-Pvul-Bclt-фрагмент от pTi Т37-плазмиды, содержащий область правого края Т-ДНК нопалин-типа (Fraley и др , 1985) Полигенный экспрессирующий кластер состоит из 0,6 кЬпромотора 35S от вируса мозаики норичника (РFMV35S) (Gowda и-др , 1989) и 0,7 кЬ-3'-нетранслируемой области от гена rbcS-E9 гороха (Е9 3') (Coruzri и д р , 1984, и Morelti и др., 1985) 0,6 кЬSspJ-фрагмент, содержащий промотор FMV35S (рис. 1), был сконструирован для введения соответствующих сайтов клонирования за в прямом направлении сайтом инициации транскрипции. СТР2-СР4-ЕПШПС-генный гибрид был введен в векторы экспрессии (включая pMON981, с образованием pMON17131, рис. 14) и трансформирован в табаке, канола (canola), картофеле, томате, сахарной свекле, хлопчатнике, латук-салате, огурце, масличном рапсе, тополе и Arabidopsis. Растительный вектор, содержащий геи ЕПШПС класса И, может быть введен в любой подходящий штамм агробактерии для трансформации нужных видов растений. Этот вектор может быть введен в штамм АВ1 агробактерии. Подходящим АВ1-штаммом является А208 agrobactenum tumefaciens, несущий обезвреженную Tt-плазмиду рТ,С58 (рМРЭОЯК) (Koncz и Schell, 1986) Т,-плазмида не содержит Т-ДНК-гены фитогормонов и поэтому она не может вызывать корневой рак растений Спаривание растительного вектора в АВ1 осуществляли с помощью системы конъюгирования трех родителей, используя хелперную плазмиду pRK2013 (Ditla и др , 1980) Если растительную ткань инкубируют с конъюгатом АВ1 растительный вектор, то вектор переносят в растительные клетки посредством vir-функций, кодированных обезвреженной ппазмидой рТ,С58. Вектор начинается в области правого края Т-ДНК, и полная последовательность растительного вектора может быть введена в хромосому растения-хозяина "Г-плазмида рТ,С58 не переносится в клетки растения, а остается в агробактерии Векторы свободных ДНК ЕПШПС класса I! Гены ЕПШПС класса II могут быть также введены в растения посредством прямой доставки Были сконструированы несколько векторов прямой доставки для СР4~ЕПШПС-гена Здесь описан вектор рМОМ 13640, карта которого показана на рис 15 Этот плазмидный вектор построен на основе ппазмиды pVC (Viesra и Messmg, 1987, 16 32548 в 0,25 мл - апиквотах Обессоленные экстракты анализировали на ЕПШПС-активность радиоактивной ВЭЖХ Концентрации б е т а в образцах определяли с помощью микробепкового анализа BioRad с использованием БСА в качестве стандарта Концентрации белка определяли с помощью метода BioRad Microprotein БСА использовали для построения стандартной кривой в пределах 2— 24 мкг 800 мкп стандартного или разведенного образца смешивали с 200 мкп концентрированного реагента Bradford BioRad Образцы интенсивно перемешивали и примерно через 5 минут проводили считывание данных при А(595), которые затем сравнивали со стандартной кривой Смесь для анализа фермента ЕПШПС содержала HEPES (50 мМ), шикимат-3 фосфат (2 мМ), Ш-молибдат (0,1 мМ) и KF (5 мМ), в присутствии (0,5 или 1,0 мМ) или в бтсутствив глифосвта Аналитическую смесь (30 мкл) и экстракт растений (10 мкл) предварительно инкубировали в течение 1 минуты при 25°С, после чего реакции инициировали путем добавления 1 С-ФЕП (1 мМ) Реакции гасили через 3 минуты добавлением 50 мкп 90% ЕЮН/0 1 М НОАс, рН 4,5 Затем образцы центрифугировали при 6000 об/мин и полученные супернзтанты анализировали на продуцирование 'Х-ЕПШПС с помощью ВЗЖХ Процент ЕПШПС рассчитывали, исходя из ЕПШПС-активностей в присутствии и в отсутствии глифосата Процент превращения 14С меченной ФЕП в 14 С-£ПШПС определили с помощью ВЭЖХ-радиоактмвного анализа с использованием С18-колонхи (Brownlee) и ВЭЖХ-колонки AX100 (0,4 з 25 с см, Synchropak), злюируя 0,26 М фосфата калия, рН 6,5 при 1 мл/мин Начальные скорости подсчитывали путем умножения фракционной конверсии за единицу времени на начальную концентрацию меченного субстрата (1 мМ) Этот анализ был линейным, при этом время составляло до 3 минут, а конверсия в ЕПШПС 30% Для получения результатов внутри линейного интервала -образцы разводили 10 мМ Трис, 10% глицерина, 10 мМ ДТТ, рН 7,5 (4°С) если это необходимо В этих анализах DL-дитиотреитол (ДТТ), бенэамидин (БАМ) и бычий сывороточный альбумин (БСА, в основном, не содержащий глобулина) были получены от Sigma Фосфоєнолпируват (ФЕП) был получен от Boehnnger Mannheim, a фосфоенол-11-1 С]пируват (28 мКи/мМ) - от Amersham Пример 1. В этом примере получали растения табака, трансформированные рядом ЕПШПС кл И-генных векторов, содержащих СР4-ЕПШПС-ДНК-последовательность (описанную выше), посредством соответствующей экспрессии ЕПШПС Эти трансформированные растения обладают устойчивостью к глифосату, сообщенную им ферментом ЕПШПС СР4 класса II Трансформацию табака проводили по схеме, в которой использовали здоровую ткань листьев (диски листьев) возрастом около 1 месяца После 15~20-минутной стерилизации поверхности с использованием 10% СІогох + ПАВ листья три раза погружали в стерильную воду Затем, используя стерильный перфоратор для бумаги, получали диски листьев и помещали их верхней стороной вниз на среду MS104 (MS-соли, 4 3 г/л, 30 г/л сахарозы, 500 х 2 мл/г витаминов В5, 1,1 мг/л NAA, и 1,0 мг/л БА) для однодневного предварительного культивирования Затем диски инокулировали ночной культурой обезвреженного АВ1-штамма агробактерии, содержащего вышеупомянутый вектор, с 1/5-раэведением (те около 0,6 ОП) Инокупяцию осуществляли путем помещения этих дисков в центрифужные пробирки ©месте с культурой Через 30-60 секунд жидкость спивали, а диски подвергали блотированию на стерильную фильтровальную бумагу Затем эта диски помещали верхней стороной вниз на чашки с питательной средой MS104 для соаместиого культивирования с дисками на фильтре После 2-3-дневного совместного культивиро» вания диски переносили (верхней стороной вниз) на селекционные чашки со средой MS 104 Через 2 3 недели образовывалась каллюсная ткань и ее отдельные скопления отделяли от дисков растений Если побеги были достаточно большими и явно отличались от стеблей, то их аккуратно вырезали из каллюса Эти побеги помещали на корнеобразующую среду, не содержащую гормона (MSO. MS-coли, 4,3 г/л, сахароза, 30 г/л, и витамин В5, 500 х 2 мл/л) для селекции на соответствующую реэмстентность к антибиотику Образование корней происходило за 1-2 недели Все анализы с использованием листового каллюса проводили лредпочппвльно на корневых побегах в условиях стерильносте. З&тэы корневые побеги высаживали з почву и выдержм&алм в условиях высокой влажности (те. в пластиковых сосудах или пакетах) Корни укрепляли путем постепенного доведения влажности ДО влажности окружающей среды. Экспрессия СР4-ЕПШПС-белка в трансформированных растениях Клетки табака были трансформированы с помощью ряда растительных векторов, содержащих нативный СР4-ЕПШПС-г©н, и с использованием различных промоторов и/или СТР Предварительное подтверждение экспрессии гена давала оценка способности листовой ткани, полученной из антибиотически селектированных трансформированных побегов, к образованию каллюса на глифосате В некоторых случаях глифосат-тояерантиый каплюс отбирали непосредственно после трансформации Уровень экспрессии СР4ЕПШПС определяли с помощью уровня активности гпифосат-толерантной ЕПШПС (оценку проводили в присутствии 0 5 мМ глифосата) или с помощью Вестерн-блот-анализа с использованием антитела против СР4-ЕПШПС Количественную оценку вестерн-блотов проводили путем слежения с помощью денситометра и сравнения со стандартной кривой, построенной с использованием очищенной СР4-ЕПШПС Эти данные представлены как % растворимого белка листьев В таблице в (см ниже) представлены данные, полученные для ряда трансформированных линий растений и векторов трансформации Толерантность к глифосату была также проиллюстрирована для трансформированных растений табака на уровне целого растения СТР2СР4-ЕПШП С -трансформ анты табака Ro опрыскивали глифосатом при дозе 0,4 фунт/акр (0,448 17 32548 кг/гектар), которая является достаточной для уничтожения контрольных нетрансформированных табачных растений с соответствующей оценкой 3, 1 и 0 за 7, 14 и 28 дней, соответственно, и анализировали на вегетацию и релродуцируемость (таблица 7). Пример 2. Были трансформированы растения canola (очевидно, рапсовое растение - прим пер) с использованием векторов pMON17110, pMON17116 и pMON17131, в результате чего были получены несколько линий трансформированных -^астений canola с устойчивостью к глифосату. Растительный материал. Саженцы Brasstca napus cv Westar были высажены в 2"~ (-5 см) - горшки, содержащие Metro Mix 350 Эти саженцы выращивали в вегетационной камере при 24°С, с фотопериодом 16/8 час и интенсивностью света 400 мкЕ 2 сек"1 (НЮ-лампы). При этом вносили специальные удобрения с использованием Peters 20-10-20 General Рифове Special Через 2,5 недели саженцы пересаживали в 6-дюймовые (~15 см)-горшки и выращивали в вегетационной камере в условиях температурного режима 15°С/10°С день/ночь, фотопериода 16/8 часов, интенсивностью света 800 мкЕ сек"1 {H1Dлампы). Подкормку удобрениями проводили с использованием Peters 15-30-15 Hi-Phos Special. Трансформация/селекция/регенерация. У растений до их стрелкования или в период стрелкования (но до цветения) удаляли 4 конечных междоузлия, и их поверхность в течение 1 минуты стерилизовали в 70% (по обьему) в течение 20 минут в 2% масс/об, в гидрохлорите натрия и 3 раза погружали в стерильную деионизованнуго воду Стебли с имеющимися на них листьями до стерилизации могут храниться в холодильнике во влажных пластиковых пакетах до 72 час. 6-7 сегментов стебля разрезали на 5-миплиметровые диски с помощью машины для резки (Pedco Vegetaaie Slicer 200) по направлению к основанию стебля. Агробактерии культивировали в течение ночи на качалке при 24°С в 2 мл-1_-бульоне, содержащем 50 мг/л канамицина, 24 мг/л хлорамфеиикола и 100 мг/л спекгиномицина. Затем осуществляли разведение 1:10 в MS-среде (Murashige и Skoog), получая приблизительно 9 х 108 клеток на мл Это подтверждалось измерением оптической лпотности при 660 нм. Полученные диски стебля (экспланты) инокулировали 0,1 мл агробактерии, а избыток отсасывали из эксллантов. Экспланты помещали (вниз той стороной, которая является как бы основанием сегмента стебля) на чашки Петри, содержащие 1/10 х стандартные MS-соли, витамины В5, 3% сахарозу, 0,8% агар, рН 5,7, 1,0 мг/л 6-бензиладенина (БА). Эти чашки покрывали слоем среды (1,5 мл), содержащей MS-соли, витамины В5, 3% сахарозу, рН 5,7, 4,0 мг/л п-хлорофеноксиуксусной кислоты, 0,005 мг/л кинетина. а затем сверху накрывали стерильной фильтровальной бумагой После 2-3-дневного совместного культивирования экспланты переносили в глубокие чашки Петри содержащие MS-соли, витамины В5, 3% сахарозу, 0,8% агар, рН 5,7, 1 мг/л БА. 500 мг/л карбенициллина, 50 мг/л цефотаксима, 200 мг/л канамицина или 175 мг/л гентамицина, для осу ществления селекции. В каждую чашку помещали семь эксплантов. Через 3 недели их переносили на свежую среду, 5 эксплантов на чашку. Эти эксплзнты культивировали в вегетационной камере при 25°С в условиях непрерывного освещения (лампа холодного белого света). Анализ на экспрессию. Через 3 недели из эксплантов вырезали побеги. Анализ на образование вторичного листового каллюса проводили для подтверждения модификации Ro-no6eroB. Три крошечных кусочка ткани листа помещали на каллюс-образующую среду, содержащую MS-соли, витамины В5, 3% сахарозу, 0,8% агар, рН 5,7, 5,0 мг/л БА, 0,5 мг/л нафталинуксусной . кислоты (NAA), 500 мг/л карбенициллина, 50 мг/л цефотаксима, и 200 мг/л канамицина или гентамицина или 0,5 мМ глифосата. Эти образцы листьев инкубировали в вегетационной камере в тех же условиях, что культуру зксплантов. Через 3 недели биопробу на повторное образование листового каллюса оценивали на толерантность к гербициду (каллюсной ткани или ткани зеленого листа) или восприимчивость к гербициду (побеление). Пересадка. При вырезании стебли побегов погружали в Rootone® и высаживали в 2й (-5 см)-горшки, содержащие Metro-Mix 350 и находящиеся в условиях, близких к условиям влажного климата. Затем их помещали в вегетационную камеру при 24°С, с периодом день/ночь = 16/8 часов при освещении с интенсивностью 400 мкЕ"1 сек"2 (НГО-лампы) приблизительно на 3 недели для закаливания. Семена, собранные от Ro-растений, являются Ri-семенами, из которых происходят Ri-растения Для оценки устойчивости к глифосату Ro-pacтения исследовали его потомство Поскольку, как предполагается, Ro - растение является гемизиготным в месте локализации каждой вставки, то самоопыпемие приводит к максимальной генотипической сегрегации в Ri. Поскольку каждая вставка действует как доминантный аллель, то в отсутствии сцепления и в предположении, что для экспрессии толерантности требуется лишь одна гемизиготная вставка, одна вставка будет давать сегрегацию 3.1, две вставки 15:1, три вставки 63:1, и т.п Поэтому для того, чтобы выявить, по крайней мере, один резистентный фенотип, необходимо культивировать относительно небольшое число Ri-растений. Семена от Ro-растений собирали, обмолачивали и осушали, а затем высаживали для проведения теста с опрыскиванием глифосатом. Для выращивания растений в целях проведения оценки Ri-опрыскивания может быть использована различная методика. Тесты проводили как в теплицах, так и вегетационных камерах Были использованы две схемы посадки -10 см - горшки или ящики для посадки, содержащие 32 или 36 ячеек. Для выращивания растений использовали либо почву Мєіго 350 + три типа удобрений с медленным высвобождением, либо садовую почву Metro 350 В теплицах проводили орошение дождеванием, а в вегетационных камерах проводили подпочвенное орошение. Удобрение, как и полагается, вносили в оросительную воду При этом поддерживали температурный режим, приемлемый для canola. Фотопериод составлял 16 часов. 18 32548 В начале стадии цветения растения пересаживали в 15 см-горшки для получения семяч "Партия" для опрыскивания состояла из нескольких саженцев Ri потомства которые все были опрысканы в тот же день Некоторые партии могут также включать в себя и другие Ri-растения для оценки Каждая партия также включает в себя обработанные и необработанные нетрансгенные генотипы, представляющие генотипы в определенной партии, предположительно являющиеся трансформированными В партии также имеется один или несколько нерасщеп л яюидихся трансформированных генотипов, которые ранее были идентифицированы как имеющие некоторую реэистентность Два-шесть растений от каждого отдельного Ro-потомства не обрабатывали и они служили в качестве контрольных растений для сравнения и измерения толерантности к глифосату, а также для оценки любой изменчивости, не вызываемой глифосатом Когда другие растения достигают стадии 2-4 листа (обычно через 10-20 дней после посадки), их опрыскивают глифосатом в дозе, колеблющейся от 0,23 до 1.12 кг/га, в зависимости от целей исследования Применялась технология с использованием низких доз и объемов Лабораторный гусеничный опрыскиватель был калиброван для подачи дозы, эквивалентной норме, используемой в попеных условиях Для опрыскивания растений, испытуемых на вегетативную устойчивость, использовали десятибалльную шкалу 0-10 Эта шкала относится к необработанным растениям, полученным из одного и того же Ro-растения О означает полное уничтожение растения, а 10 указывает на видимое отсутствие каких-либо отличий от необработанного растения Более высокий балл в пределах указанной шкалы 0-10 означает меньшие повреждения растения по сравнению с необработанным растением Растения оценивали на 7, 14 и 28-й день после обработки (DTA) или до стрелкования, и давали среднюю оценку обработанным растениям в пределах семейства Ro-растений Для качественной оценки степени нарушения репродуктивное™ растения вследствие обработки глифосатом использовали шесть числовых оценок 0. не происходит развития цветочных почек, 2 цветочные почки присутствуют, но их развитие прекращается еще до распускания, 4 цветки распускаются, но пыльники отсутствуют, либо эти пыльники не способны проталкивать опавшие лепестки, 6 стерильные пыльники, - 8 частично стерильные пыльники, 10 полностью плодоносные цветки Растения оценивали по этой шкале сразу после начала цветения или чуть-чуть позже, в зависимости от степени развития цветковой структуры Экспрессия ЕПШПС в Canola Через 3 недели трансформированные растения canota анализировали на присутствие активности глифосат-толерантного фермента ЕПШПС (оценивали в присутствии глифосэта в концентрации 0,5 ММ) Результаты показаны в таблице 8 Затем R,-трансформанты canola культивировали в вегетационной камере, опрыскивали гли фосагом в дозе 0 56 кг/іа и проводили оценку на вегетацию Полученные результаты представлены в таблице GA-9C При этом следует отметить, что для получения оптимального глифосат-толераитного фенотипа в этих трансгенных растениях предпочтительно, чтобы экспрессия глифосат-резистентного ЕПШПС-фермента имела место во всех тканях В приведенных ниже таблицах, описаны лишь результаты экспрессии, полученные для ткани листьев Данные, полученные для ЕПШПС класса IIтраисформаитов, можно сравнить с данными для глифосат-толерантных ЕПШПС (класса I )-трансформантов. где для экспрессии ЕПШПС-генов использовался один и тот же промотор, и где уровень активности глифосат-толерантной ЕПШПС был сравним для этих двух типов трансформантов Сравнение данных для pMON17110 (в таблице 9А) и pMON17131 (таблица ЭВ) с данными для PMON899 (в таблице 9С, ген класса 1 в pMON899 происходит от A thaliana (Юее и др . 1987}, где глицин в положении 101 заменен на аланин) свидетельствует о том, что ЕПШПС класса И обладают, по крайней мере, такой же хорошей активностью, как и ЕПШПС класса ! Увеличение вегетативной толерантности ЕПШПС класса II является очевидным, если принять во внимание, что растения класса И опрыскивали вдвое большей дозой и оценивали как Ri-растения Пример 3. Растения сои трансформировали с использованием вектора рМОЖЗЕМО (рис 15), в результате чего поручали ряд линий трансформированных растений сои, обладающих устойчивостью к глифосзту Соевые растения трансформировали вектором pMON 13640 посредством микроинъекции с использованием "выстреливающей" технологии, описанной Chnston и др , (1988) Семена, собранные от Ro-растений, обозначали Ri-семенам^ из которых выращивали Ri-растения Для оценки устойчивости к глифосату Ro-растения исследовали его потомство Поскольку, как предполагается, Roрастекие является гемизиготным в месте локализации каждой вставки, то самоопыление приводит к максимальной генотипической сегрегации в Ri Так как каждая вставка действует как доминантный аллель, то при отсутствии сцепления и в предположении, что для экспрессии толерантности требуется лишь одна гемизиготная вставка, одна вставка будет давать сегрегацию 3 1, две вставки - 1 5 1, три вставки - 63 1. и т п Поэтому для того, чтобы выявить, по крайней мере, один резистентный фенотип, необходимо культивировать относительно небольшое число Ri-растений. Семена от Ro-pac гений сои собирали и осушали, а затем высаживали для проведения теста путем опрыскивания глифосатом Семена высаживали в 4 дюймовые (-5 см) квадратные горшки, содержащие почву Metro 350 От каждого Ro-растения получали 20 саженцев, которые считали адекватными для тестирования Растения хранили и культивировали в условиях теплицы Фотопериод составлял 12,4-14 часов, дневная температура 30°С, а ночная 24°С Водорастворимое удобрение Peters Pete Lite использовали в соответствии с требованиями культивирования 32548 подобна многим другим плазмидам, описанным ниже, и в основном, состоит из бактериальной системы репликонов, описанной ранее, которая позволяет эту плазмиду реплицировать в E.coli, а также вводить и реплицировать в агробактерию; бактериального селектируемого маркерного гена (Spc/Str), и расположенного между правым и левым краем Т-ДНК синтетического СТР2-СР4-гена в FMV35S-npoMOTop-E9 З'-кластере. Эта плазмида имеет также уникальные сайты для нескольких рестриктирующих ферментов, расположенные в крайних областях и вне полигенного экспрессирующего кластера. Эта дает возможность легко добавлять к вектору другие гены и генетические элементы для введения в растения Схема для непосредственной селекции трансформированных растений на глифосате описана для табака. Экспланты для предварительного культивирования получали как и в стандартной процедуре, описанной в примере 1* осуществляли поверхностную стерилизацию листьев от растений табака возрастом 1 месяц (15 минут в 10% хлорокс + ПАВ; 3 X оНэО-промывки); эксппанты нарезали в виде квадратов 0,5 х 0,5 см, удаляя края листьев, средние жилки, верхние кончики, и черешки листьев для получения однородной ткани; затем экспланты помещали на один слой (верхней стороной вниз) на чашки MS104 + 2 мл среды 4СОО5КДЛЯ увлажнения поверхности и предварительно культивировали 1-2 дня. После этого экспланты инокулировали, используй ночную культуру Agrobacterium, содержащую плазмиду для трансформации растения, которую доводили до титра 1,2 х 109 бактерий/мл с помощью среды 4СОО5К. Экспланты помещали в центрифужную пробирку, добавляли суспензию агробактерии и смесь бактерий и эксплантов интенсивно вращали при максимальной скорости в течение 25 секунд для обеспечения равномерного проникновения бактерий. Затем бактерии сливали, а экспланты блотировали между слоями сухой стерильной фильтровальной бумаги для удаления избытка бактериального ма- • териала Блотированные экспланты помещали (верхней стороной вниз) на чашки М 104 + 2 мл среды 4СОО5К + диск на фильтре. Совместное культивирование проводили 2-3 дня. Затем экспланты переносили на 3 дня в среду MS 104 + 1000 мг/л карбенициллина + 100 мг/л цефотаксима (замедленная фаза). Затем экспланты переносили в среду М 104 + 0,5 мМ глифосата + 1000 мг/л карбенициллина + 100 мг/л цефоксамина (фаза селекции). Через 4-6 недель из каллюса вырезали побеги и помещали на корнеобразующую среду: MSO + 500 мг/л карбенициллина. Корни образовывались за 3-5 дней, и в это время из чашек с проросшими корнями могут быть взяты кусочки листьев для подтверждения того,что этот материал обладает толерантностью к глифосату и является трансформированным Присутствие СР4-ЕПШПС-белка в этих трансформированных тканях было подтверждено с помощью иммуноблот-анализа дисков листьев В результате проведения одного эксперимента с использованием pMON1727 получали следующие данные при инокулировании 400 эксплантов с помощью AB1/pMON 17227 Agrobacterium на глифосате образовывалось 139 побегов, из которых 97 "Партия" в тестах с опрыскиванием состояла из нескольких саженцев Ri-потомства. все из которых были обработаны в тот же день Некоторые партии могут также включать в себя оценки и других ^-растений Каждая партия также включает в себя обработанные и необработанные нетрансгенные генотипы, представляющие в конкретной партии генотипы, которые предположительно являются трансформированными В партии также имеются один или несколько нерасщеплягощихся трансформированных генотипов, которые ранее были идентифицированы как имеющие некоторую резистентностъ. Одно-двэ растения от каждого отдельного Ro-потомства не обрабатывали и они служили в качестве контрольных для сравнения и измерения толерантности к глифосату, а также для оценки любой изменчивости, не индуцированной глифосатом Когда другие растения достигали стадии первых трех листьев (обычно через 2-3 недели после высадки), их опрыскивали глифосатом в дозе равной 128 унций/акр (8,895 кг/га) (Roundup® ). Лабораторный гусеничный опрыскиватель был градуирован для подачи дозы, эквивалентной данным условиям. Для вегетативной оценки использовали десятибалльную шкалу. Эта шкала относится к необработанному потомству, полученному из одного и того же Ro-растения Оценка 0 означает полное уничтожение растения, а оценка 10 указывает на отсутствие заметных изменений отличий от необработанного растения. Чем выше балл в пределах указанной шкалы 0-10, тем меньше повреждения растения по сравнению с необработанными глифосатом растениями Растения оценивали на 7, 14 и 28-й день после обработки (ДАТ). Данные анализов, полученные для одной серии трансформированных и контрольных соевых растений и представленные в таблице 10, показали, что СР4ЕПШПС-пзн сообщает устойчивость к глифосату также и растениями сои. Пример 4. СР4-ЕПШПС-ГЄН может быть использован для селекции трансформированного растительного материала непосредственно на среде, содержащей глифосат Способность к селекции и идентификации трансформированного растительного материала в большинстве случаев зависит от использования доминантного селектируемого маркерного гена, обеспечивающего предпочтительный и непрерывный рост трансформированных тканей в присутствии обычного ингибирующего вещества. В качестве таких доминантных селектируемых маркерных генов использовали гены резистентности к антибиотикам и толерантности к гербицидам, которые почти всегда используются при культивировании в присутствии соответствующих антибиотиков или гербицидов. Чаще всего, вероятно, используется схема npt11/канамицинселекции. Было продемонстрировано, что СР4ЕПШПС также является приемлемым и, вероятно, наилучшим селектируемым маркером для использования в схеме отбора на продуцирование и идентификацию трансформированных растений • В данной схеме в качестве вектора для трансформации растения может быть использован вектор pMON17227 (рис. 16). Эта плазмида 20 32548 из таблицы 11, СР4-ЕПШПС сообщает каллюсам к>1гурузы толерантность к глифосату Для измерения С Р4-ЕПШ ПС -экспрессии в калпюсе кукурузьс использовали следующую процедуру BMS-каллюс (3 г сырого веса) осушали на фильтровальной бумаге (ватман № 1) в вакууме, снова взвешивали и добавляли экстрагирующий буфер (500 мкл/г сухого веса, 100 мМ 7рис. 1 мМ ЭДТК, 10% глицерина) Ткань гомогенизировали в течение 30 секунд с помощью верхнего смесителя Wheaton при установке на мощность 2,8 После центрифугирования (3 минуты микроцентрифуга Эппендорфа) супернэтант удаляли, а белок подвергали количественной оценке (BioRad Protein Assay) Образцы (50 мкг на лунку) загружали на ДСН~ПААГ-гель (Tule, 3-17%) наряду с СР4ЕПШПС-стандэртом (10 нг), подвергали электрофорезу и переносили на нитроцеллюлозу аналогично описанному ранее методу (PadgeHe, 1987) Нитроцеллюлозные бпоты зондировали с козьими IgG против СР4-НПШПС и проявляли с использованием 1-125 белка G Радиоактивный блот визуализировали посредством авторадиографии Количественные результаты получали путем денситометрии на лазерном денситометре LKB Ultrascan 11 и систематизировали ниже в таблице 12 Улучшение экспрессии ЕПШПС класса I может быть также достигнуто путем экспрессии гена с использованием более сильных растительных промотороз с использованием лучших сигнальных последовательностей 3' полиаденилироваиия, путем оптимизации последователь ноитей возле инициирующего кодона для загрузки рибосомы и инициации трансляции либо путем комбинации этих или других факторов экспрессии или регуляторных последовательностей Успешную трансформацию для получения нужного растения можно также осуществлять с помощью ЕПШПС-гена класса І в сочетании с другим глифосат-толеранткым ЕПШПС-геном или с геном, способным к разложению глифосата, в целях повышения глифосат-толерзнтности трансформированного растения На основании вышеизложенного мо;кно с уверенностью утверждать, что настоящее изобретение позволяет достичь все вышеуказанные цели и задачи обладая при этом очевидными преимуществами Следует отметить, что некоторые отличительные особенности и субкомбимации представляют самостоятельную ценность и могут быть использованы безотносительно к другим особенностям и субкомбинациям Причем эти особенности рассматриваются в формуле изобретения и не выходят за пределы ее объема Поскольку при осуществлении настоящего изобретения воэмежны некоторые варианты, не выходящие однакс за рамки его объема, то очевидно, что предстаьпенное описание изобретения и сопровождающие его рисунки носят иллюстративный характер и іикоим образом не должны рассматриваться каї эграничение изобретения Пример 6. ЕПШПС-ген кмеса II LBAA был введен в растения для сообщения им толерантности к глифосату Данные трансформации табака с использованием pMON 17206 (см ниже) представлены в таблице 13 показали положительный результат в отношении кэлпюсообраэовэния на глифосате Эти данные обнаружили степень трансформации равную 24 на 100 эксплантов, что свидетельствует о том, что указанная процедура трансформации растений валяется высокоэффективной и не требует много времени Аналогичная частота трансформации была получена с использованием pMON17131. и была осуществлена прямая селекция трзнсформантов с СР4-ЕПШПС-генами в присутствии глифосата для других видов растений, включая Arabtdopsis, картофель, томат, хлопчатник латуксалат и сахарная свекла Плазмида pMONi7227 содержит уникальные сайты распознавания рестриктируюших ферментов (Not), Xhol, и BstX!) между СР4-областью селекции глифосатом и левым краем вектора для клонирования дополнительных генов и для облегчения введения этих генов в растения Пример 5. СР4-ЄЛШПС-ГЄН был также введен в клетки кукурузы Black Mexican Sweet (BMS), с последующий экспрессией белка и анализом на тпмфосатрезистентность в каллюсе Остов используемой плаэмиды происходил от высококопийной плэзмиды pVCH9 (Viera и Messing, 1987) 1,3 кЬ-Fspl-Drat -фрагмент pVC119, содержащий обпасть инициации реппикации, лигировали с 1,3 кЬ - Smal-Htndfll-затупленным фрагментом, происходящим от рК7 (Rao и Rogers, 1979), который содержит ген неомицинфосфотрансферазы типа П для сообщения бактериальной резистентное™ к канамицину Эту ппаэмиду использовали для конструирования кластерного вектора для экспрессии в однодольной культуре, который содержит 0,6 кЬ - РНК-промотор вируса мозаики цветной капусты (CaMV) 35S с дупликацией 90-300-области (Кау и др , 1987), 0,8 кЬфратент, содержащий интрон из гена кукурузы в 51-не транслируемой лидерной обпасти, за которым следует полинкер З'-терминзльные последовательности от гена нопалинсинтазы (NOS) (Fraley и др , 1983) 1,7 Ко-фрагмент, содержащий 300 п о транспортного пептида хлоропласта от ЄПШПсинтазы Arabidopsis, лигироаанного с сохранением рамки с 1,4 кЬ-последовательностью, кодирующей бактериальную СР4-ЕПШП-синтазу, вставляли в однодольный экспрессирующий кластер в полипинкер между нитроном и терминаторной NOSпоследовательностью для образования ппазмиды pMON19653(pnc 17) ДНК рМО 19653 вводили в клетки Black Mexican Sweet (BMS) путем совместной бомбардировки с ЕС9, плазмидой, содержащей резистентную к сульфомочевине форму кукурузного гена ацетопактат-синтазы 2,5 мг каждой плазмиды наносили на частицы вольфрама и вводили в BMS клетки лог-фазы, используя пушку для частиц PDC-1000 как описано (Klem и д р . 1989) Затем проводили селекцию трансформантов на среде MS, содержащей 20 ppb хлорсульфурона После начала селекции на хпоросульфуроне халлюс может быть проанализирован непосредственно путем Вестерн-бпот-анализа Толерантность к глифосату можно оценить путем переноса каплюсов на среду, содержащую 5 мМ глифосата Как видно 21 32548 ' БИБЛИОГРАФИЯ which confers incteased resistance to glyphosate. Ph. D. Dissertation, Louisiana State University. AKon, N.K andVapnek. D (1979) Nature 282:864-869. Fitzgibbon, E. F. and Braymer, H. D. (1990) Cloning of a gene from Pseudomonas sp. PG2982 conferring increased glyphosate resistance Appi. Environ Mtcrobiol. 56: 3382-3388. Amrrmato, P.V , et al. Handbook ol Plan) Cell Culture - Crop Species Macmillan Publ. Co. (1984). Amon, O.I. Plant Physiol 24:1-15(1949). Fling, M.E., Kopf, J., and Richards, C. (1985). Nucleotide sequence of the transposon Tn7 gene encoding an aminoglycoside-modifying enzyme, 3"(9)-0nucleotidyttransferase. Nucleic Acids Research 13 no. 19,7095-7106. . Bachmann, B. J. et a l , Microb. Rev., 44:1-56 (1980). Bartlett, S G , Grossman. A.R, and Chua, N.H. (1982) in Methods in Chloroplast Molecular Biology, pp. 1081-1091. M. Edelman, R.S., Haltick, and Chua, N.H.,eds. Fraley, R.T., Rogers, S.G., Horsch, R.8., Sanders, P.R. Flick, J S., Adams, S.P., Bittner. M.L., Brand, LA., Fink, C.L., Fry, J.S., Galluppi, G.R , Goldberg, S.B., Hoffman. N.L.. and Woo, S С, 198Э. Expression of bacterial genes in plant cells. Proc. Natl. Acad. Set. USA 80:4803-4807. , . • • Bevan. M. (1984) Nucleic Acids Res 12 (22): 8711-8721. Birnboim, H. C. and Doly, J. (1979) A rapid alkaline extraction procedure for screening recombinant plasmid DNA. Nucl. Acids. Res. 7:1513-1525. Boyer, H. W. and Rolland-Dussoix, D. (1969) A complementation analysis of the restriction and modification of DNA in Escherichia cofi. J. Мої. Biol. 41:459. Fraley, R Т., Rogers, S. G., Horsch, R. В.. Eichhottz D. A., Flick, J. S , Fmk, С L, Hoffmann, N. L and Sanders, P R. (1985) The SEV system: a new disarmed Ті plasmid vector system for plant transformation. Christou, P., D. E. McCabe, and W.F. Swain (1988) Stable transformation of Soybean Callus by DNACoated Gold Particles. Plarrt Physiol. 87:671-674. Fromm, M., (1990) UCLA Symposium on Molecular Strategies for Crop Improvement, April 16-22. 1990. Keystone, CO. Conizzi, G., Broglie, R., Edwards, C, and Chua, N.H. (1984}. Tissue-specific and light-regulated expression of a pea nuclear gene encoding the small subunit of ribulose-1,5-bisphosphate carboxytase. EMBO J 31671. Gasser, С S., Winter, J. A., Hironaka, С. М. and Shah, D. M. (1988) Structure, expression, and evolution of the 5-enolpyruvylshtkimate 3-phosphate synthase genes of petunia and tomato. J. Biol. Chern. 263: 4280-4289. della-Cioppa, G., Bauer, S. C , Klein. В. К., Shah, D. M., Fraley, R. T. and Kishore G. K. (1986) Translocation of the precursor of 5-enolpyruvylshikimate-3phosphate synthase into chloroplasts of higher plants in vitro. Proc. Natl. Acad Set. USA 83: 6873-6877. Gowda, S., Wu, F.C., and Snepard, R.J. (1989). Identification of promoter sequences for the major RNA transcripts of figwort mosaic and peanut chlorotic streak viruses (caulimovirus group). Journal of Cellular Biochemistry supplement 13D, 301 (Abstract). della-Cioppa, G., Bauer, S. C , Taylor, M. Т., Rochester, 0. Є., Klein, B. K.T Shah, D. M., Fraley, R. T. and Krshore G. M. (1987) Targeting a herbicide-resistant enzyme from Escherichia coli to chloroplasts of higher plants. Bio/Technology 5: 579-584. Hallas, L. E., Hahn, E. M. and Komdorfer, C. (1988) Charactenzation of microbia! traits associated with glyphosate biodegradation in industrial activated sludge. J. Industrial Microbiol. 3: 377-385. Devereux, J., Haeberii, P. and Smithies, O. (1984) A comprehensive set of sequence analysis programs lor the VAX. Nuct. Acids. Res. 12:387-395. Hayford, M. В., Medford, J. I., Hoffmann, N. L , Rogers, S. G. and Klee, H. J . (1986) Development of a plant transformation selection system based on expression of genes encoding gentamicin acetyftransferases. Plant Physiol. 86: 1216-1222. Ditta, G., Stanfield, S , Corbin, D., and Helinski, D.R. (1980) Broad host range DNA cloning system lor Gram-Negative bacteria: construction ol a gene bank of Rhtzobium meliloti. Proc Natl Acad Sci USA 77, 7347-7351. Herrera-EslreHa, L., et at. (1983) Nature 303:209 Horsch, RB. and H Klee. (1986} Proc. Natl. Acad. Sci. U.S.A. 83: 4428-32. Duncan, K., Edwards, R.M., Coggins, J.R. (1987) The pentafuncttonal aroM enzyme of Saccharomyces cerevistae is a mosaic of monofunctionaf domains. Btochem. J. 246: 375-386. Hettkamp, M A , Hallas, L. and Adams, W. J. (1990) Biolrealment of industrial wastewater with immobilized microorganisms - Presented in Session 11, Paper S40, Society for Industrial Microbiology Annual Meeting, Orlando, Florida, July 29-August 3, 1990. Dunn, J.J. and Studier, F.W., (1983) J. Мої. Biol. 166: 477-535. Hohn, В and Collins J (1980) A small cosmid for efficient cloning o* large 0NA fragments Gene 11: 291-298. Fttzgibbon, J. E. (1988) Pseudomonas sp. strain PG2982: uptake of glyphosate and cloning of a gene 22 32548 HunkapiHer, M. W., Hewick, R M . Dreyer, R J., and Hood, L (19a?) Methods Enzymot 91, 399-413 phosphonate herbicide glyphosate. Appl. Environ Microbiol. 46:316-320 Jefferson, R A., Kavanaugh, Т.Д. and Bavan. M W , EMBO J., 6- 3901-3907(1987). Morelli, G , Nagy, P , Fraley, R Т., Rogers, S.G., and Chua, N H (1985) A short conserved sequence is involved in the Irght-inducibHity of a gene encoding nbulose 1.5-bisphosphate carboxylase small subuntt of pea Nature 315. 200-204. Kay, П., Chan, A., Dafy. M and McPhereon, J. 1987. Duplication of the CaMV 35S promoter sequence creates a strong enhancer for plants. Science 236,1299-1302. Ode», J.T , Naqy, F., and Chua, N H (1985). Identification of DMA sequences required for activity of the cauliflower mosaic virus 35S promoter. Nature 313, 810-812. Ktshore, G , Shah, D., Padgette, S., della-Cioppa, G., Gasser, С , Re, D., Hironaka. C , Taylor, M.T Wibbenmeyer, J., Eichholtz, D , Hayford, M., Hoffman, N.. Delannay, X., Horsch, П., Klee, H., Rogers, S , Rochester, D., Brundage, L., Sanders, P. and Fratey, R. T. (1988) 5-Eno(pyruvyIshiktmate 3-phosphate synthaseFrom Biochemistry to genetic engineering of glyphosate tolerance, m Biotechnology for Crop Protection ACS Symposium series No. 379. Eds. Hedtin P. A., Menn, J. J. and Hollingsworth, R. M pp. ЗЛ48 Olms, P. О, Devme. С S., Rangwala. S. H. and Kavka, K. S (1988) Gene 73: 227-235. Kishore, G. and Shah, D. (1988) Ann. Rev, Biochem. 57-627-663. Padgette, S. M-, Brand. L Fraley, R. Т., and isolation 3-phosphate 564-573 R., Huynh, О. К., Borgmeyer, J., Shah, D. A., Re, D В., Bishop, В F., Rogers, S. G., and Kishore, G (1987) Bacteria! expression of Petunia hybrida 5-enol-pvnjvyfshtkimatesynthase. Arch. Biochem. Biophys. 258, Kishore, G. M . Brundage, U Kolk, K., Padgette. S. R,, Rochester, O., Huynh, Q. K. and delta-Cioppa, G. (1986) Fed. Proc. 45: 1506. Padgette, S. R., Huynh, Q K., Aykent, S., Sammons, R D., Stkorski, J. A., and Kishore, G. M. (1988) J. Biol. Chem 263, 1798-1802. t Quinn, J. P., Peden, J. M. M. and Dick, E. (1988) G/yphosate tolerance and utilization by the microflora of sotls treated with the herbicide. Appl. Microbiot. Bioiechno». 29. 511-516. Klee, H J . , et al. (1985) Biotechnology 3: 637-42. Klee, H. J., Muskopf. Y. M. and Gasser, C. S (1987) Cloning ot an Arabidopsis thaltana gene encoding 5enolpynjvyt-shikimaIe-3 phosphate synthase: sequence analysis and manipulation to oblain glyphosate tolerant plants Мої. Gen. Genet. 210- 437-442 Rao, R N and Rogers, S G. 1979. PlasmidpKC7: A vector containing ten restriction endonuclease sites surtabte for ctontngDNAsegment. Gene 779. Klein, T M.. Kornstein. L , Sanford, J С . and Fromm, M.E. 1989. Genetic transformation of maize cells by particle bombardment. Plant Phys. 91 440-444. Rogers, S.G., Brand. LA. Holder, SB. Sharps, E S. and Brackin, M J. (1983) Amplification of Ihe aroA gene from E. coli results in tolerance to the herbicide glyphosate. Appl Environ. Microbtol 46:37-43. Koncz, C. and Schell, J. (1986) The promoter of TLDNA gene 5 controls the tissue-specific expression of chimeric genes earned by a novel type of Agrobacterium binary vector. Мої. Gen Genet. 204 383-396 Sambrook, J., Fntsch, E.F. and Maniatis, Т., Molecular Cloning. A Laboratory Manual, Cold Spring Harbor Laboratory Press. Cold Spnng Harbor, New Yotfc (1989). Kunkei, T. A, Roberts, J. D and Zak^ur, R А. (1987) Rapid and efficient site-spectffc mtrtagenesis without phenotypic selection. Methods Enzymol 154367. Schuler, M A., Schmitt, E. S. and Beachy, R.N. (1982) Nucleic Acids Res. 10:8225-8244. Laemmti, U.K., "Cleavage of structural proteins during the assembly of the head of the bactenophage T4" Nature, 227:680(1970). Schulz, A., Kruper, A. and Amrhein, N. (1985) Differential sensitivity of bacterial 5-enolpyruvylshiktmate-3phosphate syntheses to the herbicide glyphosate. FEMS Microbiot. Lett. 28: 297-301. Maniatis, Т., Fritsch, 6. F. and Sambrook, J. (1982) Molecular Cloning: a laboratory manual Cold Spring Harbor Laboratory, Cold Spring Harbor, New York. Schulz, A , Sost, D. and Amrhein, D. (1984) Arch. Microbiol. 137. 121-123. Shah, D , Horsch, R., Klee, H., Ktshore, G., Winter, J., Turner, N, Hironaka, C , Sanders, P., Gasser, C , Aykent, S., Siegal, N.T Rogers, S., and Fraley, R. (1986). Engineering herbicide tolerance in Uansgenic plants Science 233, 478-481.' Masked, D.J., Mornssey, P. and Dougan, G. (1988) Cloning and nucleotide sequence of the aroA gene of Bordetella pertussis. J. Bactenot. 170 2467-2471. Miller, J H (1972). Experiments in Molecular Genetics. Cold Spnng Harbor Laboratory, Cold Spring Harbor, New York. Shtmamoto, K- et al. (1989) Nature 338:274-276. Sost, D., Schulz, A. and Amrhein. N. (1984) FEBS Lett- 173:238-241. Moore, J. K., Braymer, H D and Larson, A D (1983) Isolation ol a Pseudomonas sp. which utilizes the 23 32548 Sost, D and Amrhein. N. (1990) Substitution of Gry96 to Afa tn the 5-eno!pyruvylshikima(e 3-phosphate synthase of Klebsiella pneumoniae resufts in greatfy reduced affinity for the herbicide gfyphosate. Arch. Biochem. Brophys 282 433-436. B. F., Siegel, N. R., Smith, C. E. and Tacon, W. C. (1988) Expression of excreted insulin-like growth factor-1 in Escherichia cofi. Gene 68: 193-203. Список последовательностей (1) Основная информация(1) Заявитель: Barry, Gerard F. Kishore, Ganesh M. Padgette, Staphen K. (II) Название изобретения. Ґлийросат-толерантные 5-енолпирувипшикимат-3-фосчэатсинтэзы (III) Число последовательностей- 36 (IV) Почтовый адрес: (A) адресат: Dennis R. Hoernei Jr., Monsanto Company BB4F (B) улица: 700 Chesterfield Village Parkway (C) город: St. Louis (D) urrar Missouri (E) страна' США (F)Z1P: 63198 (V) Компьютерное считывающее устройство: (A) Тип носителя информации' гибкий диск (B) Компьютер- совместимая 1ВМ PC (C) Операционная система" PC-DOS/MSDOS (D) Программное обеспечение: Patent in Release 1.0, Версия 1,25 (VI) Текущие данные заявки: (A) Номер заявки: US 07/576537 (B) Дата подачи- 31 авг. 1990 (C) Классификация: (VIH) Данные поверенного агента: (A) Имя: Hoemer Jr., Dennis R. (B) Регистрационный номер: 30914 (C) номер дела/досье: 38-21 10535 (IX) Телесвязь: (A) Телефон- 314 537-6099 .; (B) Телефакс- 314 537-6047 (2) Данные о последовательности SEQГОг * 1: Stalker, D.M, Thomas. С М . , and Helinski. D.R. (1981) Nucleotide sequence of the region of the origin of replication of the broad host range pfasmid RK2. Mot Gen Genet 181: 8-12. Stalker, D. M., Htatt, W R. and Comai, L (1985) A single amino acid substitution in the enzyme 5enotpyruvyishtkimate 3-phosphate synthase confers resistance to glyphosate. J. Biol. Chem. 260; 47244728. Tabor, S. and Richardson, С. С (1985) A bacteriophage T7 RNA polymerase/promoter system for controtted exclusive expression of specific genes. Proc. Natf. Acad. Sci USA 82: 1074-1078. Talbot, H. W , Johnson, L. M. and Munnecke, D. M. (1984) Glyphosate utilization by Pseudomonas sp. and Atcaligenes sp. isolated from environmental sources. Current Microbiol. 10: 255-260. Tafmadge, K., and Gilbert, W., "Construction of plasmid vectors wtth unique PsH cloning sites in the signal sequence coding region" Gene, (12) 235-241 (1980). Vasil, V., F. Redway and t. Vasil., Bio/Tech-nology 8: 429-434(1990). Velten, J., Velten, R.T Hain, R. and ScheJl, J. (1984) EMBO J. 3: 2723-2730. Viera, J. and Messing, J. 1987. Production of singlestranded piasrnid DNA. Methods Enzym, 153: 3-11. (I) Характеристики последовательности: (A) Длина. 597 пар оснований (B) Тип: нуклеиновая кислота (C) Цепочечность: двухцепочечная (D) Топология- линейная Wong, Є. Y,, Seetharam, R., Kotta, С Є., Heeren, R. (II) Тип молекупы: ДНК (геномная) A., Klein, B. K., Braford, S. R., Mathis, K. J., Bishop, (XI) Описание последовательности SEQ ID NB 1: ЇСАТСААААТ ATTTKGCAGC АТТССАСАТТ GCGTTCAATC AACAAGCTAC CAGCCATATC €0 Wibbenmeyer, J . . Bnjndage, L., Padgette, S. R., Likos, J. J., and Kishore, G. M. (1988) Biochem. Biophys. Res. Comm. 153, 760-766. АСТТТАТТСА AATTOGTATC СССААААССА AGAAQGAACT СССАТССТСА AACOTTTGTA 120 АССАЛСААГТ СТСАСТССАА АСССТСААСА АОСТСАОООТ АСАСАСТСТС САААССАТТА 180 СССААААОСТ ЛСАССЛСАТС ААТСААСААТ СТТСААТСАА AQTAAACTAC ТОТТССАССА 240 САТССАТСАТ GCTCAGTAAO ТТТСАСАААА AGACATCCAC CGAAGACTTA ААСТТАСТОО 300 ОСАТСТТТСА ААСТААТСТТ СТСААСЛТСС ACCAGCTCCC TTQTGCCGAC САСАСААААА 360 AGCAATGGTO САСАЛТТСТТ AGGCGCACCT ACCKAAAGCA TCTTTGCCTT TATTGCAAAC 420 АТАААССАСА TTCCTCTAGT ACAACTCGGG ААСААААТАА CGTGCKAAAC AGCTCTCCTC «80 ACAGCCCACT CACTAATCCG TATGACGAAC ССАСТСАССА CCACAAAAGA АТТСССТСТА 5«0 TATAAGAACG САТТСАТТСС CATTTCAAGG ATCATCAGAT АСТААССКАТ АТТТСТС 597 24 32548 (2) Данные о последоватрпьности SEQ ID № 2 (I) Характеристики последовательности (А) длина 1932 пар оснований (В)тип нуклеиновая кислота (С) цепочечность двухцепочечная (D)топология линейная ( I Тип молекулы ДНК (геномная) I) (IX) Особенность (А) название/кпюч C D S (В)расположение 62 1426 (XI) Описание последовательности SEO ID № 2 • AAGCCCGCGT ТСТСТССССС ССТССССССС CACAGCCCTG САТАСАТТАА GCAAGACCCC 60 С ATG ТСС CAC CGT ССА АСС ACC CCG ССС ССА АСС ССС ССС ААА ТСС Met Ser Hte Gly Ale Ser Ser Arg pro Ala Thr A U Arg Lye Ser Ю6 X % 10 П TCT GGC CTT TCC CGA ACC GTC CCC ATT CCC GGC CAC AAG TCG АТС ТСС Ser Gly Leu Ser Gly Thr Val Arg II» Pro Gly Аїр Ly« Ser II* Ser 20 25 30 154 CAC CCC TCC TTC АТО TTC COC ОСТ CTC CCG ACC GGT CAA ACO CCC АТС Hie Arg Ser Phe Met Ph» Gly Oly Leu Al« Sme Cly Glu Thr Arg II* 35 40 45 202 ACC CCC CTT CTC CAA CCC CAC GAC CTC АТС AAT ACC CGC AAG CCC АТО Thr Gly Leu Leu Clu Gly Glu A«p v«l H e Aen Thr Gly Lye Ala Met SO 55 &0 250 CAG CCC АТС CCC GCC ACG АТС CGT AAC GAA CCC CAC ACC TGG АТС АТС Gin Ala Het Gly Ala Arg II» Arg Lye Clu Cly Aep Thr Trp II* II» 6S 70 75 298 CAT GGC CTC GGC AAT CGC GGC CTC CTC CCG CCT CAC CCG CCG CTC GAT Aep Gly Val Cly Aan Gly Cly Leu Leu Al* Pro Glu Al* Pro Leu Aep 80 в5 90 95 346 . TTC CGC AAT GCC CCC ACG GGC TGC CGC CTC ACC АТС GCC CTC GTC CCC Ph» Gly A*n Ala Ala Thr Cly Су* Arg Leu Thr Met Cly Leu Val Cly 100 . 105 110 394 CTC TAC GAT TTC GAC AGC ACC TTC АТС GGC CAC CCC TCG CTC АСА AAC Val Туг Aep Phe Aap Ser Thr Phe lie Cly Аїр Ala Ser Leu Thr Lye 115 130 125 442 CCC CCC ATG GCC CCC GTC TTC AAC CCC CTG CGC GAA АТС ССС GTC CAG Arg Pro Met Gly Arg Val Leu A»n Pro Leu Arg Glu Met Gly Val Cln 130 135 140 490 GTC AAA TCC CAA CAC CCT CAC CGT CTT CCC CTT ACC TTC CCC CCC CCC Val Lya Ser Clu A»p Cly Asp Arg Leu Pro Val Thr Leu Arg Cly Pro 145 150 155 538 AAC ACC CCC ACC CCG АТС ACC TAC CCC CTC CCC АТС CCC TCC CCA CAO Lye Thr Pro Thr Pro II» Thr Tyr Arg Val Pro Het Ala Ser Ala Cln 160 16S 170 a 175 586 GTG AAG TCC CCC СТО СТО CTC CCC CGC CTC AAC ACC CCC CGC АТС ACG Val Lye Ser Ala Val Leu Leu Ala Gly Leu A»n Thr Pro Cly XI» Thr 180 18S 190 634 25 32548 ACG GTC АТС CAC ССС АТС АТС ACG ССС GAT CAT ACG САА ААО АТС СТО Thr V a l П е C l u Pro Xle Met Thr Arg A t p H i s Thr G l u Lye Met Leu 195 200 205 662 CAC ССС ГГТ CGC CCC AAC CTT ACC CTC CAG ACC CAT ССС САС ССС ОТС Gin Cly Phe Gly Ala A»n їли Thr Vsl Clu The Asp Ala Asp cly Val 210 21S 220 7J0 CCC ACC АТС CCC CTC CAA CCC CCC CCC AAC CTC ACC ССС САА CTC АТС Arg Thr Il« Arg Leu Clu Cly Arg Gly Lye Leu Thr Cly Cln Val lie 225 230 235 77$ GAC CTC CCC CCC CAC CCC TCC TCC ACC CCC TTC CCG CTC CTT CCC GCC Аир Val Pro Cly Asp Pro Ser Ser Thr Ala Phs Pro Leu V*l Ala Ala 240 245 250 255 826 CTC CTT CTT CCO CCC TCC CAC GTC ACC АТС CTC AAC CTC СТО АТС AAC Leu Leu Val Pro Cly Ser Asp Vsl Thr U s Leu Asn V«l Leu Met Asn 260 265 270 874 CCC ACC CCC ACC CCC CTC АТС СТО ACS СТО CAC САА АТС ССС CCC CAC Pro Thr Arg Thr Cly Leu lie Leu Thr Leu Cln Glu Het Cly Ala Asp 275 280 265 922 АТС GAA CTC АТС AAC CCC CCC CTT GCC CCC CCC САА САС СТО ССС CAC H e Glu V.I lie A»n Pro Arg Leo Ala Gly Gly Clu Asp Val Ala Asp 290 295 3O0 970 CCC CAA CAC Pro Clu Asp 1018 CTC CCC CCC Val Ala Ala Э35 1066 GCC TTC CCC CAA CCC CCC ACC CTC АТС AAC GCT CTC CAA CAA CTC CCC Ala Phe Ala Glu Gly Ala Thr Val Met Aan Gly Leu clu Clu Leu Arg 340 Э45 350 1114 CTC AAG CAA ACC CAC CCC CTC TCC GCC GTC CCC AAT GCC CTC AAC CTC Val Lye Glu Ser Asp Arg Leu Ser Ala Val Al* Asn Gly Leu Lys Leu 35S 360 • 365 1162 AAT CCC CTC CAT TCC CAT CAC CCC CAG ACC TCC CTC CTC CTC CCC CCC Aen Cly Val Asp Cys A»p Clu Cly Clu Thr Ser Leu Val Val Arg Gly 370 375 360 1210 CCC CCt CAC GGC AAG CGC CTC CCC AAC CCC TCC CCC CCC CCC CTC CCC Arg Pro Asp Gly Lye Cly Leu Cly Ann Ala Ser Cly Ala Ala Val Ala 385 390 395 1256 ACC CAT CTC GAT CAC CCC АТС ССС АТС АСС TTC CTC CTC АТС GCC CTC Thr His Leu Atfp His A>g H e Ala Met Ser Phe Leu Val Met Gly Leu «00 4»0 41S 1306 CTC TCC CAA AAC CCT CTC ACC CTC CAC CAT CCC ACG АТС АТС GCC ACC Val Ser Clu Asn Pro Val Thr Val A»p Asp Ala Thr Kec H e Ala Thr 420 425 1354 ACC TTC CCC GAC TTC АТС CAC CTG АТС CCC CCC CTG CGC CCC AAG АТС Ser Phe Pro Glu Phe Het A«p Leu Met Alt Cly Leu Cly Ala Ly» H e 43S 440 44$ 1403 CTG CCC CTT L*u Arg Val 305 CGC CCC CCT Arg Ala Pro 320 CCC TCC TCC ACC CTC Arg Ser S«r Thr Leu ЭЮ TCC АТС АТС CAC CAA Ser Met lie Лор Glu 325 AAG CCC CTC ACC CTC Lye Gly Val Thr Val 315 TAT CCG ATT CTC CCT Tyr Pro lie Leu Ala 330 26 32548 GAA CTC ТСС CAT ACC AAC CCT CCC TGATCACCTT CACAATCCCC ATCGATCCTC G l u L e u S e r A»p Thr Ly» A l a A l a ,' 450 4S5 1 < 5 e CCGCTGCGCC CCGCAACGGC ACCCTCTCCC CCCGTATCGC GCAGGTCTAT COCTTTCATC 1516 ATCTCCATAC CGCCCTCACC TATCCCGCCA TCCCCAAAGC GCTCCTCGAT CCCCCCCTCT 1576 CCCTTCATCA CGAGCCGGTT CCCCCCCATG TCGCCCGCAA TCTCCATCTT CCCGCCCTCO 1636 ACCGGTCGGT GCTGTCGCCC CATGCCATCC GCGAGGCCCC TTCCAAGATC CCCCTCATCC 1696 CCTCCGTGCC GCCGGCCCTG GTCCAGCCCC ACCCCACCTT TCCCGCCCGT CAGCCCCCCA 1756 CCCTCCTCCA TCCACCCCAT ATCGCCACGG TGCTCTGCCC CCATGCGCCG GTCAAGCTCT »1в ATGTCACCGC GTCACCGGAA CTCCGCGCGA AACGCCCCTA TGACGAAATC CTCGGCAATO 1«76 GCGGGTTGGC CGATTACGCG ACGATCCTCC AGCATATCCG CCGCCGCCAC CAGCCCCACA 1936 TCGGTCCGGC GGACAGTCCT TTGAAGCCCC CCCACCATCC GCACTT 1902 (2) Данные для SEQ ID № 3 (I) Характеристики последовательности (A) Длина 455 аминокислот (B) Тип аминокислотная N» 3 (D) Топология линейная (II) Тип молекулы белок p Aap Ala Thr Met H e 420 425 A U Thr Ser 430 Phe Pro Glu Pht Het Aep Leu Met Ala Cly Leu Cly Ala Ly* H e 435 440 445 Leu Ser Atp 450 Thr Lye AU Clu Ala 4S5 (2) Даннью для поаіедовзтельности SCQ JD № 4 (і) Характеристики последовательности (A) Длина 1673 пар основании (B) Тип нуклеиновая киспота (C) Цепочечмос/гь двухцепочечнап (D) Топология линейная (II) Тип молекулы ДНК (геномная) (IX) Особенности (A) название/ключ CDS (B) расположение 86 1432 (XI) Описание последовательности SEQ ID №4 28
ДивитисяДодаткова інформація
Назва патенту англійськоюIsolated dna sequence coding epsps ferment, isolated dna sequence coding protein, revealing epsps activity, recombinant bifilar dna molecule, a method for producing genetically transformed plants
Автори англійськоюBerry Gerard Francis, Kishor Ganesh Merty, Pegette Stephen Rogers
Назва патенту російськоюИзолированная последовательность днк, которая кодирует epsps фермент, изолированная последовательность днк, которая кодирует белок, выявляющий epsps активность, рекомбинантная двухниточная молекула днк, способ получения генетически трансформированных растений
Автори російськоюБерри Джерард Фрэнсис, Кишор Ганеш Мерти, Педжетт Стефен Роджерс
МПК / Мітки
МПК: C12N 9/10, A01H 5/00, C12N 15/54, C12N 15/62, C12N 15/82
Мітки: рослин, ізольована, кодує, активність, генетично, виявляє, днк, послідовність, спосіб, фермент, білок, двониткова, рекомбінантна, epsps, молекула, одержання, трансформованих
Код посилання
<a href="https://ua.patents.su/60-32548-izolovana-poslidovnist-dnk-shho-kodueh-epsps-ferment-izolovana-poslidovnist-dnk-shho-kodueh-bilok-yakijj-viyavlyaeh-epsps-aktivnist-rekombinantna-dvonitkova-molekula-dnk-sposib-ode.html" target="_blank" rel="follow" title="База патентів України">Ізольована послідовність днк, що кодує epsps фермент, ізольована послідовність днк, що кодує білок, який виявляє epsps активність, рекомбінантна двониткова молекула днк, спосіб одержання генетично трансформованих рослин</a>
Попередній патент: Подвійна водоповітряна колона
Наступний патент: Спосіб регенерації іонообмінних фільтрів
Випадковий патент: Спосіб рекультивації земель, порушених відкритими гірничими роботами