Мультивалентна імуногенна композиція проти грипу, яка включає антиген вірусу грипу та ад’ювант на основі емульсії масло-у-воді
Формула / Реферат
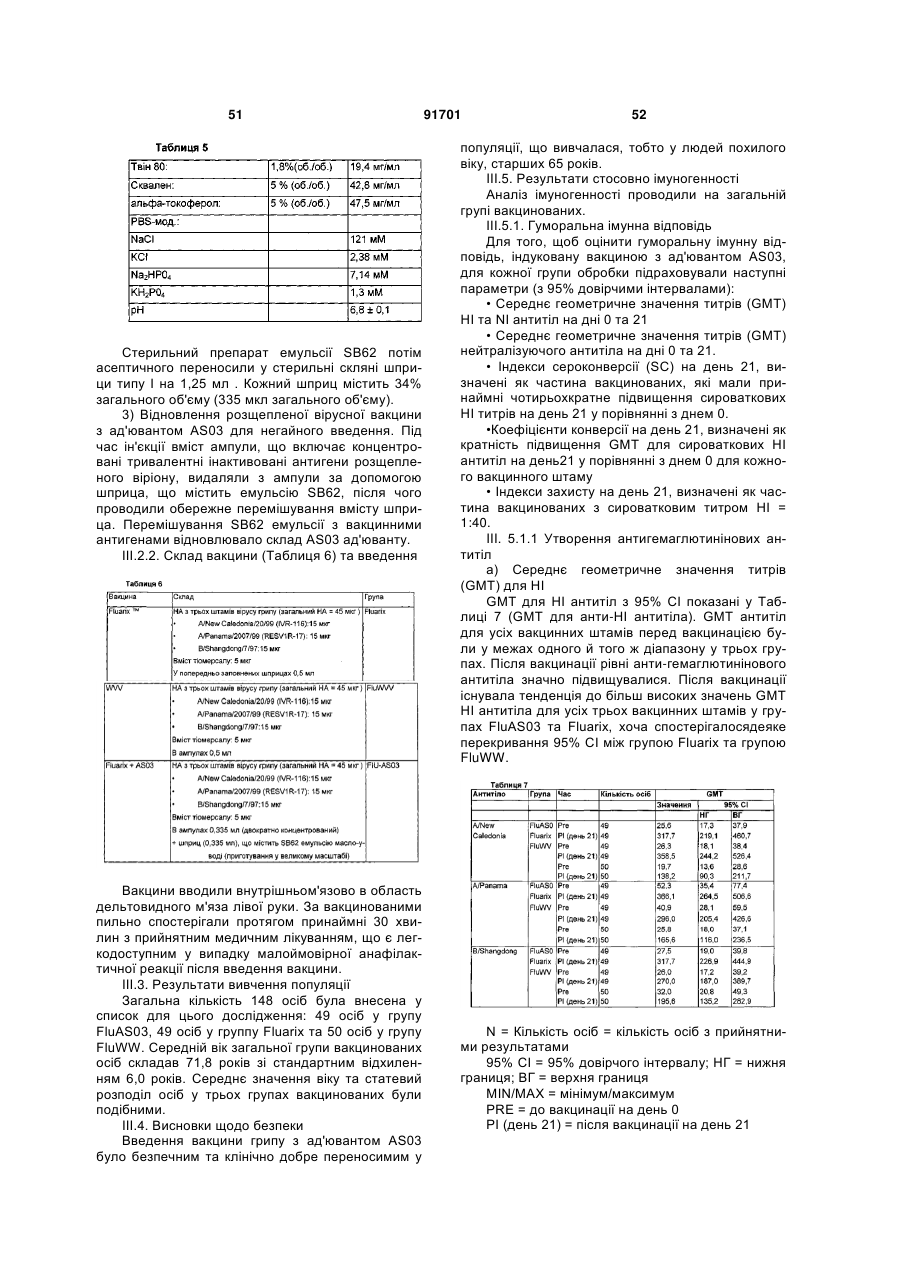
1. Мультивалентна імуногенна композиція проти грипу, яка включає антиген вірусу грипу або його антигенний препарат принаймні з двох штамів вірусу грипу, причому принаймні один штам є асоційованим з пандемічним спалахом або має потенціал бути асоційованим з пандемічним спалахом, у комбінації з ад'ювантом на основі емульсії масло-у-воді, де вказаний ад'ювант на основі емульсії масло-у-воді включає метаболічне масло, стерин та/або альфа-токоферол та емульгувальний агент.
2. Композиція згідно з пунктом 1, де вказана емульсія масло-у-воді містить краплі масла, принаймні 70 % з яких за інтенсивністю є меншими ніж 1 мкм у діаметрі.
3. Композиція згідно з будь-яким з пунктів 1 або 2, де вказана емульсія масло-у-воді містить краплі масла, принаймні 70 % з яких за інтенсивністю є меншими ніж 500 нм у діаметрі.
4. Композиція згідно з будь-яким з пунктів 1-3, де вказана емульсія масло-у-воді містить краплі масла, принаймні 80 % з яких за інтенсивністю є меншими ніж 300 нм у діаметрі.
5. Композиція згідно з будь-яким з пунктів 1-4, де вказана емульсія масло-у-воді містить краплі масла, принаймні 90 % з яких за інтенсивністю знаходяться в діапазоні від 120 до 200 нм у діаметрі.
6. Композиція згідно з будь-яким з пунктів 1-5, де вказане метаболічне масло являє собою сквален.
7. Композиція згідно з будь-яким з пунктів 1-6, де вказане метаболічне масло є присутнім у кількості від 0,5 % до 20 % від загального об'єму вказаної імуногенної композиції.
8. Композиція згідно з будь-яким з пунктів 1-7, де вказане метаболічне масло є присутнім у кількості від 1,0 % до 10 % від загального об'єму вказаної імуногенної композиції.
9. Композиція згідно з будь-яким з пунктів 1-8, де вказане метаболічне масло є присутнім у кількості від 2,0 % до 6,0 % від загального об'єму вказаної імуногенної композиції.
10. Композиція згідно з будь-яким з пунктів 1-9, де вказаний стерин є холестерином.
11. Композиція згідно з будь-яким з пунктів 1-10, де вказаний альфа-токоферол є присутнім у кількості від 1,0 % до 20,0 % від загального об'єму вказаної імуногенної композиції.
12. Композиція згідно з будь-яким з пунктів 1-11, де вказаний альфа-токоферол є присутнім у кількості від 1,0 % до 5,0 % від загального об'єму вказаної імуногенної композиції.
13. Композиція згідно з будь-яким з пунктів 1-12, де співвідношення сквален:альфа-токоферол є рівним або меншим 1.
14. Композиція згідно з будь-яким з пунктів 1-13, де вказаний емульгувальний агент являє собою Твін 80.
15. Композиція згідно з будь-яким з пунктів 1-14, де вказаний емульгувальний агент є присутнім у кількості від 0,01 до 5,0 % (ваг./ваг.) від ваги вказаної імуногенної композиції.
16. Композиція згідно з будь-яким з пунктів 1-15, де вказаний емульгувальний агент є присутнім у кількості від 0,1 до 2,0 % (ваг./ваг.) від ваги вказаної імуногенної композиції.
17. Композиція згідно з будь-яким з пунктів 1-16, де імуногенна композиція додатково включає TLR-4 ліганд.
18. Композиція згідно з будь-яким з пунктів 1-17, де вказаний TLR-4 ліганд є вибраним з групи, яка включає: нетоксичну похідну ліпіду А, таку як 3D-MPL; синтетичну похідну ліпіду A; MDP; та RSV F білок.
19. Композиція згідно з будь-яким з пунктів 1-18, де вказана похідна ліпіду А являє собою 3D-MPL.
20. Композиція згідно з будь-яким з пунктів 1-19, де 3D-MPL є присутнім у кількості від 1 до 100 мкг (ваг./об.) на дозу композиції.
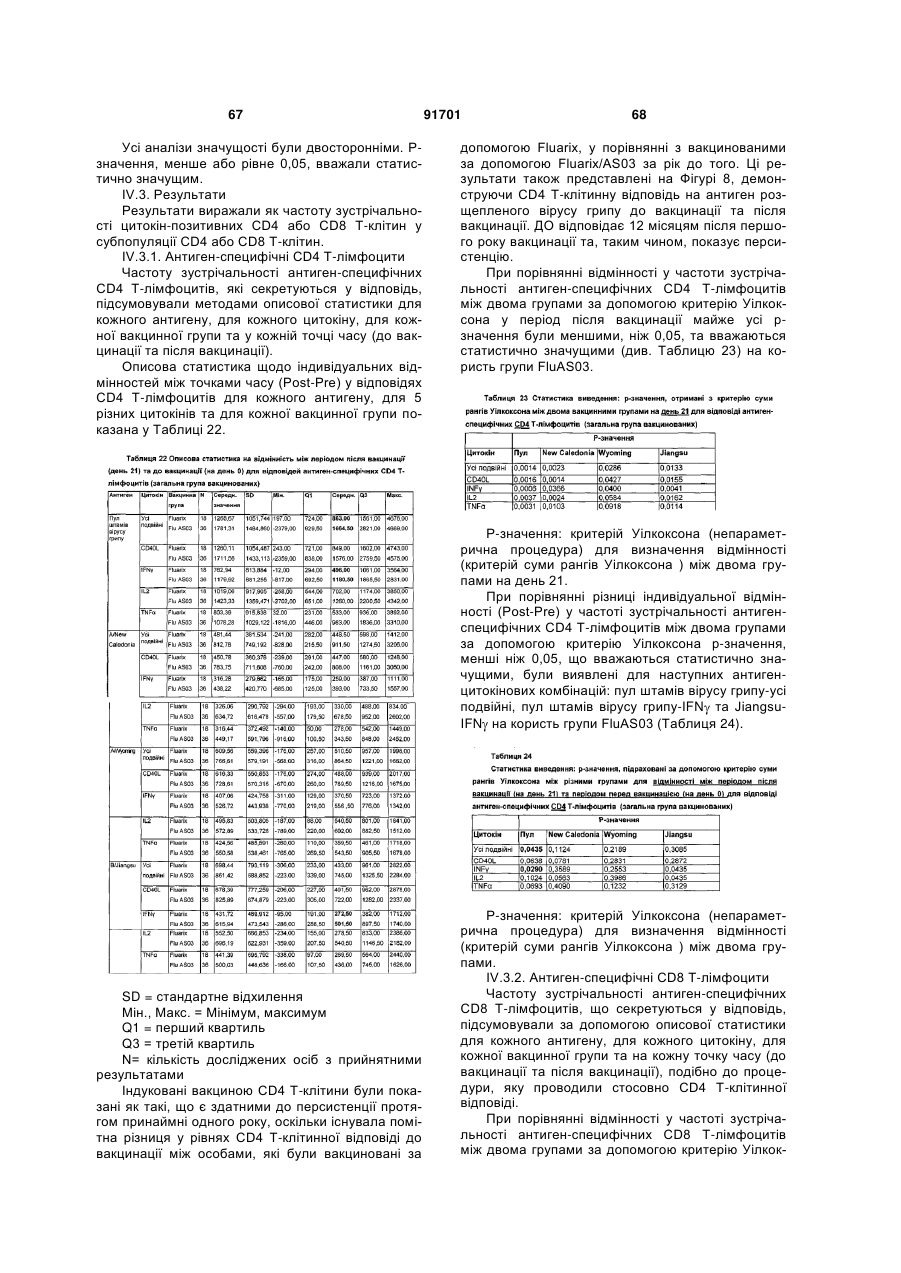
21. Композиція згідно з будь-яким з пунктів 1-20, де 3D-MPL є присутнім у кількості від 10 до 50 мкг/мл.
22. Композиція згідно з будь-яким з пунктів 1-20, де 3D-MPL є присутнім у кількості приблизно 25 мкг/мл.
23. Композиція згідно з будь-яким з пунктів 1-22, де вказана мультивалентна композиція є бівалентною, тривалентною або квадривалентною композицією.
24. Композиція згідно з будь-яким з пунктів 1-23, де вказаний пандемічний штам вірусу грипу є вибраним з групи, яка складається з: H5N1, H9N2, H7N7, H2N2 та H1N1.
25. Імуногенна композиція згідно з пунктом 24, де принаймні два штами вірусу грипу є вибраними з групи, яка складається з: H5N1, H9N2, H7N7, H2N2 та H1N1.
26. Імуногенна композиція згідно з будь-яким з пунктів 1-25, де вказаний антиген або антигенна композиція містить від 1 до 15 мкг НА на штам вірусу грипу.
27. Імуногенна композиція згідно з пунктом 26, де вказаний антиген або антигенна композиція містить низьку дозу НА на штам вірусу грипу.
28. Імуногенна композиція згідно з пунктом 27, де вказаний антиген або антигенна композиція містить від 2,5 до 7,5 мкг НА на штам вірусу грипу.
29. Імуногенна композиція згідно з будь-яким з пунктів 1-28, де вказаний антиген або антигенна композиція знаходиться у формі: очищеного цільного вірусу грипу, інактивованого вірусу грипу або субодиничного(их) компоненту(ів) вірусу грипу.
30. Імуногенна композиція згідно з пунктом 29, де вказаний інактивований вірус грипу є розщепленим вірусом грипу.
31. Спосіб одержання імуногенної композиції вірусу грипу для пандемічної ситуації, де спосіб включає змішування антигену вірусу грипу або антигенного препарату з принаймні двох штамів вірусу грипу, принаймні один з яких є асоційованим з пандемічним спалахом або має потенціал бути асоційованим з пандемічним спалахом, з емульсією масло-у-воді.
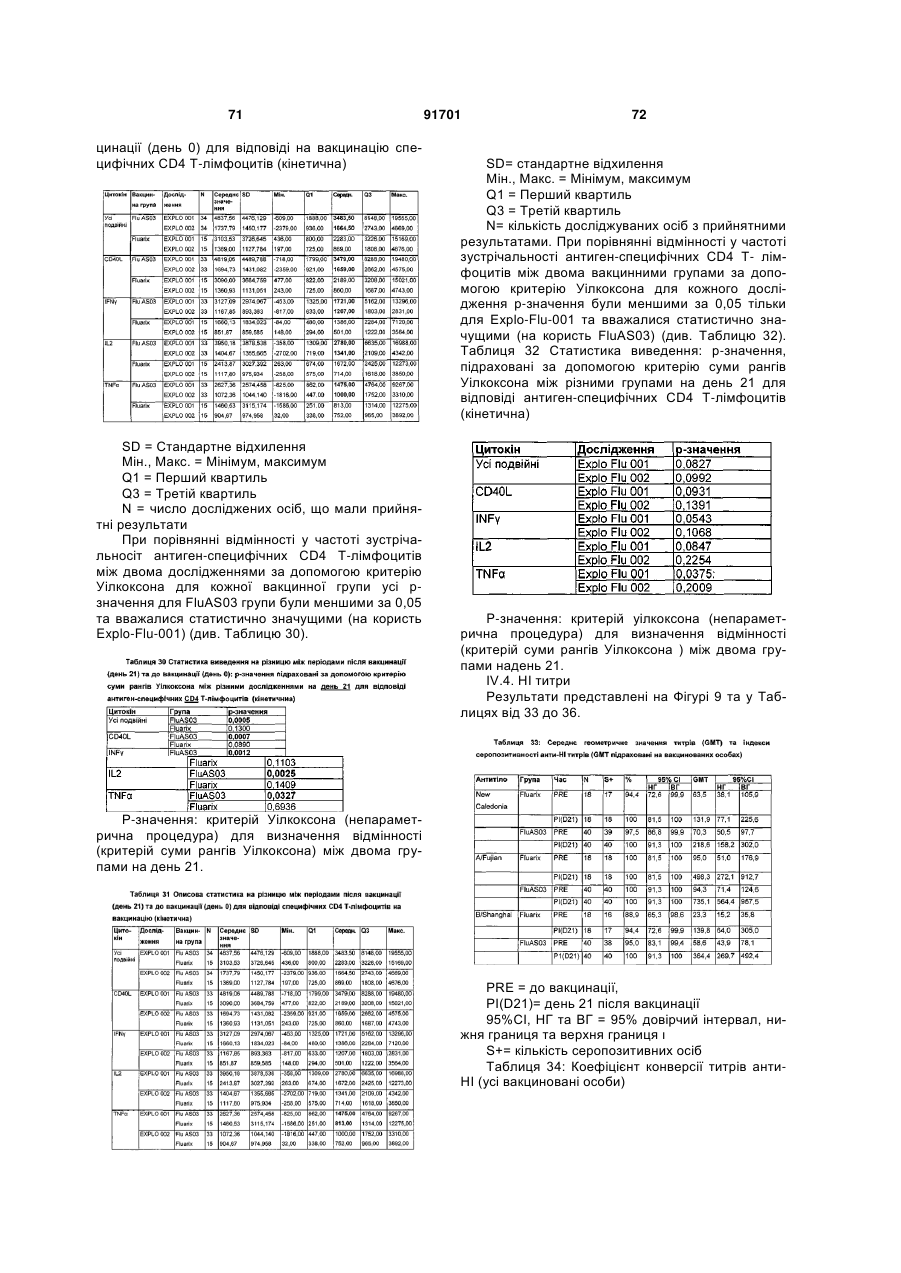
32. Спосіб згідно з пунктом 31, де вказаний ад'ювант на основі емульсії масло-у-воді є таким, як визначено у будь-якому з пунктів 1-16.
33. Спосіб згідно з пунктом 32, де емульсія масло-у-воді додатково включає TLR-4 ад'ювант.
34. Спосіб згідно з пунктом 33, де TLR-4 ад'ювант є таким, як визначено у будь-якому з пунктів 17-22.
35. Імуногенна композиція, як заявлено у будь-якому з пунктів 1-30 для застосування у медицині.
36. Застосування (а) вірусу грипу або його антигенного препарату та (b) ад'юванту на основі емульсії масло-у-воді у виробництві імуногенної композиції, як заявлено у будь-якому з пунктів 1-30 для індукції принаймні однієї з: і) поліпшеної імунної відповіді CD4 Т-клітин, іі) поліпшеної відповіді В-клітин пам'яті проти вказаного вірусу або антигенної композиції у людини.
37. Застосування вірусу грипу або його антигенного препарату та ад'юванту на основі емульсії масло-у-воді у приготуванні імуногенної композиції, як заявлено у будь-якому з пунктів 1-30 для вакцинації людини похилого віку проти грипу.
38. Застосування згідно з пунктом 37, де композиція індукує принаймні одну з і) поліпшену імунну відповідь CD4 Т-клітин, іі) поліпшену відповідь В-клітин пам'яті проти вказаного вірусу або антигенної композиції у вказаної особи похилого віку.
39. Застосування згідно з будь-яким з пунктів 36-38, де введення вказаної імуногенної композиції додатково індукує як поліпшену імунну відповідь CD4 Т-клітин, так і поліпшену відповідь В-клітин пам'яті.
40. Застосування згідно з будь-яким з пунктів 36 та 38-39, де вказана імунна відповідь CD4 Т-клітин втягує індукцію перехресно реактивної відповіді CD4 Т-хелперів.
41. Застосування згідно з будь-яким з пунктів 36-40, де цільова популяція являє собою осіб, старших 50 років.
42. Застосування згідно з пунктом 41, де цільова популяція являє собою осіб похилого віку, старших 65 років.
43. Застосування вірусу грипу або його антигенного препарату у виробництві імуногенної композиції для ревакцинації людей, раніше вакцинованих вірусом грипу або імуногенною композицією, як заявлено у будь-якому з пунктів 1-30.
44. Застосування згідно з пунктом 43, де композиція, що використовується для ревакцинації, містить додатковий ад'ювант.
45. Застосування згідно з пунктом 44, де вказаний ад'ювант є вибраним з групи, що складається з: ад'юванту на основі емульсії масло-у-воді, алюмінієвого ад'юванту, TLR-4 ліганду, сапоніну.
46. Застосування згідно з пунктом 45, де вказаний ад'ювант на основі емульсії масло-у-воді є визначеним у будь-якому з пунктів 1-16, a TLR-4 ліганд є визначеним у будь-якому з пунктів 17-22.
47. Застосування згідно з будь-яким з пунктів 43-46, де вказана імуногенна композиція для ревакцинації містить вірус грипу або його антигенний препарат, який розділяє спільні епітопи CD4 Т-клітин з розщепленим вірусом грипу або антигенним препаратом розщепленого вірусу, що використовується для першої вакцинації.
48. Застосування згідно з будь-яким з пунктів 43-47, де імунологічна відповідь після ревакцинації є будь-якою або двома, або усіма з наступних: поліпшеної CD4 відповіді проти вірусу грипу або його антигенного препарату або поліпшеної гуморальної відповіді, або поліпшеної відповіді В-клітин пам'яті.
49. Застосування згідно з будь-яким з пунктів 43-48, де антиген вірусу грипу або його антигенний препарат є таким з принаймні двох різних штамів вірусу грипу.
50. Застосування згідно з пунктом 49, де антиген вірусу грипу або його антигенний препарат є таким з трьох різних штамів вірусу грипу.
51. Застосування згідно з будь-яким з пунктів 43-50, де вказана імуногенна композиція для ревакцинації містить принаймні один штам вірусу грипу, який є асоційованим з пандемічним спалахом або має потенціал бути асоційованим з пандемічним спалахом.
52. Застосування згідно з пунктом 51 де вказаний пандемічний штам є вибраним з групи, яка складається з: H5N1, H9N2, H7N7, H2N2 та Н1 N1.
53. Застосування згідно з будь-яким з пунктів 43-52, де першу вакцинацію проводять композицією розщепленого вірусу грипу, що містить штам вірусу грипу, який може потенційно спричинити пандемічний спалах, а ревакцинацію здійснюють за допомогою циркулюючого пандемічного штаму.
54. Застосування згідно з будь-яким з пунктів 43-53, де вказана імуногенна композиція містить низьку дозу НА антигену.
55. Застосування згідно з будь-яким з пунктів 43-54, де вказаний антиген вірусу грипу або його антигенний препарат є одержаним з яєць або культури тканин.
56. Застосування антигену або антигенного препарату з першого штаму вірусу грипу у виробництві імуногенної композиції, як заявлено у будь-якому з пунктів 1-30 для захисту проти інфекцій грипу, спричинених варіантом штаму вірусу грипу.
57. Застосування згідно з пунктом 56, де перший штам вірусу грипу є асоційованим з пандемічним спалахом або має потенціал бути асоційованим з пандемічним спалахом.
58. Застосування згідно з пунктом 56, де варіант штаму вірусу грипу є асоційованим з пандемічним спалахом або має потенціал бути асоційованим з пандемічним спалахом.
59. Застосування згідно з пунктом 57 або 58, де вказаний пандемічний штам є вибраним з групи, яка складається з: H5N1, H9N2, H7N7, H2N2Ta H1N1.
60. Застосування згідно з будь-яким з пунктів 43-59, де вказаний вірус грипу є вибраним з групи, яка складається з: розщепленого вірусу грипу, цільного вірусу грипу, субодиничного вірусу грипу, віросоми вірусу грипу та його антигенного препарату.
Текст
1. Мультивалентна імуногенна композиція проти грипу, яка включає антиген вірусу грипу або його антигенний препарат принаймні з двох штамів вірусу грипу, причому принаймні один штам є асоційованим з пандемічним спалахом або має потенціал бути асоційованим з пандемічним спалахом, у комбінації з ад'ювантом на основі емульсії масло-у-воді, де вказаний ад'ювант на основі емульсії масло-у-воді включає метаболічне масло, стерин та/або альфа-токоферол та емульгувальний агент. 2. Композиція згідно з пунктом 1, де вказана емульсія масло-у-воді містить краплі масла, принаймні 70 % з яких за інтенсивністю є меншими ніж 1 мкм у діаметрі. 3. Композиція згідно з будь-яким з пунктів 1 або 2, де вказана емульсія масло-у-воді містить краплі масла, принаймні 70 % з яких за інтенсивністю є меншими ніж 500 нм у діаметрі. 4. Композиція згідно з будь-яким з пунктів 1-3, де вказана емульсія масло-у-воді містить краплі масла, принаймні 80 % з яких за інтенсивністю є меншими ніж 300 нм у діаметрі. 5. Композиція згідно з будь-яким з пунктів 1-4, де вказана емульсія масло-у-воді містить краплі масла, принаймні 90 % з яких за інтенсивністю знаходяться в діапазоні від 120 до 200 нм у діаметрі. 6. Композиція згідно з будь-яким з пунктів 1-5, де вказане метаболічне масло являє собою сквален. 7. Композиція згідно з будь-яким з пунктів 1-6, де вказане метаболічне масло є присутнім у кількості від 0,5 % до 20 % від загального об'єму вказаної імуногенної композиції. 8. Композиція згідно з будь-яким з пунктів 1-7, де вказане метаболічне масло є присутнім у кількості від 1,0 % до 10 % від загального об'єму вказаної імуногенної композиції. 9. Композиція згідно з будь-яким з пунктів 1-8, де вказане метаболічне масло є присутнім у кількості від 2,0 % до 6,0 % від загального об'єму вказаної імуногенної композиції. UA (21) a200710191 (22) 21.03.2006 (24) 25.08.2010 (86) PCT/EP2006/002837, 21.03.2006 (31) 0505989.4 (32) 23.03.2005 (33) GB (31) 0505998.5 (32) 23.03.2005 (33) GB (31) 0506000.9 (32) 23.03.2005 (33) GB (31) 0506001.7 (32) 23.03.2005 (33) GB (31) 0506004.1 (32) 23.03.2005 (33) GB (31) 0510589.5 (32) 24.05.2005 (33) GB (31) 0510591.1 (32) 24.05.2005 (33) GB (31) 0510593.7 (32) 24.05.2005 (33) GB (31) 0510596.0 (32) 24.05.2005 (33) GB (31) 0510598.6 (32) 24.05.2005 (33) GB (31) 0603788.1 (32) 24.02.2006 (33) GB (31) 0603789.9 (32) 24.02.2006 (33) GB (31) 0603790.7 (32) 24.02.2006 (33) GB (46) 25.08.2010, Бюл.№ 16, 2010 р. (72) АНОН ЕММАНУЕЛЬ ЖЮЛЬ, BE, СТЕФЕНН ЖАН, BE 2 (19) 1 3 10. Композиція згідно з будь-яким з пунктів 1-9, де вказаний стерин є холестерином. 11. Композиція згідно з будь-яким з пунктів 1-10, де вказаний альфа-токоферол є присутнім у кількості від 1,0 % до 20,0 % від загального об'єму вказаної імуногенної композиції. 12. Композиція згідно з будь-яким з пунктів 1-11, де вказаний альфа-токоферол є присутнім у кількості від 1,0 % до 5,0 % від загального об'єму вказаної імуногенної композиції. 13. Композиція згідно з будь-яким з пунктів 1-12, де співвідношення сквален:альфа-токоферол є рівним або меншим 1. 14. Композиція згідно з будь-яким з пунктів 1-13, де вказаний емульгувальний агент являє собою Твін 80. 15. Композиція згідно з будь-яким з пунктів 1-14, де вказаний емульгувальний агент є присутнім у кількості від 0,01 до 5,0 % (ваг./ваг.) від ваги вказаної імуногенної композиції. 16. Композиція згідно з будь-яким з пунктів 1-15, де вказаний емульгувальний агент є присутнім у кількості від 0,1 до 2,0 % (ваг./ваг.) від ваги вказаної імуногенної композиції. 17. Композиція згідно з будь-яким з пунктів 1-16, де імуногенна композиція додатково включає TLR4 ліганд. 18. Композиція згідно з будь-яким з пунктів 1-17, де вказаний TLR-4 ліганд є вибраним з групи, яка включає: нетоксичну похідну ліпіду А, таку як 3DMPL; синтетичну похідну ліпіду A; MDP; та RSV F білок. 19. Композиція згідно з будь-яким з пунктів 1-18, де вказана похідна ліпіду А являє собою 3D-MPL. 20. Композиція згідно з будь-яким з пунктів 1-19, де 3D-MPL є присутнім у кількості від 1 до 100 мкг (ваг./об.) на дозу композиції. 21. Композиція згідно з будь-яким з пунктів 1-20, де 3D-MPL є присутнім у кількості від 10 до 50 мкг/мл. 22. Композиція згідно з будь-яким з пунктів 1-20, де 3D-MPL є присутнім у кількості приблизно 25 мкг/мл. 23. Композиція згідно з будь-яким з пунктів 1-22, де вказана мультивалентна композиція є бівалентною, тривалентною або квадривалентною композицією. 24. Композиція згідно з будь-яким з пунктів 1-23, де вказаний пандемічний штам вірусу грипу є вибраним з групи, яка складається з: H5N1, H9N2, H7N7, H2N2 та H1N1. 25. Імуногенна композиція згідно з пунктом 24, де принаймні два штами вірусу грипу є вибраними з групи, яка складається з: H5N1, H9N2, H7N7, H2N2 та H1N1. 26. Імуногенна композиція згідно з будь-яким з пунктів 1-25, де вказаний антиген або антигенна композиція містить від 1 до 15 мкг НА на штам вірусу грипу. 27. Імуногенна композиція згідно з пунктом 26, де вказаний антиген або антигенна композиція містить низьку дозу НА на штам вірусу грипу. 28. Імуногенна композиція згідно з пунктом 27, де вказаний антиген або антигенна композиція містить від 2,5 до 7,5 мкг НА на штам вірусу грипу. 91701 4 29. Імуногенна композиція згідно з будь-яким з пунктів 1-28, де вказаний антиген або антигенна композиція знаходиться у формі: очищеного цільного вірусу грипу, інактивованого вірусу грипу або субодиничного(их) компоненту(ів) вірусу грипу. 30. Імуногенна композиція згідно з пунктом 29, де вказаний інактивований вірус грипу є розщепленим вірусом грипу. 31. Спосіб одержання імуногенної композиції вірусу грипу для пандемічної ситуації, де спосіб включає змішування антигену вірусу грипу або антигенного препарату з принаймні двох штамів вірусу грипу, принаймні один з яких є асоційованим з пандемічним спалахом або має потенціал бути асоційованим з пандемічним спалахом, з емульсією масло-у-воді. 32. Спосіб згідно з пунктом 31, де вказаний ад'ювант на основі емульсії масло-у-воді є таким, як визначено у будь-якому з пунктів 1-16. 33. Спосіб згідно з пунктом 32, де емульсія маслоу-воді додатково включає TLR-4 ад'ювант. 34. Спосіб згідно з пунктом 33, де TLR-4 ад'ювант є таким, як визначено у будь-якому з пунктів 17-22. 35. Імуногенна композиція, як заявлено у будьякому з пунктів 1-30 для застосування у медицині. 36. Застосування (а) вірусу грипу або його антигенного препарату та (b) ад'юванту на основі емульсії масло-у-воді у виробництві імуногенної композиції, як заявлено у будь-якому з пунктів 1-30 для індукції принаймні однієї з: і) поліпшеної імунної відповіді CD4 Т-клітин, іі) поліпшеної відповіді В-клітин пам'яті проти вказаного вірусу або антигенної композиції у людини. 37. Застосування вірусу грипу або його антигенного препарату та ад'юванту на основі емульсії масло-у-воді у приготуванні імуногенної композиції, як заявлено у будь-якому з пунктів 1-30 для вакцинації людини похилого віку проти грипу. 38. Застосування згідно з пунктом 37, де композиція індукує принаймні одну з і) поліпшену імунну відповідь CD4 Т-клітин, іі) поліпшену відповідь Вклітин пам'яті проти вказаного вірусу або антигенної композиції у вказаної особи похилого віку. 39. Застосування згідно з будь-яким з пунктів 3638, де введення вказаної імуногенної композиції додатково індукує як поліпшену імунну відповідь CD4 Т-клітин, так і поліпшену відповідь В-клітин пам'яті. 40. Застосування згідно з будь-яким з пунктів 36 та 38-39, де вказана імунна відповідь CD4 Т-клітин втягує індукцію перехресно реактивної відповіді CD4 Т-хелперів. 41. Застосування згідно з будь-яким з пунктів 3640, де цільова популяція являє собою осіб, старших 50 років. 42. Застосування згідно з пунктом 41, де цільова популяція являє собою осіб похилого віку, старших 65 років. 43. Застосування вірусу грипу або його антигенного препарату у виробництві імуногенної композиції для ревакцинації людей, раніше вакцинованих вірусом грипу або імуногенною композицією, як заявлено у будь-якому з пунктів 1-30. 5 91701 6 44. Застосування згідно з пунктом 43, де композиція, що використовується для ревакцинації, містить додатковий ад'ювант. 45. Застосування згідно з пунктом 44, де вказаний ад'ювант є вибраним з групи, що складається з: ад'юванту на основі емульсії масло-у-воді, алюмінієвого ад'юванту, TLR-4 ліганду, сапоніну. 46. Застосування згідно з пунктом 45, де вказаний ад'ювант на основі емульсії масло-у-воді є визначеним у будь-якому з пунктів 1-16, a TLR-4 ліганд є визначеним у будь-якому з пунктів 17-22. 47. Застосування згідно з будь-яким з пунктів 4346, де вказана імуногенна композиція для ревакцинації містить вірус грипу або його антигенний препарат, який розділяє спільні епітопи CD4 Тклітин з розщепленим вірусом грипу або антигенним препаратом розщепленого вірусу, що використовується для першої вакцинації. 48. Застосування згідно з будь-яким з пунктів 4347, де імунологічна відповідь після ревакцинації є будь-якою або двома, або усіма з наступних: поліпшеної CD4 відповіді проти вірусу грипу або його антигенного препарату або поліпшеної гуморальної відповіді, або поліпшеної відповіді В-клітин пам'яті. 49. Застосування згідно з будь-яким з пунктів 4348, де антиген вірусу грипу або його антигенний препарат є таким з принаймні двох різних штамів вірусу грипу. 50. Застосування згідно з пунктом 49, де антиген вірусу грипу або його антигенний препарат є таким з трьох різних штамів вірусу грипу. 51. Застосування згідно з будь-яким з пунктів 4350, де вказана імуногенна композиція для ревакцинації містить принаймні один штам вірусу грипу, який є асоційованим з пандемічним спалахом або має потенціал бути асоційованим з пандемічним спалахом. 52. Застосування згідно з пунктом 51 де вказаний пандемічний штам є вибраним з групи, яка складається з: H5N1, H9N2, H7N7, H2N2 та Н1 N1. 53. Застосування згідно з будь-яким з пунктів 4352, де першу вакцинацію проводять композицією розщепленого вірусу грипу, що містить штам вірусу грипу, який може потенційно спричинити пандемічний спалах, а ревакцинацію здійснюють за допомогою циркулюючого пандемічного штаму. 54. Застосування згідно з будь-яким з пунктів 4353, де вказана імуногенна композиція містить низьку дозу НА антигену. 55. Застосування згідно з будь-яким з пунктів 4354, де вказаний антиген вірусу грипу або його антигенний препарат є одержаним з яєць або культури тканин. 56. Застосування антигену або антигенного препарату з першого штаму вірусу грипу у виробництві імуногенної композиції, як заявлено у будь-якому з пунктів 1-30 для захисту проти інфекцій грипу, спричинених варіантом штаму вірусу грипу. 57. Застосування згідно з пунктом 56, де перший штам вірусу грипу є асоційованим з пандемічним спалахом або має потенціал бути асоційованим з пандемічним спалахом. 58. Застосування згідно з пунктом 56, де варіант штаму вірусу грипу є асоційованим з пандемічним спалахом або має потенціал бути асоційованим з пандемічним спалахом. 59. Застосування згідно з пунктом 57 або 58, де вказаний пандемічний штам є вибраним з групи, яка складається з: H5N1, H9N2, H7N7, H2N2Ta H1N1. 60. Застосування згідно з будь-яким з пунктів 4359, де вказаний вірус грипу є вибраним з групи, яка складається з: розщепленого вірусу грипу, цільного вірусу грипу, субодиничного вірусу грипу, віросоми вірусу грипу та його антигенного препарату. Даний винахід відноситься до вакцинних композицій вірусу грипу та режимів імунізації проти захворювання грипом, їх застосування у медицині, зокрема, їх застосування у посиленні імунних відповідей на різні антигени, та до способів їх одержання. Зокрема, винахід відноситься до мультивалентних імуногенних композицій проти вірусу грипу, що включають антиген вірусу грипу або його антигенний препарат з принаймні двох штамів вірусу грипу, при цьому принаймні один штам є асоційованим з пандемічним спалахом або має потенціал бути асоційованим з пандемічним спалахом, у комбінації з ад'ювантом на основі емульсії масло-у-воді. Віруси грипу являють собою найбільш убіквітарні віруси у світі, що впливають як на людей, так і на поголів'я худоби. Грип призводить до економічних втрат, захворюваності та навіть смертності, що є суттєвими. Вірус грипу являє собою РНК-вірус з оболонкою, що має розмір частинок приблизно 125 нм у діаметрі. Він складається, по суті, з внутрішнього нуклеокапсиду або ядра рибонуклеїнової кислоти (РНК), асоційованої з нуклеопротеїном, що оточений вірусною оболонкою, яка має двошарову ліпідну структуру та зовнішні глікопротеїни. Внутрішній шар вірусної оболонки складається, головним чином, з матриксних білків, а зовнішній шар звичайно містить ліпідний матеріал, що має походження від хазяїна. Вірус грипу включає два поверхневі антигени, глікопротеїни нейрамінідази (NA) гемаглютиніну (НА), які виявляються як виступи довжиною від 10 до 12 нм на поверхні частинок. Саме ці поверхневі білки, зокрема, гемаглютинін, визначають антигенну специфічність підтипів грипу. Ці поверхневі антигени поступово, інколи швидко, піддаються деяким змінам, що приводять до антигенних варіацій вірусу грипу. Такі антигенні зміни, що називаються «дрейфами» та «зсувами» є непередбачуваними та можуть мати значний вплив з імунологічної точки зору, оскільки вони, у кінці кінців, приводять до появи нових штамів вірусу грипу, що дозволяє вірусу уникнути імунної системи, викликаючи добре відомі, майже щорічні епідемії. 7 Штами вірусу грипу, введені у вакцину проти грипу, кожного сезону визначаються Всесвітньою організацією охорони здоров'я у співробітництві з національними органами охорони здоров'я та виробниками вакцин. НА являє собою найбільш важливий антиген у визначенні серологічної специфічності різних штамів вірусу грипу. Цей білок вагою 75-80 кДа містить численні антигенні детермінанти, деякі з яких знаходяться у ділянках, які піддаються змінам послідовності у різних штамів (штамоспецифічні детермінанти), а інші - у ділянках, що є спільними для багатьох молекул НА (загальні детермінанти). Віруси грипу викликають епідемії майже кожної зими з рівнем зараження для вірусу типу А або В таким високим, як 40%, протягом періоду часу шість тижнів. Грипозна інфекція приводить до різних станів захворювання від безсимптомної інфекції та легкої інфекції верхніх дихальних шляхів до тяжкої вірусної пневмонії. Типові епідемії грипу викликають підвищення частоти виникнення пневмонії та захворювання нижніх дихальних шляхів, про що свідчать високі проценти госпіталізації або смертності. Тяжкість цього захворювання перш за все визначається віком хазяїна, станом його імунної системи та сайтом інфекції. Люди похилого віку, у віці 65 років та старші, є особливо уразливими, вони складають 80-90% усіх смертей, пов'язаних з грипом у розвинутих країнах. Особи з існуючими хронічними захворюваннями є також найбільш можливою групою щодо виникнення таких ускладнень. Діти молодшого віку також можуть страждати на тяжку форму захворювання. Таким чином, ці групи, зокрема, потребують захисту. Крім цих груп ризику, органи охорони здоров'я також рекомендують вакцинацію здорових дорослих, які перебувають у контакті з особами похилого віку. Вакцинація грає важливу роль у контролі щорічних епідемій грипу. Доступні на сьогоднішній день вакцини проти грипу є або інактивованими або живими атенуйованими вакцинами проти грипу. Інактивовані вакцини грипу складаються з трьох можливих форм антигенного препарату: інактивований цільний вірус, субвіріони, де очищені вірусні частинки зруйновані детергентами або іншими реагентами для солюбілізації ліпідної оболонки (так звана «розщеплена» вакцина) або очищені НА та NA (субодинична вакцина. Ці інактивовані вакцини вводяться внутрішньом'язово (в/м) або інтраназально (і/н). Вакцини проти грипу усіх видів звичайно являють собою тривалентні вакцини. Вони в загальному випадку містять антигени, що походять від двох штамів вірусу грипу А та одного штаму вірусу грипу В. Стандартна доза 0,5 мл, яка вводиться, у більшості випадків містить 15 мкг антигенного компоненту гемаглютиніну з кожного штаму, як вимірюється за допомогою одномірної радіальної імунодифузії (SRD) (J.M. Wood та ін: An improved single radial immunodiffusion technique for the assay of influenza haemagglutinin antigen: adaptation for potency determination of inactivated whole virus and subunit vaccines. J. Biol. Stand. 5 (1977) 237-247; J. M. Wood та ін., International collaborative study of 91701 8 single radial diffusion and immunoelectrophoresis techniques for the assay of haemagglutinin antigen of influenza virus. J. Biol. Stand. 9 (1981) 317-330). Вакцини грипу, що існують на сьогоднішній день, вважаються безпечними для усіх вікових груп (De Donato та ін. 1999, Vaccine, 17, 30943101). Проте є небагато фактів, які свідчать про те, що існуючі на сьогоднішній день вакцини грипу працюють у маленьких дітей віком до двох років. Крім того, оприлюднені значення ефективності вакцини для запобігання типового підтвердженого захворювання на грип складають 23-72% для людей похилого віку, що є значно нижчим, ніж значення ефективності 60-90%, які оприлюднені для дорослих людей більш молодого віку (Govaert, 1994, J. Am. Med. Assoc, 21,166-1665; Gross, 1995, Ann Intern. Med. 123, 523-527). Було показано, що ефективність вакцини проти грипу корелює з титрами сироваткових антитіл до вірусного штаму, які інгібують гемаглютинін (НІ), а деякі дослідження виявили, що дорослі люди старшого віку демонструють нижчі титри НІ після імунізації вірусом грипу, ніж дорослі особи молодшого віку (Murasko, 2002, Experimental gerontology, 37, 427-439). Таким чином, все ще існує потреба у нових вакцинах з поліпшеною імуногенністю. Композиція вакцинного антигену з потужними ад'ювантами являє собою можливий підхід до поліпшення імунних відповідей на субвіріонні антигени. Субодинична вакцина грипу, що містить ад'ювант MF59 у формі емульсії масло-у-воді, є комерційно доступною та демонструє свою здатність індукувати вищий титр антитіл, ніж той, що отриманий для субодиничної вакцини, яка не містить ад'юванту (De Donato та ін. 1999, Vaccine, 17, 3094-3101). Проте у більш пізніх публікаціях та сама вакцина не продемонструвала свого поліпшеного профілю у порівнянні з розщепленою вакциною без ад'юванту (Puig-Barbera та ін., 2004, Vaccine 23, 283-289). Як відомості рівня техніки можна зазначити, що під час інтер-пандемічних періодів, ціркулюючі віруси грипу є такими, що близькі до тих, які зустрічалися під час попередньої епідемії. Віруси поширюються серед людей з різними рівнями імунітету від інфекцій з раннього дитинства. Така циркуляція протягом періоду 2-3 років сприяє відбору нових штамів, що є у достатній мірі зміненими для того, щоб знову спричинити епідемію серед основної популяції; цей процес називається «антигенним дрейфом». «Дрейф-варіанти» можуть мати різні впливи у різних угруповань, областей, країн або континентів у будь-якому році, незважаючи на те, що протягом декількох років їх сумарний вплив є часто одним й тим самим. Іншими словами, пандемії грипу виникають тоді, коли з'являється новий вірус грипу, проти якого людська популяція не має імунітету. Типові епідемії грипу викликають підвищення частоти виникнення пневмонії та захворювань нижніх дихальних шляхів, про що свідчать підвищені рівні госпіталізації або смертності. Люди похилого віку або ті, що мають хронічні захворювання, найбільш ймовірно піддаються таким ускладненням, але немовлята також можуть страждати на тяжке захворювання. 9 Через непередбачувані проміжки часу з'являються нові віруси грипу з ключовим поверхневим антигеном, гемаглютиніном, зовсім іншого підтипу, які відрізняються від штамів, які циркулювали у попередньому сезоні. Так, утворені в результаті цього антигени можуть відхилятися на 20-50% від відповідного білка штамів, які раніше циркулювали у людей. Це може приводити до появи вірусу, що уникає «популяційного імунітету» та приводить до виникнення пандемій. Цей феномен називається «антигенним зсувом». Вважається, що принаймні останні пандемії виникли, коли вірус грипу з різних видів, такий, як вірус грипу птахів або свиней, перетнув видовий бар'єр. Якщо такі віруси мають потенціал до розмноження від особи до особи, вони можуть поширюватися по усьому світу у межах періоду від декількох місяців до року, призводячи до пандемії. Наприклад, у 1957 році (азіатська пандемія грипу) віруси підтипу H2N2 замінили H1N1 віруси, що циркулювали у людській популяції з принаймні 1918 року, коли вірус був вперше ізольований. Н2 НА та N2 NA піддалися антигенному дрейфу в період між 1957 та 1968 роками доки НА не був заміщений у 1968 році (гонконгська пандемія грипу) появою H3N2 підтипу вірусу грипу, після чого N2 NA продовжував здійснювати дрейф з НЗ НА (Nakajima та ін., 1991, Epidemiol. Infect. 106, 383-395). Ознаки штаму вірусу грипу, що надають йому потенціалу викликати пандемічний спалах, є наступними: він містить новий гемаглютинін у порівнянні з гемаглютиніном штамів, які циркулюють на сьогоднішній день, що може супроводжуватися або не може супроводжуватися зміною підтипу нейрамінідази; він є здатним передаватися горизонтально у людській популяції; та він є патогенним для людини. Новий гемаглютинін може бути таким, що не є вираженим у людській популяції протягом тривалого проміжку часу, ймовірно протягом ряду десятиріч, так як Н2. Або він може бути гемаглютиніном, який не був циркулюючим у людській популяції до цього, наприклад, Н5, Н9, Н7 або Н6, які виявлені у птахів. У будь-якому випадку більшість або принаймні велика частина, або навіть ціла популяція не стикалася з цим антигеном та є імунологічно інтактною до нього. Все ще існує потреба у поліпшених вакцинах проти грипу, особливо у випадку пандемій грипу та для популяції людей похилого віку. КОРОТКИЙ ВИКЛАД ВИНАХОДУ У першому аспекті даного винаходу забезпечується мультивалентна імуногенна композиція, що включає вірус грипу або його антигенний препарат, що містить принаймні два штами вірусу грипу, при цьому принаймні один штам є асоційованим з пандемічним спалахом або має потенціал бути асоційованим з пандемічним спалахом у комбінації з ад'ювантом на основі емульсії масло-уводі, де вказаний ад'ювант на основі емульсії масло-у-воді включає метаболічне масло, стерин та емульгувальний агент. Прийнятний стерин являє собою альфатокоферол. 91701 10 Прийнятні пандемічні штами представляють собою, але не обмежені, наступні: H5N1, H9N2, H7N7, H2N2 та Н1N1. В іншому аспекті винахід забезпечує спосіб одержання імуногенної композиції вірусу грипу для пандемічної ситуації, де спосіб включає змішування антигену вірусу грипу або його антигенного препарату з принаймні двох штамів вірусу грипу, де принаймні один штам є асоційованим з пандемічним спалахом або має потенціал бути асоційованим з пандемічним спалахом, з емульсією масло-у-воді, як визначено в даній заявці вище. У третьому аспекті забезпечується імуногенна композиція, як визначено в даній заявці, для застосування у медицині. В іншому аспекті забезпечується застосування (а) вірусу грипу або його антигенного препарату, та (Ь) ад'юванту на основі емульсії масло-у-воді у виробництві імуногенної композиції для індукції принаймні одного з і) поліпшеної відповіді CD4 Тклітин, іі) поліпшеної відповіді В-клітин пам'яті проти вказаного вірусного антигену вірус або антигенної композиції у людини, бажано в осіб або у популяції осіб з порушеним імунітетом, таких, як дорослі особи з високим ступенем ризику або особи похилого віку, що є переважним. Бажано, коли імуногенна композиція є такою, як визначено в даній заявці. Також забезпечується застосування вірусу грипу або його антигенного препарату та ад'юванту на основі емульсії масло-у-воді при одержанні імуногенної композиції, як визначено в даній заявці, для вакцинації людей похилого віку проти грипу. У специфічному втіленні імуногенна композиція є здатною до індукції як поліпшеної імунної відповіді CD4 Т-клітин, так і поліпшеної відповіді Вклітин пам'яті у порівнянні з такою, одержаною при використанні антигену або антигенної композиції без ад'юванту У додатковому аспекті забезпечується застосування вірусу грипу або його антигенного препарату у виробництві імуногенної композиції для ревакцинації людей, що раніше були вакциновані за допомогою мультивалентної імуногенної композиції, що включає антиген вірусу грипу або його антигенний препарат, що містить принаймні два штами вірусу грипу, де принаймні один штам є асоційованим з пандемічним спалахом або має потенціал бути асоційованим з пандемічним спалахом, у комбінації з ад'ювантом на основі емульсії масло-у-воді, як визначено в даній заявці. У специфічному втіленні композиція, що використовується для ревакцинації, може не містити ад'юванту або містити ад'ювант, зокрема, ад'ювант на основі емульсії масло-у-воді. В іншому специфічному втіленні імуногенна композиція для ревакцинації містить вірус грипу або його антигенний препарат, який розділяє спільні епітопи CD4 Тклітин, що й вірус грипу або його антигенний препарат, який використовувався для першої вакцинації Бажано, коли ревакцинацію здійснюють у осіб, яких було вакциновано у попередньому сезоні проти грипу. Типово, вакцинацію проводять при 11 наймні через 6 місяців після першої вакцинації, бажано через 8-14 місяців по тому, найбільш бажано через 10-12 місяців. Бажано, коли вказана емульсія масло-у-воді включає метаболічне масло, альфа-токоферол та емульгувальний агент. В іншому специфічному втіленні вказаний ад'ювант на основі емульсії масло у воді включає принаймні одне метаболічне масло у кількості від 0,5% до 20% від загального об'єму та містить масляні краплі, принаймні 70% з яких за інтенсивністю має діаметр менший, ніж 1 мкм. Ще в одному аспекті даного винаходу забезпечується застосування антигену або антигенного препарату з одного штаму вірусу грипу у виробництві імуногенної композиції, як визначено в даній заявці, для захисту проти інфекцій грипу, спричинених варіантом штаму вірусу. В іншому аспекті забезпечується спосіб вакцинації людської особи або популяції осіб з імунологічними порушеннями, такої як дорослі люди високого ступеня ризику або люди похилого віку, імуногенною композицією, що включає антиген вірусу грипу або його антигенний препарат, що містить принаймні два штами вірусу грипу, де принаймні один штам є асоційованим з пандемічним спалахом або має потенціал бути асоційованим з пандемічним спалахом, у комбінації з ад'ювантом на основі емульсії масло-у-воді, як визначено в даній заявці. Ще в одному втіленні винахід забезпечується спосіб ревакцинації людей, що раніше були вакциновані мультивалентною імуногенною композицією проти грипу, що включає антиген вірусу грипу або його антигенний препарат, що містить принаймні два штами вірусу грипу, де принаймні один штам є асоційованим з пандемічним спалахом або має потенціал бути асоційованим з пандемічним спалахом, у комбінації з ад'ювантом на основі емульсії масло-у-воді, при цьому вказаний спосіб передбачає введення вказаній людині імуногенної композиції, що включає вірус грипу з ад'ювантом або без ад'юванта. Ще в одному втіленні забезпечується спосіб вакцинації популяції людей або окремої особи проти одного штаму вірусу грипу, після чого здійснюють ревакцинацію вказаної особи або популяції проти варіанта штаму вірусу грипу, вказаний спосіб включає введення вказаній особі (і) першої композиції, що містить вірус грипу або його антигенний препарат з першим штамом вірусу грипу та ад'ювант на основі емульсії масло-у-воді, та (і) другої імуногенної композиції, що включає варіант вказаного першого штаму вірусу грипу. У специфічному втіленні вказаний перший штам є асоційованим з пандемічним спалахом або має потенціал бути асоційованим з пандемічним спалахом. В іншому специфічному втіленні вказаний варіант штаму є асоційованим з пандемічним спалахом або має потенціал бути асоційованим з пандемічним спалахом. Інші аспекти та переваги даного винаходу описані далі у наступному детальному описі бажаних втілень винаходу. ПІДПИСИ ДО ФІГУР 91701 12 Фігура 1: Розподіл розмірів частинок крапель масла в емульсії масло-у-воді SB62, як визначено за допомогою PCS. Фігура 1А показує вимірювання розмірів для SB62 партії 1023 за допомогою Malvern Zetasizer 3000HS: А = розведення 1/10000 (від Rec22 до Rec24) (аналіз у Контін та адаптованій оптичній моделі 1.5/0.01); В = розведення 1/20000 (від Rec28 до Rec30) (аналіз у Контін та адаптованій оптичній моделі 1.5/0.01). Фігура 1В показує схематичну ілюстрацію запису 22 (верхня частина) та запису 23 (нижня частина) за інтенсивністю. Фігура 2: Схематична ілюстрація препарату VHL маси Фігура 3: Схематична ілюстрація препарату AS03+MPL ад'юванта Фігура 4: Explo Flu-001 клінічне дослідження. Відповідь CD4 Т-клітин на розщеплений антиген вірусу грипу (Q1 = перший квартиль, Q3 = третій квартиль). Фігура 5: Explo Flu-001 клінічне дослідження. Відповідь CD8 Т-клітин на антиген розщепленого вірусу грипу (Q1 = перший квартиль, Q3 = третій квартиль). Фігура 6: Explo Flu-001 клінічне дослідження. Перехресно-реактивна відповідь CD4 Т-клітин на антиген розщепленого вірусу грипу після вакцинації за допомогою Fluarix + AS03. Фігура 7: Explo Flu-001 клінічне дослідження. Відповідь В-клітин пам'яті після вакцинації. Фігура 8: Explo Flu-002 клінічне дослідження. Відповідь CD4 Т-клітин проти антигену розщепленого вірусу грипу після ревакцинації. Фігура 9: Explo Flu-002 клінічне дослідження. Анти-НІ титри після ревакцинації. Фігура 10: Дослідження на тхорах І. Моніторинг температури (примування та контрольне зараження).). Фігура 10А являє собою примування, Фігура 10В являє собою контрольне зараження. Фігура 11 : Дослідження на тхорах І. Виділення вірусу з організму. Фігура 12: Дослідження на тхорах II. Моніторинг температури (примування та контрольне зараження).). Фігура 12А являє собою примування, Фігура 12В являє собою контрольне зараження. Фігура 13 : Дослідження на тхорах II. Виділення вірусу з організму. Фігура 14: Дослідження на тхорах II. Титри НІ до H3N2 A/Panama (вакцинний штам) (Фігура 14А) та до H3N2 A/Wyoming (штам для контрольного зараження) (Фігура 14В). Фігура 15 : Дослідження на мишах. Частота зустрічальності CD4 Т-клітин у С57ВІ/6 примованої миші при використанні цільного інактивованого вірусу як антигену для повторної стимуляції (день 7 після імунізації). Фігура 16 : Дослідження на мишах. Частота зустрічальності CD8 Т-клітин у С57ВІ/6 примованої миші при використанні цільного інактивованого вірусу як антигену для повторної стимуляції (день 7 після імунізації). Фігура 17: Дослідження на мишах. Частота зустрічальності CD4 (верхня частина) та CD8 (нижня частина) Т-клітин у С57ВІ/6 у миші, примованої за допомогою гетерологічних штамів при використан 13 ні цільного інактивованого вірусу як антигену для повторної стимуляції (день 7 після імунізації). Фігура 18: Клінічне дослідження на людях. Відповідь В-клітин пам'яті після вакцинації людей похилого віку за допомогою Fluarix, Fluarix + AS03, Fluarix + AS03+MPL (різниця між періодами до вакцинації та після вакцинації). Фігура 19: Дослідження на тхорах III. Моніторинг температури до та після контрольного зараження. Фігура 20: Дослідження на тхорах III. Виділення вірусу з організму до та після контрольного зараження. Фігура 21: Дослідження на тхорах III. Титри НІ до H3N2 Α/Woming (вакцинний штам). Фігура 22: Дослідження на тхорах III. Титри НІ до H3N2 A/Panama (штам для контрольного зараження). Фігура 23 : Клінічне дослідження на людях. Титри НІ (GMT) на 21, 90 та 180 дні після вакцинації (персистенція). Фігура 24: Клінічне дослідження на людях. CD4 відповідь - усі дослідження подвійні - пул антигену на 21, 90 та 180 дні після вакцинації (персистенція). Фігура 25: Клінічне дослідження на людях. Титри НІ у клінічному дослідженні ревакцинації за допомогою AS03+MPL у порівнянні з Fluarix. Фігура 26: Клінічне дослідження на людях. СМІ для CD4 відповіді - усі дослідження подвійні - пул антигену на 0 та 21 дні. Фігура 27: Клінічне дослідження на людях при використанні AS03+MPL у двох концентраціях. Титри НІ на 0 та 21 дні. Фігура 28: Клінічне дослідження на людях при використанні AS03+MPL у двох концентраціях. Реактогенність. ДЕТАЛЬНИЙ ОПИС Винахідники згідно з даним винаходом виявили, що композиція вірусу грипу, яка включає вірус грипу або його антигенний препарат разом з ад'ювантом на основі емульсії масло-у-воді, що містить метаболічне масло, стерин, такий як альфатокоферол, та емульгувальний агент, є здатною до поліпшення імунної відповіді CD4 Т-клітин та/або відповіді В-клітин пам'яті проти вказаного антигену або антигенної композиції у людини у порівнянні з такими, що одержані при використанні вірусу або його антигенного препарату без ад'юванту. Композиції з ад'ювантом на основі емульсії масло-у-воді, як визначено в даній заявці, будуть переважно використовуватися для індукції антигрипозної відповіді СD4-Т-клітин, здатної до виявлення епітопів вірусу грипу, презентованих молекулами класа II МНС Заявник даного винаходу виявив, що композиція є ефективною для націлювання опосередкованої клітинами імунної системи для того, щоб підвищити реактивність проти гомологічних штамів вірусу грипу та його «дрейф»штамів (при вакцинації та інфекції). Композиції вірусу грипу з ад'ювантом згідно з даним винаходом мають декілька переваг: 1) Поліпшена імуногенність: вони дозволять відновити слабку імунну відповідь у людей похилого віку (вік яких перевищує 50 років, типово віком 91701 14 старше 65 років) до рівнів, які спостерігаються у молодих людей (антитілогенез та/або відповідь Тклітин); 2) Поліпшений профіль перехресного захисту: підвищений перехресний захист проти варіантів (дрейф-варіантів) штамів вірусу грипу; 3) Вони також дозволять знизити дозу антигену, що використовується для подібної відповіді, забезпечуючи, таким чином, підвищену здатність у випадку необхідності (наприклад, у випадку пандемій). Композиції для застосування у даному винаході є здатними забезпечити кращий серозахист проти грипу після ревакцинації, як оцінено на ряді осіб, що відповідає кореляції захисту проти грипу. Крім того, композиція для застосування згідно з даним винаходом також є здатною індукувати тенденцію до більш високої відповіді В-клітин пам'яті після першої вакцинації людини та до більш високої гуморальної відповіді після ревакцинації у порівнянні з композицією, яка не містить ад'юванту. Винахідники також змогли продемонструвати, що заявлена композиція з ад'ювантом була спроможною не тільки індукувати, але й також підтримувати протективні рівні антитіл проти усіх трьох штамів, які присутні у вакцині, у більшій кількості осіб у порівнянні з даними, одержаними з композицією без ад'юванту (див., наприклад, Таблицю 43). Таким чином, ще в одному втіленні заявлена композиція є здатною забезпечити персистентну імунну відповідь проти захворювання, близького до грипу. Зокрема, під персистенцією розуміють імунну відповідь шляхом утворення НІ антитіл, яка є здатною відповідати нормативному критерію через принаймні три місяці, бажано через принаймні 6 місяців, після вакцинації. Зокрема, заявлена композиція є здатною індукувати протективні рівні антитіл у > 70% осіб, переважно у >80% осіб або переважно у > 90% осіб для принаймні одного штаму вірусу грипу, бажано для усіх штамів, які присутні у вакцині, через принаймні три місяці. В особливому аспекті протективні рівні антитіл >90% одержані через принаймні 6 місяців після вакцинації проти принаймні одного, переважно двох або усіх штамів, які присутні у вакцинній композиції. Штами вірусу грипу та антигени Вірус грипу або його антигенний препарат для застосування згідно з даним винаходом може являти собою розщеплений вірус грипу або антигенний препарат розщепленого вірусу. В альтернативному втіленні препарат вірусу грипу може містити інший тип інактивованого антигену вірусу грипу, такий як інактивований цільний вірус або очищені НА та NA (субодинична вакцина) або віросому вірусу грипу. Ще в одному втіленні вірус грипу може являти собою препарат живого атенуйованого вірусу грипу. Розщеплений вірус грипу або антигенний препарат розщепленого вірусу для застосування згідно з даним винаходом переважно являє собою інактивований вірусний препарат, в якому вірусні частинки зруйновані за допомогою детергентів або інших реагентів для солюбілізації ліпідної оболонки. Розщеплений вірус грипу або антигенні препа 15 рати розщепленого вірусу переважно одержують шляхом фрагментації цільного вірусу грипу, або інфекційного, або інактивованого, з солюбілізуючими концентраціями органічних розчинників або детергентів та подальшого видалення усього або більшої частини солюбілізуючого агента та деякої частини або основної частини вірусного ліпідного матеріалу. Під антигенним препаратом розщепленого вірусу розуміють розщеплений вірусний препарат, який може бути у деякій мірі підданий очистці у порівнянні з розщепленим вірусом, зберігаючи при цьому більшість антигенних властивостей компонентів розщепленого вірусу. Наприклад, коли вірус одержують у яйцях, то розщеплений вірус може бути очищений від забруднюючих білків яйця, або коли він вирощується у культурі клітин, то він може бути очищений від контамінантів хазяйської клітини. Антигенний розщеплений вірусний препарат може включати антигенні компоненти розщепленого вірусу більше ніж одного вірусних штамів. Вакцини, що містять розщеплений вірус (так звані розщеплені вакцини грипу), або антигенні препарати розщепленого вірусу в загальному випадку містять залишковий матриксний білок та нуклеопротеїн, інколи ліпід, а також мембранні білки оболонки. Такі вакцини на основі розщепленого вірусу будуть звичайно містити більшість або усі структурні білки вірусу, хоча необов'язково у тих самих співвідношеннях, в яких вони існують у цільному вірусі. Альтернативно, вірус грипу може бути у формі вакцини на основі цільного вірусу. Це може бути перевагою у порівнянні з вакциною на основі розщепленого вірусу для пандемічних ситуацій, оскільки при цьому уникають непевності щодо факту, чи може вакцина на основі розщепленого вірусу бути успішно одержана для нового штаму вірусу грипу. Для деяких штамів традиційні детергенти, що використовуються для одержання розщепленого вірусу, можуть пошкоджувати вірус та робити його неприйнятним для використання. Незважаючи на те що завжди існує можливість використовувати різні детергенти та/або удосконалити різні процеси для одержання розщепленої вакцини, це може зайняти деякий час, що може бути неприйнятним у пандемічній ситуації. У доповнення до більшого ступеня упевненості при використанні підходу з цільним вірусом, у даному випадку існує також більш висока можливість для одержання вакцини, ніж для розщепленого вірусу, оскільки значні кількості антигену втрачаються під час додаткових етапів очистки, які є необхідними для одержання прийнятної розщепленої вакцини. В іншому втіленні препарат вірусу грипу знаходиться в формі очищеної субодиничної вакцини грипу. Субодиничні вакцини грипу в загальному випадку містять два основні білки оболонки, НА та NA, та можуть мати додаткову перевагу у порівнянні з вакцинами на основі цільного віріону, оскільки вони звичайно є менш реактогенними, зокрема, у молодих осіб, які піддаються вакцинації. Субодиничні вакцини можуть бути одержані або рекомбінантно або очищені зі зруйнованих вірусних частинок. 91701 16 В іншому втіленні препарат вірусу грипу знаходиться у формі віросоми. Віросоми -це сферичні, одношарові везикули, які зберігають функціональні вірусні глікопротеїни оболонки НА та NA в аутентичній конформації, включеними у фосфоліпідну двошарову мембрану віросоми. Вказаний вірус грипу або його антигенний препарат можуть бути одержані з яєць або культури тканин. Наприклад, антиген вірусу грипу або його антигенні препарати згідно з даним винаходом можуть бути одержані шляхом традиційного способу на ембріонах пташиних яєць, шляхом вирощування вірусу грипу у яйцях та очистки та збору алантоїсної рідини. Яйця можуть бути зібрані у великій кількості протягом короткого періоду часу. Альтернативно, вони можуть бути одержані шляхом будьякого зі способів нового покоління при використанні культури тканин для вирощування вірусу або експресії рекомбінантних поверхневих антигенів вірусу грипу. Прийнятні клітинні субстрати для вирощування вірусу включають, наприклад, клітини нирки собаки, такі, як MDCK або клітини, одержані з клону MDCK, MDCK-подібні клітини, клітини нирки мавпи, такі, як клітини AGMK, включаючи клітини Vero, прийнятні лінії клітин свиней або будь-який інший тип клітин ссавців, прийнятний для продукції вірусу грипу для вакцинних цілей. Прийнятні клітинні субстрати також включають клітини людини, наприклад, клітини MRC-5. Прийнятні клітинні субстрати не обмежені лініями клітин; наприклад, первинні клітини, такі, як клітини курячих фібробластів та лінії клітин птахів, також включаються. Антиген вірусу грипу або його антигенний препарат можуть бути одержані шляхом будь-якого з ряду комерційно прийнятних процесів, наприклад, процесу розщеплення вірусу грипу, описаного у патентах DD 300833 та DD 211444, введених в дану заявку як посилання. Традиційно спосіб split flu (розщеплення вірусу грипу) здійснюють при використанні обробки розчинником/детергентом, таким, як три-н-бутилфосфат або діетиловий етер у комбінації з Твін™ (що є відомим як "Твін-етер" розщеплення), цей процес ще використовується на деяких продукційних об'єктах. Інші розщеплювальні агенти, що зараз використовуються, включають детергенти або протеолітичні ферменти або солі жовчних кислот, наприклад, дезоксихолат натрію, як описано у патенті DD 155 875, введеному в дану заявку як посилання. Детергенти, що можуть використовуватися як розщеплювальні агенти, включають катіонні детергенти, наприклад, цетилтриметиламоній бромід (СТАВ), інші іонні детергенти, наприклад, лаурилсульфат, тауродезоксихолат, або неіонні детергенти, такі, як такі, що описані вище, включаючи Тритон Х-100 (наприклад, у процесі, описаному Una таін., 2000, Biologicals 28, 95-103) та Тритон N-101, або комбінації будь-яких двох або більше детергентів. Процес одержання для розщепленої вакцини може включати ряд різноманітних етапів фільтрації та/або інших етапів відокремлення, таких, як ультрацентрифугування, ультрафільтрація, зональне центрифугування та хроматографія (напри 17 клад, . іонообмінна) у різних комбінаціях та необов'язково етап інактивації, наприклад, при використанні тепла, формальдегіду або β-пропіолактону або ультрафіолетових променів, який можна проводити перед або після розщеплення. Процес розщеплення можна проводити як періодичний процес, безперервний або напівбезперервний процес. Бажані процеси розщеплення та очистки для розщепленої імуногенної композиції описані публікації WO 02/097072. Бажані розщеплені вакцинні антигенні препарати вірусу грипу згідно з даним винаходом включають залишкову кількість Твіна 80 та/або Тритону Х-100, що залишилися в результаті продукційного процесу, хоча ці речовини можуть додаватися або їх концентрації можуть доводитися після приготування розщепленого антигену. Бажано, коли є присутнім як Твін 80, так і Тритон Х-100. Бажані інтервали для заключних концентрацій цих неіонних сурфактантів у вакцинній дозі складають: Твін 80: від 0,01 до 1%, більш бажано приблизно 0,1% (об./об.) Тритон Х-100: від 0,001 до 0,1 (% ваг./об.), більш бажано від 0,005 до 0,02% (ваг./об.). У специфічному втіленні заключна концентрація для Твіну 80 коливається від 0,045% до 0,09% ваг./об. В іншому специфічному втіленні антиген забезпечується як двократно концентрована суміш, яка має концентрацію Твіну в діапазоні від 0,045 до 0,2% (ваг./об.) та яка повинна розводитися у два рази при одержанні заключної композиції з ад'ювантом (або буфером у контрольній композиції). В іншому специфічному втіленні заключна концентрація для Тритону Х-100 коливається від 0,005% до 0,017% ваг./об. В іншому специфічному втіленні антиген забезпечується як двократно концентрована суміш, яка має концентрацію Тритону Х-100 у діапазоні від 0,005 до 0,034% (ваг./об.) та яка повинна розводитися у два рази при одержанні заключної композиції з ад'ювантом (або буфером у контрольній композиції). Бажано, коли препарат вірусу грипу готують у присутності низького рівня тіомерсалу або бажано при відсутності тіомерсалу. Переважно одержаний препарат вірусу грипу є стабільним при відсутності органортутних консервантів, зокрема, препарат не містить залишкового тіомерсалу. Зокрема, препарат вірусу грипу включає гемаглютиніновий антиген, стабілізований при відсутності тіомерсалу або при низьких рівнях тіомерсалу (звичайно 5 мкг/мл або менше). Конкретно, стабілізацію штаму В вірусу грипу здійснюють при використанні похідного альфа-токоферолу, такого, як сукцинат альфатокоферолу (що також є відомими як сукцинат вітаміну Е, тобто VES). Такі препарати та способи для їх одержання розкриті у публікації WO 02/097072. Бажана композиція містить три інактивовані антигени розщеплених віріонів, одержані зі штамів, рекомендованих Всесвітньою організацією охорони здоров'я, у період прийнятного для грипу сезону. Бажано, коли вірус грипу або його антигенний препарат та ад'ювант на основі емульсії масло-у 91701 18 воді містяться в тому самому контейнері. Цей підхід називається «підходом однієї ампули». Бажано, коли ампула являє собою попередньо наповнений шприц. В альтернативному втіленні вірус грипу або його антигенний препарат та ад'ювант на основі емульсії масло-у-воді містяться у різних контейнерах або ампулах та змішуються безпосередньо до або під час введення особі. Цей підхід називається «підходом двох ампул». Для прикладу, коли вакцина являє собою двокомпонентну вакцину для загального об'єму 0,7 мл, концентровані антигени (наприклад, концентровані тривалентні антигени інактивованого розщепленого віріону) представлені в одній ампулі (335 мкл) (контейнер для антигенів), а попередньо наповнений шприц містить ад'ювант (360 мкл) (контейнер для ад'юванту). Під час ін'єкції вміст ампули, що містить концентровані тривалентні антигени інактивованого розщепленого віріону, видаляється з ампули при використанні шприца, який містить ад'ювант, після чого здійснюють обережне перемішування вмісту шприца. Перед ін'єкцією використану голку замінюють голкою для внутрішньом'язової ін'єкції, та об'єм доводять до 530 мкл. Одна доза відновленої кандидатної (перспективної) вакцини з ад'ювантом відповідає 530 мкл. Згідно з даним винаходом принаймні один штам вірусу грипу у мультивалентній імуногенній композиції, як визначено в даній заявці, є асоційованим з пандемічнимспалахом або має потенціал бути асоційованим з пандемічним спалахом. Такий штам може також називатися «пандемічним штамом» у тексті, що приведений нижче. Зокрема, коли вакцина є мультивалентною вакциною, такою, як бівалентна тривалентна або квадривалентна вакцина, принаймні один штам є асоційованим з пандемічним спалахом або має потенціал бути асоційованим з пандемічним спалахом. Прийнятні штами являють собою, але не обмежені: H5N1, H9N2, H7N7, H2N2 та H1N1. Ознаки штаму вірусу грипу, що надають йому потенціалу викликати пандемічний спалах, є наступними: він містить новий гемаглютинін у порівнянні з гемаглютиніном штамів, які циркулюють на сьогоднішній день, що може супроводжуватися або не може супроводжуватися зміною підтипу нейрамінідази; він є здатним передаватися горизонтально у людській популяції; та він є патогенним для людини. Новий гемаглютинін може бути таким, що не є вираженим у людській популяції протягом тривалого проміжку часу, ймовірно протягом ряду десятиріч, так як Н2. Або він може бути гемаглютиніном, який не був циркулюючим у людській популяції до цього, наприклад, Н5, Н9, Н7 або Н6, які виявлені у птахів. У будь-якому випадку більшість або принаймні велика частина, або навіть ціла популяція не стикалася з цим антигеном та є імунологічно інтактною до нього. Деякі частини в загальному випадку мають підвищений ризик бути інфікованими вірусом грипу у пандемічній ситуації. Люди похилого віку, хронічно хворі та маленькі діти є особливо уразливими, але багато молодих та практично здорових людей також мають ризик. Для Н2 грипу частина популяції, що була народжена після 1968 року, має підвище 19 ний ризик. Для цих груп є важливим бути ефективно захищеним якомога раніше та простим шляхом. Інша група людей, які мають підвищений ризик, є мандрівники. Люди сьогодні подорожують більше, ніж раніше, а області, де виникає більшість нових вірусів, Китай та Південно-східна Азія, стали популярними напрямками подорожей останніми роками. Ця зміна моделей подорожей дозволяє новим вірусам обійти земний шар по суті за тижні, а не протягом місяців або років. Таким чином, для цих груп людей існує особлива потреба у вакцинації для захисту проти грипу у випадку пандемічної ситуації або потенційно пандемічної ситуації. Прийнятні штами без обмеження являють собою: H5N1, H9N2, H7N7, H2N2 та H1N1. Необов'язково композиція може містити більше, ніж три валентності, наприклад, два непандемічні штами плюс пандемічний штам. Альтернативно, композиція може містити три пандемічні штами. Бажано, коли композиція містить три пандемічна штами. Ад'ювант на основі емульсії масло-у воді Ад'ювантна композиція згідно з винаходом містить ад'ювант на основі емульсії масло-у-воді, бажано, коли вказана емульсія містить метаболічне масло у кількості від 0,5% до 20% від загального об'єму та має краплі масла, принаймні 70% з яких за інтенсивністю має діаметр менший ніж 1 мкм. Для того, щоб будь-яка композиція масло-уводі була прийнятна для введення людині, масляна фаза емульсійної системи повинна включати метаболічне масло. Значення терміну «метаболічне масло» є добре відомим в області техніки. Метаболічний може бути визначений як такий, що є здатним трансформуватися шляхом метаболізму (Dorland's Illustrated Medical Dictionary, W.B. Sanders Company, 25-е видання (1974)). Масло може являти собою будь-яку рослинну олію, риб'ячий жир, тваринне масло або синтетичне масло, яке не є токсичним для реципієнта та є здатним трансформуватися шляхом метаболізму. Горіхи, насіння та злакові являють собою звичайні джерела рослинних олій. Синтетичні олії також є частиною цього винаходу та можуть включати комерційно доступні масла, такі, як NEOBEE® та інші. Особливо бажане метаболічне масло представляє собою сквален. Сквален (2,6,10,15,19,23гексаметил-2,6,10,14,18,22-тетракозагексаєн) являє собою ненасичене масло, яке виявлено у великій кількості у жирі печінки акули та у низькій кількості в оливковій олії, олії з насіння проростків пшениці, олії рисових висівок та дріжджах, та є особливо бажаним маслом для використання у даному винаході. Сквален являє собою метаболічне масло на основі того факту, що він є проміжною сполукою біосинтезу холестерину (Merck Index, 10-е видання, номер бібліографічного запису 8619). Емульсії масло-у-воді самі по собі є добре відомими в області техніки та були запропоновані як корисні для ад'ювантних композицій (ЕР 399843; WO 95/17210). 91701 20 Прийнятне метаболічне масло є присутнім у кількості від 0,5% до 20% (заключна концентрація) від загального об'єму імуногенної композиції, переважно у кількості від 1,0% до 10% від загального об'єму, бажано у кількості від 2,0% до 6,0% від загального об'єму . У специфічному втіленні метаболічне масло є присутнім у заключній кількості приблизно 0,5%, 1%, 3,5% або 5% від загального об'єму імуногенної композиції. В іншому специфічному втіленні метаболічне масло є присутнім у заключній кількості 0,5%, 1%, 3,57% або 5% від загального об'єму імуногенної композиції. Бажано, коли емульсійні системи масло-у-воді даного винаходу мають невеликий розмір крапель у субмікронному діапазоні. Прийнятні розміри крапель будуть знаходитися в діапазоні від 120 до 750 нм, більш бажано розмір буде складати від 120 до 600 нм у діаметрі. Більш бажано, коли емульсії масло-у-воді містять масляні краплі, принаймні 70% з яких за інтенсивністю мають розмір менше 500 нм у діаметрі, більш бажано, коли принаймні 80% з них за інтенсивністю мають розмір менше 300 нм у діаметрі, більш бажано, коли принаймні 80% з них за інтенсивністю мають розмір від 120 до 200 нм у діаметрі. Розмір масляних крапель, тобто діаметр, згідно з даним винаходом представлений за інтенсивністю. Існує декілька шляхів визначення діаметру розміру крапель масла за інтенсивністю. Інтенсивність вимірюють при використанні пристрою, прийнятного для визначення розміру за динамічним розсіюванням світла, такого, як Malvern Zetasizer 4000 або бажано Malvern Zetasizer 3000HS. Детальна процедура визначення наведена у Прикладі II.2. Перша можливість полягає у визначенні z середнього значення діаметру ZAD за динамічним розсіюванням світла (PCS-фотон кореляційна спектроскопія); цей метод додатково забезпечує показник полідисперсності (PDI), як ZAD, так і PDI підраховують за допомогою семі-інварінтного алгоритму. Ці значення не вимагають знання показника заломлення частинок. Другий спосіб полягає у підрахунку діаметра масляних крапель шляхом визначення розподілу розмірів цілих частинок при використанні іншого алгоритму або за допомогою Контін, або NNLS, або автоматичного "Malvern" (алгоритм по умовчанню забезпечується з пристроєм для вимірювання розміру). Більшу частину часу, оскільки показник заломлення частинок складної композиції є невідомим, тільки розподіл інтенсивності береться до уваги, і якщо це є необхідним, то середнє значення інтенсивності одержують з цього розподілу. Емульсія масло-у-воді включає стерин. Стерини є добре відомими в області техніки, наприклад, холестерин є добре відомим як існуючий в природі стерин, який міститься в тваринному жирі, і, наприклад, розкритий в Merck Index, 11-е вид., стор. 341. Інші прийнятні стерини включають βсітостерин, стігмастерин, ергостерин, альфатокоферол та ергокальциферол. Вказаний стерин прийнятно є присутнім у кількості від 0,01% до 20% (ваг./об.) від загального об'єму імуногенної композиції, бажано у кількості від 0,1% до 5% 21 (ваг./об.). Переважно, коли стерин являє собою холестерин, то він присутній у кількості від 0,02% до 0,2% (ваг./об.) від загального об'єму імуногенної композиції, більш бажано у кількості 0,02% (ваг./об.) в 0,5 мл об'єму вакцинної дози, або 0,07% (ваг./об.) в 0,5 мл об'єму вакцинної дози або 0,1% (ваг./об.) в 0,7 мл об'єму вакцинної дози. Є прийнятним, коли стерин являє собою альфа-токоферол або його похідну, таку як альфатокоферол сукцинат. Бажано, коли альфатокоферол є присутнім у кількості від 0,2% до 5,0% (об./об.) від загального об'єму імуногенної композиції, більш бажано у кількості 2,5% (об./об.) в 0,5 мл об'єму вакцинної дози, або 0,5% (об./об.) в 0,5 мл об'єму вакцинної дози або 1,7-1,9% (об./об.), бажано 1,8% в 0,7 мл об'єму вакцинної дози. Для роз'яснення, концентрації, представлені в об./об., можуть бути перетворені у концентрації ваг./об. при використанні наступного коефіцієнта перерахунку: 5% (об./об.) концентрація альфатокоферолу є еквівалентною 4,8% (ваг./об.) концентрації альфа-токоферолу. Емульсія масло-у-воді може додатково включати емульгувальний агент. Емульгувальний агент може бути присутнім у кількості від 0,01 до 5,0% від ваги імуногенної композиції (ваг/ваг.), бажано він присутній у кількості від 0,1 до 2,0% за вагою (ваг/ваг). Бажані концентрації складають від 0,5 до 1,5% від загальної ваги композиції (ваг./ваг.). Прийнятний емульгувальний агент може являти собою поліоксіетиленсорбітмоноолеат (Твін 80). В окремому втіленні 0,5 мл об'єму вакцинної дози містить1% (ваг./ваг.) Твіну 80, а 0,7 мл об'єму вакцинної дози містить 0,7% (ваг./ваг.) Твіну 80. В іншому специфічному втіленні концентрація Твіну 80 складає 0,2% (ваг./ваг). Ад'ювант на основі емульсії масло-у-воді може використовуватися з іншими ад'ювантами або імуностимуляторами, і важливе втілення даного винаходу являє собою композицію масло-у-воді, що включає сквален або інше метаболічне масло, альфа-токоферол та Твін 80. Емульсія масло-уводі може також містити спан 85 та/або лецитин. Типово емульсія масло-у-воді буде включати від 2 до 10% сквалену від загального об'єму імуногенної композиції, від 2 до 10% альфа-токоферолу та від 0,3 до 3% Твіну 80 та може бути одержана у відповідності з процедурою, описаною у публікації WO 95/17210. Бажано, коли співвідношення сквален : альфа-токоферол є рівним або меншим за 1, оскільки це забезпечує більш стабільну емульсію. Спан 85 (поліоксіетиленсорбіттриолеат) може, наприклад, бути присутнім на рівні 1%. Імуногенні властивості імуногенної композиції, що використовується для першої вакцинації, згідно з даним винаходом У даному винаході мультивалентна композиція проти грипу є здатною індукувати поліпшену імунну відповідь CD4 Т-клітин проти принаймні одного компоненту антигену(ів) або антигенної композиції у порівнянні з імунною відповіддю CD4 Т-клітин, одержаною при використанні композиції без ад'юванту, тобто такої, що не містить екзогенного ад'юванту (у даній заявці також називається «чистою композицією»). У специфічному втіленні вка 91701 22 зана поліпшена CD4 Т-клітинна імунна відповідь є такою проти пандемічного штаму вірусу грипу. Під поліпшеною імунною відповіддю CD4 Тклітин розуміють, що одержують більш високу CD4 відповідь у пацієнта, що представляє собою людину, після введення імуногеної композиції з ад'ювантом, ніж після введення такої самої композиції без ад'юванту. Наприклад, більш високу відповідь CD4 Т-клітин одержують у пацієнта, що представляє собою людину, при введенні імуногенної композиції, що включає вірус грипу або його антигенний препарат разом з ад'ювантом на основі емульсії масло-у-воді, яка включає метаболічне масло, стерин, такий як альфа-токоферол та емульгувальний агент, у порівнянні з відповіддю, що індукується після введення імуногенної композиції, що включає вірус грипу або його антигенний препарат, але не містить ад'юванту. Така композиція може переважно використовуватися для індукції направленої проти грипу відповіді CD4 Т-клітин, здатних до визначення епітопів вірусу грипу, презентованих молекулами класу II МНС Бажано, коли вказана імунологічна відповідь, індукована композицією розщепленого вірусу грипу з ад'ювантом для застосування згідно з даним винаходом, є вищою, ніж імунологічна відповідь, індукована будь-якою іншою традиційною вакциною проти грипу, такою, як субодинична вакцина грипу або вакцина на основі цілих частинок вірусу грипу. Зокрема, але не винятково, вказану «поліпшену імунну відповідь CD4 Т-клітин» одержують в імунологічно непримованого пацієнта, тобто, у пацієнта, який є серонегативним стосовно вказаного вірусу грипу або антигену. Ця серонегативність може бути результатом того, що вказаний пацієнт ніколи не зустрічався з вказаним вірусом або антигеном (пацієнт, що не піддавався впливу) або, альтернативно, виявився неспроможним до відповіді на вказаний антиген, з яким він одного разу зустрівся. Бажано, коли вказана поліпшена імунна відповідь CD4 Т-клітин одержана в особи з порушеним імунітетом, такої, як людина похилого віку, типово у віці 65 років та більше, або у дорослої людини віком до 65 років з високим ризиком медичного стану (доросла людина «високого ризику») або у дитини віком до двох років. Поліпшена імунна відповідь CD4 Т-клітин може бути оцінена шляхом вимірювання кількості клітин, що продукують будь-який з наступних цитокінів: • клітини, що продукують принаймні два різні цитокіни (CD40L, IL-2, IFN , TNF ) • клітини, що продукують принаймні CD40L та інший цитокін (IL-2, TNF , IFN ) • клітини, що продукують принаймні IL-2 та інший цитокін (CD40L, TNF , IFN ) • клітини, що продукують принаймні IFN та інший цитокін (IL-2, TNF , CD40L) • клітини, що продукують принаймні TNF та інший цитокін (IL-2, CD40L, IFN ) Буде існувати поліпшена імунна відповідь CD4 Т-клітин, коли клітини, що продукують будь-який із зазначених вище цитокінів, будуть знаходитися у більш високій кількості після введення композиції з ад'юван 23 том у порівнянні з введенням композиції без ад'юванту. Типово, принаймні одна, бажано дві з п'яти умов, зазначених вище, будуть виконані. В окремому втіленні клітини, що продукують усі чотири цитокіни, будуть присутніми у більш високій кількості у групі з ад'ювантом у порівнянні з групою без ад'юванту. Поліпшена CD4 Т-клітинна імунна відповідь, що забезпечується композицією вірусу грипу з ад'ювантом згідно з даним винаходом, може бути в ідеалі одержана після введення однієї разової дози. Підхід разової дози буде надзвичайно важливим, наприклад, при ситуації, коли швидко розвивається спалах інфекції. За деяких обставин, особливо для популяції літніх людей або у випадку дітей молодшого віку (у віці до 9 років), яких було перший раз вакциновано проти грипу, може бути вигідним вводити дві дози тієї самої композиції для цього сезону. Друга доза вказаної тієї самої композиції (що все ще вважається «композицією для першої вакцинації») може вводитися під час первинної імунної відповіді, що розвивається, та через адекватний проміжок часу. Типово, коли друга доза композиції вводиться через кілька тижнів або через приблизно один місяць, наприклад, через 2 тижні, 3 тижні, 4 тижні, 5 тижнів або 6 тижнів після першої дози, для того, щоб допомогти примувати імунну систему у нечутливої особи або особи зі слабкою чутливістю. У специфічному втіленні введення вказаної імуногенної композиції альтернативно або додатково індукує поліпшену відповідь В-клітин пам'яті у пацієнтів, яким було введено імуногенну композицію, у порівнянні з відповіддю В-клітин пам'яті, індукованої в осіб, імунізованих композицією без ад'юванту. Поліпшена відповідь Т-клітин пам'яті призначена для розуміння підвищеної частоти зустрічальності В-лімфоцитів периферичної крові, здатних до диференціації у плазмоцит, який секретує антитіла при зустрічі з антигеном, як визначено шляхом стимуляції in-vitro диференціації (див. розділ Приклади, наприклад, імуносорбентні методи при використанні імобілізованих ферментів для дослідження В-клітин пам'яті (ELISPOT)). Ще в одному специфічному втіленні вакцинація композицією для першої вакцинації, що містить ад'ювант, не має здатного до визначення впливу на CD8 відповідь. Заявник несподівано виявив, що композиція, яка включає вірус грипу або його антигенний препарат, рецептована з ад'ювантом на основі емульсії масло-у-воді, зокрема, з ад'ювантом на основі емульсії масло-у-воді, що містить метаболічне масло, стерин, такий, як альфа-токоферол, та емульгувальний агент, є ефективною для промотування Т-клітинних відповідей у популяції людей з порушеним імунітетом. Як було продемонстровано заявником, введення однократної дози імуногенної композиції для першої вакцинації, як описано у винаході, є здатною забезпечити кращий серологічний захист, як було оцінено за допомогою кореляції захисту для вакцин грипу після ревакцинації проти грипу у популяції людей похилого віку, ніж вакцинація за допомогою вакцини грипу без ад'юванту. Заявлена композиція з ад'ювантом 91701 24 також була здатною індукувати поліпшену імунну відповідь CD4 Т-клітин проти вірусу грипу у порівнянні з такою, одержаною при використанні композиції без ад'юванту. Це відкриття може бути пов'язане з підвищеною реактивністю при вакцинації або при інфекції, що викликається антигенним впливом грипу. Крім того, це може також бути асоційовано з перехресною реактивністю, тобто вищою здатністю розвивати відповідь на варіанти штамів вірусу грипу. Ця поліпшена відповідь може бути особливо вигідною у популяції людей з порушеним імунітетом, такою, як люди похилого віку (у віці 65 років і старше) та, зокрема, у популяції людей похилого віку високого ступеня ризику. Це може приводити до зниження значення сумарної захворюваності та смертності та запобігання невідкладної госпіталізації з причини пневмонії та інших грипоподібних захворювань. Вона може бути також вигідною для використання у популяції дітей молодшого віку (у віці до 5 років, бажано у віці до двох років). Крім того, вона дозволяє індукувати CD4 Т-клітинну відповідь, яка є більш тривалою у часі, тобто є ще присутньою протягом одного року після першої вакцинації, у порівнянні з відповіддю, індукованою при використанні композиції без ад'юванту. Бажано, коли CD4 Т-клітинна імунна відповідь, така, як поліпшена CD4 Т-клітинна імунна відповідь, одержана у непримованої особи, втягує індукцію перехресно реактивної CD4 Т-хелперної відповіді. Зокрема, кількість перехресно реактивних CD4 Т-клітин збільшується. Під «перехресно реактивною» СD4-відповіддю розуміють спільні для різних штамів вірусу грипу епітопи, націлені на CD4 Т-клітини. Звичайно, доступні вакцини грипу є ефективними тільки проти інфікуючих штамів вірусу грипу, що мають гемаглютиніни подібних антигенних характеристик. Коли інфікуючий (циркулюючий) вірус грипу піддається мінорним змінам (таким, як точкова мутація або накопичення точкових мутацій, що приводить до амінокислотних змін, наприклад) у поверхневих глікопротеїнах, зокрема, гемаглютиніні (антигенний дрей-варіант вірусного штаму), то вакцина може ще в деякій мірі забезпечувати захист, хоча вона може забезпечувати тільки обмежений захист, оскільки нові утворені варіанти можуть уникати імунітету, індукованого попередньою інфекцією або вакцинацією вірусом грипу. Антигенний дрейф відповідає за щорічні епідемії, що виникають протягом інтерпандемічних періодів (Wiley & Skehel, 1987, Ann. Rev. Biochem. 56, 365394). Індукція перехресної реактивності CD4 Тклітин забезпечує додаткову перевагу композиції згідно з винаходом, яка полягає у тому, що вона може також забезпечувати перехресний захист, іншими словами, захист проти гетерологічних інфекцій, тобто інфекцій, спричинених циркулюючим штамом вірусу грипу, який є варіантом (наприклад, дрейф-варіантом) штаму вірусу грипу, що міститься в імуногенній композиції. Це може бути бажаним, коли циркулюючий штам важко розмножувати на яйцях або одержувати у культурі тканин, такий підхід забезпечує робочу альтернативу використанню дрейф-штаму. Це також може бути бажа 25 ним, коли особа одержує першу та другу вакцинації з інтервалом декілька місяців або рік, і штам вірусу грипу в імуногенній композиції, що використовується для другої імунізації, являє собою штам дрейф-варіанта штаму, який використовувався у композиції для першої вакцинації. Імуногенна композиція проти вірусу грипу з ад'ювантом, як визначено в даній заявці, має, таким чином, більш високу здатність індукувати серозахист та перехресно-реактивні CD4 Т-клітини у вакцинованих осіб похилого віку. Ця характеристика може бути асоційована з більш високою здатністю відповідати на варіант штаму такого, що є присутнім в імуногенній композиції. Це може бути важливою перевагою у пандемічній ситуації. Наприклад, мультивалентна імуногенна композиція проти грип, що включає будь-який або декілька з Н5, Н2, Н9, Н7 або Н6 штам(и), може забезпечувати більш високу здатність до відповіді на пандемічний варіант, тобто дрейф-штам вказаного пандемічного штаму (ів), або при подальшій вакцинації або при інфекції вказаним дрейф-штамом. Визначення перехресно-реактивних CD4 Тклітин після вакцинації за допомогою вакцини грипу Після введення класичної тривалентної вакцина грипу (3 тижні) виникає суттєве підвищення частоти зустрічальності CD4 Т-клітин у периферичній крові у відповідь на препарат антигенного штаму (цільний вірус або розщеплений антиген), що є гомологічним до такого, що присутній у вакцині (H3N2: A/Panama/2007/99, H1N1: A/ New Caledonia/20/99, B: B/Shangdong/7/97) (див. Приклад III). Порівняне підвищення частоти зустрічальності можна спостерігати, якщо CD4 Т-клітини є повторно стимульованими за допомогою штамів вірусу грипу, які класифіковані як дрейф-штами (H3N2: A/Sydney/5/97, H1N1: A/Beijing/262/95, В: B/Yamanashi/166/98). На противагу до цього, якщо CD4 Т-клітини периферичної крові є повторно стимулюються за допомогою штамів вірусу грипу, які класифіковані як зсувні штами (H2N2: A/Singapore/1/57, H9N2: A/Hongkong/1073/99) експертами у цій галузі, не виявлено підвищення частоти зустрічальності CD4 Т-клітин після вакцинації. CD4 Т-клітини, що є здатними впізнавати як гомологічні, так і дрейф-штами вірусу грипу, називаються у даному документі «перехресно реактивними». Композиції вірусу грипу з ад'ювантом, як описано в даній заявці, були здатними демонструвати гетеросубтипічну перехресну реактивність, оскільки спостерігається перехресна реактивність проти дрейф-штамів вірусу грипу. Як зазначено вище, здатність пандемічної вакцинної композиції бути ефективною проти дрейф пандемічних штамів може являти собою важливу характеристику у випадку пандемій. У відповідності із зазначеними вище спостереженнями у людини були ідентифіковані епітопи CD4 Т-клітин, спільні для різних штамів вірусу грипу (Gelder С та ін., 1998, Int Immunol. 10(2):211-22; Gelder CM та ін., 1996 J Virol. 70(7):4787-90; Gelder CM та ін., 1995 J Virol. 1995 69(12):7497-506). 91701 26 У специфічному втіленні композиція з ад'ювантом може запропонувати додаткову перевагу у забезпеченні кращого захисту проти циркулюючих штамів, які зазнали великої зміни (такої, як генна рекомбінація, наприклад, між різними видами) у гемаглютиніні (антигенний зсув), проти яких доступні на сьогоднішній день вакцини не мають ефективності. Інші ад'юванти Композиція може включати додатковий ад'ювант, зокрема, ад'ювант на основі TRL-4 ліганда, прийнятного нетоксичного похідного ліпіда А. Прийнятний TRL-4 ліганд являє собою 3 де-Оацилований монофосфорил ліпід A (3D-MPL). Інші прийнятні TLR-4 ліганди являють собою ліпополісахарид (LPS) та похідні, MDP (мураміловий дипептид) та F білок RSV. В одному втіленні композиція може додатково включати Toll-подібний ліганд рецептора (TLR) 4, такий, як нетоксична похідна ліпіда А, зокрема, монофосфорил ліпід А або особливо 3деацилований монофосфорил ліпід A (3D-MPL). 3D-MPL продається під торговою маркою MPL® Corixa Corporation (з даній заявці MPL) та головним чином посилює CD4+ Т-клітинні відповіді з IFN (Th1) фенотипом. Він може бути одержаний згідно зі способами, розкритими в GB 2 220 211 А. З хімічної точки зору він являє собою суміш 3деацилованого монофосфорил ліпіду А з 3, 4, 5 або 6 ацилованими ланцюгами. Бажано, коли у композиціях згідно з даним винаходом використовують дрібні частинки 3D-MPL. Дрібна частинка 3D-MPL має такий розмір, що вона може стерильно фільтруватися через 0,22 мкм фільтр. Такі препарати описані в публікації з W094/21292 та у Прикладі II. 3D-MPL може використовуватися, наприклад, у кількості від 1 до 100 мкг (ваг./об.) на дозу композиції, бажано у кількості від 10 до 50 мкг (ваг./об.) на дозу композиції. Прийнятна кількість 3D-MPL являє собою, наприклад, будь-яку з 1, 2, 3, 4, 5, б, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, ЗО, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 або 50 мкг (ваг./об.) на дозу композиції. Більш бажано, коли кількість 3D-MPL коливається у межах від 25 до 75 мкг (ваг./об.) на дозу композиції. Звичайно доза композиції буде коливатися від приблизно 0,5 мл до приблизно 1 мл. Типова вакцинна доза складає 0,5 мл, 0,6 мл, 0,7 мл, 0,8 мл, 0,9 мл або 1 мл. У бажаному втіленні заключна концентрація 50 мкг 3D-MPL припадає на 1 мл вакцинної композиції або 25 мкг на 0,5 мл вакцинної дози. В інших бажаних втіленнях заключна концентрація 35,7 мкг або 71,4 мкг 3D-MPL міститься в 1 мл вакцинної композиції. Зокрема, 0,5 мл об'єму вакцинної дози містить 25 мкг або 50 мкг 3D-MPL на дозу. Доза MPL прийнятним чином є здатною поліпшувати імунну відповідь на антиген у людини. Зокрема, прийнятна кількість MPL є такою, яка поліпшує імунологічний потенціал композиції у порівнянні з композицією без ад'юванту або у порівнянні з композицією, що містить іншу кількість ад'юванту, у той час як вона є прийнятною з точки зору профілю реактогенності. 27 Синтетичні похідні ліпіду А є відомими, деякі з них описані як агоністи TLR-4 та включають без обмеження наступні: ОМ174 (2-дезокси-6-о-[2-дезокси-2-[(R)-3додеканоїлокситетрадеканоїламіно]-4-о-фосфоно(3-D-глюкопіразоніл]-2-[(R)-3гідрокситетрадеканоїламіно]- -Dглюкопіразонілдигідрогенфосфат), (WO 95/14026) ОМ 294 DP (3S,9R)-3-[(R)додеканоїлокситетрадеканоїламіно]-4-оксо-5-аза9(R)-[(R)-3-гідрокситетрадеканоїламіно]декан-1,10діол, 1,10-біс(дигідрогенфосфат), (W099 /64301 та WO 00/0462) ОМ 197 МР-Ас DP (3S-,9R)-3-[(R)додеканоїлокситетрадеканоїламіно]-4-оксо-5-a3a9-[(R)-3-гідрокситетрадеканоїламіно]декан-1,10діол, 1 -дигідрогенфосфат 10-(6-аміноксеноат), (WO 01/46127) Іншими прийнятними TLR-4 лігандами є, наприклад, ліпополісахарид та його похідні, мурамілдипептид (MDP) або F білок респіраторно синцитіального вірусу. Інший прийнятний імуностимулятор для використання у даному винаході є Quil А та його похідні. Quil А є препаратом сапоніну, ізольованого з південно-американського дерева Quilaja Saponaria Molina, та був вперше описаний Dalsgaard та ін. в 1974 ("Saponin adjuvants", Archiv. fur die gesamte Virusforschung, том 44, Springer Verlag, Berlin, стор.243-254) як такий, що володіє ад'ювантною активністю. Очищені фрагменти Quil A були ізольовані за допомогою ВЕРХ, яка зберігає ад'ювантну активність без токсичності, асоційованої з Quil А (ЕР 0 362 278), наприклад, QS7 та QS21 (що також є відомими як QA7 та QA21). QS-21 являє собою природний сапонін, що одержаний з кори Quillaja saponaria Molina, який індукує CD8+ цитотоксичні Т-клітини (CTL), Тп1 клітини та переважно lgG2a антитілогенез і є бажаним сапоніном у контексті даного винаходу. Були описані специфічні композиції QS21, які є особливо бажаними, ці композиції додатково містять стерин (W096/33739). Сапоніни, які утворюють частину даного винаходу, можуть бути у формі емульсії масло-у-воді (WO 95/17210). Ревакцинація та композиція, що використовується для ревакцинації (бустер-композиція) Аспект даного винаходу забезпечує застосування антигену вірусу грипу при виробництві імуногенної композиції проти грипу для ревакцинації людей, раніше вакцинованих вірусом грипу або його антигенним препаратом, або його варіантом, рецептованим з ад'ювантом на основі емульсії масло-у-воді, що включає метаболічне масло, стерин, такий, як альфа-токоферол, та емульгувальний агент. Типово, ревакцинацію здійснюють через 6 місяців після першої(их) вакцинації(ій), бажано через 8-14 місяців, більш бажано через приблизно 10-12 місяців по тому. Імуногенна композиція для ревакцинації (бустер-композиція) може містити будь-який тип антигенного препарату, або інактивованого, або живого атенуйованого. Вона може містити той самий тип антигенного препарату, тобто розщеплений вірус 91701 28 або розщеплений антигенний препарат вірусу грипу, цілий віріон,вакцину на основі очищених НА та NA (субодинична) або віросому, що й імуногенна композиція, яка використовується для першої вакцинації. Альтернативно, бустер-композиція може містити інший тип антигену вірусу грипу, тобто розщеплений вірус або розщеплений антигенний препарат вірусу грипу, цілий віріон, вакцину на основі очищених НА та NA (субодинична) або віросому, що й імуногенна композиція, яка використовується для першої вакцинації. Бустер- композиція може містити ад'ювант або бути без ад'юванта. Бустер-композиція без ад'юванта може являти собою Fluarix™/a-Rix®/lnflusplit®, яка вводить внутрішньом'язово. Композиція містить три інактивовані антигени розщепленого віріону, одержані зі штамів, рекомендованих Всесвітньою організацією охорони здоров'я для прийнятного сезону грипу. Згідно з цим бажане втілення винаходу забезпечує застосування вірусу грипу або його антигенного препарату у виробництві імуногенної композиції для ревакцинації людей, раніше вакцинованих імуногенною композицією, як заявлено в даній заявці. Бустер-композиція млже містити ад'ювант або не містити його. У бажаному втіленні бустерна композиція включає ад'ювант на основі емульсії масло-у-воді, зокрема, ад'ювант на основі емульсії масто-у-воді, що включає метаболічне масло, стерин, такий, як альфа-токоферол, та емульгувальний агент. Бажано, коли, вказаний ад'ювант на основі емульсії масло-у-воді переважно включає принаймні одне метаболічне масло у кількості від 0,5% до 20% від загального об'єму, та містить масляні краплі, 70% з яких за інтенсивністю мають діаметр менший ніж 1 мкм. У бажаному втіленні першу вакцинацію проводять за допомогою композиції вірусу грипу, переважно розщепленої композиції вірусу, що містить принаймні один штам вірусу грипу, що може потенційно викликати пандемічний спалах, а ревакцинацію здійснюють за допомогою композиції на основі вірусу грипу, що включає принаймні один штам, який є циркулюючим пандемічним штамом. У специфічному втіленні імуногенна композиція для ревакцинації (що також називається в даній заявці нижче «бустер-композицією») містить вірус грипу або його антигенний препарат, який має спільні загальні епітопи для CD4 Т-клітин з вірусом грипу або його антигенним препаратом, який використовується для першої вакцинації. Спільний CD4 Т-клітинний епітоп призначений для позначення пептидів/послідовностей/епітопів з різних антигенів, які можуть впізнаватися тією самою CD4 клітиною (див. приклади описаних епітопів у: Gelder С та ін. 1998, Int Immunol. 10(2): 21122; Gelder CM та ін. 1996 J Virol. 70(7): 4787-90; Gelder CM та ін. 1995 J Virol. 1995 69(12): 7497506). У втіленні згідно з даним винаходом бустеркомпозиція є моновалентною композицією на основі вірусу грипу, що включає штам вірусу грипу, що є асоційованим з пандемічним спалахом або має потенціал бути асоційованим з пандемічним 29 спалахом. Прийнятні штами являють собою, але не обмежені: H5N1, H9N2, H7N7, H2N2 та H1N1. Вказаний штам може бути тим самим, що й той, або бути одним з них, що був присутній у композиції, яка використовувалася для першої вакцинації. В альтернативному втіленні вказаний штам може бути варіантним штамом, тобто дрейф-штамом такого, що був присутній у композиції, яка використовувалася для першої вакцинації. В іншому специфічному втіленні бустеркомпозиція є мультивалентною вакциною проти грипу. Зокрема, коли бустер-композиція є мультивалентною вакциною, такою, як бівалентна, тривалентна або квадривалентна вакцина, то принаймні один штам є асоційованим з пандемічним спалахом або має потенціал бути асоційованим з пандемічним спалахом. У специфічному втіленні два або більше штамів у бустер-композиції є пандемічними штамами. В іншому специфічному втіленні принаймні один пандемічний штам у бустеркомпозиції є такого самого типу, що й той або один з тих, що присутні у композиції, використовуваній для першої вакцинації. В альтернативному втіленні принаймні один штам може бути варіантним штамом, тобто дрейф-штамом принаймні одного пандемічного штаму, що присутнім у композиції, використовуваній для першої вакцинації. Згідно з цим в іншому аспекті даного винаходу забезпечується застосування вірусу грипу або його антигенного препарату, що містить перший пандемічний штам вірусу грипу, у виробництві імуногенної композиції для захисту проти грипозної інфекції, викликаної штамом вірусу грипу, який є варіантом вказаного першого штаму вірусу грипу. Відповідно, в іншому аспекті даного винаходу забезпечується застосування: (a) вірусу грипу або його антигенного препарату, що містить перший штам вірусу грипу, та (b) ад'юванту на основі емульсії масло-у-воді, як визначено в даній заявці у виробництві імуногенної композиції для захисту проти грипозної інфекції, викликаної штамом вірусу грипу, який є варіантом вказаного першого штаму вірусу грипу. Бустер-композиція може містити ад'ювант або не містити його. Типово, бустер-композиція при використанні вводиться на наступний сезон грипу, наприклад, приблизно через рік після першої імуногенної композиції. Бустерна композиція може також вводитися кожного наступного року (третя, четверта, п'ята вакцинація і т.д.). Бустерна композиція може бути такою самою, що й композиція, яка використовується для першої вакцинації. Є прийнятним, коли бустер-композиція містить вірус грипу або його антигенний препарат, який є варіантом штаму вірусу грипу, що використовується для першої вакцинації. Зокрема, штами вірусу грипу або його антигенний препарат вибирають згідно з довідковими матеріалами, які розповсюджуються Всесвітньою організацією охорони здоров'я, за умови того, що вони адаптуються до штаму вірусу грипу, який є циркулюючим у рік проведення ревакцинації. Антиген вірусу грипу або антигенна композиція, що використовується для ревакцинації, бажа 91701 30 но включає ад'ювант або емульсію масло-у-воді, бажано такі, як описано вище. Ад'ювант може являти собою ад'ювант на основі емульсії масло-уводі, як описано в даній заявці вище, що є бажаним, яка необов'язково містить додатковий ад'ювант, такий, як TLR-4 ліганд, такий, як 3D-MPL або сапонін, або може представляти собою інший прийнятний ад'ювант, такий, як галуни або альтернативний до галунів варіант, такий, як поліфосфазен, наприклад. Бажано, коли ревакцинація індукує будь-яку одну, бажано дві або усі з наступних відповідей: (і) поліпшену CD4 відповідь проти вірусу грипу або його антигенного препарату, або (іі) поліпшену відповідь В-клітин пам'яті або (ііі) поліпшену гуморальну відповідь, у порівнянні з еквівалентною відповіддю, індукованою після першої вакцинації при використанні вірусу грипу або його антигенного препарату без ад'юванту. Бажано, коли імунологічні відповіді, індуковані після ревакцинації за допомогою вірусу грипу або його антигенного препарату з ад'ювантом, як визначено в даній заявці, є вищими, ніж відповідна відповідь, індукована після ревакцинації композицією з ад'ювантом. Бажано, коли імунологічні відповіді, індуковані після ревакцинації за допомогою вірусу грипу, переважно розщепленого, без ад'юванту, є вищими у популяції, яка була спочатку вакцинована при використанні композиції вірусу грипу, переважно розщепленої, з ад'ювантом, ніж відповідна відповідь у популяції, яка була спочатку вакцинована при використанні композиції вірусу грипу, переважно розщепленого, без ад'юванту. Як було продемонстровано заявником, ревакцинація осіб бустер-композицією, що включає вірус грипу та ад'ювант на основі емульсії масло-уводі, яка містить метаболічне масло, стерин, такий, як альфа-токоферол та емульгувальний агент, як визначено в даній заявці вище, демонструє більш високі титри антитіл, ніж відповідні значення у групі людей, яких було спочатку вакциновано композицією, що не містить ад'юванту, та повторно імунізовано композицією без ад'юванту. Ефект ад'юванту у підвищенні антитілогенезу у відповідь на ревакцинацію є особливо важливим у популяції людей похилого віку, які, як відомо, мають низький рівень відповіді на вакцинацію або інфекцію вірусом грипу. Перевага, що пов'язана з композицією з ад'ювантом, може також бути відзначена стосовно поліпшення CD4 Т-клітинної відповіді після ревакцинації. Композиція з ад'ювантом згідно з винаходом є здатною індукувати кращу перехресну реактивність проти дрейф-штаму (штам вірусу грипу наступного сезону) у порівнянні із захистом, що забезпечується контрольною вакциною. Вказана перехресна реактивність продемонструвала вищу персистенцію у порівнянні з такою, отриманою з композицією, що не містить ад'юванту. Ефект ад'юванту у поліпшенні перехресної реактивності проти дрейф-штаму є важливим у випадку пандемічної ситуації. Доклінічні дані, представлені у Прикладі 3, наприклад, показують здатність композиції згідно з винаходом захищати проти гетеротипічної інфекції 31 грипу та захворювання, як було оцінено за допомогою вимірювання температури тіла. Той самий висновок підтримує правильність клінічних дослідів, одержаних при вивченні ревакцинації. У додатковому втіленні винахід відноситься до режиму вакцинації, в якому першу вакцинацію здійснюють за допомогою композиції на основі вірусу грипу, переважно розщепленої композиції грипу, що містить принаймні один штам вірусу грипу, що може потенційно спричинити пандемічний спалах, а ревакцинацію проводять при використанні циркулюючого штаму, або пандемічного штаму, або класичного штаму. CD4 епітоп у НА Цей антигенний дрейф, головним чином, знаходиться у ділянках епітопів вірусних поверхневих білків гемаглютиніну (НА) та нейрамінідази (NA). Відомо, що будь-яка відмінність в епітопах CD4 та В-клітин між різними штамами вірусу грипу, використовуваних вірусом для уникнення адаптивного ефекту хазяйської імунної системи, буде грати основну роль та грає основну роль у вакцинації проти грипу. CD4 Т-клітинні епітопи, спільні для різних штамів вірусу грипу, були ідентифіковані у людей (див., наприклад: Gelder С та ін. 1998, Int Immunol. 10(2): 211-22; Gelder CM та ін. 1996 J Virol. 70(7): 4787-90; та Gelder CM та ін. 1995 J Virol. 1995 69(12): 7497-506). У специфічному втіленні ревакцинацію здійснюють при використанні бустер-композиції, яка містить вірус грипу або його антигенний препарат, що розділяє спільні CD4 Т-клітинні епітопи з антигеном вірусу грипу або його антигенного препарату, який використовується для першої вакцинації. Таким чином, винахід відноситься до імуногенної композиції, що включає вірус грипу або його антигенний препарат та ад'ювант на основі емульсії масло-у-воді, який містить метаболічне масло, стерин, такий, як альфа-токоферол, та емульгувальний агент, у виробництві компоненту мультидозової вакцини першої вакцинації, при цьому мультидозова вакцина додатково включає як бустерну дозу вірус грипу або його антигенний препарат, який розділяє спільні CD4 Т-клітинні епітопи з антигеном вірусу грипу або вірусним антигенним препаратом дози, яка вводиться при першій вакцинації. Засоби для вакцинації Композиція згідно з винаходом може вводитися будь-яким прийнятним шляхом доставки, таким, як інтрадермальний шлях, введення через слизову оболонку, наприклад, назальне, пероральний, внутрішньом'язовий або підшкірний шляхи. Інші способи доставки є добре відомими в області техніки. Внутрішньом'язовий шлях доставки є бажаним для композиції вірусу грипу з ад'ювантом. Інтрадермальна доставка являє собою інший прийнятний шлях. Будь-який прийнятний пристрій може використовуватися для інтрадермальної доставки, наприклад, пристрої з короткою голкою, такі, як ті, що описані у US 4,886,499, US 5,190,521, US 5,328,483, US 5,527,288, US 4,270,537, US 5,015,235, US 5,141,496, US 91701 32 5,417,662. Інтрадермальні вакцини можуть також вводитися за допомогою пристроїв, які обмежують ефективну глибину введення голки у шкіру, таких, як ті, що описані у WO99/34850 та ЕР1092444, введених в дану заявку як посилання, та їх функціональних еквівалентів. Також є прийнятними безголкові пристрої для впорскування, які доставляють рідкі вакцини до шару дерми за допомогою рідинного безтолкового інжектора або за допомогою голки, яка проколює роговий шар та випускає струмінь, який досягає шкіри. Пристрої для безголкового введення є описаними, наприклад, у US 5,480,381, US 5,599,302, US 5,334,144, US 5,993,412, US 5,649,912, US 5,569,189, US 5,704,911, US 5,383,851, US 5,893,397, US 5,466,220, US 5,339,163, US 5,312,335, US 5,503,627, US 5,064,413, US 5,520, 639, US 4,596,556US 4,790,824, US 4,941,880, US 4,940,460, WO 97/37705 та WO 97/13537. Також прийнятними є балістичні пристрої для доставки порошку/частинок, які використовують стиснений газ для прискорення вакцини у формі порошку через зовнішні шари шкіри до шару дерми. Крім того, можуть використовуватися традиційні шприци у класичному способі Манту для інтрадермального введення. Інший прийнятний спосіб введення являє собою підшкірний шлях. Будь-який прийнятний пристрій може використовуватися для підшкірної доставки, наприклад, класична голка. Бажано, коли використовується безголковий інжектор для введення такий, як ті, що описані у WO 01/05453, WO 01/05452, WO 01/05451, WO 01/32243, WO 01/41840, WO 01/41839, WO 01/47585, WO 01/56637, WO 01/58512, WO 01/64269, WO 01/78810, WO 01/91835, WO 01/97884, WO 02/09796, WO 02/34317. Більш бажано, коли вказаний пристрій є попередньо наповнений рідкою вакцинною композицією. Альтернативно, вакцину вводять інтраназально. Типово вакцина вводиться місцево у носоглоткову область, переважно при відсутності інгаляції у легені. Є бажаним використовувати пристрій для інтраназального введення, який доставляє вакцинну композицію у носоглоткову область при відсутності або суттєво без надходження до легень. Бажаними пристроями для інтраназального введення вакцин згідно з винаходом є пульверизатори. Прийнятні комерційно доступні назальні пульверизатори включають Accuspray™ (Becton Dickinson). Розпилювачі виробляють дуже тонкий аерозоль, який може легко вводитися шляхом інгаляції у легені та, таким чином, не досягає слизової оболонки носа. Тому пульверизатори не є бажаними. Бажані пульверизатори для інтраназального використання є такі, для яких поведінка пристрою не залежить від тиску, що застосовується користувачем. Ці пристрої є відомими як пристрої з пороговим тиском. Рідина вивільняється з розпилювальної насадки тільки тоді, коли використовується пороговий тиск. Такі пристрої роблять можливим легке одержання аерозолю з регулярним розміром крапель. Пристрої з пороговим тиском, прийнятні для використання у даному винаході, є відомими в 33 області техніки та описані, наприклад, у WO 91/13281, ЕР 311 863 В та ЕР 516 636, що введені в дану заявку як посилання. Такі пристрої є комерційно доступними від Pfeiffer GmbH та також описані у Bommer, R. Pharmaceutical Technology Europe, вересень 1999. Бажані інтраназальні пристрої виробляють краплі (визначено при використанні води як рідини) у діапазоні від 1 до 200 мкм, бажано від 10 до 120 мкм. При розмірі нижче 10 мкм існує ризик інгаляції, і таким чином, є бажаним мати не більше, ніж приблизно 5% крапель розміром менше 10 мкм. Краплі розміром більше 120 мкм не розбризкуються так добре, як менші краплі, таким чином, є бажаним мати не більше, ніж приблизно 5% крапель, розмір яких перевищує 120 мкм. Дводозова доставка є додатковою бажаною ознакою системи для інтраназальної доставки для застосування з вакцинами згідно з винаходом. Дводозові пристрої містять дві піддози однієї вакцинної дози, одну піддозу для введення у кожну ніздрю. В загальному випадку, дві піддози є присутніми в одній камері, та конструкція пристрою дозволяє проводити ефективну доставку узятих окремо піддоз одночасно. Альтернативно монодозовий пристрій може використовуватися для введення вакцин згідно з винаходом. Альтернативно, епідермальний або трансдермальний шлях вакцинації також передбачаються у даному винаході. У специфічному аспекті даного імуногенна композиція з ад'ювантом для першого введення може вводитися внутрішньом'язово, а бустеркомпозиція, або з ад'ювантом, або без ад'юванта, може бути введена різними шляхами, наприклад, інтрадермально, підшкірно або інтраназально. В іншому специфічному втіленні композиція для першого введення може включати стандартний вміст НА 15 мкг на штам вірусу грипу, а бустеркомпозиція може містити нижчу дозу НА, тобто нижче 15 мкг, та у залежності від шляху введення може вводитися в меншому об'ємі. Популяції для вакцинації Цільова популяція, що піддається вакцинації, може являти собою людей з порушеним імунітетом. Люди з порушеним імунітетом в загальному випадку є менш здатними відповідати на антиген, зокрема, на антиген вірусу грипу у порівнянні зі здоровими дорослими людьми. Бажано, коли цільова популяція є популяцією, яка є непримованою проти грипу, або такою, що не піддавалася антигенному впливу (такому, як наприклад, при зустрічі з пандемічним штамом) або була раніше нездатною до відповіді на інфекцію або вакцинацію вірусом грипу. Бажано, коли цільова популяція являє собою популяцію осіб похилого віку, переважно у віці 65 років та старше, більш молодших дорослих людей високого ступеня ризику (тобто у віці від 28 до 64 років), таких, як люди, що працюють у закладах охорони здоров'я, або тих дорослих, що є молодшими похилого віку, що мають фактор ризику серцево-судинного та легеневого захворювання або діабету. Інша цільова популяція являє собою усіх дітей у віці 6 місяців та більше, особливо дітей у віці 6-23 місяців, які 91701 34 піддаються відносно високому рівню госпіталізації, пов'язаної з грипом. Переважно цільовою популяцією є люди похилого віку у віці, старше 65 років. Режими вакцинації, дозування та критерії додаткової ефективності Прийнятні імуногенні композиції згідно з даним винаходом у більшості випадків являють собою стандартну здатну до ін'єкції дозу 0,5 мл та містять 15 мкг гемаглютинінового антигенного компоненту з кожного штаму вірусу грипу, як визначено за допомогою одномірної радіальної імунодифузії (SRD) (J.M. Wood та ін., J. Biol. Stand. 5 (1977) 237-247; J. M. Wood та ін., J. Biol. Stand. 9 (1981) 317-330). Згідно з цим об'єм вакцинної дози буде у межах від 0,5 мл до 1 мл, зокрема, буде складати 0,5 мл або 0,7 мл об'єму вакцинної дози. Звичайно можуть використовуватися незначні варіанти об'єму дози в залежності від концентрації НА на штам вірусу грипу. Є прийнятним, коли вказана імуногенна композиція містить низьку дозу НА антигену, наприклад, будь-яку 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 або 14 мкг НА на штам вірусу грипу. Прийнятна низька доза НА міститься у межах від 1 до 7,5 мкг НА на штам вірусу грипу, бажано від 3,5 до 5 мкг, наприклад, 3,75 мкг НА на штам вірусу грипу, типово приблизно 5 мкг НА у вихідному препараті Бажано, коли вакцинна доза згідно з даним винаходом, зокрема, вакцина з низькою дозою, може бути забезпечена у меншому об'ємі, ніж традиційні здатні до ін'єкції розщеплені вакцини грипу, які звичайно містять приблизно 0,5, 0,7 або 1 мл на дозу. Дози з низьким об'ємом згідно з даним винаходом є бажано нижчими 500 мкл, більш бажано нижчими 300 мкл та найбільш бажано - не більше 200 мкл або менше на дозу. Таким чином, бажана доза вакцини з низьким об'ємом згідно з одним аспектом даного винаходу являє собою дозу з низькою антигенною дозою у малому об'ємі, наприклад, приблизно 15 мкг або приблизно 7,5 мкг НА або приблизно 3,0 мкг НА (на штам) в об'ємі приблизно 200 мкл. Лікарський засіб проти грипу згідно з винаходом відповідає певним міжнародним критеріям для вакцин. Для вимірювання ефективності вакцин проти грипу використовуються міжнародні стандарти. Офіційні критерії Європейського Союзу для ефективної вакцини проти грипу представлені у Таблиці 1, що наведена нижче. Теоретично, для того, щоб відповідати вимогам Європейського Союзу вакцина проти грипу повинна відповідати тільки одному критерію з таблиці для усіх штамів вірусу грипу, які включені у вакцину. Композиції згідно з даним винаходом прийнятним чином відповідають принаймні одному такому критерію. Проте на практиці принаймні два або усі три критерії будуть необхідними для того, щоб задовольнятися усіма штамами, зокрема, для нової вакцини, такої, як вакцина, яка доставляється різними шляхами. За деяких обставин два критерії можуть бути достатніми. Наприклад, може бути прийнятним, коли два з трьох критеріїв задовольняються усіма штамами, у той час як третій критерій задовольняється для деяких, але не усіх шта 35 мів (наприклад, двох з трьох штамів). Вимоги є різними для популяції дорослих людей (18-60 років) та популяції людей похилого віку (>60 років). * Індекс сероконверсії визначається як процент вакцинованих, які мають принаймні чотирикратне підвищення сироваткових титрів інгібування гемаглютиніну після вакцинації для кожного вакцинного штаму. ** Коефіцієнт конверсії визначається як кратність підвищення середнього геометричного значення титрів (GMT) НІ у сироватці після вакцинації для кожного вакцинного штаму. *** Коефіцієнт захисту визначається як процент вакцинованих з титром НІ у сироватці, рівним або більшим, ніж 1:40 після вакцинації (для кожного вакцинного штаму) та є звичайно прийнятим для вимірювання захисту. В додатковому аспекті винахід забезпечує спосіб створення вакцини для захворювань, які відомі як такі, що лікуються шляхом активації CD4+ Т-клітин, що включає 1) вибір антигену, що містить CD4+ епітопи, та 2) поєднання вказаного антигену з ад'ювантом на основі емульсії масло-у-воді, як визначено в даній заявці вище, де вказана вакцина при введенні вказаному ссавцеві є здатною індукувати поліпшену CD4 Т-клітинну відповідь у вказаного ссавця. Наведення усіх посилань у даній заявці, включаючи патенті заявки та видані патенти, повністю введені в дану заявку як посилання. Для уникнення сумнівів терміни «такий, що включає», «включають» та «включає» в даній заявці призначене для того, щоб необов'язково замінювати такі терміни, як «такий, що складається з» та «складається з» відповідно у кожному випадку. Винахід буде також описаний шляхом посилання на наступні необмежувальні приклади: Приклад І описує імунологічні методи одержання інформації, що використовуються у дослідження на мишах, тхорах та людях. Приклад II описує приготування та характеристику емульсії масло-у-воді та ад'ювантних композицій, що використовуються у представлених у прикладах дослідженнях. Приклад III описує клінічне дослідження у популяції людей похилого віку (старших 65 років) при використанні вакцини, що містить розщеплений вірусний антигенний препарат вірусу грипу та ад'ювант AS03. Приклад IV описує друге клінічне дослідження - дослід по ревакцинації - у популяції людей похилого віку (старших 65 років) при використанні вакцини, що містить розщеплений вірусний антигенний препарат та ад'ювант AS03 Приклад V показує доклінічну оцінку вакцин проти грипу з ад'ювантом та без ад'юванта у тхорів (дослідження І та дослідження II). У тварин 91701 36 вимірювали температуру, виділення вірусу з організму та CD4 Т-клітинну відповідь. Приклад VI показує попередню клінічну оцінку вакцин проти грипу з ад'ювантом та без ад'юванту у С57ВІ/6 мишей, яких не піддавали попередньому антигенному впливу та у примованих мишей. Приклад VII показує попередню клінічну оцінку розщепленої та субодиничної вакцини проти грипу з ад'ювантом та без ад'юванту у С57В1/6 мишей, примованих при використанні гетерологічних штамів. Приклад VIII описує клінічне дослідження у популяції людей похилого віку (старших 65 років) при використанні вакцини, що містить розщеплений вірусний антигенний препарат вірусу грипу та ад'ювант AS03, ад'ювант AS03+MPL або не містить екзогенного ад'юванту. Приклад IX показує попередню клінічну оцінку вакцин проти грипу з ад'ювантом та без ад'юванту у тхорів (дослідження III). У тварин вимірювали температуру, виділення вірусу з організму та НІ титри. Приклад X показує клінічне дослідження у популяції людей похилого віку (старших 65 років) при використанні вакцини, що містить розщеплений антигенний препарат вірусу грипу, який включає ад'ювант AS03 з або без MPL: данні стосовно персистенції імуногенності на 90 та 180 дні. Приклад XI показує клінічне дослідження у популяції людей похилого віку (старших 65 років) при використанні вакцини, що містить розщеплений антигенний препарат вірусу грипу, який включає ад'ювант AS03 з MPL. Приклад XII показує клінічне дослідження у популяції людей похилого віку (старших 65 років) при використанні вакцини, що містить розщеплений антигенний препарат вірусу грипу, який включає ад'ювант AS03 з MPL у двох концентраціях. Приклад І - Імунологічні методи одержання інформації 1.1. Способи на мишах 1.1.1. Дослідження інгібування гемаглютинації Процедура дослідження Титри антигемаглютинінових антитіл до трьох штамів вірусу грипу визначали при використанні аналізу інгібування гемаглютинації (НІ). Принцип НІ аналізу базується на здатності специфічних антитіл до вірусу грипу інгібувати гемаглютинацію курячих еритроцитів (RBC) гемаглютиніном вірусу грипу (НА). Інактивовану прогріванням сироватку попередньо обробляли каоліном та курячими RBC для видалення неспецифічних інгібіторів. Після попередньої обробки двократні розведення сироватки інкубували з 4 одиницями гемаглютинації кожного штаму вірусу грипу. Потім додавали курячі еритроцити та підраховували аглютинацію. Титри виражали як такі, що відповідають найвищому ступеню розведення сироватки, яке є здатним повністю інгібувати гемаглютинацію. Оскільки перше розведення складало 1:20, нездатний до визначення рівень позначали як титр, рівний 10. Статистичний аналіз Статистичний аналіз проводили на титрах НІ, одержаних після вакцинації, використовуючи UNISTAT. Пропис, що застосовується для диспер 37 сійного аналізу, може бути коротко описаний наступним чином: - Log перетворення даних - Критерій Шапіро-Уілка для кожної популяції (групи) для того, щоб перевірити нормальність групованого розподілу - Критерій Кокрена для того, щоб перевірити гомогенність дисперсії між різними популяціями (групами) - Двохвидовий аналіз дисперсії, проведений на групах - HSD критерій Такі для множинних порівнянь 1.1.2. Забарвлювання внутрішньоклітинного цитокіну Ця методика дозволяє кількісно оцінювати антиген-специфічні Т-лімфоцити на основі продукції цитокіну: ефекторні Т-клітини та/або ефекторні Тклітини пам'яті, які продукують IFN-γ та/або центральні Т-клітини пам'яті, які продукуютьі L-2. РВМС (мононуклеарні клітини периферичної крові) збирали на 7 день після імунізації. Лімфоїдні клітини повторно стимулювали in vitro у присутності інгібітора секреції (Brefeldine). Ці клітини потім обробляли за допомогою традиційної імунофлуоресцентної процедури при використанні флуоресцентних антитіл (CD4, CD8, IFN-γ та IL-2). Результати виражали як частоту зустрічальності цитокін-позитивних клітин серед CD4/CD8 Т-клітин. Забарвлювання внутрішньоклітинних цитокінів Т-клітин проводили на РВМС через 7 днів після другої імунізації. Кров брали у миші та піддавали розділенню на пули клітин у гепаринізованому середовищі RPMI+ добавки. Для крові PBL суспензії, розведені RPMI + добавки, розділяли на шари на градієнті LympholyteMammal згідно з рекомендованим прописом (центрифугування протягом 20 хвилин при 2500 об./хв. та кімнатній температурі). Мононуклеарні клітини на границі розділення видаляли, промивали 2х у RPMI + добавки, та суспензії РВМС дово6 дили до значення концентрації 2 χ 10 клітин/мл у RPMI 5% фетальної сироватки теляти. In vitro антигенну стимуляцію РВМС проводили при заключній концентрації 1 х107 клітин/мл (пробірка FACS) з цільним вірусом грипу (1 мкг НА/штам) та потім інкубували 2 години при 37°С з доданням анти-СD28 та анти-СD49d (1 мкг/мл для обох). Після етапу повторної стимуляції антигену РВМС інкубували протягом ночі при 37°С у присутності Brefeldin (1мкг/мл) при 37°С для інгібування секреції цитокінів. IFN- /IL-2/CD4/CD8 забарвлювання проводили так, як описано нижче: Промивали клітинні суспензії, ресуспендували їх у 50 мкл PBS 1% FCS, що містить 2% Fc блокувального реагенту (1/50; 2.4G2). Через 10 хвилин після інкубації при темепартурі 4°С додавали 50 мкл суміші анти-СD4-РЕ (2/50) та анти-СD8 реrСр (3/50) та інкубували протягом 30 хв. при 4°С. Після промивання у PBS 1% FCS клітини перміабілізували шляхом ресуспендування в 200 мкл CytofixCytoperm (Kit BD) та інкубували протягом 20 хв. при 4°С. Потім клітини промивали Perm Wash (Kit BD) та ресуспендували з 50 мкл суміші анти-IFNАРС (1/50) + анти-ІL FITC (1/50), розведеній Perm 91701 38 Wash. Після інкубування протягом мінімум 2 годин, максимум - протягом ночі при 4°С, клітини промивали за допомогою Perm Wash та ресуспендували в PBS 1 % FCS + 1% параформальдегіду. Аналіз зразків здійснювали за допомогою FACS. Живі клітини відбирали (FSC/SSC) та збір даних проводили на ~ 20000 подіях (для лімфоцитів) або 35000 подіях для CD4+ Т-клітин. Процентне значення IFN- + або IL2+ розраховували на CD4+ та CD8+ відібраних популяціях. 1.2. Способи при використанні тхорів 1.2.1. Аналіз інгібування гемаглютинації (НІ) Процедура дослідження Титри антигемаглютинінових антитіл до трьох штамів вірусу грипу визначали при використанні аналізу інгібування гемаглютинації (НІ). Принцип НІ аналізу базується на здатності специфічних антитіл до вірусу грипу інгібувати гемаглютинацію курячих еритроцитів (RBC) гемаглютиніном вірусу грипу (НА). Сироватку спочатку обробляли 25% розчином нейрамінідази (RDE) та піддавали інактивації прогріванням для видалення неспецифічних інгібіторів. Після попередньої обробки двократні розведення сироватки інкубували з 4 одиницями гемаглютинації кожного штаму вірусу грипу. Потім додавали курячі еритроцити та підраховували аглютинацію. Титри виражали як такі, що відповідають найвищому ступеню розведення сироватки, яке є здатним повністю інгібувати гемаглютинацію. Оскільки перше розведення складало 1:10, нездатний до визначення рівень позначали як титр, рівний 5. Статистичний аналіз Статистичний аналіз проводили на титрах НІ (день 41 перед контрольним зараженням), використовуючи UNISTAT Пропис, що використовувався для дисперсійного аналізу, може бути коротко описаний наступним чином: - Log перетворення даних - Криетрій Шапіро-Уілка для кожної популяції (групи) для того, щоб перевірити нормальність групованого розподілу - Критерій Кокрена для того, щоб перевірити гомогенність дисперсії між різними популяціями (групами) - Однофакторний дисперсійний аналіз на взаємодію ANOVA - HSD критерій Такі для множинних порівнянь 1.2.2. Моніторинг температури тіла Індивідуальні температури піддавали моніторингу під час періоду контрольного зараження при використанні передавального пристрою та телеметричної реєстрації. Усі імплантати перевіряли, ремонтували та нове калібрування проводили за допомогою DSI (Data Sciences International, Centaurusweg 123, 5015 ТС Tilburg, The Netherlands) перед тим, як помістити їх у інтраперитонеальну порожнину. Усіх тварин розміщували окремо в окремі клітки під час цих вимірювань. Температури реєстрували кожні 15 хвилин протягом 4 днів перед контрольним зараженням та протягом 7 днів після зараження. 1.2.3. Носові змиви Промивання носових ходів проводили шляхом введення 5 мл PBS в обидві ніздрі тварини, яких 39 не піддавали наркозу. Інокулят збирали у чашку Петрі та поміщали у контейнери для зразків на сухий лід. Титрування вірусу з носових змивів Усі носові зразки спочатку стерильно фільтрували через фільтри Spin X (Costar) для видалення будь-якого бактеріального забруднення. 50 мкл серійних десятикратних розведень носових змивів переносили на мікротитрувальні планшети, які містили 50 мкл середовища (10 комірок/розведення). 100 мкл MDCK клітин (2,4 x 105 клітин/мл) потім додавали до кожної комірки та інкубували при 35°С протягом 5-7днів. Через 5-7 днів інкубування культуральне середовище обережно видаляли та додавали 100 мкл середовища, що містить 1/20 WST-1, та інкубували протягом подальших 18 годин. Інтенсивність жовтого забарвлення формазаном, який виробляється при відновленні WST-1 життєздатними клітинами, є пропорційною кількості життєздатних клітин, що є присутніми у комірці наприкінці аналізу титрування вірусу, інтенсивність забарвлення є здатною для кількісної оцінки шляхом вимірювання поглинання кожної пробірки при прийнятній довжині хвилі (450 нанометрів). Величину фону визначали як середнє значення OD неінфікованих контрольних клітин - 0,3 OD (0,3 OD відповідає +/- 3 StDev OD неінфікованих контрольних клітин). Позитивне значення визначали, коли OD фону. Титри виділеннявірусу з організму визначали за допомогою способу Ріда та Мюнча та виражали як Log ТСID50/мл. І.3. Аналізи для оцінки імунної відповіді у людей 1.3.1. Аналіз інгібування гемаглютинації Імунну відповідь визначали шляхом вимірювання НІ антитіл при використанні способу, описаного Центром співробітництва по грипу Всесвітньої організації охорони здоров'я, Центрами контролю захворювань, Атланта, США (1991). Вимірювання титру антитіл проводили на розморожених зразках сироватки згідно зі стандартизованим та повністю узгодженим мікрометодом, використовуючи 4 одиниці інгібування гемаглютинації (4 HIU) прийнятних антигенів та 0,5% суспензію еритроцитів птахів. Неспецифічні інгібітори сироватки видаляли шляхом теплової обробки та за допомогою ферментів, що руйнують рецептори. Одержану сироватку оцінювали на рівні НІ антитіл. Починаючи з вихідного розведення 1:10 готували серії розведень (фактор 2) до заключного розведення 1: 20480. За кінцеву точку титрування брали найбільше розведення, що демонструє повне інгібування (100%) гемаглютинації. Усі аналізи проводили у двократній повторності. 1.3.2. Аналіз інгібування нейрамінідази Аналіз проводили на мікротитрувальних планшетах, вкритих фетуїном. Готували серії двократних розведень антисироватки та змішували їх зі стандартизованою кількістю H3N2, H1N1 вірусу грипу А або вірусу грипу В. Аналіз базується на біологічній активності нейрамінідази, яка ферментативно вивільняє нейрамінову кислоту з фетуїну. 91701 40 Після відщеплення термінальної нейрамінової кислоти виявляється -D-галактоза-Nацетилгалактозамін. До комірок додавали аглютинін земляного горіху, мічений пероксидазою хрону ((НRР)-мічений) з Arachis hypogaea, який специфічно зв'язується зі структурами галактози. Кількість зв'язаного аглютиніну можна визначити та кількісно оцінити у субстратній реакції з тетраметилбензидином (ТМВ). Найвище розведення антитіла, що все ще інгібує вірусну нейрамінідазну активність принаймні на 50%, позначали як титр NI. 1.3.3. Аналіз визначення нейтралізуючих антитіл Вимірювання нейтралізуючих антитіл проводили на розморожених зразках сироватки. Нейтралізацію вірусу антитілами, що містяться у сироватці, визначали в аналізі мікронейтралізації. В аналізі використовували сироватку без додаткової обробки. Кожну сироватку титрували у трикратній повторності. Стандартизовану кількість вірусу змішували з серійними розведеннями сироватки та інкубували для зв'язування антитіл з вірусом. Клітинну суспензію, що містить визначену кількість клітин MDCK, додавали до суміші вірусу та антисироватки та інкубували при 33°С. Після періоду інкубації реплікацію вірусу візуалізували за допомогою гемаглютинації еритроцитів курки. Титр 50% нейтралізації підраховували за допомогою способу Ріда та Мюнча. 1.3.4. Опосередкований клітинами імунітет оцінювали шляхом цитокінової проточної цитометрії (CFC) Антиген-специфічні CD4 та CD8 Т-клітини периферичної крові можуть бути повторно стимульовані in vitro для продукції IL-2, CD40L, TNF-альфа та IFN, якщо їх інкубувати з відповідним антигеном. Згідно з цим антиген-специфічні CD4 та CD8 Т-клітини можуть бути підраховані шляхом проточної цитометрії, що супроводжується традиційним імунофлуоресцентним міченням клітинного фенотипу, а також внутрішньоклітинної продукції цитокінів. У даному дослідженні вакцинний антиген грипу, як і пептиди, що походять від специфічного білка вірусу грипу, використовували як антиген для повторної стимуляції специфічних для грипу Тклітин. Результати виражали як частоту зустрічальності цитокін-позитивних CD4 або CD8 Т-клітин у межах субпопуляції CD4 або CD8 Т-клітин. 1.3.5. Статистичні методи 1.3.5.1. Первинні критичні точки • Процент, інтенсивність та зв'язок з вакцинацією представлених на вимогу місцевих та загальних ознак та симптомів протягом семиденного періоду спостереження (тобто, у день вакцинації та наступні 6 днів) після вакцинації та взагалі. • Процент, інтенсивність та зв'язок з вакцинацією представлених добровільно місцевих та загальних ознак та симптомів протягом двадцятиодноденного періоду спостереження (тобто, у день вакцинації та наступні 20 днів) після вакцинації та взагалі. • Виникнення серйозних побічних ефектів під час усього періоду дослідження 1.3.5.2. Вторинні критичні точки Для гуморальної імунної відповіді: Дослідні величини: 41 • У дні 0 та 21: титри сироваткових гемаглютинінінгібуючих (НІ) та NI антитіл, досліджували окремо проти кожного з трьох штамів вірусу грипу, представлених у вакцині (анти-Н1N1, анти-Н3N2 та анти-В-антитіла). • У дні 0 та 21: титри нейтралізуючих антитіл, досліджували окремо проти кожного з трьох штамів вірусу грипу, представлених у вакцині. Похідні величини (з 95% довірчими інтервалами): • Середнє геометричне титрів (GMT) сироваткових НІ антитіл (95% СІ) до та після вакцинації • Індекси сероконверсії* з 95% СІ на день 21 • Коефіцієнти конверсії** з 95% СІ на день 21 • Коефіцієнти серозахисту з 95% СІ на день 21 • GMT сироваткового NI антитіла (з 95% довірчими інтервалами) в усіх кінцевих точках. • Індекс сероконверсії, визначений як процент вакцинованих, які мали принаймні чотирьохкратне підвищення сироваткових НІ титрів на день 21 у порівнянні з днем 0, для кожного вакцинного штаму. **Коефіцієнт конверсії, визначений як кратність підвищення GMT сироваткових НІ на день 21 у порівнянні з днем 0, для кожного вакцинного штаму. ***Індекс захисту, визначений як частина вакцинованих з сироватковим НІ титром = 40 після вакцинації (для кожного вакцинного штаму), що звичайно приймають як такий, що свідчить про захист. Для опосередкованої клітинами імунної відповіді (СМІ) Дослідні величини: У дні 0 та 21: частота зустрічальності цитокінпозитивних CD4/CD8 клітин на 106 клітин у різних аналізах. Кожний аналіз кількісно оцінює відповідь CD4/CD8 Т-клітин на: • Пептидний антиген вірусу грипу (pf) (точна природа та походження цих антигенів потребує зазначення/пояснення) • Антиген розщепленого вірусу грипу (sf) • Цільний антиген вірусу грипу (wf). Похідні величини: • клітини, що продукують принаймні два різні цитокіни (CD40L, IL-2, IFN , TNF ) • клітини, що продукують принаймні CD40L та інший цитокін (IL-2, TNF , IFN ) • клітини, що продукують принаймні IL-2 та інший цитокін (CD40L, TNF , IFN ) • клітини, що продукують принаймні IFN та інший цитокін (IL-2, TNF , CD40L) • клітини, що продукують принаймні TNFa та інший цитокін (IL-2, CD40L, IFN ) 1.3.5.3. Аналіз імуногенності Аналіз імуногенності базувався на загальній групі вакцинованих. Для кожної групи обробки розраховували наступні параметри (з 95% довірчими інтервалами): • Середнє геометричне значення титрів (GMT) НІ та N1 антитіл на дні 0 та 21 • Середнє геометричне значення титрів (GMT) нейтралізуючого антитіла на дні 0 та 21. • Коефіцієнти конверсії на день 21. 91701 42 •Індекси сероконверсії (SC) на день 21, визначені як процент вакцинованих, які мали принаймні чотирьохкратне підвищення сироваткових НІ титрів на день 21 у порівнянні з днем 0. •Індекси захисту на день 21, визначені як процент вакцинованих з сироватковим титром НІ = 1:40. •Частота зустрічальності CD4/CD8 Тлімфоцитів, які секретуються у відповідь, підсумовували (описова статистика) для кожної групи вакцинації, у кожній критичній точці (День 0, День 21) та для кожного антигену (пептид вірусу грипу (pf), розщеплений вірус грипу (sf) та цільний вірус грипу (wf)). • Описова статистика індивідуальних відмінностей між відповідями кінцевої точки (до-після) для кожної групи вакцинації та для кожного антигену (pf, sf, та wf) у 5 різних аналізах. • Непараметричний аналіз (критерій КрускалаУоліса) використовували для порівняння відмінностей між трьома групами, а статистичне рзначення підраховували для кожного антигену у кожному з 5 різних аналізів. Усі критерії значущості були двосторонніми. Р-значення, менші або рівні 0,05, вважали статистично значущими. Приклад II - Приготування та характеристика емульсії масло-у-воді та композицій з ад'ювантом Якщо не вказано інше, то масляно/водна емульсія, що використовується у подальших прикладах, складається з органічної фази, яка включає 2 масла (альфа-токоферол та сквален), та водної фази PBS, яка включає Твін 80 як емульгувальний агент. Якщо не вказано інше, то композиції з ад'ювантом на основі емульсії масло-у-воді, що використовуються у подальших прикладах, приготовлені такими, що включають наступний компонент емульсії масло-у-воді (приведена заключна концентрація): 2,5% сквален (об./об.), 2,5% альфатокоферол (об./об.), 0,9% поліоксіетиленсорбітмоноолеат (об./об.) (Твін 80), див. WO 95/17210. Цю емульсію, що позначається AS03 у подальших прикладах, готують як концентрат двократної концентрації. 11.1. Одержання емульсії SB62 11.1.1. Одержання у лабораторному масштабі Твін 80 розчиняли у фосфатно-буферному сольовому розчині (PBS) з одержанням 2% розчину у PBS. Для одержання 100 мл концентрату двократної концентрації емульсії 5 г DL альфа-токоферолу та 5 мл сквалену ретельно перемішували при струшуванні. Додавали 90 мл розчину PBS/Твін та ретельно перемішували. Одержану емульсію потім пропускали через шприц та, на завершення, піддавали мікропсевдозрідженню при використанні пристрою M110S для мікропсевдозрідження. Одержані масляні краплі мали розмір приблизно 120180 нм (виражений як середня величина Z, виміряна за допомогою PCS). Додавали інші ад'юванти/антигенні компоненти до емульсії за допомогою простого змішування. 11.1.2. Одержання у промисловому масштабі Одержання емульсії SB62 проводили шляхом змішування при інтенсивному перемішуванні масляної фази, що складається з гідрофобних компонентів (альфа-токоферол та сквален), та водної 43 фази, що містить розчинні компоненти (Твін 80 та PBS-мод. (модифікований), рН 6,8). При перемішування масляну фазу (1/10 загального об'єму) переносили у водну фазу (9/10 загального об'єму), та суміш перемішували протягом 15 хвилин при кімнатній температурі. Одержану суміш потім піддавали впливу сил зсуву, удару та кавітації у камері для взаємодії приладу для мікропсевдозрідження (15000 фунтів/кв.дюйм - 8 циклів) для одержання крапель субмікронного розміру (розподіл між 100 та 200 нм). Одержане значення рН складало 6,8 ±0,1. Емульсію SB62 потім піддавали фільтрації через фільтр 0,22 мкм та стерильний об'єм зберігали замороженим у Cupak контейнерах при температурі від 2 до 8°С. Стерильний інертний газ (азот або аргон) запускали у «мертвий» простір контейнера з емульсією SB62 протягом 15 секунд. Заключний склад SB62 емульсії є наступним : Твін 80: 1,8% (об./об.) 19,4 мг/мл; сквален: 5% (об./об.) 42,8 мг/мл; альфа-токоферол: 5% (об./об.) 47,5 мг/мл; PBS-мод.: NaCI 121 мМ, КСІ 2,38 мМ, Na2HP04 7,14 мМ, КН2РO41,3 мМ; рН 6,8 ±0,1. II.2. Вимірювання розміру крапель за допомогою динамічного розсіювання світла 11.2.1. Введення Розмір діаметру масляних крапель визначали згідно з наступною процедурою та при наступних експериментальних умовах. Величина розміру крапель представлена як величина інтенсивності та виражена як середнє значення z, що вимірюється за допомогою PCS. 11.2.2. Приготування зразка Вимірювання розміру проводили на ад'юванті на основі емульсії масло-у-воді: SB62, що була одержана у відповідності зі способом одержання у промисловому масштабі, AS03 та AS03+MPL (50 мкг/мл), дві останні були одержані безпосередньо перед використанням. Склад зразків представлений нижче (див. розділ II.2.4.). Зразки розводили 4000х - 8000х у PBS 7,4. Як контроль, стандарти розміру частинок 100 нм PL-Nanocal (кат.номер 6011-1015) розводили у 10 мМ NaCI. 11.2.3. Вимірювання розміру за допомогою пристрою для вимірювання розміру Malvern Zetasizer 3000HS Усі вимірювання розміру проводили за допомогою Malvern Zetasizer 3000HS. Зразки піддавали вимірюванню у пластиковій кюветі для Malvern аналізу при прийнятному розведенні (звичайно, при розведенні від 4000х до 20000х в залежності від концентрації зразка), та при використанні двох оптичних моделей: - або дійсного коефіцієнту заломлення частинок 0 та уявного коефіцієнту 0. -або дійсного коефіцієнту заломлення частинок 1,5 та уявного коефіцієнту 0,01 (адаптована оптична модель емульсії згідно зі значеннями, представленими у літературі), Технічні умови були наступними: - довжина хвилі лазера: 532 нм (Zeta3000HS). - потужність лазера: 50 мВ (Zeta3000HS). - розсіяне світло, визначене при 90° (Zeta3000HS). 91701 44 - температура: 25°С, - тривалість: автоматичне визначення за допомогою програмного забезпечення, - кількість: 3 послідовні вимірювання, - z - середнє значення діаметру: семіінваріантного аналізу - розподіл розміру: за допомогою способу Контін або Automatic Автоматичний алгоритм Malvern використовує алгоритми комбінації семіінваріантів, Контін та невід'ємних найменших квадратів (NNLS). Інтенсивність розподілу може бути перетворена на об'ємний розподіл завдяки теорії Мі. ІІ.2.4. Результати (див. Таблицю 2) Семіінваріантний аналіз (Z середнє значення діаметру): Z-середнє значення діаметру (ZAD) оцінювали за допомогою світла, розсіяного кожним розміром частинок у зразка. Це значення є пов'язаним з мономодальним аналізом зразка та, головним чином, використовується для цілей відтворюваності. Рівень активності (CR) є мірою розсіяного світла: він відповідає тисячам фотонів за секунду. Коефіцієнт полідисперсності (Poly) являє собою ширину розподілу. Це є безрозмірна величина ширини розподілу. Аналіз Контін та Automatic: Два інші препарати SB62 (двократно концентрований AS03) одержували та оцінювали згідно з процедурою, що пояснюється вище, з наступними незначними модифікаціями: Зразки піддавали вимірюванню у пластиковій кюветті для Malvern аналізу при двох розведеннях для одержання оптимального р-значення рівня активності: 10000х та 20000х для Zetasizer 3000HS, при цьому використовували ті ж самі оптичні моделі, що й у приведеному вище прикладі. Результатипоказані у Таблиці 3. 45 Схематичне представлення цих результатів показане на Фігурі 1 для композиції 1023. Як можна побачити, переважна більшість частинок (наприклад, принаймні 80%) має діаметр, менший ніж 300 нм за інтенсивністю. ІІ.2.5. Загальний висновок Композицію SB62 піддавали вимірюванню при різних розведеннях при використанні Malvern Zetasizer 3000HS та двох оптичних моделей. Розмір частинок ZAD (тобто середнє значення інтенсивності за семіінваріантним аналізом) композицій, оцінене так, як описано вище, було приблизно 150-155 нм. Коли використовували семіінварінатний алгоритм, то не спостерігали ніякого впливу розведення на величину ZAD та полідисперсність. II.3. Приготування AS03, що включає MPL 11.3.1. Приготування рідкої суспензії MPL Рідкий препарат MPL (як використовується у даному документі, це є абревіатурою для 3D-MPL, тобто 3-О-деацилованого монофосфорилліпіду А) готували з MPL® ліофілізованого порошку. Рідкий препарат MPL являє собою стабільну концентровану (приблизно 1 мг/мл) водну суспензію сирового матеріалу, який є готовим до застосування для композиції вакцини або ад'юванту. Схематичне представлення для процесу приготування приведене на Фігурі 2. Для максимально розміру партії 12 г рідкий препарат MPL переносили у стерильний скляний контейнер. Диспергування MPL складалося з наступних етапів: - суспендували MPL порошок у воді для ін'єкцій - піддавали дезінтеграції будь-які великі агрегати прогріванням (температурна обробка) - зменшували розмір частинок від 100 нм до 200 нм шляхом одержання мікропсевдозрідженого шару - попередньо фільтрували препарат на фільтрі для попереднього фільтрування Sartoclean, 0,8/0,65 мкм - стерильно фільтрували препарат при кімнатній температурі (Sartobran P, 0,22 нм) MPL порошок піддавали ліофілізації за допомогою одержання мікропсевдозрідженого шару, що приводило до одержання стабільної колоїдної водної дисперсії (розмір частинок MPL менший, ніж 200 нм). Ліофілізований порошок MPL диспергували у воді для ін'єкцій для того, щоб одержати грубодисперсну суспензію 10 мг/мл. Суспензію потім піддавали тепловій обробці при перемішуванні. Після охолодження до кімнатної температури починали процес одержання мікропсевдозрідженого шару для того, щоб зменшити розмір частинок. Одержання мікропсевдозрідженого шару проводили при використанні пристрою для мікропсевдозрідження М110ЕН, шляхом безперервної циркуляції дисперсії через камеру взаємодії мікропсевдозрідження, при визначеному тиску для мінімальної кількості проходження (кількість циклів: nmin). Тривалість мікропсевдозрідження, що являє собою кількість циклів, підраховували на основі виміряної швидкості потоку та об'єму дисперсії. На даному обладнанні при заданому тиску одержана 91701 46 швидкість потоку може варіювати в залежності від одної камери взаємодії до іншої та протягом життєвого циклу даної камери. У даному прикладі камера взаємодії, що використовується, являє собою таку типу F20Y Microfluidics. Оскільки ефективність мікропсевдозрідження пов'язана з тиском, то швидкість потоку, час обробки можуть варіювати від однієї партії до іншої. Час, необхідний для одного циклу, підраховують на основі швидкості потоку. Швидкість потоку вважається швидкістю потоку, що виміряна з водою для ін'єкцій перед введенням MPL у пристрій. Один цикл визначається як час (у хвилинах), що необхідний для загального об'єму MPL для однократного проходження через пристрій. Час, необхідний для одержання η циклів, підраховують так, як описано нижче: n x кількість MPL для обробки (мл) / швидкість потоку (мл/хв.) Кількість циклів уточнюють відповідним чином. Мінімальна кількість циклів для проведення процесу (nmin) описується для переважного обладнання та камер взаємодії, що використовуються. Загальна кількість циклів, що проводяться, визначається результатом вимірювання розміру частинок, який здійснюють після проведення nmin циклів. Границю розміру частинок (dlim) визначають на основі історичних даних. Вимірювання проводять за допомогою методики фотокореляційної спектроскопії (PCS) a dlim виражають як унімодальний результат (Zceреднє). При цьому граничному значенні мікропсевдозрідження може бути зупинене після проведення nmin циклів. Після цієї границі мікропсевдозрідження продовжують до тих пір, поки не одержують задовільне зниження розміру для максимум 50 інших циклів. Якщо фільтрацію не проводять безпосередньо після мікропсевдозрідження, то диспергований MPL зберігають при температурі від +2 до +8°С, очікуючи переносу на ділянку фільтрації. Після мікропсевдозрідження дисперсію розводять водою для ін'єкцій та стерильно фільтрують через 0,22 мкм фільтр під ламінарним потоком. Заключна концентрація MPL складає 1 мг/мл (0,801,20 мг/мл). ІІ.3.2. Одержання вакцини з ад'ювантом AS03+MPL: підхід однієї ампули До AS03 ад'ювантної композиції додавали MPL при заключній концентрації від 10 до 50 мкг на вакцинну дозу. Десятикратно концентрований PBS (рН 7,4 у випадку, коли є однократно концентрованим), а також суміш SB62, що містить Твін, Тритон Х-100 та VES (вітамін Ε сукцинат), додавали до води для ін'єкцій. Брали до уваги кількості детергенту, що є присутнім у штамах вірусу грипу так, щоб досягти заключної концентрації 750 мкг/мл Твін 80, 110 мкг/мл Тритон Х-100 та 100 мкг/мл VES. Після 5 хвилин перемішування додавали 15 мкг кожного штаму вірусу грипу, що представляє інтерес (наприклад, штам Η1Ν1, Η3Ν2 та В у класичній трьохвалентній вакцині). Після 15 хвилин перемішування додавали 250 мкл емульсії SB62, а потім 25 мкг або 50 мкг MPL. 47 Схематичне представлення процесу приготування приведене на Фігурі 3. Заключна композиція AS03, що включає MPL на одну дозу для людини, представлена у Таблиці 4. II.3.3. Приготування вакцини з ад'ювантом AS03+MPL: підхід двох ампул Ту саму композицію можна приготувати згідно з підходом двох ампул шляхом змішування двократно концентрованого антигену або антигенного препарату з ад'ювантом AS03 (SB62 250 мкл) або з AS03+MPL (SB62 250 мкл + 25 мкг або 50 мкг MPL). У цьому випадку процес здійснюють наступним чином. Виробництво вакцини вірусу грипу з ад'ювантом AS25 складається з трьох етапів: 1) Приготування композиції тривалентного заключного об'єму (двократно концентрована) без ад'юванту та внесення її в контейнер для антигену 2) Приготування ад'юванту AS03+MPL 3) Негайне відновлення розщепленої вакцини грипу з ад'ювантом AS03+MPL 1) Приготування композиції тривалентної заключної маси (двократно концентрована) без ад'юванту на внесення її в контейнер Об'єми трьох моновалентних препаратів базуються на вмісті НА, виміряному у кожному моновалентному препараті перед одержанням композиції та на заключному об'ємі 1100 мл. Концентрований фосфатно-буферний сольовий розчин та попередньо змішані Твін 80, Тритон Х100 та альфа-токоферил гідрогенсукцинат розводили водою для ін'єкцій. Три концентровані монопрепарати (A/New Caledonia, A/New York, B/Jiangsu) потім послідовно розводили в одержаному фосфатно-буферному розчині / Твіну 80 Тритону Х-100 - альфа-токоферил гідрогенсукцинату (рН 7,4, 137 мМ NaCI, 2,7 мМ КСІ, 8,1 мМ Na2HP04, 1,47 мМ КН2Р04, 990 мкг/мл Твіну 80,150 мкг/мл Тритону Х-100 та 130 альфа-токоферил гідрогенсукцинату) для того, щоб одержати заключну концентрацію 39,47 мкг НА А штамів (H1N1, H3N2) на мл тривалентного заключного препарату (15 мкг НА/ штаму А /380 мкл тривалентного заключного препарату) та 46 мкг НА штаму В (17,5 мкг НА/ В штаму /380 мкл тривалентного заключного препарату). Між доданням кожного моновалентного препарату суміш перемішували протягом 91701 48 10-30 хвилин при кімнатній температурі. Після додання останнього моновалентного препарату та 15-30 хвилин перемішування, перевіряли значення рН та доводили його до 7,2 ± 0,2 за допомогою НСІ або NaOH. Тривалентну заключну суміш антигенів асептично вносили в стерильні скляні ампули на 3 мл типу І (Ph. Eur). Кожна ампула містить об'єм 470 мкл (380 мкл + 90 мкл для переповнення). 2) Одержання препарату AS03/MPL ад'юванту та введення його в контейнер для ад'юванту Ад'ювант AS03/MPL одержували шляхом змішування двох компонентів: емульсії SB62 (спосіб у розділі 11.1.2) та MPL (спосіб у розділі 11.3.1). Однократно концентрований PBS-мод. (приготовлений шляхом розведення десятикратно концентрованого PBS-мод. у воді для ін'єкцій) з препаратом SB62 та рідким препаратом MPL при 1 мг/мл. Концентрація MPL буде визначатися так, щоб досягти заключної концентрації від 10 до 50 мкг, переважно приблизно 25 мкг на заключну вакцинну дозу для людини. Суміш перемішували протягом 5-30 хвилин при кімнатній температурі, та значення рН доводили до 6,8 ±0,1 за допомогою NAOH (0,05 або 0,5 М)/ НСІ (0,03 Μ або 0,3 М). Після подальшого перемішування протягом 5-30 хвилин при кімнатній температурі суміш стерилізували фільтрацією через фільтр 0,22 мкм. Проводили прокачку стерильного інертного газу (азот) для одержання інертного простору над продуктом у заповнених контейнерах протягом 1 хвилини. Стерильний AS03+MPL ад'ювант зберігали при температурі +28°С до асептичного перенесення у стерильні скляні шприци типу І (Ph. Eur.) на 1,25 мл. Кожний шприц містить надлишковий об'єм 80 мкл (320 мкл + 80 мкл переповнення). Під час ін'єкції вміст попередньо заповненого шприца, що містить ад'ювант, вводили в ампулу, що містить концентровані тривалентні інактивовані антигени розщепленого віріону. Після перемішування вміст переносили у шприц та голку заміняли голкою для внутрішньом'язової ін'єкції. Одна доза відновленої кандидатної вакцини вірусу грипу з ад'ювантом AS25 відповідає 0,7 мл. II.4. Одержання імуногенних композицій, що включають антиген вірусу грипу та необов'язково MPL у композиції емульсії масло-у-воді. До SB62 емульсії 11.1 додавали рівний об'єм двократно концентрованого антигену розщепленого вірусу грипу (Fluarix™) (15 мкг НА на штам), та суміш перемішували. Ці суміш поєднували, якщо це є прийнятним, з 50 мкг/мл MPL для одержання заключної композиції. Приклад III - Клінічне дослідження у популяції людей похилого віку, старших 65 років, при використанні вакцини, що містить розщеплений антигенний препарат вірусу грипу та AS03 ад'ювант (Explo-Flu-001) Фаза І, відкрите, рандомізоване дослідження проводили у популяції людей похилого віку, старших 65 років, у 2003 для того, щоб оцінити реактогенність та імуногенність кандидатної вакцини грипу GlaxoSmithKline Biologicals, що містить ад'ювант AS03. Гуморальну імунну відповідь (тобто, титри антигемаглютинінових, нейтралізуючих та анти 49 нейрамінідазних антитіл) та опосередковану клітинами імунну відповідь (CD4 та/або CD8 Т-клітинні відповіді) вимірювали через 21 день після внутрішньом'язового введення однієї дози вакцини з ад'ювантом AS03 або a WV вакцини. Fluarix™ використовували як стандарт. ІІІ.1 Модель дослідження Три групи осіб паралельно одержували наступну вакцину внутрішньом'язово: - одна група з 50 осіб, що одержувала одну дозу відновленої SV вакцини грипу з ад'ювантом (FluAS03) - одна група з 50 осіб, що одержувала одну дозу вакцини грипу на основі цільного вірусу (FluWVV) -одна група з 50 осіб, що одержувала одну дозу Fluarix™ (Fluarix) = контроль. Розклад вакцинації: одна ін'єкція вакцини грипу у день 0, забір зразків крові, зчитування аналізу на день 21 (визначення НІ антитіл, визначення NI антитіл, визначення нейтралізуючих антитіл та аналіз СМІ) та висновки стосовно досліду. Стандартна тривалентна розщеплена вакцина грипу - Fluarix™, яка використовується у цьому дослідженні, являє собою комерційну вакцину з 2003 року, що вдосконалена та виробляється GlaxoSmithKline Biologicals. III.2. Вакцинна композиція та введення (Таблиця 5) III.2.1. Приготування вакцини Вакцина проти грипу з ад'ювантом AS03 Кандидатна вакцина проти грипу з ад'ювантом AS03 являє собою двохкомпонентну вакцину, що складається з концентрованих тривалентних антигенів інактивованого розщепленого віріону, представлених у скляній ампулі типу І (335 мкл) (контейнер для антигенів) та попередньо заповненого скляного шприца типу І, що містить SB62 емульсію (335 мкл) (контейнер для ад'юванту). Під час ін'єкції вміст антигенного контейнеру видаляють з нього за допомогою попередньо заповненого SB62 емульсією шприца, після чого обережно перемішують вміст шприца. Перемішування SB62 емульсії з вакцинними антигенами відновлює AS03 ад'ювант. Перед ін'єкцією використану голку замінюють голкою для внутрішньом'язового введення та доводять об'єм до 500 мкл. Одна доза відновленої вакцини проти грипу з ад'ювантом AS03 відповідає 0,5 мл і містить 15 мкг НА кожного штаму вірусу грипу, як і у зареєстрованій вакцині Fluarix™/ - Rix®, а також містить 10,68 мг сквалену, 11,86 мг DL-альфа-токоферолу та 4,85 мг полісорбату 80 (Твіну 80). Одержання Виробництво вакцини проти грипу з ад'ювантом AS03 складається з трьох основних етапів: 1) Одержання тривалентного заключного препарату з ад'ювантом та введення його в антигенний контейнер. Об'єми трьох моновалентних препаратів базувалися на вмісті НА, що вимірюється у кожному моновалентному препараті перед рецептуванням та на основі заключного об'єму 800 мл. Фосфатнобуферний сольовий розчин та первинна суміш Твіну 80, Тритону Х-100 та альфа 91701 50 токоферилгідросукцинат розводили у воді для ін'єкцій. Три концентровані монопрепарати (штам A/New Caledonia, штам A/Panama та штам B/Shangdong) потім послідовно розводили в одержаній суміші, яка містить фосфатно-буферний сольовий розчин / Твін 80 - Тритон Х-100 - альфатокоферил гідросукцинат (рН 7,4, 137 мМ NaCI, 2,7 мМ КСІ, 8,1 мМ Na2HP04, 1,47 мМ КН2Р04, 1500 мкг/мл Твіну 80, 220 мкг /мл Тритону Х-100 та 200 мкг/мл альфа-токоферилгідросукцинату), для того, щоб забезпечити заключну концентрацію 60 мкг НА штамів А на 1 мл тривалентного препарату (15 мкг НА/ А штаму /250 мкл заключного тривалентного препарату) та 70 мкг НА В штаму (17,5 мкг НА/ В штаму /250 мкл тривалентного заключного препарату). У період між доданням кожного моновалентного препарату суміш перемішували протягом 10 хвилин при кімнатній температурі. Після додання останнього моновалентного препарату та 15-хвилинного перемішування, перевіряли значення рН та доводили його до 7,2 ±0,1 за допомогою НСІ або NaOH. Тривалентний заключний препарат антигенів асептично вносили у скляні ампули типу І на 3 мл. Кожна ампула містить 34% загального об'єму (335 мкл загального об'єму). 2) Одержання стерильного препарату емульсії SB62 та внесення її в ад'ювантний контейнер • Водна фаза: при перемішуванні 902 мл Твіну 80 змішували з 44105 мл PBS-мод. буфера (рН = 6,8 після доведення значення за допомогою НСІ). • Масляна фаза: при перемішуванні 2550 мл сквалену додавали до 2550 мл альфатокоферолу. • Перемішування водної та масляної фаз: при перемішуванні 5000 мл масляної фази (1/10 загального об'єму) переносили до 45007 мл водної фази (9/10 загального об'єму). Суміш перемішували протягом 15 хвилин при кімнатній температурі. • Емульгування: одержану суміш піддавали впливу сил зсуву, удару та кавітації у камері для взаємодії пристрою для мікропсевдозрідження (15000 фунтів на квадратний дюйм - 8 циклів) для одержання субмікронних крапель (розподіл між 100 та 200 нм). Одержане значення рН складало 6,8 + 0,1. • Стерильна фільтрація: емульсію SB62 стерилізували шляхом фільтрації через фільтр 0,22 мкм, та стерильний препарат емульсії зберігали у контейнерах Сирас при температурі від 2 до 8 °С. Стерильний інертний газ (азот або аргон) запускали у «мертвий» простір контейнера, що містить заключний об'єм SB62 емульсії протягом принаймні 15 секунд. Усі наведені кількості інгредієнтів є такими для приготування 50 л емульсії та приведені в об'ємах. На практиці кількості відважують, беручи до уваги густину інгредієнтів. Густина PBS вважається рівною 1. Заключний склад SB62 емульсії є таким, як приведено нижче: 51 Стерильний препарат емульсії SB62 потім асептичного переносили у стерильні скляні шприци типу І на 1,25 мл . Кожний шприц містить 34% загального об'єму (335 мкл загального об'єму). 3) Відновлення розщепленої вірусної вакцини з ад'ювантом АS03 для негайного введення. Під час ін'єкції вміст ампули, що включає концентровані тривалентні інактивовані антигени розщепленого віріону, видаляли з ампули за допомогою шприца, що містить емульсію SB62, після чого проводили обережне перемішування вмісту шприца. Перемішування SB62 емульсії з вакцинними антигенами відновлювало склад AS03 ад'юванту. III.2.2. Склад вакцини (Таблиця 6) та введення Вакцини вводили внутрішньом'язово в область дельтовидного м'яза лівої руки. За вакцинованими пильно спостерігали протягом принаймні 30 хвилин з прийнятним медичним лікуванням, що є легкодоступним у випадку малоймовірної анафілактичної реакції після введення вакцини. III.3. Результати вивчення популяції Загальна кількість 148 осіб була внесена у список для цього дослідження: 49 осіб у групу FluAS03, 49 осіб у группу Fluarix та 50 осіб у групу FluWW. Середній вік загальної групи вакцинованих осіб складав 71,8 років зі стандартним відхиленням 6,0 років. Середнє значення віку та статевий розподіл осіб у трьох групах вакцинованих були подібними. III.4. Висновки щодо безпеки Введення вакцини грипу з ад'ювантом AS03 було безпечним та клінічно добре переносимим у 91701 52 популяції, що вивчалася, тобто у людей похилого віку, старших 65 років. III.5. Результати стосовно імуногенності Аналіз імуногенності проводили на загальній групі вакцинованих. III.5.1. Гуморальна імунна відповідь Для того, щоб оцінити гуморальну імунну відповідь, індуковану вакциною з ад'ювантом AS03, для кожної групи обробки підраховували наступні параметри (з 95% довірчими інтервалами): • Середнє геометричне значення титрів (GMT) НІ та NI антитіл на дні 0 та 21 • Середнє геометричне значення титрів (GMT) нейтралізуючого антитіла на дні 0 та 21. • Індекси сероконверсії (SC) на день 21, визначені як частина вакцинованих, які мали принаймні чотирьохкратне підвищення сироваткових НІ титрів на день 21 у порівнянні з днем 0. •Коефіцієнти конверсії на день 21, визначені як кратність підвищення GMT для сироваткових НІ антитіл на день21 у порівнянні з днем 0 для кожного вакцинного штаму • Індекси захисту на день 21, визначені як частина вакцинованих з сироватковим титром НІ = 1:40. III. 5.1.1 Утворення антигемаглютинінових антитіл а) Середнє геометричне значення титрів (GMT) для НІ GMT для НІ антитіл з 95% СІ показані у Таблиці 7 (GMT для анти-НІ антитіла). GMT антитіл для усіх вакцинних штамів перед вакцинацією були у межах одного й того ж діапазону у трьох групах. Після вакцинації рівні анти-гемаглютинінового антитіла значно підвищувалися. Після вакцинації існувала тенденція до більш високих значень GMT НІ антитіла для усіх трьох вакцинних штамів у групах FluAS03 та Fluarix, хоча спостерігалосядеяке перекривання 95% СІ між групою Fluarix та групою FluWW. N = Кількість осіб = кількість осіб з прийнятними результатами 95% СІ = 95% довірчого інтервалу; НГ = нижня границя; ВГ = верхня границя MIN/MAX = мінімум/максимум PRE = до вакцинації на день 0 PI (день 21) = після вакцинації на день 21 53 b) Коефіцієнти конверсії титрів анти-НІ антитіл, індекси серозахисту та індекси сероконверсії (корелятивний зв'язок для захисту людини) Результати представлені у Таблиці 8. Коефіцієнти конверсії являють собою кратність підвищення GMT НІ антитіл у сироватці для кожного вакцинного штаму на день 21 у порівнянні з днем 0. Значення коефіцієнту конверсії варіює від 6,1 до 13,6 у відповідності з вірусним штамом та вакциною. Цей коефіцієнт конверсії значно перевищує двократне підвищення GMT, що вимагається європейськими органами. Індекси серозахисту представляють відношення кількості осіб з титром сироваткових НІ антитіл 40 на день 21. На початку дослідження половина осіб (інтервал 34,0% -69,4%) в усіх групах мали захисні рівні антитіл для усіх штамів на день 21, індекси серозахисту у трьох групах коливалися від 88,0% до 100% для різних штамів вірусу. З точки зору захисту це значення означає, що більше, ніж 88% осіб мали титр сироваткових НІ антитіл 40 після вакцинації та передбачаються як такі, що захищають проти цих трьох штамів. Цей індекс значно перевищує індекс серозахисту 60%, що вимагається для популяції осіб віком 60 років європейськими органами Індекси сероконверсії являють собою відношення осіб з принаймні чотирикратним підвищенням титру сироваткових НІ антитіл на день 21 у порівнянні з днем 0. Загальні індекси відповіді для трьох штамів були суттєво рівними у трьох групах. Для того, щоб вважатися ефективною згідно з нормами Європейського Союзу, вакцина повинна індукувати індекс сероконверсії, більший, ніж 30% у популяції людей віком 60 років. У цьому дослідженні індекс сероконверсії був більшим, ніж 50% для трьох груп. N = загальна кількість осіб Висновок: • Після вакцинації існувала тенденція до більш високих GMT НІ антитіла для усіх трьох вакцинних штамів у групах FluAS03 та Fluarix, незважаючи на те, що було існувало деяке перекривання 95% СІ між групою Fluarix та групою FluWW. • Індекс конверсії варіював від 6,1 до 13,6 відповідно до штаму вірусу та вакцини. Індекс конверсії набагато перевищує двократне підвищення значення GMT, що вимагається європейськими органами. • На день 21 коефіцієнти серозахисту у трьох групах коливалися від 88,0% до 100% для різних штамів вірусу. Цей коефіцієнт значно перевищує 91701 54 коефіцієнт серозахисту 60%, що вимагається для популяції людей похилого віку > 60, європейськими органами. • У цьому дослідженні індекс сероконверсії був більшим 50% для трьох груп. Індекси загальної відповіді для трьох штамів були суттєво рівними у трьох групах. III. 5.1.2 Титри нейтралізуючих антитіл Для того, щоб краще охарактеризувати імунну відповідь на вакцинацію проти вірусу грипу у людей похилого віку, оцінювали утворення сироваткового антитіла до нейтралізуючих антигенів. Результати показані у Таблиці 9 (Індекси сероконверсії та середні геометричні значення титрів (GMT) для анти-нейтралізуючого антитіла) та Таблиці 10 (Індекси сероконверсії для антинейтралізуючих антитіл на день 21 після вакцинації (кратність підвищення = 4)). Титри нейтралізуючого антитіла проти трьох штамів вірусу грипу вимірювали у сироватці до імунізації та після імунізації. Визначали наступні параметри: • Середнє геометричне значення титрів (GMT) сироваткових нейтралізуючих антитіл з 95% довірчими інтервалами (95% СІ) до та після вакцинації. • Індекси сероконверсії з 95% СІ на день 21, визначені як частина вакцинованих з принаймні з чотирикратним підвищенням НІ титрів на день 21 у порівнянні з днем 0 для кожного вакцинного штаму. Група 1: Вакцина проти грипу, змішана з ад'ювантом 2х конц. Flu вакц. Група 2: Вакцина проти грипу Flu вакцина Група 3: Вакцина проти грипу Flu WW вакцина N = кількість осіб з прийнятними результатами n/% = кількість/процент осіб з титром у межах вказаного інтервалу 95% СІ = 95% довірчий інтервал; НГ = нижня границя; ВГ = верхня границя PRE = перед вакцинацією на день 0 РІ(д21) = після вакцинації на день 21 55 Група1: Вакцина проти грипу (DFLU58A16), змішана з ад'ювантом (D621024A8) 2х конц. Flu вакцина Група 2: Вакцина проти грипу (18854В9) Flu вакцина Група 3: Вакцина проти грипу (DFLU59A2) Flu WW вакцина N = кількість осіб з прийнятними результатами як перед вакцинацією, так і після вакцинації. n = кількість респондерів % = частина респондерів ( n/Νx100). 95% СІ = відповідний 95% довірчий інтервал; НГ = нижня границя, ВГ = верхня границя Основні відкриття були наступними: • Для трьох вакцин на день 21 індекс серозахисту 100 % був одержаний для обох А штамів. Для штаму В індекси серозахисту у трьох групах коливалися в діапазоні від 92% до 100%. • Після вакцинації спостерігалося значне підвищення GMT для усіх трьох штамів у трьох групах. Проте була тенденція до більш високих значень GMT нейтралізуючого антитіла для усіх трьох вакцинних штамів у групах FluAS03 та Fluarix, ніж у FluWW, хоча існувало деяке перекривання 95% СІ між Fluarix групою та FluWW групою. • Для індексів сероконверсії загальні індекси відповіді для трьох штамів були суттєво рівними у трьох групах. У всіх групах результати були послідовними з тими, що були одержані з аналізу, проведеного для антигемаглютинінових антитіл. III. 5.1.3 Титри антитіл до нейрамінідази (NA) Для того, щоб краще охарактеризувати імунну відповідь на вакцинацію вірусом грипу, у популяції людей похилого віку оцінювали відповіді щодо сироваткового антитіла до нейрамінідазних антигенів. Подібно до титрів НІ антитіла, визначали наступні критичні точки: • GMT (беручи анти-log значення log титру трансформацій) • Індекс сероконверсії, визначений як частина вакцинованих з принаймні чотирикратним підвищенням титрів НІ антитіл на день 21 у порівнянні з днем 0, для кожного вакцинного штаму. GMT та індекси сероконверсії NA антитіл з 95% СІ показані у Таблиці 11 (GMT анти-NA антитіла) та Таблиці 12 (індекси сероконверсії NA після вакцинації (день 21) (чотирьохкратне підвищення)). 91701 56 FluAS03: Flu вакцина (DFLU58A16), змішана з AS03 ад'ювантом (D621024A8) Fluarix: Flu вакцина (18854В9) FluWW: Flu WW вакцина (DFLU59A2) PRE = до вакцинації, РІ(д21) = день 21 після вакцинації 95% СІ, НГ та ВГ = 95% довірчий інтервал, нижня та верхня границі FluAS03: Flu вакцина (DFLU58A16), змішана з АS03 ад‟ювантом (D621024A8), Fluarix: Flu вакцина (18854В9), FluWW: Flu WW вакцина (DFLU59A2) Ν = кількість осіб з прийнятними результатами як до вакцинації, так і після вакцинації, n = кількість респондерів. % = частина респондерів (n/Ν x 100). 95% СІ = відповідний 95% довірчий інтервал; НГ = нижня границя, ВГ = верхня границя Основні відкриття були наступними: • Більш високе значення GMT та індексів сероконверсії спостерігали для гемаглютиніну, ніж для нейрамінідази. GMT антитіл до вакцинації для усіх вакцинних штамів були в межах одного й того самого інтервалу в трьох групах. Після вакцинації рівень антинейрамінідазного антитіла підвищувався в значній мірі. Як і для титрів НІ антитіл, існувала тенденція до більш високих значень після вакцинації для усіх трьох вакцинних штамів у групах FluAS03 та Fluarix, хоча існувало деяке перекривання 95% СІ між Fluarix групою та FluWW групою. • Незважаючи на індекси сероконверсії, значення загальної відповіді для усіх трьох штамів були суттєво рівними у трьох групах та для трьох штамів. 57 Наші результати показують, що здорові люди похилого віку, вакциновані у даному дослідженні проти грипу, розвивали високий рівень антитілогенезу у відповідь на антигени нейрамінідази до будь-якого штаму вакцини. Проте відповідь на нейрамінідазний антиген є нижчою, ніж відповідь на антиген гемаглютиніну. III.5.2. Клітинна імунна відповідь Антиген-специфічні CD4 та CD8 Т-клітини периферичної крові можуть бути повторно стимульовані in vitro для продукції IL-2, CD40L, TNF-альфа та IFN шляхом інкубації їх з відповідним антигеном. Згідно з цим антиген-специфічні CD4 та CD8 Т-клітини можуть підраховуватися шляхом проточної цитометрії після традиційного імунофлуоресцентного мічення клітинного фенотипу, а також за допомогою продукції внутрішньоклітинних цитокінів. У попередньому дослідженні вакцинний антиген грипу, а також пептиди, які мають походження від специфічного білка вірусу грипу, використовували як антиген для повторної стимуляції специфічних для грипу Т-клітин. Результати представлені для CD4 та CD8 Т-клітинної відповідь у Таблицях від13 до 18. Таблиця 13 Антиген-специфічні CD4 Т-клітинні відповіді, виражені у клітинах, що продукують принаймні два різні цитокіни: описова статистика на особах до вакцинації та після вакцинації для CD40L/IL2/TNF- /IFN- (загальна група вакцинованих) 91701 58 Група 1: FluAS03: Flu вакцина Fluarix™, змішана з ад'ювантом AS03 Група 2: Fluarix: в проти грипу Fluarix™ Група 3: FluWW: Flu WW вакцина SD = стандартне відхилення; Мін., Макс. = Мінімум, максимум Q1 = перший квартиль; Q3 = третій квартиль N= число осіб з прийнятними результатами Р-значення: аналіз Крускала-Уоліса (непараметрична процедура) для порівняння відмінностей (Аналіз критерію суми рангів Уілкоксона) між трьома групами на день 21. Таблиця 14 Антиген-специфічні CD4 Т-клітинні відповіді, виражені у клітинах, які виробляють принаймні два різні цитокіни: описова статистика на відмінність між результатами до вакцинації (PRE) та після вакцинації (POST) (уся група вакцинованих) 59 91701 60
ДивитисяДодаткова інформація
Назва патенту англійськоюMonovalent influenza vaccine composition comprising a influenza virus antigen and an oil-in-water emulsion adjuvant
Автори англійськоюHanon Emmanuel Jules, Stephenne Jean
Назва патенту російськоюМультивалентная иммуногенная композиция против гриппа, которая включает антиген вируса гриппа и адъювант на основе эмульсии масла-в-воде
Автори російськоюАнон Эммануэль Жюль, Стефенн Жан
МПК / Мітки
МПК: A61K 39/145, A61K 39/39
Мітки: мультивалентна, ад"ювант, імуногенна, композиція, антиген, яка, основі, грипу, включає, масло-у-воді, вірусу, емульсії
Код посилання
<a href="https://ua.patents.su/60-91701-multivalentna-imunogenna-kompoziciya-proti-gripu-yaka-vklyuchaeh-antigen-virusu-gripu-ta-adyuvant-na-osnovi-emulsi-maslo-u-vodi.html" target="_blank" rel="follow" title="База патентів України">Мультивалентна імуногенна композиція проти грипу, яка включає антиген вірусу грипу та ад’ювант на основі емульсії масло-у-воді</a>
Попередній патент: Застосування вірусу грипу та ад’юванту на основі емульсії масло-у-воді для індукції сd4 т-клітин та/або поліпшеної відповіді в-клітин пам’яті
Наступний патент: Система зв’язку з функцією нагляду, призначена для абонентів з обмеженням свободи здійснення викликів
Випадковий патент: Лазерний висок