Спосіб одержання сполуки n-[транс-4-[4-(циклопропілметил)-1-піперазиніл]циклогексил]-4-[[(7r)-7-етил-5,6,7,8-тетрагідро-5-метил-8-(1-метилетил)-6-оксо-2-птеридиніл]аміно]-3-метоксибензаміду
Номер патенту: 101060
Опубліковано: 25.02.2013
Автори: Лінц Гюнтер, Шмід Рольф, Грауерт Маттіас, Зігер Петер
Формула / Реферат
Спосіб одержання сполуки N-[транс-4-[4-(циклопропілметил)-1-піперазиніл]циклогексил]-4-[[(7R)-7-етил-5,6,7,8-тетрагідро-5-метил-8-(1-метилетил)-6-оксо-2-птеридиніл]аміно]-3-метоксибензаміду формули (І)
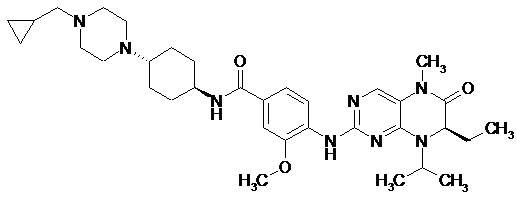 , (І)
, (І)
який характеризується тим, що сполуку формули 15с
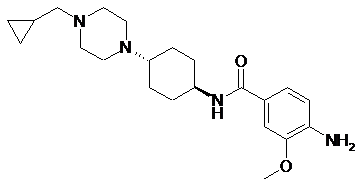 15с
15с
вводять у реакцію зі сполукою формули 16,
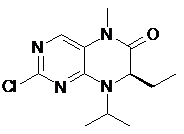 , 16
, 16
у якому сполуку формули 16 одержують метилуванням сполуки формули 8
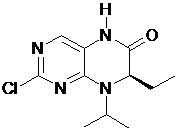 8
8
у присутності диметилкарбонату.
Текст
Реферат: У заявці описаний спосіб одержання N-[транс-4-[4-(циклопропілметил)-1-піперазиніл] циклогексил]-4-[[(7R)-7-етил-5,6,7,8-тетрагідро-5-метил-8-(1-метилетил)-6-оксо-2птеридиніл]аміно]-3-метоксибензаміду. N N O CH3 N H N N H3C O N H N H3C O CH3 N CH3 UA 101060 C2 (12) UA 101060 C2 UA 101060 C2 5 10 15 20 25 30 35 40 45 50 55 Даний винахід стосується специфічної солі похідної дигідроптеридіону, а саме тригідрохлориду сполуки N-[транс-4-[4-(циклопропілметил)-1-піперазиніл]циклогексил]-4-[[(7R)7-етил-5,6,7,8-тетрагідро-5-метил-8-(1-метилетил)-6-оксо-2-птеридиніл]аміно]-3метоксибензаміду, її безводної форми, її кристалізації у формі гідрату, способу її одержання та її застосування у фармацевтичній композиції. Рівень техніки У попередньому рівні техніки вже відомий цілий ряд похідних дигідроптеридіону. Так, наприклад, у заявках на міжнародні патенти WO 03/020722 і WO 2004/076454 описані похідні дигідроптеридіону, спосіб їх одержання і їх застосування у фармацевтичній композиції для лікування захворювань, які пов'язані з активністю специфічних кіназ клітинного циклу та які характеризуються надмірною або аномальною проліферацією клітин. Сполука N-[транс-4-[4-(циклопропілметил)-1-піперазиніліл]циклогексил]-4-[[(7R)-7-етил5,6,7,8-тетрагідро-5-метил-8-(1-метилетил)-6-оксо-2-птеридиніл]аміно]-3-метоксибензамід та спосіб її одержання зокрема розкриті в WO 2004/076454. Однак у зазначених вище заявках не описані будь-які конкретні солі й кристалічні форми будь-яких зазначених у них сполук. Хоча фармакологічно цінні характеристики похідних дигідроптеридинону, розкриті в даній галузі техніки й зазначені вище, є основною передумовою для ефективного застосування сполук як фармацевтичні композиції, у кожному разі активна речовина повинна задовольняти додатковим вимогам, щоб її можна було застосовувати як лікарський засіб. Відповідні параметри в значній мірі пов'язані з фізико-хімічною природою активної речовини. Тому зберігається необхідність у нових солях і кристалічних формах активних речовин, які можна було б ефективно застосовувати для введення пацієнтам і які є чистими й висококристалічними, так щоб вони повністю відповідали діючим фармацевтичним вимогам і специфікаціям. Бажано, щоб такі сполуки можна було легко одержати й щоб вони мали задовільні об'ємні характеристики. Прикладами об'ємних характеристик, які повинні бути задовільними, є час сушіння, здатність до фільтрування, розчинність, характеристична швидкість розчинення, стабільність в цілому й особливо термічна стабільність і гігроскопічність. Також краще, щоб у фармацевтичній композиції, яка використовується, не було продуктів розкладання, оскільки, якщо у фармацевтичній композиції містяться продукти розкладання, то вміст активної речовини у фармацевтичному препараті може бути меншим зазначеного. Іншим критично важливим регульованим параметром є гігроскопічність, оскільки поглинання вологи зменшує вміст фармацевтично активної речовини внаслідок збільшення маси, обумовленого поглинанням води. Фармацевтичні композиції, схильні поглинати вологу, при зберіганні необхідно захищати від вологи, наприклад, шляхом додавання придатних осушувальних агентів або шляхом зберігання лікарського засобу в середовищі, у якому воно захищено від вологи. Крім того, поглинання вологи може зменшити вміст фармацевтично активної речовини під час приготування, якщо на незахищену будь-яким чином від впливу вологи фармацевтичну речовину впливає навколишнє середовище. Тому краще, щоб гігроскопічність фармацевтично активної речовини була ретельно досліджена й по можливості також стабілізована. Оскільки для забезпечення відтворюваного вмісту активної речовини в препараті важлива кристалічна модифікація, необхідно по можливості досліджувати всі існуючі поліморфні форми активної речовини, які містяться в кристалічній формі. Якщо існують різні поліморфні модифікації активної речовини, то необхідно дотримуватися обережності й переконатися в тому, що кристалічна модифікація речовини залишається незміненою в приготовленому з нього фармацевтичному препараті. У противному випадку зміна може несприятливо вплинути на відтворюваність активності лікарського засобу. Із цього погляду кращі активні речовини, які характеризуються лише незначним поліморфізмом. Також бажаний зменшений вміст органічних розчинників у кристалічній решітці, почасти внаслідок можливої токсичності розчинника для реципієнта. Іншим критерієм, який може бути надзвичайно важливим при деяких обставинах залежно від вибору препарату або технології виготовлення, є розчинність активної речовини. Наприклад, якщо приготовляють фармацевтичні розчини (наприклад, для вливання), то важливо, щоб активна речовина була в достатньому ступені розчинна у фізіологічно прийнятних розчинниках. Для лікарських засобів, які вводять перорально, звичайно досить важливо, щоб активна речовина була в достатньому ступені розчинною і біологічно доступною. Крім того, спосіб одержання такої сполуки також повинен бути зручним для застосування в промисловому масштабі. 1 UA 101060 C2 5 10 15 Тому прикладами параметрів, які необхідно регулювати, є, але не обмежуються тільки ними, стабільність вихідної речовини при різних умовах навколишнього середовища, стабільність під час приготування фармацевтичного препарату й стабільність у готових композиціях лікарського засобу. Тому фармацевтично активна речовина, яка застосовується для приготування фармацевтичних композицій, повинна мати високу стабільність, що зберігається при всіх умовах впливу навколишнього середовища. Таким чином, в основу даного винаходу була поставлена задача одержання фармацевтично активної речовини, яка не тільки характеризується високою фармакологічною активністю, але й, наскільки це можливо, задовольняє зазначеним вище фізико-хімічним критеріям. Стислий виклад суті винаходу Відповідно до винаходу несподівано було встановлено, що зазначена вище задача вирішується за допомогою тригідрохлориду й кристалічної форми гідрату тригідрохлориду сполуки N-[транс-4-[4-(циклопропілметил)-1-піперазиніл]циклогексил]-4-[[(7R)-7-етил-5,6,7,8тетрагідро-5-метил-8-(1-метилетил)-6-оксо-2-птеридиніл]аміно]-3-метоксибензаміду, структура якої представлена нижче у формі вільної основи формули (І). N N O CH3 N H O 25 30 35 40 45 50 55 N H O CH3 N N HC HC CH (І) Тригiдрохлорид і кристалічна форма гідрату тригідрохлориду сполуки N-[транс-4-[4(циклопропілметил)-1-піперазиніл]циклогексил]-4-[[(7R)-7-етил-5,6,7,8-тетрагідро-5-метил-8-(1метилетил)-6-оксо-2-птеридиніл]аміно]-3-метоксибензаміду забезпечують численні переваги в порівнянні з вільною основою та безводною формою цієї сполуки. У порівнянні з безводною формою кристалічна форма гідрату тригідрохлориду характеризується, наприклад, перевагою стабільності за умов навколишнього середовища. Крім того, у порівнянні з вільною основою тригідрохлорид характеризується перевагою розчинності у воді, у якій тригідрохлорид розчинний набагато краще, ніж вільна основа. Нарешті, у порівнянні з іншими звичайними солями тригідрохлорид також характеризується перевагами з погляду виходу, чистоти й відтворюваності синтезу. Таким чином, першим об'єктом даного винаходу є тригідрохлорид сполуки N-[транс-4-[4(циклопропілметил)-1-піперазиніл]циклогексил]-4-[[(7R)-7-етил-5,6,7,8-тетрагідро-5-метил-8-(1метилетил)-6-оксо-2-птеридиніл]аміно]-3-метоксибензаміду. Іншим об'єктом даного винаходу є безводна форма тригідрохлориду сполуки N-[транс-4-[4(циклопропілметил)-1-пшеразиніл]циклогексил]-4-[[(7R)-7-етил-5,6,7,8-тетрагідро-5-метил-8-(1метилетил)-6-оксо-2-птеридиніл]аміно]-3-метоксибензаміду. Іншим об'єктом даного винаходу є кристалічні форми гідрату тригідрохлориду сполуки N[транс-4-[4-(циклопропілметил)-1-піперазиніл]циклогексил]-4-[[(7R)-7-етил-5,6,7,8-тетрагідро-5метил-8-(1-метилетил)-6-оксо-2-птеридиніл]аміно]-3-метоксибензаміду. Іншим об'єктом даного винаходу є кристалічна форма тригідрату тригідрохлориду сполуки N-[транс-4-[4-(циклопропілметил)-1-піперазиніл]циклогексил]-4-[[(7R)-7-етил-5,6,7,8-тетрагідро5-метил-8-(1-метилетил)-6-оксо-2-птеридиніл]аміно]-3-метоксибензаміду. Іншим об'єктом даного винаходу є поліпшений спосіб одержання сполуки N-[транс-4-[4(циклопропілметил)-1-піперазиніл]циклогексил]-4-[[(7R)-7-етил-5,6,7,8-тетрагідро-5-метил-8-(1метилетил)-6-оксо-2-птеридиніл]аміно]-3-метоксибензаміду. Іншим об'єктом даного винаходу є спосіб одержання тригідрохлориду сполуки N-[транс-4-[4(циклопропілметил)-1-піперазиніл]циклогексил]-4-[[(7R)-7-етил-5,6,7,8-тетрагідро-5-метил-8-(1метилетил)-6-оксо-2-птеридиніл]аміно]-3-метоксибензаміду. Іншим об'єктом даного винаходу є фармацевтична композиція, яка включає тригідрохлорид, кристалічну форму гідрату тригідрохлориду або кристалічну форму тригідрату тригідрохлориду сполуки N-[транс-4-[4-(циклопропілметил)-1-піперазиніл]циклогексил]-4-[[(7R)-7-етил-5,6,7,8тетрагідро-5-метил-8-(1-метилетил)-6-оксо-2-птеридиніл]аміно]-3-метоксибензаміду разом з одним або більшою кількістю фармацевтично прийнятних носіїв, розріджувачів або інертних наповнювачів. Іншим об'єктом даного винаходу є застосування тригідрохлориду, кристалічної форми гідрату тригідрохлориду або кристалічної форми тригідрату тригідрохлориду сполуки N-[транс-4[4-(циклопропілметил)-1-піперазиніл]циклогексил]-4-[[(7R)-7-етил-5,6,7,8-тетрагідро-5-метил-8(1-метилетил)-6-оксо-2-птеридиніл]аміно]-3-метоксибензаміду в способі лікування захворювань, 3 20 N N 3 3 2 UA 101060 C2 5 10 15 20 25 30 35 які характеризуються надмірною або аномальною проліферацією клітин, або для приготування фармацевтичної композиції, яка застосовна для лікування захворювань, що характеризуються надмірною або аномальною проліферацією клітин. Стислий опис креслень На фіг. 1 наведена порошкова рентгенограма кристалічного тригідрохлориду сполуки N[транс-4-[4-(циклопропілметил)-1-піперазиніл]циклогексил]-4-[[(7R)-7-етил-5,6,7,8-тетрагідро-5метил-8-(1-метилетил)-6-оксо-2-птеридиніл]аміно]-3-метоксибензаміду, одержана за допомогою сучасного дифрактометра Bruker D8, оснащеного позиційним детектором (OED) і анодом з Сu як джерело рентгенівського випромінювання (випромінювання CuK., = 1,54056 А, 40 кВ, 40 мА). На фіг. 2 наведена одержана за допомогою оптичного мікроскопа фотографія кристалів тригідрохлориду сполуки N-[транс-4-[4-(циклопропілметил)-1-піперазиніл]циклогексил]-4-[[(7R)7-етил-5,6,7,8-тетрагідро-5-метил-8-(1-метилетил)-6-оксо-2-птеридиніл]аміно]-3метоксибензаміду. На фіг. 3 наведені результати термічного аналізу й визначення температури плавлення (ДСК/ТГ) тригідрохлориду сполуки N-[транс-4-[4-(циклопропілметил)-1-піперазиніл]циклогексил]4-[[(7R)-7-етил-5,6,7,8-тетрагідро-5-метил-8-(1-метилетил)-6-оксо-2-птеридиніл]аміно]-3метоксибензаміду, одержані за допомогою ДСК із оцінкою на початку піка (швидкість нагрівання: 10 °C/хв). Наведені значення одержані за допомогою приладу DSC 821е, що випускається фірмою Mettler Toledo. Докладний опис винаходу Як вже відзначено вище в даному винаході, сполука N-[транс-4-[4-(циклопропілметил)-1піперазиніл]циклогексил]-4-[[(7R)-7-етил-5,6,7,8-тетрагідро-5-метил-8-(1-метилетил)-6-оксо-2птеридиніл]амiно]-3-метоксибензамід і спосіб її одержання, зокрема, розкриті в WO 2004/076454. Для ознайомлення з докладним описом способу одержання цієї сполуки дається посилання на зазначену заявку. Альтернативний спосіб одержання цієї сполуки описаний нижче. Використані абревіатури ТШХ - тонкошарова хроматографія ДСК - диференціальна сканувальна калориметрія ТГ - термогравіметрія. Вихідні речовини, транс-4-аміноциклогексанол 10, 3-метокси-4-нітробензойна кислота 2, N(циклопропілметил)піперазин 12с і 4-ацетамідоциклогексанон 18 є відомими сполуками, які є у продажу. Цей спосіб є збіжним і включає наступні стадії: (і) синтез сполуки формули 15с N N O N H NH2 O , 15с (іі) синтез сполуки формули 16 N N Cl 40 N O N 16 та (ііі) реакцію сполуки формули 15с зі сполукою формули 16. Нижче описані синтез сполуки формули 15с і синтез сполуки формули 16. (і) Синтез сполуки формули 15с 3 UA 101060 C2 O HO HO HO O O + N H + N NH2 O + O 10 5 10 2 O N O O 11 260 г (1,32 моль) 3-метокси-4-нітробензойної кислоти 2 поміщають в 1,5 л толуолу. 300 мл толуолу відганяють. До залишку додають 5 мл диметилформаміду й до них по краплях додають 123 мл (1,7 моль) тіонілхлориду. Реакційний розчин кип'ятять зі зворотним холодильником протягом 2 год. Розчинник концентрують шляхом випарювання при зниженому тиску в роторному випарнику. Залишок розчиняють в 500 мл тетрагідрофурану й по краплях додають до суспензії 202 г (1,33 моль) транс-4-аміноциклогексанолу 10 в 1,5 л тетрагідрофурану й 1,38 л 30 % розчину карбонату калію, так щоб температура підтримувалася такою, що дорівнює від 5 до 13 °C. Суміш перемішують протягом 1 год. при 20 °C і додають 5 л демінералізованої води. Осад відфільтровують з відсмоктуванням і промивають демінералізованою водою. Тверду речовину сушать при 70 °C у сушильній шафі із циркуляцією повітря. Одержують 380 г (98 % від теоретичного виходу) продукту 11. ТШХ (метиленхлорид/етанол = 9:1) Rf = 0,47 HO O O N H O N H O + O O + N N O O 11 O 13 15 20 1 г тонкоподрібненого порошкоподібного гідрату хлориду рутенiю(ІІІ) додають до 185 г (0,63 моль) N і 234 г N-метилморфолін-N-оксиду в 1,8 л ацетонітрилу й суміш кип'ятять зі зворотним холодильником протягом 1 год. При зниженому тиску випарюють 1,6 л ацетонітрилу. До залишку додають 1,5 л демінералізованої води й суспензію охолоджують до 5 °C. Осад відфільтровують з відсмоктуванням і промивають великою кількістю демінералізованої води. Тверду речовину сушать при 70 °C у сушильній шафі із циркуляцією повітря. Одержують 168 г (91 % від теоретичного виходу) продукту 13. ТШХ (метиленхлорид/етанол = 9:1) Rf = 0,64 N O N N + N O N H H + 13 O + N O 12c O N H O N O O O 14c 25 30 112 г (383 ммоль) продукту 13, 108 г (770 ммоль) N-(циклопропілметил)піперазину 12с і 4,5 мл метансульфонової кислоти в толуолі кип'ятять зі зворотним холодильником протягом 3 год. із використанням пристрою для відділення води (відокремлюють приблизно 76 мл води). При зниженому тиску випарюють 900 мл толуолу й залишок суспендують в 1,2 л етанолу. До цієї суспензії при температурі, що дорівнює від 15 до 25 °C, протягом 1 год. порціями додають 15 г борогідриду натрію. Суміш перемішують протягом 3 год. при 20 °C і додають ще 4 г борогідриду натрію. Суміш перемішують протягом 16 год. при 20 °C. При зниженому тиску випарюють 650 мл етанолу. Додають 2 л демінералізованої води й 300 мл циклогексану. Суміш охолоджують до 5 °C і суспензію фільтрують із відсмоктуванням. Залишок розчиняють в 1 н. хлористоводневій 4 UA 101060 C2 5 кислоті. Додають 5 г активованого деревного вугілля й суміш фільтрують із відсмоктуванням. До фільтрату додають 400 мл трет-бутилметилового ефіру і його підлуговують розчином аміаку. Його охолоджують до 4 °C, осад відфільтровують з відсмоктуванням і промивають демінералізованою водою. Залишок кип'ятять зі зворотним холодильником в 400 мл третбутилметилового ефіру. Його охолоджують, тверду речовину фільтрують із відсмоктуванням і промивають трет-бутилметиловим ефіром. Після сушіння в сушильній шафі із циркуляцією повітря при 60 °C одержують 73 г (46 % від теоретичного виходу) продукту 14с. ТШХ (метиленхлорид/етанол = 9:1) Rf = 0,2. Сполуку 14с альтернативно також можна одержати за наступною методикою. 10 O N NH N O + N O N H N H 12c 15 20 25 18 19 22 г (142 ммоль) 4-ацетамідоциклогексанону 18, 39,7 г (283 ммоль) Nциклопропілметилпіперазину 12с і 0,71 мл метансульфонової кислоти в 175 мл толуолу кип'ятять зі зворотним холодильником з використанням пристрою для відділення води, поки не припиняється осадження води. Суміші дають охолонути й при 50 °C додають 175 мл етанолу й одержану суміш охолоджують до 20 °C. При енергійному перемішуванні порціями додають 5,37 г (142 ммоль) борогідриду натрію й суміш перемішують протягом 16 год. при 20 °C. До реакційної суміші по краплях додають 200 мл 4 н. хлористоводневої кислоти. При зниженому тиску випарюють 200 мл розчинника. До залишку додають 100 мл насиченого розчину карбонату калію й 200 мл метилізобутилкетону. Двофазову суміш охолоджують до 5 °C при енергійному перемішуванні. Продукт фільтрують із відсмоктуванням і розчиняють при температурі кипіння в 90 мл метилізобутилкетону. Після додавання активованого вугілля суміш фільтрують у гарячому стані. Суміші дають охолонути й осад видаляють шляхом фільтрування з відсмоктуванням. Після сушіння одержують 16,2 г (41 % від теоретичного виходу) трансізомеру сполуки 12-ТШХ (метиленхлорид/етанол/аміак = 9:1:0,1) Rf = 0,39 N x 3 HCl N N N O N H NH2 19 30 20 Розчин 44 г (157 ммоль) продукту 19 в 500 мл 24 % хлористоводневої кислоти кип'ятять зі зворотним холодильником протягом 6 год. Розчинник концентрують шляхом випарювання при зниженому тиску й залишок кристалізують із 700 мл ізопропанолу. Осад відфільтровують з відсмоктуванням, промивають трет-бутилметиловим ефіром і сушать при 60 °C у вакуумній сушильній шафі. 54,7 г продукту 20 одержують у вигляді тригідрохлориду (містить 5 % води). N O x 3 HCl N N 35 2 O + NH2 20 N HO + N O O N H + O N O O O 14c 33 г (90,4 ммоль) 3-метокси-4-нітробензойної кислоти 2, суспендують в 80 мл толуолу. Додають 0,5 мл диметилформаміду й 16 г (134 ммоль) тіонілхлориду. Суміш кип'ятять зі зворотним холодильником протягом 1 год. Розчин концентрують шляхом випарювання при зниженому тиску й неочищений хлорангідрид кислоти розчиняють в 50 мл тетрагідрофурану. Розчин по краплях додають до суспензії 18,7 г (94,9 ммоль, 95 %) тригідрохлориду 20 і 49 г (397 5 UA 101060 C2 5 ммоль) діізопропілетиламіну в 150 мл тетрагідрофурану при охолодженні на бані з льодом. Для перевірки завершення реакції використовують ТШХ. Після завершення реакції до суспензії додають воду й значення рН доводять до 10 шляхом додавання розчину гідроксиду натрію. Органічну фазу відокремлюють і промивають насиченим розсолом. Об'єднані водні фази один раз екстрагують тетрагідрофураном. Об'єднані органічні фази концентрують шляхом випарювання при зниженому тиску. Залишок кип'ятять зі зворотним холодильником в 300 мл трет-бутилметилового ефіру. Суміші дають охолонути до 20 °C і осад відфільтровують з відсмоктуванням. Після сушіння у вакуумній сушильній шафі при 45 °C одержують 31,3 г (83 % від теоретичного виходу) продукту 14с. 10 N N N N O O N H + N H O NH2 N O 14c 15 20 25 O O 15c Розчин 72,5 г (174 ммоль) продукту 14с в 700 мл метанолу й 145 мл диметилформаміду гідрують у присутності 10 г нікелю Ренея при температурі, що дорівнює 20 °C, і при тиску водню, 2 що дорівнює 50 фунт-сила/дюйм . Каталізатор відфільтровують і метанол випарюють при зниженому тиску. До залишку додають 500 мл демінералізованої води й суспензію охолоджують до 5 °C. Осад відфільтровують з відсмоктуванням і промивають демінералізованою водою. Після сушіння в сушильній шафі із циркуляцією повітря при 60 °C одержують 60,5 г (90 % від теоретичного виходу) продукту 15c. ТШХ (метиленхлорид/етанол/аміак = 9:1:0,1) Rf = 0,58 (іі) Синтез сполуки формули 16 Синтез 2-хлор-7-етил-7,8-дигідро-5-метил-8-(1-метилетил)-(7R)-6(5H)-птеридинону 16 у цілому описаний в WO 2004/076454, на який дається посилання. Даний винахід стосується альтернативного шляху синтезу 2-хлор-7-етил-7,8-дигідро-5метил-8-(1-метилетил)-(7R)-6(5H)-птеридинону 16, який описаний нижче. Наступні вихідні речовини є відомими і є в продажу: (R)-2-аміномасляна кислота 21 і 2,4дихлор-5-нітропіримідин 5. H O H O O H N N O x HCl H 21 30 35 40 22 Суспензію 25 г (242 ммоль) (R)-2-аміномасляної кислоти 21 і 32 мл (290 ммоль) триметилортоформіату в 150 мл метанолу нагрівають до 50 °C. При цій температурі протягом 30 хв додають 26,5 мл (364 ммоль) тіонілхлориду. Під час виділення газу температура підвищується до 60 °C. Реакційну суміш кип'ятять зі зворотним холодильником протягом 3 год. Відганяють 125 мл метанолу й додають 100 мл толуолу. 75 мл Розчинника видаляють шляхом відгону. Суспензію 77 г (364 ммоль) триацетоксиборогідриду натрію в 175 мл толуолу додають до реакційної суміші при 60 °C. При 40 °C додають 22 мл ацетону. Реакційну суміш перемішують протягом 16 год. при кімнатній температурі. При охолодженні додають 73 мл аміаку (25 %). Після додавання 50 мл демінералізованої води суміш нагрівають до 50 °C. Органічну фазу відокремлюють і промивають демінералізованою водою. Додають 24 мл 10 М розчину хлориду водню в етанолі. 125 мл Розчинника видаляють шляхом відгону. Додають 175 мл тетрагідрофурану й суспензію охолоджують до 2 °C. Суспензію фільтрують із відсмоктуванням і промивають холодним тетрагідрофураном. Після сушіння у вакуумній сушильній шафі при 50 °C одержують 42,9 г (90 % від теоретичного виходу) продукту 22 у вигляді гідрохлориду. 6 UA 101060 C2 O O + N Cl N 10 15 + H Cl 5 5 O O NO2 COOCH3 N x HCl N Cl 22 N 23 9,3 мл 50 % водного розчину гідроксиду натрію при перемішуванні додають до суміші 33,3 г (170 ммоль) гідрохлориду 22 в 60 мл циклогексану й 60 мл демінералізованої води. Водну фазу відокремлюють і органічну фазу при кип'ятінні зі зворотним холодильником по краплях додають до суспензії 30 г (155 ммоль) 5 і 52 г (619 ммоль) гідрокарбонату натрію в 230 мл циклогексану. Суспензію кип'ятять зі зворотним холодильником протягом 5 год. із використанням пристрою для відділення води для видалення води, що утворилася. Відганяють 75 мл розчинника. При 75 °C суспензію фільтрують із відсмоктуванням для видалення солей. Розчинник відганяють. Залишок розчиняють в 240 мл 2-пропанолу й ще раз відганяють 90 мл розчинника. Розчин повільно охолоджують до 2 °C. Суспензію фільтрують із відсмоктуванням і промивають холодним 2-пропанолом. Після сушіння у вакуумній сушильній шафі при 50 °C одержують 38,9 г (79 % від теоретичного виходу) продукту 23. Ліпофільні розчинники, такі як, наприклад, циклогексан, метилциклогексан, толуол і їх суміші, є особливо придатними для забезпечення високої регіоселективності в реакції нуклеофільного заміщення зі сполукою 5. H NO2 COOCH3 N Cl Cl N 23 20 25 N N N O N 24 50 г 23 в 375 мл тетрагідрофурану гідрують у присутності 5 г платини на вугіллі (5 %) при тиску водню, що дорівнює 3 бар, і при 35 °C до припинення споживання водню. Додають 2,5 г ванаділацетилацетонату й гідрування продовжують. Суспензію фільтрують для видалення каталізаторів. Розчинник видаляють при зниженому тиску. До залишку додають 150 мл 2пропанолу й кип'ятять зі зворотним холодильником. Додають 300 мл демінералізованої води. Суспензію повільно охолоджують до 2 °C. Суспензію фільтрують із відсмоктуванням і промивають холодною сумішшю 2-пропанолу й демінералізованої води. Після сушіння у вакуумній сушильній шафі при 50 °C одержують 36 г (90 % від теоретичного виходу) продукту 24. H N N Cl 25 30 O N N Cl N N O N 16 Суспензію 7 г (27,5 ммоль) продукту 25 і 5,7 г (41 ммоль) карбонату калію в 30 мл диметилкарбонату нагрівають при 130 °C в автоклаві протягом 5 год. Суміші дають охолонути й при перемішуванні додають 25 мл демінералізованої води й 15 мл етилацетату. Органічну фазу відганяють при зниженому тиску. До залишку додають суміш 25 мл етанолу й 45 мл 7 UA 101060 C2 5 демінералізованої води й нагрівають до 60 °C. Розчину дають охолонути до кімнатної температури. Осад відфільтровують з відсмоктуванням і промивають сумішшю демінералізованої води й етанолу (2:1). Продукт сушать при 50 °C у вакуумній сушильній шафі. Одержують 6 г (82 % від теоретичного виходу) продукту 16. (ііі) Реакція сполуки формули 15с зі сполукою формули 16 N N N N O O + N H N N NH2 Cl N 10 15 20 N N N H3C O 15с CH3 N H O O N H N H3C O CH3 N CH3 (І) 16 Розчин 23 г (59,5 ммоль) сполуки 15с, 16,8 г (62,5 ммоль) 2-хлор-7-етил-7,8-дигідро-5-метил8-(1-метилетил)-(7R)-6(5H)-птеридинону 16 і 28,3 г (149 ммоль) гідрату пара-толуолсульфонової кислоти в 350 мл 2-метил-4-пентанолу кип'ятять зі зворотним холодильником протягом 22 год. із використанням пристрою для відділення води. Після додавання 1 г сполуки 16 суміш кип'ятять зі зворотним холодильником протягом ще 2 год. Відганяють 300 мл розчинника й в'язкому маслу дають охолонути до 60 °C. Додають 300 мл метиленхлориду й 300 мл демінералізованої води й значення рН підвищують до 9 шляхом додавання приблизно 20 мл 10 н. розчину гідроксиду натрію. Органічну фазу двічі промивають демінералізованою водою й сушать над сульфатом натрію. Розчинник випарюють при зниженому тиску й залишок розчиняють при 65 °C в 200 мл етилацетату. Суміші дають повільно охолонути до 20 °C, осад відфільтровують з відсмоктуванням і промивають холодним етилацетатом. Після сушіння при 60 °C у вакуумній сушильній шафі одержують 24,4 г (66 % від теоретичного виходу) продукту (І) (температура плавлення=182 °C, ДСК: 10 К/хв, додаткові ендотермічні ефекти на діаграмі ДСК до плавлення). Таким чином, об'єктом даного винаходу є спосіб одержання сполуки N-[транс-4-[4(циклопропілметил)-1-піперазиніл]циклогексил]-4-[[(7R)-7-етил-5,6,7,8-тетрагідро-5-метил-8-(1метилетил)-6-оксо-2-птеридиніл]аміно]-3-метоксибензаміду формули (І) N N O CH3 N H N N H3C N H O N H3C O CH3 N CH3 , (І) 25 який характеризується тим, що сполуку формули 15с N N O N H NH2 O , 15с вводять у реакцію зі сполукою формули 16, N N Cl 30 N O N , 16 у якому сполуку формули 16 одержують метилуванням сполуки формули 8 8 UA 101060 C2 H N N Cl 5 10 15 20 25 30 35 40 45 50 55 N O N , 8 у присутності диметилкарбонату. Даний винахід також стосується способу одержання тригідрохлориду сполуки N-[транс-4-[4(циклопропілметил)4-піперазиніл]циклогексил]-4-[[(7R)-7-етил-5,6,7,8-тетрагідро-5-метил-8-(1мeтилетил)-6-оксо-2-птеридиніл]аміно]-3-метоксибензаміду формули (І), зазначений спосіб включає стадії здійснюваної при підвищеній температурі або при кімнатній температурі взаємодії N-[транс-4-[4-(циклопропілметил)-1-піперазиніл]циклогексил]-4-[[(7R)-7-етил-5,6,7,8тетрагідро-5-метил-8-(1-метилетил)-6-оксо-2-птеридиніл]аміно]-3-метоксибензаміду, розчиненого в придатному розчиннику або в суміші розчинників, із хлористоводневою кислотою або газоподібним хлоридом водню, розчиненим в органічному розчиннику, необов'язково в присутності пара-толуолсульфонової кислоти, і збирання осаду, що утворився. Придатними розчинниками для розчинення N-[транс-4-[4-(циклопропілметил)-1-піперазиніл]циклогексил]-4[[(7R)7-етил-5,6,7,8-тетрагідро-5-метил-8-(1-метилетил)-6-оксо-2-птеридиніл]аміно]-3метоксибензаміду при одержанні солі є спирти, такі як метанол, етанол, 1- або 2-пропанол, ізомери бутанолу, ізомери пентанолу, ізомери гексанолу, такі як 2-метил-4-пентанол, кетони, такі як ацетон, діалкілові ефіри, такі як тетрагідрофуран, ефіри оцтової кислоти, такі як етилацетат, органічні кислоти, такі як оцтова кислота, аміди, такі як N-метилпіролідинон, і нітрили, такі як ацетонітрил. Альтернативний спосіб одержання ілюструється наступним експериментом, у якому тригідрохлорид одержують шляхом додавання концентрованої хлористоводневої кислоти до реакційного середовища після завершення реакції нуклеофільного ароматичного заміщення сполуки 15с зі сполукою 16, що каталізується кислотою. Наведений нижче приклад ілюструє даний винахід і тому його не слід розглядати як такий, що обмежує обсяг винаходу. Суспензію 143 г (0,37 моль) 15с і 110 г (0,41 моль) 16 в 2 л 2-метил-4-пентанолу нагрівають до 60 °C. Додають 176 г (0,93 моль) моногідрату пара-толуолсульфонової кислоти й суміш кип'ятять зі зворотним холодильником протягом 24 год. із використанням пристрою для відділення води. Розчин охолоджують до 100 °C. Додають 183 г концентрованої хлористоводневої кислоти. При 60 °C додають 1,5 л ацетону. Суспензію перемішують протягом 16 год. при кімнатній температурі. Осад відфільтровують з відсмоктуванням і промивають ацетоном. Продукт сушать при 60 °C у вакуумній сушильній шафі. Одержують 267 г (92 % від теоретичного виходу) сполуки (І) у вигляді тригідрохлориду. Другим об'єктом даного винаходу є наступна стадія очищення тригідрохлориду шляхом кристалізації, на якій: сполуку (І) у вигляді тригідрохлориду суспендують у придатному органічному розчиннику, такому як етанол; реакційне середовище кип'ятять зі зворотним холодильником; додають воду; після охолодження осад збирають, промивають придатним розчинником, таким як етанол, і сушать. Наведений нижче приклад очищення шляхом кристалізації ілюструє даний винахід і тому його не слід розглядати, як такий, що обмежує обсяг винаходу. Приклад очищення тригідрохлориду сполуки формули (І) шляхом кристалізації. Суспензію 15,5 г сполуки (І) у вигляді тригідрохлориду в 160 мл сухого етанолу кип'ятять зі зворотним холодильником. Додають 5,5 мл демінералізованої води. Розчину дають повільно охолонути до 20 °C і перемішують протягом 16 год. при 20 °C. Осад відфільтровують з відсмоктуванням і промивають етанолом. Після сушіння при 50 °C у вакуумній сушильній шафі одержують 13,3 г (86 % від теоретичного виходу) сполуки (І) у вигляді тригідрохлориду. Іншим об'єктом даного винаходу є спосіб одержання гідратованої кристалічної форми тригідрохлориду сполуки N-[транс-4-[4-(циклопропілметил)-1-піперазиніл]циклогексил]-4-[[(7R)7-етил-5,6,7,8-тетрагідро-5-метил-8-(1-метилетил)-6-оксо-2-птеридиніл]аміно]-3метоксибензаміду формули (І), зазначений спосіб включає стадії: розчинення сполуки (І) у вигляді основи в придатному органічному розчиннику, такому як етанол, при кімнатній температурі або підвищеній температурі; додавання хлористоводневої кислоти до реакційного середовища; охолодження реакційного середовища; збирання осаду, промивання осаду, наприклад, етанолом, і сушіння. 9 UA 101060 C2 5 10 15 Наведений нижче приклад одержання гідратованої кристалічної форми тригідрохлориду сполуки N-[транс-4-[4-(циклопропілметил)-1-піперазиніл]циклогексил]-4-[[(7R)-7-етил-5,6,7,8тетрагідро-5-метил-8-(1-метилетил)-6-оксо-2-птеридиніл]аміно]-3-метоксибензаміду формули (І) ілюструє даний винахід і тому його не слід розглядати, як такий, що обмежує обсяг винаходу. Приклад одержання гідратованої кристалічної форми тригідрохлориду сполуки N-[транс-4-[4(циклопропілметил)-1-піперазиніл]циклогексил]-4-[[(7R)-7-етил-5,6,7,8-тетрагідро-5-метил-8-(1метилетил)-6-оксо-2-птеридиніл]аміно]-3-метоксибензаміду формули (І). 1,1 г концентрованої хлористоводневої кислоти додають до розчину 2 г вільної основи (І) в 30 мл етанолу. Після перемішування протягом 2 год. при 20 °C суспензію охолоджують до 2 °C. Осад відфільтровують з відсмоктуванням і промивають етанолом. Після сушіння у вакуумній сушильній шафі одержують 2,15 г (91 % від теоретичного виходу) продукту (І) у вигляді тригідрохлориду. Тригідрохлорид сполуки N-[транс-4-[4-(циклопропілметил)-1-піперазиніл]циклогексил]-4[[(7R)-7-етил-5,6,7,8-тетрагідро-5-метил-8-(1-метилетил)-6-оксо-2-птеридиніл]аміно]-3метоксибензаміду формули (І) описується наступною формулою. N N O CH3 N 3 H-Cl H N H3C C34H50N8O3 × 3 HCl 20 25 30 35 N N O H N H3C O CH3 N CH3 Молекулярна маса = 728,21 Даний винахід також стосується способу одержання безводної форми тригідрохлориду сполуки N-[транс-4-[4-(циклопропілметил)-1-піперазиніл]циклогексил]-4-[[(7R)-7-етил-5,6,7,8тетрагідро-5-метил-8-(1-метилетил)-6-оксо-2-птеридиніл]аміно]-3-метоксибензаміду формули (І), у якому тригідрохлорид сполуки N-[транс-4-[4-(циклопропілметил)-1-піперазиніл]циклогексил]-4[[(7R)-7-етил-5,6,7,8-тетрагідро-5-метил-8-(1-метилетил)-6-оксо-2-птеридиніл]аміно]-3метоксибензаміду формули (І) сушать при температурі вище 130 °C і витримують у сухій атмосфері. Наведені нижче характеристики розчинності й твердого стану гідратованої форми тригідрохлориду сполуки N-[транс-4-[4-(циклопропілметил)-1-піперазиніл]циклогексил]-4-[[(7R)7-етил-5,6,7,8-тетрагідро-5-метил-8-(1-метилетил)-6-оксо-2-птеридиніл]аміно]-3метоксибензаміду формули (І) стосуються даного винаходу. Характеристики розчинності гідратованої форми тригідрохлориду N-транс-4-[4(циклопропілметил)-1-піперазиніл]циклогексил]-4-[[(7R)-7-етил-5,6,7,8-тетрагідро-5-метил-8-(1метилетил)-6-оксо-2-птеридиніл]аміно]-3-метоксибензаміду. Розчинність у водних середовищах У таблиці I наведені дані з розчинності гідратованої форми тригідрохлориду сполуки N[транс-4-[4-(циклопропілметил)-1-піперазиніл]циклогексил]-4-[[(7R)-7-етил-5,6,7,8-тетрагідро-5метил-8-(1-метилетил)-6-оксо-2-птеридиніл]амiно]-3-метоксибензаміду формули (І) у різних водних середовищах. Таблиця І Середовище вода 0,1 н. НСl 0,01 н. НСl 0,1 моль/л лимонна кислота 0,1 моль/л винна кислота 0,01 моль/л метансульфонова кислота Буфер Мак-Ільвена рН 2,2 Буфер Мак-Ільвена рН 3,0 Буфер Мак-Ільвена рН 4,0 Буфер Мак-Ільвена рН 5,0 Розчинність [мг/мл] >10 >10 >10 >10 >10 >10 >10 6,2 7,2 7,2 10 рН насиченого розчину 3,7 11,3 HB HB HB HB 2,3 3,0 3,9 4,7 UA 101060 C2 Буфер Мак-Ільвена рН 6,0 Середовище Буфер Мак-Ільвена рН 7,4 0,1 моль/л меглумін 0,01 н. NaOH 5 10 15 20 25 30 7,1 Розчинність [мг/мл] 7,8 0,017 >10 5,7 рН насиченого розчину 7,1 рН8,9 рН7,4 НВ = не визначено. З наведених вище результатів можна побачити, що ця гідратована форма тригідрохлориду сполуки N-[транс-4-[4-(циклопропілметил)-1-піперазиніл]циклогексил]-4-[[(7R)-7-етил-5,6,7,8тетрагідро-5-метил-8-(1-метилетил)-6-оксо-2-птеридиніл]аміно]-3-метоксибензаміду формули (І) має залежну від рН розчинність у водних середовищах, високу розчинність в кислих і нейтральних середовищах і сильно зменшену розчинність у лужному середовищі, обумовлену більш низькою розчинністю вільної основи. Розчинність в органічних середовищах Ця гідратована форма тригідрохлориду сполуки N-[транс-4-[4-(циклопропілметил)-1піперазиніл]циклогексил]-4-[[(7R)-7-етил-5,6,7,8-тетрагідро-5-метил-8-(1-метилетил)-6-оксо-2птеридиніл]аміно]-3-метоксибензаміду формули (І) добре розчинна (> 10 мг/мл) у пропіленгліколі, глікофурфуролі, Cremophor RH40 (30 % водний розчин), Poloxamer 188 (20 % водний розчин), Solutol HS 15 (20 % водний розчин), а також в НР-р-циклодекстрині (20, 10, 5 % водні розчини). Характеристики твердого стану гідратованої форми тригідрохлориду N-[транс-4-[4(циклопропілметил)-1-піперазиніл]циклогексил]-4-[[(7R)-7-етил-5,6,7,8-тетрагідро-5-метил-8-(1метилетил)-6-оксо-2-птеридиніл]аміно]-3-метоксибензаміду. Зовнішній вигляд У твердому стані ця гідратована форма тригідрохлориду сполуки N-[транс-4-[4(циклопропілметил)-1-піперазиніл]циклогексил]-4-[[(7R)-7-етил-5,6,7,8-тетрагідро-5-метил-8-(1метилетил)-6-оксо-2-птеридиніл]аміно]-3-метоксибензаміду формули (І) являє собою білий або майже білий мікрокристалічний порошок. Кристалічність і поліморфізм Ця гідратована форма тригідрохлориду сполуки N-[транс-4-[4-(циклопропілметил)-1піперазиніл]циклогексил]-4-[[(7R)-7-етил-5,6,7,8-тетрагідро-5-метил-8-(1-метилетил)-6-оксо-2птеридиніл]аміно]-3-метоксибензаміду формули (І) є висококристалічною. Порошкова рентгенограма наведена на фіг. 1. Відображення на порошковій рентгенограмі та інтенсивності (стандартизовані) наведені в представленій нижче таблиці II. Таблиця II dhki 20 [] [A] 4,13 7,88 8,25 8,66 9,81 11,45 12,38 13,12 13,50 14,53 15,26 15,40 15,51 16,52 16,71 17,35 18,04 18,19 18,65 21,38 11,21 10,71 10,21 9,01 7,73 7,14 6,74 6,55 6,09 5,80 5,75 5,71 5,36 5,30 5,11 4,91 4,87 4,75 Інтенсивність I/Io [%] 24 89 34 28 100 54 59 37 52 39 32 32 37 43 28 10 43 42 32 11 UA 101060 C2 19,10 20 [] 19,56 19,64 20,40 20,69 21,15 21,49 22,07 22,42 22,86 23,33 23,81 24,08 24,25 24,57 25,24 25,40 25,78 26,08 26,45 26,70 27,12 27,45 27,68 28,13 29,24 29,56 29,94 30,12 20 [] 30,39 31,04 31,29 31,64 32,16 32,69 32,92 5 10 15 4,64 dhki [Å] 4,53 4,52 4,35 4,29 4,20 4,13 4,02 3,96 3,89 3,81 3,73 3,69 3,67 3,62 3,53 3,50 3,45 3,41 3,37 3,34 3,29 3,25 3,22 3,17 3,05 3,02 2,98 2,96 dhki [Å] 2,94 2,88 2,86 2,83 2,78 2,74 2,72 19 Інтенсивність I/Io [%] 79 82 24 14 28 52 7 16 40 16 51 16 22 38 22 24 13 48 32 22 31 28 13 6 28 22 14 22 Інтенсивність I/Io [%] 9 32 15 6 8 8 21 У наведеній вище таблиці II значення "20 []" означає кут дифракції в градусах І значення "dhki [Å]" означає зазначені відстані в Å між площинами решітки. Відповідно до даних, наведених в таблиці II, даний винахід також стосується кристалічної форми тригідрату тригідрохлориду N-[транс-4-[4-(циклопропілметил)-1піперазиніл]циклогексил]-4-[[(7R)-7-етил-5,6,7,8-тетрагідро-5-метил-8-(1-метилетил)-6-оксо-2птеридиніл]аміно]-3-метоксибензаміду, яка характеризується тим, що на порошковій рентгенограмі, зокрема, спостерігаються характеристичні значення d = 3,73, 4,13, 4,52, 4,53, 6,55, 7,14, 7,73, 9,01 і 11,21 Å (найбільш інтенсивні піки рентгенограми). Ця речовина кристалізується у вигляді стрижнеподібних кристалів, наведених на фіг. 2. При стандартних умовах кристалічна форма тригідрохлориду N-[транс-4-[4(циклопропілметил)-1-піперазиніл]циклогексил]-4-[[(7R)-7-етил-5,6,7,8-тетрагідро-5-метил-8-(1метилетил)-6-оксо-2-птеридиніл]аміно]-3-метоксибензаміду, пропонована в даному винаході, міститься у вигляді гідрату й після сушіння її можна одержати у вигляді форм змінної сполуки (13 екв. води). Гідрат складу, близький до тригідрату, видимо, є гідратованою формою, стабільною за умов навколишнього середовища, i його можна одержати після кондиціювання висушеної речовини. Кристалічна вода міцно зв'язана. Зниження відносної вологості до 10 % не приводить до значної втрати маси. 12 UA 101060 C2 5 10 15 Таким чином, даний винахід також стосується кристалічного тригідрохлориду N-[транс-4-[4(циклопропілметил)-1-піперазиніл]циклогексил]-4-[[(7R)-7-етил-5,6,7,8-тетрагідро-5-метил-8-(1метилетил)-6-оксо-2-птеридиніл]аміно]-3-метоксибензаміду, який характеризується тим, що він є тригідратом. Термічний аналіз кристалічної форми тригідрохлориду N-[транс-4-[4-(циклопропілметил)-1піперазиніл]циклогексил]-4-[[(7R)-7-етил-5,6,7,8-тетрагідро-5-метил-8-(1-метилетил)-6-оксо-2птеридиніл]аміно]-3-метоксибензаміду, пропонованої в даному винаході, приводить до Tfus = -1 245±5 °C (ДСК: швидкість нагрівання 10 К. хв. ) з розкладанням і до широкої ендотермічної ділянки в діапазоні 60-140 °C, що відповідає виділенню води. Діаграма ДСК/ТГ наведена на фіг. 3. На діаграмі ТГ видна втрата маси, яка складає приблизно 7,5±0,5 мас. % у діапазоні від 60 до 140 °C. Цю втрату маси можна приписати виділенню оклюдованої кристалізаційної води. Кореляція втрати маси, що спостерігається, з молекулярною масою тригідрохлориду N[транс-4-[4-(циклопропілметил)-1-піперазиніл]циклогексил]-4-[[(7R)-7-етил-5,6,7,8-тетрагідро-5метил-8-(1-метилетил)-6-оксо-2-птеридиніл]аміно]-3-метоксибензаміду приводить до сполуки відповідної гідратованої форми, близької до тригідрату. C34H50N8O3 × 3 НСlх3 H20 М - 782,26 m = - 6,9 - 3 Н20 C34H50N8O3 × 3 HCl 20 25 30 35 40 45 50 % М 728,21 = Приблизно при 260 °C на діаграмі ДСК можна бачити інший ендотермічний пік, що свідчить про плавлення дегідратованої форми. Це плавлення починається приблизно при 245 °C. Однак плавлення відбувається з розкладанням, на що вказує втрата маси під час плавлення. За допомогою спільного дослідження за допомогою ТГ і ІК-спектроскопії можна показати, що при розкладанні виділяється хлористоводнева кислота. Відповідна безводна форма, одержувана шляхом нагрівання зразка до 140 °C, нестабільна. Таким чином, даний винахід також стосується кристалічного тригідрохлориду N-[транс-4-[4(циклопропілметил)-1-піперазиніл]циклогексил]-4-[[(7R)-7-етил-5,6,7,8-тетрагідро-5-метил-8-(1метилетил)-6-оксо-2-птеридиніл]аміно]-3-метоксибензаміду, що характеризується температурою плавлення Тm.р=24±5 °C (визначена за допомогою ДСК; оцінка по максимуму піка; швидкість нагрівання: 10 °C/хв). Стабільність у твердому стані При дослідженні стабільності кристалічної гідратованої форми тригідрохлориду N-[транс-4[4-(циклопропілметил)-1-піперазиніл]циклогексил]-4-[[(7R)-7-етил-5,6,7,8-тетрагідро-5-метил-8(1-метилетил)-6-оксо-2-птеридиніл]аміно]-3-метоксибензаміду в жорстких умовах (24 год. при 105 °C, 72 год. при 70 °C і > 90 % відносної вологості або 24 год. в апараті Xenotester (=300-800 -2 нм, 250 Вт. м )) результати показують, що гідрат тригідрохлориду Ы-[транс-4-[4(циклопропілметил)-1-піперазиніл]циклогексил]-4-[[(7R)-7-етил-5,6,7,8-тетрагідро-5-метил-8-(1метилетил)-6-оксо-2-птеридиніл]аміно]-3-метоксибензаміду є досить стабільним у твердому стані. У використаних жорстких умовах не спостерігається ні значного розкладання, ні домішок (
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess fro the preparation of n-[trans-4-[4-(cyclopropylmethyl)-1-piperazinyl]cyclohexyl]-4-[[(7r)-7-ethyl-5,6,7,8-tetrahydro-5-methyl-8-(1-methylethyl)-6-oxo-2-pteridinyl]amino]-3-methoxy-benzamide
Автори англійськоюGrauert Matthias, Lints Gyunter, Schmid Rolf, Sieger Peter
Назва патенту російськоюСпособ получения соединения n-[транс-4-[4-(циклопропилметил)-1-пиперазинил]циклогексил]-4-[[(7r)-7-этил-5,6,7,8-тетрагидро-5-метил-8-(1-метилетил)-6-оксо-2-птеридинил]амино]-3-метоксибензамида
Автори російськоюГрауэрт Маттиас, Линц Гюнтер, Шмид Рольф, Зигер Петер
МПК / Мітки
МПК: C07D 475/00, A61K 31/19
Мітки: одержання, сполуки, n-[транс-4-[4-(циклопропілметил)-1-піперазиніл]циклогексил]-4-[[(7r)-7-етил-5,6,7,8-тетрагідро-5-метил-8-(1-метилетил)-6-оксо-2-птеридиніл]аміно]-3-метоксибензаміду, спосіб
Код посилання
<a href="https://ua.patents.su/21-101060-sposib-oderzhannya-spoluki-n-trans-4-4-ciklopropilmetil-1-piperazinilciklogeksil-4-7r-7-etil-5678-tetragidro-5-metil-8-1-metiletil-6-okso-2-pteridinilamino-3-metoksibenzamidu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання сполуки n-[транс-4-[4-(циклопропілметил)-1-піперазиніл]циклогексил]-4-[[(7r)-7-етил-5,6,7,8-тетрагідро-5-метил-8-(1-метилетил)-6-оксо-2-птеридиніл]аміно]-3-метоксибензаміду</a>
Попередній патент: Автоматичний зубчастий варіатор
Наступний патент: Кріплення устя й спосіб його спорудження при будівництві й ліквідації вертикального стовбура
Випадковий патент: Пристрій для отримання тепла з димаря












