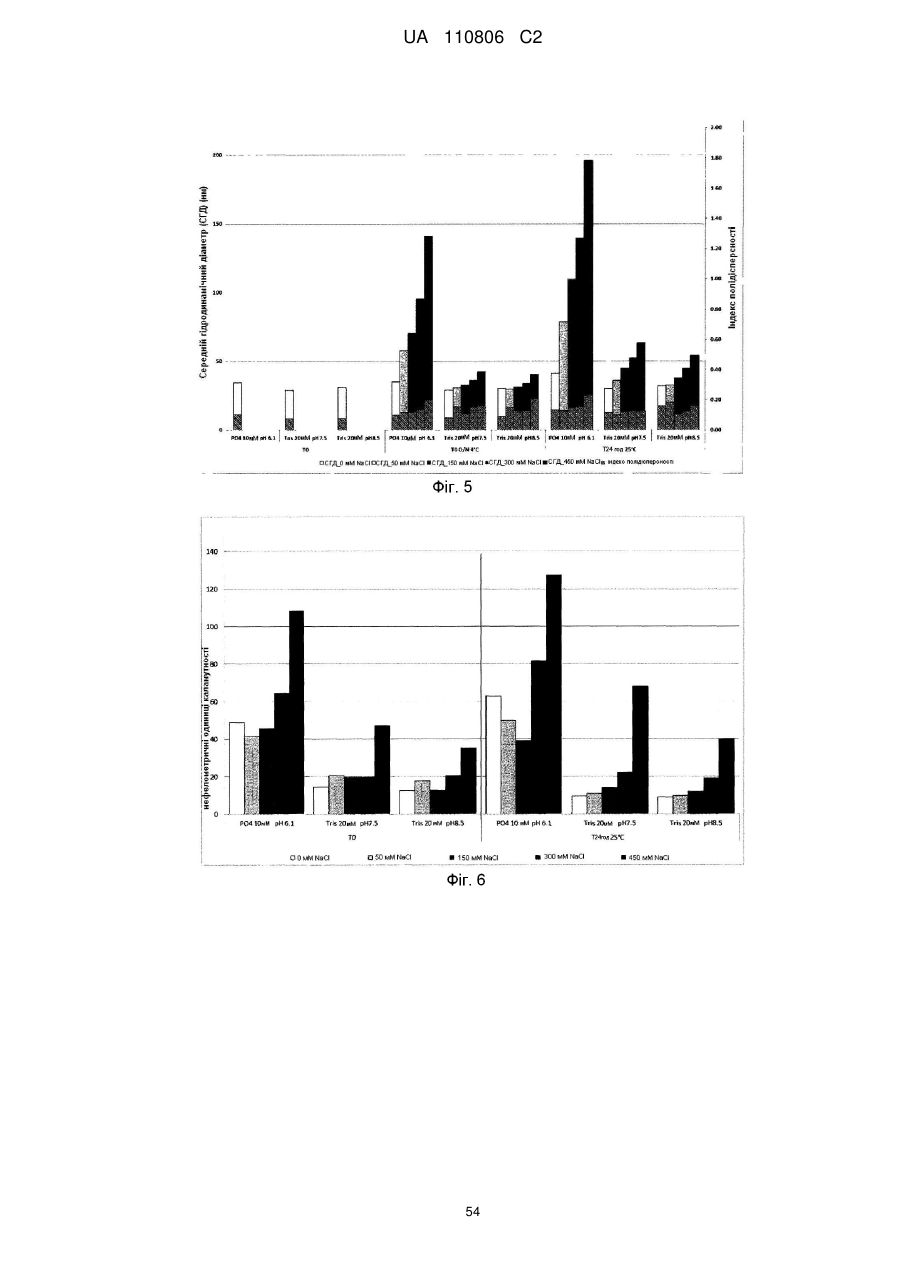
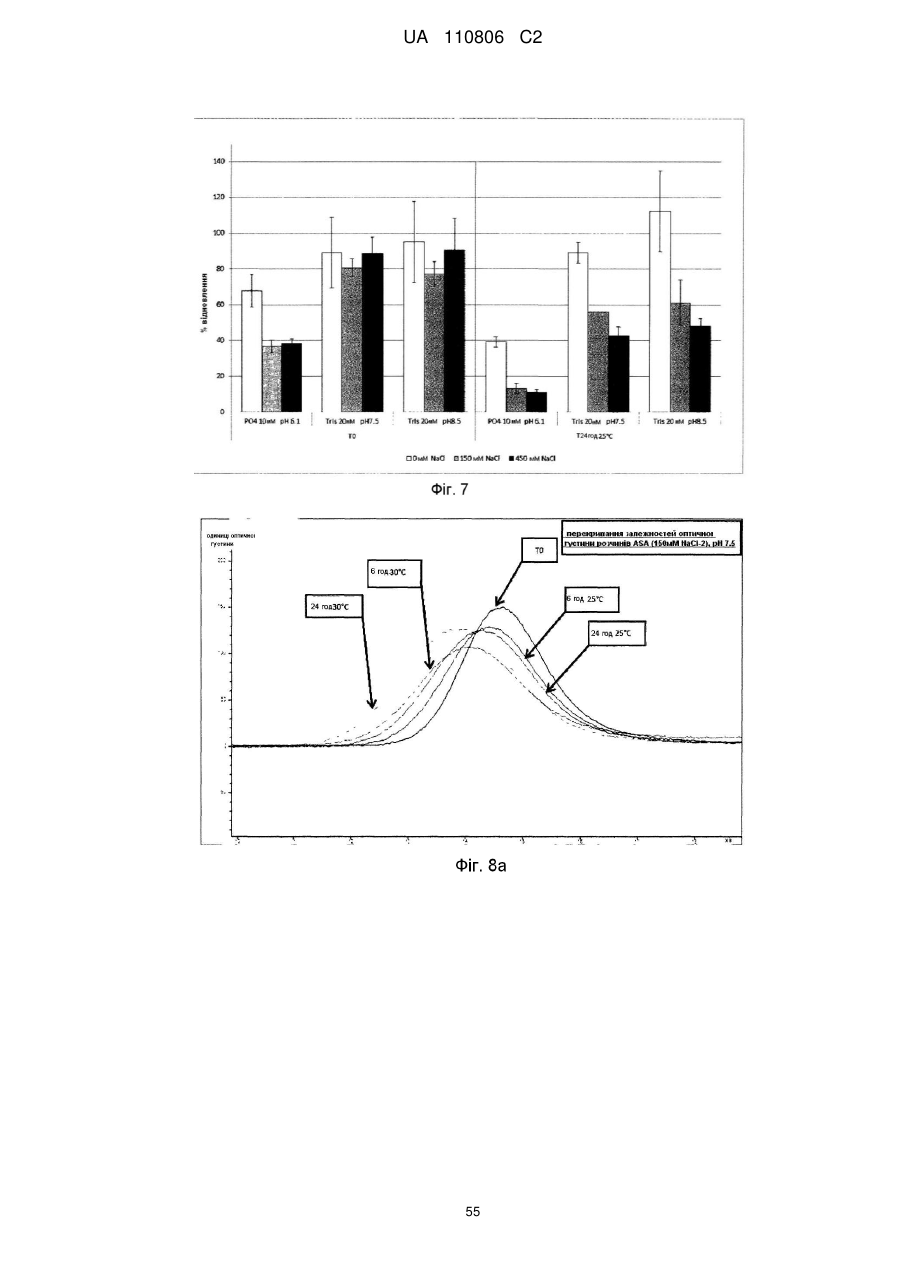
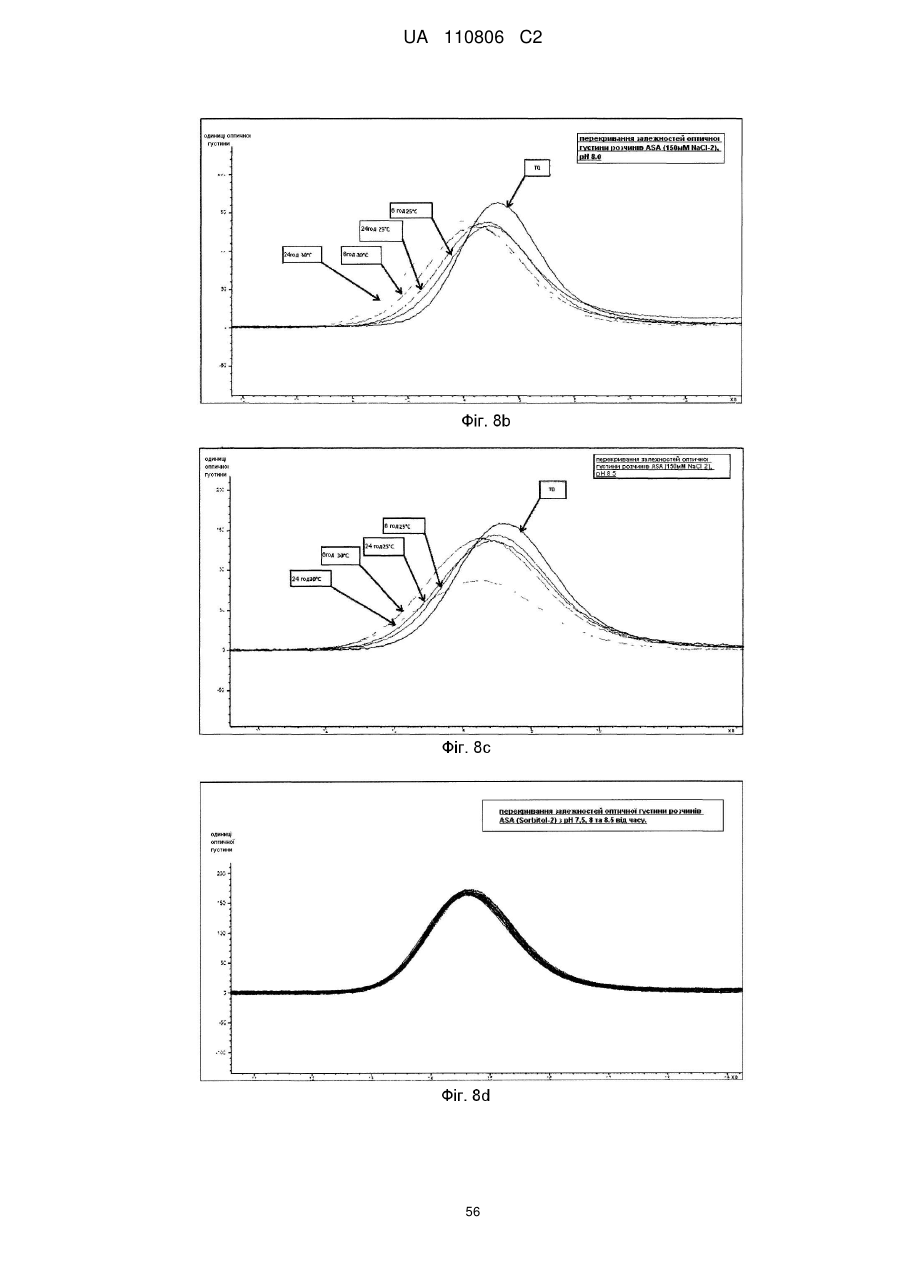
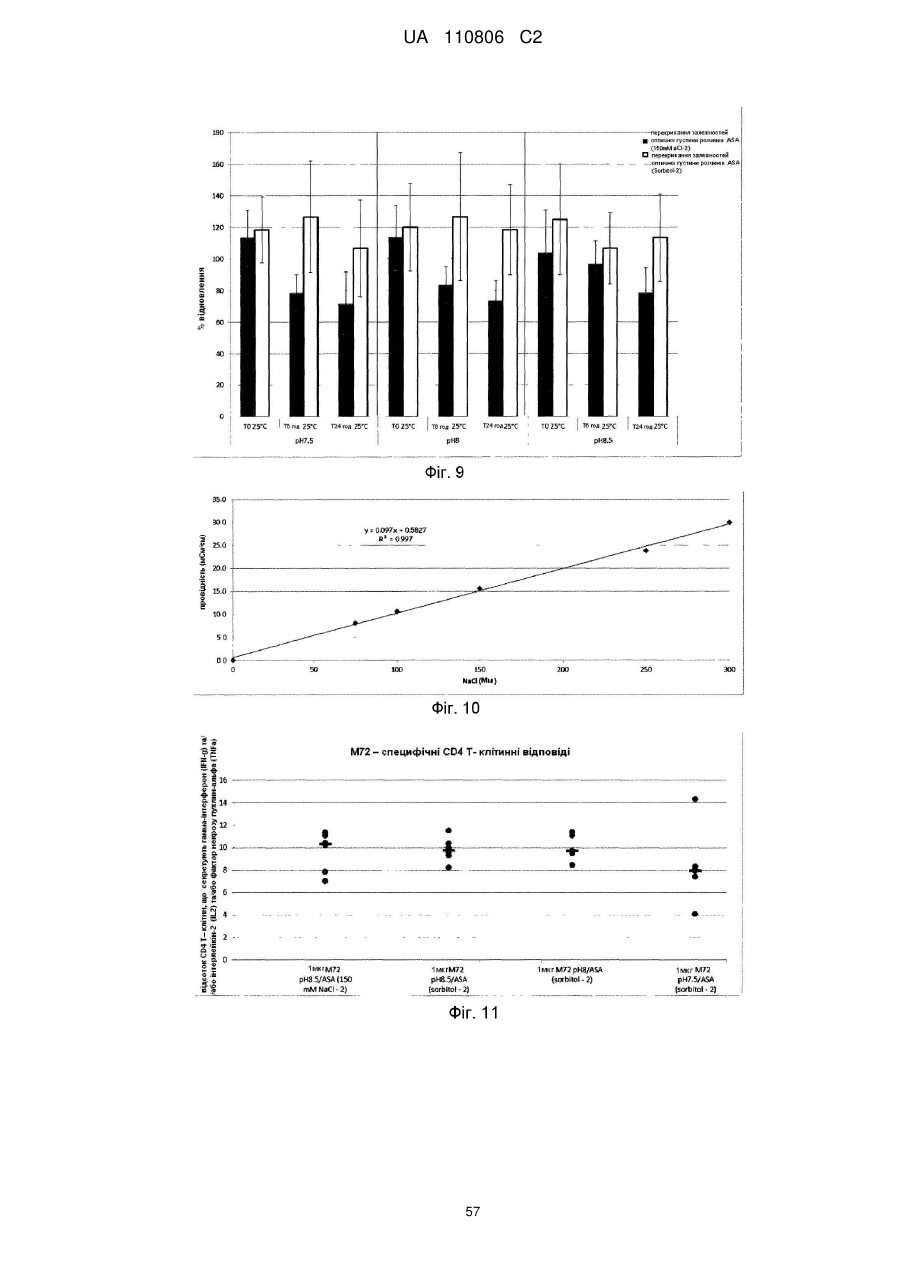
Мікобактеріальна антигенна композиція
Номер патенту: 110806
Опубліковано: 25.02.2016
Автори: Лемоін Домінік Інґрід, одарт Стефан Андре Ґеорґес, Ланан Аміна
Формула / Реферат
1. Імуногенна композиція, яка містить антиген, споріднений з Rv1196, де антиген, споріднений з Rv1196, включає (а) послідовність, що має принаймні 90 % ідентичності з послідовністю SEQ ID No: 1 або (b) фрагмент послідовності SEQ ID No: 1, який містить принаймні 350 амінокислот у довжину, та де електропровідність композиції складає 5 мСм/см або менше, а рН вказаної композиції лежить в інтервалі від 7,0, до 9,0.
2. Імуногенна композиція згідно з п. 1, де електропровідність композиції складає 4 мСм/см або менше.
3. Імуногенна композиція згідно з п. 2, де електропровідність складає 3 мСм/см або менше.
4. Імуногенна композиція за будь-яким з пп. 1-3, в якій концентрація солей дорівнює 40 мМ або менше.
5. Імуногенна композиція за будь-яким з пп. 1-4, в якій концентрація хлориду натрію дорівнює 40 мМ або менше.
6. Імуногенна композиція за будь-яким з пп. 1-5, яка додатково включає неіонний агент, що регулює тонічність.
7. Імуногенна композиція згідно з п. 6, в якій неіонний агент, що регулює тонічність, являє собою поліол.
8. Імуногенна композиція згідно з п. 7, в якій поліол являє собою сорбіт.
9. Імуногенна композиція згідно з п. 8, в якій концентрація сорбіту складає від приблизно 4 до приблизно 6 % (ваг./об.).
10. Імуногенна композиція за будь-яким з пп. 1-9, в якій концентрація сахарози складає від приблизно 4 до приблизно 6 % (ваг./об.).
11. Імуногенна композиція за будь-яким з пп. 1-10, яка додатково включає один або декілька імуностимуляторів.
12. Імуногенна композиція за п. 11, в якій імуностимулятор є сапоніном та/або агоністом TLR4.
13. Імуногенна композиція за п. 12, в якій імуностимулятор(и) має(мають) форму ліпосом.
14. Імуногенна композиція за п. 12 або п. 13, в якій сапонін є QS21.
15. Імуногенна композиція за будь-яким з пп. 12-14, в якій агоніст TLR4 являє собою 3-де-О-ацилований монофосфорилліпід А.
16. Імуногенна композиція за будь-яким з пп. 1-15, в якій осмоляльність дорівнює 250-750 мОсм/кг.
17. Імуногенна композиція за будь-яким з пп. 1-16, де композиція забезпечується у вигляді одиничної дози, що складає 50 мкл - 1 мл.
18. Імуногенна композиція згідно з п. 17, де одинична доза складає від 100 до 750 мкл.
19. Імуногенна композиція за п. 17 або п. 18, де одинична доза містить 1-100 мкг білка, спорідненого з Rv1196.
20. Імуногенна композиція за п. 19, де одинична доза містить 5-50 мкг білка, спорідненого з Rv1196.
21. Імуногенна композиція за будь-яким з пп. 1-20, де значення рН вказаної композиції знаходиться у діапазоні від 7,5 до 8,5.
22. Імуногенна композиція за будь-яким з пп. 1-21, в якій антиген, споріднений з Rv1196, включає послідовність, що має принаймні 90 % ідентичності з послідовністю SEQ ID No: 1.
23. Імуногенна композиція за будь-яким з пп. 1-21, в якій антиген, споріднений з Rv1196, включає фрагмент послідовності SEQ ID No: 1, що має принаймні 350 амінокислот у довжину.
24. Імуногенна композиція за будь-яким з пп. 1-23 для застосування у медицині.
25. Застосування імуногенної композиції за будь-яким з пп. 1-23 у виробництві лікарського засобу.
26. Імуногенна композиція згідно з п. 24 або п. 25 для введення людині.
27. Спосіб профілактики, лікування або послаблення мікобактеріальних інфекцій, таких як інфекції, спричинені Mycobacterium tuberculosis, що включає введення безпечної та ефективної кількості імуногенної композиції за будь-яким з пп. 1-23.
Текст
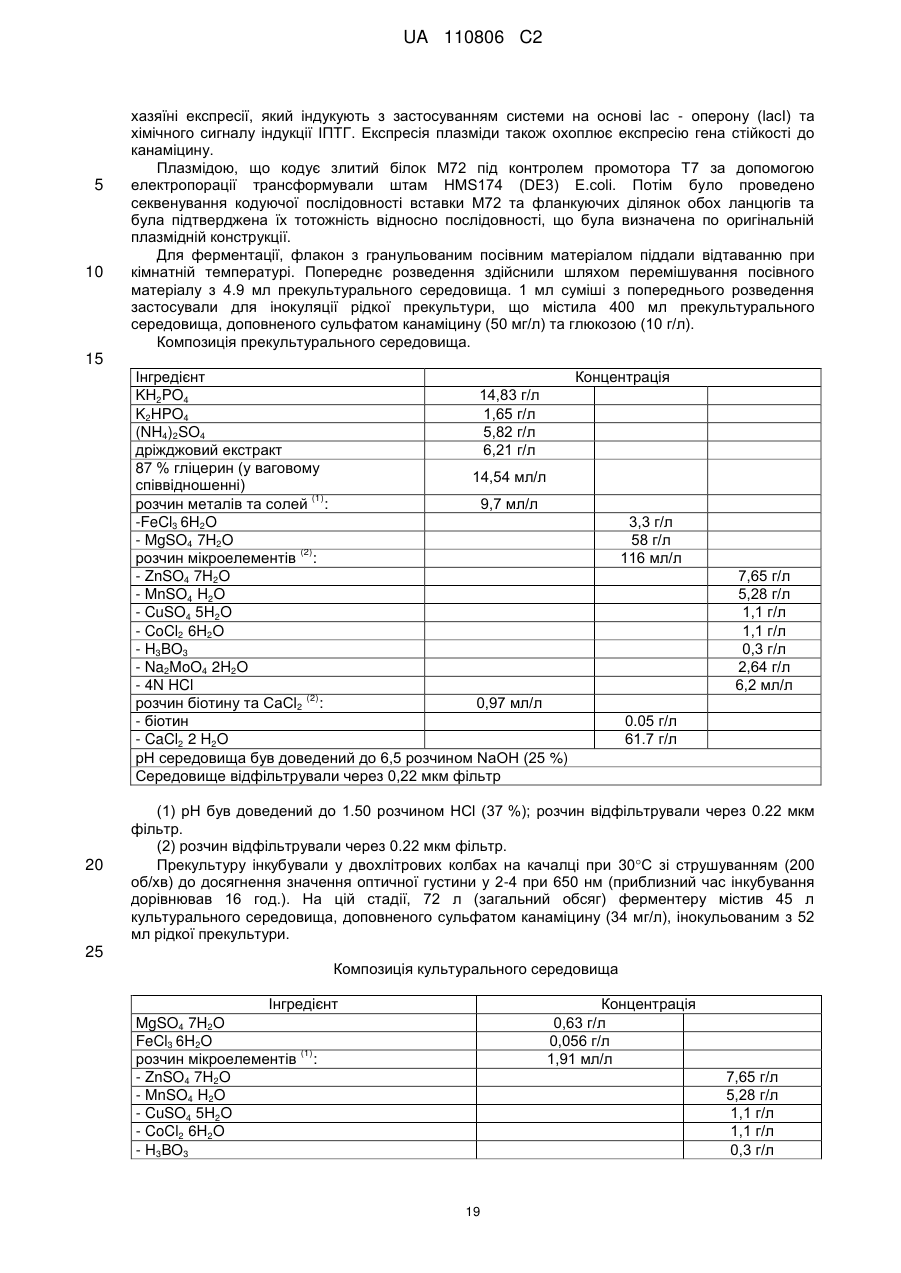
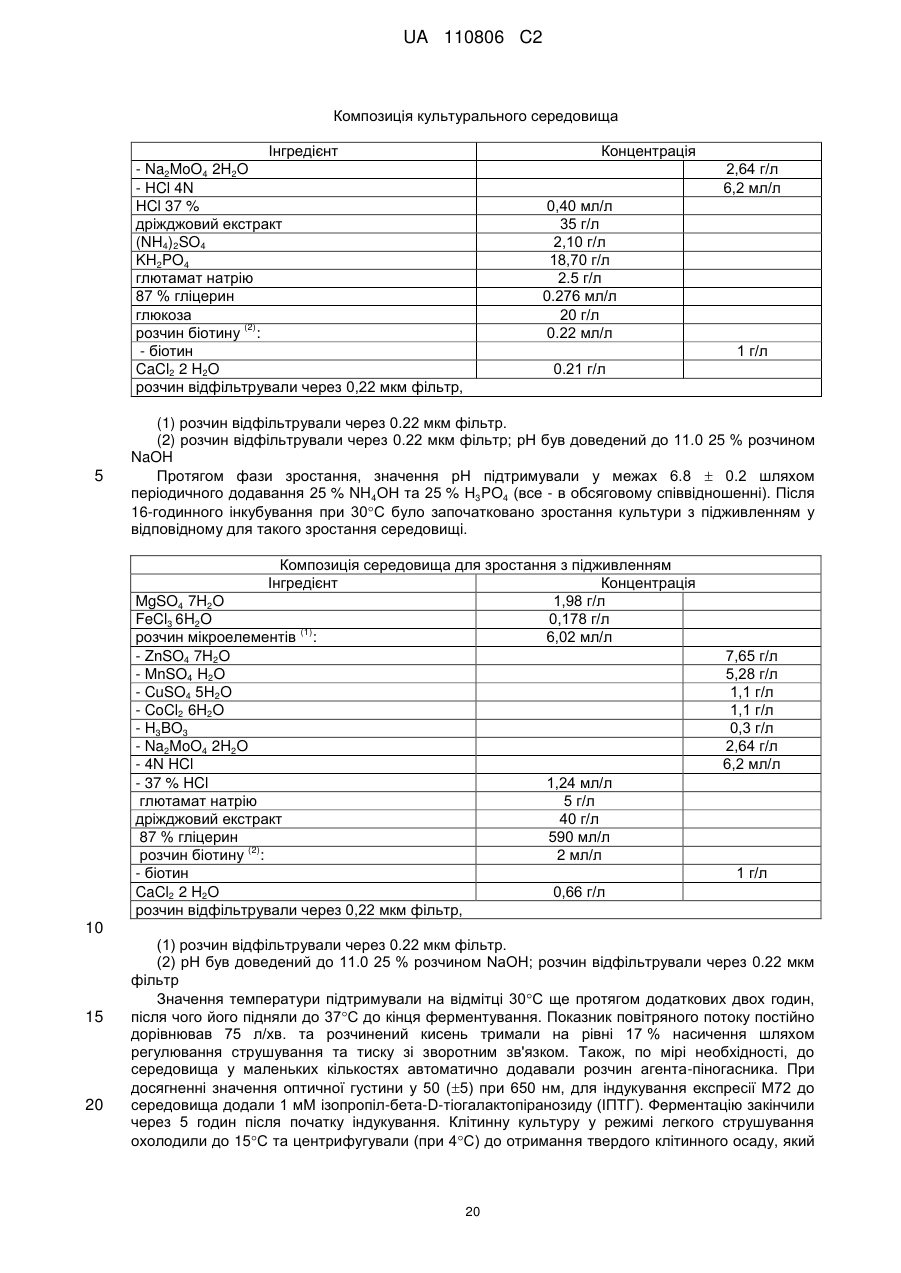
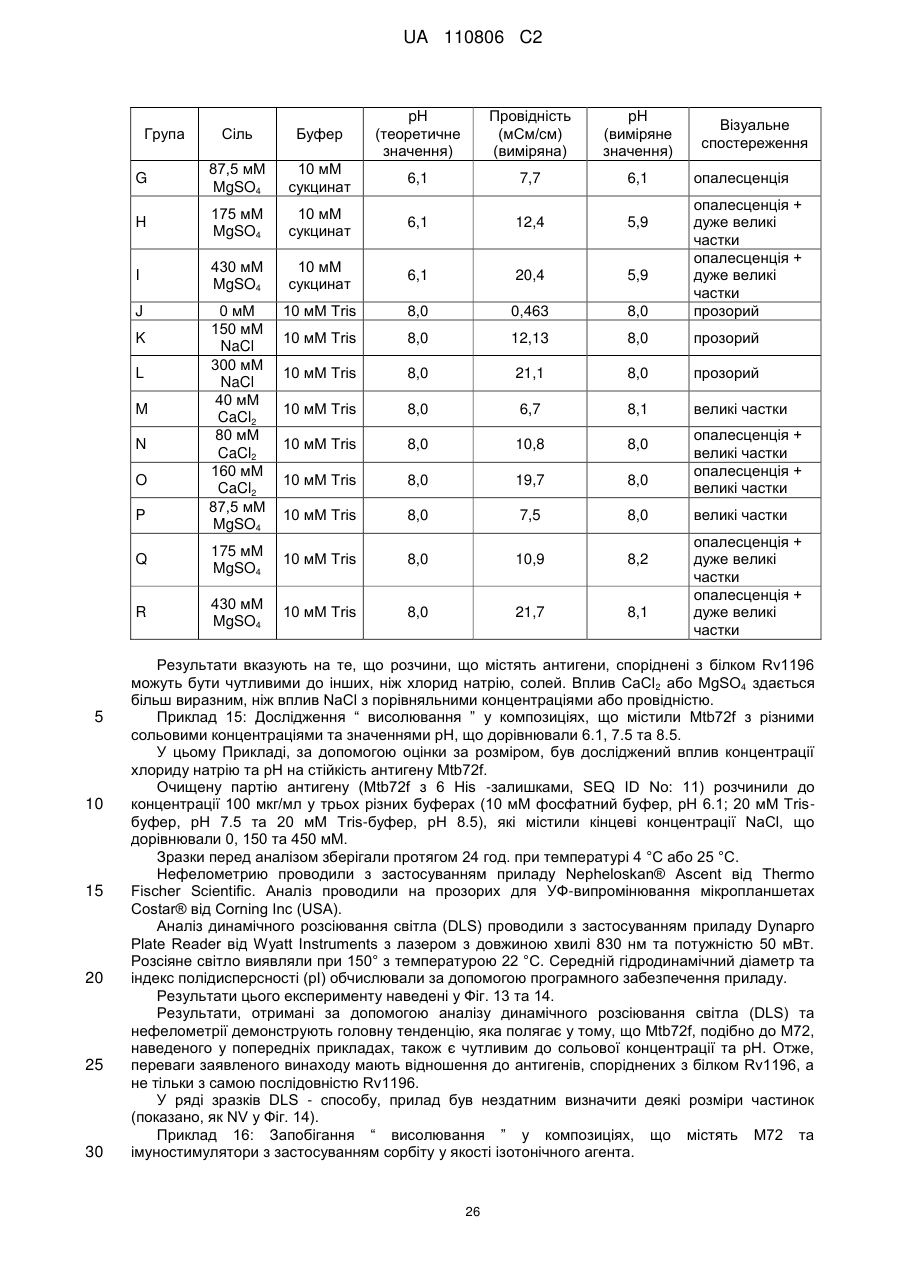
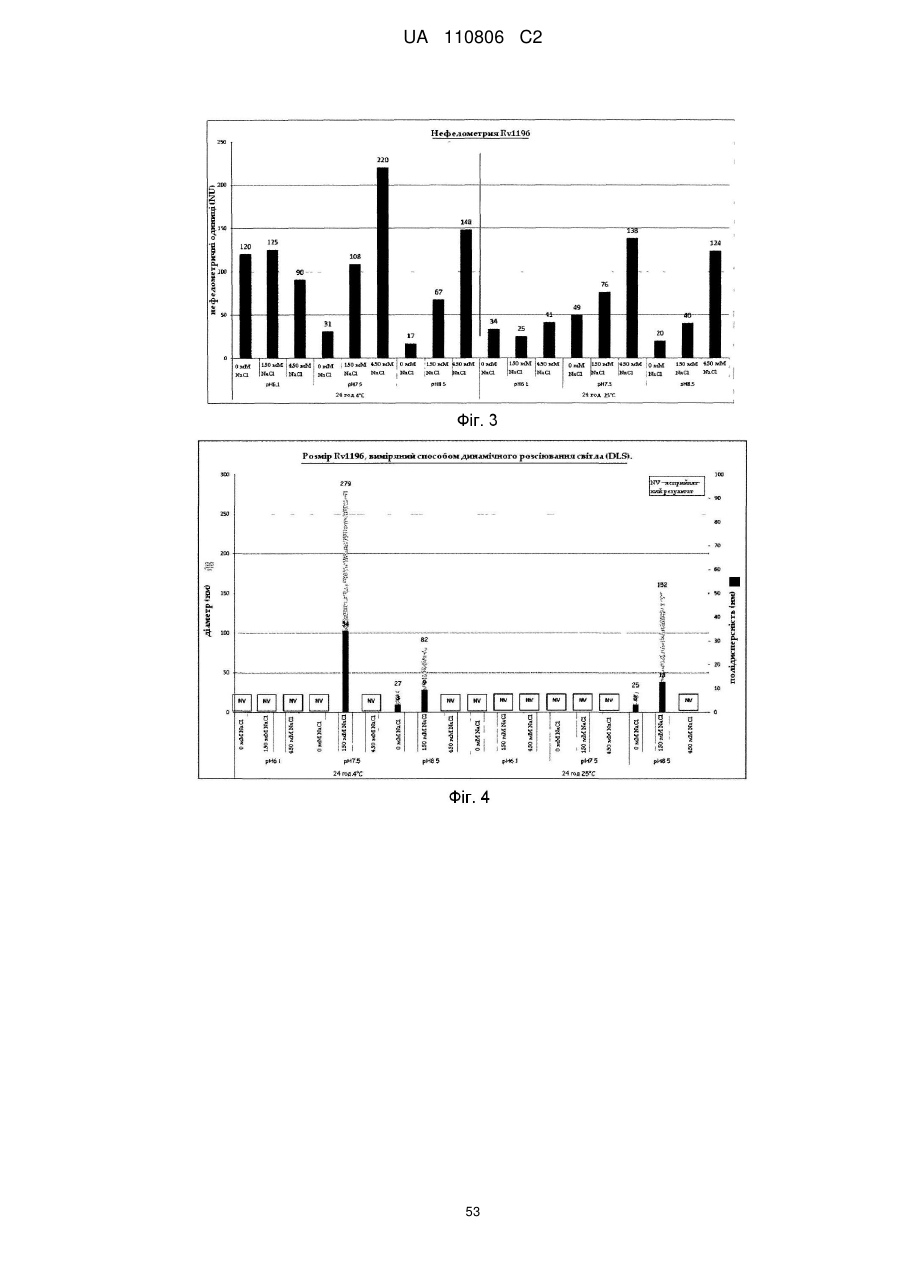
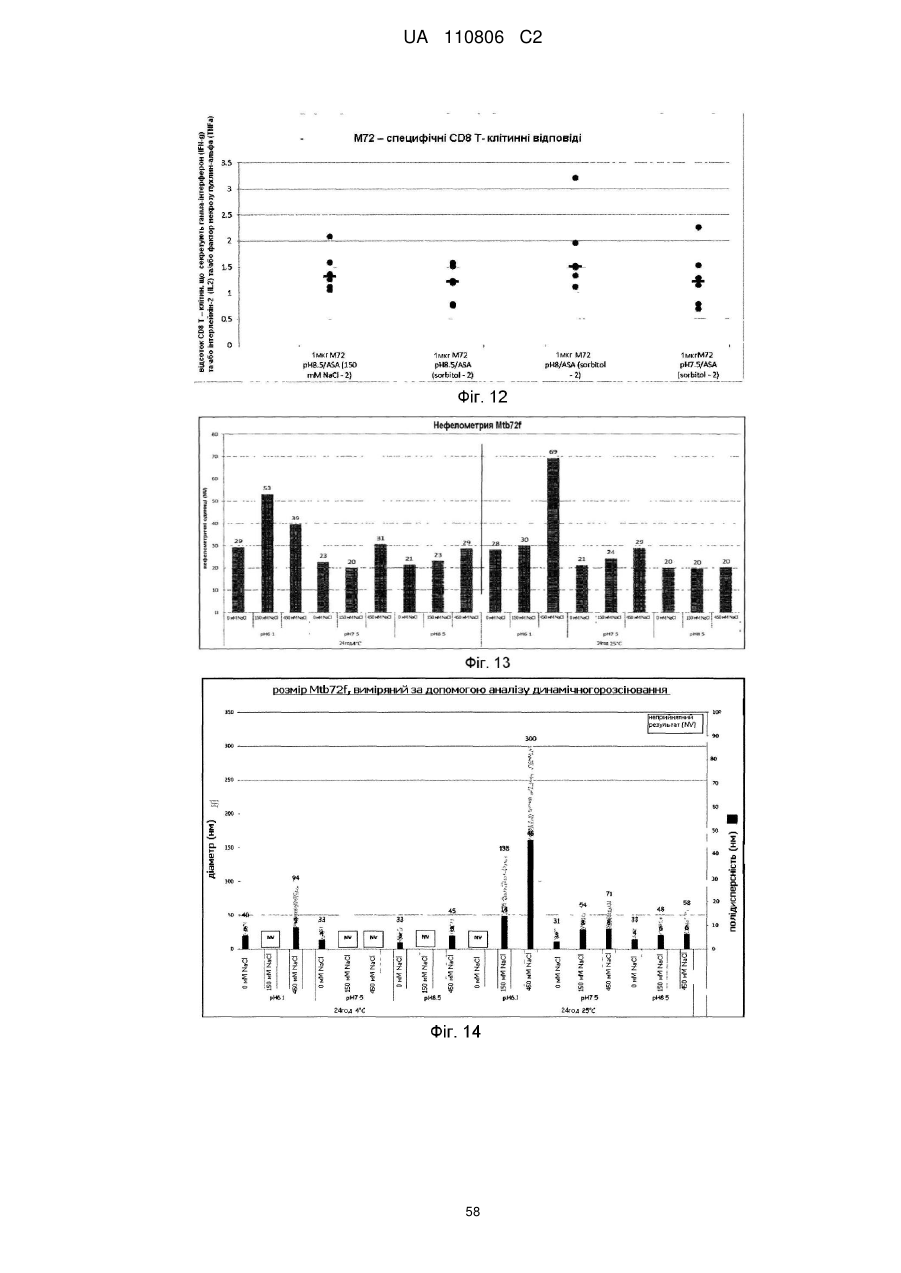
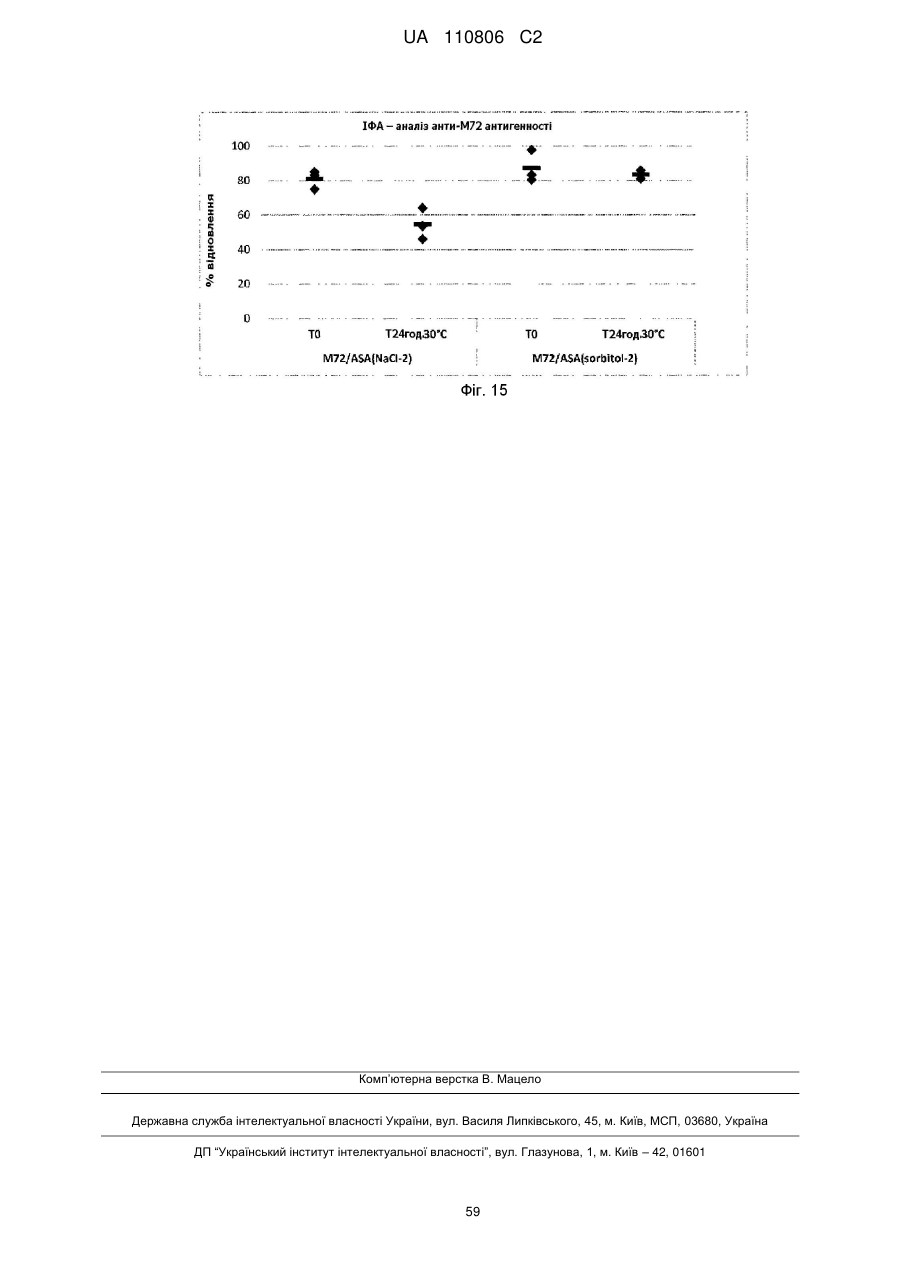
Реферат: Винахід стосується імуногенної композиції, яка містить антиген, споріднений з Rv1196, де антиген, споріднений з Rv1196, включає (а) послідовність, що має принаймні 90 % ідентичності з послідовністю SEQ ID NO: 1 або (b) фрагмент послідовності SEQ ID NO: 1, який містить принаймні 350 амінокислот у довжину, та де електропровідність композиції складає 5 мСм/см або менше, а рН вказаної композиції лежить в інтервалі від 7,0, до 9,0. UA 110806 C2 (12) UA 110806 C2 UA 110806 C2 5 10 15 20 25 30 35 40 45 50 55 60 Заявлений винахід стосується імуногенних композицій, що містять антиген, споріднений з білком Rv1196 та мають низьку іонну силу. Також заявлений винахід стосується таких імуногенних композицій, що додатково містять один або декілька імуностимуляторів. Також передбачені способи отримання таких імуногенних композицій та пов'язаних з ними наборів. Туберкульоз (TB) є хронічною інфекційною хворобою, спричиненою інфекцією Mycobacterium tuberculosis та іншими видами Mycobacterium. Він є важливою хворобою в країнах, що розвиваються, а також стає все більш серйозною проблемою у розвинених районах світу. Вважається, що більш, ніж два мільярди людей є інфікованими туберкульозною бацилою разом з появою приблизно 9.4 мільйонів нових випадків туберкульозу та 1.7 мільйонів випадків смерті через цю хворобу. У 10 % цих інфікованих туберкульозною бацилою осіб буде розвиватися активний туберкульоз та кожна особа з цією активною формою інфікує в середньому 10-15 інших осіб протягом року. У той час, як річні показники захворюваності в усьому світі досягли свого піку, кількість смертей та випадків захворювання продовжує зростати у зв'язку зі зростанням чисельності населення (Всесвітня організація охорони здоров'я; Тuberculosis Facts 2010). Мікобактеріальний білок Rv1196 (описаний, наприклад, під назвою Mtb39a (Dillon et al Infection and Immunity 1999 67(6): 2941-2950) або його фрагменти або похідні є білковими антигенами, потенційно корисними для лікування або запобігання туберкульозу. Rv1196 є дуже консервативним білком, зі 100 % тотожністю послідовності між штамами H37Rv, C, Haarlem, CDC1551, 94-M4241A, 98-R604INH-RIF-EM, KZN605, KZN1435, KZN4207, KZNR506 та з одиничною точковою мутацією Q30K у штамі F11. Rv1196 є компонентом злитих (гібридних) білкових антигенів Mtb72f та M72, (що описані, наприклад, у міжнародній патентній заявці WO2006/117240). Отримання білкових антигенів є надзвичайно важливим для забезпечення підтримання імуногенності. Іноді, імуностимулятори застосовують для посилення зростання імунної відповіді до будь-якого вибраного антигену. Однак, включення ад'ювантів до імуногенної композиції підвищує складність отримання компонентів, а також складність отримання та розповсюдження композиції. Отримання кожного з ад'ювантних компонентів, а також антигенного компоненту повинно бути розглянуто виробниками. Зокрема, повинна бути розглянута сумісність антигенного компоненту з ад'ювантним компонентом, особливо у випадках, коли ліофілізовані антигени або антигенні препарати призначені для відновлення з ад'ювантним препаратом. У таких обставинах важливо, щоб буфер ад'ювантного препарату був прийнятним для антигену та щоб ад'ювант не впливав на імуногенність або розчинність антигену. Винахідники спочатку визначили, що антигени, споріднені з білком Rv1196 є особливо чутливими до наявності солей. Не обмежуючись теоретичним матеріалом, вважається, що антигени, споріднені з білком Rv1196, зазнають негативного впливу певного явища, відомого як “висолювання”, що може бути визначено у вигляді осідання білку зі свого розчину шляхом взаємодії з солями, як-то з хлоридом натрію. Винахідники відкрили, що ці антигени утворюють агрегати та осаджуються при концентрації хлориду натрію, що є не меншою, ніж 150 мM. Отже, стійкість імуногенних композицій, що містять антигени, споріднені з білком Rv1196 може несподівано бути збільшеною шляхом зменшення концентрації хлориду натрію. Відповідно, заявлений винахід стосується імуногенної композиції, що містить антиген, споріднений з білком Rv1196, де провідність композиції дорівнює 13 мСм/см або менше. Додатково передбачено імуногенну композицію, що містить антиген, споріднений з білком Rv1196, де концентрація солей у вказаній композиції дорівнює 130 мM або менше. Заявлений винахід також стосується імуногенної композиції, що містить антиген, споріднений з білком Rv1196, де концентрація хлориду натрію у вказаній композиції дорівнює 130 мM або менше. Стислий опис малюнків. Фіг. 1. Крива літичної активності QS21. Фіг. 2. Відсоток кожного конгенеру 3D-MPL у різних препаратах ASA. Фіг. 3. Нефелометрия імуногенних композицій з різними pH та концентраціями NaCl після зберігання. Фіг. 4. DLS імуногенних композицій з різними pH та концентраціями NaCl після зберігання. Фіг. 5. DLS імуногенних композицій з різними pH та концентраціями NaCl після зберігання. Фіг. 6. Нефелометрия імуногенних композицій з різними pH та концентраціями NaCl після зберігання. Фіг. 7. Антигенна стійкість імуногенних композицій з різними pH та концентраціями NaCl, виміряна після зберігання. Фіг. 8a-8d. Ексклюзійний ВЕРХ - аналіз імуногенних композицій з різними pH та 1 UA 110806 C2 5 10 15 20 25 30 35 40 45 50 55 60 концентраціями NaCl після зберігання. Фіг. 9. Антигенність імуногенних композицій з різними pH та концентраціями NaCl після зберігання. Фіг. 10. Провідність стандартних розчинів NaCl. Фіг. 11. Викликання CD4 Т-клітинних відповідей у мишей з застосуванням імуногенних композицій винаходу. Фіг. 12. Викликання CD8 Т-клітинних відповідей у мишей з застосуванням імуногенних композицій винаходу. Фіг. 13. Нефелометрія імуногенних композицій з різними pH та концентраціями NaCl після зберігання. Фіг. 14. DLS імуногенних композицій з різними pH та концентраціями NaCl після зберігання. Фіг. 15. Антигенність імуногенних композицій з різними концентраціями NaCl після зберігання. Стислий опис ідентифікаційних номерів послідовностей. SEQ ID No: 1 Амінокислотна послідовність білка Rv1196 штаму H37Rv Mycobacterium tuberculosis. SEQ ID No: 2 Нуклеотидна послідовність, що кодує білок Rv1196 штаму H37Rv Mycobacterium tuberculosis. SEQ ID No: 3 Амінокислотна послідовність білка Rv1196 штаму F11 Mycobacterium tuberculosis. SEQ ID No: 4 Нуклеотидна послідовність, що кодує білок Rv1196 штаму F11 Mycobacterium tuberculosis. SEQ ID No: 5 Амінокислотна послідовність білка M72. SEQ ID No: 6 Нуклеотидна послідовність, що кодує білок M72. SEQ ID No: 7 Амінокислотна послідовність білка M72 з двома N-кінцевими His -залишками. SEQ ID No: 8 Нуклеотидна послідовність, що кодує M72 білок з двома N-кінцевими His залишками. SEQ ID No: 9 Амінокислотна послідовність білка Mtb72f. SEQ ID No:10. Нуклеотидна послідовність, що кодує білок Mtb72f. SEQ ID No:11. Амінокислотна послідовність білка Mtb72f з шістьма N-кінцевими His залишками. SEQ ID No:12 Нуклеотидна послідовність, що кодує білок Mtb72f з шістьма N-кінцевими His залишками. SEQ ID No: 13 Нуклеотидна послідовність CpG Oligo 1 (CpG 1826). SEQ ID No: 14 Нуклеотидна послідовність CpG Oligo 2 (CpG 1758). SEQ ID No: 15 Нуклеотидна послідовність CpG Oligo 3. SEQ ID No: 16 Нуклеотидна послідовність CpG Oligo 4 (CpG 2006). SEQ ID No: 17 Нуклеотидна послідовність CpG Oligo 5 (CpG 1686). У першому аспекті, заявлений винахід стосується імуногенної композиції, що містить антиген, споріднений з білком Rv1196, де провідність композиції дорівнює 13 мСм/см або менше. Зокрема, заявлений стосується імуногенних композиції, що містять антиген, споріднений з білком Rv1196, де провідність імуногенної композиції дорівнює 12 мСм/см або менше, наприклад 10 мСм/см або менше, 8 мСм/см або менше, 6 мСм/см або менше, 5 мСм/см або менше, 4 мСм/см або менше або 3 мСм/см або менше. У окремому втіленні, провідність імуногенної композиції дорівнює 2.5 мСм/см або менше, як-то 2.25 мСм/см або менше або 2.0 мСм/см або менше. У певному додатковому втіленні, провідність імуногенної композиції дорівнює 1.5-2.5 мСм/см. У другому аспекті, заявлений винахід стосується імуногенної композиції, що містить антиген, споріднений з білком Rv1196, де концентрація солей у вказаній композиції дорівнює 130 мM або менше. Зокрема, заявлений винахід стосується імуногенних композиції, що містять антиген, споріднений з білком Rv1196, де концентрація солей у вказаній композиції дорівнює 100 мM або менше, наприклад 90 мM або менше, 80 мM або менше, 70 мM або менше, 60 мM або менше, 50 мM або менше або 40 мM або менше. У окремому втіленні, концентрація солей у вказаній композиції дорівнює 35 мM або менше, як-то 30 мM або менше або 25 мM або менше. У додатковому окремому втіленні, концентрація солей у вказаній композиції дорівнює 20-40 мM, як-то 25-35 мM. У третьому аспекті, заявлений винахід стосується імуногенної композиції, що містить антиген, споріднений з білком Rv1196, де концентрація хлориду натрію дорівнює 130 мM або менше. Зокрема, заявлений винахід стосується імуногенних композиції, що містять антиген, споріднений з білком Rv1196, де концентрація хлориду натрію дорівнює 100 мM або менше, 2 UA 110806 C2 5 10 15 20 25 30 35 40 45 50 55 60 наприклад 90 мM або менше, 80 мM або менше, 70 мM або менше, 60 мM або менше, 50 мM або менше, 40 мM або менше, 30 мM або менше, 20 мM або менше або 15 мM або менше. У окремому втіленні, концентрація хлориду натрію у імуногенній композиції дорівнює 10 мM або менше, як-то 7.5 мM або менше. Відповідно, концентрація хлориду натрію у імуногенній композиції може або дорівнювати або бути нижчою, ніж 5 мM. У додатковому окремому втіленні, імуногенна композиція є істотно вільною від хлориду натрію. Під “ істотно вільною ” мається на увазі, що концентрація хлориду натрію дорівнює або дуже наближується до 0 мM (як-то 3 мМ або менше, 2 мМ або менше або 1 мМ або менше). Відповідно, концентрація CaCl2 у імуногенних композиціях може дорівнювати 40 мM або менше, 30 мM або менше, 20 мM або менше, 15 мM або менше або 10 мM або менше. Відповідно, концентрація MgSO4 у імуногенних композиціях може дорівнювати 80 мM або менше, 60 мM або менше, 40 мM або менше, 30 мM або менше, 20 мM або менше або 10 мM або менше. + 2+ 2+ Відповідно, загальна концентрація іонів NH 4 , Mg та Ca у імуногенних композиціях може дорівнювати 80 мM або менше, 60 мM або менше, 40 мM або менше, 30 мM або менше, 20 мM або менше або 10 мM або менше. Імуногенні композиції винаходу знаходяться у вигляді водних препаратів. Провідність імуногенної композиції винаходу можна виміряти з застосуванням відомих у цій галузі технічних засобів, наприклад, за допомогою спеціальних датчиків вимірювання провідності або інших інструментів, здатних вимірювати провідність. Одним таким прийнятним інструментом є прилад Zetasizer Nano ZS від Malvern Instruments (UK). + Досвідчений фахівець може легко здійснити перевірку концентрацій натрій (Na ) та хлорид (Cl ) іонів за допомогою відомих способів та наборів. Наприклад, натрій можна визначити за допомогою набору Sodium Enzymatic Assay Kit (Catalogue Number: BQ011EAEL) від Biosupply. Хлорид - іони можна визначити за допомогою набору Chloride Enzymatic Assay Kit (Catalogue Number: BQ006EAEL) від Biosupply. Mycobacterium tuberculosis заражає людей через дихальні шляхи. Альвеолярні макрофаги поглинають ці бактерії, але вони здатні виживати та розмножуватися шляхом інгібування злиття фагосоми з кислими лізосомами. Комплексна імунна відповідь охоплює CD4+ та CD8+T – клітинні відповіді, що в кінцевому рахунку ведуть до утворення гранульоми. Головним успіхом Mycobacterium tuberculosis, як патогену, є той факт, що ізольована, але не знищена бактерія може зберігатися протягом тривалих періодів часу, залишаючи особу уразливою для подальшого розвитку активного туберкульозу. У менш, ніж 5 % інфікованих осіб спостерігається розвиток активної форми туберкульозу у перші роки після зараження. Гранульома може зберігатися протягом десятиліть та, як вважається, вона містить живі бактерії Mycobacterium tuberculosis у стані спокою, позбавлені кисню та поживних речовин. Однак, нещодавно було припущено, що більшість бактерій у стані спокою знаходяться у розповсюджених по тілу відмінних від макрофагів типах клітин (Locht et al, Expert Opin. Biol. Ther. 2007 7(11):1665-1677). Розвиток активного TB виникає при зміненнях балансу між природним імунітетом хазяїна та патогеном, наприклад, в результаті імуносупресивної події (Anderson P Trends in Microbiology 2007 15(1):7-13; Ehlers S Infection 2009 37(2):87-95). Динамічна гіпотеза, що описує баланс між латентною та активною формами TB також запропонована у (Cardana P-J Inflammation & Allergy – Drug Targets 2006 6:27-39; Cardana P-J Infection 2009 37(2):80-86). Хоча впродовж тривалого періоду часу ця інфекція може протікати безсимптомно, активна форма захворювання найчастіше проявляється у вигляді гострого запалення легенів, що призводить до втоми, втрати ваги, лихоманці та кашлю. При відсутності лікування, звичайними результатами є серйозні ускладнення та смерть. Туберкульоз звичайно можна контролювати з застосуванням тривалого антибіотичного лікування, хоча таке лікування не є успішним відносно запобігання поширення захворювання. Особи, що мають активну форму хвороби, тривалий період часу можуть не мати її симптомів, але бути заразними. На додачу, хоча дотримання режиму лікування є критичним фактором, поведінку пацієнта дуже важко перевірити. Деякі пацієнти не повністю проходять курс лікування, що призводить до неефективного лікування та розвитку стійкості до ліків. Форма туберкульозу, що має стійкість до багатьох ліків (MDR-TB) є такою формою, що не дає відповіді на лікування медичними препаратами першої лінії. 3і всіх щорічних випадків захворювань на туберкульоз, 3 % являють собою випадки MDR-TB, що оцінюється приблизно, як 440,000 нових щорічних випадків захворювання на MDR-TB. Туберкульоз з екстенсивною стійкістю до ліків (XDR-TB) виникає, коли на піці стійкості до медичних препаратів першої лінії 3 UA 110806 C2 5 10 15 20 25 30 35 40 45 50 55 60 розвивається стійкість до медичних препаратів другої лінії. Фактично невилікований XDR-TB був підтверджений у 58 країнах (Всесвітня організація охорони здоров'я Тuberculosis Facts 2010). Навіть при закінченні повного курсу лікування антибіотиками, інфекція M. tuberculosis у заражених осіб може залишатися невикорінною та зберігатися у них у вигляді латентної інфекції, яка знов може перейти у активну фазу. Для контролю поширення туберкульозу, першорядне значення мають ефективна програма вакцинації та точна рання діагностика захворювання. На даний час, найбільш широко застосованим способом викликання захисного імунітету є вакцинація з живими бактеріями. Найбільш часто для цієї мети застосовують вид Mycobacterium, що має назву Bacillus Calmette-Guerin (BCG), який є авірулентним штамом M. bovis, розроблений вперше більш, ніж 60 років назад. Однак, безпечність та ефективність BCG є джерелом суперечок – разом з забезпеченням захисту проти тяжких проявів хвороби у дітей, BCG не запобігає утворенню латентного TB або реактивуванню легеневого захворювання у дорослому віці. На додачу до цього, деякі країни, як-то Сполучені Штати, не вакцинують основну частину населення цим агентом. Було показано, що деякі білки, які сильно експресуються протягом ранніх стадій інфекції Mycobacterium надають тваринним моделям вакцинації потужну захисну ефективність. Однак, вакцинація з антигенами, що мають сильні рівні експресії протягом ранніх стадій інфекції може не надати оптимальної імунної відповіді, прийнятної на пізніх стадіях інфекції. Адекватний контроль протягом латентної інфекції може вимагати присутності специфічних до певного антигену Т – клітин, які повинні експресуватися на цьому етапі. У захисті проти реактивування TB можуть допомогти вакцини для застосування після зараження, що безпосередньо спрямовані до стійких бактерій у сплячому стані та тим самим підвищують контроль над туберкульозом або навіть дозволяючи викорінити інфекцію. Отже, вакцини, що спрямовані до лікування латентного TB можуть значно та економічно скоротити глобальні показники TB інфекції. Субодиничні вакцини на основі антигенів пізньої стадії також можна застосувати у комбінації з антигенами ранньої стадії для отримання мультифазової вакцини. Альтернативно, антигени ранньої та/або пізньої стадії можуть бути застосовані для доповнення та посилення BCG вакцинації (або шляхом бустингу BCG – відповіді або шляхом розвитку удосконалених рекомбінантних штамів BCG). Білковий антиген Rv1196 має потенційну перевагу у лікуванні або запобіганні туберкульозу та описаний, наприклад, під назвою Mtb39a у Dillon et al (Infection and Immunity 1999 67(6): 29412950). Rv1196 є дуже консервативним білком, зі 100 % тотожністю послідовності між штамами H37Rv, C, Haarlem, CDC1551, 94-M4241A, 98-R604INH-RIF-EM, KZN605, KZN1435, KZN4207, KZNR506 та з одиничною точковою мутацією Q30K у штамі F11. Білкові антигени Mtb72f та M72 є гібридними (злитими) білками, що містять Rv1196 та мають потенційну перевагу у лікуванні або запобіганні туберкульозу. Mtb72f, як було показано, забезпечує захист численних тваринних моделей (див., наприклад: Brandt et al Infect. Immun. 2004 72(11):6622-6632; Skeiky et al J. Immunol. 2004 172:7618-7628; Tsenova et al Infect. Immun. 2006 74(4):2392-2401; Reed et al PNAS 2009 106(7):2301-2306). Також, Mtb72f є предметом клінічних досліджень (Von Eschen et al 2009 Human вакцини 5(7):475-482). M72 є покращеним антигеном, що має порівняно з Mtb72f одиничну мутацію заміщення серину на аланін, яка приводить до покращених характеристик стійкості. Також була доведена корисність M72 – споріднених антигенів у моделі латентного туберкульозу (міжнародна патентна заявка WO2006/117240). Як тут застосовано, термін “ антиген, споріднений з білком Rv1196 “ має відношення до білка Rv1196, наведеного у SEQ ID No: 1 або його імуногенної похідної. Як тут застосовано, термін “ похідна ” має відношення до антигену, модифікованого відносно референсної послідовності. Імуногенні похідні є істотно подібними до референсної послідовності, зберігаючи імуногенні властивості референсної послідовності та залишаючись здатними забезпечувати зростання імунної відповіді по відношенню до референсної послідовності. Похідна може, наприклад, містити модифіковану версію референсної послідовності або, альтернативно, може складатися з модифікованої версії референсної послідовності. Антиген, споріднений з білком Rv1196 може, наприклад, містити менш, ніж 1000 амінокислотних залишків, як-то менш, ніж 900 амінокислотних залишків, зокрема менш, ніж 800 амінокислотних залишків. T – клітинними епітопами є короткі суміжні відрізки амінокислот, що впізнаються Т клітинами (наприклад, Т-клітинами CD4+ або CD8+). Ідентифікацію Т-клітинних епітопів можна здійснити за допомогою відомих досвідченим фахівцям експериментів по картуванню епітопів 4 UA 110806 C2 5 10 15 20 25 30 35 40 45 50 55 60 (див., наприклад, Paul, Fundamental Immunology, 3rd ed., 243-247 (1993); Beiβbarth et al Bioinformatics 2005 21(Suppl. 1):i29-i37). У неоднаковій неспорідненій популяції, як-то у популяції людей, різні типи HLA означають те, що окремі епітопи можуть не впізнаватися всіма членами цієї популяції. В результаті важливості участі Т-клітинної відповіді на туберкульоз, максимізації рівня впізнавання та шкали імунної відповіді, імуногенна похідна Rv1196 є тим бажаним білком, що містить більшість (або відповідно всі) інтактних T - клітинних епітопів. Фахівцеві в даній галузі буде зрозуміло, що окремі заміни, делеції або доповнення білка Rv1196, що змінюють, доповнюють або зменшують одиничні амінокислотні положення або маленький відсоток амінокислот є “ імуногенною похідною ”, де змінення (одне або декілька) веде до заміщення амінокислоти на функціонально подібну амінокислоту або до заміщення/делеції/додавання залишків, що істотно не впливають на імуногенну функцію. Також добре відомі таблиці консервативних заміщень, де вказані функціонально подібні амінокислоти. Головним чином, такі консервативні заміщення будуть знаходитися в межах однієї з зазначених нижче амінокислотних груп, хоча у деяких обставинах інші заміщення також можуть бути можливими без істотного впливу на імуногенні властивості антигену. Кожна з наступних восьми груп охоплює амінокислоти, що, як правило, є консервативними заміщеннями одна до іншої: 1) аланін (A), гліцин (G); 2) аспарагінова кислота (D), глютамінова кислота (E); 3) аспарагін (N), глютамін (Q); 4) аргінін (R), лізин (K); 5) ізолейцин (I), лейцин (L), метіонін (M), валін (V); 6) фенілаланін (F), тирозин (Y), триптофан (W); 7) серин (S), треонін (T); та 8) цистеїн (C), метіонін (M) (див., наприклад, Creighton, Proteins 1984). Відповідно, такі заміщення не виникають у епітопній ділянці, отже не мають значного впливу на імуногенні властивості антигену. Також, імуногенні похідні можуть охоплювати такі похідні, де, порівняно з референсною послідовністю, вставлені додаткові амінокислоти. Відповідно, подібні вставки не виникають у епітопній ділянці, отже теж не мають значного впливу на імуногенні властивості антигену. Одним прикладом таких вставок є вставка короткого відрізку гістидинових залишків (наприклад, 2-6 залишків) для сприяння експресії та/або очищення вказаного антигену. Також імуногенні похідні можуть охоплювати похідні, де, порівняно з референсною послідовністю, деякі амінокислоти є видаленими. Відповідно, подібні делеції не виникають у епітопній ділянці, отже теж не мають значного впливу на імуногенні властивості антигену. Досвідченому фахівцю буде зрозуміло, що окремі імуногенні похідні можуть мстити заміщення, делеції та додавання (або будь-яку їх комбінацію). Tерміни “ ідентичний ” (тотожній) або відсоток “ ідентичності, ” у контексті двох або декількох поліпептидних послідовностей, має відношення до двох або декількох послідовностей або суб – послідовностей, що є однаковими або мають точно визначений відсоток однакових амінокислотних залишків (тобто 70 % ідентичності, вибірково 75 %, 80 %, 85 %, 90 %, 95 %, 98 % або 99 % ідентичності у зазначеній ділянці) при порівнянні та вирівнюванні на максимальну відповідність у вікні порівняння або коли зазначену ділянку вимірюють з застосуванням одного з наступних алгоритмів порівняння послідовностей або ручного вирівнювання та візуального огляду. Це визначення також має відношення до комплементу тестової послідовності. Вибірково, ідентичність має місце у ділянці, що має принаймні 250 амінокислот у довжину, як-то 300 амінокислот або 350 амінокислот. Відповідно, порівняння проводять відносно вікна, відповідного повній довжині референсної послідовності (на відміну від похідної послідовності). Для порівняння послідовностей, одна послідовність виконує функцію референсної послідовності, з якою порівнюють тестову послідовність. При застосуванні алгоритму порівняння послідовностей, тестову та референсну послідовності вводять у комп'ютер та, якщо це необхідно, задають координати субпослідовності та параметри програми алгоритму послідовності. У цьому випадку можуть бути застосовані параметри програми за замовчуванням або альтернативні параметри. Потім, за допомогою алгоритму порівняння послідовностей обчислюють відсоток ідентичностей для тестових послідовностей по відношенню до референсної послідовності на основі параметрів програми. “Вікно порівняння”, як тут застосовано, має відношення до сегменту, у якому послідовність 5 UA 110806 C2 5 10 15 20 25 30 35 40 45 50 55 60 може бути порівняна з референсною послідовністю з такою ж саме кількістю суміжних положень після оптимального вирівнювання двох послідовностей. Способи вирівнювання послідовностей для порівняння є добре відомими. Оптимальне вирівнювання послідовностей для порівняння можна здійснити, наприклад, за допомогою алгоритму локальної гомології від Smith & Waterman, Adv. Appl. Math. 2:482 (1981), за допомогою алгоритмувирівнювання гомології від Needleman & Wunsch, J. Mol. Biol. 48:443 (1970).), за допомогою пошуку подібності від Pearson & Lipman, Proc. Nat'l. Acad. Sci. USA 85:2444 (1988), за допомогою комп'ютеризованих втілень цих алгоритмів (GAP, BESTFIT, FASTA, та TFASTA у наборі програмного забезпечення Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Dr., Madison, WI) або шляхом ручного вирівнювання та візуального огляду. (див., наприклад., Current Protocols in Molecular Biology (Ausubel et al., eds. 1995 supplement)). Одним прикладом корисного алгоритму є PILEUP. PILEUP створює багато вирівнювань послідовності з групи споріднених послідовностей з застосуванням прогресивних, попарних вирівнювань, показуючи спорідненість та відсоток тотожності послідовностей. Також, у цьому алгоритмі можна отримати дерево або дендрограму, що показує кластеризовані співвідношення, застосовані для отримання вирівнювання. У PILEUP застосовано спосіб спрощення прогресивного вирівнювання від Feng & Doolittle, J. Mol. Evol. 35:351-360 (1987). Цей застосований спосіб є подібним до описаного у Higgins & Sharp, CABIOS 5:151-153 (1989). Програма може вирівняти до 300 послідовностей, де кожна має максимальну довжину у 5,000 нуклеотидів або амінокислот. Багато процедур вирівнювання починається з попарного вирівнювання двох найбільш подібних послідовностей з отриманням кластеру з двох вирівняних послідовностей. Цей кластер потім знов вирівнюють з наступними найбільш спорідненими послідовностями або кластером вирівняних послідовностей. Два кластера послідовностей вирівнюють шляхом простого розширення попарного вирівнювання двох окремих послідовностей. Кінцевого вирівнювання досягають за допомогою серій прогресивних попарних вирівнювань. Програма рухається шляхом призначення певних послідовностей та їх амінокислотних координат ділянкам порівняння послідовності та шляхом встановлення її параметрів. З застосуванням алгоритму PILEUP, референсну послідовність порівнюють з іншими тестовими послідовностями для визначення відсоткового відношення тотожності послідовності з застосуванням наступних параметрів: відкриття пробілу у послідовності по замовчуванню (3.00), продовження пробілу у послідовності по замовчуванню (0.10) та кінцевих пробілів. PILEUP можна знайти у наборі програмного забезпечення GCG sequence analysis software package, наприклад, версії 7.0 (Devereaux et al., Nuc. Acids Res. 12:387-395 (1984)). Іншими прикладами прийнятного алгоритму визначення відсотка ідентичності та подібності послідовностей є алгоритми BLAST та BLAST 2.0, описані, відповідно, у Altschul et al., Nuc. Acids Res. 25:3389-3402 (1977) та Altschul et al., J. Mol. Biol. 215:403-410 (1990). Програмне забезпечення для проведення BLAST – аналізу є загальнодоступним від Національного центру біотехнологічної інформації (National Center for Biotechnology Information; веб-сайт www.ncbi.nlm.nih.gov/). Цей алгоритм у першу чергу передбачає ідентифікацію пар сегментів з максимальною схожістю (HSP) шляхом ідентифікації коротких слів довжиною W у питомій послідовності, що або співпадають або задовольняють певному позитивно оціненому граничному значенню T при вирівнюванні зі словом тієї ж самої довжини у базі даних послідовностей, де T відноситься до граничного значення сусіднього слова (Altschul et al., supra). Ці початкові співпадіння сусідніх слів діють у якості затравки для початку пошуків більш довгих HSP, що їх містять. Співпадіння слів поширюють у обох напрямках вздовж кожної послідовності для збільшення сукупного рахунка вирівнювання. У сукупних оцінках для нуклеотидних послідовностей застосовують параметри M (заохочувальні бали для пари співпадаючих залишків; завжди > 0) та N (штрафні бали для неспівпадаючих залишків; завжди 0.1) - приблизно втричі вищої, ніж OD буферу (“0 мкг ” QS21) - у висхідної частині кривої - визначеної для кожного випробування. 2. Літична активність QS21 у ад'ювантних зразках була визнана позитивною, якщо OD для ад'ювантного зразка була більшою, ніж ODLOD. Приклад кривої QS21. 50 15 UA 110806 C2 QS21 (мкг) 0 0,5 0,6 0,7 0,8 0,9 1 1,1 1,2 1,3 1,4 1,5 2 2,5 3 5 ад'ювант * 5 10 Пригнічення літичної активності QS21 NA < LOD < LOD < LOD 98,2 % > 98 % > 97,8 % > 97,6 % > 97,4 % > 97,2 % > 97 % > 96 % > 95 % > 94 % > 90 % > 98,2 % OD 0,029 0,052 0,073 0,091 0,096 0,12 0,195 0,212 0,348 0,479 0,612 0,669 1,139 1,294 1,391 1,416 0,03 * Перевіряли 50 мкг еквіваленту QS21. 150 мM NaCl буфер. Вищенаведені дані графічно зображені у Фіг. 1. Межа визначення у цьому аналізі була при 0.9 мкг QS21 та OD=0.12. Пригнічення (згашування) активності QS21 у ад'ювантній композиції, що містила 150 мM NaCl було оцінено, як більш, ніж 98.2 % для еквіваленту 50 мкг досліджуваного QS21. У випадку з еквівалентом 90 мкг, результат був більшим, ніж 99 %. Потім пригнічення QS21 порівняли з еквівалентом ад'ювантної композиції, що містить тільки сорбіт та 5 мM NaCl. Дані були отримані після зберігання ASA при 4 °C або після прискорених досліджень на стійкість (7 днів при 37 °C). Для ASA у сорбіті була отримана стандартна крива QS21 у буфері, що містить сорбіт. Зразок ад'ювантна композиція (ASA) 150 мM NaCl ад'ювантна композиція (ASA) сорбіт, 5 мM NaCl 20 25 30 LOD < 1,4 97,2 % > 98,2 % T0 97,8 % 7 днів 37 °C 11 місяців 4 °C 15 Момент часу T0 7 днів 37 °C 97,8 %* Дослідження проводили з еквівалентом 50 мкг QS21, за виключенням *досліджень з еквівалентом 90 мкг QS21. Зроблено висновок, що QS21 належним чином пригнічується в слабкому буфері NaCl. Приклад 4: Конгенери MPL. За своїм хімічним складом, 3D-MPL є сумішшю 3-де-O-ацильованого монофосфорил - ліпіду з переважно 4, 5 або 6 ацильованими ланцюгами. Кожна окрема молекула 3D-MPL має назву конгенера. Важливо те, що конгенерна композиція залишається постійною, без будь-яких зсувів між часткою конгенерів. Також є важливим те, що будь-який застосований буфер дозволяє конгенерній композиції бути такою ж саме, як і у концентрованих ліпосомах, застосованих для отримання ад'ювантної композиції. Як видно на Фіг. 2, конгенерна композиція була перевірена у 3D-MPL концентрованих ліпосомах (концентровані ліпосоми LIP07-217, перша колонка Фіг. 2), у ад'ювантній композиції, що містила 3D-MPL ліпосоми та QS21 у 150 мM NaCl буфері (ад'ювант - 150 мM NaCl або ASA (150 мM NaCl), друга колонка) та у ад'ювантній композиції, що містила 3D-MPL ліпосоми та QS21 у сорбіті та 5 мM NaCl буфер (ад'ювант - сорбіт або ASA (сорбіт), колонки 3-7). Конгенерну композицію також перевірили у двох партіях ад'юванта ASA (сорбіт) у 0 та 7 день після їх отримання зі зберіганням при 37 °C для того, щоб переконатися у відсутності будьяких змінень протягом часу (див.останні чотири колонки Фіг. 2). Відносний розподіл тетра-, пента- та гекса-ацильованих конгенерів MPL у концентрованих ліпосомах або зразках ASA (сорбіт) визначали шляхом іонообмінної ВЕРХ-флуо-хроматографії 16 UA 110806 C2 5 10 15 20 25 30 35 40 45 50 55 60 (ARD). Стандарти та зразки спочатку дериватизували з дансилгідразином, який вводить флуоресцентно – активний хромопор у дисахаридну основу. Дериватизовані зразки аналізували на колонці C18 зі зворотною фазою з застосуванням тетрабутиламоній гідроксиду (TBAOH) у якості іонопарного реагента. Конгенери містять ті ж саме кількості жирних ацильних груп, що були елюйовані у окремих групах (тетраацил, пентаацил та гексаацил). Розподілення конгенерів отримали шляхом порівняння площі піку кожної групи до загальної площі піків всіх MPL конгенерів. У Фіг. 2 наведено відсоток кожного конгенера. Не було виявлено жодної суттєвої різниці у конгенерній композиції серед ад'ювантних буферів та конгенерна композиція залишалася незмінною у сорбітовому буфері протягом часу. Приклад 5: Отримання ад'ювантної композиції ASA (сорбіт - 2). З застосуванням сорбіту у якості ізотонічного агента, у ліпосомному препараті була отримана ад'ювантна композиція, що містила 3-де-O-ацильований монофосфорил - ліпід A та QS21 зі зменшеним порівняно з Прикладом 1 рівнем. Цю композицію отримали наступним чином: Ад'ювант отримали шляхом 1:1 розведення ASA (сорбіт), отриманого відповідно за Прикладом 1 з розчином, що містив 10 мM фосфат, 5 мM NaCl та 4.7 % сорбіт з pH 6.1. Кінцевий препарат ASA (сорбіт – 2) містив 1 мг DOPC, 250 мкг холестерину, 50 мкг/мл 3D-MPL, 50 мкг/мл QS21, 4.7 % сорбіт, 5 мM NaCl та 10 мM фосфат. Приклад 6: Отримання ад'ювантної композиції ASA (сорбіт - 3). З застосуванням сорбіту у якості ізотонічного агента, у ліпосомному препараті була отримана ад'ювантна композиція, що містила 3-де-O-ацильований монофосфорил - ліпід A та QS21 зі зменшеним порівняно з Прикладом 1 рівнем. Цю композицію отримали наступним чином: A. спосіб отримання ліпосом: Суміш ліпіду (DOPC), холестерину та 3-де-O-ацильованого монофосфорил - ліпіду (3D-MPL) у органічному розчиннику піддали вакуумній сушці, після чого додали водний розчин (сольовий розчин, буферизований за допомогою фосфатного буферу [100 мM NaCl, 50 мM фосфату, pH 6.1]) та посудину збовтували до повного суспендування всіх ліпідів. Потім цю суспензію попередньо гомогенізували у змішувачі з високим зрушенням, після чого її гомогенізували під високим тиском до зменшення розмірів ліпосом до приблизно 90 нм ± 10 нм (виміряно за допомогою способу динамічного розсіювання світла (DLS). Далі ліпосоми піддалі стерильній фільтрації. B. Отримання ASA: Для розведення концентрованих ліпосом, десятикратно розбавлений 100 мM Na 2/K фосфатний буфер (pH 6.1) додали до води для ін'єкцій до досягнення концентрації фосфатного буферу у кінцевому препараті у 10 мM, після чого до розчину додали 30 % (ваги/обсягу) розчин сорбіту у воді для ін'єкцій (WFI) до досягнення вмісту сорбіту у кінцевому препараті у 4.7 %. Потім суміш перемішували протягом 15-45 хв. при кімнатній температурі та додали до неї концентровані ліпосоми (отримані з DOPC, холестерину та 3D-MPL з концентраціями 40 мг/мл, 10 мг/мл та 2 мг/мл відповідно) до досягнення концентрації 50 мкг/мл 3D-MPL у кінцевому препараті, після чого суміш перемішували протягом 15-45 хв. при кімнатній температурі. Потім, за допомогою перистальтичної помпи, до розведених ліпосом додали QS21 у сипучому стані з перемішуванням протягом 15 хв. при кімнатній температурі за допомогою магнітної мішалки до досягнення концентрації у 50 мкг/мл у кінцевому препараті. Кінцевий препарат ASA містив 1 мг DOPC, 250 мкг холестерину, 50 мкг/мл 3D-MPL, 50 мкг/мл QS21, 4.7 % сорбіт, 2.5 мM NaCl та 10 мM фосфат. Значення pH, як було перевірено, дорівнювало 6.1±0.1. Стерильну фільтрацію отриманого продукту здійснили за допомогою фільтру з поліефірсульфону (PES) від PALL Corporation, після чого отриману ад'ювантну композицію, що містила 3-де-О-ацильований MPL та QS21 у ліпосомному препараті та сорбіт у якості ізотонічного агента (позначену, як ASA (сорбіт -3)), зберігали при 4 °C. Приклад 7: Отримання ад'ювантної композиції ASA (150 мM NaCl-2). З застосуванням NaCl у якості ізотонічного агента, у ліпосомному препараті була отримана ад'ювантна композиція, що містила 3-де-O-ацильований монофосфорил - ліпід A та QS21 зі зменшеним порівняно з Прикладом 2 рівнем. Цю композицію отримали наступним чином: A. спосіб отримання ліпосом: Суміш ліпіду (DOPC), холестерину та 3-де-O-ацильованого монофосфорил - ліпіду (3D-MPL) у органічному розчиннику піддали вакуумній сушці, після чого додали сольовий розчин, буферизований за допомогою фосфатного буферу [100 мM NaCl, 50 мM фосфату, pH 6.1]) та посудину збовтували до повного суспендування всіх ліпідів. Потім цю суспензію попередньо 17 UA 110806 C2 5 10 15 20 25 30 35 40 45 50 55 60 гомогенізували у змішувачі з високим зрушенням, після чого її гомогенізували під високим тиском до зменшення розмірів ліпосом до приблизно 90 нм ± 10 нм (виміряно за допомогою способу динамічного розсіювання світла (DLS). Далі ліпосоми піддали стерильній фільтрації за допомогою 0.22 мкм PES (поліетилсульфонової) мембрани. B. Отримання ASA: Для розведення концентрованих ліпосом, десятиразово розбавлений 100 мM Na 2/K фосфатний буфер (pH 6.45) та 1.5 M NaCl додали до води для ін'єкцій до досягнення концентрацій фосфатного буферу та NaCl у кінцевому препараті у 10 мM та у 150 мM, відповідно, після чого суміш перемішували протягом 5 хв. при кімнатній температурі та додали до неї концентровані ліпосоми (отримані з DOPC, холестерину та 3D-MPL з концентраціями 40 мг/мл, 10 мг/мл та 2 мг/мл відповідно) до досягнення концентрації 50 мкг/мл 3D-MPL у кінцевому препараті, після чого суміш перемішували протягом 5-15 хв. при кімнатній температурі. Потім до розведених ліпосом додали QS21 у сипучому стані з перемішуванням при кімнатній температурі за допомогою магнітної мішалки до досягнення концентрації у 50 мкг/мл у кінцевому препараті. Значення pH, як було перевірено, дорівнювало 6.1±0.1. Стерильну фільтрацію отриманого продукту здійснили за допомогою фільтру з поліефірсульфону (PES) від PALL Corporation, після чого отриману композицію ASA (150 мM NaCl – 2), що містила 1 мг DOPC, 250 мкг холестерину, 50 мкг 3-де-О-ацильованого MPL, 50 мкг/мл QS21, 10 мM фосфат та 150 мM NaCl зберігали при +2 °C - +8 °C. Приклад 8: Дослідження “ висолювання ” у композиціях, що містили Rv1196 з різними сольовими концентраціями з pH 6.1, 7.5 та 8.5. У цьому Прикладі, за допомогою оцінки за розміром, був досліджений вплив концентрації хлориду натрію та pH на стійкість антигену Rv1196. Отриманий від Corixa Corporation білок Rv1196 (SEQ ID No: 1) розвели до концентрації 100 мкг /мл у трьох різних буферах (10 мM фосфатний буфер з pH 6.1, 20 мM Tris-буфер з pH 7.5 та 20 мM Tris-буфер з pH 8.5), що містили кінцеві концентрації NaCl у 0, 150 та 450 мM. Потім зразки зберігали протягом 24 год. при 4 °C або при 25 °C перед початком аналізу. Нефелометрію проводили з застосуванням приладу Nepheloskan® Ascent від Thermo Fischer Scientific. Аналіз проводили на прозорих для УФ-випромінювання мікропланшетах Costar® від Corning Inc (USA). Аналіз динамічного розсіювання світла (DLS) проводили з застосуванням приладу Dynapro Plate Reader від Wyatt Instruments з лазером з довжиною хвилі 830 нм та потужністю 50 мВт. Розсіяне світло виявляли при 150° з температурою 22 °C. Середній гідродинамічний діаметр та індекс полідисперсності (pI) обчислювали за допомогою програмного забезпечення приладу. Результати цього експерименту наведені у Фіг. 3 та 4. Нефелометрія демонструє загальну тенденцію зникнення прозорості зі збільшенням концентрації солей, вказуючи на те, що Rv1196 є чутливим до концентрації солі. Для більшості зразків DLS, прилад був нездатним визначити точний розмір частинок (позначено, як NV у Фіг. 4). Тим не менш, при отриманні порівняльних даних (тобто 0 або 150 нM NaCl з pH 8.5) стало ясно, що концентрація хлориду натрію впливає на виміряний розмір частинок у імуногенних композиціях Rv1196. Приклад 9: Отримання білкових антигенів M72 з двома N-кінцевими залишками His (SEQ ID No: 7). Для отримання вектора експресії M72, за допомогою послідовного зв'язку в тандемі відкритих рамок зчитування (ORF), що кодують C - кінцевий фрагмент Mtb32a до повнорозмірної ORF Mtb39a, що знаходиться на C – кінці з N – кінцевою часткою Mtb32a, була отримана плазміда, що кодує амінокислотну послідовність Mtb72f з додатковою 6-His міткою на N - кінці. Це було досягнуто шляхом застосування специфічних до послідовностей олігонуклеотидів, що містили унікальні сайти рестрикції (EcoRI та EcoRV) та були позбавлені стоп-кодонів на C - кінцях (у випадку C - кінцевого фрагменту Mtb32a та Mtb39a) для ПЛР геномної ДНК зі штаму H37Rv M. tuberculosis. З застосуванням цього вектора в якості основи, за допомогою сайт-спрямованого мутагенезу була отримана мутація, що полягала у заміщенні серину у положенні 706 на аланін. Належну орієнтацію вставок, а також мутацію Ser706Ala підтвердили шляхом секвенування ДНК. Для отримання вектора, який кодує M72, що має тільки два His – залишка на N – кінці, за допомогою промислової системи сайт-спрямованого мутагенезу було видалено чотири His залишка. Після перевірки послідовності, послідовність, що кодує M72 вирізали з плазміди за допомогою ферментної реакції, очистили у гелі та лігували у вектор pET, після чого була здійснена перевірка послідовності отриманої рекомбінантної плазміди. Ця плазміда кодує M72 під контролем промотора T7. Експресія РНК - полімерази T7 керується з геномного інтегранта у 18 UA 110806 C2 5 10 хазяїні експресії, який індукують з застосуванням системи на основі lac - оперону (lacI) та хімічного сигналу індукції ІПТГ. Експресія плазміди також охоплює експресію гена стійкості до канаміцину. Плазмідою, що кодує злитий білок M72 під контролем промотора T7 за допомогою електропорації трансформували штам HMS174 (DE3) E.coli. Потім було проведено секвенування кодуючої послідовності вставки M72 та фланкуючих ділянок обох ланцюгів та була підтверджена їх тотожність відносно послідовності, що була визначена по оригінальній плазмідній конструкції. Для ферментації, флакон з гранульованим посівним матеріалом піддали відтаванню при кімнатній температурі. Попереднє розведення здійснили шляхом перемішування посівного матеріалу з 4.9 мл прекультурального середовища. 1 мл суміші з попереднього розведення застосували для інокуляції рідкої прекультури, що містила 400 мл прекультурального середовища, доповненого сульфатом канаміцину (50 мг/л) та глюкозою (10 г/л). Композиція прекультурального середовища. 15 Інгредієнт Концентрація KH2PO4 14,83 г/л K2HPO4 1,65 г/л (NH4)2SO4 5,82 г/л дріжджовий екстракт 6,21 г/л 87 % гліцерин (у ваговому 14,54 мл/л співвідношенні) (1) розчин металів та солей : 9,7 мл/л -FeCl3 6H2O 3,3 г/л - MgSO4 7H2O 58 г/л (2) розчин мікроелементів : 116 мл/л - ZnSO4 7H2O - MnSO4 H2O - CuSO4 5H2O - CoCl2 6H2O - H3BO3 - Na2MoO4 2H2O - 4N HCl (2) розчин біотину та CaCl2 : 0,97 мл/л - біотин 0.05 г/л - CaCl2 2 H2O 61.7 г/л pH середовища був доведений до 6,5 розчином NaOH (25 %) Середовище відфільтрували через 0,22 мкм фільтр 20 7,65 г/л 5,28 г/л 1,1 г/л 1,1 г/л 0,3 г/л 2,64 г/л 6,2 мл/л (1) pH був доведений до 1.50 розчином HCl (37 %); розчин відфільтрували через 0.22 мкм фільтр. (2) розчин відфільтрували через 0.22 мкм фільтр. Прекультуру інкубували у двохлітрових колбах на качалці при 30C зі струшуванням (200 об/хв) до досягнення значення оптичної густини у 2-4 при 650 нм (приблизний час інкубування дорівнював 16 год.). На цій стадії, 72 л (загальний обсяг) ферментеру містив 45 л культурального середовища, доповненого сульфатом канаміцину (34 мг/л), інокульованим з 52 мл рідкої прекультури. 25 Композиція культурального середовища Інгредієнт MgSO4 7H2O FeCl3 6H2O (1) розчин мікроелементів : - ZnSO4 7H2O - MnSO4 H2O - CuSO4 5H2O - CoCl2 6H2O - H3BO3 Концентрація 0,63 г/л 0,056 г/л 1,91 мл/л 7,65 г/л 5,28 г/л 1,1 г/л 1,1 г/л 0,3 г/л 19 UA 110806 C2 Композиція культурального середовища Інгредієнт - Na2MoO4 2H2O - HCl 4N HCl 37 % дріжджовий екстракт (NH4)2SO4 KH2PO4 глютамат натрію 87 % гліцерин глюкоза (2) розчин біотину : - біотин CaCl2 2 H2O розчин відфільтрували через 0,22 мкм фільтр, 5 Концентрація 2,64 г/л 6,2 мл/л 0,40 мл/л 35 г/л 2,10 г/л 18,70 г/л 2.5 г/л 0.276 мл/л 20 г/л 0.22 мл/л 1 г/л 0.21 г/л (1) розчин відфільтрували через 0.22 мкм фільтр. (2) розчин відфільтрували через 0.22 мкм фільтр; pH був доведений до 11.0 25 % розчином NaOH Протягом фази зростання, значення pH підтримували у межах 6.8 0.2 шляхом періодичного додавання 25 % NH4OH та 25 % H3PO4 (все - в обсяговому співвідношенні). Після 16-годинного інкубування при 30C було започатковано зростання культури з підживленням у відповідному для такого зростання середовищі. Композиція середовища для зростання з підживленням Інгредієнт Концентрація MgSO4 7H2O 1,98 г/л FeCl3 6H2O 0,178 г/л (1) розчин мікроелементів : 6,02 мл/л - ZnSO4 7H2O - MnSO4 H2O - CuSO4 5H2O - CoCl2 6H2O - H3BO3 - Na2MoO4 2H2O - 4N HCl - 37 % HCl 1,24 мл/л глютамат натрію 5 г/л дріжджовий екстракт 40 г/л 87 % гліцерин 590 мл/л (2) розчин біотину : 2 мл/л - біотин CaCl2 2 H2O 0,66 г/л розчин відфільтрували через 0,22 мкм фільтр, 7,65 г/л 5,28 г/л 1,1 г/л 1,1 г/л 0,3 г/л 2,64 г/л 6,2 мл/л 1 г/л 10 15 20 (1) розчин відфільтрували через 0.22 мкм фільтр. (2) pH був доведений до 11.0 25 % розчином NaOH; розчин відфільтрували через 0.22 мкм фільтр Значення температури підтримували на відмітці 30C ще протягом додаткових двох годин, після чого його підняли до 37C до кінця ферментування. Показник повітряного потоку постійно дорівнював 75 л/хв. та розчинений кисень тримали на рівні 17 % насичення шляхом регулювання струшування та тиску зі зворотним зв'язком. Також, по мірі необхідності, до середовища у маленьких кількостях автоматично додавали розчин агента-піногасника. При досягненні значення оптичної густини у 50 (5) при 650 нм, для індукування експресії M72 до середовища додали 1 мM ізопропіл-бета-D-тіогалактопіранозиду (ІПТГ). Ферментацію закінчили через 5 годин після початку індукування. Клітинну культуру у режимі легкого струшування охолодили до 15C та центрифугували (при 4C) до отримання твердого клітинного осаду, який 20 UA 110806 C2 5 10 15 20 25 30 35 40 45 50 55 60 також спостерігали у аліквотах після зберігання при -20C. Для отримання тілець включень, зібрані гранули клітинного осаду піддали відтаванню при кімнатній температурі та руйнуванню у лізуючому буфері (10 мM Tris, 50 мM NaCl, pH 8.0) за допомогою гомогенізатора з високим тиском, після чого лізати піддали центрифугуванню та отримані гранули клітинного осаду (або тільця включень) промили буфером для промивання, що містив сечовину, Tris та NaCl. Тільця включень розчинили у солюбілізаційному буфері, що містив 8 M сечовину та відфільтрували крізь 0.2 мкм мембрану. Спочатку цей відфільтрований розчин очистили шляхом аніон-обмінної хроматографії з застосуванням колонки Q Sepharose Fast Flow (QSFF). Елюювання M72 проводили за допомогою розчину, що містив 6 M сечовину, 20 мM bis-Tris пропан, 90 мM NaCl, pH 7.0. Зібраний M72 додатково очистили шляхом хроматографії на гідроксиапатиті (HA) та знов елюювали за допомогою розчину, що містив 6 M сечовину, 20 мM bis-Tris пропан, 250 мM NaCl, pH 7.0. Зібрану фракцію концентрували за допомогою мембранної касети (30 кДа) та піддали діафільтруванню проти 20 мM Tris, pH 7.5. Потім M72 стерилізували фільтруванням через 0.22 мкм, очищений матеріал розподілили на аліквоти та зберігали при -70C. Приклад 10: Дослідження “ висолювання ” у композиціях, що містили M72 з різними сольовими концентраціями зі значеннями pH 6.1, 7.5 та 8.5. За допомогою оцінки розмірів та антигенності був досліджений вплив концентрації хлориду натрію та pH на стійкість антигену M72. Очищену масу антигену (M72 з двома N-кінцевими His залишками, SEQ ID No: 7, отриманий, як наведено у Прикладі 9) розчинили до концентрації 100 мкг /мл у трьох різних буферах (10 мM фосфатний буфер з pH 6.1, 20 мM Tris-буфер з pH 7.5 та 20 мM Tris-буфер з pH 8.5) з кінцевими концентраціями NaCl у 0, 50, 150, 300 та 450 мM. Зразки або аналізували негайно (T0) або зберігали перед аналізом протягом ночі при 4 °C (T0 O/N) або зберігали перед аналізом протягом 24 годин при 25 °C (T24h25 °C). DLS проводили за допомогою приладу Malvern Zetasizer Nano ZS від Malvern Instruments (UK), де був застосований лазер потужністю 4 мВт з довжиною хвилі 633 нм. Розсіяне світло визначали під кутом 173° з температурою 22 °C. Z- середній діаметр (Zav) та індекс полідисперсності (pI) обчислювали за допомогою програмного забезпечення приладу. Нефелометрию проводили з застосуванням приладу Nepheloskan® Ascent від Thermo Fischer Scientific. Аналіз проводили на прозорих для УФ-випромінювання мікропланшетах Costar® від Corning Inc (USA). Кількісний аналіз антигенності проводили шляхом сендвіч - ІФА з захоплюванням антигену M72 - специфічними поліклональними антитілами кролів та наступним їх виявленням M72(Mtb39) – специфічними мишачими моноклональними антитілами. Всі виміряні значення наведені відносно очікуваної антигенності на основі застосованої для отримання досліджуваних препаратів очищеної партії білка. Результати цього експерименту, що наведені у Фіг. 5-7 свідчать про те, що спочатку стійкість розчинів, що містять антиген, споріднений з білком Rv1196, особливо M72, є чутливою як до pH, так і до концентрації NaCl. Вплив NaCl на розміри антигену та антигенність стає більш помітним при нижчому значенні pH. При pH 6.1, значення розмірів антигену та антигенності є нестійкими навіть у відсутності NaCl. Додавання 50 мM NaCl при pH 6.1 веде до збільшення розмірів від 35 нм (0 мM NaCl при T0) до 58 нм (T0) або 79 нм через 24 год. при 25 °C. При pH 7.5 або 8.5, розміри антигену та антигенність є відносно стійкими протягом 24 год. при 25 °C, особливо у відсутності NaCl або коли концентрація NaCl дорівнює 50 мM. Проте, підвищення концентрації хлориду натрію до 150 мM або вище веде до явного збільшення розмірів антигену та до зменшення антигенності. Отже, переваги заявленого винаходу поширюються також на послідовності, що містять антигени, споріднені з білком Rv1196, а не тільки на виключно антигенні послідовності Rv1196. Приклад 11: Запобігання “ висолювання ” композицій, що містили M72 та імуностимулятори, де у якості ізотонічного агента було застосовано сорбіт. Для порівняння стійкості імуногенних композицій, що містять 150 мM NaCl з композиціями, де у якості ізотонічного агента застосовано сорбіт, ряд зразків досліджували з застосуванням ексклюзійного ВЕРХ - аналізу та ІФА. Три різних ліофілізованих зразка осаду були отримані таким чином, що при поєднанні з відповідними ад'ювантними препаратами з Прикладів 5 та 7 було отримано бажане значення pH: (a) M72 з двома N-кінцевими His – залишками, бажане значення pH у відновленій вакцині дорівнює 8.5: Розчин цукрози (15.75 % (ваги/обсягу) у воді для ін'єкцій) додали до води для ін'єкцій до 21 UA 110806 C2 5 10 15 20 25 30 35 40 45 50 55 60 досягнення 6.3 % кінцевої концентрації цукрози. Потім до суміші додали розчин Tween 80 (3 % (ваги/обсягу) у воді для ін'єкцій) до досягнення його 0.025 % концентрації, після чого до суміші додали 1 M Tris-буфер -HCl pH 8.8 до досягнення його 50 мM концентрації. Суміш перемішували протягом 5 хв. при кімнатній температурі за допомогою магнітної мішалки, після чого до неї додали очищену партію антигену (M72 з двома N-кінцевими His – залишками (SEQ IDNo:7), отриману, як наведено у Прикладі 9), до досягнення кінцевої концентрації білка у 25 мкг/мл. Потім суміш перемішували протягом 10 хв. при кімнатній температурі за допомогою магнітної мішалки. Перевірене значення pH суміші дорівнювало 8.8. Потім у скляні флакони обсягом 3 мл додали по 0.5 мл отриманої суміші та піддали її ліофілізуванню. (b) M72 з двома N-кінцевими His – залишками, бажане значення pH у відновленій вакцині дорівнює 8.0: Розчин цукрози (15.75 % (ваги/обсягу) у воді для ін'єкцій) додали до води для ін'єкцій до досягнення 6.3 % кінцевої концентрації цукрози. Потім до суміші додали розчин Tween 80 (3 % (ваги/обсягу) у воді для ін'єкцій) до досягнення його 0.025 % концентрації, після чого до суміші додали 1 M Tris-буфер -HCl pH 8.8 до досягнення його 20 мM концентрації. Суміш перемішували протягом 5 хв. при кімнатній температурі за допомогою магнітної мішалки, після чого до неї додали очищену партію антигену (M72 з двома N-кінцевими His – залишками (SEQ ID No:7), отриману, як наведено у Прикладі 9), до досягнення кінцевої концентрації білка у 25 мкг/мл. Потім суміш перемішували протягом 10 хв. при кімнатній температурі за допомогою магнітної мішалки. Перевірене значення pH суміші дорівнювало 8.8. Потім у скляні флакони обсягом 3 мл додали по 0.5 мл отриманої суміш та піддали її ліофілізуванню. (c) M72 з двома N-кінцевими His – залишками, бажане значення pH у відновленій вакцині дорівнює 7.5: Розчин цукрози (15.75 % (ваги/обсягу) у воді для ін'єкцій) додали до води для ін'єкцій до досягнення 6.3 % кінцевої концентрації цукрози. Потім до суміші додали розчин Tween 80 (3 % (ваги/обсягу) у воді для ін'єкцій) до досягнення його 0.025 % концентрації, після чого до суміші додали 1 M Tris-буфер -HCl pH 8.8 до досягнення його 12.5 мM концентрації. Суміш перемішували протягом 5 хв. при кімнатній температурі за допомогою магнітної мішалки, після чого до неї додали очищену партію антигену (M72 з двома N-кінцевими His – залишками (SEQ ID No:7), отриману, як наведено у Прикладі 9), до досягнення кінцевої концентрації білка у 25 мкг/мл. Потім суміш перемішували протягом 10 хв. при кімнатній температурі за допомогою магнітної мішалки. Перевірене значення pH суміші дорівнювало 8.8. Потім у скляні флакони обсягом 3 мл додали по 0.5 мл отриманої суміш та піддали її ліофілізуванню. Вищеописані ліофілізовані зразки осаду були відновлені з застосуванням 625 мкл ад'ювантних розчинів, отриманих у Прикладах 5 та 7. В результаті відновлення ад'ювантними розчинами були отримані наступні імуногенні композиції: (i) M72 з двома N-кінцевими His - залишками – ASA(150 мM NaCl – 2) pH 8.5: 10 мкг антигену (20 мкг/мл) 5 % (ваги/обсягу) цукрози 40 мM Tris 0.02 % (ваги/обсягу) Tween80 500 мкг DOPC 125 мкг холестерину 25 мкг 3D-MPL 25 мкг QS21 150 мM NaCl 10 мM фосфат pH 8.5 (ii) M72 з двома N-кінцевими His - залишками – ASA(150 мM NaCl – 2) pH 8.0 10 мкг антигену (20 мкг/мл) 5 % (ваги/обсягу) цукрози 16 мM Tris 0.02 % (ваги/обсягу) Tween80 500 мкг DOPC 125 мкг холестерину 25 мкг 3D-MPL 25 мкг QS21 22 UA 110806 C2 5 10 15 20 25 30 35 40 45 50 55 60 150 мM NaCl 10 мM фосфат pH 8.0 (iii) M72 з двома N-кінцевими His - залишками – ASA(150 мM NaCl – 2) pH 7.5 10 мкг антигену (20 мкг/мл) 5 % (ваги/обсягу) цукрози 12.5 мM Tris 0.02 % (ваги/обсягу) Tween80 500 мкг DOPC 125 мкг холестерину 25 мкг 3D-MPL 25 мкг QS21 150 мM NaCl 10 мM фосфату pH 7.5 (iv) M72 з двома N-кінцевими His - залишками – ASA (сорбіт – 2) pH 8.5 10 мкг антигену (20 мкг/мл) 5 % (ваги/обсягу) цукрози 40 мM Tris 0.02 % (ваги/обсягу) Tween80 500 мкг DOPC 125 мкг холестерину 25 мкг 3D-MPL 25 мкг QS21 5 мM NaCl 4.7 % (ваги/обсягу) сорбіту 10 мM фосфат pH 8.5 (v) M72 з двома N-кінцевими His - залишками – ASA (сорбіт – 2) pH 8.0 10 мкг антигену (20 мкг/мл) 5 % (ваги/обсягу) цукрози 16 мM Tris 0.02 % (ваги/обсягу) Tween80 500 мкг DOPC 125 мкг холестерину 25 мкг 3D-MPL 25 мкг QS21 5 мM NaCl 4.7 % (ваги/обсягу) сорбіту 10 мM фосфат pH 8.0 (vi) M72 з двома N-кінцевими His - залишками – ASA (сорбіт – 2) pH 7.5 10 мкг антигену (20 мкг/мл) 5 % (ваги/обсягу) цукрози 12.5 мM Tris 0.02 % (ваги/обсягу) Tween80 500 мкг DOPC 125 мкг холестерину 25 мкг 3D-MPL 25 мкг QS21 5 мM NaCl 4.7 % (ваги/обсягу) сорбіту 10 мM фосфат pH 7.5 Характеристичний аналіз вищеописаних відновлених імуногенних композицій проводили після їх зберігання при 25 °C або 30 °C (T0, T6 год. та T24 год.). Ексклюзійний ВЕРХ - аналіз проводили шляхом ін'єкції на колонці TOSOH TSK-Gel5000Pwxl (з внутрішнім діаметром 7.8 мм x 30 cм), врівноваженій 20 мM буфером Tris, pH 8.5, УФ – визначення з довжиною хвилі у 210 нм та швидкістю потоку 0.5 мл/хв. Кількісний аналіз антигенності проводили шляхом сендвіч - ІФА з захоплюванням антигену 23 UA 110806 C2 5 10 15 20 25 30 M72 - специфічними поліклональними антитілами кролів та наступним їх виявленням M72(Mtb39) - специфічними мишачими моноклональними антитілами. Всі виміряні значення наведені відносно очікуваної антигенності на основі застосованої для отримання досліджуваних препаратів очищеної партії білка. Результати наведені у Фіг. 8a-8d та 9. Профілі результатів ексклюзійного ВЕРХ - аналізу залишалися стійкими після відновлення у низькосольових композиціях з застосуванням сорбіту у якості ізотонічного агента з кожним значенням pH (тобто pH 7.5, 8.0 та 8.5). На відміну від цього, профілі результатів ексклюзійного ВЕРХ - аналізу для імуногенних композицій, що містили 150 мM NaCl показали чіткі змінення між отриманим початковим профілем та профілями, отриманими після зберігання композицій при 25 °C або 30 °C. Ці змінення ставали більш інтенсивнішими при зменшенні pH композиції з 150 мM NaCl. Такі ж саме висновки можна зробити відносно антигенності, з відновленнями, що в основному залишалися стійкими після відновлення у низькосольових композиціях з застосуванням сорбіту у якості ізотонічного агента з кожним значенням pH (тобто pH 7.5, 8.0 та 8.5) протягом часу до 24 годин при 30 °C. Приклад 12: Визначення провідності імуногенних композицій винаходу. Була виміряна провідність ряду імуногенних композицій відповідно до заявленого винаходу, яку порівняли з провідністю контрольних розчинів NaCl та імуногенної композиції, що містила обумовлену кількість хлориду натрію. Ряд стандартів, що мали концентрації NaCl, що дорівнювали 0, 75, 100, 150, 250 та 300 мM був отриманий з базового розчину 1500 мM NaCl шляхом розведення у воді для ін'єкцій. Імуногенні композиції отримали з застосуванням M72 з двома N-кінцевими His - залишками відповідно за процедурами, наведеними у Прикладі 9. Для дослідження частки самого антигену та будь-якого з матеріалів залишків у очищеній композиції, також були отримані ліофілізовані зразки осаду плацебо без антигенного компоненту. Дослідження по визначенню провідності проводили за допомогою приладу Malvern Zetasizer Nano з нанесенням 1.5 мл кожного зразка у вигнуті капілярні кювети та застосуванням напруги у 30-150 В (що автоматично визначається приладом). Провідність стандартних розчинів хлориду натрію Концентрація NaCl (мM) 0 75 100 150 250 300 Провідність (мСм/см) 0,0 8,2 10,7 15,6 23,9 30,0 Стандартна крива, отримана на основі цих даних наведена у Фіг. 10 Провідність тестових розчинів 35 Концентрація NaCl (мM) ASA (сорбіт – 2) плацебо pH 8.0 / ASA(сорбіт – 2) M72 pH 8.0 / ASA (сорбіт – 2) плацебо pH 8.5 / ASA (сорбіт – 2) M72 pH 8.5 / ASA (сорбіт – 2) ASA(150 мM NaCl – 2) плацебо pH 8.5 / ASA(150 мM NaCl – 2) M72 pH 8.5 / ASA(150 мM NaCl – 2) 40 Провідність (мСм/см) 5 5 5 5 5 150 150 150 Опис розчину 1,46 1,95 1,96 2,36 2,28 16 14,8 15,3 Еквівалентна концентрація NaCl (мM) 9 14 14 18 17 159 147 152 Як можна побачити з вищенаведених даних, провідність розчинів, де застосовано 150 мM NaCl була значно більшою, ніж провідність розчинів з мінімальним застосуванням NaCl. Вплив антигену та будь-яких компонентів у збагаченій партії був мінімальним, тому що препарати плацебо та препарати, що містили антиген, споріднений з білком Rv1196 мали порівняно аналогічну провідність. Приклад 13: Перевірка імуногенності імуногенних композицій винаходу. 24 UA 110806 C2 5 10 15 20 25 30 35 40 Метою цього прикладу було визначення спроможності змінень препарату зменшувати кількість солі у імуногенних композиціях винаходу з метою підвищення стійкості білка, що впливає на імуногенність в природних умовах. Була проведена оцінка чотирьох імуногенних композицій: 1. M72 з двома N-кінцевими His - залишками pH 8.5/ASA (150 мM NaCl – 2) 2. M72 з двома N-кінцевими His - залишками pH 8.5/ASA (сорбіт – 2) 3. M72 з двома N-кінцевими His - залишками pH 8/ASA (сорбіт – 2) 4. M72 з двома N-кінцевими His - залишками pH 7.5/ASA (сорбіт – 2) Імуногенність цих композицій, що містили антиген досліджували на мишах C57BL/6. Для кожної з чотирьох композицій, 30 мишам C57BL/6 три рази (у 0, 14 та 28 день) внутрішньом'язово шляхом ін'єкції вводили по 1 мкг антигену у 50 мкл ад'ювантного розчину (отриманого, як наведено у Прикладі 11). Викликані M72 - специфічні Т-клітинні відповіді (CD4 та CD8 Т-клітинні відповіді) вимірювали через 6 днів після останньої імунізації (6dPIII). Для визначення M72- специфічних клітинних відповідей, лімфоцити периферичної крові від групи з 30 мишей зібрали та об'єднали у шість наборів по 5 мишей/груп). Лізис еритроцитів проводили перед посівом клітин in vitro. Клітини активували шляхом стимулювання in vitro групою перекриваючихся пептидів (15-мерних пептидів з 11 перекриваючимися амінокислотами з концентрацією 1 мкг/мл/пептид), що охоплювали послідовність M72 (без N-кінцевих His залишків). Клітини, що залишалися у середовищі (без пептидного стимулювання) застосували для визначення фонових відповідей. Через дві години після спільного культивування з набором пептидів, до лунок додали брефелдин (для інгібування цитокінової екскреції) та клітини зберігали протягом ночі при 4 °C. Потім клітини піддали забарвленню для маркерів CD4, CD8, IL-2, IFN-гамма та TNF-альфа. Кожне вимірювання у Фіг. 11 та 12 являє собою M72- специфічну CD4 або, відповідно, CD8 T – клітинну відповідь з вирахуванням фону, отриману з групи лімфоцитів периферичної крові з 5 мишей через 6 днів після третьої імунізації. Відповідь наведена у вигляді відсотка CD4 Т – клітин, що виробляють IFN-гамма та/або IL-2 та/або TNF-альфа у відповідь на стимулювання групою пептидів M72. Рисками позначені середні значення відповідей для кожної групи. Результати, наведені у Фіг. 11 та 12 показали наявність індукування порівняльних CD4 та CD8 Т-клітинних відповідей після трьох імунізацій з кожним тестовим препаратом. Отже, можна зробити висновок, що зменшення кількості солей, присутніх у імуногенних композиціях заявленого винаходу не веде до порушення індукованих Т-клітинних відповідей. Приклад 14: Дослідження “ висолювання ” у композиціях, що містять M72 з CaCl 2 або MgSO4 зі значеннями pH 6.1 та 8.0. Для дослідження впливу інших солей на стійкість антигену M72, були отримані розчини з рядом концентрацій CaCl2 або MgSO4 та з різними значеннями pH. Зчитування даних стійкості проводили шляхом візуального спостереження. Очищену партію антигену (M72 з двома N-кінцевими His - залишками, SEQ ID No: 7) розчинили до концентрації 100 мкг/мл у двох різних буферах (10 мM сукцинатний буфер з pH 6.1 та 10 мM Tris-буфер з pH 8.0), що містили точно визначені кількості солей (0 мM; 150 мM або 300 мM NaCl; 40 мM, 80 мM або 160 мM CaCl2; 87.5 мM, 175 мM або 430 мM MgSO4). Зразки аналізували безпосередньо після отримання. Провідність зразків (по 6 мл кожного зразка у несіліконізованому скляному флаконі) визначали за допомогою кондуктометру від Mettler Toledo. 45 Група A B C D E F Сіль 0 мM 150 мM NaCl 300 мM NaCl 40 мM CaCl2 80 мM CaCl2 160 мM CaCl2 Буфер 10 мM сукцинат 10 мM сукцинат 10 мM сукцинат 10 мM сукцинат 10 мM сукцинат 10 мM сукцинат pH (теоретичне значення) Провідність (мСм/см) (виміряна) pH (виміряне значення) 6,1 1,1 6,3 прозорий 6,1 13,4 6,1 прозорий 6,1 20,0 6,1 прозорий 6,1 8,0 6,1 опалесценція 6,1 11,2 5,8 6,1 20,2 5,8 25 Візуальне спостереження опалесценція + великі частки опалесценція + великі частки UA 110806 C2 Сіль Буфер pH (теоретичне значення) Провідність (мСм/см) (виміряна) pH (виміряне значення) G 87,5 мM MgSO4 10 мM сукцинат 6,1 7,7 6,1 H 175 мM MgSO4 10 мM сукцинат 6,1 12,4 5,9 I 430 мM MgSO4 10 мM сукцинат 6,1 20,4 5,9 0 мM 150 мM NaCl 300 мM NaCl 40 мM CaCl2 80 мM CaCl2 160 мM CaCl2 87,5 мM MgSO4 10 мM Tris 8,0 0,463 8,0 опалесценція + дуже великі частки опалесценція + дуже великі частки прозорий 10 мM Tris 8,0 12,13 8,0 прозорий 10 мM Tris 8,0 21,1 8,0 прозорий 10 мM Tris 8,0 6,7 8,1 великі частки 10 мM Tris 8,0 10,8 8,0 10 мM Tris 8,0 19,7 8,0 10 мM Tris 8,0 7,5 8,0 Група J K L M N O P Q 10 15 20 25 30 10 мM Tris 8,0 10,9 8,2 R 5 175 мM MgSO4 430 мM MgSO4 10 мM Tris 8,0 21,7 8,1 Візуальне спостереження опалесценція опалесценція + великі частки опалесценція + великі частки великі частки опалесценція + дуже великі частки опалесценція + дуже великі частки Результати вказують на те, що розчини, що містять антигени, споріднені з білком Rv1196 можуть бути чутливими до інших, ніж хлорид натрію, солей. Вплив CaCl2 або MgSO4 здається більш виразним, ніж вплив NaCl з порівняльними концентраціями або провідністю. Приклад 15: Дослідження “ висолювання ” у композиціях, що містили Mtb72f з різними сольовими концентраціями та значеннями pH, що дорівнювали 6.1, 7.5 та 8.5. У цьому Прикладі, за допомогою оцінки за розміром, був досліджений вплив концентрації хлориду натрію та pH на стійкість антигену Mtb72f. Очищену партію антигену (Mtb72f з 6 Нis -залишками, SEQ ID No: 11) розчинили до концентрації 100 мкг/мл у трьох різних буферах(10 мM фосфатний буфер, pH 6.1; 20 мM Trisбуфер, pH 7.5 та 20 мM Tris-буфер, pH 8.5), які містили кінцеві концентрації NaCl, що дорівнювали 0, 150 та 450 мM. Зразки перед аналізом зберігали протягом 24 год. при температурі 4 °C або 25 °C. Нефелометрию проводили з застосуванням приладу Nepheloskan® Ascent від Thermo Fischer Scientific. Аналіз проводили на прозорих для УФ-випромінювання мікропланшетах Costar® від Corning Inc (USA). Аналіз динамічного розсіювання світла (DLS) проводили з застосуванням приладу Dynapro Plate Reader від Wyatt Instruments з лазером з довжиною хвилі 830 нм та потужністю 50 мВт. Розсіяне світло виявляли при 150° з температурою 22 °C. Середній гідродинамічний діаметр та індекс полідисперсності (pI) обчислювали за допомогою програмного забезпечення приладу. Результати цього експерименту наведені у Фіг. 13 та 14. Результати, отримані за допомогою аналізу динамічного розсіювання світла (DLS) та нефелометрії демонструють головну тенденцію, яка полягає у тому, що Mtb72f, подібно до M72, наведеного у попередніх прикладах, також є чутливим до сольової концентрації та pH. Отже, переваги заявленого винаходу мають відношення до антигенів, споріднених з білком Rv1196, а не тільки з самою послідовністю Rv1196. У ряді зразків DLS - способу, прилад був нездатним визначити деякі розміри частинок (показано, як NV у Фіг. 14). Приклад 16: Запобігання “ висолювання ” у композиціях, що містять M72 та імуностимулятори з застосуванням сорбіту у якості ізотонічного агента. 26 UA 110806 C2 5 10 15 20 25 30 35 40 45 50 55 60 Для порівняння стійкості імуногенних композицій, що містили 150 мM NaCl з композиціями, де у якості ізотонічного агента був застосований сорбіт, зразки були піддані перевірці з застосуванням альтернативного ІФА. Ліофілізовані зразки осаду отримали, як описано у Прикладі 11 (особливо спосіб (a)) таким чином, щоб у поєднанні з відповідними ад'ювантними препаратами з Прикладу 7 була б отримана суміш з pH 8.5. Вищеописані ліофілізовані зразки осаду були відновлені у 625 мкл ад'ювантних розчинів, отриманих у Прикладі 7. При відновленні з ад'ювантними розчинами були отримані наступні імуногенні композиції: (i) M72 з двома N-кінцевими His - залишками – ASA(150 мM NaCl – 2) pH 8.5 10 мкг антигену (20 мкг/мл) 5 % (ваги/обсягу) цукрози 40 мM Tris 0.02 % (ваги/обсягу) Tween80 500 мкг DOPC 125 мкг холестерину 25 мкг 3D-MPL 25 мкг QS21 150 мM NaCl 10 мM фосфат pH 8.5 (ii) M72 з двома N-кінцевими His - залишками – ASA (сорбіт – 2) pH 8.5 10 мкг антигену (20 мкг/мл) 5 % (ваги/обсягу) цукрози 40 мM Tris 0.02 % (ваги/обсягу) Tween 80 500 мкг DOPC 125 мкг холестерину 25 мкг 3D-MPL 25 мкг QS21 5 мM NaCl 4.7 % (ваги/обсягу) сорбіту 10 мM фосфат pH 8.5 Характеристичний аналіз вищеописаних відновлених імуногенних композицій проводили після їх зберігання при 30 °C (T24 год.), порівнюючи їх з випадково отриманим зразком (Т0). Кількісний аналіз антигенності проводили шляхом непрямого сендвіч - ІФА з захоплюванням антигену M72 - специфічними поліклональними антитілами кролів та наступним їх виявленням M72(Mtb39) – специфічними мишачими моноклональними антитілами. Стисло кажучи, на планшет наносили анти- M72 - специфічні поліклональні антитіла кролів з розведенням 1/8000 у сольовому розчині Дульбекко, буферизованому допомогою фосфатного буферу з наступним інкубуванням при 4 °C протягом ночі. Після чотирьох промивань реакцію на планшетах призупиняли шляхом інкубування протягом години при 37 °C з буфером насичення (PBS, 0.1 % Tween 20, 1 % BSA). Після етапу промивання, білковий стандарт (очищена партія M72: 1950 мкг/мл), внутрішній контроль (M72: 1768 мкг/мл) та зразки нанесли у лунки з першого рядку планшету з концентрацією приблизно у 0.25 мкг/мл, після чого здійснили двократне серійне розведення буфером насичення (PBS, 0.025 % Tween 20) з лунок 1-12 та інкубували зразки протягом 1 год. 30 хв. при 37 °C. Після промивання, імунний комплекс знову інкубували 1 год. при 37 °C з анті-M72 мишачими моноклональними антитілами з розведенням 1/1000 у буфері насичення (PBS, 0.025 % Tween 20). Після чотирьох промивань, до зразків додали біотінільовані анті-мишачі поліклональні антитіла кролів з розведенням 1/1000 у буфері насичення (PBS, 0.025 % Tween 20). Ще після чотирьох промивань, сигнал ампліфікували шляхом додавання комплексу стрептавидин-пероксидаза хріну з розведенням 1/4000 у буфері насичення (PBS, 0.025 % Tween 20). Після чотирьох промивань, сигнал був виявлений за допомогою реакції з орто-фенілен-діамін дигідрохлоридом (OPDA) протягом 15 хв. при кімнатній температурі та реакцію призупинили шляхом додавання 1M HCl. Отримане забарвлення було пропорційним до кількості зв'язаних анти-M72 антитіл та його вимірювали при 490 нм та 620 нм. Всі етапи промивання проводили з застосуванням буферу PBS, 0.025 % Tween 20. Всі виміряні кількості наведені по відношенню до очікуваноїантигенності на основі очищеної партії білка, застосованої для отримання тестових препаратів. Результати наведені у Фіг.15. Ромбами вказані особливі вимірювання для кожного з трьох 27 UA 110806 C2 5 10 15 20 25 тестових зразків, разом з лінією, якою позначено середнє значення. Відновлення антигену після відновлення у низькосольових композиціях з застосуванням сорбіту у якості ізотонічного агента з pH 8.5, що тривало до 24 год. при 30 °C значною мірою було стійким. Відновлення у ASA (сорбіт-2) через 24 год. дорівнювало 83.5 % (T0 87.1 % означає, що підтримується 95.9 % відносної антигенності), у той час, як відновлення у ASA NaCl-2) через 24 год. дорівнювало 54.5 % (T0 81.0 % означає, що після зберігання підтримується тільки 67.3 % відносної антигенності). Таким чином, Приклад 8 вперше демонструє згубний вплив значення pH та концентрації NaCl на стійкість імуногенних композицій, що містять антиген, споріднений з білком Rv1196. Приклад 14 доповнює це, показуючи, що інші солі також можуть негативно впливати на стійкість імуногенних композицій, що містять антиген, споріднений з білком Rv1196. Приклади 10, 11, 12, 15 та 16 демонструють, що цей ефект також може бути застосованим до інших послідовностей. Змінення складу імуногенних композицій з неіонними ізотонічними агентами спрямовано на вирішення проблем стійкості антигену. На додачу до цього, Приклади 3, 4, 13 та 16 демонструють видалення по суті всього NaCl з імуногенного препарату та його заміщення сорбітом у якості ізотонічного агента, що не має шкідливого впливу на стимулювання T – клітинних відповідей. Стійкість імуногенних композицій є ключовим фактором та може бути особливо актуальною у ізольованих місцях, де охолодження не завжди є легко доступним. Шляхом зменшення наявності солей у імуногенних композиціях, автори цього винаходу можуть скоротити обсяг змінень, що відбуваються при зберіганні імуногенних композицій. В описі та у Формулі Винаходу, якщо контекст не вимагає іншого, слово “ включати “ та його варіації, як-то “включає“ та “включає в себе“, слід розуміти як включення зазначеного цілого числа, етапу, групи цілих чисел або групи етапів, але без виключення будь-якого іншого цілогo числа, етапу, групи цілих чисел або групи етапів. Всі згадані тут документи, в тому числі патенти та патентні заявки включені сюди у якості посилання у повному обсязі. 28
ДивитисяДодаткова інформація
Назва патенту англійськоюMycobacterium antigenic composition
Автори англійськоюGodart, Stephane Andre Georges, Laanan, Amina, Lemoine, Dominique Ingrid
Автори російськоюГодарт Стефан Андре Георгес, Ланан Амина, Лемоин Доминик Ингрид
МПК / Мітки
МПК: A61K 39/04, A61P 37/04
Мітки: мікобактеріальна, антигенна, композиція
Код посилання
<a href="https://ua.patents.su/61-110806-mikobakterialna-antigenna-kompoziciya.html" target="_blank" rel="follow" title="База патентів України">Мікобактеріальна антигенна композиція</a>
Попередній патент: Дозуюча головка для дозуючої системи
Випадковий патент: Пристрій для вібраційної діагностики циклічних механізмів