Композиція інсуліну тривалої дії
Номер патенту: 108475
Опубліковано: 12.05.2015
Автори: Рау Харальд, Лессманн Торбен, Каден-Фагт Сільвія, Спрогеє Кеннетт, Херзель Ульріх, Клеєманн Фелікс, Вегге Томас
Формула / Реферат
1. Фармацевтична композиція, що містить сполуку інсуліну в концентрації щонайменше 10 мг/мл, яка характеризується тим, що вона має фармакокінетичний профіль in vivo по суті без викиду сполуки інсуліну, при цьому сполука інсуліну повністю міститься в депо-препараті, і сполука інсуліну ковалентно зв'язана в депо-препараті, де сполука інсуліну являє собою пролікарську сполуку або її фармацевтично прийнятну сіль, що являє собою кон'югат інсуліну з лінкером D-L, в якому
D являє собою молекулу інсуліну; а
-L є біологічно неактивною лінкерною молекулою -L1, представленою формулою (І),
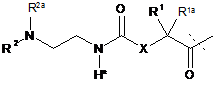 , (І)
, (І)
в якій пунктирна лінія вказує приєднання однієї з аміногруп інсуліну з утворенням амідного зв'язку;
X є C(R3R3a) або N(R3);
R1a, R3a незалежно вибрані з групи, що складається з Н, NH(R2b), N(R2b)C(O)R4 і С1-4алкілу;
R1, R2, R2a, R2b, R3, R4 незалежно вибрані з групи, яка складається з Н і С1-4алкілу,
в якій L1 заміщена одним замісником L2-Z і необов'язково додатково заміщена, за умови, що атом водню, позначений зірочкою у формулі (І), не заміщений замісником, і в якій
L2 є одиночним хімічним зв'язком або спейсером; а
Z є гідрогелем.
2. Фармацевтична композиція за п. 1, що містить сполуку інсуліну в концентрації щонайменше 11 мг/мл, для введення в разовій дозі щонайменше 10 мг сполуки інсуліну.
3. Композиція за будь-яким з пп. 1 або 2, в якій концентрація сполуки інсуліну складає щонайменше 11 мг/мл, наприклад від 11 мг/мл до 35 мг/мл.
4. Композиція за будь-яким з пп. 1-3, яка характеризується тим, що має співвідношення пікової концентрації і залишкової менше 2, наприклад менше 1,75, менше 1,5 або менше 1,25.
5. Композиція за будь-яким з пп. 1-4, яка характеризується постійним вивільненням сполуки структурно інтактного інсуліну протягом всього інтервалу часу між введеннями.
6. Композиція за п. 5, для якої повний інтервал часу між введеннями складає щонайменше приблизно 80 годин, наприклад щонайменше приблизно 110 годин, звичайно щонайменше тиждень.
7. Композиція за будь-яким з пп. 1-6, яка характеризується тим, що її вводять за допомогою ін'єкції, наприклад підшкірної або внутрішньом'язової.
8. Композиція за будь-яким з пп. 1-7, в якій сполука інсуліну вибрана з інсуліну людини, інсуліну гларгін, інсуліну детемір, інсуліну лізпро, інсуліну аспартат, інсуліну глулізин або їх пролікарських сполук.
9. Композиція за будь-яким з пп. 1-8, для якої пікова концентрація досягається в перші 24 години після введення, наприклад в перші 12 годин після введення, наприклад, протягом перших 6 годин після введення.
10. Композиція за будь-яким з пп. 1-9, що додатково містить сполуку GLP-1.
11. Застосування сполуки інсуліну для виготовлення фармацевтичної композиції за будь-яким з пп. 1-10 для лікування або попередження захворювання або розладу, асоційованих з недостатністю інсуліну, лікування або попередження яких з використанням сполуки інсуліну є корисним, таких як гіперглікемія, переддіабет, порушена глюкозотолерантність, діабет І типу, діабет ІІ типу, синдром X.
12. Фармацевтична композиція за будь-яким з пп. 1-10, причому фармацевтична композиція є сухою.
13. Фармацевтична композиція за п. 12, причому фармацевтична композиція висушена за допомогою ліофілізації.
14. Композиція за п. 12 або 13, причому композиція містить дозу пролікарської сполуки інсуліну з гідрогелем, достатню для забезпечення терапевтично ефективної кількості інсуліну протягом щонайменше трьох днів, при одному введенні.
15. Композиція за будь-яким з пп. 1-10, 13-14, причому вона є однодозовою композицією.
16. Композиція за будь-яким з пп. 1-11, 12-14, причому вона є багатодозовою композицією.
17. Композиція за будь-яким з пп. 1-10, 12-16, яка характеризується тим, що вона містить один або декілька додаткових біологічно активних агентів або у вільній формі, або в формі пролікарської сполуки, особливо в формі пролікарської сполуки з гідрогелем; і в якій один або декілька біологічно активних агентів вибрані з групи, яка складається з сульфонілсечовин, таких як, наприклад, хлорпропамід, толазамід, толбутамід, глібурид, гліпізид, глімепірид і т.п.; меглітинідів, таких як, наприклад, репаглінід; глюкагоноподібного пептиду-1 (GLP-1) і його міметиків, глюкозоінсулінотропного пептиду (GIP) і його міметиків, ексендину і його міметиків і інгібіторів дипептилпротеази (DPPIV); бігуанідів, таких як, наприклад, метформін; тіазолідиндіонів, таких як, наприклад, розиглітазон, піоглітазон, троглітазон, ізаглітазон (відомий як МСС-555), 2-[2-[(2R)-4-гексил-3,4-дигідро-3-оксо-2H-1,4-бензоксазин-2-іл]етокси]-бензолоцтова кислота і т.п.; GW2570 і т.п.; модуляторів ретиноїд-Х-рецепторів (RXR), таких як, наприклад, таргретин, 9-цис-ретиноєва кислота і т.п.; інших інсулін-сенсибілізуючих агентів, таких як, наприклад, INS-1, інгібітори PTP-1B, інгібітори GSK3, інгібітори глікоген-фосфорилази, інгібітори фруктозо-1,6-бісфосфатази і т.п.; інсулінів, включаючи регулярний або короткої дії, середньої тривалості дії і пролонгованої дії, інгаляційний інсулін і аналоги інсуліну, такі як молекули інсуліну з мінімальними відмінностями в природній амінокислотній послідовності; низькомолекулярних міметиків інсуліну, що включають, але не обмежених цим, L-783281, ТE-17411 і т.п.; інгібіторів Na-глюкозного ко-транспортера, таких як Т-1095, Т-1095 А, флоризин і т.п.; агоністів аміліну, які включають, не обмежуючись цим, прамлінтид і т.п.; антагоністів глюкагону, таких як AY-279955 і т.п.; агентів проти ожиріння, таких як орлістат, інгібітор панкреатичної ліпази; сибутрамін; норепінефрин і допамін; гормон росту, IGF-1, рилізинг-фактор гормону росту; оксинтомодулін і модулятори греліну; сполук, які пригнічують апетит, таких як бензфетамін, фенметразин, фентермін, діетилпропіон, мазиндол, сибутрамін, фенілпропаноламін або ефедрин; агентів, які пригнічують апетит, таких як квіпазин, флуоксетин, сертралін, фенфлурамін або дексфенфлурамін; агентів, які пригнічують апетит, таких як апоморфін; агентів, які пригнічують апетит, таких як гістамінові міметики, модулятори Н3-рецептора; підсилювачів енергозатрат, таких як бета-3 адренергічні агоністи і стимулятори функцій роз'єднуючих білків; лептину і лептинових міметиків (наприклад, метрелептину); антагоністів нейропептиду Y; модуляторів рецепторів меланокортину-1, -3 і -4; агоністів холецистокініну; міметиків і аналогів глюкагоноподібного пептиду-1, як, наприклад, Ексендин; андрогенів, таких як дегідроепіандростерон, і похідних, таких як етіохоландіон; тестостерону; анаболічних стероїдів, таких як оксандролон і стероїдні гормони; антагоністів галанінових рецепторів; цитокінів, таких як циліарний нейротропний фактор; інгібіторів амілази.
18. Фармацевтична композиція за будь-яким з пп. 1-10, 12-15, що знаходиться в контейнері.
19. Фармацевтична композиція за п. 18, причому контейнер являє собою двокамерний шприц.
20. Суспензія, що містить фармацевтичну композицію за будь-яким з пп. 1-10, 13-18.
21. Спосіб отримання суспензії за п. 20, що включає стадії відновлення сухої фармацевтичної композиції за п. 12 або 13 шляхом додавання розчину для відновлення.
22. Набір, що включає фармацевтичну композицію за будь-яким з пп. 1-10, 12-17 і контейнер для введення композиції.
23. Набір, що включає голку і контейнер, що містить розчин для відновлення, і суху композицію за п. 12 або 13 для застосування з голкою.
24. Набір за п. 23, в якому контейнером є двокамерний шприц, і в якому одна з двох камер двокамерного шприца містить розчин для відновлення.
25. Набір за будь-яким з пп. 22-24, в якому композицію можна вводити за допомогою ін'єкції через голку.
26. Набір за п. 25, в якому внутрішній діаметр голки менший 300 мкм.
27. Набір за п. 25, в якому внутрішній діаметр голки менший 225 мкм.
28. Набір за п. 25, в якому внутрішній діаметр голки менший 175 мкм.
Текст
Реферат: Винахід стосується фармацевтичної композиції, що містить сполуку інсуліну в концентрації щонайменше 10 мг/мл, яка характеризується тим, що вона має фармакокінетичний профіль in vivo по суті без викиду сполуки інсуліну, при цьому сполука інсуліну повністю міститься в депопрепараті. UA 108475 C2 (12) UA 108475 C2 UA 108475 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки Даний винахід стосується фармацевтичної композиції, що містить сполуку інсуліну, застосування композиції, способу лікування, набору, а також комбінованого лікування зі сполукою GLP-1, такою як агоніст GLP-1. Фармацевтичну композицію можна вводити менш часто відносно існуючих препаратів інсуліну тривалої дії, і вона відрізняється вивільненням структурно інтактного інсуліну протягом всього періоду часу між введення по суті без викиду сполуки інсуліну. Цей метод лікування може допомогти пацієнтам знизити частоту ін'єкцій, зберігаючи при цьому можливість оптимального контролю рівня інсуліну в плазмі і, відповідно, рівня глюкози в крові. Передумови створення винаходу Лікування інсуліном характеризується тим, що вивільнення препарату інсуліну необхідно підтримувати в дуже обмеженому діапазоні концентрацій через вузьке "терапевтичне вікно", а побічні ефекти гіперінсулінемії потенційно небезпечні для життя. У продажу є множина препаратів інсуліну з різними профілями дії, що задовольняють певні потреби популяції людей з діабетом. Швидкодіючі аналоги інсуліну вводять безпосередньо перед їжею для контролю пікових концентрацій глюкози в плазмі після прийняття їжі, в той час як аналоги інсуліну тривалої дії звичайно приймаються один або два рази на день для забезпечення постійного базального рівня інсуліну. Сучасні розробки також включають пероральний інсулін і інгаляційний інсулін. Однак внаслідок того, що інсулін являє собою білок, при пероральному прийомі він легко розщеплюється в шлунку і шлунково-кишковому тракті. Як альтернатива, протягом короткого періоду часу в продажу був доступний інгаляційний інсулін, що вводиться в легені за допомогою інгалятора (Ексубера®, компанія Pfizer припинила його випуск в 2007 році). Цей склад забезпечував інсулін протягом тривалого періоду часу (години), але проте вимагав введення пацієнтами базального інсуліну тривалої дії за допомогою ін'єкцій. Інші недоліки інгаляційного інсуліну включали складність виготовлення, що приводить до непомірно дорогої системи доставки. У результаті всі доступні в продажу склади інсуліну необхідно вводити за допомогою ін'єкцій, підшкірних або внутрішньовенних. Різні доступні в продажу інсуліни відрізняються різними профілями їх концентрації в плазмі. Вказані профілі концентрації в плазмі можна описати як профілі з максимальною і мінімальною концентрацією в плазмі, які залежать від складу і типу використовуваного інсуліну. Для того, щоб було можливо прогнозувати ефект зниження рівня глюкози в плазмі в результаті дії введеного інсуліну, дуже важливо отримати профіль концентрації в плазмі, що відтворюється як від пацієнта до пацієнта, так і у одного пацієнта. Крім того, при багаторазовому введенні базального інсуліну, бажано, щоб відмінність між максимальною і мінімальною концентрацією в плазмі було мінімально можливою. Це приводить до більш постійної концентрації інсуліну в плазмі, і, тому, до більш уніфікованого ефекту зниження рівня глюкози протягом всього інтервалу дозування. Існуюча на сьогоднішній день базальна інсулінова терапія складається з щоденного введення або введення двічі на день базальних інсулінів тривалої дії, таких як NPH-інсулін, інсулін гларгін або інсулін детемір. Хоча при розробці нових інсулінових аналогів метою було зниження варіабельності інсулінотропних ефектів, ефект зниження рівня глюкози у цих складів тривалої дії все ще відрізняється сильною варіабельністю як у окремих суб'єктів, так і між ними, що описано в роботі Heise et al. (Diabetes, 2004 (53), 1614-1620). У цьому дослідженні інсулін детемір виявляв найменшу фармацевтичну варіабельність з коефіцієнтом варіабельності (CV) 15 в порівнянні з CV для NPH-інсуліну і інсуліну гладрину, що становлять 26 і 34, відповідно. Ця досить висока варіабельність є основною перешкодою до досягнення оптимального контролю рівня глюкози, оскільки важко передбачити рівень доступності інсуліну. У цьому ж дослідженні вивчали фармакодинамічну варіабельність, що оцінюється по швидкості інфузії глюкози (GIR). У цьому дослідженні також було продемонстровано, що інсулін детемір мав меншу варіабельність у індивідуальних суб'єктів в порівнянні з NPH-інсуліном і інсуліном гладрин відносно фармакодинамічного маркера - GIR. Крім того, в цьому дослідженні було продемонстровано, що ефект інсуліну на швидкість інфузії глюкози не тривав протягом всього періоду дозування 24 годин, що вказує на явну необхідність в інсуліні тривалої дії, який буде повноцінно знижувати рівень глюкози протягом всього інтервалу часу між дозами. Щоб подолати проблему того, що існуючі базальні інсуліни для щоденного прийому не діють протягом 24 годин, деякі пацієнти розбивають своє дозування базального інсуліну на дві щоденні ін'єкції для кращого контролю рівня глюкози протягом дня. Тому, очевидно необхідні нові препарати інсуліну тривалої дії, які постійно вивільняють інсулін протягом всього періоду часу між введеннями препарату. 1 UA 108475 C2 5 10 15 20 25 30 35 40 45 50 55 Крім того, навіть якщо пацієнти можуть регулювати свій рівень глюкози в крові за допомогою щоденних ін'єкцій базального інсуліну, то через щоденні ін'єкції вони чинять опір початку інсулінової терапії. Це є небажаним, оскільки Американська Асоціація Діабету (ADA) і Європейська Асоціація по Дослідженнях Діабету (EASD) називають інсулін препаратом першої лінії після перорального метформіну, як забезпечуючий найкращий результат лікування (DM Nathan et al., Diabetologica (2008) 51: 8-11). При зниженні частоти введення інсуліну вірогідне зниження фізіологічного бар'єра перед початком інсулінової терапії, що дає можливість пацієнтам почати терапію інсуліном на більш ранній стадії і значно поліпшує їх стан здоров'я. Проблема при розробці складів базального інсуліну тривалої дії полягає у вузькому терапевтичному діапазоні концентрацій інсуліну і високому співвідношенні між максимальною і мінімальною концентраціями в фармакокінетичному профілі інсуліну, крім того, у всіх випадках необхідно уникати викиду інсуліну. Для зниження частоти введення із збереженням вивільнення інсуліну у вузькому діапазоні концентрацій були запропоновані декілька підходів, але вони не збільшували тривалість ефекту зниження рівня глюкози більше ніж на пару днів, хоча відрізнялися низьким співвідношенням між максимальною і мінімальною концентрацією інсуліну в плазмі. У публікації WO 06003014 описаний здатний вивільняти інсулін гідрогель з можливістю зниження частоти дозування в порівнянні зі стандартними щоденними ін'єкціями базального інсуліну. Однак вивільнення інсуліну відбувається з дуже великою швидкістю для гарантії жорсткого інсулінотропного контролю протягом періодів часу більше 2 днів. Насправді, час вивільнення інсуліну складає приблизно 30 годин, тому, пролікарську сполуку необхідно вводити щонайменше кожні 30 годин для того, щоб співвідношення між максимальною і мінімальною концентраціями було нижчим ніж 2 в рівноважному стані. Концепція отримання оборотного полімерного кон'югату інсуліну досліджувалася групою Shechter і інш. і описана в наукових статтях і патентних заявках (наприклад, в European Journal of Pharmaceutics and Biopharmaceutics 2008(70), 19-28 і WO 2004/089280). Інсулін кон'югований з ПЕГ-полімером 40 кДа через спейсерну молекулу 9-гідроксиметил-7-(аміно-3малеімідопропіонат)-флуорен-N-гідроксисукцинімід. Гідроліз вказаної спейсерної молекули вивільняє інсулін з часом півжиття приблизно 30 годин, тобто пролікарську сполуку необхідно вводити щонайменше кожні 30 годин, для того, щоб співвідношення між максимальною і мінімальною концентраціями було нижчим ніж 2 в рівноважному стані. Були проведені інші спроби зниження частоти дозування інсуліну. Групою Hinds і інш. (Journal of Controlled Release, 2005 (104), 447-460) був описаний спосіб отримання інсуліну для введення один раз на тиждень, в результаті початкового безповоротного ПЕГилювання молекули інсуліну і потім подальшого вміщення ПЕГільованого інсуліну в мікрокапсули (в PLGAмікрочастинки). Було показано, що вміщення білків в PLGA викликає побічні реакції складного ефіру полімеру з аміногрупами пептиду або білка. Після впливу на склади буферних розчинів з нейтральним рН спостерігалися продукти ацилування молочної кислоти. (Nat. Biotechnol. 18 (2000) 52-57; Pharm. Res. 11 (1994) 865-868; Pharm. Res. 19 (2002) 175-181). Конкретно у випадку інсуліну був продемонстрований негативний вплив полімерних складів (Pharm. Dev. Technol. 4 (1999) 633-642; Pharm. Dev. Technol. 5 (2000) 1-9). У вказаному вище випадку інсулін піддався значним структурним змінам в результаті перманентної модифікації високомолекулярним полімером, оскільки ПЕГилювання інсуліну, мабуть, служить для захисту пептиду від руйнування в складі PLGA-полімеру. На жаль, такі високомолекулярні інсуліни можуть виявляти меншу ефективність в результаті послаблення зв'язування з рецепторами, а також можуть давати реакцію в місці ін'єкцій, таку як ліподистрофія, внаслідок більш тривалої присутності високих концентрацій високомолекулярного інсуліну в підшкірній тканині. Крім того, такі ПЕГильовані інсуліни будуть мати менший об'єм розподілу, що є значним недоліком в лікуванні діабету. Крім того, фармакокінетичний профіль кон'югату інсуліну, що вивільняється, відрізняється початковим викидом безпосередньо після введення, за яким йде падіння концентрації кон'югату інсуліну в плазмі з подальшим збільшенням концентрації кон'югату інсуліну в плазмі протягом наступних днів. Цей фармакокінетичний профіль типовий для мікрокапсулованих складів лікарських засобів і може привести до непрогнозованої реакції на глюкозу у суб'єктів, які одержують лікування таким складом. Тому залишається проблемою розробка інсуліну тривалої дії без порушення фармакодинаміки інсуліну в результаті перманентного приєднання високомолекулярної сполуки. 2 UA 108475 C2 5 10 15 20 25 30 35 40 45 50 55 Ситуація додатково ускладнюється тим, що інсулін легко вступає в побічні реакції, що пов'язано з присутністю в його молекулі трьох дисульфідних зв'язків. Наприклад, інсулін може розбиватися на А і В-ланцюги в результаті розщеплення дисульфідних зв'язків, або можуть формуватися димери або олігомери внаслідок обмінних реакцій між дисульфідними групами. Таке "перетасовування" дисульфідних зв'язків особливо вірогідне, якщо молекули інсуліну примусово знаходяться в близькому контакті випадковим чином ("Stability of insulin: studies on the physical and chemical stability of insulin in pharmaceutical formulation", Jens Brange, Springer, 1994). Така природна лабільність молекули інсуліну істотно утрудняє прогрес в розробці депоскладів тривалої дії і не дозволяє використовувати інші полімерні склади, в яких інсулін поміщений в форму, подібну до аморфного осаду, який, як відомо, дає різні продукти деградації, виникаючі в результаті інтенсивних реакцій обміну між дисульфідними групами. На швидкість побічних реакцій додатково впливає концентрація інсуліну - швидкість підвищується при високій концентрації інсуліну. Тому, проблемою є отримання складів з високою концентрацією інсуліну тривалої дії, в яких інсулін не піддається небажаним побічним реакціям. Тому, існує явна необхідність в нових препаратах інсуліну тривалої дії, які постійно вивільняють структурно інтактний інсулін протягом всього періоду часу між введеннями препарату і, крім того, зберігають низьке співвідношення між максимальною і мінімальною концентрацією інсуліну в плазмі для виключення дуже високих або дуже низьких концентрацій інсуліну, потенційно шкідливих для пацієнта. Кількість інсуліну, необхідна пацієнтам з діабетом, є вельми індивідуальною, причому доза залежить від декількох фізіологічних факторів, включаючи функцію панкреатичних бета-клітин, чутливість до інсуліну, масу тіла і харчовий раціон. Досить часто пацієнтам потрібно 40 МЕ інсуліну (або більше) на день. Це дорівнює 280 МЕ на тиждень, що відповідає 12,6 мг інсуліну людини на тиждень. Для мінімізації дискомфорту у пацієнта ця кількість повинна бути введена в маленькому об'ємі, наприклад, одному мілілітрі. Тому, задача даного винаходу стосується складу інсуліну, в якому концентрація інсуліну складає щонайменше 10 мг/мл, що одночасно вивільняє структурно інтактний інсулін і має фармакокінетичний профіль по суті без викиду інсуліну. Крім того, в результаті вищезгаданого, задача даного винаходу полягає в можливості введення однієї дози інсуліну тривалої дії у вигляді однієї ін'єкції складу, що містить щонайменше 10 мг сполуки інсуліну. У US2007/0207210 A1 описаний спосіб отримання аморфних мікрочастинок високомолекулярних білків і, зокрема, антитіл. Згідно з описом в прикладі згадають інсулін, введений в склад в концентрації до 400 мг/мл. Однак задача винаходу стосується складу з фармакокінетичним профілем, аналогічного нативному білку, тобто не стосується пролонгованого вивільнення. Тому, US2007/0207210 A1 не пропонує рішення зниження частоти введення інсуліну. Визначення Нижче в даному документі викладені деякі визначення, важливі для розуміння даного винаходу. Передбачається, що використовуваний в даному документі термін « по суті немає викиду" або "по суті без викиду" (обидва терміни використовуються взаємозамінно в даному описі) означає, що після введення сполуки інсуліну, яка може являти собою пролікарську сполуку або діючу сполуку інсуліну, співвідношення пікової концентрації детектованої сполуки інсуліну в плазмі крові протягом перших 48 годин після введення, наприклад, підшкірного або внутрішньом'язового, до мінімальної концентрації детектованої сполуки інсуліну в плазмі крові після пікової концентрації протягом перших 48 годин після введення складає менше 2 (по суті немає детектованого викиду), переважно менше 1,5 (немає детектованого викиду). Передбачається, що використовуваний в даному документі термін "викид" означає, що після введення сполуки інсуліну, яка може являти собою пролікарську сполуку або діючу сполуку інсуліну, співвідношення пікової концентрації детектованої сполуки інсуліну в плазмі крові протягом 48 годин після введення, наприклад, підшкірного або внутрішньом'язового, до мінімальної концентрації детектованої сполуки інсуліну в плазмі крові після пікової концентрації протягом 48 годин після введення становить 2 або вище. Відносно детекції сполуки інсуліну в плазмі крові, така сполука інсуліну може являти собою структурно інтактну форму введеної сполуки інсуліну, або у випадку коли введена сполука інсуліну являє собою пролікарську сполуку, детектованою сполукою інсуліну буде інтактна сполука інсуліну, що вивільняється з пролікарської сполуки, наприклад, інсулін людини, аналоги інсуліну, похідне інсуліну і їх фрагменти. 3 UA 108475 C2 5 10 15 20 25 30 35 40 45 50 55 Передбачається, що використовуваний в даному документі термін "сполука GLP-1" означає будь-яку сполуку GLP-1, наприклад, GLP-1(7-37), GLP-1(7-36)NH2 і аналог GLP-1, включаючи агоніста GLP-1. Прикладами агоністів GLP-1, що використовуються в даному винаході, є агоністи GLP-1, ексендину-3 або ексендину-4, в тому числі без обмежень: (i) аналоги ексендину-4 і амідовані аналоги ексендину-4, в послідовностях яких один або декілька амінокислотних залишків були замінені іншими амінокислотними залишками, включаючи N-кінцеві модифікації, (ii) укорочений ексендин-4 і амідовані укорочені форми, (iii) укорочений ексендин-4 і амідовані укорочені форми, в послідовностях яких один або декілька амінокислотних залишків були замінені іншими амінокислотними залишками, (iv) GLP-1 і амідований GLP-1, (v) аналоги GLP-1 і амідовані аналоги GLP-1, в послідовностях яких один або декілька амінокислотних залишків були замінені іншими амінокислотними залишками, включаючи Nкінцеві модифікації, (vi) укорочений GLP-1 і амідовані укорочені форми, (vii) укорочений GLP-1 і амідовані укорочені форми, в послідовностях яких один або декілька амінокислотних залишків були замінені іншими амінокислотними залишками, (viii) відомі речовини AVE-0010(ZP-10) (Sanofi-Aventis Zealand Pharma), BAY-73-7977 (Bayer), TH-0318, BIM-51077 (Ipsen, Tejin, Roche), NN-2211 (Novo Nordisk), LY315902. Агоністи GLP-1 імітують функції нативного GLP-1, в результаті зв'язування рецепторів, на які чинить дію GLP-1, що є корисним як інсулінотропний, а також при лікуванні цукрового діабету, або в результаті імітації ефектів ексендину на виділення сечі, сповільнення евакуації вмісту шлунка, підвищення почуття ситості, підвищення виведення натрію з сечею і/або зниження концентрації калію в сечі в результаті зв'язування рецептора(ів), через які ексендин здійснює цю дію. Передбачається, що використовуваний в даному документі термін "відношення пікової концентрації до залишкової" означає співвідношення між максимальною концентрацією в плазмі і мінімальною концентрацією в плазмі сполуки інсуліну, наприклад, інсуліну людини, в заданий період часу між введеннями. Передбачається, що використовуваний в даному документі термін "структурно інтактна сполука інсуліну" означає інтактний інсулін, що складається з двох пептидів, що називаються А і В-ланцюгами, з'єднаними двома дисульфідними містками. Крім того, А-ланцюг містить внутрішньомолекулярний дисульфідний місток. Втрата внутрішньо- або міжмолекулярних дисульфідних містків або перестановка двох ланцюгів, наприклад, А-А або В-В гомодимери, можуть викликати інактивацію інсуліну. Структурну цілісність вимірюють, розщеплюючи інсулін відповідною ендопротеазою, наприклад, ендопротеїназою Glu-C, і аналізуючи отримані фрагменти за допомогою мас-спектрометрії. Відсутність сигналів, що виникають від одиничних інсулінових ланцюгів, вказує на інтактний інсулін. Передбачається, що використовуваний в даному документі термін "пролікарська сполука" означає сполуку інсуліну, яка піддається біотрансформації перед виявом своїх фармакологічних ефектів. Тому, пролікарські сполуки можна розглядати як біологічно активні залишки, що містять спеціалізовані нетоксичні захисні групи, що використовуються тимчасово для зміни або усунення небажаних властивостей вихідної молекули. Наприклад, пролікарською сполукою може бути біогідролізований амід і біогідролізований складний ефір, а також це поняття охоплює: а) сполуки, в яких біогідролізована функціональна група в такій пролікарській сполуці включена в сполуку, і b) сполуки, які можуть біологічно окиснюватися або відновлюватися по даній функціональній групі. Типові пролікарські сполуки можуть являти собою пов'язану з носієм пролікарську сполуку, що містить тимчасовий зв'язок даної діючої речовини з тимчасовою групою носія, яка забезпечує поліпшені фізико-хімічні або фармакокінетичні властивості, і яка легко видаляється in vivo, звичайно в результаті гідролітичного розщеплення; або це може бути каскадна пролікарська сполука, для якої відщеплення носія стає ефективним тільки після демаскування активуючої групи. Для посилення фізико-хімічних або фармакокінетичних властивостей лікарської сполуки, наприклад, інсуліну, таку лікарську сполуку можна кон'югувати з носієм. Якщо лікарську сполуку транзієнтно з'єднану з носієм і/або лінкером, то такі системи звичайно називають пов'язані з носієм пролікарські сполуки. По визначенню, даному IUPAC (цитата з http://www.chem.qmul.ac.uk/iupac.medchem, за станом на 22 липня 2009 року), пов'язана з носієм пролікарська сполука являє собою пролікарську сполуку, яку містить тимчасовий зв'язок даної діючої речовини з транзієтною групою-носієм, яка забезпечує поліпшені фізико-хімічні або 4 UA 108475 C2 5 10 15 20 25 30 35 40 45 50 55 60 фармакокінетичні властивості, і яка легко видаляється in vivo, звичайно в результаті гідролітичного розщеплення. Лінкер, що використовуються в таких пов'язаних з носіями пролікарських сполуках є транзієнтними, тобто вони гідролітично деградують (розщеплюються) без залучення ферментів при фізіологічних умовах (водний буфер при рН 7,4, 37 °C) з часом півжиття в діапазоні, наприклад, від однієї години до трьох місяців. Прийнятними носіями є полімери, і вони можуть бути або кон'юговані з лінкером напряму, або через нерозщеплюваний спейсер. "Пролікарська сполука інсулін-гідрогелю" стосується пролікарської сполуки, в якій інсулін транзієнтно з'єднаний з гідрогелевим носієм. Терміни "гідрогелева пролікарська сполука" і "пов'язана з гідрогелем пролікарська сполука" належать до пролікарських сполук біологічно активних агентів, транзієнтно пов'язаних з гідрогелем, і використовуються як синоніми. Терміни "лікарська сполука", "біологічно активна молекула", "біологічно активна частина молекули", "біологічно активний агент", "діючий агент" і т. п. означають будь-яку речовину, яка може впливати на фізично або біохімічні властивості біологічного організму, включаючи без обмежень, віруси, бактерії, гриби, рослини, тварин і людину. Зокрема, біологічно активні молекули, що використовуються в даному винаході, включають будь-яку речовину, призначену для діагностики, лікування, пом'якшення, лікування або попередження захворювання у людини або тварин, або в іншому випадку - для посилення фізичного або душевного здоров'я людини або тварини. Використовуваний в даному документі вираз "терапевтично ефективна кількість" інсуліну означає кількість, достатню для лікування, послаблення або часткової зупинки клінічних виявів даного захворювання або його ускладнень. Кількість, достатню для цього, визначають як "терапевтично ефективну кількість". Ефективна кількість для кожної мети буде залежати від тяжкості захворювання або ураження, а також від маси і загального стану суб'єкта. Зрозуміло, що відповідне дозування можна визначити з використанням стандартних експериментів шляхом створення матриці значень і тестування різних елементів в матриці, що входить в компетенцію досвідченого терапевта. "Стабільний" і "стабільність" означає, що в межах вказаного часу зберігання кон'югати залишаються кон'югованими і не гідролізуються значною мірою, а також мають прийнятний склад домішок відносно інсуліну. Стабільною вважається композиція, що містить менше 5 % лікарської сполуки у вільній формі. Використовуваний в даному документі термін "біогідролізований складний ефір" являє собою складний ефір сполуки, який або (а) не порушує біологічну активність вихідної речовини, але надає даній речовині переважних властивостей in vivo, таких як тривалість дії, початок дії і т. п., або b) є біологічно неактивним, але легко перетворюється in vivo суб'єктом в біологічно активне начало. Використовуваний в даному документі термін "біогідролізований амід" являє собою амід сполуки, який або (а) не порушує біологічну активність вихідної речовини, але надає даній речовині переважних властивостей in vivo, таких як тривалість дії, початок дії і т. п., або b) є біологічно неактивним, але легко перетворюється in vivo суб'єктом в біологічно активне начало. Передбачається, що використовуваний в даному документі термін "гідрогель" означає тривимірну, гідрофільну або амфіфільну полімерну сітку, здатну поглинати велику кількість води. Мережі складатися з гомополімерів або співполімерів, є нерозчинними внаслідок присутності ковалентних хімічних або фізичних (іонних, гідрофобних взаємодій, переплетень) зшивань. Зшивання забезпечують структуру мережі і фізичну цілісність. Гідрогелі виявляють термодинамічну сумісність з водою, яка дозволяє їм набухати у водному середовищі. Ланцюги з'єднані в мережі, утворюючи пори, і розмір значної частини даних пор знаходиться між 1 нм і 1000 нм. Термін "гель" стосується незшитого, гелеподібного розчину полімеру. Передбачається, що використовуваний в даному документі термін "депо-препарат" означає систему доставки для лікарського сполуки інсуліну, що звичайно вводиться за допомогою підшкірної або внутрішньом'язової ін'єкції і здатну до постійного вивільнення діючої сполуки протягом тривалого періоду часу. Передбачається, що використовуваний в даному документі термін "пікова концентрація" означає максимальну концентрацію, отриману після введення сполуки інсуліну. Передбачається, що використовуваний термін "сполука інсуліну" означає будь-який інсулін ссавців, наприклад, інсулін людини, свинячий інсулін або бичачий інсулін з дисульфідними містками між CysA7 і CysB7 і між CysA20 і CysB19, а також з внутрішньомолекулярним дисульфідним містком між CysA6 і CysA11, рекомбінантний інсулін ссавців, наприклад, 5 UA 108475 C2 5 10 15 20 25 30 35 40 45 50 55 60 рекомбінантний інсулін людини, аналоги інсуліну, похідне інсуліну і їх фрагменти, типовими прикладами є rh інсулін, інсулін гларгін, інсулін детемір, інсулін глулізин, інсулін аспартат, інсулін лізпро, інсулін, кон'югований з низькомолекулярним ПЕГ, де низькомолекулярний ПЕГ має молекулярну масу меншу 10 кДа. Сполука інсуліну може знаходитися в формі пролікарської сполуки, у випадку якої сполука, що вивільняється в плазму, є активним інсуліном, що утворюється після введення пролікарської сполуки. Під "аналогом інсуліну", що використовується в даному винаході, розуміється поліпептид, що має молекулярну структуру, яку формально можна отримати з структури природного інсуліну, наприклад, інсуліну людини, в результаті видалення і/або заміни щонайменше одного амінокислотного залишку, присутнього в природному інсуліні, і/або в результаті додавання щонайменше одного амінокислотного залишку. Амінокислотні залишки, що додаються і/або використовуються для заміни, можуть являти собою або амінокислотні залишки, що кодуються, або інші природні залишки, або чисто синтетичні амінокислотні залишки. Аналогами інсуліну можуть бути білки, в яких природний залишок Pro в позиції 28 в Вланцюга може бути змінений на один з Asp, Lys або Ile. У іншому аспекті Lys в позиції B29 змінений на Pro. Також Asn в позиції A21 може бути змінений на Ala, Gln, Glu, Gly, His, Ile, Leu, Met, Ser, Thr, Trp, Tyr або Val, зокрема, на Gly, Ala, Ser або Thr і, переважно, на Gly. Крім того, Asn в позиції B3 може бути змінений на Lys або Asp. Додатковими прикладами аналогів інсуліну є інсулін des(B30) людини; аналоги інсуліну des(B30) людини; аналоги інсуліну, в яких видалений PheB1; аналоги інсуліну з подовженим з N-кінця А-ланцюгом і/або В-ланцюгом і аналоги інсуліну з подовженим з С-кінця А-ланцюгом і/або В-ланцюгом. Таким чином, один або два залишки Arg можуть бути додані до позиції B1. Під "інсулін desB30", "інсулін desB30 людини" розуміється природний інсулін або його аналог, у якого відсутній амінокислотний залишок В30. Аналогічним чином "інсулін desB29desB30" або "інсулін desB29desB30 людини" означає природний інсулін або його аналог, у якого відсутні амінокислотні залишки В29 і В30. Під "В1", "А1" і т. д. розуміється амінокислотний залишок в позиції 1 в В-ланцюга інсуліну (вважаючи з N-кінця) і амінокислотний залишок в позиції 1 в А-ланцюгу інсуліну (вважаючи з Nкінця), відповідно. Також може бути вказаний амінокислотний залишок у вказаній позиції, як наприклад, PheB1, що означає, що амінокислотним залишком в позиції В1 є залишок фенілаланіну. Використовуваний в даному документі термін "неактивний лінкер" означає лінкер, який не надає фармакологічних ефектів лікарської сполуки, отриманої з біологічно активного агента. Використовуваний в даному документі термін "алкіл" означає прямий або розгалужений вуглецевий ланцюг. Кожний водень вуглецю в алкілі може бути заміщений замісником. Використовуваний в даному документі термін « С1-4алкіл" означає алкільний ланцюг, що має 1-4 атомів вуглецю, наприклад, на кінці молекули: метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, втор-бутил, трет-бутил або, наприклад, -CH2-, -CH2-CH2-, -CH(CH3)-, -CH2-CH2-CH2-, -CH(C2H5)-, -C(CH3)2-, коли дві частини молекули з'єднані алкільною групою. Кожний водень вуглецю в С1-4алкілі може бути заміщений замісником. Використовуваний в даному документі термін "С1-6алкіл" означає алкільний ланцюг, що має 1-6 атомів вуглецю, наприклад, на кінці молекули: С1-4алкіл, метил, етил, н-пропіл, ізопропіл, нбутил, ізобутил, втор-бутил, трет-бутил, н-пентил, н-гексил або, наприклад, -CH2-, -CH2-CH2-, CH(CH3)-, -CH2-CH2-CH2-, -CH(C2H5)-, -C(CH3)2-, коли дві частини молекули з'єднані алкільною групою. Кожний водень вуглецю в С1-6алкілі може бути заміщений замісником. Відповідно, "С1-18алкіл" означає алкільний ланцюг, що має від 1 до 18 атомів вуглецю, а "С8-18алкіл" означає алкільний ланцюг, що має від 8 до 18 атомів вуглецю. Відповідно, "С150алкіл" означає алкільний ланцюг, що має від 1 до 50 атомів вуглецю. Використовуваний в даному документі термін "С2-50алкеніл" означає прямий або розгалужений алкенільний ланцюг, що має від 2 до 50 атомів вуглецю, наприклад, на кінці молекули: -CH=CH2, -CH=CH-CH3, -CH2-CH=CH2, -CH=CH-CH2-CH3, -CH=CH-CH=CH2, або, наприклад, -CH=CH-, коли дві частини молекули з'єднані алкенільною групою. Кожний водень вуглецю в С2-50алкенілі може бути заміщений додатково вказаним замісником. Відповідно, термін "алкеніл" стосується вуглецевого ланцюга щонайменше з одним подвійним вуглецевим зв'язком. Необов'язково, можуть бути присутніми один або декілька потрійних зв'язків. Використовуваний в даному документі термін « С2-50алкініл" означає прямий або розгалужений алкінільний ланцюг, що має від 2 до 50 атомів вуглецю, наприклад, на кінці молекули: -C≡CH, -CH2-C=CH, CH2-CH2-C=CH, CH2-C≡C-CH3, або, наприклад, -C≡C-, коли дві частини молекули з'єднані алкінільною групою. Кожний водень вуглецю в С2-50алкінілі може бути заміщений додатково вказаним замісником. Відповідно, термін "алкініл" стосується 6 UA 108475 C2 5 10 15 20 25 30 35 40 45 50 55 60 вуглецевого ланцюга щонайменше з одним потрійним вуглецевим зв'язком. Необов'язково, можуть бути присутним одна або декілька подвійних зв'язків. Використовуваний в даному документі термін "С3-7циклоалкіл" або "С3-7циклоалкільне кільце" означає циклічний алкільний ланцюг, що має від 3 до 7 атомів вуглецю, яка може мати вуглецеві подвійні зв'язки, при цьому щонайменше частково насичений, наприклад, циклопропіл, циклобутил, циклопентил, циклогексил, циклогексеніл, циклогептил. Кожний водень вуглецю в циклоалкілі може бути заміщений замісником. Термін "С3-7циклоалкіл" або "С3-7циклоалкільно кільце" також включає з'єднані містками біцикли, такі як норбонан або норбонен. Відповідно, "С3-5циклоалкіл" означає циклічний алкіл, що має від 3 до 5 атомів вуглецю. Відповідно, "С3-10циклоалкіл" означає циклічний алкіл, що має від 3 до 10 атомів вуглецю, наприклад, "С3-7циклоалкіл", циклопропіл, циклобутил, циклопентил, циклогексил, циклогексеніл, циклогептил, циклооктил, циклононіл, циклодецил. Термін "С3-10циклоалкіл" також включає щонайменше частково насичені карбомоно- і -біцикли. Використовуваний в даному документі термін "галоген" означає фтор, хлор, бром або йод. Звичайно переважно, щоб галогеном був фтор або хлор. Використовуваний в даному документі термін "4-7-членний гетероцикліл" або "4-7-членний гетероцикл" означає кільце з 4, 5, 6 або 7 атомами в кільці, яке може містити до максимальної кількості подвійних зв'язків (ароматичне або неароматичне кільце, повністю насичене, частково насичене або ненасичене), в якому щонайменше один атом в кільці (і до 4 атомів в кільці) замінений гетероатомом, вибраним з групи, що складається з сірки (включаючи -S(О)-, -S(О)2-), кисню і азоту (включаючи =N(О)-), і коли кільце приєднане до іншої молекули через атом вуглецю або азоту. Прикладами 4-7-членних гетероциклів є азетидин, оксетан, тієтан, фуран, тіофен, пірол, піролідин, імідазол, імідазолін, піразол, піразолін, оксазол, оксазолін, ізоксазол, ізоксазолін, тіазол, тіазолін, ізотіазол, ізотіазолін, тіадіазол, тіадіазолін, тетрагідрофуран, тетрагідротіофен, піролідин, імідазолідин, піразолідин, оксазолідин, ізоксазолідин, тіазолідин, ізотіазолідин, тіадіазолідин, сульфолан, піран, дигідропіран, тетрагідропіран, імідазолідин, піридин, піридазин, піразин, піримідин, піперазин, піперидин, морфолін, тетразол, триазол, триазолідин, тетразолідин, діазепан, азепін або гомопіперазин. Використовуваний в даному документі термін "9-11-членний гетеробіцикліл" або "9-11членний гетеробіцикл" означає гетероциклічну систему з двох кілець з 9-11 атомами в кільці, причому щонайменше один кільцевий атом входить в обидва кільця, і яка може містити до максимальної кількості подвійних зв'язків (ароматичне або неароматичне кільце, повністю насичене, частково насичене або ненасичене), в якій щонайменше один атом в кільці (і до 6 атомів в кільці) заміщений гетероатомом, вибраним з групи, що складається з сірки (включаючи -S(О)-, -S(О)2-), кисню і азоту (включаючи =N(О)-), і коли кільце приєднане до іншої молекули через атом вуглецю або азоту. Прикладами 9-11-членних гетеробіциклів є індол, індолін, бензофуран, бензотіофен, бензоксазол, бензизоксазол, бензотіазол, бензизотіазол, бензімідазол, бензімідазолін, хінолін, хіназолін, дигідрохіназолін, хінолін, дигідрохінолін, тетрагідрохінолін, декагідрохінолін, ізохінолін, декагідроізохінолін, тетрагідроізохінолін, дигідроізохінолін, бензазепін, пурин або птеридин. Термін 9-11-членний гетеробіцикл також включає спіроструктури з двох кілець, такі як 1,4-діокса-8-азаспіро[4.5] декан або з'єднані містком гетероцикли, такі як 8-аза-біцикло[3.2.1]октан. Використовуваний в даному документі термін "фармацевтично прийнятний" означає схвалений наглядовими органами, такими як EMEA (Європа) і/або FDA (США), і/або будь-якими іншими національними наглядовими органами для застосування у тварин, переважно у людини. Використовуваний в даному документі термін "фармацевтична композиція" або "композиція" означає одні або декілька діючих інгредієнтів, і один або декілька інертних інгредієнтів, а також будь-який продукт, який виходить прямо або посередньо в результаті об'єднання, утворення комплексів або агрегації будь-яких двох або декількох інгредієнтів, або в результаті дисоціації одного або декількох інгредієнтів, або внаслідок інших типів реакцій або взаємодій одного або декількох інгредієнтів. Відповідно, фармацевтичні композиції за даним винаходом охоплюють будь-яку композицію, виготовлену шляхом змішування сполуки за даним винаходом і фармацевтично прийнятної допоміжної речовини (фармацевтично прийнятного носія). "Вільна форма" лікарської сполуки стосується лікарської сполуки в її немодифікованій фармакологічно активній формі, наприклад, після вивільнення з полімерного кон'югату. "Суха композиція" означає, що композиція пролікарської сполуки інсуліну з гідрогелем представлена в сухій формі в контейнері. Прийнятними способами висушування є сушіння розпиленням і ліофілізація (сушіння при заморожуванні). Така суха композиція пролікарської сполуки інсуліну з гідрогелем має залишковий вміст води максимум 10 %, переважно, менше 7 UA 108475 C2 5 10 15 20 25 30 35 40 45 50 55 60 5 % і, ще більш переважно, менше 2 % (що визначається по Karl Fischer). Переважним способом сушіння є ліофілізація. "Ліофілізована композиція" означає, що композицію пролікарської сполуки інсуліну в гідрогелі початково заморожують і далі видаляють воду, знижуючи тиск. Ця термінологія не виключає додаткові стадії сушіння, які присутні в процесі виготовлення до заповнення композицією кінцевого контейнера. "Ліофілізація" (сушіння при заморожуванні) являє собою процес видалення води, який відрізняється заморожуванням композиції і потім зниженням тиску і, необов'язково, нагріванням для прямої сублімації замороженої води в композиції з твердої фази в газ. Звичайно, пари води збирають десублімацією. "Відновлення" означає додавання рідини для відновлення вихідної форми композиції. "Розчин для відновлення" стосується рідини, що використовується для відновлення сухої композиції пролікарської сполуки інсуліну з гідрогелем перед введенням пацієнту, що її потребує. "Контейнер" означає будь-який контейнер, який містить композицію пролікарської сполуки інсуліну в гідрогелі, і в якому вона може зберігатися до відновлення. Використовуваний в даному документі вираз "терапевтично ефективна кількість" сполуки інсуліну означає кількість, достатню для лікування, послаблення або часткової зупинки клінічних виявів даного захворювання і його ускладнень. Кількість, достатня для цього, визначають як "терапевтично ефективна кількість". Ефективна кількість для кожної мети буде залежати від тяжкості захворювання або ураження, а також від маси і загального стану суб'єкта. Зрозуміло, що відповідне дозування можна визначити з використанням стандартних експериментів шляхом створення матриці значень і тестування різних елементів в матриці, що входить в компетенцію досвідченого терапевта або ветеринара. Термін "буфер" або "буферний агент" стосується хімічних сполук, які підтримують рН в заданому діапазоні. Фізіологічно сумісними буферами є, наприклад, натрію фосфат, сукцинат, гістидин, бікарбонат, цитрат і ацетат, сульфат, нітрат, хлорид, піруват. Також можна використати антациди, такі як Mg(OH)2 або ZnCО3. Буферну ємність можна підводити, щоб відповідати умовам, найбільш чутливим до стабільності рН. Термін "допоміжні речовини" стосується сполук, що вводяться спільно з терапевтичним агентом, наприклад, буферними агентами, модифікаторами ізотонічності, консервантами, стабілізіторами, анти-адсорбційними агентами, агентами, що захищають від окиснення, і з іншими допоміжними агентами. Однак в деяких випадках одна допоміжна речовина може мати подвійні або потрійні функції. "Ліопротектант" являє собою молекулу, яка при об'єднанні з цільовим білком, значною мірою попереджає або знижує хімічну і/або фізичну нестабільність білка при висушуванні загалом, і, особливо, в ході ліофілізації і подальшого зберігання. Приклади ліопротектантів включають цукри, такі як сахароза або трегалоза; амінокислоти, такі як мононатрію глутамат або гістидин; метиламіни, такі як бетаїн; ліотропні солі, такі як сульфат магнію; багатоатомні спирти, такі як триатомні або поліатомні цукрові спирти, наприклад, гліцерин, еритрит, гліцерин, арабіт, ксиліт, сорбіт і маніт; етиленгліколь; пропіленгліколь; поліетиленгліколь; плюроніки; гідроксіалкільні крохмаль, наприклад, гідроксіетиловий крохмаль (HES) і їх комбінації. "Поверхнево-активна речовина" стосується змочувальних агентів, що знижують поверхневий натяг рідини. "Модифікатори ізотонічності" стосується сполук, що мінімізують біль, який може виникнути в результаті пошкодження клітин внаслідок різниці осмотичного тиску в місці депо-ін'єкції. Термін "стабілізатори" стосується сполук, що використовуються для стабілізації полімерного пролікарської сполуки. Стабілізація досягається в результаті підвищення сил, що стабілізують білок, дестабілізації денатурованого стану або в результаті прямого зв'язування допоміжних речовин з білком. "Анти-адсорбційні агенти" належить в основному до іонних або неіонних поверхневоактивних речовин або інших білків або розчинних полімерів, що використовуються для конкурентного покриття внутрішньої поверхні або адсорбції на внутрішню поверхню контейнера, що містить композицію. Вибір концентрації і типу допоміжної речовини залежать від ефекту, якого потрібно уникати, але звичайно моношар поверхнево-активної речовини утворюється на поверхні розділення фаз трохи вище за значення критичної концентрації міцелоутворення. "Агенти, що захищають від окиснення" стосується антиоксидантів, таких як аскорбінова кислота, ектоїн, метіонін, глутатіон, монотіолгліцерин, морин, поліетиленімін (PEI), пропілгалат, вітамін Е, хелатуючі агенти, такі як лимонна кислота, EDTA, гексафосфат, тіогліколева кислота. "Протимікробні агенти" стосується хімічної речовини, яка вбиває або інгібує ріст мікроорганізмів, такі як бактерії, гриби, дріжджі, найпростіші, і/або руйнує віруси. 8 UA 108475 C2 5 10 15 20 25 30 35 40 45 50 55 "Герметизація контейнера" означає, що контейнер закритий таким чином, що він є повітронепроникним, не дозволяючи газообмін між зовнішнім середовищем і внутрішнім середовищем контейнера, і зберігає вміст в стерильному стані. Мається на увазі, що вираз "фармацевтично прийнятний" охоплює будь-яку допоміжну речовину і/або добавку, які не порушують ефективність біологічної активності діючого інгредієнта і не токсичні для хазяїна, якому їх вводять. Термін "реагент" стосується проміжної сполуки або вихідного матеріалу, що використовується в способі виготовлення, що приводить до пролікарської сполуки за даним винаходом. Термін "хімічна функціональна група" стосується карбонової кислоти і активованих похідних, аміногрупи, малеімідної групи, тіольної групи і похідних, сульфонової кислоти і похідних, карбонату і похідних, карбамату і похідних, гідроксилу, альдегіду, кетону, гідразину, ізоціанату, ізотіоціанату, фосфорної кислоти і похідних, фосфонової кислоти і похідних, галоацетилу, алкілгалідів, акрилоїльної групи і інших альфа-бета-ненасичених акцепторів Міхаеля, арилуючих агентаів, таких як арилфториди, гідроксиламіну, дисульфідів, таких як піридилдисульфід, вінілсульфон, вінілкетон, діазоалканів, діазоацетильних сполук, оксирану і азиридину. Якщо хімічна функціональна група з'єднана з іншою хімічною функціональною групою, отримана в результаті хімічна структура називається "зв'язком". Наприклад, реакція аміногрупи з карбоксильною групою дає амідний зв'язок. "Реакційно-здатні функціональні групи" є хімічними функціональними групами каркасної частини молекули, які з'єднані з гіпер-розгалуженою частиною молекули. "Функціональна група" є збірним терміном, що використовується для "реакційно-здатної функціональної групи", "деградованої зв'язаної (утворюючої міжмолекулярний зв'язок) функціональної групи" або "кон'югуючої функціональної групи". "Деградована зв'язана функціональна група" являє собою сполуку, що містить біодеградований зв'язок, який з одного боку з'єднаний зі спейсером, пов'язаним з каркасною частиною молекули, а з іншого боку з'єднаний із зшиваючою частиною молекули. Терміни "деградована зв'язана функціональна група", "біодеградована зв'язана функціональна група", "зв'язана біодеградована функціональна група" і "зв'язана функціональна група" використовуються як синоніми. Терміни "блокуюча група" або "кепіруюча група" використовуються як синоніми і стосуються частин молекул, які необоротно приєднані до реакційно-здатних функціональних груп для блокування їх здатності вступати в реакції, наприклад, з хімічними функціональними групами. Терміни "захищаюча група" або "захисна група" стосуються частин молекул, оборотно приєднаних до реакційно-здатних функціональних груп для блокування їх здатності вступати в реакції, наприклад, з хімічними функціональними групами. Термін "здатна утворювати міжмолекулярний зв'язок функціональна група" стосується хімічних функціональних груп, які беруть участь в реакції радикальної полімеризації і є частиною зшиваючого реагенту або каркасного реагенту. Термін "полімеризована функціональна група" стосується хімічних функціональних груп, які беруть участь в реакції полімеризації зшиваючого типу і є частиною зшиваючого реагенту або каркасного реагенту. Для зв'язаних функціональних груп термін "гідролітично деградовані" належить в контексті даного винаходу до сполук, які гідролітично деградують без участі ферментів при фізіологічних умовах (водний буфер з рН 7,4, 37 °C) з часом півжиття в діапазоні від однієї години до трьох місяців, і які включають в себе, але не обмежені цими сполуками, аконітили, ацеталі, ангідриди карбонових кислот, складний ефір, іміни, гідразони, аміди малеамінової кислоти, ортоефіри, фосфаміди, фосфоефіри, силільні ефіри фосфору, силільні ефіри, сульфонові ефір, ароматичні карбамати, їх комбінації і т. п. Переважними біодеградованими сполуками є карбонові ефіри, карбонати, фосфоефіри і ефіри сульфонової кислоти, а найбільш переважними є карбонові ефіри або карбонати. Очевидно, що в дослідженнях in vitro в практичних цілях можна використати прискорені умови, наприклад, рН 9, 37 °C, водний буфер. Каркасна частина молекули може містити спейсерну частину молекули, яка одним кінцем приєднана до каркасної частини молекули, а іншим кінцем до зшиваючої частини молекули. Термін "похідні" стосується хімічних функціональних груп, відповідно заміщених захищаючими і/або активуючими групами або активованих форм відповідної хімічної функціональної групи, відомих досвідченому фахівцеві в даній галузі. Наприклад, активовані форми карбоксильної групи включають, але не обмежені цим, реакційно-здатні складні ефіри, 9 UA 108475 C2 5 10 15 20 25 30 35 40 45 50 55 60 такі як сукцинімідний ефір, бензотриазольний ефір, нітрофенільний ефір, пентафторфенільний ефір, азабензотриазольний ефір, ацилгалогеніди, змішані і симетричні ангідриди, ацилімідазол. Термін "лінкер, що розщеплюється без участі ферментів" стосується лінкерів, гідролітично деградованих при фізіологічних умовах без ферментативної активності. "Біологічно неактивний лінкер" означає лінкер, який не показує фармакологічних ефектів лікарської сполуки (D-H), отриманієї з біологічно активної молекули. Терміни "спейсер", "спейсерна група", "спейсерна молекула" і "спейсерна частина молекули" використовуються взаємозамінно, і при використанні для опису молекули, присутньої в гідрогелевому носії за винаходом, стосуються будь-якої молекули, прийнятної для сполуки двох частин молекули, наприклад, C1-50алкілу, C2-50алкенілу або C2-50алкінілу, яка необов'язково уривається однією або декількома групами, вибраними з -NH-, -N(C1-4алкіл)-, -O-, -S-, -C(О)-, C(О)NH-, -C(О)N(C1-4алкіл)-, -O-C(О)-, -S(О)-, -S(О)2-, 4-7-членного гетероциклу, фенілу або нафтилу. Терміни "кінцевий", "кінець" або "дальній кінець" стосується позиції функціональної групи або зв'язку в молекулі або частині молекули, відповідно до яких така функціональна група може бути хімічною функціональною групою, а зв'язок може бути деградованим або постійним зв'язком, які характеризуються тим, що вони розташовані близько до сполуки або в з'єднанні між двома частинами молекули або на кінці олігомерного або полімерного ланцюга. Фрази "в зв'язаній формі" або "частина молекули" стосуються субструктур, які є частиною більшої молекули. Фразу "в зв'язаній формі" використовують для спрощення посилання на частини молекул шляхом згадки або переліку реагентів, вихідних матеріалів або можливих вихідних матеріалів, добре відомих в даній галузі, і відповідно до якої "в зв'язаній формі" означає, що, наприклад, один або декілька радикалів водню (-Н) або одна або декілька активуючих або захисних груп, присутніх в реагенті або вихідних речовинах, не присутні в частині молекули. Очевидно, що всі реагенти і молекули, що містять полімерні молекули, належать до макромолекулярних структур, які, як відомо, мають варіабельність по своїй молекулярній масі, довжині ланцюгів або мірі полімеризації, або числу функціональних груп. Тому, структури, показані для каркасних реагентів, каркасних частин молекул, реагентів для зшиття і зшивань, є тільки представницькими прикладами. Реагент або частина молекули можуть бути лінійними або розгалуженими. Якщо реагент або частина молекули мають дві кінцевих групи, вони називаються лінійним реагентом або частиною молекули. Якщо реагент або частина молекули мають більше двох кінцевих груп, вони вважаються розгалуженими або багатофункціональними реагентом або частиною молекули. Термін "полімерний ланцюг на основі поліетиленгліколю" "ланцюг на основі ПЕГ" стосується олігомерного або полімерного молекулярного ланцюга. Переважно, щоб такий полімерний ланцюг на основі поліетиленгліколю був пов'язаний з ядром (точкою розгалуження), і являв собою лінійний поліетиленгліколевий ланцюг, у якого один кінець приєднаний до ядра, а інший до гіперрозгалуженої частини. Очевидно, що ланцюг на основі ПЕГ може закінчуватися (або уриватися) алкільною або арильною групами, необов'язково заміщеними гетероатомами і хімічними функціональними групами. Якщо термін "полімерний ланцюг на основі поліетиленгліколю" використовується в застосуванні до зшиваючого реагенту, він стосується зшивання або ланцюга, що містять щонайменше 20 % (по масі) молекул етиленгліколю. Однина, що використовується в даному документі, і аналогічні посилання потрібно тлумачити як посилання на однину і множину, якщо в даному документі прямо не вказано інше, або якщо цьому прямо не суперечить контекст. Опис Даний винахід стосується препарату інсуліну тривалої дії для забезпечення базального інсуліну. Базальні інсуліни являють собою склади інсуліну або аналогів інсуліну тривалої дії, розроблені для імітації секреції базального інсуліну бета-клітинами підшлункової залоза. Оптимально, щоб таким чином здійснювався безперервний контроль вмісту глюкози в крові протягом всього інтервалу дозування. Авторами винаходу було відкрито, що сполука інсуліну може безперервно вивільнятися з ін'єкційного депо-препарату, (наприклад, для підшкірного введення) в структурно інтактній формі в інтервалі між введеннями без якого-небудь ефекту викиду. Структурну цілісність сполуки інсуліну, що вивільняється, забезпечує високогідратована полімерна матриця, що мінімізує міжмолекулярні контакти молекул інсуліну. Крім того, в результаті відсутності викиду інсуліну знижується ризик шкідливих побічних ефектів у пацієнта. 10 UA 108475 C2 5 10 15 20 25 30 35 40 45 50 55 Даний винахід знижує ризик гіпоглікемії після введення інсуліну завдяки відсутності "вибухоподібного" вивільнення інсуліну, знижує ризик гіперглікемії в кінці періоду дозування, знижує частоту ін'єкцій і забезпечує передбачуваний рівень інсуліну в плазмі крові пацієнта. Додаткова задача даного винаходу стосується нового базальному інсуліну, що вимагає менш частого введення відносно існуючих схем щоденного введення базального інсуліну і забезпечує високий рівень безпеки в результаті вивільнення структурно інтактного інсуліну протягом всього інтервалу часу межу ін'єкціями і, звичайно, що має співвідношення пікової концентрації до залишкової концентрації менше 2. Додаткові переваги будуть очевидні з даного опису. У першому аспекті даний винахід стосується фармацевтичної композиції, що містить сполуку інсуліну в концентрації, достатній для підтримування терапевтично ефективного рівня сполуки інсуліну в плазмі крові протягом щонайменше 3 днів, звичайно, щонайменше 80 годин, наприклад, протягом тижня, характеризуються тим, що вона має фармакокінетичний профіль in vivo по суті без викиду сполуки інсуліну. Така концентрація буде варіювати від суб'єкта до суб'єкта і залежить від терапевтичного вікна у окремого суб'єкта, але для тривалості терапевтичного ефекту протягом щонайменше 3 днів, наприклад, тижні (тобто, приблизно 7 днів), концентрація звичайно складає щонайменше близько 10 мг/мл, наприклад, більше ніж 10 мг/мл. Відповідно, в додатковому аспекті даний винахід стосується фармацевтичної композиції, що містить сполуку інсуліну в концентрації щонайменше 10 мг/мл, характеризуються тим, що вона має фармакокінетичний профіль in vivo по суті без викиду сполуки інсуліну. У додатковому аспекті даний винахід стосується фармацевтичної композиції, що містить сполуку інсуліну з концентрацією щонайменше 11 мг/мл, для введення в разовій дозі щонайменше 10 мг сполуки інсуліну. Разова доза сполуки інсуліну, що використовується в даному описі, дана в мг, а концентрація сполуки інсуліну в фармацевтичній композиції дана в мг/мл. Якщо сполуки інсуліну є пролікарською сполукою, концентрація основана на кількісному вивільненні вільного інсуліну з пролікарської сполуки. За допомогою відомих в даній галузі способів аліквоту композиції поміщують в умови для вивільнення інсуліну (водний буфер, рН 7,4, 37 °C, або прискорені умови при підвищеному рН) до припинення помітного збільшення концентрації інсуліну і визначають загальну кількість вивільненого інсуліну. Очевидно, що у випадку розчинних носіїв, кількісне вивільнення є синонімом кількісного гідролізу. У одному варіанті здійснення даного винаходу концентрація сполуки інсуліну складає щонайменше 11 мг/мл, наприклад від 11 мг/мл до 35 мг/мл, більш переважно, від 15 мг/мл до 25 мг/мл, ще більш переважно, близько 20 мг/мл, і, ще більш переважно, концентрація складає близько 24 мг/мл. Об'єм, який використовують для введення ефективної дози, наприклад, за допомогою шприца, суб'єкту, наприклад, людині, переважно складає менше 1,5 мл, звичайно - 1,0 мл або менше. У додатковому варіанті здійснення винаходу разова доза сполуки інсуліну складає щонайменше 5 мг, наприклад, від 5 мг до 100 мг, більш переважно, від 5 мг до 50 мг і, ще більш переважно, від 5 мг до 25 мг. У додатковому варіанті здійснення винаходу співвідношення пікової концентрації сполуки інсуліну в плазмі крові протягом перших 48 годин після введення, наприклад, за допомогою підшкірної або внутрішньом'язової ін'єкції, до мінімальної концентрації сполуки інсуліну в плазмі крові після пікової концентрації протягом перших 48 годин після введення, складає менше 2, звичайно менше 1,5. Вищезгадані варіанти здійснення винаходу, а також варіанти здійснення, описані нижче, потрібно розглядати відносно будь-якого з аспектів, описаних в даному документі, а також відносно будь-якого з варіантів здійснення, описаних в даному документі, якщо не указано, що варіант здійснення стосується певного аспекту або аспектів даного винаходу. Звичайно фармацевтична композиція являє собою регульовану систему доставки, яка включає в себе сполуки інсуліну і характеризується тим, що при доставці сполуки інсуліну в плазму крові ссавців по суті не відбувається викиду інсуліну. У ще одному додатковому варіанті здійснення винаходу фармакокінетичний профіль вимірюють в плазмі крові ссавців, наприклад, в плазмі крові людини. Концентрацію інсуліну в плазмі можна виміряти за допомогою доступних в продажу наборів для ELISA, порівнюючи результати вимірювань з калібрувальною кривою, отриманою з використанням інсулінових стандартів. Для статистичної достовірності експеримент проводять з достатнім числом 11 UA 108475 C2 5 10 15 20 25 30 35 40 45 50 55 60 біологічних і технічних повторів і обчислюють середні і медіанні значення для обліку біологічної і технічної варіабельності. У додатковому варіанті здійснення винаходу композиція характеризується тим, що має співвідношення пікової концентрації до залишкової концентрації менше 2, звичайно - менше 1,75, переважно, менше 1,5 або, ще більш переважно менше - 1,25. У ще одному додатковому варіанті здійснення винаходу композиція відрізняється постійним вивільненням сполуки структурно інтактного інсуліну протягом всього інтервалу часу між введеннями. "Постійне вивільнення" стосується безперервного вивільнення інсуліну. У додатковому варіанті здійснення винаходу повний інтервал часу між введеннями складає щонайменше приблизно 80 годин, наприклад, приблизно 110 годин, звичайно, щонайменше тиждень, наприклад, 1-2 тижні або навіть більше. У ще одному додатковому варіанті здійснення винаходу сполука інсуліну є пролікарською сполукою. У додатковому варіанті здійснення винаходу сполука інсуліну є пов'язаною з носієм пролікарською сполукою. У ще одному додатковому варіанті здійснення винаходу сполука інсуліну є каскадною пролікарською сполукою. Пролікарську сполуку можна вводити у вигляді рідини, наприклад, розчину або гелю, або вона може міститися в депо-препараті, або навіть може бути вбудоване в депо-препарат, так що депо-препарат діє як пролікарська сполука. У додатковому варіанті здійснення винаходу сполуки інсуліну повністю міститься в депопрепараті. Термін "повністю міститься" стосується депо-препарату, в якому менше ніж 10 % лікарської сполуки, тобто інсуліну, присутнє у водній фракції після додавання 1 мл води до 1 мл депопрепарати, змішування і відділення депо-препарату від води. У ще одному додатковому варіанті здійснення винаходу депо-препаратом є полімерний гель, наприклад, гідрогель. У додатковому варіанті здійснення винаходу депо-препаратом є високогідратований полімерний матрикс. Сполука інсуліну може міститися в депо-препараті в різних варіантах, наприклад, сполука інсуліну може бути нековалентно пов'язана з депо-препаратом або ковалентно пов'язана з депо-препаратом, причому депо-препарат (без обмежень) можна вибрати з полімерного гелю гідрогелю або високогідратованого полімерного матриксу. Необмежуючими прикладами прийнятних полімерів є полімери, здатні утворювати квазі-нескінченні тривимірні високогідратовані молекулярні мережі. Такими гідрогелюми є хімічно або фізично перехреснозшиті функціоналізовані або нефункціоналізовані поліалкоксільні полімери, наприклад, поліпропіленгліколь або поліетиленгліколь, декстран, хітозан, гіалуронова кислота і похідні, альгінат, ксилан, манан, карагінан, агароза, целюлоза, крохмаль, гідроксіетилкрохмаль (HES) і інші вуглеводні полімери, полівінілові спирти, поліоксазоліни, поліангідриди, поліортоефіри, полікарбонати, поліуретани, поліакрилові кислоти, поліакриламіди, наприклад, полігідроксипропілметакриламід (HMPA), поліакрилати, поліметакрилати, наприклад, полігідроксіетилметакрилат, поліорганофосфазени, полісилоксани, полівінілпіролідон, поліціаноакрилати, поліефіри, наприклад, полімолочна кислота або полігліколеві кислоти, поліімінокарбонати, поліамінокислоти, наприклад, поліглутамінова кислота або полілізин, колаген, желатин, співполімери, прищеплені співполімери, перехресно-зшиті полімери, гідрогелі і блок-співполімери з вищеперелічених полімерів. Ці полімери можуть служити як каркасні частини молекул або зшиваючі частини молекул, а також можлива комбінація різних полімерів у вигляді співполімерів при умові високої міри гідратації молекулярної мережі. Крім олігомерних або полімерних зшиваючих частин молекул перерахованих вище типів полімерів, можна використати низькомолекулярні зшивання, особливо, при використанні високомолекулярних каркасних частин молекул для утворення гідрогелевих носіїв пролікарських сполук. Одним шляхом мінімізації контактів між молекулами інсуліну є гомогенний розподіл молекул інсуліну у високогідратованому полімерному матриксі. Гомогенний розподіл можна отримати за допомогою ковалентного зв'язування інсуліну з полімером, а в результаті використання лінкер, що розщеплюються у водному середовищі при нейтральному рН, гарантується повільне вивільнення структурно інтактного інсуліну. Переважним є пов'язана з полімером пролікарська сполука інсуліну, яка по суті не має біологічної активності, причому вказана властивість обумовлює те, що вся інсулінотропна активність стосується інсуліну, що вивільняється. Тому, шляхом моделювання властивостей 12 UA 108475 C2 5 10 15 20 25 30 35 40 45 50 вивільнення пролікарської сполуки можна досягнути високої міри контролю рівня інсуліну в плазмі. Інсулін може бути приєднаний через всі значущі функціональні групи в молекулі, і такі переважні функціональні групи в природних амінокислотах звичайно вибрані з гуанадинової, імідазольної, індольної, карбоксильної, карбоксамідної, первинної і вторинної гідроксильної, фенольної, і первинної аміногруп. Наприклад, інсулін людини має наступні важливі функціональні групи: карбоксильну, карбоксіамідну, первинну і вторинну гідроксильну, фенольну, імідазольну і первинну аміногрупу. У додатковому варіанті здійснення винаходу сполука інсуліну пов'язана з носієм пролікарської сполуки або ковалентно з будь-яким із залишків лізину, або з N-кінцем будь-якого з А- або В-ланцюга сполуки інсуліну. У конкретному варіанті здійснення винаходу пролікарська сполука або її фармацевтично прийнятна сіль містять кон'югат інсуліну з лінкером D-L, в якому D являє собою молекулу інсуліну; а - L є біологічно неактивною лінкерною молекулою -L1, представленою формулою (I), в якій пунктирна лінія вказує приєднання однієї з аміногруп інсуліну з утворенням амідного зв'язку; X є C(R3R3a); або N(R3); R1a, R3a незалежно вибрані з групи, що складається з Н, NH(R2b), N(R2b)C(O)R4 і C14алкілу; R1, R2, R2a, R2b, R3, R4 незалежно вибрані з групи, що складається з Н і C1-4алкілу, в якій L1 заміщена одним замісником L2-Z і необов'язково додатково заміщена, при умові, що атом водню, позначений зірочкою в формулі (I) не заміщений замісником, і в якій L2 є одиничним хімічним зв'язком або спейсером; а Z є гідрогелем. У випадку, коли сполуки за формулою (I) містять одну або декілька кислотних або основних груп, винахід також містить їх відповідні фармацевтично або токсикологічно прийнятні солі, зокрема, їх солі, що фармацевтично використовуються. Тому, сполуки за формулою (I), які містять кислотні групи, можна використати за винаходом, наприклад, як солі лужних металів, солі лужноземельних металів або солі амонію. Більш конкретні приклади таких солей включають солі натрію, солі калію, солі кальцію, солі магнію або солей амонію або органічних амінів, таких як, наприклад, етиламін, етаноламін, триетаноламін або амінокислоти. Сполуки за формулою (I), які містять одну або декілька основних груп, тобто груп, які можуть протонуватися, можуть бути присутніми, і їх можна використати за винаходом в формі їх солей приєднання з неорганічними або органічними кислотами. Приклади прийнятних кислот включають хлорид водню, бромід водню, фосфорну кислоту, сірчану кислоту, азотну кислоту, метансульфонову кислоту, п-толуолсульфонову кислоту, нафталиндисульфонову кислоту, щавлеву кислоту, оцтову кислоту, винну кислоту, молочну кислоту, саліцилову кислоту, бензойну кислоту, мурашину кислоту, пропіонову кислоту, півалінову кислоту, діетилоцтову кислоту, малонову кислоту, бурштинову кислоту, пімелінову кислоту, фумарову кислоту, малеїнову кислоту, яблучну кислоту, сульфамінову кислоту, фенілпропіонову кислоту, глюконову кислоту, аскорбінову кислоту, ізонікотинову кислоту, лимонну кислоту, адипінову кислоту і інші кислоти, відомі досвідченим фахівцям в даній галузі. Якщо сполуки за формулою (I) одночасно містять кислі і основні групи в молекулі, то винахід також включає (в доповнення до вказаних форм солей) внутрішні солі або бетаїни (цвітер-іони). Відповідні солі за формулою (I) можна отримати звичайними способами, відомими досвідченому фахівцеві в даній галузі, наприклад, шляхом контакту з органічними або неорганічними кислотою або основою в розчиннику або диспергуючій речовині або в результаті аніонообміну або катіонообміну з іншими солями. Даний винахід також включає всі солі сполук за формулою (I), які внаслідок низької фізіологічної сумісності, напряму не підходять для використання в фармацевтичних препаратах, але які можна використати, наприклад, як проміжні сполуки для хімічних реакцій або для отримання фармацевтично прийнятних солей. Переважно, в формулі (I) R2 заміщений L2-Z. 13 UA 108475 C2 5 10 15 20 25 Переважно, в формулі (I) R1 заміщений L2-Z. Переважно, в формулі (I) X є N(R3). Переважно, в формулі (I) X є С(R3R3a), а R3a є N(R2b)С(О)R4. Переважно, Х є С(R3R3a), R3a є N(R2b)-L2-Z. Переважні пролікарські сполуки за даним винаходом містять кон'югат інсуліну з лінкером DL, в якому L1 з формули (I) представлена формулами (Ia), (Ib), (Ic) або (Id): в яких R1, R1a, R2, R2a, R2b, R3, R4, L2, Z мають значення, вказані в даному документі, і в яких L1 необов'язково додатково заміщена, при умові, що атом водню, позначений зірочкою в формулах (Ia)-(Id), не заміщений замісником. Переважно, L1 додатково не заміщена (крім обов'язкового замісника L2-Z). Як показано, наприклад, в формулах (Ia)-(Id) один водень заміщений групою L2-Z. Загалом, L2 може бути приєднана до L1 по будь-якому положенню, крім заміщення водню, позначеного зірочкою в формулі (I). Переважно, щоб один з атомів водню з R1, R1a, R2, R2a, R2b, R3, R4 прямо або як водень з C1-4алкілу або додаткові групи був заміщений L2-Z. Крім того, L1 необов'язково може бути заміщена. Загалом, можна використати будь-який замісник, при умові, що не стосується принципу розщеплення. Однак переважно, щоб L1 не була додатково заміщена. Переважно, щоб один або декілька додаткових замісників були незалежно вибрані з групи, що складається з галогену; CN; COOR9; OR9; C(O)R9; C(O)N(R9R9); S(O)2N(R9R9); S(O)N(R9R9); S(O)2R9; S(O)R9; N(R9)S(O)2N(R9R9b); SR9; N(R9R9); NO2; °C(O)R9; N(R9)C(O)R9; N(R9)S(O)2R9; N(R9)S(O)R9; N(R9)C(O)OR9; N(R9)C(O)N(R9R9b); °C(O)N(R9R9); T; C1-50алкілу; C2-50алкенілу або C2-50алкінілу, де Т; C2-50алкіл, C2-50алкеніл і C2-50алкініл необов'язково заміщені одним або декількома R10, які можуть бути однаковими або різними, і де C1-50алкіл, C2-50алкеніл і C2-50алкініл необов'язково перервані однією або декількома групами, вибраними з групи, що складається з T, -C(O)O-; -O-; -C(O)-; -C(O)N(R11)-; 14 UA 108475 C2 5 10 15 20 25 30 35 40 45 50 55 60 -S(O)2N(R11)-; -S(O)N(R11)-; -S(O)2-; -S(O)-; -N(R11S(O)2N(R11a)-; -S-; -N(R11)-; -OC(O)R11; N(R11)C(О)-; -N(R11)S(О)2-; -N(R11)S(О)-; -N(R11)C(O)O-; -N(R11)C(O)N(R11а)- і OC(O)N(R11R11a); R9, R9, R9b незалежно вибрані з групи, що складається з Н; Т; C1-50алкілу; C2-50алкенілу або C2-50алкінілу, де Т; C1-50алкіл, C2-50алкеніл і C2-50алкініл необов'язково заміщені одним або декількома R10, які можуть бути однаковими або різними, і де C1-50алкіл, C2-50алкеніл і C2-50алкініл необов'язково перервані однією або декількома групами, вибраними з групи, що складається з T, -C(O)O-; -O-; -C(O)-; -C(O)N(R11)-; -S(O)2N(R11)-; -S(O)N(R11)-; -S(O)2-; -S(O)-; -N(R11S(O)2N(R11a)-; -S-; -N(R11)-; -OC(O)R11; -N(R11)C(О)-; -N(R11)S(О)2-; -N(R11)S(О)-; N(R11)C(O)O-; -N(R11)C(O)N(R11а)- і -OC(O)N(R11R11a); Т вибрана з групи, що складається з фенілу; нафтилу; інденілу; інданілу; тетралінілу; С310циклоалкілу; 4-7- членного гетероциклілу; або 9-10-членного гетеробіциклілу, причому Т необов'язково заміщена одним або декількома з R10, які можуть бути однаковими або різними; R10 є галогеном; CN; оксогрупою (=О); COOR12; OR12; C(O)R12; C(O)N(R12R12a); S(O)2N(R12R12a); S(O)N(R12R12a); S(O)2R12; S(O)R12; N(R12)S(O)2N(R12aR12b); SR12; N(R12R12a); NO2; °C(O)R12; N(R12)C(O)R12a; N(R12)S(O)2R12a; N(R12)S(O)R12a; N(R12)C(O)OR12a; N(R12)C(O)N(R12aR12b); °C(O)N(R12R12a); або С1-6алкілом, причому С16алкіл необов'язково заміщений одним або декількома галогенами (однаковими або різними); R11, Rl1a, R12, R12a, R12b незалежно вибрані з групи, що складається з Н або С1-6алкілу, причому С1-6алкіл необов'язково заміщений одним або декількома галогенами (однаковими або різними). Термін "перерваний" означає, що між двома атомами вуглецю або на кінці вуглецевого ланцюга між атомами вуглецю і водню вставлена група. L2 являє собою одиничний хімічний зв'язок або спейсер. У тому випадку, коли L2 є спейсером, то він переважно, описаний як один або декілька необов'язкових замісників, описаних вище, при умові, що L2 заміщений Z. Відповідно, коли L2 не є одиничним хімічним зв'язком, то L2-Z є COOR9; OR9; C(O)R9; C(O)N(R9R9a); S(O)2N(R9R9a); S(O)N(R9R9a); S(O)2R9; S(O)R9; N(R9)S(O)2N(R9aR9b); SR9; N(R9R9a); °C(O)R9; N(R9)C(O)R9a; N(R9)S(O)2R9a; N(R9)S(O)R9a; N(R9)C(O)OR9a; N(R9)C(O)N(R9aR9b); °C(O)N(R9R9a); T; C1-50алкілом; C2-50алкенілом або C2-50алкінілом, причому Т, C1-50алкіл, C2-50алкеніл і C2-50алкініл необов'язково заміщені одним або декількома R10, які можуть бути однаковими або різними, і де C1-50алкіл, C2-50алкеніл і C250алкініл необов'язково перервані однією або декількома групами, вибраними з групи, що складається з -T-, -C(O)O-; -O-; -C(O)-; -C(O)N(R11)-; -S(O)2N(R11)-; -S(O)N(R11)-; -S(O)2-; -S(O); -N(R11S(O)2N(R11a)-; -S-; -N(R11)-; -OC(O)R11; -N(R11)C(О)-; -N(R11)S(О)2-; -N(R11)S(О)-; N(R11)C(O)O-; -N(R11)C(O)N(R11а)- і -OC(O)N(R11R11a); R9, R9, R9b незалежно вибрані з групи, що складається з Н; Z; Т; і C1-50алкілу; C250алкенілу або C2-50алкінілу, причому Т, C1-50алкіл, C2-50алкеніл і C2-50алкініл необов'язково заміщені одним або декількома R10, які можуть бути однаковими або різними, і де C1-50алкіл, C2-50алкеніл і C2-50алкініл необов'язково перервані однією або декількома групами, вибраними з групи, що складається з T, -C(O)O-; -O-; -C(O)-; -C(O)N(R11)-; -S(O)2N(R11)-; S(O)N(R11)-; -S(O)2-; -S(O)-; -N(R11S(O)2N(R11a)-; -S-; -N(R11)-; -OC(O)R11; -N(R11)C(О)-; N(R11)S(О)2-; -N(R11)S(О)-; -N(R11)C(O)O-; -N(R11)C(O)N(R11а)- і -OC(O)N(R11R11a); Т вибрана з групи, що складається з фенілу; нафтилу; інденілу; інданілу; тетралінілу; С310циклоалкілу; 4-7- членного гетероциклілу; або 9-10-членного гетеробіциклілу, причому Т необов'язково заміщена одним або декількома з R10, які можуть бути однаковими або різними; R10 є Z; галогеном; CN; оксогрупою (=О); COOR12; OR12; C(O)R12; C(O)N(R12R12a); S(O)2N(R12R12a); S(O)N(R12R12a); S(O)2R12; S(O)R12; N(R12)S(O)2N(R12aR12b); SR12; N(R12R12a); NO2; °C(O)R12; N(R12)C(O)R12a; N(R12)S(O)2R12a; N(R12)S(O)R12a; N(R12)C(O)OR12a; N(R12)C(O)N(R12aR12b); °C(O)N(R12R12a); або С1-6алкілом, причому С16алкіл необов'язково заміщений одним або декількома галогенами (однаковими або різними); R11, Rl1a, R12, R12a, R12b незалежно вибрані з групи, що складається з Н; Z; або С16алкілу, причому С1-6алкіл необов'язково заміщений одним або декількома галогенами (однаковими або різними); при умові, що один з R9, R9a, R9b, R10, R11, R11a, R12, R12a, R12b є Z. Більш переважно, щоб L2 являла собою C1-20алкільний ланцюг, який необов'язково уривався однією або декількома групами, незалежно вибраними з -O- і С(О)N(R3aa); необов'язково була заміщена однією або декількома групами, незалежно вибраними з OH; і C(O)N(R3aaR3aaa), в яких R3aa, R3aaa незалежно вибрані з групи, що складається з Н і C14алкілу. 15 UA 108475 C2 Переважно, щоб молекулярна маса L2 знаходився в діапазоні від 14 г/моль до 750 г/моль. Переважно, щоб L2 була приєднана до Z через кінцеву групи, вибрану з 5 10 15 20 25 30 35 40 45 50 55 У випадку, коли L2 має таку кінцеву групу, більш переважно, щоб молекулярна маса L2 знаходилася в діапазонівід 14 г/моль до 500 г/моль, розрахована без даної кінцевої групи. Переважно, щоб ковалентний зв'язок, що утворюється між лінкером і гідрогелем Z, був постійним. Переважно, щоб гідрогель Z являв собою біодеградований водонерозчинний гідрогель на основі поліетиленгліколю (ПЕГ). У цьому документі термін "на основі ПЕГ" означає, що масове співвідношення ланцюгів ПЕГ в гідрогелі становить щонайменше 10 % по масі, переважно, 25 %, від загальної маси гідрогелю. Іншу частину гелю можуть складати інші спейсери і/або олігомери або полімери, такі як оліго- або полілізини. Крім того, термін "водонерозчинний" стосується набухаючої тривимірно-зшитої молекулярної мережі, що утворює гідрогель. Гідрогель при ресуспендуванні у великому надлишку води або водного буфера з фізіологічною осмоляльністю може включити в себе значну кількість води, наприклад, 10-кратна маса, і, тому, є такою, що набухає, але після видалення надлишку води зберігає фізичну стабільність і форму гелю. Гель може приймати будь-яку геометричну форму, і очевидно, що такий окремий гідрогель потрібно розглядати, як єдину молекулу, що складається з компонентів, в якій кожний компонент з'єднаний з іншим за допомогою хімічних зв'язків. За винаходом гідрогель може складатися з каркасних частин, з'єднаних один з одним гідролітично розщеплюваними зв'язками. Переважно, щоб каркасна частина молекули мала молекулярну масу в діапазоні від 1 кДа до 20 кДа, більш переважно, від 1 кДа до 15 кДа, і ще більш переважно, від 1 кДа до 10 кДа. Переважно, щоб основою каркасної частини молекули був ПЕГ, і каркасна частина містила один або декілька ланцюгів ПЕГ. У гідрогелі, який несе кон'югати лікарської сполуки і лінкер за винаходом, каркасна частина молекули характеризується тим, що вона несе ряд функціональних груп, які включають в себе біодеградовані зв'язані функціональні групи, і з'єднані з гідрогелем кон'югати лікарської сполуки і лінкер, і, необов'язково кепіруючі групи. Це означає, що каркасна частина молекули характеризується рядом з'єднаних з гідрогелем кон'югатів лікарської сполуки і лінкер; функціональними групами, що містять біодеградовані зв'язані функціональні групи; і, необов'язково, кепіруючими групами. Переважно, щоб сума зв'язаних біодеградованих функціональних груп, кон'югатів лікарської сполуки з лінкером і кепіруючих груп становила 16128, переважно, 20-100, більш переважно, 24-80 і, найбільш переважно, 30-60. Переважно, щоб сума зв'язаних функціональних груп, кон'югатів лікарської сполуки з лінкером і кепіруючих груп в каркасній молекулі була порівну розділена між числом полімерних ланцюгів на основі ПЕГ, виступаючих з точки розгалуження. Наприклад, якщо число зв'язаних функціональних груп і кон'югатів лікарської сполуки з лінкером і кепіруючих груп становить 32, то на кожен з чотирьох полімерних ланцюгів на основі ПЕГ, виступаючих з точки розгалуження, доводиться по 8 груп, переважно за допомогою дендритних частин молекули, приєднаних на кінці кожного полімерного ланцюга на основі ПЕГ. Як альтернатива, на кожен з восьми полімерних ланцюгів на основі ПЕГ, виступаючих з ядра, доводиться по 4 групи, або по 2 групи доводиться на кожен з шістнадцяти полімерних ланцюгів на основі ПЕГ. Якщо число полімерних ланцюгів на основі ПЕГ, виступаючих з точки розгалуження, не дозволяє рівного розподілу, то переважно, щоб відхилення від середнього від суми зв'язаних функціональних груп, кон'югатів лікарської сполуки з лінкером і кепіруючих груп на полімерний ланцюг на основі ПЕГ зберігалося мінімальним. У таких з'єднаних з носієм пролікарських сполуках за винаходом бажано, щоб вивільнення майже усієї лікарської сполуки (>90 %) відбувалося до вивільнення каркасних молекул в значній кількості (
ДивитисяДодаткова інформація
Назва патенту англійськоюLong acting insulin composition
Автори англійськоюSprogoe, Rennett, Cleemann, Felix, Hersel, Ulrich, Kaden-Vagt, Silvia, Lessmann, Torben, Rau, Harald, Wegge, Thomas
Автори російськоюСпрогее Кеннет, Клееманн Феликс, Херзель Ульрих, Каден-Фагт Сильвия, Лессманн Торбен, Рау Харальд, Вегге Томас
МПК / Мітки
МПК: A61K 9/19, A61P 3/10, A61K 38/28, A61K 47/48
Мітки: інсуліну, дії, композиція, тривалої
Код посилання
<a href="https://ua.patents.su/64-108475-kompoziciya-insulinu-trivalo-di.html" target="_blank" rel="follow" title="База патентів України">Композиція інсуліну тривалої дії</a>
Попередній патент: Синтетичний промотор, який індукується патогенами
Наступний патент: Модульний мультиенергетичний термодинамічний пристрій
Випадковий патент: Пневматичний елемент "і" нечіткої логіки












